Изобретение относится к биологии и медицине, в частности к вирусологии. Представлено новое синтетическое соединение, а именно: производное декагидро-клозо-декаборатного аниона, содержащего пендантную группу раскрытого цикла диоксана с метиловым эфиром L-триптофана (Na2[B10H9OCH2CH2OCH2CH2CH2CO-Trp-ОМе]), обладающее противовирусными свойствами против современных штаммов вируса гриппа А. Изобретение может быть использовано с целью разработки этиотропного препарата, для применения, как в виде индивидуального лекарства, так и в составе комплексной терапии.
Значение химиопрофилактики и химиотерапии в надзоре за распространением гриппозной инфекции трудно переоценить, особенно в целях своевременной защиты населения в экстренных эпидемических ситуациях. Угроза появление устойчивости вируса гриппа к существующим противовирусным лекарственным препаратам вызывает необходимость комплексного подхода как к диагностике лекарственной устойчивости, так и разработке новых фармацевтических препаратов прямого действия [1]. Для лечения и профилактики заболеваний, вызванных вирусом гриппа, Всемирной Организацией Здравоохранения (ВОЗ) рекомендованы две группы лекарственных средств прямого действия: блокаторы белка М2 (амантадин и римантадин) и ингибиторы нейраминидазы (занамивир, озельтамивир, перамивир) [2]. Однако впоследствии протоколы ВОЗ были доработаны ввиду возникшей устойчивости пандемических H1 и эпидемических Н3 штаммов к амантадину/римантадину, так что использование препаратов адамантана для лечения гриппа не рекомендуется [3].
В работе [4] подробно описан пример синтеза карборанового аналога осельтамивира и представлена оценка его биологической активности в сравнении с эталонным пролекарством и его активной формой (осельтамивиркарбоновой кислотой).
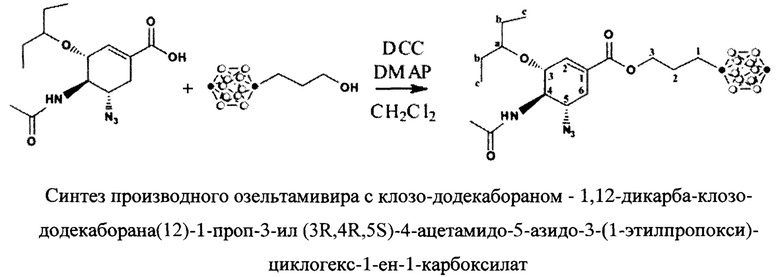
Известно, что осельтамивир является пролекарством, которое должно подвергнуться гидролитической биотрансформации (омыление сложноэфирной связи) до соответствующей карбоновой кислоты, чтобы стать активным ингибитором нейраминидазы [5]. Поскольку кластеры бора уже зарекомендовали себя в медицинской химии как модераторы фармакофорных свойств, авторы предложили заменить эфирный остаток в осельтамивире на карборан. Нужно отметить, что полученный карборановый эфир продемонстрировал по меньшей мере в 10 раз меньшую 50%-ную ингибирующую концентрацию (IC50) in vitro, в анализе уменьшения бляшкообразования. Разница в наблюдаемых ингибирующих свойствах синтезированного соединения и прпарата сравнения (осельтамивир) указывает на то, что такое сочетание проверенного фармакофора с бороводородным кластером привело к снижению ингибирующей активности [4].
Ингибиторы функции белка М2 вируса гриппа А, как правило, состоят из гидрофобной части молекулы (в препаратах амантадин и римантадин - адамантан), соединенной с полярной функциональной группой. Как было показано ранее, адамантильный остаток может быть заменен на другие гидрофобные группы, в том числе, производные терпенов, конденсированные ароматические системы и другие углеводороды [6, 7]. Кластерные анионы бора в качестве мембранных носителей видятся наиболее перспективными каркасными соединениями для присоединения к ним функционально активных групп ввиду их низкой токсичности, 50%-ная цитотоксическая концентрация (СТ50) составляет более 250,0 мкг/мл, более того соединения обладают хорошей растворимости в воде.
Наиболее близким соединением к предлагаемому соединению в настоящем изобретение является ингибитор репликации вируса гриппа А на основе производных аминокислот с борным кластером содержащим линкерную группу [8]. Описано производное клозо-декаборатного аниона [B10H9-O(CH2)4C(O)-His-OMe]2-, в котором функциональная группа His-OMe, связана с кластерным анионом бора через образование амидной связи через спейсер O(СН2)4. Это соединение представлено ниже
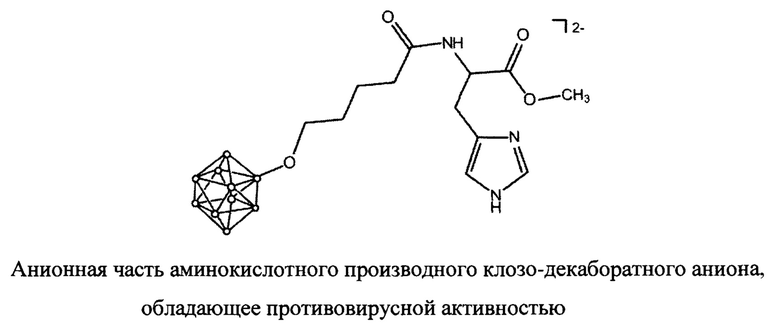
Противовирусная активность его натриевой соли изучена in vitro в отношении вируса гриппа A/Moscow/01/2009(HlNl)pdm09. Показано, что соединение обладает противовирусной активностью при 5,0 мкг/мл и демонстрирует отсутствие цитотоксического действия до 160,0 мкг/мл [9].
Производное клозо-декаборатного аниона [B10H9-O(CH2)4C(O)-His-OMe]2-исследовано на противовирусную активность в отношении коронавируса SARS-CoV-2 in vitro. На клеточной культуре Vero-Е6 показано, что производное гистидина с кластерным анионом бора [В10Н10]2- обладает способностью подавлять репликацию вируса. Данное соединение проявляло умеренную противовирусную активность в отношении варианта коронавируса SARS-CoV-2 [10].
Таким образом, есть все предпосылки полагать, что синтетические производные кластерных соединений бора с остатками аминокислот и пептидов, ввиду их значительной активности и низкой токсичности, могут претендовать на модель для создания новых противовирусных препаратов против современных штаммов гриппа А.
Сущность изобретения заключается в создании нового синтетического соединения, являющегося производным клозо-декаборатного аниона [В10Н9-O(СН2)2О(СН2)3С(O)-Trp-ОМе]2-. В молекуле присутствует пендантная функциональная группа -Trp-ОМе, связанная с кластерным анионом бора через оксибис[(этан-2,1-диил)окси]-спейсер, который образуется в результате нуклеофильного раскрытия присоединенной молекулы диоксана в производном [B10H9O(СН2)4O]-. Предложенное соединение ингибирует репродукцию вируса гриппа А в экспериментах in vitro. Соединение Na2[B10H9-O(CH2)2O(CH2)3C(O)-Trp-OMe] обладает низким токсическим эффектом на монослой перевиваемой линии клеток почки эмбриона собак (MDCK). Анион в соединении Na2[В10Н9-O(СН2)2O(СН2)3С(O)-Trp-ОМе] имеет следующую структурную формулу:
Технический результат - получено новое соединение: метил-2-[4-(2-метоксиэтокси)бутанамидо]-3-(1H-индол-3-ил)пропаноат-нонагидро-клозо-декаборат натрия, малотоксичное, обладающее противовирусной активностью в отношении современных штаммов вируса гриппа А.
Краткое описание чертежей
Для более ясного понимания сути заявленного изобретения, которое отражено в формуле изобретения, а также для демонстрации ее особенностей и преимуществ далее приводится подробное описание со ссылками на фигуры чертежей.
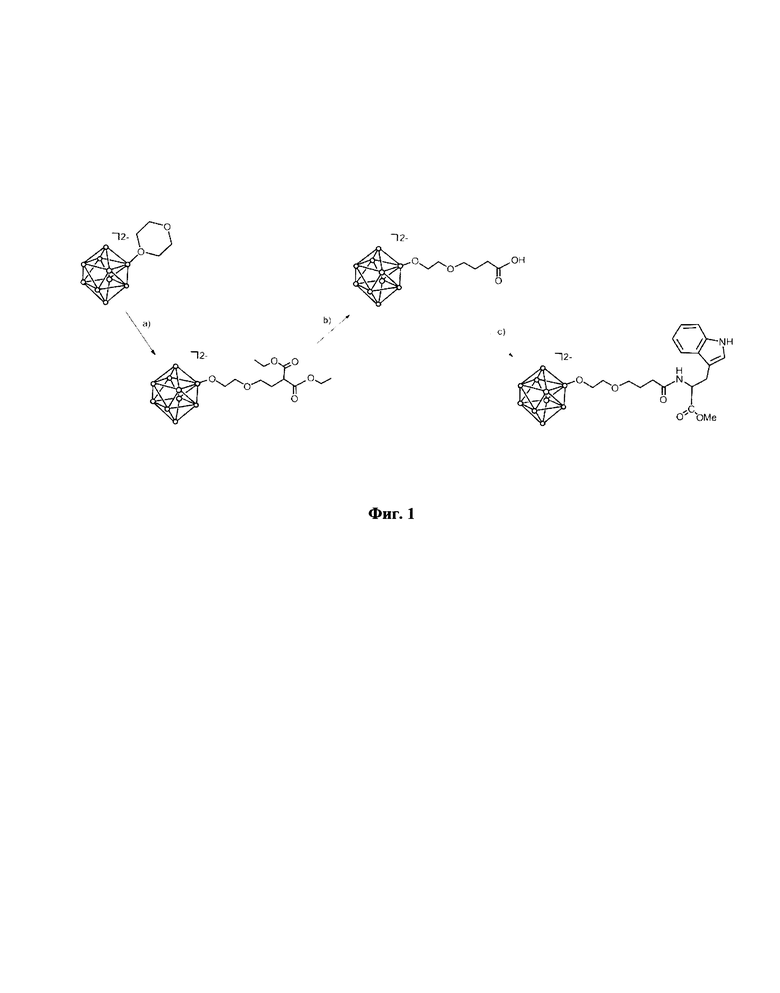
На фиг. 1 представлена схема постадийного синтеза Na2[В10Н9-O(СН2)2O(СН2)3С(O)-TrP-ОМе]. На первой стадии, обозначенной на схеме индексом (а), осуществляли нуклеофильное раскрытие циклического оксониевого заместителя (1,4-диоксана) соединения (Bu4N)[B10H9O(CH2)4O] действием малонового эфира в присутствии карбоната калия. Полученное ациклическое производное затем гидролизовали в кислой среде 11%-го раствора соляной кислоты в этаноле, обозначенной на схеме индексом (b), для получения пендантной карбоксильной группы (Ph4P)2[B10H9O(CH2)2O(CH2)2CH2COOH]. На заключительной стадии синтеза, обозначенной на схеме индексом (с), с использованием методологии пептидного синтеза (в качестве конденсирующего реагента использовали смесь изобутилхлорформиата с N-метилморфолином) получали производное эфира L-триптофана.
Для получения соединения Na2[В10Н9-O(СН2)2O(СН2)3С(O)-Trp-ОМе] могут быть использованы различные подходы. Один из способов получения соединения Na2[B10H9-O(СН2)2О(СН2)3С(O)-Trp-ОМе] представлен на схеме (фиг. 1). Однако предложенный метод синтеза не должен рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
При синтезе соединений использовали карбонат калия (ХЧ), соляную кислоту (36%, ХЧ) ООО ТД "ХИММЕД" (Россия), декаборан(14) (В10Н14) фирмы Acros Organics (Бельгия), дихлоргидрат метилового эфира L-триптофана, N-метилморфолин (NMM) и изо-бутилхлорформиат (IBCF), малоновый эфир (98%), ацетонитрил (99%), хлорид тетрафенилфосфония (99%), тетрафенилборат натрия (99,5%) фирмы Sigma-Aldrich (США). Представленные реактивы были использованы без дополнительной очистки.
[2-(1-(1,4-диоксаний))]нонагидро-клозо-декаборат тетрабутиламмония (n-Bu4N)[B10H9O(CH2)4O] синтезирован по разработанной ранее методике [10]. 1,4-диоксан очищали согласно [12].
Все используемые для реакции растворители предварительно очищали и перегоняли по стандартным методикам. Полнота прохождения реакции контролировалась с помощью тонкослойной хроматографии (ТСХ) на пластинах Silufol (Чехия), а также с помощью 11 B ЯМР-спектроскопии и инфракрасной спектроскопии (ИК).
ИК-спектры соединений записывали на ИК Фурье - спектрометре ИНФРАЛЮМ ФТ-02 в области 400-4000 см-1. Образцы готовили в виде таблеток из смеси исследуемого соединения и бромида калия (KBr).
1Н, 11 B, 13С ЯМР спектры растворов исследуемых веществ в DMOO-d6 записывали на ЯМР-спектрометре Bruker DPX-300 (Германия) на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. Масс-спектры записывали с использованием четырехканального насоса Agilent 1200 (G1311A) (Германия) и тройного квадрупольного масс-спектрометра TSQ Quantum Access МАХ, снабженного источником API (HESI-II) и 6-портовым инжектором с внешней петлей объемом 0,002 см3. Образцы вводили в источник ионов путем ручной петлевой инжекции в поток растворителя. В качестве растворителей использовали ацетонитрил для ВЭЖХ и спектроскопии, 99,8% и воду Milli-Q от Millipore (Германия).
Элементный анализ на бор проводили на масс-спектрометре с индуктивно связанной плазмой ELAN DRC-e PerkinElmer (США). Содержание углерода, водорода и азота в образцах определяли на элементном CHNS-анализаторе Eurovector «EuroEA 3000» (Италия).
Вирусологические исследования проведены с использованием пандемического штамма вируса гриппа A/IIV-Orenburg/83/2012(H1N1)pdm09. Исследование инфекционного титра вируса гриппа проводили на перевиваемой линии клеток MDCK, полученной из Государственной коллекции культур клеток лаборатории культур тканей Института вирусологии им. Д.И. Ивановского Национального исследовательского центра эпидемиологии и микробиологии имени Н.Ф. Гамалеи (ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России). В работе использовали 3-х дневный монослой перевиваемой клеточной линии MDCK, выращенный на среде Игла MEM с добавлением 10% эмбриональной телячьей сыворотки (ЭТС), L-глутамина и антибиотиков - 150,0 ед/мл пенициллина и 150,0 ед/мл стрептомицина. Контроль культуральных клеток проводили с помощью светооптического микроскопа.
Настоящее изобретение проиллюстрировано нижеследующими примерами. Однако эти примеры не должны рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
Пример 1. Синтез 2-[2-(2-(2-метилкарбокси)этокси)этокси]нонагидро-клозо-декабората тетрафенилфосфония, (Ph4P)2[B10H9O(CH2)2O(CH2)2CH2COOH]
(соединение (Ph4P)21)
(Bu4N)[B10H9O2C4H8] (1,00 г, 2,23 ммоль), малоновый эфир (1,02 мл, 6,9 ммоль) и карбонат калия (1,54 г, 11,2 ммоль) добавляли в 50,0 мл ацетонитрила, и полученную суспензию кипятили при перемешивании в течение 2 часов. После охлаждения полученную систему отфильтровывали от избытка непрореагировавшего карбоната калия. Полученный светло-желтый фильтрат упаривали практически полностью до небольшого количества желтой вязкой жидкости. К ней добавили раствор 70,0 мл 11%-го раствора соляной кислоты и 15,0 мл 96% - ного этанола. Полученный раствор нагревали при температуре кипения в течение 24 часов. Далее охлажденный прозрачный раствор упаривали досуха, полученный белый порошок растворяли в воде (10,0 мл) и добавляли раствор Ph4PC1 (1,67 г, 4,46 ммоль) в воде (15,0 мл). Выпавший желтый осадок отфильтровывали и высушивали в глубоком вакууме. Получено 1,70 г (81%) соединения (Ph4P)2l.

Пример 2. Синтез (Ph4P)2[B10H9O(CH2)2O(CH2)2CH2C(O)-Trp-OMe] (соединение (Ph4P)22)
Готовили раствор соединения (Ph4P)21 (0,35 г; 0,37 ммоль) в 10,0 мл и прибавляли 0,034 мл (0,37 мМ) N-метилморфолина (NMM). Охлаждали до -25°С и при перемешивании в реакционную массу добавляли 0,052 мл (0,37 мМ) изо-бутилхлорформиата (IBCF). Перемешивали 10 мин. Затем добавляли заранее приготовленный и охлажденный до -20°С раствор 0,10 г (0,39 мМ) хлоргидрата метилового эфира триптофана в 10,0 мл CHCl3 с 0,036 мл (0,39 мМ) NMM. Перемешивают 30 мин при -15°С, затем еще 1 час при 0°С и 10 часов при комнатной температуре.
Реакционную массу переносили в делительную воронку и последовательно промывали: Н2О (10,0 мл × 1); 0,5 н серной кислотой (4,0 мл × 1); 0,5 н КНСО3 (10,0 мл × 2), затем подкисляли 1н H2SO4 и промывали Н2О (5,0 мл х 1). Органический слой отделяли и сушили безводным Na2SO4. Хлороформ удаляли в вакууме на роторном испарителе при 45°С и 15 мм.р.ст., получали вспененное масло, которое через некоторое время затвердевало.
Выход: 0,33 г (78,5%), твердый, белый порошок.
m/z: найдено [М+Н]+: 1144,7; вычислено M(C18H33B10N2O5) 1143,21 Да
Строение замещенного клизо-декабората с пептидной функциональной группой устанавливали с помощью мультиядерной ЯМР-спектроскопии и ИК-спектроскопии.
Пример 3. Синтез Na2[B10H9O(CH2)2O(CH2)3CO-Trp-OMe] (соединение Na22)
Соединение (Na22) получали по обменной реакции с тетрафенилборатом натрия. (Ph4P)22 (0,22 г, 0,19 ммоль) растворяли в 2,0 мл метанола. К этому раствору добавили раствор Na[BPh4] (0,13 г, 0,38 ммоль) в 2,0 мл метанола, наблюдали образование белого осадка. Осадок отфильтровывали, раствор упаривали с получением белого гигроскопичного порошка, который высушивали в глубоком вакууме. Выход 0,044 г (47%).

Пример 4. Исследование противовирусной активности Na2[B10H9-O(СН2)2O(СН2)3С(O)-Trp-ОМе]
Изучение противовирусной активности предлагаемого синтетического соединения проводили на 96-луночных планшетах со сформировавшимся монослоем клеток культуры ткани MDCK. Одномоментно с инфицированием на монослой клеток вносили римантадин (в качестве контроля) и изучаемое синтетическое соединение в концентрациях 5,0; 10,0 и 20,0 мкг/мл. Панели инкубировали 24 часа при 37°С, а затем останавливали реакцию фиксированием клеток 80% ацетоном на фосфатном буфере. Постановку метода клеточного иммуноферментного анализа (ИФА) проводили согласно методике, описанной ранее [13, 14]. Процент ингибирования вирусной активности соединения определяли по формуле (1):
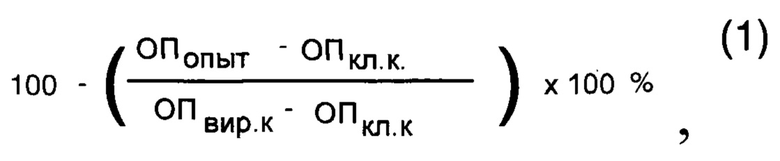
где: ОПопыт - оптическая плотность опытной лунки (с соединением) при 492 н.м., ОП кл к -ОП450 клеточного контроля, ОП вир.к - ОП450 вирусного контроля.
В табл. 1 представлены данные влияния трех концентраций соединения Na2[B10H9-O(СН2)2О(СН2)3С(O)-Trp-ОМе] на репродукцию вируса гриппа человека A/IIV-Orenburg/83/2012(H1N1)pdm09 в культуре клеток MDCK при добавлении вещества одномоментно с вирусом.
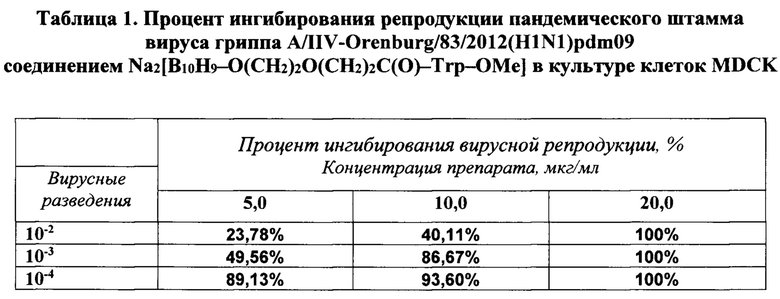
Обнаружено, что синтетическое соединение Na2[B10H9-O(CH2)2O(CH2)3C(O)-Trp-ОМе] показало высокую степень ингибирования репродукции штамма вируса гриппа A(H1N1)pdm09, резистентного к действию препаратов адамантана (табл. 1). 50%-ная ингибирующая доза составила 5,0 мкг/мл.
Пример 5. Определение цитотоксического действия (МТТ-тест)
Цитотоксическое действие соединеня изучали при внесении их разных концентраций на монослой клеток культуры ткани MDCK в 96-луночных планшетах и инкубировании при 37°С. Изначально состояние клеточного монослоя проверяли под микроскопом. Концентрацию вещества, вызывающую дегенерацию 50% клеток по сравнению с контролем, принимали за среднетоксичную концентрацию (СТ50).
Цитотоксическое действие соединения также изучали колориметрическим тестом для оценки метаболической активности клеток с красителем 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромида (МТТ). В ячейки 96-луночного планшета на сформировавшейся монослой клеток культуры MDCK вносили исследуемое соединение в концентрации 40,0; 80,0; 160,0; 320,0 и 640,0 мкг/мл (по 8 ячеек для каждого разведения) на питательной среде Игла MEM с L-глутамином с двойным набором аминокислот. Планшеты инкубировали в термостате с подачей СО2 при температуре 37°С в течение 48 часов с визуальным контролем через каждые сутки под оптическим микроскопом. Далее среду сливали, и в каждую лунку вносили по 20,0 мкл раствора тетразолиевого красителя МТТ в концентрации 5,0 мг/мл (т.е. по 100 мкг МТТ). Инкубировали панели в термостате с подачей СО2 при 37°С в течение 2-4 часов, после чего наблюдали изменение цвета среды: в лунках - наблюдалось образование темно-синих кристаллов формазана в клетках. Затем из лунок планшета с помощью многоканальной пипетки аккуратно удаляли среду, при этом слой клеток с кристаллами формазана становится виден в виде синего налета на дне планшета. В каждую ячейку вносили 150,0 мкл диметилсульфоксида (ДМСО). В течение 5 минут планшет встряхивали на шейкере для эффективного растворения формазана в ДМСО. Измеряли оптическую плотность (ОП) раствора в каждой лунке, при длине волны 490 нм (длина волны сравнения - 620 нм) с помощью планшетного флуориметра "Synergy HT" фирмы BioTek Instruments (США) (таблица 2). Концентрацию изучаемого соединения, способную снизить значение оптической плотности на 50% по сравнению с клеточным контролем, принимали за 50% цитотоксическую дозу (СТ50)-Соединение можно считать малотоксичным по отношению к монослою клеток MDCK, цитотоксическая доза составила 80,0 мкг/мл (CT50=80,0 мкг/мл).
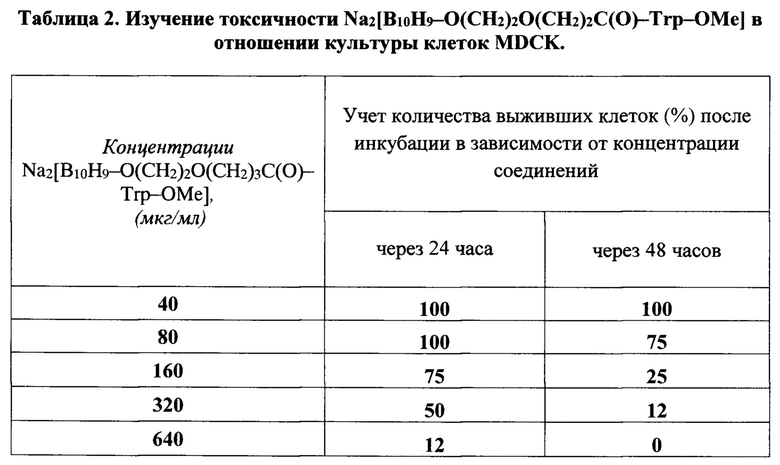
Т.о., исходя из данных таблицы 2 следует, что химиотерапевтический индекс (ХТИ=СТ50 / IC50) для соединения Na2[B10H9-O(CH2)2O(CH2)3C(O)-Trp-OMe] составил 16.
Патентуемое соединение может быть применено для создания новых противовирусных препаратов, ингибиторов функции ионоселективного канала М2 вируса гриппа А с использованием как в виде индивидуального лекарства, так и в составе комплексной терапии.
Предлагаемое соединение в виду его высокой противовирусной активности (ИД50 5,0 мкг/мл) и низкой токсичности (ЦТ50 более 80,0 мкг/мл), а также экономической и синтетической доступности может быть рекомендовано в качестве кандидата на доклинические и клинические испытания с целью получения этиотропного противовирусного препарата на его основе. Полученное соединение может быть использовано для терапии заболеваний, вызванных современными штаммами вирусов гриппа А, как самостоятельное средство, так и в составе композиций для терапии вируса гриппа А в том числе штаммов, резистентных к препаратам адамантанового ряда.
СПИСОК ЛИТЕРАТУРЫ
1. Kiso М., Mitamura К., Sakai-Tagawa Y., Shiraishi К., Kawakami С, Kimura К., et al. Resistant influenza A viruses in children treated with oseltamivir: descriptive study. Lancet. 2004; 364: 759-765.
2. Gani R., Hughes H., Fleming D., Griffin Т., Medlock J., Leach S. Potential impact of antiviral drug use during influenza pandemic. Emerg. Infect. Dis. 2005; 11: 1355-1362.
3. Wainright P.O., Perdue M.L., Brugh M., Beard C.W. Amantadine resistance among hemagglutinin subtype 5 strains of avian influenza virus. Avian Dis. 1991; 35. C.31-39.
4. Adamska A., Olejniczak A.B., Zwoliński K., Szczepek W.J., Król E., Szewczyk В., Grynkiewicz G., Leśnikowski Z.J. Oseltamivir analog with boron cluster modulator. Acta Pol Pharm. 2012;69(6): 1218-1223.
5. Satoh N., Akiba Т., Yokoshima S., Fukuyama T. A practical synthesis of (-)-oseltamivir. Tetrahedron. 2009; 65: 3239-3245.
6. Shibnev V.A., Deryabin P.G., Garaev T.M., Finogenova M.P., Botikov A.G., Mishin D.V., Peptide Carbocyclic Derivatives as Inhibitors of the Viroporin Function of RNA-Containing Viruses. Russian Journal of Bioorganic Chemistry. 2017: 43(5); 517-525.
7. Шибнев B.A., Дерябин П.Г., Бурцева Е.И., Гараев Т.М., Финогенова М.П., Кириллова Е.С., Ботиков А.Г. Производные 2-хинальдинкарбоновой кислоты и их противовирусная активность. Патент РФ RU 2624906 приоритет от 22.12.2015. (Опубликовано: 10.07.2017).
8. Гараев Т.М., Гребенникова Т.В., Авдеева В.В., Малинина Е.А., Кузнецов Н.Т., Жижин К.Ю., Бреслав Н.В., Жданов А.П., Бурцева Е.И. Аминокислотное производное декагидро-клозо-декаборатного аниона и его противовирусная активность в отношении вируса гриппа А. Патент РФ RU 2 749 006 приоритет от 27.11.2020 (Опубликовано: 02.06.2021).
9. Avdeeva V.V., Garaev Т.М., Breslav N.V., Burtseva E.I., Grebennikova T.V., Zhdanov A.P., Zhizhin K.Yu., Malinina E.A., Kuznetsov N.T. New type of RNA virus replication inhibitor based on decahydro-closo-decaborate anion containing amino acid ester pendant group.J Biol Inorg Chem. 2022; 27(4-5): 421-429.
10. Гараев T.M., Гребенникова T.B., Авдеева B.B., Лебедева В.В., Ларичев В.Ф., Противовирусные свойства синтетических производных гистидина, содержащих мембранотропные объемные карбоциклы в своей молекуле, против вируса SARS-CoV-2 in vitro. Вопросы вирусологии 2023; 68: 18-25.
11. Zhizhin, K.Yu., Mustyatsa, V.N., Malinina, E.A., et al., Russ. J. Inorg. Chem., 2004: 49(2); 180-189.
12. Органикум. В 2-х т./ [X. Беккер и др.]; Пер. с нем. Е.В. Ивойловой. - Т. 1. -Москва: Мир, 1992. - 487 с. ISBN 5-03-001965-0.
13. Shibnev, V.A., Garaev, Т.М., Finogenova, M.P., Shevchenko, E.S., Burtseva, E.I. (2012). Some pathways to overcoming drug resistance of influenza a virus to adamantane derivatives. Pharmaceutical Chemistry Journal. 2012; 46: 1-5.
14. Shibnev V.A., Garaev T.M., Finogenova M.P., Shevchenko E.S., Burtseva E.I. New adamantane derivatives can overcome resistance of influenza A(HlNl)pdm2009 and A(H3N2) viruses to remantadine. Bulletin of experimental biology and medicine. 2012; 153(2): 233-235.
| название | год | авторы | номер документа |
|---|---|---|---|
| Аминокислотное производное декагидро-клозо-декаборатного аниона и его противовирусная активность в отношении вируса гриппа А | 2020 |
|
RU2749006C1 |
| ЭТИЛ (3S,4R,5S)-4-АЦЕТАМИДО-5-АМИНО-3-(1-ЭТИЛПРОПОКСИ)ЦИКЛОГЕКС-1-ЕН-1-КАРБОКСИЛАТА ЭТОКСИСУКЦИНАТ В КАЧЕСТВЕ ПРОТИВОВИРУСНОГО ПРЕПАРАТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2639158C1 |
| ПРОИЗВОДНЫЕ 2-ХИНАЛЬДИНКАРБОНОВОЙ КИСЛОТЫ И ИХ ПРОТИВОГРИППОЗНАЯ АКТИВНОСТЬ | 2015 |
|
RU2624906C2 |
| Аминокислотные производные 2-норборнануксусной кислоты и их противогриппозная активность | 2017 |
|
RU2676699C1 |
| ПРОИЗВОДНОЕ 1,3-АДАМАНТАНДИУКСУСНОЙ КИСЛОТЫ И ЕГО ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ | 2013 |
|
RU2553991C1 |
| ПРОИЗВОДНЫЕ 4-АМИНОМЕТИЛ-6-БРОМ-5-ГИДРОКСИИНДОЛ-3-КАРБОКСИЛАТОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ПРИМЕНЕНИЕ | 2006 |
|
RU2330018C2 |
| ПРОИЗВОДНЫЕ 1-(1-АДАМАНТИЛ)ЭТИЛАМИН-N-АЦИЛАМИНОКИСЛОТ И ИХ ПРОТИВОГРИППОЗНАЯ АКТИВНОСТЬ | 2014 |
|
RU2572102C1 |
| ГОМО- И ГЕТЕРО-ПОЛИАМИНОКИСЛОТНЫЕ ПРОИЗВОДНЫЕ ФУЛЛЕРЕНА C, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2011 |
|
RU2458914C1 |
| СРЕДСТВО ДЛЯ ИНАКТИВАЦИИ ВИРУСОВ, ОБЛАДАЮЩЕЕ ОДНОВРЕМЕННОЙ РИБОНУКЛЕАЗНОЙ, МЕМБРАНОЛИТИЧЕСКОЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЯМИ | 2008 |
|
RU2399388C2 |
| АДАМАНТИЛАМИДЫ СЕРОСОДЕРЖАЩИХ КИСЛОТ И ИХ ПРОТИВОГРИППОЗНАЯ АКТИВНОСТЬ | 2015 |
|
RU2617850C1 |
Изобретение относится к новому аминокислотному производному декагидро-клозо-декаборатного аниона (Na2[В10Н9-O(СН2)2O(СН2)3С(O)-Trp-ОМе], которое ингибирует репродукцию вируса гриппа А, в том числе и штаммы, резистентные к препаратам адамантанового ряда, обладает низкой токсичностью и может быть использовано для создания новых противовирусных препаратов, как в виде индивидуального средства, так и в составе композиций. Соединение Na2[B10H9-O(CH2)2O(CH2)3C(O)-Trp-OMe] имеет следующую структурную формулу анионной части:
 . 1 з.п. ф-лы, 1 ил., 2 табл, 5 пр.
. 1 з.п. ф-лы, 1 ил., 2 табл, 5 пр.
1. Соединение Na2[В10Н9-O(СН2)2O(СН2)3С(O)-Trp-ОМе], которое имеет следующую структурную формулу анионной части:
2. Соединение по п. 1, обладающее противовирусной активностью в отношении вируса гриппа А, в том числе штаммов, резистентных к действию препаратов адамантанового ряда.
| Аминокислотное производное декагидро-клозо-декаборатного аниона и его противовирусная активность в отношении вируса гриппа А | 2020 |
|
RU2749006C1 |
| Avdeeva, V.V | |||
| et al | |||
| "New type of RNA virus replication inhibitor based on decahydro-closo-decaborate anion containing amino acid ester pendant group", J Biol Inorg Chem, 2022, 27, pages 421-429 | |||
| Avdeeva, V.V | |||
| et al | |||
| "Physiologically Active Compounds Based on Membranotropic Cage Carriers-Derivatives of Adamantane and | |||
Авторы
Даты
2025-02-12—Публикация
2024-07-18—Подача