со
00
Изобретение относится к способам опЬеделения ферментов, а именно ще- лонной фосфатазы, и может быть приме- неЦо в иммуноферментном анализе раз- ли чньгх биологически активных соединений в клинической диагностике в ми|кробиологических отраслях промьшз- леиности, aнaлити lecкoй химии и др.
: Цель изобретения - увеличение чув- ст|вительности, упрощение и ускорение определения активности щелочной фссфатазы.
Способ осуществляют след пощим об- paJ3OM.
В кювету спектрофотометра вносят
0.
9 МП 0,05 М трис-НС буфера рН 8с,59,l, содержащего lO MMgCl, 100 мкл огределяемого образца, НАДФИ с конечной кондентрахщей Ми
И ЛС
ст
,
:кубируют 10-15 мин при 30-37 С, По этого в кювету добавляют 1 мл ра вора, содержащего в конечных кон- ц4нтрациях, М: АДГ из печени лошади
-10, .п-нитрозо-Н,ы -диметил -(НДМА) 5-10 -3 10- этанол 0,1 11 амид сали1даловой кислоты (АСК) 2 1-10 -5 10 , ортофосфат натрия 0,0 в:том же буфере, и определяют ско- ферментативной реак11 1И по увеличению оптической плотности 687 нм за 1-3 мин. Контроль за фэновой реакцией в системе регенерации осуществляют аналогично указанному, но иэ системы исключается опре- дйлйвмый образец.
I Фоновая реакция протекает вслед- с|твие содержащегося примесного ШХЦН и субстрате НАДФН, а также нефермен- 4атив наго гидролиза НАДФН за время цнкубаи 1И,
Эффект усиления в данной системе р|егенерации кофактора достигается :-|а счет циклического процесса окис- - восстановления НАД(Н) в ак- 1 ивном центре фермента с параллельны Протеканием необратимых реакций окисления спирта и восстановления НДМА. 1 аствор НДМА имеет желтую окраску i «oiKc Р ферментативном восстановлении он обесцвечиваетс Л1ля удобства слежения -за скоростью 1 еакцик по возрастанию оптической шютности раствора от нулевого уров Мя в реакционную среду вводят АСК, ))соторьй, взаимодействуя с продуктом восстановления НДМА, образует голубой краситель индалин, имеющий мак
5
0
5
0
Q
симум поглощения в нидимон области спектра при 687 нм.
По калибровочному графику зависимости скорости реакции от концентрации щелочной фосфатазы в растворе можно с высокой чувствительностью определять содержание фермента в образце.
Предлагаемая система регенерации кофактора проще по сравнению с известной, так как.включает всего один фермент и позволяет определять НАД(Н) в минимальных концентрациях за меньший отрезок времени. Выбор АДГ печени лощади в качестве фермента регенерации обусловлен е способностью осуществлять циклический процесс окисления - восстановления кофактора при участии двух сопряженных субстратов, в отлгтеие от дрожжевой АДГ5 используемой в известном способе, которая участвует только в восстановлении НАД и НАДИ,.при этом для регенерации НАД из НАДИ требуется введение в систему второго фермента-диафо- разы.
Выбор диапазона концентрации АДГ , обусловлен пропорциональным увеличением скорости реакции при возрастании концентрации АДГ в растворе. При со - держа1ши АДГ вьш1е з системе наблюдается усилелгае фона реакции от примесного эвдогенного НАД, содержащегося в препарата фермента, а тйкж возникают трудности детектирования вследствие высоких скоростей реакции.
Диапазоны концентраций сопряженных субстратов - НДМА и этанола выбраны с учетом насыщения фермента- по субстрату (К) и постоянства ско- .рости ферментативной реакдаи.
Использование субстратов в концентрациях ниже указанных пределов приводит к пропорциональному снижению скоростей, а вьппе - к непроизводительному расходу реагентов. АСК вводится В систему в большом избытке для достижения максимальной скорости взаимодействия с продуктом восстановления НДМА. Верхняя граница - 5 мМ обусловлена независимостью наблюдаемой скорости реакции при дальнейшем повышении концентрации АСК в реакционной среде.
В качестве буферной среды в системе регенерации предлагается трис-НС1 с тем же рН, что и на стадии инкубации щелочной фосфатазы с субстратом
14495884
НАДФН. Наблюдаемая скорость фермента- с использованием одноферментной систетивной реакции в системе регенерации резко возрастает с увеличением рН реды в интервале 7,2-9,1. Дальнейшее увеличение рН на изменение скорости практически не влияет.Для сближения рН оптимумов действия щелочной Фосфатазы и АДГ в данной системе еще ОЫи-Ч . J МГ/МТТ ДГ1Г 9П п-,/.
ран рН в интервале 8 5-9 Ч ., ш ,, / ALK 0 мг/мл-, стандартные граница к„„р„ о ,: .Т - ™- У
граница которого лимитируется буферными свойствами ТРИС-.НС1. Использование трис-НС в качестве буфера в системе регенерации обусловлено тем.
мы регенерации кофактора.
Приготовляют растворы 0,05 трис- 5 буфера рН 9,1, содержащего: MRC1, 10-Н1, НАДФН в концентрации 5-10- М Na,P04 1 М,- АДГ Ю м в этом же буфере; зтанольные растворы НДМА 4- 4,5 мг/мл; АСК 20 мг/мл-, стандартные
т -±-- . t, y/UCJitlНОИ активностью 1000 U/мин-мг белка в области концентраций в воде или трис-НС буфере рН 8,0. В отдельной емкости готовят субгигт р: е; ;:н :°г:: Гд гг - -д- г;;;Гб;образующегося при tcK 0% Р . Молекула триса (3-оксиметила ноГ,е: IS 02
:., -
ГФ О-Г::-а-и-) - ----с-е-ГЙф-Т t ООТГ с%°нд ар-.о- .
для инактивации п.елочной фосфата-20о жсп ;ас%Га 1™°1
зы с целью проведения реакции во вто-бируют в кювете п1 3 Г1Г Т
ричной одноферментной системе регене- 25ле этого ГГ °
рации с постоянной скоростью (едГ Добавляют 1 суб,опт. гхп/мин) в систему вво т ин;и- J.- определ.як,г возрас- битрр щелочной Фосфатазы - ортофосфат натрия в конечной концентрации 0,05М.
.-.-iiit-cuj ijn U.UJn, ПРИ vy h« 7 u ттт
°
мы НАДФН связано с его повышенной по сравнению с НАДФ стабильностью в щелочной среде. Содержание НАДФН в растворе варьирует в пределах 10 М. Верхняя граница обусловлена независимостью ферментативной скорости реакции от концентрации НАДФН, а также возможным возрастанием фоновой скорости реакции,нижняя - уменьшением ферментативной скорости и как следствие снижением чувствительности определения щелочной Фосфатазы.
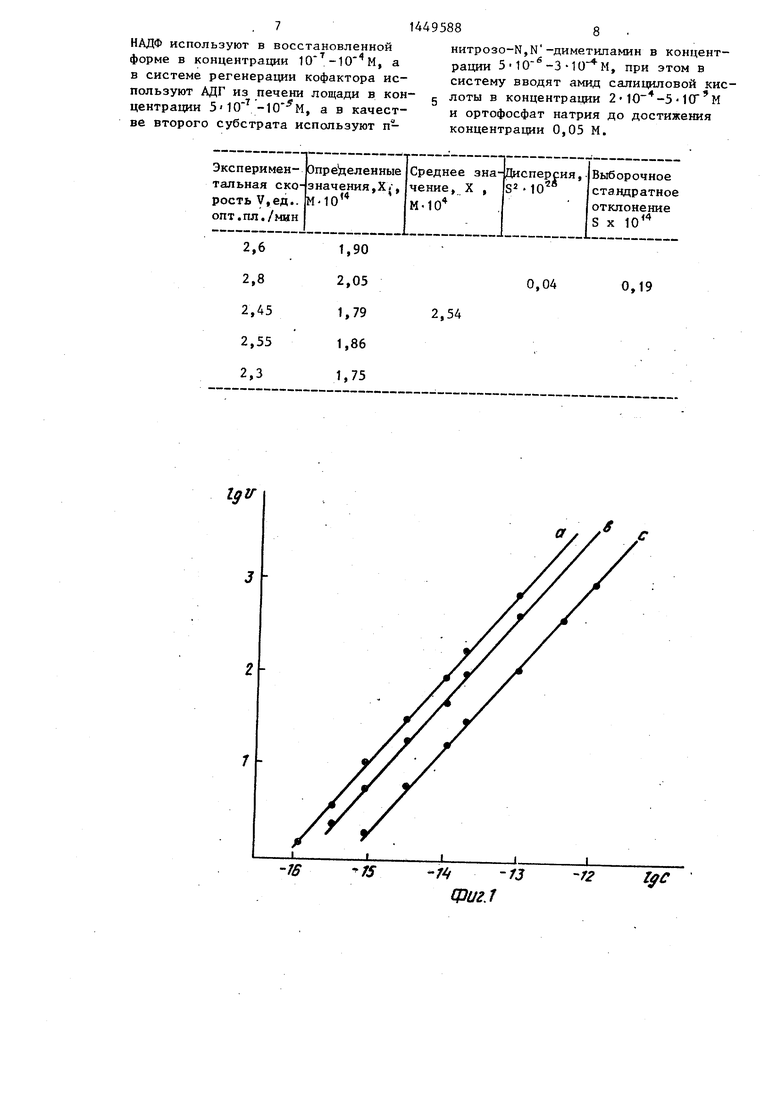
На фиг. 1-4 приведены зависимости наблюдаемой скорости (ед.опт.
тание оптической плотности за опре- деленньй промежуток времени (1 г-шн) Р /иакс 687 нм, что соответствует
ед.опт.пл./мин).
Полученная зависимость наблюдаемой скорости ферментативного восста. новления НДМА в системе регенерации 35 кофактора от концентрации щелочной Фосфатазы в инкубируемом растворе в логарифмических координатах приведена на фиг. 1 а. Видно, что с увеличением концентрации щелочной фосфата- 40 зы в области 10- -10- %, скорость реакции в системе пропорционально возрастает. Вследствие того, что очень высокие скорости реакции в системе в области больших концентраций щелочпл. X 10 мин- ) ферментативного вог- больших концентращ1й щело становления НДМА в сист мГрегенера- ° Фоефатазы технически трудно из- ции кофактора от концентрации С(М) рить, определение активности про- . щелочной Фосфатазы в раств в лога- Уменьшении концентраций
РИфмических координатах при «SIT ных РН буферной средыГфиг 1 - пН «ДМА « пр.) или при снижении рН рс- 9,1 (а), 8 5 (Ь) 8 . ° акционнои смеси, что уменьшает фер- „,L,.l .... J РИ раз- ментативную скорость реакции.
Пример 2. Определение активности щелочной Фосфатазы в растворе в области концентраций 10 -10 м с 55 использованием одноферментной системы регенерации кофактора.
А. Приготовляют раствор 0,05 М трис-НС буфера рН 8,0. Растворы реагентов готовятся из тех же веществ и
-7 /, ,j vi;/j, при различных концентрациях в системе НАДФН
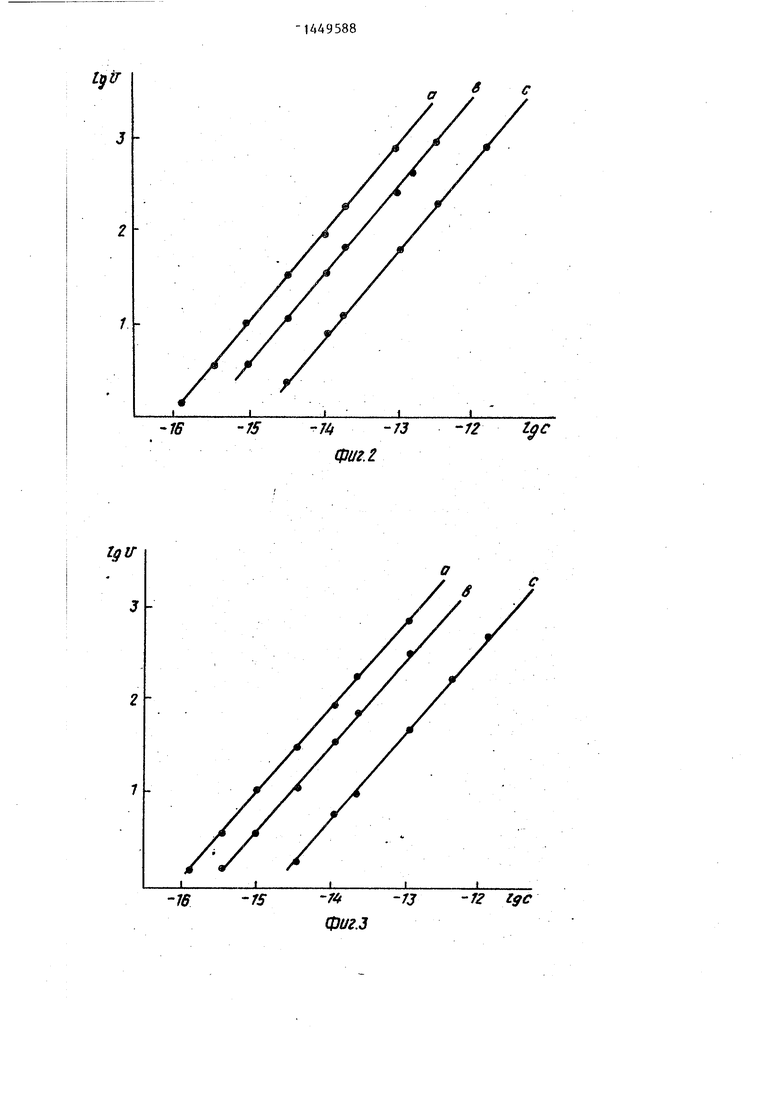
xtnV; l (b); 5 10 М (с), АДГСФИГ. 3 - (а)- 2,5ЧО- М (Ь); 5-10- (c)J.
Пример 1. Определение активности щелочной Фосфатазы в растворе в области концентраций
с использованием одноферментной систеЧ . J МГ/МТТ ДГ1Г 9П п-,/.
,, / ALK 0 мг/мл-, стандартные - ™- мы регенерации кофактора.
Приготовляют растворы 0,05 трис- буфера рН 9,1, содержащего: MRC1, 10-Н1, НАДФН в концентрации 5-10- М Na,P04 1 М,- АДГ Ю м в этом же буфере; зтанольные растворы НДМА 4- 4,5 мг/мл; АСК 20 мг/мл-, стандартные
,, / ALK 0 мг/мл-, стандартные - ™- т -±-- . t, y/UCJitlНОИ активностью 1000 U/мин-мг белка в области концентраций в воде или трис-НС буфере рН 8,0. В отдельной емкости готовят субг т -д- г;;;Гб; J.- определ.як,г возрас-
ПРИ vy h« 7 u ттт
тание оптической плотности за опре- деленньй промежуток времени (1 г-шн) Р /иакс 687 нм, что соответствует
°
ед.опт.пл./мин).
Полученная зависимость наблюдаемой скорости ферментативного восстановления НДМА в системе регенерации 35 кофактора от концентрации щелочной Фосфатазы в инкубируемом растворе в логарифмических координатах приведена на фиг. 1 а. Видно, что с увеличением концентрации щелочной фосфата- 40 зы в области 10- -10- %, скорость реакции в системе пропорционально возрастает. Вследствие того, что очень высокие скорости реакции в системе в области больших концентраций щелоч больших концентращ1й щело ° Фоефатазы технически трудно из- рить, определение активности про- Уменьшении концентраций
51449588.
в тех же концентрациях что ив приме-фермента. Полученные значения скоpfe 1, но рН используемого трис-НС1рости реакции переносят на калибробуфера равен 8,0, а конечная концент--вочную кривую (фиг. 1, кривая а),
HJIMA в реакционной смеси состав- gДля более точного нахояодения неизnke-r . Определение активностивестной концентрации щелочной фосфащ лочной фосфатазы проводят аналогич-тазы в исследуемом образце строят
н|э примеру 1. По полученным значениямкалибровочный график зависимости
с -роят капибровочную кривую зависи-скорости реакции от концентрации щем
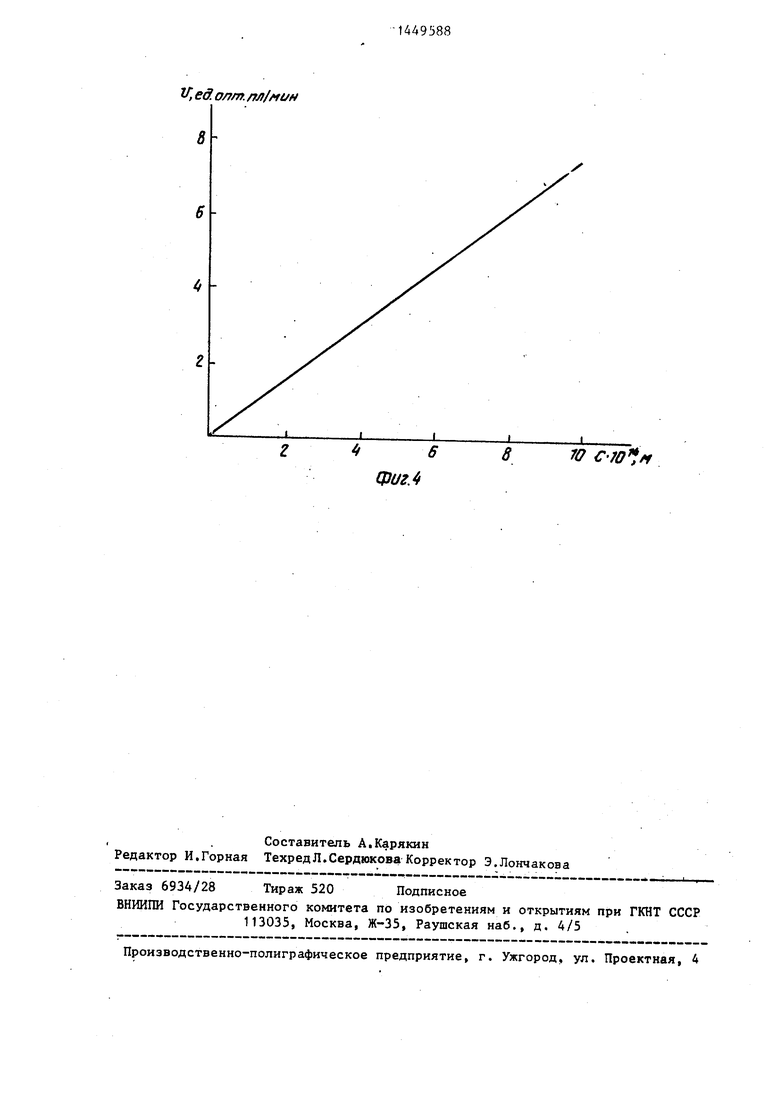
)сти скоростей ферментативной реак-10 лочной фосфатазы в растворе в нор- Ц)Ш в системе от концентрации щелоч- мальных координатах (У,ед.опт.пл./мин; нзй фосфатазы-в логарифмических коор- ), выбирая при этом соответст- динатах (фиг. 1, кривая с),Таующий более узкий диапазон концентБ. Все растворы реагентов и суб- раций щелочной фосфатазы 10 -1СГ М
сгратная смесь готовятся аналогично15 в растворе (фиг. 4), пэимеру 1 с использованием 0,05 М Полученные значения концентраций ТЭИС-НС1 рН 9,1, В кювету спектрофо- фермента в определяемом образце по тометра вносят 0,9 ми буфера, 0,1 мл калибровочной кривой приведены в стандартного образца и 10 мкл исход- таблице. Коэффициент вариации значеHJoro раствора НАДФН с конечной кон-20 иий составляет 7,5%.
центрацией в кювете . Даль--Коэффиикент вариации Kg -|-
нейшее проведение анализа выполняетсял
аналогично примеру 1, при этом конеч-si100% 7,5%. :
йая концентрация АСК в системе сос Предлагаемый способ определения
вляет Р.. Калибровочная кри-- активности щелочной фосфатазы отличая (с) приведена на фиг. 2.ется более высокой чувствительностью
В. Буферный раствор и растворы(до ) по сравнению с известным
реагентов приготовляются аналогично(до 10 М), экономичностью (вместо .
примеру 1. Субстратная смесь готовит-ДВух ферментов в системе определес1я так же, как в примере 1, но берут30 ния используется один - АДГ), -а его
1Ю мкл исходного раствора АДГ с кснеч-.проведение требует незначительных заЦой концентрацией в системе 6«10 Мтрат времени (15-20 мин, в известном
Ц соответственно 8,7 мл буфера, Ана-способе до 3 ч). ,
ЛИЗ проводится согласно методике при-Предлагаемый способ может найти
i-epa 1. Калибровочный график (с) «ирокое применение в твердофазном
Еисимости скорости ферментативнойиммуноферментном анализе антигенов и
реакции в системе от концентрацииантител при использовании щелочной
Щелочной фосфатазы приведен на фнг.З.фосфатазы в качестве-метки.
Таким образом, ферментативная скорость реакции в системе регенерации40Формулаизобрете н.и я 1|офактора линейно возрастает с увеличением концентрации щелочной фос- Способ определения активности фатазы. При отююнении от оптималь-щелочной фосфатазы, предусматривающий «ык условий определ.ения щелочной фос-инкубацию определяемого образца с фатазы в растворе (пример А-В) диапа-45 субстратом никоткнамидадениндинуклео- :ioH измеряемых ее концентраций смеща- тидфосфатом (НАДФ) в буферной среде в сторону больших величин почтис последующей спектрофотометрической la порядок.регистрацией продукта гидролиза в фер- Пример 3. Определение актив-ментативной системе регенерации кофак- ности щелочной фосфатазы в исследуе-50 тора, включающей алкогольдегидрогена- мом образце с использованием однофер-зу (АДГ) и два субстрата, одним из ментной системы регенерации кофакторакоторых является этанол, о т л и - Приготовляют растворы буфера, pea-чающийся тем, что, с целью Гентов и субстратной смеси аналогич-увеличения кувствительности, упрощено примеру 1. Определение активное-55 ускорения споосба определения, ти щелочной фосфатазы в образце про-инкубацию определяемого образца и ре- водят аналогично примеру 1, отбираягистрацию продукта гидролиза, ката- по 100 мкл образца для каждого изме-лизируемого щелочной фосфатазой, осу- рения вместо стандартного раствораществляют в трис-НС1 буфере рН 8,5-9,1,
НАДФ используют в восстановленной форме в концентрации , а в системе регенерации кофактора используют АДГ из печени лощади в концентрации 510 , а в качестве второго субстрата используют пHHTpo3o-N,N -диметиламин в концентрации 5 10 -3 , при этом в систему вводят амид салициловой кислоты в концентрации 2 КГ м и ортофосфат натрия до достижения концентрации 0,05 М.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения электропроводных фермент-ковакторных систем | 1975 |
|
SU593439A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ОСТРОГО ЭНДОМЕТРИТА ПОСЛЕ МЕДИЦИНСКОГО АБОРТА | 2010 |
|
RU2452377C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПОВТОРНЫХ ЦЕРЕБРОВАСКУЛЯРНЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНЬЮ В СОЧЕТАНИИ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА | 2010 |
|
RU2425640C1 |
| СПОСОБ ДИАГНОСТИКИ АСПИРИНОРЕЗИСТЕНТНОСТИ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | 2007 |
|
RU2348041C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СОСТОЯНИЯ НОВОРОЖДЕННЫХ ОТ ЖЕНЩИН С ГЕСТОЗОМ РАЗЛИЧНОЙ СТЕПЕНИ ТЯЖЕСТИ | 2009 |
|
RU2421732C2 |
| Способ прогнозирования формирования развернутой астматической триады у больных полипозным риносинуситом после полипотомии | 2018 |
|
RU2679414C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОБОСТРЕНИЙ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА В У ПОДРОСТКОВ | 2010 |
|
RU2437620C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОБОСТРЕНИЯ ХРОНИЧЕСКОГО ГЕПАТИТА С У ДЕТЕЙ ПОДРОСТКОВОГО ВОЗРАСТА | 2009 |
|
RU2412444C1 |
| СПОСОБ ПРОГНОЗА ЧУВСТВИТЕЛЬНОСТИ К ИНТЕРФЕРОНУ У БОЛЬНЫХ ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ | 2010 |
|
RU2437101C1 |
| СПОСОБ ПРОГНОЗА ПРОГРЕССИРОВАНИЯ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИИ У БОЛЬНЫХ ПОСТИНФАРКТНЫМ КАРДИОСКЛЕРОЗОМ | 2014 |
|
RU2554808C1 |
Изобретение относится к биотехнологии, а именно к способам определения активности щелочной фосфатазы, и может быть использовано в иммуно- ферментном анализе, микробиологической промышленности, аналитической химии и т.л. Цель изобретения - увеличение чувствитепьности, упрощение и ускорение определения. В качестве субстрата используют восстановленный никoтинa шдaдeнивдинyклeoтидфocфaт, регистрацию продукта гидролиза ведут в ферментативной среде регенерации кофактора, содержащей алкогольдегид- рогеназу из печени лошади и; два суб- . страта: этанол и п-нитрозо-М,м -димв- тиламин, при этом в систему вводят амид салициловой кислоты. 4 ил 1 табл. с S (Л
J
-16-/5-7«-73-12
ф1/г.2
Фиг.з
1I
-13 -12 IffC
/
Ю C fOfff
фиг. 4
| , ЕР № 27036, G 01 N 33/54, 1981 | |||
| Self С.Н | |||
| Enzyme araplification - -а general method applied to provide an immunoassisted ussay for placenta alkaline phosphatase | |||
| - I.Immu- nol | |||
| meth., 1985, v | |||
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
Авторы
Даты
1989-01-07—Публикация
1987-04-30—Подача