Изобретение относится к способу получения электропроводных фермент-ко- факторных систем, которые могут найти применение в ферментативных электро химических реакторах, ТОПЛИВНЬЕХ элементах и индикаторных электродах. Известен ряд способов получения иммобилизованных коферментов. Такие системы используются в основном для целей аминной хроматографии. Известен, в частности способ получения кофермекта никотинамидадениндшуклеотида (HA/f) ковалентно связанного с полиэтиленом С Это водорастворимое производное, обладающее коферментной активностью со сво бодной и связанной с матрицей дегидрогеназой (кофермент может быть восстановлен до НАДИ). Ковалентно связанное восстановленное производное НАДН) в свою очередь может быть окислено с участием лактатдегидрогеназы. Однако полученные до последнего времени продукты иммобилизации коферментов на нерастворимых и растворимых неэлектропровоцнь1х полимерах и продуктах неорганической природы непригодны для использования их в ферментативных электрохимических реакторах, топливных элементах и индикаторных электродах, вследствие их неспособности обеспечить электропроводность иммобилизованной системы. С целью получения ферменткофакторных систем, обладающих проводниковыми свойствами и способных обеспечить перенос заряда с иммобилизованных кофакторов на электропроводный материал матрицы, а также с целью разработки способа удаления с электропроводной основы отработанных неактивных веществ и нанесения на нее новых активных компонентов в предлагаемом способе сорбцию кофактора производят на различные электропроводные материалы (графит, окисленный графит, металлы, карбохромы). Замена инактивированных в процессе длительной работы кофактора и фермента на новые осуществляется посредстBOM десорбции в условиях, отличных от тех, в которых работает система - ферментиммобилизованный кофермент.
Предлагают способ получения электропроводных ферменткофакторных систем путем адсорбции кофакторов - никотинамидадениндинуклеотиаа в окисленной (НАД) или восстановленной (НАДН) форме, никотинамидапениндннуклеотидфосфат в окисленной (НАДФ) или восстановленной (НАДФН) формах или флавинаденин.динуклеотида в окисленной (ФАД) или восстановленной (ФАДН) формах - на различные электропроводные материалы - графит, окисленный графит,- металлы, карбохромы, с последующим контактированием полученной системы с раствором, содержащим соответствукяцие субстраты и ферменты.
Возможность получения фермент-ко- . факторных систем на различных электропроводных материалах проверена на системе; окисленный графит - НАД алкогольдегидрогеназа. Для этого кофермент НАД сорбируют из водного 0,015 М буферного раство15а фосфора . калия с рН 7,7 на гранулированный графит, который предварительно обрабатывают кипящей концентрированной азотной кислотой в течение 6 ч. Получен-. ная таким образом ферменткофермент- ная система прочно удерживается на электропроводном метериале - окисленном графите. Система работает в течение 250 ч в условиях работы системы фермент-кофактор, при этом не наблюдается заметной инакт1тации активных компонентов, В случае потери активности системы, например, во времени, осуществляют ее десорбцию водноспиртовой смесью (3:1) при рН Ю с последующей иммобилизацией активных компонентов.
Пример I. Из исходного раствора восстановленного никотинамидадениндинуклеотида (НАДНд) с концентрацией О,005 моль/л в буферном 0,0 15 М растворе фосфата калия с рН 7,7 берут аликвоту, содержшцую 26О 10 г -НАДН в 2 мл буферного раствора (количество взятого для сорбции НАДН проверяют спектрофотометрическим методом при 340 ммк в 1 см кювете, учитьтая, что коэ44ициент светопоглощения для НАДН, 6,2). Приготовленный раствор кофермента приливают к 0,1 г гранулиро ваннотх) гранита, преовзрительно окисленного кипящей концентрированной азотной кислотой в течение 6 ч. Сорбцию кофермента проводят при 5С в течение 1 ч и периодическом перемешивании. После сорбции графит отделяют от раствора и последний спектрофотометрируют. По разности исходных и конечных количеств НАДНа зпределяют величину сорбции. Для окисленного графита она соответствует 62%. Слабо связанный с сорбентом НАДН отмывают буферным раствором.
Количественное опрецеление иммобилизированного на графите НАДН осуществляют по цингиарин-сериокислотной методике C2j. Для этого готовят раствор, содержащий следующие компоненты: Oj 15 ммоль/мп буфера фосфата калия и рН 7,7, 5О мкмоль/мл этанола, 17 мкмоль/мл лактальдегица и 0,16 мг/ мл алкоголь дегидро ген азы (все компоненты реакционной смеси смешивают
при О С). 0,2 мл полученной смеси приливают в пробирки: со стандартными растворами, содержащими известное количество , , и с 0,1 г графита с сорбированным НАДН2 . Реакционные смеси инкубируют в термостате при 37 С в течение 45 мин, после чего графит отделяют от раствора, ферментативную реакцию останавливают добавлением I мл концентрированной серной кислоты
в выделенный и стандартные растворы. Растворы пцательно перемешивают и снова инкубируют при 70 С в течение 10 мин. Затем реакционную смесь охлаждают до комнатной температуры и
при тщательном перемешивании добавляют 40 мкл свежеприготовленного раствора нингидрина (3% нингидрина и 5% бисульфита натрия). Раствор оставляют стоять при комнатной темпе-ратуре в течение вО мин, затем в
смесь приливают еще 1 мл концейтри- .рованной серной кислоты и оставляют стоять при комнатной температуре в течение 5 мин. Оптическую плотность
раствора замеряют при 595 ммк. Количество сорбированного кофермента определяют по калибровочной кривой в зависимости от величины оптической плотности. Получают количественное
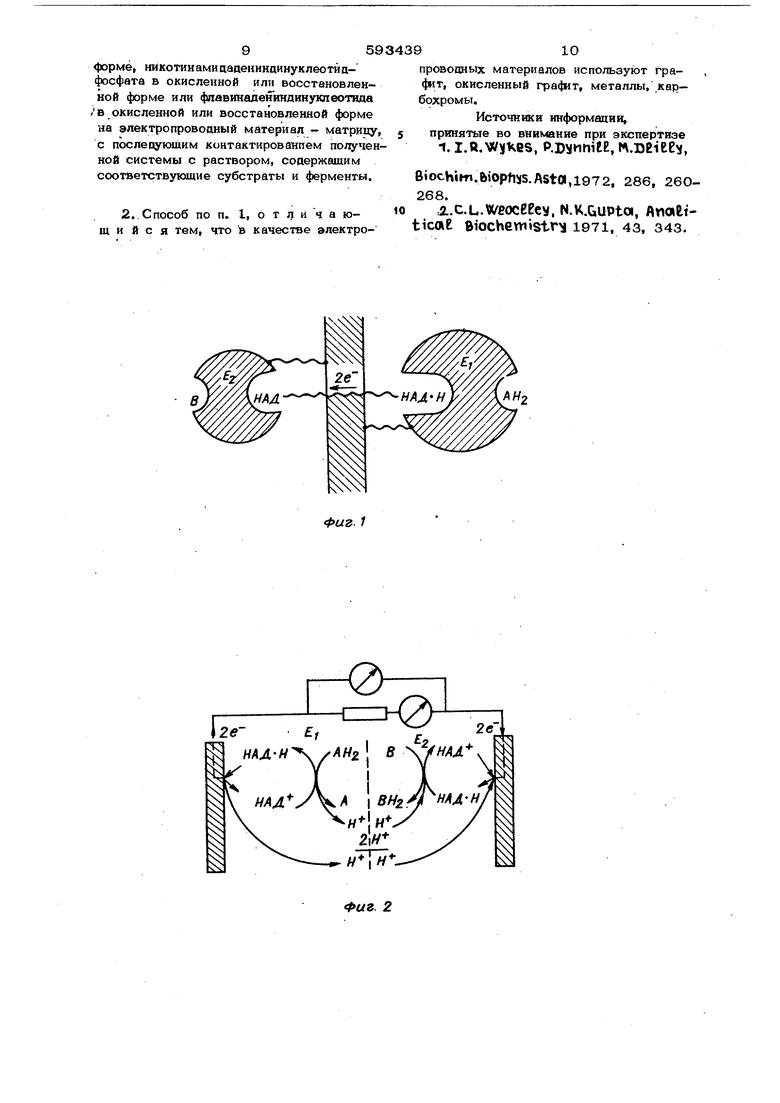
значение сорбированного НАДН , проявляющего физиологическую активность ь иммобилизованном состоянии. Оно равно 74% от общего количества кофермента, сорбированного на графит. 55 Многократные опыты по определению активности иммобилизованного на окисленную поверхность графита кофермента аают стабильное дают стабильные результаты. При м е р 2. К 100 мг карбохром прилршают 2,5 мл 0,002 М раствора КАДФН, соцержащего 0,015 М буферный раствор фосфата калия с рН . Количественную оценку содержания НАДФН осуществляют спектрофотомётрическим методом при 340 ммк в 1 см кварцевой кювете. Коэффициент светопоглощения для НАДФН равен Ез4о 6,3- 10 . Сорбцию проводят в течение 2,5 ч при 5 С , раствор затем отделяют центрифугированием и спектрофотометрируют, По разности исходных и конечных количеств НАДФН определяют величину сорбции. На карбохроме сорбция НАДФН составляет 4,8 мг на 1 г сорбента Много кратное промывание сорбента 0,0 15 М буферным раствором с рН 7,8и последую щее спектрофотометрирование промывных вод свидетельствует о стабильности иммобилизованной системы. Сорбцию коферментов НАДН И ФАД н карбохроме проводят аналогичным путем Разница лишь в том, что для ФАД в качестве буферного раствора используют 0,1 М раствор фосфата калия с рН 7,0, Коэффициент светопоглощения для ФАД 25,3 - 10 , Сорбция ФАД на карбохроме составляла-1,2 мг/г, НАДН3,1 .мг/г. Пример 3, К 10О мг окисленного графита приливают 2,5 мл О,ОО32 М раствора ФАД, содержащего 0,1 М буферный раствор фосфата калия с рН 7, Количество ФАД определяют спектрофото метрически по максимуму поглощения в области 260 ммк. Анализ выполняют в 1 см кварцевой кювете, 25,3 -10 . Сорбцию проводят в течение 2,5 ч при 5 С, затем раствор фильтруют :центрифугированием. По количеству ФАД до и после сорбции судят о ее величине. На 1 г окисленного графита сорбируегся 2,1 мг ФАД, Промывание сорбента 0,1 М буферным раствором с рН 7,0 и последующий анализ промывных эоц свидетельствует о стабильности полученной системы. Аналогично проводят сорбцию НАДФН на окисленном графите. Для этого исполь зуют О,О15 Мфосфатный буферный раствор с рН 7,8, Количественную оценку сорбции осуществляют спектрофотометрич 9 ки по максимуму поглощения при 340 ммк. Esf4o- 10 . Найдено, чтосорбция НАДФН на окисленном г рафите составляет 7,8 мг на I г сорбента. П р и м е р 4. 2,5 мл О,, раствора НАДФН Б 0,015 М раствора фосфата калия с рН 7,8 приливают к 1ОО мг платиновой черни. Сорбцию проводят fe течение 2,5 ч при С. Затем лорошок отделяют от раствора дентриф ггнрованием Раствор спектрофотометрирутот и определяют количество сорбированного НАДФН, На платиновой черни сор- . бируются 4,4 мг НАДФН на 1 г сорбента. Многократное промывание буфернымраствором сорбента с иммобилизованным НАДФН показывает стабильность системы, Аналогично проводят сорбцию коферментов НАДН и ФАД на платиновой черни. Величина сорбции НАДН 3,6 мг/г, ФАД 2,6 мг/г. Сорбция рассматриваемых коферментов на графите незначительна ( в пределах 0,1-О,5 мг на I г),- Восстановленные и окисленные формы коферментов сорбируются одинаково, П р и м е р 5. С целью доказательства способности фермент-кофакторной системы обеспечивать перенос заряда на электропроводный материал матрицы использован биологический топливный элемент, в котором ЭДС возникает за счет сопряженной ферментативной окислительно-восстановительной реакции. Перенос заряда в элементе достигается за счет того, что в качестве катализатора используется иммобилизованный на электропроводной основе ферк ент-кофа торный комплекс. В этом случае фермент и его кофактор явл5иотся частью электрода, на котором происходит непосредственный перенос заряда с материала электрода в активные центры ферментов, На фиг, I приведена схема реконструированной НАД-вависимой ферментатиЬнрй системы, где Е и иммобилизованные ферменты, АН и В - продукты окис, ления и восставовлениЯ5-на фиг. 2 - механизм работы двухэлектродной системы, построенной по указанному принципу на фиг. 3 - схема топливного элемента. Чтобы исключить возможность протекаия побочных процессов, используется симетричная система из эквивалентных псяуэлементов с одним и тем же НАД-зависимым ферментом и фоновым электролитом. В качестве модельной ферментативной системы выбрана алкогольцегицрогеназа(АДГ) в сочетании с никотинамидадениндинуклеотидом (НАД). Ферменткофакторная система получена иммобилизацией на электропроводной матрице. В качестве электролита используют О,О15 М фосфатный буфер с рН 7,7 на фоне 0,5 М раствора хлорида натрия. Электро химические исследования проводят в .микроячейках, изготовленных из полиметилметакрилата и фторопласта. В одном из полуэлементов проходит окислетаге спирта цо ацетальцегида, в другом восстановление лактальдегида до 1,2 пропандиола. В результате электрохимического сопряжения указанных процессов в системе возникает ЭДС. При замыкании полуэлементов через нагрузку в системе генерируется устойчивый ток. Биологический топливный элемент, работающий по предлагаемому способу, в котором используется иммобилизованная на электропроводном носителе фермент-кофакторная система, имеет ряд преимуществ; исключается стадия диффузии компонентов в объем.- раствора, а также перенос кофактора между электродом и ферментом, лимитирующие окислительно-восстановительную реак-. цию;обеспечиваетея эффективный перенос заряаа с кофермента на матрицу электрода; появляется возможность распространения этого принципа на многие ферменткофакторные системы, что позволяет использовать в топливных элементах самые разнообразные субстраты в качестве топлива и окислителя.
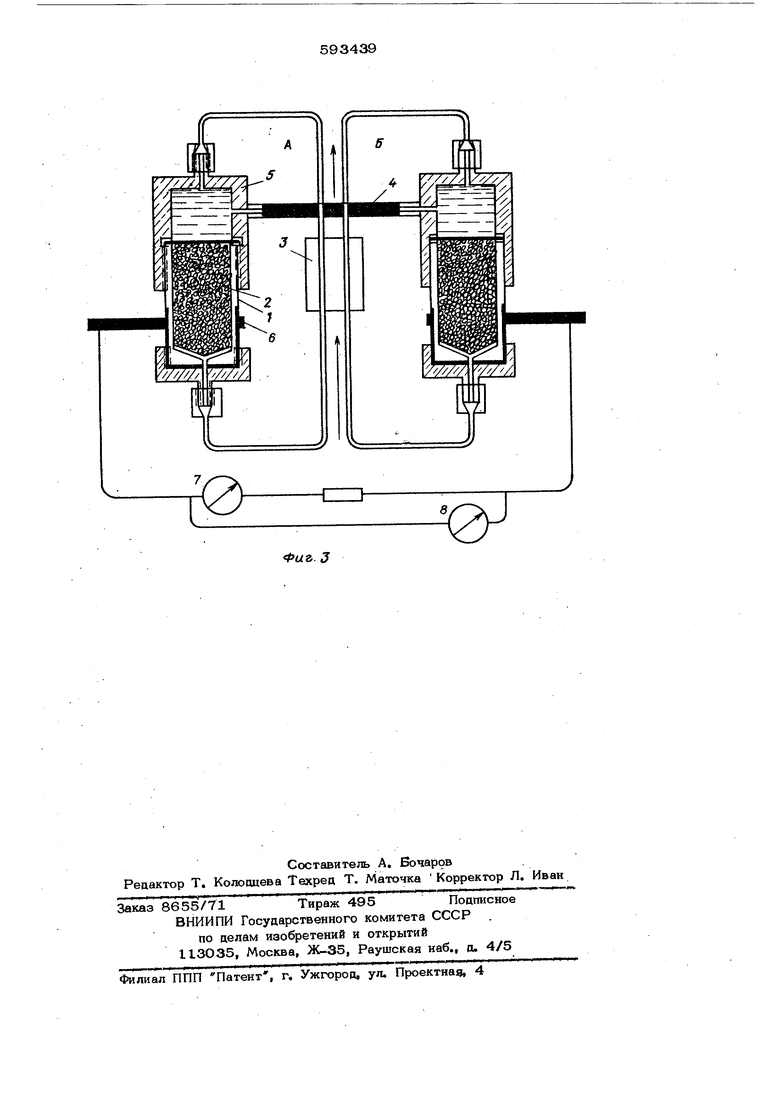
Топливный элемент состоит из симметричных эквивалентных камер А и Б. Графитовый электропроводный корпус I каме заполняется гранулированным окисленным гра4итом 2 с сорбированной ферменткофакторной системой. В целях эффектнаной подачи продуктов в зону реакции и удаления отработанных веществ проводят рециркул5щию растворов в камерах А и Б. Рециркуляцию субстратов осуществляю с помощью перестальтического насоса 3.
Электрическая схема топливного эле мента состоит из электролитического мотика 4, заполненного сефадексом в 0,0 15 М буферном растворе фосфата калия с рН 7,7 и содержащим 0,5 М
раствор хлорида натриа Для эффективного снятия заряда к омедненной снаружи поверхности 5 графитового корпуса I топливного элемента лрипаян контакт 6.
Для контроля тока .и напряжения, возникающего в результате ферментативных окислительно-восстановительных .процессов, используются микроамперметр
7и милливольтметр 8.
В качестве модели выбрана НАД-зависимая фермент-кофакторная система. Она создается сорбцией НАДНд на окисленном графите в растворе 0,О15 М буферного раствора фосфата калия с рН 7,7 и последующей иммобилизацией ферментаалкогольдегидрогеназы (АДГ),
8предлагаемой системе фермент АДГ участвует как в окислении этилового спита до аце та льде гида, так и в восстановлении лактальдегида в 1,2-пропанциол. Камера А биологического топливного элемента, в которой идет окисление спирта по схеме
СН5 СН 2.
CHj СНО + 2Н , содержит 1 М раствор этилового спирта в О,015 М фосфатном буферном растворе с рН 7,7 на фоне 0,5 М раствора хлорида натрия. Спирт, окисляясь, отдает .два электрона, которые посредством фермента по сопряженной
иммобиЛИЗированной алектропроводной цепи включающей кофактор, переносятся камеру Б4.
НАДН-2еНАД + Н , (камера А - генерация восстановленной формы кофактора)
ie
НАД + Н
.-НАДН, (камера Б - генерация окисленной формы кофактора) и затем принимают участие в восстановлении лактальцегида в 1,2пропандиол СН, СН (ОН) СН +
. CHgCH (ОН) СНдО
В камере Б используется 0,03 М раствор лактальдегида в фосфатном буферном растворе на фоне 0,5 М хлорида натрия.
Опыты показьтают, что реконструированная ферментативная.система может эксплуатироваться в течение длительного времени без потери каталитической %ктивности. Увеличение скорости рециркуляции субстратов приводит к значительному воэростанию тока, что обусловлено интенсификацией транспорта субстрата к ферментативной системе.
Фор .мул а изобретения
1, Способ получения электропроводных фер мент-кофакторных систем, о т л и ч аю.щ и и с я тем, что производят адсорбvjfao кофакторов икотинамидааенинаинуклеотида в окисленной или восстановленной 959 1юрмё, никотинамицацекинаинуклеотйафосфата в окисленной или восстановленной форме или фпавинадениндикухлеотнда в окисленной или восстановленной форме на электропроводный материал - матрицу, с последующим контактированием полученной системы с раствором, содержащим соответствующие субстраты и ферменты. 2. Способ по п. I, о т л и ч а ющ и и с я тем, что в качестве электропроводных материалов используют графкт, окисленный грабит, металлы, кар- бохромы. Источи (ОС и информации, принятые во внимание при экспертизе t.I.R., P.D MnitE,M.DEiEe j, B ochiw.biOpfiss.AStOi,1972, 286, 260268. ,2..c.L.WeocEBev, N.K.GUPtoi, AnatficaE Biochemists 1971. 43, 343.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения иммобилизованных никотинамидадениндинуклеотид (над)-зависимых ферментов | 1975 |
|
SU615087A1 |
| СПОСОБ ДИАГНОСТИКИ АСПИРИНОРЕЗИСТЕНТНОСТИ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | 2007 |
|
RU2348041C1 |
| ФОТОБИОКАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ ВОССТАНОВЛЕННЫХ ФОРМ НИКОТИНАМИДНЫХ КОФЕРМЕНТОВ NADH ИЛИ NADPH И ФОТОКАТАЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ NADH ИЛИ NADPH | 2009 |
|
RU2416644C1 |
| Способ получения иммобилизованной холинэстеразы | 1987 |
|
SU1472503A1 |
| Способ приготовления электродов для количественного электрохимического определения 1,4-дигидроникотинамида аденин динуклеотида (NA DH) в растворе | 1988 |
|
SU1806187A3 |
| Способ прогнозирования формирования развернутой астматической триады у больных полипозным риносинуситом после полипотомии | 2018 |
|
RU2679414C1 |
| Способ определения активности никотинамидных дегидрогеназ | 1984 |
|
SU1255934A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОБОСТРЕНИЙ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА В У ПОДРОСТКОВ | 2010 |
|
RU2437620C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОЙ ГЛЮКОАМИЛАЗЫ | 2000 |
|
RU2181770C2 |
| Способ определения активности щелочной фосфатазы | 1987 |
|
SU1449588A1 |

Фаг. 2
Авторы
Даты
1980-10-07—Публикация
1975-08-04—Подача