Изобретение относится к иммунохимии и иммунологии, в частности к способам автоматизированного анализа взаимодействия биологических клеток с индикаторными частицами, мечеными флуорохромом.
Целью изобретения является упрощение и повышение точности определения количества меченых клеток относительно их общего количества.
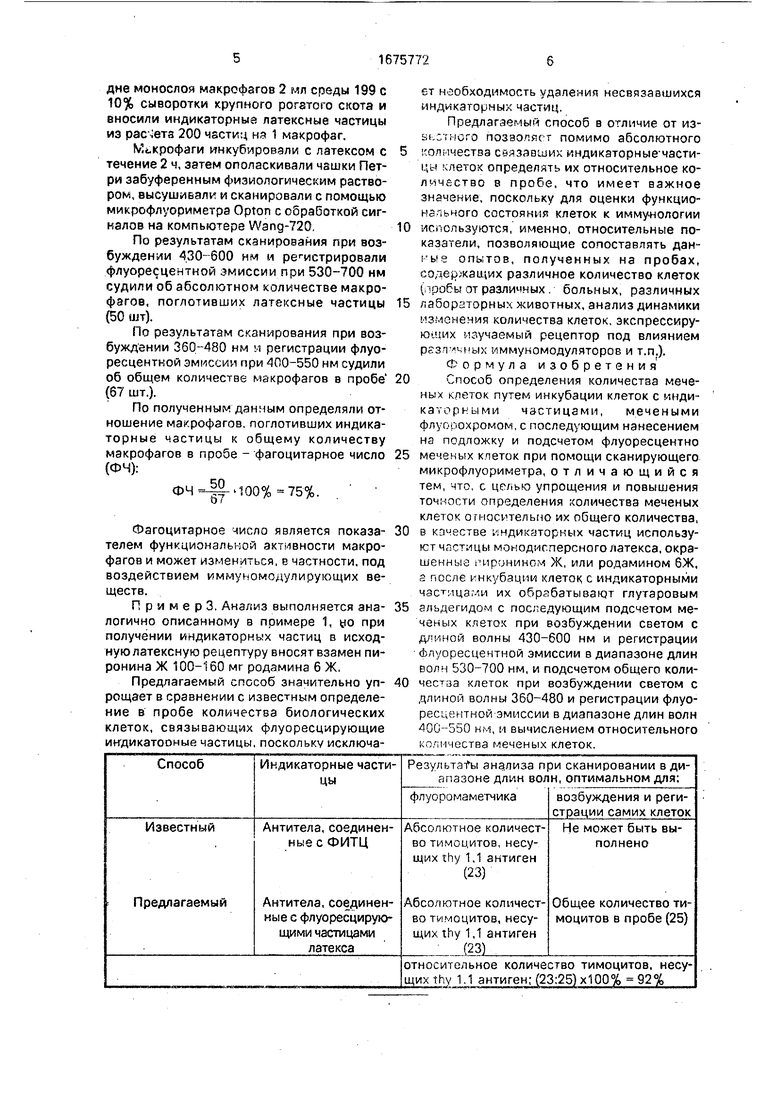
На фиг.1 изображена гистрограмма распределения по амплитуде сигналов от розеток тимоцитов мыши с флуоресцентными латексными частицами, мечеными пирони- ном Ж при длине волны возбуждающего света 430-600 нм с регистрацией флуоресцентной эмиссии в диапазоне длин волн от 530 до 700 нм; на фиг,2 - гистограмма распределения по амплитуде сигналов от всех (как меченых, так и немеченых) биологических клеток. Длина волны возбуждающего света ЗбСЬ-480 не, регистрация флуоресцентной эмиссии 400-550 нм; на фиг.З - гистограмма распределения сигналов по амплитуде при окраске тимоцитов флуоресцирующими антителами по известному способу (возбуждение 360-480 не и регистрация 400-550 нм; на фиг,4 - гистограмма распределения сигналов от сенсибилизированных латексных частиц до внесения тимоцитов.
Гистрограмма распределения сигналов от розеток сенсибилизированных латэкс- ных частиц с тимоцитами, несущими thy 1,1 антиген при облучении их светом с длимой1 волны 430-600 нм (преимущественно 500 нм) и регистрацией флуоресцентной эмиссии в диапазоне длин волн 530-700 нм (преимущественно 560 нм) приведена на фиг,1.
Количество импульсов в пике гистограммы (23 импульса) соответствует количеству латексных розеток в анализируемом препарате. При визуальном наблюдения видны ярко-красные латексные розетки, Затем сканирующий стол возвращали в исходное положение и сканировали тог же препарат при возбуждении светом с длиной волны 360-480 нм (преимущественно 450 нм). Флуоресцентную эмиссию регистрировали в диапазоне длин волн от 400 до 550 нм (преимущественно 580 нм). При визуальном наблюдении видна ярко-зеленая флуоресценция тела тимоцитов.
Количество импульсов в пике гистограммы (фиг.2, 25 импульсов ) соответствует общему количесту тимоцитов в анализируемой пробе.
По результатам сканирования вычисляли отношение количества тимоцитов, несущих thy 1,1 антиген, к общему количеству
ОТ
тимоцитов в пробе: -Ц-100% 92%.
При выполнении анализа известным способом в качестве индикаторных частиц использовали моноклональные антитела, меченые флуоресценизотиоцианатом
(ФИТЦ).
Гистограмма сигналов, получаемых при сканировании тимоцитов, обработанных специфическими антителами, мечеными ФИТЦ, представлена на фиг.З.
П р и м е р 1, Примером пробы, содержащей биологические клетки, является суспензия тимоцитов мыши в забуферном физиологическом растворе рН 7,4.
Индикаторные частицы, меченые фпуо- рохромом, получали нагреванием 1,5%-но- го раствора меламина в 3%-ном растворе формальдегида с добавлением 10-160 мг флуоресцентного красителя пиронина Ж, Нагревание проводили на кипящей водяной бане до помутнения.
Полученную, таким образом, суспензию монодисперсных флуоресцирующих латексных частиц отмывали декантацией и сенсибилизировали монокловальными антитела и к thy 1,1 антигену путем коваленг- ного присоединений их с помощью глутарового альдегида.
Сенсибилизированные флуоресцирующие индикаторные частицы добавляли в
0 пробу, содержащую тимоциты мыши линии СВА в концентрации 1 х 106 кл/мл из расчета 300 индикаторных частиц на 1 тимоцит,
Тимоциты инкубировали в течение 1 ч, после чего проводили обработку их глутаро5 вым альдегидом, добавляя его к пробе до конечной концентрации 0,2%.
Пробу инкубировали с глутаровым альдегидом а течение 1 ч, после чего каплю суспензии наносили на предметное стекло,
0 накрывали покровным стеклом и края стекла парафинировали.
Полученный таким образом препарат анализировали с помощью микрофлуори- метра Opton со сканирующим столом. Обра5 ботку сигналов проводили с помощью компьютера Wang-720.
По да -.ным сканирования при проведение анализа известным способом, можно установить абсолютное количество меченых
0 тимо дигов в пробе (23), но нельзя определите их относительное количество (см. таблицу 1).
Из гистограммы (фиг.4) видно, что сигналы от несвязавшихся латексных частиц
5 легко отдифференцировать от сигналов ла- тексных розеток по амплитуде (Np). Поэтому анализ по предлагаемому способу проводится гомогенно, без удаления непрореагировавших индикаторных частиц, меченых
0 флуорохромом, что снижает трудоемкость проведения анализа в сравнении с известным способом, в котором несвязавшиеся флуоресцирующие индикаторные частицы необходимо удалить фильтрацией либо мно5 гократным центрифугированием.
Пример 2. В качестве примера пробы, содержащей биологические клетки, использовалась суспензия перитональных макрофагов мыши линии СВА в среде 199 с
0 10%-ной инактивированной сыворотки .крупного рогатого скота,
Индикаторные частицы получали как описано в примере 1, но не подвергали сенсибилизации антителами.
5 2 мл суспензии макрофагов с концентрацией 1 х 106 кл/мл наслаивали на поверхность пластиковой чашки Петри диаметром 40 мм и инкубировали в течение 1 ч. Затем чашку ополаскивали средой 199, наслаивали на поверхность образовавшегося на ее
дне монослоя макрофагов 2 мл среды 199 с 10% сыворотки крупного рогатого с(сота и вносили индикаторные латексные частицы из расчета 200 частиц н 1 макрофаг.
Ме-крофаги инкубировали с латексом с течение 2 ч, затем ополаскивали чашки Петри забуференным физиологическим раствором, высушивали и сканировали с помощью микрофлуориметра Qpton с обработкой сигналов на компьютере Wang-720,
По результатам сканирования при возбуждении 430-600 нм и регистрировали флуоресцентной эмиссии при 530-700 нм судили об абсолютном количестве макрофагов, поглотивших латексные частицы (50 шт).
По результатам сканирования при возбуждении 360-480 нм п регистрации флуоресцентной эмиссии при 400-550 нм судили об общем количестве макрофагов э пробе (67 шт.).
По полученным данным определяли отношение макрофагов, поглотивших индикаторные частицы к общему количеству макрофагов в пробе - фагоцитарное число (ФЧ):
ФЧ-50
100% 75%.
Фагоцитарное число является показателем функциональной активности макрофагов и может измениться, в частности, под воздействием иммуномсдулирующих веществ.
ПримерЗ. Анализ выполняется аналогично описанному в примере 1, но при получении индикаторных частиц в исходную латексную рецептуру вносят взамен пи- ронина Ж 100-160 мг родамина 6 Ж,
Предлагаемый способ значительно упрощает в сравнении с известным определение в пробе количества биологических клеток, связывающих флуоресцирующие икдикатооные частицы, поскольку исключает необходимость удаления несвязавшихся индикаторных частиц.
Предлагаемый способ в отличие от известного позаочяс г помимо абсолютного
количества связавших индикаторные части- цы клеток определять их относительное количество в пробе, что имеет важное значение, поскольку для оценки функционального состояния клеток к иммунологии
используются, именно, относительные показатели, позволяющие сопоставлять дан- кые опытов, полученных на пробах, содержащих различное количество клеток лробы от различных больных, различных
лабораторных животных, анализ динамики изменения количества клеток, экспрессиру- ющих изучаемый рецептор под влиянием различных мммуьомодуляторов и т.п.). Формула изобретения
Способ определения количества меченых клеток путем инкубации клеток с мнди- каторными частицами, мечеными флуорохромом, с последующим нанесением на подложку и подсчетом флуоресцентно
меченых клеток при помощи сканирующего микрофлуориметра, отличающийся тем, что, с це/sbK) упрощения и повышения точности определения количества меченых клеток относительно их общего количества,
в качестве индикаторных частиц используют частицы монодмгперсного латекса, окра- шенные рирининсм Ж, или родамином 6Ж, а после инкубации клеток с индикаторными частицами их обрабатывают глугарозым
альдегидом с последующим подсчетом меченых клеток при возбуждении светом с длиной волны 430-600 нм и регистрации Флуоресцентной эмиссии в диапазоне длин волн 530-700 нм, и подсчетом общего количестаэ клеток при возбуждении светом с длиной волны 360-480 и регистрации флуоресцентной эмиссии в диапазоне длин волн 400-550 нм, и вычислением относительного количества меченых клеток.
1234 56 1 89 Wtfp Фиг.З
П3456Т8910 Фм.2
8
W
Ъ

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2007 |
|
RU2339953C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2008 |
|
RU2379691C1 |
| МИКРОФЛУОРИМЕТР ДЛЯ ИССЛЕДОВАНИЯ ФЛУОРЕСЦЕНЦИИ ОДИНОЧНЫХ КЛЕТОК | 2010 |
|
RU2442140C1 |
| Способ проведения биологического микроанализа | 2019 |
|
RU2710262C1 |
| СПОСОБ ДИСКРИМИНАЦИИ ПО МЕНЬШЕЙ МЕРЕ ДВУХ КЛЕТОЧНЫХ ПОПУЛЯЦИЙ И ЕГО ПРИМЕНЕНИЕ | 2006 |
|
RU2397494C2 |
| СПОСОБЫ И СРЕДСТВА | 2005 |
|
RU2480770C2 |
| НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ ОСНОВАННЫЙ НА FRET ДАЛЬНЕ-КРАСНЫЙ БИОСЕНСОР ДЛЯ ИЗМЕРЕНИЯ АКТИВНОСТИ КАСПАЗЫ 3 ВНУТРИ КЛЕТОК | 2013 |
|
RU2535981C1 |
| СЕКВЕНИРОВАНИЕ С ПОМОЩЬЮ ОДИНОЧНОГО ИСТОЧНИКА СВЕТА И ДВУХ ОПТИЧЕСКИХ КАНАЛОВ | 2018 |
|
RU2736384C1 |
| СПОСОБ НЕКОВАЛЕНТНОЙ ФИКСАЦИИ ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДОВ НА ВНЕШНЕЙ ПОВЕРХНОСТИ ЖИВЫХ КЛЕТОК | 2007 |
|
RU2394916C2 |
| СПОСОБ ЛЮМИНЕСЦЕНТНОГО ИММУНОАНАЛИЗА | 1992 |
|
RU2009505C1 |
Изобретение относится к области иммунохимии и иммунологии и к исследованиям биологического материала путем азтсм8- тического анализа его взаимодействия с флуоресцентной меткой и может быть использовано в иммунологии и иммунохимии при проведении научных исследований. Целью изобретения является упрощение и повышение точности определения количества меченых клеток относительно их общего количества. Способ включает инкубацию пробы с флуоресцирующим индикаторным материалом, облучение возбуждающим светом регистрацию флуоресцентной эмиссии с помощью сканирующего микро- флуориметра. В качестве флуоресцирующего индикаторного материала используют флуоресцентный латекс, а пробу дополнительно флуорохромируют. Затем проводят облучение возбуждающим светом з диапазоне длин волн от 360 до 480 нм с регистрацией флуоресцентной эмиссии в диапазоне длин вели от 400 дл 550 нм и от 430 до 600;нм с регистрацией флуоресцентной эмиссии в диапазоне длин волн от 530 до 700 нм, затем полученные результаты сравнивают между собой и по результатам сравнения судят о количестве меченых клеток, связавшихся с флуоресцирующим индикаторным материалом, относительно общего числа клеток з пробе. Анализ прово- .дят гомогенно, без разделения связавшегося и не связавшегося с биологическими частицами индикаторного материала. Способ прост в исполнении и позволяет помимо абсолютного количества связавших индикаторные частицы клеток, определять их относительное количество в пробе. 4 ил. О XI sj ю

| Патент США № 3902971, 1965. |
Авторы
Даты
1991-09-07—Публикация
1988-12-26—Подача