Изобретение относится к иммунологии, в частности к медицинской и ветеринарной микробиологии и вирусологии, и может быть использовано для диагностики заболеваний человека и животных.
Известен способ гомогенного иммуноанализа с использованием люминесцирующих метчиков (флуорохромов). Способ основан на том, что при образовании комплексов антиген/антитело (АГ-АТ) резко изменяется их подвижность, что приводит к поляризации флуоресценции метчика, ковалентно связанного с одним из компонентов пары АГ-АТ. Однако, этот способ пригоден для определения антигенов в пробах, не содержащих люминесцирующих и рассеивающих свет примесей, так как фоновые люминесценция и рассеянный свет снижают чувствительность анализа и ограничивают область применения способа.
За прототип принят способ, основанный на эффекте переноса энергии света с метчика-донора на метчик акцептор. При осуществлении способа в кювету с пробой вносят растворы, содержащие антитела к искомому антигену, одна часть которых мечена флуоресцеином, а другая - эозином. Возбуждение флуоресценции пробы осуществляют на длине волны максимума поглощения флуоресцеина (донора) 495 нм, а прием люминесценции осуществляют на длине волны 545 нм, соответствующей флуоресценции эозина (акцептора).
При отсутствии в пробе искомого антигена эффективность переноса энергии излучения донора в области 520 нм на молекулу акцептора, имеющего максимум поглощения в этой области, невелика, интенсивность люминесценции ограничена и определяется только остаточным уровнем поглощения акцептора в области 495 нм.
При наличии в пробе искомого антигена происходит образование комплексов антигенов и антител. Антитела, меченные флуоресцеином и эозином, "концентрируются" на антигенах, в результате чего эффективные расстояния между молекулами флуоресцеина и эозина сокращаются до 100  и резко возрастает вероятность переноса энергии излучения с донора на акцептор. При этом наблюдается увеличение сигнала флуоресценции эозина в области 545 нм.
и резко возрастает вероятность переноса энергии излучения с донора на акцептор. При этом наблюдается увеличение сигнала флуоресценции эозина в области 545 нм.
По уровню сигнала в области люминесценции акцептора по сравнению с контролем (без антител) судят о наличии и концентрации искомого антигена в пробе.
Если в пробе имеются люминесцирующие и рассеивающие примеси, то при облучении светом создается дополнительный шумовой фон люминесценции и рассеяния, уровень которого может быть сравним с полезным сигналом при анализе небольших концентраций исследуемых веществ.
Существующие методы гомогенного иммуноанализа, основанные на поляризации флуоресценции или переносе энергии с молекулы донора на молекулу акцептора, пригодны только для анализа водорастворимых, преимущественно низкомолекулярных, соединений.
Анализ низких концентраций корпускулярных антигенов (клеток, микроорганизмов и т. п. ), обладающих высоким уровнем светорассеяния и собственной люминесценции, невозможен с помощью известных методов из-за наличия дополнительного шумового фона, обусловленного сигналами светорассеяния и люминесценции.
Снижение этих сигналов при проведении гомогенного иммуноанализа достигается за счет того, что в известном способе, включающем добавление в пробу антител, меченных двумя люминесцирующими соединениями, одно из которых является донором, а другое - акцептором, возбуждение люминесценции в полосе поглощения донора, регистрацию люминесценции в полосе излучения акцептора, заключение о наличии искомого антигена в пробе по результатам сравнения полученного и контрольного сигналов, в качестве соединения донора используют флуоресцеин изотиоцианат, в качестве соединения акцептора - металлокомплекс порфирина, пробу обрабатывают сульфитом натрия, а люминесценцию акцептора регистрируют с задержкой во времени между актами возбуждения и регистрации, эквивалентной времени затухания металлокомплекса порфирина.
Металлокомплексы Pd и Pt порфиринов, во-первых, имеют очень маленький коэффициент поглощения в области возбуждения флуоресцеин изотиоцианат, во-вторых, способны длительно фосфоресцировать с высоким квантовым выходом в водных растворах при комнатной температуре, т. е. их фосфоресценция в водных растворах, в отличие от большинства других ароматических и гетероциклических соединений, остается высокой при ковалентном связывании с антителами. Время задержки между актами возбуждения и измерения люминесценции, на 6 порядков превышающее время затухания флуоресценции, позволяет уменьшить влияние сигналов фоновой флуоресценции и светорассеяния примесей. Обработка пробы сульфитом натрия позволяет устранить тушащее действие кислорода, растворенного в воде. При этом вся совокупность признаков позволяет снизить фоновый и увеличить полезный сигнал.
Способ осуществляется следующим образом. Методики получения конъюгатов антител известны.
П р и м е р 1. Определение иммуноглобулина человека.
В кварцевую кювету объемом 3 мл вносят по 1 мл конъюгата специфичных к IgG человека антител, кроличьих, меченных Pt копропорфирином III и флуоресцеин изотиоцианатом концентрацией 1 мкг/мл. Смесь конъюгатов представляет собой изотоничный раствор хлорида натрия с 15 мМ фосфатного буфера и 2 мг сульфита натрия при рН 7,8. Сульфит натрия добавляют в пробу для устранения тушащего действия кислорода, растворенного в воде. Кювету помещают в фосфориметр LS - 5В (фирмы Perkin - Elmer, США), облучают светом с длиной волны λex 460 нм и регистрируют фосфоресценцию пробы в области λem 645 нм при времени задержки между актом возбуждения и приемом люминесценции td = 0,04x x10-3 с и времени измерения строба люминесценции tg = 0,2 ˙ 10-3 с.
Затем в кювету вносят анализируемую пробу - сыворотку человека в объеме 10 мкл в разведении 1 : 10; после в контрольную кювету вносят сыворотку кролика в том же объеме и концентрации. Обе кюветы облучают светом с длиной волны λex 460 нм, регистрируют фосфоресценцию на λem645 нм. Сигнал в рабочей кювете от исследуемой пробы возрос с 3,0 отн. ед. в контроле до 8,2 отн. ед. в рабочем опыте, что указывает на наличие IgG человека в пробе. Сигнал в контрольной кювете остался без изменения.
П р и м е р 2. Определения микроорганизмов F. tularensis.
В кювету объемом 3 мл вносят по 1 мл конъюгатов лошадиных антител с флуоресцеин изотиоцианатом и Pd копропорфирином I, специфичных к микроорганизмам F. tularensis. Концентрация каждого конъюгата 2 мкг/мл. Смесь конъюгатов представляет собой изотоничный раствор хлорида натрия с 15 ммоль фосфатного буфера рН 7,4 и 2 мг сульфита натрия в концентрации 3 мг/мл. Кювету помещают в фосфориметр Perkin - Elmer LS-5В и регистрируют фосфоресценцию пробы при λex 480 нм, λem 665 нм, td = 0,1 ˙ 10-3 с и tg = 1 ˙ 10-3 с.
Затем в кювету последовательно вносят различные концентрации корпускулярных частиц антигена F. tularensis. Каждая порция антигена объемом 10 мкл содержит соответственно 106, 107, 108, 109 м. т F. tularensis. Параллельно в контрольную кювету, содержащую лошадиные конъюгаты антител, вносят гетерологичный антиген E. Coli М-17 в тех же концентрациях. Пробу снова облучают светом при λex 480 нм, регистрируют фосфоресценцию на длине λem 665 нм. Сигнал в рабочем опыте увеличился с 4,0 отн. ед. до 4,2; 5,6; 7,6 соответственно в зависимости от концентрации антигена в пробе. В контрольной пробе сигнал остается без изменения.
П р и м е р 3. Определение вируса осповакцины.
В кварцевую кювету вносят конъюгаты лошадиных антител с флуоресцеин изотиоцианатом и Pt уpопорфирином, специфичных к вирусу осповакцины. Объем и концентрация антител и режим регистрации аналогичны примеру 1.
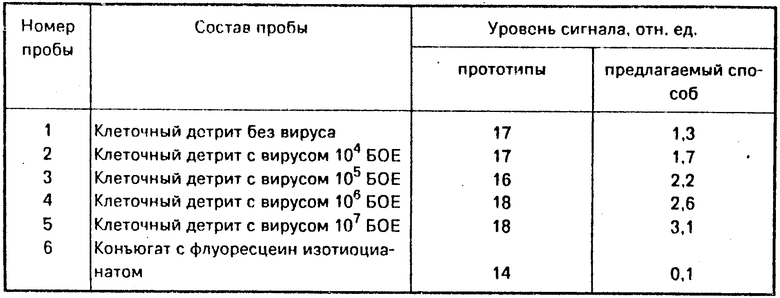
После регистрации исходного уровня сигнала в кювету последовательно вносят различные концентрации клеточного детрита теленка, содержащего вирус осповакцины в концентрациях от 104 до 107 БОЕ (бляшкообразующих единиц) по данным предварительного титрования на культуре клеток. Параллельно в контрольную кювету вносят клеточный детрит без вируса осповакцины.
В таблице представлены результаты анализа опытных и контрольных проб, а также сравнительный анализ уровня сигнала от конъюгата с флуоресцеин изотиоцианатом и клеточного детрита с вирусом в режиме флуоресценции.
Как видно из экспериментальных данных предлагаемый способ обеспечивает определение вируса осповакцины в клеточном детрите - на фоне флуоресцирующих примесей. Сигнал флуоресценции с 1,3 отн. ед. в пробе без вируса увеличивается до 3,1 отн. ед. для пробы с 107 БОЕ.
Уровень сигнала при осуществлении способа - прототипа практически остается неизменным из-за высокого фонового уровня клеточного детрита.
Способ пригоден для анализа не только растворимых, но и корпускулярных антигенов (клеток, микроорганизмов и т. п. ), обладающих высоким уровнем светорассеяния и собственной флуоресценции, который соизмерим с уровнем люминесценции вводимых в пробу аналитов и может быть использован в здравоохранении для диагностики заболеваний человека. (56) Заявка РСТ N 87/07385, МКИ G 01 N 33/533.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ТВЕРДОФАЗНОГО ЛЮМИНЕСЦЕНТНОГО ИММУНОАНАЛИЗА КОМПОНЕНТОВ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ | 1994 |
|
RU2082982C1 |
| СПОСОБ ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ КЛЕТОК МИКРООРГАНИЗМОВ И ВИРУСОВ | 2001 |
|
RU2197732C1 |
| УСТРОЙСТВО ДЛЯ ИЗМЕРЕНИЯ КОНЦЕНТРАЦИИ КИСЛОРОДА В ЖИДКОСТЯХ И ГАЗАХ | 1999 |
|
RU2156969C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2007 |
|
RU2339953C1 |
| СПОСОБ ЛИПОСОМАЛЬНОГО ИММУНОАНАЛИЗА ДЛЯ ДЕТЕКТИРОВАНИЯ АНАЛИТОВ В ОБРАЗЦЕ | 2001 |
|
RU2203495C2 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2008 |
|
RU2379691C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА | 2001 |
|
RU2184970C1 |
| Способ твердофазного фосфоресцентного иммуноанализа | 1989 |
|
SU1679382A1 |
| Маркер для люминесцентного иммуноанализа | 1990 |
|
SU1707539A1 |
| Способ проведения иммуноанализа | 1988 |
|
SU1561042A1 |
Изобретение относится к иммунологии и может быть использовано в медицинской и ветеринарной микробиологии для диагностики заболеваний человека и животных. Цель - повышение чувствительности способа. При определении люминесцентного иммуноанализа в пробу добавляют антитела, меченные двумя люминесцентными соединениями, одно из которых является донором, например флуоресцеин изотиоцианат, а другое - акцептором, например металлокомплекс порфирина. Пробу обрабатывают сульфитом натрия и регистрируют люминесценцию с задержкой во времени между актами возбуждения и регистрации, эквивалентной времени затухания люминесценции металлокомплекса порфирина. 1 табл.
СПОСОБ ЛЮМИНЕСЦЕНТНОГО ИММУНОАНАЛИЗА, включающий добавление в пробу антител, меченных двумя люминесцентными соединениями, одно из которых является донором, а другое - акцептором, возбуждение люминесценции в полосе поглощения донора, регистрацию люминесценции в полосе излучения акцептора и заключение о наличии антигена в пробе по результатам сравнения полученного и стандартного сигналов, отличающийся тем, что в качестве соединения донора используют флуоресцеин изотиоцианат, в качестве соединения акцептора - металлокомплекс порфирина, пробу обрабатывают сульфитом натрия, а люминесценцию регистрируют с задержкой во времени между актами возбуждения и регистрации, эквивалентной времени затухания люминесценции металлокомплекса порфирина.
Авторы
Даты
1994-03-15—Публикация
1992-02-04—Подача