Изобретение относится к биоаналитической химии и может быть использовано при оценке токсичности объектов окружающей среды, исследовании антиферментативной активности природных и синтетических лекарственных препаратов, веществ пестицидного типа и т.п.
Известны методы определения антиферментативной активности химических соединений, основанные на изучении степени ингибирования активности ферментов в присутствии исследуемых соединений.
Недостатком данных методов является необходимость проведения большого количества экспериментов для получения граду- ировочных графиков, по которым затем возможно определение равновесных (только) констант взаимодействия исследуемых веществ с биокатализатором (основная характеристика соединения); а также отсутствие возможности непосредственного определения степени обратимости взаимодействия эффекторов с ферментными системами.
Наиболее близким к предлагаемому является способ с использованием прочной системы, в котором ингибирующих свойств химического соединения проводится по степени подавлекйя активности ката- лазы, раствор которой вместе с раствором субстрата и ингибитора подается в капиллярный реактор, где происходит биокаталитический процесс. Скорость этого процесса регистрируется на выходе реактора по изменению концентрации продукта или субстрата. Процесс осуществляют следующим образом: в реактор пропускают смесь потоков субстрата и фермента, при этом регистрируют фоновое значение сигнала, затем в систему добавляют поток раствора ингибитора и после установления равновесия регистрируютзначениесигнала, соответствующее скорости биокаталитической реакции при данной концентрации ингибитора. Проводят ряд экспериментов при различных концентрациях ингибитора и строят калибровочный график, по которому затем можно определить относительную (по
отношению к выбранному стандарту) инги- бирующую активность исследуемых веществ. Подобные измерения можно проводить и при импульсном вводе ингибитора в поток субстрата для уменьшения времени анализа.
Недостатками метода являются необходимость построения калибровочной зависимости концентрация ингибитора - падание активности фермента, отсутствие характеристик обратимости взаимодействия фермент - ингибитор и ограниченность получаемой информации, в частности не определены кинетические константы взаимодействия, являющиеся основными характеристиками исследуемого соединения.
Целью изобретения является расширение инфоративности и упрощение способа оценки ингибирующих свойств химических веществ.
Поставленная цель достигается тем, что применяют колоночный реактор, заполненный носителем с иммобилизованным ферментом, что дает возможность применить последовательность операций, состоящую в поочередном пропускании через реактор раствора субстрата, смеси растворов ингибитора и субстрата той же концентрации и затем снова раствора субстрата, причем каждая операция проводится до установления стационарного значения активности фермента, а регистрируется динамика изменения активности в ходе опыта.
Способ отличается применением в проточной системе иммобилизованного Ф.ре- мента, позволяющего физически отделить компоненты реакционной смеси в потоке (субстрат, продукт, ингибитор) от биокатализатора, что дает возможность по кривым релаксации активности фермента (ветвь инактивации, ветвь реактивации) получить новую информацию об антиферментативной активности ингибиторов ферментов.
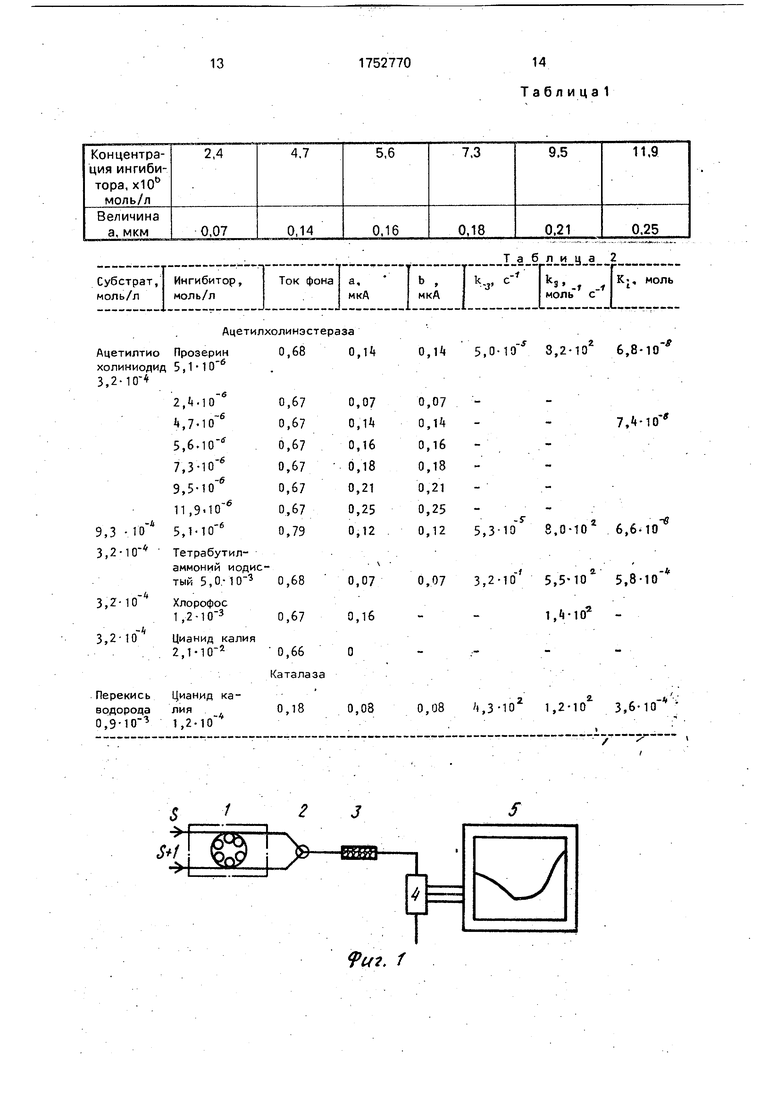
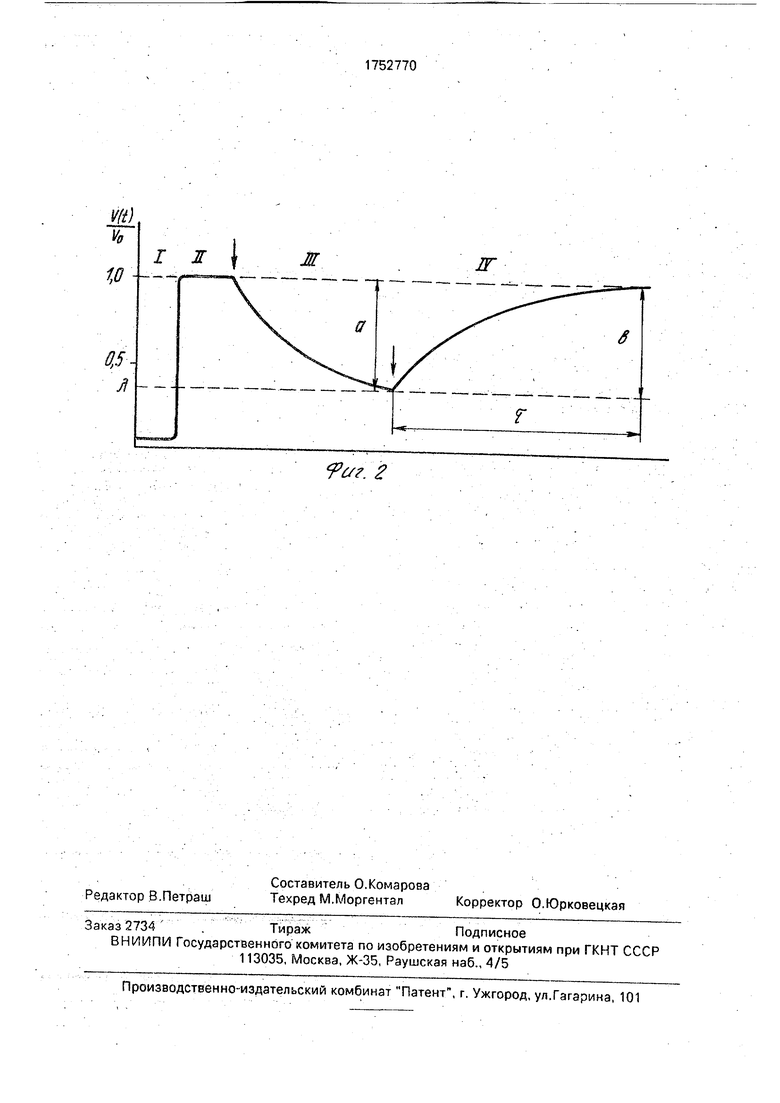
На фиг. 1 дана схема установки для осуществления способа; на фиг, 2 - сигнал про- точногодетекторапродукта
ферментативного процесса.
Установка состоит из двухканального перистальтического насоса 1, обеспечивающего раздельную подачу раствора субстрата (S) и смеси растворов субстрата и ингибитора (S+1), которые переключением двухходового крана 2 могут попеременно подаваться в колоночный реактор 3, наполненный носителем с иммобилизованным ферментом, где протекает процесс. На выходе реактора установлен проточный детектор 4, регистрирующий концентрацию субстрата или продукта ферментативной реакции в потоке, которая пропорциональна скорости процесса. Сигнал детектора записывается самописцем 5 в координатах сигнал - время. Таким образом, при
пропускании через реактор раствора субстрата регистрируют сигнал в0, величина которого пропорциональна V0: 00 a V0, где а- коэффициент пропорциональности, С свою очередь, скорость процесса пропорциональна активности биокатализатора. При пропускании смеси растворов субстрата и ингибитора регистрируется сигнал в () V(t). Для расчетов используется соотношение: 0 (t)/ в0 V(t)/Vo, что избавляет от необходимости производить калибровку детектора в размерных величинах. Для детектирования применяют любой тип детектора, который может быть использован для регистрации активности выбранной ферментативной системы в потоке. При выборе детектора необходимо учитывать, что время его отклика должно быть, как минимум, на порядок ниже времени релаксации проточного реактора при скачкообразном изменении концентрации субстрата в нем. В примерах, в частности, был использован электрохимический проточный детектор, регистрирующий ток окисления продукта реакции (в случае холинэстеразной реакции) или субстрата (в случае каталазной ре- акции). Для расчетов использовали отношение величины тока, регистрируемое в ходе эксперимента, к величине, зарегистрированной в стационарных условиях при
пропускании раствора субстрата (участок II, фиг. 2),
По указанному способу возможна регистрация динамики изменения активности
иммобилизованного биокатализатора в виде зависимости, общий вид которой показан на фиг. 2. На получаемой динамической кривой сигнал детектора (регистрируется продукт реакции) - время выделено четыре
участка: f - фоновый сигнал (субстрата в системе нет); II - сигнал в системе без ингибитора (постоянный поток субстрата); ill - динамика ингибирования фермента (в реактор подается смесь растворов субстрата и
ингибитора, стрелкой обозначен момент начала подачи); IV - динамика реактивации фермента в случае взаимодействия с обратимым ингибитором (подается только раствор субстрата). Непосредственно по виду
полученной кривой определяют величину ингибирующей активности изучаемого соединения (величина отрезка а), степень обратимости взаимодействия с ферментом (отношение величин отрезков а и Ь) и степень сродства фермент-ингибитор (величина т).
Таким образом, в одном эксперименте получают информацию о степени обратимости взаимодействия фермент - ингибитор и определяют индивидуальные кинетические константы (кз, k з, К,) процесса, характеризующие антиферментативную активность исследуемого соединения по формулам:
VЈ)A.
+
КЗ
КЗ
i -exp -k-3t(1+S+i)/(1 +S)
1 +S +I
k-з
У-dJ - 1 - t
V01 +5 +T
равновесное значение
V0 - скорость биокаталитического процесса в отсутствие ингибитора;
V(t) - скорость процесса при введении ингибитора (функция времени); V(t)/V0 - величина непосредственно
регистрируемая в ходе опыта;
)
VO
регистрируемого сигнала в присутствии ингибитора; t - время,
S - концентрация субстрата;
i - концентрация ингибитора,
Km - константа Михаэлиса
По исходным данным (зависимость V(t)/Vo - t), полученным из динамической кривой реактивации (участок IV фиг. 2), с использованием уравнения (2) рассчитывают величину k-з. Для этого (2) преобразуют к виду; 1 - A Bexp -k-3t, где А V(t)/V0; В (ik3/k-3)/(1 + S + iks/k-s). Прологарифмируем левую и правую части полученного уравнения: In (1 - А) In В - k-3t. Таким образом, откладывая экспериментальные данные в коодинатах In (1 - V(t)/V0) - t, получим прямую, тангенс угла наклона которой равен величине -k-з. При этом величина V(t)/V0 равна сигналу проточного детектора (в относительных единицах), регистрируемому в ходе эксперимента (фиг 2). Затем по данным инактивации (участок III, фиг. 2) с использованием (1) и рассчитанной k-з определяют ks. Для этого (1) преобразуют к виду:
(C ik3/k3)/C.
5
15
20
25
30
35
40
45
50
55
где А - V(t)/V0;
В (ik3/k 3)/(1 + S + lk3/k-3), С - 1 + S. Прологарифмируем левую и правую части полученного уравнения:
In (А - Я ) In В - k-3t (С + lk3/k-3)/C. Таким образом, откладывая экспериментальные данные в координатах ln(V(t)/V0 - -А) - t, получим прямую, тангенс угла наклона (tg a ) которой равен k-s(C iks/k з)/С Далее, используя величину k-з, полученную описанным способом, определяют
k3 k-a(C tg a )/k-3 - .
Далее рассчитывают KI как k-зАз. В случае проведения серии опытов при различных концентрациях ингибитора и определения в каждом случае величины А по (3) можно непосредственно рассчитать величину К,. Для этого уравнение (3) преобразуем к виду 1/А - 1 iD/K,. где D 1/(1 + + S) Таким образом, откладывая данные эксперимента в координатах (1/ А - 1) - I, получим прямую, тангенс угла наклона которой равен 1/К|.
Процесс осуществляют в проточном капиллярном реакторе (диаметр 1-2 мм, длина 10-15 мм), заполненном носителем и иммобилизованным ферментом. В качестве биокатализаторов использовали ацетилхо- линэстеразу и каналазу. Все реакции проводили при температуре, оптимальной для данных ферментов (37°С).
Иммобилизацию ферментов проводят известным способом, например сорбцион- но на силохромах. Для этого раствор биокатализатора (концентрация 0,05-5 мг/мл) пропускают с помощью перистальтического насоса (скорость 0,5-5 мл/мин) через реактор, заполненный силохромом, в течение 30-50 мин Раствор белка готовят в 0,01 н. натрийфосфатном буферном растворе (рН 7,5) в количестве 2 мл. После пропускания раствора биокатализатора реактор промывают в течение 10 мин чистым раствором буфера для удаления несорбировавшегося биокатализатора.
Для детектирования использовали проточный электрохимический детектор.
В примерах, приводимых ниже, с целью иллюстрации конкретных экспериментов приведены размерные величины отрезков а и b (фиг. 2), а также величины сигнала в отсутствие ингибитора V0 и его стационарное значение А в его присутствии. Для расчетов использована безразмерная величина А , равная отношению размерной А к величине V0. При расчетах констант ks и k-з использовали безразмерную величину V(t)/V0, получаемую преобразованием.
Пример 1.В реактоо с иммобилизованной ацетилхолинэстеразой i подают раствор субстрата: ацетилтиохолиниодида (концентрация 3,2 t моль/л). При этом регистрируют стационарный ток окисления образующегося продукта (фиг. 2, участок II), равный 0,68 мкА. Затем в реактор подают смесь растворов субстрата и ингибитора - прозеринз (концентрация 5,1110 моль/л), При этом наблюдается падение регистрируемого сигнала (фиг. 2, участок III) до стационарной величины 0,54 мкА. После этого в реактор подают раствор субстрата, активность иммобилизованного фермента восстанавливается, что проявляется как возрастание регистрируемого тока до первоначального значения (фиг. 2, учаток IV). Получено, что значения величин отрезков а и b равны, следовательно ингибитор - обратимый, По уравнению (2) рассчитано: k-з с(5,0 + 0,8). Затем поданным инактивации и вычисленному k-з определяют кз :(8,2 + 0,5)102 . Далее рассчитвают Ki k-з/кз и получают величину (6,8 + 0,5) моль. Опыты проводят при тех же условиях, но с шестью различными концентрациями ингибитора. Регистрируют величину отрезка а (фиг. 2). Получают данные о величине сигнала, регистрируемого при различных концентрациях ингибитора, в системе ацетилхолинэстеразз - ацетилтиохолинио- дид- прозерин, которые приведены в табл. 1. С использованием (3) методом наименьших квадратов рассчитывают значение Ki, равное (7,4 + 0,7) х10 8моль.
Построив калибровочную характеристику концентрация ингибитора - а по изве- стному способу можно определить неизвестную концентрацию ингибитора.
Пример 2. Способ осуществляют по примеру 1. Применяют раствор субстрата с большей концентрацией (9,3 ± 10 моль/л) и тот же ингибитор. Регистрируют величину стационарного тока, равную 0,79 мкА, уменьшение сигнала до 0,67 мкА при той же концентрации ингибитора. По данным эксперимента рассчитаны значения: k-з - (5,3 + 0,4) х , k3 (8,0 + 0,2) х 102 моль Ki (6,6+ 0,5) х моль. Таким образом, изменение концентрации субстрата не приводит к изменению кинетических констант, что говорите правильности предполагаемого механизма реакций.
Пример 3. Способ осуществляют по примеру 1, но вместо прозерина используют тетрабутиламмоний йодистый (концентрация 5,0i моль/л). Стационарный сигнал равен 0,68 мкА, Регистрируется уменьшение сигнала при пропускании ингибитора до 0,61 мкА. При реактивации активность фермента восстанавливается до первоначального значения. По виду регистрируемой кривой сделан вывод о том, что ингибитор - обратимый. Из данных эксперимента рассчитаны значения: k-з (3,2 ±
Ю,6) х ks (5Л5 ± 0,3) хЮ моль с
А«
v3
fc Ki (0,58 + 0,1) х 10 моль.
Пример 4. Условия, как в примере 1. Используют ингибитор - хлорофос (концен- 0 трация 1,2 + 10 моль/л). Регистрируют стационарный сигнал 0,67 мкА. Уменьшение сигнала до 0,51 мкА. Восстановление сигнала при попытке реактивировать фермент не наблюдается, Следовательно, ингибитор - необратимый. Рассчитано значение ks
5
(1,4+ 0,3) х 102
Пример 5. Условия,как в примере 1. Используют ингибитор - цианид калия (концентрация 2,1 + моль/л). Регистрируют
стационарный сигнал 0,66 мкА. При пропускании смеси растворов субстрата и ингибитора значение сигнала не изменяется, следовательно, данное вещество не является ингибитором ацетилхолинэстеразы,
П р и м е р 6. Используют реактор с иммобилизованной каталазой, через который пропускают раствор перекиси водорода (концентрация 0,9 моль/л). Регистрируют уменьшение тока окисления субстрата вследствие протекания ферментативной реакции до 0,18 мкА. При пропускании смеси растворов субстрата и ингибитора .(цианид калия, концентрация 1,2 10 моль/л) наблюдается увеличение тока окисления i субстрата до i 0,26 мкА вследствие подавления активности биокатализатора. При подаче чистого раствора субстрата регистрируемый сигнал уменьшается до первоначального значения. Следовательно, цианид калия - обратимый
ингибитор каталазы. Рассчитаны: k-з (4,3t +0,5) х , k3 (1,2 -t 0.3) х 102 и Ki (3,6 + 0,5) моль.
Пример 7. Используют реактор с
иммобилизованной каталазой и раствор субстрата - перекиси водорода, как в примере 6. Для детекции протекания ферментативного процесса используют проточный спектрофотометрический детектор. Регистрацию перекиси водорода проводят при длине волны 230 нм. В начальный момент регистрируют значение оптической плотности, равное 0,31. При пропускании через реактор раствора субстрата и ингибитора,
как в примере 6, наблюдается увеличение значения оптической плотности до 0,42. При подаче в реактор чистого раствора субстрата наблюдается восстановление сигнала до первоначального значения. По результатам
Эксперимента рассчитаны: k-з (4.1 1006)х
, k3 (1.3 ±0,4)хЮ2моль1с 1 и Ki (3,1 ±0,6) х10 4моль.
Полученные данные зависимости кинетических параметров процессов ингибиро- вания от условий их проведения по примерам 1-7 приведены в табл. 2.
Таким образом, предлагаемый способ по сравнению с известным более информативен, позволяет рассчитать концентрацию ингибитора (с использованием калибровочного графика), определить качественно и количественно ks степень сродства фермент - ингибитор, оценить обратимость взаимодействия и количественно рассчитать кинетические характеристики процесса.
Вывод формул для расчета кинетических констант.
Взаимодействие между биокатализатором, субстратом и ингибитором описывается схемой:
S ki
h
+Р, к- 1
+
I I t
(1)
(2)
где Е - фермент;
S - субстрат;
Р - продукт;
I - ингибитор;
ES и Е - фермент-субстратный и ферм ент-ингибиторный комплексы соответственно;
ki и k-i - константы скорости образо вания и распада на исходные соединения фермент субстратного комплекса;
k2 - константа скорости образования продукта реакции;
ks и k-з - константы скорости образова ния и распада фермент-ингиби торного комплекса:
Ki к-зАз - равновесная константа диссоциации фермент-ингибиторного комплекса
В случае взаимодействия с необратимым ингибитором обратная реакция (константа k-з) отсутствует.
Введем обозначения: х Ces. у CEI, г СЕ, i Ci, S Cs, P - Ср, V dCp/dt, где СЕ, Cs, Ci, Ср, CES, CEI - концентрации фермента, субстрата, ингибитора, продукта, фермент-субстратного и фермент-ингибиторного комплексов соответственно: V - скорость процесса. Тогда дифференциальные уравнения, описывающие протекание реакций(1)и (2) имеют вид:
dx/dt kizS-(k2 + k-i)x.(3)
dy/dt -di/dt kszi k-зу,(4)
dz/dt -kizS + (k2 + k-i)x - kszi + k-зу, (5)
dS/dt -kizS +k-ix,(6)
V dP/dt k2X.(7)
Ферментативный реактор имеет малые размеры, поэтому можно допустить, что в нем достигается режим полного перемешивания компонентов в подвижной фазе и а) Р- VodP/dt, где а) - объемная скорость потока; V0 - свободный объем реактора. Таким образом, измеряемый сигнал пропорционален скорости образования продукта, кото0 рую можно найти из уравнения (7), решив (3) - (6). В условиях эксперимента концентрации субстрата и ингибитора в потоке велики (по сравнению с концентрацией фермента), поэтому их изменением в ходе реакции мож5 но пренебречь (S const, i const). В этом случае уравнения (3) - (7) линейны и для расчета dP/dt достаточно решить систему (3)-(5).
Чтобы описать ветви инактивации (I
0 const) и реактивации (i 0) фермента систему (3) (5) следует решать при различных начальных условиях. Исходное стационарное состояние определяется кинетикой Ми- хаэлиса-Ментен. Поэтому, считая момент
5 ввода ингибитора нулевым, для процесса инактивации имеем следующие начальные условия:
see
0
X Л0
Km СЁ
Km+S
,,
, V V0 К2 Х0 .
Km +S
где СЕ° - общая концентрация иммобили - зованного фермента в реакторе; 5 Km (k2 + k-i)/ki - константа Михаэлиса. Решим (3) - (5) методом преобразования Лапласа, который связывает функцию x(t) с ее операторным изображением x(q) посредством интегрального уравнения:
0 д г
x(q) J x(t) exp (-qt) dt,
0
где q - параметр преобразования.
Умножив (3) - (5) на exp(-qt) и проинтегриро- 5 вав по времени, получим:
qx - х0 kizS - (k2 + ki)x,,(8)
qy kszi - k-зу,(9)
qz - z0 -kizS + (k2 + MX - kszi + k-3y. (10)
Из алгебраической системы (8) - (10) нахо0 Дим
l 1 Mk±JizO /q, (и)
q + Aq + В
V0 х0
где А G + Н; В GH - kiksSi; G kiS + k2 + +k-i; H k-3 + ksi.
Свойства преобразования Лапласа позволяют определить стационарное значение скорости образования продукта
lim Ј qV(q)/ V0Him (V(t)/V0 )- Urn (x(t)/x01+S
1+5+7 q -0t - t - °°
где 5 S/Km, i iks/k-s. Из (8) - (10) несложно найти и стационарные значения других переменных:
хг х0 Я ; ус (xoT/S) Я; zc (x0/S) Я ; Vc -V0 Я .(12)
Обращение преобразования Лапласа сделаем после разложения (11) на сумму простых дробей
Vfg) Я+ 3i(l 2+k-i) x ЛЛ qqi-Q2
х
о q qi-Q2
11
j.. i . i
q2(q+q2) qi(q +qi )
(13)
где -qi и -П2 - полюсы изображения (11), которые, как легко проверить, при любых положительных кинетических константах находятся в левой полуплоскости на вещественной оси. Оригинал изображения (13) имеет вид:
V(t) , , Vo Я+ P CzL91l} exp ( -qi t),
x
(14)
Ц2Q1
В эксперименте установлено, что при быстром изменении концентрации субстрата релаксации сигнала происходит значительно быстрее, чем при изменении концентрации ингибитора, т.е. G Н. При этом с высокой точностью q 1 ka + k-ч + kiS, q2 - M1 + S +T)/(1 + S). Так как qi q2, то для больших значений времени (14) дает асимптотику:
V(t) , Т ехр - k -з t (1 + S+F)/(1 + S)
1 +S+T
Формула (15) имеет удовлетворительную точность практически во всем интересующем диапазоне времени.
Для реактивации фермента имеет начальные условия (12). Используя вместо (9) уравнение Ру - ус k-зу, получим
()
(q+k-з).(16)
Оригинал изображения (16) выражается как
х ТТ$С (Zc +Xc К (-G )) - Ет ( ехр ( - К-jt ) -exp(-G t ))+ус(1exp(-k-3t)+xcexp(-G t).
Так как G k-з, то для большого значения
времени
V(t)/V0 1 - (Гехр -k-3tj/(1 + S + i). (17)
л
у П±
Асимптотики (15) и (17) спрямляются соответственно в координатах t - ln(V(t)/V0 - Я ) и t - ln(1 - V(t)/V0). Тангенс угла наклона первой прямой равен + кз(/(1 + S)), а
второй -k-з.
Еще один способ расчета К) основан на измерении Kj при различных концентрациях ингибитора. так как 1 j Т
I К|ХТ+5
Формула изобретения Способ оценки ингибирующих свойств химических веществ, включающий пропуекание через проточныцй реактор растворов субстрата и исследуемого вещества в присутствии фермента и определение параметра, соответствующего величине активности фермента, отличающийся тем,
что, с целью упрощения и расширения информативности способа, используют реактор с иммобилизованным ферментом, пропускание растворов осуществляют в три стадии, при этом на первой и третьей стадиях пропускают растворы субстрата одной и той же концентрации, а на второй стадии - смесь растворов исследуемого вещества и субстрата, и каждую стадию проводят до установления стационарного значения активности фермента, в процессе пропускания определяют в качестве параметра, соответствующего величине активности фермента, скорость ферментативного процесса в присутствии исследуемого вещества
vt и скорость процесса в его отсутствие v0, вычисляют отношение vt/v0 и на протяжении второй стадии по величине убывания отношения оценивают ингибирующую активность исследуемого вещества, на протяжении третьей стадии оценивают степень обратимости процесса ингибирования, если величина отношения достигает соответствующей величины на первой стадии, исследуемое вещество считают обратимым
ингибитором, а если величина отношения в конце третьей стадии меньше соответствующей величины на первой стадии, то исследуемое вещество - необратимый ингибитор, по продолжительности времени возрастания величины отношения на третьей стадии оценивают степень сродства фермент-ингибитор, при этом чем больше время возра- стания, тем прочнее сродство фермент-ингибитор, а для количественной
характеристики ингибирующей активности вычисляют равновесную и кинетические константы диссоциации фермент-ингиби- торного комплекса.
13
1752770
14 Таблица





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения популяционной принадлежности командорских кальмаров | 1987 |
|
SU1535503A1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОКАТАЛИЗАТОРА И БИОКАТАЛИЗАТОР ДЛЯ ДЕТОКСИКАЦИИ ФОСФОРОРГАНИЧЕСКИХ НЕЙРОТОКСИЧНЫХ СОЕДИНЕНИЙ В ПРОТОЧНЫХ СИСТЕМАХ | 2006 |
|
RU2315103C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОЙ ХОЛИНЭСТЕРАЗЫ | 1991 |
|
RU2005785C1 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ГИДРОЛИЗА ФОСФОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В ПОЧВОГРУНТЕ | 2011 |
|
RU2451077C1 |
| БЫСТРЫЙ БИОСЕНСОР СО СЛОЕМ РЕАГЕНТА | 2007 |
|
RU2482495C2 |
| Способ получения фумаровой кислоты | 2020 |
|
RU2748229C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОКАТАЛИЗАТОРА И БИОКАТАЛИЗАТОР ДЛЯ ДЕТОКСИКАЦИИ ФОСФОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | 2004 |
|
RU2261911C1 |
| БИОКАТАЛИЗАТОР НА ОСНОВЕ ИММОБИЛИЗОВАННЫХ КЛЕТОК БАКТЕРИЙ ДЛЯ РАЗЛОЖЕНИЯ МЕТИЛФОСФОНОВОЙ КИСЛОТЫ И ЕЕ ЭФИРОВ | 2007 |
|
RU2360967C1 |
| Способ получения гетерогенного биокатализатора на основе целлюлазы, иммобилизованной на катионообменном волокне ВИОН КН-1 в Н-форме | 2024 |
|
RU2834720C1 |
| ИММОБИЛИЗОВАННЫЙ БИОКАТАЛИЗАТОР ДЛЯ МИКРОБИОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ ПЕКТИНАЗ | 2008 |
|
RU2383618C1 |
Использование: в биоаналитической химии, при оценке ингибирующей активности природных и синтетических лекарственных препаратов. Сущность изобретения: через проточный реактор, содержащий иммобилизованный фермент, последовательно пропускается раствор субстрата до насыщения, смесь растворов субстрата той же концентрации и ингибитора до установления равновесного состояния и снова раствор субстрата до насыщения. По виду регистрируемой кривой оценивают ингибирующие свойства исследуемых веществ. 2 ил,, 2 табл.
Ацетилхолинэстераза
PU2. f
иг. 2
| Кулис Ю,Ю | |||
| Аналитические системы на основе иммобилизованных ферментов | |||
| - Вильнюс: Моклас, 1981, 200 с | |||
| Способ определения токсических соединений азота | 1979 |
|
SU894989A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1992-08-07—Публикация
1989-10-02—Подача