Изобретение относится к синтезу новых производных 3-азабицикло[3,2,1] октана, а именно к дигидрохлориду DL-3-{4-[4-(2-пиридил)-1-пиперазинил] бутил}-1,8,8-триметил-3-азабицикло [3,2,1] октан-2,4-диона формулы I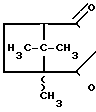 N-(CH2)4-N
N-(CH2)4-N N
N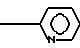 обладающему противотревожной, нейролептической и противорвотной активностью.
обладающему противотревожной, нейролептической и противорвотной активностью.
Ближайшими структурными аналогами нового соединения I являются мостиковые бициклические имидопроизводные общей формулы II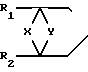 N-(CH2)4-N
N-(CH2)4-N N
N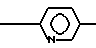 R3 где Х CН2, СН2-CН2, СН2СН2СН2;
R3 где Х CН2, СН2-CН2, СН2СН2СН2;
Y CН2, СН(СН3), С(СН3)2, С(СН2)4, СН2СН2;
R1 и R2 Н, СН3;
R3 Н, F.
Целью изобретения является синтез нового соединения с широким спектром психотропного действия, обладающего не только противотревожной, но также нейролептической и противорвотной активностью. Поставленная цель достигается соединением формулы I. Указанное соединение получают взаимодействием DL-камфоримида с 8-(2-пиридил)-8-аза-5- азониаспиро [4,5] деканбромидом в присутствии карбоната калия в среде полярного растворителя с последующим переводом полученного DL-3-{ 4-[4-(2-пиридил)-1-пиперазинил]-бутил}-1,8,8-триметил-3-азабици- кло [3,2,1] октан-2,4-диона в дигидрохлорид пропусканием в его эфирный раствор хлористого водорода.
Состав и строение соединения формулы I подтверждено данными элементарного анализа, и ПМР-спектроскопии.
П р и м е р 1. Смесь 4,07 г (0,225 моль) DL-камфоримида, 6,71 г (0,0225 моль) 8-(2-пиридил)-8-аза-5-азониаспиро [4,5] декан-бромида и 3,73 г (0,027 моль) карбоната калия кипятят в 80 мл абсолютного диметилформамида в течение 24 ч, затем полученную смесь охлаждают, фильтруют и отгоняют диметилформамид при пониженном давлении. Остаток растворяют в 100 мл 5%-ного НСl, полученный раствор дважды экстрагируют эфиром (по 50 мл) для очистки от примесей, не имеющих основного характера, и насыщают содой. Выделившееся основание экстрагируют этилацетатом, экстракт сушат карбонатом калия и очищают пропусканием через колонку с нейтральной окисью алюминия высотой 5 см (элюент этилацетат). После отгонки растворителя получают свободное основание в виде масла, которое затем кристаллизуется, т.пл. 96-97оС.
Найдено, C 69,4; Н 8,6; N 14,0.
С23Н34N4О2
Вычислено, C 69,3; Н 8,6; N 14,1;
Спектр ИК: 3440, 2950, 1725, 1685, 1600, 1490, 1440, 1360, 1315, 1250, 1185, 1170, 1150, 1100, 1085, 985, 960, 950, 880 см-1.
П р и м е р 2. Для получения дигидрохлорида полученный (см. пример 1) продукт растворяют в 50 мл абсолютного эфира и пропускают газообразный НСl до насыщения. Выпавший дигидрохлорид отфильтровывают, промывают абсолютным эфиром и перекристаллизовывают из изопропилового спирта. Выход чистого продукта, представляющего собой белый кристаллический порошок, составляет 9,021 г 85% Т.пл. 189-190оС.
Найдено, С 58,5; Н 7,7; N 12,0; Cl 15,1.
С23Н36N4Cl2O2
Вычислено, C 58,6; Н 7,7; N 11,9; Сl 15,0.
Спектр ИК: 3470, 2960, 2930, 1725, 1670, 1635, 1610, 1540, 1435, 1355, 1280, 1180 см-1.
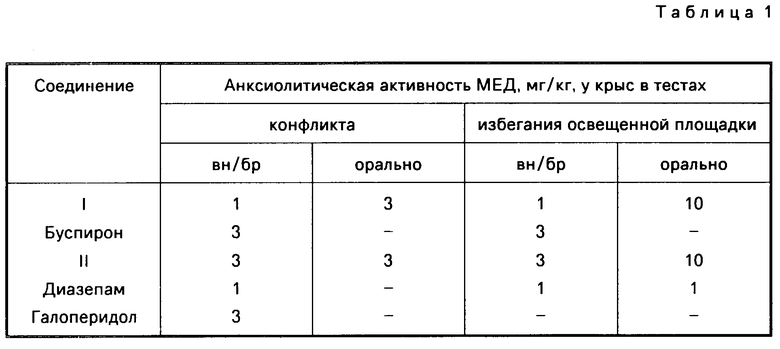
Фармакологическая активность соединения I сопоставлена в одинаковых методических условиях с активностью соединения II, буспирона и эталонных препаратов. В табл.1 приведены данные по транквилизирующей и нейролептической активности для соединения I, II, буспирона, диазепама, галоперидола и сульпирида.
Анксиолитическую активность соединений оценивали в моделях конфликтной ситуации (Т. Клыгуль, В. Криволапов, Фармакология и токсикология, 1966, N 29, с. 241) и методом избегания освещенного поля. Соединения вводили внутрибрюшинно и орально за 20-60 мин до начала опыта. Определяли минимально эффективные дозы (МЕД), повышающие число взятий воды и удлиняющие время пребывания на освещенном поле не менее, чем на 50% Нейролептическую активность обнаруживали и измеряли, используя метод "боя крыс" и тест "лазания" у мышей (Р. Рrotais et al. Psychopharmacology, 50, р.1, 1976). Седативную активность оценивали по угнетанию спонтанной локомоции и ориентировочного поведения (J. Bolssler, Р. Simon, Arch. Int. Pharmacodyn. 147, р. 372, 1964), миорелаксирующую в тесте вращающегося стержня (N. Dunham. Т. Miya. J. Am. Pharmacol. Sci. 46, р. 208, 1957), наркопотенциирующую по усилению эффекта не наркотической дозы гексенала. Противорвотное действие при рвотах, вызванных апоморфином или цисплатиной, изучено на голубях (Р. Рresiosi et al. Arch. Int. Pharmacodyn. 298, р. 301, 1989) и беспородных собаках массой 6-8 кг.
Установлено, что системное воздействие дигидрохлорида соединения I вызывает в дозах 0,1-50 мг/кг массы тела характерные для транквилизаторов и нейролептиков эффекты: анксиолитический, антиагрессивный, антиапоморфиновый и гексеналпотенцирующий.
Анксиолитическая активность соединений I, II и буспирона в двух моделях тревоги близка, однако активность соединения I в три раза выше, чем у соединения II и буспирона (внутрибрюшинно). Только анксиолитические дозы соединения I совпадают с аналогичными дозами диазепама (при внутрибрюшинном введении). Напротив, гексеналпотенцирующая активность соединения I существенно меньше активности диазепама. Как антагонист апоморфина в тесте "лазания" только соединение I сравнимо с галоперидолом.
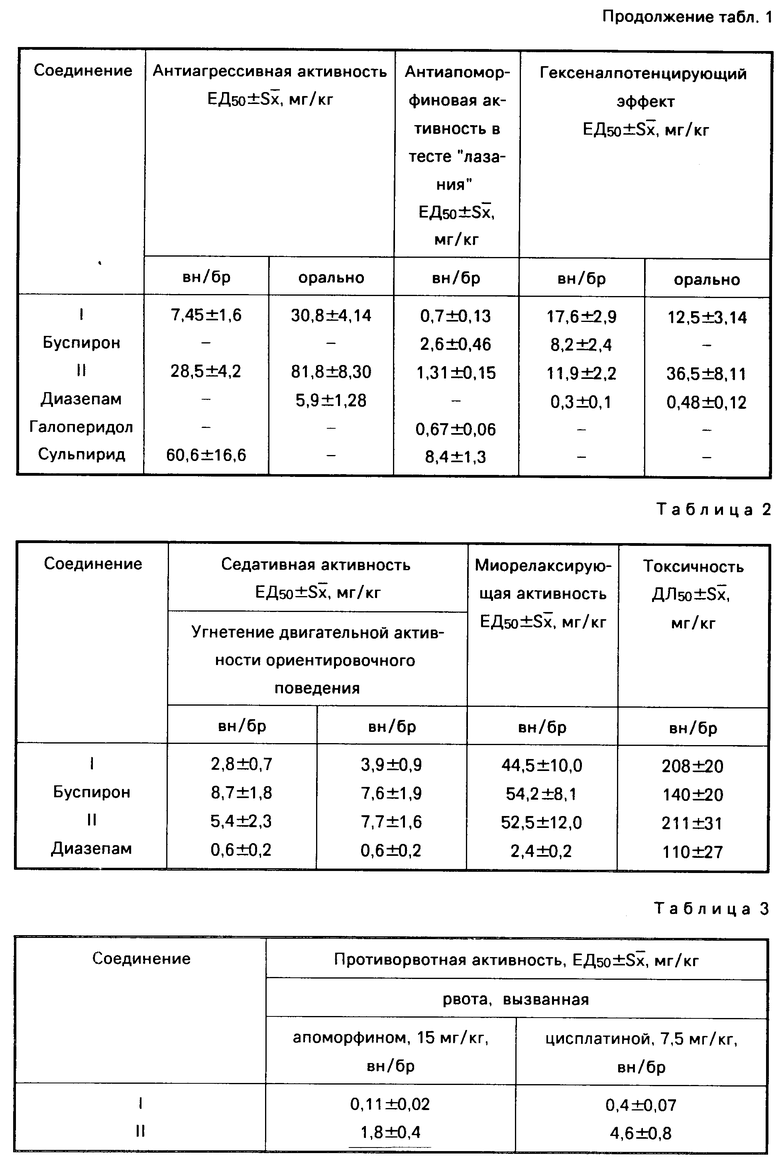
В табл.2 приводятся данные по седативной, миорелаксирующей активности и токсичности для соединения I, II, буспирона и диазепама.
Из табл.2 следует, что седативная, миорелаксирующая активность и токсичность соединения I существенно ниже активности и токсичности диазепама.
В табл. 3 приводятся данные по противорвотной активности соединений I, II, галоперидола, трифтазина и метоклопрамида у голубей.
Из табл.3 видно, что противорвотная активность соединения I значительно превышает этот показатель для других соединений. В опытах на собаках соединение I в диапазоне доз 0,003-0,25 мг/кг предупреждает вызываемую апоморфином и цисплатиной рвоту. ЕД50 соответственно равны 0,02±0,06 и 0,013±0,005 мг/кг массы тела.
Из сказанного следует, что предлагаемое соединение I обладает выраженной транквилизирующей, нейролептической и противорвотной активностью при низкой токсичности.
Преимущества нового соединения, отличающие его от ближайших структурных аналогов по действию, состоят в том, что оно превосходит буспирон по противотревожной активности, отличаясь от него и диазепама меньшей токсичностью, а по потенциальной нейролептической и противорвотной активности превосходит как соединение II, так и буспирон, а также классические нейролептики и антиэметики галоперидол, сульпирид и метоклопрамид.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ ПРИМЕНЕНИЕ 2-[5-(4-ФТОРФЕНИЛ)-3-ПИРИДИЛМЕТИЛАМИНОМЕТИЛ]-ХРОМАНА И ЕГО ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 2002 |
|
RU2297833C2 |
| ДИЭТИЛАМИНОЭТИЛАМИДА 1-ПРОПИЛ-2-ОКСО-4-ГИДРОКСИХИНОЛИН-3-КАРБОНОВОЙ КИСЛОТЫ ГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ АНЕСТЕЗИРУЮЩУЮ, ПРОТИВОАРИТМИЧЕСКУЮ, АНТИОКСИДАНТНУЮ, АНТИМИКРОБНУЮ И ФУНГИЦИДНУЮ АКТИВНОСТЬ | 1990 |
|
RU1774624C |
| ПРОИЗВОДНЫЕ 3,4-БИС(ФУРАЗАН-3-ИЛ)ФУРОКСАНА, ГЕНЕРИРУЮЩИЕ ОКСИД АЗОТА, АКТИВИРУЮЩИЕ РАСТВОРИМУЮ ФОРМУ ГУАНИЛАТЦИКЛАЗЫ, ИНГИБИРУЮЩИЕ АГРЕГАЦИЮ ТРОМБОЦИТОВ И ОБЛАДАЮЩИЕ СПАЗМОЛИТИЧЕСКИМ, СОСУДОРАСШИРЯЮЩИМ, ГИПОТЕНЗИВНЫМ ДЕЙСТВИЕМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2240321C2 |
| ТВЕРДЫЕ ФОРМЫ 3-(5-АМИНО-2-МЕТИЛ-4-ОКСО-4Н-ХИНАЗОЛИН-3-ИЛ)ПИПЕРИДИН-2, 6-ДИОНА И ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРИМЕНЕНИЕ | 2012 |
|
RU2611007C2 |
| 1,1,1-ТРИФТОР-3-ГИДРОКСИПРОПАН-2-ИЛКАРБАМАТНЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ MAGL | 2018 |
|
RU2720203C1 |

Сущность изобретения: продукт DL-3 4- [4-(2-пиридил)-1- пиперазил]бутил -1,8,8-триметил-3-азабицикло[3,2,1] октан-2,4-диондигидрохлорид. БФ: C23H36N4Cl2O2 Выход 85% Т.пл. 189-190°С. Реагент 1: DL-камфоримид. Реагент 2: 8-(2-пиридил)-2-аза-5-азониаспиро [4,5] деканбромид. Условия реакции: в присутствии карбоната калия в абс.ДМФ с последующей обработкой HC1. 3 табл.
DL-3- 4-[4-(2-пиридил) -1-пиперазинил] бутил} -1, 8, 8-триметил-3-азабицикло [3, 2, 1] октан-2, 4-диона дигидрохлорид формулы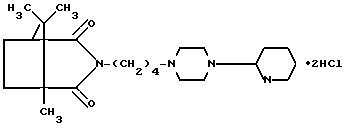
проявляющий противотревожную, нейролептическую и противорвотную активность.
| Способ получения циклических имидопроизводных 2-(4-бутилпиперазин-1-ил)-пиридинов или их фармацевтически приемлемых солей | 1986 |
|
SU1521282A3 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-12-10—Публикация
1990-10-29—Подача