ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым 1,1,1-трифтор-3-гидроксипропан-2-илкарбаматным производным, которые являются ингибиторами моноацилглицеринлипазы (MAGL), к их фармацевтическим композициям и их применению для лечения опосредованных MAGL заболеваний, таких как боль, воспалительное нарушение, депрессия, тревожное расстройство, болезнь Альцгеймера, метаболическое нарушение, инсульт или рак.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
MAGL является основным ферментом, ответственным за деградацию in vivo 2-арахидоноилглицерина (2-AG), эндогенного лиганда каннабиноидных рецепторов (например, СВ1 и СВ2). См., например, Patel, J. Z. et al., «Loratadine analogues as MAGL inhibitors», Bioorg. Med. Chem. Lett., 2015, 25(7):1436-42; Mechoulam, R. et al., «Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors», Biochem. Pharmacol., 50 (1995), 83-90; Sugiura, T. et al., «2-Arachidonoylglycerol: a possible endogenous cannabinoid receptor ligand in brain», Biochem. Biophys. Res. Commun., 215 (1995), 89-97.
Ингибиторы MAGL потенциально полезны для лечения опосредованного MAGL заболевания или нарушения. Примеры опосредованных MAGL заболеваний или нарушений включают метаболическое нарушение (например, ожирение); срыгивание или рвоту; тошноту; нарушение пищевого поведения (например, анорексию или булимию); невропатию (например, диабетическую невропатию, пеллагрическую невропатию, алкогольную невропатию, невропатию бери-бери); синдром жжения стоп; нейродегенеративное нарушение [множественный склероз (MS), болезнь Паркинсона (PD), болезнь Гентингтона, болезнь Альцгеймера, амиотрофический боковой склероз (ALS), эпилепсию, нарушение сна, болезнь Крейтцфельда-Якоба (CJD) или прионную болезнь]; сердечно-сосудистое заболевание (например, гипертензию, дислипидемию, атеросклероз, сердечные аритмии или сердечную ишемию); остеопороз; остеоартрит; шизофрению; депрессию; биполярное расстройство; тремор; дискинезию; дистонию; спастичность; синдром Туретта; апноэ во сне; потерю слуха; болезни глаз (например, глаукому, глазную гипертензию, дегенерацию желтого пятна или заболевание, возникающее в результате повышенного внутриглазного давления); кахексию; инсомнию; менингит; сонную болезнь; прогрессирующую многоочаговую лейкоэнцефалопатию; болезнь де Виво; отек мозга; церебральный паралич; абстинентный синдром [абстинентный алкогольный синдром, синдром отмены антидепрессантов, синдром отмены антипсихотических средств, синдром отмены бензодиазепина, абстиненцию каннабиса, неонатальную абстиненцию, никотиновую абстиненцию или опиоидную абстиненцию]; травматическое повреждение головного мозга; повреждение спинного мозга; судороги; воздействие эксайтотоксина; ишемию [инсульт, ишемию или реперфузию печени, ишемию или реперфузию ЦНС]; фиброз печени, перегрузку железом, цирроз печени; легочное расстройство [астму, аллергические реакции, ХОЗЛ, хронический бронхит, эмфизему, муковисцидоз, пневмонию, туберкулез, отек легких, рак легких, острый респираторный дистресс-синдром, интерстициальную легочную болезнь (ILD), саркоидоз, идиопатический легочный фиброз, легочную эмболию, экссудативный плеврит или мезотелиому]; нарушение печени [острую печеночную недостаточность, синдром Алажиля, гепатит, увеличенную печень, синдром Жильбера, кисты печени, гемангиому печени, жировую болезнь печени, стеатогепатит, первичный склерозирующий холангит, фасциолез, первичный билиарный цирроз, синдром Бадда-Киари, гемохроматоз, болезнь Вильсона или транстиретин-опосредованный наследственный амилоидоз], инсульт [например, ишемический инсульт; геморрагический инсульт]; субарахноидальное кровоизлияние; вазоспазм; синдром истощения при СПИДе; почечную ишемию; нарушение, связанное с аномальным ростом или пролиферацией клеток [например, доброкачественную опухоль или рак, такие как доброкачественная опухоль кожи, опухоль головного мозга, папиллома, бластома предстательной железы, опухоль головного мозга (глиобластома, медуллоэпителиома, медуллобластома, нейробластома, астроцитома, астробластома, эпендимома, олигодендроглиома, опухоль сплетения, нейроэпителиома, эпифизарная опухоль, эпендимобластома, злокачественная менингиома, саркоматоз, меланома, шваннома), меланома, метастатическая опухоль, рак почки, рак мочевого пузыря, рак головного мозга, глиобластома (GBM), рак желудочно-кишечного тракта, лейкоз или рак крови]; аутоиммунное заболевание [например, псориаз, эритематозную волчанку, синдром Шегрена, анкилозирующий спондилит, недифференцированный спондилит, болезнь Бехчета, гемолитическую анемию, отторжение трансплантата]; воспалительное нарушение [например, аппендицит, бурсит, колит, цистит, дерматит, флебит, ринит, тендонит, тонзиллит, васкулит, обыкновенные угри, хронический простатит, гломерулонефрит, гиперчувствительность, СРК, воспаление тазовых органов, саркоидоз, ВИЧ-энцефалит, бешенство, абсцесс мозга, нейровоспаление, воспаление в центральной нервной системе (ЦНС)]; нарушение иммунной системы (например, отторжение трансплантата или целиакия); посттравматическое стрессовое расстройство (PTSD); острое стрессовое расстройство; паническое расстройство; тревожное расстройство, индуцированное веществами; обсессивно-компульсивное расстройство (OCD); агорафобию; специфическую фобию; социофобию; тревожное расстройство; синдром дефицита внимания (ADD); синдром дефицита внимания с гиперактивностью (ADHD); синдром Аспергера; боль [например, острую боль; хроническую боль; воспалительную боль; висцеральную боль; послеоперационную боль; мигрень; боль в пояснице; боль в суставах; боль в животе; боль в груди; болевой синдром после мастэктомии; менструальную боль; боль при эндометриозе; боль вследствие физической травмы; головную боль; синусовую головную боль; головную боль напряжения, боль вследствие вируса герпеса, диабетическую боль; боль вследствие нарушения, выбранного из: остеоартрита, ревматоидного артрита, спондилита, подагры, родов, заболевания опорно-двигательного аппарата, заболевания кожи, зубной боли, изжоги, ожога, солнечного ожога, укуса змеи, укуса ядовитой змеи, укуса паука, укуса насекомого, нейрогенного мочевого пузыря, интерстициального цистита, инфекции мочевыводящих путей (UTI), ринита, контактного дерматита/гиперчувствительности, зуда, экземы, фарингита, мукозита, энтерита, синдрома раздраженного кишечника (СРК), холецистита и панкреатита; невропатическую боль (например, невропатическую боль в пояснице, комплексный регионарный болевой синдром, посттравматическую невралгию тройничного нерва, каузалгию, токсическую невропатию, рефлекторную симпатическую дистрофию, диабетическую невропатию, хроническую невропатию от химиотерапевтического агента или боль в пояснично-крестцовом отделе)]; демиелинизирующее заболевание [например, множественный склероз (MS), болезнь Девика, невропатии ЦНС, центральный понтинный миелинолиз, сифилитическую миелопатию, лейкоэнцефалопатию, лейкодистрофию, синдром Гийена-Барре, хроническую воспалительную демиелинизирующую полиневропатию, анти-MAG (миелин-ассоциированный гликопротеин) периферийную невропатию, болезнь Шарко-Мари-Тута, периферическую невропатию, миелопатию, невропатию зрительного нерва, прогрессирующую воспалительную невропатию, неврит зрительного нерва, поперечный миелит]; и когнитивные нарушения [например, когнитивные нарушения, связанные с синдромом Дауна; когнитивные нарушения, связанные с болезнью Альцгеймера; когнитивные нарушения, связанные с PD; легкие когнитивные нарушения (MCI), деменцию, когнитивные нарушения после химиотерапии (PCCI), послеоперационную когнитивную дисфункцию (POCD)]. См., например, US 8415341, US 8835418, или US 8772318.
По-прежнему существует потребность в альтернативных ингибиторах MAGL.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в частности, относится к новому соединению формулы I:
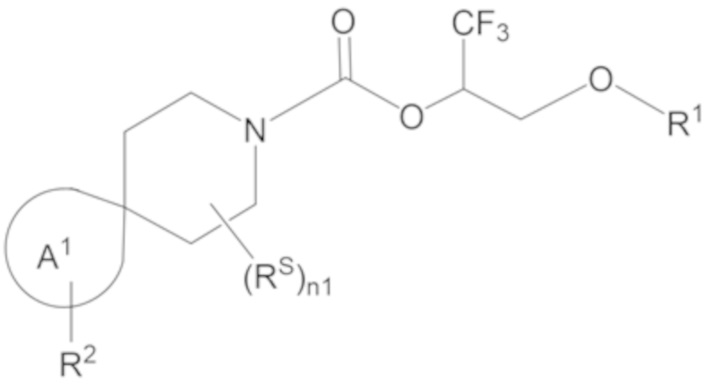
I
или к его фармацевтически приемлемой соли, где
R1 представляет собой H, -P(=O)(OR81)(OR82); или -S(=O)2OR90;
каждый из R81, R82 и R90 независимо выбран из группы, состоящей из H и C1-6 алкила, при этом каждый C1-6 алкил необязательно замещен одним или более (например, 0, 1, 2, 3, 4, 5 или 6) заместителями, каждый из которых независимо выбран из группы, состоящей из -NH2, -NH(C1-4 алкила) и -N(C1-4 алкила)2;
каждый RS независимо выбран из группы, состоящей из OH, оксо, галогена, C1-4 алкила, C1-4 галогеналкила, C3-4 циклоалкила, C3-4 циклоалкила-C1-2 алкила-, C1-4 алкокси и C1-4 галогеналкокси;
n1 равно 0, 1, 2, 3, 4, 5 или 6;
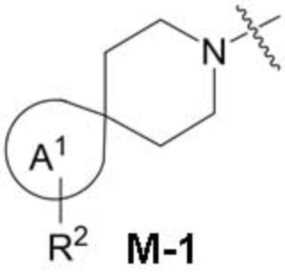
фрагмент М-1 формулы I:
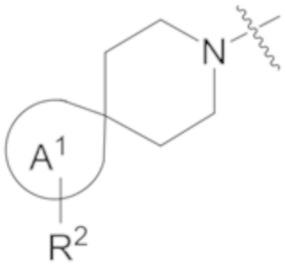
M-1
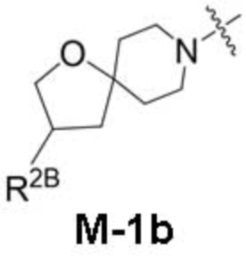
представляет собой фрагмент формулы M-1a, M-1b или M-1c:
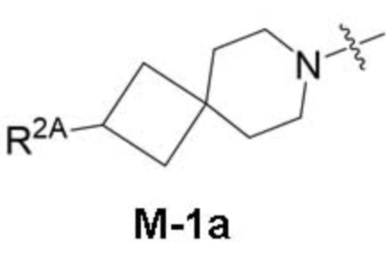
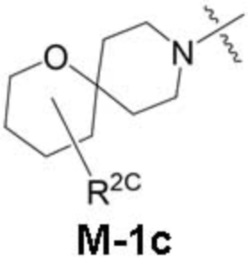
каждый из R2A и R2C независимо представляет собой -NR3S(=O)2R4, -NR3C(=O)R4; R5 или -OR5;
R2B выбран из группы, включающей [4-(трифторметил)-1H-пиразол-1-ил]метил-, (циклопентилкарбонил)(метил)амино-, (трет-бутилсульфонил)(метил)амино-, (2,2-диметилпропанoил)(метил)амино-, 4-(трифторметил)-1H-пиразол-1-ил-, 4-фтор-1H-пиразол-1-ил-, 3-цианoфенил-, 6-(трифторметил)пиридин-2-ил-, 5-фторпиридин-2-ил-, 4-(дифторметил)-1H-пиразол-1-ил-, 4-трет-бутил-1H-пиразол-1-ил-, 4-хлор-1H-пиразол-1-ил-, 4-циклопропил-1H-пиразол-1-ил-, 4-метил-1H-пиразол-1-ил-, 2-фторфенил-, 4-цианo-3-фторфенил-, 3-цианo-4-фторфенил-, 5-цианo-2-фторфенил-, 4-цианoфенил-, 2,6-дифторфенил-, 2,4-дифторфенил-, 4-фторфенил-, 4-(дифторметил)пиридин-2-ил-, 6-(дифторметил)пиридин-3-ил-, 5-цианoпиридин-2-ил-, 5-(дифторметил)пиридин-2-ил-, 5-(трифторметил)пиридин-2-ил-, пиридин-2-ил-, 3-трет-бутил-1H-пиразол-1-ил-, 3-(трифторметил)-1H-пиразол-1-ил-, 3,4-диметил-1H-пиразол-1-ил-, {[(3,3-дифторциклобутил)метил]сульфонил}(метил)амино-, [(3,3-дифторциклобутил)карбонил](метил)амино-, 1H-индазол-1-ил-, 3-цианo-2-фторфенил- и 4-цианo-2-фторфенил-;
каждый R3 независимо представляет собой C1-3 алкил;
каждый R4 независимо выбран из C1-6 алкила, C3-7 циклоалкила, (C3-7 циклоалкила)-C1-2 алкила-, (C6-10 арила)-C1-2 алкила-, (5- или 10-членного гетероарила)-C1-2 алкила-, 5- или 10-членного гетероарила, и C6-10 арила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 галогенами;
или R3 и R4 вместе с промежуточным фрагментом «-NS(=O)2-» или «-NC(=O)-», к которому они присоединены, образуют 4-10-членный гетероциклоалкил, который замещен 0, 1, 2, 3, 4 или 5 заместителями, каждый из которых независимо выбран из группы, состоящей из OH, оксо, галогена, C1-4 алкила, C1-4 галогеналкила, C1-4 алкокси и C1-4 галогеналкокси, и при этом каждый из образующих кольцо атомов 4-10-членного гетероциклоалкила представляет собой C, N, O или S; и
каждый R5 представляет собой фенил или 5- или 6-членный гетероарил, при этом каждый фенил или 5- или 6-членный гетероарил замещен 0, 1, 2, или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси, и при этом каждый из образующих кольцо атомов 5- или 6-членного гетероарила представляет собой атом углерода или атом азота.
В некоторых вариантах осуществления каждый RS независимо выбран из группы, состоящей из галогена, C1-4 алкила, C1-4 галогеналкила, C1-4 алкокси, и C1-4 галогеналкокси. В некоторых других вариантах осуществления каждый RS независимо выбран из группы, состоящей из галогена, C1-2 алкила, C1-2 галогеналкила, C1-2 алкокси и C1-2 галогеналкокси.
В некоторых вариантах осуществления, n1 равен 0, 1, 2, 3 или 4. В некоторых других вариантах осуществления n1 равен 0, 1 или 2. Еще в некоторых других вариантах осуществления n1 равен 0 или 1. Еще в некоторых других вариантах осуществления n1 равен 0.
В некоторых вариантах осуществления каждый R3 независимо представляет собой C1-3 алкил; и каждый R4 независимо выбран из C1-6 алкила, C3-7 циклоалкила, (C3-7 циклоалкила)-C1-2 алкила-, (C6-10 арила)-C1-2 алкила-, (5- или 10-членного гетероарила)-C1-2 алкила-, 5- или 10-членного гетероарила, и C6-10 арила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 галогенами. В некоторых других вариантах осуществления каждый R3 независимо представляет собой C1-3 алкил; и каждый R4 независимо выбран из C1-6 алкила, C3-7 циклоалкила, (C3-7 циклоалкила)-C1-2 алкила-, (C6-10 арила)-C1-2 алкила- и C6-10 арила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 галогенами.
В некоторых вариантах осуществления соединение формулы I или его фармацевтически приемлемая соль представляет собой соединение формулы I-1, I-2 или I-3:
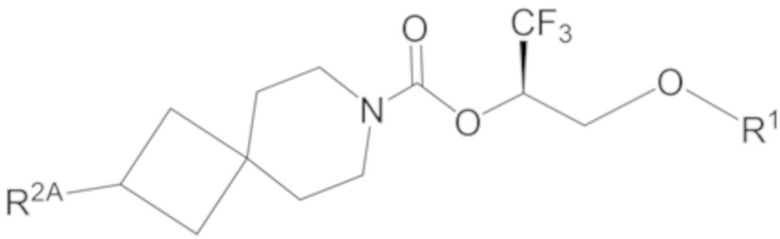
I-1
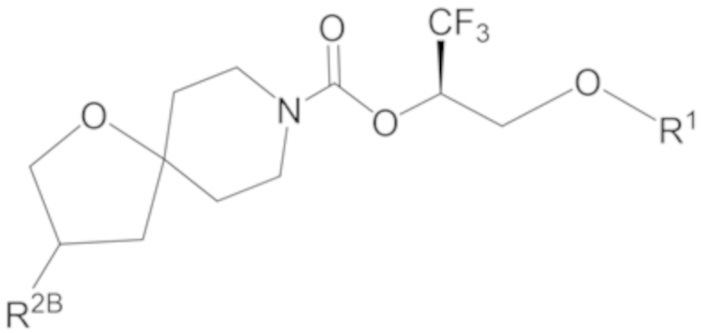
I-2
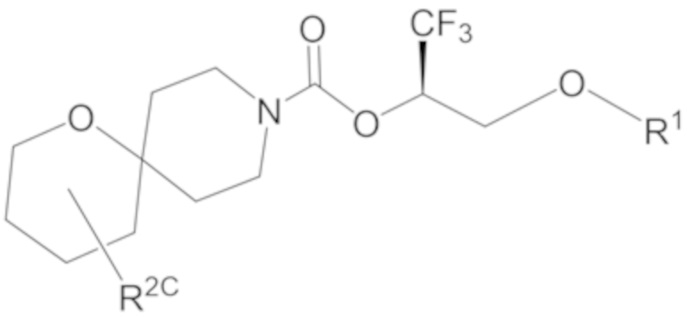
I-3,
или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления R1 представляет собой H или -P(=O)(OH)(OH). В некоторых других вариантах осуществления R1 представляет собой Н.
В некоторых вариантах осуществления соединение формулы I или его фармацевтически приемлемая соль представляет собой соединение формулы I-1 или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы I или его фармацевтически приемлемая соль представляет собой соединение формулы I-2 или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы I или его фармацевтически приемлемая соль представляет собой соединение формулы I-3 или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-1) или его фармацевтически приемлемой соли R2A представляет собой R5 или -OR5. В некоторых других вариантах осуществления R5 представляет собой фенил или 5- или 6-членный гетероарил, где 1 или 2 образующих кольцо атомов 5- или 6-членного гетероарила представляют собой атомы азота, а остальные образующие кольцо атомы представляют собой атомы углерода; и фенил или 5- или 6-членный гетероарил R5 замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-1) или его фармацевтически приемлемой соли R2A представляет собой R5. В некоторых других вариантах осуществления R5 представляет собой фенил, который замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-1) или его фармацевтически приемлемой соли R2A представляет собой R5; и R5 представляет собой 5- или 6-членный гетероарил, где 1 или 2 образующих кольцо атомов 5- или 6-членного гетероарила представляют собой атомы азота, а остальные образующие кольцо атомы представляют собой атомы углерода; и 5- или 6-членный гетероарил R5 замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси. В некоторых других вариантах осуществления R5 выбран из группы, состоящей из 1H-пиразолила (например, 1H-пиразол-1-ила-) и пиридинила (например, пиридин-2-ила- и пиридин-3-ила-), где каждый из выбранных вариантов замещен 0 или 1 заместителем, выбранным из группы, состоящей из -CN, галогена, C1-2 алкила, C3-4 циклоалкила, C1-2 алкокси, C1-2 галогеналкила и C1-2 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-1) или его фармацевтически приемлемой соли R2A представляет собой R5; и R5 выбран из группы, состоящей из фенила, 1H-пиразолила и пиридинила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси. В некоторых других вариантах осуществления R5 выбран из группы, состоящей из фенила, 1H-пиразол-1-ила-, пиридин-2-ила-, пиридин-3-ила- и пиридин-4-ила, где каждый из выбранных вариантов замещен 0 или 1 заместителем, выбранным из группы, состоящей из -CN, галогена, C1-2 алкила, C3-4 циклоалкила, C1-2 алкокси, C1-2 галогеналкила и C1-2 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-1) или его фармацевтически приемлемой соли R2A представляет собой -OR5. В некоторых других вариантах осуществления R5 представляет собой фенил, который замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-1) или его фармацевтически приемлемой соли R2A представляет собой -OR5; и R5 представляет собой 5- или 6-членный гетероарил, где 1 или 2 образующих кольцо атомов 5- или 6-членного гетероарила представляют собой атомы азота, а остальные образующие кольцо атомы представляют собой атомы углерода; и 5- или 6-членный гетероарил R5 замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-1) или его фармацевтически приемлемой соли R2A представляет собой -OR5; и R5 выбран из группы, состоящей из фенила, 1H-пиразолила и пиридинила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси. В некоторых других вариантах осуществления R5 выбран из группы, состоящей из фенила, 1H-пиразол-1-ила-, пиридин-2-ила-, пиридин-3-ила- и пиридин-4-ила, где каждый из выбранных вариантов замещен 0 или 1 заместителем, выбранным из группы, состоящей из -CN, галогена, C1-2 алкила, C3-4 циклоалкила, C1-2 алкокси, C1-2 галогеналкила и C1-2 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-1) или его фармацевтически приемлемой соли R2A представляет собой -NR3S(=O)2R4 или -NR3C(=O)R4;R3 представляет собой метил; каждый R4 независимо выбран из группы, состоящей из C1-6 алкила, C3-7 циклоалкила, (C3-7 циклоалкила)-C1-2 алкила-, (фенила)-C1-2 алкила- и фенила.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-2) или его фармацевтически приемлемой соли R2B представляет собой 4-(трифторметил)-1H-пиразол-1-ил-, 4-фтор-1H-пиразол-1-ил-, 3-цианoфенил-, 6-(трифторметил)пиридин-2-ил-, 5-цианo-2-фторфенил-, или 4-(дифторметил)пиридин-2-ил-.
В некоторых вариантах осуществления соединение формулы I или его фармацевтически приемлемая соль представляет собой соединение формулы I-3 или его фармацевтически приемлемую соль, и соединение формулы I-3 или его фармацевтически приемлемая соль представляет собой соединение формулы I-3а или формулы I-3b:
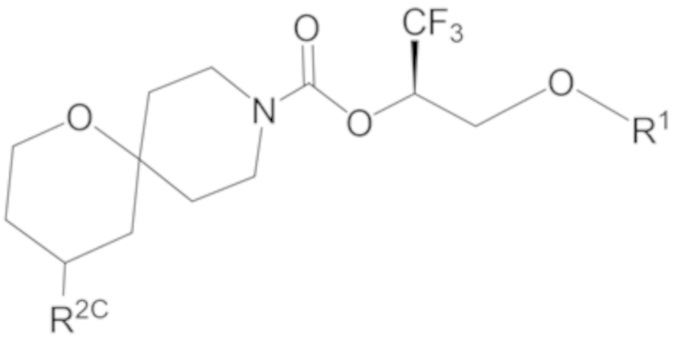
I-3a
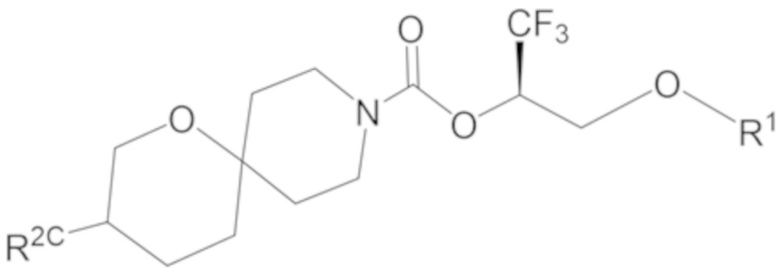
I-3b,
или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы I или его фармацевтически приемлемая соль представляет собой соединение формулы I-3a или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы I или его фармацевтически приемлемая соль представляет собой соединение формулы I-3b или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-3, I-3a или I-3b) или его фармацевтически приемлемой соли R2C представляет собой -NR3S(=O)2R4 или R5. В некоторых других вариантах осуществления R5 выбран из группы, состоящей из фенила, 1H-пиразолила и пиридинила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-3, I-3a или I-3b) или его фармацевтически приемлемой соли R2C представляет собой -NR3S(=O)2R4. В некоторых других вариантах осуществления R3 представляет собой метил; и R4 выбран из группы, состоящей из C1-6 алкила, C3-7 циклоалкила и (C3-7 циклоалкила)-C1-2 алкила-. Еще в некоторых других вариантах осуществления R4 выбран из группы, состоящей из C1-6 алкила и (C3-7 циклоалкила)-C1-2 алкила-. Еще в некоторых других вариантах осуществления R4 представляет собой (C3-7 циклоалкил)-C1-2 алкил-.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-3, I-3a или I-3b) или его фармацевтически приемлемой соли R2C представляет собой R5. В некоторых других вариантах осуществления R5 представляет собой фенил, который замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-3, I-3a или I-3b) или его фармацевтически приемлемой соли R2C представляет собой R5; и R5 представляет собой 5- или 6-членный гетероарил, где 1 или 2 образующих кольцо атомов 5- или 6-членного гетероарила представляют собой атомы азота, а остальные образующие кольцо атомы представляют собой атомы углерода; и 5- или 6-членный гетероарил R5 замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси. В некоторых других вариантах осуществления R5 выбран из группы, состоящей из 1H-пиразолила (например, 1H-пиразол-1-ила-) и пиридинила (например, пиридин-2-ила-, пиридин-3-ила- или пиридин-4-ила), где каждый из выбранных вариантов замещен 0 или 1 заместителем, выбранным из группы, состоящей из -CN, галогена, C1-2 алкила, C3-4 циклоалкила, C1-2 алкокси, C1-2 галогеналкила и C1-2 галогеналкокси.
В некоторых вариантах осуществления соединения формулы I (например, соединения формулы I-3, I-3a или I-3b) или его фармацевтически приемлемой соли R2C представляет собой R5; и R5 выбран из группы, состоящей из фенила, 1H-пиразолила и пиридинила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси. В некоторых других вариантах осуществления R5 выбран из группы, состоящей из фенила, 1H-пиразол-1-ила-, пиридин-2-ила-, пиридин-3-ила- и пиридин-4-ила, где каждый из выбранных вариантов замещен 0 или 1 заместителем, выбранным из группы, состоящей из -CN, галогена, C1-2 алкила, C3-4 циклоалкила, C1-2 алкокси, C1-2 галогеналкила и C1-2 галогеналкокси.
В некоторых вариантах осуществления настоящее изобретение предлагает соединение, выбранное из примеров 1-90 приведенного ниже раздела «ПРИМЕРЫ», или его фармацевтически приемлемую соль (или исходное соединение этого, где приводимое в качестве примера соединение является, например, солью).
В некоторых вариантах осуществления настоящее изобретение предлагает соединение, выбранное из группы, включающей:
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 2;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3S)-3-(3-цианoфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 1;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-{[6-(дифторметил)пиридин-3-ил]окси}-7-азаспиро[3.5]нонан-7-карбоксилат;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-(5-цианo-2-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 2;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[4-(дифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 1;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-[5-(дифторметил)пиридин-2-ил]-7-азаспиро[3.5]нонан-7-карбоксилат;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-(4-циклопропил-1H-пиразол-1-ил)-7-азаспиро[3.5]нонан-7-карбоксилат; и
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-(3-фторфенокси)-7-азаспиро[3.5]нонан-7-карбоксилат,
или его фармацевтически приемлемую соль.
Настоящее изобретение включает в себя любое подмножество любого описанного здесь варианта осуществления.
Настоящее изобретение включает в себя комбинации двух или более описанных выше вариантов осуществления или любое их подмножество.
Настоящее изобретение также относится к соединению формулы I или его фармацевтически приемлемой соли (включая все описанные здесь варианты осуществления и комбинации двух или более вариантов осуществления, или любую их подкомбинацию) для применения в лечении опосредованного MAGL заболевания или нарушения, описанного в данном документе.
Настоящее изобретение также относится к применению соединения формулы I или его фармацевтически приемлемой соли (включая все описанные здесь варианты осуществления и комбинации двух или более вариантов осуществления, или любую их подкомбинацию) для лечения опосредованного MAGL заболевания или нарушения, описанного в данном документе.
Настоящее изобретение также относится к способу лечения опосредованного MAGL заболевания или нарушения у пациента (например, у млекопитающего, такого, как человек), включающего введение пациенту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли (включая все описанные здесь варианты осуществления и комбинации двух или более вариантов осуществления, или любую их подкомбинацию).
Настоящее изобретение также относится к применению соединения формулы I или его фармацевтически приемлемой соли (включая все описанные здесь варианты осуществления и комбинации двух или более вариантов осуществления, или любую их подкомбинацию) при производстве лекарственного средства для применения в лечении опосредованного MAGL заболевания или нарушения, описанного в данном документе.
Соединение формулы I или его фармацевтически приемлемая соль по настоящему изобретению (или метаболит этого) представляет собой ингибитор MAGL. Таким образом, настоящее изобретение также предлагает способ ингибирования MAGL (т.е. активности MAGL in vitro или in vivo), включающий контактирование (в том числе инкубирование) MAGL с соединением формулы I или его фармацевтически приемлемой солью (как например, выбранными из приведенных здесь примеров 1-90), описанными в данном документе.
Используемый здесь термин «контактирование» относится к объединению указанных фрагментов в системе in vitro или системе in vivo. Например, «контактирование» MAGL с соединением по изобретению включает введение соединения настоящего изобретения индивидууму или пациенту, такому как человек, имеющему MAGL, а также, например, введение соединения по изобретению в образец, содержащий клеточный или очищенный препарат, содержащий MAGL.
Количество соединения формулы I или его фармацевтически приемлемой соли, используемого в любом из способов (или применений) настоящего изобретения, является эффективным для ингибирования MAGL.
Опосредованные MAGL заболевания или нарушения включают, например, метаболическое нарушение (например, ожирение); срыгивание или рвоту; тошноту; нарушение пищевого поведения (например, анорексию или булимию); невропатию (например, диабетическую невропатию, пеллагрическую невропатию, алкогольную невропатию, невропатию бери-бери); синдром жжения стоп; нейродегенеративное нарушение [множественный склероз (MS), болезнь Паркинсона (PD), болезнь Гентингтона, болезнь Альцгеймера, амиотрофический боковой склероз (ALS), эпилепсию, нарушение сна, болезнь Крейтцфельда-Якоба (CJD) или прионную болезнь]; сердечно-сосудистое заболевание (например, гипертензию, дислипидемию, атеросклероз, сердечные аритмии или сердечную ишемию); остеопороз; остеоартрит; шизофрению; депрессию; биполярное заболевание; тремор; дискинезию ; дистонию; спастичность; синдром Туретта; апноэ во сне; потерю слуха; болезни глаз (например, глаукому, глазную гипертензию, дегенерацию желтого пятна или заболевание, возникающее в результате повышенного внутриглазного давления); кахексию; инсомнию; менингит; сонную болезнь; прогрессирующую многоочаговую лейкоэнцефалопатию; болезнь де Виво; отек мозга; церебральный паралич; абстинентный синдром [абстинентный алкогольный синдром, синдром отмены антидепрессантов, синдром отмены антипсихотических средств, синдром отмены бензодиазепина, абстиненцию каннабиса, неонатальную абстиненцию, никотиновую абстиненцию или опиоидную абстиненцию]; травматическое повреждение головного мозга; повреждение спинного мозга; судороги; воздействие эксайтотоксина; ишемию [инсульт, ишемию или реперфузию печени, ишемию или реперфузию ЦНС]; фиброз печени, перегрузку железом, цирроз печени; легочное расстройство [астму, аллергические реакции, ХОЗЛ, хронический бронхит, эмфизему, муковисцидоз, пневмонию, туберкулез, отек легких, рак легких, острый респираторный дистресс-синдром, интерстициальную легочную болезнь (ILD), саркоидоз, идиопатический легочный фиброз, легочную эмболию, экссудативный плеврит или мезотелиому]; нарушение печени [острую печеночную недостаточность, синдром Алажиля, гепатит, увеличенную печень, синдром Жильбера, кисты печени, гемангиому печени, жировую болезнь печени, стеатогепатит, первичный склерозирующий холангит, фасциолез, первичный билиарный цирроз, синдром Бадда-Киари, гемохроматоз, болезнь Вильсона или транстиретин-опосредованный наследственный амилоидоз], инсульт [например, ишемический инсульт; геморрагический инсульт]; субарахноидальное кровоизлияние; вазоспазм; синдром истощения при СПИДе; почечную ишемию; нарушение, связанное с аномальным ростом или пролиферацией клеток [например, доброкачественную опухоль или рак, такие как доброкачественная опухоль кожи, опухоль головного мозга, папиллома, бластома предстательной железы, опухоль головного мозга (глиобластома, медуллоэпителиома, медуллобластома, нейробластома, астроцитома, астробластома, эпендимома, олигодендроглиома, опухоль сплетения, нейроэпителиома, эпифизарная опухоль, эпендимобластома, злокачественная менингиома, саркоматоз, меланома, шваннома), меланома, метастатическая опухоль, рак почки, рак мочевого пузыря, рак головного мозга, глиобластома (GBM), рак желудочно-кишечного тракта, лейкоз или рак крови]; аутоиммунные заболевания [например, псориаз, эритематозную волчанку, синдром Шегрена, анкилозирующий спондилит, недифференцированный спондилит, болезнь Бехчета, гемолитическую анемию, отторжение трансплантата]; воспалительное нарушение [например, аппендицит, бурсит, колит, цистит, дерматит, флебит, ринит, тендонит, тонзиллит, васкулит, обыкновенные угри, хронический простатит, гломерулонефрит, гиперчувствительность, СРК, воспаление тазовых органов, саркоидоз, ВИЧ-энцефалит, бешенство, абсцесс мозга, нейровоспаление, воспаление в центральной нервной системе (ЦНС)]; нарушение иммунной системы (например, отторжение трансплантата или целиакия); посттравматическое стрессовое расстройство (PTSD); острое стрессовое расстройство; паническое расстройство; тревожное расстройство, индуцированное веществами; обсессивно-компульсивное расстройство (OCD); агорафобию; специфическую фобию; социофобию; тревожное расстройство; синдром дефицита внимания (ADD); синдром дефицита внимания с гиперактивностью (ADHD); синдром Аспергера; боль [например, острую боль; хроническую боль; воспалительную боль; висцеральную боль; послеоперационную боль; мигрень; боль в пояснице; боль в суставах; боль в животе; боль в груди; болевой синдром после мастэктомии; менструальную боль; боль при эндометриозе; боль вследствие физической травмы; головную боль; синусовую головную боль; головную боль напряжения, боль вследствие вируса герпеса, диабетическую боль; боль вследствие нарушения, выбранного из: остеоартрита, ревматоидного артрита, спондилита, подагры, родов, заболевания опорно-двигательного аппарата, заболевания кожи, зубной боли, изжоги, ожога, солнечного ожога, укуса змеи, укуса ядовитой змеи, укуса паука, укуса насекомого, нейрогенного мочевого пузыря, интерстициального цистита, инфекции мочевыводящих путей (UTI), ринита, контактного дерматита/гиперчувствительности, зуда, экземы, фарингита, мукозита, энтерита, синдрома раздраженного кишечника (СРК), холецистита и панкреатита; невропатическую боль (например, невропатическую боль в пояснице, комплексный регионарный болевой синдром, посттравматическую невралгию тройничного нерва, каузалгию, токсическую невропатию, рефлекторную симпатическую дистрофию, диабетическую невропатию, хроническую невропатию от химиотерапевтического агента или боль в пояснично-крестцовом отделе)]; демиелинизирующее заболевание [например, множественный склероз (MS), болезнь Девика, невропатии ЦНС, центральный понтинный миелинолиз, сифилитическую миелопатию, лейкоэнцефалопатию, лейкодистрофию, синдром Гийена-Барре, хроническую воспалительную демиелинизирующую полиневропатию, анти-MAG (миелин-ассоциированный гликопротеин) периферийную невропатию, болезнь Шарко-Мари-Тута, периферическую невропатию, миелопатию, невропатию зрительного нерва, прогрессирующую воспалительную невропатию, неврит зрительного нерва, поперечный миелит]; и когнитивные нарушения [например, когнитивные нарушения, связанные с синдромом Дауна; когнитивные нарушения, связанные с болезнью Альцгеймера; когнитивные нарушения, связанные с PD; легкие когнитивные нарушения (MCI), деменцию, когнитивные нарушения после химиотерапии (PCCI), послеоперационную когнитивную дисфункцию (POCD)].
Используемый в данном описании термин «терапевтически эффективное количество» относится к такому количеству соединения (включая его фармацевтически приемлемую соль), которое при введении будет облегчать в некоторой степени один или более симптомов подлежащего лечению нарушения. В случае лечения опосредованного MAGL заболевания или нарушения (например, болезни Альцгеймера, воспаления или боли) терапевтически эффективное количество относится к такому количеству, которое оказывает воздействие в виде ослабления до некоторой степени (или, например, устранения) одного или более симптомов, связанных с опосредованным MAGL заболеванием или нарушением (например, психотического симптома болезни Альцгеймера).
Используемый в данном описании термин «лечить», если не указано иное, означает реверсирование, ослабление, ингибирование развития или предупреждение нарушения или состояния, к котором такой термин применяется, или одного или более симптомов такого нарушения или состояния. Используемый в данном описании термин «лечение», если не указано иное, относится к действию лечения в том смысле, как термин «лечить» определен в данном описании. Термин «лечение» также включает адъювантное и неоадъювантное лечение субъекта.
Используемый в настоящем описании термин «n-членный», где n представляет собой целое число, обычно описывает число образующих кольцо атомов в фрагменте, где число образующих кольцо атомов равно n. Например, пиридин представляет собой пример 6-членного гетероарильного кольца, а тиофен представляет собой пример 5-членной гетероарильной группы.
В разных местах настоящего описания заместители соединений по изобретению описаны в группах или в диапазонах. Специально оговаривается, что изобретение включает все без исключения индивидуальные подкомбинации членов таких групп и диапазонов. Например, термин «С1-6 алкил» специально предназначен для включения C1 алкила (метил), С2 алкила (этил), C3 алкила, C4 алкила, C5 алкила и C6 алкила. В качестве другого примера, термин «5-10-членная гетероарильная группа» специально предназначен для включения любой 5-, 6-, 7-, 8-, 9- или 10-членной гетероарильной группы.
Используемый в настоящем описании термин «алкил» определен как включающий насыщенные алифатические углеводороды, включая прямые цепи и разветвленные цепи. В некоторых вариантах осуществления алкильная группа имеет 1-6 атомов углерода, 1-4 атомов углерода, 1-3 атома углерода или 1-2 атома углерода. Например, термин «С1-6 алкил», а также алкильные фрагменты других групп, на которые делается ссылка в данном описании (например, C1-6 алкокси), относится к линейным или разветвленным радикалам из 1-6 атомов углерода (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил или н-гексил). В еще одном примере термин «C1-4 алкил» относится к линейной или разветвленной алифатической углеводородной цепи, содержащей от 1 до 4 атомов углерода; термин «C1-3 алкил» относится к линейной или разветвленной алифатической углеводородной цепи, содержащей от 1 до 3 атомов углерода; термин «C1-2 алкил» относится к метилу и/или этилу; и термин «C1 алкил» относится к метилу. Алкильная группа может быть необязательно замещена одним или более (например, от 1 до 5) подходящими заместителями.
Используемый в настоящем описании термин «алкенил» относится к алифатическим углеводородам, имеющим по меньшей мере одну двойную углерод-углеродную связь, включая прямые цепи и разветвленные цепи, имеющие по меньшей мере одну двойную углерод-углеродную связь. В некоторых вариантах осуществления алкенильная группа имеет 2-6 атомов углерода, 3-6 атомов углерода или 2-4 атома углерода. Например, используемый в данном описании термин «C2-6 алкенил» означает ненасыщенные радикалы с прямой или разветвленной цепью (имеющие по меньшей мере одну двойную углерод-углеродную связь) из 2-6 атомов углерода, включая, без ограничения, этенил, 1-пропенил, 2-пропенил (аллил), изопропенил, 2-метил-1-пропенил, 1-бутенил, 2-бутенил и тому подобное. Алкенильная группа может быть необязательно замещена одним или более (например, от 1 до 5) подходящими заместителями. Когда соединения формулы I содержат алкенильную группу, алкенильная группа может существовать как чистая Е форма, чистая Z форма или любая их смесь.
Используемый в настоящем описании термин «циклоалкил» относится к насыщенным или ненасыщенным, неароматическим, моноциклическим или полициклическим (таким как бициклические) углеводородным кольцам (например, моноциклическим, таким как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, или бициклическим, включая спиро-, конденсированные или мостиковые системы (такие как бицикло[1.1.1]пентанил, бицикло[2.2.1]гептанил, бицикло[3.2.1]октанил или бицикло[5.2.0]нонанил, декагидронафталинил и т.п.). Циклоалкильная группа имеет от 3 до 15 атомов углерода. В некоторых вариантах осуществления циклоалкил может необязательно содержать одну, две или более некумулятивных неароматических двойных или тройных связей и/или от одной до трех оксогрупп. В некоторых вариантах осуществления бициклоалкильная группа имеет от 6 до 14 атомов углерода. Например, термин «C3-7 циклоалкил» относится к насыщенным или ненасыщенным, неароматическим, моноциклическим или полициклическим (например, бициклическим) углеводородным кольцам из 3-7 образующих кольцо атомов углерода (например, циклопропил, циклобутил, циклопентил, циклогексил, бицикло[1.1.1]пентан-1-ил или бицикло[1.1.1]пентaн-2-ил). В качестве другого примера термин «C3-6 циклоалкил» относится к насыщенным или ненасыщенным, неароматическим, моноциклическим или полициклическим (например, бициклическим) углеводородным кольцам из 3-6 образующих кольцо атомов углерода. В качестве еще одного примера термин «C3-4 циклоалкил» относится к циклопропилу или циклобутилу. Также в определение циклоалкила включены фрагменты, которые имеют одно или более ароматических колец (включая арил и гетероарил), конденсированных с циклоалкильным кольцом, например, бензо- или тиенильные производные циклопентана, циклопентена, циклогексана и тому подобное (например, 2,3-дигидро-1Н-инден-1-ил или 1Н-инден-2(3H)-он-1-ил). Циклоалкильная группа может быть необязательно замещена одним или более (например, от 1 до 5) подходящими заместителями.
Используемый в настоящем описании термин «арил» относится к состоящим полностью из углерода моноциклическим или конденсированным кольцевым полициклическим ароматическим группам, имеющим сопряженную систему пи-электронов. Арильная группа имеет 6 или 10 атомов углерода в кольце (кольцах). Чаще всего арильная группа имеет 6 атомов углерода в кольце. Например, используемый в данном описании термин «C6-10 арил» означает ароматические кольцевые радикалы, содержащие 6-10 атомов углерода, такие как фенил или нафтил. Арильная группа может быть необязательно замещена одним или более (например, от 1 до 5) подходящими заместителями.
Используемый в настоящем описании термин «гетероарил» относится к моноциклическим или конденсированным кольцевым полициклическим ароматическим гетероциклическим группам с одним или более гетероатомами в качестве членов кольца (образующих кольцо атомов), каждый из которых независимо выбран из О, S и N в по меньшей мере одном кольце. Гетероарильная группа имеет от 5 до 10 образующих кольцо атомов, включая от 1 до 9 атомов углерода и от 1 до 9 гетероатомов, каждый из которых независимо выбран из О, S и N. В некоторых вариантах осуществления гетероарильная группа имеет от 5 до 10 образующих кольцо атомов, включая от одного до четырех гетероатомов. Гетероарильная группа может также содержать от одной до трех оксо или тионо (т.е. =S) групп. В некоторых вариантах осуществления гетероарильная группа имеет 5-8 образующих кольцо атомов, включая один, два или три гетероатома. Например, термин «5-членный гетероарил» относится к моноциклической гетероарильной группе, как определено выше, с 5 образующими кольцо атомами в моноциклическом гетероарильном кольце; термин «6-членный гетероарил» относится к моноциклической гетероарильной группе, как определено выше, с 6 образующими кольцо атомами в моноциклическом гетероарильном кольце; и термин «5- или 6-членный гетероарил» относится к моноциклической гетероарильной группе, как определено выше, с 5 или 6 образующими кольцо атомами в моноциклическом гетероарильном кольце. В качестве другого примера, термин «5- или 10-членный гетероарил» относится к моноциклической или бициклической гетероарильной группе, как определено выше, с 5, 6, 7, 8, 9 или 10 образующими кольцо атомами в моноциклическом или бициклическом гетероарильном кольце. Гетероарильная группа может быть необязательно замещена одним или более (например, от 1 до 5) подходящими заместителями. Примеры моноциклических гетероарилов включают гетероарилы с 5 образующими кольцо атомами, включая от одного до трех гетероатомов, или гетероарилы с 6 образующими кольцо атомами, включая один, два или три гетероатома азота. Примеры конденсированных бициклических гетероарилов включают два конденсированных 5- и/или 6-членных моноциклических кольца, включающих от одного до четырех гетероатомов.
Примеры гетероарильных групп включают пиридинил, пиразинил, пиримидинил, пиридазинил, тиенил, фурил, имидазолил, пирролил, оксазолил (например, 1,3-оксазолил, 1,2-оксазолил), тиазолил (например, 1,2-тиазолил, 1,3-тиазолил), пиразолил (например, 1H-пиразол-1-ил, пиразол-3-ил, пиразол-4-ил), тетразолил, триазолил (например, 1,2,3-триазолил, 1,2,4-триазолил), оксадиазолил (например, 1,2,3-оксадиазолил), тиадиазолил (например, 1,3,4-тиадиазолил), хинолил, изохинолил, бензотиенил, бензофурил, индолил, 1H-имидазо[4,5-c]пиридинил, имидазо[1,2-a]пиридинил, 1H-пирроло[3,2-c]пиридинил, имидазо[1,2-a]пиразинил, имидазо[2,1-c][1,2,4]триазинил, имидазо[1,5-a]пиразинил, имидазо[1,2-a]пиримидинил, 1H-индазолил, 9H-пуринил, имидазо[1,2-a]пиримидинил, [1,2,4]триазоло[1,5-a]пиримидинил, [1,2,4]триазоло[4,3-b]пиридазинил, изоксазолo[5,4-c]пиридазинил, изоксазолo[3,4-c]пиридазинил, пиридон, пиримидон, пиразинон, пиримидинон, 1H-имидазол-2(3H)-он, 1H-пиррол-2,5-дион, 3-оксо-2H-пиридазинил, 1H-2-оксо-пиримидинил, 1H-2-оксо-пиридинил, 2,4(1H,3H)-диоксо-пиримидинил, 1H-2-оксо-пиразинил и тому подобное. Гетероарильная группа может быть необязательно замещена одним или более (например, от 1 до 5) подходящими заместителями.
Используемый в настоящем описании термин «гетероциклоалкил» относится к моноциклической или полициклической [включая 2 или более колец, которые конденсированы вместе, включая спиро-, конденсированные или мостиковые системы, например, бициклическую кольцевую систему], насыщенной или ненасыщенной, неароматической 4-15-членной кольцевой системе (такой как 4-14-членная кольцевая система, 4-12-членная кольцевая система, 4-10-членная кольцевая система, 5-10-членная кольцевая система, 4-7-членная кольцевая система, 4-6-членная кольцевая система или 5-6-членная кольцевая система), включающей 1-14 образующих кольцо атомов углерода и 1-10 образующих кольцо гетероатомов, каждый из которых независимо выбран из O, S и N (и необязательно P или B, если они присутствуют). Гетероциклоалкильная группа может также необязательно содержать одну или более оксо (т.е. =O) или тионо (т.е. =S) групп. Например, термин «4-10-членный гетероциклоалкил» относится к моноциклической или полициклической, насыщенной или ненасыщенной, неароматической 4-10-членной кольцевой системе, которая содержит один или более образующих кольцо гетероатомов, каждый из которых независимо выбран из О, S и N. В качестве другого примера, термин «4-6-членный гетероциклоалкил» относится к моноциклической или полициклической, насыщенной или ненасыщенной, неароматической 4-6-членной кольцевой системе, которая содержит один или более образующих кольцо гетероатомов, каждый из которых независимо выбран из О, S и N; и термин «5-6-членный гетероциклоалкил» относится к моноциклической или полициклической, насыщенной или ненасыщенной, неароматической 5-6-членной кольцевой системе, которая содержит один или более образующих кольцо гетероатомов, каждый из которых независимо выбран из О, S и N. Также в определение гетероциклоалкила включены фрагменты, имеющие одно или более ароматических колец (включая арильное и гетероарильное), конденсированных с неароматическим гетероциклоалкильным кольцом, например, пиридинил, пиримидинил, тиофенил, пиразолил, фталимидил, нафталимидил и бензо-производными неароматических гетероциклоалкильных колец. Гетероциклоалкильная группа может быть необязательно замещена одним или более (например, от 1 до 5) подходящими заместителями.
Примеры таких гетероциклоалкильных колец включают азетидинил, тетрагидрофуранил, имидазолидинил, пирролидинил, пиперидинил, пиперазинил, оксазолидинил, тиазолидинил, пиразолидинил, тиоморфолинил, тетрагидротиазинил, тетрагидротиадиазинил, морфолинил, оксетанил, тетрагидродиазинил, оксазинил, оксатиазинил, хинуклидинил, хроманил, изохроманил, бензоксазинил, 2-оксаспиро[3.3]гептил {например, 2-оксаспиро[3.3]гепт-6-ил}, 7-азабицикло[2.2.1]гептан-1-ил, 7-азабицикло[2.2.1]гептан-2-ил, 7-азабицикло[2.2.1]гептан-7-ил, 2-азабицикло[2.2.1]гептан-3-он-2-ил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил и тому подобное. Другие примеры гетероциклоалкильных колец включают тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидропиранил (например, тетрагидро-2H-пиран-4-ил), имидазолидин-1-ил, имидазолидин-2-ил, имидазолидин-4-ил, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, пиперазин-1-ил, пиперазин-2-ил, 1,3-оксазолидин-3-ил, 1,4-оксазепан-1-ил, изотиазолидинил, 1,3-тиазолидин-3-ил, 1,2 пиразолидин-2-ил, 1,2-тетрагидротиазин-2-ил, 1,3-тиазинан-3-ил, 1,2-тетрагидродиазин-2-ил, 1,3 тетрагидродиазин-1-ил, 1,4-оксазин-4-ил, оксазолидинонил, 2-оксо-пиперидинил (например, 2-оксо-пиперидин-1-ил), 2-оксоазепан-3-ил, и тому подобное. Некоторые примеры ароматических конденсированных гетероциклоалкильных групп включают индолинил, изоиндолинил, изоиндолин-1-он-3-ил, 5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил, 6,7-дигидро-5H-пирроло[3,4-d]пиримидин-6-ил, 4,5,6,7-тетрагидротиено[2,3-c]пиридин-5-ил, 5,6-дигидротиено[2,3-c]пиридин-7(4H)-он-5-ил, 1,4,5,6-тетрагидропирролo[3,4-c]пиразол-5-ил, и 3,4-дигидроизохинолин-1(2H)-он-3-ил. Гетероциклоалкильная группа необязательно замещена одним или более (например, от 1 до 5) подходящими заместителями. Примеры гетероциклоалкильных групп включают 5- или 6-членные моноциклические кольца и 9- или 10-членные конденсированные бициклические кольца.
Используемый в настоящем описании термин «галоген» или «галогеновая» группа определяется как включающий фтор, хлор, бром или йод.
Используемый в настоящем описании термин «галогеналкил» относится к алкильной группе, имеющей один или более галогеновых заместителей (вплоть до пергалогеналкила, т.е. когда каждый атом водорода алкильной группы замещен атомом галогена). Например, термин «C1-4 галогеналкил» относится к C1-4 алкильной группе, имеющей один или более галогеновых заместителей (вплоть до пергалогеналкила, т.е. когда каждый атом водорода алкильной группы замещен атомом галогена); термин «C1-3 галогеналкил» относится к C1-3 алкильной группе, имеющей один или более галогеновых заместителей (вплоть до пергалогеналкила, т.е. когда каждый атом водорода алкильной группы замещен атомом галогена); и термин «C1-2 галогеналкил» относится к C1-2 алкильной группе, имеющей один или более галогеновых заместителей (вплоть до пергалогеналкила, т.е. когда каждый атом водорода алкильной группы замещен атомом галогена). В еще одном примере термин «C1 галогеналкил» относится к метильной группе, имеющей один, два или три галогеновых заместителя. Примеры галогеналкильных групп включают CF3, C2F5, CHF2, CH2F, CH2CF3, CH2Cl и тому подобное.
Используемый в настоящем описании термин «алкокси» или «алкилокси» относится к группе -O-алкил. Например, термин «C1-6 алкокси» или «С1-6 алкилокси» относится к группе -O-(C1-6 алкил); и термин «C1-4 алкокси» или «C1-4 алкилокси» относится к группе -O-(C1-4 алкил). В качестве другого примера, термин «C1-2 алкокси» или «C1-2 алкилокси» относится к группе -O-(C1-2 алкил). Примеры алкокси включают метокси, этокси, пропокси (например, н-пропокси и изопропокси), трет-бутокси и тому подобное. Алкокси- или алкилоксигруппа может быть необязательно замещена одним или более (например, от 1 до 5) подходящими заместителями.
В данном описании термин «галогеналкокси» относится к группе -О-галогеналкил. В качестве другого примера, термин «C1-4 галогеналкокси» относится к группе -O-(C1-4 галогеналкил); и термин «C1-2 галогеналкокси» относится к группе -O-(C1-2 галогеналкил). В еще одном примере термин «C1 галогеналкокси» относится к метоксигруппе, имеющей один, два или три галогеновых заместителя. Примером галогеналкокси является -OCF3 или -OCHF2.
Используемый в настоящем описании термин «оксо» относится к =O. Когда оксо является заместителем на атоме углерода, они вместе образуют карбонильный фрагмент [-С(=O)-]. Когда оксо является заместителем на атоме серы, они вместе образуют сульфинильный фрагмент [-S(=O)-]; когда две оксогруппы являются заместителями на атоме серы, они вместе образуют сульфонильный фрагмент [-S(=O)2-].
Используемый в настоящем описании термин «необязательно замещенный» означает, что замещение является необязательным, и поэтому включает как незамещенные, так и замещенные атомы и фрагменты. «Замещенный» атом или фрагмент означает, что любой водород в указанном атоме или фрагменте может быть заменен группой, выбранной из указанных групп-заместителей (вплоть до того, что каждый атом водорода в указанном атоме или фрагменте заменен группой, выбранной из указанных групп-заместителей), при условии, что нормальная валентность указанного атома или фрагмента не превышена, и что замещение приводит к стабильному соединению. Например, если метильная группа (т.е. CH3) необязательно замещена, тогда вплоть до 3 атомов водорода на атоме углерода могут быть заменены группами-заместителями.
В настоящем описании, если не указано иное, место присоединения заместителя может быть из любого подходящего положения заместителя. Например, пиперидинил может представлять собой пиперидин-1-ил (присоединенный через атом N пиперидинила), пиперидин-2-ил (присоединенный через атом С в положении 2 пиперидинила), пиперидин-3-ил (присоединенный через атом С в положении 3 пиперидинила) или пиперидин-4-ил (присоединенный через атом С в положении 4 пиперидинила). В качестве другого примера, пиридинил (или пиридил) может представлять собой 2-пиридинил (или пиридин-2-ил), 3-пиридинил (или пиридин-3-ил) или 4-пиридинил (или пиридин-4-ил).
В настоящем описании место присоединения заместителя может быть определено, чтобы указать положение, в котором заместитель присоединен к другому фрагменту. Например, «(C3-7 циклоалкил)-C1-2 алкил-» означает, что место присоединения находится в «C1-2 алкильной» части «(C3-7 циклоалкил)-C1-2 алкила-». В качестве другого примера, «(C6-10 арил)-C1-2 алкил-» означает, что место присоединения находится в «C1-2 алкильной» части «(C6-10 арил)-C1-2 алкила-».
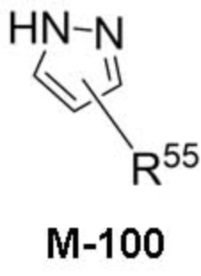
В данном описании, когда связь с заместителем показана пересекающей кольцо (или связь, соединяющую два атома в кольце), тогда такой заместитель может быть связан с любым из образующих кольцо атомов, которые являются замещаемыми (т.е. связаны с одним или более атомами водорода), если не указано иное или иное не следует из контекста. Например, как показано в формуле М-1 ниже, R2 может быть связан с любым из образующих кольцо атомов кольца A1 (например, азотом или углеродом), который несет атом водорода (например, NH или CH2). В качестве другого примера, как показано в фрагменте M-1c ниже, R2C может быть связан с любым образующим кольцо атомом тетрагидропиранового кольца, который является замещаемым (т.е. одним из атомов углерода -CH2-CH2-CH2- групп тетрагидропиранового кольца); но не на пиперидиновом кольце фрагмента M-1c, потому что связь не пересекает пиперидиновое кольцо. В качестве еще одного примера, как показано в структуре М-100, R55 может быть связан с азотом (NH) или одним из атомов углерода.

Когда описывается замещенный или необязательно замещенный фрагмент без указания атома, через который такой фрагмент связан с заместителем, тогда заместитель может быть связан через любой подходящий атом в таком фрагменте. Например, в замещенном арилалкиле заместитель на арилалкиле [например, (C6-10 арил)-C1-4 алкил-] может быть связан с любым атомом углерода в алкильной части или в арильной части арилалкила. Комбинации заместителей и/или переменных допустимы, только если такие комбинации имеют результатом стабильные соединения.
Как отмечалось выше, соединения формулы I могут существовать в форме фармацевтически приемлемых солей, таких как, например, кислотно-аддитивные соли и/или основно-аддитивные соли соединений формулы I. Выражение «фармацевтически приемлемая соль (соли)», используемое в данном описании, если не указано иное, включает соли присоединения кислоты или основания, которые могут быть представлены в соединениях формулы I.
Фармацевтически приемлемые соли соединений формулы I включают их кислотно-аддитивные соли и соли оснований.
Подходящие кислотно-аддитивные соли образуются из кислот, которые образуют нетоксичные соли. Примеры солей включают ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камфорсульфонат, цитрат, цикламат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинафоат.
Подходящие основные соли образуются из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка.
Могут также образовываться полусоли кислот и оснований, например, полусульфаты и полукальциевые соли.
Для обзора подходящих солей см. «Handbook of Pharmaceutical Salts: Properties, Selection, and Use», Stahl, Wermuth (Wiley-VCH, 2002). Способы получения фармацевтически приемлемых солей соединений формулы I известны специалисту в данной области.
Используемые в настоящем документе термины «формула I», «формула I или ее фармацевтически приемлемая соль» определены как включающие все формы соединения формулы I или его фармацевтически приемлемых солей, включая его гидраты, сольваты, изомеры (в том числе, например, поворотные стереоизомеры), кристаллические и некристаллические формы, изоморфы, полиморфы, метаболиты и пролекарства.
Как известно специалисту в данной области, аминные соединения (т.е. соединения, которые содержат один или более атомов азота), например, третичные амины, могут образовывать N-оксиды (также известные как аминоксиды или аминные N-оксиды). N-оксид имеет формулу (R100)(R200)(R300)N+-O-, где родительский амин (R100)(R200)(R300)N может представлять собой, например, третичный амин (например, каждый из R100, R200, R300 независимо представляет собой алкил, арилалкил, арил, гетероарил и тому подобное), гетероциклический или гетероароматический амин [например, (R100)(R200)(R300)N вместе образуют 1-алкилпиперидин, 1-алкилпирролидин, 1-бензилпирролидин или пиридин]. В частности, иминный азот, особенно гетероциклический или гетероароматический иминный азот, или атом азота пиридинового типа (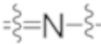 ) [такой как атом азота в пиридине, пиридазине или пиразине], может быть N-окисленным с образованием N-оксида, содержащего группу (
) [такой как атом азота в пиридине, пиридазине или пиразине], может быть N-окисленным с образованием N-оксида, содержащего группу (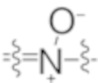 ). Таким образом, соединение по настоящему изобретению, содержащее один или более атомов азота (например, иминный атом азота), может быть способно образовывать его N-оксид (например, моно-N-оксиды, бис-N-оксиды или мульти-N-оксиды, или их смеси в зависимости от числа атомов азота, подходящих для образования стабильных N-оксидов).
). Таким образом, соединение по настоящему изобретению, содержащее один или более атомов азота (например, иминный атом азота), может быть способно образовывать его N-оксид (например, моно-N-оксиды, бис-N-оксиды или мульти-N-оксиды, или их смеси в зависимости от числа атомов азота, подходящих для образования стабильных N-оксидов).
Используемый в настоящем описании термин «N-оксид (N-оксиды)» относится ко всем возможным и, в частности, всем стабильным N-оксидным формам аминных соединений (например, соединений, содержащих один или более иминных атомов азота), описанным в данном описании, таким как моно-N-оксиды (включая разные изомеры, когда более чем один атом азота аминного соединения может образовывать моно-N-оксид) или мульти-N-оксиды (например, бис-N-оксиды), или их смеси в любом соотношении.
Описанные здесь соединения формулы I и их соли также включают их N-оксиды.
В приведенном ниже описании, если не указано иное, соединения формулы I (или соединения данного изобретения) включают соли соединений и N-оксиды соединений или солей.
Как также известно специалисту в данной области, соединения третичного амина (т.е. соединения, содержащие один или более атомов азота третичного амина) могут образовывать соли четвертичного аммония. В приведенном ниже описании, если не указано иное, соединения формулы I (или соединения данного изобретения) также включают их соли четвертичного аммония.
Соединения формулы I могут существовать в континууме твердых состояний от полностью аморфного до полностью кристаллического. Термин «аморфный» относится к состоянию, в котором вещество не имеет дальнего порядка на молекулярном уровне и, в зависимости от температуры, может проявлять физические свойства твердого вещества или жидкости. Обычно такие материалы не дают четких рентгендифракционных картин, и, несмотря на то, что они демонстрируют свойства твердого вещества, их более формально описывают как жидкость. При нагревании происходит переход от видимого твердого вещества к материалу со свойствами жидкости, что характеризуется фазовым переходом, обычно второго рода («стеклование»). Термин «кристаллический» относится к твердой фазе, в которой вещество имеет регулярную упорядоченную внутреннюю структуру на молекулярном уровне и дает характерную рентгеновскую дифрактограмму с определенными пиками. Такие материалы при достаточном нагревании также будут демонстрировать свойства жидкости, но изменение от твердого состояния к жидкому характеризуется фазовым переходом, обычно первого рода («точка плавления»).
Соединения формулы I могут существовать в несольватированных и сольватированных формах. Когда растворитель или вода прочно связаны, комплекс будет иметь хорошо определенную стехиометрию, независимо от влажности. Однако, когда растворитель или вода слабо связаны, как в канальных сольватах и гигроскопичных соединениях, содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях отсутствие стехиометрии будет нормой.
Соединения формулы I могут существовать как клатраты или другие комплексы (например, сокристаллы). В объем изобретения включены комплексы, такие как клатраты, комплексы включения лекарственное средство-хозяин, где лекарственное средство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. Также включены комплексы соединений формулы I, содержащие два или более органических и/или неорганических компонентов, которые могут находиться в стехиометрических или нестехиометрических количествах. Полученные комплексы могут быть ионизированными, частично ионизированными или неионизированными. Сокристаллы обычно определяют как кристаллические комплексы нейтральных молекулярных компонентов, которые связаны друг с другом через нековалентные взаимодействия, но они также могут быть комплексом нейтральной молекулы с солью. Сокристаллы могут быть получены кристаллизацией из расплава или перекристаллизацией из растворителей, или физическим измельчением компонентов друг с другом - см. O. Almarsson, M. J. Zaworotko, Chem. Commun. 2004, 17, 1889-1896. Что касается общего обзора многокомпонентных комплексов, - см. J. K. Haleblian, J. Pharm. Sci. 1975, 64, 1269-1288.
Соединения данного изобретения также могут существовать в мезоморфном состоянии (мезофаза или жидкий кристалл) при воздействии подходящих условий. Мезоморфное состояние является промежуточным между истинным кристаллическим состоянием и истинным жидким состоянием (либо расплав, либо раствор). Мезоморфизм, появляющийся в результате изменения температуры, описывают как «термотропный», и мезоморфизм, появляющийся в результате добавления второго компонента, такого как вода или другой растворитель, описывают как «лиотропный». Соединения, которые имеют возможность образовывать лиотропные мезофазы, описываются как «амфифильные» и содержат молекулы, которые имеют ионную (например, -COO-Na+, -COO-K+ или -SO3-Na+) или неионную (например, -N-N+(CH3)3) полярную головную группу. Дополнительную информацию см. в «Crystals and the Polarizing Microscope», N. H. Hartshorne, A. Stuart, 4th Edition (Edward Arnold, 1970).
Изобретение также относится к пролекарствам соединений формулы I. Таким образом, определенные производные соединений формулы I, которые сами по себе могут иметь слабую фармакологическую активность или не иметь ее вовсе, при введении внутрь организма или при нанесении снаружи могут превращаться в соединения формулы I, имеющие желательную активность, например, путем гидролитического расщепления. Такие производные называются «пролекарствами». Дополнительную информацию об использовании пролекарств можно найти в «Pro-drugs as Novel Delivery Systems», Vol. 14, ACS Symposium Series (T. Higuchi, W. Stella) и «Bioreversible Carriers in Drug Design», Pergamon Press, 1987 (Ed. E. B. Roche, American Pharmaceutical Association).
Пролекарства в соответствии с изобретением могут, например, быть получены замещением соответствующих функциональных групп, присутствующих в соединениях формулы I, на определенные фрагменты, известные специалистам в данной области как «профрагменты», как описано, например, в «Design of Prodrugs», H. Bundgaard (Elsevier, 1985), или в «Prodrugs: Challenges and Reward», 2007 edition, под ред. Valentino Stella, Ronald Borchardt, Michael Hageman, Reza Oliyai, Hans Maag, Jefferson Tilley, pp.134-175 (Springer, 2007).
Кроме того, некоторые соединения формулы I могут сами выступать в качестве пролекарств других соединений формулы I.
Также в объем изобретения включены метаболиты соединений формулы I, то есть соединения, образующиеся in vivo при введении лекарственного средства.
Соединения формулы I включают все стереоизомеры и таутомеры. Стереоизомеры формулы I включают цис- и транс-изомеры, оптические изомеры, такие как R и S энантиомеры, диастереомеры, геометрические изомеры, поворотные изомеры, атропоизомеры и конформационные изомеры соединений формулы I, включая соединения, существующие более чем в одном типе изомерии; и их смеси (такие как рацематы и диастереомерные пары). Также включены кислотно-аддитивные или основно-аддитивные соли, в которых противоион является оптически активным, например, D-лактат или L-лизин, или рацемическим, например, DL-тартрат или DL-аргинин.
В некоторых вариантах осуществления соединения формулы I (включая их соли) могут иметь асимметричные атомы углерода. Углерод-углеродные связи соединений формулы I могут быть представлены в данном описании, используя сплошную линию ( ), волнистую линию (
), волнистую линию ( ), сплошной клин (
), сплошной клин ( ) или пунктирный клин (
) или пунктирный клин ( ). Использование сплошной линии для изображения связей с асимметричными атомами углерода предполагается для указания на то, что включены все возможные стереоизомеры (например, конкретные энантиомеры, рацемические смеси и так далее) по этому атому углерода. Использование сплошного или пунктирного клина для изображения связей с асимметричными атомами углерода предназначено для того, чтобы указать на то, что включенным считается только показанный стереоизомер. Использование волнистой линии для изображения связей с асимметричными атомами углерода означает, что стереохимия неизвестна (если не указано иное). Возможно, что соединения формулы I могут содержать более одного асимметричного атома углерода. В таких соединениях использование сплошной линии для изображения связей с асимметричными атомами углерода предназначено для того, чтобы указать на то, что все возможные стереоизомеры подразумеваются как включенные. Например, если не указано иное, предполагается, что соединения формулы I могут существовать как энантиомеры и диастереомеры или как рацематы и их смеси. Использование сплошной линии для изображения связей с одним или более асимметричных атомов углерода в соединении формулы I и использование сплошного или пунктирного клина для изображения связей с другими асимметричными атомами углерода в том же соединении означает, что присутствует смесь диастереомеров.
). Использование сплошной линии для изображения связей с асимметричными атомами углерода предполагается для указания на то, что включены все возможные стереоизомеры (например, конкретные энантиомеры, рацемические смеси и так далее) по этому атому углерода. Использование сплошного или пунктирного клина для изображения связей с асимметричными атомами углерода предназначено для того, чтобы указать на то, что включенным считается только показанный стереоизомер. Использование волнистой линии для изображения связей с асимметричными атомами углерода означает, что стереохимия неизвестна (если не указано иное). Возможно, что соединения формулы I могут содержать более одного асимметричного атома углерода. В таких соединениях использование сплошной линии для изображения связей с асимметричными атомами углерода предназначено для того, чтобы указать на то, что все возможные стереоизомеры подразумеваются как включенные. Например, если не указано иное, предполагается, что соединения формулы I могут существовать как энантиомеры и диастереомеры или как рацематы и их смеси. Использование сплошной линии для изображения связей с одним или более асимметричных атомов углерода в соединении формулы I и использование сплошного или пунктирного клина для изображения связей с другими асимметричными атомами углерода в том же соединении означает, что присутствует смесь диастереомеров.
В некоторых вариантах осуществления соединения формулы I могут существовать и/или могут быть выделены как атропоизомеры (например, один или более аторопэнантиомеров). Для специалиста в данной области будет понятно, что атропоизомерия может существовать в соединении, которое имеет два или более ароматических кольца (например, два ароматических кольца, связанные посредством простой связи). См., например, Freedman, T. B. et al., «Absolute Configuration Determination of Chiral Molecules in the Solution State Using Vibrational Circular Dichroism». Chirality 2003, 15, 743-758; и Bringmann, G. et al., «Atroposelective Synthesis of Axially Chiral Biaryl Compounds», Angew. Chem., Int. Ed. 2005, 44, 5384-5427.
При кристаллизации любого рацемата возможны кристаллы различных типов. Один тип представляет собой рацемическое соединение (истинный рацемат), в котором образуется одна гомогенная форма кристалла, содержащая оба энантиомера в эквимолярных количествах. Другой тип представляет собой рацемическую смесь или конгломерат, в котором две формы кристаллов образуются в одинаковых или разных молярных количествах, каждая из которых содержит единственный энантиомер.
Соединения формулы I могут демонстрировать явления таутомерии и структурной изомерии. Например, соединения формулы I могут существовать в нескольких таутомерных формах, включая енольную и иминную форму, амидную и имидную кислотную форму, и кето и енаминную форму, и их геометрические изомеры и смеси. Все такие таутомерные формы включены в объем соединений формулы I. Таутомеры могут существовать как смеси таутомерного комплекса в растворе. В твердой форме обычно превалирует один таутомер. Хотя может быть описан один таутомер, настоящее изобретение включает все таутомеры соединений формулы I. Например, когда раскрывается один из следующих двух таутомеров (где R может быть, например, фенилом, который дополнительно замещен), специалисты в данной области техники легко распознают другой таутомер.
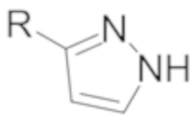 и
и 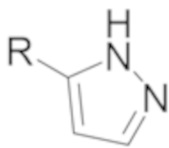 .
.
Настоящее изобретение включает все фармацевтически приемлемые изотопно-меченные соединения формулы I или их соли, в которых один или более атомов замещены атомами, имеющими тот же самый атомный номер, но атомную массу или массовое число, отличающиеся от атомной массы или массового числа, которое преобладает в природе.
Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода, такие как 2H и 3H, углерод, такой как 11C, 13C и 14C, хлор, такой как 36Cl, фтор, такой как 18F, йод, такой как 123I и 125I, азот, такой как 13N и 15N, кислород, такой как 15O, 17O и 18O, фосфор, такой как 32P, и серу, такую как 35S.
Некоторые изотопно-меченные соединения формулы I, например, соединения, которые включают радиоактивный изотоп, можно использовать при исследованиях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы трития, т.е. 3Н, и углерод-14, т.е. 14C, особенно подходят для этой цели из-за простоты их включения и легкости способов обнаружения.
Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2Н, может дать определенные терапевтические преимущества в результате большей метаболической стабильности, например, увеличенного периода полураспада in vivo или снижение требуемых дозировок, и, следовательно, может быть предпочтительным в некоторых обстоятельствах.
Замещение позитрон-излучающими изотопами, такими как 11C, 18F, 15O и 13N, может быть полезным для позитронно-эмиссионной томографии (PET) для исследования заполнения рецептора субстратом.
Изотопно-меченные соединения формулы (I) обычно могут быть получены традиционными методами, известными специалистам в данной области, или способами, аналогичными описанным в прилагаемых примерах и способах получения, с использованием подходящего изотопно-меченного реагента вместо применявшегося ранее немеченного реагента.
Настоящее изобретение также относится к композициям (например, фармацевтическим композициям), содержащим новое соединение формулы I. Соответственно, в одном варианте осуществления изобретение предлагает фармацевтическую композицию, содержащую (терапевтически эффективное количество) нового соединения формулы I или его фармацевтически приемлемой соли, и необязательно содержащую фармацевтически приемлемый носитель. В еще одном варианте осуществления изобретение предлагает фармацевтическую композицию, содержащую (терапевтически эффективное количество) соединения формулы I или его фармацевтически приемлемой соли, и необязательно содержащую фармацевтически приемлемый носитель, и, необязательно, по меньшей мере одно дополнительное лекарственное или фармацевтическое средство (такое как антипсихотическое средство или средство против шизофрении, описанное ниже). В одном варианте осуществления дополнительное лекарственное или фармацевтическое средство представляет собой средство против шизофрении, как описано ниже.
Фармацевтически приемлемый носитель может включать любой традиционный фармацевтический носитель или эксципиент. Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители (такие как гидраты и сольваты). Фармацевтические композиции могут, при необходимости, содержать дополнительные ингредиенты, такие как вкусоароматические вещества, связующие вещества, эксципиенты и тому подобное. Так, для перорального введения таблетки, содержащие различные эксципиенты, такие как лимонная кислота, могут использоваться вместе с различными разрыхлителями, такими как крахмал, альгиновая кислота и некоторые сложные силикаты, и со связующими веществами, такими как сахароза, желатин и аравийская камедь. Кроме того, в процессе таблетирования часто являются полезными смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также могут использоваться в мягких и твердых желатиновых капсулах. Неограничивающие примеры материалов, соответственно, включают лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии или эликсиры, активное соединение может быть объединено с различными подсластителями или корригентами, окрашивающими веществами или красителями и, при необходимости, эмульгирующими агентами или суспендирующими агентами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их сочетания.
Фармацевтическая композиция может, например, быть в форме, подходящей для перорального введения - такой как таблетка, капсула, пилюля, порошок, форма замедленного высвобождения, раствор или суспензия, для парентерального введения - такой как стерильный раствор, суспензия или эмульсия, для местного введения - такой как мазь или крем, или для ректального введения - такой как суппозиторий.
Примеры форм для парентерального ведения включают растворы или суспензии активных соединений в стерильных водных растворах, например, водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы при необходимости могут быть соответствующим образом забуферены.
Фармацевтическая композиция может быть в дозированных лекарственных формах, подходящих для однократного введения точных дозировок. Для специалиста очевидно, что композиция может быть составлена в субтерапевтической дозировке, так что предполагается множество доз.
В одном варианте осуществления композиция содержит терапевтически эффективное количество соединения формулы I или его соли и фармацевтически приемлемый носитель.
Соединения формулы I (включая их соли) являются ингибиторами MAGL. В некоторых вариантах осуществления ЕС50 соединения формулы I (или его метаболита) составляет менее чем примерно 10 мкМ, 5 мкМ, 2 мкМ, 1 мкМ, 500 нМ, 200 нМ, 100 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 5 нМ, 2 нМ или 1 нМ, как определено способом в примере AA, описанном ниже.
Введение соединений формулы I (в том числе их солей) может быть осуществлено любым способом, который делает возможной доставку соединений к месту действия. Эти методы включают, например, парентеральные пути (например пероральные пути, буккальные пути, сублабиальные пути, сублингвальные пути), пероральные пути, интраназальные пути, ингаляционные пути, интрадуоденальные пути, парентеральную инъекцию (включая внутривенную, подкожную, внутримышечную, внутрисосудистую инъекцию или инфузию), интратекальные пути, эпидуральные пути, интрацеребральные пути, интрацеребровентрикулярные пути, местное и ректальное введение.
В одном варианте осуществления настоящего изобретения соединения формулы I могут быть введены/задействованы путем парентеральных инъекций (например, путем внутривенной инъекции).
В одном варианте осуществления настоящего изобретения соединения формулы I могут быть введены/задействованы пероральными путями.
Режимы дозирования могут быть скорректированы для обеспечения оптимального желаемого ответа. Например, препарат можно вводить в виде одной разовой дозы, можно вводить в виде нескольких разделенных доз в течение времени, или дозу можно пропорционально снизить или увеличить в соответствии с требованиями терапевтической ситуации. Может быть удобно готовить парентеральные композиции в единичной дозированной форме для простоты введения и единообразия дозировок. Используемый в настоящем описании термин «единичная дозированная форма» относится к физически дискретным единицам, подходящим для использования в качестве единичных доз для субъектов-млекопитающих, подвергаемых лечению; каждую единичную форму, содержащую заранее определенное количество активного соединения, рассчитывают для обеспечения желаемого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем. Спецификации для единичных дозированных форм по изобретению диктуются разнообразием факторов, таких как уникальные характеристики терапевтического агента и конкретный терапевтический или профилактический эффект, который должен быть достигнут. В одном варианте осуществления настоящего изобретения соединения формулы I могут быть использованы для лечения людей.
Следует иметь в виду, что величины дозировок могут варьировать в зависимости от типа и тяжести состояния, которое должно быть облегчено, и могут включать одну или несколько доз. Также должно быть понятно, что для каждого конкретного субъекта конкретные схемы введения следует корректировать с течением времени, исходя из потребности индивидуума и с учетом профессионального мнения лица, проводящего введение или наблюдение за введением композиций, и что диапазон доз приводится в настоящем описании только в качестве примера и не предназначен для ограничения объема или практики применения заявленной композиции. Например, дозы могут быть скорректированы на основании фармакокинетических или фармакодинамических параметров, которые могут включать клинические эффекты, такие как токсические эффекты и/или лабораторные показатели. Таким образом, настоящее изобретение охватывает увеличение дозы для одного пациента, определяемое специалистом в данной области. Определение соответствующих дозировок и режимов введения химиотерапевтического агента хорошо известно в соответствующей области и должно быть понятно специалисту в данной области после знакомства с информацией, раскрытой в данном описании.
Вводимое количество соединения формулы I будет зависеть от подлежащего лечению субъекта, тяжести нарушения или состояния, скорости введения, распределения соединения и усмотрения лечащего врача. Как правило, эффективная дозировка находится в диапазоне от примерно 0,0001 до примерно 50 мг на кг массы тела в сутки, например, от примерно 0,01 до примерно 10 мг/кг/сут, в однократной или разделенных дозах. Для человека массой 70 кг это будет количество от примерно 0,007 мг до примерно 3500 мг/сут, например, от примерно 0,7 мг до примерно 700 мг/сут. В некоторых обстоятельствах уровни дозирования ниже нижнего предела вышеуказанного диапазона могут быть более чем адекватными, тогда как в других случаях могут применяться еще большие дозы, не вызывая никакого вредного побочного эффекта, при условии, что такие большие дозы сначала делят на несколько маленьких доз для введения на протяжении суток.
Используемый в настоящем описании термин «комбинированная терапия» относится к введению соединения формулы I или его фармацевтически приемлемой соли вместе с по меньшей мере одним дополнительным фармацевтическим или лекарственным средством (например средством против шизофрении), либо последовательно, либо одновременно.
Настоящее изобретение включает применение комбинации соединения формулы I (включая его соль) и одного или более дополнительных фармацевтически активных агентов. Если вводят комбинацию активных веществ, то их можно вводить последовательно или одновременно, в отдельных лекарственных формах или комбинировать в виде одной лекарственной формы. Соответственно, настоящее изобретение также включает фармацевтические композиции, содержащие некоторое количество: (а) первого агента, содержащего соединение формулы I (включая его фармацевтически приемлемую соль); (b) второго фармацевтически активного агента; и (c) фармацевтически приемлемого носителя, наполнителя или разбавителя.
Различные фармацевтически активные агенты могут быть выбраны для применения в сочетании с соединениями формулы I, в зависимости от подлежащего лечению заболевания, нарушения или состояния. Фармацевтически активные агенты, которые могут быть использованы в сочетании с композициями настоящего изобретения, включают, без ограничения:
(i) ингибиторы ацетилхолинэстеразы, такие как донепезила гидрохлорид (ARICEPT, MEMAC); или антагонисты аденозинового А2А рецептора, такие как преладенант (SCH 420814) или SCH 412348;
(ii) амилоид-β (или его фрагменты), такой как Aβ1-15, конъюгированный с pan HLA DR-связывающим эпитопом (PADRE) и АСС-001 (Elan/Wyeth);
(iii) антитела к амилоиду-β (или его фрагментам), такие как бапинейзумаб (также известный как ААВ-001) и ААВ-002 (Wyeth/Elan);
(iv) агенты, понижающие уровень или ингибирующие амилоид (включая те, которые снижают продуцирование амилоида, его накопление и фибриллизацию), такие как колостринин и биснорцимсерин (также известный как BNC);
(v) агонисты альфа-адренергических рецепторов, такие как клонидин (CATAPRES);
(vi) агенты, блокирующие бета-адренергические рецепторы (бета-блокаторы), такие как картеолол;
(vii) антихолинэргические агенты, такие как амитриптилин (ELAVIL, ENDEP);
(viii) противосудорожные агенты, такие как карбамазепин (TEGRETOL, CARBATROL);
(ix) антипсихотические агенты, такие как луразидон (также известный как SM-13496; Dainippon Sumitomo);
(x) блокаторы кальциевых каналов, такие как нилвадипин (ESCOR, NIVADIL);
(xi) ингибиторы катехол-О-метилтрансферазы (СОМТ), такие как толкапон (TASMAR);
(xii) стимуляторы центральной нервной системы, такие как кофеин;
(xiii) кортикостероиды, такие как преднизон (STERAPRED, DELTASONE);
(xiv) агонисты дофаминовых рецепторов, такие как апоморфин (APOKYN);
(xv) антагонисты дофаминовых рецепторов, такие как тетрабеназин (NITOMAN, XENAZINE, дофаминовый D2 антагонист, такой как Кветиапин);
(xvi) ингибиторы обратного захвата дофамина, такие как номифензина малеат (MERITAL);
(xvii) агонисты рецепторов гамма-аминомасляной кислоты (GABA), такие как баклофен (LIORESAL, KEMSTRO);
(xviii) антагонисты гистамина 3 (H3), такие как ципроксифан;
(xix) иммуномодуляторы, такие как глатирамера ацетат (также известный как сополимер-1; COPAXONE);
(xx) иммуносупрессанты, такие как метотрексат (TREXALL, RHEUMATREX);
(xxi) интерфероны, включая интерферон бета-1а (AVONEX, REBIF) и интерферон бета-1b (BETASERON, BETAFERON);
(xxii) леводопа (или ее метиловый или этиловый сложный эфир), сама по себе или в комбинации с ингибитором DOPA декарбоксилазы (например, карбидопа (SINEMET, CARBILEV, PARCOPA));
(xxiii) антагонисты рецепторов N-метил-D-аспартата (NMDA), такие как мемантин (NAMENDA, AXURA, EBIXA);
(xxiv) ингибиторы моноаминоксидазы (МАО) такие как селегилин (EMSAM);
(xxv) агонисты мускариновых рецепторов (в частности подтипа М1 или М4), такие как бетанехола хлорид (DUVOID, URECHOLINE);
(xxvi) нейропротективные лекарственные средства, такие как оксим 2,3,4,9-тетрагидро-1H-карбазол-3-она;
(xxvii) агонисты никотиновых рецепторов, такие как эпибатидин;
(xxviii) ингибиторы обратного захвата норэпинефрина (норадреналина), такие как атомоксетин (STRATTERA);
(xxix) ингибиторы фосфодиэстеразы (PDE), например, ингибиторы PDE9, такие как BAY 73-6691 (Bayer AG), и ингибиторы PDE 10 (например, PDE10A), такие как папаверин;
(xxx) другие ингибиторы PDE, включая (а) ингибиторы PDE1 (например, винпоцетин), (b) ингибиторы PDE2 (например, эритро-9-(2-гидрокси-3-нонил)аденин (EHNA)), (с) ингибиторы PDE4 (например, ролипрам), и (d) ингибиторы PDE5 (например, силденафил (VIAGRA, REVATIO));
(xxxi) хинолины, такие как хинин (включая его соли гидрохлорид, дигидрохлорид, сульфат, бисульфат и глюконат);
(xxxii) ингибиторы β-секретазы, такие как WY-25105;
(xxxiii) ингибиторы γ-секретазы, такие как LY-411575 (Lilly);
(xxxiv) антагонисты рецепторов серотонина (5-гидрокситриптамина) 1А (5-HT1A), такие как спиперон;
(xxxv) агонисты рецепторов серотонина (5-гидрокситриптамина) 4 (5-НТ4), такие как PRX-03140 (Epix);
(xxxvi) антагонисты рецепторов серотонина (5-гидрокситриптамина) 6 (5-НТ6), такие как миансерин (TORVOL, BOLVIDON, NORVAL);
(xxxvii) ингибиторы обратного захвата серотонина (5-НТ), такие как алапроклат, циталопрам (CELEXA, CIPRAMIL);
(xxxviii) трофические факторы, такие как фактор роста нервов (NGF), основной фактор роста фибробластов (bFGF; ERSOFERMIN), нейротрофин-3 (NT-3), кардиотрофин-1, нейротрофический фактор из тканей мозга (BDNF), нейбластин, метеорин и глиальный нейротрофический фактор (GDNF), и агенты, которые стимулируют продуцирование трофических факторов, такие как пропентофиллин;
(xxxix) антигеморрагические (т.е. гемостатические) агенты, такие как ривароксабан или апиксабан;
и тому подобное.
Соединение формулы I (включая его соль) можно использовать в комбинации с другим активным агентом. Такой активный агент может представлять собой, например, атипический антипсихотический агент, или агент против болезни Паркинсона, или агент против болезни Альцгеймера. Соответственно, в другом варианте осуществления изобретения предложены способы лечения опосредованного MAGL заболевания или нарушения у млекопитающего, включающие введение млекопитающему эффективного количества соединения формулы I (включая его фармацевтически приемлемую соль) и дополнительно включающие введение другого активного агента.
Используемый в настоящем описании термин «другой активный агент» относится к любому терапевтическому агенту, отличному от соединения формулы I (включая его фармацевтически приемлемую соль), который полезен для лечения нарушения у субъекта. Примеры дополнительных терапевтических агентов включают антидепрессанты, антипсихотические агенты (такие как агенты против шизофрении), обезболивающие агенты, агенты против болезни Паркинсона, агенты против LID (дискинезии, вызванной леводопой), агенты против болезни Альцгеймера, противотревожные и кровоостанавливающие агенты. Примеры конкретных классов антидепрессантов, которые могут быть использованы в комбинации с соединениями по изобретению, включают ингибиторы обратного захвата норэпинефрина, селективные ингибиторы обратного захвата серотонина (SSRI), антагонисты рецепторов NK-1, ингибиторы моноаминоксидазы (MAOI), обратимые ингибиторы моноаминоксидазы (RIMA), ингибиторы обратного захвата серотонина и норадреналина (SNRI), антагонисты фактора высвобождения кортикотропина (CRF), антагонисты α-адренорецепторов и атипичные антидепрессанты. Подходящие ингибиторы обратного захвата норэпинефрина включает третичные аминные трициклики и вторичные аминные трициклики. Примеры подходящих третичных аминных трицикликов и вторичных аминных трицикликов включают амитриптилин, кломипрамин, доксепин, имипрамин, тримипрамин, дотиепин, бутриптилин, иприндол, лофепрамин, нортриптилин, протриптилин, амоксапин, дезипрамин и мапротилин. Примеры подходящих селективных ингибиторов обратного захвата серотонина включают флуоксетин, флувоксамин, пароксетин и сертралин. Примеры ингибиторов моноаминоксидазы включают изокарбоксазид, фенелзин и транилциклопрамин. Примеры подходящих обратимых ингибиторов моноаминоксидазы включают моклобемид. Примеры подходящих ингибиторов обратного захвата серотонина и норадреналина для применения в настоящем изобретении включают венлафаксин. Примеры подходящих атипичных антидепрессантов включают бупропион, литий, нефазодон, тразодон и вилоксазин. Примеры агентов против болезни Альцгеймера включают димебон, антагонисты NMDA рецепторов, такие как мемантин; и ингибиторы холинэстеразы, такие как донепезил и галантамин. Примеры подходящих классов противотревожных агентов, которые могут быть использованы в комбинации с соединениями по изобретению, включают бензодиазепины и агонисты или антагонисты серотонина 1А (5-НТ1А), особенно 5-НТ1А частичные агонисты, и антагонисты кортикотропин-высвобождающего фактора (CRF). Подходящие бензодиазепины включают алпразолам, хлордиазэпоксид, клоназепам, хлоразепат, диазепам, галазепам, лоразепам, оксазепам и празепам. Подходящие агонисты или антагонисты 5-НТ1А рецепторов включают буспирон, флесиноксан, гепирон и ипсапирон. Подходящие атипичные антипсихотические агенты включают палиперидон, бифепрунокс, зипразидон, рисперидон, арипипразол, оланзапин и кветиапин. Подходящие агонисты никотина-ацетилхолина включают испрониклин, варенициклин и MEM 3454. Обезболивающие агенты включают прегабалин, габапентин, клонидин, неостигмин, баклофен, мидазолам, кетамин и зиконотид. Примеры подходящих агентов против болезни Паркинсона включают L-DOPA (или ее метиловый или этиловый сложный эфир), ингибитор DOPA-декарбоксилазы (например, карбидопа (SINEMET, CARBILEV, PARCOPA), антагонист аденозинового A2A рецептора [например, преладенант (SCH 420814) или SCH 412348], бенсеразид (MADOPAR), α-метилдопа, монофторметилдопа, дифторметилдопа, брокрезин или м-гидроксибензилгидразин), агонист дофамина [такой как апоморфин (APOKYN), бромокриптин (PARLODEL), каберголин (DOSTINEX), дигидрексидин, дигидроэргокриптин, фенолдопам (CORLOPAM), лизурид (DOPERGIN), перголид (PERMAX), пирибедил (TRIVASTAL, TRASTAL), прамипексол (MIRAPEX), квинпирол, ропинирол (REQUIP), ротиготин (NEUPRO), SKF-82958 (GlaxoSmithKline) и саризотан], ингибитор моноаминоксидазы (МАО) [такой как селегилин (EMSAM), селегилина гидрохлорид (L-депренил, ELDEPRYL, ZELAPAR), диметилселегилин, брофаромин, фенелзин (NARDIL), транилципромин (PARNATE), моклобемид (AURORIX, MANERIX), бефлоксатон, сафинамид, изокарбоксазид (MARPLAN), ниаламид (NIAMID), разагилин (AZILECT), ипрониазид (MARSILID, IPROZID, IPRONID), CHF-3381 (Chiesi Farmaceutici), ипроклозид, толоксатон (HUMORYL, PERENUM), бифемелан, дезоксипеганин, гармин (также известный как телепатин или банастерин), гармалин, линезолид (ZYVOX, ZYVOXID) и паргилин (EUDATIN, SUPIRDYL)], ингибитор катехол-О-метилтрансферазы (СОМТ) [такой как толкапон (TASMAR), энтакапон (COMTAN) и трополон], антагонист рецептора N-метил-D-аспартата (NMDA) [такой как амантадин (SYMMETREL)], антихолинэргические агенты [такие как амитриптилин (ELAVIL, ENDEP), бутриптилин, бензтропина мезилат (COGENTIN), тригексифенидил (ARTANE), дифенгидрамин (BENADRYL), орфенадрин (NORFLEX), гиосциамин, атропин (ATROPEN), скополамин (TRANSDERM-SCOP), скополамина метилбромид (PARMINE), дицикловерин (BENTYL, BYCLOMINE, DIBENT, DILOMINE, толтеродин (DETROL), оксибутинин (DITROPAN, LYRINEL XL, OKCMTROL), пентиената бромид, пропантелин (PRO-BANTHINE), циклизин, имипрамина гидрохлорид (TOFRANIL), имипрамина малеат (SURMONTIL), лофепрамин, дезипрамин (NORPRAMIN), доксепин (SINEQUAN, ZONALON), тримипрамин (SURMONTIL) и гликопирролат (ROBINUL)] или их комбинацию. Примеры агентов против шизофрении включают зипразидон, рисперидон, оланзапин, кветиапин, арипипразол, азенапин, блонансерин или илоперидон. Некоторые примеры ряда дополнительных «других активных агентов» включают ривастигмин (Exelon), клозапин, леводопа, ротиготин, арицепт, метилфенидат, мемантин, милнаципран, гуанфацин, бупропион и атомоксетин. Примеры кровоостанавливающих агентов (включая, например, факторы свертывания крови, активаторы или стабилизаторы) включают ингибиторы фактора Ха (например, ривароксабан или апиксабан) и рекомбинантный фактор свертывания крови VIIa (например, NovoSeven®).
Как указано выше, соединения формулы I или их соли могут быть использованы в комбинации с описанными здесь одним или более дополнительными агентами против болезни Альцгеймера. При использовании комбинационной терапии один или более дополнительных агентов против болезни Альцгеймера могут быть введены последовательно или одновременно с соединением по изобретению. В одном варианте осуществления дополнительный агент (агенты) против болезни Альцгеймера вводят млекопитающему (например, человеку) перед введением соединения по изобретению. В другом варианте осуществления дополнительный агент (агенты) против болезни Альцгеймера вводят млекопитающему после введения соединения по изобретению. В другом варианте осуществления дополнительный агент (агенты) против болезни Альцгеймера вводят млекопитающему (например, человеку) одновременно с введением соединения по изобретению (или его фармацевтически приемлемой соли).
Изобретение также предлагает фармацевтическую композицию для лечения воспалительного нарушения (например, нейровоспаления) у млекопитающего, включая человека, которая включает количество соединения формулы I (включая его соль), как определено выше (включая гидраты, сольваты и полиморфы указанного соединения или его фармацевтически приемлемых солей), в сочетании с одним или несколькими (например, от одного до трех) противовоспалительными агентами, при этом количества активного агента и сочетания, взятые в целом, являются терапевтически эффективными для лечения воспалительного нарушения.
Изобретение также предлагает фармацевтическую композицию для лечения опосредованного MAGL заболевания или нарушения у млекопитающего, включая человека, которая включает количество соединения формулы I (включая его соль), как определено выше (включая гидраты, сольваты и полиморфы указанного соединения или его соли), в сочетании с одним или несколькими (например, от одного до трех) других агентов для лечения опосредованного MAGL заболевания или нарушения, при этом количества активных агентов и сочетания, взятые в целом, являются терапевтически эффективными для лечения опосредованного MAGL заболевания или нарушения.
Следует понимать, что соединения формулы I, раскрытые выше, не ограничены конкретным показанным стереоизомером (например, энантиомером или диастереомером), но также включают все стереоизомеры и их смеси.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения по изобретению, включая соли соединений, могут быть получены с помощью известных методов органического синтеза и могут быть синтезированы в соответствии с любым из многочисленных возможных путей синтеза. Реакции для получения соединений по изобретению могут быть осуществлены в подходящих растворителях, которые могут легко быть выбраны специалистом в области органического синтеза. Подходящие растворители могут по существу не взаимодействовать с исходными материалами (реагентами), промежуточными соединениями или продуктами при температурах, при которых проводятся взаимодействия, например, при температурах, которые могут варьировать от температуры замерзания растворителя до температуры кипения растворителя. Данные взаимодействия могут быть осуществлены в одном растворителе или в смеси более чем одного растворителя. В зависимости от конкретной стадии реакции специалистом могут быть выбраны подходящие растворители для конкретной стадии реакции.
Получение соединений по изобретению может включать в себя введение и снятие защиты с различных химических групп. Необходимость введения и снятия защиты и выбор соответствующих защитных групп могут быть легко определены специалистом в данной области. С химией защитных групп можно познакомиться, например, в документе T. W. Greene, P. G. M. Wuts, «Protective Groups in Organic Synthesis», 3rd Ed., Wiley & Sons, Inc., New York (1999), который включен в данное описание посредством ссылки во всей полноте.
Реакции можно отслеживать любым подходящим способом, известным в данной области. Например, за образованием продукта можно следить посредством спектроскопии, такой как ядерная магнитно-резонансная спектроскопия (например, 1Н или 13С), инфракрасная спектроскопия, спектрофотометрия (например, в УФ и видимой областях спектра), масс-спектрометрия, или с помощью хроматографических способов, таких как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография (ТСХ).
Соединения формулы I, соли и их промежуточные соединения могут быть получены в соответствии со следующими схемами реакций и сопровождающим описанием. Если не указано иное, R1, R2, R2A, RS,R3, R4, R5, кольцо А1, n1 и структурная формула I (включая, например, I-1, I-2, I-3) в схемах реакции и последующем описании являются такими, как определено выше. В целом, соединения по данному изобретению могут быть получены способами, которые включают способы, аналогичные способам, известным специалистам в области химии, особенно в свете содержащегося здесь их описания. Некоторые способы получения соединений по данному изобретению и их промежуточных соединений представлены в качестве дополнительных отличительных признаков изобретения и иллюстрируются следующими схемами реакций. Другие способы раскрыты в экспериментальной части. Представленные здесь схемы и примеры (включая соответствующе описание) приводятся только в иллюстративных целях и не предназначены для ограничения объема настоящего изобретения.
Схема 1 относится к синтезу соединений формулы I. Соединение формулы 1-3 [в котором Pg1 представляет собой спиртовую защитную группу, такую как п-метоксибензил (PMB) или трет-бутилдиметилсилил (TBDMS)], может быть получено реакцией амина формулы 1-1 с соединением формулы 1-2 с помощью стандартных способов образования карбамата, хорошо известных специалистам в данной области [например, в присутствии фосгена, трифосгена или подходящего активированного карбонатного реагента, такого как бис(пентафторфенил)карбонат или N, N'-дисукцинимидилкарбонат]. Образование карбамата может быть осуществлено в присутствии основания (такого как триэтиламин или основание Хунига). В качестве альтернативы, соединение формулы 1-3 может быть получено путем взаимодействия амина формулы 1-1 с соединением формулы 1-2a [где Lg1 представляет собой уходящую группу, такую как пентафторфенокси] в присутствии основания, такого как триметиламин, в подходящем апротонном растворителе, таком как ацетонитрил. Амины формулы 1-1 могут быть получены коммерческим путем, синтезированы описанными здесь способами или получены другими способами, хорошо известными специалистам в данной области. Соединение формулы 1-4 может быть получено снятием защиты соединений формулы 1-3, используя соответствующие условия в зависимости от выбора группы Pg1. Например, когда Pg1 представляет собой PMB или TBDMS, может применяться обработка кислотой, такой как трифторуксусная кислота, в апротонном растворителе, таком как дихлорметан. Соединение формулы 1-4 (которое представляет собой соединение формулы I, где R1 представляет Н) необязательно может быть превращено в соединение формулы I, где R1 является отличным от H. Например, реакция спирта формулы 1-4 с дифосфорилтетрахлоридом в подходящем растворителе, таком как ацетонитрил, дает соединения формулы I, где R1 представляет собой -P(=O)(OH)2, или их соль. В качестве другого примера, реакция спирта формулы 1-4 с сульфатирующим агентом [например, SO3, сульфаминовой кислотой H2N-S(=O)2(OH), хлорсульфоновой кислотой HO-S(=O)2(Cl)] в подходящих условиях позволяет получить соединение формулы I, где R1 представляет собой -S(=O)2(OH), или его соль.
Схема 1
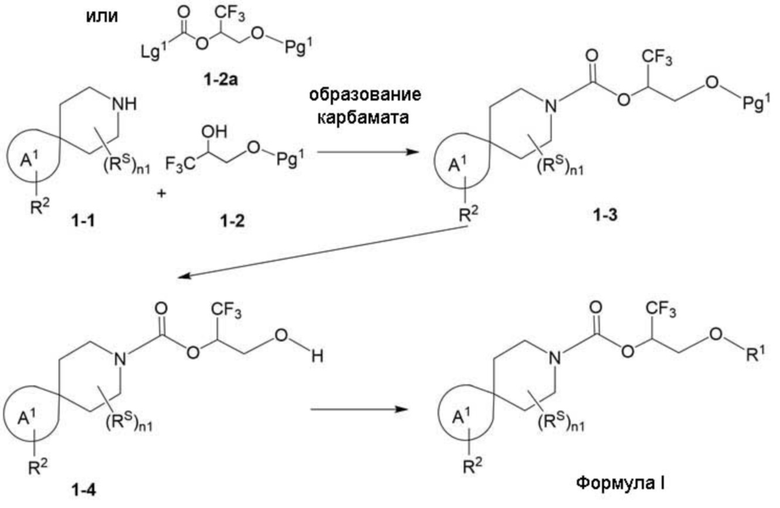
Схема 2 относится к синтезу соединения формулы 2-3 [в котором Pg1 представляет собой спиртовую защитную группу, такую как п-метоксибензил] и/или соединения формулы 2-4 [в котором Lg1 представляет собой уходящую группу, такую как пентафторфенокси]. Согласно схеме 2, реакция эпоксида формулы 2-1 со спиртом формулы 2-2 в присутствии основания (например, гидроксида натрия) в непротонном растворителе (например, THF или DMF) дает соединение формулы 2-3, которое может быть использовано в качестве соединения формулы 1-2 на схеме 1. Соединение формулы 2-3 можно затем превратить в соединение формулы 2-4, в котором Lg1 представляет собой уходящую группу. Например, когда Lg1 является пентафторфенокси, реакция соединения формулы 2-3 с таким соединением, как бис(пентафторфенил)карбонат, в присутствии основания, такого как триметиламин, дает соединение формулы 2-4. Соединение формулы 2-4 можно использовать в качестве соединения формулы 1-2a в схеме 1.
Схема 2
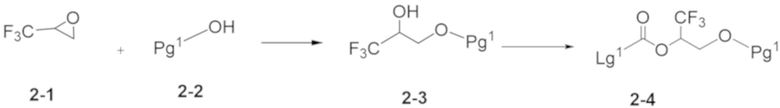
Схема 3 относится к синтезу соединения формулы 3-5 [где R2A представляет собой, например, R5, такой как 1H-пиразолил или 5- или 6-членный гетероарил (например, пиридинил), который замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси]. Как показано на схеме 3, амин формулы 3-1 может образовывать карбамат с соединением формулы 3-2 (которое может быть таким же, как соединение формулы 2-4) в присутствии основания (например, триметиламина) и подходящего растворителя, с получением бромидного промежуточного соединения формулы 3-3. Бромидное промежуточное соединение формулы 3-3 может подвергаться дальнейшим превращениям с образованием бромидного соединения формулы 3-4. Например, обработка бромидного промежуточного соединения формулы 3-3 соединением 1H-пиразола (который не замещен в 1-положении, но необязательно замещен в 3-, 4- и/или 5-положении) в присутствии подходящего основания (например, Cs2CO3) в растворителе, таком как диметилформамид, при повышенной температуре (например, 80°C) позволяет получить соединение формулы 3-4, где R2A представляет собой необязательно замещенный 1H-пиразол-1-ил. В качестве другого примера, соединение формулы 3-4 (где R2A представляет собой R5, такой как необязательно замещенный 5- или 6-членный гетероарил) может быть получено сочетанием арил- или гетероарилгалогенида (R5-X1, где Х1 представляет собой галоген, такой как Cl или Br), с бромидным промежуточным соединением формулы 3-3, с использованием каталитической системы, такие как хлорид никеля (II), 1,2-диметоксиэтан, фенантролин, тетрафторборат натрия и порошкообразный марганец, в растворителе, таком как этилпиридин, в инертной атмосфере при 60°С.
В качестве альтернативы, соединение формулы 3-4 может быть получено сочетанием арил- или гетероарилгалогенида с боронатным соединением, таким как боронатное соединение формулы 3-6 (которое может быть получено стандартными способами, известными специалистам в данной области) с получением алкена формулы 3-7, с последующим восстановлением алкена формулы 3-7 с получением соединения формулы 3-4. Некоторые примеры условий сочетания включают катализатор, такой как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II), с основанием, таким как фторид цезия, в растворителе, таком как 1,4-диоксан, в присутствии воды. Восстановление алкеновой группы соединения формулы 3-7 может быть осуществлено гидрированием, например, H2 в присутствии металлического катализатора, такого как палладий на угле, в растворителе, таком как этилацетат, с получением соединения формулы 3-4.
С соединения формулы 3-4 можно снять защиту, чтобы получить соединение формулы 3-5 в подходящих условиях в зависимости от выбора Pg1. Например, когда Pg1 представляет собой п-метоксибензил, снятие защиты может быть осуществлено обработкой кислотой, такой как трифторуксусная кислота; в качестве альтернативы, путем гидрогенолиза соединения формулы 3-4 с помощью Н2 при повышенном давлении и с использованием катализатора, такого как палладий на угле.
Схема 3
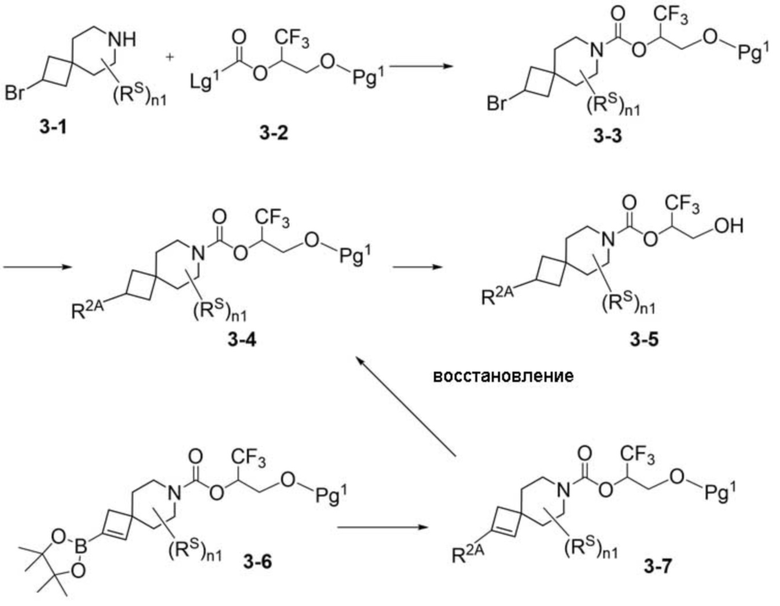
Схема 4 относится к получению амина формулы 4-5, который можно использовать в качестве соединения формулы 1-1 в схеме 1. Соединение формулы 4-1 (где Pg2 представляет собой защитную группу, такую как ВОС) может быть превращено в соединение формулы 4-2 [где Lg2 является уходящей группой, такой как тозилат], обработкой реагентом, таким как тозилхлорид, в присутствии катализатора, такого как диметиламинопиридин, в подходящем растворителе (например, дихлорметане). Соединение формулы 4-2 может быть превращено в соединение формулы 4-4 взаимодействием с 1Н-пиразольным соединением формулы 4-3 (которое не замещено в 1-положении, но необязательно замещено в 3-, 4- и/или 5-положении; где t1 равно 0, 1, 2 или 3; и каждый R30 независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси) в присутствии основания, такого как карбонат цезия, в апротонном растворителе (например, DMF). Снятие защиты с соединения формулы 4-4 затем дает аминное соединение формулы 4-5 в зависимости от выбора защитной группы Pg2. Например, когда Pg2 представляет собой BOC, снятие защиты может быть достигнуто обработкой трифторуксусной кислотой.
Схема 4
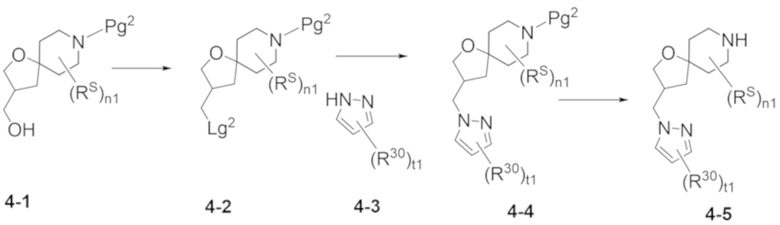
Схема 5 относится к синтезу защищенного аминного промежуточного соединения 5-8, которое может быть использовано в качестве соединения формулы 6-1 в Схеме 6. Соединение формулы 5-1 [в котором Pg3 представляет собой аминозащитную группу, такую как ВОС] может быть превращено в соединение формулы 5-2 в соответствующих условиях в зависимости от природы другой выбранной аминозащитной группы Pg4. Pg4 представляет собой другую аминозащитную группу, которая может быть удалена ортогонально к Pg3. Например, Pg4 представляет собой Alloc, когда Pg3 является BOC. Алкилирование соединения формулы 5-2 алкилгалогенидом 5-3 (где R40 представляет собой C1-4 алкил, такой как метил; и X2 представляет собой Cl, Br или I), например, MeI, в присутствии основания, такого как гидрид натрия, в апротонном растворителе, таком как DMF, дает соединение формулы 5-4. Pg3 может быть удалена при соответствующих условиях, например, с использованием реагента, такого как трифторуксусная кислота [когда Pg3 представляет собой BOC], с получением соединения формулы 5-5. Образование карбамата может быть осуществлено путем взаимодействия соединения формулы 5-5 с соединением формулы 5-6 (таким же, как соединение формулы 2-4) в присутствии основания, такого как триметиламин, в растворителе, таком как ацетонитрил, с получением соединения формулы 5-7. В зависимости от выбора защитной группы Pg4, Pg4 может быть удален при соответствующих условиях без воздействия на Pg1. Например, когда Pg4 представляет собой Alloc (и Pg1 является PMB), соединение формулы 5-7 может быть обработано тетракис(трифенилфосфин)палладием(0) в присутствии 1,3-диметилпиримидин-2,4,6(1H,3H,5H)-триона, в растворителе, таком как THF, с получением соединения формулы 5-8.
Схема 5
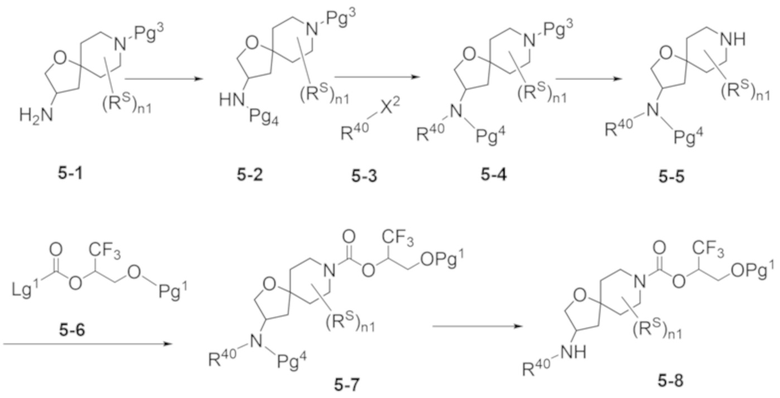
Как показано на схеме 6, предложен способ получения соединения формулы 6-6 или 6-7 (в котором каждый из R41 и R42 может обозначать, например, алкил, циклоалкил, арил, гетероарил, циклоалкилалкил, арилалкил или гетероарилалкил). Сульфонилирование соединения формулы 6-1 с реагентом формулы 6-2 (где Lg3 представляет собой уходящую группу, такую как хлорид) в присутствии основания, такого как основание Хунига, дает сульфонамид формулы 6-3. Снятие защиты Pg1 с использованием способа, подходящего для защитной группы, дает соединение формулы 6-7. Аналогичным образом, сочетание соединения формулы 6-1 с соединением формулы 6-4 [где Lg4 представляет собой OH или уходящую группу, такую как хлорид], например, где Lg4 представляет собой OH, с использованием стандартного реагента сочетания, такого как HATU, в присутствии органического основания (например, диизопропилэтиламина) дает амид формулы 6-5. Альтернативным способом получения соединения формулы 6-5 является ацилирование ацилхлоридом, таким как соединение формулы 6-4, где Lg4 представляет собой галогенид, такой как хлорид. Удаление защитной группы Pg1 из соединения формулы 6-5 в соответствующих условиях, известных специалистам в данной области, дает соединение формулы 6-6.
Схема 6
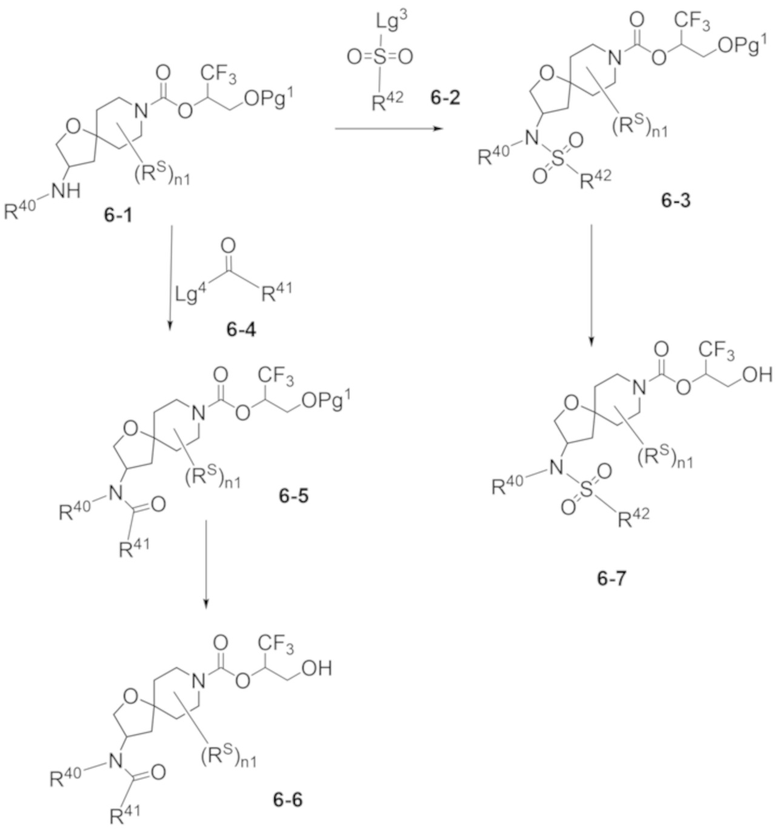
Схема 7 относится к способу получения амина формулы 7-4, который можно использовать в качестве соединения формулы 1-1 в схеме 1. Обработка соединения формулы 7-1 [в котором Pg5 представляет собой аминозащитную группу, такую как ВОС; Y1 представляет собой уходящую группу, такую как Br, мезилат или тозилат; и m равно 1 или 2] 1H-пиразольным соединением формулы 7-2 (которое не замещено в 1-положении, но необязательно замещено в 3-, 4- и/или 5-положении; где t1 равно 0, 1, 2 или 3; и каждый R30 независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси) в присутствии основания, такого как карбонат цезия, в растворителе, таком как DMF, при подходящей температуре (например, 80°C) дает соединение формулы 7-3. Защитная группа Pg5 может быть удалена с использованием стандартных условий с получением амина формулы 7-4.
Схема 7
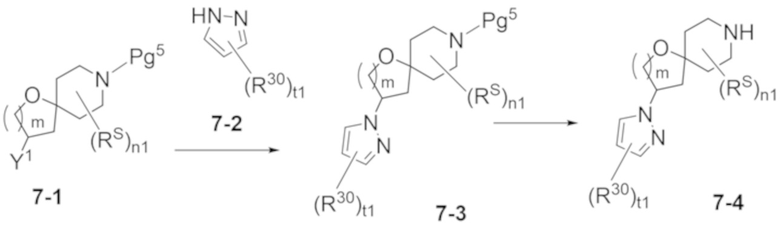
Схема 8 относится к синтезу соединения формулы 8-6. Карбамат формулы 8-3 можно получить взаимодействием соединения формулы 8-1 с соединением формулы 8-2 [таким же, как соединение формулы 2-4, например, где Lg1 представляет собой пентафторфенокси] в присутствии основания, такого как триметиламин. Сочетание бороновой кислоты формулы 8-4 [где R47 может быть, например, необязательно замещенным арилом или гетероарилом] с бромидом формулы 8-3 с получением соединения формулы 8-5 может быть осуществлено с использованием катализатора, такого как йодид никеля, и сильного основания, такого как бис(триметилсилил)амид натрия, в присутствии лиганда, такого как транс-2-аминоциклогексанол. Реакцию можно проводить в протонном растворителе, таком как 2-пропанол, при повышенной температуре (например, примерно 60°С). Защитная группа Pg1 соединения формулы 8-5 может быть удалена с образованием соединения формулы 8-6 в соответствующих условиях, например, когда Pg1 представляет собой PMB, с помощью обработки органической кислотой, такой как трифторуксусная кислота.
Схема 8
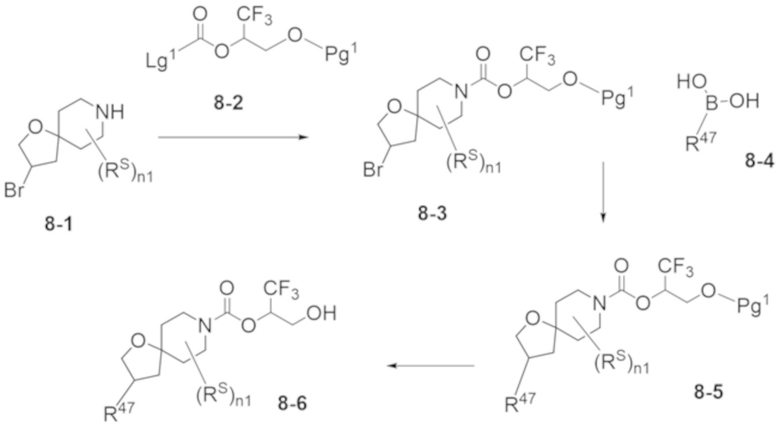
Схема 9 относится к получению соединения формулы 9-7. Соединение формулы 9-2, в котором -O-Z1 представляет собой уходящую группу, такую как трифлатная группа (т.е. Z1 представляет собой -SO2CF3), можно синтезировать с помощью обработки кетона формулы 9-1 [где Pg4 представляет собой аминозащитную группу, такую как BOC; и m равно 1 или 2] сильным основанием, таким как бис(триметилсилил)амид калия и трифлатирующим реагентом, таким как 1,1,1-трифтор-N-фенил-N-[(трифторметил)сульфонил]метансульфонамид. Реакцию можно проводить в апротонном растворителе, таком как THF, при подходящей температуре (например, примерно -70°С). Трифлат, такой как в формуле 9-2, может быть превращен в бороновый сложный эфир, такой как в соединении формулы 9-3, путем сочетания с 4,4,4',4',5,5,5',5'-октaметил-2,2'-би-1,3,2-диоксабороланом посредством катализируемого палладием сочетания с подходящей каталитической системой. Некоторые примеры условий включают обработку катализатором [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия(II) и 1,1'-бис(дифенилфосфино)ферроценовым лигандом в растворителе, таком как 1,4-диоксан, при подходящей температуре (например, примерно 80°С). Бороновый сложный эфир формулы 9-3 может быть подвергнут сочетанию с арил- или гетероарилбромидом формулы 9-4 [где R47 может быть, например, необязательно замещенным арилом или гетероарилом; и X3 является галогеном, таким как Br или Cl], используя стандартные условия сочетания при катализе палладием, с получением соединения формулы 9-5. Некоторые примеры условий сочетания включают катализатор, такой как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), с основанием, таким как фторид цезия, в растворителе, таком как 1,4-диоксан, в присутствии воды. Восстановление алкеновой группы соединения формулы 9-5 может быть осуществлено гидрированием, например, при 1-6 атм (0,1-0,6 МПа) H2 в присутствии металлического катализатора, такого как палладий на угле или никель Ренея, в протонном растворителе, таком как MeOH или EtOH, с получением соединения формулы 9-6. Снятие защиты соединения формулы 9-6 может быть осуществлено стандартными способами в зависимости от защитной группы. Соединение формулы 9-7 можно использовать в качестве соединения формулы 1-1 в схеме 1.
Схема 9
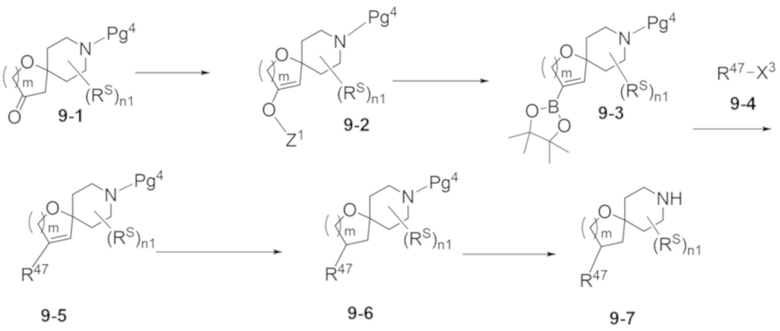
Схема 10 относится к получению амина формулы 10-8, который можно использовать в качестве амина формулы 1-1 в схеме 1. Соединение формулы 10-4 [в котором Pg5 представляет собой аминозащитную группу, такую как Cbz, и Pg6 представляет собой ортогонально удаляемую аминозащитную группу, такую как BOC] может быть получено путем алкилирования соединения формулы 10-2 алкилгалогенидом формулы 10-3 [где X4 представляет собой галоген, такой как Cl, Br или I], таким как метилиодид, в присутствии основания, такого как гидрид натрия в полярном апротонном растворителе, таком как DMF. Удаление Pg6 может быть достигнуто с помощью способов, известных специалистам в данной области. Например, если Pg6 представляет собой ВОС, тогда обработка органической кислотой, такой как трифторуксусная кислота, в растворителе, таком как дихлорметан, дает амин формулы 10-5. Обработка амина формулы 10-5 реагентом, таким как сульфонилхлорид, или, в качестве альтернативы, активированным сульфонилирующим реагентом формулы 10-6 (где Lg5 является уходящей группой) дает сульфонамид формулы 10-7. Впоследствии Pg5 может быть удалена с использованием способов, хорошо известных специалистам. Например, когда Pg5 представляет собой группу Cbz, она может быть удалена гидрогенолизом.
Схема 10
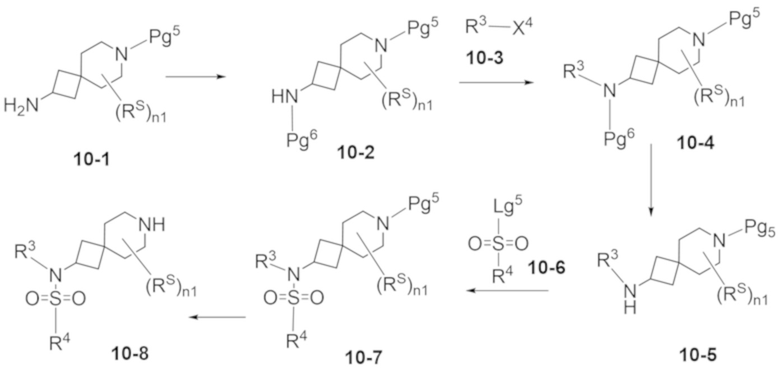
Схема 11 относится к синтезу простого гетероарилового эфира или простого арилового эфира формулы 11-4. Реакция Мицунобу арилового или гетероарилового спирта формулы 11-2 со спиртом формулы 11-1 дает соединение формулы 11-3 (где Pg7 представляет собой аминозащитную группу, например, ВОС). Пример условий Мицунобу включает обработку диизопропилазодикарбоксилатом и трифенилфосфином в апротонном растворителе, таком как THF, при комнатной температуре. Альтернативный способ получения соединения формулы 11-3 включает сочетание соединения формулы 11-1 с соединением формулы 11-2а [где X5 представляет собой уходящую группу, такую как галогенид, например хлорид или бромид], с использованием палладиевого катализатора и подходящего лиганда. Примеры условий включают использование трис(дибензилиденацетон)дипалладия(0) и лиганда Josiphos в присутствии основания, такого как карбонат цезия, в растворителе, таком как толуол, при повышенной температуре (например, 80°C). Другой дополнительный способ получения соединения формулы 11-3 включает галогенидное замещение соединения формулы 11-2а [где Х5 представляет собой, например, бромид или фторид], в присутствии основания, такого как гидрид натрия в полярном апротонном растворителе, таком как DMF.
Удаление Pg7 из соединения формулы 11-3 затем приводит к образованию соединения формулы 11-4.
Схема 11
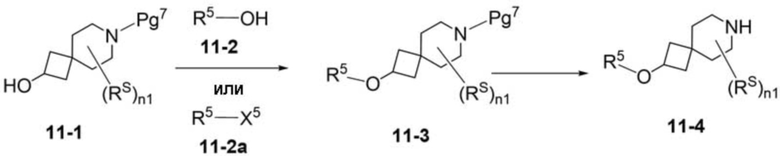
Дополнительные исходные материалы и промежуточные соединения, пригодные для получения соединений по настоящему изобретению, могут быть получены от поставщиков химических веществ, таких как Sigma-Aldrich, или могут быть получены в соответствии со способами, описанными в химической технологии.
Для специалиста в данной области будет понятно, что на всех схемах, описанных в данном документе, если имеются функциональные (реакционноспособные) группы, присутствующие на части структуры соединения, такие как защитная группа, например, R1, R2, RS, R2A, R3, R4, R5 и так далее, может быть выполнена дополнительная модификация, если необходимо и/или желательно, с использованием способов, хорошо известных специалистам в данной области. Например, группа -CN может быть подвергнута гидролизу с получением амидной группы; группа карбоновой кислоты может быть превращена в амид; группа карбоновой кислоты может быть превращена в сложный эфир, который в свою очередь может быть восстановлен до спирта, который в свою очередь может быть модифицирован далее. В качестве другого примера, группа ОН может быть превращена в более удобную уходящую группу, такую как метансульфонат, который в свою очередь является подходящим для нуклеофильного замещения, такого как посредством цианидного иона (CN-). В качестве другого примера, -S- может быть окислен до -S(=O)- и/или -S(=O)2-. В еще одном примере ненасыщенная связь, такая как С=С или C≡C, может быть восстановлена до насыщенной связи с помощью гидрирования. В еще одном примере аминогруппа может быть превращена в амидную или сульфонамидную группу. Для специалиста будут очевидны и другие такие модификации. Так, соединение формулы I, имеющее заместитель, который содержит функциональную группу, может быть превращено в другое соединение формулы I, имеющее другую группу-заместитель.
Аналогичным образом, для специалиста в данной области также понятно, что на всех схемах, описанных в данном документе, в случае, если имеются функциональные (реакционноспособные) группы, присутствующие на группах-заместителях, таких как R1, R2, R3, R4, R5 и т.д., эти функциональные группы могут быть подвергнуты введению защиты/снятию защиты в ходе реализации описанных здесь схем синтеза, если это необходимо и/или желательно. Например, ОН группа может быть защищена бензильной, метильной или ацетильной группой, а затем подвергнута снятию защиты с превращением обратно в ОН группу на более поздней стадии способа синтеза. В качестве еще одного примера, группа NH2 может быть защищена бензилоксикарбонильной (Cbz) или BOC группой; превращение снова в группу NH2 может быть осуществлено на более поздней стадии способа синтеза посредством снятия защиты.
Используемый в настоящем описании термин «взаимодействие» (или «реакция» или «подвергнутый взаимодействию») относится к приведению в контакт указанных химических реагентов, благодаря которому имеет место химическое превращение с образованием соединения, отличного от любого соединения, изначально введенного в систему. Реакции могут происходить в присутствии или в отсутствие растворителя.
Соединения формулы I могут существовать как стереоизомеры, такие как атропоизомеры, рацематы, энантиомеры или диастереомеры. Традиционные методики получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата с помощью, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ). В качестве альтернативы, рацемат (или рацемический предшественник) может быть подвергнут взаимодействию с подходящим оптически активным соединением, например, спиртом, или, в случае, когда соединение содержит кислотный или основной фрагмент, с кислотой или основанием, например, винной кислотой или 1-фенилэтиламином. Полученная диастереомерная смесь может быть разделена хроматографией и/или фракционной кристаллизацией, и один или оба диастереоизомера могут быть превращены в соответствующий чистый энантиомер (энантиомеры) с помощью методов, хорошо известных специалисту. Хиральные соединения формулы I (и их хиральные предшественники) могут быть получены в энантиомерно обогащенной форме с помощью хроматографии, обычно ВЭЖХ, на ассимметричной смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащей от 0% до 50% 2-пропанола, обычно от 2% до 20%, и от 0% до 5% алкиламина, обычно 0,1% диэтиламина. Концентрирование элюата позволяет получить обогащенную смесь. Стереоизомерные конгломераты могут быть разделены традиционными методами, известными специалистам в данной области. См., например, «Stereochemistry of Organic Compounds», E. L. Eliel, S. H. Wilen (Wiley, New York, 1994), описание которой включено в настоящий документ посредством ссылки в полном объеме. Подходящие стереоселективные методы хорошо известны специалистам в данной области.
Если соединение формулы I содержит алкенильную или алкениленовую (алкилиденовую) группу, возможны геометрические цис/транс (или Z/E) изомеры. Цис/транс изомеры могут быть разделены обычными методами, хорошо известными специалистам в данной области, например хроматографией и фракционной кристаллизацией. Соли по настоящему изобретению могут быть получены в соответствии со способами, известными специалистам в данной области.
Соединения формулы I, которые являются основными по своей природе, способны образовывать большое разнообразие солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто является желательным на практике сначала выделить соединение по настоящему изобретению из реакционной смеси в виде фармацевтически неприемлемой соли и затем просто превратить соль обратно в свободное основание путем обработки щелочным реагентом, и далее превратить это свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Кислотно-аддитивные соли основных соединений по данному изобретению могут быть получены обработкой основного соединения по существу эквивалентным количеством выбранной неорганической или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После выпаривания растворителя получают желаемую твердую соль. Желательная кислотная соль может быть также осаждена из раствора свободного основания в органическом растворителе путем добавления к раствору соответствующей неорганической или органической кислоты.
Если соединение по изобретению представляет собой основание, желаемая фармацевтически приемлемая соль может быть получена любым подходящим способом, известным в данной области, например обработкой свободного основания неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, изоникотиновая кислота, молочная кислота, пантотеновая кислота, бивинная кислота, аскорбиновая кислота, 2,5-дигидроксибензойная кислота, глюконовая кислота, сахарная кислота, муравьиная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота и памоевая [т.е. 4,4'-метандиилбис(3-гидроксинафталин-2-карбоновая)] кислота, пиранозидильная кислота, такая как глюкуроновая кислота или галактоуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как этансульфоновая кислота, или тому подобное.
Те соединения формулы I, которые являются кислотными по своей природе, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных и щелочноземельных металлов и, в частности, соли натрия и калия. Все эти соли получают обычными методами. Химическими основаниями, которые используют в качестве реагентов для получения фармацевтически приемлемых основных солей по данному изобретению, являются те основания, которые образуют нетоксичные основные соли с кислотными соединениями формулы I. Эти соли могут быть получены любым подходящим способом, например обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочноземельного металла, или тому подобным. Эти соли также могут быть получены обработкой соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые катионы, и затем выпариванием досуха полученного раствора, например, при пониженном давлении. В качестве альтернативы, они также могут быть получены смешиванием низших алканольных растворов кислых соединений и желаемого алкоксида щелочного металла и затем выпариванием полученного раствора досуха таким же образом, как и выше. В любом случае используют, например, стехиометрические количества реагентов, чтобы быть уверенными в завершении реакции и получении максимальных выходов желаемого конечного продукта.
Фармацевтически приемлемые соли соединений формулы I (включая соединения формулы I-a или I-b) можно получить, например, одним или более из трех способов:
(i) взаимодействием соединения формулы I с желаемой кислотой или основанием;
(ii) путем удаления лабильной в кислотных или щелочных условиях защитной группы из подходящего предшественника соединения формулы I или путем раскрытия кольца подходящего циклического предшественника, например, лактона или лактама, с использованием желаемой кислоты или основания; или же
(iii) путем превращения одной соли соединения формулы I в другую реакцией с подходящей кислотой или основанием или с помощью подходящей ионообменной колонки.
Все три реакции обычно проводятся в растворе. Полученная соль может выпадать в осадок и может быть собрана фильтрованием или может быть выделена выпариванием растворителя. Степень ионизации полученной соли может меняться от полностью ионизированной до почти неионизированной.
Полиморфы могут быть получены в соответствии с методиками, хорошо известными специалистам в данной области, например, путем кристаллизации.
При кристаллизации любого рацемата возможны кристаллы двух различных типов. Первый тип представляет собой указанное выше рацемическое соединение (истинный рацемат), в котором образуется одна гомогенная форма кристалла, содержащая оба энантиомера в эквимолярных количествах. Второй тип представляет собой рацемическую смесь или конгломерат, в котором две формы кристаллов образуются в эквимолярных количествах, каждая из которых содержит единственный энантиомер.
Хотя обе кристаллические формы, присутствующие в рацемической смеси, могут иметь идентичные физические свойства, они могут иметь отличающиеся физические свойства по сравнению с истинным рацематом. Рацемические смеси могут быть разделены традиционными методами, известными специалистам в данной области - см., например, E. L. Eliel, S. H. Wilen, «Stereochemistry of Organic Compounds», (Wiley, New York, 1994).
Изобретение также включает изотопно-меченные соединения формулы I, в которых один или более атомов замещены атомом, имеющим тот же самый атомный номер, но атомную массу или массовое число, отличное от атомной массы или массового числа, обычно обнаруживаемого в природе. Изотопно-меченные соединения формулы I (или их фармацевтически приемлемые соли или N-оксиды) обычно могут быть получены традиционными методами, известными специалистам в данной области, или способами, аналогичными описанным в данном документе, с использованием подходящего изотопно-меченного реагента вместо используемого в иных случаях немеченного реагента.
Пролекарства в соответствии с изобретением могут, например, быть получены замещением соответствующих функциональных групп, присутствующих в соединениях формулы I, на определенные фрагменты, известные специалистам в данной области как «профрагменты», как описано, например, в «Design of Prodrugs», H. Bundgaard (Elsevier, 1985).
Соединения формулы I должны быть оценены в отношении их биофармацевтических свойств, таких как растворимость и стабильность раствора (при разных величинах рН), проникающая способность и т.д., для того, чтобы выбрать наиболее подходящую лекарственную форму и путь введения для лечения по предполагаемому показанию.
Соединения по изобретению, предназначенные для фармацевтического применения, можно вводить в форме кристаллических или аморфных продуктов. Они могут быть получены, например, в виде твердых брикетов, порошков или пленок такими способами, как осаждение, кристаллизация, лиофилизация, распылительная сушка или испарительная сушка. Для этой цели может быть использована сушка под действием микроволнового излучения или радиочастотного излучения.
Они могут вводиться по отдельности или в сочетании с одним или более другими соединениями по изобретению или в сочетании с одним или более другими лекарственными средствами (или в виде любой комбинации этого). Как правило, их вводят в виде лекарственной формы вместе с одним или несколькими фармацевтически приемлемыми эксципиентами. Термин «эксципиент» используется в данном описании для описания любого ингредиента, отличного от соединения (соединений) по изобретению. Выбор эксципиента будет в значительной степени зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы.
Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению (или их фармацевтически приемлемых солей), и способы их получения будут ясны специалистам в данной области. Такие композиции и способы их получения могут быть найдены, например, в «Remington's Pharmaceutical Sciences», 19th Edition (Mack Publishing Company, 1995).
Соединения по изобретению (включая их фармацевтически приемлемые соли) могут быть введены перорально. Пероральное введение может включать проглатывание, благодаря чему соединение попадает в желудочно-кишечный тракт, и/или буккальное, лингвальное или сублингвальное введение, посредством которого соединение проникает в кровоток непосредственно из полости рта.
Лекарственные формы, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; пастилки (включая наполненные жидкостью); жевательные таблетки; гели; быстродиспергируемые лекарственные формы; пленки; капсулы; спреи и буккальные/мукоадгезивные пластыри.
Жидкие лекарственные формы включают суспензии, растворы, сиропы и эликсиры. Такие лекарственные формы могут применяться в качестве наполнителей в мягких или твердых капсулах (изготовленных, например, из желатина или гидроксипропилметилцеллюлозы), и они обычно содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более эмульгирующих агентов и/или суспендирующих агентов. Жидкие лекарственные формы также могут быть получены растворением твердого вещества, например, из саше.
Соединения по изобретению также могут быть использованы в быстрорастворимых, быстрораспадающихся лекарственных формах, таких как формы, описанные Liang и Chen, в «Expert Opinion in Therapeutic Patents», 2001, 11, 981-986.
Для таблетированных лекарственных форм в зависимости от дозы лекарственное средство может составлять от 1% масс. до 80% масс. лекарственной формы, более типично от 5% масс. до 60% масс. лекарственной формы. В дополнение к лекарственному средству таблетки в большинстве случаев содержат разрыхлитель. Примеры разрыхлителей включают крахмалгликолят натрия, натрийкарбоксиметилцеллюлозу, кальцийкарбоксиметилцеллюлозу, натрийкроскармелозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшими алкилами, крахмал, прежелатинизированный крахмал и альгинат натрия. В большинстве случаев разрыхлитель будет составлять от 1% масс. до 25% масс., например от 5% масс. до 20% масс. лекарственной формы.
Связывающие агенты используются для придания таблетированной лекарственной форме когезионных свойств. Подходящие связывающие агенты включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические камеди, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, моногидрат, подвергнутый распылительной сушке, безводная форма и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция.
Таблетки могут также необязательно содержать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и скользящие вещества, такие как диоксид кремния и тальк. В случае присутствия поверхностно-активные агенты могут составлять от 0,2% масс. до 5% масс. таблетки, и скользящие вещества могут составлять от 0,2% масс. до 1% масс. таблетки.
Таблетки также в большинстве случаев содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Обычно смазывающие вещества составляют от 0,25% масс. до 10% масс., например, от 0,5% масс. до 3% масс. таблетки.
Другие возможные ингредиенты включают антиоксиданты, красители, корригенты, консерванты и вещества, маскирующие вкус лекарственного средства.
Типичные таблетки содержат до примерно 80% лекарственного средства, от примерно 10% масс. до примерно 90% масс. связывающего агента, от примерно 0% масс. до примерно 85% масс. разбавителя, от примерно 2% масс. до примерно 10% масс. разрыхлителя и от примерно 0,25% масс. до примерно 10% масс. смазывающего вещества.
Таблеточные смеси могут быть спрессованы непосредственно или с помощью валика для получения таблеток. Перед таблетированием таблеточные смеси или части смесей могут в качестве альтернативы быть подвергнуты влажному гранулированию, сухому гранулированию или гранулированию из расплава, затвердеванию расплава или экструдированию. Конечная лекарственная форма может содержать один или более слоев и может иметь покрытие или не иметь покрытия; она может даже быть инкапсулирована.
Изготовление таблеток обсуждается в «Pharmaceutical Dosage Forms: Tablets», Vol. 1, H. Lieberman, L. Lachman (Marcel Dekker, New York, 1980).
Годные к употреблению пероральные пленки для применения у людей или животных обычно представляют собой мягкие растворимые в воде или набухающие в воде тонкие пленчатые лекарственные формы, способные быстро растворяться или являющиеся мукоадгезивными, и обычно содержащие соединение формулы I, пленкообразующий полимер, связывающий агент, растворитель, увлажнитель, пластификатор, стабилизатор или эмульгатор, агент, модифицирующий вязкость, и растворитель. Некоторые компоненты лекарственной формы могут выполнять более чем одну функцию.
Соединение формулы I (или его фармацевтически приемлемые соли или N-оксиды) может быть водорастворимым или нерастворимым в воде. Водорастворимое соединение обычно содержит от 1% масс. до 80% масс., более типично от 20% масс. до 50% масс. растворенных веществ. Менее растворимые соединения могут составлять меньшую часть композиции, обычно вплоть до 30% масс. растворенных веществ. В качестве альтернативы, соединение формулы I может быть представлено в форме гранул из множества частиц.
Пленкообразующий полимер может быть выбран из природных полисахаридов, белков или синтетических гидроколлоидов, и обычно представлен в количестве от 0,01-99% масс., более типично в количестве 30-80% масс.
Другие возможные ингредиенты включают антиоксиданты, красители, корригенты и усилители вкуса и запаха, консерванты, агенты, стимулирующие слюноотделение, охлаждающие агенты, сорастворители (включая масла), смягчающие средства, наполнители, пеногасители, поверхностно-активные вещества и вещества, маскирующие вкус.
Пленки по изобретению обычно изготавливают испарительной сушкой тонких водных пленок, нанесенных на отслаивающуюся подложку или бумагу. Это можно осуществить в сушильном шкафу или камере, обычно в комбинированной сушилке для покрытий, или путем лиофильной сушки или вакуумирования.
Твердые лекарственные формы для перорального введения могут быть приготовлены с возможностью немедленного и/или модифицированного высвобождения. Лекарственные формы с модифицированным высвобождением включают отсроченное, замедленное, импульсное, контролируемое, направленное и программируемое высвобождение.
Подходящие лекарственные формы с модифицированным высвобождением для целей изобретения описаны в патенте US 6106864. Подробности о других подходящих технологиях высвобождения, таких как высокоэнергетические дисперсии, и осмотические частицы, а также частицы с покрытием представлены в Verma et al., «Pharmaceutical Technology On-line», 25(2), 1-14 (2001). Использование жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298.
Соединения настоящего изобретения (включая их фармацевтически приемлемые соли) можно также вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, интраперитонеальное, интратекальное, интравентрикулярное, интрауретральное, интрастернальное, интракраниальное, внутримышечное, внутрисуставное и подкожное введение. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) инъекторы, безыгольные инъекторы и инфузионное оборудование.
Лекарственные формы для парентерального применения обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (например, до pH 3-9), но, для некоторых применений, они могут быть более подходящим образом приготовлены в виде стерильного неводного раствора или в виде высушенной формы для применения в сочетании с подходящим носителем, таким как стерильная апирогенная вода.
Получение лекарственных форм для парентерального применения в стерильных условиях, например, лиофилизацией, может быть легко осуществлено с применением стандартных фармацевтических методик, хорошо известных специалистам.
Растворимость соединений формулы I (включая их фармацевтически приемлемые соли), используемых при получении парентеральных растворов, можно повысить путем использования соответствующих методик изготовления лекарственных форм, таких как включение агентов, повышающих растворимость.
Лекарственные формы для парентерального введения могут быть приготовлены с возможностью немедленного и/или модифицированного высвобождения. Лекарственные формы с модифицированным высвобождением включают отсроченное, замедленное, импульсное, контролируемое, направленное и программируемое высвобождение. Так, соединения по изобретению могут быть приготовлены в виде суспензии или в виде твердой, полутвердой лекарственной формы или тиксотропной жидкости для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких лекарственных форм включают покрытые лекарственным средством стенты и полутвердые лекарственные формы или суспензии, содержащие несущие лекарственное средство микросферы сополимера D- и L-изомеров молочной и гликолевой кислот (PGLA).
Соединения по изобретению (или их фармацевтически приемлемые соли) также могут быть введены местно, (интра)дермально или трансдермально на кожу или слизистую оболочку. Типичные лекарственные формы для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, капсулы, имплантаты, губки, волокна, бандажи и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены усилители проникновения. См., например, Finnin и Morgan, J. Pharm. Sci. 1999, 88, 955-958.
Другие способы местного введения включают доставку электропорацией, ионтофорезом, фонофорезом, сонофорезом и микроигольную или безыгольную (например, Powderject™, Bioject™ и т.п.) инъекцию.
Лекарственные формы для местного введения могут быть приготовлены с возможностью немедленного и/или модифицированного высвобождения. Лекарственные формы с модифицированным высвобождением включают отсроченное, замедленное, импульсное, контролируемое, направленное и программируемое высвобождение.
Соединения по изобретению (или их фармацевтически приемлемые соли) также могут быть введены интраназально или ингаляцией, обычно в форме сухого порошка (либо отдельно, либо в виде смеси, например, в сухой смеси с лактозой, или в виде смешанной компонентной частицы, например, смешанной с фосфолипидами, такими как фосфатидилхолин) из ингалятора сухого порошка, в виде аэрозольного спрея из герметизированного контейнера, насоса, спрея, аэрозольного ингалятора (например, аэрозольного ингалятора с использованием электрогидродинамики для образования мелкодисперсного аэрозоля), или небулайзера, с применением или без применения подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или в виде капель в нос. Для интраназального применения порошок может содержать биоадгезивный агент, например, хитозан или циклодекстрин.
Герметизированный контейнер, насос, спрей, аэрозольный ингалятор или небулайзер содержит раствор или суспензию соединения (соединений) по изобретению, содержащую, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, солюбилизации или продления высвобождения активного соединения, пропеллент (пропелленты) в качестве растворителя и, необязательно, поверхностно-активное вещество, такое как сорбитантриолеат, олеиновая кислота или олигомолочная кислота.
Перед применением в сухом порошке или суспензионном препарате лекарственное средство микронизируют до размера, подходящего для доставки ингаляцией (обычно менее 5 мкм). Это может быть осуществлено любым подходящим способом измельчения, таким как измельчение в спиральной струе, измельчение в струе псевдоожиженного слоя, обработка сверхкритической текучей средой с образованием наночастиц, гомогенизация под высоким давлением или распылительная сушка.
Капсулы (изготовленные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для применения в ингаляторе или инсуффляторе можно изготовить в виде препарата так, чтобы они содержали порошковую смесь соединения по изобретению, подходящую порошковую основу, такую как лактоза или крахмал, и модификатор эффективности, такой как L-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Подходящая лекарственная форма в виде раствора для использования в аэрозольном ингаляторе с применением электрогидродинамики для образования мелкодисперсного аэрозоля может содержать от 1 мкг до 20 мг соединения по изобретению на одно срабатывание, и объем, высвобождаемый при одном срабатывании, может варьировать от 1 мкл до 100 мкл. Типичная лекарственная форма может содержать соединение формулы I или его фармацевтически приемлемую соль, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут быть использованы вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
Подходящие корригенты, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия, могут быть добавлены к тем лекарственным формам по изобретению, которые предназначены для ингаляционного/интраназального введения.
Лекарственные формы для ингаляционного/интраназального введения могут быть приготовлены с возможностью немедленного и/или модифицированного высвобождения, с использованием, например, PGLA. Лекарственные формы с модифицированным высвобождением включают отсроченное, замедленное, импульсное, контролируемое, направленное и программируемое высвобождение.
В случае ингаляторов сухого порошка и аэрозолей единица дозирования определяется с помощью клапана, который подает дозированное количество. Устройства в соответствии с изобретением обычно оборудованы для введения отмеренной дозы или «впрыскивания», содержащего 0,01-100 мг соединения формулы I. Общая суточная доза будет обычно составлять от 1 мкг до 200 мг, которые могут быть введены в однократной дозе, или, более часто, в виде разделенных доз в течение всего дня.
Соединения по изобретению (включая их фармацевтически приемлемые соли) могут быть введены ректально или вагинально, например, в виде суппозитория, пессария или клизмы. Масло какао является обычной основой суппозиториев, но при необходимости могут использоваться различные альтернативы.
Лекарственные формы для ректального/вагинального введения могут быть приготовлены с возможностью немедленного и/или модифицированного высвобождения. Лекарственные формы с модифицированным высвобождением включают отсроченное, замедленное, импульсное, контролируемое, направленное и программируемое высвобождение.
Соединения по изобретению (включая их фармацевтически приемлемые соли) также могут быть введены непосредственно в глаз или ухо, обычно в виде капель микронизированной суспензии или раствора в изотоническом стерильном физиологическом растворе с отрегулированным рН. Другие лекарственные формы, подходящие для глазного или ушного введения включают мази, гели, биоразлагаемые (например, губки с абсорбируемыми гелями, коллаген) и бионеразлагаемые (например, силиконовые) имплантаты, капсулы, линзы и системы микрочастиц или везикулярные системы, такие как ниосомы или липосомы. Полимер, такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например, геллановая камедь, может быть включен вместе с консервантом, таким как бензалконийхлорид. Такие лекарственные формы также могут доставляться ионтофорезом.
Лекарственные формы для глазного/ушного введения могут быть приготовлены с возможностью немедленного и/или модифицированного высвобождения. Лекарственные формы с модифицированным высвобождением включают отсроченное, замедленное, импульсное, контролируемое, направленное или программируемое высвобождение.
Соединения по изобретению (включая их фармацевтически приемлемые соли) можно объединять с растворимыми макромолекулярными веществами, такими как циклодекстрин и его подходящие производные или полиэтиленгликоль-содержащие полимеры, с целью улучшения их растворимости, скорости растворения, маскировки вкуса, биодоступности и/или стабильности для применения в любом из указанных выше способов введения.
Например, было обнаружено, что комплексы циклодекстрин-лекарственное средство, в целом применимы для большинства лекарственных форм и путей введения. Могут быть использованы как комплексы включения, так и комплексы без включения. В качестве альтернативы прямому комплексообразованию с лекарственным средством циклодекстрин может использоваться в качестве вспомогательной добавки, т.е. в качестве носителя, разбавителя или солюбилизатора. Чаще всего для этих целей используют альфа-, бета- и гамма-циклодекстрины, примеры которых могут быть найдены в международных патентных заявках №№ WO 91/11172, WO 94/02518 и WO 98/55148.
Поскольку настоящее изобретение имеет аспект, который относится к лечению описанного здесь заболевания/состояний с помощью комбинации активных ингредиентов, которые могут быть введены по отдельности, изобретение также относится к комбинированию отдельных фармацевтических композиций в форме набора. Набор содержит две отдельные фармацевтические композиции: соединение формулы I, его пролекарство или соль такого соединения или пролекарства; и второе соединение, как описано выше. Набор содержит средства для хранения отдельных композиций, такие как контейнер, разделенная бутыль или разделенный пакет из фольги. Обычно набор включает инструкции для введения отдельных компонентов. Форма набора является особенно предпочтительной, когда отдельные компоненты вводят, например, в разных лекарственных формах (например, пероральной и парентеральной), вводят с различными интервалами дозирования, или когда желательно титрование индивидуальных компонентов комбинации лечащим врачом.
Примером такого набора является так называемая блистерная упаковка. Блистерные упаковки хорошо известны в упаковочной промышленности и широко используются для упаковки фармацевтических дозированных лекарственных форм (таблеток, капсул и тому подобного). Блистерные упаковки обычно состоят из листа относительно плотного материала, покрытого пленкой из прозрачного пластика. Во время процесса упаковки в полимерной пленке формируют углубления. Эти углубления имеют размер и форму таблеток или капсул, которые подлежат упаковке. Затем таблетки или капсулы помещают в углубления и запечатывают слоем относительно плотного материала с лицевой стороны полимерной пленки, которая противоположна тому направлению, в котором были сформированы углубления. В результате, таблетки или капсулы запечатываются в углублениях между пластиковой пленкой и листом. В некоторых вариантах осуществления прочность слоя такова, что таблетки или капсулы можно извлечь из блистерной упаковки, надавливая рукой на углубления, в силу чего на слое напротив углубления образуется отверстие. Затем таблетка или капсула может быть извлечена через указанное отверстие.
Может быть желательным приложение к набору памятки, например в форме номеров рядом с таблетками или капсулами, где номера соответствуют дням в схеме приема лекарства, в которые помеченные таким образом таблетки или капсулы следует принимать. Другим примером такой памятки является отпечатанный на карточке календарь, например, такой: «Первая неделя, понедельник, вторник, и т.д.... Вторая неделя, понедельник, вторник,... и т.д.». Легко можно представить и другие варианты памятки. «Суточная доза» может представлять собой одну таблетку или капсулу, или несколько таблеток или капсул, которые надо принимать в определенный день. Также суточная доза соединения формулы I может состоять из одной таблетки или капсулы, тогда как суточная доза второго соединения может состоять из нескольких таблеток или капсул, и наоборот. Памятка должна это отражать.
В другом конкретном варианте осуществления изобретения предложен дозатор, предназначенный для дозирования суточных доз по одной в порядке их предполагаемого применения. Например, дозатор снабжают памяткой, чтобы дополнительно облегчить соблюдение схемы приема лекарства. Примером такой памятки является механический счетчик, который указывает количество суточных доз, которые уже были выделены. Другим примером такой памятки является микрочип памяти с питанием от батарейки, связанный с жидкокристаллическим индикатором, или слышимый напоминающий сигнал, который, например, зачитывает вслух дату, когда принята последняя суточная доза, и/или напоминает, когда надо принять следующую дозу.
Изобретение будет описано более подробно на конкретных примерах. Следующие примеры приводятся с целью иллюстрации и не предназначены для ограничения изобретения каким-либо образом. Специалисты в данной области легко определят множество некритических параметров, которые могут быть изменены или модифицированы для получения по существу таких же результатов. Дополнительные соединения, входящие в объем данного изобретения, могут быть получены с использованием способов, проиллюстрированных в данных примерах, отдельно или в сочетании с методиками, широко известными в данной области техники. В следующих ниже примерах и получениях, «ДМСО» означает диметилсульфоксид, "н." там, где он относится к концентрации, означает «нормальный», «М» означает «молярный», «мл» означает миллилитр, «ммоль» означает миллимоль, «мкмоль» означает микромоль, «экв.» означает эквивалент, «°С» означает градусы Цельсия, «МГц» означает мегагерц, «ВЭЖХ» означает высокоэффективную жидкостную хроматографию.
ПРИМЕРЫ
Ниже проиллюстрован синтез различных соединений по настоящему изобретению. Дополнительные соединения, входящие в объем данного изобретения, могут быть получены с использованием способов, проиллюстрированных в данных примерах, отдельно или в сочетании с методиками, широко известными в данной области техники.
Эксперименты обычно проводили в инертной атмосфере (азота или аргона), в частности в тех случаях, когда использовали реагенты или промежуточные соединения, чувствительные к кислороду или влаге. Имеющиеся в продаже растворители и реагенты обычно использовали без дополнительной очистки. При необходимости использовались безводные растворители, обычно продукты AcroSeal® от Acros Organics или продукты DriSolv® от EMD Chemicals. В других случаях коммерческие растворители пропускали через колонки, заполненные молекулярными ситами 4Å, до тех пор, пока не были достигнуты следующие стандарты контроля качества для воды: a) <100 ч/млн для дихлорметана, толуола, N,N-диметилформамида и тетрагидрофурана; b) <180 ч/млн для метанола, этанола, 1,4-диоксана и диизопропиламина. Для очень чувствительных реакций растворители дополнительно обрабатывали металлическим натрием, гидридом кальция или молекулярными ситами и дистиллировали непосредственно перед использованием. Продукты обычно сушили под вакуумом перед тем, как подвергать их дальнейшим взаимодействиям или биологическому тестированию. Данные масс-спектрометрии получены с помощью оборудования для жидкостной хроматографии-масс-спектрометрии (ЖХМС), химической ионизации при атмосферном давлении (ХИАД) или оборудования для газовой хроматографии-масс-спектрометрии (ГХМС). Данные по химическим сдвигам для ядерного магнитного резонанса (ЯМР) представлены в миллионных долях (м.д., δ) и соотносятся с остаточными пиками используемых дейтерированных растворителей. В некоторых примерах хиральные разделения осуществлялись для разделения энантиомеров или диастереомеров некоторых соединений по изобретению или их предшественников/промежуточных соединений. В некоторых примерах разделенные энантиомеры обозначаются как ENT-1 и ENT-2, в соответствии с порядком их элюирования. В некоторых примерах разделенные диастереомеры обозначаются как DIAST 1 и DIAST 2, в соответствии с порядком их элюирования; и если обозначения определены для некоторых предшественников/промежуточных продуктов, - данные обозначения соответственно переносятся на их последующие продукты. В некоторых примерах оптическое вращение энантиомера измеряли с использованием поляриметра. В соответствии с наблюдаемыми данными по его вращению (или данными по его удельному вращению), энантиомер с вращением по часовой стрелке обозначали как (+)- энантиомер, а энантиомер с вращением против часовой стрелки обозначали как (-)- энантиомер. Рацемические соединения обозначаются наличием (+/-) рядом со структурой; в этих случаях указанная стереохимия представляет относительную (а не абсолютную) конфигурацию заместителей соединения.
Реакции, протекающие через детектируемые промежуточные соединения, обычно сопровождались ЖХМС и продолжались до полного превращения перед добавлением последующих реагентов. Для методик, относящихся к синтезу в других примерах или способах, условия реакции (продолжительность реакции и температура) могут варьировать. Обычно за ходом реакций следили с помощью тонкослойной хроматографии или масс-спектрометрии и реакционные смеси подвергали соответствующей обработке, когда это было необходимо. Процедуры очистки могут варьировать между экспериментами: в общем, растворители и соотношения растворителей, используемые для элюентов/градиентов, выбирали так, чтобы обеспечить соответствующие значения Rf или времени удерживания.
Сокращения:
BOC (или Boc) -трет-бутоксикарбонил
ВЭЖХ - высокоэффективная жидкостная хроматография
PMB - пара-метоксибензил (или 4-метоксибензил)
фунт/кв. дюйм - фунты на квадратный дюйм
Пример 1
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-2-[4-(трифторметил)-1H-пиразол-1-ил]-7-азаспиро[3.5]нонан-7-карбоксилат (1)
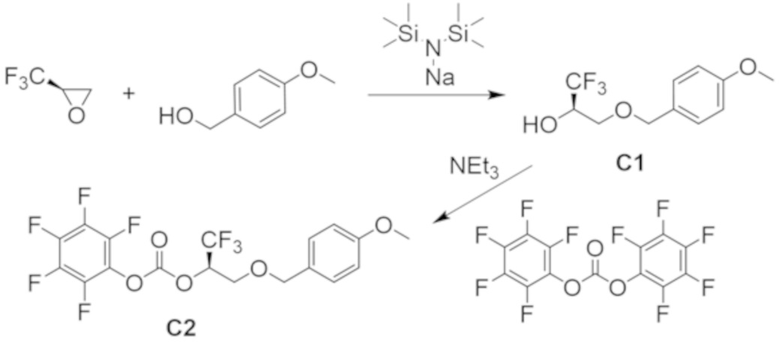
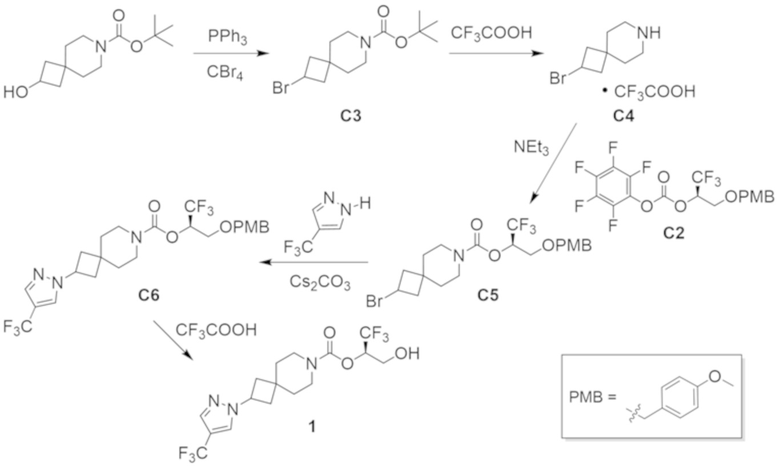
Стадия 1. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ола ( C1 ).
(4-Метоксифенил)метанол (98%, 1,14 мл, 8,96 ммоль) медленно добавляли к раствору с температурой 0°С бис(триметилсилил)амида натрия в тетрагидрофуране (1,0 M, 8,9 мл, 8,9 ммоль) в сосуде для микроволновой обработки. После перемешивания реакционной смеси при 0°С в течение 45 мин, (2R)-2-(трифторметил)оксиран (500 мг, 4,46 ммоль) в тетрагидрофуране (2 мл) добавляли с помощью шприца и сосуд герметично закрывали и нагревали при 100°С в течение 18 ч. Затем реакционную смесь охлаждали до комнатной температуры и разбавляли водой; смесь дважды экстрагировали простым трет-бутилметиловым эфиром и объединенные органические слои промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Очистка хроматографией на силикагеле (градиент: от 0% до 60% этилацетата в гептане) давала продукт в виде бледно-желтого масла. Выход: 1,09 г, 4,36 ммоль, 98%. ГХМС m/z 250,1 [M+]. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,26 (д, J=8,5 Гц, 2H), 6,91 (д, J=8,5 Гц, 2H), 6,36 (д, J=6,7 Гц, 1H), 4,46 (с, 2H), 4,21-4,09 (м, 1H), 3,74 (с, 3H), 3,58 (дд, половина АВХ картины, J=10,6, 4,5 Гц, 1H), 3,48 (дд, половина АВХ картины, J=10,5, 6,3 Гц, 1H).
Стадия 2. Синтез пентaфторфенил-(2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-илкарбоната ( C2 ).
Бис(пентaфторфенил)карбонат (9,44 г, 24,0 ммоль) добавляли к 0°С раствору C1 (5,99 г, 23,9 ммоль) в ацетонитриле (100 мл). Добавляли триэтиламин (12,8 мл, 91,8 ммоль), и реакционной смеси давали нагреться до 25°C и перемешивали в течение 1 ч. Полученный раствор С2 использовали непосредственно на стадии 5. Для последующих описанных здесь синтезов, в которых используется С2, это вещество было получено в соответствующем масштабе, и реакционный раствор С2 использовали непосредственно в реакции сочетания.
Стадия 3. Синтез трет-бутил-2-бром-7-азаспиро[3.5]нонан-7-карбоксилата ( C3 ).
Раствор трет-бутил-2-гидрокси-7-азаспиро[3.5]нонан-7-карбоксилата (4,87 г, 20,2 ммоль) в тетрагидрофуране (65 мл) охлаждали до 0°С и обрабатывали трифенилфосфином (6,35 г, 24,2 ммоль), затем тетрабромметаном (8,03 г, 24,2 ммоль). Через 30 мин реакционную смесь нагревали до комнатной температуры и давали перемешиваться в течение 3,5 ч, после чего ее концентрировали под вакуумом с получением светло-коричневого твердого вещества. Это вещество объединяли с неочищенным веществом из аналогичной реакции, проводимой с использованием трет-бутил-2-гидрокси-7-азаспиро[3.5]нонан-7-карбоксилата (1,12 г, 4,64 ммоль), и подвергали хроматографии на силикагеле (градиент: 5-10% этилацетата в гептане), получая продукт в виде белого твердого вещества. Общий выход: 5,62 г, 18,5 ммоль, 74%. ГХМС m/z 303,0 (наблюдали изотопную картину брома) [M+]. 1H ЯМР (400 МГц, CDCl3) δ 4,49 (квинт., J=7,8 Гц, 1H), 3,36-3,27 (м, 4H), 2,65-2,57 (м, 2H), 2,34-2,26 (м, 2H), 1,68-1,62 (м, 2H), 1,57-1,51 (м, 2H), 1,45 (с, 9H).
Стадия 4. Синтез 2-бром-7-азаспиро[3.5]нонана, трифторацетатной соли ( С4 ).
Трифторуксусную кислоту (25 мл) добавляли к 0°С раствору C3 (5,60 г, 18,4 ммоль) в дихлорметане (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, после чего ее концентрировали под вакуумом, получая продукт в виде масла. Выход: 5,86 г, 18,4 ммоль, количественно. ГХМС m/z 203,0 (наблюдали изотопную картину брома) [M+]. 1H ЯМР (400 МГц, CDCl3) δ 4,47 (квинт., J=7,7 Гц, 1H), 3,25-3,13 (м, 4H), 2,75-2,66 (м, 2H), 2,44-2,35 (м, 2H), 2,07-1,99 (м, 2H), 1,93-1,85 (м, 2H).
Стадия 5. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-бром-7-азаспиро[3.5]нонан-7-карбоксилата ( C5 ).
Триэтиламин (12,8 мл, 91,8 ммоль) добавляли к 0°С раствору C4 (5,86 г, 18,4 ммоль) в ацетонитриле (100 мл) и смесь перемешивали при 0°С в течение нескольких минут. Добавляли соединение C2 [со стадии 2, в виде неочищенной реакционной смеси в ацетонитриле (100 мл); 23,9 ммоль], и реакционную смесь перемешивали при 0°С в течение нескольких минут, после чего ей давали нагреться до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь концентрировали под вакуумом и остаток растворяли в этилацетате и последовательно промывали 1 М водной соляной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Хроматография на силикагеле (градиент: 75-100% дихлорметана в гептане) давала продукт в виде густого непрозрачного масла. Выход: 5,08 г, 10,6 ммоль, 58%. 1H ЯМР (400 МГц, CDCl3) δ 7,24 (ушир. д, J=8,8 Гц, 2H), 6,88 (ушир. д, J=8,6 Гц, 2H), 5,51-5,42 (м, 1H), 4,54-4,44 (м, 1H), 4,50 (AB квартет, JAB=11,7 Гц, ΔνAB=28,5 Гц, 2H), 3,82 (с, 3H), 3,75 (дд, половина АВХ картины, J=11,2, 4,0 Гц, 1H), 3,68 (дд, половина АВХ картины, J=11,1, 7,0 Гц, 1H), 3,48-3,33 (ушир. м, 4H), 2,67-2,56 (м, 2H), 2,36-2,26 (м, 2H), 1,75-1,63 (ушир. м, 2H), 1,63-1,51 (ушир. м, 2H).
Стадия 6. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-[4-(трифторметил)-1H-пиразол-1-ил]-7-азаспиро[3.5]нонан-7-карбоксилата ( C6 ).
К раствору С5 (100 мг, 0,208 ммоль) комнатной температуры в N,N-диметилформамиде (2 мл) добавляли карбонат цезия (170 мг, 0,522 ммоль), затем 4-(трифторметил)-1H-пиразол (42,5 мг, 0,312 ммоль), и реакционную смесь перемешивали при 80°С в течение ночи. Затем ее распределяли между водой и этилацетатом и водный слой экстрагировали этилацетатом (3 × 15 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали под вакуумом. Хроматография на силикагеле (градиент: 0-25% этилацетата в гептане) давала продукт в виде масла. Выход: 71 мг, 0,13 ммоль, 62%. ЖХМС m/z 536,4 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,74 (с, 1H), 7,69 (с, 1H), 7,25 (ушир. д, J=8,6 Гц, 2H), 6,88 (ушир. д, J=8,6 Гц, 2H), 5,54-5,44 (м, 1H), 4,78 (квинт., J=8,4 Гц, 1H), 4,51 (AB квартет, JAB=11,7 Гц, ΔνAB=28,5 Гц, 2H), 3,81 (с, 3H), 3,76 (дд, половина АВХ картины, J=11,3, 3,9 Гц, 1H), 3,69 (ушир. дд, половина АВХ картины, J=10,9, 7,0 Гц, 1H), 3,55-3,47 (ушир. м, 2H), 3,47-3,38 (ушир. м, 2H), 2,52-2,42 (м, 2H), 2,38 (дд, половина АВХ картины, J=12,5, 8,6 Гц, 2H), 1,76-1,62 (ушир. м, 4H).
Стадия 7. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-[4-(трифторметил)-1H-пиразол-1-ил]-7-азаспиро[3.5]нонан-7-карбоксилата ( 1 ).
Трифторуксусную кислоту (1,2 мл, 15,6 ммоль) добавляли к 0°С раствору C6 (71 мг, 0,13 ммоль) в дихлорметане (6,6 мл). Реакционную смесь перемешивали при 0°С в течение 1,5 ч, после чего ее разбавляли насыщенным водным раствором хлорида натрия и экстрагировали этилацетатом (3 × 5 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле (градиент: 10-55% этилацетата в гептане) с получением продукта в виде масла. Выход: 49 мг, 0,12 ммоль, 92%. ЖХМС m/z 416,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,74 (с, 1H), 7,69 (с, 1H), 5,31-5,21 (м, 1H), 4,79 (квинт., J=8,3 Гц, 1H), 4,00 (дд, половина АВХ картины, J=12,5, 3,5 Гц, 1H), 3,87 (дд, половина АВХ картины, J=12,5, 6,6 Гц, 1H), 3,63-3,34 (м, 4H), 2,54-2,44 (м, 2H), 2,39 (дд, половина АВХ картины, J=12, 8,4 Гц, 2H), 2,43-2,27 (м, 1H), 1,79-1,67 (ушир. м, 4H).
Пример 2
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-2-(5-фторпиридин-2-ил)-7-азаспиро[3.5]нонан-7-карбоксилат ( 2 )
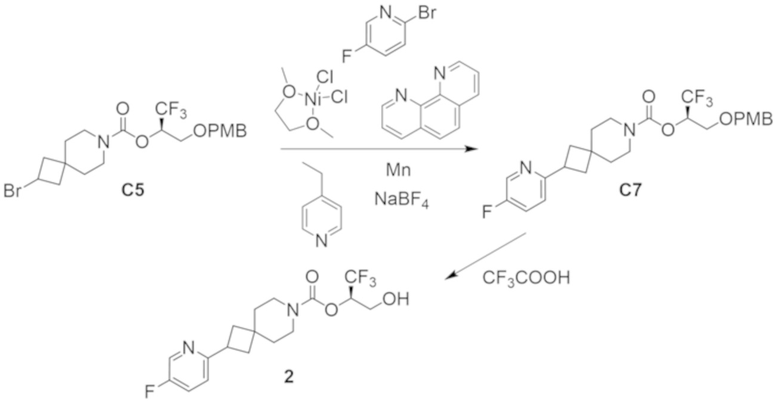
Стадия 1. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-(5-фторпиридин-2-ил)-7-азаспиро[3.5]нонан-7-карбоксилата ( C7 ).
Комплекс 1,2-диметоксиэтана с хлоридом никеля (II) (14,0 мг, 63,7 мкмоль), 1,10-фенантролин (23,0 мг, 0,128 ммоль), тетрафторборат натрия (95%, 36,1 мг, 0,312 ммоль) и порошкообразный марганец (68,6 мг (1,25 ммоль) объединяли в сосуде, который затем вакуумировали и заполняли азотом. Этот цикл вакуумирования повторяли дважды. В отдельном сосуде раствор 4-этилпиридина (36 мкл, 0,32 ммоль), C5 (300 мг, 0,625 ммоль) и 2-бром-5-фторпиридина (110 мг, 0,625 ммоль) в метаноле (4,0 мл) продували азотом и затем вакуумировали; этот цикл повторяли дважды и сосуд снова продували азотом. Раствор, содержащий С5, добавляли в содержащий никель сосуд, и реакционную смесь нагревали при 60°С в течение 17 ч. Затем содержимому давали остыть до комнатной температуры и фильтровали через мембранный фильтр 0,45 мкм. Фильтр промывали метанолом, и объединенные фильтраты концентрировали под вакуумом и подвергали двум циклам хроматографии на силикагеле (Колонка #1: элюенты, 0%, затем 5%, 10%, 15%, 20% и 25% этилацетата в гептане. Колонка #2: элюент, 5% метанол в дихлорметане), с получением продукта в виде бесцветного масла, которое являлось загрязненным по результатам ЖХМС анализа. Это вещество использовали непосредственно на следующей стадии. Выход: 146 мг, ≤0,294 ммоль, ≤47%. ЖХМС m/z 497,5 [M+H]+.
Стадия 2. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-(5-фторпиридин-2-ил)-7-азаспиро[3.5]нонан-7-карбоксилата ( 2 ).
Трифторуксусную кислоту (1,0 мл, 13 ммоль) добавляли к 0°С раствору С7 (с предыдущей стадии; 146 мг, ≤0,294 ммоль) в дихлорметане (4 мл). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре, после чего ее концентрировали под вакуумом и распределяли между дихлорметаном и насыщенным водным раствором бикарбоната натрия. Водный слой экстрагировали дважды дихлорметаном и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Хроматография на силикагеле (элюенты: 10%, затем 20%, 30% и 40% этилацетата в гептане) давала слегка загрязненный продукт в виде почти белой смолы (35 мг). ЖХМС m/z 377,4 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,42 (д, J=2,7 Гц, 1H), 7,32 (ддд, J=8,6, 8,2, 3,1 Гц, 1H), 7,13 (дд, J=8,6, 4,3 Гц, 1H), 5,30-5,20 (м, 1H), 4,00 (дд, половина АВХ картины, J=12, 3 Гц, 1H), 3,87 (дд, половина АВХ картины, J=12, 7 Гц, 1H), 3,63 (квинт, J=9,0 Гц, 1H), 3,6-3,28 (м, 4H), 2,29 (дд, J=11,5, 9,2 Гц, 2H), 2,12 (дд, J=11,9, 9,2 Гц, 2H), 1,82-1,72 (м, 2H), 1,67-1,57 (м, 2H). Это вещество повторно очищали с помощью обращенно-фазовой ВЭЖХ (колонка: Waters Sunfire C18, 5 мкм; подвижная фаза A: 0,05% трифторуксусной кислоты в воде (об./об.); подвижная фаза B: 0,05% трифторуксусной кислоты в ацетонитриле (об./об.); градиент: от 5,0% до 100% B), с получением продукта. Выход: 30,1 мг, 80,0 мкмоль, 13% за две стадии. ЖХМС m/z 377,3 [M+H]+.
Примеры 3 и 4
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-{[4-(трифторметил)-1H-пиразол-1-ил]метил}-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 1 [из C13 , DIАST 1] ( 3 ) и (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-{[4-(трифторметил)-1H-пиразол-1-ил]метил}-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 2 [из C14 , DIАST 2] ( 4 )
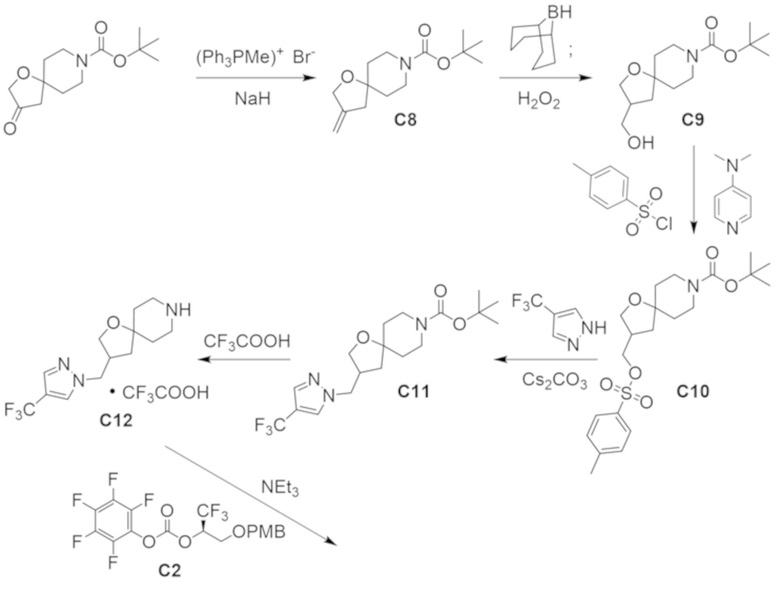
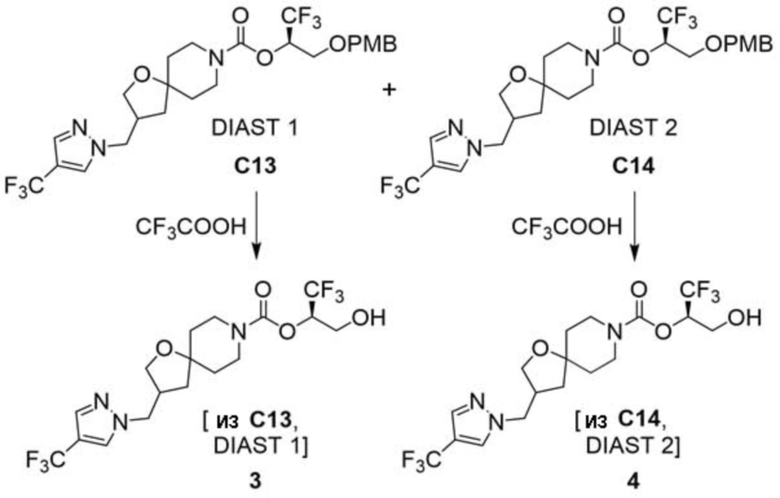
Стадия 1. Синтез трет-бутил-3-метилиден-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C8 ).
Бромид метилтрифенилфосфония (8,4 г, 24 ммоль) порциями добавляли к смеси гидрида натрия (60% дисперсия в минеральном масле; 940 мг, 23,5 ммоль) в диметилсульфоксиде (40 мл) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Раствор трет-бутил-3-оксо-1-окса-8-азаспиро[4.5]декан-8-карбоксилата (2,0 г, 7,8 ммоль) в диметилсульфоксиде (18 мл) затем добавляли по каплям, и реакционную смесь оставляли при непрекращающемся перемешивании при комнатной температуре в течение 72 ч. Затем реакционную смесь осторожно гасили водой (250 мл) и экстрагировали простым диэтиловым эфиром (5 × 50 мл). Объединенные органические слои промывали водой (2 × 25 мл), сушили над сульфатом магния, фильтровали и концентрировали под вакуумом. Остаток трижды растирали с гептаном с получением почти белого твердого вещества, которое при анализе оказалось в основном оксидом трифенилфосфина. Объединенные порции гептана, полученные в результате растирания, концентрировали под вакуумом и подвергали хроматографии на силикагеле (элюенты: 0%, затем 10% и 20% этилацетата в гептане), с получением продукта в виде бесцветного масла. Выход: 1,77 г, 6,99 ммоль, 90%. ГХМС m/z 253,1 [M+]. 1H ЯМР (400 МГц, CDCl3) δ 5,02-4,98 (м, 1H), 4,95-4,91 (м, 1H), 4,37-4,33 (м, 2H), 3,60 (ддд, J=13, 5, 5 Гц, 2H), 3,34 (ддд, J=13,3, 9,9, 3,3 Гц, 2H), 2,42-2,38 (м, 2H), 1,70-1,63 (м, 2H), 1,55 (ддд, J=13,3, 10,0, 4,5 Гц, 2H), 1,46 (с, 9H).
Стадия 2. Синтез трет-бутил-3-(гидроксиметил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C9 ).
Смесь C8 (2,30 г, 9,08 ммоль) и 9-борабицикло[3.3.1]нонана (0,5 М раствор в тетрагидрофуране; 54,5 мл, 27,2 ммоль) перемешивали при 70°C в течение 15 ч. После охлаждения реакционной смеси добавляли воду (54,5 мл), затем 30% перекиси водорода (водная; 5,15 г, 45,4 ммоль) и перемешивание продолжали при 30°C в течение 15 ч. Окислитель гасили путем добавления насыщенного водного раствора сульфита натрия (~150 мл), пока результат тестирования смеси на крахмал не становился отрицательным на индикаторной бумаге с йодидом калия. Полученную смесь экстрагировали этилацетатом (2 × 100 мл) и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Очистка хроматографией на силикагеле (градиент: от 0% до 50% этилацетата в петролейном эфире) давала продукт в виде бесцветного масла. Выход: 1,75 г, 6,45 ммоль, 71%. ЖХМС m/z 216,1 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 МГц, CDCl3) δ 3,97 (дд, J=9,0, 7,5 Гц, 1H), 3,70-3,54 (м, 5H), 3,37-3,27 (м, 2H), 2,62-2,50 (м, 1H), 1,92 (дд, J=12,6, 8,5 Гц, 1H), 1,91-1,84 (м, 1H), 1,69-1,58 (м, 2H, предполагаемый; частично скрытый пиком воды), 1,53-1,39 (м, 3H), 1,46 (с, 9H).
Стадия 3. Синтез трет-бутил-3-({[(4-метилфенил)сульфонил]окси}метил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C10 ).
4-(Диметиламино)пиридин (1,08 г, 8,84 ммоль) добавляли к суспензии C9 (1,20 г, 4,42 ммоль) в дихлорметане (45 мл). Добавляли п-толуолсульфонилхлорид (927 мг, 4,86 ммоль) и реакционную смесь перемешивали при 30°С в течение 18 ч, после чего ее концентрировали под вакуумом и очищали хроматографией на силикагеле (градиент: от 0% до 30% этилацетата в петролейном эфире). Продукт объединяли с веществом, полученным по аналогичной реакции, проведенной на С9 (400 мг, 1,47 ммоль), с получением С10 в виде бесцветной смолы. Общий выход: 2,0 г, 4,7 ммоль, 80%. ЖХМС m/z 370,0 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,79 (ушир. д, J=8,5 Гц, 2H), 7,36 (ушир. д, J=8,0 Гц, 2H), 4,02-3,92 (м, 2H), 3,88 (дд, J=9,3, 7,3 Гц, 1H), 3,63-3,49 (м, 3H), 3,31-3,20 (м, 2H), 2,73-2,61 (м, 1H), 2,46 (с, 3H), 1,88 (дд, J=12,8, 8,8 Гц, 1H), 1,63-1,55 (м, 1H), 1,55-1,49 (м, 2H), 1,45 (с, 9H), 1,49-1,40 (м, 1H), 1,35 (дд, J=12,8, 7,3 Гц, 1H).
Стадия 4. Синтез трет-бутил-3-{[4-(трифторметил)-1H-пиразол-1-ил]метил}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C11 ).
Смесь 4-(трифторметил)-1H-пиразола (150 мг, 1,1 ммоль), C10 (516 мг, 1,21 ммоль) и карбоната цезия (1,08 г, 3,31 ммоль) в N,N-диметилформамиде (5 мл) перемешивали при 40°С в течение 15 ч, после чего реакционную смесь распределяли между этилацетатом (15 мл) и насыщенным водным раствором хлорида натрия (15 мл). Органический слой промывали насыщенным водным раствором хлорида натрия (2 × 15 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (градиент: от 0% до 30% этилацетата в петролейном эфире) с получением продукта (500 мг) в виде бесцветного масла. 1H ЯМР анализ показал, что это вещество содержало N,N-диметилформамид и этилацетат. Выход с поправкой на растворители: 420 мг, 1,08 ммоль, 98%. ЖХМС m/z 290,1 {[M - (2-метилпроп-1-ен и диоксид углерода)]+H}+. 1H ЯМР (400 МГц, CDCl3) δ 7,71 (с, 1H), 7,67 (с, 1H), 4,20-4,15 (м, 1H), 4,15-4,09 (м, 1H), 3,92 (дд, J=9,2, 7,0 Гц, 1H), 3,68-3,54 (ушир. м, 2H), 3,62 (дд, J=9,2, 6,2 Гц, 1H), 3,35-3,22 (м, 2H), 2,98-2,86 (м, 1H), 1,93 (дд, J=12,8, 8,4 Гц, 1H), 1,73-1,58 (м, 4H), 1,49-1,42 (м, 1H), 1,45 (с, 9H).
Стадия 5. Синтез 3-{[4-(трифторметил)-1H-пиразол-1-ил]метил}-1-окса-8-азаспиро[4.5]декана, трифторацетатной соли ( C12 ).
Трифторуксусную кислоту (1 мл) добавляли к 0°С раствору С11 (с предыдущей стадии; 420 мг, 1,08 ммоль) в дихлорметане (4 мл), и реакционную смесь перемешивали при 28°С в течение 2 ч. Концентрирование под вакуумом давало продукт в виде желтой смолы, которую непосредственно переносили на следующую стадию. ЖХМС m/z 289,9 [M+H]+.
Стадия 6. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-{[4-(трифторметил)-1H-пиразол-1-ил]метил}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 1 ( C13 ) и (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-{[4-(трифторметил)-1H-пиразол-1-ил]метил}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 2 ( C14 ).
Триэтиламин (334 мг, 3,30 ммоль) добавляли к 0°С раствору C12 (с предыдущей стадии; ≤1,08 ммоль) в ацетонитриле (3 мл). После перемешивания смеси при 0°С в течение нескольких минут по каплям добавляли С2 (реакционный раствор в ацетонитриле, содержащий 1,76 ммоль); перемешивание продолжали при 0°С в течение нескольких минут, и затем реакционную смесь оставляли перемешиваться при 28°С в течение 15 ч. Летучие компоненты удаляли путем концентрирования под вакуумом, и остаток очищали с использованием хроматографии на силикагеле (градиент: от 0% до 40% этилацетата в петролейном эфире) с получением смеси С13 и С14 в виде желтой смолы. Выход диастереомерной смеси: 483 мг, 0,854 ммоль, 79% за 2 стадии. ЖХМС m/z 588,1 [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 7,72 (с, 1H), 7,67 (с, 1H), 7,24 (ушир. д, J=8,5 Гц, 2H), 6,88 (ушир. д, J=8,5 Гц, 2H), 5,53-5,42 (м, 1H), 4,51 (AB квартет, сильнопольный дублет уширен, JAB=11,5 Гц, ΔνAB=28,4 Гц, 2H), 4,19-4,12 (м, 2H), 3,93 (дд, J=9,3, 6,8 Гц, 1H), 3,88-3,60 (м, 5H), 3,81 (с, 3H), 3,41-3,24 (м, 2H), 2,99-2,87 (м, 1H), 2,00-1,85 (м, 1H), 1,76-1,38 (м, 5H, предполагаемый; частично скрытый пиком воды).
Это вещество разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 85:15 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)], с получением C13, элюирующегося первым диастереомера, в виде бесцветной смолы. Выход: 200 мг, 0,354 ммоль, 41% для разделения. ЖХМС m/z 588,1 [M+Na+].
Соединение С14 представляло собой элюирующийся вторым диастереомер, выделенный в виде светло-желтой смолы. Выход: 211 мг, 0,373 ммоль, 44% для разделения. ЖХМС m/z 588,1 [M+Na+].
Стадия 7. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-{[4-(трифторметил)-1H-пиразол-1-ил]метил}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 1 [из C13 , DIАST 1] ( 3 ).
Трифторуксусную кислоту (1 мл) добавляли к 10°C раствору C13 (200 мг, 0,354 ммоль) в дихлорметане (4 мл) и реакционную смесь перемешивали при 30°C в течение 1 ч. Затем смесь промывали насыщенным водным раствором бикарбоната натрия (2 × 3 мл), концентрировали под вакуумом и очищали с помощью обращенно-фазовой ВЭЖХ (колонка: Agela Durashell, 5 мкм; подвижная фаза A: 0,225% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил; градиент: от 39% до 59% B), с получением продукта в виде бесцветной смолы. Выход: 43,7 мг, 98,1 мкмоль, 28%. ЖХМС m/z 446,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,72 (с, 1H), 7,67 (с, 1H), 5,30-5,20 (ушир. м, 1H), 4,16 (д, J=7,5 Гц, 2H), 4,00 (ушир. дд, половина АВХ картины, J=12,6, 3,0 Гц, 1H), 3,93 (дд, J=9,3, 6,8 Гц, 1H), 3,90-3,70 (ушир. м, 3H), 3,65 (дд, J=9,0, 6,5 Гц, 1H), 3,42-3,23 (м, 2H), 3,00-2,87 (м, 1H), 2,6-2,2 (оч. ушир. с, 1H), 1,95 (дд, J=12,8, 8,3 Гц, 1H), 1,76-1,52 (м, 4H, предполагаемый; частично скрытый пиком воды), 1,49 (дд, J=12,8, 7,8 Гц, 1H).
Стадия 8. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-{[4-(трифторметил)-1H-пиразол-1-ил]метил}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 2 [из C14 , DIАST 2] ( 4 ).
Превращение С14 в продукт осуществляли с использованием способа, использованного для синтеза 3 из С13, с получением продукта в виде бесцветной смолы. Выход: 37,7 мг, 84,6 мкмоль, 23%. ЖХМС m/z 446,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,72 (с, 1H), 7,67 (с, 1H), 5,31-5,19 (ушир. м, 1H), 4,16 (д, J=7,0 Гц, 2H), 4,04-3,73 (м, 5H), 3,64 (дд, J=9,0, 6,5 Гц, 1H), 3,45-3,26 (м, 2H), 3,00-2,87 (м, 1H), 2,5-2,2 (оч. ушир. с, 1H), 1,95 (дд, J=12,8, 8,3 Гц, 1H), 1,77-1,44 (м, 4H, предполагаемый; частично скрытый пиком воды), 1,50 (дд, J=12,6, 7,5 Гц, 1H).
Пример 5
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-(3R)-3-[(циклопентилкарбонил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат ( 5 )
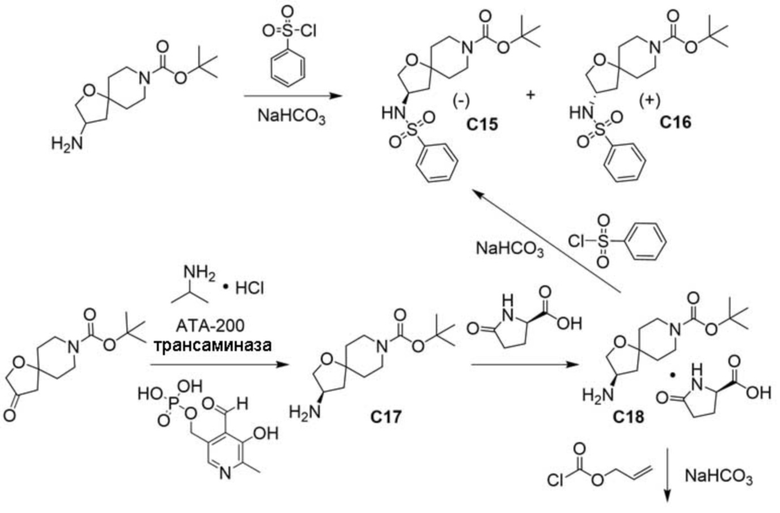
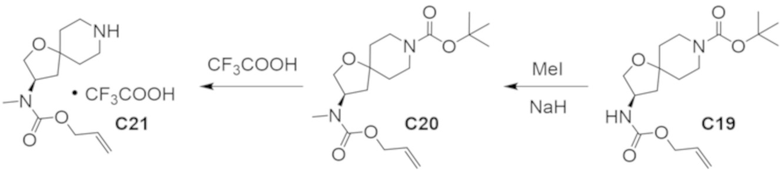
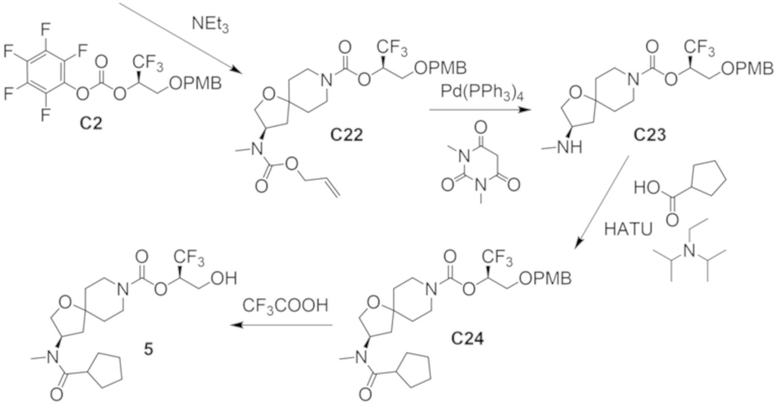
Стадия 1. Синтез трет-бутил-(3R)-3-[(фенилсульфонил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C15 ) и трет-бутил-(3S)-3-[(фенилсульфонил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C16 ).
Раствор трет-бутил-3-амино-1-окса-8-азаспиро[4.5]декан-8-карбоксилата (1,98 г, 7,72 ммоль) в дихлорметане (80 мл) обрабатывали насыщенным водным раствором бикарбоната натрия (20 мл). Бензолсульфонилхлорид (1,49 мл, 11,7 ммоль) добавляли по каплям, и реакционную смесь перемешивали в течение 23 ч при комнатной температуре. Водный слой экстрагировали дихлорметаном и объединенные органические слои промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Этот рацемический продукт очищали с помощью хроматографии на силикагеле (градиент: от 20% до 50% этилацетата в гептане) с получением белого твердого вещества (2,88 г), которое затем разделяли на его составляющие энантиомеры с помощью сверхкритической флюидной хроматографии [колонка: Phenomenex Lux Cellulose-3, 5 мкм; подвижная фаза: 7,5% (1:1 метанол/ацетонитрил) в диоксиде углерода]. Элюирующийся первым продукт, полученный в виде липкого белого твердого вещества, который продемонстрировал отрицательное (-) вращение, был обозначен как C15. Выход: 1,35 г, 3,40 ммоль, 45%. ЖХМС: m/z 395,5 (M-H)+. 1H ЯМР (400 МГц, CDCl3) δ 7,90-7,86 (м, 2H), 7,64-7,59 (м, 1H), 7,57-7,52 (м, 2H), 4,81 (д, J=7,9 Гц, 1H), 4,00-3,91 (м, 1H), 3,81 (дд, J=9,7, 5,7 Гц, 1H), 3,59-3,48 (м, 3H), 3,30-3,19 (м, 2H), 1,97 (дд, J=13,4, 7,7 Гц, 1H), 1,67-1,49 (м, 4H), 1,48-1,38 (м, 1H), 1,44 (с, 9H).
Элюирующийся вторым продукт, полученный в виде липкого белого твердого вещества, который продемонстрировал положительное (+) вращение, был обозначен как C16. Выход: 1,15 г, 2,90 ммоль, 38%. ЖХМС: m/z 395,5 (M-H)+. 1H ЯМР (400 МГц, CDCl3) δ 7,90-7,86 (м, 2H), 7,64-7,59 (м, 1H), 7,57-7,52 (м, 2H), 4,79 (д, J=8,0 Гц, 1H), 4,00-3,91 (м, 1H), 3,81 (дд, J=9,7, 5,7 Гц, 1H), 3,59-3,48 (м, 3H), 3,30-3,19 (м, 2H), 1,97 (дд, J=13,4, 7,7 Гц, 1H), 1,67-1,49 (м, 4H), 1,47-1,38 (м, 1H), 1,44 (с, 9H).
Показанные абсолютные конфигурации были установлены следующим образом: часть этой партии С15 была перекристаллизована из смеси дихлорметан/простой трет-бутилметиловый эфир, и абсолютная конфигурация соединения была определена с помощью монокристальной рентгеновской дифрактометрии:
Монокристальное рентгеноструктурное определение С15
Монокристальная рентгеновская дифрактометрия
Сбор данных проводили на дифрактометре Bruker APEX при комнатной температуре. Сбор данных состоял из омега- и фи- сканирований.
Структуру определяли прямыми способами, с использованием программного комплекса SHELX в пространственной группе P212121. Структура была впоследствии уточнена полноматричным методом наименьших квадратов. Все неводородные атомы находили и уточняли с использованием параметров анизотропного смещения.
Атом водорода, расположенный у азота, был найден по разностной карте Фурье и уточнен с ограничением расстояний. Оставшиеся атомы водорода помещали в расчетные положения и позволяли им перемещаться на своих атомах-носителях. Конечное уточнение включало параметры изотропного смещения для всех атомов водорода.
Анализ абсолютной структуры с использованием методов правдоподобия (Hooft, 2008) проводили с использованием PLATON (Spek, 2010). Результаты показывают, что абсолютная структура была правильно определена. Метод вычисляет, что вероятность того, что структура является правильной, равна 100,0. Параметр Хуфта определяется как 0,015 с esd 0,09.
Конечный R-фактор составлял 4,2%. Конечная разностная карта Фурье не показала отсутствующей или неверно установленной электронной плотности.
Соответствующая информация о кристалле, сборе данных и уточнении приведена в таблице 1. Атомные координаты, длины связей, углы связей и параметры смещения приведены в таблицах 2-5.
Программное обеспечение и ссылки на источники
SHELXTL, версия 5.1, Bruker AXS, 1997.
PLATON, A. L. Spek, J. Appl. Cryst. 2003, 36, 7-13.
MERCURY, C. F. Macrae, P. R. Edington, P. McCabe, E. Pidcock, G. P. Shields, R. Taylor, M. Towler, J. van de Streek, J. Appl. Cryst. 2006, 39, 453-457.
OLEX2, O. V. Dolomanov, L. J. Bourhis, R. J. Gildea, J. A. K. Howard, H. Puschmann, J. Appl. Cryst. 2009, 42, 339-341.
R. W. W. Hooft, L. H. Straver, and A. L. Spek, J. Appl. Cryst. 2008, 41, 96-103.
H. D. Flack, Acta Cryst. 1983, A39, 867-881.
Таблица 1. Данные кристалла и уточнение структуры для C15.
Таблица 2. Атомные координаты (× 104) и эквивалентные параметры изотропного смещения (Å2× 103) для C15. U(eq) представляет собой 1/3 следа ортогонализированного тензора Uij.
Таблица 3. Длины [Å] и углы [°] связей для C15.
Преобразования симметрии использовали для формирования эквивалентных атомов.
Таблица 4. Параметры анизотропного смещения (Å2×103) для C15. Показатель коэффициента анизотропного смещения принимает вид: -2π2[h2 a*2U11 +...+2 h k a* b* U12].
Таблица 5. Координаты атомов водорода (× 104) и параметры изотропного смещения (Å2×103) для C15.
Стадия 2. Синтез трет-бутил-(3R)-3-амино-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C17 ).
Готовили буферный раствор с рН 8,0, содержащий 0,1 М водного фосфата калия и 2 мМ хлорида магния. Исходный раствор субстрата готовили следующим образом: трет-бутил-3-оксо-1-окса-8-азаспиро[4.5]декан-8-карбоксилат (18,0 г, 70,5 ммоль) растворяли в воде, содержащей 4% диметилсульфоксида (14,4 мл). Для растворения требовались нагревание и перемешивание, и полученный раствор выдерживали при 40°С.
Пропан-2-амин, гидрохлоридную соль (16,8 г, 176 ммоль) добавляли к смеси моногидрата пиридоксаль-5′-фосфата (1,87 г, 7,05 ммоль) и буфера с pH 8.0 (300 мл). Полученный рН составлял приблизительно 6,5; рН доводили до 8 добавлением водного раствора гидроксида калия (6 М; приблизительно 4 мл). Исходный раствор субстрата добавляли с помощью шприца порциями по 5 мл, в результате чего получали суспензию, все еще с pH 8. Codex® ATA-200 трансаминазу (партия 899; 1,4 г) почти полностью растворяли в буфере с рН 8 (20 мл) и вливали в реакционную смесь. Дополнительный буфер с pH 8 (25,6 мл) использовали для обеспечения полного переноса фермента. Реакционную смесь перемешивали при 35°С с помощью азотной струи (32 мл/мин) через иглу, расположенную примерно на 0,5 см выше реакционной поверхности. Из-за трудностей при перемешивании через 3 ч применяли вакуум (220 Торр, 300 мбар (0,03 МПа)) для удаления ацетона, образующегося в результате реакции трансаминирования. Суспендированные твердые вещества дробили вручную, что улучшало перемешивание реакционной смеси. Через 26 ч реакционной смеси давали остыть до комнатной температуры и добавляли водный раствор соляной кислоты (6 М, 5 мл), чтобы довести рН от 8 до 6,5. После добавления этилацетата (200 мл) смесь энергично перемешивали в течение 5 мин и затем фильтровали через диатомовую землю (43 г; этот вспомогательный фильтрующий материал суспендировали в воде перед введением в фильтровальную воронку. Затем воду удаляли с получением сильно уплотненного слоя. Фильтрующий слой промывали последовательно водой (120 мл) и этилацетатом (100 мл), и водный слой объединенных фильтратов доводили до рН 9-9,5 водным раствором гидроксида калия (6 М; приблизительно 10 мл). Водный слой затем обрабатывали дихлорметаном (200 мл) и полученную смесь энергично перемешивали в течение 5 мин, после чего фильтровали через слой диатомовой земли. Фильтрующий слой промывали дихлорметаном (100 мл) и водный слой объединенных фильтратов дважды экстрагировали дихлорметаном, таким же образом, как описано выше, с доведением рН до 9-10 (на что требуется приблизительно 2 мл 6 М водного раствора гидроксида калия в обоих случаях). Все экстракты дихлорметана объединяли и сушили над сульфатом натрия при интенсивном перемешивании. Фильтрование и концентрирование под вакуумом давали продукт в виде маслянистого желтого твердого вещества (14,76 г). Четвертую экстракцию проводили таким же образом, но в этом случае водный слой доводили до рН> 10. Продукт, полученный в результате этой экстракции, представлял собой белое твердое вещество (1,9 г). Общий выход: 16,61 г, 64,79 ммоль, 92%. 1H ЯМР (500 МГц, CDCl3) δ 3,95 (дд, J=9,0, 5,6 Гц, 1H), 3,69-3,63 (м, 1H), 3,62-3,52 (м, 3H), 3,38-3,27 (м, 2H), 2,6-2,2 (оч. ушир. с, 2H), 2,07 (дд, J=13,0, 7,6 Гц, 1H), 1,78-1,71 (м, 1H), 1,69-1,56 (м, 2H), 1,55-1,47 (м, 2H), 1,45 (с, 9H).
Стадия 3. Синтез трет-бутил-(3R)-3-амино-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, соли (2R)-5-оксопирролидин-2-карбоксилата ( C18 ).
Раствор C17 (16,61 г, 64,79 ммоль) в этаноле (400 мл) нагревали до 63°С и порциями обрабатывали (2R)-5-оксопирролидин-2-карбоновой кислотой (7,78 г, 60,3 ммоль). Затем реакционную смесь удаляли из нагревательной бани и оставляли охлаждаться в течение ночи. Смесь охлаждали до 12°С на ледяной бане и фильтровали. Собранные твердые вещества промывали холодным этанолом (2 × 50 мл) и затем простым диэтиловым эфиром (100 мл), получая продукт в виде твердого вещества бледно-желтого цвета (19,2 г). Объединенные фильтраты концентрировали под вакуумом с удалением приблизительно 400 мл растворителей. На внутренней поверхности колбы образовывалась тонкая линия твердого вещества. Его переводили обратно в оставшиеся растворители взбалтыванием; добавляли простой диэтиловый эфир (100 мл) и смесь охлаждали на ледяной бане при перемешивании. Примерно через 15 мин смесь фильтровали и собранные твердые вещества промывали простым диэтиловым эфиром (100 мл), получая дополнительный продукт в виде желтого твердого вещества (1,5 г). Общий выход: 20,7 г, 53,7 ммоль, 89%. 1H ЯМР (500 МГц, D2O) δ 4,16 (дд, J=8,9, 5,9 Гц, 1H), 4,11 (дд, половина АВХ картины, J=10,4, 5,8 Гц, 1H), 4,09-4,03 (м, 1H), 3,93 (дд, J=10,3, 3,1 Гц, 1H), 3,61-3,46 (м, 2H), 3,46-3,30 (м, 2H), 2,53-2,36 (м, 4H), 2,06-1,97 (м, 1H), 1,85 (дд, J=14,1, 4,6 Гц, 1H), 1,82-1,72 (м, 2H), 1,72-1,65 (м, 1H), 1,59 (ддд, половина АВХY картины, J=18, 9, 4,5 Гц, 1H), 1,43 (с, 9H).
Превращение С18 в С15 для подтверждения абсолютной стереохимии
Небольшой образец С18 дериватизировали реакцией с бензолсульфонилхлоридом и насыщенным водным раствором бикарбоната натрия в течение 1 ч при 40°С. Реакционную смесь экстрагировали этилацетатом и растворитель удаляли из экстракта в токе азота. Сверхкритический флюидный хроматографический анализ (колонка: Chiral Technologies Chiralcel OJ-H, 5 мкм; подвижная фаза A: диоксид углерода; подвижная фаза B: метанол; градиент: от 5% до 60% B), показал, что продукт имеет энантиомерный избыток >99%. Инъекция в тех же условиях образцов С15 и С16 приводила к получению продукта дериватизации, который идентичен С15, абсолютная конфигурация которого была определена с помощью рентгеноструктурного анализа (см. выше).
Стадия 4. Синтез трет-бутил-(3R)-3-{[(проп-2-ен-1-илoкси)карбонил]амино}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C19 ).
Проп-2-ен-1-илкарбонохлоридат (7,13 г, 59,2 ммоль) добавляли по каплям к 0°С раствору C18 (15,2 г, 39,4 ммоль) в насыщенном водном растворе бикарбоната натрия (160 мл) и тетрагидрофурана (40 мл). Реакционную смесь перемешивали при 10°C в течение 14 ч, после чего экстрагировали этилацетатом (3 × 100 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением продукта в виде бледно-желтой смолы (13,6 г). Это вещество использовали непосредственно на следующей стадии. 1H ЯМР (400 МГц, CDCl3) δ 5,98-5,85 (м, 1H), 5,31 (видимый ушир. дд, J=17,2, 1,4 Гц, 1H), 5,23 (ушир. д, J=10,3 Гц, 1H), 4,95-4,84 (м, 1H), 4,62-4,51 (м, 2H), 4,39-4,27 (м, 1H), 4,00 (дд, J=9,4, 5,6 Гц, 1H), 3,73-3,52 (м, 3H), 3,38-3,24 (м, 2H), 2,13 (дд, J=13,3, 7,8 Гц, 1H), 1,74-1,57 (м, 4H, предполагаемый; частично скрытый пиком воды), 1,56-1,46 (м, 1H), 1,46 (с, 9H).
Стадия 5. Синтез трет-бутил-(3R)-3-{метил[(проп-2-ен-1-илoкси)карбонил]амино}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C20 ).
Гидрид натрия (60% дисперсия в минеральном масле; 2,36 г, 59,0 ммоль) добавляли к 0°С раствора C19 (с предыдущей стадии; 13,4 г, ≤38,8 ммоль) в тетрагидрофуране (200 мл), и реакционную смесь перемешивали при 0°С в течение 30 мин. По каплям добавляли йодметан (16,8 г, 118 ммоль) и перемешивание продолжали в течение 16 ч при температуре 0-5 °С. Снова добавляли гидрид натрия (60% дисперсия в минеральном масле; 2,36 г, 59,0 ммоль) и реакционную смесь перемешивали при 25°С в течение 16 ч, после чего реакционную смесь выливали в насыщенный водный раствор хлорида аммония (200 мл) и экстрагировали этилацетатом (3×300 мл). Объединенные органические слои промывали насыщенным водным раствором хлорида натрия (600 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением продукта в виде коричневой смолы (16 г). Это вещество использовали на следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, CDCl3) δ 5,99-5,89 (м, 1H), 5,34-5,27 (м, 1H), 5,24-5,19 (м, 1H), 5,09-4,85 (ушир. м, 1H), 4,59 (ддд, J=5,5, 1,5, 1,4 Гц, 2H), 3,94 (дд, половина АВХ картины, J=9,7, 7,6 Гц, 1H), 3,76 (дд, половина АВХ картины, J=9,9, 5,4 Гц, 1H), 3,69-3,52 (м, 2H), 3,38-3,23 (м, 2H), 2,87 (с, 3H), 2,09 (дд, J=13,1, 9,0 Гц, 1H), 1,75-1,60 (м, 4H, предполагаемый; частично скрытый пиком воды), 1,51-1,41 (м, 1H), 1,46 (с, 9H).
Стадия 6. Синтез проп-2-ен-1-илметил[(3R)-1-окса-8-азаспиро[4.5]дец-3-ил]карбамата, трифторацетатной соли ( C21 ).
Трифторуксусную кислоту (20 мл) добавляли к раствору C20 (с предыдущей стадии; 16 г, ≤38,8 ммоль) в дихлорметане (100 мл), и реакционную смесь перемешивали при 15°С в течение 2 ч. Удаление летучих веществ под вакуумом давало продукт в виде коричневой смолы (20 г). Это вещество использовали непосредственно на следующей стадии. ЖХМС m/z 255,2 [M+H]+.
Стадия 7. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3R)-3-{метил[(проп-2-ен-1-илoкси)карбонил]амино}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C22 ).
Триэтиламин (19,9 г, 197 ммоль) медленно добавляли к 0°С раствору C21 (с предыдущей стадии; 20 г, ≤38,8 ммоль) в ацетонитриле (250 мл). Реакционную смесь перемешивали при 0°C в течение 30 мин, после чего добавляли C2 [реакционный раствор в ацетонитриле (80 мл), содержащий 40 ммоль], и перемешивание продолжали при 13°C в течение 18 ч. Реакционную смесь концентрировали под вакуумом, и остаток очищали хроматографией на силикагеле (градиент: от 9% до 50% этилацетата в петролейном эфире) с получением продукта в виде бледно-желтой смолы. Выход: 16,67 г, 31,4 ммоль, 81% за 4 стадии. ЖХМС m/z 553,1 [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 7,24 (ушир. д, J=8,8 Гц, 2H), 6,88 (ушир. д, J=8,8 Гц, 2H), 6,01-5,89 (м, 1H), 5,53-5,43 (м, 1H), 5,35-5,27 (м, 1H), 5,26-5,20 (м, 1H), 5,08-4,86 (ушир. м, 1H), 4,60 (ддд, J=5,5, 1,5, 1,2 Гц, 2H), 4,51 (AB квартет, JAB=11,5 Гц, ΔνAB=28,3 Гц, 2H), 3,94 (дд, J=9,8, 7,5 Гц, 1H), 3,81 (с, 3H), 3,80-3,64 (м, 5H), 3,43-3,25 (м, 2H), 2,88 (с, 3H), 2,13-2,00 (м, 1H), 1,80-1,60 (м, 4H), 1,47 (ддд, J=13,6, 10,8, 4,3 Гц, 1H).
Стадия 8. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3R)-3-(метиламино)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C23 ).
Тетракис(трифенилфосфин)палладий(0) (2,12 г, 1,83 ммоль) добавляли к 10°С раствору C22 (6,50 г, 12,2 ммоль) и 1,3-диметилпиримидин-2,4,6(1H,3H,5H)-триона (2,87 г, 18,4 ммоль) в тетрагидрофуране (100 мл). После перемешивания реакционной смеси при 25°С в течение 2 ч добавляли твердый карбонат натрия (65 мг, 0,61 ммоль) и перемешивание продолжали при 10°С в течение 20 мин. Реакционную смесь фильтровали и фильтрат концентрировали под вакуумом. Остаток дважды очищали хроматографией на силикагеле (градиент: 0-10% метанола в дихлорметане) с получением продукта в виде желтой смолы. Выход: 3,8 г, 8,5 ммоль, 70%. ЖХМС m/z 447,3 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,24 (ушир. д, J=8,7 Гц, 2H), 6,88 (ушир. д, J=8,7 Гц, 2H), 5,53-5,42 (м, 1H), 4,51 (AB квартет, JAB=11,6 Гц, ΔνAB=28,0 Гц, 2H), 3,96 (дд, J=9,2, 6,0 Гц, 1H), 3,81 (с, 3H), 3,8-3,64 (м, 5H), 3,43-3,28 (м, 3H), 2,43 (с, 3H), 2,08-1,97 (м, 1H), 1,85-1,46 (м, 5H, предполагаемый; частично скрытый пиком воды).
Стадия 9. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3R)-3-[(циклопентилкарбонил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C24 ).
К 18°С суспензии C23 (110 мг, 0,246 ммоль) в дихлорметане (1 мл) добавляли циклопентанкарбоновую кислоту (33,7 мг, 0,295 ммоль), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU; 281 мг, 0,739 ммоль) и N,N-диизопропилэтиламин (159 мг, 1,23 ммоль). Реакционную смесь перемешивали при 18°C в течение 2 ч, после чего ее объединяли с аналогичной реакционной смесью, полученной из C23 (20 мг, 45 мкмоль), концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле (градиент: от 0% до 80% этилацетата в петролейном эфире). Продукт выделяли в виде бесцветной смолы. Выход: 158 мг, 0,291 ммоль, 100%. ЖХМС m/z 565,1 [M+Na+].
Стадия 10. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-[(циклопентилкарбонил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( 5 ).
Трифторуксусную кислоту (3 мл) добавляли по каплям к 0°С раствору С24 (158 мг, 0,291 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при 18°С в течение 2 ч, после чего ее разбавляли насыщенным водным раствором хлорида натрия и экстрагировали дихлорметаном (3 × 15 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Очистка с помощью обращенно-фазовой ВЭЖХ (колонка: YMC-Actus Triart C18, 5 мкм; подвижная фаза A: вода, содержащая 0,225% муравьиной кислоты; подвижная фаза B: ацетонитрил; градиент: от 40% до 60% B) давала продукт в виде белой смолы. 1Н ЯМР с переменной температурой (ДМСО-d6, 80°С) использовали для установления того, что продукт существует в виде смеси ротамеров. Выход: 45,1 мг, 0,107 ммоль, 37%. ЖХМС m/z 423,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ [5,47-5,36 (м) и 4,82-4,71 (м), совокупный 1H], 5,31-5,19 (ушир. м, 1H), 4,02-3,89 (м, 2H), 3,89-3,67 (м, 4H), 3,47-3,25 (м, 2H), [2,98 (с) и 2,85 (с), совокупный 3H], 2,96-2,79 (м, 1H), [2,16-2,02 (м), 1,88-1,67 (м), и 1,64-1,41 (м), совокупный 14H].
Пример 6
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-(3R)-3-[(трет-бутилсульфонил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат ( 6 )
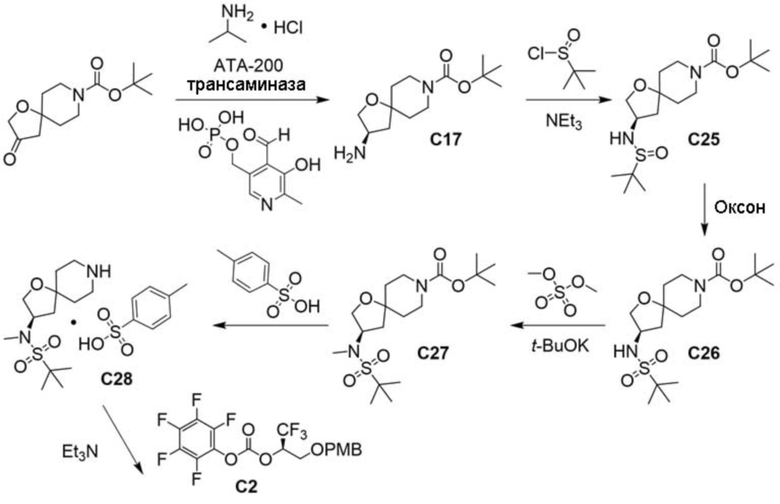
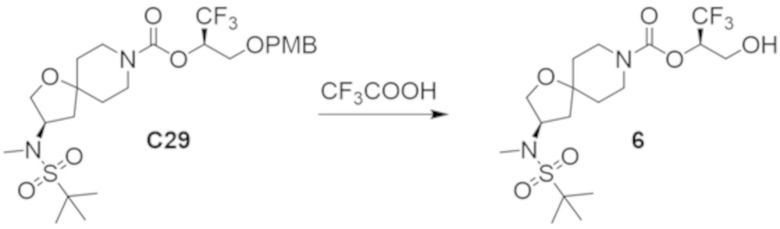
Стадия 1. Усовершенствованный синтез трет-бутил-(3R)-3-амино-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C17 ).
Готовили буферный раствор с рН 8,0, содержащий 0,1 М водного фосфата калия. Исходный раствор субстрата готовили следующим образом: трет-бутил-3-оксо-1-окса-8-азаспиро[4.5]декан-8-карбоксилат (4,00 г, 15,7 ммоль) растворяли в диметилсульфоксиде (4 мл); для растворения требовалось некоторое нагревание.
Водный раствор пропан-2-амина, гидрохлоридной соли (4,0 М; 9,80 мл, 39,2 ммоль) объединяли с калий-фосфатным буфером (63,8 мл). Затем медленно добавляли раствор субстрата, в течение 2 мин. После перемешивания этой смеси в течение ночи добавляли Codex® ATA-200 трансаминазу (партия D11099; 320 мг) и моногидрат пиридоксаль-5'-фосфата (40 мг, 0,16 ммоль) и реакционную смесь перемешивали в течение 24 ч при 35°С с помощью азотной струи (50 мл/мин) через иглу, расположенную над реакционной поверхностью. Затем рН доводили до 3,2 добавлением водной соляной кислоты (12 М, приблизительно 500 мкл) и полученную смесь обрабатывали с помощью диатомовой земли (2,6 г) и этилацетата (50 мл) и перемешивали в течение 30 мин. Смесь фильтровали через слой диатомовой земли (предварительно увлажненной 1,3 г воды), и рН водного слоя фильтрата доводили до 10,2 путем добавления водного раствора гидроксида натрия (25%; приблизительно 3,5 мл). Эту смесь многократно экстрагировали простым трет-бутилметиловым эфиром (50 мл), причем водный слой повторно доводили до pH 10,2 между экстракциями. После 4 экстракций органические слои объединяли, сушили над сульфатом натрия и фильтровали. {Растворы этого типа, либо в простом трет-бутилметиловом эфире, либо в 2-метилтетрагидрофуране, обычно использовались непосредственно в последующих реакциях; концентрацию С17 определяли путем удаления растворителя из определенного объема раствора и определения массы остатка.} Концентрирование под вакуумом давало продукт в виде белого твердого вещества. Выход: 1,85 г, 7,22 ммоль, 46%. 1H ЯМР (400 МГц, CDCl3) δ 3,94 (дд, J=8,8, 5,7 Гц, 1H), 3,67-3,51 (м, 3H), 3,49 (дд, J=8,8, 5,3 Гц, 1H), 3,39-3,26 (м, 2H), 2,06 (дд, J=12,9, 7,4 Гц, 1H), 1,77-1,42 (м, 5H), 1,45 (с, 9H).
Стадия 2. Синтез трет-бутил-(3R)-3-[(трет-бутилсульфинил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C25 ).
Раствор С17 в 2-метилтетрагидрофуране (134 мг/мл; 7,5 мл, 1,0 г, 3,9 ммоль) охлаждали до 0°С и обрабатывали 2-метилпропан-2-сульфинилхлоридом (0,48 мл, 3,9 ммоль). После перемешивания смеси при 0°С в течение 1 мин добавляли триэтиламин (0,54 мл, 3,9 ммоль) и перемешивание продолжали при 0°С в течение 5 мин. Затем реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1 ч, после чего ее фильтровали через слой диатомовой земли, и слой промывали 2-метилтетрагидрофураном. Объединенные фильтраты концентрировали под вакуумом и очищали хроматографией на силикагеле (градиент: 50-100% этилацетата в гептане), с получением продукта в виде твердой белой пены. На основе 1H ЯМР анализа это вещество предположительно существует в виде смеси диастереомеров вследствие стереохимии у сульфинамида. Выход: 1,26 г, 3,49 ммоль, 89%. ЖХМС m/z 361,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 4,11-3,99 (м, 2H), 3,77-3,69 (м, 1H), 3,68-3,52 (ушир. м, 2H), [3,38-3,25 (м) и 3,18 (д, J=5,8 Гц), совокупный 3H], [2,21 (дд, J=13,1, 7,2 Гц) и 2,15-2,06 (м), совокупный 1H], 1,81-1,48 (м, 5H, предполагаемый; частично скрытый пиком воды), 1,46 (с, 9H), [1,22 (с) и 1,22 (с), совокупный 9H].
Стадия 3. Синтез трет-бутил-(3R)-3-[(трет-бутилсульфонил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C26 ).
Раствор пероксимоносульфата калия (Oxone®, 98%; 4,35 г, 6,93 ммоль) в воде (18 мл) добавляли по каплям в течение 5 мин к 0°C раствору С25 (1,25 г, 3,47 ммоль) в метаноле (18 мл). Реакционную смесь перемешивали при 0°С в течение 1 мин и затем давали нагреться до комнатной температуры и перемешивали в течение 17 ч. Затем ее охлаждали до 0°С и медленно подщелачивали путем добавления насыщенного водного раствора бикарбоната натрия. Полученную смесь трижды экстрагировали дихлорметаном и объединенные органические слои промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом, с получением продукта в виде белого твердого вещества. Выход: 1,16 г, 3,08 ммоль, 89%. ЖХМС: m/z 375,6 (M-H)+. 1H ЯМР (400 МГц, CDCl3) δ 4,17-4,08 (м, 1H), 4,06-3,99 (м, 2H), 3,70 (дд, J=9,4, 4,7 Гц, 1H), 3,68-3,54 (ушир. м, 2H), 3,38-3,25 (м, 2H), 2,20 (дд, J=13,5, 7,6 Гц, 1H), 1,75-1,46 (м, 5H, предполагаемый; частично скрытый пиком воды), 1,46 (с, 9H), 1,40 (с, 9H).
Стадия 4. Синтез трет-бутил-(3R)-3-[(трет-бутилсульфонил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C27 ).
Трет-бутоксид калия (1 М раствор в тетрагидрофуране; 4,58 мл, 4,58 ммоль) добавляли по каплям к 0°C раствору C26 (1,15 г, 3,05 ммоль) в тетрагидрофуране (25 мл). Перемешивание продолжали при 0°С в течение 30 мин, после чего к реакционной смеси по каплям добавляли диметилсульфат (867 мкл, 9,16 ммоль), затем давали нагреться до комнатной температуры и перемешивали в течение 2 ч. Затем реакционную смесь охлаждали до 0°С, гасили добавлением насыщенного водного раствора хлорида аммония и трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток перемешивали в гептане (100 мл) в течение 1 ч и фильтровали; собранное твердое вещество промывали гептаном с получением продукта в виде белого твердого вещества (988 мг). Фильтрат концентрировали под вакуумом с получением дополнительного продукта в виде белого твердого вещества (138 мг). Общий выход: 1,126 г, 2,883 ммоль, 94%. ЖХМС m/z 291,5 {[M - (2-метилпроп-1-ен и диоксид углерода)]+H}+. 1H ЯМР (400 МГц, CDCl3) δ 4,71-4,61 (м, 1H), 3,96 (дд, половина АВХ картины, J=10,0, 7,6 Гц, 1H), 3,83 (дд, половина АВХ картины, J=10,0, 5,3 Гц, 1H), 3,70-3,52 (ушир. м, 2H), 3,38-3,21 (м, 2H), 2,91 (с, 3H), 2,10 (дд, половина АВХ картины, J=13,3, 9,4 Гц, 1H), 1,77 (дд, половина АВХ картины, J=13,5, 7,2 Гц, 1H), 1,74-1,60 (м, 3H), 1,50-1,40 (м, 1H), 1,46 (с, 9H), 1,37 (с, 9H).
Стадия 5. Синтез N,2-диметил-N-[(3R)-1-окса-8-азаспиро[4.5]дец-3-ил]пропан-2-сульфонамида, п-толуолсульфонатной соли ( C28 ).
К раствору C27 (1,12 г, 2,87 ммоль) в этилацетате (25 мл) добавляли моногидрат п-толуолсульфоновой кислоты (1,09 г, 5,73 ммоль) и реакционную смесь перемешивали при 50°С в течение 1,5 ч. Затем ее охлаждали до 0°С; твердые вещества собирали фильтрованием и промывали холодным этилацетатом, получая продукт в виде белого твердого вещества. Выход: 1,07 г, 2,31 ммоль, 80%. ЖХМС m/z 291,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,97-8,83 (ушир. м, 1H), 8,64-8,49 (ушир. м, 1H), 7,74 (ушир. д, J=8,2 Гц, 2H), 7,23 (ушир. д, J=7,8 Гц, 2H), 4,68-4,57 (м, 1H), 3,89 (дд, половина АВХ картины, J=10,2, 7,4 Гц, 1H), 3,78 (дд, половина АВХ картины, J=10,0, 5,6 Гц, 1H), 3,41-3,07 (м, 4H), 2,86 (с, 3H), 2,39 (с, 3H), 2,19-2,08 (м, 1H), 2,05 (дд, половина АВХ картины, J=13,5, 9,2 Гц, 1H), 1,90-1,73 (м, 4H), 1,35 (с, 9H).
Стадия 6. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3R)-3-[(трет-бутилсульфонил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C29 ).
Превращение C28 в C29 проводили с использованием способа, описанного для синтеза C5 из C4 в примере 1. В этом случае хроматографию на силикагеле проводили с использованием элюентов 20%, затем 40% и 60% этилацетата в гептане, получая продукт в виде густого бесцветного масла. Выход: 974 мг, 1,72 ммоль, 91%. 1H ЯМР (400 МГц, CDCl3) δ 7,24 (ушир. д, J=8,6 Гц, 2H), 6,88 (ушир. д, J=8,6 Гц, 2H), 5,54-5,42 (ушир. м, 1H), 4,72-4,61 (м, 1H), 4,51 (AB квартет, JAB=11,7 Гц, ΔνAB=28,1 Гц, 2H), 3,96 (дд, половина АВХ картины, J=10,2, 7,4 Гц, 1H), 3,90-3,64 (м, 5H), 3,82 (с, 3H), 3,43-3,24 (м, 2H), 2,91 (с, 3H), 2,14-1,99 (м, 1H), 1,86-1,62 (м, 4H), 1,45 (ддд, J=13,7, 10,9, 4,3 Гц, 1H), 1,37 (с, 9H).
Стадия 7. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-[(трет-бутилсульфонил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( 6 ).
Трифторуксусную кислоту (5,0 мл) добавляли по каплям к 0°С раствору С29 (972 мг, 1,72 ммоль) в дихлорметане (20 мл). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 70 мин, после чего ее концентрировали под вакуумом и остаток распределяли между дихлорметаном и насыщенным водным раствором бикарбоната натрия. Водный слой экстрагировали дважды дихлорметаном и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Хроматография на силикагеле (элюенты: 10%, затем 25%, 50% и 75% этилацетата в гептане) давала продукт в виде белого твердого вещества. Выход: 697 мг, 1,56 ммоль, 91%. ЖХМС m/z 447,6 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 5,31-5,20 (ушир. м, 1H), 4,72-4,63 (м, 1H), 4,04-3,92 (м, 2H), 3,92-3,72 (м, 4H), 3,47-3,27 (м, 2H), 2,91 (с, 3H), 2,16-2,05 (м, 1H), 1,86-1,42 (м, 6H, предполагаемый; частично скрытый пиком воды), 1,38 (с, 9H).
Пример 7
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-(3R)-3-[(2,2-диметилпропанoил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат (7)
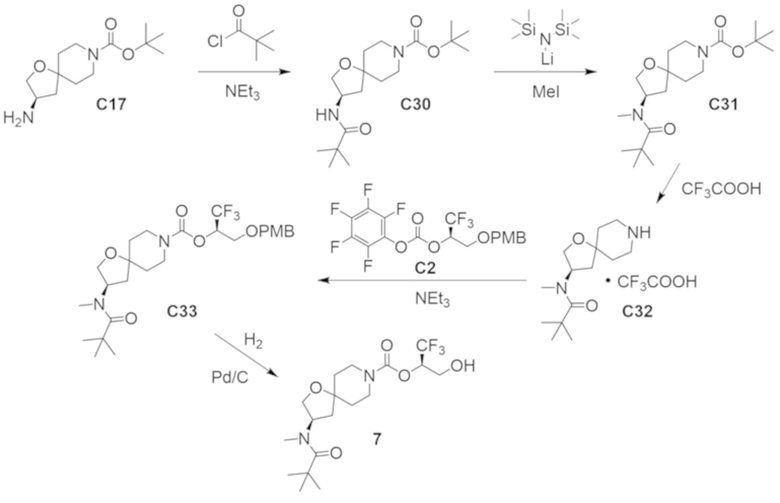
Стадия 1. Синтез трет-бутил-(3R)-3-[(2,2-диметилпропанoил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C30 ).
Раствор C17 в 2-метилтетрагидрофуране (428 мг/мл; 114 мл, 48,8 г, 190 ммоль) разбавляли 2-метилтетрагидрофураном (250 мл), охлаждали до 0°C и обрабатывали триэтиламином (31,8 мл, 228 ммоль), затем 2,2-диметилпропаноилхлоридом (25,0 мл, 203 ммоль). После перемешивания реакционной смеси при 0°С в течение 30 мин ей позволяли медленно нагреться до комнатной температуры и перемешивали в течение 75 мин. Затем ее фильтровали через слой диатомовой земли, который затем промывали 2-метилтетрагидрофураном (500 мл). Объединенные фильтраты концентрировали под вакуумом и подвергали двухкратному растиранию с простым диэтиловым эфиром, получая продукт в виде твердого вещества. Выход: 65 г, 190 ммоль, количественно. ЖХМС m/z 341,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 5,78 (ушир. д, J=7,0 Гц, 1H), 4,55-4,46 (м, 1H), 4,02 (дд, J=9,8, 5,5 Гц, 1H), 3,65 (ушир. дд, J=9,8, 3,5 Гц, 1H), 3,65-3,55 (м, 2H), 3,38-3,27 (м, 2H), 2,16 (дд, J=13,3, 7,4 Гц, 1H), 1,7-1,58 (м, 4H, предполагаемый; частично скрытый пиком воды), 1,56-1,47 (м, 1H), 1,46 (с, 9H), 1,19 (с, 9H).
Стадия 2. Синтез трет-бутил-(3R)-3-[(2,2-диметилпропанoил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C31 ).
0°C раствор бис(триметилсилил)амида лития (1,5 М; 253 мл, 380 ммоль) добавляли через канюлю к 0°C раствору C30 (65 г, 190 ммоль) в тетрагидрофуране (1 л). Реакционную смесь перемешивали при 0°С в течение 1,5 ч, после чего добавляли йодметан (41,4 мл, 665 ммоль) и реакционную смесь оставляли перемешиваться при комнатной температуре в течение 3 ч. Затем ее распределяли между насыщенным водным раствором хлорида аммония (400 мл) и этилацетатом (250 мл) и водный слой дважды экстрагировали этилацетатом (общий объем 2,5 л). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали под вакуумом. Полученный смолистый материал делили пополам для обработки; каждую половину смешивали с простым диэтиловым эфиром (600 мл), затем с гептаном (200 мл), и колбу взбалтывали вращательным движением до тех пор, пока твердые частицы не прилипали к сторонам колбы. Супернатант фильтровали через небольшой слой из диатомовой земли, и фильтрат концентрировали под вакуумом с получением продукта в виде светло-желтого твердого вещества. Суммарный выход: 37 г, 100 ммоль, 53%. ЖХМС m/z 355,6 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 5,23-5,12 (м, 1H), 3,95 (дд, половина АВХ картины, J=9,8, 7,8 Гц, 1H), 3,77 (дд, половина АВХ картины, J=10,0, 5,3 Гц, 1H), 3,68-3,55 (м, 2H), 3,39-3,24 (м, 2H), 2,95 (с, 3H), 2,09 (дд, J=13,3, 9,0 Гц, 1H), 1,75-1,60 (м, 4H), 1,53-1,43 (м, 1H), 1,46 (с, 9H), 1,30 (с, 9H).
Стадия 3. Синтез N,2,2-триметил-N-[(3R)-1-окса-8-азаспиро[4.5]дец-3-ил]пропанамида, трифторацетатной соли ( C32 ).
Трифторуксусную кислоту (84 мл) добавляли к 0°С раствору C31 (20,0 г, 56,4 ммоль) в дихлорметане (280 мл) и реакционную смесь перемешивали при 0°С. Через 30 мин ее концентрировали под вакуумом, и остаток трижды азеотропировали гептаном, получая продукт в виде высоковязкого масла. Это вещество использовали на следующей стадии без дополнительной очистки. ЖХМС m/z 255,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3), характеристические пики продукта: δ 8,35-8,05 (ушир. с, 2H), 5,25-5,15 (м, 1H), 3,97 (дд, половина АВХ картины, J=10,2, 7,4 Гц, 1H), 3,83 (дд, половина АВХ картины, J=10,3, 5,3 Гц, 1H), 3,44-3,23 (м, 4H), 3,02 (с, 3H), 2,21 (дд, J=13,3, 9,0 Гц, 1H), 1,31 (с, 9H).
Стадия 4. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3R)-3-[(2,2-диметилпропанoил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C33 ).
Раствор C32 (с предыдущей стадии; ≤56,4 ммоль) в ацетонитриле (140 мл) охлаждали до 0°C и обрабатывали триэтиламином (78 мл, 560 ммоль). Соединение C2 (реакционный раствор в ацетонитриле, при 0°C, содержащий 72,7 ммоль) добавляли через канюлю, и реакционной смеси давали медленно нагреться до комнатной температуры в течение ночи. Затем ее концентрировали под вакуумом; остаток растворяли в этилацетате (600 мл) и последовательно промывали водной соляной кислотой (1 М; 100 мл), насыщенным водным раствором хлорида аммония (125 мл) и насыщенным водным раствором хлорида натрия (100 мл). Органический слой сушили, фильтровали и концентрировали под вакуумом, после чего неполярные примеси удаляли путем загрузки полученного материала на 4-дюймовый (10 см) слой силикагеля и элюирования этилацетатом в гептане (4 л при 20%, затем 1 л при 40%). Последующее элюирование смесью 1:1 этилацетат/гептан давало частично очищенный продукт (25 г), который подвергали хроматографии на силикагеле (элюент: 1:1 этилацетат/гептан) с получением продукта в виде вязкого масла. Выход: 19,0 г, 35,8 ммоль, 63% за две стадии. ЖХМС m/z 531,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,24 (ушир. д, J=8,6 Гц, 2H), 6,88 (ушир. д, J=8,6 Гц, 2H), 5,53-5,43 (ушир. м, 1H), 5,23-5,12 (ушир. м, 1H), 4,51 (AB квартет, JAB=11,7 Гц, ΔνAB=28,5 Гц, 2H), 3,95 (дд, J=10,0, 7,6 Гц, 1H), 3,89-3,64 (м, 4H), 3,81 (с, 3H), 3,77 (дд, J=10,0, 5,3 Гц, 1H), 3,44-3,26 (м, 2H), 2,96 (ушир. с, 3H), 2,13-1,99 (ушир. м, 1H), 1,82-1,62 (ушир. м, 4H), 1,48 (ддд, J=13,3, 11,1, 4,5 Гц, 1H), 1,30 (с, 9H).
Стадия 5. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-[(2,2-диметилпропанoил)(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( 7 ).
Гидрирование С33 (30,8 г, 58,0 ммоль) проводили в этаноле (620 мл), используя палладий на угле [10% Pd (50% увлажненный водой); 3,08 г] и водород при 50 фунт/кв. дюйм (0,34 МПа). Для завершения реакции потребовалось менее 3 ч, после чего катализатор удаляли фильтрованием через диатомовую землю. Фильтрующий слой промывали этанолом и объединенные фильтраты концентрировали под вакуумом. Полученный смолистый материал обрабатывали этилацетатом (100 мл), затем гептаном (300 мл) и смесь энергично перемешивали в токе азота. Полученное твердое вещество выделяли фильтрованием с использованием нейлонового фильтра с получением продукта в виде белого твердого вещества. Выход: 16 г, 39 ммоль, 68%. ЖХМС m/z 411,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 5,31-5,13 (м, 2H), 4,04-3,92 (м, 2H), 3,92-3,73 (м, 4H), 3,48-3,28 (м, 2H), 2,96 (с, 3H), 2,15-2,05 (м, 1H), 1,82-1,66 (м, 4H), 1,6-1,44 (м, 1H, предполагаемый; частично скрытый пиком воды), 1,30 (с, 9H). Образец 7 перемешивали в гептане в течение ночи и фильтровали, получая белое твердое вещество (температура плавления 105,2°С), которое оказалось кристаллическим, что подтверждено порошковой рентгеновской дифракцией.
Примеры 8 и 9
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 1 [из C39 , DIАST 1] ( 8 ) и (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 2 [из C40 , DIАST 2] ( 9 )
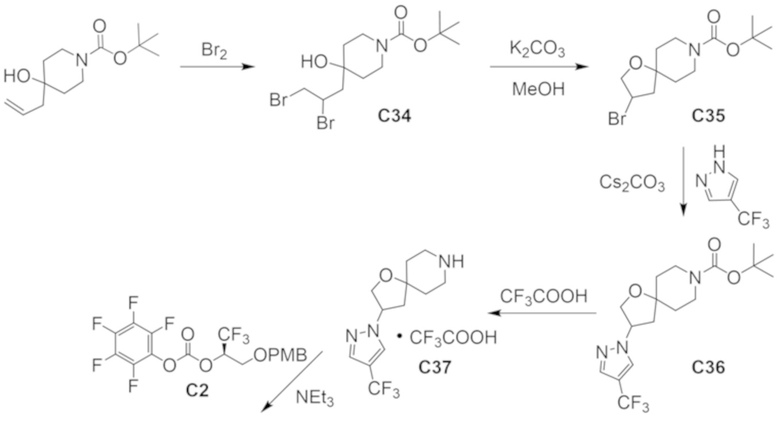
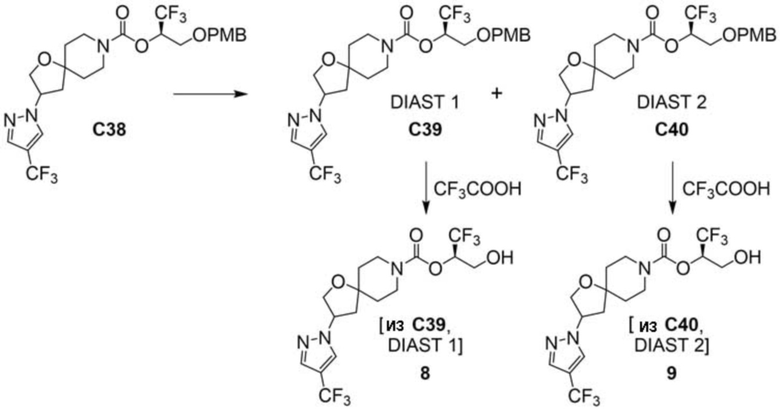
Стадия 1. Синтез трет-бутил-4-(2,3-дибромпропил)-4-гидроксипиперидин-1-карбоксилата ( C34 ).
Эту реакцию осуществляли в двух идентичных партиях. Раствор трет-бутил-4-гидрокси-4-(проп-2-ен-1-ил)пиперидин-1-карбоксилата (209 г, 0,866 моль) в дихлорметане (1,2 л) охлаждали на бане с холодной водой. Раствор брома (152 г, 0,951 моль) в дихлорметане (250 мл) добавляли с такой скоростью, чтобы цвет реакционной смеси не становился интенсивным. По завершении добавления водный раствор, содержащий тиосульфат натрия и бикарбонат натрия, добавляли к реакционной смеси и перемешивание продолжали до полного обесцвечивания смеси. В этот момент две партии объединяли. Водный слой экстрагировали дихлорметаном (3 × 400 мл) и объединенные органические слои промывали насыщенным водным раствором хлорида натрия (2 × 200 мл), сушили над сульфатом натрия и концентрировали под вакуумом с получением продукта в виде красной смолы. Выход: 600 г, 1,5 моль, 87%. 1H ЯМР (400 МГц, CDCl3) δ 4,43-4,33 (м, 1H), 3,96-3,74 (м, 2H), 3,91 (дд, J=10,3, 4,0 Гц, 1H), 3,66 (дд, J=10,0, 9,8 Гц, 1H), 3,27-3,13 (м, 2H), 2,47 (дд, половина АВХ картины, J=15,8, 2,8 Гц, 1H), 2,13 (дд, половина АВХ картины, J=15,7, 8,9 Гц, 1H), 1,78-1,68 (м, 2H), 1,65-1,53 (м, 2H, предполагаемый; частично скрытый пиком воды), 1,47 (с, 9H).
Стадия 2. Синтез трет-бутил-3-бром-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C35 ).
Карбонат калия (119 г, 861 ммоль) добавляли к охлажденному раствору C34 (230 г, 573 ммоль) в метаноле (1,5 л), и реакционную смесь перемешивали при температуре от 10°С до 15°С в течение 16 ч. Неочищенную реакционную смесь объединяли с неочищенными реакционными смесями из двух аналогичных реакций, используя C34 (350 г, 873 ммоль; и 20 г, 50 ммоль), и фильтровали. Фильтрат концентрировали под вакуумом и полученное красное масло перекристаллизовывали из простого петролейного эфира (150 мл) при 0°C с получением светло-желтого твердого вещества (360 г). Его подвергали хроматографии на силикагеле (элюент: дихлорметан) и очищенный материал перекристаллизовывали из петролейного эфира (120 мл) и промывали петролейным эфиром (3 × 40 мл) с получением продукта в виде белого твердого вещества (180 г). Маточные растворы после перекристаллизации концентрировали при пониженном давлении и очищали хроматографией на силикагеле (градиент: 0-20% этилацетата в петролейном эфире). Полученный материал перекристаллизовывали из петролейного эфира (100 мл) и промывали петролейным эфиром (3 × 40 мл), получая дополнительный продукт в виде белого твердого вещества (95 г). Общий выход: 275 г, 0,859 моль, 57%. 1H ЯМР (400 МГц, ДМСО-d6) δ 4,71-4,63 (м, 1H), 4,12 (дд, J=10,4, 4,9 Гц, 1H), 3,90 (дд, J=10,5, 3,8 Гц, 1H), 3,52-3,40 (м, 2H), 3,3-3,15 (м, 2H), 2,41 (дд, J=14,3, 7,3 Гц, 1H), 2,10 (дд, J=14,0, 4,0 Гц, 1H), 1,79-1,71 (м, 1H), 1,65 (ушир. ддд, половина АВХY картины, J=13, 10, 4 Гц, 1H), 1,55-1,41 (м, 2H), 1,39 (с, 9H).
Стадия 3. Синтез трет-бутил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C36 ).
Смесь C35 (3,39 г, 10,6 ммоль), 4-(трифторметил)-1H-пиразола (1,20 г, 8,82 ммоль) и карбоната цезия (8,62 г, 26,5 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 80°С в течение 2 ч, после чего ее распределяли между этилацетатом (50 мл) и водой (50 мл). Водный слой экстрагировали этилацетатом (2×50 мл), и объединенные органические слои промывали насыщенным водным раствором хлорида натрия (3×50 мл), сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Очистка хроматографией на силикагеле (градиент: от 0% до 20% этилацетата в петролейном эфире) давала продукт в виде белого твердого вещества. Выход: 2,90 г, 7,73 ммоль, 88%. ЖХМС m/z 320,0 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,79 (с, 1H), 7,72 (с, 1H), 5,03-4,94 (м, 1H), 4,23 (дд, половина АВХ картины, J=10,0, 6,5 Гц, 1H), 4,17 (дд, половина АВХ картины, J=10,0, 4,5 Гц, 1H), 3,72-3,60 (ушир. м, 2H), 3,40-3,28 (м, 2H), 2,36 (дд, половина АВХ картины, J=13,6, 8,5 Гц, 1H), 2,24 (дд, половина АВХ картины, J=13,6, 5,5 Гц, 1H), 1,84-1,64 (м, 3H), 1,64-1,54 (м, 1H), 1,47 (с, 9H).
Стадия 4. Синтез 3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декана, трифторацетатной соли ( C37 ).
Трифторуксусную кислоту (4 мл) добавляли к 0°С раствору C36 (2,90 г, 7,73 ммоль) в дихлорметане (16 мл). Реакционную смесь перемешивали при 25°C в течение 2 ч, после чего ее концентрировали под вакуумом, получая продукт в виде желтого масла. Это вещество использовали непосредственно на следующей стадии. ЖХМС m/z 276,0 [M+H]+.
Стадия 5. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C38 ).
Превращение С37 в С38 осуществляли, используя способ, описанный для синтеза смеси С13 и С14 из С12 в примерах 3 и 4. Продукт выделяли в виде бесцветной смолы, которая содержала немного этилацетата. Выход диастереомерной смеси за 2 стадии, с поправкой на растворитель: 3,20 г, 5,80 ммоль, 75%. 1H ЯМР (400 МГц, CDCl3) δ 7,78 (с, 1H), 7,73 (с, 1H), 7,24 (д, J=8,5 Гц, 2H), 6,88 (ушир. д, J=8,0 Гц, 2H), 5,54-5,43 (ушир. м, 1H), 5,03-4,93 (ушир. м, 1H), 4,51 (AB квартет, сильнопольный дублет уширен, JAB=11,5 Гц, ΔνAB=28 Гц, 2H), 4,26-4,15 (м, 2H), 3,91-3,65 (м, 4H), 3,81 (ушир. с, 3H), 3,45-3,29 (ушир. м, 2H), 2,41-2,16 (м, 2H), 1,91-1,52 (м, 4H).
Стадия 6. Выделение (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 1 ( C39 ), и (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 2 ( C40 ).
Разделение С38 (с предыдущей стадии; 2,0 г, 3,6 ммоль) на составляющие его диастереомеры проводили с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 65:35 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующимся первым диастереомером был С39, полученный в виде желтого масла. Выход: 830 мг, 1,51 ммоль, 42%. ЖХМС m/z 574,0 [M+Na+].
Элюирующимся вторым диастереомером был C40, также выделяемый в виде желтого масла. Выход: 920 мг, 1,67 ммоль, 46%. ЖХМС m/z 574,1 [M+Na+].
Стадия 7. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 1 [из C39 , DIАST 1] ( 8 ).
Трифторуксусную кислоту (2,5 мл) добавляли к раствору С39 (830 мг, 1,51 ммоль) в дихлорметане (10 мл) при комнатной температуре. Реакционную смесь перемешивали при 30°С в течение 2 ч, после чего ее промывали насыщенным водным раствором бикарбоната натрия (2 × 3 мл) и концентрировали под вакуумом. Обращенно-фазовая ВЭЖХ (колонка: Agela Durashell, 5 мкм; подвижная фаза A: 0,225% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил; градиент: от 51% до 71% B) давала продукт в виде желтой смолы. Выход: 248 мг, 0,575 ммоль, 38%. ЖХМС m/z 432,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,78 (с, 1H), 7,73 (с, 1H), 5,31-5,20 (ушир. м, 1H), 5,03-4,95 (м, 1H), 4,24 (дд, половина АВХ картины, J=10,0, 6,5 Гц, 1H), 4,22-4,16 (м, 1H), 4,04-3,97 (м, 1H), 3,93-3,76 (м, 3H), 3,48-3,28 (м, 2H), 2,36 (дд, половина АВХ картины, J=13,8, 8,3 Гц, 1H), 2,28 (дд, половина АВХ картины, J=13,8, 5,3 Гц, 1H), 1,93-1,84 (ушир. м, 1H), 1,83-1,5 (ушир. м, 4H, предполагаемый; частично скрытый пиком воды).
Стадия 8. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 2 [из C40 , DIАST 2] ( 9 ).
Превращение С40 в продукт осуществляли с использованием способа, использованного для синтеза 8 из С39. Продукт получали в виде бесцветной смолы. Выход: 356 мг, 0,825 ммоль, 49%. ЖХМС m/z 432,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,78 (с, 1H), 7,73 (с, 1H), 5,31-5,20 (ушир. м, 1H), 5,03-4,95 (м, 1H), 4,24 (дд, половина АВХ картины, J=10,0, 6,5 Гц, 1H), 4,19 (дд, половина АВХ картины, J=10,0, 5,0 Гц, 1H), 4,01 (дд, половина АВХ картины, J=12,8, 3,3 Гц, 1H), 3,93-3,76 (м, 3H), 3,49-3,30 (м, 2H), 2,36 (дд, половина АВХ картины, J=13,6, 8,5 Гц, 1H), 2,28 (ушир. дд, половина АВХ картины, J=13,8, 5,3 Гц, 1H), 1,94-1,83 (ушир. м, 1H), 1,83-1,5 (ушир. м, 4H).
Примеры 10 и 11
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-(3S)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат (10) и (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат (11)
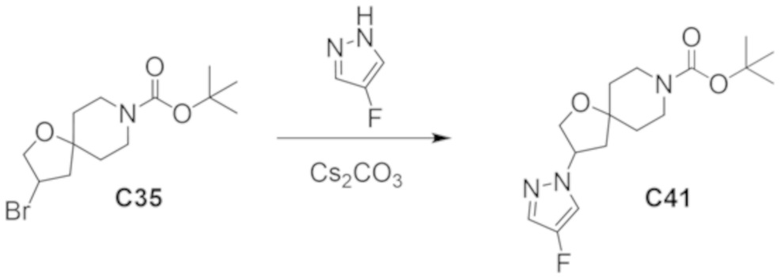
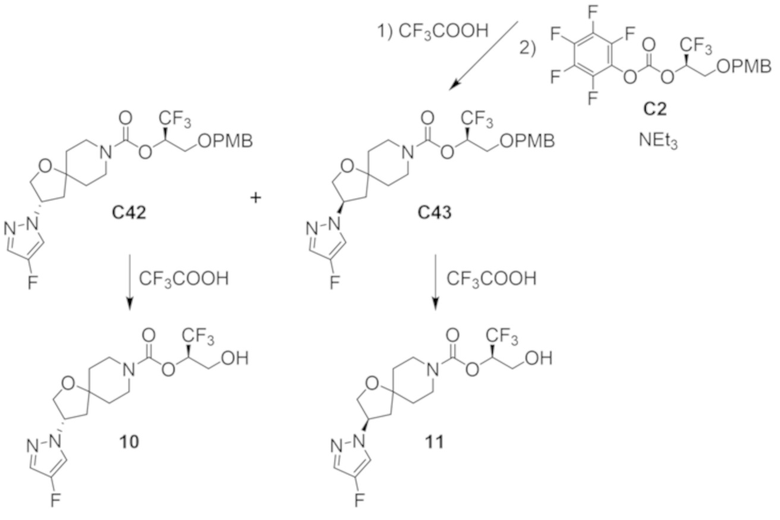
Стадия 1. Синтез трет-бутил-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C41 ).
К суспензии 4-фтор-1H-пиразола (40 мг, 0,46 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли C35 (223 мг, 0,696 ммоль), затем карбонат цезия (454 мг, 1,39 ммоль). Реакционную смесь перемешивали при 80°C в течение 2 ч, после чего ее разбавляли водой (40 мл) и экстрагировали этилацетатом (3 × 25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали, концентрировали под вакуумом и очищали хроматографией на силикагеле (градиент: от 0% до 40% этилацетата в петролейном эфире) с получением продукта в виде белого твердого вещества. Выход: 133 мг, 0,409 ммоль, 89%. ЖХМС m/z 269,9 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,39 (д, J=4,5 Гц, 1H), 7,35 (д, J=4,5 Гц, 1H), 4,90-4,82 (м, 1H), 4,17 (дд, половина АВХ картины, J=10,0, 6,5 Гц, 1H), 4,12 (дд, половина АВХ картины, J=10,0, 5,0 Гц, 1H), 3,71-3,57 (ушир. м, 2H), 3,39-3,28 (м, 2H), 2,31 (дд, половина АВХ картины, J=13,6, 8,5 Гц, 1H), 2,19 (дд, половина АВХ картины, J=13,6, 5,0 Гц, 1H), 1,82-1,63 (м, 3H), 1,61-1,52 (м, 1H), 1,46 (с, 9H).
Стадия 2. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3S)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C42 ) и (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C43 ).
Трифторуксусную кислоту (3 мл) добавляли по каплям к 0°С раствору С41 (273 мг, 0,839 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при 20°C в течение 2 ч, после чего ее концентрировали под вакуумом. Полученный материал растворяли в ацетонитриле (5 мл), охлаждали до 0°С и медленно обрабатывали С2 (реакционный раствор в ацетонитриле, содержащий 1,01 ммоль), а затем триэтиламином (679 мг, 6,71 ммоль). Реакционную смесь перемешивали при 20°С в течение 16 ч, после чего ее концентрировали при пониженном давлении и очищали с помощью хроматографии на силикагеле (градиент: от 0% до 30% этилацетата в петролейном эфире), с получением смеси С42 и С43 в виде желтой смолы. Выход диастереомерной смеси: 269 мг, 0,536 ммоль, 64%. ЖХМС m/z 524,0 [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 7,38 (д, J=4,5 Гц, 1H), 7,36 (д, J=4,0 Гц, 1H), 7,25 (д, J=9,0 Гц, 2H), 6,88 (ушир. д, J=8 Гц, 2H), 5,53-5,43 (ушир. м, 1H), 4,91-4,81 (ушир. м, 1H), 4,51 (AB квартет, сильнопольный дублет уширен, JAB=12 Гц, ΔνAB=29 Гц, 2H), 4,22-4,10 (м, 2H), 3,90-3,65 (м, 4H), 3,81 (с, 3H), 3,43-3,31 (ушир. м, 2H), 2,35-2,13 (м, 2H), 1,88-1,5 (м, 4H, предполагаемый; частично скрытый пиком воды).
Входящие в состав диастереомеры разделяли с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 3:2 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующимся первым диастереомером был С42, полученный в виде бесцветной смолы. Выход: 110 мг, 0,219 ммоль, 41% для разделения. ЖХМС m/z 524,1 [M+Na+]. Элюирующимся вторым диастереомером был C43, также выделяемый в виде бесцветной смолы. Выход: 116 мг, 0,231 ммоль, 43% для разделения. ЖХМС m/z 524,1 [M+Na+]. Указанные абсолютные стереохимические параметры C42 и C43 были определены на основе монокристальной рентгеновской дифрактометрии для производного продукта 11 (см. ниже).
Стадия 3. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3S)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( 10 ).
Трифторуксусную кислоту (3 мл) добавляли к 0°C раствору C42 (110 мг, 0,219 ммоль) в дихлорметане (10 мл) и реакционную смесь перемешивали при 20°C в течение 1 ч. Затем ее разбавляли насыщенным водным раствором хлорида натрия и экстрагировали дихлорметаном (15 мл) и этилацетатом (2 × 20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Очистку проводили с помощью обращенно-фазовой ВЭЖХ (колонка: Agela Durashell, 5 мкм; подвижная фаза A: 0,225% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил; градиент: от 26% до 46% B), с получением продукта в виде бесцветной смолы. Выход: 36,4 мг, 95,4 мкмоль, 44%. ЖХМС m/z 382,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,38 (д, J=4,8 Гц, 1H), 7,35 (д, J=4,3 Гц, 1H), 5,31-5,20 (ушир. м, 1H), 4,91-4,82 (м, 1H), 4,22-4,11 (м, 2H), 4,04-3,96 (м, 1H), 3,92-3,73 (м, 3H), 3,48-3,28 (м, 2H), 2,31 (дд, половина АВХ картины, J=13,6, 8,3 Гц, 1H), 2,24 (дд, половина АВХ картины, J=13,7, 5,1 Гц, 1H), 1,91-1,54 (ушир. м, 4H, предполагаемый; частично скрытый пиком воды).
Стадия 4. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( 11 ).
Превращение С43 в продукт осуществляли с использованием способа, использованного для синтеза 10 из С42. Продукт выделяли в виде белого твердого вещества. Выход: 40,7 мг, 0,107 ммоль, 46%. ЖХМС m/z 382,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,38 (д, J=4,8 Гц, 1H), 7,35 (д, J=4,3 Гц, 1H), 5,31-5,20 (ушир. м, 1H), 4,91-4,82 (м, 1H), 4,19 (дд, половина АВХ картины, J=10,0, 6,3 Гц, 1H), 4,15 (дд, половина АВХ картины, J=10,0, 5,0 Гц, 1H), 4,00 (ушир. дд, половина АВХ картины, J= 12,4, 3,1 Гц, 1H), 3,91-3,74 (ушир. м, 3H), 3,49-3,30 (м, 2H), 2,52-2,36 (оч. ушир. с, 1H), 2,31 (дд, половина АВХ картины, J=13,6, 8,3 Гц, 1H), 2,28-2,20 (ушир. м, 1H), 1,91-1,53 (ушир. м, 4H, предполагаемый; частично скрытый пиком воды).
Образец 11 кристаллизовали из этилацетата/пентана диффузией из паровой фазы и использовали для определения абсолютной конфигурации с помощью рентгеновской кристаллографии:
Монокристальное рентгеноструктурное определение 11
Монокристальная рентгеновская дифрактометрия
Сбор данных проводили на дифрактометре Bruker APEX при комнатной температуре. Сбор данных состоял из омега- и фи- сканирований.
Структуру определяли прямыми способами, с использованием программного комплекса SHELX в пространственной группе P212121 орторомбического класса. Структура была впоследствии уточнена полноматричным методом наименьших квадратов. Все неводородные атомы находили и уточняли с использованием параметров анизотропного смещения.
Атомы водорода, расположенные у кислорода, были найдены по разностной карте Фурье и уточнены с ограничением расстояний. Оставшиеся атомы водорода помещали в расчетные положения и позволяли им перемещаться на своих атомах-носителях. Конечное уточнение включало параметры изотропного смещения для всех атомов водорода.
Анализ абсолютной структуры с использованием методов правдоподобия (Hooft, 2008) проводили с использованием PLATON (Spek, 2010). При условии энантиомерной чистоты представленного образца результаты показывали, что абсолютная структура была правильно определена. Метод вычисляет, что вероятность того, что структура была правильно определена, равна 100,0. Параметр Хуфта определяется как -0,04 с esd 0,005.
Конечный R-фактор составлял 4,2%. Конечная разностная карта Фурье не показала отсутствующей или неверно установленной электронной плотности.
Соответствующая информация о кристалле, сборе данных и уточнении приведена в таблице 6. Атомные координаты, длины связей, углы связей и параметры смещения приведены в таблицах 7-9.
Программное обеспечение и ссылки на источники
SHELXTL, версия 5.1, Bruker AXS, 1997.
PLATON, A. L. Spek, J. Appl. Cryst. 2003, 36, 7-13.
MERCURY, C. F. Macrae, P. R. Edington, P. McCabe, E. Pidcock, G. P. Shields, R. Taylor, M. Towler, J. van de Streek, J. Appl. Cryst. 2006, 39, 453-457.
OLEX2, O. V. Dolomanov, L. J. Bourhis, R. J. Gildea, J. A. K. Howard, H. Puschmann, J. Appl. Cryst. 2009, 42, 339-341.
R. W. W. Hooft, L. H. Straver, and A. L. Spek, J. Appl. Cryst. 2008, 41, 96-103.
H. D. Flack, Acta Cryst. 1983, A39, 867-881.
Таблица 6. Данные кристалла и уточнение структуры для 11.
Таблица 7. Атомные координаты (× 104) и эквивалентные параметры изотропного смещения (Å2×103) для 11. U(eq) представляет собой 1/3 следа ортогонализированного тензора Uij.
Таблица 8. Длины [Å] и углы [°] связей для 11.
Преобразования симметрии использовали для формирования эквивалентных атомов.
Таблица 9. Параметры анизотропного смещения (Å2×103) для 11. Показатель коэффициента анизотропного смещения принимает вид: -2π2[h2 a*2U11 +...+2 h k a* b* U12 ].
Примеры 12 и 13
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-(3R)-3-(3-цианoфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат ( 12 ) и (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3S)-3-(3-цианoфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат ( 13 )
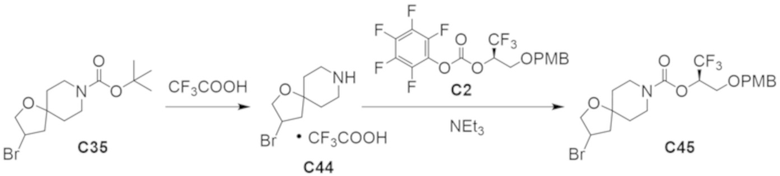
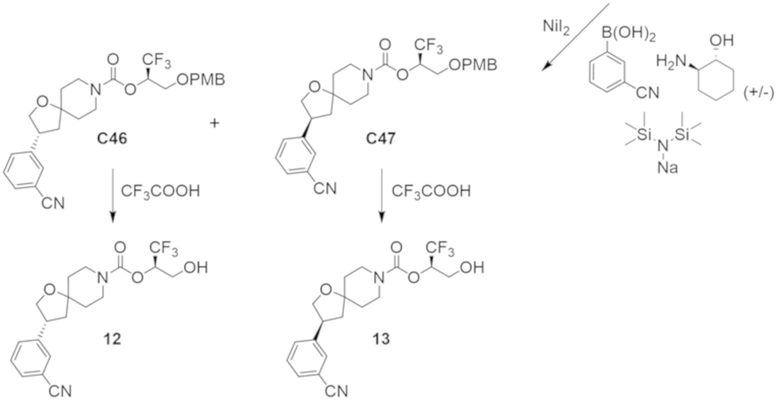
Стадия 1. Синтез 3-бром-1-окса-8-азаспиро[4.5]декана, трифторацетатной соли ( C44 ).
Трифторуксусную кислоту (100 мл) добавляли по каплям к 0°С раствору C35 (25,0 г, 78,1 ммоль) в дихлорметане (400 мл). После перемешивания реакционной смеси при 13°C в течение 15 ч ее концентрировали под вакуумом, получая продукт в виде коричневого масла (30 г). Это вещество использовали на следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, CD3OD) δ 4,63-4,55 (м, 1H), 4,20 (дд, половина АВХ картины, J=10,5, 4,5 Гц, 1H), 4,04 (дд, половина АВХ картины, J=10,5, 3,5 Гц, 1H), 3,3-3,21 (м, 4H), 2,50 (дд, половина АВХ картины, J=14,6, 7,0 Гц, 1H), 2,30-2,18 (м, 2H), 1,97 (ддд, J=14, 10, 6,5 Гц, 1H), 1,91-1,77 (м, 2H).
Стадия 2. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-бром-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C45 ).
Триэтиламин (39,5 г, 390 ммоль) добавляли к 15°С раствору C44 (с предыдущей стадии; ≤78,1 ммоль) в ацетонитриле (400 мл). Полученный раствор перемешивали при 15°C в течение 1 ч, после чего его охлаждали до 0°C и обрабатывали C2 [реакционный раствор в ацетонитриле (400 мл), содержащий 85,9 ммоль]. После перемешивания реакционной смеси при 13°С в течение 15 ч ее концентрировали под вакуумом и дважды очищали с помощью хроматографии на силикагеле (градиент: от 5% до 9% этилацетата в петролейном эфире). Конечная хроматографическая очистка на силикагеле (градиент: от 0% до 9% этилацетата в петролейном эфире) давала продукт в виде бесцветной смолы. Выход: 20,3 г, 40,9 ммоль, 52% за 2 стадии. ЖХМС m/z 519,8 (наблюдали изотопную картину брома) [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 7,25 (д, J=8,5 Гц, 2H), 6,89 (д, J=8,7 Гц, 2H), 5,54-5,43 (м, 1H), 4,51 (AB квартет, сильнопольный дублет уширен, JAB=11,7 Гц, ΔνAB=29,1 Гц, 2H), 4,44-4,36 (м, 1H), 4,19 (дд, J=10,4, 5,3 Гц, 1H), 4,07-3,99 (м, 1H), 3,91-3,63 (м, 4H), 3,82 (с, 3H), 3,44-3,27 (м, 2H), 2,42-2,25 (м, 1H), 2,24-2,08 (м, 1H), 2,04-1,89 (м, 1H), 1,81-1,47 (м, 3H).
Стадия 3. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3R)-3-(3-цианoфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата (C46) и (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3S)-3-(3-цианoфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата (C47).
Бис(триметилсилил)амид натрия (1 M раствор в тетрагидрофуране; 1,81 мл, 1,81 ммоль) добавляли к смеси C45 (450 мг, 0,907 ммоль), (3-цианoфенил)бороновой кислоты (266 мг, 1,81 ммоль), транс-2-аминоциклогексанола (20,9 мг, 0,181 ммоль) и йодида никеля (56,7 мг, 0,181 ммоль) в 2-пропанoле (высушенном над молекулярными ситами; 5 мл). Реакционную смесь перемешивали при 60°С в течение 14 ч, после чего ее фильтровали через диатомовую землю. Фильтрат концентрировали под вакуумом и остаток очищали с помощью хроматографии на силикагеле (градиент: от 0% до 20% этилацетата в петролейном эфире), с получением смеси С46 и С47 в виде бесцветного масла. Выход диастереомерной смеси: 320 мг, 0,617 ммоль, 68%.
Это вещество разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; Подвижная фаза: 3:1 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующимся первым диастереомером был C46, который выделяли в виде светло-желтого масла. Выход: 154 мг, 0,297 ммоль, 48% для разделения. ЖХМС m/z 541,1 [M+Na+].
Элюирующимся вторым диастереомером был C47, также получаемый в виде желтого масла. Выход: 138 мг, 0,266 ммоль, 43% для разделения. ЖХМС m/z 541,1 [M+Na+]. Указанные абсолютные стереохимические параметры C46 и C47 были определены на основе монокристальной рентгеновской дифрактометрии для производного продукта 13 (см. ниже).
Стадия 4. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-(3-цианoфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( 12 ).
Трифторуксусную кислоту (1 мл) добавляли к 10°C раствору C46 (154 мг, 0,297 ммоль) в дихлорметане (4 мл) и реакционную смесь перемешивали при 30°C в течение 1 ч. Затем ее промывали насыщенным водным раствором бикарбоната натрия (2 × 3 мл) и концентрировали при пониженном давлении. Очистка с помощью обращенно-фазовой ВЭЖХ (колонка: Agela Durashell, 5 мкм; подвижная фаза A: 0,225% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил; градиент: от 53% до 73% B) давала продукт в виде желтой смолы. Выход: 59,7 мг, 0,150 ммоль, 50%. ЖХМС m/z 399,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,56-7,52 (м, 2H), 7,51-7,41 (м, 2H), 5,32-5,21 (ушир. м, 1H), 4,25 (дд, J=8,4, 7,9 Гц, 1H), 4,05-3,97 (м, 1H), 3,93-3,77 (м, 4H), 3,61-3,50 (м, 1H), 3,48-3,29 (м, 2H), 2,50-2,35 (ушир. с, 1H), 2,30 (дд, J=12,8, 8,4 Гц, 1H), 1,87-1,70 (м, 4H), 1,70-1,6 (м, 1H, предполагаемый; частично скрытый пиком воды).
Стадия 5. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3S)-3-(3-цианoфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( 13 ).
Трифторуксусную кислоту (1 мл) добавляли к 30°C раствору C47 (138 мг, 0,266 ммоль) в дихлорметане (4 мл) и реакционную смесь перемешивали при 30°C в течение 1,5 ч. Затем ее промывали насыщенным водным раствором бикарбоната натрия (2 × 3 мл) и концентрировали при пониженном давлении. Очистка с помощью обращенно-фазовой ВЭЖХ (колонка: Agela Durashell, 5 мкм; подвижная фаза A: 0,225% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил; градиент: от 53% до 73% B) давала продукт в виде белой смолы. Выход: 58,6 мг, 0,147 ммоль, 55%. ЖХМС m/z 399,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,56-7,52 (м, 2H), 7,51-7,41 (м, 2H), 5,32-5,21 (ушир. м, 1H), 4,25 (дд, J=7,9, 7,9 Гц, 1H), 4,05-3,97 (м, 1H), 3,94-3,76 (м, 4H), 3,61-3,50 (м, 1H), 3,50-3,32 (м, 2H), 2,50-2,35 (ушир. с, 1H), 2,30 (ушир. дд, J=12,1, 8,6 Гц, 1H), 1,87-1,73 (м, 4H), 1,70-1,55 (м, 1H, предполагаемый; в значительной степени скрытый пиком воды).
Образец 13 кристаллизовали из хлороформа диффузией из паровой фазы и использовали для определения абсолютной конфигурации с помощью рентгеновской кристаллографии:
Монокристальное рентгеноструктурное определение 13
Монокристальная рентгеновская дифрактометрия
Сбор данных проводили на дифрактометре Bruker APEX при комнатной температуре. Сбор данных состоял из омега- и фи- сканирований.
Структуру определяли прямыми способами, с использованием программного комплекса SHELX в пространственной группе P21 моноклинального класса. Структура была впоследствии уточнена полноматричным методом наименьших квадратов. Все неводородные атомы находили и уточняли с использованием параметров анизотропного смещения.
Атомы водорода, расположенные у кислорода, были найдены по разностной карте Фурье и уточнены с ограничением расстояний. Оставшиеся атомы водорода помещали в расчетные положения и позволяли им перемещаться на своих атомах-носителях. Конечное уточнение включало параметры изотропного смещения для всех атомов водорода.
Анализ абсолютной структуры с использованием методов правдоподобия (Hooft, 2008) проводили с использованием PLATON (Spek, 2010). При условии энантиомерной чистоты представленного образца результаты показывали, что абсолютная структура была правильно определена. Метод вычисляет, что вероятность того, что структура была правильно определена, равна 1,000. Параметр Хуфта определяется как 0,01 с esd 0,009.
Конечный R-фактор составлял 4,4%. Конечная разностная карта Фурье не показала отсутствующей или неверно установленной электронной плотности.
Соответствующая информация о кристалле, сборе данных и уточнении приведена в таблице 10. Атомные координаты, длины связей, углы связей и параметры смещения приведены в таблицах 11-13.
Программное обеспечение и ссылки на источники
SHELXTL, версия 5.1, Bruker AXS, 1997.
PLATON, A. L. Spek, J. Appl. Cryst. 2003, 36, 7-13.
MERCURY, C. F. Macrae, P. R. Edington, P. McCabe, E. Pidcock, G. P. Shields, R. Taylor, M. Towler, J. van de Streek, J. Appl. Cryst. 2006, 39, 453-457.
OLEX2, O. V. Dolomanov, L. J. Bourhis, R. J. Gildea, J. A. K. Howard, H. Puschmann, J. Appl. Cryst. 2009, 42, 339-341.
R. W. W. Hooft, L. H. Straver, and A. L. Spek, J. Appl. Cryst. 2008, 41, 96-103.
H. D. Flack, Acta Cryst. 1983, A39, 867-881.
Таблица 10. Данные кристалла и уточнение структуры для 13.
Таблица 11. Атомные координаты (× 104) и эквивалентные параметры изотропного смещения (Å2×103) для 13. U(eq) представляет собой 1/3 следа ортогонализированного тензора Uij.
Таблица 12. Длины [Å] и углы [°] связей для 13.
Преобразования симметрии использовали для формирования эквивалентных атомов.
Таблица 13. Параметры анизотропного смещения (Å2×103) для 13. Показатель коэффициента анизотропного смещения принимает вид: -2π2[h2 a*2U11 +...+2 h k a* b* U12 ].
Примеры 14 и 15
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 1 [из C54 , DIАST 1] ( 14 ) и (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 2 [из C55 , DIАST 2] ( 15 )
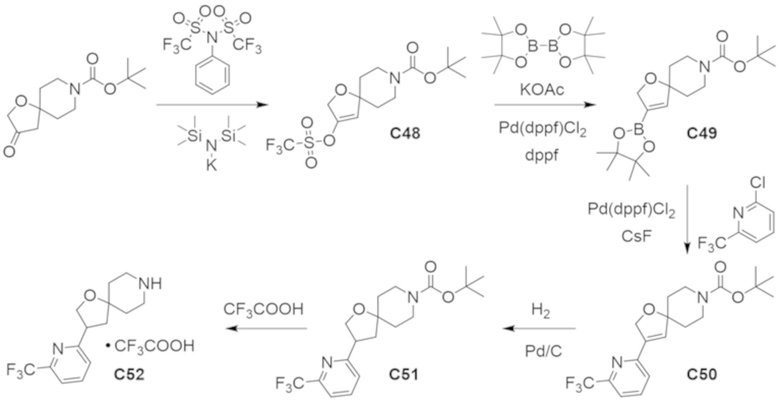
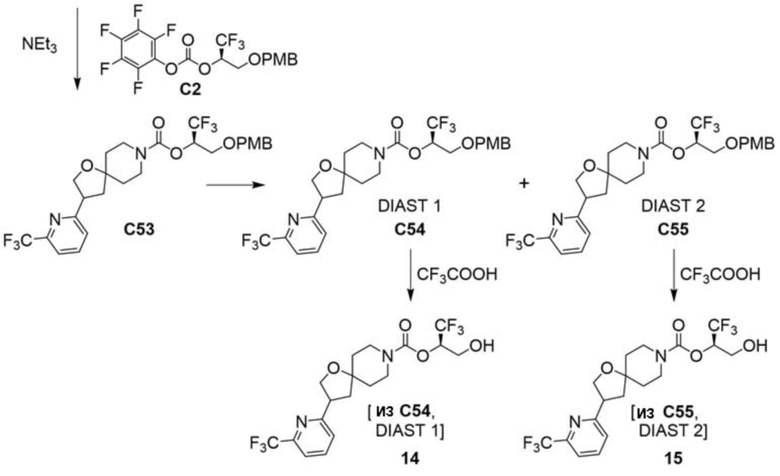
Стадия 1. Синтез трет-бутил-3-{[(трифторметил)сульфонил]окси}-1-окса-8-азаспиро[4.5]дец-3-ен-8-карбоксилата (C48).
Бис(триметилсилил)амид калия (1 M раствор в тетрагидрофуране; 58,8 мл, 58,8 ммоль) добавляли по каплям к -70°С раствору трет-бутил-3-оксо-1-окса-8-азаспиро[4.5]декан-8-карбоксилата (10,0 г, 39,2 ммоль) в тетрагидрофуране (250 мл). После перемешивания реакционной смеси при -70°С в течение 30 мин медленно добавляли раствор 1,1,1-трифтор-N-фенил-N-[(трифторметил)сульфонил]метансульфонамида (18,2 г, 50,9 ммоль) в тетрагидрофуране (100 мл). Затем реакционную смесь нагревали до 20°С и перемешивали в течение 1 ч, после чего ее гасили, добавляя насыщенный водный раствор хлорида аммония (200 мл), и разбавляли водой (300 мл). Полученную смесь экстрагировали этилацетатом (3 × 300 мл) и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Повторная хроматография на силикагеле (градиент: от 0% до 10% этилацетата в петролейном эфире) с последующей конечной хроматографической очисткой на силикагеле (градиент: от 0% до 2% этилацетата в петролейном эфире с последующим добавлением 100% этилацетата) давала продукт в виде белого твердого вещества. Выход: 12,2 г, 31,5 ммоль, 80%. ЖХМС m/z 332,0 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 МГц, CDCl3) δ 5,75 (т, J=2,2 Гц, 1H), 4,65 (д, J=2,0 Гц, 2H), 3,84-3,69 (ушир. м, 2H), 3,32-3,20 (м, 2H), 1,74-1,66 (м, 4H), 1,47 (с, 9H).
Стадия 2. Синтез трет-бутил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-окса-8-азаспиро[4.5]дец-3-ен-8-карбоксилата ( C49 ).
Этот эксперимент проводился в двух одинаковых партиях. К раствору C48 (2,45 г, 6,32 ммоль) в 1,4-диоксане (30 мл) добавляли 4,4,4',4',5,5,5',5'-октaметил-2,2'-би-1,3,2-диоксаборолан (1,69 г, 6,65 ммоль), ацетат калия (1,86 г, 19,0 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (463 мг, 0,633 ммоль), и 1,1'-бис(дифенилфосфино)ферроцен (351 мг, 0,633 ммоль). Реакционную смесь перемешивали при 80°С в течение 16 ч, после чего ее объединяли со второй партией и разбавляли этилацетатом (100 мл). После фильтрования фильтрат концентрировали под вакуумом, разбавляли гептаном (150 мл) и перемешивали при 75°С в течение 50 мин. Полученную смесь фильтровали и фильтрат концентрировали при пониженном давлении до тех пор, пока не оставалась 1/3 добавленного гептана. При охлаждении до 0°С осаждалось желтое твердое вещество; его удаляли фильтрованием и фильтрат концентрировали под вакуумом. Полученную смолу обрабатывали петролейным эфиром (5 мл) и охлаждали на ледяной бане. Продукт, который медленно выпадал в осадок, выделяли фильтрованием в виде желтого твердого вещества. Общий выход: 2,38 г, 6,52 ммоль, 52%. ЖХМС m/z 310,1 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 МГц, CDCl3) δ 6,39 (т, J=2,4 Гц, 1H), 4,76 (д, J=2,5 Гц, 2H), 3,81-3,66 (ушир. м, 2H), 3,34-3,24 (м, 2H), 1,69-1,54 (м, 4H, предполагаемый; частично скрытый пиком воды), 1,47 (с, 9H), 1,29 (с, 12H).
Стадия 3. Синтез трет-бутил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]дец-3-ен-8-карбоксилата ( C50 ).
К раствору C49 (370 мг, 1,01 ммоль) в 1,4-диоксане (5 мл) добавляли 2-хлор-6-(трифторметил)пиридин (203 мг, 1,12 ммоль), фторид цезия (392 мг, 2,58 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (63,0 мг, 86,1 мкмоль) и воду (0,5 мл). Реакционную смесь перемешивали при 80°C в течение 16 ч, после чего ее объединяли с аналогичной реакционной смесью, полученной из C49 (30 мг, 82 мкмоль), концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле (градиент: от 0% до 20% этилацетата в петролейном эфире) с получением продукта в виде желтого твердого вещества. Общий выход: 280 мг, 0,728 ммоль, 67%. ЖХМС m/z 328,9 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,84 (дд, J=8,0, 7,8 Гц, 1H), 7,56 (д, J=7,8 Гц, 1H), 7,50 (д, J=8,0 Гц, 1H), 6,57 (т, J=2,1 Гц, 1H), 5,11 (д, J=2,0 Гц, 2H), 3,90-3,74 (ушир. м, 2H), 3,39-3,27 (м, 2H), 1,81-1,67 (м, 4H), 1,48 (с, 9H).
Стадия 4. Синтез трет-бутил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C51 ).
Смесь С50 (280 мг, 0,728 ммоль) и палладия на угле (10%; 155 мг) в метаноле (10 мл) перемешивали в течение 2 ч при 28°С в атмосфере водорода из баллона. Реакционную смесь фильтровали и фильтрат концентрировали под вакуумом с получением продукта в виде желтой смолы. Это вещество использовали непосредственно на следующей стадии. ЖХМС m/z 330,9 [(M - 2-метилпроп-1-ен)+H]+.
Стадия 5. Синтез 3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декана, трифторацетатной соли ( C52 ).
Трифторуксусную кислоту (2 мл) добавляли к 0°С раствору С51 (с предыдущей стадии; ≤0,728 ммоль) в дихлорметане (8 мл). Реакционную смесь перемешивали при 25°C в течение 1 ч, после чего ее концентрировали под вакуумом, получая продукт в виде желтой смолы. Это вещество использовали непосредственно на следующей стадии. ЖХМС m/z 286,9 [M+H]+.
Стадия 6. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C53 ).
Триэтиламин (368 мг, 3,64 ммоль) добавляли медленно к 0°С раствору C52 (с предыдущей стадии; ≤0,728 ммоль) в ацетонитриле (10 мл). Через 30 мин C2 (реакционный раствор в ацетонитриле, содержащий 1,09 ммоль) добавляли к холодному раствору и реакционную смесь перемешивали при 25°C в течение 15 ч. Летучие компоненты удаляли при пониженном давлении, и остаток очищали хроматографией на силикагеле (градиент: от 0% до 25% этилацетата в петролейном эфире) с получением продукта в виде бесцветной смолы. Выход: 240 мг, 0,427 ммоль, 59% за 3 стадии. ЖХМС m/z 585,1 [M+Na+].
Стадия 7. Выделение (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 1 ( C54 ) и (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 2 ( C55 ).
Разделение С53 (240 мг, 0,427 ммоль) на составляющие его диастереомеры проводили с помощью сверхкритической флюидной хроматографии [колонка: Phenomenex Lux Cellulose-2, 10 мкм; подвижная фаза: 4:1 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующимся первым диастереомером был С54, полученный в виде бесцветной смолы. Выход: 110 мг, 0,196 ммоль, 46%. ЖХМС m/z 585,1 [M+Na+].
Элюирующийся вторым диастереомер дополнительно очищали с использованием тех же условий сверхкритической флюидной хроматографии, что давало С55 в виде бесцветной смолы. Выход: 80 мг, 0,142 ммоль, 33%. ЖХМС m/z 585,1 [M+Na+].
Стадия 8. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 1 [из C54 , DIАST 1] ( 14 ).
Трифторуксусную кислоту (1,5 мл) добавляли по каплям к 0°С раствору С54 (110 мг, 0,196 ммоль) в дихлорметане (6 мл). Реакционную смесь перемешивали при 0°C в течение 1 ч, после чего ее концентрировали под вакуумом. Остаток распределяли между этилацетатом (10 мл) и насыщенным водным раствором бикарбоната натрия (15 мл), и водный слой экстрагировали этилацетатом (2 × 15 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Очистку проводили с помощью обращенно-фазовой ВЭЖХ (колонка: Waters XBridge C18 OBD, 5 мкм; подвижная фаза A: вода, содержащая 0,225% муравьиной кислоты; подвижная фаза B: ацетонитрил; градиент: от 25% до 95% B), после чего следовала вторая очистка с обращенной фазой (колонка: Agela Durashell С18, 5 мкм; подвижная фаза A: 0,225% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил; градиент: от 40% до 60% B). Продукт выделяли в виде коричневой смолы. Выход: 33,5 мг, 75,7 мкмоль, 39%. ЖХМС m/z 443,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,80 (дд, J=7,9, 7,9 Гц, 1H), 7,54 (д, J=7,9 Гц, 1H), 7,39 (д, J=7,9 Гц, 1H), 5,32-5,21 (ушир. м, 1H), 4,29 (дд, J=8,6, 7,7 Гц, 1H), 4,04-3,98 (м, 1H), 4,00 (дд, J=8,8, 8,8 Гц, 1H), 3,92-3,72 (м, 4H), 3,52-3,34 (м, 2H), 2,66-2,35 (ушир. с, 1H), 2,25 (дд, половина АВХ картины, J=12,5, 8,6 Гц, 1H), 2,21-2,12 (м, 1H), 1,93-1,56 (м, 4H, предполагаемый; частично скрытый пиком воды).
Стадия 9. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 2 [из C55 , DIАST 2] ( 15 ).
Превращение С55 в продукт осуществляли с использованием способа, использованного для синтеза 14 из С54. Очистку в этом случае проводили с помощью однократного разделения обращенно-фазовой ВЭЖХ (колонка: Agela Durashell С18, 5 мкм; подвижная фаза A: 0,225% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил; градиент: от 40% до 60% B). Продукт выделяли в виде коричневой смолы. Выход: 9,66 мг, 21,8 мкмоль, 15%. ЖХМС m/z 443,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,81 (дд, J=8,0, 7,5 Гц, 1H), 7,54 (д, J=7,5 Гц, 1H), 7,39 (д, J=8,0 Гц, 1H), 5,33-5,20 (ушир. м, 1H), 4,29 (дд, J=8,5, 8,0 Гц, 1H), 4,05-3,96 (м, 2H), 3,92-3,72 (м, 4H), 3,51-3,33 (м, 2H), 2,58-2,36 (ушир. с, 1H), 2,25 (ушир. дд, половина АВХ картины, J=12,6, 8,5 Гц, 1H), 2,16 (дд, половина АВХ картины, J=12,6, 9,0 Гц, 1H), 1,93-1,6 (м, 4H, предполагаемый; частично скрытый пиком воды).
Примеры 16 и 17
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-3-(5-фторпиридин-2-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 1 [из C59 , DIАST 1] ( 16 ) и (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-(5-фторпиридин-2-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 2 [из C60 , DIАST 2] ( 17 )
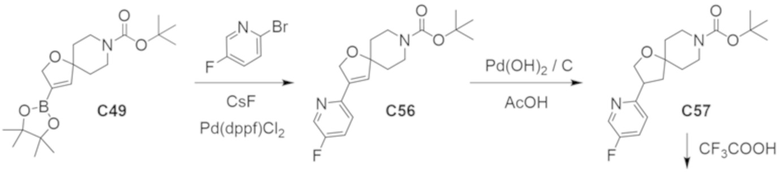
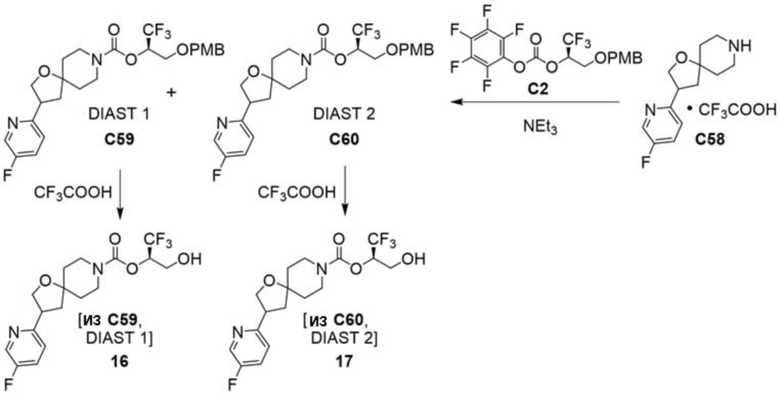
Стадия 1. Синтез трет-бутил-3-(5-фторпиридин-2-ил)-1-окса-8-азаспиро[4.5]дец-3-ен-8-карбоксилата ( C56 ).
2-Бром-5-фторпиридин (1,35 г, 7,67 ммоль), фторид цезия (2,69 г, 17,7 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (432 мг, 0,590 ммоль) и воду (5 мл) добавляли к C49 [неочищенной реакционной смеси от получения C49 из C48; 5,9 ммоль C49 в 1,4-диоксане (50 мл)]. Реакционную смесь перемешивали при 80°C в течение 16 ч, после чего ее концентрировали под вакуумом. Остаток растворяли в этилацетате (200 мл) и фильтровали, и фильтрат концентрировали при пониженном давлении и очищали с помощью хроматографии на силикагеле (градиент: 0-25% этилацетата в петролейном эфире), получая продукт в виде почти белого твердого вещества. По данным 1Н ЯМР этот продукт был слегка загрязненным. Выход: 1,23 г, <3,68 моль, <62%. ЖХМС m/z 278,9 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 МГц, CDCl3), только характеристические пики продукта: δ 8,42 (д, J=2,5 Гц, 1H), 7,42-7,34 (м, 2H), 6,37 (т, J=2,2 Гц, 1H), 5,08 (д, J=2,0 Гц, 2H), 3,86-3,73 (ушир. м, 2H), 3,39-3,27 (м, 2H), 1,48 (с, 9H).
Стадия 2. Синтез трет-бутил-3-(5-фторпиридин-2-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C57 ).
Раствор С56 (295 мг, 0,882 ммоль) в смеси уксусной кислоты и метанола (соотношение 1:20; 25 мл) добавляли к суспензии гидроксида палладия на угле [20% Pd (50% увлажненный водой); 30 мг] в метаноле (2 мл) в реакторе Парра. Реакционную смесь гидрировали при 50 фунт/кв.дюйм (0,34 МПа) при комнатной температуре до тех пор, пока ЖХМС-анализ не показал, что реакция по существу завершена, после чего реакционную смесь фильтровали через диатомовую землю. Фильтрующий слой промывали метанолом и объединенные фильтраты концентрировали под вакуумом, получая продукт в виде прозрачного золотистого масла (375 мг). По данным 1Н ЯМР этот продукт содержал некоторое количество примесей; его переносили непосредственно на следующую стадию. ЖХМС m/z 281,4 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 МГц, CD3OD), только пики продукта: δ 8,39 (д, J=2,7 Гц, 1H), 7,53 (ддд, J=8,6, 8,6, 3,0 Гц, 1H), 7,39 (дд, J=8,8, 4,5 Гц, 1H), 4,22 (дд, J=8,2, 7,8 Гц, 1H), 3,92 (дд, J=9,0, 8,6 Гц, 1H), 3,79-3,69 (м, 1H), 3,67-3,56 (м, 2H), 3,42-3,3 (м, 2H), 2,28 (дд, J=12,5, 8,2 Гц, 1H), 2,05 (дд, J=12,5, 9,8 Гц, 1H), 1,78-1,69 (м, 3H), 1,68-1,57 (м, 1H), 1,46 (с, 9H).
Стадия 3. Синтез 3-(5-фторпиридин-2-ил)-1-окса-8-азаспиро[4.5]декана, трифторацетатной соли ( C58 ).
Трифторуксусную кислоту (2 мл) добавляли к 0°С раствору С57 (с предыдущей стадии; ≤0,882 ммоль) в дихлорметане (10 мл), и реакционной смеси давали нагреться до комнатной температуры. Через 2 ч при комнатной температуре ее концентрировали под вакуумом, с получением продукта в виде масла (395 мг). Это вещество использовали непосредственно на следующей стадии. ЖХМС m/z 237,4 [M+H]+. 1H ЯМР (400 МГц, CDCl3), характеристические пики: δ 8,64 (д, J=2,0 Гц, 1H), 7,76-7,69 (м, 1H), 7,51 (дд, J=9,2, 4,9 Гц, 1H), 4,31 (дд, J=9,0, 7,4 Гц, 1H), 4,01 (дд, J=8,6, 8,2 Гц, 1H), 3,97-3,87 (м, 1H), 2,44 (дд, J=13,1, 8,4 Гц, 1H), 2,09 (дд, J=13,1, 9,2 Гц, 1H).
Стадия 4. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(5-фторпиридин-2-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 1 ( C59 ) и (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(5-фторпиридин-2-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 2 ( C60 ).
Превращение С58 в смесь С59 и С60 осуществляли, используя способ, описанный для синтеза С5 из С4 в примере 1. В этом случае хроматографию на силикагеле проводили с использованием элюентов 5%, затем 10%, 20% и 30% этилацетата в гептане, получая продукт в виде густого бесцветного масла. Выход диастереомерной смеси: 231 мг, 0,451 ммоль, 51% за три стадии.
Разделение С59 и С60 проводили с помощью сверхкритической флюидной хроматографии (колонка: Chiral Technologies Chiralcel OJ, 5 мкм; Подвижная фаза: 9:1 диоксид углерода/(метанол, содержащий 0,2% гидроксида аммония)]. Элюирующимся первым диастереомером был С59, полученный в виде бесцветного масла. Выход: 70,3 мг, 0,137 ммоль, 30% для разделения. ЖХМС m/z 558,6 [M+HCOOH+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,42 (д, J=2,7 Гц, 1H), 7,34 (ддд, J=8,6, 8,2, 2,7 Гц, 1H), 7,25 (ушир. д, J=8,6 Гц, 2H), 7,18 (дд, J=8,6, 4,7 Гц, 1H), 6,88 (ушир. д, J=7,4 Гц, 2H), 5,54-5,43 (м, 1H), 4,51 (AB квартет, сильнопольный дублет уширен, JAB=11,7 Гц, ΔνAB=27,7 Гц, 2H), 4,24 (дд, J=8,2, 7,8 Гц, 1H), 3,95 (дд, J=9,0, 8,6 Гц, 1H), 3,87-3,62 (м, 5H), 3,81 (ушир. с, 3H), 3,48-3,35 (м, 2H), 2,26-2,13 (м, 1H), 2,13-2,00 (м, 1H), 1,88-1,65 (м, 3H), 1,67-1,54 (м, 1H).
Элюирующимся вторым диастереомером был C60, также выделяемый в виде бесцветного масла. Выход: 69,3 мг, 0,135 ммоль, 30% для разделения. ЖХМС m/z 535,7 [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 8,41 (д, J=2,7 Гц, 1H), 7,34 (ддд, J=8,6, 8,2, 3,1 Гц, 1H), 7,25 (ушир. д, J=8,6 Гц, 2H), 7,18 (дд, J=8,6, 4,3 Гц, 1H), 6,88 (ушир. д, J=8,2 Гц, 2H), 5,55-5,43 (ушир. м, 1H), 4,51 (AB квартет, сильнопольный дублет уширен, JAB=11,5 Гц, ΔνAB=27,5 Гц, 2H), 4,24 (дд, J=8,2, 7,8 Гц, 1H), 4,00-3,90 (ушир. м, 1H), 3,88-3,61 (м, 5H), 3,81 (ушир. с, 3H), 3,47-3,34 (м, 2H), 2,27-2,12 (м, 1H), 2,12-2,00 (м, 1H), 1,87-1,50 (м, 4H).
Стадия 5. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-(5-фторпиридин-2-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 1 [из C59 , DIАST 1] ( 16 ).
Трифторуксусную кислоту (1 мл) добавляли по каплям к 0°С раствору С59 (70 мг, 0,14 ммоль) в дихлорметане (4 мл). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2 ч, после чего ее концентрировали под вакуумом. Остаток распределяли между насыщенным водным раствором бикарбоната натрия и дихлорметаном и водный слой экстрагировали дихлорметаном. Объединенные органические слои сушили над сульфатом натрия, фильтровали, концентрировали при пониженном давлении и очищали хроматографией на силикагеле (элюенты: 10%, затем 25% и 50% этилацетата в гептане), с получением продукта в виде бесцветного масла, которое содержало некоторое количество растворителя. Выход: 60 мг. ЖХМС m/z 393,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,46 (д, J=2,7 Гц, 1H), 7,42 (ддд, J=8,4, 8,2, 2,9 Гц, 1H), 7,26 (дд, J=8,6, 4,3 Гц, 1H), 5,31-5,20 (ушир. м, 1H), 4,25 (дд, J=8,6, 7,8 Гц, 1H), 4,00 (дд, половина АВХ картины, J=12,5, 3,1 Гц, 1H), 3,96 (дд, J=8,6, 8,6 Гц, 1H), 3,92-3,68 (м, 4H), 3,51-3,33 (м, 2H), 2,26 (дд, половина АВХ картины, J=12,5, 8,6 Гц, 1H), 2,05 (дд, половина АВХ картины, J=12,5, 9,8 Гц, 1H), 1,87-1,70 (м, 3H), 1,70-1,55 (м, 1H).
Стадия 6. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-(5-фторпиридин-2-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, DIАST 2 [из C60 , DIАST 2] ( 17 ).
Превращение С60 в продукт осуществляли с использованием способа, использованного для синтеза 16 из С59. Продукт получали в виде бесцветного масла. Выход с поправкой на растворитель: 48 мг, 0,12 ммоль, 92%. ЖХМС m/z 415,0 [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 8,41 (д, J=2,7 Гц, 1H), 7,34 (ддд, J=8,6, 8,2, 2,7 Гц, 1H), 7,18 (дд, J=8,6, 4,7 Гц, 1H), 5,31-5,20 (ушир. м, 1H), 4,24 (дд, J=8,2, 8,2 Гц, 1H), 4,04-3,91 (м, 2H), 3,91-3,73 (м, 3H), 3,73-3,63 (м, 1H), 3,51-3,31 (м, 2H), 2,8-2,3 (оч. ушир. с, 1H), 2,22 (дд, половина АВХ картины, J=12,7, 8,4 Гц, 1H), 2,08 (дд, половина АВХ картины, J=12,5, 9,4 Гц, 1H), 1,89-1,58 (м, 4H).
Пример 18
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-{[(циклопропилметил)сульфонил](метил)амино}-7-азаспиро[3.5]нонан-7-карбоксилат ( 18 )
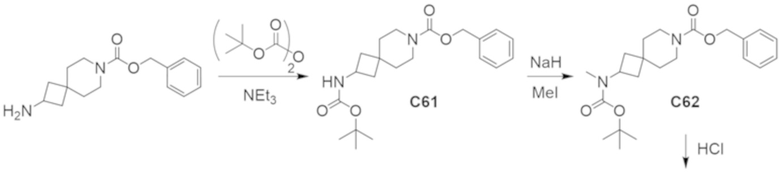
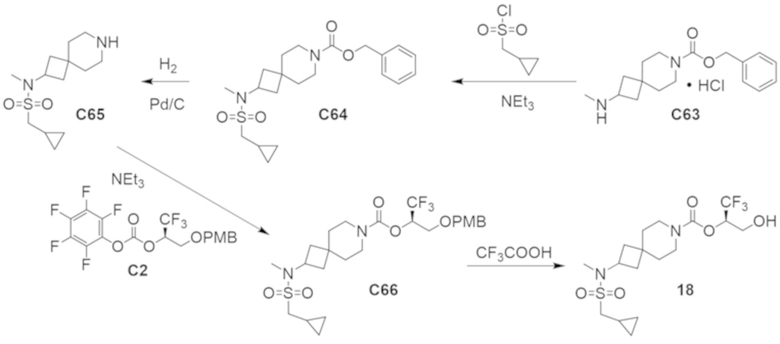
Стадия 1. Синтез бензил-2-[(трет-бутоксикарбонил)амино]-7-азаспиро[3.5]нонан-7-карбоксилата ( C61 ).
К раствору бензил-2-амино-7-азаспиро[3.5]нонан-7-карбоксилата (17,8 г, 64,9 ммоль) и триэтиламина (9,86 г, 97,4 ммоль) в метаноле (300 мл) добавляли ди-трет-бутилдикарбонат (15,6 г, 71,5 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем ее концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле, получая продукт в виде белого твердого вещества. Выход: 13,0 г, 34,7 ммоль, 53%. 1H ЯМР (400 МГц, CDCl3) δ 7,39-7,28 (м, 5H), 5,12 (с, 2H), 4,75-4,60 (ушир. м, 1H), 4,19-4,04 (ушир. м, 1H), 3,48-3,40 (м, 2H), 3,40-3,30 (м, 2H), 2,37-2,22 (м, 2H), 1,64-1,37 (м, 6H, предполагаемый; частично скрытый пиком воды), 1,44 (с, 9H).
Стадия 2. Синтез бензил-2-[(трет-бутоксикарбонил)(метил)амино]-7-азаспиро[3.5]нонан-7-карбоксилата ( C62 ).
Гидрид натрия (60% дисперсия в минеральном масле; 320 мг, 8,0 ммоль) добавляли к 0°C раствору C61 (2,00 г, 5,34 ммоль) в тетрагидрофуране (25 мл) и реакционную смесь перемешивали при 0°C в течение 30 мин. Добавляли по каплям йодметан (985 мг, 6,94 ммоль) к реакционной смеси 0°С, которую затем оставляли перемешиваться при 30°С в течение 16 ч. Медленно добавляли воду (15 мл), полученную смесь экстрагировали этилацетатом (2×30 мл), и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом с получением продукта в виде желтой смолы (2,36 г). Это вещество использовали непосредственно на следующей стадии. ЖХМС m/z 411,2 [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 7,40-7,29 (м, 5H), 5,12 (с, 2H), 4,67-4,35 (оч. ушир. м, 1H), 3,48-3,42 (м, 2H), 3,41-3,35 (м, 2H), 2,80 (с, 3H), 2,15-2,06 (м, 2H), 1,89-1,80 (м, 2H), 1,67-1,56 (м, 2H, предполагаемый; частично скрытый пиком воды), 1,56-1,47 (м, 2H), 1,46 (с, 9H).
Стадия 3. Синтез бензил-2-(метиламино)-7-азаспиро[3.5]нонан-7-карбоксилата, гидрохлоридной соли ( C63 ).
Соединение C62 (с предыдущей стадии, ≤5,34 ммоль) растворяли в метанольном растворе хлористого водорода (0,2 М, 25 мл) и перемешивали при 30°C в течение 2 ч. Затем реакционную смесь концентрировали под вакуумом, с получением продукта в виде бледно-желтой смолы (3,1 г), часть которой непосредственно использовали на следующей стадии. ЖХМС m/z 289,1 [M+H]+.
Стадия 4. Синтез бензил-2-{[(циклопропилметил)сульфонил](метил)амино}-7-азаспиро[3.5]нонан-7-карбоксилата ( C64 ).
Циклопропилметансульфонилхлорид (134 мг, 0,867 ммоль) добавляли по каплям к 0°C раствору C63 [с предыдущей стадии; 400 мг (загрязненный), ≤0,69 ммоль] и триэтиламина (202 мг, 2,00 ммоль) в дихлорметане (8 мл). Реакционную смесь перемешивали при комнатной температуре (28°С) в течение 2,5 ч, после чего ее концентрировали под вакуумом. Остаток очищали хроматографией на силикагеле (градиент: от 17% до 33% этилацетата в петролейном эфире) с получением продукта в виде бледно-желтой смолы. Выход: 90 мг, 0,22 ммоль, 32% за три стадии.
Стадия 5. Синтез N-(7-азаспиро[3.5]нон-2-ил)-1-циклопропил-N-метилметансульфонамида ( C65 ).
Смесь C64 (140 мг, 0,344 ммоль) и Pd/C (20 мг) в метаноле (10 мл) перемешивали при комнатной температуре (26°С) в атмосфере водорода (15 фунт/кв. дюйм (0,10 МПа)) в течение 16 ч. Катализатор удаляли фильтрованием и собранное твердое вещество промывали метанолом (10 мл). Объединенные фильтраты концентрировали под вакуумом, получая продукт в виде бледно-желтой смолы (80 мг), который по данным 1Н ЯМР не являлся чистым. Это вещество использовали непосредственно на следующей стадии. 1H ЯМР (400 МГц, CD3OD), только пики продукта: δ 4,38-4,26 (м, 1H), 2,90 (д, J=7,0 Гц, 2H), 2,87 (с, 3H), 2,78-2,72 (м, 2H), 2,70-2,64 (м, 2H), 2,14-1,95 (м, 4H), 1,64-1,59 (м, 2H), 1,56-1,50 (м, 2H), 1,10-0,97 (м, 1H), 0,69-0,60 (м, 2H), 0,40-0,33 (м, 2H).
Стадия 6. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-{[(циклопропилметил)сульфонил](метил)амино}-7-азаспиро[3.5]нонан-7-карбоксилата ( C66 ).
Превращение С65 в С66 осуществляли, используя способ, описанный для синтеза смеси С13 и С14 из С12 в примерах 3 и 4. В этом случае очистку проводили с помощью хроматографии на силикагеле (градиент: от 9% до 25% этилацетата в петролейном эфире) с последующей обращенно-фазовой ВЭЖХ (колонка: Waters XBridge C18 OBD, 5 мкм; подвижная фаза A: вода, содержащая 0,05% гидроксида аммония; подвижная фаза B: ацетонитрил; градиент: от 45% до 75% B). Выход: 43 мг, 78 мкмоль, 23% за две стадии. ЖХМС m/z 571,1 [M+Na+].
Стадия 7. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-{[(циклопропилметил)сульфонил](метил)амино}-7-азаспиро[3.5]нонан-7-карбоксилата ( 18 ).
Трифторуксусную кислоту (1 мл) добавляли к раствору C66 (42 мг, 77 мкмоль) в дихлорметане (3 мл) и реакционную смесь перемешивали при комнатной температуре (28°С) в течение 3 ч. После разбавления дихлорметаном (20 мл) смесь промывали насыщенным водным раствором бикарбоната натрия (3 × 10 мл), концентрировали под вакуумом и очищали обращенно-фазовой ВЭЖХ (колонка: Agela Durashell С18, 5 мкм; подвижная фаза A: 0,225% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил; градиент: от 30% до 50% B). Продукт выделяли в виде желтой смолы. Выход: 7,13 мг, 16,6 мкмоль, 22%. ЖХМС m/z 429,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 5,30-5,18 (м, 1H), 4,46-4,31 (м, 1H), 4,00 (дд, половина АВХ картины, J=12,5, 2,9 Гц, 1H), 3,87 (дд, половина АВХ картины, J=12,3, 6,6 Гц, 1H), 3,56-3,30 (ушир. м, 4H), 2,89 (с, 3H), 2,83 (д, J=7,0 Гц, 2H), 2,19-2,09 (м, 2H), 2,01 (дд, J=11,9, 9,2 Гц, 2H), 1,71-1,51 (ушир. м, 4H, предполагаемый; частично скрытый пиком воды), 1,14-1,02 (м, 1H), 0,73-0,66 (м, 2H), 0,39-0,32 (м, 2H).
Пример 19
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-2-{[6-(дифторметил)пиридин-3-ил]окси}-7-азаспиро[3.5]нонан-7-карбоксилат ( 19 )
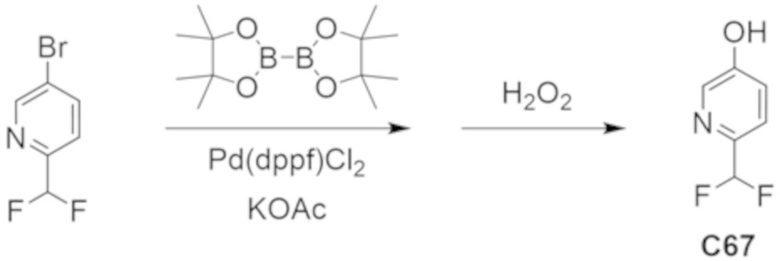
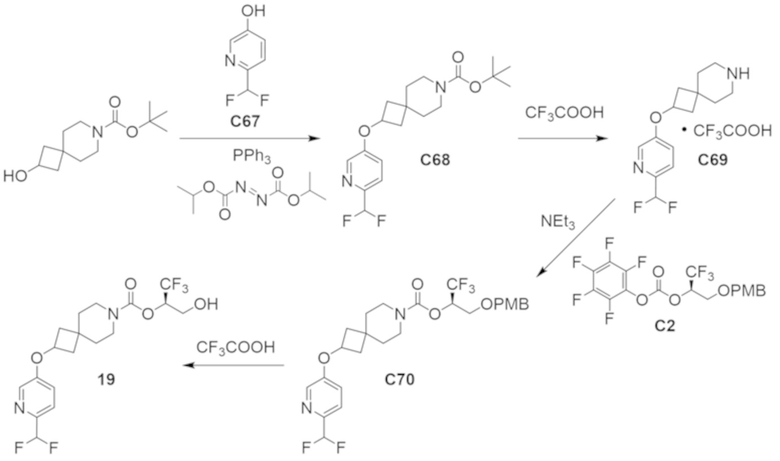
Стадия 1. Синтез 6-(дифторметил)пиридин-3-ола ( C67 ).
4,4,4',4',5,5,5',5'-Октaметил-2,2'-би-1,3,2-диоксаборолан (537 мг, 2,11 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (141 мг, 0,193 ммоль), и ацетат калия (377 мг, 3,84 ммоль) добавляли в 30°С раствор 5-бром-2-(дифторметил)пиридина (400 мг, 1,92 ммоль) в 1,4-диоксане (5 мл). После того как реакционную смесь дегазировали азотом в течение 5 мин, ее перемешивали в течение 18 ч при 115°C, после чего ее фильтровали. Концентрирование фильтрата давало черное твердое вещество (1,17 г), которое разделяли на две части для добавления следующего реагента. Одну часть этого вещества (870 мг, ≤1,43 ммоль) растворяли в смеси тетрагидрофурана (10 мл) и воды (10 мл) и обрабатывали перекисью водорода (30% водный раствор; 487 мг, 4,29 ммоль) при 28°С. Реакционную смесь перемешивали в течение 15 ч при 28°С, после чего ее объединяли с реакционной смесью из второй порции, и окислитель гасили добавлением насыщенного водного раствора сульфита натрия (5 мл) (пока результат тестирования смеси на крахмал не становился отрицательным на индикаторной бумаге с йодидом калия). Полученную смесь экстрагировали этилацетатом (2 × 20 мл) и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Хроматография на силикагеле (градиент: от 0% до 25% этилацетата в петролейном эфире) давала продукт в виде белого твердого вещества. Выход: 148 мг, 1,02 ммоль, 53%. ЖХМС m/z 145,9 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,28 (д, J=2,5 Гц, 1H), 7,56 (д, J=8,5 Гц, 1H), 7,30 (дд, J=8,5, 2,5 Гц, 1H), 6,62 (т, JHF=55,7 Гц, 1H).
Стадия 2. Синтез трет-бутил-2-{[6-(дифторметил)пиридин-3-ил]окси}-7-азаспиро[3.5]нонан-7-карбоксилата ( C68 ).
К 0°С смеси трет-бутил-2-гидрокси-7-азаспиро[3.5]нонан-7-карбоксилата (50 мг, 0,21 ммоль), C67 (39,1 мг, 0,269 ммоль) и трифенилфосфина (109 мг, 0,416 ммоль) в тетрагидрофуране (1,5 мл) по каплям добавляли диизопропилазодикарбоксилат (83,8 мг, 0,414 ммоль), и реакционную смесь перемешивали при 28°С в течение 15 ч. Затем ее непосредственно очищали препаративной тонкослойной хроматографией на силикагеле (элюент: 3:1 петролейный эфир/этилацетат), получая продукт в виде желтой смолы (100 мг), который по данным 1Н ЯМР-анализа был загрязнен материалом, полученным из диизопропилазодикарбоксилата. 1H ЯМР (400 МГц, CDCl3), только пики продукта: δ 8,22 (д, J=2,5 Гц, 1H), 7,56 (д, J=8,5 Гц, 1H), 7,18 (дд, J=8,5, 3,0 Гц, 1H), 6,61 (т, JHF=55,7 Гц, 1H), 4,80-4,72 (м, 1H), 3,42-3,36 (м, 2H), 3,36-3,30 (м, 2H), 2,49-2,41 (м, 2H), 2,03-1,95 (м, 2H), 1,65-1,56 (м, 4H, предполагаемый; частично скрытый пиком воды), 1,46 (с, 9H).
Стадия 3. Синтез 2-{[6-(дифторметил)пиридин-3-ил]окси}-7-азаспиро[3.5]нонана, трифторацетатной соли ( C69 ).
Трифторуксусную кислоту (1 мл) добавляли к 0°С раствору С68 (256 мг, 0,695 ммоль) в дихлорметане (4 мл). Реакционную смесь перемешивали при 28°C в течение 2 ч, после чего ее концентрировали при пониженном давлении с получением продукта в виде желтой смолы. Это вещество использовали непосредственно на следующей стадии. ЖХМС m/z 268,9 [M+H]+.
Стадия 4. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-{[6-(дифторметил)пиридин-3-ил]окси}-7-азаспиро[3.5]нонан-7-карбоксилата ( C70 ).
Превращение С69 в С70 осуществляли, используя способ, описанный для синтеза смеси С13 и С14 из С12 в примерах 3 и 4. Продукт получали в виде желтой смолы. Выход: 259 мг, 0,476 ммоль, 68% за 2 стадии. ЖХМС m/z 545,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3), характеристические пики: δ 8,21 (д, J=3,0 Гц, 1H), 7,57 (д, J=8,5 Гц, 1H), 7,24 (д, J=8,5 Гц, 2H), 7,19 (дд, J=8,5, 3,0 Гц, 1H), 6,88 (д, J=8,5 Гц, 2H), 6,62 (т, JHF=55,7 Гц, 1H), 5,53-5,42 (м, 1H), 4,82-4,72 (м, 1H), 4,51 (AB квартет, JAB=11,8 Гц, ΔνAB=28,5 Гц, 2H), 3,81 (с, 3H), 3,79-3,65 (м, 2H), 3,54-3,35 (ушир. м, 4H), 2,52-2,41 (м, 2H), 2,05-1,95 (м, 2H).
Стадия 5. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-{[6-(дифторметил)пиридин-3-ил]окси}-7-азаспиро[3.5]нонан-7-карбоксилата ( 19 ).
Трифторуксусную кислоту (1 мл) добавляли к 10°С раствору С70 (259 мг, 0,476 ммоль) в дихлорметане (4 мл). Реакционную смесь перемешивали при 30°С в течение 1 ч, после чего ее промывали насыщенным водным раствором бикарбоната натрия (2 × 3 мл) и концентрировали под вакуумом. Остаток очищали обращенно-фазовой ВЭЖХ (колонка: Agela Durashell, 5 мкм; подвижная фаза A: 0,225% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил; градиент: от 42% до 62% B), затем сверхкритической флюидной хроматографией (колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 3:2 диоксид углерода/этанол) с получением продукта в виде коричневой смолы. Выход: 27,7 мг, 65,3 мкмоль, 14%. ЖХМС m/z 425,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,21 (д, J=3,0 Гц, 1H), 7,56 (д, J=8,5 Гц, 1H), 7,18 (дд, J=8,8, 2,8 Гц, 1H), 6,61 (т, JHF=55,7 Гц, 1H), 5,30-5,21 (м, 1H), 4,82-4,73 (м, 1H), 4,00 (дд, половина АВХ картины, J=12,6, 3,0 Гц, 1H), 3,86 (дд, половина АВХ картины, J=12,3, 6,8 Гц, 1H), 3,59-3,34 (м, 4H), 2,53-2,42 (м, 2H), 2,07-1,98 (м, 2H), 1,75-1,6 (ушир. м, 4H, предполагаемый; частично скрытый пиком воды).
Альтернативный синтез примера 11
(2R)-1,1,1-Трифтор-3-гидроксипропан-2-ил-(3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат ( 11 )
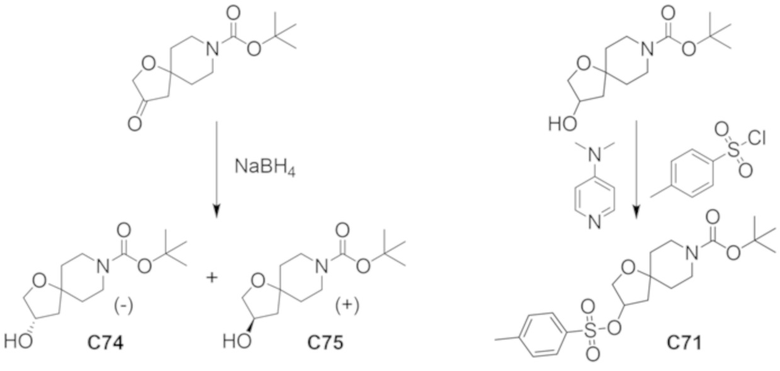
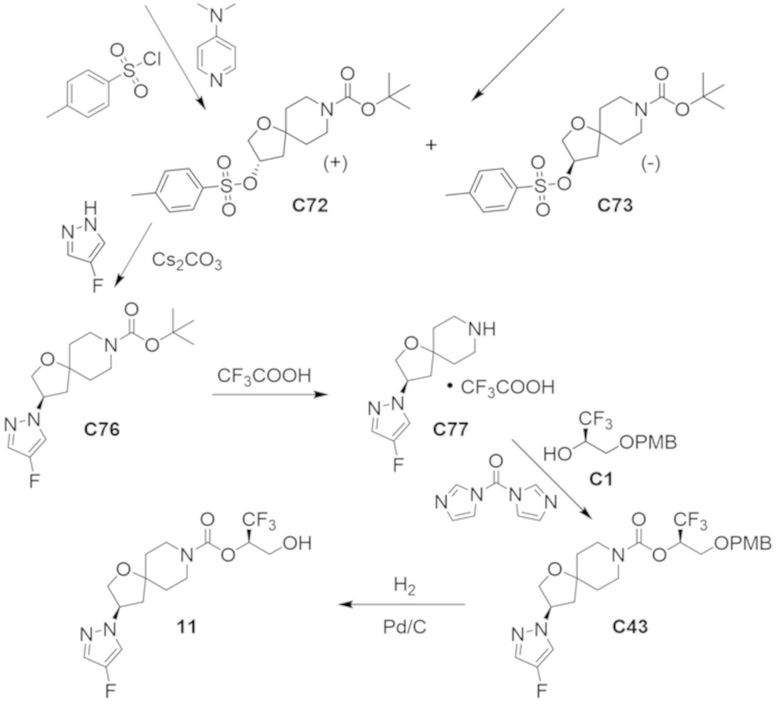
Стадия 1. Синтез трет-бутил-3-{[(4-метилфенил)сульфонил]окси}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C71 ).
П-толуолсульфонилхлорид (359 мг, 1,88 ммоль) и 4-(диметиламино)пиридин (558 мг, 4,57 ммоль) добавляли к 27°С раствору трет-бутил-3-гидрокси-1-окса-8-азаспиро[4.5]декан-8-карбоксилата (440 мг, 1,71 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при 25°С в течение 16 ч, после чего ее объединяли с аналогичной реакционной смесью, полученной с трет-бутил-3-гидрокси-1-окса-8-азаспиро[4,5]декан-8-карбоксилатом (30 мг, 0,12 ммоль) и концентрировали под вакуумом. Остаток очищали хроматографией на силикагеле (градиент: от 0% до 30% этилацетата в петролейном эфире) с получением продукта в виде бесцветной смолы. Общий выход: 640 мг, 1,56 ммоль, 85%. ЖХМС m/z 434,0 [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 7,79 (д, J=8,4 Гц, 2H), 7,36 (д, J=8,4 Гц, 2H), 5,13-5,06 (ушир. м, 1H), 3,97-3,88 (м, 2H), 3,67-3,53 (ушир. м, 2H), 3,31-3,19 (м, 2H), 2,46 (с, 3H), 2,01 (ушир. дд, половина АВХ картины, J=14,3, 2,0 Гц, 1H), 1,93 (дд, половина АВХ картины, J=14,5, 6,6 Гц, 1H), 1,82-1,74 (м, 1H), 1,61-1,48 (м, 3H), 1,45 (с, 9H).
Стадия 2. Выделение трет-бутил-(3S)-3-{[(4-метилфенил)сульфонил]окси}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C72 ) и трет-бутил-(3R)-3-{[(4-метилфенил)сульфонил]окси}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C73 ).
Сверхкритическую жидкостную хроматографию использовали для разделения C71 (из предыдущей стадии; 640 мг, 1,56 ммоль) на составляющие его энантиомеры [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 3:2 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым продукт, полученный в виде бесцветной смолы, который показал положительное (+) вращение, был обозначен как C72. Указанная абсолютная стереохимия C72 была установлена на основе рентгеновской кристаллической структуры, определенной на его энантиомере C73 (см. ниже). Выход: 259 мг, 0,629 ммоль, 40%. ЖХМС m/z 434,0 [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 7,79 (ушир. д, J=8,0 Гц, 2H), 7,36 (д, J=8,0 Гц, 2H), 5,14-5,06 (ушир. м, 1H), 3,97-3,89 (м, 2H), 3,67-3,54 (ушир. м, 2H), 3,31-3,20 (м, 2H), 2,47 (с, 3H), 2,01 (ушир. дд, половина АВХ картины, J=14,3, 1,8 Гц, 1H), 1,93 (дд, половина АВХ картины, J=14,6, 6,5 Гц, 1H), 1,82-1,74 (м, 1H), 1,60-1,48 (м, 3H), 1,45 (с, 9H).
Элюирующийся вторым продукт, также полученный в виде бесцветной смолы, показал отрицательное (-) вращение и был обозначен как C73. Выход: 263 мг, 0,639 ммоль, 41%. ЖХМС m/z 434,1 [M+Na+]. 1H ЯМР (400 МГц, CDCl3) δ 7,79 (ушир. д, J=8,0 Гц, 2H), 7,36 (д, J=8,0 Гц, 2H), 5,13-5,06 (ушир. м, 1H), 3,97-3,89 (м, 2H), 3,68-3,53 (ушир. м, 2H), 3,31-3,20 (м, 2H), 2,46 (с, 3H), 2,01 (ушир. дд, половина АВХ картины, J=14,3, 1,8 Гц, 1H), 1,93 (дд, половина АВХ картины, J=14,6, 6,5 Гц, 1H), 1,82-1,74 (м, 1H), 1,61-1,48 (м, 3H), 1,45 (с, 9H).
Образец C73 перекристаллизовывали из простого трет-бутилметилового эфира/пентана и использовали для определения абсолютной конфигурации с помощью рентгеновской кристаллографии:
Монокристальное рентгеноструктурное определение С73
Монокристальная рентгеновская дифрактометрия
Сбор данных проводили на дифрактометре Bruker D8 Quest при комнатной температуре. Сбор данных состоял из омега- и фи- сканирований.
Структуру определяли прямыми способами, с использованием программного комплекса SHELX в орторомбической пространственной группе P212121. Структура была впоследствии уточнена полноматричным методом наименьших квадратов. Все неводородные атомы находили и уточняли с использованием параметров анизотропного смещения.
Атомы водорода помещали в расчетные положения и позволяли им перемещаться на своих атомах-носителях. Конечное уточнение включало параметры изотропного смещения для всех атомов водорода.
Анализ абсолютной структуры с использованием методов правдоподобия (Hooft, 2008) проводили с использованием PLATON (Spek, 2010). При условии энантиомерной чистоты образца результаты показывают, что абсолютная структура была правильно определена. Метод вычисляет, что вероятность того, что структура была правильно определена, равна 100,0. Параметр Хуфта определяется как 0,04 с esd 0,002.
Конечный R-фактор составлял 6,0%. Конечная разностная карта Фурье не показала отсутствующей или неверно установленной электронной плотности.
Соответствующая информация о кристалле, сборе данных и уточнении приведена в таблице 14. Атомные координаты, длины связей, углы связей и параметры смещения приведены в таблицах 15-17.
Программное обеспечение и ссылки на источники
SHELXTL, версия 5.1, Bruker AXS, 1997.
PLATON, A. L. Spek, J. Appl. Cryst. 2003, 36, 7-13.
MERCURY, C. F. Macrae, P. R. Edington, P. McCabe, E. Pidcock, G. P. Shields, R. Taylor, M. Towler, J. van de Streek, J. Appl. Cryst. 2006, 39, 453-457.
OLEX2, O. V. Dolomanov, L. J. Bourhis, R. J. Gildea, J. A. K. Howard, H. Puschmann, J. Appl. Cryst. 2009, 42, 339-341.
R. W. W. Hooft, L. H. Straver, and A. L. Spek, J. Appl. Cryst. 2008, 41, 96-103.
H. D. Flack, Acta Cryst. 1983, A39, 867-881.
Таблица 14. Данные кристалла и уточнение структуры для C73.
Таблица 15. Атомные координаты (× 104) и эквивалентные параметры изотропного смещения (Å2×103) для C73. U(eq) представляет собой 1/3 следа ортогонализированного тензора Uij.
Таблица 16. Длины [Å] и углы [°] связей для C73.
Преобразования симметрии использовали для формирования эквивалентных атомов.
Таблица 17. Параметры анизотропного смещения (Å2×103) для C73. Показатель коэффициента анизотропного смещения принимает вид: -2π2[h2 a*2U11 +...+2 h k a* b* U12 ].
Стадия 3. Синтез трет-бутил-(3S)-3-гидрокси-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C74 ) и трет-бутил-(3R)-3-гидрокси-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C75 ).
Борогидрид натрия (445 мг, 11,8 ммоль) добавляли к 0°С раствору трет-бутил-3-оксо-1-окса-8-азаспиро[4.5]декан-8-карбоксилата (1,50 г, 5,88 ммоль) в метаноле (59 мл) и реакционную смесь перемешивали при 23°С в течение 2 ч. После удаления растворителя под вакуумом остаток распределяли между этилацетатом и водой. Водный слой экстрагировали этилацетатом и объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением смеси С74 и С75 в виде бесцветного масла. Выход рацемического продукта: 1,45 г, 5,63 ммоль, 96%. ГХМС m/z 257,1 [M+]. 1H ЯМР (400 МГц, CDCl3) δ 4,54-4,48 (ушир. м, 1H), 3,93 (дд, половина АВХ картины, J=10,2, 4,3 Гц, 1H), 3,85-3,79 (м, 1H), 3,67-3,53 (ушир. м, 2H), 3,40-3,28 (м, 2H), 1,97 (дд, половина АВХ картины, J=13,7, 6,2 Гц, 1H), 1,89-1,48 (м, 6H, предполагаемый; частично скрытый пиком воды), 1,46 (с, 9H).
Часть этого рацемического вещества (1,30 г, 5,05 ммоль) разделяли на составляющие его энантиомеры с помощью сверхкритической флюидной хроматографии [колонка: Phenomenex Lux Amylose-1, 5 мкм; подвижная фаза: 85:15 диоксид углерода/(метанол, содержащий 0,2% гидроксида аммония)].
Элюирующийся первым продукт, полученный в виде смолы, который продемонстрировал отрицательное (-) вращение, был обозначен как C74. Выход: 650 мг, 2,53 ммоль, 50% для разделения.
Элюирующийся вторым продукт, полученный в виде твердого вещества, который продемонстрировал положительное (+) вращение, был обозначен как C75. Выход: 620 мг, 2,41 ммоль, 48% для разделения. Указанные абсолютные стереохимические параметры C74 и C75 были определены на основе превращения С74 в С72 (см. стадию 4).
Стадия 4. Альтернативный синтез трет-бутил-(3S)-3-{[(4-метилфенил)сульфонил]окси}-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C72 ).
П-толуолсульфонилхлорид (244 мг, 1,28 ммоль) добавляли к раствору C74 (300 мг, 1,17 ммоль) в дихлорметане (12 мл). Затем добавляли 4-(диметиламино)пиридин (285 мг, 2,33 ммоль) и реакционную смесь перемешивали в течение ночи. После добавления воды смесь экстрагировали дихлорметаном и объединенные органические слои концентрировали под вакуумом и очищали хроматографией на силикагеле (градиент: 10-55% этилацетата в гептане). Продукт получали в виде смолы, которая показала положительное (+) вращение. Выход: 426 мг, 1,04 ммоль, 89%. ЖХМС m/z 412,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,76 (д, J=8,2 Гц, 2H), 7,34 (д, J=7,8 Гц, 2H), 5,10-5,03 (м, 1H), 3,94-3,86 (м, 2H), 3,62-3,53 (м, 2H), 3,27-3,17 (м, 2H), 2,43 (с, 3H), 1,98 (дд, половина АВХ картины, J=14,4, 2,0 Гц, 1H), 1,90 (дд, половина АВХ картины, J=14,6, 6,4 Гц, 1H), 1,79-1,71 (м, 1H), 1,59-1,45 (м, 3H), 1,42 (с, 9H). Данный образец, полученный из C74, был определен как имеющий указанную абсолютную стереохимию путем сравнения его оптического вращения с образцом C72, синтезированным на стадии 2 выше.
Стадия 5. Синтез трет-бутил-(3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C76 ).
К раствору C72 (222 мг, 0,539 ммоль) в N,N-диметилформамиде (3 мл) добавляли карбонат цезия (528 мг, 1,62 ммоль) и 4-фтор-1H-пиразол (69,6 мг, 0,809 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, и затем при 50°С в течение 3 ч, после чего ее разбавляли водой и экстрагировали этилацетатом (3 × 50 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле (градиент: 10-65% этилацетата в гептане) с получением продукта в виде бесцветного масла. Выход: 148 мг, 0,455 ммоль, 84%. ЖХМС m/z 326,4 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,37 (д, J=5,1 Гц, 1H), 7,32 (д, J=4,3 Гц, 1H), 4,88-4,80 (м, 1H), 4,15 (дд, половина АВХ картины, J=10,0, 6,0 Гц, 1H), 4,10 (дд, половина АВХ картины, J=10,2, 4,7 Гц, 1H), 3,68-3,56 (ушир. м, 2H), 3,37-3,26 (м, 2H), 2,28 (дд, половина АВХ картины, J=13,7, 8,6 Гц, 1H), 2,17 (дд, половина АВХ картины, J=13,5, 5,3 Гц, 1H), 1,80-1,59 (м, 3H), 1,59-1,49 (м, 1H), 1,44 (с, 9H).
Стадия 6. Синтез (3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декана, трифторацетатной соли ( C77 ).
Трифторуксусную кислоту (0,70 мл) добавляли к 0°C раствору C76 (148 мг, 0,455 ммоль) в дихлорметане (4,6 мл) и реакционную смесь перемешивали при 0°C в течение 35 мин. Затем ее концентрировали под вакуумом и неоднократно азеотропировали с гептаном (3 × 25 мл), с получением продукта в виде масла. Это вещество использовали непосредственно на следующей стадии. ЖХМС m/z 226,4 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,2-7,9 (ушир. с, 2H), 7,48 (ушир. д, J=3,9 Гц, 1H), 7,45 (ушир. д, J=4,7 Гц, 1H), 5,06-4,98 (м, 1H), 4,23 (дд, половина АВХ картины, J=10,6, 3,9 Гц, 1H), 4,19 (дд, половина АВХ картины, J=10,6, 5,9 Гц, 1H), 3,47-3,30 (ушир. м, 4H), 2,44 (дд, половина АВХ картины, J=14,1, 8,2 Гц, 1H), 2,27 (дд, половина АВХ картины, J=14,1, 4,7 Гц, 1H), 2,12-1,93 (м, 4H).
Стадия 7. Синтез (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( C43 ).
1,1'-Карбонилдиимидазол (75,6 мг, 0,466 ммоль) добавляли к раствору C1 (111 мг, 0,444 ммоль) в ацетонитриле (2 мл). Через 1 ч добавляли раствор C77 (с предыдущей стадии; ≤0,455 ммоль) в ацетонитриле (3 мл) и реакционную смесь перемешивали в течение ночи. Затем растворитель удаляли под вакуумом и остаток растворяли в этилацетате (20 мл), промывали водой, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Хроматография на силикагеле (градиент: 10-50% этилацетата в гептане) давала продукт в виде масла, который по данным 1H ЯМР-анализа содержал загрязнитель. Выход: 80 мг, 0,16 ммоль, 36%. ЖХМС m/z 502,5 [M+H]+. 1H ЯМР (400 МГц, CDCl3), только пики продукта: δ 7,37 (д, J=4,7 Гц, 1H), 7,34 (д, J=4,3 Гц, 1H), 7,24 (ушир. д, J=8,6 Гц, 2H), 6,90-6,84 (м, 2H), 5,53-5,42 (м, 1H), 4,89-4,80 (м, 1H), 4,50 (AB квартет, сильнопольный дублет уширен, JAB=11,7 Гц, νAB=28,5 Гц, 2H), 4,17 (дд, половина АВХ картины, J=9,8, 5,8 Гц, 1H), 4,12 (ушир. дд, половина АВХ картины, J=10, 5 Гц, 1H), 3,84-3,72 (м, 3H), 3,80 (с, 3H), 3,68 (дд, половина АВХ картины, J=11,1, 7,2 Гц, 1H), 3,43-3,29 (ушир. м, 2H), 2,34-2,13 (м, 2H), 1,89-1,61 (м, 3H), 1,56 (ддд, J=13,5, 10,9, 4,5 Гц, 1H).
Стадия 8. Синтез (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата ( 11 ).
Смесь С43 (40 мг, 80 мкмоль) и палладия на угле [10% Pd (50% увлажненный водой); 4 мг] в этаноле (8 мл) гидрировали при 50 фунт/кв.дюйм (0,34 МПа) и 23°С в течение 60 ч. Затем реакционную смесь загружали дополнительным количеством палладия на угле [10% Pd (50% увлажненный водой); 17 мг] и гидрирование при 50 фунт/кв. дюйм (0,34 МПа) продолжали в течение 7 ч, после чего реакционную смесь фильтровали. Фильтрат концентрировали под вакуумом с получением продукта в виде твердого вещества. Это вещество оказалось идентично аутентичному образцу 11 согласно хиральной сверхкритической флюидной хроматографии [колонка: Phenomenex Lux Amylose-1, 5 мкм; подвижная фаза A: диоксид углерода; подвижная фаза B: этанол; градиент: 5% B в течение 1 мин, затем от 5% до 60% B в течение 8,0 мин; скорость потока: 3,0 мл/мин]. Время удерживания: 6,96 мин в сравнении с 6,97 мин. Выход: 25 мг, 66 мкмоль, 82%. ЖХМС m/z 382,4 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,38 (д, J=4,7 Гц, 1H), 7,35 (д, J=3,9 Гц, 1H), 5,31-5,20 (ушир. м, 1H), 4,91-4,82 (м, 1H), 4,18 (дд, половина АВХ картины, J=9,8, 6,2 Гц, 1H), 4,14 (дд, половина АВХ картины, J=10,2, 5,1 Гц, 1H), 4,00 (дд, половина АВХ картины, J=12,5, 3,1 Гц, 1H), 3,91-3,74 (м, 3H), 3,50-3,28 (м, 2H), 2,31 (дд, половина АВХ картины, J=13,7, 8,6 Гц, 1H), 2,23 (ушир. дд, половина АВХ картины, J=13,5, 4,5 Гц, 1H), 1,90-1,53 (м, 4H).
Таблица 18. Способ получения, структура и физико-химические данные для соединений примеров 20-90.
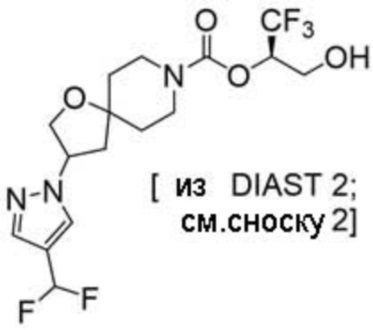
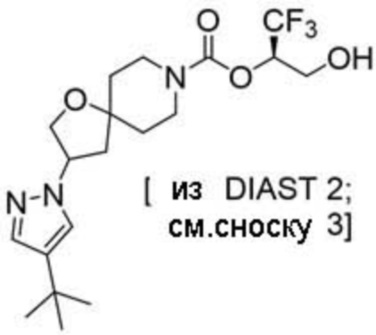
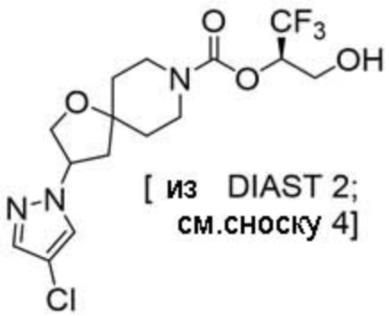
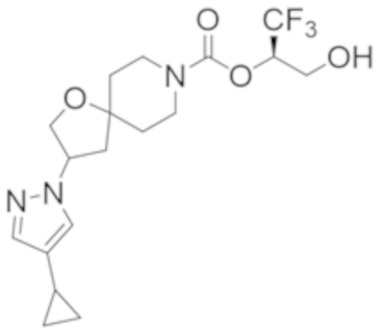
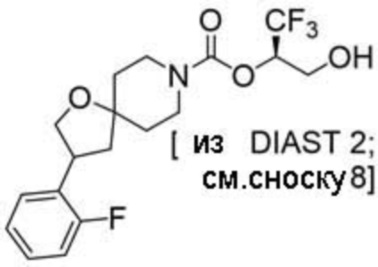
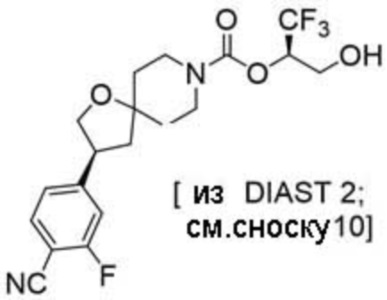
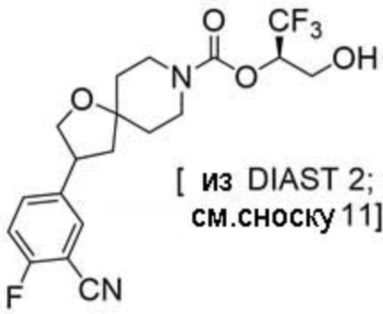
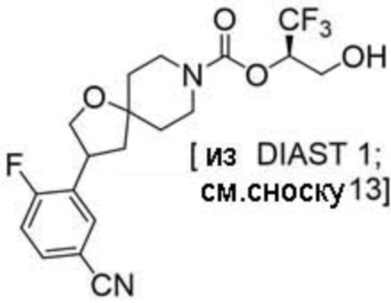
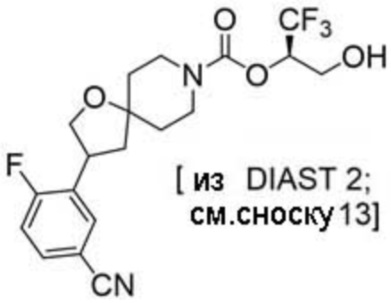
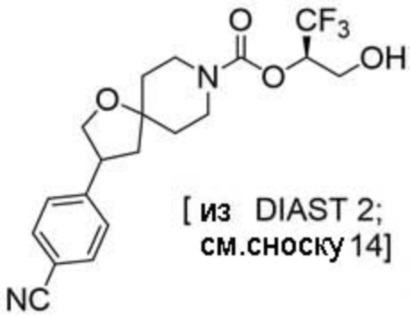
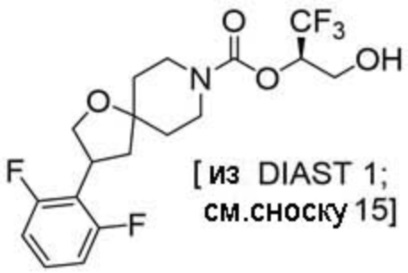
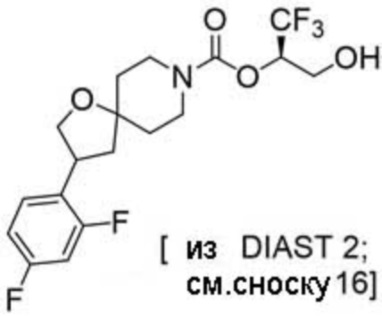
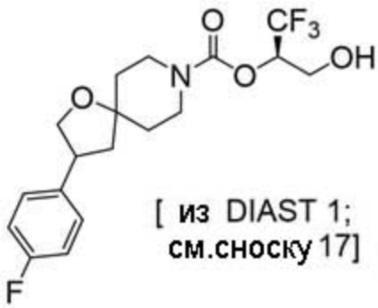
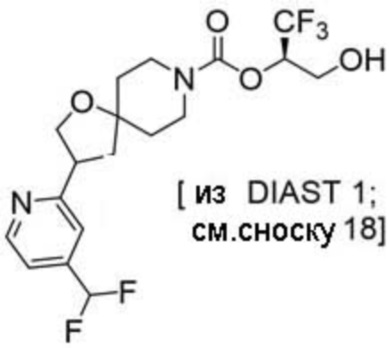
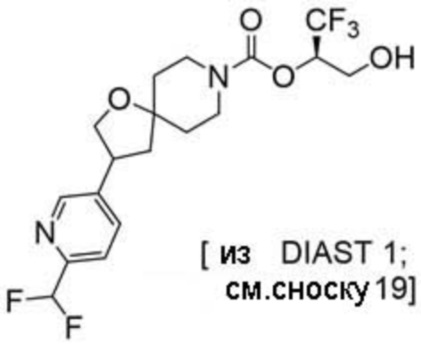
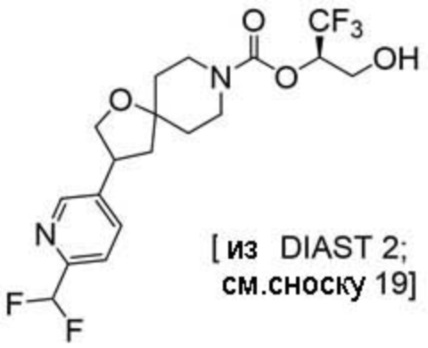
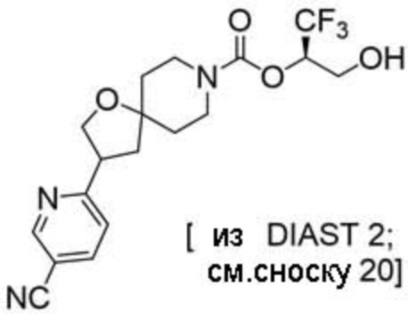
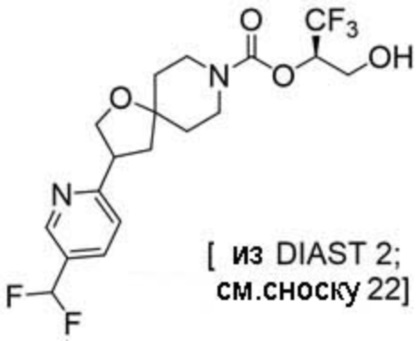
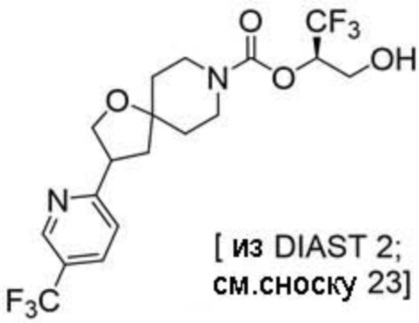
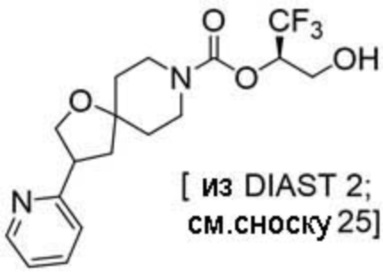
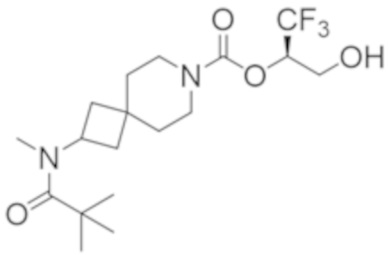
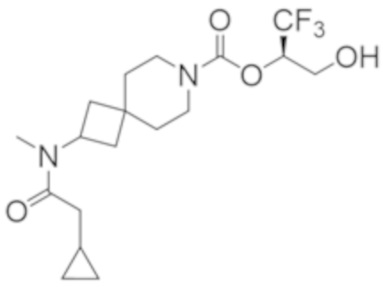
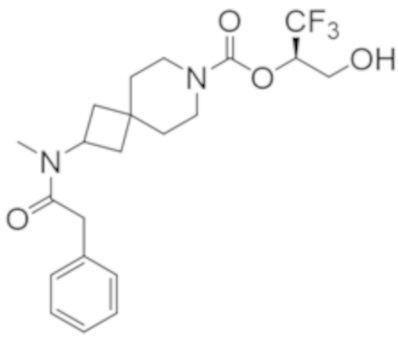
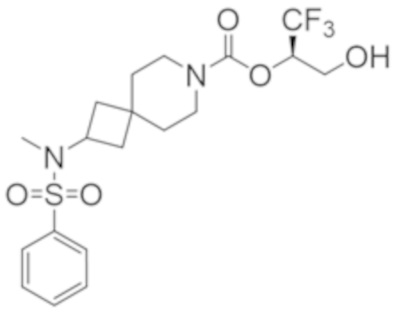
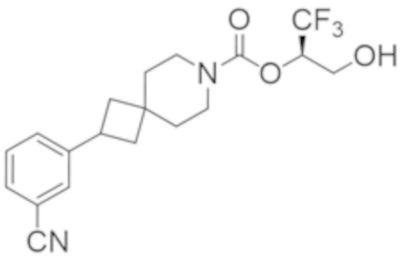
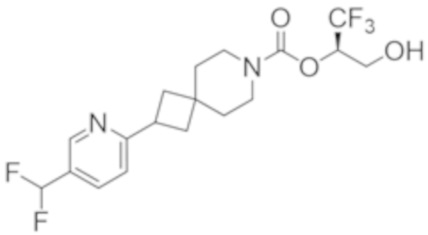
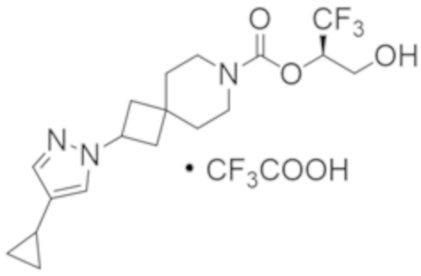
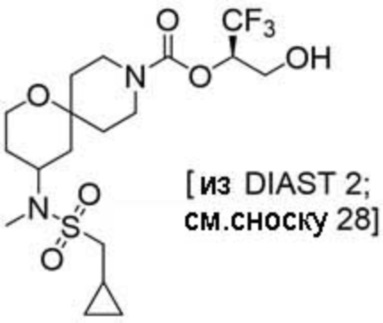
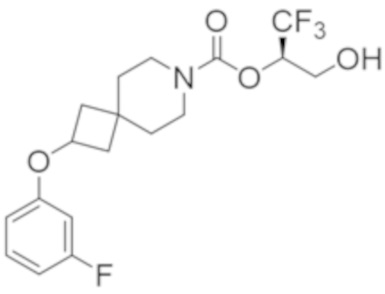
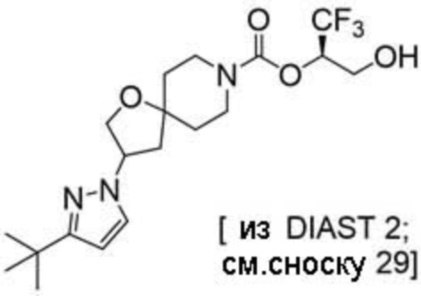
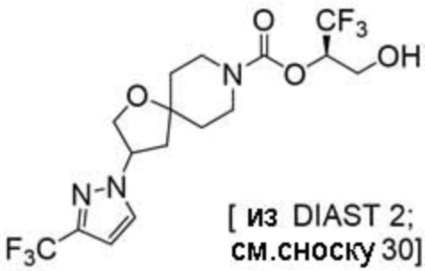
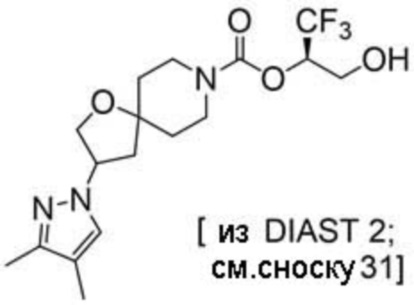
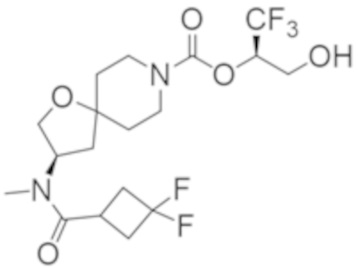
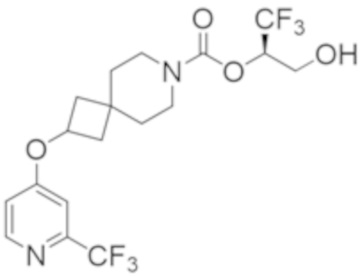
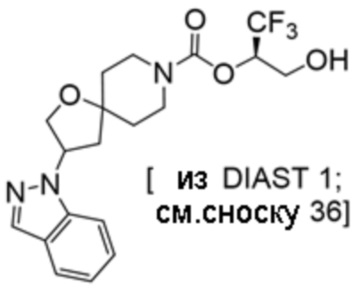
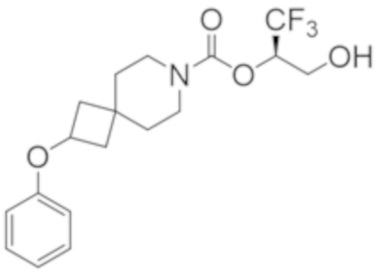
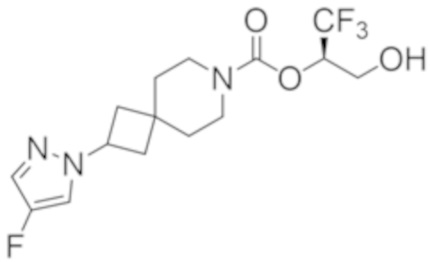
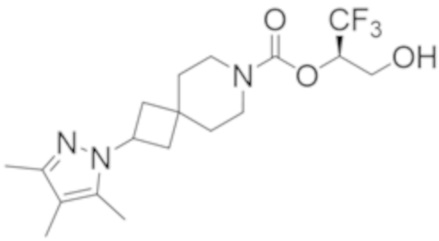
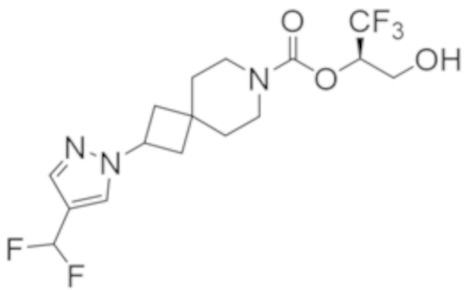
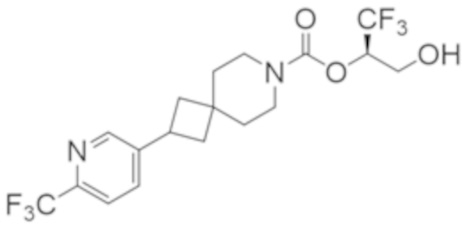
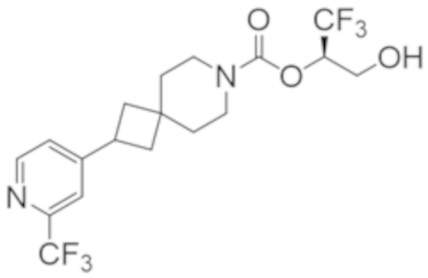
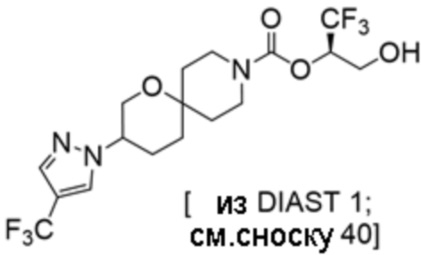
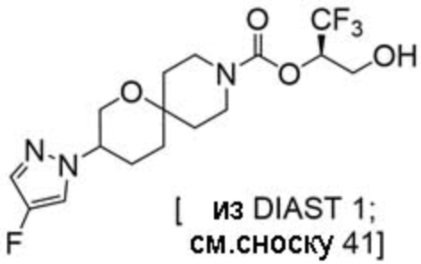
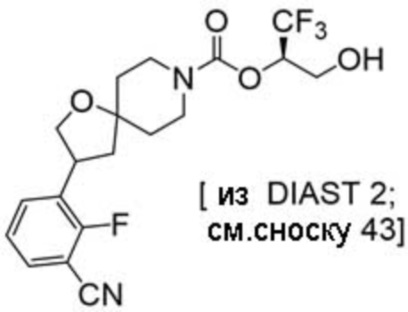
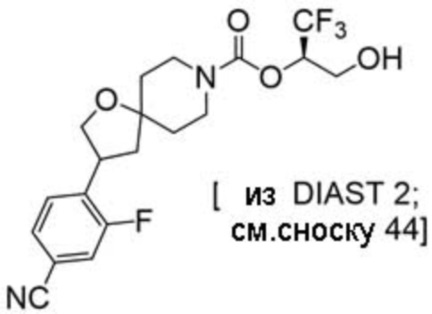
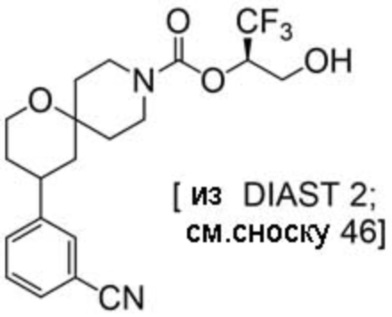
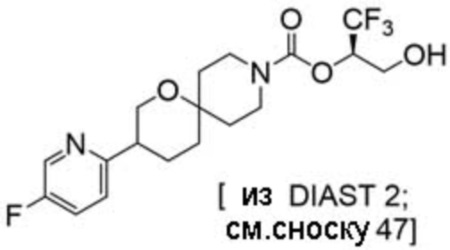
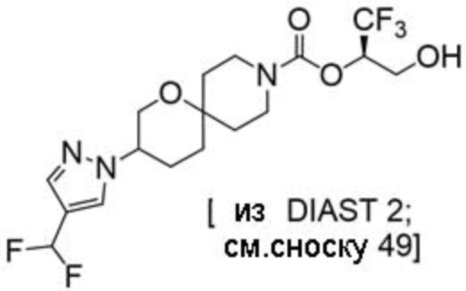
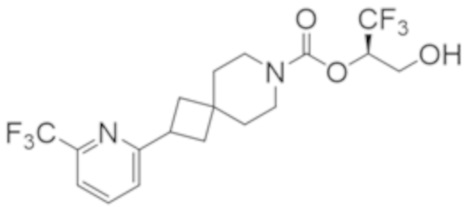
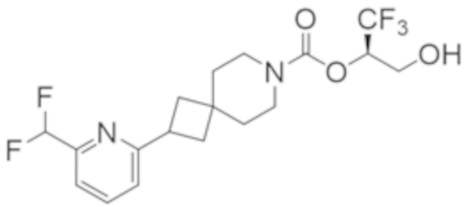
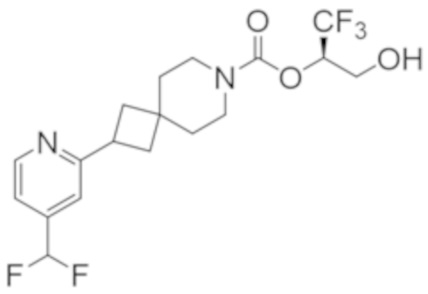
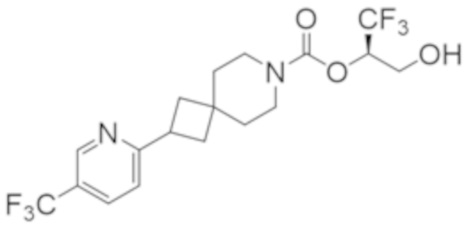
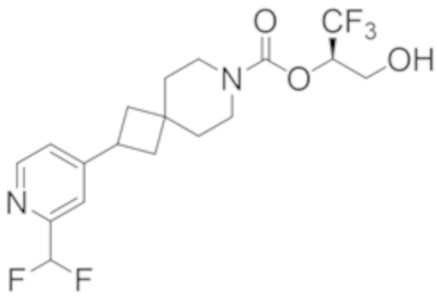
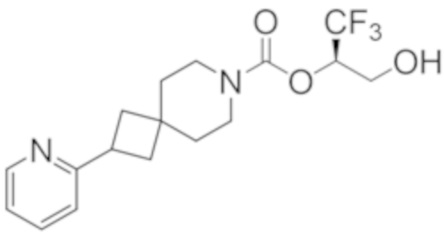
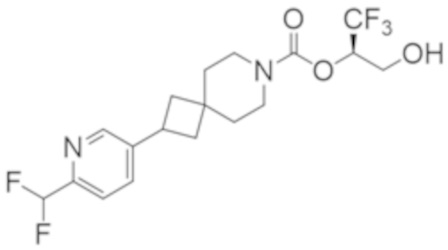
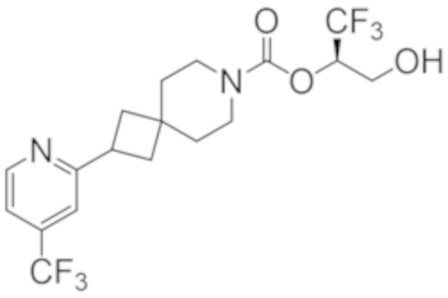
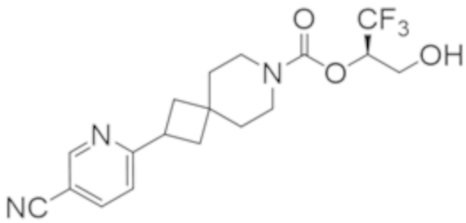
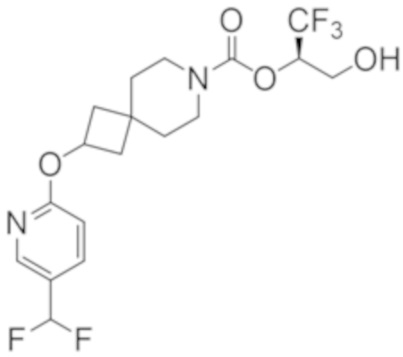
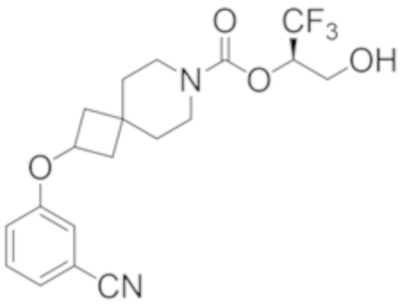
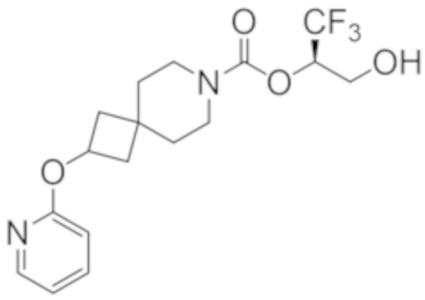
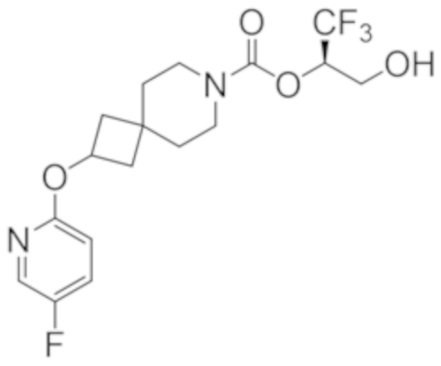
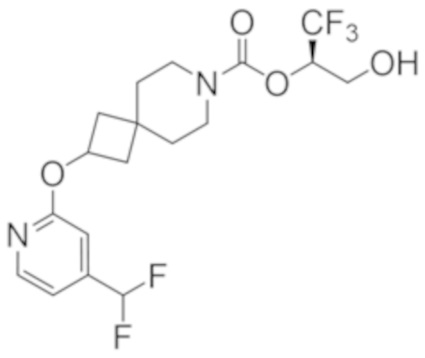
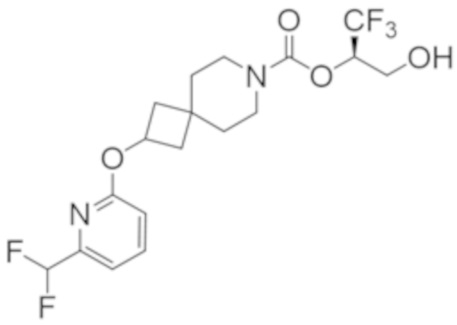
1. Соединение C35 подвергали реакции с 1H-пиразол-4-карбальдегидом с получением трет-бутил-3-(4-формил-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата; его превращали в требуемый трет-бутил-3-[4-(дифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат путем обработки трифторидом (диэтиламино)серы.
2. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[4-(дифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 3:2 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 20, ЖХМС m/z 414,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,065 мкМ.
3. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(4-трет-бутил-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 65:35 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 21, ЖХМС m/z 420,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,007 мкМ.
4. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(4-хлор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 1:1 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 22, ЖХМС m/z 398,0 (наблюдалась изотопная картина хлора) [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,023 мкМ.
5. Условия проведения аналитической ВЭЖХ. Колонка: Waters Atlantis dC18, 4,6 × 50 мм, 5 мкм; Подвижная фаза A: 0,05% трифторуксусной кислоты в воде (об./об.); Подвижная фаза B: 0,05% трифторуксусной кислоты в ацетонитриле (об./об.); Градиент: от 5,0% до 95% B, линейный в течение 4,0 мин; Скорость потока: 2 мл/мин.
6. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(4-хлор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; Подвижная фаза: 7:3 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 24, ЖХМС m/z 378,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,060 мкМ.
7. Реакция C48 с (2-фторфенил)бороновой кислотой в присутствии [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) и карбоната натрия при 95°С давала требуемый трет-бутил-3-(2-фторфенил)-1-окса-8-азаспиро[4.5]дец-3-ен-8-карбоксилат.
8. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(2-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 3:2 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. Соединение примера 25 синтезировали из DIAST 1, и соединение примера 26 синтезировали из DIAST 2.
9. Трет-бутил-3-(4-цианo-3-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат синтезировали с помощью реакции C35 с (4-цианo-3-фторфенил)бороновой кислотой, используя методику, описанную для синтеза C46 и C47 из C45 в примерах 12 и 13.
10. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил 3-(4-цианo-3-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 65:35 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 2 использовали для синтеза соединения примера 27, которое кристаллизовали из этилацетата/пентана диффузией из паровой фазы; это кристаллическое вещество использовали для определения указанной абсолютной конфигурации с помощью рентгеновской кристаллографии. DIAST 1 использовали для синтеза диастереомера примера 27, (2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-(4-цианo-3-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилата, ЖХМС m/z 417,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,017 мкМ.
11. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(3-цианo-4-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 65:35 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 28, ЖХМС m/z 417,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,014 мкМ.
12. Трет-бутил-3-(5-цианo-2-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат синтезировали из C35 с помощью реакции с 3-бром-4-фторбензонитрилом в присутствии йодида никеля (II), цинка и пиридина.
13. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(5-цианo-2-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 65:35 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. Соединение примера 29 синтезировали из DIAST 1, и соединение примера 30 синтезировали из DIAST 2.
14. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(4-цианoфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 3:1 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 31, ЖХМС m/z 399,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,023 мкМ.
15. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(2,6-дифторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии (колонка: Chiral Technologies Chiralcel OJ, 5 мкм; подвижная фаза: 85:15 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 2 использовали для синтеза диастереомера примера 32, ЖХМС m/z 410,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,001 мкМ.
16. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(2,4-дифторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 7:3 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 33, ЖХМС m/z 410,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,002 мкМ.
17. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(4-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 7:3 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 2 использовали для синтеза диастереомера примера 34, ЖХМС m/z 392,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,001 мкМ.
18. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[4-(дифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Phenomenex Lux Cellulose-2, 10 мкм; подвижная фаза: 3:1 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 2 использовали для синтеза диастереомера примера 35, ЖХМС m/z 425,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,019 мкМ.
19. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[6-(дифторметил)пиридин-3-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 65:35 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. Соединение примера 36 синтезировали из DIAST 1, и соединение примера 37 синтезировали из DIAST 2.
20. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(5-цианoпиридин-2-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 3:2 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 38, ЖХМС m/z 400,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,336 мкМ.
21. Реакция C48 с гексаметилдистаннаном в присутствии тетракис(трифенилфосфин)палладия(0) и хлорида лития давала трет-бутил-3-(триметилстаннанил)-1-окса-8-азаспиро[4.5]дец-3-ен-8-карбоксилат. Это вещество подвергали реакции сочетания Стилле с 2-бром-5-(дифторметил)пиридином в присутствии дихлорбис(трифенилфосфин)палладия (II) с получением требуемого трет-бутил-3-[5-(дифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]дец-3-ен-8-карбоксилата.
22. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[5-(дифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии {колонка: Chiral Technologies Chiralpak 1A, 5 мкм; подвижная фаза: 7:3 диоксид углерода/[метанол, содержащий 0,2% (7 М аммиака в метаноле)]}. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 39, ЖХМС m/z 425,5 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,031 мкМ.
23. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[5-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 65:35 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 40, ЖХМС m/z 443,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,009 мкМ.
24. В этом случае порядок присоединения был обратным: 1-окса-8-азаспиро[4.5]декан-3-он превращали в (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-оксо-1-окса-8-азаспиро[4.5]декан-8-карбоксилат с помощью реакции с C2, и это вещество превращали в боронатное промежуточное соединение (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-окса-8-азаспиро[4.5]дец-3-ен-8-карбоксилат.
25. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(пиридин-2-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 65:35 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 41, ЖХМС m/z 375,2 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,020 мкМ.
26. Синтез бензил-2-[(циклопропилацетил)(метил)амино]-7-азаспиро[3.5]нонан-7-карбоксилата осуществляли с помощью амидного сочетания между C63 и циклопропилуксусной кислотой, опосредованного гексафторфосфатом О-(7-азабензотриазол-1-ил-N,N,N',N'-тетраметилурония и N,N-диизопропилэтиламином.
27. Требуемый трет-бутил-4-оксо-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат может быть получен с помощью способа, описанного T. Cernak et al., Tetrahedron Lett. 2011, 52, 6457-6459. Это вещество подвергали восстановительному аминированию с помощью метиламингидрохлорида с использованием цианоборгидрида натрия в присутствии триэтиламина и сульфата магния с получением трет-бутил-4-(метиламино)-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилата.
28. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-4-{[(циклопропилметил)сульфонил](метил)амино}-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 3:1 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 50, ЖХМС m/z 459,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,284 мкМ.
29. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(3-трет-бутил-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии (колонка: Chiral Technologies Chiralcel OJ, 5 мкм; подвижная фаза: 85:15 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 52, ЖХМС m/z 420,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,004 мкМ.
30. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[3-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 85:15 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 53, ЖХМС m/z 432,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,009 мкМ.
31. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(3,4-диметил-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии (колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 4:1 диоксид углерода/метанол). Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 54, ЖХМС m/z 392,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,020 мкМ.
32. Опосредованная трифенилфосфином реакция (3,3-дифторциклобутил)метанола и 2,2'-дисульфандиилбис(1,3-бензотиазола) давала 2-{[(3,3-дифторциклобутил)метил]сульфанил}-1,3-бензотиазол, который окисляли 3-хлорпероксибензойной кислотой с получением соответствующего сульфона. Это вещество подвергали реакции с боргидридом натрия и полученную (3,3-дифторциклобутил)метансульфиновую кислоту подвергали реакции с 1-хлорметил-4-фтор-1,4-диазабицикло[2.2.2]октанбис(тетрафторборатом) [Selectfluor®] с получением (3,3-дифторциклобутил)метансульфонилфторида. Образование сульфонамида с помощью C23 осуществляли с использованием бис(трифторметансульфонимида) бария, и с продукта (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-(3R)-3-[{[(3,3-дифторциклобутил)метил]сульфонил}(метил)амино]-1-окса-8-азаспиро[4.5]декан-8-карбоксилата снимали защиту трифторуксусной кислотой, получая соединение примера 57.
33. В данном случае реакцию Мицунобу проводили с использованием 1,1'-(азодикарбонил)дипиперидина и трибутилфосфина.
34. В данном случае промежуточный сульфинамид окисляли до соответствующего сульфонамида с помощью 3-хлорпероксибензойной кислоты, а не оксона.
35. Восстановительное аминирование трет-бутил-2-оксо-7-азаспиро[3.5]нонан-7-карбоксилата с помощью метиламингидрохлорида и цианоборгидрида натрия давало трет-бутил-2-(метиламино)-7-азаспиро[3.5]нонан-7-карбоксилат. Это вещество превращали в (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-(метиламино)-7-азаспиро[3.5]нонан-7-карбоксилат, используя общую методику, описанную для синтеза C23 из C18 в примере 5.
36. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(1H-индазол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии (колонка: Chiral Technologies Chiralcel OD, 5 мкм; подвижная фаза: 7:3 диоксид углерода/(этанол, содержащий 0,05% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 2 использовали для синтеза диастереомера примера 62, ЖХМС m/z 414,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,049 мкМ.
37. В данном случае C3 реагировал с 1H-пиразол-4-карбальдегидом и карбонатом цезия с получением трет-бутил-2-(4-формил-1H-пиразол-1-ил)-7-азаспиро[3.5]нонан-7-карбоксилата. Это вещество обрабатывали трифторидом (диэтиламино)серы с получением требуемого трет-бутил-2-[4-(дифторметил)-1H-пиразол-1-ил]-7-азаспиро[3.5]нонан-7-карбоксилата.
38. Требуемый трет-бутил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-азаспиро[3.5]нон-1-ен-7-карбоксилат синтезировали из трет-бутил-2-оксо-7-азаспиро[3.5]нонан-7-карбоксилата, используя общий способ, описанный для синтеза C49 в примерах 14 и 15. В этом случае N-(5-хлорпиридин-2-ил)-1,1,1-трифтор-N-[(трифторметил)сульфонил]метансульфонамид использовали для получения енoлтрифторметансульфоната, а не 1,1,1-трифтор-N-фенил-N-[(трифторметил)сульфонил]метансульфонамида.
39. Трет-бутил-3-гидрокси-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат обрабатывали метансульфонилхлоридом и триэтиламином, с получением трет-бутил-3-[(метилсульфонил)окси]-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилата. Это вещество, а не соответствующий бромид, использовали в синтезе примера.
40. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 4:1 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 2 использовали для синтеза диастереомера примера 69, ЖХМС m/z 446,2 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,003 мкМ.
41. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(4-фтор-1H-пиразол-1-ил)-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 3:2 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 2 использовали для синтеза диастереомера примера 70, ЖХМС m/z 396,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,014 мкМ.
42. В данном случае C45 связывали с соответствующим арилбромидом в присутствии йодида никеля (II), 4,4'-ди-трет-бутил-2,2'-бипиридина, цинкового порошка и пиридина.
43. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(3-цианo-2-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 65:35 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 71, ЖХМС m/z 417,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,008 мкМ.
44. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(4-цианo-2-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 3:2 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 72, ЖХМС m/z 417,0 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,012 мкМ.
45. Окисление по Сверну трет-бутил-4-гидрокси-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилата давало трет-бутил-4-оксо-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат, который превращали в трет-бутил-4-{[(трифторметил)сульфонил]окси}-1-окса-9-азаспиро[5.5]ундец-4-ен-9-карбоксилат, используя способ, применявшийся для синтеза C48 в примерах 14 и 15. Затем его подвергали реакции с (3-карбамоилфенил)бороновой кислотой в присутствии карбоната натрия с получением трет-бутил-4- (3-карбамоилфенил)-1-окса-9-азаспиро [5.5]ундец-4-ен-9-карбоксилата. После гидрирования двойной связи амидную функциональную группу превращали в нитрил с помощью обработки трифторуксусным ангидридом и триэтиламином.
46. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-4-(3-цианoфенил)-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 10 мкм; подвижная фаза: 3:2 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 73, ЖХМС m/z 413,3 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,074 мкМ.
47. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-(5-фторпиридин-2-ил)-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии (колонка: Chiral Technologies Chiralcel OD, 5 мкм; подвижная фаза: 3:1 диоксид углерода/(этанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 74, ЖХМС m/z 407,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,015 мкМ.
48. Трет-бутил-3-[(метилсульфонил)окси]-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат подвергали реакции с 1H-пиразол-4-карбальдегидом и карбонатом цезия с получением трет-бутил-3-(4-формил-1H-пиразол-1-ил)-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилата. Это вещество обрабатывали трифторидом (диэтиламино)серы с получением требуемого трет-бутил-3-[4-(дифторметил)-1H-пиразол-1-ил]-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилата.
49. Перед конечным снятием защиты промежуточный (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-3-[4-(дифторметил)-1H-пиразол-1-ил]-1-окса-9-азаспиро[5.5]ундекан-9-карбоксилат разделяли на составляющие его диастереомеры с помощью сверхкритической флюидной хроматографии [колонка: Chiral Technologies Chiralpak AD, 5 мкм; подвижная фаза: 3:2 диоксид углерода/(метанол, содержащий 0,1% гидроксида аммония)]. Элюирующийся первым диастереомер обозначили как DIAST 1, и элюирующийся вторым диастереомер - как DIAST 2. DIAST 1 использовали для синтеза диастереомера примера 75, ЖХМС m/z 428,1 [M+H]+, который демонстрировал следующие биологические показатели: MAGL (T=30 мин) IC50=0,003 мкМ.
50. 2-Бром-6-(трифторметил)пиридин литиировали по реакции с н-бутиллитием и затем объединяли с трет-бутил-2-оксо-7-азаспиро[3.5]нонан-7-карбоксилатом; полученный трет-бутил-2-гидрокси-2-[6-(трифторметил)пиридин-2-ил]-7-азаспиро[3.5]нонан-7-карбоксилат дегидратировали путем воздействия тионилхлорида, пиридина и 4-(диметиламино)пиридина с получением трет-бутил-2-[6-(трифторметил)пиридин-2-ил]-7-азаспиро[3.5]нон-1-ен-7-карбоксилата. Это вещество превращали в соединение примера 76, используя способ, описанный для синтеза соединений примеров 14 и 15 из C50.
51. В этом случае сочетание Сузуки проводили между трет-бутил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-7-азаспиро[3.5]нон-1-ен-7-карбоксилатом и 6-бромпиридин-3-карбоксамидом. После гидрирования двойной связи амидную функциональную группу превращали в соответствующий нитрил с помощью обработки трифторуксусным ангидридом и триэтиламином, с получением трет-бутил-2-(5-цианoпиридин-2-ил)-7-азаспиро[3.5]нонан-7-карбоксилата.
52. Реакция 7-азаспиро[3.5]нонан-2-ола с триэтиламином и C2 давала (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-гидрокси-7-азаспиро[3.5]нонан-7-карбоксилат. Образование простого эфира с 2-бром-5-(дифторметил)пиридином осуществляли с использованием гидрида натрия с получением (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-{[5-(дифторметил)пиридин-2-ил]окси}-7-азаспиро[3.5]нонан-7-карбоксилата; последующее снятие защиты с использованием трифторуксусной кислоты давало соединение примера 85.
53. Реакция 7-азаспиро[3.5]нонан-2-ола с триэтиламином и C2 давала (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-гидрокси-7-азаспиро[3.5]нонан-7-карбоксилат. Это вещество обрабатывали 2-бромпиридином в присутствии (R)-1-[(SP)-2-(дифенилфосфино)ферроценил]этилди-трет-бутилфосфина (Josiphos SL-J002-1), трис(дибензилиденацетон)дипалладия(0) и карбоната цезия с получением (2R)-1,1,1-трифтор-3-[(4-метоксибензил)окси]пропан-2-ил-2-(пиридин-2-илoкси)-7-азаспиро[3.5]нонан-7-карбоксилата, с которого снимали защиту трифторуксусной кислотой с получением соединения примера 87.
54. В данном случае первую стадию осуществляли путем реакции трет-бутил-2-гидрокси-7-азаспиро[3.5]нонан-7-карбоксилата с 2-бром-4-(дифторметил)пиридином в присутствии (R)-1-[(SP)-2-(дифенилфосфино)ферроценил]этилди-трет-бутилфосфина (Josiphos SL-J002-1), трис(дибензилиденацетон)дипалладия(0) и карбоната цезия, с получением трет-бутил-2-{[4-(дифторметил)пиридин-2-ил]окси}-7-азаспиро[3.5]нонан-7-карбоксилата.
Пример AA: ферментный анализ MAGL
Для оценки ингибирования MAGL используют человеческую рекомбинантную моноацилглицеринлипазу и флуорогенный субстрат 7-гидроксикумариниларахидонат (7-HCA, Biomol ST-502). 400 нл тестового соединения при уменьшении концентрации (в диапазоне от 150 мкМ до 1,5 нм) помещали в 384-луночный черный планшет (PerkinElmer, 6007279) с помощью Labcyte Echo, затем добавляли 10 мкл фермента MAGL в аналитическом буфере (50 мМ HEPES, рН 7,4, 100 мМ NaCl, 5 мМ MgCl2, 0,1% Тритон Х-100 и 25% глицерина). Равный объем 7-HCA в аналитическом буфере с 10% ДМСО добавляли либо сразу (Т=0 мин), либо после 30 мин инкубации (Т=30 мин) для инициирования реакции. Конечная концентрация фермента MAGL составляла 88 пМ, и конечная концентрация субстрата 7-HCA составляла 5 мкМ. После этих разбавлений конечная концентрация тестового соединения находилась в диапазоне от 3 мкМ до 0,03 нМ. Реакции позволяли протекать в течение 60 мин, после чего планшет считывали при Ex/Em 340/465. Процент ингибирования рассчитывали на основе контрольных лунок, не содержащих соединения (0% ингибирования) и контрольного соединения (например, ингибитора MAGL, активность которого известна или ранее сообщалась в литературе, такого как ингибитор с ингибированием примерно 100%). Значения IC50 были получены на основе 4-параметрической модели соответствия с использованием программного обеспечения ABASE от IDBS. См., например, Wang, Y. et al., «A Fluorescence-Based Assay for Monoacylglycerol Lipase Compatible with Inhibitor Screening», Assay and Drug Development Technologies, 2008, Vol. 6 (3) pp.387-393 (отчет об анализе для измерения активности MAGL).
Чтобы измерить инактивацию MAGL осуществляли ту же методику для анализа показателя ингибирования MAGL IC50 (T=0 мин) с помощью данных, собираемых каждую минуту, для построения кривых изменения концентрации фермента при уменьшении концентрации соединения. По этим данным рассчитывали значения Kobs и определяли отношения kinact/KI на основе графика зависимости значений Kobs от концентрации соединения.
Таблица 19. Биологические данные (MAGL IC50, и MAGL kinact/KI) для примеров 1-90.
a. Указанные значения IC50 или значения kinact/KI представляют собой среднее геометрическое значение из 2-5 определений, если не указано иное.
b. Указанное значение IC50 или значение kinact/KI является средним геометрическим значением из ≥6 определений.
c. не опр.=не определяли
Различные модификации изобретения в дополнение к здесь описанным будут очевидны специалистам из приведенного выше описания. Такие модификации также входят в объем прилагаемой формулы изобретения. Каждый источник (включая все патенты, заявки на патенты, статьи в журналах, книги и любые другие публикации), процитированный в настоящей заявке, включен в настоящую заявку во всей полноте посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ СПИРОСОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ MAGL | 2018 |
|
RU2726631C1 |
| СПИРО-КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ПИПЕРИДИНА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ КАЛИЕВОГО КАНАЛА НАРУЖНОГО МЕДУЛЛЯРНОГО СЛОЯ | 2013 |
|
RU2642066C2 |
| ГИДРОКСИПУРИНОВЫЕ СОЕДИНЕНИЯ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2673458C1 |
| ПРОЛЕКАРСТВО ПРОИЗВОДНОГО АМИНОКИСЛОТЫ | 2017 |
|
RU2739318C2 |
| ГЕМИНАЛЬНО-ЗАМЕЩЕННЫЕ ЦИАНОЭТИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ JANUS КИНАЗ | 2014 |
|
RU2664533C2 |
| АНТИПРОЛИФЕРАТИВНЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ PAH | 2020 |
|
RU2786588C1 |
| ИНГИБИТОРЫ УРИДИН-5-ДИФОСФАТ (UDP) ГЛИКОЗИЛТРАНСФЕРАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2810928C2 |
| АЗАСПИРОПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ TRPM8 | 2015 |
|
RU2683309C2 |
| ОКСАДИАЗОЛЫ В КАЧЕСТВЕ АГОНИСТОВ МУСКАРИНОВОГО РЕЦЕПТОРА M1 И/ИЛИ M4 | 2019 |
|
RU2817018C2 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АЛЛОСТЕРИЧЕСКИХ ИНГИБИТОРОВ SHP2 | 2018 |
|
RU2776846C2 |
Изобретение относится к соединению формулы I
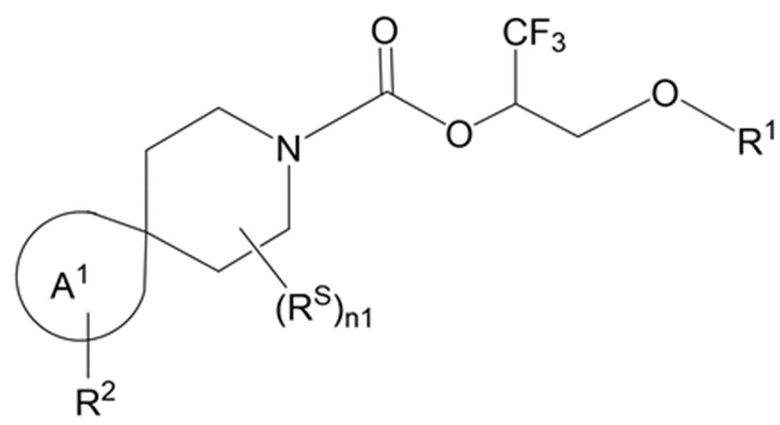
I
или его фармацевтически приемлемым солям, где R1 представляет собой H; фрагмент М-1 формулы I
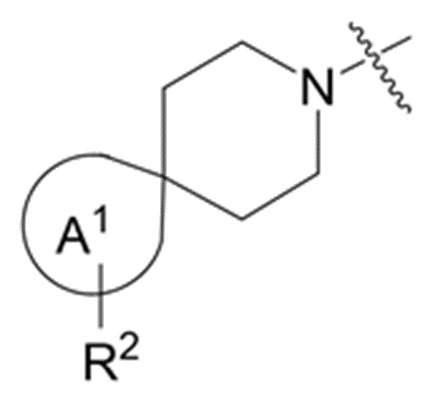
M-1 представляет собой фрагмент формулы M-1a, M-1b или M-1c:
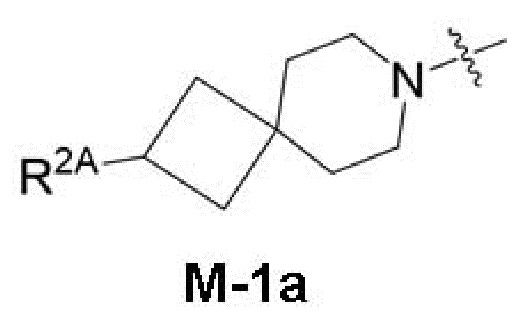 ,
, 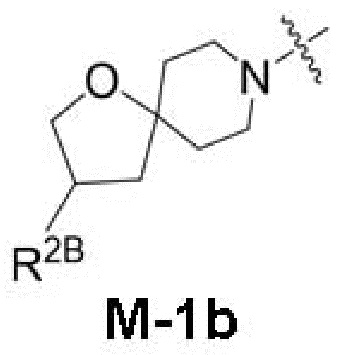 ,
, 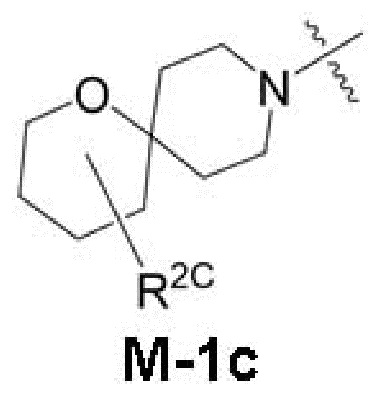
каждый из R2A и R2C независимо представляет собой -NR3S(=O)2R4, -NR3C(=O)R4; R5 или -OR5; R2B выбран из группы, включающей [4-(трифторметил)-1H-пиразол-1-ил]метил, циклопентилкарбонил)(метил)амино-, (трет-бутилсульфонил)(метил)амино-, (2,2-диметилпропанoил)(метил)амино-, 4-(трифторметил)-1H-пиразол-1-ил-, 4-фтор-1H-пиразол-1-ил-, 3-цианoфенил-, 6-(трифторметил)пиридин-2-ил-, 5-фторпиридин-2-ил-, 4-(дифторметил)-1H-пиразол-1-ил-, 4-трет-бутил-1H-пиразол-1-ил-, 4-хлор-1H-пиразол-1-ил-, 4-циклопропил-1H-пиразол-1-ил-, 4-метил-1H-пиразол-1-ил-, 2-фторфенил-, 4-цианo-3-фторфенил-, 3-цианo-4-фторфенил-, 5-цианo-2-фторфенил-, 4-цианoфенил-, 2,6-дифторфенил-, 2,4-дифторфенил-, 4-фторфенил-, 4-(дифторметил)пиридин-2-ил-, 6-(дифторметил)пиридин-3-ил-, 5-цианoпиридин-2-ил-, 5-(дифторметил)пиридин-2-ил-, 5-(трифторметил)пиридин-2-ил-, пиридин-2-ил-, 3-трет-бутил-1H-пиразол-1-ил-, 3-(трифторметил)-1H-пиразол-1-ил-, 3,4-диметил-1H-пиразол-1-ил-, {[(3,3-дифторциклобутил)метил]сульфонил}(метил)амино-, [(3,3-дифторциклобутил)карбонил](метил)амино-, 1H-индазол-1-ил-, 3-цианo-2-фторфенил-, и 4-цианo-2-фторфенил-; каждый R3 независимо представляет собой C1-3 алкил; каждый R4 независимо выбран из C1-6 алкила, C3-7 циклоалкила, (C3-7 циклоалкила)-C1-2 алкила-, (фенил)-C1-2 алкила- и фенила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 галогенами; и каждый R5 представляет собой фенил или 5- или 6-членный гетероарил, при этом каждый фенил или 5- или 6-членный гетероарил замещен 0, 1, 2 или 3 заместителями (см. в п.1 формулы); способам получения; композиции, содержащей такие соединения, и к их применению для лечения опосредованных MAGL заболеваний и нарушений. 5 н. и 17 з.п. ф-лы, 19 табл., 19 пр.
1. Соединение формулы (I)
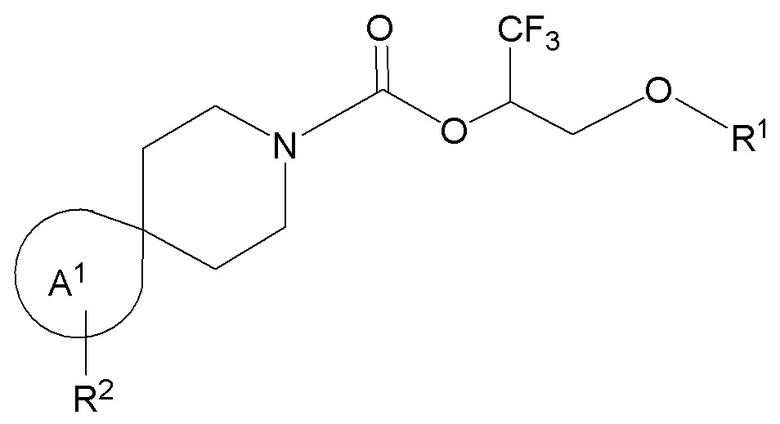
или его фармацевтически приемлемая соль,
где R1 представляет собой H;
фрагмент М-1 формулы I
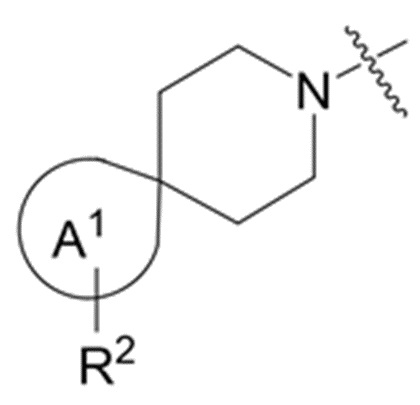
M-1
представляет собой фрагмент формулы M-1a, M-1b или M-1c:
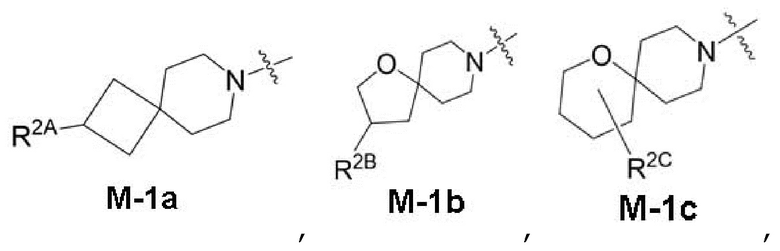
каждый из R2A и R2C независимо представляет собой -NR3S(=O)2R4, -NR3C(=O)R4; R5 или -OR5;
R2B выбран из группы, включающей [4-(трифторметил)-1H-пиразол-1-ил]метил-, (циклопентилкарбонил)(метил)амино-, (трет-бутилсульфонил)(метил)амино-, (2,2-диметилпропанoил)(метил)амино-, 4-(трифторметил)-1H-пиразол-1-ил-, 4-фтор-1H-пиразол-1-ил-, 3-цианoфенил-, 6-(трифторметил)пиридин-2-ил-, 5-фторпиридин-2-ил-, 4-(дифторметил)-1H-пиразол-1-ил-, 4-трет-бутил-1H-пиразол-1-ил-, 4-хлор-1H-пиразол-1-ил-, 4-циклопропил-1H-пиразол-1-ил-, 4-метил-1H-пиразол-1-ил-, 2-фторфенил-, 4-цианo-3-фторфенил-, 3-цианo-4-фторфенил-, 5-цианo-2-фторфенил-, 4-цианoфенил-, 2,6-дифторфенил-, 2,4-дифторфенил-, 4-фторфенил-, 4-(дифторметил)пиридин-2-ил-, 6-(дифторметил)пиридин-3-ил-, 5-цианoпиридин-2-ил-, 5-(дифторметил)пиридин-2-ил-, 5-(трифторметил)пиридин-2-ил-, пиридин-2-ил-, 3-трет-бутил-1H-пиразол-1-ил-, 3-(трифторметил)-1H-пиразол-1-ил-, 3,4-диметил-1H-пиразол-1-ил-, {[(3,3-дифторциклобутил)метил]сульфонил}(метил)амино-, [(3,3-дифторциклобутил)карбонил](метил)амино-, 1H-индазол-1-ил-, 3-цианo-2-фторфенил-, и 4-цианo-2-фторфенил-;
каждый R3 независимо представляет собой C1-3 алкил;
каждый R4 независимо выбран из C1-6 алкила, C3-7 циклоалкила, (C3-7 циклоалкила)-C1-2 алкила-, (фенил)-C1-2 алкила- и фенила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 галогенами; и
каждый R5 представляет собой фенил или 5- или 6-членный гетероарил, при этом каждый фенил или 5- или 6-членный гетероарил замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси, и при этом каждый из образующих кольцо атомов 5- или 6-членного гетероарила представляет собой атом углерода или атом азота, где 5- или 6-членный гетероарил включает 1 или 2 образующих кольцо атома азота.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где каждый R3 независимо представляет собой C1-3 алкил; и каждый R4 независимо выбран из C1-6 алкила, C3-7 циклоалкила, (C3-7 циклоалкила)-C1-2 алкила-, (фенил)-C1-2 алкила- и фенила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 галогенами.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, где соединение представляет собой соединение формулы I-1, I-2 или I-3:
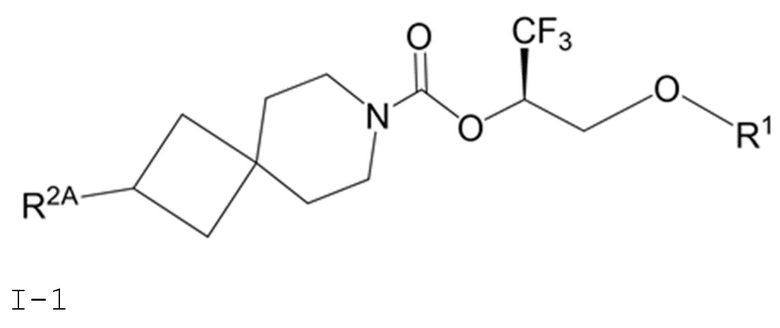 ,
,
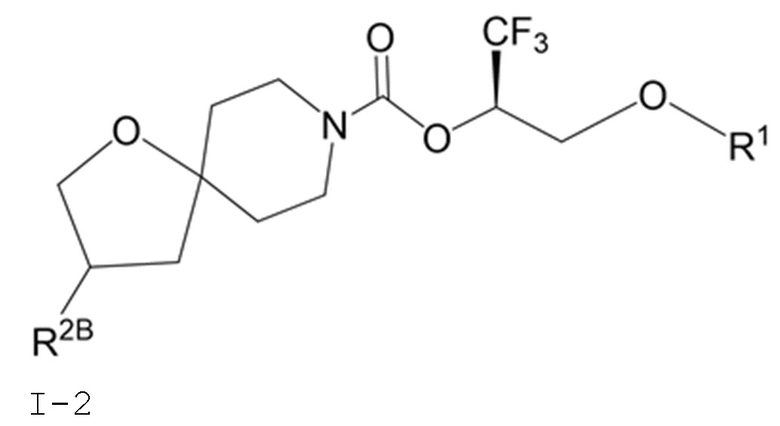 ,
,
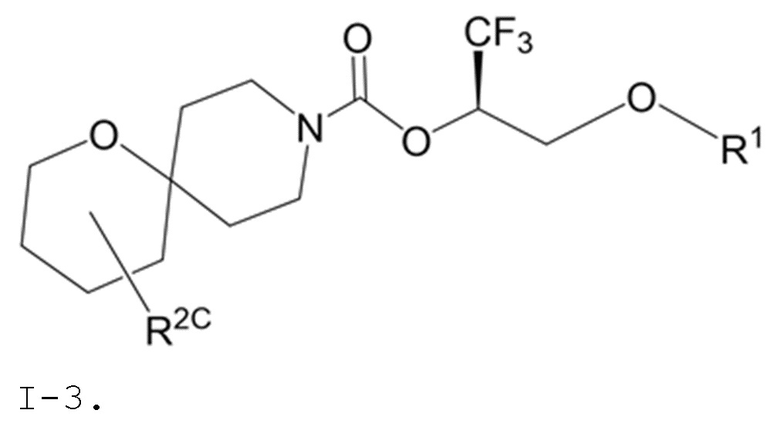
4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где соединение представляет собой соединение формулы I-1.
5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R2A представляет собой R5 или -OR5.
6. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R2A представляет собой R5; и R5 выбран из группы, состоящей из фенила, 1H-пиразолила и пиридинила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси.
7. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R2A представляет собой R5; и R5 выбран из группы, состоящей из фенила, 1H-пиразол-1-ила-, пиридин-2-ила-, пиридин-3-ила- и пиридин-4-ила, где каждый из выбранных вариантов замещен 0 или 1 заместителем, выбранным из группы, состоящей из -CN, галогена, C1-2 алкила, C3-4 циклоалкила, C1-2 алкокси, C1-2 галогеналкила и C1-2 галогеналкокси.
8. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R2A представляет собой -OR5; и R5 выбран из группы, состоящей из фенила, 1H-пиразолила и пиридинила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси.
9. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R2A представляет собой -OR5; и R5 выбран из группы, состоящей из фенила, 1H-пиразол-1-ила-, пиридин-2-ила-, пиридин-3-ила- и пиридин-4-ила, где каждый из выбранных вариантов замещен 0 или 1 заместителем, выбранным из группы, состоящей из -CN, галогена, C1-2 алкила, C3-4 циклоалкила, C1-2 алкокси, C1-2 галогеналкила и C1-2 галогеналкокси.
10. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R2A представляет собой -NR3S(=O)2R4 или -NR3C(=O)R4; R3 представляет собой метил; каждый R4 независимо выбран из группы, состоящей из C1-6 алкила, C3-7 циклоалкила, (C3-7 циклоалкила)-C1-2 алкила-, (фенила)-C1-2 алкила- и фенила.
11. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где соединение представляет собой соединение формулы I-2.
12. Соединение по любому из пп.1-3 и 11 или его фармацевтически приемлемая соль, где R2B представляет собой 4-(трифторметил)-1H-пиразол-1-ил-, 4-фтор-1H-пиразол-1-ил-, 3-цианoфенил-, 6-(трифторметил)пиридин-2-ил-, 5-цианo-2-фторфенил- или 4-(дифторметил)пиридин-2-ил-.
13. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где соединение представляет собой соединение формулы I-3.
14. Соединение по п.13 или его фармацевтически приемлемая соль, где соединение представляет собой соединение формулы I-3a или формулы I-3b:
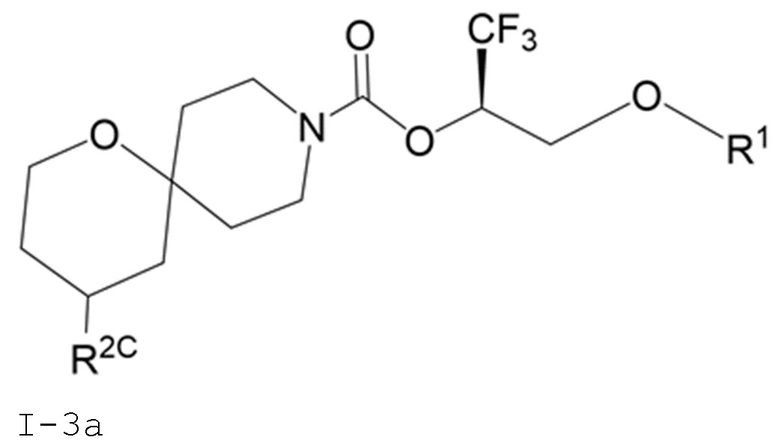 ,
,
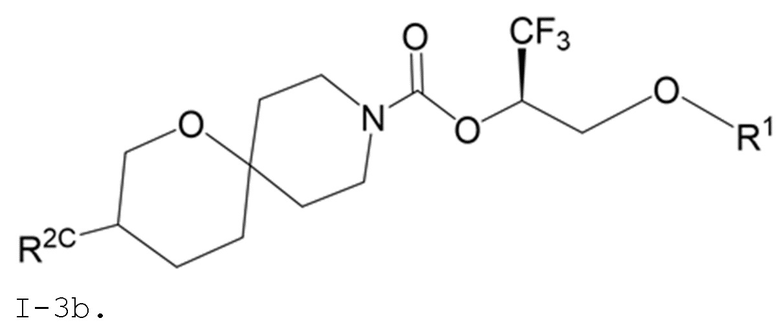
15. Соединение по любому из пп.1-3, 13 и 14 или его фармацевтически приемлемая соль, где R2C представляет собой -NR3S(=O)2R4 или R5; и R5 выбран из группы, состоящей из фенила, 1H-пиразолила и пиридинила, где каждый из выбранных вариантов замещен 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, галогена, C1-4 алкила, C3-6 циклоалкила, C1-4 алкокси, C1-4 галогеналкила и C1-4 галогеналкокси.
16. Соединение по любому из пп.1-15 или его фармацевтически приемлемая соль, где R3 представляет собой метил; и R4 выбран из группы, состоящей из C1-6 алкила, C3-7 циклоалкила и (C3-7 циклоалкила)-C1-2 алкила-.
17. Соединение по п.1, выбранное из группы, включающей:
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[4-(трифторметил)-1H-пиразол-1-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 2;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3R)-3-(4-фтор-1H-пиразол-1-ил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-(3S)-3-(3-цианoфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[6-(трифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 1;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-{[6-(дифторметил)пиридин-3-ил]окси}-7-азаспиро[3.5]нонан-7-карбоксилат;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-(5-цианo-2-фторфенил)-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 2;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-3-[4-(дифторметил)пиридин-2-ил]-1-окса-8-азаспиро[4.5]декан-8-карбоксилат, DIАST 1;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-[5-(дифторметил)пиридин-2-ил]-7-азаспиро[3.5]нонан-7-карбоксилат;
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-(4-циклопропил-1H-пиразол-1-ил)-7-азаспиро[3.5]нонан-7-карбоксилат; и
(2R)-1,1,1-трифтор-3-гидроксипропан-2-ил-2-(3-фторфенокси)-7-азаспиро[3.5]нонан-7-карбоксилат,
или его фармацевтически приемлемая соль.
18. Фармацевтическая композиция, обладающая способностью ингибировать моноацилглицеринлипазу (MAGL), содержащая терапевтически эффективное количество соединения или фармацевтически приемлемой соли по любому из пп.1-17 и фармацевтически приемлемый носитель.
19. Соединение или фармацевтически приемлемая соль по любому из пп.1-17 для применения в лечении опосредованного MAGL заболевания или нарушения.
20. Способ лечения опосредованного MAGL заболевания или нарушения у млекопитающего, который включает введение указанному млекопитающему терапевтически эффективного количества соединения или фармацевтически приемлемой соли по любому из пп.1-17.
21. Применение соединения или фармацевтически приемлемой соли по любому из пп.1-17 для получения лекарственного средства для лечения опосредованного MAGL заболевания или нарушения.
22. Способ ингибирования MAGL, включающий контактирование MAGL с соединением или фармацевтически приемлемой солью по любому из пп.1-17.
| Patel, J | |||
| Z., Ahenkorah, S., Vaara, M., Staszewski, M., Adams, Y., Laitinen, T | |||
| Nevalainen, T | |||
| J | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Loratadine analogues as MAGL inhibitors | |||
| Bioorganic & Medicinal Chemistry Letters, 25(7), 1436-1442 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| WO 2014074715 A1, 15.05.2014 | |||
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2009 |
|
RU2553451C2 |
Авторы
Даты
2020-04-27—Публикация
2018-01-08—Подача