Предлагаемый способ получения электролитическим путем щелочных металлов из их амальгамы, которая образуется при электролизе водного раствора щелочных солей с ртутным катодом, состоит в том, что для выделения щелочного металла, например, натрия, из амальгамы, последней пользуются в качестве анода при неизменяемом металлическом катоде и инертном электролите, при чем электролиз ведется при низкой температуре (от -30°C до +30°C). Электролитом может служить какая-либо соль щелочного металла, растворяющаяся в жидком безводном аммиаке, метиламине или другом растворителе, дающем электролит, не действующий на щелочный металл, который выделяется в виде раствора. При этом щелочный раствор всплывает над раствором соли, от которого его отделяют и подвергают выпариванию. Испаряющийся растворитель улавливают, конденсируют и направляют в электролит.
Металл может быть выделен на катоде и в твердом виде, для чего аммиачный раствор пересыщают при электролизе металлом.
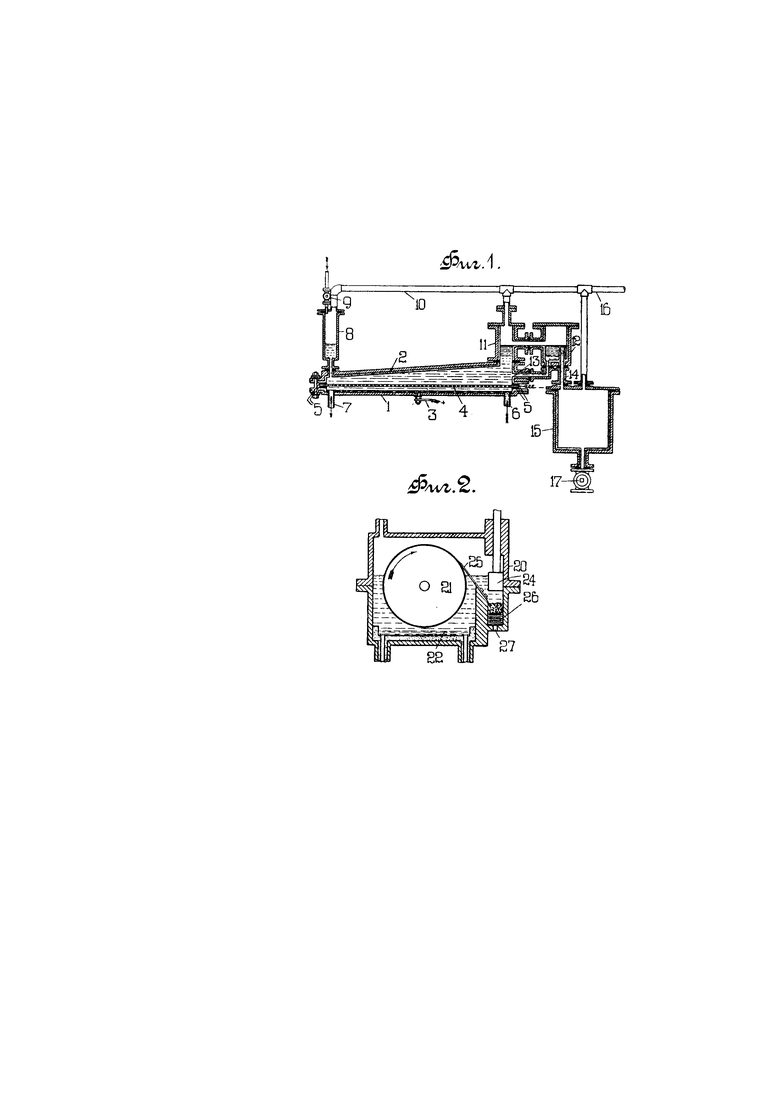
Для выполнения указанного способа предлагаются аппараты, изображенные на чертеже в вертикальном разрезе; на фиг. 1 - для выделения щелочного металла в виде раствора, и на фиг. 2 - в твердом виде.
Опыты показали, что растворы солей щелочных металлов в жидком аммиаке можно разделить на три группы:
1) в которых соответствующий металл растворяется; раствор может состоять из двух фаз;
2) в которых металл не растворяется или мало растворяется и с которыми он может существовать вместе в виде раствора металла в аммиаке, и которые свободны или почти свободны от солей и
3) такие, в которых металл нерастворим и с которыми он может существовать вместе в твердом виде.
Если, например, прибавлять легко растворимую натриевую соль к раствору натрия в аммиаке, то можно достигнуть того, что раствор разделяется на два определенных слоя, из которых нижний состоит из раствора натриевой соли в аммиаке, содержащего только следы свободного натрия, между тем как верхний слой содержит в себе весь натрий, растворенный в аммиаке, и почти, свободен от соли. Повышение концентрации соли повышает концентрацию соответствующего натриевого раствора, пока последний не насыщается; выше этой точки выделяется твердый натрий.
Относящиеся к первой группе растворы, т.-е. такие, в которых металл более или менее легко растворяется, сравнительно малоценны при получении металла по предлагаемому способу, потому что металл, образующийся на катоде, более или менее легко растворяется в электролите и из него опять поглощается ртутью на аноде. Часть металла, которая не поглощается, можно удалить из сосуда только вместе с растворенной солью, от которой металл отделяется последующими операциями, почему способ усложняется нежелательным образом. Чем более растворы приближаются к предельной линии, отделяющей их от растворов второй группы, тем менее влияют эти недостатки. При пользовании разбавленными растворами применяют диафрагму, которая препятствует соприкосновению растворенного натрия со ртутью.
Растворы второй группы, т.-е. такие, из которых щелочный металл почти полностью выделяется в виде раствора в аммиаке, являются подходящими электролитами для описываемого способа. Растворы металла плавают на поверхности растворов солей и поэтому не могут соприкасаться с амальгамой анода. Так как они жидки, то их легко удалить из электролизера, и металл выпариванием аммиака получается в чистом виде.
Концентрации, при которых образуются два жидких слоя, зависят от температуры, и так как слабые растворы густо окрашены, то недостатки неравномерности нужно определить анализом проб, которые берутся в нижних и верхних слоях жидкости. При -26°C и при применении натриевого цианида пределы, при которых образуется два жидких слоя, таковы: от 3%-44% натриевого цианида, т.-е. 44 части натриевого цианида на каждые 100 частей раствора. При получении натрия посредством электролиза этих растворов при применении анода из натриевой амальгамы лучшие результаты получаются между 28% и 41% натриевого цианида. Ниже 17% нужно применять диафрагму, дабы воспрепятствовать соприкосновению растворенного натрия с амальгамой. Полученный натрий содержит обыкновенно мало цианида, особенно, когда концентрация цианида мала. Выше 41% колебания содержания аммиака могут вызвать выделение твердого натрия.
Растворы третьей группы равным образом являются подходящими, хотя отделение твердого металла и удаление его из сосуда, который должен быть плотно закрыт, в виду летучести раствора, представляют известные трудности.
Число натриевых или щелочно-металлических солей, дающих подходящие электролитические растворы, ограничено. Большинство их или нерастворимы в аммиаке, или получаются растворы только первой группы (например, хлористый натрий или бромистый натрий дают только растворы первой группы). Другие соли, которые достаточно растворимы, не могут быть использованы, так как они реагируют на натрий или другой щелочный металл, как, напр., нитраты и тиоцианаты.
Натриевый цианид и натриевый иодид дают растворы второй и третьей группы. Они не реагируют на натрий в присутствии жидкого аммиака и растворы их хорошие проводники электричества. При этом предпочитается цианид, так как при употреблении иодида могут образоваться взрывчатые вещества.
Амальгама щелочного металла может быть любой плотности, но слабые жидкие амальгамы предпочтительны, так как они легко сохраняются. При пользовании ими нужно регулировать плотность тока на аноде в отношении к содержанию щелочного металла в амальгаме и скорости ее движения. Если плотность тока слишком высока, то ртуть растворяется таким же образом, как щелочный металл, и образование последнего уменьшается. Опыты показали, что Для натриевой амальгамы плотность тока на аноде в 3-4 амп. на см2 для каждого процента натрия является нормальной при спокойной амальгаме; более высокая плотность тока может быть применена, если амальгама перемешивается или течет тонким слоем. Если перейти эти критические плотности тока, то ртуть растворяется, и образование натрия может прекратиться. Плотность тока на катоде можно выбрать значительно меньше применяемых при электролизе расплавленных солей.
Катод изготовляется из железа или бедной углеродом стали, но можно употреблять и другие вещества хорошо проводящие электричество и на которые не действуют вещества, находящиеся в сосуде, например, монель-металл. Чугун, платина и ртуть не пригодны, как и металлы, которые ускоряют реакцию между щелочными металлами и аммиаком с образованием амидов. Также не годятся металлы, образующие с щелочным металлом сплавы (свинец), так как металл должен быть отделен после выпаривания раствора. Натрий может быть употреблен, если требуется получить твердый металл.
Части электролизера, соприкасающиеся с растворами щелочных металлов, должны быть изготовлены из вещества, не влияющего каталитически на образовании реакции для получения металламида. Когда, например, раствор щелочного металла в аммиаке в присутствии раствора соли соприкасается со сталью, то реакция образования металламида может быть подвергнута такому сильному каталитическому влиянию, что образуется почти один амид.
Пример 1. Калий. Раствор калиевого иодида в жидком аммиаке, содержащий не менее 0,6-0,7 г калиевого иодида на каждый см3 раствора, подвергается электролизу с медным катодом и калиево-амальгамовым (0,05%) анодом, при этом раствор держат при точке кипения или немного ниже, при атмосферном давлении. Калий выделяется из амальгамы и образует на катоде окрашенный в бронзовый цвет раствор калия в аммиаке, поднимающийся от катода на поверхность раствора иодида и легко отделяющийся от него при помощи соответствующего отделителя, который держат ниже температуры кипения раствора.
Истощенная амальгама вынимается из сосуда и заменяется свежей. Когда вынутая амальгама содержит 0,01% калия, то плотность тока на аноде может быть 0,03 амп. на см2. Раствор калия можно выпаривать при атмосферном давлении, что уменьшает потерю через реакцию с аммиаком, при образовании амида калия. Остающийся металл имеет губчатый вид; его расплавляют при возможно низкой температуре и выливают в формы.
Часть электролизера, в которой собирается раствор калия, а также испаритель, должны быть изготовлены из вещества или обложены веществами, которые не ускоряют реакцию между калием и аммиаком, как, напр., из эбонита, стекла, эмалированного железа или меди.
Когда раствор иодида значительно более разбавлен, чем выше указано, то калий не получается, а образуется только амид калия.
На фиг. 1 чугунный сосуд для электролита защищен в верхней части эбонитовой подкладкой 2. Ток подводят к зажиму 3, так что анодом служит амальгама, а катодом продырявленная стальная пластинка 4, изолированная прокладкой 5. Амальгама входит по трубе 6, проходящей по дну сосуда, и выходит через трубу 7. Жидкий аммиак протекает в сосуд 8 через вентиль 9; газообразный же аммиак выходит через трубу 10, которая соединяется патрубками с сосудами 8, 11 и 15, и может быть удален через трубу 16. Верхний жидкий слой раствора калия в жидком аммиаке собирается в сосуде 11 и переходит для отстаивания от увлеченного электролита в сосуд 12, откуда он протекает через трубу 14 в сосуд 15 и выходит через вентиль 17. Переходящий с раствором калия раствор иодида возвращается по трубе 13 в сосуд 1. Аппарат может, если желательно, находиться под давлением. Необходимые для сосуда 12 охладительные рубашки не указаны на чертеже.
Пример 2. Твердый натрий. Раствор 90-100 г цианида в 100 г жидкого аммиака подвергается электролизу при атмосферном давлении, и при температуре между его точками кипения и замерзания (приблизительно между -20°C и -34°C), при чем катодом является сталь с малым содержанием углерода, а анодом натриева амальгама (0,05%). Натрий выделяется в виде твердой кристаллической губки, которая собирается и сжимается приспособлениями, находящимися внутри сосуда, как, напр., помощью ножа и поршня, без доступа воздуха и влаги, чтобы удалить электролит и соединить отделенные кристаллы в однородную металлическую массу. Металл продавливается через отверстие в стенке сосуда, которое закрыто всегда пробкой из твердого натрия. Отдача (коэфф. пол. действия) только в этом случае почти теоретическая.
Предлагаемый способ можно выполнить в аппарате схематически изображенном на фиг. 2. В сосуде 20, охлаждаемом снаружи, помещается медленно вращающийся барабанный катод 21, анодом служит амальгама 22. Отлагающийся на катоде щелочный металл снимается ножом 25, по которому скатывается в отделение 26, откуда удаляется через отверстие 27 поршнем 24.
Пример 3. Раствор 50 частей цианида натрия в 100 частях жидкого аммиака подвергается электролизу при атмосферном давлении и при температуре между точками замерзания и кипения раствора (т.-е. между -31°C до -28°C), при чем анодом служит амальгама натрия, а катодом - металл, который не действует каталитически на реакцию между натрием и аммиаком и который не изменяется в данных условиях, как, напр., сталь с малым содержанием углерода. Плотность тока на аноде 0,06 амп. на см2; истощенную амальгаму можно выпустить с 0,002% содержанием натрия, если скорость течения амальгамы 200 см в минуту. Более высокая скорость течения допускает более высокую плотность тока или более низкую концентрацию при выходе и наоборот. Отдача тока, в общем, теоретическая. Натрий собирается в виде бронзового раствора в аммиаке, который свободен от цианида, плавающего на электролите; последний остается обыкновенно бесцветным. Раствор натрия в аммиаке не смешивается с раствором цианида и отделяется помощью охлажденного отделителя. Металл получается в чистом состоянии посредством выпаривания досуха при атмосферном давлении, а газообразный аммиак используют известным образом. Остающийся твердый натрий имеет форму плотной губки, подверженной окислению, вследствие чего его расплавляют при возможно низкой температуре и выпускают в формы. Выпаривание возможно производить также под давлением. Части электролизера, соприкасающиеся с раствором натрия, изготовляются из веществ, не влияющих каталитически на реакцию между натрием и аммиаком.
Пример 4. Раствор 60 г цианида натрия в 100 г жидкого аммиака подвергается при 17-30°C электролизу в сосуде, стенки которого могут выдержать внутреннее давление. В этом случае очень важно, чтобы части аппарата, соприкасающиеся с раствором натрия, состояли из веществ, не влияющих каталитически на реакцию между натрием и аммиаком, скорость которой при высокой температуре гораздо выше. Как на более подходящие вещества, можно указать на стекло, стеклянную эмаль, эбонит, медь и монель-металл. Катод состоит из меди или монель-металла, анод же из натриевой амальгамы, которая накачивается в сосуд или течет с соответствующей высоты; истощенная амальгама также вытекает самотеком. Натрий собирается в аммиаке в виде бронзового раствора, который свободен от цианида и плавает на электролите. Натрий очень мало растворяется в растворе цианида, который окрашен в синий цвет. Раствор натрия в аммиаке течет через отделитель в испаритель, где аммиак испаряется и конденсируется в наполненном водою конденсаторе, из которого возвращается обратно в сосуд. Когда в испарителе собирается достаточное количество натрия, приток раствора прекращается, металл нагревается до плавления и чистый расплавленный металл выпускается в формы.
Так как на катоде из раствора цианида отделяется аммиак, и его концентрация увеличивается, то необходимо смешивать концентрированный раствор с жидким аммиаком, возвращающимся в сосуд. Это производится проще всего регулированием давления в сосуде, так что раствор находится в постоянном волнении; циркуляцию можно также производить термосифоном.
Возможно также употреблять другую концентрацию цианида натрия. 15 ч. цианида натрия в 100 частях жидкого аммиака можно подвергать электролизу вместе с амальгамой, которая находится в движении или которая в виде тонкого слоя течет, с такой скоростью, что находящийся в ней натрий почти полностью выделяется во время течения. Наиболее подходящая температура для этого, при атмосферном давлении, от -40°C до -31,5°C. При этой концентрации отдача тока небольшая, но ее можно повысить, поместив между электродами диафрагму, которая препятствует соприкосновению растворенного натрия с амальгамой.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ЛИТИЯ | 2000 |
|
RU2250274C2 |
| Способ электролитического получения алкильных производных металлов II-V групп периодической системы | 1959 |
|
SU132136A1 |
| ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА И СПОСОБ ПОЛУЧЕНИЯ ЩЕЛОЧНОГО МЕТАЛЛА ИЗ АМАЛЬГАМЫ ЩЕЛОЧНОГО МЕТАЛЛА И ОБЪЕДИНЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ХЛОРА И ЩЕЛОЧНОГО МЕТАЛЛА ИЗ ХЛОРИДА ЩЕЛОЧНОГО МЕТАЛЛА | 1999 |
|
RU2250933C2 |
| ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ЩЕЛОЧНОГО МЕТАЛЛА ИЗ ВОДНОГО РАСТВОРА | 2000 |
|
RU2253703C2 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ ЭЛЕМЕНТ ДЛЯ ПОЛУЧЕНИЯ ЩЕЛОЧНОГО МЕТАЛЛА | 2000 |
|
RU2252981C2 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ПОЛУЧЕНИЯ КАТАЛИЗАТОРОВ | 1995 |
|
RU2154529C2 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ПОЛУЧЕНИЯ КАТАЛИЗАТОРА НА ОСНОВЕ ПЕРЕХОДНОГО МЕТАЛЛА И ФОСФИНА | 1996 |
|
RU2167716C2 |
| ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ТЕТРАЭТИЛ СВИНЦА | 1966 |
|
SU189772A1 |
| Способ амальгамирования металлов и сплавов,слабовзаимодействующих с ртутью | 1983 |
|
SU1133311A1 |
| СПОСОБ ЭЛЕКТРОЛИТИЧЕСКОГО ВЫДЕЛЕНИЯ ТАЛЛИЯ И СВИНЦА ИЗ СМЕШАННЫХ АМАЛЬГАМ | 1968 |
|
SU211103A1 |
1. Способ электролитического получения щелочных металлов, как, например, натрия из их амальгамы, одновременно получаемой электролизом водного раствора их солей с ртутным катодом, отличающийся тем, что, при пользовании амальгамой в качестве анода и неизменяемым металлическим катодом, в качестве электролита применяют раствор цианистой или т.п. соли в безводном жидком аммиаке, метиламине или т.п. с целью получения щелочного металла в виде раствора, всплывающего над раствором соли, после чего из верхнего слоя выделяют металл путем испарения растворителя, прибавляемого затем в сжиженном состоянии к электролиту.
2. Видоизменение указанного в п. 1 способа, отличающееся тем, что электролиз ведут до пересыщения аммиачного раствора металлом и дальнейшего выделения металла на катоде в твердом состоянии.
3. Аппарат для выполнения указанного в п. 1 способа, отличающийся применением чугунного электролитического сосуда, верхняя часть которого с внутренней стороны защищена эбонитовой и т.п. подкладкой 2, дно покрыто слоем протекающей амальгамы щелочного металла, впускаемой и выпускаемой по трубам 6 и 7, служащей анодом, катода 4 в виде продырявленной стальной пластинки, изолированной при 5, вентиля 9 и сосуда 8 для впуска в электролизер жидкого аммиака, сосуда 11 для вмещения верхнего жидкого слоя, состоящего из раствора щелочного металла в жидком аммиаке, сосуда 12 для отстаивания этого слоя от увлеченного электролита, трубы 13 для спуска отстоявшегося нижнего слоя электролита обратно в электролизер, трубы 14 для стока раствора щелочного металла в жидком аммиаке в сосуд 15 с выпускным вентилем 17, трубы 10 и 16, соединяющейся патрубками с сосудами 8, 11, 15 для выпуска газообразного аммиака (фиг. 1).
4. Аппарат для выполнения указанного в п. 2 способа, отличающийся применением. охлаждаемого снаружи сосуда 20 с амальгамой 22 в качестве анода и с вращаемым барабаном 21 в виде катода, применяемым для отложения щелочного металла, для снятия которого с барабана 21 служит нож 25, а для удаления из аппарата через отверстие 27 - поршень 24.
Авторы
Даты
1927-09-30—Публикация
1924-04-14—Подача