Хлористый натрий5,0
Вода для осуществления
процесса1000 мл
Жидкая среда дополнительно обогащается таким источником углерода,как глюкоза в количестве 0,1 - 1,0% от объема воды. В случае культивировани микоплазмового куриного септика в указанную жидкую среду дополнительно добавляется птичья кровяная сыворотка в количестве 5-15% от объема среды. В случае культивирования микоплазмового синовия в жидкую среду дополнительно добавляется 5-15% птичьей кровяной сыворотки, 0,001 0,1% (от объема воды)дифосфопир. динануклиотида, 0,001 - 0,1% хлоргидрата L-цистеина и 0,01-0,1% (от объема воды), витаминов Игл (100%-ной концентрации).
1 л концентрата витаминов содержит ; мг :
aL-Биотин0,24
Фолевую кислоту0,44
Амид никотиновой кислоты 0,12 Пантотенат кальция 0,24 Хлоргидрат Пиридоксал0,20
Хлоргидрат тиамина 0,34 Рибофлавин0,04
Хлорид холина0,14
При культивировании грибков микоплазмовой пневмонии в питательную среду дополнительно добавляется 1020% (от объема воды) сыворотки свино крови, а при культивировании микоидов микоплазмы для козьих паразитических грибков в питательную среду дополнительно добавляется 5-15% (от объема воды) сыворотки козьей крови.
Каждая из вышеупомянутых сывороток может по желанию быть заменена на препарат из яичного желтка в количестве 3-8% от объема воды. Препарат из яичного желтка может быть приготовлен путем экстрагирования яичного желтка равным по объему количеством чистой (деионизированной или дистиллированной) воды или водным.раствором, имеющим рН 6,0-7,8 таким, например, как физиологический соляной раствор, 100-мольный фосфатный буферный раствор или смесь этих двух растворов. Экстрагирование может быть, например, выполнено путем перемешивания смеси яичного желтка и деионизированной воды (1:1 по объему) при 56°С в течение 2 час с последующим охлаждением до комнатной температуры Затем смесь центрифугируют при 10000 об/мин и всплывшую жидкость фильтруют в условиях полной стерильности для получения препарата из яичного желтка.
Каждый из перечисленных штаммов микоплазм засевают в при;оговленную описанным выше способом питательную среду для выращивания клеток микоплазмы, которое . уществляется аэробным способом при 35-38 С в течение 1-7 дней, и обеспечивает высокий выход клеток микоплазм, составляющий 1,0 - 5,0 г клеток на 1 л питательно среды.
Для сбора урожая клеток миксплазмы питательный раствор центрифугируют с применением центробежного сепаратора при 8000 об/мин или более в течение не менее 20 мин или с применением центробежного сепаратора непрерывного действия, работающего, например, со скоростью 16000 об/мин (около 25000 } .
Отделение клеток микоплазмы от питательного раствора может осуществляться добавлением геля гидроокиси алюминия или геля фосфата алюминия, который, являясь адсорбентом, способствует отделению или осаждению клеток микоплазмы. Количество используемого адсорбента может лежать в пределах 10 - 400 мл (предпочтительно 30 - 100 мл) на 1 л питательной среды.
Собранные таким образом клетки микоплазмы затем смешивают с физиологическим водным раствором, имеющим рН 6,0 - 7,8 (предпочтительнее 6,57,4). Такой физиологической средой может быть физиологический соляный раствор, 100-мольный буферный раствор фосфата или смесь двух этих растворов. В результате получают взвесь клеток штамма микоплазма.
Типичным примером смеси фосфатного буферного раствора и соляного физиологического раствора может служит раствор, имеющий следующий состав: NaHjPOi, 2HjO507 мг
NaHPO/i959 мг
NaCE8,5 г
Вода1000 см
рН7,2
Б полученной взвеси клеток регулируют их концентрацию, которая должна быть не менее 2,0 х 10 клеток/мл.
Взвесь клеток подогревают в течение 5-30 мин до 50-56 С для умерщвления клеток. Этого же результата можно добиться добавлением инактивирующего клетки реактива. Таким реактиво может быть, например, формалин (0,010,5% от объема воды), натрий- этил- -ртутная соль салициловой кислоты (0,01-0,02% от объема воды) или jj - -пропиолактон (0,01-0,2% от объема воды).
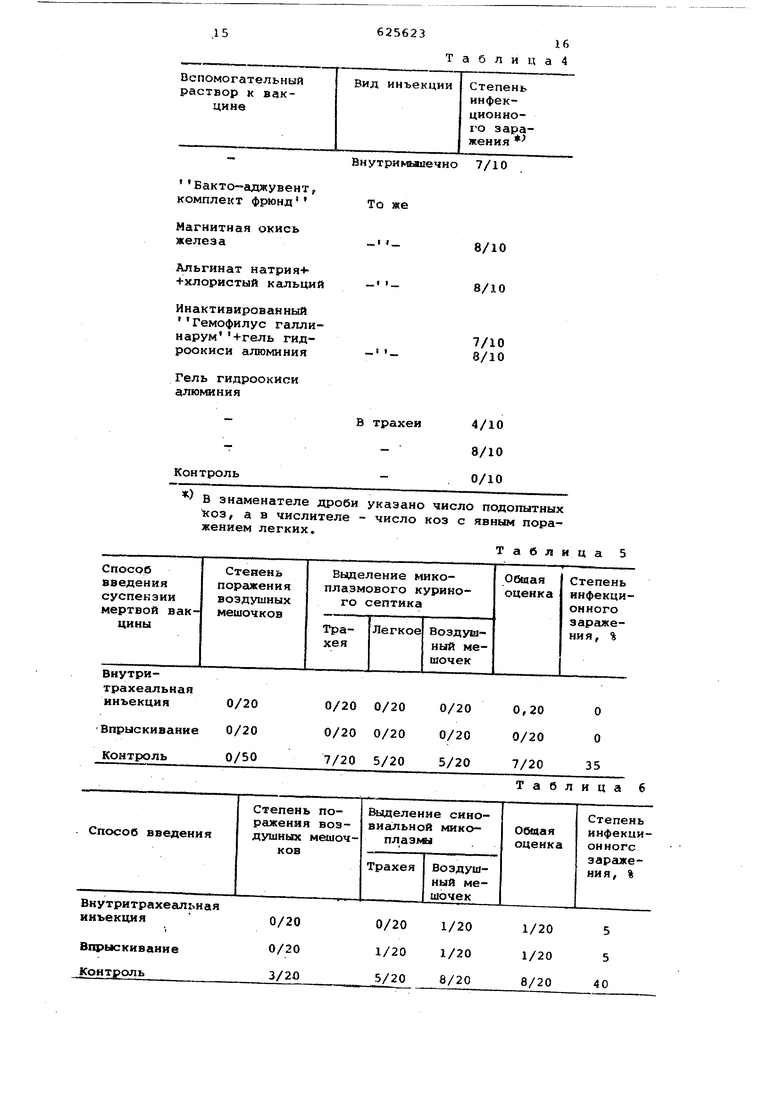
Взвесь клеток может быть получена путем суспендирования осадка в небольшом количестве физиологического соляного раствора. Затем полученную суспензию подвергают такой инактивирующей обработке, которая обеспечивает полное разрушение клеток микоплазмы, например, ультразвуковой дезинтеграции, осуществляемой в тече5ние 0,5-lb мин в 10 кГц, или прессо ванию французским способом. Раствор разбавляют физиологическим соляным Раствором до указанной выше концент рации клеток и получгиот суспензию инактивированных клеток. Приготовленная таким образом ина тивированная вакцина микррплазмы яв ляется суспензией инактивированных клеток микроплазмы или их частиц в физиоло;ическом соляном растворе с рН 6,0 - 7,8. Число клеток или их частиц должно быть не менее 2,ОХ1о на 1 мл суспензии живых клеток. Прекрасный иммунизирующий эффект может быть получен даже в том случа когда используется также суспензия инактивированных клеток. Однако для усиления этого эффекта предпочтитель нее, чтобы суспензия содержала стабилизирующее вещество. Стабилизирующим веществом может служить один из перечисленных ниже составов (или смеси этих составов). Сахариды,%: глюкоза 0,3-1,0; сахароза 0,5-1,0; лактоза 0,1-1,0 или декстран 0,5-3,0. Аминокислоты,%: глутаминовая кислота 0,1-0,5 или глкцин 0,5-5,0. Сыворотки. В случае применения вакцины на ос нове микроплазмового куриного септика или на основе синовиальной микоплазмы:сыворотка птичьей крови (0,1-1,0% или альбумин сыворотки птичьей крови (0,1 0,5%) . В случае применения вакцины на основе пневмониальной микоплазмы: сыворотка свиной крови (0,1-1,0%) или альбумин сыворотки свиной крови (0,1-0,5%) В случае применения вакцины на ос нове микоидов микоплазмы или козьих паразитических грибков: сыворотка Кзьей крови (0,1-1,0) или альбумин сыворотки козьей крови (0,1-0,50% Прочие: Твин 80 (0,05-0,5%), желатин (0,01-0,05%) или динатрий этилендиамин-тетраацетат (0,03-0,3%). Перед добавлением стабилизирующего состава к инактивированной суспен зии клеток эта суспензия должна быть подвергнута гомогенизации с использованием любого физического метода, например,обработки ультразвуком мощностью 10 кГц в течение 0,5-1,0 мин или встряхивания с помещением в сосу мелких стеклянных шариков. После это го стабилизирующий состав добавляетс в соответствующих количествах в суспензию клеток для получения суспензи вакцины убитых клеток микоплазмы. 3 Предотвращение респираторных забо лёваний, вызываемых инфекционной микоплазмой, достигается за счет иммунизации органов дыхания домашних животных путем впрыскивания суспензии вакцины в трахеи. Однако суспензия вакцины мертвой ми{;оплазмы, приготовленная в соответствии с изобретением, не может дать сколько-нибудь заметного эффекта,когда вакцина вводится внутримьшечно либо одна, либо в смеси с различными вспомогательными растворами, такими, например, как Бакто-аджувент, комплект фрюнд, магнитная окись железа, смесь альгината натрия с хлоридом кальция, смесь анактивированного вещества Темофилус галлинарум с гелем гидроокиси алюминия или гель гидроокиси алюминия. Суспензия инактивированной вакцины микоплазмы, .приготовленная в соответствии с изобретением, может, однако, дать прекрасный защитный эффект при введении или впрыскивании непосредственно в трахеи. Эта иммунизируквдая процедура является безвредной и не дает таких побочных эффектов , как отвердение места инъекции, которое часто наблюдается в случаях применения внутримышечной инъекции вакцин, предварительно инактивированных. Количес ВО суспензии вакцины мертвой микоплазмы, вводимой путем впрыскивания или инъецирования в трахеи, может изменяться в зависимости от степени инфекции домашних животных. Так, длн предотвращения заболевания дыхательных органов у птиц необходимо вводить не менее 0,1 мл суспензии вакцины мертвого микоплазмового. куриного септика или мертвой синовиальной микоплазмы (или смеси этих вакцин); для предотвращения заболевания свиней энзоотической пневмонией необходимо вводить не менее 0,5 мл суспензии вакцины мертвой пневмониальной микоплазмы; для предотвращения заболевания овец инфекционной плевропневмонией необходимо вводить не менее 0,5 мл суспензии вакцины мертвых микоидов микоплазмы или козьих паразитических грибков. Обычно вакцины можно вводить путем вспрыскирания или инъекции их в трахеи с помощью небулизатора другого устройства для впрыскивания. Введение вакцин следует делать не менее 2-3 раз с интервалом в 10 дней. Суспензия вакцин мертвой микоплазмы, приготовленная в соответствии с изобретением, показала значительный иммунизирующий эффект против воздействия сильных штаммов микоплаэмы даже в том случае, когда подвергающиеся иммунизации этой вакциной домашние животные были-заражены и другими патогенными микроорганизмами. 7 6 Пример, К1л исходной жидкой питательной ореды для микоплазмы добавляют 0,5% (от объема воды) глюкозы и 10% по объему подогретой сыворотки крови цыпленка. Приготовленную жидкую питательную среду засевают микоплазменньлм куриным септиком. Культивирование бактерий осуществляют в аэробных условиях при 35-38 С в течение 2 дней. По окончании культивирования питательную жидкость центрифугируют при 13000 об/ми .в течение 30 мин и получают осажденвые .(отцеженные) клетки микоплазмово го куриного септика. К этому осадку добавляют водный физиологический раствор, забуференный фосфатом и имеющий рН 7,2. Количество раствора выбирается так, чтобы обеспечить кон центрацию клеток в суспензии не менее 2,0 X 10 клеток на 1 мл. В приготовленную таким образом суспензию клеток добавляют 0,01% формалина,который убивает клетки. После этого суспензию мертвых клеток гомогенизируют с помощью ультразвука при 100 кГц в течение 30 сек, а затем к полученному раствору добавляют стабилизатор суспензии - смесь 0,02% желатина с 0,1% Твин 80 для получения суспензии инактивированной вакцины куриного септика. Пример 2. Повторяют процедуру, описанную в примере 1, Однако подогретую сыворотку крови цыпленка, используемую в качестве компонента при приготовлении питательной среды для размножения клеток микоплазмового куриного септика, заменяют 6%-ным по объему, количеством препарата яичного желтка, экстрагированного деионизированной водой. Получают суспензию инактивированной вакцины микоплазмового куриного септика. Примерз. Повторяют процедуру, описанную в примере 1, однако, осаждение клеток микоплазмового кури ного септика проводят добавлением 50 мл геля гидроокиси алюминия в 1000 мл питательной среды. Получают суспензию инактивированной вакцины микоплазмового куриного септика. П р и м е р 4. Повторяют процедуру, описанную в примере 1, однако, в качестве исходной культуры используют бактерии синовиальной микоплазмы и в питательнуюсреду добавляют 13% по объему подогретой сыворотки крови цыпленка, а также 0,01% хлоргидрата L-цистеина и 0,025% витаминов Игл (100%-ной концентрации). Получают суспензию инактивированной вакцины синовиальной микоплазмы. П р и м е р 5. Повторяют процедуру, описанную в примере 1, однако, в качестве исходной культуры для засев питательной среды используют микоидную микоплазму или козьи паразитичес кие грибки и в среду вводят подогретую сыворотку козьей крови в количестве 1% по объему. Получают суспензию мертвой вакцины микоидной микоплазмы. Пример 6. Повторяют процедуру, описанную в примере 5, однако, подогретую сыворотку козьей крови заменяют 6%-ным яичным желтком. Получают суспензию инактивированной вакцины микоидной микоплазмы. 1-ый опыт. 10 цыплят 10-дневного возраста без патологических явлений были подвергнуты иммунизации путем впрыскивания в дыхательные трахеи суспензии мертвой вакцины микоплазмового куриного септика (группа 1). Другие 10 цыплят были подвергнуты иммунизации путем внутримышечного введения той же самой суспензии мертвой вакцины (группа 2). Еще 10 таких же цыплят были подвергнуты иммунизации путем внутримышечного введения той же суспензии мертвой вакцины, которая была использована при иммунизации цыплят группы 1, но с добавлением различных вспомогательных растворов (группа 3). Иммунизация была повторена 3 раза с интервалом в 10 дней. Разовая иммунизирующая доза составляла 0,1 мл. Спустя 10 дней испытуемые цыплята всех трех групп были подвергнуты заражению путем впрыскивания сильного штамма микоплазмового куриного септика, содержащ.его 3,2 х 10 или 1,6 X Ю живых клеток. Спустя 2 недели после заражения подопытные цыпля,та были вскрыты и обследованы с целью оценки эффективности действия вакцины, главным образом с точки зрения макроскопического поражения воздушных мешочков. Результаты обследования приведены .в табл.1. На основании данных табл.1 можно сделать вывод, что вышеупомянутая суспензия мертвой вакцины не может обеспечить сколько-нибудь заметный защитный эффект, если она вводится внутримышечно либо одна, либо в смеси с различными вспомогательными веществами.. Однако введение этой вакцины непосредственно в трахеи может обеспечить требуемый защитный эффект. 2-ой опыт. Был повторен 1-ый опыт с тем лишь изменением, что вместо суспензии мертвой вакцины микоплазмового куриного септика и сильного штамма микоплазмового куриного септика были взяты соответственно суспензия мертвой вакцины синовиальной микоплазмы и сильный штамм синовиальной микоплазмы, имеющий концентрацию, равную 5,7 X 10 живых клеток. Полученные результаты приведены в табл.2. 3-ий Опыт. Был повторен 1-ый опыт с тем лишь изменением, что вместо 9 вакцины микоплазмового куриного сеп тика и сильного штамма микоплазмово го куриного септика были взяты соотБетственно суспензия инактивирован ной вакцины свиной пневмониальной микоплазмы и сильным штамм свиной пневмониальной микоплазмы. Опыт про водили на свиньях без патологических изменений в возрасте 3-4 недель Доза разовой иммунизации составила 0,5 мл. Десять дней спустя после про ведения последней иммунизации свиньи были подвергнуты заражению путем впрыскивания сильно- j штамма свиной пневмониальной микоплазмы, имеющей концентрацию 5,5 х 10 живых клеток. Спустя 6 недель подопытные свиньи были вскрыты и обследованы с целью оценки, эффективности действия вакцины по патологическим изменениям в легких. Полученные результаты приведены в табл.3. 4-ый Опыт. Был повторен 3-ий опы с тем лишь изменением, что вместо суспензии мертвой вакцины свиной пневмониальной микоплазмы, сильного штамма свиной пневмониальной микоплазмы и свиней без патологических изменений были соответственно взяты суспензия мертвой вакцины микоидов микоплазмы или паразитических козьих грибков, полученная в примере 5, сильный штамм микоидов микоплазмы или паразитических козьих грибков, имеющий концентрацию 7,0 х 10 живых клеток. Опыт ставили на козах без патологических изменений в возрасте 3 недель. Полученные результаты приведены в табл.4. Для того, чтобы узнать защитный эффект суспензии мертвой вакцины микоплазмы от респираторных заболеваНИИ домашних животных, вызываемых заражением этих животных сильными штаммами микоплазмы, были проведены следующие опыты. 5-ый Опыт. 10 цыплят 10-дневного возраста, не имеющих признаков патологии, были иммунизированы 2 или 3 раза с 10-дневным интервалом, причем доза суспензии мертвой вакцины микоплазмового куриного септика и вводимой внутритратеально с помощью инъекции или впрыскивания, была 0,1 мл. Спустя 10 дней после последней иммунизации все 40 цыплят, 20 и которых составляли не иммунизирован ную группу (контрольную), были поме щены вместе с десятью цыплятами, за раженными сильным микоплазмовым кур ным септиком, имеющим концентрацию 2,3 X 10 живых клеток. Спустя 4 не дели была произведена оценка защитно го эффекта инактивированной вакцины оказываемого на дыхательные органы цыплят в условиях воздействия на них инфекционной микоплазмы. Оценка производилась по степени поражения воздушных мешочков .;: по резуз1ьтатам выделения микоплазмового куриного септика из трахей, легких к воздушных мешочков. Полученные результаты приведены в табл.5, В табл. 5-9 в знсчменателе дроби указано число подопы-тных цыплят, в числителе - число пораженных цыплят. Общая оценка - это отношение числа подопытных цыплят к общему числу зараженных цыплят. б-ой Опыт. Был повторен 5-ый опыт, но вместо суспензии мертвой вакцины микоплазмового куриного септика и сильного штам1ма микоплазмового куриного септика были взяты соответственно,суспензия мертвой вакцины синовиальной микоплазмы и сильная синовиальная микоплазма, имеющая концентрацию 5,0 X 10 живых клеток. Заражение иммунизированной и неиммунизированной групп путем помещения их вместе с зараженными цыплятами было осуществлено спустя 12 дней после последней иммунизации. Полученные результаты показаны в табл.6 7-ой Опыт. Был повторен 6-ой опыт с тем лишь изменением, что через 7 дней после последней иммунизации иммунизированнйя группа была подвергнута заражению через питьевую воду вирусом инфекционного бронхита и вирусом ньюкаслской болезни. Спустя еще 5 дней зараженные таким образом цыплята (20 голов) были помешены вместе с десятью цыплятами, зараженными сильной синовиальной микоплазмой, как в 6-ом опыте. Полученные результаты приведены в табл.7. 8-ой Опыт. Был повторен 5-ый опыт, но вместо суспензии мертвой вакцины микоплазмового куриного септика ьыла использована смесь суспензии мертвой вакцины микоплазмового куриного септика и суспензии мертвой вакцины синовиальной муа оплазмы. Заражение иммунизированной и некммунизированной группы путем помещения их вместе с зараженной раннее группой было осуществлено через 12 дней после проведения последней иммунизации. Полученные результаты приведены в табл.8. 9-ый Опыт. Зыл повторен 8-ой опыт, но вместо сильного микоплазмового куриного септика была применена сильная синовиальная микоплазма, имеющая концентрацию 5,0 х 10 живых клеток. Полученные результаты приведены в табл.9. 10-ый Опыт, Опыт проведен на свиньях трехнедельного возраста, не имеющих признаков патологических изменений, которым вводили суспензию мертвой вакцины свиной пневмониальной микоплазмы с последующим заражением сильной свиной пневмониальной микоплазмой,имеющей концентрацию 11 5,0 X 10 живых клеток. Разовая иммуниэйрующая доза вакцины составляла 0,5 МП. Спустя 6 недель после зараже ния свиньи балк вскрыты и обследованы с целью выявления патологических изменений в легких. Полученные результаты приведены в табл.10. 11-ый Оцыт. Опыт был поставлен на козах трехнедельного возраста,не имеющих признаков патологических изменений, которым вводили суспензию мертвой в:акцины микоидов микоплазмы или козьих паразитических грибков, а для их заражения использовали силь ный раствор микоидов микоплазмы, име юший концентрацию 5,0 х 10 живых клеток. Полученные результаты приведены в табл.11. 12-ый Опыт. Для того, чтобы выявить влияние стабилизатора суспензии
Таблица .1 3 входящего в состав инактивированной вакцины микоплазмы, были проведены следующие сопоставительные опыты. Цыплята 10-дневного возраста были трижды (с интервалом в 10 дней) подвергнуты иммуниза1;ии с помощью суспензии мертвых клеток и вакцины мертвых клеток/ в состав которой вошел стабилизатор суспензии (доза разовой иммунизации - не менее 0,1 мл). Спустя 10 дней после последней иммунизации цыплята были заражены сильные раствором микоплазмового куриного j септика, имеюшим концентрацию 7,4x10 живых клеток. Еще через 2 недели подопытные цыплята были обследованы для оценки влияния вакцины, главным образом, по состоянию воздушных меаючков и по выделению из трахей, легких и воздушных мешочков штамма микоплазмы. Полученные результаты приведены в табл.12.




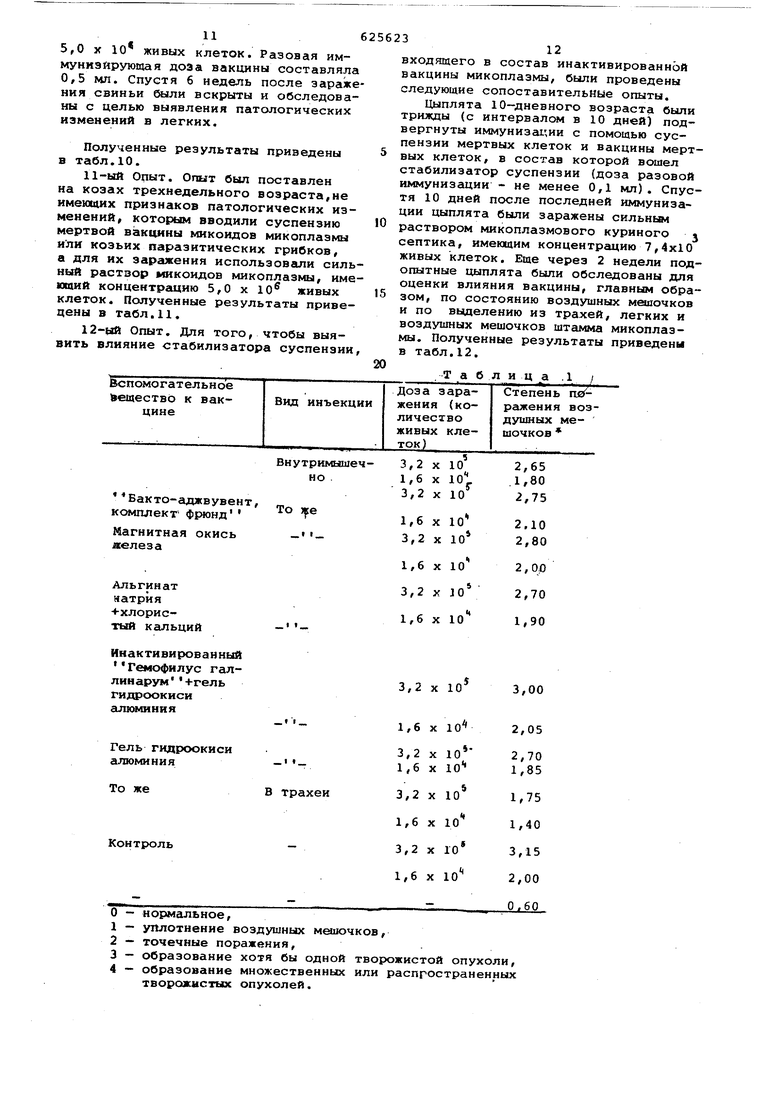


| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ "О" ВИРУСА ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2207372C1 |
| ВИРУСВАКЦИНА ПРОТИВ БОЛЕЗНИ МАРЕКА | 2009 |
|
RU2410117C1 |
| ПРОИЗВОДСТВЕННЫЙ ШТАММ "ВЛАДИМИР" ВИРУСА ГЕРПЕСА ИНДЕЕК ДЛЯ ИЗГОТОВЛЕНИЯ ВИРУСВАКЦИНЫ ПРОТИВ БОЛЕЗНИ МАРЕКА | 2007 |
|
RU2336303C1 |
| Способ профилактики болезни Гамборо | 1991 |
|
SU1824443A1 |
| ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ | 2003 |
|
RU2257225C1 |
| АССОЦИИРОВАННАЯ КУЛЬТУРАЛЬНАЯ СУХАЯ ВИРУСВАКЦИНА ПРОТИВ НЬЮКАСЛСКОЙ БОЛЕЗНИ И ОСПЫ ПТИЦ | 2005 |
|
RU2295357C1 |
| ВАКЦИНА ПРОТИВ ОСПЫ ПТИЦ И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1986 |
|
RU1405148C |
| ШТАММ ПТИЧЬЕГО РЕОВИРУСА, ВАКЦИНА, СОДЕРЖАЩАЯ УКАЗАННЫЙ РЕОВИРУС, СПОСОБ ПОЛУЧЕНИЯ ПТИЧЬИХ РЕОВИРУСОВ, СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ И СПОСОБ БОРЬБЫ С ПАТОЛОГИЯМИ ПТИЦЫ, ВЫЗЫВАЕМЫМИ ПТИЧЬИМИ РЕОВИРУСАМИ | 2000 |
|
RU2265659C2 |
| ШТАММ № 3004/№ 109 ВИРУСА БОЛЕЗНИ МАРЕКА ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ | 2001 |
|
RU2199583C1 |
| Штамм "Ямал" вируса гриппа птиц рода Alphainfluenzavirus вида Influenza A virus подтипа H5N1 для изготовления биопрепаратов для специфической профилактики гриппа птиц типа А подтипа Н5 | 2022 |
|
RU2796987C1 |

Бакто-аджвувент, комплект фрюнд
Магнитная окись яелеза
Альгинат натрия -«хлористый кальций
Инактивированный Гемофилус галлинарум-нгельгидроокиси
С1ЛКЯ4ИННЯ
Гель гидроокиси алюминия
То же
Контроль
нормальное,
уплотнение воздушных мешочков,
точечные поражения,
образование хотя бы одной творожистой опухоли,
образование множественных или распространенных
творожистых опухолей.
1,6 X 10
2/ОХ)
3,2 X 10 2,70 1/6 X ю 1,90
X 10
3/00
X 10
2/05
X
2,70 X Ю 1,85
X 10
1,75 X ю 1/40 X 10 3,15 ю
2,00 0,60
Вспомогательный раствор к вакцине
Бакто-аджувент, комплект Фрюнд
Магнитная окись железа
Альгинат натрия + +хлористый кальций
Инактивированный Гемофилус галлинарум + гель гидроокиси aлю Iини
Контроль
Магнитная окись железа
Альгинат натрия + хлористый кальций
Инактивированный Гемофилус галЛИНарум
+ гель
гидроокиси алюминия
Гель гидроокиси алюминия
В трахеи
Контроль
)
В знаменателе дроби указано число подопытных свиней, а в числителе - число свиней с ЯВНЕЛМ поражением легких.
Степень
Вид инфекции поражения воздушных мешочков
нутримы2,20 шечно 2,25
То же
I |
2,30 2,25
1,55
В трахеи 2,35 0,50
ТаблицаЗ
8/10
9/10
8/10
9/10
4/10
9/10
О
Бакто-аджувент, комплект фрюнд
Магнитная окись железа
Альгинат натрия- +ХЛОРИСТЫЙ КсШЫЩЙ
Инактивированный Темофилус галлинарум+гель гидроокиси алюминия
Гель гидроокиси алюминия
Контроль
В знаменателе дроби указано число подопытных коз, а в числителе - число коз с явным поражением легких.
Внутритрахеальная
инъекция ° 0/20
Впрыскивание 0/20 Контроль3/20
Внутриквлиечно 7/10
То же
8/10
™ , 8/10
7/10 8/10
4/10
В трахеи 8/10 0/10
Таблица 5
Таблица 6
0/20 1/20 1/20 5 1/20 1/20 1/20 5 5/20 8/20 8/20 40
Внутритрахеальная инъекция
Впрыскивание Контроль
Внутритрахеальная
) -В знаменателе дроби указано число подопытных свиней,, а в числителе - число свиней, у которых обнаружено привитое заболевание легких.
Таблица
2/20
2/20 10 1/20 1/20 5 9/20 9/20 45
Таблица
19
625623
Способ иммунизации
Степень инфекционного
Впрыскивание Контроль
В знаменателе дроби показано число подопытных коз, а в числителе - число коз, у которых обнаружено привитое заболевание легких.
Степень пораВакцинажения воздушных мешочков
Инакт;;зированная вакцина без стабилизатора суспензии
Инактивированная вакцина со стабилизатором суспензии
Контроль
В знаменателе дроби указано число подопытных цыплят, а в числителе - -;исло цыплят, у которых был выделен N-.икоплазмовый куриный септик.
Формула изобретения
Способ получения вакцины против респираторных заболеваний животных и птиц, вызываемых микоплазмами, включающий суспендирование клеток микоплазм в физиологическом растворе и инактивирование их, отличающийся тем, что, с целью повышения иммуногенности вакцины и возможности введения ее внутритрахеально заражения
3/10 10/10
12
Таблиц
Выделение микоплазмового куриного септика
Трахея
Легкое
Воздушный мешочек
2/10 0/10
1/10
1/10 10 0/10 10/10 10/1 8/10
животным и птице, клетки микоплазм после инактивирования дополнительно подвергают гомогенизации, к пол/ченной суспензии добавляют стаби.-изатор и доводят концентрацию клеток до величины 2,0 X Ю - - 2,0 X 10 клеток/мл вакцины.
Источники информации, принятые во внимание при экспертизе:

Авторы
Даты
1978-09-25—Публикация
1973-09-28—Подача