Предлагается усовершенствованный способ получения сложных эфиров полиоксистероидов прегнанового ряда общей формулы I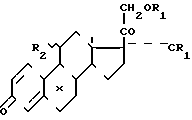 где R1 - остаток карбоновой кислоты алифатического ряда с 1-12 атомами углерода;
где R1 - остаток карбоновой кислоты алифатического ряда с 1-12 атомами углерода;
R2 - атом водорода или ацилоксигруппа;
Х - атом водорода или галоида, представляющих собой промежуточные продукты высокоэффективных лекарственных препаратов, например триамцинолона и его производных.
Сложные эфиры полиоксистероидов прегнанового ряда, содержащий пространственно затрудненную третичную 17α -оксигруппу и 21-оксигруппу, получают, в частности, ацилированием преимущественно из 21-ацетатов смесью карбоновой кислоты и ангидрида карбоновой кислоты в присутствии кислотных катализаторов при температуре 18-35oC. Однако соединения формулы I получают при этом с низкими выходами из-за неполноты завершения процесса ацилирования, образования побочных продуктов и вследствие этого необходимости очистки получаемых соединений, ацилирование Δ1,4-3-кетополистероидов со свободными 17α - и 21-оксигруппами в условиях известных способов проходит с более низкими выходами по сравнению с 21-моноацетатами и практически не применяется.
Известен способ получения 11,17,21-триацетата 9α -фтор-11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20 (триацетата 9α -фторпреднизолона) ацетилированием 21-ацетата или свободного 9α-фтор-11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20, заключающийся в том, что исходное соединение ацилируют смесью уксусного ангидрида и уксусной кислоты в присутствии n-толуолсульфокислоты, взятой в количестве 0,6 моль на 1 моль стероида, при 18-35oC, обычно при 20-25oC, в течение 16 ч, причем n-толуолсульфокислоту прибавляют к суспензии стероида в смеси уксусного ангидрида и уксусной кислоты при указанной температуре. Триацетат 9α -фторпреднизолона получают из 21-ацетата 9α -фторпреднизолона с выходом, близким к количественному.
Существенными недостатками этого способа являются большая продолжительность процесса и образование побочных продуктов реакции при ацетилировании, особенно свободного 9 α -фторпреднизолона, вследствие этого способ не позволяет получить триацетоксипроизводное из 9α -фторпреднизолона с высоким выходом и удовлетворительным качеством.
Целью изобретения является интенсификация процесса и повышение выхода и качества целевого продукта.
Поставленная цель достигается тем, что процесс ацилирования проводят, используя в качестве катализатора 55-70%-ную хлорную кислоту в количестве 0,9-3 моль на 1 моль исходного стероида, и стероид прибавляют к охлажденной до 0-10oC ацилирующей смеси.
Предлагаемый способ получения сложных эфиров полиоксистероидов прегнанового ряда общей формулы I заключается в том, что к приготовленной ацилирующей смеси: ангидрид карбоновой кислоты - карбоновая кислота - хлорная кислота, охлажденной до 0-10oC, прибавляют исходный стероид, полученную реакционную массу перемешивают при комнатной температуре 40-90 мин и затем выделяют целевой продукт известными приемами.
Описываемый способ позволяет значительно сократить продолжительность процесса и получать целевые продукты с количественным выходом и хроматографически чистыми из полиоксистероидов со свободной 21-оксигруппой.
П р и м е р 1. 11,17,21-Триацетат 9α -фтор-11β,17α ,21-триокси-1,4-прегнадиендиона-3,20 (триацетат 9α -фторпреднизолона).
К смеси 32 мл (339 ммоль) уксусного ангидрида, 25 мл уксусной кислоты и 1,55 мл (13,2 ммоль) 57%-ной хлорной кислоты, охлажденной до 5oС, прибавляют 5 г (13,2 ммоль) 9α -фтор-11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20. Реакционную массу перемешивают при 18-20oC в течение 60-90 мин, постепенно выливают в охлажденную смесь 520 мл дистиллированной воды и 50 мл 20%-ного раствора аммиака (рН реакционной смеси в конце прибавления 6-6,5) и перемешивают 15 мин. Выпавший осадок фильтруют, промывают водой и сушат при 60oС до постоянного веса.
Получают 5,65 г (100%) 11,17,21-триацетата 9α -фтор-11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20 с т.пл. 213-214oC, после перекристаллизации из метанола т.пл. 218,5-219,5oC. [α]20D + 72,2o (c 1, хлороформ).
ИК-спектр, см-1: 1753-1738, 1235 (ацетатные группы), 1668 (3-кето), 1630 (Δ4-3-кето), 1610 ( Δ 1-3-кето).
УФ-спектр: λ МеOHмакс 236,5 нм (ε 236,5 15500).
П р и м е р 2. 11,17,21-Триацетат 9α -фтор-11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20 (триацетат 9α -фторпреднизолона).
К смеси 15 мл (159 ммоль) уксусного ангидрида, 12,5 мл уксусной кислоты и 0,78 мл (6,6 ммоль) 57%-ной хлорной кислоты, охлажденной до 5oС, прибавляют 2,78 г (6,6 ммоль) 21-ацетата 9α -фтор-11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20. Реакционную массу перемешивают при 18-20oC в течение 40-60 мин и обрабатывают по методике примера 1. Получают 3,32 г (100%) 11, 17 ,21-триацетата 9α -фтор-11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20 с т.пл. 212-213oC, после перекристаллизации из метанола т.пл. 218-219oC. [α ] 20D +72,0o (c 1, хлороформ).
ИК-спектр, см-1: 1753-1738, 1233 (ацетатные группы), 1668 (3-кето), 1630 ( Δ 4-3-кето), 1610 ( Δ 1-3-кето).
УФ-спектр: λMeOHмакс 236,5 нм (ε236,5 15500).
П р и м е р 3. 11,17,21-Триацетат 11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20 (триацетат преднизолона).
К смеси 20 мл (189 ммоль) уксусного ангидрида, 13,5 мл уксусной кислоты и 0,88 мл (7,5 ммоль) 57%-ной хлорной кислоты, охлажденной до 5oC, прибавляют 2,7 г (7,5 ммоль) 11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20. Реакционную массу перемешивают при 18-20oC в течение 50-70 мин и далее обрабатывают по методике примера 1.
Получают 4,03 г (100%) 11,17,21-триацетата 11β ,17α ,21-триокси-1,4-прегнадиендиона-3,20 c т.пл. 105-107oC, после перекристаллизации из диэтилового эфира т.пл. 121-123oC. [α]20D+ 69,6 (с 0,5, хлороформ).
ИК-спектр, см-1: 1755-1733, 1235 (ацетатные группы), 1663 (3-кето), 1625 ( Δ4 -3-кето), 1605 ( Δ 1-3-кето).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИОКСИСТЕРОИДОВ ПРЕГНАНОВОГО РЯДА | 1976 |
|
SU677409A1 |
| СЛОЖНЫЕ ЭФИРЫ 16 АЛЬФА 17 АЛЬФА - АЦЕТАЛЬЗАМЕЩЕННОЙ АНДРОСТАН-17 БЕТА - КАРБОНОВОЙ КИСЛОТЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ | 1991 |
|
RU2081879C1 |
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА, 17АЛЬФА, 21-ТРИГИДРОКСИ-16АЛЬФА-МЕТИЛ-9АЛЬФА-ФТОРПРЕГНА-1,4-ДИЕН-3,20-ДИОНА (ДЕКСАМЕТАЗОНА) ИЗ ФИТОСТЕРИНА | 2013 |
|
RU2532902C1 |
| 22R- ИЛИ 22S-ЭПИМЕРЫ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1992 |
|
RU2111212C1 |
| СТЕРОИДНЫЕ ЭФИРЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2112775C1 |
| ПРОИЗВОДНЫЕ АНДРОСТЕНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2194053C2 |
| СПОСОБ ПОЛУЧЕНИЯ 6-(N-МЕТИЛ-N-ФЕНИЛ)АМИНОМЕТИЛ-ГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663483C1 |
| СПОСОБ ПОЛУЧЕНИЯ НОВЫХ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ ИЗ Δ-20-КЕТОСТЕРОИДОВ И СПОСОБ ПОЛУЧЕНИЯ 3β-АЦЕТОКСИ-17α-ГИДРОКСИ-16α-МЕТИЛПРЕГНАНОВ С ИСПОЛЬЗОВАНИЕМ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ | 2009 |
|
RU2418805C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6α-МЕТИЛГИДРОКОРТИЗОНА | 2006 |
|
RU2297423C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЛУМЕТАЗОНА, СОЕДИНЕНИЕ | 2002 |
|
RU2260596C1 |
СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ ПОЛИОКСИСТЕРОИДОВ ПРЕГНАНОВОГО РЯДА общей формулы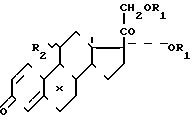
где R1 - остаток карбоновой кислоты алифатического ряда с 1-12 атомами углерода;
R2 - атом водорода или ацилоксигруппа;
X - атом водорода или галоида,
путем ацилирования полиоксистероидов со свободными α - и 21-оксигруппами или их 21-ацилатов смесью карбоновой кислоты и ангидрида карбоновой кислоты в присутствии кислотного катализатора при 18-35oС с последующим выделением целевых продуктов, отличающийся тем, что, с целью интенсификации процесса и повышения выхода и качества целевого продукта, процесс ацилирования проводят, используя в качестве катализатора 55-70%-ную хлорную кислоту в количестве 0,9-3 моль на 1 моль исходного стероида, и стероид прибавляют к охлажденной до 0-10oС ацилирующей смеси.
| ПУСКОВАЯ ТРУБА | 2003 |
|
RU2243480C1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1994-09-15—Публикация
1976-08-17—Подача