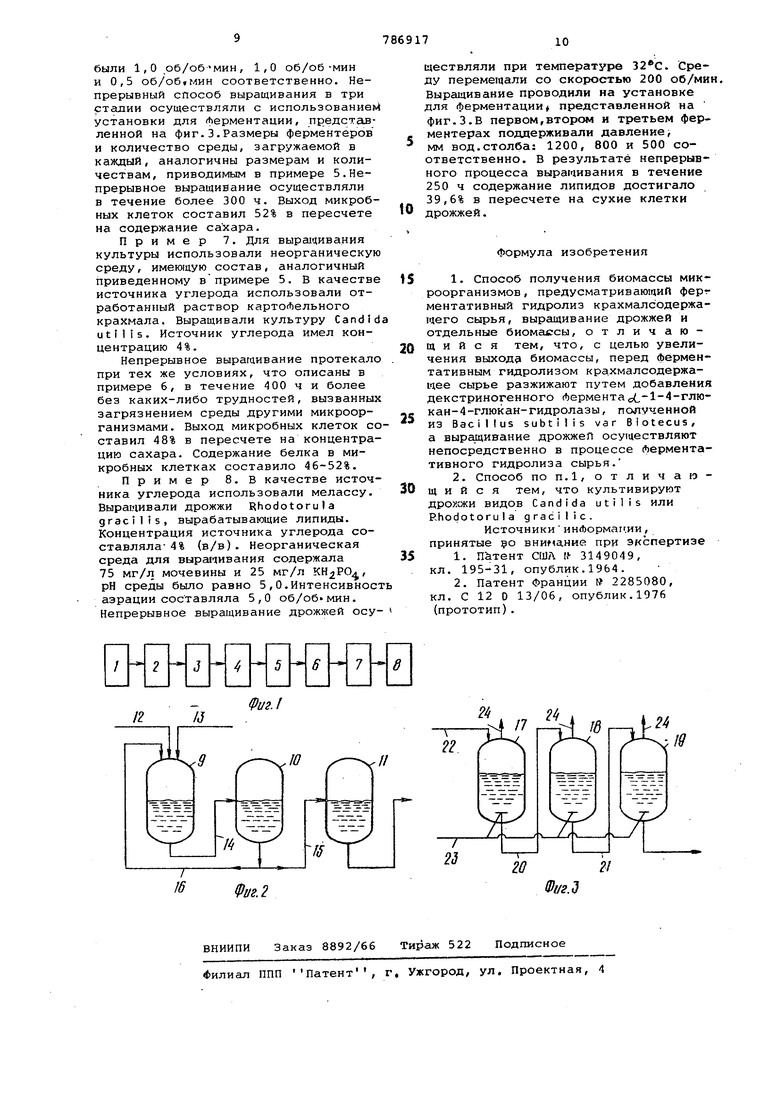
Изобретение относится к микробиологической промьшшенности и включает способ получения биомассы путем куль тивирования микроорганизмов на крахмалсодержащем сырье, предварительно разжиженном и гидролизованном с помощью амилолитических ферментов. Известен способ разжижения крахмалсодержащего сырья с помощью декстриногенных амилолитических ферментов l . Полученное разжиженное сырье после гидролиза может быть использовано для культивирования микроорганизмов. Наиболее близким к изобретению техническим решением является способ получения биомассы микроорганизмов, предусматривающий ферментативный гидролиз крахмалсодержащего сырья, выращизание дрожжей и отделение биомассы 2 . Недостатком известного способа является невысокий выход биомассы в процессе выращивания микроорганизмов. Цель изобретения - увеличение выхода биомассы. Поставленная цель достигается тем что перед ферментативным гидролизом крахмалсодержащее сырье разжижают путем добавления декстриногенного ферментас -1-4-глюкан-4-глюкан-гидролазы, полученной из Bacillus subtil is var Blotecus, a вырсицивание дрожжей осуществляют, непосредственно в процессе ферментативного гидролиза сырья, причем культивируют дрожжи видов Candida utilis или Rhodotorala grac-1 I I s . Способ осуществляют следующим образом. Микроорганизмы утилизируют монои олигосахариды. Высокомолекулярные углеводы, к числу которых относится крахмал, перед выращиванием микроорганизмов гидролизуют с помощью амилолитических осахаривающих ферментов и получают смесь Сахаров. Эту смесь используют в качестве источника углерода. Интенсивность гидролиза крахмала возрастает, если крахмалсодержгицее сырье перед гидролизом подвергают разжижению aмилo литическими декстриногенными Лермен тами. В качестве сырья используют различные растительные источники крахмала, предпочтительно картофельный крахмал или отработанную жидкость с предприятий производства крахмала. Сырье, содержащее крахмал, маниок или другие сорта картофеля, измельчают, просеивают и смешивают с водой до определенной концентрации крахмала в смеси. При использовании в качестве сырья отработа1;ной жидкос ти с предприятий производства крах мала из сырья предварительно извлекают белок известными способами; рН суспензии крахмала доводят ,до определенной величины и добавляют в нее декстриногенный фермент о6-1-4-глюкан-4-глюкангидролазу. Фермент подается непрерывно в аппараты для двухстадийного разжижения. При этом смесь нагревают до температуры 85-8 Продолжительность процесса разжижени составляет от 60 до 90 мин. Разжиженная масса разбавляется водой до содержания сахара 1-8%, предпочтительно 4%. Затем в смесь добавляют нeoбxoди 5ыe количества неорганических питательных солей, со держащих азот, фосфор,магний и калий Доводят рН полученной питательной среды до 4 , 6-6. В качестве источника азота используют одно или несколько неоргани ческих соединений: сульфат аммония, фосфат аммония и нитрат аммония. В некоторых случаях используют органический азот в виде мочевины. В качес тве других источниковпитания микроорганизмов используют дигидрофосфат калия, гидрофосфат натрия, сульфат магния, а также сульфат двухвалентного железа. Полученную питательную среду стерилизуют, при температуре 120-135°под давлением в течение 1060 мин. Стерильная питательная средапоступает в ферментеры и инокулируетс микроорганизмами: дрожжами,,бактери ями или другими микроорганизмами, предпочтительно дрожжами рода Candida, синтезирующими белок, или, дрожжами рода Rhodotorula, синтези рующими предпочтительно липиды,Одно временно с инокулятором в ферментер добавляют необходимое количество сахарогенной амилазы, предпочтитель но глюко амилазы. Фермент добавляют в стерильных условиях. В ферментере проходит одновременно осахаривание разжиженного крахмала и рост микроорганизмов. Микроорганизмы использу для роста образующиеся глюкозу и ма . тозу. Раствор сахарогенной амилазы Ylucuzyme N (фирмы Амане Сейияку, Япония) стерилизуют пропусканием через микрофильтр q размером пор около 0,2 мк, например фильтр ЕХ НППроге фирмы Миллипор Корп , США. Затем амилазу подают в среду. Выращивание микроорганизмов проводя в аэробных условиях при перемешива НИИ рЛ среды 4,0-7,0, температура 30-45.. Выращивание осуществляют периодическим и непрерывным способом в несколько стадий на установке, состоящай из нескольких Ферментеров, соединенных последовательно. Время выращивания дрожжей в питательной среде, содержащей разжиженный крахмал, который непрерывно осахаривают сахарогенной амилазой, составляет 14-21 ч. Биомассу отделяют от среды сцеживанием или центрифугированием. Затем биомассу сушат. Выход биомассы составляет 45-52% от .введенного сахара. Количество неиспользованнох о сахара составляет 0,10,2%. На фиг.1 представлена технологическая схема предлагаемого способа; на фиг.2 и 3 - примеры реализации стадии ферментативного осахаривания и выращивания культур. Способ включает следующие технологические стадии: предварительная подготовка исходного сырья 1/ ферментативное разжижение крахмала 2, получение питательной среды для выращивания культуры 3, стерилизация питательной среды 4, Ферментативное осахаривание и выращивание культуры 5, отделение микробных клеток 6, сушка 7 и получение готового продукта 8. . Установка для ферментации (см. фиг.2) содержит три ферментера 9-11, расположенные последовательно. Объем третьего ферментера в два раза больше объема первого или второго ферментеров. Среда для выращивания культуры поступает через трубопровод 12, а сахарогенная амилаза через трубопровод 13. Три ферментера последовательно связаны при помощи трубопроводов 14 и.15. Часть среды для выращивания культуры возвращается из второго ферментера в первый через трубопровод 16. Количество возвращаемой среды определяется скоростью роста используемых микроорга- низмов, эффективной емкостью ферментеров, концентрацией микроорганизмов-, а также концентрацией и количеством среды для выращивания, поступающей в ферментеры.Часть среды для выращивания культуры из второго ферментера возвращается в первый для того, чтобы привить в первом ферментере культуру микроорганизмов с высокой скоростью роста. Этим добиваются стабилизации концентрации микроорганизмов в.первом ферментере.При этом, предотвращается возникновение явления так называемого вымывания клеток, если в первый ферментер будет поступать большее количество среды для выращивания культуры. В непрерьданом многостадийном процессе выращивания возврат среды осуществля ется из последнего аппарата. 1. . В непрерывной системе трехстадийного выращивания, в первом ферментере наблюдается рост активности микро организмов и ускорение процесса осахаривания. Во втором ферментере находятся микроорганизмы в логарифмической фазе роста. В третьем аппарате микроорганизмы находятся в стационарной фазе роста. Благодаря ассимиляции сахара в последнем ферментере значительно снижается биологическая потребность в кислороде отработанной водной среды. Установка для ферментации (см. фиг.З) состоит также из трех Ферментеров 17-19, расположенных последовательно, как и в установке, представленной на фиг.2, но со значитель но улучшенными показателями процесса ферментации. Процесс выращивания аэробных микроорганизмов требует аэрации среды Это приводит к образованию обильной пены. Кроме того, меласса, отработан ный раствор крахмала или отработанные эффлюенты пищевой промышленности содержат вспенивающие вещества, вызывающие обильное образование пены. Поток жидкости из первого Ферментера во второй или поток жидкости из второго ферментера в третий содержат пену и пузырьки воздуха, что делает этот поток нестабильным.Колебания скорости потока и скорости разбавления в известных системах непрерывного действия с перетоком или системах с рециклом приводят к нарушению развития микроорганизмов и нежелательному снижению выхода продукта. Установка для ферментации, показанная на фиг.З, предназначена для преодоления пенообразован1 я. Она отличается тем, что между первым,вторым и третьим Ферментерами поддерживается перепащ давления. Процесс непрерывного выращивания аэробных микроорганизмов протекает спокойно. Уровень жидкости в ферментерах легко балансируется регулированием пере-пада давления Р, и Р в фермент ах 17 и 18 и Р и Р в ферментерах 18 и 19. Если уровень жидкости в первом аппарате начинает повышаться из-за сильного образования пены, его можно снизить при помощи небольшого увеличения уровня давления Р . При этом, одновременно несколько увеличи вается давление Р и Р ,, .Этим добиваются стабильного протекания непрерывного выргицивания культуры. Ферментеры- связаны между собой трубопроводами 20 и 21. Исходный материал загружают через вход 22 в первый ферментер. Воздух подают через трубопровод 23 в каждый аппарат и выходит через отверстие 24. В первом ферментере поддерживают давление 1000-2500 мм водяного столба, во втором 600-1800 мм водяного столба и в третьем 300-1500 мм водяного столба. Если необходимо, давление в первом ферментере можно поднять выше 2500 мм вод.столба. Небо;1ьшое повышение давления в аппаратах увеличивает скорость переноса кислорода, что приводит к увеличению скорости роста микроорганизмов и увеличению производительности процесса. При непрерывном выращивании дрожжей рода Candida в среде, содержащей неорганические питательные соли и источник углерода, приготовленный из сельскохозяйственных продуктов, в установке для ферментации, представленной на фиг.З, выход биомассы составляет 50% и более в пересчете на общие затраты сырья. Биомассу отделяют от отработанной среды сцеживанием, затем концентрируют на центробежном сепараторе с жиклером или на других сепараторах. Далее биомассу высушивают на распылительной сушилке, барабанной сушилке или в аппарате мгновенного испарения. В некоторых случаях можно использовать сушки специального типа с целью получения продукта в виде гранул или таблеток. Способ позволяет обрабатывать большие количества исходнрго материала в течение короткого промежутка времени. Процесс выращивания микроорганизмов протекает спокойно. Контроль за течением процесса осуществляется автоматически. Можно перерабатывать исходный материал высокой концентрации. Так как ферментативное осахаривание и выращивание микроорганизмов осуществляется одновременно, то в дополнительной емкости для осахаривания нет необходимости. Предварительное разжижение способствует увеличению скорости гидролиза. Способ иллюстрируется следуклцими примерами. .Пример 1 . Корни маниоки (тапиока) измельчали и разбавляли водой до образования кашицы с содержанием крахмала примерно 16%, рН кашицы доводили до 6,0-6,2, добавили декстриногенный фермент (Спигаз К, фирма Нагазе Индастриэл Корп, Япония) в количестве 0,2% в пересчете на содержание крахмала. Кашицу непрерывно разжижали при температуре 85-88С. После удаления примесей разжиженный раствор разбавляли водой до концентрации сахара 1,5-6%. В раствор добавляли необходимое количество неорганических питательных солей, рН доводили до 4,4-5., Полученную среду для выращивания культуры непрерывно стерилизовали
нагреванием в стерилизаторе, а затем подавали в первый ферментер. Среду инокулировали культурой Candida utilis. Одновременно и непрерывно в среду для выращивания с заданной скоростью добавляли в стерильных условиях сахарогенную амилазу, Общее время выращивания составило 4-8 ч.
Биомассу отделяли при помощи центрифуги и высушивали. Выход сухих микробных клеток составил 45-53% в пересчете на содержание крахмала в тапиоке.
Пример 2. Корни маниоки (тапиоки) обрабатывали и разжимали тем же способом, что описан в примере 1. Разжиженный раствор разбавляли водой, так чтобы содержание крахмала составляло 4%. В раствор добавляли необходимое количество неорганических солей, таких как неорганические соединения азота, фосфора, калия и другие. Раствор стерилизовали при помощи нагревания и непрерывно подавали в ферментер. Среду инокулировали дрожжами Saccharomyces cerevisial. Одновременно в стериль.ных условиях в среду добавляли 0,3-0,5% сахарогенного фермента в пересчете на общее содержание сахара в среде. Время выращивания составило 6-10 ч.
Клетки дрожжей отделяли,концентрировали и сушили. Выход клеток дрожжей составил 45-50% в пересчете на вес крахмала.
Пример 3. Отработанный эффлюент с предприятия по производству картофельного крахмала (содержание сухих веществ около 8|, содержание растворимых веществ, не содержащих азота, 3-4%) обрабатывали для получения рН, равного 6. Затем массу разжижали добавлением заданного количества разжижающего фермента. Затем в раствор добавляли необходимо количество неорганических питательных солей и. получали, среду для выращивания культуры. Среду стерилизовали нагреванием и непрерывно подавали в ферментер. Выращивали дрожжи рода Candida. В-среду в стерильных условиях с заданной скоростью непрерывно добавляли сахарогенную амилазу. После выращивания клетки дрожжей отделяли от среды, концентрировали и сушили. Около 45% р.астворимых не содержащих азот, веществ переходили в клетки дрожжей.
Пример 4. Сырые корни маниоки обрабатывали и разжижали по аналогии с примером 1. Разжиженный раствор разбавляли так, чтобы концентрация сахара составляла 2-5%. В раствор добавляли необходимые неорганические соли. В полученной среде для выращивания культуры соотношение концентрации С/Ц составляло
Среду стерилизовали и подавали в ферментер. Осуществляли периодическое или непрерывное выращивание дрожжей, рода Rhodotorula, которые продуцируют липиды. Одновременно в стерильных условиях в среду добавляли с заданной скоростью сахарогенную амилазу. После отделения и концентрирования биомассу высушивали. Выход сухих клеток составил 40-48% в пересчете на содержание крахмала в сырой маниоке. Содержащие липидов в сухих клетках дрожжей составило 15-50%.
Липид имели состав, аналогичный составу растительного масла. Кроме того, остаток, образовавшийся после извлечения липидов, представлял собой массу, богатую белками.
Пример 5. Непрерывное выращивание микроорганизмов проводили на установке для аэробной ферментации, представленной на фиг.З. Давление в первом ферментере составляло 1800 мм водяного столба, во втором 1500 мм водяного столба и в третьем 1000 мм водяного столба. Интенсивность аэрации бЕЛла в первом ферментере 0,5 об/об-мин, во втором 1,0 об/об-мин и 0,5 об/обМИН - в третьем ферментере.
Общий объем первого, второго и третьего ферментеров составлял 500 л, 500 л и 1000 л, соответственно. Объем среды для выращивания культуры составлял 300 л, 300 л и 600 л соответственно. Скорость подачи среды была 250 л/ч. Использовали дрожжи Candida genus. Среда для вырацивания культуры содержала следующие неорганические соли: NH NO-j- 6 г 3 г, Na2HPOx 12H2 O ,5 г, MgSO47H2O - 0,5 г, FeSO4- 0,5 г, водопроводная вода - 1000 мл, рН 5,5
В качестве источника углерода использовали раствор,полученный измельчением и разжижением сырого сладкого картофеля,который добавляли в среду так, чтобы концентрация глюкозы была 4%, рН среды поддерживали на за-, данном уровне при помощи . Длительность непрерывного выращивания в три стадии составляла 500 ч. Выход биомассы был 50% в пересчете на источник углерода, а скорость роста дрожжей равнялась 0,6 ч-,
Пример 6. Для выращивания культуры использовали среду, состав которой приведен в примере 5, В качестве источника углерода в среду добавляли мелассу с концентрацией 4%
(в/в) в пересчете на сахар. Осуществляли непрерывное выращивание штамма дрожжей Candida uti)is. В первом, втором и третьем ферментерах поддерживали давление 2500 мм вод.столба
(Р ) , 2000 мм вод.столба (Р J и 1500 мм вод,столба (Р) соответственно. При «этом интенсивность аэрации
были 1,О ,об/об мин, 1,0 об/об-мин и 0,5 об/об,мин соответственно. Непрерывный способ выращивания в три стсшии осуществляли с использованием установки для ферментации, представленной на фиг.3,Размеры ферментеров и количество среды, загружаемой в каждый, аналогичны размерам и количествам, приводимым в примере 5.Непрерывное выращивание осуществляли в течение более 300 ч. Выход микробных клеток составил 52% в пересчете на содержание сахара.
Пример 7. Для выращивания культуры использовали неорганическую среду, имеющую состав, аналогичный приведенному в примере 5. В качестве источника углерода использовали отработанный раствор картофельного крахмала. Выращивали культуру Candid utills. Источник углерода имел концентрацию 4%.
Непрерывное выращивание протекало при тех же условиях, что описаны в примере 6, в течение 400 ч и более без каких-либо трудностей, вызванных загрязнением среды другими микроорганизмами. Выход микробных клеток составил 48% в пересчете на концентрацию сахара. Содержание белка в микробных клетках составило 46-52%.
Пример 8. в качестве источника углерода использовали мелассу. Выращивали дрожжи Rhodotorula gracilis, вырабатывающие липиды. Концентрация источника углерода составляла- 4% (в/в). Неорганическая среда для вырапивания содержала 75 мг/л мочевины и 25 мг/л , рН среды было равно 5 ,0.Интенсивност аэрации составляла 5,0 об/об«мин. Непрерывное выращивание дрожжей осуществляли при температуре . Среду переметали со скоростью 200 об/мин. Выращивание проводили на установке для ферментацииJ представленной на фиг.З.В первом,втором и третьем ферментерах поддерживали давление, мм вод.столба: 1200, 800 и 500 соответственно. В результате непрерывного процесса выращивания в течение 250 ч содержание липидов достигало 39,6% в пересчете на сухие клетки дрожжей.
Формула изобретения
s
1.Способ получения биомассы микроорганизмов , предусматривающий ферг ментативный гидролиз крахмалсодержащего сырья, выращивание дрожжей и отдельные биомассы, отличающийся тем, что, с целью увели0чения выходэ биомассы, перед ферментативным гидролизом крахмалсодержащее сырье разжижают путем добавления декстриногенного Лерментао(,-1-4-глюкан-4-глюкан-гидролазы, полученной
5 из Bacillus subtilis var Biotecus,
a выравнивание дрожжеП осуществляют непосредственно в процессе ферментативного гидролиза сырья.
2.Способ по п.1, отличаю0щий с я тем, что культивируют дрохсжи видов Candida utilis или Rhodotorula gracllic.
Источникиинформации, принятые 9О .HHe при экспертизе
5
1.Патент США № 3149049, кл. 195-31, опублик.1964.
2.Патент Франции 2285080, кл. С 12 D 13/06, опублик.1976
(прототип).



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения белково-витаминной добавки из крахмалсодержащего зернового сырья | 2015 |
|
RU2613493C2 |
| СПОСОБ ВЫРАЩИВАНИЯ ДРОЖЖЕЙ | 2013 |
|
RU2522006C1 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА ASPERGILLUS AWAMORI - ПРОДУЦЕНТ ГЛЮКОАМИЛАЗЫ | 2000 |
|
RU2196821C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ | 1996 |
|
RU2111253C1 |
| Способ получения белкового кормового продукта | 1989 |
|
SU1674771A1 |
| Способ производства белковой кормовой добавки | 2024 |
|
RU2840152C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ЗЕРНОВОГО СЫРЬЯ НА СПИРТ И КОРМОВОЙ ПРОДУКТ | 2009 |
|
RU2396007C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКОВОЙ КОРМОВОЙ ДОБАВКИ | 2017 |
|
RU2658977C1 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА ASPERGILLUS ORYZAE - ПРОДУЦЕНТ КИСЛОЙ АЛЬФА-АМИЛАЗЫ | 2007 |
|
RU2354697C2 |
| Способ подготовки крахмалсодержащего сырья для получения продуктов брожения | 1987 |
|
SU1495365A1 |



Авторы
Даты
1980-12-07—Публикация
1977-06-23—Подача