(54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИМИДАЗОЛИЛЭТОКСИПИРАЗОЛО СЗ,4-.Ь ПИРИДИН-5-МЕТАНОЛОВ
Изобретение относится к.способу полу- сипиразоло 3,4-Упириаин-5-метанолов чения новых произвоцных имиаазопнлэток- формулы I, ИЛИ ИХ СОЛЕЙ2
гае R - водороа, низший алкмл, фенил, фенил-низший лкил или циклонизший алкил;
R-,R.,Rc и Rjj- каждый водород, низший
алкил или фенил;
I. - воаороц, ОКСИ-, низшая апкокСИ-, низшая алкилтио-, фенркСИ-, или фенил- низшая алкоксигруппа, галоген {ли группа-о
-K:
RIO
где Rg и кажцый водород, низший
алкил, фенил...
16 или зймещенный фенил,. гае заместителем фенила является галоген, окси-, низшая алкокси-, низший алкил, меркапто-, низшая алкилтио-, циано или нитро-группа;
20Н- и R - каждый воцороа, галоген,
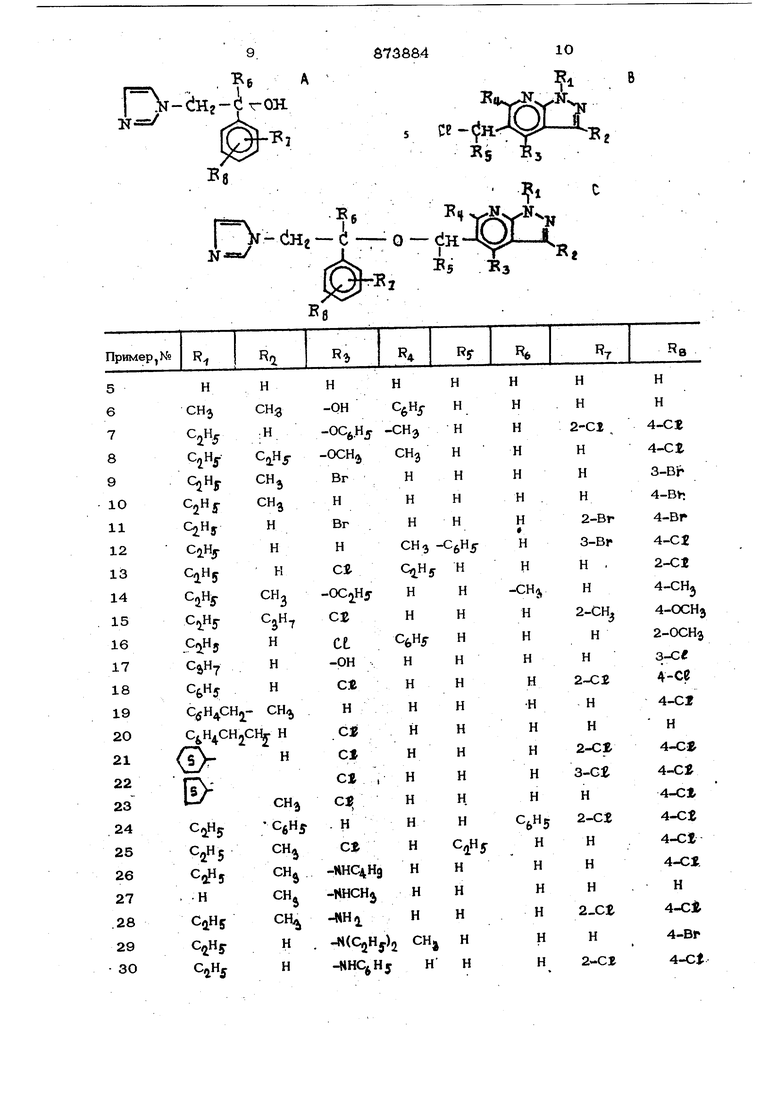
ОКСИ-, низшая алкокси-, низшая алкнлтио-, низший алкил или нитро-грулпа, илл их солей, которые облааают противогрибковой или антибактериальной активностью и мо25 171 найти применение в мепицине. 8 В литературе известен способ алкили- рования оксисоецинений галоиасоцержапгам соединением с образованием эфирной связи из. Целью изобретения является способ получения новых произвоаных имидазолилэтоксипиразоло 3,4-Ь тфнаин-5-метанолов или их солей, которые обладают противогрибковой или антибактериальной активностью. Предлагаемый способ получения соединений формулы 1, основанный на известной в органической химии реакции, зак лючается в том, что соединение формугде X - хлор, бром или иод, подвергают взаимодействию с соединением формулы Л1 Вб I ii-dHz-cI-OH где Ri. тл имеют указанные значения. Соединения формулы I образуют соли нетоксичных физиологически приемлемых представителей. Основания формулы I образуют соли реакцией с одним или более эквивалентами любой из широкого мн жества обычных неорганических и органических кислот, обеспечивающих аддитивные соли кислот, включающие, например гкдрогалогениды (особенно гидрохлори и гтцфобромид), сульфат, нитрат, борат, фосфат, соль щавелевой кислоты, кислая соль винной кислоты, соль малеиновой ки слоты, цитрат, ацетат, аксорбат, соль янтарной кислоты, бензолсульфонат, метан сульфонат, никлргексансульфонат и толуол сульфонат. Аддитивные соли кислоты часто являются удобным средством для выде ления и очистки продукта, например, образованием и осаждением соли, (которые не обязательно нетоксичны) в соответст вуюшей среде, в которой соль нераствори ма, затем после отделения соли нейтрали ацией основанием, таким как гидроокись бария или гидроокись кальция, чтобы полуить свободное основание. Другие соли могут затем образовываться из свободного основания реакцией g одним или более эквивалентами кислоты, содержащей требуемую кислотную группу. Новые соединения формулы I и их соли полезнь как противогрибковые агенты и могут быть использованы для борьбы с инфекцией в различных роцах млекопитающих таких как мышь, крысы, собаки, морские свинки и тому подобные, особенно для таких организмов как qtbicans.Tr cViomonas raojinaCis или ТН f-Vioph iion mentoc3jrcipt -kes. РГапример, соединение или смесь соедине НИИ формулы I, или их физиологическая приемлемая аддитивная соль кислоты могут быть введены оральным путем зараженному животному, например, мышам в количестве примерно от 5 до 25 мг/кг в день, в 2-4 отдельные дозы. Они могут быть преобразованы в препараты в виде таблеток, капсул или эликсира, содержащую 10-250 мг на единицу дозировки, смешением активного вещества или веществ с обычным носителем, связующим веществом, предохранительным средством, вкусовым и т.д. Предпочтительно применить их, например, местным путем интравагинально (внутриматочно) в, виде лосьена, или в виде обычного крема а концентрациях 0,01 3 вес.% в период около 3-7 цней от двух ао четырех раз ежедневно. Пример. 4-Хлор-5-| 1-(2,4-дихлорфенил)-2-(1Н-имвдазол-1-ил)-эт оксиJ -метил -1 -этил-3-метил-1 Н-пираэол- 3,4-Ь1 пиридин, гидрохлорид. А. 4-Хлор-5-хлорметш1-1-эТил-3-метил-1Н-пиразоло 3,4-Ь}- пиридин. В трехгорлую колбу с мешалкой, дефлегматором и капельной воронкой добавляют 94,6 г 4-хлор-1-этил-3-метил-1Н-пиразол C3,4-ti3 пиридин-5-метанола (О,42 моль). При перемешивании добавляют 745 мл гионилхлорида капельным способом в течение 45 мин и смесь затем в течение полутора часов нагревают с обратным холодильником. Избыток тионилхлорида удаляют с помощью вращающегося испарителя и остаток растворяют в бензоле. Растворитель снова удаляют и оставщийся твердый продукт растирают с лигрином, фильтруют и, сушат при 7О°С, давая выход 91 г 4- хлор-5-хлорметил-1-этил-1Н-шфазоло ,4-6} ридина, который после перузкристаллизацив из гексана цает 83,5 г чистого продукта (точка плавления 96-97°С). Упаривание лигроиновой маточной жицкостк и перекристаллизация остатка дает вторичный сбор 5,7 г, точка плавлентш 95-9бс, общий выход 89,2 г (87%). В 4-хлор-5-{I l-(2,4-aиxлopфeнил)-2 - (1 Н-имидазол-1 -ил) -этокси -метил -1 -этил-3-метил-1Н-пиразоло Гз,4-Ь пиридин, гидрохлорид TIЦ В трехгорлую колбу с мешалкой, дифлегматором и газоотводной трубкой вводят 24,4 г гидроокиси натрия (0,61 мол и 23 мл воды. При пропускании через колбу азота раствор охлаждают до 45°С, а затем добавляют 6,43 г 1-(2,4-дихпо фенил )-2-( 1 Н-имидазол-1-ил)-этанола (0,025 моль), 0,43 г бензилтриметиламмонийхлорида и 25 мл тетрагидрофурана. К смеси, которую нагревают до , добавляют раствор 6,1 г 4-хлор- -5-хлорметил-1-этил-3-метил-1Н-пиразоло ГЗ,4-bJ-пиридина (0,025 моль) в 10 мл тетрагидрофурана из предварительно нагретой капельной воронки в течение 3 мин. Смесь энергично перемешивают в течение 3ч при , используя водяную баню. Затем теплую смесь переносят в разделительную воронку, водную гидроокись натрия экстрагируют 10 мл тетрагидрофурана. Объединённые слои тетрагид рофурана сушатся посредством сульфата натрия , после удаления растворителя остаточное масло экстрагируют эфиром, обрабатывают древесным углем и фильтруют К раствору свободного основания добавля ют капельным способом 5,9 мл эфирной соляной кислоты (30,9%). Осажденный 4-хлЬр-5- |Г1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)-этоксиЗ-метилЗ -1-этил -3-метил-1Н-пиразоло ГЗ ,4-Ь пирицина, гидрохлорид отфильтровывают, сушат в ва куумном эксикаторе и перекристаплизовывают из ацетонитрила, точка плавления 200-201 0, выход 5,67 г (45%). П р и. м е р 2. 4-Хлор-5-|Г1-(4-хло фенил)-2-(1Н-имндазол-1-ип -sTOKCHj-метил -1 -этил-3-метил-1 Н-Шфазопо 3,4 -Ь пиридин, гицрохлорвд. Следуют методике примера 1В, но берут 5,6 г(О,О25 Моль) 1-{4-хлорфенип)-2-( 1 Н-имидазол-1-ил)-3TaBOjja вместо 1-( 2,4-дихлорфенш1 )-2-(1 Н-кмидааол-1-ил)-этанопа, В протмвопопожность примеру 1 В Кнечный продукт пристаплизуют. После охлаждения до комнатной температуры шлам отсасывают в воронку из спеченного стекла. Затем твердое веще- ство суспендируется в 4О мл воды, нейтрализуют уксусной кислотой, снова фильтруют, промывают водой и сушат при , перекристаллизация из ацетонитрила дает 5,6 г (52%) чистого продукта, точка плавления 176-177с, К 5,4 этого продукта, 4-хлор-5- 1- -(4-хлорфешш)-2-(1Н-имкцазол-1-ил -этокси -метил -1-этил-3-метил-1Нр {золо- 3,4-) пиридина, растворенного в 15 мл абсолютного спирта, и 5 мл спиртовой соляной кислоты (184 г HCt/л) при слабом нагреве добавляют 120 мл эфира. Осажденный гидрохлорид отфильтровывают после того, как он простоит ночь, промывают смесью эфира и спирта (5:1) и высушивают, выход 6,3 г(10О%), точка плавления 184-185 С. Примерз. 4-Хлор-5- -(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)aTOKCvi -метил |-1-этил-1Н-пиразоло Гз,4-Ь пиридин, гидрохлорид. A.4-Хло{ -5-хлорметил-1-этил-1Н-пнразолоГз,4-ЪЗпиридин. 150 мл тионилхлоркца осторожно добавляют к 20 г 4-хлор-1-ЭТИЛ-1Н -пираэоло,4-Ь пиридин-5-метанола(О,О094 моль) так, что имеет место нагревание и умеренное выделение газа. Смесь оставляют на ночь и после ртого времени избыток тионилхлорида отгоняют роторным испарителем и остаток обрабать1вают льдом. Кристаллический 4-хлор)-5-хлорметил-1-этил-1Н-пиразоло Сз,4-Ъ} пиридин отсасывают, промывают водой и сушат в вакуумном эксикаторе над пятиокисью фосфора, выход 19,7 г (91%), после рекристаллизации из гексана точка плавления 73-74С. B.2-Хлор-5- -(2,4-дихлорфенил)-2-(1Н-имидаз6л-1-ил)-этоксп}-метил -1-этил-1Н-11иразоло 3,4-Ь пиридин, гидрохлорид. 7,71 г l-(2,4-диxлopфeнил)-2-(lH-имидaзoл-l-ШI)этaнpл (0,03 моль) и 6,9 г 4-хлор-5-хлорметш1-1-втил-1Н-пиразоло СЗ,4-Ь пиридина (0,03 моль) вводят в реакцию согласно методике примера 1В. Объединенные слои тетрагидр(офурана обрабатывают древесным углем и фильтруют. Добавляют 25О мл эфира к раствору тетрагидрофурана, отделяют маслянистую примесь, которую удаляют деантированием раствора. После того как раствор, содержащий свободное основание, осветляют при помощи добавления HufEO фильтровального средства, добавляют избыток эфирной соляной кислоты. Осажденный гшрохлорид отстаивают в течение 2ч. затем отфильтровывают, промывают эфиром и сушат в вакуумном эксикаторе, выход 8,3 г (61%). Продукт перекристалл 87зуется иэ 3N соляной кислоты с древеоным углем,. Полученный таким образом -4-.хлор-5 (4-цихлорфенил)-2-(1Н-имиааэоп-1-ил)-этоксиЗ-метил1-1-этил-1Н-пиразояо-Сз,4-1г пирицин, гицрохлориц (1:1) содержит псшмоля воды; точка плав;.ле1шя, 166-167 С. П р и м е р 4. 5-|11-(2,4-ДихлорфеНИЛ -2-(1Н-имицазол-1-ил)-этокси1-метил}-1-этил-3-метил-1Н-пиразоло 13,4-Ь -пириаин, гидрохлорид. А. Этилочый эфир 1-этил-3-метил-1Н. -пиразоло 1314-Ь пщ иаин-5-карбоновой кислоты. К 8О,3 г этилового эфира 4-хлор-1-зтнл-3-метил-1Н-пиразоло 3,4-Ь пиридин-5-карбоновой кислоты (,О,3 моль), растворенного в 270 мл ледяной уксусной кислоты, добавляют 33,4 г триэтиламина (0,33 моль) и 7,5 г палладия на древесном угле (1О%). Смесь гидрируют при комнатной температуре и давлении 2,5атм Примерно после 19 ч поглощается теоретическое количество водорода. Затем катализатор отфильтровывают и фильтрат испаряют. Остаток обрабатывают 2ОО мл воды и экстрагируют эфиром. Объединенные эфирные экстракты сущат, а эфир отгоняют. Маслянистый этиловый эфир 1-этил-3-метил-1Н-Ш1разоло 3,4-ЬЗпиридин-5-карбоновой кислоты через короткий промежуток вромени начинает кристаллизоваться выход 64.5 г(92%),т.пп.144-146 С В. 1-5тил-3-метил-1Н-пиразоло 3,4-ЬЗпиридин-5-метанол, гидрохлорид. 49 гЭТИЛОВОГО эфира 1-этил-3-метил-1Н-пиразолЬ Гз,4-1)2-карбоновой кислоты растворяют в 25О мл безводного тетрагидрофурана. . Азот пропускают через колбу во время перемешивания и охлаждения водопроводной водой 6 г литий алюминий гидрйда (0,16 моль) добавляют малыми частями для поддержания температуры реакции . Перемешивание продолжается дополнительно в течение 3 ч при комнатной .температуре. Затем добавляют 3N соляную кислоту (380 мл) во время охлаждения колбы ледяной водой и мутный раствор испаряют в вакууме. Остаток растворяют Б 95 мл горячей воды и раствор отстаивают в течедае 2 дней. Закрио таллизовакный продукт (8 г, точка плавл ния 2О7-2О8С) отбрасывают. Водная м точная жидкость экстрагируется 3 порция ми по 1ОО мл хявро арма. Объединенные эксгр&кпл хлсфофо{й4а сушат с сульфатом натрия и упаривают в вакууме. Подученная в результате маслянисто-кристалличе ская масса отсаодвается;, промывается адетонитрйлом и сушится при 70 С, выход 10 г (21%) 1-этил-3-метил-1Н-пиразоло 3,4-Ъ1пиридин-5-метанол, гицрохлориц (1:1), точка плавления 169-170 с. Образец рекристаллизованный из ацетонитрила плавится при 170-171°С. , С.5-Хпорметил-1-этип-3-метил-1Н-пирааоло- 3,4- пиридин, гиарохлориц( 1:1). К 11 г 1-9Тил-3-метил-1Н-пиразоло 3,4-ЪЗпиридин-5-метанола (0,057 моль), растворенного в 50 мл безводного бензола,каплями добавляют 55 мл тионилхлорида. Белую суспензию, образованную при этой реакции, дополнительно перемешивают в течение 3 ч при комнатной температуре. Затем шлам отсасывают, промывают бензолом и сушат при 7ОС,выход 6,6 г 5-хлорметил-1-зтил-3-метил-1Н-шфазолоС3,4-Ь3пиридин, гндр охлорид (1:1), точка плавления 154-157 С. Упаривание маточной жидкости, растворение остатка в хлороформе и удаление рйс1;ворителя дает дополнительно 7,4 г (точка плавления 152-154С, общий выход 14 г (10О%), Д. 5- {Г1-(2,4-Дихлорфенил)-2Н-(1Н-имицазол-1-ил)-этркси2-метил -1-этил-3-метил-1Н-пиразоло- 3,4-Ъ пиридин, гидрохлорид, 7,71 г 1-(2,4-цихлррфенил)-2Н-(1Н-имидазол-1-ил)-этанол .0,03 моль) и 7,4 г 5-хпор{ 1етил-1-этил-3-метил-1Н-пиразоло-Гз,4-Ь пиридин, гидрохлорид (О,ОЗ моль)вводят в реакцию согласно методике примера 1В, Объединенные слои тетрагидрофурана обрабатывают древесным углем, фильтруют и сушат с сульфатом натрия. После добавления 300 мл эфира и фильтрацией через древесный уголь фильтрат, содержащий свободное основание, смеши а « эфирной соляной кислоты (415 г нее/л, 0,09 моль). Осажденный 5- 1-(2,4-дихлорфенил-2Н-( 1Н-имидаЗОЛ-1-ИЛ этокси мет1ш -1-этил-3-метил-1Н-пиразолоГЗ,4-Ь} пиридин, гидрохлорад (14,8 г) обрабатывают эфиром, отфильтровывают, сушат в вакуумном эксикаторе и перекристаллизовывают из ацетона, точка плавления 158-159 С с раз- ложением, выход 8,11 г (58%). Следующие дополнительные продукты формулы С получаются по методике примера 1В реакцией незамещенного или замещенного 2-(1Н-имидазол-1-ил)-этанола формулы А с незамещенным или замещенным 5-хлорметил-1Н-пиразоло СЗ,4-Ь. пиридином формулы В /Заместители используются в соответствующих формулах . (сМ. таблицу).
9
КбА
П -енг- т-он
.
S73884
Процолжение табл. гце R - воаороц, низший алкнп, фенил, фетш-низший алкил или циклонизший алкил; . кажцый воцороц, низший алкил или фенил; R а.- воцороц, ОКСИ-, низшая ал- КОКСИ-, низшая алкилтис, фенокси-или фенил- низшая алкокси- группа, галоген или группа где Rg и ff воаороц, низший алкил, фенил или замешенный фенил, где заместителем фенила является галоген, оксинизшая алкокси-, низший алкил, меркап ° шая алкилтио-, циано или нитро группа; RV и каждый воцороц, галоген, ОКСИ-, низшая алкокси-, низшая алкилтио низший алкил или нитрогруппа, или их солей, отличаюшийся тем, что соецинение формулы 4 Б Ц К д 5 -RZ где X - хлор, бром;или иоц, подвергают взаимодействию с соединением формулы г )т-еНг с1-( ,Л, где 1, имеют указанные; значения. Источники информации, принятые во внимание экспертизе 1. Вагнер В. Алкилирование оксисоецинений.галиоцным соединением-Химия органического синтеза , 1953, с. 22627.





| название | год | авторы | номер документа |
|---|---|---|---|
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЙ АМИНО-ПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ПРОСТАГЛАНДИНА D2 | 2005 |
|
RU2417990C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, МЕТОДЫ ИХ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ ИХ В КАЧЕСТВЕ АГОНИСТОВ ФАРНЕЗОИД-Х-РЕЦЕПТОРА (FXR) И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ | 2007 |
|
RU2424233C2 |
| ПИРАЗОЛИЛЗАМЕЩЕННЫЙ БЕНЗОЛСУЛЬФОНАМИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ ОТ ВОСПАЛЕНИЯ ИЛИ СВЯЗАННОГО С ВОСПАЛЕНИЕМ ЗАБОЛЕВАНИЯ | 1994 |
|
RU2139281C1 |
| СПОСОБ ЛЕЧЕНИЯ ВОСПАЛЕНИЯ ИЛИ СВЯЗАННОГО С ВОСПАЛЕНИЕМ ЗАБОЛЕВАНИЯ У СОБАК | 1996 |
|
RU2253456C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ДИГИДРОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2296766C2 |
| ПРОИЗВОДНОЕ ТЕТРАГИДРОИЗОХИНОЛИН-1-ОНА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ АНТАГОНИСТА ВВ2 | 2008 |
|
RU2479578C2 |
| 5-[(ПИПЕРАЗИН-1-ИЛ)-3-ОКСО-ПРОПИЛ]-ИМИДАЗОЛИДИН-2,4-ДИОНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ADAMTS ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРИТА | 2015 |
|
RU2693459C2 |
| ОРТОЗАМЕЩЕННЫЕ АМИДЫ 2-МЕТОКСИИМИНОФЕНИЛУКСУСНОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СРЕДСТВО ДЛЯ БОРЬБЫ С ВРЕДОНОСНЫМИ ГРИБАМИ И ИНСЕКТОАКАРИЦИДНОЕ СРЕДСТВО | 1994 |
|
RU2130924C1 |
| 2-САХАРИНИЛМЕТИЛГЕТЕРОЦИКЛИЧЕСКИЕ КАРБОКСИЛАТЫ ИЛИ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ ЭТИХ СОЕДИНЕНИЙ ОСНОВНОГО ХАРАКТЕРА ИЛИ ОСНОВНО-АДДИТИВНЫЕ СОЛИ ЭТИХ СОЕДИНЕНИЙ КИСЛОТНОГО ХАРАКТЕРА, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ АКТИВНОСТЬ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ | 1992 |
|
RU2078081C1 |
| Способ получения /1,2/-аннелированных 7-фенил-1,4-бензодиазепинов или их солей | 1979 |
|
SU904526A3 |


Авторы
Даты
1981-10-15—Публикация
1979-07-09—Подача