Изобретение относится к биотехнологии, а именно к штамму гибридных клеток, продуцирующему моноклональные антитела к вирусу геморрагической болезни кроликов (ВГБК), которые могу быть использованы в диагностических и научных исследованиях.
Известны способы получения гибридных клонов, продуцирующих моноклональные антитела к различным вирусам животных (Sasaki. O et al. 1990, NobisP. 1985) и в частности, к полипептидам вируса геморрагической болезни кроликов (Liang M. , 1989).
Однако эти моноклональные антитела не позволяют выявлять вирус геморрагической болезни кроликов в органах больных и павших животных и поэтому не могут быть использованы для быстрой диагностики данного заболевания. Известен также штамм гибридных клеток, секретирующий моноклональные антитела к ВП60 вируса ГБК (Rodak L. etal 1990), полученный путем слияния клеток миеломы Sp 2/0 - Ag 14.1 с иммунными лимфоцитами мышей линии Bald/c в соотношении 1: 5. Иммунизацию проводят путем подкожной инокуляции очищенного препарата ВГБК в масляном адъюванте. За три - четыре дня до слияния мышам вводят внутрибрюшинно суспензию ВГБК. Описанные моноклональные антитела позволяют выявлять вирусный антиген в мазках-отпечатках из органов больных и павших животных с помощью метода флюоресцирующих антител (МФА). Однако предложенная схема иммунизации не достаточна эффективна, так как при сочетании только подкожного и внутрибрюшинного введения препарата выход положительных клонов невысок и аффинность секретируемых ими антител ниже по сравнению с длительной иммунизацией и внутривенным введением бустер-дозы. Вышеуказанное соотношение клеток миеломы с лимфоцитами мыши 1: 5 при гибридизации не является оптимальным, особенно в случае нефракционированных спленоцитов. Наилучший выход полезных клонов получают при соотношении клеток миеломы к лимфоцитам 1: 10 (Игнатьева Г. А. , 1989). Не приводят данных о классе иммуноглобулинов и о количестве пассажей гибридом как in vitro, так и in vivo, что, во-первых, имеет важное значение для очистки и дальнейшего использования моноклональных антител, и, во-вторых, характеризует стабильность штамма гибридных клеток, секретирующего моноклональные антитела. Следует также отметить, что не показана возможность антигена в органах больных и павших животных, а также для серологической диагностики с помощью иммуноферментного анализа (ИФА).
Задачей изобретения является получение штамма гибридных культивируемых клеток животных, продуцирующего моноклональные антитела к вирусу геморрагической болезни кроликов.
Предлагаемый штамм обозначен как ВГБК x Sp 2/0-4C11,89 и хранится во Всесоюзной специализированной коллекции клеточных культур (ВСКК (П)) института цитологии АН СССР под номером 560Д.
Штамм гибридных клеток ВГБК х Sp 2/0-4C11,89 получают путем гибридизации мышиной миеломной линии Sp 2/0-Ag 14.1 с лимфоцитами селезенки иммунных мышей линии Balb/c по методу Келлера и Мильдштейна (1976). Иммунизацию проводят высокоочищенным препаратом вируса геморрагической болезни кроликов (1014 вирион/мл). В первый день вводят подкожно в три точки очищенного препарата вируса (с концентр. белка 3,5 мг/мл) с равным объемом полного адъюванта Фрейнда. На 14-й день вводят внутрибрюшинно 150 мкл того же вируса в смеси с неполным адъювантом Фрейнда. На 45-й, 46-й день инъецируют внутривенно по 200 мкл вирусного препарата, что приводит к активации лимфоцитов, синтезирующих антитела к антигенным детерминантам вируса геморрагической болезни кроликов. Гибридизацию проводят на 4-й день после последней инъекции антигена в соотношении клеток миеломы и лимфоцитов 1: 10. Гибридные клоны отбирают на селективной среде, содержащей гипоксантин, тимидин и аминоптерин. Продукцию специфических антител определяют методом твердофазного иммуноферментного анализа в непрямом варианте. В качестве антигена для сенсибилизации пластин использовали очищенный в градиенте плотности хлористого цезия вирус геморрагической болезни кроликов. Клоны, дающие положительную реакцию вы ИФА, отбирают и проводят 3-кратное их клонирование в "мягком" агаре с целью получения стабильных штаммов клеток. Клон считают стабильным, если при последующем клонировании не менее 90% субклонов сохраняют антителопродукцию.
Полученный штамм ВГБК х Sp 2/0-4C11,89 иммет следующие морфологическую и физиологическую характеристики.
Культура состоит из клеток округлой формы различной величины с ядром, занимающим большую часть клетки и расположенным эксцентрично. Каждое ядро содержит 2-4 ядрышка. Цитоплазма имеет вид тонкого ободка. Кариотип соответствует мышиному. Модальный класс 89 хромосом (модальный класс для родительской миеломной линии Sp 2/0-Ag 14-1 72 хромосомы). В кариотипе клеток идентифицированы 6-я и 12-я хромосомы, несущие структурные гены иммуноглобулинов.
Клетки обладают слабой адгезивной способностью. Тип роста - стационарная суспензия. Клетки легко снимаются при встряхивании или пипетировании, образуя мелкую однородную взвесь. Частота пассирования 1 раз в 2-3 дня. Коэффициент пересева 1: 2-1: 3. Посевная доза 150-200 тыс. клеток в 1 мл.
Среда культивирования - модифицированная Дульбекко, среда Игла с содержанием 15% эмбриональной сыворотки теленка, 2 мМ глутамина, 1 мМ пирувата натрия и 50 мкг/мл гентамицина. Оптимальный рН среды 6,8-7,2.
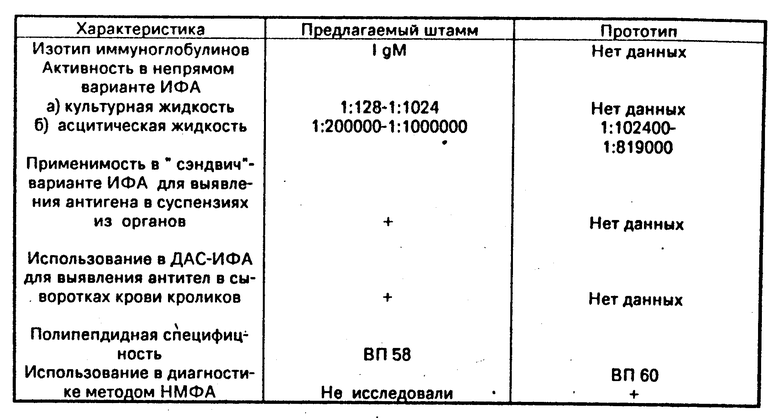
При хранении в условиях низких температур клетки сохраняют жизнеспособность в течение 6 мес при -70о С и неограниченно долго в жидком азоте (-196оС). Клетки хранят в пластиковых ампулах после 2-3-кратного клонирования в "мягком" агаре и перевивания на мышах линии Balb/c в концентрации 5-10 млн. клеток в 1 мл. Криозащитная среда - ростовая среда с добавлением 40% эмбриональной сыворотки и 10% диметилсульфоксида. Жизнеспособность клеток после замораживания 72-75% . Гибридные клетки штамма ВГБК х Sp 2/0-4C11,89 сохраняют стабильную продукцию моноклональных антител в культуральной среде на протяжении 25 пассажей (срок наблюдения). При культивировании предлагаемых клеток в брюшинной полости мышей Balb/c (1-2 млн. кл. на мышь), предварительно сенсибилизированных пристаном, образуются асцитные опухоли. Асцитические жидкости (3-10 мл на мышь) получают на 10-14-й день после инокуляции клеток. Антитела, продуцируемые предлагаемым клоном, относятся к иммуноглобулинам класса М. Иммуноглобулины выделяют методом солевой преципитации гельпроникающей хроматографией (ультрагель АсА-34).
Следовательно, моноклональные антитела, секретируемые штаммом ВГБК х Sp 2/0-4C11 89, имеют ряд преимуществ по сравнению с существующим прототипом. Они имеют несколько высокую активность в ИФА, позволяют выявлять антиген в органах больных и павших животных, а также могут быть использованы для серологической диагностики.
Полипептидную специфичность к ВП58 вируса геморрагической болезни кроликов подтверждают методом иммуноблотинга и радиоиммунопреципитации.
Специфичность моноклональных антител к ВГБК подтверждена также, в непрямом и "сэндвич" - вариантах ИФА с гетерологичными антигенами, которые сходны в клиническом проявлении с ВГБК (пастерелл1014з, хламидиоз, листериоз, печень здорового кролика).
Для выявления специфического антигена в органах больного и павших животных, а также в вакцинных препаратах с помощью моноклональных антител, предлагаемого штамма, используют "сэндвич" - вариант ИФА. При этом лунки 96-луночных пластин предварительно сенсибилизируют моноклональными антителами в количестве 1-2 мкг на лунку, а затем вносят исследуемые пробы суспензии органов животных. Выявление специфического антигена, связывающегося с моноклональными антителами, проводят пероксидазным конъюгатом на основе иммуноглобулинов кролика, предварительно иммунизированного очищенным препаратом ВГБК.
С целью выявления антител в сыворотках крови кроликов, больных ВГБК, применяют двойной антительный "сэндвич" - вариант ИФА (ДАС-ИФА). Для этого в 96-луночные пластины, покрытые моноклональными антителами, вносят специфический антиген ВГБК в рабочем разведении. После инкубации (1 ч, 37оС) и промывки добавляют разведения исследуемых сывороток. Обнаружение специфического комплекса антитело-антиген-антитело проводят антивидовым пероксидазным конъюгатом к иммуноглобулинам кролика.
Таким образом, применение штамма гибридных клеток ВГБК х Sp 2/0 89 в лабораторных условиях практически доступно и удобно. Продуцируемые штаммом моноклональные антитела высокочувствительны, специфичны и пригодны для изготовления диагностических препаратов в промышленных условиях. (56) Rodak L. et al. J. Gen. Virol.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К БЕЛКУ Р30 ВИРУСА АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ С ИСПОЛЬЗОВАНИЕМ РЕКОМБИНАНТНЫХ КОНСТРУКЦИЙ | 2013 |
|
RU2534343C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. CCHFV VD-1-ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 4G/B К ВИРУСУ КРЫМ-КОНГО ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ | 2013 |
|
RU2535982C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК MUS MUSCULUS L., ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К IGG СВИНЬИ | 1995 |
|
RU2093574C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК MUS MUSCULUS L., ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К IGM СВИНЬИ | 1995 |
|
RU2093573C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. CCHFV Vd-3-ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 3H6/F2 К ВИРУСУ КРЫМ-КОНГО ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ | 2013 |
|
RU2528869C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. CCHFV Vd-2-ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 1E2/E5 К ВИРУСУ КРЫМ-КОНГО ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ | 2013 |
|
RU2528868C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК MUS MUSCULUS L., ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ГЕКСОНУ АДЕНОВИРУСА СОБАКИ ПЕРВОГО СЕРОТИПА (CAV-1) | 1995 |
|
RU2095411C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК MUS MUSCULUS L., ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К L -ЦЕПЯМ ИММУНОГЛОБУЛИНОВ СВИНЬИ | 1995 |
|
RU2093572C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ВИРУСУ ПРОСТОГО ГЕРПЕСА I ТИПА | 1991 |
|
RU2031117C1 |
| ШТАММ "БЕЛГОРОДСКИЙ-03" ВИРУСА ГЕМОРРАГИЧЕСКОЙ БОЛЕЗНИ КРОЛИКОВ ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ И ДИАГНОСТИЧЕСКИХ ПРЕПАРАТОВ | 2010 |
|
RU2417262C1 |
Использование: биотехнология, ветеринария. Сущность: штамм получают при слиянии перевиваемой мышиной миеломной линии sp 2/0 - Ag 14 - 1 с лимфоцитами селезенки мыши линии Balb/c, иммунизированной высокоочищенным вирусом геморрагической болезни кроликов (ГБК). Гибридные клетки штамма сохраняют стабильную продукцию моноклональных антител в культуральной среде на протяжении 25 пассажей, при внутрибрюшинном введении мышам линии Balb/c индуцируют образование асцитных опухолей с титром моноклональных антител в асцитической жидкости до 1:106. Антигенная специфичность антител к vp 58 вируса геморрагической болезни кроликов подтверждена методом "вестерн" - блота и радиоиммунопреципитации. Штамм обозначен ВГКБ хsp 2/0 - 4С11, 89 и хранится под номером ВСКК(П) 560Д. 1 табл.
Штамм гибридных культивируемых клеток Mus musculus l. ВСКК(П) 560Д - продуцент моноклональных антител, используемых для диагностики вирусной геморрагической болезни кроликов.
Авторы
Даты
1994-02-15—Публикация
1992-01-16—Подача