Изобретение относится к новым биологически активным химическим соединениям, конкретно к производным циклического амида формулы I
R1-(CH2)n-Z,
где R1 - группа циклического амида, такого как 2Н-3,4-дигидро-1,3-бензоксазин-2-она, 2Н-3,4-дигидро-1,3-бензоксазин-2,4-диона, 1,2,3,4-тетрагидрохиназолин-2,4-диона, 1,2,3,4-тетрагидрохиназолин-2-она, 1,2,3,4-тетрагидропиридо(3,2-d)-пиримидин-2,4- диона, 1,2,3,4-тетрагидропиридо(3,2-d)пиримидин-2-она, 1,2,3,4-тетрагидроптеридин-2,4-диона, пирролидин-2-она, 1,2,3,4- тетрагидроптеридин-2-она, 5Н-6,7,8,9-тетрагидропиридо(3,2-b)азепин-6-она, 9Н-5,6,7,8-тетрагидропиридо(2,3-b)азепин- 8-она, 2Н-3,4-дигидропиридо(2,3-е)-1, 3-оксазин-2-тиона или 2-она, пирролидино (3,4-b)-пиразин-5-она, 1Н-2,3,4,5-тетрагидроазепино(2,3-b)индол-2-она, 8Н-4,5,6,7-тетрагидроазепино(2,3-b)тиофен-7-она, 4Н-пиразоло(5,4-е)бензазепин-9-она, изоиндолин-1,3-диона, бензоксазолин-2-она, незамещенного или замещенного низшим алкилом, низшим алкокси, галогеном, нитрогруппой, карбокси, бензоилом или бензилом, n является нулем или целым числом от 1 до 6, Z является группой формулы (А) или (В):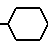 N-(CH2)mR2(A) или -
N-(CH2)mR2(A) или -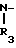 (CH2)p-R4(B) где R2 - фенил, замещенный галогеном, фенил, С5-С6-циклоалкил или радикал пиридина, диоксолана, фурана, тетрагидрофурана, метилфурана или тиофена, m - целое число от 1 до 3; R3 - низкий алкил; R4 - фенил или радикал диоксолана, фурана или тиофена, р = 1, при условии, что, если R1- радикал 1,2,3,4-тетрагидрохиназол-2-она или 1,2,3,4-тетрагидрохиназолин-2,4-диона, R2 и R4 не являются ни фенилом, ни замещенным галогеном фенилом, или их фармакологически приемлемой соли, обладающим антиацетилхолинэстеразной активностью.
(CH2)p-R4(B) где R2 - фенил, замещенный галогеном, фенил, С5-С6-циклоалкил или радикал пиридина, диоксолана, фурана, тетрагидрофурана, метилфурана или тиофена, m - целое число от 1 до 3; R3 - низкий алкил; R4 - фенил или радикал диоксолана, фурана или тиофена, р = 1, при условии, что, если R1- радикал 1,2,3,4-тетрагидрохиназол-2-она или 1,2,3,4-тетрагидрохиназолин-2,4-диона, R2 и R4 не являются ни фенилом, ни замещенным галогеном фенилом, или их фармакологически приемлемой соли, обладающим антиацетилхолинэстеразной активностью.
В связи с быстрым ростом численности пожилых весьма требуется создание медицинского лечения сенильной деменции (старческого слабоумия), такой как болезнь Алзгеймера.
Хотя существуют попытки различных лечений сенильной деменции с помощью лекарственных средств, пока не разработано лечение, достаточно эффективное для этих болезней.
Различные исследования находятся в развитии с целью разработки терапевтических средств для этих заболеваний. В частности, разработка предшественников ацетилхолина и ингибиторов ацетилхолинэстеразы преложена, так как болезнь Алзгеймера сопровождается церебральной холинергической гипофункцией, и они находятся на текущем анализе. Типичные примеры ингибиторов антихолинергической эстеразы включают физестигмин и тетрагидроаминоакридин. Однако, они имеют недостатки в том, что их действия являются все же недостаточными и в том, что они имеют неблагоприятные побочные реакции. Таким образом, они в настоящее время являются не решающими терапевтическими средствами.
Цель может быть достигнута путем использования производных общей формулы I, представленной ниже. В частности, соединения изобретения, представленные структурной формулой I имеют такие свойства, что они имеют сильнодействующую, высокоселективную антиацетилхолинэстеразную активность, чтобы повысить количество ацетилхолина в головном мозге, что они являются эффективными при лечении моделей нарушения памяти и что их действие продолжается в течение длительного периода времени и что они имеют более высокую безопасность, чем такие же свойства физостигмина, часто используемого в этой области. Таким образом, настоящее изобретение является чрезвычайно ценным.
Соединения изобретения найдены на основе ингибирования ацетилхолинэстеразы и, поэтому они являются эффективными при лечении и предупреждении различных заболеваний, обусловленных недостаточностью центральных функций холина, т. е. отсутствием ацетилхолина в качестве нейротрансмиттера ин виво.
Типичные примеры таких заболеваний включают деменцию (слабоумие), представляемую пресбиофренией Алзгеймера (конфабуляторное старческое слабоумие). Они включают также хорею Хантингтона, болезнь Пика и позднюю дискинезию (осложнение длительного приема нейролептиков).
Поэтому, целью изобретения является разработка новых производных пиперидина, пригодных к употреблению в качестве лекарственного средства и особенно эффективных при лечении и предупреждении заболеваний центрально-нервной системы.
Термин "низкие алкильные группы" в указанном определении включает линейно-цепные и разветвленные алкильные группы, имеющие 1-6 атомов углерода, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил (амил), изопентил, неопентил, трет-пентил, 1-метилбутил, 2-метилбутил-1,2-диметилпропил, гексил, изогексил, 1-метилпентил, 2-метилбутил-1,2-диметилпропил, гексил, изогексил, 1-метилпентил-, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 3,2-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил. Предпочтительными среди них являются метильная, этильная, пропильная и изопропильная группы, наиболее желательными являются метильная группа и этильная группа.
Термин "низшие алкокси-группы" относится к низшим алкокси-группам, имеющим 1-6 атомов углерода, получаемым из описанных низших алкильных групп. Наиболее желательные среди них низшие алкоксигруппы включают метокси-, этокси- и н-пропокси-группы.
Соединения формулы I могут быть получены по аналогичным химическим способам производства:
Способ получения А.
Когда R1 представляет группу, полученную из соединения циклического амида, выбираемого из тетрагидрохиназолиндиона, азатетрагидробензазепинона, бензилпиперидинона и бензоилпиперидинона, соединение может быть получено по следующему способу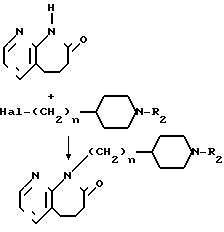 (
( где n представляет целое число от 1 до 6, R2 является таким, как это определено выше, а Наl представляет атом галогена.
где n представляет целое число от 1 до 6, R2 является таким, как это определено выше, а Наl представляет атом галогена.
А именно 9-аза-1-бензапенин-2-он (II) конденсируется с соединением общей формулы (III) в присутствии, например, гидрида натрия, в растворителе, например диметилформамиде, по обычному методу, чтобы получить заданное (целевое) соединение общей формулы (IY).
Когда R1 является моновалентной группой, получаемой из соединения циклического амида, отличного от описанного выше, исходное соединение формулы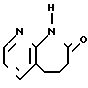 заменяется тетрагидроиназолиндионом, бензилпиперидиноном или безоилпиперидиноном, который конденсируется с соединением общей формулы III, чтобы получить легко целевое соединение.
заменяется тетрагидроиназолиндионом, бензилпиперидиноном или безоилпиперидиноном, который конденсируется с соединением общей формулы III, чтобы получить легко целевое соединение.
Способ получения Б.
Когда R1 представляет группу, получаемую из тетрагидрохиназолиндиона, соединение может быть получено по следующему способу: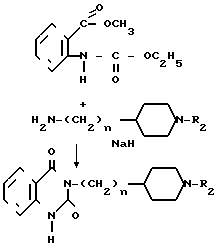
 где n и R2 являются такими, как определено выше.
где n и R2 являются такими, как определено выше.
А именно сложный диэфир общей формулы (Y) подвергается реакции с производным пиперидина общей формулы (YI) при нагревании в подходящем растворителе, инертном к реакции, или в отсутствие какого-либо растворителя, чтобы получить соединение хиназолона (YII), которое является одним из целевых соединений.
Способ получения В.
Когда R1 в общей формуле I представляет группу, получаемую из тетрагидрохиназолиндиона, тетрагидроптеридиндиона, или тетрагидропиридинопиримидиндиона, соединение может быть получено также по следующему способу:  (VIII)
(VIII) 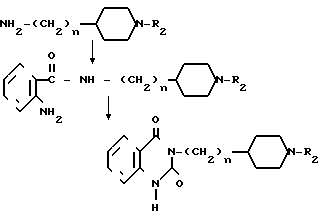
 где n и R2 являются такими, как определено выше.
где n и R2 являются такими, как определено выше.
А именно N-ацилпроизводное общей формулы (YIII) конденсируется с амином общей формулы (YI) в растворителе, таком как тетрагидрофуран, и конденсат дополнительно подвергают реакции с 1,1-карбонилдиимидазолом, чтобы получить соединение I, которое является одним из целевых соединений.
Способ получения Г.
Когда R1 в общей формуле I представляет одновалентную группу, получаемую из замещенного или незамещенного тетрагидробензоксазинона, соединение может быть получено также по следующему способу: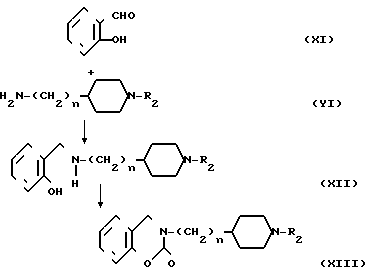 где n и R2 являются такими, как определено выше.
где n и R2 являются такими, как определено выше.
Производное салицилового альдегида общей формулы XI конденсируется с амином общей формулы YI в растворителе, таком как метанол, в конденсат восстанавливают с помощью натрийборогидрида, чтобы получить соединение XI. Соединение это подвергается реакции с 1,1-карбонилдиимидазолом, в растворителе, таком как тетрагидрофуран, чтобы получить соединение XIII, которое является одним из заданных соединений.
Способ получения Д.
Когда R1 в общей формуле I представляет группу, получаемую из замещенного или незамещенного тетрагидробензоксазиндиона, а R2представляет замещенную или незамещенную арилметильную, фурилметильную или тиенилметильную группу или тому подобные, соединение может быть получено также по следующему способу
 где n и R2 являются такими, как определено выше, а представляет защитную группу, такую как метоксиметильная или метоксиэтоксиметильная группа.
где n и R2 являются такими, как определено выше, а представляет защитную группу, такую как метоксиметильная или метоксиэтоксиметильная группа.
А именно производное салициловой кислоты общей формулы XIY и амин общей формулы YI конденсируются, например, с 1,1-карбонилдиимидазолом в растворителе таком, как тетрагидрофуран, и защитная группа удаляется с помощью кислоты, такой как соляная кислота, чтобы получить соединение XY. Это соединение подвергается реакции с 1,1-карбонилдиимидазолом в растворителе, таком как тетрагидрофуран, чтобы получить соединение XYI, которое является одним из целевых соединений.
Способ получение Е.
Когда R1 в общей формуле I представляет группу, получаемую из замещенного или незамещенного тетрагидробензоксазиндиона, а R2представляет циклоалкилметильную, 1,3-диоксолан-2-илметильную или тетрагидрофурилметильную группу или тому подобную, соединение может быть получено также по следующему способу: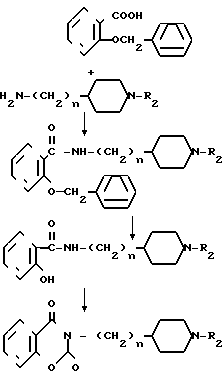
 где n и R2 являются такими, как определено выше. А именно производное салициловой кислоты общей формулы XYII и амин общей формулы YI конденсируются, например, 1,1-карбонилдиимидазолом в растворителе таком как тетрагидрофуран, чтобы получить соединение XYIII и защитная группа удаляется из него путем каталитического восстановления, проводимого в присутствии Рd-С или тому подобного катализатора, в растворителе, таком как метанол. Это соединение подвергается реакции с 1,1-карбонилдиимидазолом в растворителе, таком как тетрагидрофуран, чтобы получить соединение XIX, которое является одним из целевых соединений.
где n и R2 являются такими, как определено выше. А именно производное салициловой кислоты общей формулы XYII и амин общей формулы YI конденсируются, например, 1,1-карбонилдиимидазолом в растворителе таком как тетрагидрофуран, чтобы получить соединение XYIII и защитная группа удаляется из него путем каталитического восстановления, проводимого в присутствии Рd-С или тому подобного катализатора, в растворителе, таком как метанол. Это соединение подвергается реакции с 1,1-карбонилдиимидазолом в растворителе, таком как тетрагидрофуран, чтобы получить соединение XIX, которое является одним из целевых соединений.
Способ получения Ж.
Когда R1 в общей формуле I представляет группу, получаемую из замещенного или незамещенного тетрагидрохиназолинона или тетрагидроптеридинона, соединение может быть получено также по следующему способу: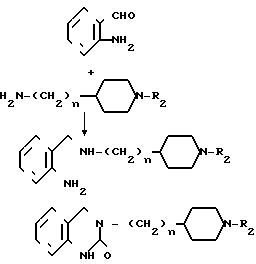
 где n и R2 являются такими, как определено выше.
где n и R2 являются такими, как определено выше.
А именно производное аминобензальдегида общей формулы YI в растворителе таком, как метанол, и конденсат восстанавливается с помощью натрийборогидрида, чтобы получить соединение XXII, которое подвергается реакции с 1,1-карбонилдиимидазолом в растворителе таком, как тетрагидрофуран, чтобы получить соединение XXIII, которое является одним из целевых соединений.
Способ получения З.
Когда R1 в общей формуле I представляет группу, получаемую из замещенного или незамещенного тетрагидробензоксазин-2-она или тетрагидробензоксазин-2,4-диона, соединение может быть получено также по следующему способу: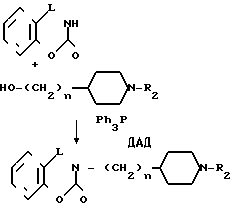
 где n и R2 является такими, как определено выше, а L представляет карбонильную или метиленовую группу.
где n и R2 является такими, как определено выше, а L представляет карбонильную или метиленовую группу.
А именно соединение циклического амида общей формулы XXIY конденсируется со спиртом общей формулы XXY в растворителе таком, как тетрагидрофуран, в присутствии ДАД-диэтилового эфира азодикарбоновой кислоты или диизопропилового эфира азодикарбоновой кислоты - и трифенилфосфина, чтобы получить соединение XXYI, которое является одним из целевых соединений.
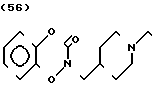
Способ получения И.
Когда R1 в общей формуле I представляет группу, получаемую из замещенного или незамещенного тетрагидробензоксазин-2-она или 2-бензоксазолинона, соединение может быть получено также по следующему способу: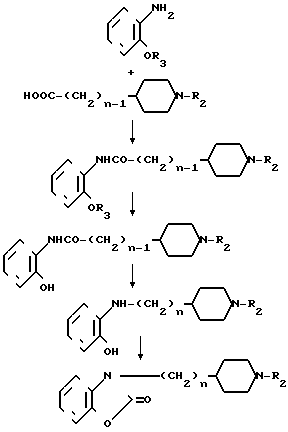
 где n и R2 являются такими, как определено выше, а R3 представляет защитную группу такую, как бензильная, метоксиметильная или метоксиэтоксиметильная группа.
где n и R2 являются такими, как определено выше, а R3 представляет защитную группу такую, как бензильная, метоксиметильная или метоксиэтоксиметильная группа.
А именно амин общей формулы XXYII конденсируется с карбоновой кислотой общей формулы XXYIII, чтобы получить амидное соединение XXIY и защитная группа удаляется из него, чтобы получить соединение XXX, которое восстанавливается с помощью литийалюминийгидрида в растворителе таком, как тетрагидрофуран, чтобы получить амин XXXI. Это соединение подвергается реакции с 1,1-карбонилдиимидазолом в растворителе таком, как тетрагидрофуран или ацетонитрил, чтобы получить соединение XXXII, которое является одним из целевых соединений.
Соединения формулы I или их соли при присоединении кислоты, получаемые так, как описано выше, являются эффективными при лечении различных сенильных деменций, в частности болезни Алзгеймера.
Следующие результаты фармакологических испытаний иллюстрируют полезность соединений общей формулы I и их солей при присоединении кислоты.
Экспериментальный пример 1.
Ин витро ангибирование действия ацетилхолинэстеразы.
Эстеразная активность была определена путем использования гомогената головного мозга мышей в качестве источника ацетилхолинэстеразы по методу Эллмана и др. (1). Ацетилтиохолин в качестве субстрата, образец и ДТNB были добавлены к гомогенату головного мозга мышей и эта смесь была инкубирована. Желтый продукт, образуемый по реакции продуцируемого тиохолина с ДТNB, был определен на основе изменения в спектре поглощения при 412 нм, чтобы оценить активность ацетилхолин-эстеразы.
Ингибирование активности ацетилхолин-эстеразы для образа была выражена в виде концентрации ингибирования активности на 50% (IC50). Результаты даны в табл. 1.
Из описанных выше фармакологических экспериментальных примеров очевидно, что производные пиперидина изобретения имеют сильнодействующий ингибирующий эффект на ацетилхолинэстеразу.
Производные циклического амида, полученные по изобретению, имеют такие особенности, что их структура полностью отличается от структуры обычных ингибиторов ацетилхолинэкстеразы, они имеют сильнодействующий ингибирующий эффект на ацетилхолинэстеразу, различие между целевым эффектом и подобным эффектом на ацетилхолинэстеразу является довольно значительным, эффект продолжается в течение длительного периода времени, они являются довольно стабильными соединениями, имеющими высокую растворимость в воде, которая является полезной с точки зрения технологии приготовления лекарственного средства, их использование ин виво является главным, они являются по существу свободными от первого пасэффекта (проходящего мимо эффекта) и что они имеют высокую скорость миграции в головном мозге.
Таким образом, целью изобретения является разработка новых соединений, эффективных при лечении различных деменций и последствий заболеваний церебральных кровеносных сосудов.
Соединения изобретения являются эффективными при лечении, предупреждении, ремиссии (временном исчезновении симптомов заболевания), улучшения (положительной динамики заболевания) и т. д. , сенильной деменции, в частности, заболеваниях церебральных кровеносных сосудов, обусловленных пресбиофренией Алзгеймера, церебральном приступе (внутримозговом кровизлиянии или церебральном инфаркте), атеросклерозе и наружном ранении головы, и невнимательности, рассторойстве речи, ослабленной воле, эмоциональном рассторойстве, неспособности становиться сосредточенным (неподвижным), состояния галюцинации и бреда и изменениях поведения вследствие последствий энцефалита и коркового паралича.
Соединения изобретения являются эффективными при лечении пресбиофрении Алзгеймера, а также хореи Хантингтона, болезни Пика и поздней дискинезии (осложнения длительного приема нейролептиков).
Когда соединения изобретения используются в качестве лекарственного средства для такой болезни, они назначаются перорально или парентерально. Обычно они даются путем парентерального введения такого, как внутривенная, подкожная или внутримышечная инъекция, или в форме суппозиторий или таблеток под язык. Доза соединений особенно не ограничивается, так как она варьирует в зависимости от симптомов, возраста, пола, жидкой массы и чувствительности пациента, лекарственного средства, периода и интервалов приема, свойств, состава и вида препарата, и вида действующего ингредиента. Обычно, однако, они даются в количестве примерно от 0,1 до 3000 мг, предпочтительно примерно от 1 до 100 мг, в день (от 1 до 4 раз в день).
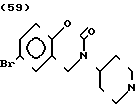
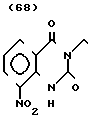
П р и м е р 1. Хлоргидрат 2-/2-(1-бензил-4-пиперидил)-этил/-5-метокси-2Н-3,4-ди- гидро-1,3-бензоксазин- 2-она: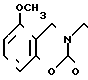



К 1,87 г 1-бензил-4-(2-аминоэтил)-пиперидина добавляют 10 мл метанола, чтобы получить раствор, и к этому раствору добавляют раствор 0,53 г 6-метоксисалицилового альдегида в 10 мл метанола. Смесь перемешивают при комнатной температуре в течение 30 мин, а затем охлаждают льдом. К смеси добавляют натрийборогидрид малыми порциями, чтобы осуществить восстановление. Растворитель отгоняют и к остатку добавляют воду. После экстракции эталацетатом, за которым следует высушивание над сульфатом магния, отгоняют растворитель. Полученный таким образом маслянистый продукт реакции растворяют в 450 мл тетрагидрофурана и к смеси добавляют 2,77 N, N-карбонилдиимидазола. Смесь нагревают при кипячении с обратным стеканием флегмы в течение 1 ч. Растворитель отгоняют и полученное таким образом маслянистое вещество очищают с помощью колоночной хроматографии на силикагеле. Продукт реакции превращают в его хлоргидрат обычным методом, чтобы получить 0,31 г целевого соединения в бесцветном, аморфном виде. Температура плавления: аморфное вещество. Молекулярная формула: C23H28N2O3 ˙HCl ЯМР (СДСl3) δ:
1,20-2,12 (9Н, мультиплет), 2,84 (2Н, уширенный дублет), 3,37-3,54 (4Н, мультиплет), 3,80 (3Н, синглет), 4,29 (2Н, синглет), 6,54 (1Н, квартет, I = 2,1 Гц, 8,2 Гц), 7.04-7.18 (7Н, мельтиплет). Масс-спектр: (М + 1+) = 381.
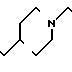
П р и м е р 2. Хлоргидрат 3-[2-(1-бензил-4-пиперидил)-этил] -2Н-3,4-дигидро-1,3-бен- зоксазин- 2-она.
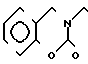
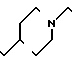

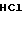
К 0,954 г 1-бензил-4-(2-аминоэтил)-пиперидина добавляют 6 мл метанола, чтобы получить раствор, и к раствору добавляют раствор 0,53 г салицилового альдегида в 6 мл метанола. Смесь перемешивают при комнатной температуре в течение 30 мин, а затем охлаждают льдом. К смеси малыми порциями добавляют натрийборогидрид, чтобы осуществить восстановление, Растворитель отгоняют и к остатку добавляют воду. После экстракции этилацетатом высушивают над сульфатом магния и растворитель отгоняют. Полученный таким образом маслянистый продукт реакции растворяют в 15 мл ацетонитрила и к смеси добавляют 2,58 г N, N -карбонилдиимидазола. Смесь нагревают при температуре кипения с обратным стеканием флегмы в течение 1 ч. Растворитель отгоняют и полученное таким образом маслянистое вещество очищают колоночной хроматографией на силикагеле. Продукт реакции превращают в его хлоргидрат обычным методом, чтобы получить 0,68 г целевого соединения в виде бесцветного, аморфного вещества. Температура плавления: 209,8-210оС. Молекулярная формула: С22Н26N2O2˙HCl ЯМР (СДСl3) δ:
1,24-2,08 (9Н, мультиплет), 2,83 (2Н, уширенный дублет), 3,45 (2Н, синглет), 3,46 (2Н, триплет, I = 7,5 Гц), 4,38 (2Н, синглет), 6,89-7,34 (9Н, мультиплет).
Масс-спектр: (М + 1+) = 351.
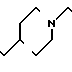
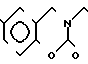
П р и м е р 3. Хлоргидрат 3-[2-(1-бензил-4-пиперидил)-этил] -2Н-3,4-дигидро-1,3-бен- зоксазин-2,4-диона:

В 70 мл тетрагидрофурана растворяют 2,15 г 4-[2-(2-гидроксибензоиламино)-этил] -1-бензилпиперидина и к смеси добавляют 2,06 г N, N'-карбонилдимидазола. Смесь нагревают при кипячении с обратным стеканием флегмы в течение 24 ч. Растворитель отгоняют и полученное таким образом маслянистое вещество очищают колоночной хроматографией на силикагеле. Продукт реакции превращают в его хлоргидрат обычным методом, чтобы получить 2,14 г целевого соединения в виде бесцветного, аморфного вещества. Температура плавления: 225,3-227,1оС (разл. ). Молекулярная формула: C22H24N2O3˙HCl ЯМР (СДСl3) δ:
1,24-2,19 (9Н, мультиплет), 2,86 (2Н, уширенный дублет), 3,46 (2Н, синглет), 4,02 (2Н, триплет, ж : I = 7,5 Гц), 7,14-7,36 (7Н, мультиплет), 7,59 (1Н, квартет, I = 1,8 Гц и 9,0 Гц), 8,00 )1Н, квартет, I = 1,8 Гц и 8,0 Гц).
Масс-спектр: (М + 1+) = 365.
П р и м е р 4. Дихлоргидрат 3-[2-(4-пиридилметил)-4-пиперидил] -этил] -2Н-3,4-ди- гидро-1,3- бензоксазин-2-она.


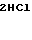
К 0,83 г 1-(4-пиридилметил)-4-(2-аминоэтил)-пиперидина добавляют 10 мл метанола, чтобы получить раствор, и к этому раствору добавляют раствор 0,63 г 5-метоксисалицилового альдегида в 5 мл метанола. Смесь перемешивают при комнатной температуре в течение 30 мин, а затем охлаждают со льдом. К смеси малыми порциями добавляют натрийборогидрид, чтобы осуществить восстановление. Растворитель отгоняют и к остатку добавляют воду. После экстракции этилацетатом и высушивания над сульфатом магния отгоняют растворитель. Полученный таким образом маслянистый продукт реакции растворяют в 20 мл ацетонитрила и к смеси добавляют 2,28 г N, N'-карбонилдиимидазола. Смесь нагревают при кипячении с обратным стеканием флегмы в течение 4 ч. Растворитель отгоняют и полученное таким образом маслянистое вещество очищают с помощью колоночной хроматографии на силикагеле. Продукт реакции превращают в его хлоргидрат обычным методом и перекристаллизовывают из смеси метанола-эфира, чтобы получить 0,35 г целевого соединения в виде бесцветных, иглоподобных кристаллов. Температура плавления: 132,2-132,8оС (разл. ). Молекулярная формула: C22H27N3O3˙2HCl. ЯМР (СДСl3) δ:
1,20-2,13 (9Н, мультиплет), 2,82 (2Н, уширенный дублет), 3,46 (2Н, синглет), 3,48 (2Н, триплет, I = 7,5 Гц), 3,75 (3Н, синглет), 4,18 (2Н, синглет), 6,58 (1Н, два дублета, I = 2,8 Гц и 8,5 Гц), 6,79 (1Н, дублет, I = 2,8 Гц), 6,92 (1Н, дублет, I = 8,5 Гц), 7,23 (2Н, дублет, I = 6,2 Гц), 8,48 (2Н, дублет, I = 6,2 Гц).
Масс-спектр: (М + 1+) = 382.
П р и м е р 5. Хлоргидрат 3-[2-[1-(1,3-диоксолан-2-илметил)-4-пиперидин] -этил-] -6-метокси- 2Н-3,4-дигидро-1,3-бензоксазин-2-она: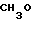
В 10 мл метанола растворяют 0,70 г 5-метоксисалицилового альдегида и раствор 1,28 г 1-(1,3-диоксолан-2-илметил)- 4-(2-аминоэтил)-пиперидина в 10 мл метанола добавляют к указанному раствору. Смесь перемешивают при комнатной температуре в течение 1 ч, а затем к смеси добавляют натрийборогидрид при охлаждении со льдом до тех пор, пока не исчезнет желтое окрашивание. Реакционную смесь концентрируют при пониженном давлении и к смеси добавляют 150 мл насыщенного водного раствора бикарбоната натрия. После экстракции дважды со 100 мл хлористого метилена, за которым следует промывание со 150 мл водного раствора хлористого натрия или солевым раствором и высушивание над сульфатом магния, продукт реакции концентрируют при пониженном давлении. Полученный таким образом маслянистый продукт реакции растворяют в 100 мл ацетонитрила и к смеси добавляют 2,98 г N, N'-карбонилдиимидазола. Смесь нагревают при кипячении с обратным стеканием флегмы в течение 3 ч, а затем оставляют охлаждаться до комнатной температуры. После концентрирования при пониженном давлении к остатку добавляют 200 мл этилацетата, смесь промывают с 200 мл насыщенного водного раствора бикарбоната натрия, а затем с 200 мл насыщенного водного раствора хлористого натрия. После высушивания над сульфатом магния, за которым следует концентрирование при пониженном давлении, остаток очищают с помощью колоночной хроматографии на силикагеле (хлористый метилен: метанол = 100: 1). Полученное таким образом белое твердое вещество перекристаллизовывают из смеси этилацетата/гексана, чтобы получить 1,30 г белых кристаллов. Продукт реакции превращают в его хлоргидрат, чтобы получить 1,43 г (выход: 75% ) целевого соединения в аморфной форме. Температура плавления: аморфное вещество. Молекулярная формула: C22H28N2O5˙HCl. ЯМР (СДСl3) δ:
1,30-1,41 (3Н, мультиплет), 1,60 (2Н, два дублета), 1,72 (2Н, дублет), 2,06 (2Н, триплет), 2,56 (2Н, дублет), 2,98 (2Н, дублет), 3,49 (2Н, два дублета), 3,78 (3Н, синглет), 3,82-4,00 (4Н, мультиплет), 4,41 (2Н, синглет), 5,00 (1Н, триплет), 6,60 (1Н, дублет), 6,79 (1Н, два дублета), 6,95 (1Н, дублет).
Масс-спектр: (М + 1+) = 377. П р и м е р 6. Хлоргидрат 3-[2-(1-циклопентилметил-4-пиперидил)-этил] -2Н-3,4-дигидро-1,3- бензоксазин-2,4-диона: 
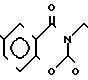


В 50 мл метанола растворяют 0,91 г 4-[2-(2-бензилокси-5-метоксибензоиламино)-этил] -1-циклопентилметилпиперидина и к раствору добавляют 0,07 к 10% Pd-С. Смесь перемешивают при комнатной температуре в атмосфере водорода в течение 1 ч. Использованный Рd-С удаляют фильтрацией и растворитель отгоняют, чтобы получить светло-желтое маслянистое вещество. К этому веществу добавляют 30 мл тетрагидрофурана, чтобы получить раствор, и к раствору добавляют 0,65 г N, N'-карбонилдиимидазола. Смесь нагревают при кипячении с обратным стеканием флегмы в течение 13 ч. Растворитель отгоняют и полученное таким образом маслянистое вещество очищают с помощью колоночной хроматографии на силикагеле. Это вещество превращают в его хлоргидрат обычным способом и перекристаллизовывают из смеси метанола/эфира, чтобы получить 0,39 г целевого соединения в виде бесцветных иглоподобных кристаллов. Температура плавления: 213,5-214,1оС. Молекулярная формула: C22H30N2O4˙HCl. ЯМР (СДСl3) δ:
1,17-1,21 (2Н, мультиплет), 1,36-1,39 (3Н, мультиплет), 1,50-1,68 (6Н, мультиплет), 1,74-1,79 (4Н, мультиплет), 1,97 (2Н, триплет, I = 10,8 Гц), 2,08 (1Н, септет, I = 7,6 Гц), 2,31 (1Н, дублет, I = 7,2 Гц), 2,97 (2Н, уширенный дублет), 3,87 (3Н, синглет), 4,06 (2Н, мультиплет), 7,19 (1Н, дублет, I = 9,2 Гц), 7,25 (1Н, два дублета, I = 3,2 Гц и 9,2 Гц), 7,45 (1Н, дублет, I = 3,2 Гц).
Масс-спектр: (М + 1+) = 387.
П р и м е р 7. Хлоргидрат 3-[2-[1-(1,3-диоксолан-2-илметил)-4-пиперидил] -этил] -2Н- 3,4-дигидро- 1,3-бензоксазин-2,4-диена: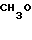

В 30 мл метанола растворяют 0,99 г 4-[2-(2-бензилокси-5-метоксибензоил-амино)- этил] -1-(1,3-диоксолан-2- илметил)-пиперидина и добавляют к раствору 0,11 г 10% Рd-С. Смесь перемешивают при комнатной температуре в атмосфере водорода в течение 2 ч. Использованный Рd-С удаляют фильтрацией и растворитель отгоняют, чтобы получить 0,82 г светло-желтого маслянистого вещества. К нему добавляют 30 мл тетрагидрофурана, чтобы получить раствор, и к нему добавляют 0,71 г N, N'-карбонилдиимидазола. Смесь нагревают при кипячении с обратным стеканием флегмы в течение 20 ч. Растворитель отгоняют и полученное таким образом маслянистое вещество очищают с помощью колоночной хроматографии на силикагеле. Вещество превращают в его хлоргидрат обычным путем и перекристаллизовывают из смеси метанола/эфира, чтобы получить 0,85 г целевого соединения в виде бесцветных игл. Температура плавления: 155,3-156,8оС. Молекулярная формула: C20H26N2O6˙HCl. ЯМР (СДСl3) δ:
1,35-1,43 (3Н, мультиплет), 1,64 (2Н, уширенный квартет), 1,76 (2Н, уширенный дублет), 2,08 (2Н, триплет, I = 11,0 Гц), 2,56 (2Н, дублет, I = 4,4 Гц), 3,50 (2Н, уширенный дублет), 3,87 (3Н, синглет), 3,82-3,90 (2Н, мультиплет), 3,92-3,99 (2Н, мультиплет), 4,03-4,07 (2Н, мультиплет), 5,00 (1Н, триплет, I = 4,4 Гц), 7,10 (1Н, дублет, I = 9,2 Гц), 7,16 (1Н, квартет, I = 2,8 Гц и 9,2 Гц), 7,35 (1Н, дублет, I = 2,8 Гц).
Масс-спектр: (М + 1+) = 391.
П р и м е р 8. Дихлоргидрат 5-[2-(1-бензил-4-пиперидил)-этил] -5Н-6,7,8,9-тетра- гидропиридо-[3,2-b] - азепин-6-она.
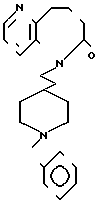


0,73 г гидрида натрия промывают н-гексаном, а затем суспендируют в 1 мл N, N-диметилформамиде (ДМФА) и суспензию перемешивают при охлаждении со льдом. К суспензии по каплям добавляют раствор 0,989 5Н-6,7,8,9-тетрагидропиридо-[3,2-b] -азепин-6-она в 15 мл ДМФА. Смесь перемешивают в течение 20 мин при 60оС. Продукт реакции снова охлаждают со льдом и к нему добавляют 2,51 г хлоргидрата 1-бензил-4-(2-хлорэтил)-пиперидина. Смесь перемешивают в течение 2,5 ч, выдерживая внешнюю температуру при 60оС. Растворитель отгоняют и к остатку добавляют воду. После экстракции хлористым метиленом, за которым следует промывание насыщенным водным раствором хлористого натрия и высушивание над сульфатом магния, отгоняют растворитель. Полученный таким образом маслянистый продукт реакции очищают с помощью колоночной хроматографии на силикагеле. Продукт реакции превращают в его хлоргидрат обычным способом, чтобы получить 2,09 г целевого соединения в виде бесцветного, аморфного вещества. Теспература плавления: аморфное вещество. Молекулярная формула: C23H29N3O˙HCl. ЯМР (СДСl3) δ:
1,21-2,04 (9Н, мультиплет), 2,26 (4Н, уширенный синглет), 2,82 (4Н, уширенный дублет), 3,44 (2Н, синглет), 3,81 (2Н, уширенный триплет), 7,08-7,45 (7Н, мультиплет), 8,30 (1Н, два дублета, I = 1,3 Гц и 4,6 Гц).
Масс-спектр: (М+ = 363 (Д1-Е1).
П р и м е р 9. Хлоргидрат 3-[2-(1-бензил-4-пиперидил)-этил] -2Н-3,4-дигидро-6-метил- пиридо- [2,3-е] -мета-оксазин-2-тиона.

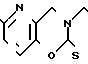

 ·HCl
·HCl
К основанию Шиффа, полученному кипячением с обратным холодильником 0,50 г 3-гидрокси-6-метил-2-пиридинкарбоксиаль- дегида и 1,00 г 1-бензил-[4-(2-аминоэтил)] -пиперидина в метаноле, добавляют избыточное количество натрийборогидрида. Смесь перемешивают при комнатной температуре в течение 30 мин и реакционную смесь выливают в 0,2 н. водный раствор гидроокиси натрия. После экстракции смесью этилацетата/диэтилового эфира, за которым следует промывка насыщенным раствором хлористого натрия, высушивание над безводным сульфатом магния и перегонка растворителя при пониженном давлении, остаток растворяют в 30 мл ацетонитрила. К растворе добавляют 2,00 г 1,1'-тиокарбонилдиимидазола и реакцию проводят при 70оС в течение 30 мин. Жидкую реакционную смесь выливают в 0,2 н. водный раствор гидроокиси натрия. После экстракции смесью этилацетата/диэтилового эфира, за которым следует промывание насыщенным раствором хлористого натрия и высушивание над безводным сульфатом магния, отгоняют растворитель при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле (хлористый метилен: метанол = = 97: 3). Полученное голубое маслянистое вещество превращают в его хлоргидрат и обрабатывают Норитом SX-2, чтобы получить 0,40 г целевого соединения в виде светло-желтых кристаллов (выход: 26% ). Температура плавления: 138-139оС (разл. ). Молекулярная формула: C22H27N3OS˙HCl. ЯМР (СДСl3) δ:
1,16-2,10 (9Н, мультиплет), 2,49 (3Н, синглет), 2,64-2,97 (2Н, мультиплет), 3,47 (2Н, синглет), 3,96 (2Н, триплет), 4,49 (2Н, синглет), 6,95-7,40 (7Н, мультиплет).
Масс-спектр: (М + 1+) = 382.
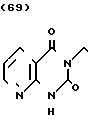
П р и м е р 10. Фумарат 3-[2-[4-[(1-бензил)-пиперидил] ] -этил] -пиразино-[2,3-d] пи- римидин- 2,4-диона.
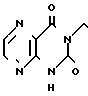
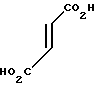
В 200 мл ацетонитрила суспендируют 5 г 3-аминопиразин-2-карбоновой кислоты и 6,7 г 1,1'-карбонилдиимидазола и суспензию нагревают при кипячении с обратным стеканием флегмы в течение 6 ч. Нерастворенную часть удаляют фильтрацией и остаток охлаждают до комнатной температуры. Полученные таким образом кристаллы извлекают фильтрацией, чтобы получить 3,5 г производного ацилимидазола в виде желтых иглоподобных кристаллов.
В 15 мл тетрагидрофурана растворяют 1,5 г полученного таким образом производного ацилимидазола и 1,4 г 2-[4-[(1-бензил)-пиперидил] ] -этиламина и раствор перемешивают при комнатной температуре в течение ночи. Тетрагидрофуран отгоняют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле (хлористый метилен: метанол = 9: 1), чтобы получить 1,9 г амидного соединения.
В 50 мл ацетонитрила и 50 мл тетрагидрофурана растворяют 1,9 г амидного соединения и 2,2 г 1,1'-карбонилдиимидазола и раствор нагревают при кипячении с обратным стеканием флегмы в течение 26 ч. Растворитель отгоняют при пониженном давлении и к остатку добавляют воду. После экстракции хлористым метиленом и высушивания над сульфатом магния продукт реакции очищают с помощью колоночной хроматографии на силикагеле (хлористый метилен: метанол = 10: 1), чтобы извлечь 1,5 г амидного соединения и получить 150 мг продукта реакции. Продукт реакции превращают в его фумарат обычным методом, чтобы получить порошкообразное целевое соединение. Температура плавления: 223-226оС (разл. ). Молекулярная формула: C20H23N5O2 x C4H4O4.
ЯМР (СДСl3) δ:
1,08-2,20 (9Н, мультиплет), 2,76-3,08 (2Н, мультиплет), 3,52 (2Н, синглет), 3,80-4,24 (2Н, мультиплет), 6,32 (1Н, уширенный синглет), 6,92-7,32 (5Н, мультиплет), 8,52 (2Н, синглет).
Масс-спектр: (М + 1+) = 366.
П р и м е р 11. 1-[2-[4-[(1-Бензил)-пиперидил] ] -этил] -7-гидрокси-7-метилпипера- зино- [2,3-c] -пирролидин-2-он.
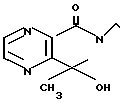
Раствор 4,8 г ангидрида 2,3-пиразиндикарбоновой кислоты и 7 г 2-[4-[(1-бензил)-пиперидил] ] -этиламина в 70 мл толуола нагревают при кипячении с обратным стеканием флегмы в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и фильтрацией извлекают 10 г получаемой таким образом N-[2-[4-(1-бензил)-пиперидил] ] -этил] -2-пира- зинкарбоксамид-3-карбоновой кислоты.
1,76 г полученной таким образом амидо-карбоновой кислоты нагревают при 70оС в 25 мл уксусного ангидрида в течение 30 мин. Легколетучее вещество отгоняют при пониженном давлении и остаток подвергают азеотропной перегонке с толуолом, а затем последующей реакции без дополнительной очистки.
Полученный таким образом сырой продукт реакции растворяют в 20 мл тетрагидрофурана и к смеси по каплям добавляют при комнатной температуре в течение 2 мин 2 мл 3 М раствора метилмагнийбромида в эфире. Смесь перемешивают при комнатной температуре в течение 30 мин и к смеси добавляют водный раствор хлористого аммония. После экстракции хлористым метиленом, за которым следует высушивание над сульфатом магния, продукт реакции очищают с помощью колоночной хроматографии на силикагеле (хлористый метилен: метанол = 9: 1), чтобы получить 0,15 г целевого соединения. Температура плавления: аморфное вещество. Молекулярная формула: C21H26N4O2.
ЯМР (СДСl3) δ:
1,00-2,24 (12Н, мультиплет), 2,72-3,20 (2Н, мультиплет), 3,40-3,72 (4Н, мультиплет), 7,16-7,40 (5Н, мультиплет), 8,52-8,68 (2Н, два дублета).
Масс-спектр: (М + 1+) = 367.
П р и м е р 12. Фумарат 1-[2-[4-[(1-бензил)-пиперидил] ] -этил] -7-метиленпипера- зино-[2,3-c] - пирролидин-2-она.

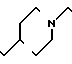
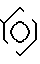 ·
· 
В 3 мл уксусного ангидрида растворяют 0,1 г 1-[2-[4-[(1-бензил)-пиперидил] ] -этил] -7-гидрокси-7-метилпиперазино-[2,3- с] -пирролидин-2-она и раствор нагревают при кипячении с обратным стеканием флегмы в течение 3,5 ч. Легколетучие вещества отгоняют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле (хлористый метилен: метанол = 9: 1), чтобы получить 0,06 г продукта реакции. Его превращают в соответствующий фумарат обычным методом, чтобы получить целевое соединение. Температура плавления: аморфное вещество. Молекулярная формула: C21H24N4O x xC4H4O4.
ЯМР (СДСl3) δ:
1,04-2,20 (9Н, мультиплет), 2,68-3,04 (2Н, мультиплет), 3,48 (2Н, синглет), 3,76-4,04 (2Н, триплет), 5,04-5,12 (1Н, дублет), 5,72-5,80 (1Н, дублет), 7,12-7,40 (5Н, мультиплет), 8,64-8,80 (2Н, два дублета).
Масс-спектр: (М + 1+) = 349.
П р и м е р 13. Хлоргидрат 1-[2-[4-[(1-бензил)-пиперидил] ] -этил] - 4-бензоилпирролидин-2-она.

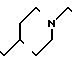



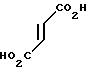
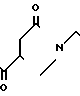
(1) Синтез 1-[2-[4-[(1-бензил)-пиперидил] ] -этил] -пирролидин-2-он- 4-карбоновой кислоты.
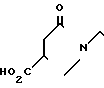

При температуре 150-160оС в течение 2 ч 15 мин расплавляют 12 г итаконовой кислоты и 20 г 4-(2-аминоэтил)-1-бензилпиперидина. Реакционную смесь экстрагируют водой и водный слой промывают хлористым метиленом. Воду отгоняют при пониженном давлении и остаток подвергают азеотропной перегонке с толуолом, чтобы получить 27 г сырой карбоновой кислоты.
(2) Синтез хлоргидрата 1-[2-[4-[(1-бензил)-пиперидил] ] -этил] -4- бензоилпирролидин-2-она:


В 80 мл хлористого метилена растворяют 4,3 г сырой карбоновой кислоты, полученной в вышеприведенном способе (1), и к раствору при комнатной температуре в течение 5 мин добавляют по каплям 5 мл хлористого тионила. Смесь перемешивают в течение дополнительных 10 мин при комнатной температуре и легколетучие вещества отгоняют при пониженном давлении.
Остаток растворяют в 70 мл хлористого метилена и к раствору добавляют 12 мл бензола и охлаждают со льдом. К смеси в течение 5 мин добавляют 5,5 г хлористого алюминия. После перемешивания при комнатной температуре в течение ночи реакционную смесь выливают на лед, подщелачивают с помощью гидроокиси натрия, экстрагируют хлористым метиленом и высушивают над сульфатом магния. Хлористый метилен отгоняют при пониженном давлении и 6 г сырого продукта реакции очищают с помощью колоночной хроматографии на силикагеле (хлористый метилен: метанол = 9: 1), чтобы получить 1 г свободного основания. Его превращают в соответствующий хлоргидрат обычным способом, чтобы получить целевое соединение в виде гигроскопичного аморфного вещества. Температура плавления: аморфное вещество. Молекулярная формула: C25H30N2O2˙HCl. ЯМР (СДСl3) δ:
1,00-4,28 (2ОН, мультиплет), 7,04-6,68 (8Н, мультиплет), 7,72-8,00 (2Н, мультиплет).
Масс-спектр: (М + 1+) = 391.
П р и м е р 14. Хлоргидрат 1-[2-[4-[(1-бензил)-пиперидил] ] -этил] -4-бензилпирроли- дин-2-она.
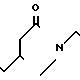




В 10 мл метанола растворяют 0,58 г 1-[2-[4-[(1-бензил)-пиперидил] ] -этил] -4-бензоил- пирролидин-2-она и к раствору при комнатной температуре добавляют 60 мг натрийборогидрида. Смесь перемешивают в течение 10 мин. Метанол отгоняют при пониженном давлении и к остатку добавляют воду. После экстракции хлористым метиленом, за которым следует высушивание над сульфатом магния, отгоняют при пониженном давлении хлористый метилен. Продукт реакции очищают с помощью колоночной хроматографии на силикагеле (хлористый метилен: метанол = 9: 1), чтобы получить 0,41 г спиртового соединения в виде бесцветной, вязкой, маслообразной смеси двух изомеров, которая подвергается последующей реакции без разделения.
В 5 мл пиридина растворяют 0,41 г спиртового соединения, полученного выше, и к раствору при комнатной температуре добавляют 0,22 мл пара-толуилового эфира хлортиономуравьиной кислоты. Смесь перемешивают в течение 3 ч и к смеси добавляют воду. После экстракции этилацетатом, за которым следует высушивание над сульфатом магния, отгоняют при пониженном давлении этилацетат. Продукт реакции очищают с помощью колоночной хроматографии на силикагеле (хлористый метилен: метанол = 95: 5), чтобы получить 0,4 г тиокарбонатного соединения в виде коричневого масла.
В 9 мл толуола растворяют 0,39 г полученного выше тиокарбонатного соединения и к раствору добавляют 0,5 мл гидрида трибутилолова и каталитическое количество 2,2'-азобис-(изобутиронитрила). Смесь нагревают при 70-80оС в течение 8 ч. Толуол отгоняют при пониженном давлении и остаток очищают с помощью колоночной хроматографии на силикагеле (хлористый метиле: метанол = 9: 1), чтобы получить 0,12 г свободного основания. Это основание превращают в его хлоргидрат обычным способом, чтобы получить целевое аморфное соединение. Температура плавления: аморфное вещество. Молекулярная формула: C25H32N2O˙HCl. ЯМР (СДСl3) δ:
1,16-3,48 (20Н, мультиплет), 3,52 (2Н, синглет), 7,00-7,40 (10Н, мультиплет).
Масс-спектр: М+ = 376 (FD).
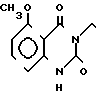
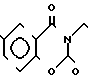
П р и м е р 15. Хлоргидрат 3-[2-[1-(1,3-диоксолан-2-илметил)-4-пиперидин] -этил] -5-метокси-1,2,3,4- тетрагидрохиназолин-2,4-диона.
 ·HCl
·HCl
В 150 мл тетрагидрофурана растворяют 1,8 г 1-(2-амино-6-метоксибензолкарбонил)-имидазола и 2,14 г 1-(1,3-диоксолан-2-ил-метил)-4-(2-амино- этил)-пиперидина и раствор перемешивают при комнатной температуре в течение 2 ч. Затем растворитель отгоняют и остаток растворяют в 100 мл тетрагидрофурана. К раствору добавляют 3,7 г N, N'-карбонилдиимидазола и кипятят с обратным холодильником в течение ночи. Растворитель отгоняют и к остатку добавляют хлористый метилен. Раствор промывают водой и растворитель высушивают над безводным сульфатом магния. После фильтрации, за которым следует перегонка растворителя, полученное масло очищают с помощью колоночной хроматографии на силикагеле, чтобы получить продукт реакции в виде белых кристаллов, который превращают в его хлоргидрат обычным способом, чтобы получить 1,6 г целевого соединения в аморфной форме. Температура плавления: аморфное вещество. Молекулярная формула: C20H27N3O5˙HCl. ЯМР (СДСl3) δ:
1,20-2,20 (9Н, мультиплет), 2,60 (2Н, дублет), 2,98 (2Н, дублет), 3,69-4,20 (6Н, мультиплет), 3,97 (3Н, синглет), 5,03 (1Н, мультиплет), 6,56-6,74 (2Н, мультиплет), 7,50 (1Н, два дублета).
Масс-спектр: (М + 1+) = 390.
П р и м е р 16. Хлоргидрат 3-[2-[1-(1,3-диоксолан-2-илметил)-4-пиперидил] -этил] - 1,2,3,4- тетрагидрохиназолин-2-она.
CH3O

 ·HCl
·HCl
К 1,04 г 1-(1,3-диоксолан-2-илметил)-4-(2-аминоэтил)-пиперидина добавляют 15 мл метанола, чтобы получить раствор, и к этому раствору добавляют раствор 1,47 г 2-амино-5-метоксибензальдегида в 30 мл метанола. Смесь перемешивают при комнатной температуре в течение 0 мин и охлаждают со льдом. К реакционной смеси добавляют по порциям натрийборогидрид, чтобы осуществить восстановление. Растворитель отгоняют и к остатку добавляют воду. После экстракции этилацетатом, за которым следует высушивание над сульфатом магния, отгоняют растворитель и полученное маслянистое вещество растворяют в 30 мл тетрагидрофурана. К раствору добавляют 2,42 г N, N'-карбонилдиимидазола и нагревают при кипячении с обратным стеканием флегмы в течение 2,5 ч. Растворитель отгоняют и полученное маслянистое вещество очищают с помощью колоночной хроматографии на силикагеле. Продукт реакции превращают в его хлоргидрат обычным методом, чтобы получить 0,19 г целевого соединения в виде светло-желтого аморфного вещества.
Температура плавления: аморфное вещество. Молекулярная формула: C20H29N3O5˙HCl.
ЯМР (СДСl3) δ:
1,20-1,38 (3Н, мультиплет), 1,52-1,54 (2Н, уширенный квартет), 1,71 (2Н, уширенный дублет), 2,04 (2Н, триплет, I = = 9,2 Гц), 2,54 (2Н, дублет, I = 4,6 Гц), 2,97 (2Н, уширенный дублет), 3,44 (2Н, триплет, I = 7,4 Гц), 3,66 (3Н, синглет), 3,80-3,84 (2Н, мультиплет), 3,92-3,95 (2Н, мультиплет), 4,99 (1Н, триплет, I = = 4,6 Гц), 6,57 (1Н, дублет, I = 3,2 Гц), 6,62 (1Н, дублет, I = 8,4 Гц), 6,70 (1Н, квартет, I = 3,2 Гц и 8,4 Гц).
Масс-спектр: (М + 1+) = 376.
П р и м е р 17. 3-[2-[1-(1,3-диоксолан-2-илметил)-4-пиперидил] -этил] - 1,2,3,4-тетрагидрохиназолин-2,4-дион.
CH3O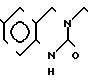
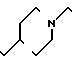
 ·HCl
·HCl
К 0,83 г 1-(1,3-диоксолан-2-илметил)-4-(2-аминоэтил)-пиперидина добавляют 10 мл тетрагидрофурана, чтобы получить раствор и к раствору добавляют 0,93 г 1-(2-амино-5-метоксибензолкарбонил)-имидазола. Смесь перемешивают. К раствору добавляют 1,26 г N, N'-карбонилдиимидазола и смесь нагревают при кипячении с обратным стеканием флегмы в течение 19 ч. Растворитель отгоняют и полученное маслянистое вещество очищают с помощью колоночной хроматографии на силикагеле. Продукт реакции превращают в его хлоргидрат обычным способом, чтобы получить 0,30 г целевого соединения в виде светло-желтого аморфного вещества.
Температура плавления: аморфное вещество. Молекулярная формула: C20H27N3O5˙HCl.
ЯМР (СДСl3) δ:
1,36 (3Н, уширенный синглет), 1,59-1,64 (2Н, мультиплет), 1,76 (2Н, уширенный дублет), 2,05 (2Н, уширенный триплет), 2,53 (2Н, дублет, I = 4,6 Гц), 2,98 (2Н, уширенный дублет), 3,80-3,83 (2Н, мультиплет), 3,83 (3Н, синглет), 3,91-1,93 (2Н, мультиплет), 4,08 (2Н, уширенный триплет), 4,98 (1Н, триплет, I = 4,6 Гц), 7,04 (1Н, дублет, I = 8,8 Гц), 7,18 (1Н, квартет, I = 2,8 Гц и 8,8 Гц), 7,49 (1Н, дублет, I = 2,8 Гц), 11,05 (1Н, уширенный синглет).
Масс-спектр: (М + 1+) = 390.
П р и м е р ы 18-75. Следующие соединения получают таким же образом, что и в примерах от 1 до 17. Арабские цифры относятся к номерам примеров.

 Температура плавление: аморфное вещество. Молекулярная формула: C27H33N3O˙HCl. ЯМР (СДСl3) δ:
Температура плавление: аморфное вещество. Молекулярная формула: C27H33N3O˙HCl. ЯМР (СДСl3) δ:
1,2-2,1 (9Н, мультиплет), 2,31 (4Н, уширенный синглет), 2,78 (4Н, уширенный дублет), 3,41 (2Н, синглет), 3,67 (3Н, синглет), 3,90 (2Н, уширенный триплет), 7,02-7,46 (9Н, мультиплет).
Масс-спектр: М+ = 415 (FD).

 Температура плавления: аморфное вещество. Молекулярная формула: C22H28N2OS˙HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C22H28N2OS˙HCl. ЯМР (СДСl3) δ:
1,18-2,01 (9Н, мультиплет), 2,26-2,30 (4Н, мультиплет), 2,68-2,88 (4Н, мультиплет), 3,41 (2Н, синглет), 3,67 (2Н, уширенный триплет), 6,79 (1Н, дублет, I = 5,7 Гц), 7,00 (1Н, дублет, I = 5,7 Гц), 7,18 (5Н, синглет).
Масс-спектр: М+ = 368 (FD).

 Температура плавления: аморфное вещество. Молекулярная формула: C23H29N3O˙HCl.
Температура плавления: аморфное вещество. Молекулярная формула: C23H29N3O˙HCl.
ЯМР (СДСl3) δ:
1,20-1,86 (9Н, мультиплет), 2,24-2,29 (4Н, мультиплет), 2,59-2,81 (4Н, мультиплет), 3,43 (2Н, сингнет), 4,05 (2Н, уширенный триплет), 7,01 (1Н, два дублета, I = 4,9 Гц и 7,5 Гц), 7,20 (5Н, синглет), 7,46 (1Н, два дублета, I = 1,8 Гц и 7,5 Гц), 8,29 (1Н, два дублета, I = 1,8 Гц и 4,9 Гц).
Масс-спектр: (М + 1+) = 364 (FAB).

 Температура плавления: аморфное вещество. Молекулярная формула: C27H32N4O˙HCl.
Температура плавления: аморфное вещество. Молекулярная формула: C27H32N4O˙HCl.
ЯМР (СДСl3) δ:
1,24-2,04 (11Н, мультиплет), 2,18 (3Н, синглет), 2,83 (2Н, уширенный дублет), 3,37-3,48 (4Н, мультиплет), 3,64 (3Н, синглет), 6,96-7,36 (8Н, мультиплет), 7,62 (1Н, два дублета, I= 2,8 Гц и 5,5 Гц).
Масс-спектр: (М + 1+) = 429 (FAB).

 Температура плавления: 217,6-218,8оС Молекулярная формула: C23H28N2O2˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 217,6-218,8оС Молекулярная формула: C23H28N2O2˙HCl. ЯМР (СДСl3) δ:
1,16-2,04 (11Н, мультиплет), 2,83 (2Н, уширенный дублет), 2,40 (2Н, триплет, I = 7,2 Гц), 2,43 (2Н, синглет), 4,39 (2Н, синглет), 6,88-7,35 (9Н, мультиплет).
Масс-спектр: М+ = 364 (Д1-Е1)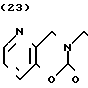


 Температура плавления: аморфное вещество. Молекулярная формула: C21H25N2O3˙2HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C21H25N2O3˙2HCl. ЯМР (СДСl3) δ:
1,28-2,04 (9Н, мультиплет), 2,85 (2Н, уширенный дублет), 2,45 (2Н, синглет), 2,50 (2Н, триплет, i = 7,3 Гц), 4,49 (2Н, синглет), 7,02-7,32 (7Н, мультиплет), 8,24 (1Н, два дублета, I = 2,1 Гц и 4,1 Гц).
Масс-спектр: (М + 1+) = 352 (FAB)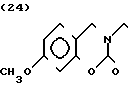
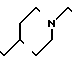

 Температура плавления: 209,5-210,7оС Молекулярная формула: C 23H28N2O3˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 209,5-210,7оС Молекулярная формула: C 23H28N2O3˙HCl. ЯМР (СДСl3) δ:
1,22-2,12 (9Н, мультиплет), 2,89 (2Н, уширенный дублет), 3,48 (2Н, триплет, I= 7,3 Гц, 3,51 (2Н, синглет), 3,76 (3Н, синглет), 4,35 (2Н, синглет), 6,59 (1Н, два дублета, I = 2,8 Гц и 13,1 Гц), 6,94 (1Н, дублет, I = 13,1 Гц), 7,18-7,38 (6Н, мультиплет).
Масс-спектр: (М + 1+) = 381 (FAB).

 Температура плавления: аморфное вещество. Молекулярная формула: C23H28N2O3˙HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C23H28N2O3˙HCl. ЯМР (СДСl3) δ:
1,16-2,12 (9Н, мультиплет), 2,85 (2Н, уширенный дублет), 3,38-3,55 (4Н, мультиплет), 3,83 (3Н, синглет), 4,37 (2Н, синглет), 6,54-7,00 (3Н, мультиплет), 7,24 (5Н, синглет).
Масс-спектр: (М + 1+) = 381 (FAB).

 температура плавления: 209,8-210,9оС (разл. ). Молекулярная формула: С23Н28N2O3˙HCl. ЯМР (СДСl3) δ:
температура плавления: 209,8-210,9оС (разл. ). Молекулярная формула: С23Н28N2O3˙HCl. ЯМР (СДСl3) δ:
1,19-2,11 (9Н, мультиплет), 2,87 (2Н, уширенный дублет), 3,43 (2Н, триплет, I = 7,5 Гц), 3,48 (2Н, синглет), 3,94 (3Н, синглет), 4,35 (2Н, синглет), 6,60 (1Н, два дублета, IK = 2,6 Гц и 9,8 Гц), 6,78 (1Н, дублет, I = 2,6 Гц), 6,91 (1Н, дублет, I = 9,8 Гц), 7,24 (5Н, синглет).
Масс-спектр: (М + 1+) = 381 (FAB)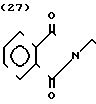


 Температура плавления: аморфное вещество. Молекулярная формула: C23H26N2O˙HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C23H26N2O˙HCl. ЯМР (СДСl3) δ:
1,18-2,11 (9Н, мультиплет), 2,85 (2Н, уширенный дублет), 3,47 (2Н, синглет), 3,76 (2Н, триплет, I = 7,3 Гц), 4,78 (1Н, дублет, I = = 2,3 Гц), 5,14 (1Н, дублет, I = = 2,3 Гц), 7,24 (5Н, синглет), 7,38-7,81 (4Н, мультиплет).
Масс-спектр: (М + 1+) = 347 (FAB)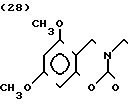


 Температура плавления: аморфное вещество. Молекулярная формула: C24H30N2O4˙HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C24H30N2O4˙HCl. ЯМР (СДСl3) δ:
1,24-2,12 (9Г, мультиплет), 2,88 (2Н, уширенный дублет), 3,38-3,56 (4Н, мультиплет), 3,75 (3Н, синглет), 3,78 (3Н, синглет), 4,24 (2Н, синглет), 6,15 (1Н, уширенный синглет), 7,20-7,30 (6Н, уширенный синглет).
Масс-спектр: (М + 1+) = 441 (FAB)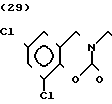
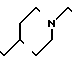
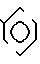

 Температура плавления: 220,5-221,8оС Молекулярная формула: C22H24Cl2N2O2˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 220,5-221,8оС Молекулярная формула: C22H24Cl2N2O2˙HCl. ЯМР (СДСl3) δ:
1,24-2,20 (9Н, мультиплет), 2,95 (2Н, уширенный дублет), 3,36-3,56 (4Н, мультиплет), 4,38 (2Н синглет), 6,96 (1Н, уширенный синглет), 7,29 (6Н, уширенный синглет).
Масс-спектр: (М + 1+) = 419 (FAB).

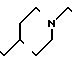
 Температура плавления: аморфное вещество. Молекулярная формула: C21H23Cl2N3O2˙HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C21H23Cl2N3O2˙HCl. ЯМР (СДСl3) δ:
1,20-1,12 (9Н, мультиплет), 2,78 (2Н, уширенный дублет), 3,36-3,53 (4Н, мультиплет), 4,36 (2Н, синглет), 6,92 (1Н, дублет, I = 2,3 Гц), 7,08-7,28 (3Н, мультиплет), 8,41 (2Н, дублет, I = 8,5 Гц).
Масс-спектр: (М + 1+) = 420 (FAB).
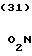
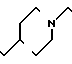

 Температура плавления: 231,1-232,3оС (разл. ). Молекулярная формула: C22H25N3O4˙HCl.
Температура плавления: 231,1-232,3оС (разл. ). Молекулярная формула: C22H25N3O4˙HCl.
ЯМР (СДСl3) δ:
1,16-2,09 (9Н, мультиплет), 2,84 (2Н, уширенный дублет), 2,40-2,56 (4Н, мультиплет), 4,47 (2Н, синглет), 7,06 (1Н, дублет, I = = 9,3 Гц), 7,23 (5Н, синглет), 7,97 (1Н, дублет, I = 2,6 Гц), 8,08 (1Н, два дублета, I = 2,6 Гц и 9,3 Гц).
Масс-спектр: (М + 1+) = 396 (FAB).

 Температура плавления: 225,3-227,1оС (разл. ). Молекулярная формула: C22H25ClN2O2˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 225,3-227,1оС (разл. ). Молекулярная формула: C22H25ClN2O2˙HCl. ЯМР (СДСl3) δ:
1,20-2,08 (9Н, мультиплет), 2,83 (2Н, уширенный дублет), 3,35-3,52 (4Н, мультиплет), 4,33 (2Н, синглет), 6,85 (1Н, дублет, I = = 9,0 Гц), 7,04 (1Н, два дублета, I = 2,8 Гц и 9,0 Гц), 7,22 (6Н, уширенный синглет).
Масс-спектр: (М + 1+) = 385 (FAB).


 Температура плавления: аморфное вещество. Молекулярная формула: C24H30N2O4˙HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C24H30N2O4˙HCl. ЯМР (СДСl3) δ:
1,16-2,12 (9Н, мультиплет), 2,84 (2Н, уширенный синглет), 3,36-3,52 (4Н, мультиплет), 3,81 (6Н, синглет), 4,31 (2Н, синглет), 6,47 (1Н, дублет, I = 1,8 Гц), 7,22 (6Н, уширенный синглет).
Масс-спектр: (М + 1+) = 411 (FAB).
 Температура плавления: 189,1-189,8оС. Молекулярная формула: C21H24N4O4˙2HCl. ЯМР (СДСl3) δ:
Температура плавления: 189,1-189,8оС. Молекулярная формула: C21H24N4O4˙2HCl. ЯМР (СДСl3) δ:
1,21-2,15 (9Н, мультиплет), 2,82 (2Н, уширенный дублет), 3,42-3,62 (4Н, мультиплет), 4,56 (2Н, синглет), 7,06 (1Н, дублет, I = = 8,2 Гц), 7,24 (2Н, дублет, IK = 6,2 Гц), 8,03-8,15 (2Н, мультиплет), 8,44 (2Н, дублет, I = 6,2 Гц).
Масс-спектр: (М + 1+) = 397 (FAB).
 Температура плавления: аморфное вещество. Молекулярная формула: C22H27N3O2˙2HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C22H27N3O2˙2HCl. ЯМР (СДСl3) δ:
1,16-2,07 (9Н, мультиплет), 2,82 (2Н, уширенный дублет), 3,32-3,48 (4Н, мультиплет), 3,92 (2Н, уширенный синглет), 4,24 (2Н, синглет), 6,30 (1Н, дублет, I = 2,3 Гц), 6,46 (1Н, квартет, I = 2,3 Гц и 8,7 Гц), 6,72 (1Н, дублет, I = 8,7 Гц), 7,22 (5Н, уширенный синглет).
Масс-спектр: (М + 1+) = 366 (FAB).
 ONH
ONH 
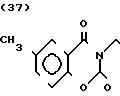
 Температура плавления: аморфное вещество. Молекулярная формула: C24H29N3O3˙HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C24H29N3O3˙HCl. ЯМР (СДСl3) δ:
1,16-2,12 (9Н, мультиплет), 2,14 (3Н, синглет), 2,84 (2Н, уширенный дублет), 3,45 (4Н, уширенный синглет), 4,33 (2Н, синглет), 6,78 (1Н, дублет, I = 9,5 Гц), 7,14-7,28 (6Н, мультиплет), 7,63 (1Н, уширенный синглет), 9,00 (1Н, синглет).
Масс-спектр: (М + 1+) = 408 (FAB).

 Температура плавления: аморфное вещество. Молекулярная формула: C23H26N2O3˙HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C23H26N2O3˙HCl. ЯМР (СДСl3) δ:
1,24-2,12 (9Н, мультиплет), 2,40 (3Н, синглет), 2,86 (2Н, уширенный дублет), 3,47 (2Н, синглет), 4,00 (2Н, уширенный триплет), 7,00-7,44 (7Н, мультиплет), 7,76 (1Н, уширенный синглет).
Масс-спектр: (М + 1+) = 379 (FAB).
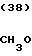
 Температура плавления: 195,1-195,8оС Молекулярная формула: C23H26N2O4˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 195,1-195,8оС Молекулярная формула: C23H26N2O4˙HCl. ЯМР (СДСl3) δ:
1,34 (3Н, уширенный синглет), 1,65 (2Н, уширенный синглет), 1,74 (2Н, уширенный синглет), 1,95 (2Н, уширенный триплет), 2,87 (2Н, уширенный дублет), 3,48 (2Н, синглет), 3,86 (3Н, синглет), 4,05 (2Н, уширенный триплет, I = 2,0 Гц и 7,2 Гц), 7,19 (1Н, дублет, I = 9,4 Гц), 7,24 (1Г, квартет, I = 3,0 Гц, 9,4 Гц), 7,31 (5Н, уширенный синглет), 7,45 (1Н, дублет, I = 3,0 Гц).
Масс-спектр: (М + 1+) = 395 (FAB).


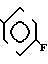
 Температура плавления: 199,5-200,4оС. Молекулярная формула: C22H23FN2O3˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 199,5-200,4оС. Молекулярная формула: C22H23FN2O3˙HCl. ЯМР (СДСl3) δ:
1,34 (3Н, уширенный синглет), 1,63-1,66 (2Н, мультиплет), 1,73-1,77 (2Н, мультиплет), 1,95 (2Н, уширенный триплет), 2,86 (2Н, уширенный дублет), 3,48 (2Н, синглет), 4,04 (2Н, дублет и триплет, I = 4,0 Гц и 5,2 Гц), 7,23-7,28 (6Н, мультиплет), 7,37-7,42 (1Н, мультиплет), 7,71-7,73 (1Н, мультиплет).
Масс-спектр: (М + 1+) = 383 (FAB).
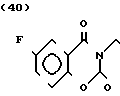
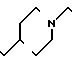
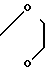
 Температура плавления: 209,4-210,6оС (разл. ). Молекулярная формула: C19H23FN2O5˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 209,4-210,6оС (разл. ). Молекулярная формула: C19H23FN2O5˙HCl. ЯМР (СДСl3) δ:
1,34-1,41 (3Н, мультиплет), 1,60-1,66 (2Н, уширенный квартет), 1,73-1,76 (2Н, уширенный дублет), 2,06 (2Н, триплет, I = = 11,2 Гц), 2,55 (2Н, дублет, I = 4,4 Гц), 2,98 (2Н, уширенный дублет), 3,83-3,86 (2Н, мультиплет), 3,94-3,98 (2Н, мультиплет), 4,02-4,06 (2Н, мультиплет), 4,09 (1Н, триплет, I = 4,4 Гц), 7,25-7,28 (1Н, мультиплет), 7,37-7,42 (1Н, мультиплет), 7,72 (1Н, квартет, I = 2,6 Гц и 7,2 Гц).
Масс-спектр: (М + 1+) = 379 (FAB).

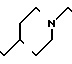
 Температура плавления: 210,5-211,4оС Молекулярная формула: C22H32N2O3˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 210,5-211,4оС Молекулярная формула: C22H32N2O3˙HCl. ЯМР (СДСl3) δ:
1,15-1,20 (2Н, мультиплет), 1,25-1,38 (3Н, мультиплет), 1,51-1,60 (6Н, мультиплет), 1,72-1,78 (4Н, мультиплет), 1,93 (2Н, триплет, I = 9,6 Гц), 2,06 (1Н, мультиплет), 2,25 (2Н, два дублета, I = 2,0 Гц и 7,2 Гц), 2,91 (2Н, уширенный дублет), 3,45-3,49 (2Н, мультиплет), 3,75 (3Н, синглет), 4,38 (2Н, синглет), 6, 58 (1Н, синглет), 6,76 (1Н, дублет, I = 10,0 Гц), 6,91 (1Н, дублет, I = 10,0 Гц).
Масс-спектр: (М + 1+) = 373 (FAB).

 Температура плавления: 206,5-207,8оС Молекулярная формула: C23H34N2O3˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 206,5-207,8оС Молекулярная формула: C23H34N2O3˙HCl. ЯМР (СДСl3) δ:
0,81-0,89 (2Н, мультиплет), 1,09-1,23 (3Н, мультиплет), 1,23-1,35 (2Н, мультиплет), 1,46 (1Н, мультиплет), 1,54-1,76 (10Н, мультиплет), 1,84 (2Н, уширенный триплет), 2,08 (2Н, дублет, IK = 7,2 Гц), 2,84 (2Н, уширенный дублет), 3,49 (2Н, мультиплет), 3,76 (3Н, синглет), 4,41 (2Н, синглет), 6,60 (1Н, дублет, I = 2,8 Гц), 6,78 (1Н, два дублета, I = 2,8 Гц и 8,8 Гц), 6,92 (1Н, дублет, I = 8,8 Гц).
Масс-спектр: (М + 1+) = 387 (FAB).
C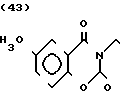

 Температура плавления: 205,9-207,2оС (разл. ). Молекулярная формула: C23H32N2O4˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 205,9-207,2оС (разл. ). Молекулярная формула: C23H32N2O4˙HCl. ЯМР (СДСl3) δ:
0,84-0,92 (2Н, мультиплет), 1,15-1,25 (3Н, мультиплет), 1,36-1,42 (2Н, мультиплет), 1,51 (1Н, мультиплет), 1,63-1,78 (10Н, мультиплет), 1,93 (2Н, триплет, I = 10,6 Гц), 2,15 (2Н, дублет, I = 7,2 Гц), 2,91 (2Н, уширенный дублет), 3,87 (3Н, синглет), 4,06 (2Н, мультиплет), 7,19 (1Н, дублет, I = 8,8 Гц), 7,25 (1Н, два дублета, I = 2,8 Гц и 8,8 Гц), 7,45 (1Н, дублет, I = 2,8 Гц).
Масс-спектр: (М + 1+) = 401 (FAB).



 ·
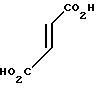
·  Температура плавления: 119,5-120,8оС. Молекулярная формула: C21H26N2O4 x C4H4O4
Температура плавления: 119,5-120,8оС. Молекулярная формула: C21H26N2O4 x C4H4O4
ЯМР (СДСl3) δ:
1,28-1,33 (3Н, мультиплет), 1,58-1,62 (2Н, мультиплет), 1,63-1,75 (2Н, мультиплет), 1,93 (2Н, уширенный триплет), 2,90 (2Н, уширенный дублет), 3,37 (2Н, синглет), 3,50 (2Н, мультиплет), 3,78 (3Н, синглет), 4,41 (2Н, синглет), 6,38 (1Н, два дублета, I = 0,8 Гц и 1,6 Гц), 6,60 (1Н, дублет, I = 2,8 Гц), 6,79 (1Н, два дублета, I = 2,8 Гц и 8,8 Гц), 6,95 (1Н, дублет, I = 8,8 Гц), 7,32 (1Н, два дублета, I = = 0,8 Гц и 1,6 Гц), 7,37 (1Н, триплет, I = 1,6 Гц).
Масс-спектр: (М + 1+) = 371 (FAB).



 Температура плавления: 155,3-156,0оС. Молекулярная формула: C21H24N2O5 x C4H4O4. ЯМР (СДСl3) δ:
Температура плавления: 155,3-156,0оС. Молекулярная формула: C21H24N2O5 x C4H4O4. ЯМР (СДСl3) δ:
1,30-1,43 (3Н, мультиплет), 1,62-1,68 (2Н, мультиплет), 1,76-1,80 (2Н, мультиплет), 1,99 (2Н, уширенный триплет), 2,89 (2Н, уширенный дублет), 3,52 (2Н, синглет), 3,87 (3Н, синглет), 4,04 (2Н, мультиплет), 6,18 (1Н, дублет, I = 3,2 Гц), 6,31 (1Н, два дублета, I = 3,2 Гц и 6,4 Гц), 7,19 (1Н, дублет, I = 8,8 Гц), 7,20-7,28 (2Н, мультиплет), 7,36-7,37 (1Н, мультиплет), 7,45 (1Н, дублет, I = 3,2 Гц).
Масс-спектр: (М + 1+) = 385 (FAB).
 Температура плавления: 162,9-163,6оС. Молекулярная формула: C21H23N2O5 x C4H4O4. ЯМР (СДСl3) δ:
Температура плавления: 162,9-163,6оС. Молекулярная формула: C21H23N2O5 x C4H4O4. ЯМР (СДСl3) δ:
1,30-1,38 (3Н, мультиплет), 1,62-1,66 (2Н, мультиплет), 1,77-1,79 (2Н, мультиплет), 1,94 (2Н, уширенный триплет), 1,90 (2Н, уширенный дублет), 3,37 (2Н, синглет), 3,87 (3Н, синглет), 4,05 (2Н, мультиплет), 6,38 (1Н, уширенный синглет), 7,19 (1Н, дублет, IK = 9,2 Гц), 7,32 (1Н, уширенный синглет), 7,37 (1Н, уширенный синглет), 7,44 (1Н, дублет, I = 2,8 Гц).
Масс-спектр: (М + 1+) = 385 (FAB).
 ·
· Температура плавления: 113,3-113,8оС. Молекулярная формула: C21H26N2O4 x C4H4O4. ЯМР (СДСl3) δ:
Температура плавления: 113,3-113,8оС. Молекулярная формула: C21H26N2O4 x C4H4O4. ЯМР (СДСl3) δ:
1,31-1,38 (3Н, мультиплет), 1,56-1,62 (2Н, мультиплет), 1,73 (2Н, уширенный дублет), 1,97 (2Н, триплет, I = 11,0 Гц), 2,88 (2Н, уширенный дублет), 3,48 (2Н, мультиплет), 3,51 (2Н, синглет), 3,77 (3Н, синглет), 4,40 (2Н, синглет), 6,18 (1Н, дублет, I = 3,2 Гц), 6,30 (1Н, два дублета, I = 2,0 Гц и 3,2 Гц), 6,59 (1Н, дублет, I = 2,8 Гц), 6,79 (1Н, два дублета, I = = 2,8 Гц и 8,8 Гц), 6,93 (1Н, дублет, I = 8,8 Гц), 7,36 (1Н, дублет, I = 2,0 Гц).
Масс-спектр: (М + 1+) = 371 (FAB).
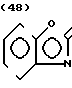 O
O
 Температура плавления: 176,2-176,8оС. Молекулярная формула: C21H24N2O2 x C4H4O4
Температура плавления: 176,2-176,8оС. Молекулярная формула: C21H24N2O2 x C4H4O4
ЯМР (СДСl3) δ:
1,31-1,36 (3Н, мультиплет), 1,69-1,76 (4Н, мультиплет), 1,95 (2Н, уширенный триплет), 2,88 (2Н, уширенный дублет), 3,49 (2Н, синглет), 3,85 (2Н, триплет, I = 7,4 Гц), 6,95 (1Н, дублет, I = 7,6 Гц), 7,10-7,31 (8H, мультиплет).
Масс-спектр: (М + 1+) = 337 (FAB).
 ·HCl Температура плавления: 217,9-219,2оС (разл. ). Молекулярная формула: C20H22N2O2 ˙HCl.
·HCl Температура плавления: 217,9-219,2оС (разл. ). Молекулярная формула: C20H22N2O2 ˙HCl.
ЯМР (СДСl3) δ:
1,72-1,78 (2Н, мультиплет), 1,84-1,94 (2Н, мультиплет), 2,11-2,16 (2Н, мультиплет), 2,99 (2Н, уширенный дублет), 3,52 (2Н, синглет), 4,33 (1Н, мультиплет), 4,39 (2Н, синглет), 7,03 (1Н, дублет, I = 8,0 Гц), 7,10-7,11 (2Н, мультиплет), 7,24-7,33 (6Н, мультиплет).
Масс-спектр: (М + 1+) = 323 (FAB).

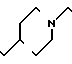
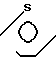 ·
·  Температура плавления: 178,5-179,1оС. Молекулярная формула: C21H26N2O3S x C4H4O4.
Температура плавления: 178,5-179,1оС. Молекулярная формула: C21H26N2O3S x C4H4O4.
ЯМР (СДСl3) δ:
1,28-1,38 (3Н, мультиплет), 1,57-1,61 (2Н, мультиплет), 1,71-1,73 (2Н, мультиплет), 1,98 (2Н, уширенный триплет), 2,91 (2Н, уширенный дублет), 3,48 (2Н, мультиплет), 3,70 (2Н, синглет), 3,76 (3Н, синглет), 4,39 (2Н, синглет), 6,59 (1Н, дублет, I = 1,2 Гц), 6,78 (1Н, два дублета, I = 1,2 Гц и 8,8 Гц), 6,88-6,94 (3Н, мультиплет), 7,20 (1Н, дублет, I = 4,8 Гц).
Масс-спектр: М+ = 386 (Д1-Е1).
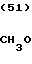
 Температура плавления: 188,3-189,2оС. Молекулярная формула: C21H26N2O3S x C4H4O4.
Температура плавления: 188,3-189,2оС. Молекулярная формула: C21H26N2O3S x C4H4O4.
ЯМР (СДСl3) :
1,24-1,36 (3Н, мультиплет), 1,61-1,63 (2Н, мультиплет), 1,72-1,74 (2Н, мультиплет), 1,92 (2Н, уширенный триплет), 2,89 (2Н, уширенный дублет), 3,48-3,53 (2Н, мультиплет), 3,53 (2Н, синглет), 3,78 (3Н, синглет), 4,41 (2Н, синглет), 6,60 (1Н, дублет, I = 2,8 Гц), 6,79 (1Н, два дублета, I = 2,8 Гц и 8,8 Гц), 6,96 (1Н, дублет, I = 8,8 Гц), 7,05 (1Н, два дублета, I = 0,8 Гц и 5,0 Гц), 7,11 (1Н, уширенный синглет), 7,25-7,27 (1Н, уширенный синглет).
Масс-спектр: М+ = 386 (Д1-Е1).
 C
C
 ·HCl Температура плавления: аморфное вещество. Молекулярная формула: C20H28N2O5˙HCl. ЯМР (СДСl3) δ:
·HCl Температура плавления: аморфное вещество. Молекулярная формула: C20H28N2O5˙HCl. ЯМР (СДСl3) δ:
1,26-1,43 (3Н, мультиплет), 1,59-1,67 (2Н, мультиплет), 1,74 (2Н, уширенный дублет), 2,08 (2Н, триплет), 2,56 (2Н, дублет), 3,00 (2Н, дублет), 3,52 (2Н, триплет), 3,83-3,90 (2Н, мультиплет), 3,86 (3Н, синглет), 3,92-4,00 (2Н, мультиплет), 4,37 (2Н, синглет), 5,00 (1Н, два дублета), 6,63 )2Н, два дублета), 7,21 (1Н, триплет).
Масс-спектр: (М + 1+) = 377 (FAB).
C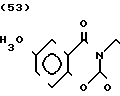
 Температура плавления: 194-195оС. Молекулярная формула: C23H25N2O4F˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 194-195оС. Молекулярная формула: C23H25N2O4F˙HCl. ЯМР (СДСl3) δ:
1,30-1,41 (3Н, мультиплет), 1,62-1,70 (2Н, мультиплет), 1,76 (2Н, уширенный дублет), 1,97 (2Н, триплет), 1,87 (2Н, дублет), 3,48 (2Н, синглет), 3,88 (3Н, синглет), 4,07 (2Н, два дублета), 6,92 (1Н, триплет), 7,03-7,10 (2Н, мультиплет), 7,18-7,29 (3Н, мультиплет), 7,46 (1Н, дублет).
Масс-спектр: (М + 1+) = 413 (FAB).
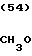
 Температура плавления: 229-230оС. Молекулярная формула: C23H27N2O3F˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 229-230оС. Молекулярная формула: C23H27N2O3F˙HCl. ЯМР (СДСl3) δ:
1,22-1,39 (3Н, мультиплет), 1,58-1,65 (2Н, мультиплет), 1,72 (2Н, уширенный дублет), 1,96 (2Н, триплет), 2,84 (2Н, дублет), 3,46 (2Н, синглет), 3,50 (2Н, триплет), 3,78 (3Н, синглет), 4,41 (2Н, синглет), 6,60 (1Н, дублет), 6,79 (1Н, два дублета), 6,90-6,98 (2Н, мультиплет), 7,02-7,10 (2Н, мультиплет), 7,20-7,30 (1Н, мультиплет).
Масс-спектр: (М + 1+) = 399 (FAB).


 Температура плавления: 100-101oC. Молекулярная формула: C20H28N2O5.
Температура плавления: 100-101oC. Молекулярная формула: C20H28N2O5.
ЯМР (СДСl3) δ:
1,30-1,41 (3Н, мультиплет), 1,60 (2Н, два дублета), 1,72 (2Н, дублет), 2,06 (2Н, триплет), 2,56 (2Н, дублет), 2,98 (2Н, дублет), 3,49 (2Н, два дублета), 3,78 (3Н, синглет), 3,82-4,00 (4Н, мультиплет), 4,41 (2Н, синглет), 5,00 (1Н, триплет), 6,60 (1Н, дублет), 6,79 (1Н, два дублета), 6,95 (1Н, дублет).
Масс-спектр: (М + 1+) = 377 (FAB).

 Температура плавления: 243- 244оС (разл. ). Молекулярная формула: C21H24N2O2˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 243- 244оС (разл. ). Молекулярная формула: C21H24N2O2˙HCl. ЯМР (СДСl3) δ:
1,25-2,48 (7Н, мультиплет), 2,72-3,02 (2Н, мультиплет), 3,32 (2Н, дублет), 3,48 (2Н, синглет), 4,42 (2Н, синглет), 6,98-7,40 (9Н, мультиплет).
Масс-спектр: М+ = 336 (FD).
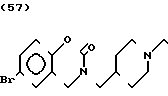

 Температура плавления: 264-265оС (разл. ). Молекулярная формула: C21H23N2O2Br˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 264-265оС (разл. ). Молекулярная формула: C21H23N2O2Br˙HCl. ЯМР (СДСl3) δ:
1,24-2,52 (7Н, мультиплет), 2,80-3,10 (2Н, мультиплет), 3,31 (2Н, дублет), 3,64 (2Н, синглет), 4,38 (2Н, синглет), 6,70-7,40 (8Н, мультиплет).
Масс-спектр: М+ + 1 = 416 (FD).
М+ - 1 = 414 (FD).
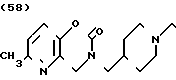

 Температура плавления: 261-263оС (разл. ). Молекулярная формула: C21H25N3O2˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 261-263оС (разл. ). Молекулярная формула: C21H25N3O2˙HCl. ЯМР (СДСl3) δ:
1,16-2,26 (7Н, мультиплет), 2,48 (3Н, синглет), 2,76-3,05 (2Н, мультиплет), 3,32 (2Н, дублет), 3,54 (2Н, синглет), 4,48 (2Н, синглет), 6,92-7,34 (7Н, мультиплет).
Масс-спектр: М+ = 351 (FD).

 Температура плавления: 116-117оС. Молекулярная формула: C20H21N2O2Br˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 116-117оС. Молекулярная формула: C20H21N2O2Br˙HCl. ЯМР (СДСl3) δ:
1,58-2,48 (6Н, мультиплет), 2,84-3,18 (2Н, мультиплет), 3,51 (2Н, синглет), 4,04-4,30 (1Н, мультиплет), 4,32 (2Н, синглет), 6,84 (1Н, дублет), 7,14-7,40 (7Н, мультиплет).
Масс-спектр: М+ - 1 = 402 (FD)
М+ - 1 = 400 (FD).
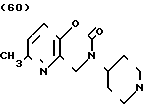

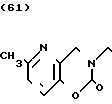
 Температура плавления: 250-252оС (разл. ). Молекулярная формула: C20H23N3O2˙HCl. ЯМР (СДСl3) δ: 1,60-2,40 (6Н, мультиплет), 2,48 (3Н, синглет), 2,84-3,12 (2Н, мультиплет), 3,52 (2Н, синглет), 4,04-4,32 (1Н, мультиплет), 4,41 (2Н, синглет), 6,88-7,16 (2Н, мультиплет), 7,25 (5Н, уширенный синглет).
Температура плавления: 250-252оС (разл. ). Молекулярная формула: C20H23N3O2˙HCl. ЯМР (СДСl3) δ: 1,60-2,40 (6Н, мультиплет), 2,48 (3Н, синглет), 2,84-3,12 (2Н, мультиплет), 3,52 (2Н, синглет), 4,04-4,32 (1Н, мультиплет), 4,41 (2Н, синглет), 6,88-7,16 (2Н, мультиплет), 7,25 (5Н, уширенный синглет).
Масс-спектр: М+ = 337 (FD).

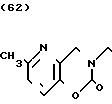
 Температура плавления: 210-213оС (разл. ). Молекулярная формула: C22H27N3O2˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 210-213оС (разл. ). Молекулярная формула: C22H27N3O2˙HCl. ЯМР (СДСl3) δ:
1,16-2,15 (9Н, мультиплет), 2,48 (3Н, синглет), 2,70-2,96 (2Н, мультиплет), 3,45 (3Н, синглет), 3,47 (2Н, триплет), 4,44 (2Н, синглет), 6,80-7,40 (7Н, мультиплет).
Масс-спектр: М + 1+ = 366 (FAB).


Температура плавления: 183-184оС (разл. ). Молекулярная формула: C21H26N4O2 x 3/2C4H4O4.
ЯМР (СДСl3) δ:
1,08-2,20 (9Н, мультиплет), 2,49 (3Н, синглет), 2,64-2,96 (2Н, мультиплет), 3,44 (2Н, синглет), 3,50 (3Н, триплет), 4,47 (2Н, синглет), 6,88-7,30 (4Н, мультиплет), 8,44 (2Н, дублет).
Масс-спектр: М+ + 1 = 367 (FAB).
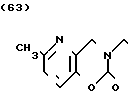
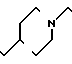
 Температура плавления: 111оС. Молекулярная формула: C19H27N3O4.
Температура плавления: 111оС. Молекулярная формула: C19H27N3O4.
ЯМР (СДСl3) δ:
1,27-1,80 (7Н, мультиплет), 2,08 (2Н, триплет), 2,53 (3Н, синглет), 2,57 (2Н, дублет), 2,99 (2Н, дублет), 3,55 (2Н, триплет), 3,80-4,04 (4Н, мультиплет), 4,51 (2Н, синглет), 5,00 (1Н, триплет), 7,06 (1Н, дублет), 7,24 (1Н, дублет).
Масс-спектр: М+ + 1 = 362 (FAB).
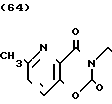

 ·HCl температура плавления: 70оС. Молекулярная формула: C22H25N3O3˙ HCl. ЯМР (СДСl3) δ:
·HCl температура плавления: 70оС. Молекулярная формула: C22H25N3O3˙ HCl. ЯМР (СДСl3) δ:
1,24-1,40 (3Н, мультиплет), 1,62-1,84 (4Н, мультиплет), 1,88-2,05 (2Н, триплет), 2,70 (3Н, синглет), 2,87 (2Н, дублет), 3,48 (2Н, синглет), 4,09 (2Н, триплет), 7,20-7,36 (5Н, мультиплет, 7,48 (1Н, дублет), 7,53 (1Н, дублет).
Масс-спектр: М+ + 1 = 380 (FAB).

 N
N
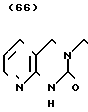
 ·HCl Температура плавления: 233-235оС. Молекулярная формула: C23H26N2O2˙ HCl. ЯМР (СДСl3) δ:
·HCl Температура плавления: 233-235оС. Молекулярная формула: C23H26N2O2˙ HCl. ЯМР (СДСl3) δ:
1,44-2,28 (6Н, мультиплет), 2,60-3,08 (4Н, мультиплет), 3,22-4,24 (6Н, мультиплет), 7,12-7,72 (8Н, мультиплет), 7,76-8,00 (2Н, мультиплет).
Масс-спектр: (М + 1+) = 363 (FAB).

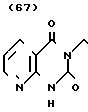
 Температура плавления: 158-160оС (разл. ). Молекулярная формула: С18H26N4O3 x C4H4O4
Температура плавления: 158-160оС (разл. ). Молекулярная формула: С18H26N4O3 x C4H4O4
ЯМР (СДСl3) δ:
1,20-1,40 (3Н, мультиплет), 1,47-1,60 (2Н, мультиплет), 1,65-1,78 (2Н, мультиплет), 2,00-2,13 (2Н, уширенный триплет), 2,53-2,78 (2Н, дублет), 2,93-3,03 (2Н, дублет), 3,40-3,50 (2Н, мультиплет), 3,80-4,00 (4Н, мультиплет), 4,41 (2Н, синглет), 4,98 (1Н, триплет), 6,90-6,87 (1Н, два дублета), 7,31-7,37 (1Н, мультиплет), 8,20-8,27 (1Н, мультиплет), 9,08 (1Н, синглет).
Масс-спектр: (М + 1+) = 347 (FAB).

 Температура плавления: 262-263оС (разл. ). Молекулярная формула: C18H24N4O4˙2HCl. ЯМР (СДСl3) δ:
Температура плавления: 262-263оС (разл. ). Молекулярная формула: C18H24N4O4˙2HCl. ЯМР (СДСl3) δ:
1,30-1,45 (2Н, мультиплет), 1,50-1,85 (5Н, мультиплет), 2,00-2,15 (2Н, уширенный триплет), 2,52-2,60 (2Н, дублет), 2,95-3,05 (2Н, уширенный дублет), 3,80-4,15 (6Н, мультиплет), 5,01 (1Н, триплет), 7,20-7,27 (1Н, мультиплет), 8,42-8,47 (1Н, мультиплет), 8,70-8,75 (1Н, мультиплет), 10,96 (1Н, уширенный синглет),
Масс-спектр: (М + 1+) = 361 (FAB).
 Температура плавления: 166-168оС. Молекулярная формула: C19H24N4O6˙HCl. ЯМР (СДСl3) δ:
Температура плавления: 166-168оС. Молекулярная формула: C19H24N4O6˙HCl. ЯМР (СДСl3) δ:
1,23-1,45 (2Н, мультиплет), 1,50-1,80 (5Н, мультиплет), 2,00-2,13 (2Н, уширенный триплет), 2,53-2,60 (2Н, дублет), 2,95-3,05 (2Н, уширенный дублет), 3,80-4,15 (6Н, мультиплет), 5,00 (1Н, триплет), 7,34 (1Н, триплет), 8,50-8,55 (1Н, два дублета), 8,55-8,60 (1Н, два дублета), 10,43 (1Н, уширенный синглет).
Масс-спектр: (М + 1+) = 405 (FAB).
 ·2HCl Температура плавления: 235-238оС 9разл. ). Молекулярная формула: C21H22F2N4O2˙2HCl. ЯМР (СДСl3/CД3OД) δ:
·2HCl Температура плавления: 235-238оС 9разл. ). Молекулярная формула: C21H22F2N4O2˙2HCl. ЯМР (СДСl3/CД3OД) δ:
ЯМР (СДСl3 :
1,08-2,24 (9Н, мультиплет), 2,64-3,04 (2Н, мультиплет), 3,48 (2Н, синглет), 3,92-4,24 (2Н, мультиплет), 6,52-7,00 (3Н, мультиплет), 7,12-7,40 (1Н, два дублета), 8,32-8,52 (1Н, два дублета), 8,56-8,72 (1Н, два дублета).
Масс-спектр: (М + 1+) = 401 (FAB).


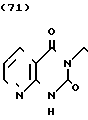
 Температура плавления: 245-247оС (разл. ). Молекулярная формула: C23H26N4O2˙2HCl. ЯМР (СДСl3) δ:
Температура плавления: 245-247оС (разл. ). Молекулярная формула: C23H26N4O2˙2HCl. ЯМР (СДСl3) δ:
1,08-2,24 (9Н, мультиплет), 2,76-3,28 (4Н, мультиплет), 3,80-4,20 (2Н, мультиплет), 6,04-6,64 (2Н, мультиплет), 7,00-7,40 (6Н, мультиплет), 8,24-8,48 (1Г, два дублета), 8,56-8,76 (1Н, два дублета).
Масс-спектр: (М + 1+) = 391 (FAB) .
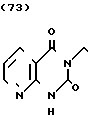
 ·
· Температура плавления: 182-184оС. Молекулярная формула: C20H23N5O2 x C4H4O4
Температура плавления: 182-184оС. Молекулярная формула: C20H23N5O2 x C4H4O4
ЯМР (СДСl3) δ:
1,08-2,28 (9Н, мультиплет), 2,64-3,00 (2Н, мультиплет), 3,44 (2Н, синглет), 3,84-4,20 (2Н, мультиплет), 7,00-7,36 (3Н, мультиплет), 8,24-8,80 (4Н, мультиплет).
Масс-спектр: (М + 1+) = 366 (FAB).

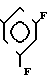
 ·2HCl Температура плавления: 220оС (разл. ). Молекулярная формула: C21H23FN4O2 ˙2HCl.
·2HCl Температура плавления: 220оС (разл. ). Молекулярная формула: C21H23FN4O2 ˙2HCl.
ЯМР (СДСl3) δ:
1,04-2,24 (9Н, мультиплет), 2,68-3,04 (2Н, мультиплет), 3,44 (2Н, синглет), 3,88-4,24 (2Н, мультиплет), 6,76-7,36 (5Н, мультиплет), 8,28-8,48 (1Н, два дублета), 8,60-8,76 (1Н, мультиплет). Масс-спектр: (М + 1+) = 383 (FAB).
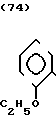
 Температура плавления: 220-222оС (разл. ). Молекулярная формула: C21H24N4O2˙2HCl. ЯМР (СДСl3) δ:
Температура плавления: 220-222оС (разл. ). Молекулярная формула: C21H24N4O2˙2HCl. ЯМР (СДСl3) δ:
1,00-2,20 (9Н, мультиплет), 2,60-3,00 (2Н, мультиплет), 3,44 (2Н, синглет), 3,88-4,20 (2Н, мультиплет), 7,08-7,36 (6Н, мультиплет), 8,28-8,48 (1Н, два дублета), 8,60-8,76 (1Н, два дублета).
Масс-спектр: (М + 1+) = 365 (FAB).
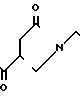
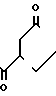 N
N
 ·HCl Температура плавления: аморфное вещество. Молекулярная формула: C27H34N2O3˙HCl. ЯМР (СДСl3) δ:
·HCl Температура плавления: аморфное вещество. Молекулярная формула: C27H34N2O3˙HCl. ЯМР (СДСl3) δ:
1,04-2,20 (12Н, мультиплет), 2,56-3,00 (4Н, мульттиплет), 3,12-3,80 (6Н, мультиплет), 3,88-4,32 (3Н, мультиплет), 6,72-7,72 (9Н, мультиплет).
Масс-спектр: М+ = 434 (FD).

 Температура плавления: аморфное вещество. Молекулярная формула: C27H34N2O3˙HCl. ЯМР (СДСl3) δ:
Температура плавления: аморфное вещество. Молекулярная формула: C27H34N2O3˙HCl. ЯМР (СДСl3) δ:
1,00-2,40 (12Н, мультиплет), 2,48-3,04 (4Н, мультиплет), 3,08-4,28 (9Н, мультиплет), 6,80-7,00 (2Н, дублет), 7,08-7,36 (5Н, мультиплет), 7,72-7,96 (2Н, дублет).
Масс-спектр: М+ = 434 (FD).

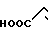
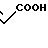 Температура плавления: 138,8-139,2оС. Молекулярная формула: C21H28N2O5 x C4H4O4.
Температура плавления: 138,8-139,2оС. Молекулярная формула: C21H28N2O5 x C4H4O4.
ЯМР (СДСl3) δ:
1,30-1,60 (7Н, мультиплет), 1,61-1,68 (2Н, мультиплет), 1,75-1,79 (2Н, мультиплет), 1,82-2,09 (2Н, мультиплет), 1,94-2,08 (3Н, мультиплет), 2,41-2,52 (2Н, мультиплет), 2,99-3,06 (2Н, мультиплет), 3,87 (3Н, синглет), 4,03-4,08 (2Н, мультиплет), 7,19 (1Н, дублет, I = 9,0 Гц), 7,25 (1Н, два дублета, I = = 3,0 Гц и 9,0 Гц), 7,45 (1Н, дублет, I = 3,0 Гц).
Масс-спектра: М+ = 389 (FAB).


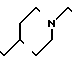
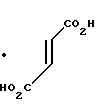
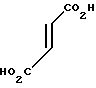
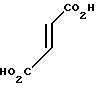
 · HOOC
· HOOC
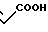 Температура плавления: 152-152,8оС. Молекулярная формула: C21H30N2O4 x C4H4O4
Температура плавления: 152-152,8оС. Молекулярная формула: C21H30N2O4 x C4H4O4
ЯМР (СДСl3) δ:
1,30-2,10 (13Н, мультиплет), 2,18-2,51 (2Н, мультиплет), 3,01 (2Н, уширенный триплет), 3,49 (2Н, мультиплет), 3,70-3,68 (1Н, мультиплет), 3,77 (3Н, синглет), 3,82-3,88 (1Н, мультиплет), 4,01-4,08 (1Н, мультиплет), 4,41 (2Н, синглет), 6,64-6,84 (2Н, мультиплет), 6,94-6,96 (1Н, мультиплет).
Масс-спектр: М+ = 375 (FAB).

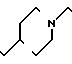
 ·
· 
 COOH Температура плавления: 171,8-172,2оС. Молекулярная формула: C22H28N2O4.
COOH Температура плавления: 171,8-172,2оС. Молекулярная формула: C22H28N2O4.
ЯМР (СДСl3) δ:
1,31-1,38 (3Н, мультиплет), 1,58-1,68 (4Н, мультиплет), 1,86-2,00 (2Н, мультиплет), 2,01 (3Н, синглет), 2,88 (2Н, уширенный дублет), 3,46 (2Н, синглет), 3,50 (2Н, уширенный триплет), 3,78 (3Н, синглет), 4,40 (2Н, синглет), 6,60 (1Н, дублет, I = 2,8 Гц), 6,72 (1Н, дублет, I= 1,4 Гц), 6,79 (1Н, два дублета, I = = 2,8 Гц и 9,0 Гц), 6,95 (1Н, дублет, I = 9,0 Гц), 7,28 (1Н, дублет, I = 1,4 Гц).
Масс-спектр: М+ = 385 (FAB).

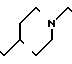
 · HOOC
· HOOC
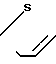
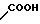 Температура плавления: 190,2-190,8оС. Молекулярная формула: C21H24N2O4S x C4H4O4.
Температура плавления: 190,2-190,8оС. Молекулярная формула: C21H24N2O4S x C4H4O4.
ЯМР (СДСl3) δ:
1,32-1,38 (3Н, мультиплет), 1,62-1,66 (2Н, мультиплет), 1,72-1,79 (2Н, мультиплет), 1,99 (2Н, уширенный триплет), 292 (2Н, уширенный дублет), 3,71 (2Н, синглет), 3,87 (3Н, синглет), 4,02-4,05 (2Н, мультиплет), 6,88-6,90 (1Н, мультиплет), 7,18-7,26 (4Н, мультиплет), 7,43-7,46 (1Н, мультиплет).
Масс-спектр: М+ = 101 (FAB).

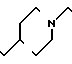
 ·
· 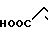
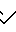 COOH Температура плавления: 197,2-198,0оС. Молекулярная формула: C21H24N2O4S x C4H4O4.
COOH Температура плавления: 197,2-198,0оС. Молекулярная формула: C21H24N2O4S x C4H4O4.
ЯМР (СДСl3) :
1,33-1,38 (3Н, мультиплет), 1,62-1,67 (2Н, мультиплет), 1,75-1,78 (2Н, мультиплет), 1,95 (2Н, уширенный триплет), 2,89 (2Н, уширенный дублет), 3,52 (2Н, синглет), 3,87 (3Н, синглет), 4,04-4,07 (2Н, мультиплет), 7,05 (1Н, дублет, I = 4,8 Гц), 7,10 (1Н, уширенный синглет), 7,19 (1Н, дублет, I = 8,8 Гц), 7,23-7,27 (2Н, мельтиплет), 7,45 (1Н, дублет, I = = 2,8 Гц).
Масс-спектр: М+ = 401 (FAB).
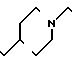
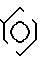
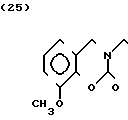
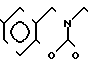
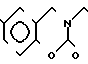
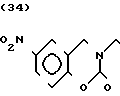
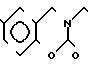
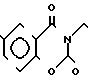
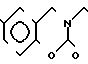
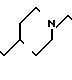
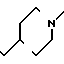
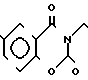
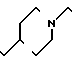
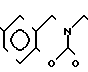
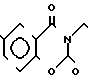
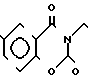
П р и м е р 81. Фумарат[(N-бензил-N-метил)-5-аминопентил] -6-метокси-2Н-3,4-ди- гидро- 1,3-бензоксазин-2-она:
CH3O 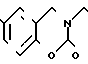





К 1,62 г 1-бензил-1-метил-1,5-диаминопентана добавляют 10 мл метанола, чтобы получить раствор, который перемешивают при комнатной температуре. К раствору добавляют 0,98 мл 5-метоксисалицилового альдегида и раствор перемешивают как таковой в течение 20 мин. Реакционную смесь охлаждают со льдом и добавляют малыми порциями к смеси натрийборогидрид до тех пор, пока реакционная жидкость не окажется бледно-желтой. После перемешивания при комнатной температуре в течение дополнительных 30 мин, растворитель отгоняют. К смеси добавляют насыщенный водный раствор бикарбоната натрия и этилацетата и раствор тщательно перемешивают. Образующийся таким образом органический слой отделяют. Водный слой экстрагируют эталацетатом. Органический слой и экстракт объединяют вместе и промывают насыщенным водным раствором обычной соли. После высушивания над сульфатом магния отгоняют растворитель. К остатку добавляют 30 мл тетрагидрофурана, чтобы получить раствор. К раствору добавляют 1,91 г N, N-карбонилдиимидазола, и полученный раствор нагревают при кипячении с обратным стеканием флегмы в течение 3 ч. Растворитель отгоняют. Полученный таким образом маслянистый продукт реакции очищают с помощью колоночной хроматографии на силикагеле, чтобы получить 1,44 г бесцветного маслянистого продукта реакции, который растворяют в метаноле. К раствору добавляют раствор 0,45 г фумаровой кислоты в метаноле. Растворитель отгоняют, чтобы получить 1,89 г названного выше соединения в виде бесцветного аморфного вещества. Температура плавления: аморфное вещество. Молекулярная формула: C22H28N2O3 x C4H4O4.
ЯМР (СДСl3) δ:
1,33-1,41 (2Н, мультиплет), 1,52-1,70 (4Н, мультиплет), 2,18 (3Н, синглет), 2,36 (2Н, триплет, I = 7,4 Гц), 3,45 (2Н, триплет, I = = 7,6 Гц), 3,47 (2Н, синглет), 3,73 (3Н, синглет), 4,41 (2Н, синглет), 6,59 (1Н, дублет, I = 2,8 Гц), 6,80 (1Н, два дублета, I = 2,8 Гц и 8,8 Гц), 6,96 (1Н, дублет, I = 8,8 Гц), 7,21-7,30 (5Н, мультиплет).
Масс-спектр: М+ = 369 (FAB).
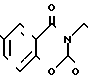
П р и м е р 82. Фумарат [(N-бензил-N-метил)-5-аминопентил] -6-метокси-2Н-3,4-ди-гидро-1,3- бензоксазин-2,4-диона.
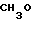



 ·
·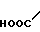
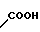
К 1,57 г 2-метоксиметил-5-метоксибензойной кислоты добавляют 10 мл тетрагидрофурана, чтобы получить раствор. К раствору добавляют 1,91 г N, N-карбонилдиимидазола и полученный раствор перемешивают при комнатной температуре в течение 15 мин. Раствор 1,43 г 1-бензил-1-метил-1,5-диаминопентана в 5 мл тетрагидрофурана добавляют к смеси. После перемешивания в течение дополнительных 13 ч отгоняют растворитель. Остаток охлаждают со льдом и к смеси добавляют 8,3 мл 5 н. соляной кислоты и 5 мл метанола. Полученный раствор перемешивают при комнатной температуре в течение 4,5 ч. Метанол отгоняют при пониженном давлении и остаток охлаждают со льдом. рН реакционной смеси доводят до 8 с помощью бикарбоната натрия. После экстракции этилацетатом два раза, за которым следует промывание насыщенным водным раствором обычной соли и высушивание над сульфатом магния, отгоняет растворитель. К остатку добавляют 30 тетрагидрофурана, чтобы получить раствор. К раствору добавляют 2,24 г N, N-карбонилдиимидазола и полученный раствор нагревают при кипячении с обратным стеканием флегмы в течение 16 ч. Растворитель отгоняют. Полученный таким образом маслянистый продукт реакции очищают с помощью колоночной хроматографии на силикагель, чтобы получить 2,16 г бесцветного маслянистого продукта реакции, который растворяют в пентаноле. К раствору добавляют раствор 0,66 г фумаровой кислоты в метаноле. Растворитель отгоняют, чтобы получить 2,82 г названного соединения в виде бесцветного аморфного вещества. Температура плавления: аморфное вещество. Молекулярная формула: C22H26N2O4 x C4H4O4.
ЯМР (СДСl3) δ:
1,40 (2Н, уширенный квинтет), 1,57 (2Н, уширенный квинтет), 1,72 (2Н, уширенный квинтет), 2,17 (3Н, синглет), 2,37 (2Н, триплет, I = 7,2 Гц), 3,47 (2Н, синглет), 3,87 (3Н, синглет), 4,03 (2Н, триплет, I = 7,6 Гц), 7,18-7,44 (8Н, мультиплет).
Масс-спектр: М+ = 383 (FAB).
(М + 1+).
П р и м е р ы 83-87. Перечисленные ниже соединения получают таким же образом, что и в Примерах 81 и 82.
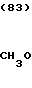

 · HOOC
· HOOC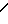
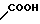 Температура плавления: аморфное вещество. Молекулярная формула: C18H26N2O5 x C4H4O4.
Температура плавления: аморфное вещество. Молекулярная формула: C18H26N2O5 x C4H4O4.
ЯМР (СДСl3) δ:
1,49-1,74 (4Н, мультиплет), 2,32 (3Н, синглет), 2,48 (2Н, триплет, I = 7,2 Гц), 2,57 (2Н, дублет, I = 4,5 Гц), 3,48 (2Н, триплет, I = 7,6 Гц), 3,78 (3Н, синглет), 3,81-3,84 (2Н, мультиплет), 3,86-3,89 (2Н, мультиплет), 4,43 (2Н, синглет), 4,95 (1Н, триплет, I = 4,5 Гц), 6,59 (1Н, дублет, I = 3,2 Гц), 6,79 (1Н, два дублета, I = 3,2 Гц и 8,8 Гц), 6,96 (1Н, дублет, I = 8,8 Гц).
Масс-спектр: М+ = 351 (FAB)
(М + 1+)



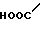
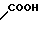 Температура плавления: аморфное вещество. Молекулярная формула: C21H26N2O2 x C4H4O4.
Температура плавления: аморфное вещество. Молекулярная формула: C21H26N2O2 x C4H4O4.
ЯМР(СДСl3) δ:
1,03 (3Н, триплет, I= 7,2 Гц), 1,51 (2Н, квинтет, I = 7,6 Гц), 1,66 (2Н, квинтет, I = 7,6 Гц), 2,46 (2Н, триплет, I = 7,2 Гц), 2,50 (2Н, квартет, I = 7,5 Гц), 3,42 (2Н, триплет, I = 7,6 Гц), 3,54 (2Н, синглет), 4,39 (2Н, синглет), 6,99-7,11 (4Н, мультиплет), 7,19-7,32 (5Н, мультиплет).
Масс-спектр: М+ = 339 (FAB).
(М + 1+).
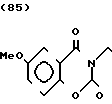

 ·
·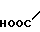
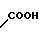 Температура плавления: аморфное вещество.
Температура плавления: аморфное вещество.
Молекулярная формула: C21H26N2O5 x C4H4O4.
ЯМР (СДСl3) δ:
1,06 (3Н, триплет, I = 7,2 Гц), 1,37 (2Н, квинтет, I = 7,2 Гц), 1,45-1,58 (2Н, мультиплет), 1,72 (2Н, квинтет, I = 7,5 Гц), 2,43 (2Н, триплет, I = 7,6 Гц), 2,51 (2Н, квартет, I = 7,2 Гц), 3,64 (2Н, синглет), 3,87 (3Н, синглет), 4,03 (2Н, триплет, IK = 7,5 Гц), 6,15 (1Н, дублет, I = 3,0 Гц), 6,30 (1Н, два дублета, I = 3,2 Гц и 2,0 Гц), 7,20 (1Н, дублет, I = 8,8 Гц), 7,25 (1Н, два дублета, I = 3,0 Гц и 8,8 Гц), 7,34-7,36 (1Н, мультиплет), 7,46 (1Н, дублет, I = 3,2 Гц).
Масс-спектр: М+ = 387 (FAB)
(М + 1+)


 ·
·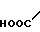
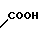 Температура плавления: аморфное вещество. Молекулярная формула: C21H27ClN2О2S x C4H4O4.
Температура плавления: аморфное вещество. Молекулярная формула: C21H27ClN2О2S x C4H4O4.
ЯМР (СДСl3) δ:
1,05 (3Н, триплет, I = 7,1 Гц), 1,33-1,38 (4Н, мультиплет), 1,45-1,53 (2Н, мультиплет), 1,62-1,70 (2Н, мультиплет), 2,43 (2Н, триплет, I = 7,4 Гц), 2,53 (2Н, квартет, I = 7,1 Гц), 3,45 (2Н, триплет, I = 7,6 Гц), 3,79 (2Н, синглет), 4,42 (2Н, синглет), 6,80 (3Н, мультиплет), 7,07-7,10 (1Н, мультиплет), 7,18-7,24 (2Н, мультиплет).
Масс-спектр: М+ = 407 (FAB)
(М + 1+).
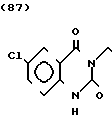

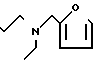

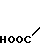
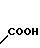 Температура плавления: аморфное вещество Молекулярная формула: C20H24ClN3O3х хC4H4O4
Температура плавления: аморфное вещество Молекулярная формула: C20H24ClN3O3х хC4H4O4
ЯМР (СДСl3) δ:
1,05 (3Н, триплет, I = 7,2 Гц), 1,39 (2Н, уширенный квинтет), 1,56 (2Н, уширенный квинтет), 1,72 (2Н, уширенный квинтет), 2,33 (2Н, триплет, I = 7,2 Гц), 2,51 (2Н, квартет, I = 7,2 Гц), 3,64 (2Н, синглет), 4,06 (2Н, триплет, I = 7,6 Гц), 6,15 (1Н, дублет, I = 3,4 Гц), 6,29 (1Н, два дублета, I = 2,0 Гц и 3,4 Гц), 7,05 (1Н, дублет, I = 8,8 Гц), 7,35 (1Н, два дублета, I = 0,8 Гц и 2,0 Гц), 7,54 (1Н, два дублета, I = = 2,3 Гц и 8,8 Гц), 8,10 (1Н, дублет, I = 2,3 Гц).
Масс-спектр: М+ = 390 (FAB)
(М + 1+). (56) Ellman G. L. et al. Biochem Pharmacol, 1961, v. 7, р. 88-95.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИНДОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2045518C1 |
| ПРОИЗВОДНЫЕ 4,5,6,7-ТЕТРАГИДРОБЕНЗИМИДАЗОЛА | 1991 |
|
RU2033414C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРЕДУПРЕЖДЕНИЯ И УСТРАНЕНИЯ ТРОМБОЗОВ | 1992 |
|
RU2103276C1 |
| ПРОИЗВОДНЫЕ ГЛИЦЕРИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1989 |
|
RU2040521C1 |
| ПРОИЗВОДНОЕ БЕНЗОТИАЗОЛА ИЛИ ЕГО ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1992 |
|
RU2041216C1 |
| ПРОИЗВОДНЫЕ ПИРРОЛО(2,1-b)ТИАЗОЛА И ПРОИЗВОДНЫЕ 2-ТИОКСОПИРРОЛИДИНА В КАЧЕСТВЕ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ДЛЯ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРРОЛО(2,1-b)ТИАЗОЛА | 1991 |
|
RU2026288C1 |
| ФУНГИЦИДНЫЕ ПРОИЗВОДНЫЕ ОКСЕТАНА И ИХ СОЛИ | 1992 |
|
RU2044736C1 |
| ПРОИЗВОДНОЕ СКОНДЕНСИРОВАННОГО ПИРАЗИНА | 1991 |
|
RU2095352C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦЕФЕМА | 1989 |
|
RU2007408C1 |
| ПРОИЗВОДНЫЕ ИНДОЛИЛПИПЕРИДИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1991 |
|
RU2039056C1 |
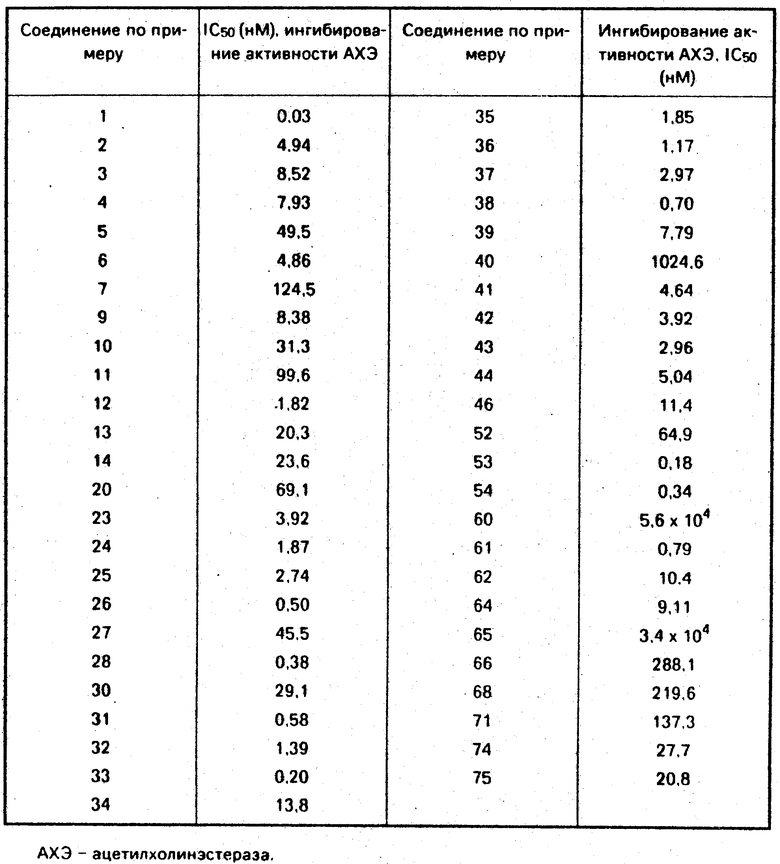
Использование: в медицине, в частности в качестве веществ с антиацетилхолинэстеразной активностью. Сущность изобретения: продукт - производные циклического амида ф-лы 1 R1-(CH2)n-Z, где R1 - одна из групп - 2Н-3,4-дигидро-1,3-бензоксазин-2-он, 2Н-3,4-дигидро-1,3-бензоксазин-2,4-дион, 1,2,3,4-тетрагидрохиназолин-2,4-дион, 1,2,3,4-тетрагидрохиназолин-2-он, 1,2,3,4-тетрагидропиридо[3,2-d] пиримидин-2,4-дион, 1,2,3,4-тетрагидропиридо[3,2-d] пиримидин-2-он, 1,2,3,4-тетрагидроптеридин-2,4-дион, пирролидин-2-он, 1,2,3,4-тетрагидроптеридин-2-он, 5Н-6,7,8,9-тетрагидропиридо[3,2-b] азепин-6-он, 9Н-5,6,7,8-тетрагидропиридо[3,2-b] азепин-8-он, 2Н-3,4-дигидропиридо[3,2-е] -1,3-азепин-2-тион или -2-он, пирролидино[3,4-b] пиразин-5-он, 1Н-2,3,4,5-тетрагидроазепино[3,2-b] индол-2-он, 8Н-4,5,6,7-тетрагидроазепино[3,2-b] тиофен-7-он, 4Н-пиразоло[5,4-е] бензазепин-9-он, изоиндолин-1,3-дион, бензаксазолин-2-он, возможно замещенный низшим алкилои, алкокси, галоидом, нитро, карбокси, бензолом или бензоилом; n = 0, 1 - 6; Z - группа ф-лы 2 или 3 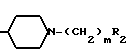 (2) или
(2) или 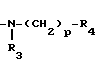 (3), где R2 - фенил, возможно галоидфенил, C5-C6-циклоалкил или радикал пиридина, диоксолана, фурана, тетрагидрофурана, метилфурана или тиофена; m-1 - 3; R3 - низший алкил; R4 - фенил или радикал диоксолана, фурана или тиофена; p = 1, при условии, что при R1 - 1,2,3,4-тетрагидрохиназол-2-он или -2,4-дион, R2 и R4 не являются ни фенилом, ни галогенфинилом, или их фармакологически приемлемых солей. 1 табл.
(3), где R2 - фенил, возможно галоидфенил, C5-C6-циклоалкил или радикал пиридина, диоксолана, фурана, тетрагидрофурана, метилфурана или тиофена; m-1 - 3; R3 - низший алкил; R4 - фенил или радикал диоксолана, фурана или тиофена; p = 1, при условии, что при R1 - 1,2,3,4-тетрагидрохиназол-2-он или -2,4-дион, R2 и R4 не являются ни фенилом, ни галогенфинилом, или их фармакологически приемлемых солей. 1 табл.
Производные циклического амида общей формулы
R1 - (CH2)n - Z,
где R1 - группа циклического амида, такого, как 2H - 3,4 - дигидро - 1,3 - бензоксазин - 2 - она, 2H - 3,4 - дигидро - 1,3 - бензоксазин - 2,4 - диона, 1,2,3,4 - тетрагидрохиназолин - 2,4 - диона, 1,2,3,4 - тетрагидрохиназолин - 2 - она, 1,2,3,4 - тетрагидропиридо (3,2 - d)пиримидин - 2,4 - диона, 1,2,3,4 - тетрагидропиридо (3,2 - d)пиримидин - 2 - она, 1,2,3,4 - тетрагидроптеридин - 2,4 - диона, пирролидин - 2 - она, 1,2,3,4 - тетрагидроптеридин - 2 - она, 5H - 6,7,8,9 - тетрагидропиридо(3,2 - b)азепин - 6 - она, 9H - 5,6,7,8 - тетрагидропиридо(2,3 - b)азепин - 8 - она, 2H - 3,4 - дигидропиридо(2,3 - e) - 1,3 - оксазин - 2 - тиона или 2 - она, пирролидино (3,4-- b) пиразин - 5 - она, 1H - 2,3,4,5 - тетрагидроазепино (2,3 - b)индол - 2 - она, 8H - 4,5,6,7 - тетрагидроазепино(2,3 - b)тиофен - 7 - она, 4H-пиразоло(5,4 - e) бензазепин - 9 - она, изоиндолин-1,3 - диона, бензоксазолин - 2 - она, незамещенного или замещенного низшим алкилом, низшей алкоксигруппой, галогеном, нитрогруппой, аминогруппой, ацетиламиногруппой, карбокси, бензоилом или бензилом;
n= 0 - 6 - целое число;
Z - группа формулы A или B: N-(CH2)mR2(A)
N-(CH2)mR2(A)
или
-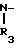 (CH2)p-R4(B)
(CH2)p-R4(B)
где R2 - фенил, замещенный галогеном, фенил, C5 - C6-циклоалкил или радикал пиридина, диоксолана, фурана, тетрагидрофурана, метилфурана или тиофена;
m= 1 - 3 - целое число;
R3 - низший алкил;
R4 - фенил или радикал диоксалана, фурана или тиофена;
p = 1,
при условии, если R1 - радикал 1,2,3,4-тетрагидрохиназол-2-она или 1,2,3,4-тетрагидрохиназолин-2,4-диона, R2 и R4 не являются ни фенилом, ни замещенным галогеном фенилом,
или их фармакологически приемлемая соль, обладающие антиацетилхолинэстеразной активностью.
Авторы
Даты
1994-04-15—Публикация
1991-06-14—Подача