Изобретение относится к производным 4,5,6,7-тетрагидробензимидазола общей формулы I или их солям, которые являются полезными в качестве лекарственных средств:
R R6 (I) в которой группы представляются следующим образом: R1, R2, R3 независимо представляют атом водорода, окси-группу, низшую алкильную группу, которая необязательно может быть замещенной атомом галогена, низшую алкокси-группу, низшую алкилтио-группу, аралкилокси-группу, арилокси-группу, низшую алканоильную группу, карбокси-группу, низшую алкоксикарбонильную группу или нитро-группу;
R6 (I) в которой группы представляются следующим образом: R1, R2, R3 независимо представляют атом водорода, окси-группу, низшую алкильную группу, которая необязательно может быть замещенной атомом галогена, низшую алкокси-группу, низшую алкилтио-группу, аралкилокси-группу, арилокси-группу, низшую алканоильную группу, карбокси-группу, низшую алкоксикарбонильную группу или нитро-группу;
R4, R5, R6 представляют атом водорода или низшую алкильную группу;
Х представляет атом кислорода или атом серы.
В определениях для групп в общей формуле описания изобретения термин "низший" относится к линейной или разветвленной углеродной цепи, состоящей из от 1 до 6 углеродных атомов, если не указано особо.
Таким образом, "низшая алкильная группа" включает метильную группу, этильную группу, пропильную группу, бутильную группу, амильную группу, гексильную группу, изопропильную группу, изобутильную группу, трет-бутильную группу, изоамильную группу, трет-амильную группу, изогексильную группу и т. д.
"Низшая алкокси-группа" включает метокси-группу, этокси-группу, пропокси-группу, бутокси-группу, амилокси-группу, гексилокси-группу, изопропокси-группу, изобутокси-группу, трет-бутокси-группу, изоамилокси-группу, трет-амилокси-группу, изогексилокси-группу, 2-этилбутокси-группу и т. д. "Низшая алкилтио-группа" включает метилтио-группу, атилтио-группу, пропилтио-группу, бутилтио-группу, амилтио-группу, изопропилтио-группу, изобутилтио-группу, трет-бутилтио-группу, изоамилтио-группу и т. д. "Низшая алканоильная группа" включает формильную группу, ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, валериальную группу и т. д. "Низшая алкоксикарбонильная группа" включает метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, изопропоксикарбонильную группу, бутоксикарбонильную группу, трет-бутоксикарбонильную группу, амилоксикарбонильную группу, гексилоксикарбонильную группу и т. д.
Кроме того, "арилокси-группа" включает фенилокси-группу, нафтилокси-группу и т. д. "Аралкилокси-группа" включает бензилокси-группу, фенетилокси-группу, фенилпропокси-группу, фенилбутокси-группу и т. д. "Атом галогена" включает атом фтора, атом хлора, атом брома и атом йода.
Соединения изобретения могут образовывать соответствующие соли. Примерами таких солей с неорганическими кислотами, такими как хлористоводородная, бромистоводородная, борная, фосфорная, серная и т. д. и соли с органическими кислотами, такими так уксусная, винная, дибензоилвинная, малеиновая, фумаровая, лимонная, янтарная, бензойная, пара-толуолсульфоновая и т. д.
Кроме того, соединения изобретения содержат асимметрические атомы углерода и соединения, подпадающие под общую формулу I, включают все изомеры, такие как оптически активные, рацемические и тому подобные на основе этих асимметрических атомах углерода.
Способы получения соединений изобретения.
Способ 1.
R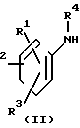 + HO
+ HO R
R
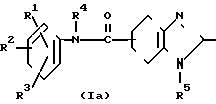
Соединение 1 изобретения может быть получено путем взаимодействия производного анилина, представленного общей формулой II, с 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислототой (или тиокарбоновой кислотой), представленной общей формулой III, или с ее реакционноспособными производными.
Реакция между соединением II и соединением III или с его реакционноспособными производными может быть проведена в большинстве случаев в растворителе при комнатной температуре или при нагревании. Любой растворитель является пригодным к употреблению без определенного ограничения, поскольку он не принимает участия в реакции. Примеры растворителя, который в большинстве случаев используется, включает ацетон, диоксан, эфир, тетрагидрофуран, метилэтилкетон, хлороформ, дихлорэтан, дихлорметан, этилацетат, этиловый эфир муравьиной кислоты, диметилформамид, диметилсульфоксид и т. д. Эти растворители могут быть использованы также путем соответствующего смешивания их.
Соединение III может быть использовано в виде свободной карбоновой кислоты и в дополнение к этому может быть представлено также для реакции в виде реакционноспособных производных карбоновой кислоты. В качестве реакционноспособных производных карбоновой кислоты могут быть использованы активированный сложный эфир (например, сложный эфир 1-оксибензотриазола и т. д.), смешанный ангидрид кислоты, галоидангидрид кислоты, активированный амид, ангидрид кислоты, азит кислоты и т. д. Когда соединение III используется в виде свободной карбоновой кислоты, то предпочитается использовать конденсирующий агент, такой как N,N'-дициклогексилкарбодиимид, N,N'-диэтилкарбодиимид и т. д.
В зависимости от типа реакционноспособных производных карбоновой кислоты иногда желательно проводить реакцию в присутствии оснований, исходя из той точки зрения, что реакция при этом протекает гладко. Примеры таких оснований включают неорганические основания, такие как гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия и т. д. органические основания, такие как триметиламин, триэтиламин, диметиланилин, пиридин и т. д.
Способ 2.
 R6_____→
R6_____→ 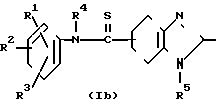 R6
R6
Способ получения производных 4,5,6,7-тетрагидробензимидазол-5-тиокарбоксам- ида, представленных общей формулой Ib.
То есть, производные карбоксамида, представленные общей формулой Iа, подвергаются взаимодействию с пентасульфидом фосфора или с реагентом Лавессона в растворителе, таком как бензол, толуол, ксилол, тетрагидрофуран, диоксан и т. д. Температура реакции является комнатной температурой или температурой кипения с обратным стеканием флегмы.
Способ 3.
 R6_____→
R6_____→  R6 где R1a, R2a и R3a независимо представляют атом водорода, окси-группу, атом галогена, низшую алкильную группу, которая необязательно может быть замещенной атомом галогена, низшую алкоксигруппу, низшую алкилтио-группу, аралкилокси-группу, низшую алканоильную группу, карбокси-группу или низшую алкоксикарбонильную группу; R1b, R2b и R3bнезависимо представляют атом водорода, окси-группу, атом галогена, низшую алкильную группу, которая необязательно может быть замещенной атомом галогена, низшую алкокси-группу, низшую алкилтио-группу, низшую алканоильную группу, карбокси-группу или низшую алкоксикарбонильную группу; при условии, что, по меньшей мере, один из R1a, R2a и R3aявляется защищенной окси-группу (например, бензилокси-группой, триметилсилилокси-группой или ацетокси-группой) и, по меньшей мере, один из R1b, R2b и R3b является окси-группой).
R6 где R1a, R2a и R3a независимо представляют атом водорода, окси-группу, атом галогена, низшую алкильную группу, которая необязательно может быть замещенной атомом галогена, низшую алкоксигруппу, низшую алкилтио-группу, аралкилокси-группу, низшую алканоильную группу, карбокси-группу или низшую алкоксикарбонильную группу; R1b, R2b и R3bнезависимо представляют атом водорода, окси-группу, атом галогена, низшую алкильную группу, которая необязательно может быть замещенной атомом галогена, низшую алкокси-группу, низшую алкилтио-группу, низшую алканоильную группу, карбокси-группу или низшую алкоксикарбонильную группу; при условии, что, по меньшей мере, один из R1a, R2a и R3aявляется защищенной окси-группу (например, бензилокси-группой, триметилсилилокси-группой или ацетокси-группой) и, по меньшей мере, один из R1b, R2b и R3b является окси-группой).
Способ направляется на получение соединений, содержащих окси-группы, которые представляются общей формулой Id.
То-есть, соединения могут быть получены путем обычного каталитического гидрирования соединений, представленных общей формулой Iс, в присутствии катализатора, такого как платина, палладий, никель Ренея, родий и т. д.
Способ 4.
Кроме того, соединения изобретения могут быть получены также путем алкилирования соединений, представленных общей формулой Iе R6_____→
R6_____→ 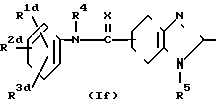 R6 где R1c, R2c и R3c независимо представляют атом водорода, окси-группу, атом галогена, низшую алкильную группу, которая необязательно может быть замещенной атомом галогена, низшую алкокси-группу, низшую алкилтио-группу, аралкилокси-группу, низшую алканоильную группу, карбокси-группу или низшую алкоксикарбонильную группу, (при условии, что, по меньшей мере один из R1c, R2c и R3c является окси-группой); и R1d, R2d и R3d независимо представляют атом водорода, окси-группу, атом галогена, низшую алкильную группу, которая может необязательно быть замещенной атомом галогена, низшую алкокси-группу, низшую алкилтио-группу, низшую алканоильную группу, карбокси-группу или низшую алкоксикарбонильную группу, (при условии, что, по меньшей мере, один из R1d, R2d и R3d является низшей алкокси-группой).
R6 где R1c, R2c и R3c независимо представляют атом водорода, окси-группу, атом галогена, низшую алкильную группу, которая необязательно может быть замещенной атомом галогена, низшую алкокси-группу, низшую алкилтио-группу, аралкилокси-группу, низшую алканоильную группу, карбокси-группу или низшую алкоксикарбонильную группу, (при условии, что, по меньшей мере один из R1c, R2c и R3c является окси-группой); и R1d, R2d и R3d независимо представляют атом водорода, окси-группу, атом галогена, низшую алкильную группу, которая может необязательно быть замещенной атомом галогена, низшую алкокси-группу, низшую алкилтио-группу, низшую алканоильную группу, карбокси-группу или низшую алкоксикарбонильную группу, (при условии, что, по меньшей мере, один из R1d, R2d и R3d является низшей алкокси-группой).
Соответствующее алкилирование может быть принято из метода, который включает реакцию взаимодействия с низшим спиртом, таким как метанол, этанол, пропанол и т. д. в присутствии дегидратирующего агента, такого как хлористоводородная кислота, серная кислота, ароматическая сульфоновая кислота и т. д. метода, который включает реакцию взаимодействия галоидированного низшего алкила, такого как метил йодистый, этил йодистый, пропил йодистый и т. д. в присутствии основания, такого как карбонат натрия, карбонат калия и т. д. метода, который включает реакцию взаимодействия с алкилсульфатом, таким как диэтилсульфат и т. д. в присутствии щелочи и тому подобных, принимая во внимание условия реакции.
Растворителем для реакции может быть растворитель, инертный к реакции, такой как вода, спирт, например, метанол, этанол и т. д. ацетон, тетрагидрофуран, эфир, диоксан, хлороформ, дихлорметан и т. д. Дополнительно, реакция может быть проведена также в отсутствии какого-либо растворителя.
Полученные таким образом соединения изобретения выделяются и очищаются в свободной форме, каковыми они являются или в форме их солей. Выделение и очистка могут быть осуществлены применением обычных химических операций, таких как экстракция, кристаллизация, перекристаллизация, разнообразные хроматографии и т. д.
Рацемические соединения могут быть приведены к стереохимически чистым изомерам путем использования соответствующих исходных соединений или с помощью cтандартных методов разделения рацематов (например, с помощью метода, который включает превращение в диастереомер с обычной оптически активной кислотой (винная кислота и т. д.), за которым следует оптическое разделение и т. д.).
Соединения изобретения или их соли ингибируют в особенности транзиторную брадикардию (пониженную частоту сердечных сокращений), индуцированную серотонином у анестезированных крыс и, как полагают таким образом, обладают 5-НТ3-антагонистической активностью.
Поэтому соединения изобретения предотвращают работу, индуцированную противоопухолевыми средствами, такими как Цисплатин или тому подобными, и излучением, и должны рассматриваться как эффективные при профилактике и лечении мигрени, "гистаминовой" головной боли, тригеминальной (тройничного нерва) невралгии, страха, желудочно-кишечных растройств, пептической язвы (желудка или 12-перстной кишки), синдрома раздраженной толстой кишки и т. д.
В качестве 5-НТ3-антагонистов до сих пор были известными азабицикло-соединения; тетрагидрокарбазольные соединения; азабицикло-соединения. Однако соединения изобретения являются сильнодействующими 5-НТ3-антагонистами, которые имеют структуру, полностью отличную от описанных соединений.
Фармакологические эффекты соединений изобретения были подтверждены следующим образом.
1) 5-НТ3-антагонистическая активность.
Самцы крыс штамма Вистар 9-недельного возраста были анеcтезированы путем внутрибрюшинного ввода (этиловый эфир карбаминовой кислоты при дозе 1 г/кг. При искусственном дыхании были измерены кровяное давление и частота сердечных сокращений. Транзиторное понижение в частоте сердечных сокращений и в кровяном давлении, индуцированное путем внутривенного ввода серотонина или 2-метилсеротонина, который является селективным агонистом (веществом, обладающим сродством к рецептору) для 5-НТ3, было использовано в качестве показателя для реакции через 5-НТ3 рецептор (рефлекс Безольд-Джариша: Пейнтэл А. С. (Рaintal A. S.) Рhysiol. Rev.  ,159, 1973).
,159, 1973).
Соединения изобретения и их соли были внутривенно введены (от 0,03 до 3 мкг/кг) за 10 мин до или орально введены (от 1 до 30 мкг/кг) за 60 мин до ввода серотонина и 2-метилсеротонина, понижение в частоте сердечных сокращений и кровяном давлении, индуцированное серотонином или 2-метилсеротонином, было ингибировано в зависимости от дозы.
Ингибиторная активность соединений изобретения на индуцированный серотонином рефлекс Безольда-Джариша (рефлекс БД) у крыс представлен в таблице.
2) Ингибирующее действие от рвоты, индуцированной канцероцидным средством.
Путем ввода предлагаемых соединений подкожно или перорально самцам африканского хорька массой от 1 до 1,5 кг при дозе от 0,01 до 0,3 мг/кг, рвота, индуцированная путем внутрибрюшинного ввода 100 мг/кг Цисплетина, была предотвращена.
3) Ингибирующее действие от стрессовой дефекации.
Самцы крыс штамма Вистар 9-недельного возраста вносятся в клетку для создания стресса на ограничение и количество фекалий было измерено. Соединения изобретения или их соли предотвращают зависимое от дозы ускорение дефекации, индуцированное стрессом на ограничение.
Соединения изобретения имеют низкую токсичность. Острая токсичность у самцов выше (метод "вверх и вниз") составляет от 100 до 150 мг/кг при внутривенном вводе.
Фармацевтическая композиция, включающая, по меньшей мере, одно из соединений изобретения или их солей, получается в форме таблеток, порошков, гранул, капсул, пилюлей, жидкостей, инъекций, суппозиторий, мазей, паст и т. д. используя носители, эксцициенты и другие добавки, обычно используемые для фармацевтических композиций. Композиция может быть введена перорально (включая подъязычный прием) или парантерально.
В качестве носителя или эксцициента для фармацевтической композиции существуют твердые или жидкие нетоксичные фармацевтические вещества. Примеры включают лактозу, стеарат магния, крахмал, тальк, желатину, агар, пектин, гуммиарабик, оливковое масло, кокосовое масло, кунжутное масло, этиленгликоль и т. д. и другие обычно используемые вещества.
Клиническая доза предлагаемого соединения определяется соответствующим образом, принимая во внимание состояния, живой вес, возраст, пол и т. д. обращаемого пациента, но ежедневная доза обычно должна составлять от 0,1 до 10 мг внутривенного ввода и от 0,5 до 50 мг для перорального приема, для взрослых особей. Доза может быть принята один раз или более, чем один раз в день.
Способы для получения исходных соединений, используемых в примерах, представляются в ссылочных примерах.
Ссылочный пример 1.

 ________→
________→ 

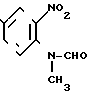
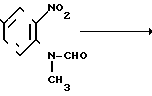
4-Метил-2-нитроанилин, 30 г (197 ммоль), растворяют в 500 мл хлористого метилена и жидкую смесь из 52 мл (1,378 моль) муравьиной кислоты и 31 мл (328 ммоль) уксусного ангидрида по каплям добавляют к раствору. Смесь перемешивают при комнатной температуре в течение 16 ч. Растворитель перегоняют при пониженном давлении. Полученные кристаллы промывают эфиром, чтобы получить 34,7 г (97,7%) N-(4-метил-2-нитрофенил)формамида.
Физико-химические свойства: ЯМР (ДМСО-do, тетраметилсилан (ТМС, 100 МГц): δ 2,40 (3Н, синглет, СН3), 7,55 (1Н, двойной дублет, 10 Гц, 1 Гц, АrН), 7,90 (2Н, уширенный синглет, АrН), 8,40 (1Н, уширенный синглет, СНO), 10,40 (1Н, уширенный сигнал, NН) Масс-спектр (Е1?): м/е 180 (М+)

 (2)
(2)
В токе аргона к 400 мл сухого диметилформамида добавляют 8,1 г (202 ммоль) гидрида натрия (60% -ного в масле) и смесь охлаждают до 5-10оС. К смеси по каплям добавляют 34,7 г (192 ммоль) N-(4-метил-2-нитрофенил)формамида (раствор в 150 мл сухого диметилформамида). Смесь перемешивают при 50оС в течение часа. После охлаждения заново до 5-10оС к смеси добавляют 18 мл (289 ммоль) йодистого метила (раствора в 30 мл сухого диметилформамида). Реакционную систему перемешивают при комнатной температуре в течение 16 ч. После растворитель отгоняют при пониженном давлении, к остатку добавляют 200 мл воды, за которым следует экстракция этилацетатом. После промывки этилацетатного слоя насыщенным водным раствором хлористого натрия и высушивания над безводным сульфатом магния отгоняют при пониженном давлении растворитель. Полученные кристаллы промывают н-гексаном, чтобы получить 31,2 г (83,4%) N-метил-N-(4-метил-2-нитрофенил)формамида.
Физико-химические свойства: ЯМР (ДМСО-d6, ТМС, 100 МГц): δ 2,44 (3H дублет, 1 Гц, СН3), 3,10, 3,40 (3Н, синглет, N-СН3), 7,60 (2Н, мультиплет, АrH), 7,90 (1Н, дублет, 14 Гц, АrН), 8,18 (1Н, дублет, 8 Гц, СНО) Масс-спектр (FAВ, Роs): м/е 195 (М+ + +1)

 (3)
(3)
К 400 мл этанола добавляют N-метил-N-(4-метил-2-нитрофенил)формамид, 20 г (103 ммоль), к смеси по каплям добавляют при 80оС раствор 54 г (310 ммоль) гидросульфита натрия в 300 мл воды. После перемешивания при 80оС в течение 7 ч смесь перемешивают при комнатной температуре в течение дополнительных 16 ч. Растворитель отгоняют при пониженном давлении и к остатку добавляют 200 мл 1 н. водного раствора гидроокиси натрия, за которым следует экстракция этилацетатом. Органический слой высушивают над безводным сульфатом магния и выпаривают. Полученные кристаллы промывают эфиром, чтобы получить 10,0 г (67,3%) 1,5-диметилбензимидазола).
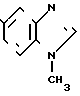
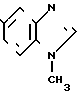
Физико-химические свойства: ЯМР (ДМСО-d6, ТМС, 100 МГц): δ 2,44 (3Н, синглет, CH3), 3,82 ( 3H, cинглет, N-Ме), 7,10 (1Н, двойной дублет, 8 Гц, 1 Гц, АrН), 4,75 (2Н, мультиплет, АrН), Масс-спектр (Е1): м/е 146 (M+)

 · HCl (4)
· HCl (4)
К 250 мл воды добавляют 8,5 г (58,1 ммоль) 1,5-диметилбензимидазола и к смеси при 50-60оС по порциям добавляют 21 г (133 ммоль) перманганата калия. Смесь перемешивают в течение 2 ч при той же температуре. После охлаждения смесь фильтруют и к фильтрату добавляют 1 н. раствор соляной кислоты, чтобы довести рН до 4. Перегонка при пониженном давлении дает 20,2 г (включая неорганические вещества) хлоргидрата 1-метилбензимидазол-5-карбоновой кислоты.
Физико-химические свойства: ЯМР (СН3ОД, ТМС, 100 МГц): δ 4,20 (3Н, синглет, N-Ме), 8,05 (1Н, двойной дублет, 10 Гц, 1 Гц, АrН), 8,35 (1Н, двойной дублет, 10 Гц, АrН), 8,50 (1Н, квартет, 1 Гц, АrН), 9,54 (1Н, синглет, 2-Н).
Масс-спектр (FAВ, Роs): м/е 177 (М+ + 1, в виде свободного основания)
 · HCl
· HCl 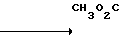
 · H2SO4 (5)
· H2SO4 (5)
К 300 мл метанола добавляют 20,2 г (включая неорганические вещества) хлоргидрата 1-метилбензимидазол-5-карбоновой кислоты и к смеси добавляют 5 мл конц. соляной кислоты, за которым следует нагревание при температуре кипения с обратным стеканием флегмы в течение 7 ч. Растворитель отгоняют и к остатку добавляют 200 мл воды. К смеси добавляют при 5-10оС 1 н. раствор гидроокиси натрия, чтобы довести рН до 9-10, за которым следует экстракция этилацетатом. Этилацетатный слой высушивают над безводным сульфатом магния и фильтруют. Растворитель отгоняют при пониженном давлении. Полученные кристаллы промывают эфиром, чтобы получить 4,8 г метилового эфира 1-метилбензимидазол-5-карбоновой кислоты (43,6% в расчете на 1,5-диметилбензимидазол).
Физико-химические свойства: ЯМР (ДМСО-d6, ТМС, 90 МГц): δ 3,86 (6Н, синглет, N-Ме, COOМе), 7,65 (1Н, двойной дублет, 10 Гц, 1 Гц, АrН), 7,94 (1Н, двойной дублет, 10 Гц, 1Гц, АrН), 8,24 (1Н, дублет, 1 Гц, АrН), 8,32 (1Н, синглет, 2-Н) Масс-спектр (Е1): м/е 190 (М+).
Описанное соединение, 4,8 г, растворяют в 26,6 мл 2 н. серной кислоты и растворитель отгоняют при пониженном давлении, чтобы получить 7,2 г сульфат метилового эфира 1-метилбензимидазол-5-карбоновой кислоты.
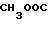

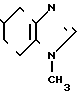 (6)
(6)
В автоклав загружают 6,6 г (22,9 ммоль) сульфата метилового эфира 1-метилбензимидазол-5-карбоновой кислоты, 60 мл уксусной кислоты и 3,0 г 5%-ного родийугольного порошка и гидрирование проводят при 80оС в течение 92 ч под давлением 60 атм. После охлаждения родийугольные порошки отфильтровывают и фильтрат отгоняют при пониженном давлении. После этого к остатку добавляют 200 мл воды, к смеси добавляют при 0-5оС 1 н. раствор гидроокиcи натрия, чтобы довести рН до 9-10, за которым следует экстракция этилацетатом. Этилацетатный слой высушивают над безводным сульфатом магния и растворитель отгоняют, чтобы получить 3,45 г (77,7%) метилового эфира 1-метил-4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты (масло).
Физико-химические свойства: ЯМР (СДСl3, ТМС, 100 МГц): δ 1,70-3,00 (7Н, мультиплет, СН2 x 3, СН), 3,50 (3Н, синглет, N-СН3), 3,70 (3Н, синглет, COOCH3), 7,30 (1Н, синглет, 2-Н). Масс-спектр (Е1): м/е 194 (М+).


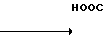
 · HCl (7)
· HCl (7)
К 130 мл метанола добавляют 3,45 г (17,7 ммоль) метилового эфира 1-метил-4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты, затем к смеси добавляют 3,53 г (88,3 ммоль) гидроокиси натрия в 15 мл воды, за которым следует нагревание при температуре кипения с обратным стеканием флегмы в течение 5 ч. Растворитель отгоняют при пониженном давлении и к остатку добавляют 100 мл 1 н. соляной кислоты. Смесь отгоняют при пониженном давлении, чтобы получить 8,5 г (включая 57 мас. NaCl) хлоргидрата 1-метил-4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты.
Физико-химические свойства: ЯМР (СД3OД, ТМС, 60 МГц): δ 2,00-3,10 (7Н, мультиплет, СН2 x 3, СН) 3,80 (3Н, синглет, N-Ме), 8,75 (1Н, синглет, 2-Н).
Масс-спектр (Е1): м/е 180 (М+, в виде свободного основания)
Ссылочный пример 2.

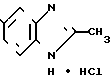
 CH3· HCl (1) Смесь 5,0 г (32,8 ммоль) 3,4-диаминобензойной кислоты, 50 мл конц. соляной кислоты и 10 мл (0,175 моль) уксусной кислоты нагревают при 100оС в течение 24 ч, затем при пониженном давлении отгоняют растворитель, чтобы получить 6,6 г (94,5%) хлоргидрата 2-метилбензимидазол-5-карбоновой кислоты.
CH3· HCl (1) Смесь 5,0 г (32,8 ммоль) 3,4-диаминобензойной кислоты, 50 мл конц. соляной кислоты и 10 мл (0,175 моль) уксусной кислоты нагревают при 100оС в течение 24 ч, затем при пониженном давлении отгоняют растворитель, чтобы получить 6,6 г (94,5%) хлоргидрата 2-метилбензимидазол-5-карбоновой кислоты.
Физико-химические свойства: ЯМР (ДМСО-d6, ТМС, 90 МГц): δ 2,85 (3Н, синглет, 2-СН3), 7,84 (1Н, двойной дублет, 8 Гц, 1 Гц АrН), 8,05 (1Н двойной дублет, 8 Гц, 1 Гц, АrН), 8,24 (1Н, дублет, 1 Гц, АrН).
Масс-спектр (FAВ, Роs): м/е 177 (М+ +1, в виде свободного основания).

 CH3
CH3
 (2)
(2)
К 200 мл метанола добавляют 6,6 г (32,5 ммоль) хлоргидрата 2-метилбензимидазол-5-карбоновой кислоты и к смеси добавляют 5 мл конц. cоляной кислоты, за которым следует нагревание при температуре кипения с обратным стеканием флегмы в течение 8 ч. Растворитель отгоняют при пониженном давлении и к остатку добавляют 200 мл воды. К смеси добавляют 1 н. раствор гидроокиси натрия, чтобы довести рН до 9-10, затем смесь экстрагируют этилацетатом. Этилацетатный слой высушивают над безводным сульфатом магния и фильтруют. Растворитель отгоняют, чтобы получить 5,5 г (93,2%) метилового эфира 2-метилбензимидазол-5-карбоновой кислоты.
Физико-химические свойства: ЯМР (СДСl3, ТМС, 60 МГц): δ 2,65 (3Н, синглет, 2-СН3), 3,90 (3Н, синглет, OСН3), 7,65 (2Н, АВ-квартет, I 8 Гц, Δ V 21 Гц, АrН), 8,20 (IH, синглет, АrН) Масс-спектр FAВ, Роs): м/е 191 (М+ + 1)
Описанное соединение (5,7 г) растворяют в 30 мл 1 н. соляной кислоты и растворитель отгоняют при давлении, чтобы получить 6,8 г хлоргидрата метилового эфира 2-метилбензимидазол-5-карбоновой кислоты.


 CH3 (3)
CH3 (3)
В автоклав загружают 6,8 г (30 ммоль) хлоргидрида метилового эфира 2-метилбензимидазол-5-карбоновой кислоты, 6,0 г 5%-ного палладия на сульфате бария и 140 мл уксусной кислоты и гидрирование проводят при 80оС в течение 115 ч под давлением 60 атм при перемешивании. После охлаждения отфильтровывают 5%-ный палладий на сульфате бария и фильтрат отгоняют при пониженном давлении. К остатку добавляют 200 мл воды, затем к смеси при 0-5оС добавляют 1 н. раствор гидроокиси натрия, чтобы довести рН до 9-10, за которым следует экстракция этилацетатом. Этилацетатный слой высушивают над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле и элюируют смесью хлористого метилена и метанола (10:1), чтобы получить 0,70 г (12,0%) метилового эфира 2-метил-4,5,6,7-тетрагидробензимидазол-5-карбон- овой кислоты.
Физико-химические свойства: ЯМР (СДCl3, ТМС, 60 МГц): δ 1,80-3,00 (7Н, мультиплет, СН2 x 3,СН), 2,35 (3Н, синглет, 2-СН3) 3,70 (3Н, синглет, OCН3), 9,90 (1H, синглет, 11H)
Масс-спектр (FAВ, Роs): м/е 195 (М+ + I).

 CH3
CH3
 (4)
(4)
К 40 мл метанола добавляют 0,70 г (3,6 ммоль) метилового эфира 2-метил-4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты, затем к смеси добавляют раствор 0,74 г (18,5 ммоль) гидроокиси натрия в 2 мл воды, за которым следует нагревание при температуре кипения с обратным стеканием флегмы в течение 16 ч. Растворитель отгоняют при пониженном давлении, затем к остатку добавляют 100 мл 1 н. соляной кислоты. Смесь отгоняют при пониженном давлении, чтобы получить 1,6 г (включая 58 мас. NаСl) хлоргидрата 2-метил-4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты.
Физико-химические свойства: ЯМР (СД3OД, ТМС, 60 МГц): δ 2,00-3,00 (7Н, мультиплет, СН2, СН), 2,60 (3Н, синглет, 2-СН3). Масс-спектр (ЕI): м/е 180 (М+, в виде свободного основания).
П р и м е р 1.
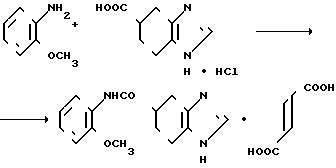
К 5 мл хлористого тионила добавляют 0,60 г (2,95 ммоль хлоргидрата 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты, затем смесь нагревают при 90оС в течение 2,5 ч. После этого отгоняют при пониженном давлении хлористый тионил и к остатку добавляют 10 мл хлористого метилена, 0,4 мл (3,57 ммоль) ортоанизидина и 1,0 мл (7,22 ммоль) триэтиламина, за которым следует перемешивание при комнатной температуре в течение 18 ч. Смесь промывают 5%-ным водным раствором гидрокарбоната натрия, а затем высушивают над безводным сульфатом магния, после чего при пониженном давлении отгоняют растворитель. Остаточное масло очищают колоночной хроматографией на силикагеле (элюент: дихлорметан: метанол 10:1). К 0,22 г получающегося пенистого вещества добавляют 0,10 г фумаровой кислоты в этаноле, чтобы получить фумарат. Фумарат перекристаллизовывают из смеси этилацетата и метанола (10:1), чтобы получить фумарат 0,8 гидрат N-(2-метилоксифенил)-4,5,6,7-тетрагидробензимида- зол-5-карбоксамида.
Физико-химические свойства: Температура плавления 168-170оС. Элементный анализ (в виде С19Н21N3O6x x 0,8 Н2O). Вычислено, C 56,79; Н 5,67; N 10,46. Найдено, C 56,91; Н 5,62; N 10,42. ЯМР (СДСl3): δ (м.д.) (2Н, широкий сигнал, СН2), 2,90 (5Н, мультиплет, СН2 x 2, СН), 3,84 (3Н, синглет, OCH3), 6,90 (3Н, мультиплет, Н ароматического ядра), 7,50 (IH, широкий сигнал, 2-СН), 7,96 (IH, синглет, CONH), 8,35 (IH, двойной дублет, 9 Гц, 1 Гц, Н ароматического ядра). Масс-спектр (ЕI): м/е 271 (М+, в виде свободного основания).
П р и м е р 2.


В 0,7 мл хлористого тионила нагревают с обратным холодильником в течение 30 мин 0,13 г хлоргидрида 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты (содержащего хлористый натрий), после этого летучие компоненты отгоняют при пониженном давлении. Полученный остаток добавляют к раствору 0,14 г 2-аминоацетофенона и 0,15 мл триэтиламина в 2 мл хлористого метилена при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение ночи, затем к смеси добавляют 5 мл водного раствора карбоната натрия, за которым следует экстракция хлороформом. Органическую фазу высушивают над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток подвергают затем колоночной хроматографии (силикагель, хлороформ-метанол), чтобы получить 0,14 г N-(2-ацетилфенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида. Путем обработки основания раствором фумаровой кислоты в смеси метанола и ацетонитрила получают 0,15 г фумарата N-(2-ацетилфенил)-4,5,6,7-тетрагидробензимидазол-5-ка- рбоксамида.
Физико-химические свойства: Температура плавления 94-98оС. Элементный анализ (в виде С16Н17 N3O2 ˙ 0,5 Н2O˙ 0,5 СН3СN). Вычислено, С 58,80; Н 5,52; N 11,43. Найдено, С 58,81; Н 5,38; N 11,43. Масс-спектр (ЕI): м/е 283 (М+, в виде свободного основания).
Следующие соединения получают по способу, подобно описанному в примере 2.
П р и м е р 3.
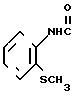


Фумарат N-(2-метилтиофенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамид.
Физико-химические свойства: Температура плавления 143-145оС (метанол-ацетонитрил). Элементный анализ (в виде С15Н17 N3OS C4H4O4 ˙0,2 Н2O ˙0,15 СН3СN). Вычислено, С 56,10; Н 5,33; N 10,68; S 7,76. Найдено, С 56,12; Н 5,28; N 10,50; S 7,77. Масс-спектр (ЕI): м/е 287 (М+, в виде свободного основания).
П р и м е р 4.
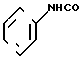

 Фумарат N-фенил-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Фумарат N-фенил-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 186-188оС. Элементный анализ (в виде С14Н15N3O4 ˙3/4 С4Н4O4˙ 0,7 Н2O). Вычислено, С 59,88; Н 5,73; N 12,32. Найдено, С 59,89; Н 5,58; N 12,26. Масс-спектр (FAB, Pos): м/е 242 (М+ + 1 в виде свободного основания).
П р и м е р 5.

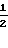
 0,5 Фумарат N-(2-бензилоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
0,5 Фумарат N-(2-бензилоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 199-201оС (метанол-ацетонитрил). Элементный анализ (в виде С21Н21N3O2 ˙ 0,5 С4Н4O4). Вычислено,
С 68,13; Н 5,72; N 10,36. Найдено, С 68,18; Н 5,83; N 10,36. Масс-спектр (ЕI): м/е 347 (М+, в виде свободного основания).
П р и м е р 6.
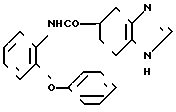
 Фумарат N-(2-феноксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Фумарат N-(2-феноксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 182-183оС (метанол-ацетонитрил). Элементный анализ (в виде С20Н19 N3O2˙ ˙C4H4O4 ˙0,2 Н2O).
Вычислено, С 63,63; Н 5,21; N 9,27. Найдено, С 63,70; Н 5,24; N 9,23. Масс-спектр (ЕI): м/е 333 (М+, в виде свободного основания).
П р и м е р 7.


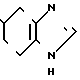
 Фумарат N-(3-хлор-6-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбок- самида.
Фумарат N-(3-хлор-6-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбок- самида.
Физико-химические свойства: Температура плавления 149-152оС (метанол-ацетонитрил). Элементный анализ (в виде С15Н16Сl N3O2 C4H4O4 ˙0,7 H2O). Вычислено, С 52,53; Н 4,96; N 9,62. Сl 8,16. Найдено, С 52,49; Н 4,98; N 9,67; Сl 8,32. Масс-спектр (ЕI): м/е 305,307 (М+, в виде свободного основания).
П р и м е р 8.
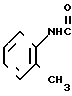
 N-(2-метилфенил)-4,5,6,7-тетрагидробензи- мидазол-5-карбоксамид.
N-(2-метилфенил)-4,5,6,7-тетрагидробензи- мидазол-5-карбоксамид.
Физико-химические свойства: Температура плавления 100-105оС (эталацетат). ЯМР (СДСl3 CД3ОД-ТМС): δ м.д. 2,00-3,00 (7Н, мультиплет, СН2 и СН 2,25 (3Н, синглет, Ме), 7,10-7,50 (5Н, мультиплет, АrH). Масс-спектр (ЕI): м/е 255 (М+).
П р и м е р 9.


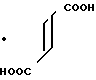 Фумарат N-(2-бромфенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Фумарат N-(2-бромфенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 98-100оС (этилацетат-метанол). Элементный анализ (в виде С14Н14Вr˙ ˙N3O ˙ C4H4O4). Вычислено, С 49,55; Н 4,15; N 9,63; Вr 18,31. Найдено, С 49,27; Н 4,02; N 9,44; Вr 18,55. Масс-спектр (FAB): м/е 320, 322 (М+ + 1, в виде свободного основания.
П р и м е р 10.

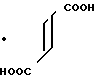 Фумарат N-(2-метоксикарбонилфенил)-4,5,6,7-тетрагидробензимидазол-5-карбок-самида.
Фумарат N-(2-метоксикарбонилфенил)-4,5,6,7-тетрагидробензимидазол-5-карбок-самида.
Физико-химические свойства: Температура плавления 95-97оС (этилацетат-метанол). Элементный анализ (в виде С16Н17 N3O2˙ ˙C4H4O4.) Вычислено, С 57,59; Н 5,63; N 11,19. Найдено, С 57,30; Н 5,23; N 11,00. Масс-спектр (FAB): м/е 300 (М+ + 1, в виде свободного основания).
П р и м е р 11.
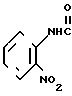

 Фумарат N-(2-нитрофенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Фумарат N-(2-нитрофенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 144-146оС (этилацетат-метанол). Элементный анализ (в виде С14Н14 N4O3˙ ˙C4H4O4). Вычислено, С 53,73; Н 4,50; N 13,92. Hайдено, C 53,89; H 4,30; N 13,71. Масс-спектр (FAB): м/е 287 (М+ + 1, в виде свободного основания).
П р и м е р 12.


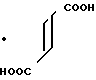 Фумарат N-(2-метоксифенил)-N-метил-4,5,6,7-тетрагидробензимидазол-5-карбок- самида.
Фумарат N-(2-метоксифенил)-N-метил-4,5,6,7-тетрагидробензимидазол-5-карбок- самида.
Физико-химические свойства: Температура плавления 124-127оС (метанол-ацетонитрил). Элементный анализ (в виде С16Н19 N3O2˙ ˙C4H4O4 x 0,7 Н2O). Вычислено, С 58,02; Н 5,94; N 10,15. Найдено, С 57,89; Н 5,66; N 9,87. Масс-спектр (ЕI): м/е 286 (М+ + 1 в виде свободного основания).
П р и м е р 13.
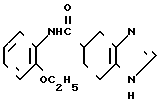
 Фумарат N-(2-этоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Фумарат N-(2-этоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 89-92оС (этилацетат-метанол). Элементный анализ (в виде С16Н19 N3O2˙ ˙С4H4O4) Вычислено, С 59,84; Н 5,77; N 10,46. Найдено, С 59,55; Н 5,74; N 10,33. Масс-спектр (FAB): м/е 286 (М+, в виде свободного основания).
П р и м е р 14.
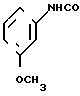
 ·
· 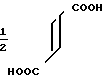 0,5 Фумарат N-(3-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
0,5 Фумарат N-(3-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 195-196оС (метанол-ацетонитрил). Элементный анализ (в виде С15Н17N3O2x x 0,5 C4H4O4). Вычислено, С 62,0; Н 5,81; N 12,76. Найдено, С 61,87; Н 5,85; N 12,46. Масс-спектр (ЕI): м/е (М+, в виде свободного основания).
П р и м е р 15.

 Фумарат N-(2-бутилоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Фумарат N-(2-бутилоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура-плавления 157-160оС (метанол-ацетонитрил). Элементный анализ (в виде С13Н23 N3O2 C4H4O4 ˙0,4 H2O). Вычислено, С 60,51; Н 6,42; N 9,62. Найдено, С 60,21; Н 6,10; N 9,71. Масс-спектр (ЕI): м/е 313 (М+, в виде свободного основания).
П р и м е р 16.
 ·
·  0,5 Фумарат N-(4-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
0,5 Фумарат N-(4-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 217-218оС (метанол-ацетонитрил). Элементный анализ (в виде С17Н19 N3O4x x 0,2 H2O). Вычислено, С 61,33; Н 5,87; N 12,62. Найдено, С 61,28; Н 5,84; N 12,61. Масс-спектр (ЕI): м/е 271 (М+, в виде свободного основания).
П р и м е р 17.
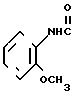
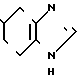 ____→
____→ 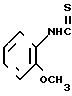

 К 10 мл толуола добавляют 0,24 г (0,88 ммоль) N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида, полученного в примере 1, и к cодержимому дополнительно прибавляют 0,36 г (0,89 ммоль) реагента Лавессона, за которым следует нагревание при 110-120оС в течение 16 ч. После охлаждения отгоняют толуол и к остатку добавляют 20 мл воды. К смеси добавляют 1 н. раствор гидроокиси натрия, чтобы сделать ее щелочной. Смесь экстрагируют хроpофоpмом. Хлороформную фазу высушивают над безводным сульфатом магния и фильтруют, затем фильтрат перегоняют при пониженном давлении. Остаток разделяют и очищают с помощью колоночной хроматографии на силикагеле. После этого к 0,20 г получающегося пенистого вещества добавляют 0,08 г (0,69 ммоль) фумаровой кислоты, чтобы превратить его (вещество) в фумарат, затем фумарат перекристаллизовывают из смеси этилацетата и метанола (10:1), чтобы получить 0,12 г (34,3% ) 1/2 фумарата N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-тиокар-боксамида.
К 10 мл толуола добавляют 0,24 г (0,88 ммоль) N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида, полученного в примере 1, и к cодержимому дополнительно прибавляют 0,36 г (0,89 ммоль) реагента Лавессона, за которым следует нагревание при 110-120оС в течение 16 ч. После охлаждения отгоняют толуол и к остатку добавляют 20 мл воды. К смеси добавляют 1 н. раствор гидроокиси натрия, чтобы сделать ее щелочной. Смесь экстрагируют хроpофоpмом. Хлороформную фазу высушивают над безводным сульфатом магния и фильтруют, затем фильтрат перегоняют при пониженном давлении. Остаток разделяют и очищают с помощью колоночной хроматографии на силикагеле. После этого к 0,20 г получающегося пенистого вещества добавляют 0,08 г (0,69 ммоль) фумаровой кислоты, чтобы превратить его (вещество) в фумарат, затем фумарат перекристаллизовывают из смеси этилацетата и метанола (10:1), чтобы получить 0,12 г (34,3% ) 1/2 фумарата N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-тиокар-боксамида.
Физико-химические свойства: Температура плавления 218-219оС. Элементный анализ (в виде С15Н17 N3OS˙ ˙1/2 ˙C4H4O4). Вычислено, С 59,11; Н 5,54; S 9,28. Найдено, С 58,91; Н 5,46; N 12,01; S 9,68. Масс-спектр (FAB, Pos): м/е 288 (М+ + 1, в виде свободного основания).
П р и м е р 18.
 ___→
___→ 
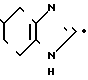

В растворе 15 мл этанола при обычном давлении каталитически гидрируют 0,24 г N-(2-бензилоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида, используя в качестве катализатора 30 мг 10%-ного палладия на угле. После реакции катализатор отфильтровывают, реакционный раствор концентрируют и остаток подвергают колоночной хроматографии на силикагеле (3 г). Элюирование с помощью 10% -ного метанола в хлороформе дает 0,10 г (56%) N-(2-оксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида, часть которого очищают в форме фумарата.
Физико-химические свойства: Температура плавления 203-205оС (метанол-ацетонитрил). Элементный анализ (в виде С14Н15 N3O2 ˙0,5 C4H4O4˙ 0,5 H2O). Вычислено, С 59,25; Н 5,59; N 12,96. Найдено, С 59,21; Н 5,32; N 12,90. Масс-спектр (ЕI): м/е 257 (М+, в виде свободного основания).
П р и м е р 19.

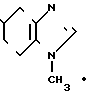
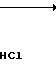
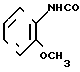
 · H2O
· H2O
К 1,4 г (2,7 ммоль) хлоргидрата 1-метил-4,5,6,7-тетрагидробензимидазол-5-карбон- овой кислоты (включая NaCl, полученного в примере 1, добавляют 10 мл хлористого тионила и смесь нагревают при 90оС в течение 4 ч. После этого при пониженном давлении отгоняют хлористый тионил и к остатку добавляют 10 мл хлористого метилена, затем к смеси добавляют при температуре от 0 до 4оС 0,50 мл (4,4 ммоль) орто-анизидина и 1,0 мл (7,2 ммоль) триэтиламина, за которым следует перемешивание при комнатной температуре в течение 21 ч. К реакционной смеси добавляют 40 мл хлористого метилена и смесь промывают 1 н. раствором гидроокиси натрия, затем ее высушивают над безводным сульфатом магния и растворитель отгоняют. Остаток подвергают колоночной хроматографии на силикагеле и элюируют смесью хлористого метилена-метанола-аммиачной воды (10:1:0,1). Растворитель отгоняют и получающиеся кристаллы перекристаллизовывают из этилацетата, чтобы получить 0,18 г гидрата N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 94-96оС. Элементный анализ (в виде С16Н19 N3O2˙ ˙H2O). Вычиcлено, С 63,34; H 6,97; N 13,85. Hайдено, C 63,02; H 6,92; N 13,74. Масс-спектр (ЕI): м/е 285 (М+).
П р и м е р 20.

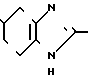 CH3 _____→
CH3 _____→ 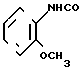
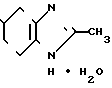
К 0,50 г (0,97 ммоль) хлоргидрата 2-метил-4,5,6,7-тетрагидробензимидазол-5-кар- боновой кислоты (включая 58 мас. NaCl), полученного в примере 2, добавляют 5 мл хлористого тионила и смесь нагревают при 90оС в течение 3 ч. При пониженном давлении отгоняют хлористый тионил и к остатку добавляют 10 мл хлористого метилена, затем к смеси добавляют при температуре от 0 до 5оС 0,20 мл (1,78 ммоль) орто-анизидина и 0,40 мл (2,89 ммоль) триэтиламина, за которым следует перемешивание при комнатной температуре в течение 16 ч. После добавления 50 мл хлористого метилена смесь промывают 1 н. раствором гидроокиси натрия, а затем высушивают над безводным сульфатом магния. После этого растворитель отгоняют. Остаток подвергают колоночной хроматографии на силикагеле и элюируют смесью хлористого метилена-метанола-аммиачной воды (10: 1:0,1). Растворитель отгоняют и получающиеся бесцветные кристаллы перекристаллизовывают из этилацетата, чтобы получить 0,10 г (37,0%) моногидрата N-(2-метоксифенил)-2-метил-4,5,6,7-тетрагидробе- нзимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления 108-110оС. Элементный анализ (в виде С16Н19 N3O2˙ ˙1,05 H2O). Вычислено, С 63,16; Н 6,98; N 13,81. Найдено, С 62,75; Н 6,98; N 13,64. Масс-спектр (FAB, Pos): м/е 286 (М+ + 1, в виде свободного основания). Ссылочный пример 3. (а)

В автоклаве растворяют 40,0 г сульфата метилового эфира бензимидазол-5-карбоновой кислоты в 600 мл уксусной кислоты и гидрирование проводят при 80оС в течение 5 ч под давлением 60 атм, используя 11 г 101%-ного палладия на угле в качестве катализатора. После отфильтровывания катализатора маточник концентрируют при пониженном давлении и получают 41,0 г (выход, 101%) маслообразного сульфата метилового эфира 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты. (б)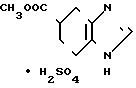


В 350 мл воды и 340 мл конц. соляной кислоты растворяют 41,0 г маслообразного сульфата сложного эфира, описанного в примере (а), после чего перемешивают при 100оС в течение 3 ч. После концентрирования получающиеcя кристаллы промывают ацетоном, чтобы получить 29,6 г (выход, 76,8% в расчете на сложный эфир бензимидазола) сульфата 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты.
Физико-химические свойства: Температура плавления 145-148оС. ЯМР (в d6-ДМСО): δ 1,60-3,00 (7Н, мультиплет), 8,84 (IH, синглет) Масс-спектр (ЕI): м/е 166 (М+, в виде свободного основания). Масс-спектр (СI): м/е 167 (М+ + 1, в виде свободного основания). Ссылочный пример 4.
 · HCl Хлоргидрат 1-метил-4,5,6,7-тетрагидробензимидазол-6-карбоновой кислоты (а)
· HCl Хлоргидрат 1-метил-4,5,6,7-тетрагидробензимидазол-6-карбоновой кислоты (а)

Раствор 9,10 г 3,4-динитротолуола в 100 мл 30%-ного метиламина в метаноле подвергают реакции при 150оС в течение 6 ч в запаянной трубке. Реакционный раствор концентрируют при пониженном давлении и остаток подвергают колоночной хроматографии на силикагеле (200 г). Элюирование смесью этилацетата и гексана (1:3) дает 7,95 г (96%) 3-(N-метиламино)-4-нитротолуола.
Физико-химические свойства: ЯМР (СДСl3): δ 2,37 (3Н, синглет), 3,16 (3Н, синглет), 6,30-6,71 (2Н, мультиплет), 8,00 (IH, дублет, I 9 Гц). (б) 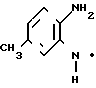

В 200 мл метанола растворяют 7,95 г 3-(N-метиламино)-4-нитротолуола и смесь каталитически восстанавливают, используя в качестве катализатора 1,0 г 10% -ного палладия на угле. После отфильтровывания катализатора реакционный раствор концентрируют при пониженном давлении, чтобы получить 6,60 г (101%) 1-амино-4-метил-2-(N-метиламино)бензола.
Физико-химические свойства: ЯМР (СДCl3): δ 2,24 (3Н, синглет), 2,82 (3Н, синглет), 4,10 (3Н, широкий сигнал, синглет), 6,33-6,80 (3Н, мультиплет). (в) 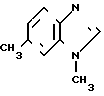
Смесь 6,60 г 1-амино-4-метил-2-(N-метиламино)бензола и раствора 3,5 мл муравьиной кислоты в 50 мл 4 н. НСl перемешивают при 100оС в течение 3,5 ч. Реакционный раствор концентрируют при пониженном давлении и к остатку добавляют воду. После промывания этилацетатом водную фазу делают щелочной водным раствором карбоната калия, за которым следует экстракция хлороформом. Хлороформный слой промывают насыщенным водным раствором хлористого натрия, высушивают над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле (40 г). Элюирование этилацетатом, за которым следует перекристаллизация из смеси этилацетата и гексана, дает 4,01 г (57%) 1,6-диметилбензимидазола.
Физико-химические свойства: ЯМР (СДCl3): δ 2,51 (3Н, синглет), 3,76 (3Н, синглет), 7,09 (1H, дублет, I 8 Гц), 7,14 (1H, синглет), 7,65 (IH, дублет, I 8 Гц), 7,73 (1H, синглет). (г) · H2SO4
· H2SO4
Водный раствор (100 мл) 3,95 г 1,6-диметилбензимидазола и 10 г перманганата калия перемешивают при 50оС в течение 2 ч и к смеси дополнительно добавляют еще 2 г перманганата калия. Смесь перемешивают при 80оС в течение дополнительных 2 ч. После фильтрации нерастворимых веществ фильтрат подкисляют до рН 4 с помощью 1 н. соляной кислоты и концентрируют при пониженном давлении, чтобы получить 7,33 г 1-метилбензимидазол-6-карбоновой кислоты в виде смеси с хлористым калием.
Указанное соединение нагревают при температуре кипения с обратным стеканием флегмы в 150 мл метанола в течение ночи в присутствии 3 мл конц. серной кислоты. Реакционный раствор концентрируют при пониженном давлении и к концентрату добавляют воду. После промывки этилацетатом водный слой подщелачивают водным раствором карбоната калия, за которым следует экстракция этилацетатом. Этилацетатный слой промывают насыщенным водным раствором хлористого натрия, высушивают над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток промывают эфиром, чтобы получить 2,90 г (56%) метилового эфира 1-метилбензимидазол-6-карбоновой кислоты.
Физико-химические свойства: ЯМР (СДCl3): δ 3,82 (3Н, синглет), 3,91 (3Н, синглет), 7,71 (1H, дублет, I 9 Гц), 7,84-8,20 (3Н, мультиплет). В 40 мл этанола растворяют 2,80 г указанного соединения и к раствору постепенно по каплям добавляют 1 мл конц. серной кислоты при комнатной температуре. Получающиеся кристаллы собирают фильтрацией, тщательно промывают этанолом и высушивают, чтобы получить 3,78 г сульфата метилового эфира 1-метилбензимидазол-6-карбоновой кислоты. (д)  · HCl
· HCl
Раствор 3,39 г сульфата метилового эфира 1-метилбензимидазол-6-карбоновой кислоты в 70 мл уксусной кислоты кристаллически гидрируют при 90оС в течение 6 ч под давлением 60 атм, используя в качестве катализатора 1,9 г 5% -ного палладия на угле. После фильтрации катализатора реакционный раствор концентрируют при пониженном давлении, к концентрату добавляют этилацетат, после чего подвергают экстракции с помощью 1 н. НСl. Водную фазу подщелачивают карбонатом калия и экстрагируют хлороформом. Хлороформную фазу промывают насыщенным водным раствором хлористого натрия, высушивают над безводным сульфатом магния и концентрируют при пониженном давлении, чтобы получить 2,10 г (92% ) метилового эфира 1-метил-4,5,6,7-тетрагидробензимидазол-6-карбоновой кислоты.
Указанный сложный эфир 2,05 г перемешивают при 100оС в течение ночи в 60 мл 3 н. раствора НСl. Реакционный раствор концентрируют при пониженном давлении и остаток промывают ацетоном, чтобы получить 2,19 г (96%) хлоргидрата 1-метил-4,5,6,7-тетрагидробензимидазол-6-карбоновой кислоты.
Физико-химические свойства: ЯМР (ДМСО-d6) -СН3ОД (1:2): δ 1,70-2,51 (2Н, мультиплет), 2,57-3,20 (5Н, мультиплет), 3,82 (3Н, синглет), 8,75 (1H, синглет), 8,75 (1H, синглет).
П р и м е р 21.
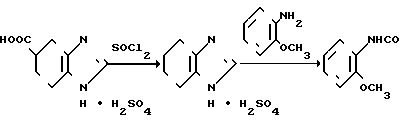

В 50 мл 1,2-дихлорэтана и 3 мл хлористого тионила перемешивают 5,42 г сульфата 4,5,6,7-тетрагидробензимидазол-5-карбоно-вой кислоты при температуре от 55 до 60оС в течение часа. Растворитель отгоняют при пониженном давлении и к остатку добавляют 50 мл 1,2-дихлорэтана, который затем заново отгоняют при пониженном давлении. К остатку добавляют 50 мл 1,2-дихлорэтана. При перемешивании к смеси по каплям прибавляют 6,25 г орто-анизидина при температуре ниже 30оС. После завершения прибавления смесь перемешивают при комнатной температуре в течении 2 ч и реакционный раствор добавляют к смеси 60 мл воды и 30 мл метанола. После этого рН доводят примерно до 4,8 с помощью 10% -ного раствора гидроокиси натрия и органическую фазу отделяют. К водной фазе добавляют 15 мл метанола. При перемешивании и охлаждении со льдом рН постепенно доводят до 11,0 с помощью 10%-ной гидроокиси натрия. Получающиеся кристаллы собирают и промывают смесью охлажденной воды и метанола (3: 1), чтобы получить 5,62 г (выход, более чем 100%) N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбо-ксамида.
Физико-химические свойства: Температура плавления 100-101оС. Элементный анализ (в виде С15Н17 N3O2х 1,5 H2O). Вычислено, С 60,39; Н 6,76; N 14,08. Найдено, С 60,48; Н 6,41; N 14,04. ЯМР (СДСl3-ДМСО-d6): δ 1,80-2,40 (2Н, мультиплет), 2,52-3,04 (5Н, мультиплет), 3,90 (3Н, синглет), 6,80-7,12 (3Н, мультиплет), 7,40 (1H, синглет), 8,12-8,28 (1H, двойной дублет), 8,30 (1H, уширенный синглет). Масс-спектр (ЕI): м/е 271 (М+).
П р и м е р 22. В этаноле растворяют 5,07 г N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида, полученного в примере 21, и обрабатывают раствор смесью этанола и хлористоводородной кислоты, чтобы получить 5,66 г (выход 98,4%) хлоргидрата N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства: Температура плавления более 250оС. Элементный анализ (в виде С15Н17N3O2 х HCl). Вычислено, С 58,54; Н 5,89; N 13,65; Cl 11,52. Найдено, С 58,24; Н 5,98; N 13,48; Cl 11,68. Масс-спектр (ЕI): м/е 271 (М+, в виде свободного основания).
П р и м е р 23.
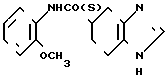 · HCl Хлоргидрат (S)-(-)-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбо- ксамида. (а). В 70 мл метанола растворяют 5,0 г (±) -N-(2-метоксифенил)-4,5,6,7-тетрагидробе-нзимидазол-5-карбоксамида, полученного в примере 21, и к раствору добавляют раствор 3,47 г (-)-дибензоилвинной кислоты в 300 мл метанола. Получающиеся кристаллы собирают фильтрацией. Кристаллы перекристаллизовывают дважды из диметилформамида и воды, чтобы получить 1,89 г (-)-дибензоилтетрата (S)-(-)-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида, показывающего вращение -55,9о (20оС, Д линия натрия, С 1,02 г/дл, диметилформамид).
· HCl Хлоргидрат (S)-(-)-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбо- ксамида. (а). В 70 мл метанола растворяют 5,0 г (±) -N-(2-метоксифенил)-4,5,6,7-тетрагидробе-нзимидазол-5-карбоксамида, полученного в примере 21, и к раствору добавляют раствор 3,47 г (-)-дибензоилвинной кислоты в 300 мл метанола. Получающиеся кристаллы собирают фильтрацией. Кристаллы перекристаллизовывают дважды из диметилформамида и воды, чтобы получить 1,89 г (-)-дибензоилтетрата (S)-(-)-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида, показывающего вращение -55,9о (20оС, Д линия натрия, С 1,02 г/дл, диметилформамид).
Физико-химические свойства: Температура плавления 142,0-143,5оС. Элементный анализ (в виде С15Н17N3O2˙ C18H14O8˙1,2 H2O). Вычислено, С 60,86; Н 5,17; N 6,45. Найдено, С 60,86; Н 5,17; N 6,61. Масс-спектр (ЕI): м/е 271 (М+, в виде свободного основания).
(б). К 2 н. соляной кислоте добавляют 1,70 г упомянутого тартрата. После промывания этилацетатом к водной фазе добавляют карбонат натрия, чтобы довести рН примерно до 9. Водная фаза экстрагируется смесью хлороформа и метанола (4:1). После высушивания экстракта над безводным сульфатом магния отгоняют растворитель. Перекристаллизация 0,15 г получающегося пенистого вещества из смеси этанола и воды дает 0,1 г (S)-(-)-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамида, показывающего вращение -27,0о (20оС, Д линия натрия, С 1,08 г/дл, метанол), в виде кристаллов.
Физико-химические свойства: Температура плавления 99,5-100,5оС. Элементный анализ (в виде С15Н17N3O2x xH2O). Вычислено, С 62,27; Н 6,62; N 14,52. Найдено, С 62,33; Н 6,67; N 14,55. Масс-спектр (ЕI): м/е 271 (М+).
(в). Соединение, полученное выше, растворяют в смеси этанола и этилацетата и раствор обрабатывают раствором хлористого водорода в этилацетате, чтобы получить 0,49 г хлоргидрата (S)-(-)-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5- карбоксамида, показывающего вращение -12,2оС (20оС, Д линия натрия, С 1,08 г/дл), в виде кристаллов.
Физико-химические свойства: Температура плавления 215-222оС (разложение). Элементный анализ (в виде С15Н17N3O2) HCl ˙0,5 H2O). Вычислено, С 56,87; Н 6,05; N 13,26. Найдено, С 56,77; Н 6,01; N 13,24. Масс-спектр (ЕI): м/е 271 (М+, в виде свободного основания).
П р и м е р 24.
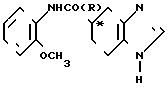 · HCl Хлоргидрат (R)-(+ )-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбо- ксамид (+)-дибензоил-тартрат, показывающий вращение +56,1о (20оС, Д линия натрия, С 1,03 г/дл, диметилформамид) получают в виде кристаллов, используя (+)-дибензоил-винную кислоту, по способу, описанному в примере 23 (а).
· HCl Хлоргидрат (R)-(+ )-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбо- ксамид (+)-дибензоил-тартрат, показывающий вращение +56,1о (20оС, Д линия натрия, С 1,03 г/дл, диметилформамид) получают в виде кристаллов, используя (+)-дибензоил-винную кислоту, по способу, описанному в примере 23 (а).
Физико-химические свойства: Температура плавления 139,0-141,0оС. Элементный анализ (в виде С15Н17N3O2х xC18H14O8 ˙1,1 H2O). Вычислено. С 61,03; Н 5,15; N 6,47. Найдено, С 60,99; Н 5,11; N 6,57. Масс-спектр (ЕI): м/е 271 (М+, в виде свободного основания).
(б). (R)-(+)-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамид, показывающий вращение +27,4оС (20оС, Д линия натрия, С 1,04 г/дл, метанол), получают в виде кристаллов из тартрата, полученного в примере (а) по способу, описанному в примере 23 (б).
Физико-химические свойства: Температура плавления 100,0-101,0оС. Элементный анализ (в виде С15Н17N3O2˙ ˙H2O). Вычислено, С 62,27; Н 6,62; N 14,52. Найдено, С 62,07; Н 6,65; N 14,51. Масс-спектр (ЕI): м/е, 271 (М+). (в). (R)-(+)-N-(2-метоксифенил)-4,5,6,7-тетрагидробензимидазол-5-карбоксамид хлоргидрат, показывающий вращение +12,3о (20оС, Д линия натрия, С 1,09 г/дл, метанол), получают в виде кристаллов из соединения, полученного в примере (б) по способу, описанному в примере 23 (в).
Физико-химические свойства: Температура плавления 217-223оС. Элементный анализ (в виде С15Н17N3O2˙ ˙HCl). Вычислено, С 58,54; Н 6,01; N 13,24. Найдено, С 58,54; Н 5,93; N 13,59. Масс-спектр (ЕI): м/е 217 (М+, в виде свободного основания).
Следующие соединения получают по способу, описанному в примере 21.
П р и м е р 25.
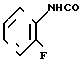
 N-(2-фторфенил)-4,5,6,7-тетрагидробензи-мидазол-5-карбоксамид.
N-(2-фторфенил)-4,5,6,7-тетрагидробензи-мидазол-5-карбоксамид.
Физические свойства: Температура плавления 164-165оС. Элементный анализ (в виде С14Н14N3OF ˙H2O). Вычислено, С 60,64; Н 5,82; N 15,15; F 6,85. Найдено, С 60,82; Н 5,79; N 15,18; F 6,83. Масс-спектр (ЕI): м/е 259 (М+).
П р и м е р 26.
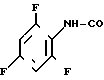
 N-(2,4,6-трифторфенил)-4,5,6,7-тетрагидро- бензимидазол-5-карбоксамид.
N-(2,4,6-трифторфенил)-4,5,6,7-тетрагидро- бензимидазол-5-карбоксамид.
Физико-химические свойства: Температура плавления 223-224оС. Элементный анализ (в виде С14Н12 N3OF3˙ ˙0,4 H2O). Вычислено, С 55,59; Н 4,27; N 13,89; F 18,84. Найдено, С 55,53; Н 4,43; N 13,84; F 18,75. Масс-спектр (ЕI): м/е 295 (М+).
П р и м е р 27.
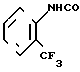
 N-(2-трифторметилфенил)-4,5,6,7-тетрагид- робензимидазол-5-карбоксамид.
N-(2-трифторметилфенил)-4,5,6,7-тетрагид- робензимидазол-5-карбоксамид.
Физико-химические свойства: Температура плавления 222-223оС. Элементный анализ (в виде С15Н14 N3OF3˙ ˙0,5 Н2O). Вычислено, С 56,60; Н 4,75; N 13,20; F 17,90. Найдено, С 56,51; Н 4,74; N 13,16; F 17,13. Масс-спектр (ЕI): м/е 309 (М+).
П р и м е р 28.
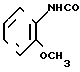
Хлоргидрат 1-метил-4,5,6,7-тетрагидробензимидазол-6-карбоновой кислоты, полученный в примере 4, обрабатывают по способу, описанному в примере 21, и в дальнейшем превращают в фумарат по известному методу, чтобы получить фумарат N-(2-метоксифенил)-1-метил-4,5,6,7-тетра-гидробензимидазол-6-карбоксамида.
Физико-химические свойства: Температура плавления 188-190оС (метанол-ацетонитрил). Элементный анализ (в виде С16Н19 N3O2˙ C4H4O4 ˙H2O). Вычислено,
С 57,27; Н 6,01; N 10,02. Найдено, С 57,56; Н 5,56; N 10,12. Масс-спектр (ЕI): м/е 285 (М+ в виде свободного основания). ЯМР (ДМСО-d6): δ 1,48-2,16 (2Н, мультиплет), 2,34-3,13 (5Н, мультиплет), 3,50 (3Н, синглет, 3,79 (3Н, синглет), 6,56 (2Н, синглет), 6,72-7,13) (3Н, мультиплет), 7,68 (1H, синглет), 7,88 (1H, дублет, I 8 Гц), 9,16 (1Н, синглет).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ТЕТРАГИДРОБЕНЗИМИДАЗОЛА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ СОЛИ | 1990 |
|
RU2024516C1 |
| Способ получения 4,5,6,7-тетрагидробензимидазольных производных | 1989 |
|
SU1836358A3 |
| ПРОИЗВОДНОЕ СКОНДЕНСИРОВАННОГО ПИРАЗИНА | 1991 |
|
RU2095352C1 |
| ПРОИЗВОДНЫЕ ПИРРОЛО(2,1-b)ТИАЗОЛА И ПРОИЗВОДНЫЕ 2-ТИОКСОПИРРОЛИДИНА В КАЧЕСТВЕ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ДЛЯ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРРОЛО(2,1-b)ТИАЗОЛА | 1991 |
|
RU2026288C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦЕФЕМА | 1989 |
|
RU2007408C1 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО АМИДА ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ОБЛАДАЮЩАЯ АНТИАЦЕТИЛХОЛИНЭСТЕРОДНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2010794C1 |
| ПРОИЗВОДНЫЕ ИНДОЛИЛПИПЕРИДИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1991 |
|
RU2039056C1 |
| СПИРОСОЕДИНЕНИЕ ИЛИ ЕГО СОЛИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, ОБЛАДАЮЩАЯ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ | 1989 |
|
RU2094432C1 |
| ПРОИЗВОДНЫЕ ТИАЗОЛА | 1991 |
|
RU2048468C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТИАЗОЛА ИЛИ ИХ СОЛЕЙ С ГАЛОИДВОДОРОДНОЙ КИСЛОТОЙ | 1990 |
|
RU2010026C1 |

Использование: в качестве лекарственных средств. Сущность изобретения: соединение ф-лы 1, где R1-R3, R4,R5 и R6 , независимо, атом водорода или низшая алкильная группа, X - атом кислорода или атом серы, его таутомеров или его фармацевтически приемлемая соль. Соединение ф-лы 1: 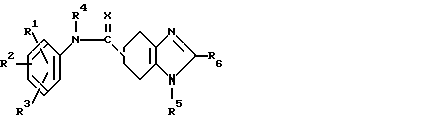 3 з.п. ф-лы, 1 табл.
3 з.п. ф-лы, 1 табл.
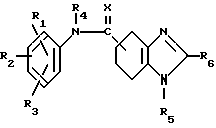
где R1 R3 независимо представляют атом водорода, оксигруппу, атом галогена, низшую алкильную группу, которая необязательно может быть замещенной атомом галогена, низшую алкоксигруппу, низшую алкилтиогруппу, аралилоксигруппу, арилоксигруппу, низшую алканоильную группу, карбоксигруппу, низшую алкоксикарбонильную группу или нитрогруппу;
R4, R5 и R6 независимо представляют атом водорода или низшую алкильную группу;
X атом кислорода или атом серы, или его таутомер, или его фармацевтически приемлемая соль.
| ДОЗИМЕТР МАГНИТОТЕРАПЕВТИЧЕСКИХ ПРОЦЕДУР | 1993 |
|
RU2125398C1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Колосниковая решетка с чередующимися неподвижными и движущимися возвратно-поступательно колосниками | 1917 |
|
SU1984A1 |
Авторы
Даты
1995-04-20—Публикация
1991-10-14—Подача