Изобретение относится к биотехнологии и может быть использовано для получения стабильных форм иммунобиологических препаратов.
Для сохранения специфических свойств биопрепаратов при лиофилизации и хранении используют стабилизирующие составы, основу которых составляют, как правило, белковые (полипептидные) и углеводные компоненты. Сыворотки крови являются сложными биологическими смесями, основу которых составляют белки. В силу этого сыворотки крови нашли широкое применение в качестве стабилизирующих составов при лиофилизации биопрепаратов [1] .
Действующее начало положительной сыворотки - специфические антитела. Стабилизирующий состав должен, во-первых, способствовать сохранению активности антител, во-вторых, предотвращать появление ложноположительного сигнала за счет неспецифической сорбции компонентов сыворотки. Белковые компоненты положительной сыворотки являются защитной средой для специфических антител, однако они не обеспечивают полного сохранения активности антител при лиофилизации и хранении.
Известны стабилизирующие составы для получения лиофилизированных препаратов сывороток и плазмы крови человека, включающие углеводы [2] , например сахароза, глюкоза.
Недостатком таких составов является то, что при их использовании в процессе лиофилизации достижение заданной влажности (1-3% ) препарата затруднено и требует специальных режимов досушивания. Кроме того, они не обеспечивают сохранение сигнала в иммуноферментном анализе (ИФА) при хранении при положительных температурах.
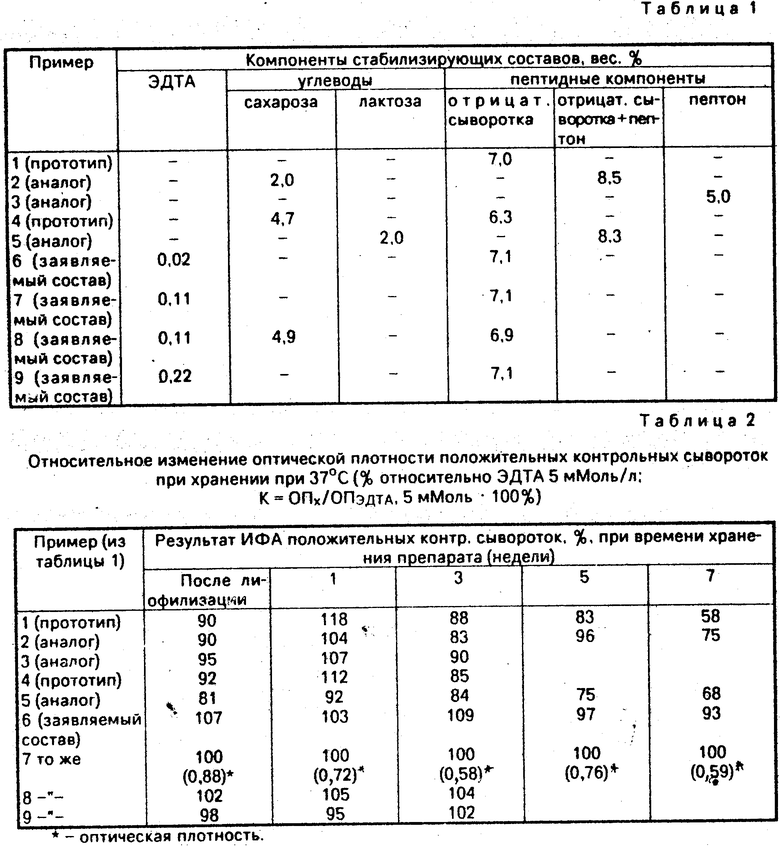
Наиболее близким техническим решением (прототипом) является стабилизирующий состав для получения лиофилизированных контрольных положительных сывороток крови на антитела к вирусу иммунодефицита человека (ВИЧ-1), включающий пептидные и/или смесь пептидных и углеводных компонентов [3] . В качестве пептидных компонентов используют отрицательную сыворотку крови человека, не содержащую специфические антитела к ВИЧ-1 (7,0% ), а в качестве смеси пептидных и углеводных компонентов - сыворотку крови человека, не содержащую специфические антитела к ВИЧ-1 (6,3% ) и сахарозу (4,7).
Недостатком стабилизирующего состава-прототипа является то, что он не достаточно обеспечивает сохранение сигнала в ИФА при хранении положительных контрольных сывороток, используемых в тест-системах для определения специфических антител.
В основу изобретения поставлена задача создания такого стабилизирующего состава, который обеспечивал бы сохранение сигнала в ИФА за счет снижения потерь специфической активности положительных контрольных сывороток (при их хранении), используемых в тест-системах для определения специфических антител.
Поставленная задача решается тем, что в стабилизирующий состав, включающий пептидные и/или смесь пептидных и углеводных компонентов, согласно изобретению, дополнительно вводят этилендиамин- тетраацетата (ЭДТА) при следующем соотношении компонентов, мас. % :
Этилендиаминтет-
раацетат (ЭДТА) 0,02-0,22% ;
Пептидные и/или смесь
пептидных и углеводных
компонентов 1-20%
Вода Остальное.
В состав дополнительно вводят этилендиаминтетраацетат при следующем соотношении всех компонентов, мас. % :
Этилендиаминтетра-
ацетат 0,02-0,22% ;
Пептидные и/или смесь
пептидных и
углеводных компонентов 1-20% ;
Вода Остальное.
Сравнение заявляемого стабилизирующего состава с известными составами того же назначения показывает, что отличительные от прототипа компоненты состава и их количественное соотношение обеспечивают новое, неизвестное ранее свойство, а именно снижение потерь специфической активности при хранении положительных контрольных сывороток, используемых в тест-системах для определения специфических антител. Снижение потерь специфической активности при хранении препарата обусловлено тем, что введение в состав ЭДТА обеспечивает связывание ионов тяжелых металлов в растворе препарата. Ионы тяжелых металлов являются инициаторами перекисных процессов в лиофилизированном препарате. Устранение процессов окисления обеспечивает сохранение биологической активности препарата при его хранении.
Получение заявляемого стабилизирующего состава приведено на примерах их подготовки для получения лиофилизированных положительных контрольных сывороток, используемых в тест-системах для определения специфических антител к вирусу иммунодефицита человека (ВИЧ-1). Компоненты стабилизатора (ЭДТА, пептидные компоненты или смесь пептидных и углеводных компонентов) перемешивают при комнатной температуре до полного растворения. Полученный раствор добавляют в положительные на антитела к ВИЧ-1 сыворотки для получения требуемой степени разбавления (обычно от 1/10 до 1/100). Препарат разливают по 0,1 мл во флаконы объемом 5-10 мл. Замораживание проводят при -60оС в течение 10-16 ч. После чего проводят вакуумное обезвоживание, причем температура материала на этапе сублимации льда не превышает -35оС. Скорость нагревания на этапе досушивания составляет 4-6оС/ч. Конечная температура матриала 25оС. Общее время вакуумного обезвоживания 20 ч. По окончании лиофилизации флаконы укупоривают под вакуумом. Остаточную влажность препарата определяют по стандартной методике, величина которой для всех экспериментальных образцов не превышает 2% .
Примеры стабилизирующих составов (прошедших экспериментальную проверку) приведены в табл. 1.
Следует отметить, что нижний предел концентрации ЭДТА (0,02% ) в составе ограничен погрешностью приготовления раствора заданной концентрации (погрешнос- тью взвешивания). Использование в составе больших концентраций ЭДТА (более 0,22% ) нецелесообразно, так как увеличение концентрации не приводит к увеличению стабилизирующего эффекта. Нижний предел (1% ) пептидных компонентов или их смеси с углеводами обосновывается тем, что при меньшей их концентрации не образуется таблетка (препарат не имеет товарного вида, возникают трудности с определением остаточной влажности). Верхний предел (20% ) этих компонентов ограничен тем, что при большем содержании сухого остатка резко увеличивается вязкость жидкого продукта, что технологически усложняет розлив препарата.
Активность специфических антител в положительных сыворотках определяли методом иммуноферментного анализа (ИФА) после лиофилизации и в процессе хранения при 37оС. ИФА проводили в тест-системе "Рекомбинант ВИЧ" производства НПО "Вектор" в соответствии с инструкцией по применению. Специфическая активность антител определяется после взаимодействия антигена, сорбированного на планшете, с антителами сыворотки и проявления провзаимодействовавших антител конъюгатом белка А с пероксидазой хрена. Специфическая активность выражается в единицах оптической плотности (ОП) при λ = 492 нм (где λ - длина волны).
Результаты ИФА положительных контрольных сывороток при хранении приведены в табл. 2. Результаты показывают, что при хранении при 37оС препаратов с составами, содержащими ЭДТА, имеют большее сохранение специфической активности, чем составы без ЭДТА. Специфическая активность положительной сыворотки, приготовленной с заявляемыми составами, сохраняется в течение времени наблюдения (7 нед. ), в пределах погрешности воспроизводимости. Активность положительной сыворотки с предлагаемым составом выше после трех недель выдерживания при 37оС по сравнению с прототипом и аналогами и при увеличении срока хранения разница заметно увеличивается (в 1,4-1,9 раза). Более высокая активность положительной сыворотки (пример 1, табл. 1) через 1 нед. хранения объясняется ростом неспецифического сигнала (показано для сыворотки, заведомо несодержащей антитела к ВИЧ-1).
Погрешность сходимости результатов составляет 5% . Расчеты произведены относительно ЭДТА 5 мМоль/л исходя из того, что указанное количество ЭДТА является наиболее оптимальным в заявляемом соотношении компонентов состава. Следует отметить, что предлагаемый стабилизирующий состав (в заявляемом соотношении компонентов) может быть использован для контрольных сывороток, используемых в тест-системах для определения антител не только к ВИЧ-1, но и к другим вирусам или микроорганизмам. Действующим началом контрольной сыворотки являются специфические антитела. Специфические антитела к различным антигенам (например, ВИЧ, вирус герпеса и т. п. ) имеют общее строение, отличаясь лишь отдельными аминокислотными заменами в вариабельной части. Действие ЭДТА, как компонента стабилизирующего состава, основано на связывании ионов тяжелых металлов, что затормаживает процессы окисления и модифицирует окружение антитела. Поэтому защитное действие стабилизирующего состава на положительные сыворотки, содержащие антитела к различным антигенам (вирусов, микроорагнизмов), будет одинаково эффективным при одном и том же соотношении компонентов заявляемого состава.
Предлагаемый стабилизирующий состав по сравнению с прототипом [3] и аналогами [2] позволяет снизить потери специфической активности (в 1,4-1,9 и более раз) положительных контрольных сывороток (при их хранении), используемых в тест-системах для определения специфических антител к вирусам или микроорганизмам. (56) 1. Долинов. Основы технологии сухих биопрепаратов, М. , 1969, с. 208.
2. Подольский М. В. Высушивание препаратов крови и кровезаменителей. М. : Медицина, 1973, с. 101-102.
3. Экспериментально-производственный регламент "Тес-система иммуноферментная для выявления антител к вирусу иммунодефицита человека "Рекомбиат ВЧЧ" НПО "Вектор", Новосибирск, 1988, с. 1-7.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛИЗИРУЮЩИЙ СОСТАВ ДЛЯ ПОЛУЧЕНИЯ РЕФЕРЕНС-СЫВОРОТОК, СОДЕРЖАЩИХ IGM-АНТИТЕЛА | 1997 |
|
RU2136313C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТАНДАРТНОЙ ПОЗИТИВНОЙ ПАНЕЛИ СЫВОРОТОК ДЛЯ КОНТРОЛЯ КАЧЕСТВА ИММУНОФЕРМЕНТНЫХ ТЕСТ-СИСТЕМ И ИММУНОБЛОТОВ | 1993 |
|
RU2094807C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИОФИЛИЗИРОВАННОГО ПРЕПАРАТА КРОВЬ ГЕМОЛИЗИРОВАННАЯ | 2011 |
|
RU2455014C1 |
| Способ получения стандартного образца содержания антител IgG человека к вирусу клещевого энцефалита | 2020 |
|
RU2735782C1 |
| ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В И СПОСОБ ОПРЕДЕЛЕНИЯ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСНОГО ГЕПАТИТА В | 2006 |
|
RU2325655C9 |
| СПОСОБ ХРАНЕНИЯ СЫВОРОТОК КРОВИ С АНТИТЕЛАМИ К ВОЗБУДИТЕЛЯМ ПАРАЗИТАРНЫХ БОЛЕЗНЕЙ | 2019 |
|
RU2704134C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕФЕРЕНС-ПАНЕЛИ ОБРАЗЦОВ СЫВОРОТОК, ПРЕДНАЗНАЧЕННОЙ ДЛЯ ОЦЕНКИ СПЕЦИФИЧНОСТИ РЕЗУЛЬТАТОВ СЕРОЛОГИЧЕСКОЙ ДИАГНОСТИКИ СОЦИАЛЬНО ЗНАЧИМЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2521232C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ОТРАСЛЕВОГО СТАНДАРТНОГО ОБРАЗЦА (ОСО) ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В (HBsAg) ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ И ОПРЕДЕЛЕНИЯ КОЛИЧЕСТВЕННОГО СОДЕРЖАНИЯ АНТИГЕНА В СЫВОРОТКЕ (ПЛАЗМЕ) И ПРЕПАРАТАХ КРОВИ ЧЕЛОВЕКА МЕТОДОМ ИФА | 2007 |
|
RU2342158C2 |
| СТАБИЛИЗИРУЮЩИЙ СОСТАВ ДЛЯ ПОЛУЧЕНИЯ ЛИОФИЛИЗИРОВАННЫХ ПРЕПАРАТОВ НА ОСНОВЕ КОНЪЮГАТА БЕЛКА А И ПЕРОКСИДАЗЫ ХРЕНА | 1991 |
|
RU2046342C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕФЕРЕНС-ПАНЕЛИ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ И ВАКЦИН ПРОТИВ ГЕПАТИТА В | 1999 |
|
RU2181893C2 |
Изобретение относится к биотехнологии и может быть использовано для получения стабильных форм иммунобиологических препаратов. Сущность применения: состав для получения лиофилизированных препаратов, включающий пептидные и/или смесь пептидных и углеводных компонентов и этилендиаминтетраацетат, готовят при следующем соотношении компонентов, мас. % : этилендиаминтетраацетат - 0,02 - 0,22; пептидные и/или смесь пептидных и углеводных компонентов 1 - 20; вода - остальное. Состав обеспечивает сохранение сигнала в иммуноферментном анализе за счет снижения потерь специфической активности положительных контрольных сывороток при их хранении. 2 табл.
СТАБИЛИЗИРУЮЩИЙ СОСТАВ ДЛЯ ПОЛУЧЕНИЯ ЛИОФИЛИЗИРОВАННЫХ ПОЛОЖИТЕЛЬНЫХ КОНТРОЛЬНЫХ СЫВОРОТОК ИСПОЛЬЗУЕМЫХ В ТЕСТ-СИСТЕМАХ ДЛЯ ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К ВИРУСАМ И МИКРООРГАНИЗМАМ, включающий пептидные и/или смесь пептидных и углеводородных компонентов, воду, отличающийся тем, что состав дополнительно содержит этилендиаминтетраацетат при следующем соотношении компонентов, мас. % :
Этилендиаминтетраацетат 0,02 - 0,22
Пептидные и/или смесь пептидных и углеводородных компонентов 1 - 20
Вода Остальное
Авторы
Даты
1994-04-15—Публикация
1992-03-26—Подача