Изобретение относится к способам получения ацетиленовых кетоэпоксидов, конкретно к ацетиленовым кетоэпоксидам общей формулы
R1-C ≡ C- -CH
-CH H-R2, где R1 - фенил; R2 - водород или низший алкил.
H-R2, где R1 - фенил; R2 - водород или низший алкил.
Соединения данного класса представляют интерес в связи с антимикотической и другими видами физиологической активности.
Известен четырехстадийный способ получения ацетиленовых кетоэпоксидов, исходя из непредельных кетонов, включающий стадии эпоксидирования α , β -непредельных кетонов, конденсацию эпоксидов с бензальдегидом, бромирование полученного продукта и дегидробромирование дибромэпоксидов триэтиламином (1). Недостатком данного способа является многостадийность и невысокий выход конечных продуктов несмотря на то, что в первых промежуточных стадиях выходы достигают 70-80%. Из-за низкого выхода в конечной стадии (20-30%) и большого числа стадий суммарный выход конечных продуктов составляет 7-15%.
Наиболее близким к предлагаемому решению является способ получения ацетиленовых кетоэпоксидов путем жидкофазного окисления вторичных ениновых спиртов (2). Достоинством данного способа является меньшее число стадий, а недостатком - низкий выход 3-5% и сложность выделения целевых продуктов из смеси продуктов окисления.
Цель изобретения - увеличение выхода и упрощение процесса.
Поставленная цель достигается предложенным способом получения ацетиленовых кетоэпоксидов формулы 1, отличительной особенностью которого является то, что проводят одновременное раздельное прибавление к ацетоновым растворам соответствующих сопряженных ениновых кетонов 15-20%-ного раствора пероксида водорода и 1-5%-ного раствора гидрокарбоната натрия при соотношении скоростей прибавления растворов гидрокарбоната натрия и пероксида водорода 1:(4-10).
Желательно процесс вести в присутствии гидрохинона в количестве 1-2 г на моль кетона.
Ениновые кетоны растворяют в 8-12-кратном по объему количестве ацетона. Смесь одновременно из двух разных капельных воронок при перемешивании прибавляют 15-20%-ный раствор пероксида водорода и 1-5%-ный раствор гидрокарбоната натрия. Необходимым условием является прибавление пероксида водорода с большей скоростью, чем гидрокарбоната натрия. Скорость прибавления пероксида водорода в 4-10 раз выше. После прикапывания указанных компонентов перемешивание проводят при pH 8-9, поддерживая pH в указанных пределах периодическим прибавлением малых количеств 0,05-0,2 н. раствора KOH или NaOH. Несоблюдение любых из указанных условий ведет к резкому падению выхода или к нулевому выходу. Молярное соотношение компонентов: кетон, пероксид водорода, гидрокарбонат натрия - 1:1,5-2:0,1-0,2.
После окончания реакции смесь нейтрализуют 10% H2SO4, ацетон отгоняют в вакууме, остаток экстрагируют эфиром, промывают насыщенным раствором сульфата аммония, сушат безводным сульфатом магния. Эфир упаривают, остаток очищают перегонкой в вакууме в присутствии гидрохинона или очисткой методом колоночной хроматографии. Вместо промывки раствором сульфата аммония можно разлагать избыток пероксида водорода двуокисью марганца. При хроматографической очистке выходы достигают 80-90%, однако чистота продуктов ниже.
Несоблюдение этих условий и увеличение температуры выше -5оС приводит к нулевым выходам. Замена ацетона на метанол также ухудшает протекание реакции.
При эпоксидировании ацетиленовых кетонов смесями пероксида водорода и едкого натра или гидрокарбоната натрия в молярных соотношениях кетон, пероксид водорода, едкий натр или гидрокарбонат натрия 1:(2-2,5):(0,2-0,4) получены следующие результаты.
15% H2O2, 4н. NaOH, ацетон - выход 0%
20% H2O2, 1н. NaOH, метанол - выход 0%
27% H2O2, 4н. NaOH, метанол - выход 0%
30% H2O2, 1н. NaOH, метанол - выход 0%
20% H2O2, 5% NaHCO3, ацетон - выход 0%.
Образование эпоксидов в этих опытах не отмечено, хотя расходование ениновых кетонов наблюдалось. При раздельном прибавлении 27 % H2O2 и 1н. NaOH при скоростях 4:1 выделить эпоксиды также не удалось. При раздельном прибавлении 27% H2O2 и 5% NaHCO3 при равном соотношении скоростей прибавления, в продуктах реакции по данным ТСХ образуются ацетиленовые кетоэпоксиды, однако выделить и очистить их не удалось.
П р и м е р 1. 1-Фенил-4,5-эпокси-1-пентин-3-он (I).
В трехгорлую колбу, снабженную механической мешалкой и двумя капельными воронками, помещают 12 г 1-фенил-4-пентен-1-ин-3-она (II), растворенного в 100 мл ацетона, добавляют 100 мг гидрохинона. При энергичном перемешивании и охлаждении до -15-10оС одновременно прибавляют 28 мл 18%-ного раствора H2O2 и 42 мл 2%-ного раствора NaHCO3.
Скорость прибавления гидрокарбоната натрия в 6 раз ниже, чем пероксида водорода. Время прибавления 1 ч. Смесь перемешивают в течение 3 ч, поддерживая pH среды в пределах 8-9 добавлением 0,1 н. раствора KOH. После окончания реакции реакционную смесь нейтрализуют 10%-ным раствором серной кислоты, ацетон упаривают в вакууме, смесь экстрагируют эфиром, промывают насыщенным раствором сульфата аммония сушат безводным сульфатом магния, эфир отгоняют в вакууме. Получают 8,7 г эпоксида (I), выход 66%, Т.кип. 104-105оС /2 мм рт.ст., Т.пл. 28-29оС.
ИК спектр ν, см-1: 2250-C≡С-; 1675-С=O, 1235, 960, 880-триплет эпоксицикла.
Спектр ПМР δ, м.д.: 3,12-СН3, 3,52-СН, 7,40-C2H5 (2).
П р и м е р 2. 1-Фенил-4,5-эпокси-1-гексин-3-он (III).
К раствору 17 г 1-фенил-4-гексен-1-ин-3-она (IV), растворенного в 180 мл ацетона, добавляют 150 мг гидрохинона. При -15-10оС прибавляют 37 мл 18% H2O2 и 54 мл 2%-ного раствора гидрокарбоната натрия. Скорость прибавления гидрокарбоната натрия в 10 раз ниже. Смесь перемешивают в течение 4 ч, поддерживая pH среды 8-9 добавлением 0,1 н. раствора KOH. Смесь нейтрализуют 10%-ным раствором серной кислоты, добавляют диоксид марганца для разложения избытка пероксида водорода, осадок отфильтровывают, раствор упаривают в вакууме, насыщают мелкоизмельченным хлоридом натрия, экстрагируют эфиром, сушат сульфатом магния, отгоняют эфир. Остаток фракционируют в вакууме. Получают 15,2 г вязкой жидкости. Выход 82%. Т.кип. 98-98,5оС/0,15 мм рт.ст. , nD20= = 1,4570.
ИК-спектр ν см-1: 2245 -С≡С, 1678 - С=O, 1235, 960, 880 - эпоксицикл. Спектр ПМР δ , м.д.: 1,34-1,40 - CH3, 3,14-3,28 - CH-CH, 7,30 - C6H5 (2).
П р и м е р 3. 1-Фенил-4,5-эпокси-1-пентин-3-он (1).
Аналогично примеру 1 из 7,8 г кетона (II) в 50 мл ацетона, 20 мл 15%-ного раствора H2O2 и 8,5 мл 5%-ного раствора NaHCO3. Скорость прибавления NaHCO3 в 10 раз ниже. Выход 54%.
П р и м е р 4. 1-Фенил-4,5-эпокси-1-гексин-3-он (III).
Аналогично примеру 2 из 8,5 г кетона (IV) в 50 мл ацетона и 14 мл 20% -ного раствора H2O2 и 40 мл 1%-ного раствора NaHCO3. Скорость прибавления NaHCO3 в 4 раза ниже. Выход 64%.
П р и м е р 5. 1-Фенил-4,5-эпокси-1-пентин-3-он (I).
К раствору 12,36 г 1-фенил-4-пентен-1-ин-3-она (II) в 100 мл ацетона при -15-10оС прибавляют 27 мл 18%-ного раствора H2O2 и 40 мл 2%-ного раствора NaHCO3. Скорость прибавления гидрокарбоната натрия в 6 раз ниже, чем пероксида водорода. Время прибавления реагентов 1 ч. Смесь перемешивают в течение 3 ч, поддерживая pH среды в пределах 8-9 добавлением 0,1 н. раствора KOH. Обработку реакционной смеси проводят по примеру 1. Получают 6,54 г эпоксида (I). Выход 48%.
Приведенные примеры показывают эффективность предложенного способа получения ацетиленовых кетоэпоксидов. Выходы ацетиленовых кетоэпоксидов, синтезированных по предложенному способу, в 4-20 раз выше, чем у аналога или прототипа. Наличие групп, обуславливающих антимикотическую активность и реакционно-способность эпоксидной группы, позволяет использовать ацетиленовые кетоэпоксиды в качестве промежуточных продуктов для синтеза гетероциклических соединений.
Кроме того, предложенный способ позволяет по сравнению с прототипом упростить стадию выделения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТА ДЛЯ РЕГЕНЕРАЦИИ ВОЗДУХА | 2014 |
|
RU2575025C2 |
| (22ζ)-6b-МЕТОКСИ-3a,5-ЦИКЛО-5a-ХОЛЕСТАН-24-ОН-22-ОЛ В КАЧЕСТВЕ ПОЛУПРОДУКТА В СИНТЕЗЕ (22R,23R)-3b-АЦЕТОКСИ-22,23-ИЗОПРОПИЛИДЕНДИОКСИ-24-МЕТИЛХОЛЕСТ-5-ЕНА | 1991 |
|
RU2024540C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТРУКТУРИРОВАННОГО РЕГЕНЕРАТИВНОГО ПРОДУКТА | 2015 |
|
RU2599664C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТА ДЛЯ РЕГЕНЕРАЦИИ ВОЗДУХА | 2013 |
|
RU2538902C1 |
| Способ получения гидрохинона | 2022 |
|
RU2784427C1 |
| Диацетиленовые гидроперекиси в качестве инициаторов полимеризации виниловых мономеров | 1981 |
|
SU1025100A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТА ДЛЯ РЕГЕНЕРАЦИИ ВОЗДУХА | 2013 |
|
RU2538898C1 |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОМЕГА-ИОДАЛИФАТИЧЕСКИХ КАРБОНОВЫХ КИСЛОТ И ИХ ЭФИРОВ | 2012 |
|
RU2494087C1 |
| СПОСОБ ЭПОКСИДИРОВАНИЯ ОЛЕФИНА | 1996 |
|
RU2162466C2 |
Использование: в медицине в качестве антимикробных средств. Сущность изобретения: ацетиленовые кетоэпоксиды ф-лы 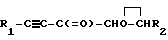 , где R1 - фенил; R2 - водород или низший алкил. Реагент 1: сопряженные ениновые кетоны. Реагент 2: пероксид водорода. Условия реакции: 15 - 20%-ный раствор пероксида водорода, 1 - 5%-ный раствор гидрокарбоната, соотношение скоростей прибавления растворов гидрокарбоната натрия и пероксида водорода 1 : (4 - 10). Желательно процесс вести в присутствии гидрохинона.
, где R1 - фенил; R2 - водород или низший алкил. Реагент 1: сопряженные ениновые кетоны. Реагент 2: пероксид водорода. Условия реакции: 15 - 20%-ный раствор пероксида водорода, 1 - 5%-ный раствор гидрокарбоната, соотношение скоростей прибавления растворов гидрокарбоната натрия и пероксида водорода 1 : (4 - 10). Желательно процесс вести в присутствии гидрохинона.
R1-C = C-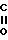 -C
-C  CH-R2,
CH-R2,
где R1 - фенил;
R2 - водород или низший алкил;
отличающийся тем, что, с целью увеличения выхода и упрощения процесса, проводят одновременное раздельное прибавление к ацетоновым растворам соответствующих сопряженных ениновых кетонов 15 - 20%-ного раствора пероксида водорода и 1 - 5% -ного раствора гидрокарбоната натрия при соотношении скоростей прибавления растворов гидрокарбоната натрия и пероксида водорода 1 : 4 - 10.
| Степин С.Г., Тищенко И.Г | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1994-10-15—Публикация
1991-05-16—Подача