Изобретение относится к органической химии, конкретно к синтезу гидрохинона, который является важным сырьем для химической и фармацевтической промышленности.
Гидрохинон является сильным восстановителем, используется в фотографии как проявитель, в химической и пищевой промышленности как антиоксидант, в аналитической химии как реагент для определения ионов некоторых металлов (ниобия, вольфрама, золота и цезия), как ингибитор реакции полимеризации виниловых мономеров, в производстве органических красителей, лекарственных средств, фотографических материалов как сырье, в косметике и медицине в средствах для отбеливания кожи.
Известен способ получения гидрохинона окислением анилина двуокисью марганца в водном растворе серной кислоты с образованием 1,4-бензохинона, который далее восстанавливают различными восстановителями - железными стружками или водородом до гидрохинона [Shearon W.H., Davy L.G., Von Bramer H. Hydroquinone manufacture // Ind. Eng. Chem. 1952. № 44. P. 1730-1735.]. Общий выход гидрохинона по анилину составляет 85%.
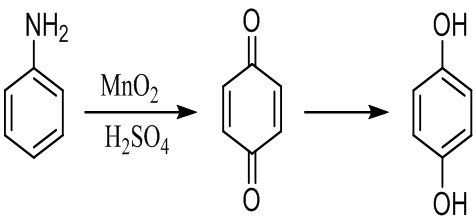
Основными недостатками данного способа являются трудоемкость выделения промежуточного 1,4-бензохинона и образование большого количества отходов (непрореагировавшая двуокись марганца, сульфат марганца, неорганические соли, продукты вторичных и побочных реакций), а также абразивный износ оборудования вследствие использования марганцевой руды.
Известен способ получения гидрохинона окислением 1,4-диизопропилбензола по Хоку. п-Диизопропилбензол окисляют воздухом в щелочной среде при 80-90 °С и получают дигидропероксид п-диизопропилбензола, который затем разлагают при 60-80 °С при катализе серной кислотой (0.2-1.0 %). Выход гидрохинона по диизопропилбензолу достигает 80%. Разложение дигидропероксида п-диизопропилбензола можно проводить также в хлорорганических растворителях [US 3798277, опубл. 19.03.1974, US 4112243, опубл.05.09.1978] и спиртах [US 3928469, опубл. 23.12.1975], в качестве катализатора использовать анионообменные смолы [ЕР 0271623, опубл. 22.06.1988], серный ангидрид [US 3923908,опубл. 02.12.1975].
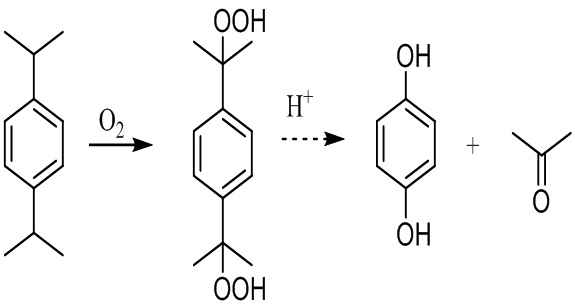
Недостаток данного способа - многостадийность, образование значительных количеств токсичных органических отходов (ацетон). Модификациями метода разложения дигидропероксида п-диизопропилбензола не удалось решить проблему образования значительных количеств токсичных органических отходов, загрязненных кислотами.
Известен способ получения гидрохинона гидроксилированием фенола пероксидом водорода в присутствии гомогенных или гетерогенных катализаторов. Окисление фенола водным раствором пероксида водорода приводит к совместному образованию катехола и гидрохинона.
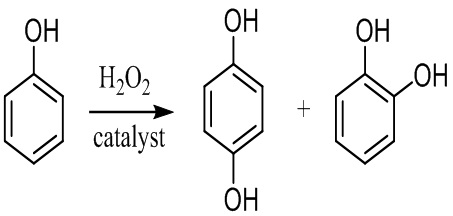
Среди гетерогенных катализаторов - силикаты титана [US 4410501. опубл. 18.10.83, US 5233097. опубл. 03.08.93], германосиликаты [EP 0346250 опубл. 13.12.89], цирконосиликаты [US 5675042. опубл. 07.10.97], макропористые гетерогенные катализаторы на основе цеолитов, модифицированных переходными металлами (Cu, Со, Мп и Fe) [Dai P.E., Petty R.H., Ingram C.W., Szostak R. Metal substituted aluminophosphate molecular sieves as phenol hydroxylation catalysts // Applied Catalysis A: General. 1996. №143. p. 101-110].
Гомогенный катализ окисления фенола проводят надмуравьиной кислотой или смесью 70%-ного водного раствора пероксида водорода с карбоновыми или минеральными кислотами, такими, как Н3РО4 или HClO4 при 90 °С [Varagnat J. Hydroquinone and Pyrocatechol Production by Direct Oxidation of Phenol // Ind. Eng. Chem., Prod. Res. Dev. 1976. V. 15. № 3. p. 212-215] либо 60%-ным водным раствором пероксида водорода в присутствии каталитических количеств солей железа и кобальта при 40 °С [Minosci F., Maggioni P. Catalytic Hydroxylation of Phenol by Hydrogen Peroxide // Chim. Ind. 1977. № 59. p. 239-242].
Недостаток способа - низкая степень конверсии фенола (10-20%), образование побочного трудноотделимого катехола, необходимость введения стадии отмывки реакционной массы от катализатора. Ни один из предложенных катализаторов не обеспечивает высокий выход по гидрохинону.
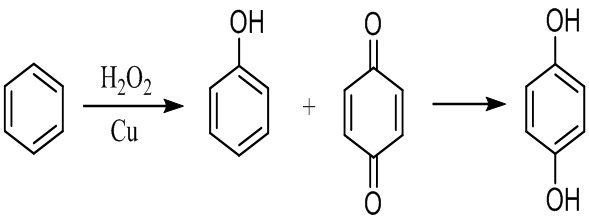
Известно прямое окисление бензола пероксидом водорода при комнатной температуре и атмосферном давлении в присутствии чистого элементарного медного катализатора или катализатора на основе соли меди (I), приводящее к образованию смеси фенола и 1,4-бензохинона, который затем восстанавливают до гидрохинона [US 9 630 899, опубл. 25.04.2017.]. Недостаток способа - невысокий выход гидрохинона, образование побочного фенола.
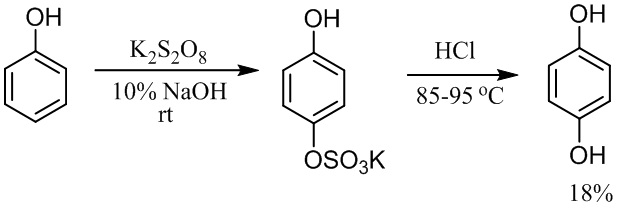
Наиболее близким к заявляемому способу получения гидрохинона является двухстадийный процесс, на первой стадии которого фенол окисляют по Эльбсу водным раствором персульфата калия в щелочной среде (10% NaOH) при комнатной температуре в течение 24 ч до промежуточного 4-гидроксифенилсульфата, реакционную смесь подкисляют, непрореагировавший фенол удаляют экстракцией диэтиловым эфиром, водную фазу подвергают гидролизу избытком HCl на кипящей водяной бане в течение 30 мин., охлаждают, экстрагируют эфиром, органическую фазу сушат, упаривают и получают гидрохинон с выходом 18% [Baker W., Brown N.C. The Elbs persulphate oxidation of phenols, and its adaptation to the preparation of monoalkyl ethers of quinols // J. Chem. Soc. 1948. P. 2303-2307]. Недостатком способа является низкий выход продукта - гидрохинона.
Задача, на решение которой направлено настоящее изобретение: получение гидрохинона, заключается в увеличении выхода целевого соединения.
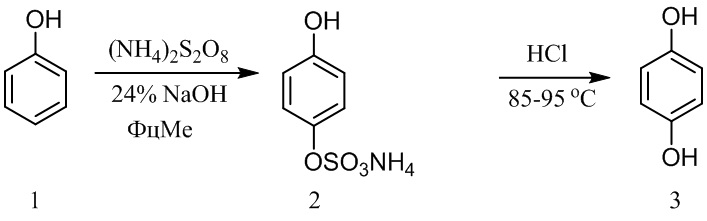
Поставленная задача решается предлагаемым способом получения гидрохинона, на первой стадии которого фенол окисляют персульфатом аммония (ПСА) или калия (ПСК) или натрия (ПСН) при 40-60 °С в щелочной среде (24% NaOH) при мольном соотношении Фенол : NaOH : ПСА (ПСК, ПСН) равном 1:1,25:3 в присутствии 0,01-0,3 мас % фталоцианинового катализатора окисления (фталоцианина кобальта или железа (II) или железа (III) или марганца или никеля или цинка - ФцМе) при перемешивании в течение 10 ч до промежуточного 4-гидроксифенилсульфата (ГФС). Затем реакционную смесь охлаждают до комнатной температуры, непрореагировавший фенол удаляют экстракцией хлороформом, путем экстракции бутанолом выделяют 4-гидроксифенилсульфат (выход 42-92%), который затем гидролизуют серной кислотой при 85-95 °С и получают гидрохинон, суммарный выход которого на исходный фенол составляет 42-85%.
Сущность заявленного технического решения подтверждается примерами конкретного выполнения.
Пример 1. Получение гидрохинона при катализе фталоцианином кобальта (табл 1., п. 2)
а) В трехгорлой колбе, снабженной обратным холодильником и механической мешалкой, к 0.016 моль фенола в 15 мл дистиллированной воды медленно приливали 15 мл 24%-ого раствора гидроксида натрия при постоянном перемешивании, затем порциями присыпали 0.048 моль надсернокислого аммония, после полного прибавления которого вносили 0,01 мас% катализатора - фталоцианина кобальта. Реакционную смесь перемешивали при температуре 45 °С в течение 10 ч, охлаждали до комнатной температуры, упаривали при пониженном давлении на 1/3 объема, экстрагировали хлороформом (2×20 мл) для удаления непрореагировавшего фенола, бутанолом (3×50 мл). Бутаноловые фракции объединяли, упаривали досуха, остаток промывали горячим этанолом, фильтрат упаривали, получали 2,2 г (67%) 4-гидроксифенилсульфата в виде густой массы светло-коричневого цвета.
б) 2,8 г (0,012 моль) 4-гидроксифенилсульфата растворяли в 20 мл дистиллированной воды при перемешивании, после полного растворения прикапывали 1,43 г 0,82 мл (0,018 моль) серной кислоты, реакционную смесь нагревали до 90 °С и выдерживали при этой температуре 3 ч, контролируя по ТСХ (элюент этанол:аммиак 4:1), охлаждали до комнатной температуры, нейтрализовывали раствором NaHCO3 до рН 7-8, упаривали при пониженном давлении, остаток экстрагировали горячим этанолом, после удаления растворителя получали 1,34 г (90%) гидрохинона в виде порошка светло-желтого цвета. В пересчете на исходный фенол выход гидрохинона составляет 60%.
Гидрохинон (3). Порошок светло-желтого цвета. Тпл=171-173°С. ЯМР 1H (DMSO-d6, δ, м.д.): 6.5 (4H, с, 4 CH), 8.6 (2H, уш.с, 2 ОН). ЯМР 13С (DMSO-d6, δ, м.д.): 115.67 (С2, С3, С5, С6), 149.73 (С1-ОН, С4-ОН).
Результаты экспериментов с варьированием количества и вида катализатора, а также окислителя приведены в табл. 1-3, пп 1,3-52. Оптимальные продолжительность окисления, мольное соотношение реагентов и температура установлены в предварительных экспериментах.
Таким образом, предложен простой в аппаратурном оформлении способ получения гидрохинона, позволяющий получить целевое соединение с выходом до 85%, суммарно в пересчете на исходный фенол.
| название | год | авторы | номер документа |
|---|---|---|---|
| Каталитический способ получения фенола | 2023 |
|
RU2838430C2 |
| Эффективный способ получения фенола | 2023 |
|
RU2838431C2 |
| Способ получения пиридин-2(1Н)-она | 2022 |
|
RU2784429C1 |
| Способ получения пара-ацетиламинофенола | 2022 |
|
RU2800098C1 |
| Эффективный способ получения орто- и пара-аминофенолов | 2022 |
|
RU2800093C1 |
| Способ получения орто- и пара-аминофенолов | 2022 |
|
RU2793758C1 |
| Способ получения аминофенолов | 2022 |
|
RU2800099C1 |
| НОВЫЕ МЕТАЛЛОКОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ОЛИГОПИРОКАТЕХИНА И СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРОВ ОКИСЛЕНИЯ СЕРНИСТЫХ СОЕДИНЕНИЙ НА ИХ ОСНОВЕ | 2017 |
|
RU2677226C1 |
| Способ выделения Ni-63 из облученной мишени и очистки его от примесей | 2019 |
|
RU2720703C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОФТАЛЕВОЙ И МУРАВЬИНОЙ КИСЛОТ ОКИСЛЕНИЕМ м-ДИИЗОПРОПИЛБЕНЗОЛА И м-ЭТИЛ-ИЗОПРОПИЛБЕНЗОЛА | 2011 |
|
RU2485091C2 |
Изобретение относится к органической химии, конкретно к синтезу гидрохинона, который является важным сырьем для химической и фармацевтической промышленности. Раскрыт способ получения гидрохинона, заключающийся в окислении фенола персульфатом аммония, или калия, или натрия в щелочной среде при 40-60°С, в присутствии 0,01-0,3 мас.% фталоцианинового катализатора окисления (фталоцианина кобальта, или железа (II), или железа (III), или марганца, или никеля, или цинка) с последующим охлаждением реакционной смеси, выделением промежуточного 4-гидроксифенилсульфата. При гидролизе последнего в кислой среде при 85-95°С получают целевой гидрохинон. Технический результат: увеличение выхода целевого продукта. 3 табл., 1 пр.
Способ получения гидрохинона путем окисления фенола в щелочной среде в течение 8 ч, кислотного гидролиза промежуточного 4-гидроксифенилсульфата при 85-95°С, отличающийся тем, что окисление фенола проводят персульфатом аммония (ПСА), или калия (ПСК), или натрия (ПСН) при мольном соотношении Фенол:NaOH:ПСА (ПСК, ПСН) равном 1:1,25:3, температуре 40-60°С в присутствии 0,01-0,3 мас.% фталоцианинового катализатора окисления (фталоцианина кобальта, или железа (II), или железа (III), или марганца, или никеля, или цинка) в течение 10 ч, реакционную смесь охлаждают до комнатной температуры, экстракцией бутанолом выделяют промежуточный 4-гидроксифенилсульфат, который подвергают кислотному гидролизу, целевой гидрохинон получают с выходом до 85%.
| CHEN JUNMIN et al | |||
| Catalysis Communications, 2011, vol | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Раскладочно-вытяжной станок для льна | 1924 |
|
SU1463A1 |
| BAKER W | |||
| et al | |||
| The Elbs persulphate oxidation of phenols, and its adaptation to the preparation of monoalkyl ethers of quinols | |||
| J | |||
| Chem | |||
| Soc, 1948 | |||
| Колесное устройство для экипажей | 1923 |
|
SU2303A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХИНОНА | 2013 |
|
RU2538062C1 |
Авторы
Даты
2022-11-24—Публикация
2022-09-09—Подача