Изобретение относится к химии фосфорорганических соединений с С-Р-связью, а именно к новому соединению - 4-триметилсилоксиметилфосфинил-2-триметилсилокси--2-бутеннитрилу формулы I
Me CH=
CH=  где Me - метил, который может быть использован в качестве полупродукта для получения 4-метилгидроксифосфинил-2-кетобутановой кислоты формулы II
где Me - метил, который может быть использован в качестве полупродукта для получения 4-метилгидроксифосфинил-2-кетобутановой кислоты формулы II
Me O)CH2CH
O)CH2CH -COOH обладающей высокой гербицидной активностью и находящей применение в сельском хозяйстве в качестве системного гербицида (1), и способом его получения.
-COOH обладающей высокой гербицидной активностью и находящей применение в сельском хозяйстве в качестве системного гербицида (1), и способом его получения.
4 - Метилгидроксифосфинил-2-кетобута- новая кислота (II) известна также и как полупродукт синтеза высокоэффективного нетоксичного контактного гербицида сплошного спектра действия "глюфосината аммония" (2), представляющего собой моноаммониевую соль 4-метилгидроксифосфинил-2-аминобутановой кислоты (фосфинотрицина), формулы III
Me CH2CH
CH2CH OOH "Глюфосинат аммония" получают с высоким выходом из 4-метилгидроксифосфинил-2-кетобутановой кислоты восстановительным аминированием в присутствии катализаторов гидрирования (3).
OOH "Глюфосинат аммония" получают с высоким выходом из 4-метилгидроксифосфинил-2-кетобутановой кислоты восстановительным аминированием в присутствии катализаторов гидрирования (3).
Предлагаемый 4-триметилсилоксиметилфосфинил-2-триметилсилокси-2-бутен-нитрил (I), его свойства, способ получения, а также способ синтеза на его основе 4-метилгидроксифосфинил-2-кетобутановой кислоты (II) в литературе отсутствуют.
Известен этиловый эфир 3-метилэтоксифосфинилпропионовой кислоты формулы IV
Me )CH2CH2COOEt где М - метил,
)CH2CH2COOEt где М - метил,
Et - этил, который также используется в качестве полупродукта для получения 4-метилгидроксифосфинил-2-кетобутановой кислоты (II) (1). Этот способ синтеза гербицида (II) заключается во взаимодействии этилового эфира (IV) с диэтилоксалатом в присутствии стехиометрического количества этилата натрия с последующим гидролизом и декарбоксилированием в концентрированной соляной кислоте при кипячении продукта сложноэфирной конденсации. Me )CH
)CH H2COOEt+EtOOC-COOEt
H2COOEt+EtOOC-COOEt  Me
Me O)C
O)C CH
CH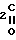 COOH Выход фосфорилированной 2-кетобутановой кислоты (II) составляет в этом случае около 28% из расчета на этиловый эфир 3-метилэтоксифосфинилпропионовой кислоты (IV).
COOH Выход фосфорилированной 2-кетобутановой кислоты (II) составляет в этом случае около 28% из расчета на этиловый эфир 3-метилэтоксифосфинилпропионовой кислоты (IV).
Исходный этиловый эфир 3-метилэтоксифосфинилпропионовой кислоты (IV) получают обычно из метилдихлорфосфина, акриловой кислоты или ее эфира и этилового спирта в несколько стадий. Например, по реакции Пудовика из метилэтоксифосфонита и этилакрилата (4):
MePCl2+EtOH _ _ _ → Me )H
)H 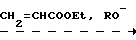 Me
Me )CH2CH2COOEt Другой способ заключается во взаимодействии 2-метил-2,5-диоксо-1,2-оксафосфолана с этиловым спиртом и последующей этерификацией образующейся фосфорилированной пропионовой кислоты этиловым спиртом в условиях кислотного катализа (5):
)CH2CH2COOEt Другой способ заключается во взаимодействии 2-метил-2,5-диоксо-1,2-оксафосфолана с этиловым спиртом и последующей этерификацией образующейся фосфорилированной пропионовой кислоты этиловым спиртом в условиях кислотного катализа (5):
Me-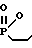 C= 0
C= 0  Me
Me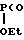 )CH2CH2COOH
)CH2CH2COOH  Me
Me )CH2CH2COOEt Выход целевого соединения (IV) в обоих случаях не превышает 40% из расчета на метилдихлорфосфин. Однако, для получения такого полупродукта синтеза 4-метилгидроксифосфинил-2-кетобутановой кислоты как предлагаемый 2-бутеннитрил подобные методы не пригодны.
)CH2CH2COOEt Выход целевого соединения (IV) в обоих случаях не превышает 40% из расчета на метилдихлорфосфин. Однако, для получения такого полупродукта синтеза 4-метилгидроксифосфинил-2-кетобутановой кислоты как предлагаемый 2-бутеннитрил подобные методы не пригодны.
Таким образом, рассмотренный способ получения 2-кетобутановой кислоты (II), основанный на конденсации Кляйзена этилового эфира 3-метилэтоксифосфинилпропионовой кислоты и диэтилоксалата, имеет следующие недостатки: многостадийный синтез исходной фосфорорганической компоненты и низкий выход конечного продукта.
Наиболее близким аналогом предлагаемого 2-бутеннитрила (I) по структуре и назначению является натриевая соль метил-(3-кето-3-цианопропил)фосфиновой кислоты (V), которую получают взаимодействием 2-метил-2,5-диоксо-1,2-оксафосфолана с цианидом натрия, взятым в избытке 5-20 мол.%, в полярном апротонном растворителе при температуре 45-50оС (6):
Me- C=0+NaCN _ _ _ → Me
C=0+NaCN _ _ _ → Me )CH
)CH CH
CH CN Гидролиз натриевой соли (V) концентрированной соляной кислотой при 70-110оС в течение 1-3 ч приводит с выходом 80-88% к 4-метилгидроксифосфинил-2-кетобутановой кислоте (II):
CN Гидролиз натриевой соли (V) концентрированной соляной кислотой при 70-110оС в течение 1-3 ч приводит с выходом 80-88% к 4-метилгидроксифосфинил-2-кетобутановой кислоте (II):
Me )C
)C CH
CH CN
CN  Me
Me O)C
O)C CH
CH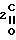 COOH
COOH
Способ получения натриевой соли метил-(3-кето-3-цианопропил)фосфиновой кислоты и, соответственно, на ее основе 4-метилгидроксифосфинил-2-кетобутановой кислоты также имеет определенные недостатки. К ним следует отнести необходимость применения твердого цианида натрия, что усложняет технологическую схему процесса при ее реализации в промышленности. Кроме того, в качестве побочного продукта здесь образуется хлористый натрий, который требует дополнительных технологических операций для его отделения, и безусловно значительные проблемы возникают при утилизации хлористого натрия, загрязненного фосфорорганическими примесями.
Изобретение позволяет расширить ассортимент промежуточных соединений из класса фосфорорганических кетоцианидов, на основе которых осуществляют синтез эффективных нетоксичных гербицидов, а также упростить способ получения последних за счет использования более простого безотходного метода получения соответствующих полупроводников.
Сущность изобретения заключается в новом химическом соединении - 4-триметилсилоксиметилфосфинил-2-триметилси-локси-2-бутеннитриле (I) и способах его получения, заключающимся во взаимодействии 2-метил-2,5-диоксо-1,2-оксафосфолана с триметилсилилцианидом в присутствии четыреххлористого титана при молярном соотношении реагентов 1:(2-4):0,01 в хлороформе при 60-70оС в течение 6-7 ч с последующей перегонкой или нагреванием в вакууме при 100-120оС в течение 1-2 ч, или во взаимодействии 2-метил-2,5-диоксо-1,2-оксафосфолана с триметилсилилцианидом в присутствии триэтиламина при молярном соотношении реагентов 1: (2-4): (0,05-0,1) в течение 5-6 ч при 100-110оС. Схема синтеза следующая: e
e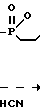 C
C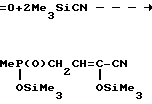 Me
Me CH
CH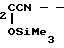 _ →
_ →
Реакция в присутствии четыреххлористого титана приводит первоначально к 4-триметилсилоксиметилфосфинил-2-триме-тилсилокси-2-цианобутиронитрилу (VI), который легко отщепляет молекулу цианистого водорода при перегонке в вакууме масляного насоса или при нагревании в вакууме /20 мм рт.ст./. В присутствии триэтиламина в результате реакции сразу получают целевое соединение (I).
Температурный интервал проведения процесса получения 4-триметилсилоксиметилфосфинил-2-триметилсилокси-2-бутен-нитрила (I) в присутствии четыреххлористого титана определяется на первой стадии условиями получения промежуточного соединения (VI) - при температуре ниже 60оС реакция существенно замедляется, а при температуре выше 70оС происходит осмоление реакционной смеси, что приводит к снижению выхода промежуточного цианобутиронитрила (VI) и, соответственно, конечного продукта (I). В дальнейшем при нагревании в вакууме, происходит отщепление цианистого водорода (который улавливают ловушкой с сухой щелочью), протекающее не до конца при температуре ниже 100оС, а при температуре выше 120оС конечный 2-бутеннитрил (I) разлагается. При проведении реакции в присутствии триэтиламина при температуре ниже 100оС образуется смесь соединений (I) и (IV), а температура 110оС - это температура кипения реакционной массы.
При стехиометрическом молярном соотношении реагентов степень превращения исходного 1,2-оксафосфолана не достигает 100%, оптимальным является соотношение фосфолана и триметилсилилцианида, равное 2,5-3,5. Использование более чем четырехкратного избытка триметилсилилцианида нецелесообразно, так как не позволяет увеличить выход конечного продукта.
В присутствии четыреххлористого титана временной интервал проведения первой стадии процесса определяется тем, что при нагревании в течение менее 6 ч выход промежуточного цианобутиронитрила и конечного бутеннитрила (I) падает не менее, чем на 20%. Нагревание более 7 ч нецелесообразно, так как реакция полностью завершается за этот период времени. При нагревании в вакууме цианистый водород не отщепляется на 100% менее, чем за 1 ч, а нагревание более 2 ч приводит к последующему разрушению 2-бутеннитрила.
Гидролизом соединения (I), представляющим собой силилированную енольную форму 4-метилгидроксифосфинил-2-кетобутиронитрила, получают с практически количественным выходом 4-метилгидроксифосфинил-2-кетобутановую кислоту (II).
 e
e

В отличие от натриевой соли метил-(3-кето-3-цианопропил)фосфиновой кислоты (V) 4-триметилсилоксиметилфосфинил-2-три- метилсилокси-2-бутеннитрил (I) является жидкостью, что технологически упрощает его введение в стадию гидролиза. Причем, соединение (I) может быть введено в стадию гидролиза и без предварительной очистки перегонкой. Это позволяет проводить весь комплекс операций по синтезу 4-метигидроксифосфинил-2-кетобутановой кислоты (II) из 1,2-оксафосфолана и триметилсилилцианида в одном аппарате, существенно снизив, таким образом, непроизводительные потери. Отметим также, что кремнийорганические эфиры гидролизуются чрезвычайно легко (7), образующийся при этом триметилхлорсилан, в отличие от хлористого натрия, легко отделяется от конечного продукта и может быть возвращен в рецикл для синтеза триметилсилилцианида.
Кроме того, следует подчеркнуть, что 2-метил-2,5-диоксо-1,2-оксафосфолан представляет собой внутренний циклический ангидрид 3-метилгидроксифосфинилпропиновой кислоты. А, как известно, ангидриды карбоновых кислот легко взаимодействуют с цианидами щелочных металлов (8, 9), но не реагируют с триметилсилилцианидом даже в условиях катализа (10). Таким образом, предлагаемый способ получения 4-триметилсилоксиметилфосфинил-2-триметилси-локси-2-бутеннитрила (I) является неочевидным, а реакция смешанных ангидридов фосфинилкарбоновых кислот с силилцианидом описана впервые.
Исходный 1,2-оксафосфолан получают легко, в том числе и в промышленности, с высокими выходами в одну стадию из метилдихлорфосфина и акриловой кислоты по описанным методикам (11-13).
П р и м е р 1. Получение 4-триметилсилоксиметилфосфинил-2-триметилсилокси-2-бутеннитрила.
а) В круглодонную колбу, снабженную механической мешалкой, термометром, обратным холодильником и капельной воронкой, помещают 39,6 г (0,4 моля) триметилсилилцианида, 0,2 г (0,001 моля) TiCl4 и при 20оС прибавляют 13,4 г (0,01 моля) 2-метил-2,5-диоксо-1,2-оксафосфолана в 70 мл хлороформа. По окончании прибавления реакционную массу нагревают до 70оС и выдерживают при этой температуре в течение 7 ч. После отгонки растворителя и избытка триметилсилилцианида остаток выдерживают при 110оС в течение 1,5 ч. Получают после перегонки 27,4 г (90%) конечного 2-бутеннитрила (I), т.кип. 103-104оС (0,1 мм рт. ст.), в виде смеси геометрических изомеров - Z и E, в соотношении 65:35, соответственно.
ИК-спектр ( ν , см): 2220 (C ≡ N), 1640 (C=C), 1260 (P=O). Спектр ПМР ( δ, м. д. , J, Гц, CDCl3): 0,07; 0,12; 0,15 три синглета (18 Н, (СН3)3Si), 1,59 д (CH3P, E, 2J(PH) 13,4), 1,60 д (СH3P, Z, 2J(PH) 12,2), 2,50-2,82 м (2H, PCH2, Z, E) 5,47 дублет триплетов (СН, Z, 3J(PH) 6,2, 3J(HH) 7,8), 5,62 дублет триплетов (CH, E, 3J(PH) 5,9, 3J(HH) 8,2).
Спектр ЯМР 31P ( δ , м.д., CDCl3): 39,08 (Z), 38,97(E).
Спектр ЯМР 13С ( δ м.д., J, Гц, CDCl3): 14,71 д (CH3P, E, 1J(PC) 95,4), 15,07 д (CH3P, Z, 1J(PC) 97,4), 28,78 д (CH2P, Z, 1J(PC) 103,8), 29,12 д (CH2P, E, 1J(PC) 104,4), 113,40 д (CN, E, 4J(PC) 5,9), 114,9 д (CN, Z, 4J(PC) 3,6) 116,50 д (CH=, Z, 2J(PC) 9,5), 116,79 д (CH=, E, 2J(PC) 10,5), 124,65 д (= C(OSiMe3), Z, 3J(PC) 13,2), 126,40 д (=C(OSiMe3), E, 3J(PC) 14,0).
Масс-спектр m/I: [M] + 305/1, [M-CH3]+ 290/12, [MeP(O)OSiMe3]+151/40, [Me3Si]+ 73/100.
б) При медленной перегонке реакционной смеси без предварительного нагревания соединение (I) получено с выходом 79%.
П р и м е р ы 2-18 приведены в табл. 1. Спектральные параметры и физико-химические константы бутеннитрила (I), полученного в этих примерах идентичны данным для соединения, синтезированного по методике примера 1. Во всех примерах количество катализатора составляло 0,01 моля на 1 моль исходного 1,2-оксафосфолана.
П р и м е р 19. В круглодонную колбу, снабженную мешалкой, термометром, обратным холодильником и капельной воронкой, помещают 39,6 г (0,4 моля) триметилсилилцианида и медленно прибавляют к нему 13,4 г (0,1 моля) 2-метил-2,5-диоксо-1,2-оксафосфолана. К смеси реагентов добавляют 1 г (0,01 моля) триэтиламина. Температуру реакционной смеси доводят до 100оС и выдерживают, перемешивая при этой температуре в течение 2 ч. Избыток триметилсилилцианида и триэтиламин отгоняют в вакууме, остаток перегоняют. Получают после перегонки 25,8 г (85%) 2-триметилсилокси-2-бутеннитрила (I), спектральные параметры которого и физико-химические константы совпадают с константами соединения, полученного в присутствии четыреххлористого титана.
П р и м е р ы 20-26 приведены в табл. 2.
П р и м е р 27. Получение 4-метилгидроксифосфинил-2-кетобутановой кислоты.
В круглодонную колбу, снабженную мешалкой, термометром, газовым вводом и обратным холодильником, помещают 30,5 г (0,1 моля) 4-триметилсилоксиметилфосфинил-2-триметилсилокси-2-бутеннитрила в 100 мл диэтилового эфира. Раствор насыщают в течение 15-20 мин газообразным хлористым водородом. Растворитель и триметилхлорсилан отгоняют, к остатку добавляют 200 мл 1 н соляной кислоты и кипятят полученную смесь в течение 0,5-1 ч. Воду и HCl отгоняют в вакууме, добавляют 50 мл ацетона, отфильтровывают хлористый аммоний, фильтрат упаривают, моют диэтиловым эфиром и сушат в вакууме масляного насоса. Получают 17,5 г (98% ) 4-метилгидроксифосфинил-2-кетобутановой кислоты (II) в виде желтого масла, которое закристаллизовывается при стоянии, т.пл. 104-105оС.
Спектр ЯМР 31P ( δ , м.д.): 56,37 (D2O).
Спектр ЯМР 13С (δ , м.д., J, Гц, CD3C(O)CD3): 14,10 д (CH3P, 1J(PC) 94,2), 23,26 д (PCH2, 1J(PC) 97,0), 31,82 c (PCH2CH2), 161,7 c (COOH), 194,00 д ( (O)COOH, 3J(PC) 13,8).
(O)COOH, 3J(PC) 13,8).
Найдено, %: C 32,60; H 4,87; P 16,98.
C5H9O5P.
Вычислено, %: C 33,36; H 5,04; P 17,20.
Таким образом, 4-триметилсилоксиметилфосфинил-2-триметилсилокси-2-бутен- нитрил является перспективным соединением для синтеза высокоэффективного гербицида 4-гидроксиметилфосфинил-2-кетобутановой кислоты. Способ его получения прост в аппаратурном оформлении, соединение можно вводить в стадию гидролиза без предварительной очистки и, следовательно, синтез 2-кетобутановой кислоты можно проводить в одном аппарате, что позволяет избежать непроизводительных потерь. Применение соединения I позволяет упростить способ получения целевого гербицида за счет исключения из схемы синтеза твердого цианистого натрия при одновременном повышении выхода конечного продукта.
Предложенный способ получения 4-триметилсилоксиметилфосфинил-2-триметил-силокси-2-бутеннитрила I позволяет получать это соединение с высоким выходом, исходя из доступного промышленного сырья и отличается максимальной простотой аппаратурного оформления.

Использование: в качестве полупродукта в синтезе гербицидного препарата. Сущность изобретения: продукт-4-триметилсилокси-метилфосфинил-2-триметилсилокси-2-бутеннитрил. БФ C11H24NO3PSi2 , выход 90%, т.кип. 103-104°С (0,1 мм рт. ст.). Реагент 1: соединение формулы 1. Реагент 2: (CH3)3SiCN . Условия реакции: процесс ведут в присутствии четыреххлористого титана при молярном соотношении реагентов 1 : (2 - 4) : 0,01 в среде хлороформа при 60 - 70°С в течение 6 - 7 ч с последующей перегородкой или нагреванием при 100 - 120°С в течение 1 - 2 ч, или в присутствии триэтиламина при молярном соотношении реагентов 1 : (2 - 4) : (0,05 - 0,1), в среде хлороформа при 100 - 110°С в течение 5 - 6 ч. Структура соединения формулы 1:  . 3 с.п. ф-лы, 2 табл.
. 3 с.п. ф-лы, 2 табл.
CH =
=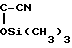
в качестве полупродукта синтеза 4-метилгидроксифосфинил-2-кетобутановой кислоты, обладающей гербицидной активностью.
| СПОСОБ ОПРЕДЕЛЕНИЯ ДИАМЕТРА ФЕРРОМАГНИТНЫХ ЧАСТИЦ И ОБЪЕМНОЙ ДОЛИ ТВЕРДОЙ ФАЗЫ МАГНИТНОЙ ЖИДКОСТИ | 2016 |
|
RU2611694C1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1994-12-15—Публикация
1992-01-09—Подача