Изобретение относится к области технологии лекарств, а точнее касается новых гранулированных композиций, хорошо таблетируемых и содержащих водорастворимые непрессуемые или труднопрессуемые кристаллические фармацевтические вещества, и способа их получения.
Известны гранулированные композиции, предназначенные для таблетирования и содержащие водорастворимые непрессуемые или труднопрессуемые кристаллические фармацевтические компоненты, в которых содержание вспомогательных веществ достигает 40-90 мас.% [1].
Однако высокое содержание вспомогательных ингредиентов в указанных композициях снижает биодоступность фармакологических компонентов и значительно изменяет их фармакокинетику. Кроме того, введение в фармацевтические композиции больших количеств вспомогательных веществ влечет за собой существенные дополнительные энергетические и материальные затраты.
Известен способ получения гранулированных фармацевтических композиций [2], согласно которому фармацевтические композиции получают гранулированием порошка фармацевтического вещества раствором связующего в аппарате псевдоожиженного слоя, высушиванием полученного гранулята и последующим опудриванием его смазывающим. Однако этот способ не позволяет получать гранулированные композиции, содержащие водорастворимые непрессуемые или труднопрессуемые кристаллические фармацевтические компоненты, с минимальным содержанием вспомогательных веществ.
Заявляемые гранулированная композиция и способ ее получения являются новыми и в литературе не описаны.
В основу изобретения положена задача создания новой гранулированной композиции, хорошо таблетируемой и содержащей водорастворимые непрессуемые или труднопрессуемые кристаллические фармацевтические компоненты с минимальным содержанием вспомогательных веществ и разработки способа ее получения.
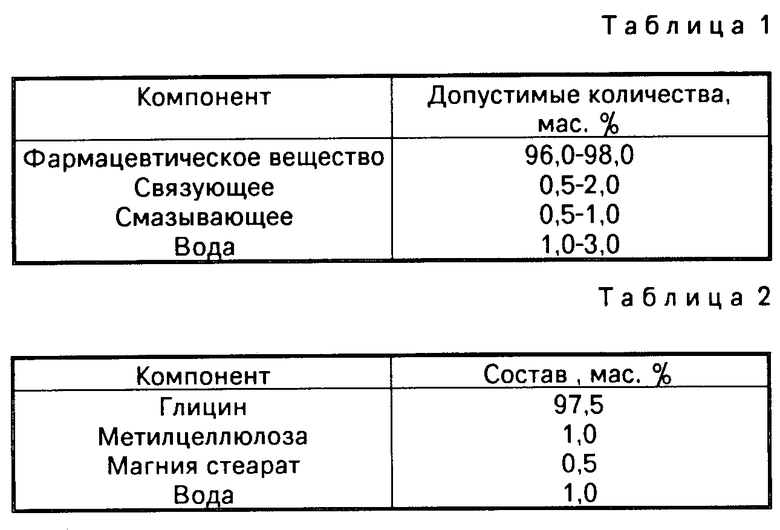
Задача решена тем, что заявляемая гранулированная композиция содержит следующие компоненты, мас.%: фармацевтически активное вещество в количестве от 96,0 до 98,0 в расчете на общую массу конечной композиции; фармацевтически приемлемое связующее вещество в эффективном количестве 0,5-2,0; фармацевтически приемлемое смазывающее вещество в эффективном количестве 0,5-1,0 и вода в эффективном количестве 1-3.
Заявляемая гранулированная композиция содержит минимальное количество вспомогательных веществ, что обеспечивает максимальную биодоступность фармакологически активных компонентов и их оптимальную фармакокинетику. Кроме того, заявляемая гранулированная композиция хорошо прессуется в таблетки, обладающие необходимой прочностью и регулируемым временем растворения, что позволяет предотвратить местнораздражающее действие фармакологически активных компонентов.
Способ получения предлагаемой гранулированной композиции включает следующие стадии:
а) предварительное гранулирование порошка фармацевтического вещества водой или концентрированным раствором его в воде. Целесообразно использовать порошок фармацевтического вещества размером частиц основной фракции не более 0,3 мм. Предварительное гранулирование порошка фармацевтического вещества предпочтительно проводят в аппарате псевдоожиженного слоя;
б) последующее гранулирование полученного предварительно гранулята фармацевтического вещества раствором связующего в воде или органическом растворителе или их смеси в аппарате псевдоожиженного слоя;
в) высушивание полученного гранулята. Целесообразно доводить последний до влажности 1-3 мас.%;
г) опудривание высушенного гранулята смазывающим.
Заявляемый способ получения гранулированной композиции обеспечивает повышение ее пластичности за счет изменения формы и структуры гранул и снижение себестоимости изготавливаемых из нее таблеток.
Лучший вариант осуществления изобретения.
Фармацевтические компоненты (глицин, маннит и гистидин), связующий компонент поливинилпирролидон, органические растворители и вода отвечают требованиям качества Государственной фармакопеи СССР; связующие компоненты: крахмал, эфиры целлюлозы, а также смазывающие компоненты: стеариновая кислота и ее соли, отвечают требованиям качества нормативно-технической документации СССР.
Порошки фармацевтических компонентов содержат более 99% основного вещества. Размер частиц основной фракции порошка фармацевтических компонентов предпочтительно не превышает 0,3 мм, что позволяет получать таблетки с гладкой однородной поверхностью, отвечающие требованиям их внешнего вида Государственной фармакопеи СССР, XI, вып. 2, с. 154-155.
В качестве связующих компонентов могут быть использованы любые фармацевтически приемлемые связующие, такие как метилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, натрий карбоксиметилцеллюлоза, этилцеллюлоза, ацетилфталилцеллюлоза, поливинилпирролидон, крахмал, сахара, природные камеди, желатин, декстрины, щеллак, пектин, производные альгиновой кислоты, хитозан.
Предпочтительно использование эфиров целлюлозы, крахмала и поливинилпирролидона в связи с их безопасностью и широким применением в фармацевтической промышленности.
Количество связующего в заявляемой композиции определяет время растворения таблеток и составляет от 0,5 до 2 мас .% из расчета на общую массу композиции.
В качестве смазывающих компонентов могут быть использованы любые фармацевтически приемлемые смазывающие, такие как стеариновая кислота и ее соли, полиэтиленгликоли, гидрогенизированные растительные масла, тальк, натрия лаурилсульфат или их рациональные комбинации.
Предпочтительно использование стеариновой кислоты, кальция стеарата или магния стеарата, гидрофобизирующих поверхность гранул водорастворимых фармацевтических компонентов. Количество смазывающего составляет от 0,5 до 1,0 мас.% из расчета на общую массу композиции.
Заявляемая композиция включает также воду в количестве, необходимом для осуществления процесса прямого таблетирования, т.е. от 1,0 до 3,0 мас.% из расчета на общую массу композиции.
Таким образом, заявляемая композиция включает указанные компоненты в следующем соотношении, из расчета на общую массу композиции (см. табл. 1).
Оптимальный состав заявляемой композиции определяется в каждом конкретном случае природой фармацевтического компонента и временем растворения таблеток.
Заявляемая гранулированная композиция может быть подвергнута прямому прессованию в таблетки, имеющие прочность от 13 до 138 Н и время растворения от 1 до 55 мин.
Способ получения заявляемой композиции осуществляют следующим образом.
Порошок фармацевтического вещества подвергают предварительному гранулированию. С целью более равномерного распределения воды в массе фармацевтического компонента и ускорения процесса целесообразно проводить предварительное гранулирование порошка в аппарате псевдоожиженного слоя.
Для этого расчетное количество порошка фармацевтического компонента помещают в гранулирующий аппарат псевдоожиженного слоя и увлажняют водой или концентрированным раствором его в воде. Затем полученный гранулят сушат до остаточной влажности 3-5 мас.% и подвергают последующему гранулированию в том же аппарате раствором связующего в воде или органическом растворителе или их смеси. Полученный гранулят высушивают. Для обеспечения оптимальной пластичности гранулята целесообразно доводить его до остаточной влажности 1-3 мас . % . Затем гранулят выгружают из аппарата псевдоожиженного слоя, просеивают через сито с диаметром отверстий 0,5 мм и опудривают смазывающим в смесителе.
Предварительное гранулирование порошка фармацевтического вещества можно проводить также в грануляторе для влажного гранулирования. Для этого расчетное количество порошка помещают в гранулятор для влажного гранулирования, увлажняют водой или концентрированным раствором его в воде и тщательно перемешивают. Затем гранулируемую массу выгружают из гранулятора, протирают через сито с диаметром отверстий 1 мм и сушат до остаточной влажности 3-5 мас. % . Высушенный гранулят протирают через сито с диаметром отверстий 0,5 мм, загружают в аппарат псевдоожиженного слоя и далее процесс проводят аналогично описанному.
Конечную гранулированную композицию подвергают прямому таблетированию, т. е. без использования каких-либо дополнительных вспомогательных веществ, при различных давлениях прессования, выраженных в МПа: 98; 196 и 294.
Прочность таблеток измеряют на Erweka Tablet Hardness Tester и выражают в международных единицах силы - ньютонах, Н.
Для оценки растворения таблеток используют показатель Т100%, означающий время, в течение которого фармацевтический компонент полностью переходит в раствор, выраженный в минутах. Определение значения Т100% проводят согласно Государственной фармакопее СССР, XI, вып. 2, с. 159-160.
Для оценки прочности таблеток на истирание используют показатель потери их массы в процессе испытаний, выраженный в процентах. Определение прочности таблеток, на истирание проводят согласно Государственной фармакопее СССР, XI, вып. 2, с. 157-158. Таблетки, изготовленные из заявляемой композиции, имеют диаметр 9 мм и массу 300 мг.
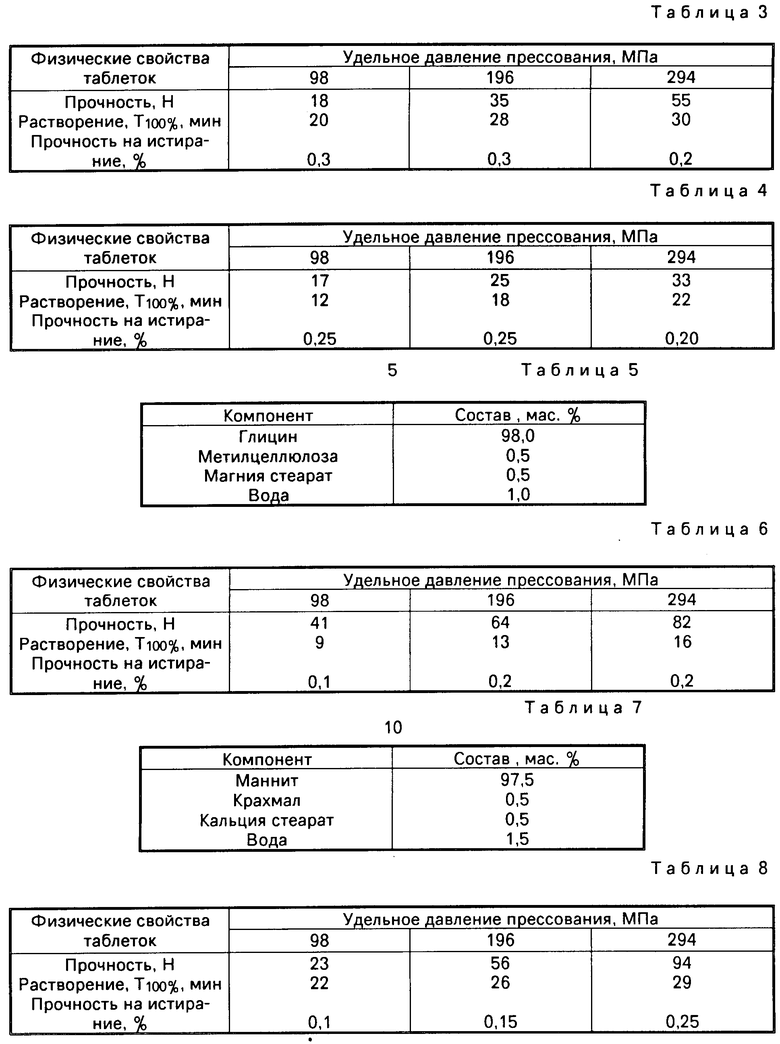
П р и м е р 1. 292,5 г порошка глицина размером частиц основной фракции не более 0,2 мм помещают в аппарат для сушки в псевдоожиженном слое (Aeromatic AG, Model STREA-1) и гранулируют 100 мл воды. Затем полученный гранулят сушат до остаточной влажности 5 мас.% и продолжают гранулирование в том же аппарате 150 мл 2%-ного водного раствора метилцеллюлозы марки М-100. Полученный гранулят высушивают до остаточной влажности 1 мас.%, выгружают из аппарата псевдоожиженного слоя, просеивают через сито с диаметром отверстий 0,5 мм и опудривают 1,5 г магния стеарата в кубовом смесителе (Erweka, Model KB20/UG).
Конечная гранулированная композиция включает указанные ингредиенты в соотношении из расчета на общую массу композиции (см. табл. 2).
Гранулированную композицию подвергают прямому таблетированию на эксцентриковом таблеточном прессе (Erweka, Model EKO). Полученные таблетки имеют физические свойства, указанные в табл. 3.
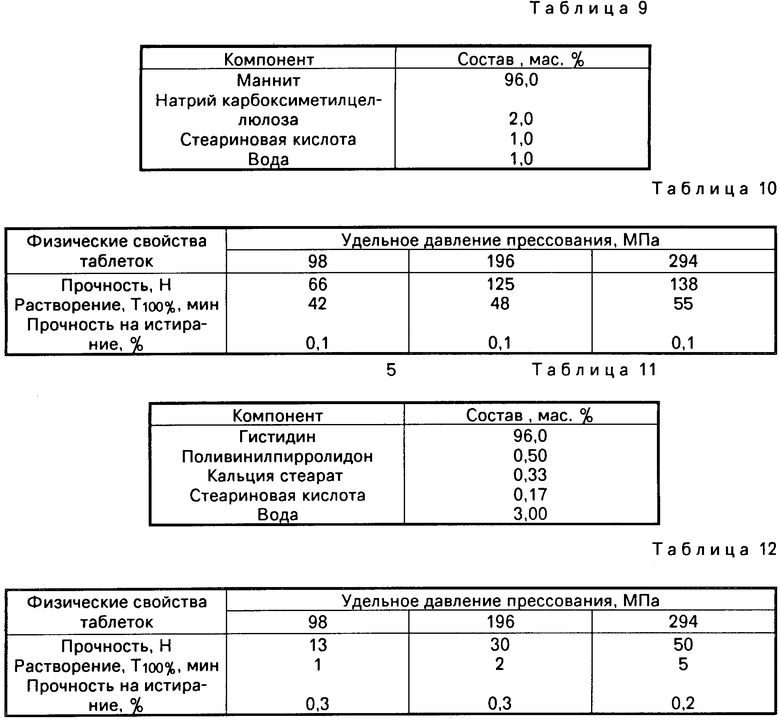
П р и м е р 2. 292,5 г порошка глицина размером частиц основной фракции не более 0, 2 мм помещают в лабораторный смеситель для влажного гранулирования (Erweka, Model SW 1/S) и гранулируют 90 мл воды. Полученную массу переносят во влажный гранулятор (Erweka, Model FGS), протирают через сетку с диаметром отверстий 1 мм и высушивают в сушильном шкафу (B&T "Stabilec" Oven, Model 322/0205) при температуре 60оС до остаточной влажности 5 мас.%. Полученный гранулят помещают в аппарат для сушки в псевдоожиженном слое (Aeromatic AG, Model STREA-1) и гранулируют 300 мл 1%-ного водного раствора метилцеллюлозы марки М-100. Далее процесс проводят аналогично описанному в примере 1.
Конечная гранулированная композиция имеет состав, указанный в табл. 2.
Гранулированную композицию подвергают прямому таблетированию на эксцентриковом таблеточном прессе (Erweka, Model EKO). Полученные таблетки имеют физические свойства, указанные в табл. 4.
П р и м е р 3. 276 г порошка глицина размером частиц основной фракции не более 0,2 мм помещают в лабораторный смеситель для влажного гранулирования (Erweka, Model SW 1/S) и гранулируют 90 г 20%-ного водного раствора глицина. Далее процесс проводят аналогично описанному в примере 2, за исключением того, что последующее гранулирование в аппарате псевдоожиженного слоя полученного предварительно гранулята проводят 300 мл 0,5%-ного водного раствора метилцеллюлозы марки М-100.
Конечная гранулированная композиция включает ингредиенты в соотношении из расчета на общую массу композиции (см. табл. 5).
Гранулированную композицию подвергают прямому таблетированию на эксцентриковом прессе (Erweka, Model EKO). Полученные таблетки имеют физические свойства, указанные в табл. 6.
П р и м е р 4. 292,5 г порошка D-маннита фирмы Chemapol размером частиц основной фракции не более 0,2 мм помещают в лабораторный смеситель для влажного гранулирования (Erweka, Model SW 1/S) и гранулируют 100 мл воды. Далее процесс проводят аналогично описанному в примере 2, за исключением того, что последующее гранулирование в аппарате псевдоожиженного слоя полученного предварительно гранулята маннита проводят 150 мл 1%-ного водного раствора крахмального клейстера, после чего гранулят сушат до остаточной влажности 1,5 мас.% и в качестве смазывающего используют кальция стеарат.
Конечная гранулированная композиция включает ингредиенты в соотношении из расчета на общую массу композиции (см. табл. 7).
Гранулированную композицию подвергают прямому таблетированию на эксцентриковом прессе (Erweka, Model EKO). Полученные таблетки имеют физические свойства, указанные в табл. 8.
П р и м е р 5. 280,5 г порошка D-маннита фирмы Chemapol размером частиц основной фракции не более 0,3 мм, помещают в аппарат для сушки в псевдоожиженном слое (Aeromatic AG, Model STREA-1) и гранулируют 75 г 10%-ного водного раствора маннита. Далее процесс проводят аналогично описанному в примере 1, за исключением того, что последующее гранулирование полученного предварительно гранулята маннита проводят 300 мл 2%-ного раствора натрия карбоксиметилцеллюлозы в растворителе состава вода - этанол - ацетон в массовом соотношении 5 : 4 : 1 и в качестве смазывающего используют 3,0 г стеариновой кислоты.
Конечная гранулированная композиция включает ингредиенты в соотношении из расчета на общую массу композиции (см. табл. 9).
Гранулированную композицию подвергают прямому таблетированию на эксцентриковом прессе (Erweka, Model EKO). Полученные таблетки имеют физические свойства, указанные в табл. 10.
П р и м е р 6. 288 г порошка D-гистидина гидрохлорида фирмы Sigma размером частиц основной фракции не более 0,3 мм помещают в аппарат для сушки в псевдоожиженном слое (Aeromatic AG, Model STREA-1) и гранулируют 75 г 10% -ного водного раствора гистидина. Далее процесс проводят аналогично описанному в примере 1, за исключением того, что последующее гранулирование полученного предварительно гранулята гистидина проводят 300 мл 0,5%-ного раствора поливинилпирролидона мол. м. 12600 ± 2700 в этаноле, после чего гранулят сушат до остаточной влажности 3 мас.% и в качестве смазывающего используют смесь 1 г кальция стеарата с 0,5 г стеариновой кислоты.
Конечная гранулированная композиция включает ингредиенты в соотношении из расчета на общую массу композиции (см. табл. 11).
Гранулированную композицию подвергают прямому таблетированию на эксцентриковом прессе (Erweka, Model EKO). Полученные таблетки имеют физические свойства, указанные в табл. 12.
Заявляемые гранулированная композиция и способ ее получения находят применение в технологии непрессуемых и труднопрессуемых водорастворимых кристаллических фармацевтических веществ для производства гранулированных и таблетированных лекарственных форм.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭНТЕРОСОРБЕНТА | 1996 |
|
RU2084236C1 |
| ТАБЛЕТИРОВАНИЕ ЭРИТРИТА | 2009 |
|
RU2498636C2 |
| ДИСПЕРГИРУЕМАЯ ТАБЛЕТКА СМЕКТИТА ДИОКТАЭДРИЧЕСКОГО И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2558091C2 |
| СПОСОБЫ ТАБЛЕТИРОВАНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ (ВАРИАНТЫ) | 2002 |
|
RU2205630C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С 2-ЭТИЛ-6-МЕТИЛ-3-ГИДРОКСИПИРИДИНА СУКЦИНАТА ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2444359C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ТВЕРДОЙ ФОРМЕ С АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2545861C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЦЕРЕБРОВАСКУЛЯРНЫХ РАССТРОЙСТВ И СПОСОБЫ ИХ ИЗГОТОВЛЕНИЯ | 2012 |
|
RU2559776C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА, СОДЕРЖАЩАЯ ДЕЗЛОРАТАДИН И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2013 |
|
RU2550958C2 |
| КОМБИНИРОВАННЫЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ В ФОРМЕ ШИПУЧИХ ТАБЛЕТОК И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2686694C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА (ВАРИАНТЫ) | 2011 |
|
RU2471482C1 |
Область применения: изобретение относится к области химико-фармацевтической промышленности. Сущность изобретения: композиция содержит непрессуемые или труднопрессуемые кристаллические вещества, связующее, смазывающее и воду при следующем соотношении компонентов, мас.%: фармацевтическое вещество 96,0 - 98,0, связующее 0,5 - 2,0, смазывающее 0,5 - 1,0, вода 1,0 - 3,0. Способ получения указанной композиции заключается в том, что порошок фармацевтического вещества предварительно гранулируют водой или его водным раствором, затем гранулируют с раствором связующего, сушат и опудривают смазывающим. 2 с. и 6 з. п. ф-лы, 12 табл.
Фармацевтическое вещество 96,0 - 98,0
Связующее 0,5 - 2,0
Смазывающее 0,5 - 1,0
Вода 1,0 - 3,0
2. Композиция по п. 1, отличающаяся тем, что она содержит в качестве связующего растворимые в воде, или в органическом растворителе, или в их смеси эфиры целлюлозы.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Remington's pharmaceutical sciences, 17 th idition, 1985, Mack publishing company, Easton Pennsylwania, p.1610-1612. | |||
Авторы
Даты
1994-12-30—Публикация
1992-12-11—Подача