Изобретение относится к медицине, в частности к фармации, и касается фармацевтических композиций в твердой лекарственной форме, проявляющих анальгетическую активность.
Несмотря на расширяющийся поиск альтернативного пути введения и методов лекарственной доставки, оральный способ введения остается наиболее популярным. Около 70% всех лекарственных форм предназначены для перорального применения, так как данный способ введения является самым приемлемым и удобным для пациентов. Кроме того, это наиболее изученный и отработанный метод заводского производства, используемый для получения твердых дозированных лекарственных форм (таких как таблетки и капсулы). Твердые дозированные лекарственны формы дешевы в производстве, у них оптимально соотношение цена-качество. К преимуществам таблеток относятся: точное дозирование лекарственных веществ в условиях массового производства; длительное действие лекарственного вещества; последовательное всасывание лекарственных веществ; маскировка неприятных органолептических свойств (вкуса, запаха или красящих свойств) лекарственных веществ за счет нанесения оболочек; полная механизация процесса изготовления, обеспечивающая высокую производительность, чистоту и гигиеничность таблеток.
Наиболее распространены три технологические схемы получения таблеток: с применением влажного или сухого гранулирования и прямое прессование.
Преобладающим является способ получения таблеток с использованием гранулирования. Гранулирование - совокупность физических и физико-химических процессов, обеспечивающих формирование частиц определенного спектра размеров, формы, необходимой структуры и физических свойств. Гранулирование проводят с целью улучшения качества как промежуточных, так и готовых продуктов. Гранулирование может быть «влажным» и «сухим». Первый вид гранулирования связан с использованием жидкостей - растворов вспомогательных веществ; при сухом гранулировании к помощи смачивающих жидкостей или не прибегают, или используют их только на одной определенной стадии подготовки материала к таблетированию.
Гранулирование позволяет корректировать технологические свойства порошков лекарственных веществ, например сыпучесть и другие. Кроме того, гранулирование обеспечивает высокую точность массы таблетки и дозы вещества, равномерность распределения активного компонента, что особенно важно при получении таблеток сложного состава, снижение влияния температуры и влажности окружающей среды на качество таблеток, уменьшение возможности образования пыли.
Обычно операции смешивания и равномерного увлажнения порошкообразной смеси различными гранулирующими растворами совмещают и проводят в одном смесителе. Иногда операции смешивания и гранулирования совмещаются в одном аппарате (высокоскоростные смесители - грануляторы). Смешивание обеспечивается за счет энергичного принудительного кругового перемешивания частиц и сталкивания их друг с другом. Другая конструкция аппарата для совмещения операций смешивания и гранулирования - центробежный смеситель - гранулятор.
По сравнению с сушкой в сушильных шкафах, которые являются малопроизводительными и в которых длительность сушки достигает 20-24 часа, более перспективной считается сушка гранул в кипящем (псевдоожиженом) слое. Основными ее преимуществами являются: высокая интенсивность процесса; уменьшение удельных энергетических затрат; возможность полной автоматизации процесса.
В некоторых случаях, если лекарственное вещество разлагается в присутствии воды, прибегают к сухому гранулированию. Для этого из порошка прессуют брикеты, которые затем размалывают, получая крупку. После отсеивания от пыли крупку таблетируют. В настоящее время под сухим гранулированием понимают метод, при котором порошкообразный материал подвергают первоначальному уплотнению (прессованию), получая гранулят, который затем таблетируют - вторичное уплотнение. При первоначальном уплотнении в массу вводят сухие склеивающие вещества, обеспечивающие под давлением сцепление частиц как гидрофильных, так и гидрофобных веществ. Доказана пригодность для сухого гранулирования полиэтиленоксида (ПЭО) в сочетании с крахмалом и тальком.
Технология прямого прессования таблеток заключается в смешении лекарственных препаратов с необходимым количеством вспомогательных веществ и прессовании на таблеточных прессах [Дараган А.Г. Физика таблетирования и основные технологические процессы получения таблеток / А.Г. Дараган // Химико-фармацевтическая промышленность: обзор, информ. / ЦБНТИ Минмедпром. 1983. - Вып. 10. - 25 с.]. Наиболее очевидное преимущество прямого прессования перед традиционной влажной грануляцией - экономичность - достигается благодаря уменьшению стоимости оборудования и производства. Однако применение данного метода возможно в силу физико-химических особенностей субстанций не для всех лекарственных веществ.
Большинство составов твердых лекарственных форм (70-80%) характеризуется содержанием большего количества вспомогательных ингредиентов, чем лекарственных веществ. Вследствие того, что большинство лекарственных веществ обладают низкими показателями сыпучести и неудовлетворительными физико-механическими характеристиками, в состав таблеточной и инкапсулируемой масс для получения необходимых реологических и технологических свойств вводятся различные вспомогательные вещества. Вспомогательные вещества не являются индифферентными формообразователями, а оказывают сложное, многогранное влияние на лекарственный препарат, на его фармакокинетику и, в конечном итоге, на терапевтическую эффективность лекарственного препарата.
При производстве таблеток и капсул используется широкий ассортимент вспомогательных веществ. Для правильного выбора рецептуры необходимо знать свойства субстанции лекарственного вещества: сыпучесть, прессуемость, способность скольжения, также необходимо знать, является ли материал ядовитым, раздражающим, взрывоопасным, как влияет на него влага, тепло, свет, воздух, давление, как он действует на пуансоны и матрицы [Гуреева С.Н. Оптимизация промышленного производства таблеток с полимерной оболочкой, содержащих труднорастворимые и окрашенные вещества: автореф. дис. канд. фармац. наук / С.Н. Гуреева. Харьков, 1991. - 21 с.].
На основании изложенного научно-обоснованный выбор вспомогательных веществ в каждом конкретном случае является одним из важных условий получения таблетированных препаратов с максимальной терапевтической активностью при наименьших дозировках и побочном действии.
Известны анальгетики с большой рецепторной селективностью и минимальными морфиноподобными побочными эффектами - препараты смешанного типа действия агониты-антагонисты опиоидных рецепторов. Фармакология этих препаратов является комплексной. Синтетические производные фенантрена (налбуфин, бупренорфин) и морфинана (буторфанол) относятся к агонистам-антагонистам, опиоидным анальгетикам смешанного типа действия с аффинитетом к мю-, дельта- и каппа-подтипам опиоидных рецепторов. Многочисленные фармакологические исследования, работы по лиганд-рецепторному связыванию привели к заключению, что налбуфин действует как к-агонист и парциальный мю-антагонист, бупренорфин - парциальный мю-агонист и антагонист каппа-опиоидных рецепторов, буторфанол - парциальный агонист мю-, агонист каппа-опиоидных рецепторов, а также обладает свойствами дельта-антагониста (Редькин А.Н., Бунятян А.А., Насонов Е.Л., Никода В.В., 2004).
Препараты смешанного типа действия (налбуфин, бупренорфин и буторфанол) нашли ограниченное применение в качестве обезболивающих средств в практической медицине. Синтезированные агонисты-антагонисты, по ряду показателей значительно превосходившие традиционные опиаты, сохранили большинство негативных свойств, и, прежде всего, их наркогенность, что послужило основанием внесения их в списки психотропных препаратов, оборот которых в РФ ограничен.
Наиболее близкий по выполнению дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола является представителем структурного класса веществ с каппа-рецепторным профилем фармакологической активности, то есть без влияния на мю- и дельта-опиоидные рецепторы, а следовательно, без наркогенного потенциала (патент на изобретение РФ №2413512, МПК А61К 31/4188, 2011 г.).
Задачей изобретения является создание фармацевтической композиции для перорального введения с каппа-опиоидной агонистической активностью, то есть без влияния на мю- и дельта-опиоидные рецепторы.
Техническим результатом является фармацевтическая композиция в твердой форме с каппа-опиоидной агонистической активностью, проявляющая анальгетический эффект.
Технический результат достигается фармацевтической композицией, характеризующейся тем, что содержит в качестве действующего начала дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола, в качестве вспомогательных веществ - наполнитель, обеспечивающий достаточную массу твердой лекарственной формы, представляющий собой по меньшей мере одно вещество, выбранное из группы: микрокристаллическая целлюлоза, лактоза, кальция фосфат, кальция дигидрофосфат, кальция гидрофосфат дигидрат, кальция сульфат дигидрат, кальция карбонат основной, производные поливинилпирролидона; декстрин, амилопектин, ультра-амилпектин, сорбит, маннит, пектин, магния карбонат основной, магния окись, желатин, метилцеллюлоза (МЦ), прежелатинизированный крахмал, лудипресс, картофельный и кукурузный крахмал карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, вспомогательные вещества с повышенной сорбционной способностью: коллоидный кремний (аэросил, Syloid®), алюмометосиликат магния (Neusilin®, Fuji, Япония), скользящее вещество, и при необходимости связывающее вещество, обеспечивающее прочность гранул и таблеток, представляющее собой по меньшей мере одно вещество, выбранное из группы: вода очищенная, спирт этиловый, крахмальный клейстер, сахарный сироп, растворы: карбоксиметилцеллюлозы (КМЦ), оксиэтилцеллюлозы (ОЭЦ), оксипропилметилцеллюлозы (ОПМЦ); поливинилового спирта (ПВС), поливинилпирролидона (ПВП), альгиновой кислоты, натрия альгината, желатина, метилцеллюлозы, гидроксипропилметилцеллюлозы, крахмал предпочтительно используют картофельный и/или кукурузный или крахмал марки Starch-1500, и пленочное покрытие, при следующем соотношении компонентов, мас. %:
Фармацевтическая композиция в частном случае может содержать компоненты при следующем их соотношении, мас. % /состав 1/:
Фармацевтическая композиция в частном случае может содержать компоненты при следующем их соотношении, мас. % /состав 2/:
Фармацевтическая композиция в частном случае может содержать компоненты при следующем их соотношении /состав 3/, мас. %:
Фармацевтическая композиция в частном случае может содержать компоненты при следующем их соотношении, мас. % /состав 4/:
В качестве скользящих вспомогательных веществ, предотвращающих налипание и обеспечивающих выталкивание из матрицы, композиция может содержать по меньшей мере одно вещество, выбранное из группы: стеариновая кислота и/или ее соли, например стеарат магния, аэросил.
В состав пленочных покрытий может входить одно или смесь из следующих вспомогательных веществ: полиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, гидроксипропилцеллюлоза, гидроксиметилцеллюлоза и гидроксипропилметилцеллюлоза, гидроксипропилметилцеллюлоза (Opadry YellowT, Colorcon Corp.), оксипропилметилцеллюлозы фталат, ацетилцеллюлозы фталат, поливинилацетата фталат, метилцеллюлозы фталат, сополимер метакриловой кислоты или сложные метиловые эфиры метакриловой кислоты (Eudragit R, Акрил-из), Колликут® МАЕ 100 П, Колликут® МАЕ 30 D, Колликут® МАЕ 100 D, этил целлюлоза, ацетилцеллюлоза, сополимеры поливинилового спирта и малеинового ангидрида, полиэтиленгликоль (полиэтиленгликоль 6000), триэтилцитрат, диэтилфталат, пропиленгликоль, глицерин, бутилфталат, двуокись титана и красители, окись железа, алюминиевые красители.
Фармацевтическая композиция выполнена в твердой лекарственной форме, преимущественно в виде таблеток или капсул. Таблеточную или капсульную массу получают влажной грануляцией, методом сухой грануляции или прямым прессованием.
Для обеспечения длительного срока годности предлагаемых композиций важно, чтобы полученный гранулят имел влажность, не превышающую 3% и предпочтительно не более 2%.
Процесс сушки осуществляется в лотковой сушилке или сушкой в псевдоожиженном слое, причем последняя предпочтительнее. Сушку обычно проводят при температуре на входе около 40°C и относительной влажности менее 50%.
Полученные частицы затем смешиваются с другими вспомогательными веществами, например связующим, смазывающими веществами и т.д. Предлагаемые композиции, полученные любым из вышеуказанных методов, формуются в любую лекарственную форму при использовании общеизвестных в данной области технологий и методов, например таблетированием, включением в желатиновую капсулу и т.д. Из предлагаемых композиций изготавливаются лекарственные формы известными методами с обеспечением унифицированных доз заявляемого соединения для перорального приема, например 50 мг, 100 мг, 200 мг, 300 мг и т.д. в виде капсул, таблеток и тому подобное.
Полученные таблетированные или капсульные лекарственные формы должны быть защищены во время хранения от внешних факторов (действия тепла или света, а также и проникновения влаги). В целях обеспечения конкретного положительного эффекта на лекарственную форму может наноситься пленочное покрытие.
Пленочное покрытие лекарственных форм при использовании водного пленкообразующего состава следует осуществлять при температуре ядер таблеток от 30 до 50°C, температуре на входе 50-80°C и относительной влажности менее 50%.
Покрытие наносят на лекарственную форму с увеличением ее массы примерно на 1-15, предпочтительно на 8-10 мас. %.
Пленочные покрытия можно наносить общеизвестными способами: погружением в раствор пленкообразующего вещества, наслаиванием в соответствующем перфорированном барабане, получением покрытия во взвешенном слое. Прекращают нанесение пленочного покрытия по достижении необходимой массы таблетки. Барабан с боковой вентиляцией обеспечивает высокую скорость испарения растворителя, благодаря чему покрытие таблеток применяемыми в фармацевтической технологии пленочными покрытиями осуществляется за достаточно короткое время. Подача в одном направлении распыляемой среды и подготовленного теплого воздуха, а также сведение турбулентности в барабане к минимуму уменьшают высушивание распыляемого материала, обеспечивая эффективность покрытия более 95%. Прирост массы таблетки, покрытой оболочкой, может находиться в интервале от 1 до 15%.
Покрытые пленкой таблетки или капсулы имеют время высвобождения примерно от 10 до 30 минут. Таблетки или капсулы с кишечнорастворимой оболочкой имеют время высвобождения обычно от 30 мин до 6 часов.
В качестве пленкообразователя при производстве таблеток можно применять Опадрай II (гипромеллоза, лактозы моногидрат, полидекстроза, макрогол, титана диоксид, железа оксид желтый, железа оксид красный). Для нанесения покрытия, устойчивого к воздействию желудочного сока, можно применять водную суспензию, например, Акрил-из, или Колликут® МАЕ 100 П, или Колликут® МАЕ 30 D.
Капсулы и таблетки, полученные из предлагаемых фармацевтических композиций, обладают требуемой устойчивостью при хранении.
Следующие примеры иллюстрируют варианты получения фармацевтической композиции.
Пример 1. Получение композиции состава 1 влажным гранулированием с последующим таблетированием
4,32 г дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола (15 мас. %), 22,59 г лактозы (80,45 мас. %) /наполнитель/ и 0,8 г микрокристаллической целлюлозы (2,85 мас. %) /наполнитель/ смешивают в смесителе. Увлажняют массу 5,0% раствором ПВП в количестве (в пересчете на чистое вещество) 0,2 г (0,7 мас. %) /связующее/. Увлажненную массу подвергают влажной грануляции. Влажный гранулят высушивают в сушильном шкафу в течение 2-3 часов при температуре 40± 5°C или при комнатной температуре в течение 22-24 часов до остаточной влажности 2-3%. Высушенную массу гранул размалывают в грануляторе с диаметром отверстий в сетке 1,0-1,5 мм. Массу сухого гранулята опудривают стеаратом магния (1 мас. %) /скользящее/ в количестве 0,28 г. Сыпучесть полученной таблеточной массы составляла 6,34 г/с.
Гранулят прессуют в таблетки. Таблетирование производят на ротационном прессе фирмы «Киллиан» с продолговатыми пуансонами. Средняя масса таблеток в процессе производства имела значение при дозировке 10 мг - 0,115 г. Значение прочности на сжатие полученных таблеток, которую определяли на приборе тип ТВ-24 фирмы Erweka (Германия), составляло 80 Н. Показатели прочности на истирание, определенное на фриабиляторе тип ТАР фирмы Erweka (Германия), составляли менее 0,5%. Распадаемость таблеток, определенная на приборе ″Качающаяся корзинка″ типа VZ-4 фирмы Erweka (Германия), составляла в воде не более 15 минут при температуре 37±2°C. Тест «Растворение» таблеток определяли на приборе фирмы Erweka (Германия).
При внешнем осмотре поверхность полученных таблеток ровная и однородная, таблетки не крошатся. Полученные таблетки имеют среднюю массу 0,07 г, распадаемость - 7-10 минут. Полученные таблетки отвечают требованиям Государственной фармакопеи.
Пример 2. Получение композиции состава 1 влажным гранулированием с последующим капсулированием
10,0 г дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α] бензимидазол (8,7 мас. %), 98,5 г лактозы (85,65 мас. %) /наполнитель/, 5 г МКЦ 102 (4,35 мас. %) /наполнитель/ смешивают в смесителе. Увлажняют массу 5,0% раствором ПВП в количестве (в пересчете на чистое вещество) 0,04 г (0,4 мас. %) /связующее/. Увлажненную массу подвергают влажной грануляции. Влажный гранулят высушивают в сушильном шкафу в течение 2-3 часов при температуре 40-50°C или при комнатной температуре в течение 22-24 часов до остаточной влажности 2-3%. Высушенную массу гранул размалывают в грануляторе фирмы Erweka (Германия) с размером пор 1,0-1,5 мм. Массу сухого гранулята опудривают стеаратом магния /скользящее/ в количестве 1,0 г (0,9 мас. %). Полученный гранулят капсулируют в твердые желатиновые капсулы. Полученные капсулы отвечают требованиям Государственной фармакопеи.
Пример 3. Получение композиции состава 1 влажным гранулированием с сушкой в сушильном шкафу с последующим таблетированием
10,0 г дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо [1,2-α]бензимидазола (9,3 мас. %), 87,0 г лактозы (80,6 мас. %) /наполнитель/ и 5,0 г микрокристаллической целлюлозы (4,6 мас. %) /наполнитель/ смешивают в смесителе. Увлажняют массу 8,0% крахмальным клейстером в количестве (в пересчете на чистое вещество) 5,0 г (4,6 мас. %) /связующее/. Влажный гранулят высушивают в сушильном шкафу в течение 2-3 часов при температуре 40±5°C или при комнатной температуре в течение 22-24 часов до остаточной влажности 2-3%. Высушенную массу гранул размалывают в грануляторе с диаметром отверстий в сетке 1,0-1,5 мм. Массу сухого гранулята опудривают стеариновой кислотой в количестве 1 г (0,9 мас. %) /скользящее/. Сыпучесть полученной таблеточной массы составляла 7,14 г/с.
Гранулят прессуют на ротационном прессе фирмы «Киллиан». При внешнем осмотре поверхность таблеток ровная и однородная, таблетки не крошатся. Полученные таблетки имеют среднюю массу 0,20 г, распадаемость - 5-7 минут. Полученные таблетки отвечают требованиям Государственной фармакопеи.
Пример 4. Получение композиции состава 1 влажным гранулированием с сушкой в сушильном шкафу с последующим таблетированием
10,0 г дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо [1,2-α]бензимидазола (7,7 мас. %), 90,0 г кальция карбоната основного (69,2 мас. %) /наполнитель/, 10,0 г микрокристаллической целлюлозы (7,7 мас. %) /наполнитель/ и 19,0 г крахмал марки Starch-1500 (14,6 мас. %) /связующее/ перемешивают, после чего увлажняют полученную смесь водой очищенной, далее увлажненную массу гранулируют и сушат в сушильном шкафу до остаточной влажности 2-3%. Высушенные гранулы размалывают в грануляторе фирмы Erweka (Германия). Сухие гранулы опудривают 1,0 г (0,8 мас. %) магния стеарата /скользящее/. Получают таблетки с содержанием дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола 0,01 г. Полученные твердые лекарственные формы отвечают требованиям Государственной фармакопеи.
Пример 5. Получение композиции состава 4 прямым прессованием с последующим таблетированием
Получение фармацевтической композиции дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола осуществляют, смешивая дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазол 50,0 г (5 мас. %), лактоза 100 г (10,0 мас. %) /наполнитель/, лудипресс 840,0 г (84 мас. %) /наполнитель/ и 10,0 г магния стеарата (1 мас. %) /скользящее/ в смесителе в течение 10-15 мин. Смесь порошков брикетируют на таблеточном или брикетировочном прессе (диаметр брикетов - от 12 мм до 50 мм). Полученные брикеты разламывают в грануляторе с размерами отверстий сетки 1,0-1,5 мм. Таблетирование производят на ротационном прессе фирмы «Киллиан». Диаметр пуансонов 8,0 мм, средняя масса таблеток 0,20 г. Получают таблетки с содержанием дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола 0,01 г, отвечающие всем требованиям Государственной фармакопеи.
Аналогично получены композиции с использованием вместо лактозы в качестве наполнителя, или микрокристаллической целлюлозы, или кальция фосфата, или кальция дигидрофосфата, или кальция гидрофосфат дигидрата, или кальция сульфат дигидрата, или кальция карбоната основного, или производных поливинилпирролидона, или декстрина, или амилопектина, или ультра-амилпектина, или сорбита, или маннита, или пектина, или магния карбоната основного, или магния окиси, или желатина, или метилцеллюлозы (МЦ), или прежелатинизированного крахмала, а вместо лудипресса или картофельного и кукурузного крахмала карбоксиметилцеллюлозы, или гидроксипропилметилцеллюлозы, или вспомогательных веществ с повышенной сорбционной способностью: коллоидный кремний (аэросил, Syloid®), алюмометосиликат магния (Neusilin®, Fuji, Япония).
Пример 6. Получение композиции состава 1 с сушкой в псевдоожиженном слое с последующим таблетированием
Получение фармацевтической композиции на основе дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола осуществляют смешением компонентов в соотношении, аналогичном примеру 3, с сушкой в псевдоожиженном слое. Сыпучесть полученной таблеточной массы составляет 6,1 г/с. Получают таблетки с содержанием дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо [1,2-α]бензимидазола 0,01 г и временем распадаемости 6-8 мин, отвечающие всем требованиям Государственной фармакопеи.
Пример 7. Получение композиции состава 4 сухой грануляцией с последующим таблетированием
10,0 г дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола (6,25 мас. %), 129,0 г лактозы (80,62 мас. %) /наполнитель/ и 20,0 г микрокристаллической целлюлозы (12,5 мас. %) /наполнитель/ перемешивают, после чего смесь порошков брикетируют на таблеточном или брикетировочном прессе (диаметр брикетов - от 12 мм до 50 мм). Полученные брикеты разламывают в грануляторе с размерами отверстий сетки 1,0-1,5 мм. Опудривают стеаратом калия 1,0 г (0,63 мас. %) /скользящее/. Таблетирование производят на ротационном прессе фирмы «Киллиан». Диаметр пуансонов 8,0 мм, средняя масса таблеток 0,160 г. Получают таблетки или капсулы с содержанием дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола 0,1 г, отвечающие всем нормативным требованиям. Полученные твердые лекарственные формы отвечают требованиям Государственной фармакопеи.
Пример 8. Получение композиции состава 3 прямым прессованием с последующим таблетированием и покрытием пленочной оболочкой
Получение фармацевтической композиции осуществляют смешением дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола 20,0 г (5 мас. %), лактозы 336,0 г (84 мас. %) /наполнитель/ и 4,0 г стеариновой кислоты (1 мас. %) /скользящее/ в смесителе в течение 10-15 мин. Смесь порошков брикетируют на таблеточном или брикетировочном прессе (диаметр брикетов - от 12 мм до 50 мм). Полученные брикеты разламывают в грануляторе с размерами отверстий сетки 1,0-1,5 мм. Таблетирование производят на ротационном прессе фирмы «Киллиан». Диаметр пуансонов 8,0 мм, средняя масса таблеток 0,20 г. Получают таблетки с содержанием дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола 0,01 г, отвечающие всем нормативным требованиям. Получение таблетки ядра покрывают пленочным покрытием Опадрай II (гипромеллоза, лактозы моногидрат, полидекстроза, макрогол, титана диоксид, железа оксид желтый, железа оксид красный) 40,0 г (10 мас. %) /пленочное покрытие/. Нанесение оболочки проводят известным способом (псевдоожижение или в установках барабанного типа) и прекращают по достижении необходимой массы таблетки. Полученные твердые лекарственные формы отвечают требованиям Государственной фармакопеи.
Пример 9. Получение композиции состава 2 влажным гранулированием с последующим таблетированием и покрытием пленочной оболочкой
10,0 г дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола (7,0 мас. %), 90,0 г лактозы (62,9 мас. %) /наполнитель/, 10,0 г микрокристаллической целлюлозы (7,0 мас. %) /наполнитель/ и 19,0 г крахмала марки Starch-1500 (13,3 мас. %) /связующее/ перемешивают, после чего увлажняют полученную смесь водой очищенной, далее увлажненную массу гранулируют и сушат до остаточной влажности 2-3%. Высушенные гранулы размалывают в грануляторе фирмы Erweka (Германия). Сухие гранулы опудривают 1,0 г (0,7 мас. %) магния стеарата /скользящее/.
Получение таблетки ядра покрывают пленочным покрытием Колликут МАЕ 100 D (сополимера метакриловой кислоты с этилакрилатом (1:1)) 13,0 г (9,1 мас. %) /пленочное покрытие/. Полученные твердые лекарственные формы отвечают требованиям Государственной фармакопеи.
Аналогично получены композиции с использованием вместо крахмала марки Starch-1500 в качестве связующего, или спирта этилового, или крахмального клейстера, или сахарного сиропа, или растворов: карбоксиметилцеллюлозы (КМЦ), оксиэтилцеллюлозы (ОЭЦ), оксипропилметилцеллюлозы (ОПМЦ), или поливинилового спирта (ЛВС), или поливинилпирролидона (ПВП), или альгиновой кислоты, или натрия альгината, или желатина, или метилцеллюлозы, или гидроксипропилметилцеллюлозы, или крахмала картофельного и/или кукурузного, или крахмала марки Starch-1500.
Пример 10. Получение композиции состава 2 прямым прессованием с последующим таблетированием и покрытием пленочной оболочкой
Получение фармацевтической композиции дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола осуществляют, смешивая дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазол 50,0 г (4,5 мас. %), лактозы 100 г (9,1 мас. %) /наполнитель/, лудипресса 830,0 г (75,5 мас. %) /наполнитель/ и 10,0 г магния стеарата (0,9 мас. %) /скользящее/ в смесителе в течение 10-15 мин. Смесь порошков брикетируют на таблеточном или брикетировочном прессе (диаметр брикетов - от 12 мм до 50 мм). Полученные брикеты разламывают в грануляторе с размерами отверстий сетки 1,0 - 1,5 мм. Таблетирование производят на ротационном прессе фирмы «Киллиан». Диаметр пуансонов 8,0 мм, средняя масса таблеток 0,22 г. Получают таблетки с содержанием дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола 0,01 г, отвечающие всем нормативным требованиям. Получение таблетки ядра покрывают пленочным покрытием Опадрай II (гипромеллоза, лактозы моногидрат, полидекстроза, макрогол, титана диоксид, железа оксид желтый, железа оксид красный) 110,0 г (10,0 мас. %) /пленочное покрытие/. Нанесение оболочки проводят известным способом (псевдоожижение или в установках барабанного типа) и прекращают по достижении необходимой массы таблетки. Полученные твердые лекарственные формы отвечают требованиям Государственной фармакопеи.
Пример 11. Получение композиции состава 4 сухой грануляцией с последующим таблетированием
198,8 г дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола (99,4 мас. %), 6 г лактозы (0,3 мас. %) и 4 г микрокристаллической целлюлозы (0,2 мас. %) /наполнитель/ перемешивают, после чего смесь порошков брикетируют на таблеточном или брикетировочном прессе (диаметр брикетов - от 12 мм до 50 мм). Полученные брикеты разламывают в грануляторе с размерами отверстий сетки 1,0-1,5 мм. Опудривают стеаратом калия 2 г (0,1 мас. %) /скользящее/. Таблетирование производят на ротационном прессе фирмы «Киллиан». Диаметр пуансонов 8,0 мм, средняя масса таблеток 0,160 г. Получают таблетки или капсулы с содержанием дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола 0,198 г, отвечающие всем нормативным требованиям Государственной фармакопеи.
Пример 12. Получение композиции состава 4 сухой грануляцией с последующим таблетированием
0,2 г дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола (0,1 мас. %), 160,0 г лактозы (80,0 мас. %) и 39,6 г микрокристаллической целлюлозы (19,8 мас. %) /наполнитель/ перемешивают, после чего смесь порошков брикетируют на таблеточном или брикетировочном прессе (диаметр брикетов - от 12 мм до 50 мм). Полученные брикеты разламывают в грануляторе с размерами отверстий сетки 1,0-1,5 мм. Опудривают стеаратом калия 2 г (0,1 мас. %) /скользящее/. Таблетирование производят на ротационном прессе фирмы «Киллиан». Диаметр пуансонов 8,0 мм, средняя масса таблеток 0,160 г. Получают таблетки или капсулы с содержанием дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола 0,2 мг, отвечающие всем нормативным требованиям Государственной фармакопеи.
Пример 13. Получение композиции состава 4 сухой грануляцией с последующим таблетированием
0,2 г дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола (0,1 мас. %), 160,0 г лактозы (80,0 мас. %) и 39,2 г микрокристаллической целлюлозы (19,6 мас. %) /наполнитель/ перемешивают, после чего смесь порошков брикетируют на таблеточном или брикетировочном прессе (диаметр брикетов - от 12 мм до 50 мм). Полученные брикеты разламывают в грануляторе с размерами отверстий сетки 1,0-1,5 мм. Опудривают стеаратом калия 6 г (0,3 мас. %) /скользящее/. Таблетирование производят на ротационном прессе фирмы «Киллиан». Диаметр пуансонов 8,0 мм, средняя масса таблеток 0,160 г. Получают таблетки или капсулы с содержанием дигидрохлорид-9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола 0,2 мг, отвечающие всем нормативным требованиям Государственной фармакопеи.
Пример 14. Получение композиции состава 1 влажным гранулированием с последующим таблетированием
30,0 г дигидрохлорид 9-морфолиноэтил-2(4-фторфенил)имидазо[1,2-α]бензимидазола (15,0 мас. %), 30,0 г лактозы (15,0 мас. %) /наполнитель/ и 20,0 г микрокристаллической целлюлозы (10 мас. %) /наполнитель/ смешивают в смесителе. Увлажняют массу раствором ПВП в количестве (в пересчете на чистое вещество) 120,0 г (60,0 мас. %) /связующее/. Увлажненную массу подвергают влажной грануляции. Влажный гранулят высушивают в сушильном шкафу в течение 2-3 часов при температуре 40±5°C или при комнатной температуре в течение 22-24 часов до остаточной влажности 2-3%. Высушенную массу гранул размалывают в грануляторе с диаметром отверстий в сетке 1,0-1,5 мм. Гранулят прессуют в таблетки.
Полученные таблетки имеют среднюю массу 0,200 г, распадаемость - 7-10 минут. Полученные таблетки отвечают требованиям Государственной фармакопеи.
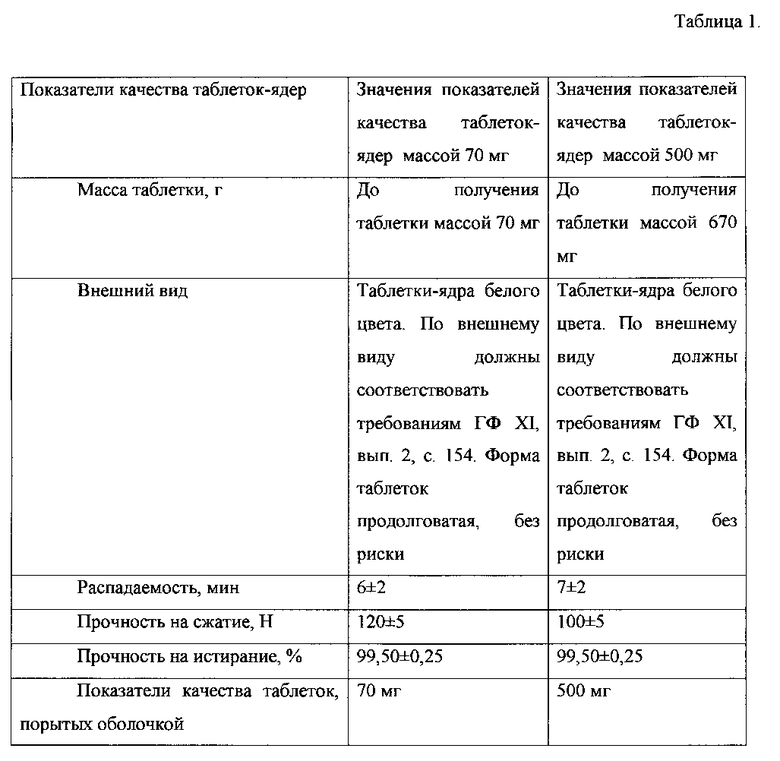
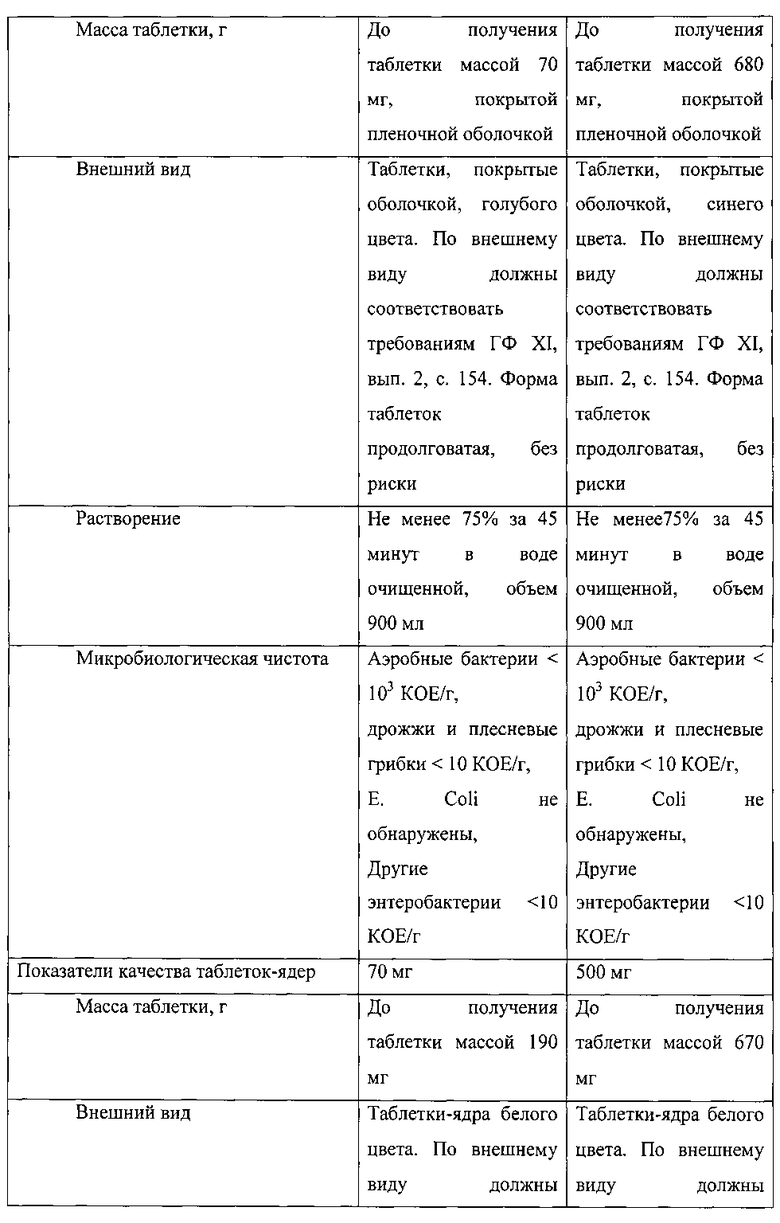
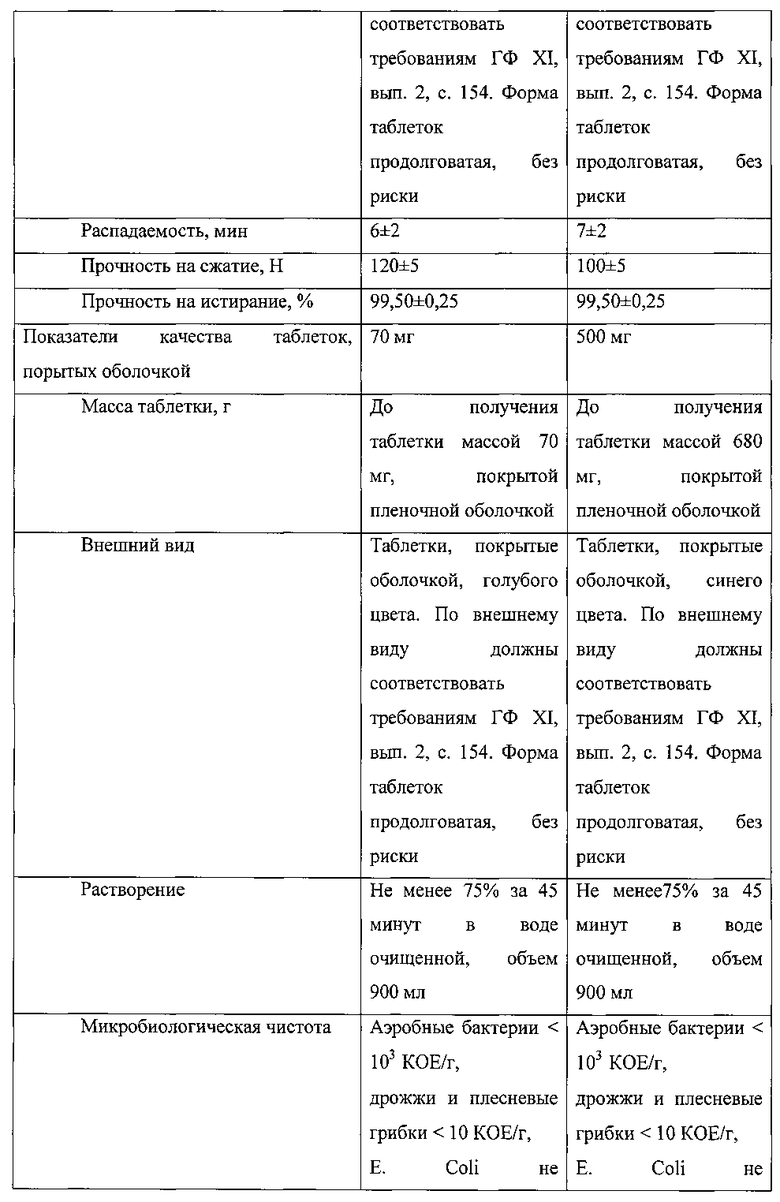
В таблице 1 приведены показатели качества полученных таблеток.

ФАРМАКОКИНЕТИЧЕСКИЕ СВОЙСТВА СОЕДИНЕНИЯ В ТВЕРДОЙ ДОЗИРОВАННОЙ ЛЕКАРСТВЕННОЙ ФОРМЕ
Методы исследования фармакокинетических свойств соединения
В процессе изучения фармакокинетических свойств соединения использовался физико-химический метод определения в биоматериале концентрации исследуемого вещества - высокоэффективная жидкостная хроматография. Эксперименты проводились на кроликах породы «Шиншилла» массой 2-2,5 кг. Субстанция и лекарственная форма вводились перорально. За двенадцать часов до проведения экспериментов животные лишались доступа к пище без ограничения потребления воды.
Количественное определение изучаемого соединения проводилось с помощью высокоэффективной жидкостной хроматографии на компьютеризованной системе Shimadzu (Япония) с УФ-детектором при λ=205 нм на аналитической колонке SUPELCOSIL LC-18 (5 мкм; 100 мм×4,6 мм). Мобильная фаза включала ацетонитрил (J.T. Baker, США) и буферную систему, состоящую из однозамещенного фосфата калия 50 мМ pH 5,0, в соотношении 1:1 [Смирнова Л.А., Ращенко А.И., Рябуха А.Ф., Кузнецов К.А., Сучков Е.А. // Количественное определение соединения РУ-1205 в биологических пробах / Волгоградский научно-медицинский журнал, 2/2012. - С. 15-17].
Зависимость площадей пиков от концентрации изучаемого соединения анализировалась методом регрессионного анализа. Статистическая обработка результатов проводилась при помощи компьютерной программы Excel [Фирсов А.А., Жердев В.П. и др. // Методические рекомендации по изучению анальгетической активности лекарственных средств / Руководство по проведению доклинических исследований лекарственных средств под ред. В.П. Фисенко. М., 2012. - С. 843-851].
Исследуемые материалы
1. Субстанция соединения дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазол.
2. Твердая лекарственная форма, полученная по примеру 10 (состав таблетки: дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазол - 0,011 г (4,5 мас %); лактоза - 0,02 г (9,1 мас %); лудипресс - 0,1661 г (75,5 мас %); магния стеарат - 0,002 г (0,9 мас %), opodry 200f- 0,02 (10,0 мас %)).
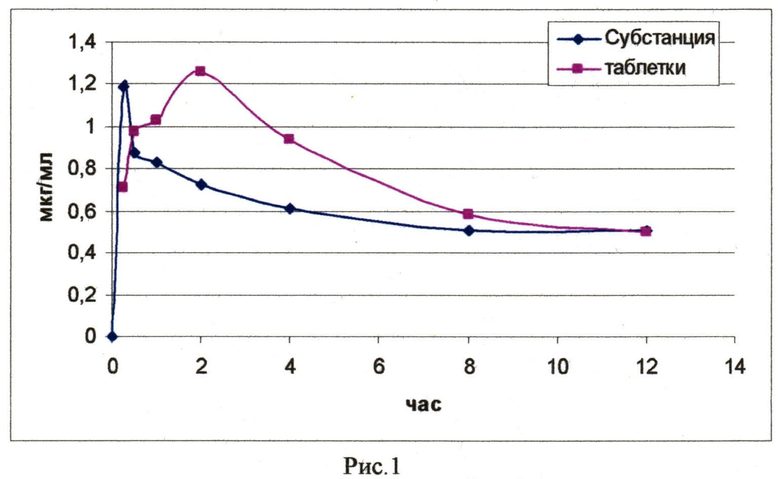
На рис. 1 приведено содержание действующего начала (соединения) вышеприведенной композиции, полученной по примеру 10, и субстанции в крови кроликов после перорального введения их в дозе 50 мг/кг (в расчете на соединение) в зависимости от времени.
В таблице 2 приведены фармакокинетические параметры соединения у кроликов при пероральном введении субстанции и вышеописанных таблеток в оболочке в дозе 50 мг/кг.
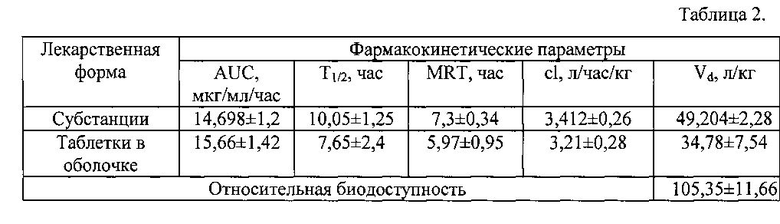
На основании приведенных данных установлено, что фармакокинетические профили субстанции и твердой лекарственной формы отличаются временем наступления максимальной концентрации в крови. Для лекарственной формы наблюдаются характерные фазы всасывания и более плавная фаза элиминации (Рис. 1). Это связано с распадом таблеточной массы в желудочно-кишечном тракте организма животных, дальнейшим ее растворением и перераспределением в кровь. При анализе фармакокинетических параметров не было выявлено статистически значимых отличий между субстанцией и таблетированной лекарственной формой. Значение площади под кривой соединения в виде лекарственной формы незначительно превосходит данный показатель соединения в виде субстанции. Период полувыведения, среднее время удерживания, клиренс и кажущийся объем распределения, характерные для субстанции соединения, выше относительно лекарственной формы. Было выявлено, что для твердой дозированной лекарственной формы при пероральном введении характерна высокая относительная биодоступность (табл. 2).
ОБЕЗБОЛИВАЮЩИЕ СВОЙСТВА СОЕДИНЕНИЯ В ТВЕРДОЙ ДОЗИРОВАННОЙ ЛЕКАРСТВЕННОЙ ФОРМЕ
Методы исследования анальгетической активности соединения
Тест горячей пластины [Kitchen I. Assessment of the hot-plate antinociceptive test in mice. A new method for the statistical treatment of graded data. / Kitchen I, Crowder M. // J Pharmacol Methods. - 1985. Vol. 13, №1. - P. 1-7] позволяет оценить наличие центрального механизма обезболивающего действия и основан на поведенческих реакциях, контролируемых супраспинальными структурами, в ответ на болевое воздействие [Воронина Т.А., Гузеватых Л.С. / Методические рекомендации по изучению анальгетической активности лекарственных средств // Руководство по проведению доклинических исследований лекарственных средств / Под ред. В.П. Фисенко. М., 2012. С. 202]. Экспериментальное исследование проводили на мышах-самцах. Изучаемое соединение вводили в дозе 5 мг/кг. Через различные временные интервалы после введения изучаемого соединения животное помещали на разогретую до 55°C медную пластину, окруженную пластиковым цилиндром. Фиксировали латентное время ноцицептивной реакции в виде облизывания задних лап, которая появляется у животных с достижением порога болевой чувствительности [D. le Bars, Μ. Gozariu. Animal models of nociception / D. le Bars, M. Gozariu, S.W. Cadden. //, Pharmacol. Rev. - 2001. Vol. 53 №4 - P. 611]. Критерием анальгетического эффекта считали статистически значимое увеличение латентного периода реакции после введения вещества. Статистическую обработку данных проводили с использованием критериев Краскела-Уоллиса и Манна-Уитни.
Исследуемые материалы
1. Субстанция соединения дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазол.
2. Твердая лекарственная форма - композиция, полученная по примеру 10 (состав таблетки: дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо [1,2-α]бензимидазол - 0,011 г (4,5 мас %); лактоза - 0,02 г (9,1 мас %); лудипресс - 0,1661 г (75,5 мас %); магния стеарат - 0,002 г (0,9 мас %), opodry 200f- 0,02 (10,0 мас %)).
В таблице 3 приведено влияние соединения на антиноцицептивные эффекты в тесте «Горячая пластина» при пероральном введении в дозе 5 мг/кг (М±m).
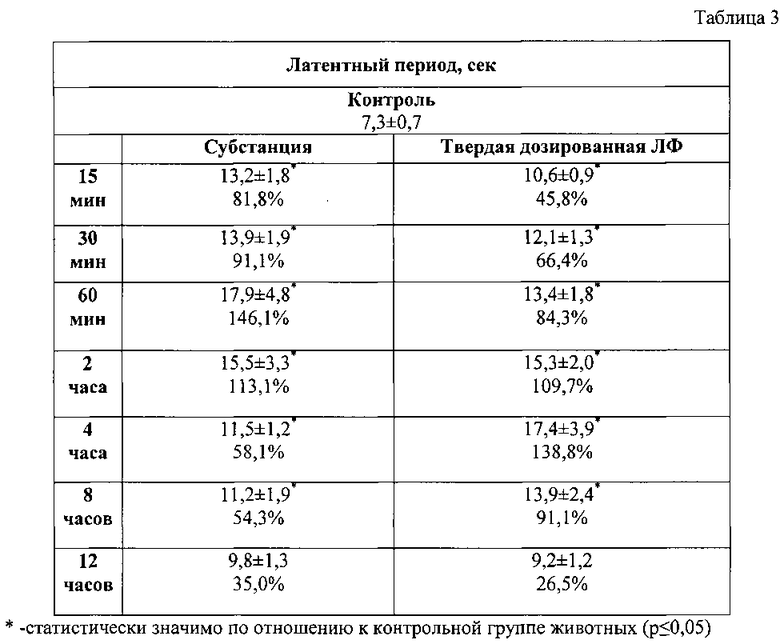
На рис. 2 показана продолжительность обезболивающего действия соединения при пероральном введении в дозе 5 мг/кг в тесте «Горячая пластина».
Через 15 минут после введения субстанции соединения порог болевой реакции статистически значимо повышался на 81,8% и достигал максимального эффекта к 60 минуте. При изучении обезболивающей активности твердой дозированной лекарственной формы наблюдалось медленное возрастание анальгетического действия с пиком максимального эффекта на 300 минуте исследования (табл. 3). Продолжительность действия лекарственной формы сохранялась до 500 минут (Рис. 2).
По фармакодинамическому эффекту отмечается некоторая пролонгация и усиление обезболивающей активности твердой дозированной лекарственной формы изучаемого соединения по сравнению с субстанцией.
Аналогичные результаты получены и для композиций, полученных по примерам 1, 5 и 8.
Таким образом, предлагаемая фармацевтическая композиция может быть использована как обезболивающее средство.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЦЕРЕБРОВАСКУЛЯРНЫХ РАССТРОЙСТВ И СПОСОБЫ ИХ ИЗГОТОВЛЕНИЯ | 2012 |
|
RU2559776C2 |
| ПРОЛОНГИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ЛЕКАРСТВЕННАЯ ФОРМА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ (ВАРИАНТЫ) | 2009 |
|
RU2435584C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ИНЪЕКЦИОННОЙ ФОРМЕ С АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ) | 2013 |
|
RU2563211C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ ДЛЯ ЛЕЧЕНИЯ ЦЕРЕБРОВАСКУЛЯРНЫХ РАССТРОЙСТВ | 2014 |
|
RU2611339C2 |
| Фармацевтическая композиция пролонгированного действия на основе 5-этокси-2-[2-(морфолино)-этилтио] бензимидазола дигидрохлорида и/или основания (Афобазола) | 2017 |
|
RU2694837C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2019 |
|
RU2736184C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ФАБОМОТИЗОЛА ДИГИДРОХЛОРИДА | 2022 |
|
RU2828872C2 |
| СРЕДСТВО НА ОСНОВЕ СУХОГО ЭКСТРАКТА ПУСТЫРНИКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2589507C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ С АНТИПСИХОТИЧЕСКОЙ АКТИВНОСТЬЮ И СПОСОБЫ ЕЁ ПОЛУЧЕНИЯ | 2012 |
|
RU2584653C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОТИВОМИГРЕНОЗНОГО ДЕЙСТВИЯ В ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЕ В ВИДЕ ТАБЛЕТОК | 2019 |
|
RU2696866C1 |
Изобретение относится к фармацевтической композиции с каппа-опиоидной агонистической активностью, проявляющей анальгетический эффект. Фармацевтическая композиция содержит в качестве действующего начала дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола, а в качестве вспомогательных веществ наполнители, связывающие, скользящие и пленочные покрытия, в указанных в формуле изобретения количествах. Композиция может быть выполнена в виде твердой лекарственной формы, преимущественно в виде таблеток или капсул. Полученные твердые лекарственные формы отвечают требованиям Государственной Фармакопеи. 6 з.п. ф-лы, 2 ил., 3 табл., 14 пр.
1. Фармацевтическая композиция с каппа-опиоидной агонистической активностью, проявляющая анальгетический эффект, характеризующаяся тем, что содержит в качестве действующего начала дигидрохлорид 9-(2-морфолиноэтил)-2-(4-фторфенил)имидазо[1,2-α]бензимидазола, в качестве вспомогательных веществ - наполнитель, представляющий собой по меньшей мере одно вещество, выбранное из группы: микрокристаллическая целлюлоза, лактоза, кальция фосфат, кальция дигидрофосфат, кальция гидрофосфат дигидрат, кальция сульфат дигидрат, кальция карбонат основной, производные поливинилпирролидона; декстрин, амилопектин, ультра-амилпектин, сорбит, маннит, пектин, магния карбонат основной, магния окись, желатин, метилцеллюлоза (МЦ), прежелатинизированный крахмал, лудипресс, картофельный и кукурузный крахмал, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, вспомогательные вещества с повышенной сорбционной способностью: коллоидный кремний (аэросил, Syloid®), алюмометосиликат магния (Neusilin®, Fuji, Япония), скользящее вещество, и при необходимости связывающее вещество, представляющее собой по меньшей мере одно вещество, выбранное из группы: вода очищенная, спирт этиловый, крахмальный клейстер, сахарный сироп, растворы: карбоксиметилцеллюлозы (КМЦ), оксиэтилцеллюлозы (ОЭЦ), оксипропилметилцеллюлозы (ОПМЦ); поливинилового спирта (ПВС), поливинилпирролидона (ПВП), альгиновой кислоты, натрия альгината, желатина, метилцеллюлозы, гидроксипропилметилцеллюлозы, крахмал предпочтительно используют картофельный и/или кукурузный или крахмал марки Starch-1500, и пленочное покрытие, при следующем соотношении компонентов, мас. %:
2. Фармацевтическая композиция по п.1, характеризующаяся тем, что содержит компоненты при следующем их соотношении, мас. %:
3. Фармацевтическая композиция по п.1, характеризующаяся тем, что содержит компоненты при следующем их соотношении, мас. %:
4. Фармацевтическая композиция по п.1, характеризующаяся тем, что содержит компоненты при следующем их соотношении, мас. %:
5. Фармацевтическая композиция по п.1, характеризующаяся тем, что содержит компоненты при следующем их соотношении, мас. %:
6. Фармацевтическая композиция по п.1, характеризующаяся тем, что в качестве скользящего содержит по меньшей мере одно вещество, выбранное из группы: стеариновая кислота и/или ее соли, например стеарат магния, аэросил.
7. Фармацевтическая композиция по п.1, характеризующаяся тем, что в качестве пленочного покрытия содержит по меньшей мере одно вещество, выбранное из группы: полиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, гидроксипропилцеллюлозу, гидроксиметилцеллюлозу и гидроксипропилметилцеллюлозу (Opadry YellowT, Colorcon Corp.), оксипропилметилцеллюлозы фталат, ацетилцеллюлозы фталат, поливинилацетата фталат, метилцеллюлозы фталат, сополимер метакриловой кислоты или сложные метиловые эфиры метакриловой кислоты (Eudragit R, Акрил-из), Колликут® МАЕ 100 П, Колликут® МАЕ 30 D, Колликут МАЕ 100 D, этилцеллюлоза, ацетилцеллюлоза, сополимеры поливинилового спирта и малеинового ангидрида, полиэтиленгликоль (полиэтиленгликоль 6000), триэтилцитрат, диэтилфталат, пропиленгликоль, глицерин, бутилфталат, двуокись титана и красители, окись железа, алюминиевые красители.
| СРЕДСТВО, ОБЛАДАЮЩЕЕ КАППА-ОПИОИДНОЙ АГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2413512C1 |
| СРЕДСТВО, ПРОЯВЛЯЮЩЕЕ СВОЙСТВА АНТАГОНИСТА СЕРОТОНИНОВЫХ 5-HT-РЕЦЕПТОРОВ | 2010 |
|
RU2438669C1 |
| US 6303611 B1, 16.10.2001 | |||
| СОЛИ 9-(2-МОРФОЛИНОЭТИЛ)-2-(4-ФТОРФЕНИЛ)ИМИДАЗО[1,2-a]БЕНЗИМИДАЗОЛА И СОЛИ 9-АМИНОЭТИЛЗАМЕЩЕННЫХ 2-(4-ФТОРФЕНИЛ)ИМИДАЗО[1,2-a]БЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЕ ОБЕЗБОЛИВАЮЩЕЕ ДЕЙСТВИЕ | 2009 |
|
RU2412187C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ МЕСТНО-АНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2313341C1 |
| О.Ю.Гречко и др., Изучение анальгетической активности нового производного бензимидазола при различных путях введения., Волгоградский научно-медицинский журнал, 2012, 2, стр.17-19 | |||
| Л.А.Смирнова и др., Количественное | |||
Авторы
Даты
2015-04-10—Публикация
2013-10-02—Подача