Изобретение касается обнаружения рака, в частности способов и проб для обнаружения присутствия опухолевого маркера, являющегося надежным показателем присутствия раковых клеток.
В течение прошедших 15 лет были открыты ряд связанных с опухолью белков, часть которых считалась пригодной для использования в качестве опухолевых маркеров. Многие такие опухолевые маркеры связаны исключительно со специфическими опухолями. В результате их присутствие может быть использовано для надежного обнаружения этих опухолей. Поскольку опухолевый маркер может быть легче обнаружен, чем сама опухоль как таковая, то этот маркер обеспечивает возможность более раннего и более надежного обнаружения опухоли. Наиболее хорошо известными опухолевыми маркерами являются: (a) зародышевый антиген (CEA) для раков прямой кишки, легких, желудка и поджелудочной железы; (b) альфа-фетобелок (AFP) для семенного рака и рака печени; (c) недавно обнаруженный опухолевый маркер рака молочной железы (CA-549).
Был обнаружен опухолевый маркер, который в отличие от упомянутых, является универсальными опухолевым маркером. Этот опухолевый маркер в форме субмикроскопических частиц кольцевой формы левый маркер в форме субмикроскопических частиц кольцевой формы (RSP) при рассмотрении в электронном микроскопе выделяется в окружающую ткань и биологическую жидкость (организма) из раковых клеток, но не выделяется в обнаруживаемых количествах нормальными клетками, RSP, известный также как просома, протеасома, миничастицы, LAMP, макропаин, протеолипид РНК и миничастицы кольцевой формы, выделяются различными типами человеческих опухолей, а также опухолями других млекопитающих животных и злокачественными клеточными линиями. Исследования в условиях "ин витро" и "ин виво" показывают, что выделение RSP злокачественными клетками является типичным для карцерогенеза и не зависит от разновидностей, типов опухолей или места нахождения опухоли в организме. Кроме того, этот опухолевый маркер выделяется пропорционально опухолевому разрастанию (грузу) и выделяется за 4-10 месяцев до того, как возможен диагноз рецидива, основанный на явных клинических симптомах. Следовательно, в отличие от других маркеров, RSP является универсальным опухолевым маркером. RSP как таковой может служить для обнаружения присутствия любого ракового заболевания на ранней стадии, давая более надежные перспективы и лечения. RSP способен также обеспечить контроль эффективности лечения раковых больных. Снижение концентрации RSP в сыворотке может служить индикатором успешного лечения. Поскольку все злокачественные клетки, испытанные ранее в тканевой культуре, выделяют RSP, и клетки, дающие злокачественность тканевой культуре после обработки канцерогенами, также выделяют RSP, то RSP может использоваться как конечная точка для нового семейства систем кратковременного испытания для обнаружения также карцерогенов. Проведенные первые исследования привели к разработке системы флюоресцентного анализа для обнаружения ДНК компонента в RSP. Этот метод был успешно использован на спринцовочных жидкостях для исследования женщин на рак шейки матки. Известна методика связывания флуоресцирующего красителя с ДНК компонентом RSP и регистрации повышенной эмиссии света (интенсивность флуоресценции) как непрямое измерение RSP концентрации. К сожалению, эта методика должна быть модифицирована для возможности количественного измерения RSP в различных жидкостях организма для учета таких показателей, как разбавление и неодинаковые объемы. Кроме того, флюоресцентный анализ требует использование специального оборудования даже для качественного анализа, кроме того, он нелегко применим для локального, в большей или меньшей степени домашнего использования или для включения в систему испытательных средств для использования во врачебном кабинете.
Сущность изобретения.
Предметом изобретения является способ и проба для обнаружения присутствия опухолевого маркера RSP как способа обнаружения злокачественности, который является недорогим, простым, легким в использовании, чувствительным и надежным.
Следующим предметом изобретения является способ и проба для обнаружения присутствия опухолевого маркера RSP в биологической жидкости путем захвата этого маркера из жидкости на субстрат и последующего выявления присутствия RSP на субстрате.
Также предметом изобретения являются способ и проба для обнаружения присутствия злокачественности, которые включают захват опухолевого маркера RSP из биологической жидкости, содержащей раковые клетки, на субстрат, и последующее выявление присутствия опухолевого маркера RSP на субстрате как индикатора присутствия злокачественности.
Кроме того, предметом данного изобретения является способ и проба для захвата опухолевого маркера RSP из биологической жидкости посредством анти-RSP антител, выбранных из группы, включающей моноклональные антитела, поликлональные антитела, очищенные с использованием принципа средства, и их смеси.
Следующим предметом изобретения является способ и проба для захвата опухолевого маркера RSP из биологической жидкости с пробой транспортной рибонуклеиновой кислотой (тРНК) и последующего выявления присутствия этой пробы как индикатора присутствия RSP.
Предметом изобретения является захват опухолевого маркера RSP из биологической жидкости на субстрат с тРНК специфической для рецепторной точки аминоапиловой транспортной тРНК синтезы на данном маркере.
Кроме того, предметом изобретения является способ обнаружения присутствия опухолевого маркера RSP в биологических жидкостях от пациентов с предлагаемой злокачественностью, в котором используется принцип проявления цвета и осуществляется прямое или непрямое связывание реагирующих на цвет молекул с опухолевым маркером RSP.
Согласно изобретению указанные цели достигаются благодаря способу обнаружения присутствия RSP в биологических жидкостях от пациентов, которые могут иметь злокачественные опухоли, способу, который включает захват RSP в указанной жидкости, на субстрат, и выявление присутствия RSP на субстрате. Этот способ может быть использован для выявления присутствия злокачественных раковых клеток у человека или животных путем получения образца жидкости организма от человека или животного, подвергаемого испытанию, захвата RSP в этой жидкости на субстрат и выявления присутствия RSP на субстрат. Согласно одному из принципов осуществления изобретения RSP захватывается из образца жидкости организма анти-RSP антителами, выбранными из числа следующих: моноклональные антитела, поликлональные антитела, антитела, очищенные посредством хроматографии средства, и их смеси. После этого определяется присутствие RSP на субстрате, например, способом проявления цвета. Согласно другому принципу изобретения RSP захватывается из образца жидкости организма путем контактирования RSP в образце жидкости организма с меченой тРНК пробой для скрепления тРНК с активной точкой аминоациловой транспортной РНК синтетазой на маркере RSP и обнаружения присутствия молекулы синтетазы на RSP.
Согласно предпочтительному аспекту изобретения, как захват, так и обнаружение RSP или обнаружение уже захваченной RSP на субстрате осуществляется с использованием пробы для RSP, включающей тРНК, специфическую для активной точки аминоацил транспортной тРНК синтетазы на RSP. Желательно, чтобы эта проба была связанной молекулой, которая посредством тРНК компонента связывается с активной точкой аминоацил тРНК синтетазы (динуклеотидная ветка) на RSP, и включает вторичные молекулы для проявления видимого цвета. Такая предпочтительная проба включает связанные молекулы: тРНК - фотобиотин - стрептавидин - щелочная фосфатаза. Другая предпочтительная проба включает тРНК - фотобиотин -авидин - глюкозооксидазу.
Согласно следующему аспекту изобретения предусматривается проба для RSP, включающая, по меньшей мере, одно или несколько анти-RSP антител, выбранных из числа следующих: моноклональные и очищенные с использованием принципа средства антитела, причем указанные антитела связаны с пробным маркером, присутствие которого обнаруживается и принято как индикатор присутствия опухолевого маркера RSP.
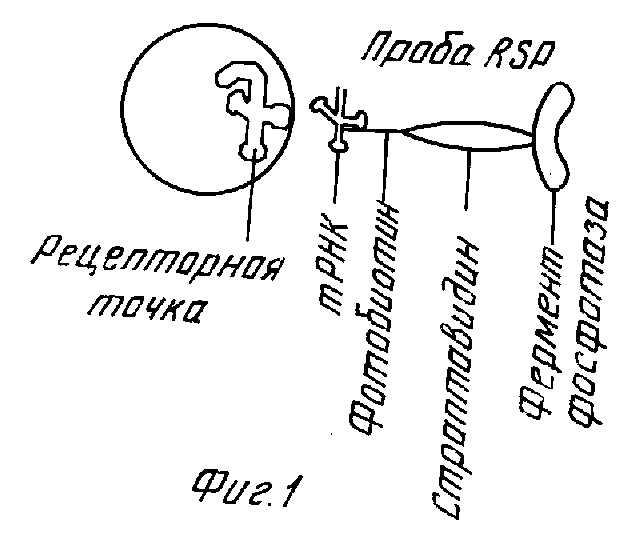
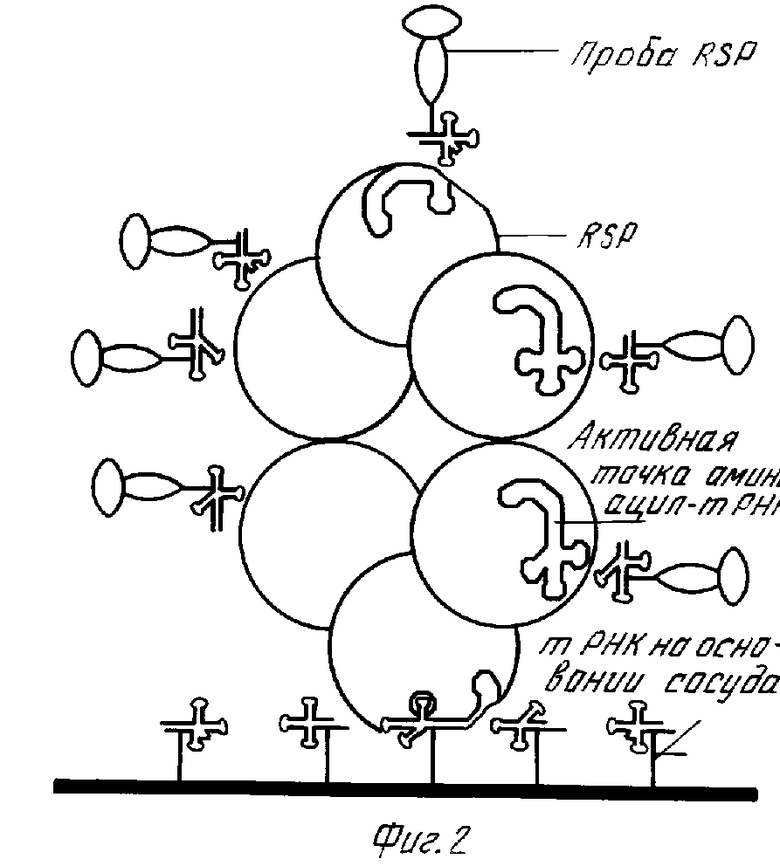
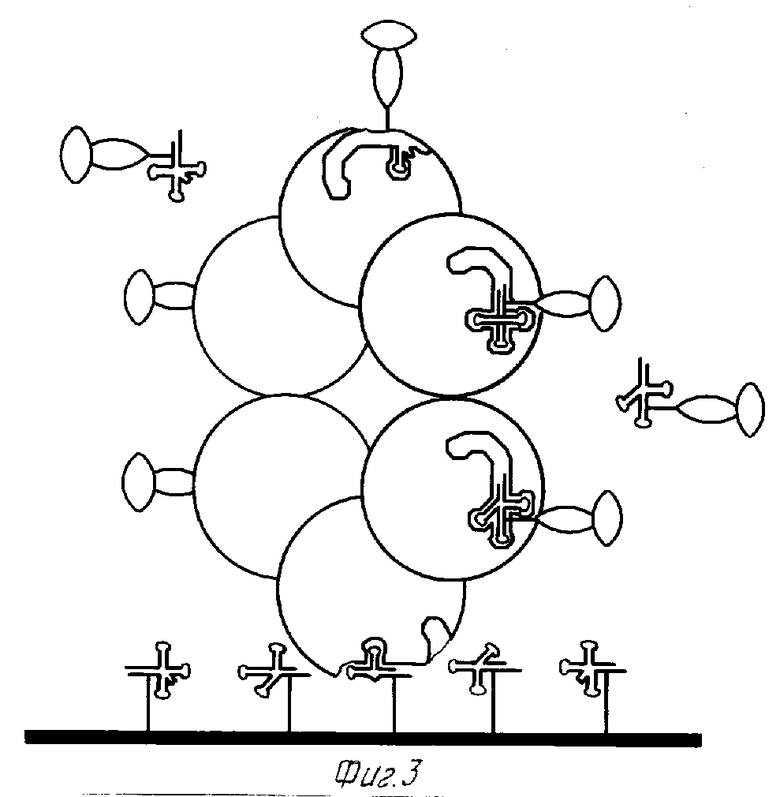
На фиг. 1 показана в форме диаграммы рецепторная точка аминоацил тРНК синтетазы RSP и одна из форм пробы RSP, специфической для указанной точки; на фиг. 2 - в форме диаграммы RSP, связанной с реакционным сосудом через предварительно обработанные тРНК поверхности непосредственно перед связыванием тРНК проб с доступными рецепторными точками аминоацил тРНК синтетазы на RSP; на фиг.3 - в форме диаграммы RSP фиг.2 после реакции с тРНК пробами на их рецепторных точках.
Предпочтительный вариант осуществления изобретения.
Согласно изобретению предусматривается способ определения присутствия опухолевых маркеров RSP в биологических жидкостях и обнаружения присутствия злокачественности у человека и животных, который включает захват маркера RSP из этой жидкости на субстрат и последующее обнаружение присутствия маркера RSP на этом субстрате как индикатора присутствия злокачественности. Согласно предпочтительному аспекту изобретение включает использование анти-RSP антитела (rspAb) для захвата опухолевого маркера RSP в жидкости организма на субстрате. Такая возможность обеспечивается за счет сродства rspAb с опухолевым маркером RSP, которое приводит к связыванию rspAb с опухолевым маркером RSP, и тем самым обеспечивает желаемый захват RSP из жидкости. Согласно другому предпочтительному аспекту изобретение включает использование пробы тРНК, которая связывается с очень специфической точкой, активной точкой амино-ацил-транспортной РНК синтетазы, на RSP. Такая проба способна не только к захвату опухолевого маркера RSP в жидкости организма на субстрате, но и к обнаружению присутствия RSP на субстрате благодаря включению в пробе соответствующих вторичных молекул, которые облегчают это обнаружение, например, за счет проявления видимого цвета. То, что захват и обнаружение опухолевого маркера RSP является эффективным, точным и надежным методом выявления присутствия злокачественных раковых клеток у человека и животных, является прямым результатом выделения RSP раковыми клетками за пределы клеток и ввиду этого RSP могут быть обнаруживаемыми в сыворотке или других жидкостях организма.
Способность анти-RSP антител распознавать и идентифицировать RSP в биологических жидкостях, например в жидкостях организма человека и животных, и захватывать RSP из этих жидкостей, и использование этого способа для обнаружения раковых клеток в жидкостях организма человека и животных, таких как сыворотка раковых больных хорошо иллюстрируется на фиг.1. Цель этого примера - продемонстрировать, что анти-RSP антитело (rspAb) может эффективно захватывать RSP из сыворотки ракового больного.
П р и м е р 1 осуществляется путем извлечения с использованием принципа очистки методом сродства rspAb из организма бывшего ракового больного, который уже более не выделяет RSP, но еще имеет анти-RSP-антитело. Если это rspAb эффективно, то захваченные RSP будут обнаруживаться способами проявления цвета, например, с системой обнаружения тРНК пробы.
П р и м е р 1. Процедуры очистки с использованием принципа сродства.
а) Смола Сефароза 4-В на основе цианогенбромида вводится в колонку и происходит связывание RSP с этой смолой. Приготовление этой смолы, ввод ее в колонку и связывание с ней антигена (RSP) являются хорошо известными стандартными процедурами.
b) 1 мл сыворотки от бывшего ракового больного смешивается с 3 мл буферного раствора бората с рН 8,5, затем пропускается через колонку при комнатной температуре и атмосферном давлении. Любое rspAb в сыворотке реагирует и связывается с RSP антигеном в колонке. Несвязанные белки сыворотки вымываются из колонки солевым буферным раствором фосфата (RSP) с величиной рН 7,5. Промывка прекращается, когда достигается значение оптической плотности (О.Д.) 0,0 при 200 нм в спектрофотометре ультрафиолетового излучения.
с) Связанные rspAb элюируются из колонки 2-миллилитровыми аликвотами по 4,0 моль хлорида магния. Оптическая плотность каждой аликвоты элюэнта при 280 нм регистрируется на спектроометре, давая следующие результаты:
d) Пониженная концентрация белка (rspAb) показывает, что масса rspAb находится в первых четырех элюциях. Эти четыре элюции сливаются, вводятся в пробирку для диализа с фракцией с мол.м. 10000 и диализируются в течение первых 18 ч через 0,85%-ный хлорид натрия при 4оС и затем в течение последних 2,5 ч через PBS с величиной рН 7,5, для удаления избытка соли.
е) Полученный в результате объем (15 мл) диализированного материала выпаривается до 2,5 мл с центрифугированием в ячейке ультрафильтрации Амикон с использованием мембраны РМ-10.
f) Оптическая плотность (О.Д.) концентрата антитела сопоставляется со стандартной кривой для белка и, как установлено, она соответствует концентрации белка 0,1 мг/мл. Этот продукт представляет собой очищенный с применением метода сродства rspAb.
2. Испытательная система с анти-RSP антителом.
а) rspAb наносится на нитроцеллюлозную мембрану (1) на пластмассовом стержне, блокируется сывороткой и затем реагирует с 0,1 мл сыворотки от ракового больного в течение 10 мин. Мембрана высушивается путем отсоса. Затем она в течение 15 мин реагирует с системой обнаружения пробой тРНК, которая описывается далее более подробно. Протекающие поэтапно реакции следующие:
i. rspAb наносится на нитроцеллюлозную мембрану
= > ] - rspAb
ii. мембрана реагирует с сывороткой ракового больного, содержащей RSP:
==>] -rspAb - RSP
iii. RSP на мембране реагирует со смесью пробы тРНК
=>] rspAb - RSP - тРНК - формазан
Данные реакции приводят к образованию характерного серо-черного пятна формазана лишь там, где анти-RSP антисыворотка нанесена на мембрану. Этот пример показывает, что RSP захватывается из сыворотки ракового больного посредством rspAb, скрепленного с мембраной. Иллюстрируется также, что rspAb успешно заключается и в систему обнаружения злокачественности из аликвоты сыворотки ракового больного.
П р и м е р 2. Почти такой же результат, что иллюстрирован в примере 1, может быть получен с использованием поликлональных антител. Изложенное далее иллюстрирует типичную процедуру получения поликлональных антител от кроликов.
Продуцирование поликлонального анти-RSP антитела у кроликов.
Анти-RSP антитела получаются для дальнейшей разработки системы обнаружения рака, основанной на антителах, с использованием следующих процедур:
1. Процедуры очистки антигена (RSP)
а) Приготовление сырого экстракта RSP
IgG и RSP из 300 мл сыворотки от больного раком молочной железы осаждаются из данной сыворотки (ppt) путем смешивания с равным объемом насыщенного сульфата аммония.
b) Получение RSP ppt из сыворотки:
i. ppt растворяется в стандартном "буферном растворе" (50 мМоль трис-НСl, рН 7,5, 1 ммоль дитиотреитола, 20% (об/об) глицерина в 0,02% (мас./об) азида натрия).
ii. Компонент RSP/IgG снова осаждается из небольшого объема насыщенного сульфата аммония, ppt снова растворяется в стандартном буферном растворе и снова осаждается и еще раз снова растворяется.
iii. Растворенная смесь RSP/IgG диализируется через мембрану для диализа с фракцией 10000 MW с применением фосфатного буферного солевого раствора (рН 7,5) с 0,02% азида натрия при температуре 4оС в течение 18 ч.
с) Гель - фильтрация на биогеле А-0,5 М:
Деализированная смесь (10 мл) RSP концентрируется и фракционируется в колонке 4х8 см, заполненной смолой биогель 0-0,5 м. Смола кондиционируется стандартным буферным раствором до ее использования. Элюированные фракции подвергаются анализу с использованием системы пробы тРНК, описанной далее более подробно, с целью выявления какие фракции содержит компонент RSP.
d) Хроматография на гидроксилацатите.
Фракции, содержащие RSP, сливаются и затем диализируются с использованием 25 ммоль фосфата калия (рН 6,8), содержащего 1 ммоль дитиотреитола и 20% глицерина, в течение 18 ч при 4оС. Диализированная смесь затем концентрируется и фракционируется в колонке, заполненной 25 мл гидроксиланатита, предварительно кондиционированного тем же фосфатным буферным раствором. RSP элюируется 100 мл 100 - 150 ммоль фосфатного буферного раствора. Элюированные порции подвергаются анализу с использованием указанной системы пробы тРНК для выявления какая из порций содержит компонент RSP.
е) Хроматография на ДЕАЕ Аффи-геле синем.
Фракции, содержащие RSP сливаются и затем диализируются с использованием стандартного буферного раствора в течение 18 ч при 4оС. Диализированная RSP смесь затем концентрируется и фракционируется в колонке, заполненной 20 мл ДЕАЕ Аффи-геля синем со стандартным буферным раствором. Колонка промывается 50-ю мл стандартного буферного раствора, после чего RSP элюируется 100 - 130 мл градиента 0-0,6 моль хлорида калия. Активные фракции, которые определены анализом, основанным на РНК пробе, сливаются и диализируются с использованием стандартного буферного раствора в течение 18 ч при 4оС. Подвергнутый диализу RSP компонент концентрируется с одновременным центрифугированием в ячейке Амикон с мембраной РМ-10 до конечной концентрации белка 5 мг/мл, определяемой по оптической плотности (О.Д.) при 280 нм в спектрофотометре ультрафиолетового излучения.
f) Критерии частоты.
Очищенный RSP исследуется путем электрофореза на полиакриламидном геле в неденатурирующих условиях. В результате наблюдается характерная единичная полоса, соответствующая положению 600000-675000 mW.
2. Иммунизация кроликов.
а) Паликлональная RSP антисыворотка.
Антисыворотка специфическая для RSP приготавливается путем модификации способа Winberry и Holten, "Rat Liver Glucose-6-p Dehydrogenase Dietary Regulation of the Rate of syntesis", The journal of Biological Chemistry, т. 252, N 21, с.7796-7801 (1977 г.)
b) Процедура иммунизации.
i. Первичная иммунизация со 100 мкг иммуногена (RSP) в равных объемах (об/об) с полным адъювантом Френда. Многократные подкожные (SQ) инъекции.
ii. Трехнедельный интервал.
iii. Вторичная иммунизация 50-ю мкг иммуногена в равном объеме (об/об) с неполным адъювантом Френда.
iv. Интервал от 9 до 10 дней.
v. Анализируемая кровь или продуцируемая кровь в зависимости от концентрации rspAb в анализируемой партии сыворотки.
vi. Интервал 14-18 дней.
vii. Третья иммунизация с 50 мкг иммуногена в равном объеме (об/об) с неполным адъювантом Френда. Многократные подкожные инъекции.
viii. Интервал 9-11 дней.
ix. Продуцированная кровь.
с) Очистка и подготовка rspAb.
i. IgG отделяются от других иммуноглобулинов путем хроматографии средства на А/Сефарозе.
ii. Элюированные кислотой IgG нейтрализуются и фракции, имеющие О.Д. более чем 0,01 при 280 нм, сливаются и концентрируются с одновременным центрифугированием до примерно 1 мг белка на мл. в ячейке Амикон с мембраной РМ-10.
iii. Полученные в результате очищенные и концентрированные препараты rspAb хранятся при 5оС и предохраняются посредством 0,02 (вес/об) % азида натрия. Этот продукт может использоваться в системе обнаружения рака (RSP) согласно настоящему изобретению.
При практическом осуществлении способа данного изобретения rspAb могут скрепляться с любыми хорошо известными субстратами, такими как акриловые шарики, мембраны, латексные шарики, металлы (например, стальные шарики, коллоидное золото и т. д.), стеклянные поверхности, различные полимерные поверхности и т. д. , захватывая или фиксируя RSP из жидкостей организма человека или животного на поверхности. Примерами таких жидкостей организма являются сыворотка, моча, слезы, мокрота, слюна, сперма, жидкости молочной железы, а также промывки доступных участков, таких как легочная полость, шейка матки, толстая кишка или клеточные либо тканевые лизаты, или питательная среда и т.д. Захваченный RSP затем может быть обнаружен посредством любых общеизвестных систем обнаружения, таких как флюоресцентные маркеры, радиоизотопы, каталитические ферменты и био- или хемилюминесцетные системы анализа, или посредством проб, каких как пробы РНК или ДНК для обнаружения компонента нуклеиновой кислоты RSP, или посредством пробы тРНК, описанной в одновременной рассматриваемой патентной заявке. Например, rspAb может быть связан с любыми общеизвестными системами обнаружения с образованием пробы, желаемой для использования согласно изобретению. Так, он может быть связан с флюоресцентными маркерами, такими как флюоресцеин, родамин, техас красный, этилиденбромид, акридиновые красители, и т.д., и может регистрироваться посредством спектрофлуорометра, флуоресцентного микроскопа или спектрофотометра ультрафиолетового излучения. Кроме того, он может быть связан с любым из изотопов и может быть обнаружен посредством бета или гамма счетчика или методом ауторадиографии в зависимости от используемого изотопа и конфигурации системы анализа, анти-RSP антителе может быть также связано с биотином или фотобиотином, ввиду этого может быть связано с авидином, стрептавидином, экстравидином и т.д., и может быть связано с любым из ферментов, используемым в системах обнаружения стандартным ферментным иммуносорбентным анализом, таким как глюкооксидаза, щелочная фосфатаза, пероксидаза конской редьки и т.д. Эти связанные ферментом антитела могут использоваться с любой из систем усиления конечных цветовых точек, например с инициированными щелочной фосфатазой системами двойных непрерывных каталитических реакций с одновременным образованием формазана и индиго и т.д.
Пробы основаны на уникальном и специфическом средстве одного типа молекулы с другим типом. Примерами молекул, обычно используемых в качестве проб, являются следующие: сродство антиген: антитело, сродство гибридизированная РНК или ДНК : ДНК, сродство авидин : биотин и сродство белка А или белка G со специфическими иммуноглобулинами. Таким образом, захват RSP антителом rspAb является примером сродства антиген : антитело. Другим высоко специфическим молекулярным сродством является сродство рецепторной точки на молекуле фермента с его субстратом. Это сродство никогда не используется как проба, поскольку (1) субстрат очень часто является небольшой молекулой, которая сама по себе не способна к мечению маркером, (2) субстрат быстро превращается под действием фермента в продукт и (3) этот продукт быстро выделяется из молекулы фермента. Однако теперь определено, что может быть разработана проба для некоторых видов сродства фермент : субстрат, таких как с RSP, где указанные условия неприменимы. При отсутствии либо ионов магния, либо трифосфата аденозина (АТР) специфические рецепторные точки на ферментном компоненте RSP могут связывать специфические тРНК с их родственной аминокислотой или без нее, без образования выделяемого продукта. Связанная тРНК может быть мечена фотобиотином, который позволяет легко связывать тРНК со стрептавидином, коньюгированным щелочной фосфатазой. После того как проба избирательно связывается с родственной ее структурой синтетазы в RSP, ее присутствие может быть продемонстрировано путем проявления видимого цвета в результате реакции щелочная фосфатаза/субстрат. Примерами чувствительных процедур проявления цвета для данного фермента являются одновременное образование индиго и формазана.
Согласно способу изобретения присутствие RSP определяется путем отбора образца биологической жидкости от пациентов, подвергаемых исследованию. Однако в отличие от предыдущих способов, при обнаружении RSP не ставится вопрос, какой тип ракового заболевания предполагается у больного или какая биологическая жидкость используется. После отбора биологической жидкости RSP в этой жидкости захватывается на субстрате с использованием анти-RSP антитела, выбранного из одного или более моноклональных, поликлональных или очищенных по принципу сродства антител, как описано в примерах 1 и 2. Затем обнаруживается присутствие RSP на субстрате с использованием предпочтительно пробы тРНК, как описано далее. Согласно другому предпочтительному аспекту изобретения, RSP в биологической жидкости как захватывается на субстрате, так и обнаруживается с использованием пробы тРНК.
Как схематически иллюстрируется на фиг.1, проба тРНК включает тРНК, специфическую для активной точки аминоацил-тРНК синтазы на опухолевом маркере RSP. Желательно, чтобы тРНК была мечена для последующего обнаружения, как и с фотобиотином. Проба тРНК прикрепляется к активной точке аминоацил-тРНК на RSP. Обнаружение RSP посредством пробы тРНК облегчается путем связывания стрептавидина с меченой фотобиотином тРНК, и щелочной фосфатазы со стрептавидином. И, наконец, проявитель цвета, такой как реакционная смесь 5-бром-4-хлор-3-индолил фосфат/нитро синий тетразол, взаимодействует с щелочной фосфатазой на пробе тРНК с проявлением цвета, интенсивность которого взаимосвязана с количеством RSP, выделяемого раковыми клетками в биологической жидкости. В частности, проявление синего/фиолетового цвета в системе биотинстрептавидин-щелочная фосфатаза является показателем присутствия опухолевого маркера RSP, следовательно, злокачественности. Количественное определение основывается на интенсивности получаемого цвета. Так, по визуальному сопоставлению колориметрической интенсивности при выявлении различия между ничтожно малым и значительным продуцированием RSP, определено, что продуцирование RSP от ничтожно малого до небольшого количества, наблюдаемое в случае некоторых незлокачественных клеток, на несколько порядков величины меньше, чем продуцирование RSP, наблюдаемое в случае злокачественных клеток. Следует отметить, что проба rspAb может быть приготовлена точно таким же образом, как и проба тРНК, как описано в данной заявке, и может быть схематически иллюстрирована как на фиг.1, с той разницей, что компонент тРНК этой пробы заменяется компонентом rspAb.
Опухолевый маркер RSP предпочтительно захватывается из биологической жидкости, предпочтительно с использованием rspAb, и метится и связывается с соответствующими вторичными молекулами для последующего проявления видимого цвета путем реакции опухолевого маркера (согласно предпочтительному аспекту изобретения) с пробой тРНК-фотобиотин-стрептавидин-щелочная фосфатаза, как показано на фиг.1. Однако, согласно другому аспекту изобретения, проба тРНК используется вместе rspAb для захвата, а также для обнаружения RSP путем реакции опухолевого маркера с пробой тРНК-фотобиотин-стрептавидин-щелочная фосфатаза. Независимо от того, используется ли тРНК или rspAb для захвата RSP из биологической жидкости, проба тРНК является наиболее эффективной и используется предпочтительно для обнаружения присутствия RSP. Таким образом, при проведении слепого опыта, осуществляемого с использованием кровяной сыворотки от хорошо обследованных пациентов в клинических условиях, проба тРНК четко идентифицирует 71/73 раковых сывороток при чувствительности 97,3% и 63/62 нераковых сывороток при специфичности 85,5%.
Примером такого использования пробы тРНК для обнаружения RSP на субстрате является способ изобретения, в котором проба тРНК используется как для захвата, так и для обнаружения. Используя образец кровяной сыворотки, взятый от пациента, на котором проводятся исследования, аликвоту сыворотки помещают в подготовленную микротитровальную ячейку, которую покрывают, или которую предварительно обрабатывают по поверхности основания и/или стенки тРНК. За счет средства между тРНК и активными точками аминоацил-тРНК синтетазы на RSP, любой RSP в образце скрепляется с предварительно обработанными тРНК поверхностями ячейки. Эта ячейка несколько раз промывается водой или солевым буферным раствором фосфата (PBS), рН 7,4 для вымывания всего образца кровяной сыворотки ячейки. Проба тРНК, согласно изобретению, заключающая в себе связанные молекулы тРНК - фотобиотина - стрептавидина - щелочной фосфатазы, как показано на фиг.1, вводится в ячейку, в которой молекула тРНК реагирует с дополнительными активными точками аминоацил - тРНК - синтетазы на RSP и связывается с ними. Условия в этой ячейке непосредственно до и непосредственно после реакции между пробой тРНК и RSP иллюстрируются соответственно на фиг.2 и 3. На фиг.2 показаны маркеры RSP, связанные с тРНК, предварительно нанесенной на основание ячейки, и непрореагировавшие пробы тРНК согласно изобретению непосредственно до связывания с активными точками RSP. На фиг. 3 иллюстрируются маркеры RSP после реакции и показаны пробы тРНК, связанные с доступными активными точками на RSP. После скрепления проб тРНК с рецепторными точками RSP, ячейка снова промывается водой или PBS для вымывания непрореагировавшей пробы из ячейки. В этом месте она остается лишь для визуальной индикации количества RSP в ячейке. Это осуществляется в системе фотобиотин - стрептавидин - щелочная фосфатаза путем ввода реакционной смеси 5-бром-4-хлор-3-инделилфосфата (BCIP)/нитро синий тетразол (NBT) в ячейку. В зависимости от концентрации RSP в ячейке данная цветовая система будет давать окрашивание, наблюдаемое визуально, которое может быть оценено как диапазон в интервале от полного отсутствия окрашивания, когда не обнаруживается каких-либо количеств RSP, захваченных из биологической жидкости, до очень интенсивного синего/фиолетового окрашивания, когда происходит захват значительных количеств RSP. Количественная оценка интенсивности цвета может быть осуществлена с помощью спектрофотометра. Используя регулятор с цифровой шкалой, который ясно показывает интенсивности цвета, что означает присутствие злокачественности, можно довольно просто оценить результаты анализа обнаружения RSP.
П р и м е р 3. Осуществляется эксперимент, имеющий целью: (1) подтвердить, что частицы кольцевой формы содержат ферменты с динуклеотидной цепью, то есть содержат аминоацил-тРНК синтетазы, и (2) подтвердить, что субстрат, тРНК, избирательно связывается с указанной рецепторной точкой. Колонка средства для динуклеотидной молекулы в белках (те ферменты, которые связывают нуклеотиды как субстраты), содержащая аффигель синий (100-200 меш, Лаборатория биорадиации, Ричмонд, Калифорния) приготавливается согласно процедуре Thompson и др. (Procaedings of the National Academy of Science, США, 72; 669-672, 1975 г.). Питательная среда, кондиционированная ростом рС3, раковыми клетками предстательной железы человека и содержащая RSP, пропускается через колонку и элюируется солевым буферным раствором фосфата (PBS), рН 7,4. Двухмиллиметровые аликвоты элюированной жидкости анализируются на содержание в них белка с использованием метода Брэдфорда (Analytical Biochemystry 72, 248, 1976). После того как все типы белка без нуклеотидных молекул пропускаются через колонку, в эту колонку вводится 1 мг/мл (4х10-1 ммоль) тРНК. В последующих элюированных фракциях обнаруживается значительное увеличение содержания белка, указывая на то, что тРНК предпочтительно связывается с динуклеотидными молекулами в молекулах синтетазы и выводят RSP из колонны с аффигелем синим. Этот результат может быть получен, если не выполняются оба указанные условия (присутствует динуклеотидная молекула, которая показывает средство в тРНК).
П р и м е р 4. Осуществляется эксперимент с целью продемонстрировать, что тРНК, меченая фотобиотином и стрептавидином - щелочной фосфатазой, с использованием метода Миерендорфа (Pronega Notes, 1988 г.), будет связываться с RSP, нанесенным на основание микротитровальной ячейки, и может быть обнаружена по изменению цвета синий/фиолетовый в ячейке.
Микротитровальные ячейки Иммулен, покрытые по поверхности основания тРНК (см. фиг. 2), заполняются 100 мкл среды, кондиционированной раковыми клетками предстательной железы РСЗ, и осуществляется четырехкратное концентрирование в микроконцентраторе Амикон центрикон 30. Таким образом, происходит четырехкратное концентрирование RSP в среде. По прошествии 30 мин среда удаляется и ячейки десятикратно промываются буферным солевым раствором фосфата (PBS), рН 7,4. RSP в результате реакции с тРНК скрепляется с основанием ячейки. Десять микролитров меченой фотобиотином тРНК вводится в рабочие ячейки (ячейки обработки), и одновременно 10 мкл буферного раствора трис , рН 7,4, без тРНК вводится в отрицательные контрольные ячейки. По прошествии 30 мин выдержки при комнатной температуре ячейки пятикратно промываются PBS. На этом этапе тРНК скрепляется с активной точкой аминоацил-тРНК (см. фиг. 3), в то время как в ячейках, обработанных трис, но без тРНК, активная точка остается неотреагировавшей.
В ячейки вводится 25 мкл 0,1 мг/мл стрептавидина. После 30 мин выдержки при комнатной температуре ячейки 10-кратно промываются PBS. Стрептавидин связывается с фотобиотином на тРНК, не вымывается из ячеек без тРНК.
Во все ячейки вводится 25 мкл 0,1 мг/мл биотинилированной щелочной фосфатазы. После выдержки при комнатной температуре в течение 30 мин ячейки 10-кратно промываются PBS. На этом этапе молекулы биотина-щелочной фосфатазы связываются со стрептавидином на фотобиотинизированной тРНК, связанной с RSP на основании ячеек. Этот этап является завершающим этапом приготовления пробы (фиг.1). Щелочная фосфатаза вымывается из ячеек без тРНК.
И, наконец, 100 мкл реакционной смеси 5-бром-4-хлор-3-индолил-фосфат (BCIP)/нитро синий тетразол (NBT) вводится в каждую ячейку. Цвет проявляется через 45-60 мин. RSP, обработанный тРНК, проявляет сильный синий-фиолетовый цвет, в то время как отрицательная контрольная ячейка остается неокрашенной.
Данное исследование ясно продемонстрировало, что RSP имеет активную точку, специфическую для тРНК, и что проба тРНК связывается с RSP и точно идентифицирует его. Данная проба обеспечивает уникальный способ обнаружения злокачественностей у человека и животных.
Другой желательный способ обнаружения RSP заключается в использовании второго анти-RSP антитела (rspAb2), которое связывается со скрепленным RSP : rspAb, полученным в результате захвата RSP из жидкости организма посредством rspAb. Согласно данному способу обнаружения, приготавливается продукт в форме сэндвича субстрат (в твердом состоянии) - rspAb : RSP: : rspAb2, в котором используется антитело rspAb2 для склеивания или осаждения указанных молекул типа сэндвича. Осажденный продукт фильтруется через прозрачные поликарбонатные фильтры, и количество осажденного продукта измеряется путем сопоставления с шкалой стандартного цвета, проявляемого у образцов, содержащих RSP, или количественно определяется путем измерения дифференциальным отражающим спектрометром. Используемый твердофазный субстрат представляет собой окрашенные в черный цвет латексные шарики, которые образуют осадок черных тонов, интенсивность которых зависит от присутствия RSР в сыворотке.
Пример практического осуществления способа.
a) rspAb связываются с шариками карбоксилирированного черного латекса (0), например = 0 - rspAb.
b) 0 - rspAb реагирует с анализируемой сывороткой в пробирках микроцентрифуги в течение такого периода времени, после которого шарики удаляются из сыворотки. Эти шарики промываются несколько раз PBS(буферный солевой раствор фосфата) и центрифугируются с удалением их из PBS после каждой промывки.
В результате протекают реакции:
раковая сыворотка = 0 - rspAb : RSP
нераковая сыворотка = 0 - rspAb
с) Такие прореагировавшие шарики затем реагируют с rspAb2 в пробирках микроцентрифуги в течение такого периода времени, после которого шарики удаляются из реакционной смеси, и несвязанные молекулы вымываются, как описано в (b). В результате протекают реакции:
раковая сыворотка = 0 - rspAb : RSP - rspAb (осадок)
нераковая сыворотка = 0 - rspAb (нет осадка)
d) Осадок фильтруется через прозрачную поликарбонатную фильтровальную мембрану и осуществляются измерения. Неосажденные латексные шарики проходят через мембрану, а агрегаты осажденные латексные шарики - антитело : RSP : антитело не проходят. Таким образом, шарики могут быть отделены от осадка очень легко.
Хотя указанные способ и система используют окрашенные латексные шарики, следует иметь ввиду, что окрашенный осадок, флюоресцентный осадок или радиоактивный осадок также могут использоваться с осуществлением мечения rspAb2 соответствующими молекулами (например) любой интенсивно окрашено частицей, такой как формазан, углерод и т.д.; флуоресцентными молекулами, такими как родамин, техасовый красный, этиленбромид, флуоресцин и т.д. и изотопами, такими как 125I, 3Н, 14С и т.д. Согласно другому варианту данного способа и данной системы rspAb необязательно связывается с твердофазным субстратом и rspAb : RSP : rspAb2 или просто прореагировашие с rspAb : RSP молекулы могут осаждаться из сыворотки анти-rspAb антителом. Любые указанные индикаторные системы могут представлять собой любое из антител. Все другие операции: промывка, фильтрация и процедуры количественной оценки в основном такие же, как описано выше.
Хотя все биохимические свойства RSP не были описаны, следует иметь ввиду, что каждый из сегментов, который составляет RSP, имеет активность аминоацил-тРНК-азы для специфической комбинации тРНК : аминокислота. В связи с этим для приготовления пробы согласно изобретению может использоваться любая тРНК-аза или любая комбинация тРНК-азы. Кроме того, в пробе могут использоваться одинаковые или различные тРНК и одинаковые или различные обработанные тРНК поверхности реакционного сосуда. Данная проба может быть легче также приготовлена с использованием обычной системы обнаружения отличной от цветовой системы биотинстрептавидин-щелочная фосфатаза. Так например, тРНK может быть связана с флуоресцентными маркерами, такими как флуоресцеин, родамин, техасовый красный, этилиденбромид, акридиновые красители, и т.д., и может быть зарегистрирован посредством спектрофлуорометра, флуоресцентного микроскопа или спектрофотометра ультрафиолетового излучения. тРНК может быть связана также с любыми радиоактивными изотопами и может быть обнаружена бета или гамма счетчиком, или посредством ауторадиографии в зависимости от используемых изотопов. Кроме того, хотя описывается система, в которой проявление цвета происходит в жидкой фазе реакционного сосуда, которая является наиболее чувствительной, может быть также принята система обнаружения пробы RSP-тРНК для конфигураций твердых субстратов, таких как мембраны, стекло, различные полимерные поверхности, латексные шарики и кровяные клетки (в анализах со склеиванием), и металлы, такие как коллоидальное золото, или другие ферментные системы, такие как кислотная фосфатаза, пероксидаза конской редьки, глюкозооксидаза и системы на основе уреазы.
Промышленная применимость.
Способы и пробы согласно изобретению широко применимы для массовой проверки людей на ранее обнаружение рака, обеспечивая простую систему контроля раковых пациентов, подвергаемых лечению, и обеспечивают значительно усовершенствованный способ проверки на карцирогены окружающей среды и промышленных предприятий. По всей вероятности, наиболее важным является возможность использования данных способов для включения проб RSP в систему средств для анализа, что дает лечащему врачу быструю, чувствительную, надежную и недорогую систему для обнаружения RSP в жидкостях организма пациентов в ходе обычных физических исследований или при лечении раковых больных после курса облучения и химотерапии. Если результат анализа казалось бы здорового человека является положительным, то необходимо проведение повторного анализа. Если второй анализ подтверждает присутствие RSP, то должны быть проведены дополнительные анализы (например, методом ЯМР отображения) для обнаружения места и идентификации опухоли в организме. На этом этапе рекомендуется проведение курса лечения для удаления или разрушения злокачественных тканей, и RSP может служить как показатель успеха лечения.
Возможность однократного легкого при практическом использовании в условиях "ин витро" диагностического анализа на карцирогенную активность и осуществить точный контроль при лечении рака. Если принять в расчет, что имеются, по меньшей мере, пять миллионов людей с историей раковой болезни, которые должны проходить ежеквартальное обследование, и дополнительно несколько миллионов людей, вновь диагностируемых каждый год, то станет ясно, насколько необходим быстрый и эффективный диагностический анализ. Кроме того, возможность анализа биологической жидкости вместо используемого в настоящее время неудобно и очено часть затруднительного анализа мазка "Рар", позволит получить разрешение некоторых упорно сопротивляющихся женщин на анализ RSP по крайней мере ежегодно, что будет являться еще одним доказательством необходимости и полезности данного анализа.
Использование: медицина, для диагностики злокачественности. Сущность изобретения: способ, осуществляемый в условиях их витро, и проба для обнаружения присутствия частицы кольцевой формы (RSP), как опухолевого маркера, и для обнаружения присутствия злокачественности у людей и животных, заключается в захвате этого маркера из биологической жидкости, содержащей раковые клетки, на субстрате и обнаружении присутствия опухолевого маркера RSP на субстрате как индикатора присутствия злокачественности. Предпочтительный принцип данного способа включает использование анти RSP антитела (zs pAB), выбранного из одного или из нескольких моноклональных, поликлональных или очищенных по принципу сродства антител для захвата опухолевого маркера из образца биологической жидкости, такой как кровяная сыворотка, мокрота, моча, жидкости от спринцевания и т.д. Опухолевый маркер захватывается на субстрате посредством rs pAb, и его присутствие на субстрате обнаруживается посредством известных детектирующих систем, таких, как система проявления цвета. Опухолевый маркер в его предпочтительной форме обнаруживается на субстрате путем реакции с пробой РНК-фотобиотин-стрептавидин-щелочная фосфатаза. Другой предпочтительный способ включает использование транспортной рибонуклеиновой кислоты (РНК) как пробы, которая является специфической для активной точки транспортной РНК синтетазы аминоацила на данном маркере, и обнаружение присутствия RSP способом проявления цвета с использованием пробы РНК-фотобиотин-стрептавидин-щелочная фосфатаза. 3 с. и 10 з.п. ф-лы, 3 ил.
| Патент США N 3798131, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1994-12-30—Публикация
1990-09-10—Подача