Изобретение относится к соматическим мутациям в гене многофункционального опухолевого супрессора (MTS) в случае неоплазий человека и использованию этих мутаций для диагностики и прогнозирования указанных заболеваний. Изобретение также относится к мутациям гена MTS в зародышевой линии и использованию данных мутаций для диагностики предрасположенности к таким формам рака, как меланома, окулярная меланома, лейкоз, астроцитома, глиобластома, лимфома, глиома, лимфома Ходжкина, множественная миелома, саркома, миосаркома, холангиосаркома, чешуеклеточная карцинома, хронический лимфоидный лимфолейкоз (CLL), а также опухоли поджелудочной железы, молочной железы, мозга, простаты, мочевого пузыря, щитовидной железы, яичников, матки, семенников, почек, желудка, ободочной и прямой кишки. Изобретение также имеет отношение к терапии тех неоплазий человека, при которых произошла мутация в гене MTS, включая генотерапию, заменяющую белковую терапию и использование белковых миметиков. Наконец, изобретение относится к скринингу препаратов для терапии опухолей.
Публикации и другие материалы, использованные для описания уровня техники, и в особенности случаи из практики, включены в настоящую заявку в качестве ссылок, на них имеются указания в последующем тексте и соответственно к описанию изобретения приложен список публикаций.
Генетика рака сложна и включает в себя многочисленные доминантные, позитивные регуляторы трансформированного состояния (онкогены), так же как и многочисленные рецессивные, негативные регуляторы (гены-супрессоры опухолей). Охарактеризовано более ста онкогенов. Идентифицировано менее дюжины генов-супрессоров, но ожидается что их число превысит пятьдесят (Knudson, 1993).
Участие столь многих генов подчеркивает сложность механизмов контроля роста, функционирующих в клетке для поддержания целостности нормальной ткани. Эта сложность проявляется и другим образом. Так, показано, что ни один из онкогенов не участвует в развитии всех или хотя бы большинства неоплазий человека. Наиболее часто встречающимися онкогенными мутациями являются мутации гена H-ras, обнаруживаемые в 10-15% всех солидных опухолей (Anderson et аl., 1992). Наиболее часто мутирующим геном-супрессором опухолей является ген р53, мутации которого обнаруживаются приблизительно в 50% всех опухолей.
Без "мишени", общей для всех трансформированных клеток, мечта о "волшебной пуле", которая может разрушить или ревертировать раковые клетки, не повреждая нормальные ткани, остается беспочвенной. Надежда на новое поколение специфически "нацеленных" противоопухолевых препаратов может основываться на возможности идентификации генов-супрессоров опухолей и онкогенов, играющих ключевые роли в контроле клеточного деления.
На сегодня клонированы и охарактеризованы гены-супрессоры, которые определяют чувствительность к следующим видам неоплазий: 1) ретинобластоме (RB1); 2) опухоли Вилмса (WT1); 3) опухоли Ли-Фраумени (ТР53); 4) семейному аденоматозному полипозу (АРС); 5) нейрофиброматозу типа 1 (NF1); 6) нейрофиброматозу типа 2 (NF2); 7) синдрому фон Хиппель-Линдау (VHL) и 8) множественной эндокринной неоплазии типа 2A (MEN2A).
Локусы генов-супрессоров, которые были генетически картированы, но пока не выделены, включают гены, определяющие развитие следующих заболеваний: множественная эндокринная неоплазия типа 1 (MEN 1); синдром раковых семей Линча типа 2 (LCFS2); семейный рак молочной железы (BRCA1); нейробластома (NB); синдром невуса базальных клеток (BCNS); синдром Беквита-Вайдеманна (BWS); ренальная клеточная карцинома (RCC); бугорчатый склероз 1 (TSC1) и бугорчатый склероз 2 (TSC2).
Охарактеризованные на сегодня гены-супрессоры кодируют продукты, имеющие сходство с белками различных типов, включая ДНК- связывающие белки (WT1), вспомогательные регуляторы транскрипции (RB1), белки, активирующие ГТФазу (GAPs) (NF1), компоненты цитоскелета (NF2), связанные с мембраной рецепторные киназы (MEN2A) и другие продукты, не имеющие явного сходства с известными белками (APC и VHL).
Во многих случаях гены-супрессоры были первоначально идентифицированы благодаря генетическим исследованиям, обнаружившим их утрату или мутацию в некоторых спорадических опухолях.
Это дало основание считать, что области хромосомных аберраций могут указывать на расположение важных генов-супрессоров, задействованных как в предрасположенности к раку, так и в спорадических неоплазиях.
Одной из важных особенностей охарактеризованных на сегодня генов-супрессоров, является то, что они с высокой частотой делетированы в опухолях определенных типов. Делеция часто приводит к утрате одного аллеля (так называемая гетерозиготная утрата LOH), но встречается и гомозиготная делеция обоих аллелей. В случае LOH остающийся аллель нефункционален в силу предсуществующей наследуемой мутации или в результате вторичной случайной мутации.
Меланома является широко распространенной опухолью, от которой страдает один американец из ста (Американское противораковое общество, 1992). Факторы окружающей среды, такие как облучение ультрафиолетовым светом, вносят существенный вклад в частоту возникновения этой неоплазии, однако наследственные факторы также играют важную роль. На хромосоме 9р21 был картирован ген семейной меланомы (MLM) (Cannon- Albright et al., 1992; Nancarrow et al., 1993; Gruis et al. , 1993; Goldstein et al., 1994). Наличие единственного предрасполагающего аллеля в локусе MLM увеличивает вероятность возникновения меланомы у данного индивидуума приблизительно в 50 раз. MLM принадлежит к увеличивающемуся семейству генов, подозреваемых в качестве генов-супрессоров опухолей. Предрасположенность к меланоме наследуется как доминантный менделевский признак, хотя предрасполагающие мутации в локусе MLM, по-видимому, действуют как соматические рецессивные аллели как это впервые предположил Knudson (1971). У индивидуума, предрасположенного к меланоме и несущего один мутантный аллель MLM и один аллель MLM дикого типа, в делящихся клетках происходят вторичные мутации, приводящие к утрате или инактивации копии MLM дикого типа; при этом реализуется наследуемый мутантный аллель MLM.
Наоборот, единственная копия гена дикого типа предотвращает развитие неоплазии.
Хромосомные аберрации в непосредственной близости от MLM в 9р21 локусе были широко охарактеризованы для опухолей нескольких различных типов, включая глиомные клеточные линии, линии немелкоклеточного рака легких и линии острого лимфобластного лейкоза (Olopade et al., 1992; Olopade et al., 1993; Lukeis et al., 1990; Diaz et al., 1988; Middleton et al., 1991; Fountain et al., 1992; Cheng et al., 1993; James et al., 1993).
Таким образом, исходя из частоты хромосомных аномалий в локусе 9р21 в немеланомных опухолевых клетках, можно предположить, что область MLM содержит ген (или гены), участвующий по меньшей мере в прогрессии опухолей нескольких различных типов. В этих событиях задействована LOH, а также высокая частота гомозиготных делеций.
Клетки тканей имеют только три возможности своего существования - они могут расти и делиться, не делиться, но оставаться живыми, или же умереть через апоптоз. Опухоли возникают или в результате неприемлемого роста и деления клеток, или же при "отказе" клеток умирать, когда они должны это сделать.
Один из механизмов контроля опухолевого роста должен включать прямую регуляцию клеточного цикла. Например, гены, контролирующие инициацию репликации ДНК, являются возможными кандидатами в онкогены или гены-супрессоры опухолей, в зависимости от стимулирующей или ингибирующей роли в этом процессе. Продвижение эукариотических клеток по циклу (фазы G1, S, G2 и М) регулируется последовательным образованием, активацией и последующей инактивацией ряда циклин/циклин- зависимых киназных (Cdk) комплексов. Показано участие в этих процессах циклина D's/Cdk2,4,5, циклина E/Cdk2, циклина A/Cdk2 и циклина B/A/Cdk2. Циклины D's и Cdk2, Cdk4 и Cdk5 участвуют в переходе от G1 к S, то есть на том этапе, когда в клетке "принимается решение" о начале репликации ДНК. Недавно были обнаружены дополнительные элементы контроля клеточного цикла. Это ингибиторы Cdk (Cdk-ингибиторы, Cdl), к которым относятся Farl, р21, р40, р20 и р16 (Marx,1994; Nasmyth & Hunt, 1993).
Недавно было показано прямое участие в регуляции клеточного цикла нескольких онкогенов и генов-супрессоров. Например, один из циклинов (белков, ускоряющих репликацию ДНК) был идентифицирован как онкоген (Motokura et al., 1991; Lammie et al., 1991; Withers et al., 1991; Rosenberg et al., 1991), a опухолевый супрессор Rb взаимодействует с первичными циклин-связывающими партнерами, Cdks (Ewen et al., 1993). Идентификация локуса чувствительности к меланоме открывает путь для генетического скрининга пациентов в отношении того, например, насколько возрастает риск рака при облучении прямым солнечным светом. MTS может также предрасполагать к большому числу опухолей других локализаций, которые включают (но не ограничиваются указанными) лейкозы, астроцитому, глиобластому, лимфому, глиому, лимфому Ходжкина, множественную миелому, саркому, миосаркому, холангиосаркому, чешуеклеточную карциному, хронический лимфоидный лейкоз (CLL), а также опухоли поджелудочной железы, молочной железы, мозга, простаты, мочевого пузыря, щитовидной железы, яичника, матки, семенников, почки, желудка, ободочной и прямой кишки. Кроме того, поскольку MTS влияет на прогрессию опухолей нескольких различных типов, анализ MTS может быть полезен для определения прогноза для раковых больных. Так, MTS может служить основой для разработки очень важных диагностических тестов, позволяющих определить предрасположенность к таким формам неоплазий, как меланома, окулярная меланома, лейкоз, астроцитома, глиобластома, лимфома, глиома, лимфома Ходжкина, множественная миелома, саркома, миосаркома, холангиокарцинома, чешуеклеточная карцинома, хронический лимфоидный лейкоз (CLL), а также опухоли поджелудочной железы, молочной железы, мозга, простаты, мочевого пузыря, щитовидной железы, яичника, матки, семенников, почки, желудка, ободочной и прямой кишки, а также прогнозировать течение ракового заболевания. Кроме того, поскольку MTS участвует в прогрессии опухолей многих типов, можно предложить прямое или непрямое использование способности MTS к супрессии опухолевого роста для общей противоопухолевой терапии. Например, восстановление нормальной функции MTS в опухолевой клетке может превратить ее в неопухолевую.
Настоящее изобретение относится к соматическим мутациям в гене многофункционального опухолевого супрессора (MTS) в злокачественных новообразованиях человека и их использованию для диагностики и прогнозирования рака. Изобретение также относится к мутациям в гене MTS в зародышевой линии и их применению для выявления предрасположенности ко многим типам злокачественных опухолей, таким как меланома, окулярная меланома, лейкоз, астроцитома, глиобластома, лимфома, глиома, лимфома Ходжкина, множественная миелома, саркома, миосаркома, холангиокарцинома, чешуеклеточная карцинома, хронический лимфобластный лимфолейкоз (CLL) и опухоли поджелудочной железы, молочной железы, мозга, простаты, мочевого пузыря, щитовидной железы, яичника, матки, семенников, почки, желудка, ободочной и прямой кишки. Кроме того, изобретение относится к терапии злокачественных опухолей человека, для которых характерна мутация в гене MTS, в том числе генной терапии, замещающей белковой терапии и применению белков- миметиков. И наконец, изобретение относится к подбору лекарственных препаратов для лечения рака.
На Фиг. 1A показана родословная 3137. Во всех случаях меланомы выявлен чувствительный гаплотип. Кроме того, показаны случаи возникновения других злокачественных новообразований у индивидуумов, имеющих чувствительный гаплотип. Использованы следующие обозначения: закрашенные кружки и квадраты означают меланому; частично закрашенные кружки и квадраты означают другие злокачественные опухоли; / - означает смерть больного, * означает, что у индивидуума неизвестна чувствительность гаплотипа; ** означают, что, по-видимому, индивидуум имеет чувствительный гаплотип; возраст исследованных больных обозначен цифрами. Кроме того, указан установленный диагноз.
На Фиг. 1B показана родословная 3161. Во всех случаях меланомы выявлен чувствительный гаплотип. Для других злокачественных новообразований чувствительность гаплотипа не определялась. Использованы следующие обозначения: закрашенные кружки и квадраты означают меланому; частично закрашенные кружки и квадраты означают другие злокачественные опухоли; / означает смерть больного; = означает появление болезни в родословной; цифра "3" в пятиугольнике означает несколько браков; цифрами обозначен возраст больного. Кроме того, указан установленный диагноз.
На Фиг. 1C показана родословная 3355. Во всех случаях меланомы выявлен чувствительный гаплотип. Для других злокачественных новообразований чувствительность гаплотипа не определялась. Использованы следующие обозначения: закрашенные кружки и квадраты означают меланому; частично закрашенные кружки и квадраты означают другие злокачественные опухоли; / означает смерть больного. Кроме того, указан установленный диагноз.
На Фиг. 1D показана родословная 1771 с указанием случаев заболевания меланомой и другими злокачественными опухолями. При изучении этой родословной были идентифицированы мутации в MTS. Использованы следующие обозначения: * означает, что достоверно выявлен носитель мутации; закрашенные кружки и квадраты означают меланому; частично закрашенные кружки и квадраты означают другие злокачественные опухоли (в этой родословной - рак ободочной кишки); / означает смерть больного; цифрами обозначен возраст больного. Кроме того, указан установленный диагноз.
На Фиг. 2 показаны YAC (Yeast Artificial Chromosome) и P1-клоны в области, связанной IFNA-s и D9S171. Центромера находится справа. Для P1-клонов стрелки указывают направление к последовательности Т7-промотора в векторе. YACs, сгруппированные вместе, соответствуют клонам, которые сходным образом расположены относительно STSs области. Предположительно, эти YACs не идентичны. YACs A5, B11, C6 и F9 содержат IFN-1 и IFN-s. YACs D1, F5 и E3 содержат D9S126 и D9S171. Ни проксимальные концы YACs, содержащие D9S171, ни дистальные концы YACs, содержащие IFNA-s, не показаны. Расстояния приведены не в масштабе. Маркеры, внутренние по отношению к IFNA-s и D9S171, показаны на Фиг. 2. Маркеры, которые начинаются с "с", происходят из концевых последовательностей космид. Космиды не показаны. Расстояния между c1b и с5.3 и между 760-L и D9S171 неизвестны.
На Фиг.3 приведена диаграмма делеций, наблюдаемых в меланомных клеточных линиях. Делеции сгруппированы в 12 классов на основе набора маркеров, которые делетированы. Одиннадцать клеточных линий утратили все маркеры, показанные на Фиг.3. Этот класс не приведен. Количество делеций каждого из 12 других классов указано в колонке, обозначенной "#-линии". Расположение точек разрыва в результате делеций в классах 1-10 показано как приходящееся на маркер, прилегающий к делетированной ДНК; т.е. последний позитивный маркер в серии указывает на делецию. Для классов 11 и 12 сайты делеций обозначены закрашенными треугольниками.
На Фиг. 4A показана карта космиды c5. Релевантные STSs, использованные для делеционного анализа, одинаковы для космид и P1-клонов. C1.b-маркер находится проксимально по отношению к P1-1062 и не показан. Транскрипционные ориентации MTS1 и MTS2 отмечены стрелками.
На Фиг. 4B показана карта рестрикции и STS-карта космиды c5. Положения кодирующих экзонов для MTSI и MTS2 отмечены черными прямоугольниками. E1 и E2 обозначают кодирующий экзон 1 и кодирующий экзон 2. "B" обозначает BamHI, "S" - SalI, "R" - EcoRI и "R5" - EcoRV.
На Фиг.5A и 5B сравниваются геномная последовательность MTS1, содержащая 5'-нетранслируемую область, экзон 1 и часть интрона 1, и опубликованная последовательность pl6 (Serrano et al., 1993). Стартовый кодон (подчеркнут черной линией) находится в положении 891, а участок сплайсинга (отмечен стрелкой) находится в положении 1016. Последовательность MTS1, показанная на Фиг. 5A-B, представляет собой последовательность SEQ ID NO:3. Последовательность p16, показанная на Фиг.5B, представляет собой последовательность SEQ ID NO:24.
На Фиг.6A и 6B сравниваются геномная последовательность MTS1, содержащая экзон 2 и часть интрона 2, и опубликованная последовательность p16 (Serrano et al., 1993). Участки сплайсинга (отмечены стрелками) расположены до положения 192 и после положения 498. Последовательность MTS1, показанная на Фиг. 6A-B, представляет собой последовательность SEQ ID NO:4. Последовательность p16, показанная на Фиг.6A, идентична последовательности нуклеотидов 192-498 SEQ ID NO:4.
На Фиг.7A и 7B сравнивается геномная последовательность MTS2, содержащая часть интрона 1, "экзон 2" и промежуточные участки, и опубликованная последовательность p16. Последовательность "экзона 2" сходна с экзоном 2 MTS1 от нуклеотида 273 до 580. Сайт сплайсинга в MTS2 и p16 отмечены стрелками. Точка, в которой начинается расхождение, обозначена "о". Кодон терминации MTS2 расположен в экзоне 2 в положении 532 и обозначен "*". Последовательность MTS2, показанная на Фиг.7B, представляет собой последовательность SEQ ID NO: 5. Последовательность p16, показанная на Фиг. 7A, идентична последовательности нуклеотидов 192-498 SEQ ID NO:4.
На Фиг. 8 сравниваются последовательности ДНК MTSI и MTS2, включающие экзон 2 и часть каждого окружающего интрона. Положения 3'- сплайсингового соединения интрона 1 и 5'-сплайсингового соединения интрона 2 в MTS1 обозначены треугольниками. Точка расхождения около 3'-конца кодирующего экзона 2 отмечена стрелкой. Приведенная последовательность MTS1 соответствует последовательности нуклеотидов 92-548 SEQ ID NО:4. Приведенная последовательность MTS2 соответствует последовательности нуклеотидов 174-630 SEQ ID NO:5.
На Фиг.9 показаны делеции различных STS в опухолевых клеточных линиях. В каждую ПЦР включали позитивные и негативные контроли. Клеточные линии, в которых были делетированы только одна или две STS (например, класс 21) повторно тестировали по крайней мере дважды.
На Фиг. 10A-C показана экспрессия мРНК MTS2. На Фиг.10A отражен относительный уровень транскриптов MTS2 мРНК (Clonetech), полученной из различных тканей человека. Линия 1 - мозг; линия 2 - молочная железа; линия 3 - почки; линия 4 - легкие; линия 5 - лимфоциты; линия 6 - яичники; линия 7 - поджелудочная железа; линия 8 - предстательная железа; линия 9 - селезенка; линия 10 - желудок; линия 11 - тимус. Происхождение продуктов с иной, чем ожидаемая, молекулярной массой (см. линию 1) неизвестно.
На Фиг.10B отражен относительный уровень транскриптов MTS2 в лимфоцитах человека как функция времени после митогенной индукции. Линия 1 - 0 часов; линия 2 - 1 час; линия 3 - 2 часа; линия 4 - 4 часа; линия 5 - 8 часов; линия 6 - 16 часов; линия 7 - 24 часа; линия 8 - 32 часа; линия 9 - 40 часов; линия 10 - 48 часов; линия 11 - 56 часов; линия 12 - 64 часа. Большая часть клеток находится в S-фазе (40-50 часов после индукции).
На Фиг. 10C отражен уровень транскриптов MTS2 как функция Rb-статуса. Rb-позитивными клеточными линиями являются следующие: полоса 1 - KIT (Hori et al. , 1987); полоса 2 - диплоидные фибробласты человека MRC5, пассаж 28; полоса 3 - VWSCC2; полоса 4 - Bris- tol 8; полоса 7 - T24. RB- негативными клеточными линиями являются следующие: полоса 8 - MDA MB 468; полоса 9 - 5637; полоса 10 - C33A; полоса 11 - SiHa; полоса 12 - CaSki; полоса 13 - WERI.
На Фиг. 11 показана последовательность кДНК (и соответствующего полипептида) для 5'-нетранслируемого участка MTS2. Начало экзона 2 находится в положении 491 и отмечено стрелкой. Приведенная последовательность соответствует последовательности SEQ ID NO: 15, а аминокислотная последовательность - последовательности SEQ ID NO: 16.
На Фиг. 12A и 12B показана последовательность кДНК (и соответствующего полипептида) MTS1E1-бета. Сайты сплайсинга отмечены стрелками. Начало экзона 2 находится в положении 335, а экзон начинается в положении 642. Приведенная последовательность соответствует последовательности SEQ ID NO: 13, a аминокислотная последовательность - последовательности SEQ ID NO: 14.
На Фиг. 13 приведена физическая карта области p16. Положения экзона 1-альфа (E1-альфа), экзона 1-бета (E1-бета), экзона 2 (E2) и экзона 3 (E3) отмечены закрашенными прямоугольниками. Отмечена локализация сайтов рестрикции EcoRI (R1), EcoRV (RV) и Sa1 I (S). Выше рестрикционной карты показаны геномные космидные клоны c5 и P1 1063. Ниже рестрикционной карты показаны делеции в клеточных линиях A375 и SK-mel 93. Пунктирная линия соответствует делетированной ДНК.
На Фиг. 14 показаны совпадения между последовательностями транскриптов р16-бета человека и мыши. Заглавными буквами обозначены идентично нуклеотиды. Стоп-кодоны в рамке считывания p16 подчеркнуты. Сплайсинговое соединение между E1-бета и E2 отмечено знаком V. Приведенная бета-последовательность мыши соответствует последовательности SEQ ID NO:25. Приведенная бета- последовательность человека соответствует последовательности нуклеотидов 193-461 SEQ ID NO: 13.
На Фиг. 15 показана экспрессия альфа-транскрипта в клеточных линиях, которые содержат делеции E1- бета. кДНК получают при использовании тотальной РНК, выделенной из указанных образцов. В реакциях амплификации P16-транскриптов использовали радиоактивно-меченный праймер. Смешивали эквивалентные объемы для амплификации альфа и бета и разделяли продукты в денатурирующем 5%-ном полиакриламидном геле: полоса 1 - Т-клетки в состоянии покоя; полоса 2 - клеточная линия SK-mel 93; полоса 3 - клеточная линия A375.
На Фиг. 16 A-D показана экспрессия транскриптов P16. В реакциях амплификации P16-транскриптов использовали радиоактивно-меченный праймер и продукты разделяли в денатурирующем 5%-ном полиакриламидном геле.
Фиг. 16A и 16D иллюстрируют эксперимент, в котором до проведения гель-электрофореза реакционные смеси альфа и бета из одного образца смешивали между собой. На Фиг.16A показан относительный уровень P16-транскриптов во фракции РНК, полученной из различных тканей и клеток человека. Полоса 1 - мозг; полоса 2 - молочная железа; полоса 3 - почки; полоса 4 - легкие; полоса 5 - лимфоциты; полоса 6 - яичники; полоса 7 - поджелудочная железа; полоса 8 - предстательная железа; полоса 9 - селезенка; полоса 10 - желудок; полоса 11 - тимус. На Фиг. 16B показано относительное количество бета-транскрипта в лимфоцитах человека как функции времени после митогенной индукции: полоса 1 - 0 часов; полоса 2 - 1 час; полоса 3 - 2 часа; полоса 4 - 4 часа; полоса 5 - 8 часов; полоса 6 - 16 часов; полоса 7 - 24 часа; полоса 8 - 32 часа; полоса 9 - 40 часов; полоса 10 - 48 часов; полоса 11 - 56 часов; полоса 12 - 64 часа.
На Фиг.16C показано относительное количество альфа-транскрипта в лимфоцитах человека как функции времени после митогенной индукции: полосы означают то же, что и на Фиг. 16B, однако временная точка, соответствующая 1 часу, опущена. Анализировалась также экспрессия других молекул, для которых предполагается их влияние на ход клеточного цикла и образование которых регулируется на транскрипционном уровне во время клеточного цикла. В соответствии с предварительными результатами уровни CDK4 GoS2 (молекулы неизвестной функции, но транскрипция которых индуцируется при вхождении покоящихся Т-клеток в клеточный цикл) возрастали при индукции Т-клеток (Russell and Forsdyke, 1991; Matsushime et al., 1992; Geng and Weinberg, 1993). В противоположность этому уровни РНК p27, по-видимому, не изменялись во время осуществления эксперимента (Tiyshima and Hunter, 1994; Kota et al., 1994).
На Фиг. 16D показан уровень транскриптов P16 как функции Rb-статуса. Rb-негативные клеточные линии: полоса 1 - WERI; полоса 2 - CaSki; полоса 3 - SiHa; полоса 4 - C334; полоса 5 - 5637; полоса 6 - MDA MB 468. Rb - положительные клеточные линии: полоса 12 - диплоидные фибробласты человека MRC5, пассаж 28; полоса 13 - KIT (Hori et al., 1987).
На Фиг. 17 показана последовательность кДНК MTS1, включая некодирующие участки кДНК. Треугольниками обозначены сплайсинговые соединения. Разбивка в последовательности второго сплайсингового соединения только выделяет его и не означает пропущенных оснований. Приведенная последовательность соответствует последовательности SEQ ID NO:36.
Настоящее изобретение относится к соматическим мутациям гена многофункционального супрессора опухолей (MTS) при раковых заболеваниях человека и использованию этих мутаций для диагностики и прогнозирования раковых заболеваний. Изобретение также относится к зародышевым мутациям гена MTS и к их использованию для диагностики предрасположенности к различным формам рака, таким как меланома, окулярная меланома, лейкоз, астроцитома, глиобластома, лимфома, глиома, лимфома Ходжкина, множественная миелома, саркома, миосаркома, холангиокарцинома, чешуеклеточная карцинома легких, хронический лимфоидный лимфолейкоз (CLL), а также опухоли поджелудочной железы, молочной железы, мозга, простаты, мочевого пузыря, щитовидной железы, яичника, матки, семенников, почек, желудка, ободочной и прямой кишки. Изобретение относится к терапии злокачественных опухолей человека, для которых характерна мутация в гене MTS, в том числе генной терапии, замещающей белковой терапии и применению миметических белков. И наконец, изобретение относится к подбору лекарственных препаратов для лечения рака.
В настоящем изобретении заявлены выделенные полинуклеотиды, представляющие целый локус MTS или его часть или мутированный локус MTS, протяженностью не менее восьми оснований и не более 100 тысяч оснований. Подобные полинуклеотиды могут быть антисмысловыми полинуклеотидами. В настоящем изобретении заявлена также рекомбинантная конструкция, содержащая подобный полинуклеотид, например, рекомбинантная конструкция, применимая для экспрессии в трансформированных клетках.
Кроме того, в настоящем изобретении заявлены методы обнаружения полинуклеотида, представляющего часть локуса MTS, или продукт его экспрессии. Подобный метод может включать этап амплификации части локуса MTS, а также этап создания набора полинуклеотидов, являющихся праймерами для амплификации указанной части локуса MTS. Метод применим как для диагностики предрасположенности к раку, так и для диагностики и прогнозирования рака.
В настоящем изобретении заявлены также антитела, предпочтительно моноклональные антитела, которые специфически связываются с выделенным полипептидом, представляющим по меньшей мере пять аминокислотных остатков, кодируемых локусом MTS.
В настоящем изобретении заявлены наборы для обнаружения в пробах полинуклеотидов, представляющих часть локуса MTS. Эти наборы представляют собой полинуклеотиды, комплементарные части локуса MTS, упакованные в подходящий контейнер и снабженные инструкцией по применению.
В настоящем изобретении заявлены также методы получения полинуклеотидов, представляющих собой полимеризующиеся полинуклеотиды, которые образуют последовательность, состоящую по меньшей мере из восьми последовательных нуклеотидов локуса MTS; методы получения полипептида, представляющего собой полимеризующиеся аминокислоты, которые образуют последовательность, состоящую по меньшей мере из пяти аминокислот, кодируемых локусом MTS.
Кроме того, в настоящем изобретении заявлены методы скрининга лекарств для терапии опухолей с целью идентификации препаратов для восстановления функции продукта гена MTS.
Наконец, в настоящем изобретении изложена стратегия создания генных терапевтических подходов, направленных на раковые клетки. Подобные терапевтические агенты могут иметь вид полинуклеотидов, представляющих часть или полный локус MTS, помещенных в соответствующие векторы или доставленные в клетку-мишень другими, более прямыми методами, с целью восстановления функции белка MTS. Терапевтические агенты могут иметь также вид полипептидов, основанных на частичной или полной белковой последовательности MTS. Они могли бы функционально замещать активность MTS in vivo.
Окрытием настоящего изобретения является тот факт, что локус MTS (ранее обозначавшийся как меланомный локус, MLM), который предрасполагает индивидуума к меланоме и другим видам рака, является геном MTS1, который является ингибитором Cdk, в частности Cdk4. Этот ген обозначен MTS1. Окрытием настоящего изобретения является еще и тот факт, что локус MTS содержит вторую кодирующую последовательность, MTS2, которая весьма сходна с MTS1 в части последовательностей. Установлено также, что ген MTS1 имеет два отдельных промотора - альфа и бета. При использовании промотора альфа РНК состоит из экзона 1-альфа, экзона 2 и экзона 3. Она обозначена как MTS1. При использовании промотора бета образующаяся РНК состоит из экзона 1-бета, экзона 2 и экзона 3. Она обозначена как MTS1 El-бета. Открытием настоящего изобретения является тот факт, что мутации локуса MTS в зародышевой линии являются показателями для предрасположенности к меланоме и другим видам рака. Наконец показано, что соматические мутации в локусе MTS ассоциированы с большинством, если не со всеми, видами опухолей и, таким образом, являются общим индикатором рака и могут служить для прогнозирования рака. Мутационные события в локусе MTS могут включать делеции, инсерции и точечные мутации как в кодирующих, так и в некодирующих последовательностях.
Локус MLM был впервые генетически картирован при выявлении драматической связи между генетическими маркерами и предрасположенностью к меланоме в нескольких родословных в Юте и одной родословной в Техасе (Cannon-Albright, 1992). Область, определенная по рекомбинантам в родословных, фланкирована маркерами D9S736 и D9S171. Впоследствии эти и другие генетические маркеры были использованы для локализации гена путем анализа гомозиготных делеций в меланомных и немеланомных опухолевых клеточных линиях, содержащих делеции. Минимальная область перекрывания делеции была фланкирована маркерами IFNA-s и D9S171. Библиотеки YAC (Yeast atrificial chromosomes - искусственная хромосома дрожжей) были проскринированы с целью идентификации геномных клонов, окружающих эти маркеры. Клоны P1, выделенные в результате "прогулки по хромосоме", оказались непрерывными от IFNA-s до D9S171, за исключением двух пробелов.
Специфические STS (site-tagged sequences) получали для конструирования более подробной молекулярной карты. С использованием этих маркеров, а также делеционного анализа область перекрывания делеции была определена возле маркеров c5.1 и c5.3, обнаруженных в космиде c5. Наиболее часто делетированным оказался маркер c5.3, наиболее близкий к MTS.
Анализ маркера c5 на наличие "CpG "-островков показал, что он содержит по меньшей мере один "ген-кандидат" в MTS. Были определены последовательности ДНК EcoRI-фрагментов c5, которые сравнили с последовательностями из генного банка. Две различные области c5 оказались сходными с ранее идентифицированным геном, кодирующим ингибитор Cdk4 человека, или p16 (Serrano et al., 1993). Эти два гена-кандидата были обозначены как MTS1 и MTS2. Скрининг кДНКовых библиотек из лимфоцитов, эмбрионального мозга и нормальной молочной железы при помощи пробы из экзона 2 MTS1 привел к обнаружению дополнительного кандидата, названного MTS1E1-бета.
Подробное сравнение геномных последовательностей c5 с последовательностью мРНК p16 показало, что MTS1 содержит фрагмент в 307 пар нуклеотидов, идентичный части кодирующей последовательности p16. Этот фрагмент MTS1 был фланкирован узнаваемыми последовательностями сплайсинговых соединений. Дальнейшие исследования MTS1 показали, что он включает полную кодирующую последовательность p16 и еще два интрона. Интрон 1 был локализован на 126 пар оснований "ниже" сайта начала трансляции; интрон 2 был локализован на 11 пар оснований "выше" сайта окончания трансляции. Два интрона разделяют кодирующие последовательности p16 на три области, 5'-область в 126 пар оснований (кодирующий Экзон 1), среднюю область в 307 пар оснований (кодирующий Экзон 2) и 3'-область в 11 пар оснований (кодирующий Экзон 3).
MTS2 содержал область последовательностей ДНК, почти идентичную p16 в той части, которая простирается от 5'-конца кодирующего экзона 2 приблизительно на 200 пар нуклеотидов по направлению к интрону 2. Однако сходство последовательностей уменьшалось к точке 51 пара нуклеотидов "выше" Интрона 2 MTS1, в которой две последовательности дивергировали полностью. Это положение соответствует локализации последнего кодона MTS2. Сравнение последовательностей MTS1 и MTS2 показало, что сходство последовательностей этих двух генов также простирается на 50 пар нуклеотидов "выше" 3'-сплайсингового соединения интрона 1. Таким образом, фрагменты некодирующей ДНК оказались более консервативными, чем некоторые области предположительно кодирующей ДНК. Чтобы исключить возможность того, что дивергенция последовательностей является артефактом клонирования, были сконструированы ПЦР-праймеры для специфической амплификации последовательности в точке дивергенции MTS2. Эти праймеры амплифицировали фрагмент предсказанного размера из космиды P1 и геномной ДНК. Таким образом, дивергированная последовательность, расположенная "ниже" 3'-конца экзона 2 MTS2, является bona fide геномной последовательностью.
MTS1E1-бета содержит экзон 1, названный экзон 1-бета или E1-бета, который имеет последовательность, отличную от обнаруживаемой в экзоне 1 MTS1 и MTS2. MTS1E1-бета также содержит экзон 2 (E2) и экзон 3 (E3), которые идентичны экзонам 2 и 3 MTS1. Экзон 1-бета локализован "выше" экзона 1 MTS1 и не содержит какой-либо кодирующей последовательности. В результате MTS1E1-бета кодирует p10, для которого началом трансляции служит первый ATG-кодон экзона 2.
MTS1 и MTS2 исследовали на соответствие с генетической чувствительностью локуса MTS путем анализа геномной ДНК индивидуумов, предположительно несущих предрасполагающие MLM- аллели. Полиморфизмы ДНК были обнаружены в экзоне 2 MTS1 одного из восьми индивидуумов. Мутация представляла собой замену одного нуклеотида, что приводило к замене аминокислоты. Этот полиморфизм сегрегировал вместе в предрасполагающим MLM-аллелем.
Преобладание повреждений в MTS1 (делеции и замены нуклеотидов) указывает на то, что MTS1 или другой близко расположенный локус участвуют в формировании опухолевого фенотипа.
Клетки, имеющие подобные повреждения, получают селективное преимущество перед теми клетками, которые не имеют таковых.
Альтернативное объяснение, состоящее в том, что указанные повреждения являются случайными и не имеют отношения к росту клеток, представляется неубедительным по ряду причин. Во-первых, высокая корреляция между опухолевым фенотипом и мутациями MTS1 указывает на причинно-следственные отношения между мутациями MTS1 и образованием опухолей. Во-вторых, MTS1 определяет чувствительность к меланоме и потому действует независимо как ген-супрессор опухолей. В-третьих, биохимическая роль p16 как мощного ингибитора Cdk хорошо согласуется с моделью, согласно которой MTS1 действует in vivo как общий ингибитор начала репликации ДНК.
В соответствии с диагностическими и прогностическими методами настоящего изобретения обнаружены изменения в локусе MTS дикого типа. Кроме того, может быть использован метод для обнаружения локуса MTS дикого типа и подтверждения отсутствия предрасположенности к неоплазии и самой неоплазии. Термин "изменения гена дикого типа" подразумевает все формы мутаций, включая делеции, инсерции и точечные мутации в кодирующих и некодирующих областях. Делеции могут затрагивать ген целиком или его части. Точечные мутации могут приводить к образованию стоп-кодонов, сдвигам рамки считывания и замене аминокислот. К соматическим мутациям относятся те, которые обнаруживаются в какой-либо из тканей организма, например в опухолевой ткани, и не наследуются в зародышевой линии. Мутации в зародышевой линии могут быть обнаружены в любой ткани организма и наследуемы. Если соматически мутирован только один аллель, это указывает на раннее неопластическое состояние. Мутация обоих аллелей служит указанием на позднее неопластическое состояние. Таким образом, обнаружение мутаций MTS дает как диагностическую, так и прогностическую информацию. Неделетированный аллель MTS (т.е. обнаруживаемый на хромосоме, сестринской по отношению к хромосоме, несущей делецию MTS) может быть исследован в отношении других мутаций, таких как инсерции, малые делеции и точечные мутации. Считается, что многие мутации, обнаруживаемые в опухолевой ткани, приводят к снижению экспрессии продукта гена MTS. Однако мутации, приводящие к образованию нефункционального продукта, также могут приводить к неопластическому состоянию. Точечные мутационные события могут происходить в регуляторных областях, таких как промотор гена, что может приводить к утрате или снижению экспрессии мРНК. Точечные мутации могут также нарушить нормальный процессинг РНК, что скажется на экспрессии продукта гена MTS, может снизить эффективность трансляции и стабильность мРНК. Полезные диагностические методы включают (но не ограничиваются) флуоресцентную гибридизацию in situ (FISH), прямое секвенирование ДНК, анализ PFGE, блот-гибридизацию по Саузерну, "одноцепочечный" конформационный анализ, тест защиты от РНКазы, аллель-специфические олигонуклеотиды (ASO), дот-блот гибридизацию и PCR-SSCP, которые более подробно изложены ниже.
Предрасположенность к меланоме и другим описанным в данной заявке формам рака может быть подтверждена исследованием любой ткани человека в отношении мутаций гена MTS. Например, человек, который унаследовал мутацию гена MTS в зародышевой линии, может быть подвержен раковым заболеваниям. Этот факт может быть установлен путем анализа любой ткани организма. Наиболее простой способ - взятие крови с последующим выделением ДНК из клеток крови. Кроме того, может быть проведена пренатальная диагностика путем анализа на мутации гена MTS клеток плода, плацентарных клеток или клеток амниотической жидкости. Изменения аллеля MTS дикого типа, например, точечной мутацией или делецией может быть обнаружено любым из описанных здесь методов.
Для обнаружения изменений в гене MTS дикого типа из ткани необходимо выделить образец, свободный от окружающей нормальной ткани. Методы обогащения опухолевых клеток, выделенных из тканевых препаратов, хорошо известны. Например, образец ткани может быть взят из парафиновых или криостатных срезов. Раковые клетки могут быть отделены от нормальных проточной цитометрией. Эти методы и другие подходы к разделению опухолевых и нормальных клеток хорошо известны. Если опухолевая ткань в значительной степени контаминирована нормальными клетками, обнаружение мутаций затруднено.
Быстрый предварительный тест на полиморфизмы последовательностей ДНК может быть проведен при анализе набора Саузерн-блотов ДНК, рестрицированной одной или несколькими эндонуклеазами, предпочтительно многими эндонуклеазами. На каждом блоте должны быть представлены образцы от нормальных индивидуумов и образцы, взятые от раковых больных. Блоты, содержащие гибридизующиеся фрагменты, отличающиеся по длине от контрольных (при гибридизации с пробой, представляющей локус MTS), указывают на возможную мутацию. При использовании крупнощепящих рестриктаз, дающих очень большие рестрикционные фрагменты, используют пульс-электрофорез ("PFGE").
Обнаружение точечных мутаций может быть дополнено молекулярным клонированием аллеля (аллелей) MTS с применением хорошо известных методов. Альтернативно, последовательности гена могут быть амплифицированы "впрямую" из геномной ДНК, выделенной из опухолевой ткани. Затем может быть определена последовательность нуклеотидов амплифицированной ДНК.
Имеется шесть хорошо известных методов более сложного, но непрямого подтверждения присутствия чувствительного аллеля: 1) одноцепочечный конформационный анализ ("SSCA") (Orita et al., 1989); 2) электрофорез в денатурирующем градиентном геле ("DGGE") (Wartell et al., 1990; Sheffield et al., 1989); 3) тест защиты от РНКазы (Finkelstein et al., 1990; Kinszler et al., 1991); 4) аллель-специфические олигонуклеотиды ("ASOs") (Conner et al., 1983); 5) использование белков, узнающих нуклеотидные несовпадения, таких как mutS-белок E.coli (Modrich, 1991); и 6) аллель-специфическая полимеразная цепная реакция (ПЦР) (Rano & Kidd, 1989). Для аллель-специфической ПЦР используют праймеры, гибридизующиеся своим 3'-концом с точкой отдельной мутации MTS. Если этой отдельной мутации нет, то отсутствует продукт амплификации. Кроме того, может быть также использована амплификационная система рефракторных мутаций (Amplification Refractory Mutation System, ARMS), как это описано в публикации европейской патентной заявки N 0332435 и Newton et al. , 1989. Инсерции и делеции генов могут быть также обнаружены при помощи клонирования, секвенирования и амплификации. Кроме того, для обнаружения повреждений аллеля или инсерции в полиморфный фрагмент могут быть применены пробы полиформизма длины рестрикционных фрагментов (RFLP), специфичные относительно данного гена или окружающих маркерных генов. Этот метод особенно полезен при скрининге родственников больного на наличие мутаций MTS, обнаруживаемых у данного больного. Могут быть использованы другие известные методы обнаружения инсерций и делеций.
В случае применения первых трех методов (т.е. SSCA, DGGE и теста на защиту от РНКазы) появляется новая электрофоретическая полоса. SSCA обнаруживает полосу, которая мигрирует иначе, поскольку изменения в последовательности обусловливают изменения во внутримолекулярных соединениях оснований одноцепочечной ДНК. В ходе анализа методом защиты от РНКазы происходит разрезание мутантного полинуклеотида на два или более двух меньших по размерам фрагмента. DGGE показывает различия в скорости миграции мутантных последовательностей по сравнению с последовательностями дикого типа в денатурирующем градиентном геле. При использовании аллель-специфического нуклеотида конструируется олигонуклеотид, способный распознавать специфическую последовательность, а вывод о результатах анализа делается по наличию или отсутствию сигнала гибридизации.
В случае mutS-теста белок связывается только с последовательностью, которая имеет нуклеотидные несовпадения в гетеродуплексе между мутантными последовательностями и последовательностями дикого типа.
В настоящей заявке под "несовпадениями" подразумеваются сгибридизованные нуклеиновые дуплексы, в которых обе цепи комплементарны не на 100%. Отсутствие полной гомологии может быть обусловлено делециями, инсерциями, инверсиями или заменами. Обнаружение несовпадений может быть использовано для выявления точечных мутаций в гене или в его мРНК. Поскольку эти методы менее чувствительны, нежели секвенирование, их проще осуществлять с большим числом образцов опухолевого материала. Примером метода "разрезания несовпадений" служит метод защиты от РНКазы. В контексте настоящего изобретения данный метод подразумевает использование меченой рибопробы, которая комплементарна кодирующей последовательности гена MTS дикого типа человека. Рибопробу и мРНК или ДНК, выделенные из опухолевой ткани, "отжигают" (гибридизуют) вместе и затем переваривают ферментом РНКазой A, способной обнаруживать некоторые несовпадения в дуплексной структуре РНК. Если РНКаза A обнаруживает несовпадение, она производит разрезание в этом месте. Таким образом, при разделении электрофорезом сгибридизованного препарата РНК в случае обнаружения несовпадения и разрезания РНКазой A будет обнаружен продукт с длиной, меньшей, чем длина полного дуплекса РНК для рибопробы и мРНК или ДНК. Рибопроба не обязательно должна иметь полную длину мРНК MTS или представлять весь ген. Если рибопроба представляет только сегмент мРНК или гена, желательно использовать набор таких проб для скринирования на несовпадения всей последовательности мРНК.
Сходным образом могут быть применены ДНК-пробы для обнаружения несовпадений с использованием энзиматического или химического разрезания. Например, см. Cotton et al., 1988; Shenk et al., 1975; Novack et al., 1986. Альтернативно, несовпадения могут быть обнаружены по сдвигу электрофоретической подвижности "несовпадающих" дуплексов по сравнению с "совпадающими" дуплексами. Например, см. Cariello, 1988. Как в случае применения рибопроб, так и в случае применения ДНК-проб клеточные мРНК или ДНК, в которых подозревают наличие мутаций, могут быть амплифицированы ПЦР (см. ниже) перед гибридизацией. Изменения в ДНК гена MTS могут быть также обнаружены гибридизацией по Саузерну, особенно если эти изменения представляют собой большие перестройки, такие как делеции и инсерции.
Последовательности ДНК гена MTS, амплифицированные с помощью ПЦР, могут быть скринированы с применением аллель-специфических проб. Эти пробы представляют собой нуклеиновые олигомеры, каждый из которых содержит область гена MTS, несущую известную мутацию. Например, один из олигомеров может иметь 30 нуклеотидов в длину и соответствовать части последовательности MTS-гена. При использовании набора таких аллель-специфических проб продукты ПЦР можно скринировать на наличие ранее идентифицированных мутаций MTS-гена. Можно провести гибридизацию аллель-специфических проб с амплифицированными последовательностями MTS, например, на нейлоновых фильтрах. Гибридизация с определенной пробой в жестких условиях указывает на наличие в опухолевой ткани той же мутации, что и в аллель-специфической пробе.
Наиболее определенным тестом на наличие мутаций в подозрительном локусе является прямое сравнение геномных последовательностей MTS от раковых больных с аналогичными образцами из контрольной популяции. Наоборот, секвенирование мРНК после амплификации, например с помощью ПЦР, может исключить необходимость определять экзонную структуру гена-кандидата.
При исследовании некодирующих областей, таких как интроны, регуляторные последовательности, расположенные около или внутри гена MTS, у раковых больных могут быть обнаружены мутации, находящиеся вне кодирующей области MTS. Указания на то, что мутации в некодирующих областях могут оказаться важными, следуют из экспериментов с применением Нозерн-блоттинга, в которых у раковых больных обнаружены молекулы РНК аномального размера или избыточности, не встречающиеся у контрольных индивидуумов.
Нарушения экспрессии мРНК MTS может быть обнаружено любым известным методом. Эти методы включают Нозерн-блоттинг, амплификацию ПЦР и тест защиты от РНКазы. Сниженная экспрессия мРНК указывает на нарушения гена MTS дикого типа. Изменения генов MTS дикого типа можно обнаружить посредством тестирования нарушений в белке MTS дикого типа. Например, могут быть использованы моноклональные антитела, иммунореактивные по отношению к белку MTS. Отсутствие распознавания антигена указывает на мутацию MTS. Антитела, специфичные относительно продуктов мутантных аллелей, могут быть использованы для обнаружения продуктов мутантного MTS-гена. Указанные иммунологические тесты могут быть осуществлены любым приемлемым методом.
Эти методы включают Вестерн-блот, иммуногистохимические методы и ELISA. Любые подходы для обнаружения измененного белка MTS уместны для поиска изменений генов MTS дикого типа. Могут быть использованы такие функциональные подходы, как определение связывания белка. Например, известно, что белок MTS связывается с Cdk, в частности с Cdk4. Таким образом, можно использовать способность связываться с белком MTS дикого типа или с Cdk4. Кроме того, можно использовать тесты, основанные на биохимических свойствах MTS, на его способности ингибировать Cdk, такие как Cdk4, и влияние MTS на клеточный цикл обнаружения мутантного продукта гена MTS указывает на изменения MTS-гена дикого типа.
Мутантные гены MTS или продукты этого гена могут быть обнаружены в других биологических образцах, взятых у пациента, а именно в сыворотке, кале, моче и мокроте. Те же описанные выше методы обнаружения мутантных генов MTS или их продуктов в тканях могут быть применены в случае других биологических образцов. Раковые клетки слущиваются с опухоли и обнаруживаются в указанных биологических образцах. Кроме того, продукт гена MTS может секретироваться в межклеточное пространство и обнаруживаться в указанных биологических образцах даже в отсутствие раковых клеток. При скринировании указанных биологических образцов возможна простая и быстрая постановка диагноза при многих формах рака. Кроме того, по результатам анализа подобных биологических образцов на мутантные гены MTS или их продукты можно судить о результативности химио- и радиотерапии.
Описанные в настоящей заявке методы диагностики применимы к любым случаям неоплазий, для которых показано участие MTS в туморогенезе. Делеции хромосомного плеча 9p или соматические мутации в области MTS наблюдались почти во всех исследованных опухолях. Представленный в настоящем изобретении метод диагностики полезен для клиницистов и позволяет им выбрать соответствующий курс лечения.
Описанные в настоящем изобретении пары праймеров применимы для определения нуклеотидной последовательности конкретного аллеля MTS с помощью ПЦР. Пары одноцепочечных ДНК-праймеров могут быть сгибридизованы с последовательностями MTS-гена или последовательностями, окружающими его на хромосоме 9, для амплифицирующего синтеза собственно MTS-гена. Полный набор этих праймеров позволяет синтезировать все нуклеотиды кодирующих последовательностей MTS- гена, т.е. экзонов. Данный набор праймеров позволяет синтезировать как интронные, так и экзонные последовательности. Могут быть использованы и аллель-специфические праймеры. Такие праймеры гибридизуются только с конкретными мутантными аллелями MTS, и, таким образом, амплификация происходит только в том случае, если в качестве матрицы присутствует мутантный аллель.
Для облегчения последующего клонирования амплифицированных последовательностей праймеры могут нести на своих 5'-концах сайты рестрикции. Таким образом, все нуклеотиды праймеров являются производными от последовательностей MTS или прилегающих к этому гену последовательностей, за исключением нескольких нуклеотидов, необходимых для формирования сайтов рестрикции. Ферменты рестрикции и сайты их узнавания на ДНК широко известны. Сами праймеры могут быть синтезированы с помощью стандартных методов. Вообще, праймеры могут быть синтезированы с применением олигонуклеотидных синтезаторов, коммерчески доступных приборов. Последовательности скрытых рамок считывания MTS приведены в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO: 5, SEQ ID NO: 13, SEQ ID NO 15 и SEQ ID NO:36, конструкция конкретных праймеров вполне очевидна.
Описанные в настоящем изобретении нуклеотидные пробы могут иметь ряд применений. Их можно применять в гибридизации по Саузерну с геномной ДНК и в методе защиты от РНКазы для обнаружения точечных мутаций, как это обсуждалось выше. Эти пробы могут быть использованы для обнаружения продуктов амплификации ПЦР. Они также применимы для обнаружения несовпадений с геном MTS или с мРНК посредством других методов.
При описании настоящего изобретения использованы следующие определения. "Амплификация полинуклеотидов" подразумевает применение таких методов, как полимеразная цепная реакция (ПЦР, PCR), лигазная амплификация (или лигазная цепная реакция, ЛЦР, LCR), а также методы амплификации, основанные на использовании Q-бета репликазы. Эти методы хорошо известны и широко применяются на практике. Например, см. патенты США 4683195 и 4683202, а также Innis et al. , 1990 (ПЦР) и Wu et al., 1989а (ЛЦР). Реагенты и оборудование для проведения ПЦР коммерчески доступны. Праймеры, используемые для амплификации последовательностей MTS-области, предпочтительно комплементарны и, соответственно, специфически гибридизуются с последовательностями MTS-области или же с последовательностями, которые фланкируют MTS-область. Последовательности MTS, полученные в результате амплификации, могут быть непосредственным образом секвенированы. Менее предпочтительно, чтобы амплифицированные последовательности были клонированы перед секвенированием. Метод прямого клонирования и секвенирования энзиматически амплифицированных геномных фрагментов описан Scharf, 1986.
"Анализируемый полинуклеотид" и "Анализируемая цепь" обозначают одно- или двуцепочечный полинуклеотид, в котором ожидается наличие искомой последовательности и который может быть представлен в образцах различных типов, включая биологические образцы.
"Антитела". В настоящем изобретении описаны поликлональные и/или моноклональные антитела, или фрагменты таковых, или их эквиваленты в отношении иммунологического связывания, которые способны специфически взаимодействовать с полипептидами MTS, фрагментами таких полипептидов, или с полинуклеотидными последовательностями MTS- области, особенно из MTS-локуса, или же с фрагментами таких нуклеотидных последовательностей. Термин "антитело" применяется для обозначения как гомогенного вещества, так и для смеси, подобной сыворотке и содержащей множество различных гомогенных веществ. Полипептиды могут быть получены синтетическим путем с помощью пептидного синтезатора, конъюгированы с молекулами носителя (например, гемоцианином моллюска фиссуреллы) и в течение нескольких месяцев вводиться кроликам. Сыворотки кроликов проверяют на иммунореактивность по отношению к полипептиду MTS или его фрагментам. Моноклональные антитела могут быть получены иммунизацией мышей природными полипептидами, слитыми белками или фрагментами тех или других. Моноклональные антитела могут быть отобраны методом ELISA и проверены на специфическую иммунореактивность с полипептидом MTS или его фрагментами (CM. Harlow & Lane, 1988). Данные антитела могут быть использованы как для аналитических исследований, так и в качестве терапевтических препаратов.
При получении достаточных количеств желаемого полипептида он может быть использован для различных целей. Типичный пример использования - получение специфичных по связыванию антител. Эти антитела, моноклональные или поликлональные, могут быть получены in vivo или in vitro широко известными методами.
Для получения поликлональных антител выбирают соответствующую целевую иммунную систему, обычно мышь или кролика. По существу очищенный антиген вводится в иммунную систему методом, зависящим от вида животного и ряда других параметров, хорошо известных иммунологам. Обычные способы введения - внутримышечно, внутрибрюшинно, внутрикожно и в подушечки лап. Конечно, кроме мышей и кроликов могут быть использованы животные других видов. Поликлональные антитела очищают с применением известных методов, достигая желаемой специфичности.
Силу иммунологического ответа обычно проверяют при помощи иимунологического анализа. Обычно такой анализ подразумевает некоторую степень очистки источника антигена, например вещества, продуцируемого теми же клетками и тем же способом, что и исходный антиген. Многочисленные варианты иммунологического анализа широко известны. Например, см. Harlow & Lane, 1988 или Coding, 1986. При проведении стандартных процедур, например, описанных Harlow & Lane, 1988 и Coding, 1986, получают моноклональные антитела с аффинностью 10-8 на Моль или предпочтительно 10-9 на Моль, 10-10 на Моль или сильнее. Должны быть отобраны приемлемые животные и проведена соответствующая процедура иммунизации. По истечении соответствующего времени у иммунизированных животных вырезают селезенки и отдельные спленоциты сливают с иммортализованными клетками миеломы в соответствующих селективных условиях. Затем гибридные клетки клонируют и супернатанты отдельных клонов тестируют на наличие антител, специфичных по отношению к определенным эпитопам антигена.
К другим приемлемым методам относится экспозиция in vitro лимфоцитов с антигенными полипептидами или селекция библиотек антител в фагах или других сходных векторах. См. Huse et al., 1989. Представленные в настоящем изобретении полипептиды и антитела могут быть использованы как с модификацией, так и без нее. Часто полипептиды и антитела метят путем ковалентного или нековалентного присоединения вещества, дающего распознаваемый сигнал. Имеется широкое разнообразие методов мечения и конъюгирования, описанных как в научной, так и патентной литературе. К приемлемым меткам относятся радионуклиды, ферменты, субстраты, кофакторы, ингибиторы, флуоресцентные агенты, хемилюминесцентные агенты, магнитные частицы и др.
Среди патентов, посвященных применению подобных меток, можно отметить следующие патенты: США 3817837; 3850752; 3939350; 3996345; 4277437; 4275149 и 4366241. Могут быть получены также и рекомбинантные иммуноглобулины (см. патент США 4816567).
"Связывающий партнер" означает молекулу, способную связывать лиганд с высокой специфичностью. Примерами подобных агентов могут служить антиген и антигенспецифическое антитело или фермент и его ингибитор. В целом, специфические связывающие партнеры могут связываться с достаточной аффинностью с иммобилизованной копией аналита (комплементарной цепью дуплекса в случае полинуклеотидной гибридизации) в условиях изоляции. Такие специфически связывающиеся агенты известны специалистам в данной области техники; к ним относятся, например, биотин и авидин или стрептавидин, lgG и белок А, а также многочисленные хорошо известные пары типа "рецептор-лиганд" и комплементарные полинуклеотидные цепи. В случае комплементарного полинуклеотидного связывания партнеры обычно имеют в длину по крайней мере 15 килобаз, а могут быть длиной около 40 килобаз.
"Биологический образец" означает образец ткани или жидкости индивидуума, в котором ожидается обнаружение искомого полинуклеотида или полипептида. К такого рода образцам относятся (но не ограничиваются указанными), например, плазма, сыворотка, спинно-мозговая жидкость, лимфа, секреты и отделяемое кожи, дыхательных путей, кишечника, мочеполовых путей, а также слезы, слюна, клетки крови, образцы опухолей, различных органов, тканей и составляющих клеточных культур, полученных in vitro.
Используемое здесь понятие "диагностика" или "прогнозирование" применительно к неоплазиям, означает следующее: 1) классификацию повреждения как неоплазии; 2) установление тяжести неоплазии или 3) наблюдение за прогрессией заболевания до, в течение и после лечения.
Термин "кодирование" означает следующее. Полинуклеотид как природный, так и сконструированный с помощью хорошо известных специалистам методов считается кодирующим полипептид, если он транскрибируется с образованием матричной РНК (мРНК), которая затем транслируется с образованием полипептида или его фрагмента. Антисмысловая, цепь комплементарна указанной полинуклеотидной цепи и поэтому на ее основе может быть выведена последовательность кодирующей цепи.
Понятие "выделенный или по существу очищенный". Это понятие применяют по отношению к биологическому объекту, в частности нуклеиновой кислоте (РНК, ДНК, смешанному полимеру), в том случае, если он по существу отделен от других клеточных компонентов, которые естественным образом загрязняют нативную последовательность нуклеиновой кислоты человека или белок, в частности от рибосом, полимераз, многих других геномных последовательностей и белков. Указанное понятие относится к нуклеиновой кислоте или белку, которые выделены из природного микроокружения, в частности к изолятам рекомбинантной или клонированной ДНК и ее химически синтезированным аналогам или же аналогам, синтезированным биологическим путем в гетерологичных системах.
Понятие "MTS-аллель" относится к нормальным аллелям MTS- локуса, так же как и к аллелям, имеющим какие-либо изменения, которые обусловливают предрасположенность индивидуума к развитию злокачественной опухоли различной локализации, например к меланоме, окулярной меланоме, лейкозу, астроцитоме, глиобластоме, лимфоме, глиоме, лимфоме Ходжкина, множественной миеломе, саркоме, миосаркоме, холангиосаркоме, чешуеклеточной карциноме, хроническому лимфобластному лимфолейкозу (CLL), а также опухолям поджелудочной железы, молочной железы, мозга, предстательной железы, мочевого пузыря, щитовидной железы, яичников, матки, семенников, почек, желудка, ободочной и прямой кишки. Такие предрасполагающие аллели также называют "MTS- чувствительными аллелями".
Понятия "локус MTS"; "ген MTS", "нуклеиновая кислота MTS" и "полинуклеотид MTS" относятся к полинуклеотидам, все из которых расположены в MTS-области и с большой долей вероятности экспрессируются в нормальных тканях, причем некоторые аллели указанных полинуклеотидов обусловливают предрасположенность индивидуума к развитию меланомы и других злокачественных опухолей, например окулярной меланомы, лейкоза, астроцитомы, глиобластомы, лимфомы, глиомы, лимфомы Ходжкина, множественной миеломы, саркомы, миосаркомы, холангиосаркомы, чешуеклеточной карциномы, хроническому лимфобластному лимфолейкозу (CLL), а также опухолей поджелудочной железы, молочной железы, мозга, предстательной железы, мочевого пузыря, щитовидной железы, яичников, матки, семенников, почек, желудка, ободочной и прямой кишки. Понятие "MTS-локус" используется взаимозаменяемым образом с предложенным ранее термином "MLM-локус", и применение термина "MTS-локус" означает применение термина "MLM-локус" по отношению к локусу, гену, области и т.д. Мутации в MTS-локусе могут быть вовлечены в развитие и/или прогрессию других типов опухолей. Частично локус выявлен благодаря мутациям, обусловливающим предрасположенность индивидуума к развитию злокачественных опухолей.
Указанные мутации затрагивают MTS-область, описанную ниже.
MTS-локус включает кодирующие последовательности, промежуточные последовательности и регуляторные элементы, контролирующие транскрипцию и/или трансляцию. MTS-локус включает также аллельные варианты ДНК-последовательности.
Указанные термины, когда они относятся к нуклеиновой кислоте, означают нуклеиновую кислоту, которая кодирует MTS-полипептид (включая p16), его фрагмент, гомолог или вариант, в том числе, например, белки слияния или делетированные белки.
Нуклеиновые кислоты, описанные в настоящем изобретении, представляют собой последовательности, которые получены на основе природного MTS-гена, или существенным образом сходного с ним гена, или гена, имеющего с природным значительную гомологию, или же на основе фрагмента природного гена. Кодирующая последовательность для MTS-полипептида (MTS1) представляет собой SEQ ID NO: 1, аминокислотная последовательность MTS-полипептида MTS1) представляет собой
SEQ ID NO:2. Кодирующая последовательность для второго MTS-полипептида (MTS1E1-бета) представляет собой SEQ ID NO: 13, а соответствующая аминокислотная последовательность представляет собой SEQ ID NO:14. Кодирующая последовательность третьего MTS-полипептида (MTS2) представляет собой SEQ ID NO: 15, а соответствующая аминокислотная последовательность представляет собой SEQ ID NO: 16.
Понятие "p16" используется взаимозаменяемым образом с понятиями MTS1 и MTS1E1-бета и применяется для обозначения локуса MTS1, который кодирует p16, и локуса MTS1E1- бета, который кодирует p10. MTS1 и MTS1E1-бета - это две формы одного и того же гена, образование различных транскриптов зависит от используемого промотора. MTS2 представляет собой отдельный участок MTS-области и кодирует p15.
Полинуклеотидные соединения, описанные в настоящем изобретении, включают РНК, кДНК, геномную ДНК, синтетические молекулы, смешанные полимеры, смысловые и антисмысловые цепи, которые могут быть химически или биохимически модифицированы или могут содержать неприродные нуклеотиды, а также производные нуклеотидов. Перечисленные соединения могут быть легко получены специалистами в данной области исследований. К указанным модификациям относятся, например, мечение, метилирование, замещение одного или более природных нуклеотидов каким-либо аналогом, межнуклеотидные модификации, такие как незаряженные связи (например, метилфосфонатные, фосфотриэфирные, фосфоамидные, карбаматные и т. д. ), заряженные связи (например, фосфотиоатные, фосфодитиоатные и т.д.), дополнительные группы (например, полипептидные), интеркалирующие соединения (например, акридин, псорален и т.д.), хелаторы, алкилаторы, а также модифицированные связи (например, альфа-аномерические нуклеиновые кислоты и т.д.). Кроме того, к полинуклеотидным соединениям относятся синтетические молекулы, которые имитируют способность полинуклеотидов связываться с определенной последовательностью посредством водородных связей или других химических взаимодействий. Указанные молекулы известны на уровне техники и включают, например, такие соединения, в которых пептидные связи замещены фосфатными связями в остове молекулы.
Настоящее изобретение относится к рекомбинантным нуклеиновым кислотам, состоящим из целой области NTS или ее части.
Рекомбинантная конструкция может автономно реплицироваться в клетке-хозяине. Альтернативно, рекомбинантная конструкция может интегрировать в хромосомную ДНК клетки-хозяина. Такой рекомбинантный полинуклеотид представляет собой полинуклеотид геномного, кДНКового, полусинтетического или синтетического происхождения и в силу своего происхождения или метода получения 1) не ассоциирован со всем или частью полинуклеотида, с которым он связан в природе; 2) связан с полинуклеотидом, отличным от того, с которым он связан в природе; 3) не встречается в природе.
Таким образом, рекомбинантные нуклеиновые кислоты, заявленные в настоящем изобретении, представлены последовательностями, не встречающимися в природе. Несмотря на то что может быть использована последовательность дикого типа, чаще всего она будет изменена, например, путем делеции, замещения или инсерции.
кДНКовые или геномные библиотеки различного происхождения могут быть скринированы как природные источники нуклеиновых кислот, заявленных в настоящем изобретении, или такие нуклеиновые кислоты могут быть получены путем амплификации (например, посредством ПЦР) последовательностей, входящих в состав геномной ДНК или других природных источников. Выбор кДНКовых библиотек обычно соотносится с источником ткани, богатой мРНК заданных белков. Предпочтительно использование фаговых библиотек, однако могут быть использованы и другие библиотеки. Клоны соответствующей библиотеки высевают на чашки, переносят на субстрат для скрининга, денатурируют и тестируют на присутствие заданных последовательностей.
Последовательности ДНК, используемые согласно настоящему изобретению, обычно содержат около пяти кодонов (15 нуклеотидов), более вероятно около 7-15 кодонов и наиболее предпочтительно около 35 кодонов. Кроме того, в них могут находиться один или более интронов. Указанное количество нуклеотидов обычно обеспечивает минимальную длину, необходимую для того, чтобы служить в качестве пробы, которая будет специфически гибридизоваться с MTS-кодирующей последовательностью.
Методики работы с нуклеиновыми кислотами описаны, например, Sambrook et al., 1989 или Ausubel et al., 1992. Реагенты, используемые при осуществлении данных методик, например ферменты рестрикции и т.д., широко известны и коммерчески доступны. Например, их поставляют такие фирмы, как New England Biolabs, Boehringer Mannheim, Amersham, Promega Biotec, U.S.Biochemicals, New England Nuclear и другие. Рекомбинантные последовательности нуклеиновых кислот, используемые для получения белков слияния согласно настоящему изобретению, могут происходить из природных или синтетических последовательностей.
Многие природные генные последовательности получают из различных кДНКовых или геномных библиотек с помощью соответствующих проб. Более подробную информацию можно получить в Генном банке Национального Института здравоохранения США.
Понятие "MTS-область" относится к участку девятой хромосомы человека, содержащейся в P1-клонах P1-1062 и P1-1063. Указанные P1-клоны в составе E. coli NS 3529 депонированы в Американской коллекции клеточных культур, Роквилл, Мэриленд, США 16 марта 1994 г. и обозначены АТСС N 69589 и 69590 соответственно. Указанная область содержит MTS-локус, включая гены MTS1, MTS2 и MTS1E1-бета.
Используемые здесь понятия "MTS-локус", "MTS-аллель" и "MTS-область" относятся к двуцепочечной ДНК, содержащей локус, аллель или область, а также и к одноцепочечной ДНК, содержащей локус, аллель или область.
Используемое здесь понятие "часть" MTS-локуса или области, или аллеля обозначает участок минимального размера, длиной около восьми нуклеотидов, предпочтительно длиной около 15 нуклеотидов, более предпочтительно длиной около 25 нуклеотидов, а также это может быть участок, минимальный размер которого составляет по крайней мере около 40 нуклеотидов.
Понятие "MTS-белок" или "MTS-полипептид" относится к белку или полипептиду, который кодируется MTS-локусом (в том числе к MTS1-полипептиду, МТS2-полипептиду и MTS1E1-бета полипептиду), а также вариантам или фрагментам соответствующего белка или полипептида. Понятием "полипептид" обозначаются полимеры, состоящие из аминокислот и их эквиваленты, и не связано с длиной указанных соединений. Таким образом, пептиды, олигопептиды и белки охватываются понятием "полипептид". Данное понятие не относится к модифицированным полипептидам, например, гликозилированным, ацетилированным, фосфорилированным и т. д., однако относится к полипептидам, содержащим один или более аминокислотных аналогов (в том числе неприродных аминокислот и т.д.), полипептидам с замещенными связями, так же как и с другими известными модификациями природного и неприродного происхождения. Обычно такие полипептиды имеют по крайней мере 50% гомологии с нативной MTS-последовательностью, предпочтительно 90% гомологии и наиболее предпочтительно по крайней мере 95% гомологии. Кроме того, к указанным полипептидам относятся белки, кодируемые ДНК, которая гибридизуется с MTS-кодирующей последовательностью в мягких или жестких условиях гибридизации, а также близкородственные полипептиды или белки, распознаваемые сывороткой к MTS-белку (белкам).
Длина полипептидных последовательностей, сравниваемых по гомологии, в целом составляет по крайней мере около 16 аминокислот, обычно около 20 аминокислотных остатков, более часто около 24 остатков, наиболее вероятно около 28 остатков и предпочтительно более чем 35 остатков.
Понятие "функционально связанный" относится к определенному расположению компонентов, которые при этом соединены таким образом, что могут функционировать, как это задано целью эксперимента. Например, промотор функционально связан с кодирующей последовательностью, если он обеспечивает ее транскрипцию или экспрессию.
"Пробы". Этим термином обозначают полинуклеотидные полиморфизмы, ассоциированные с MTS-аллелями, которые обусловливают предрасположенность к различным злокачественным опухолям, или ассоциированные с большинством злокачественных опухолей, причем данные полинуклеотиды определяются в результате гибридизации с полинуклеотидной пробой, формирующей стабильный гибрид с последовательностью-мишенью в строгих и умеренных условиях гибридизации и при отмывании. Если предполагается, что пробы будут строго комплементарны последовательности-мишени, следует использовать жесткие условия гибридизации. Условия могут быть менее жесткими, если ожидается незначительная степень перекрывания, например, в случае вариантов, когда проба не будет полностью комплементарна мишени. Условия гибридизации выбирают таким образом, чтобы исключить поверхностное или неспецифическое связывание и свести к минимуму эффект фона. Поскольку в результате таких определений идентифицируют нейтральные ДНК-полиморфизмы, так же как и мутации, необходимы дополнительные исследования для подтверждения выявления MTS-чувствительного аллеля. Пробы для MTS-аллелей могут быть получены на основе последовательностей MTS-области или соответствующих кДНК. Пробы могут иметь любую подходящую длину, чтобы перекрыть целую MTS-область или ее часть и обеспечить специфическую гибридизацию с MTS-областью. Если последовательность-мишень содержит последовательность, идентичную пробе, то пробы могут быть короче, например в среднем около 8-10 пар нуклеотидов, так что гибрид будет относительно стабильным даже в жестких условиях гибридизации. Если при использовании пробы ожидается определенная степень несовпадения, например, если происходит гибридизация с вариантом области, то для гибридизации с последовательностью-мишенью может быть использована более длинная проба с заданной специфичностью.
Под пробой понимают выделенный полинуклеотид, соединенный с меткой или репортерной молекулой, который может быть использован для выделения других полинуклеотидных последовательностей, имеющих сходство, выявляемое стандартными методами. Методы получения и мечения проб описаны, например, Sambrook et al. , 1989 или Ausubel et al., 1992. Другие сходные полинуклеотиды могут быть отобраны с использованием гомологичных полинуклеотидов. Альтернативно, полинуклеотиды, кодирующие данные или сходные полипептиды, могут быть синтезированы или отобраны на основе избыточности генетического кода. Могут быть произведены различные замены кодонов, например, так называемые "молчащие" замены (с созданием различных сайтов рестрикции). Одной из целей подобных замен может явиться оптимизация экспрессии в конкретной системе. Для модификации свойств полипептидов могут быть введены мутации, в частности для изменения лиганд-связывающих аффинностей, междуцепочечных аффинностей или скоростей кругооборота и деградации полипептидов.
Пробы, представляющие собой синтетические олигонуклеотиды или другие полинуклеотиды, заявленные в настоящем изобретении, могут быть получены из природных или рекомбинантных одно- или двуцепочечных полинуклеотидов, или же химически синтезированы. Пробы могут быть помечены ник-трансляцией, при помощи Кленовских фрагментов или другими известными методами.
В качестве проб применимы участки нуклеотидных последовательностей, представляющие по меньшей мере восемь, предпочтительно 15 нуклеотидов, реже до 6 килобаз, обычно до 1 килобазы нуклеотидной последовательности, кодирующей MTS. Пробы также могут быть использованы для обнаружения в клетках и тканях РНК, кодируемой MTS.
Понятием "модификации и фрагменты" применительно к настоящему изобретению обозначают полипептиды или фрагменты MTS, которые по существу гомологичны первичной структурной последовательности, однако имеют (например, in vivo или in vitro) химические или биохимические изменения или же содержат нетипичные аминокислоты. К подобным изменениям, например, относятся ацетилирование, карбоксилирование, фосфорилирование, гликозилирование, убиквитирование, мечение, например, радионуклидами, а также различные модификации, полученные с помощью ферментов, что хорошо известно специалистам в данной области исследований. Различные способы мечения полипептидов, а также заместители и метки, используемые для этих целей известны из уровня техники. К ним относятся радиоактивные изотопы, такие как 32P, лиганды, которые связываются с мечеными антилигандами (например, антителами), флуорохромы, хемилюминесцентные агенты, ферменты, и антилиганды, способные служить специфическим связывающим партнером для меченого лиганда. Выбор метки зависит от требуемой чувствительности, легкости конъюгирования с праймером, необходимой стабильности и доступности оборудования. Методы мечения полипептидов известны специалистам. См., например, Sambrook et al., 1989 или Ausubel et al., 1992.
Помимо полипептидов полной длины, настоящее изобретение относится и к биологически активным фрагментам данных полипептидов. Существенными биологическими активностями являются способность к связыванию лигандов, иммунологическая активность и другие виды биологической активности MTS-полипептидов. Иммунологическая активность соединения означает, во-первых, что данное соединение обладает иммуногенными свойствами по отношению к иммунной системе и, во-вторых, наличие у него связывающих иммунологических эпитопов, что обеспечивает его функционирование в качестве конкурентного или замещающего антигена для эпитопа MTS-белка. Используемый здесь термин "эпитоп" означает антигенную детерминанту полипептида. Эпитоп может содержать три аминокислоты определенной пространственной конформации, которые уникальны для данного эпитопа. В целом эпитоп состоит по крайней мере из пяти аминокислот, более вероятно - из 8-10 аминокислот. Методы определения пространственной конформации такого рода аминокислот хорошо известны из уровня техники.
Для иммунологических целей в качестве иммуногенов могут использоваться тандемно-повторяющиеся полипептидные сегменты, обладающие высокой антигенностью. Альтернативно, такие полипептиды могут служить очень эффективными заместителями в реакциях специфического связывания. Получение антител, специфически взаимодействующих с MTS-полипептидами или их фрагментами, описано ниже.
Настоящее изобретение относится также к полипептидам слияния, содержащим MTS-полипептиды и их фрагменты. Гомологичные полипептиды могут располагаться между двумя или более MTS-полипептидными последовательностями или между MTS- последовательностями и родственным белком. Подобно этому могут быть получены гетерологичные слияния с ожидаемой комбинацией свойств или активностей тех белков, которые использовались для слияния. Например, связывающие лиганд или другие домены могут быть встроены между различными, вновь полученными полипептидами слияния или их фрагментами. Такого рода гомологичные или гетерологичные полипептиды слияния могут обладать, например, измененными силой или специфичностью связывания. Партнерами слияния могут служить иммуноглобулины, бактериальная бета-галактозидаза, trp E, белок А, бета-лактамаза, альфа-амилаза, алкогольдегидрогеназа и дрожжевой фактор спаривания. См., например, Godowski et al., 1988.
Белки слияния обычно получают методами рекомбинантных нуклеиновых кислот, как описано ниже, или путем химического синтеза. Методики синтеза полипептидов описаны, например, Merrifield, 1963.
Понятие "очистка белка" относится к различным методам выделения MTS-полипептидов из биологического материала, например из клеток, трансформированных рекомбинантными нуклеиновыми кислотами, кодирующими MTS. Указанные методы хорошо известны из уровня техники. Например, полипептиды могут быть очищены иммуноаффинной хроматографией, скажем, при использовании антител, полученных согласно настоящему изобретению. Различные методы очистки белков известны специалистам и описаны, например, Deutscher, 1990 и Scopes, 1982.
Понятия "выделенный", "по существу очищенный" и "по существу гомогенный" используются как взаимозаменяемые по отношению к белку или полипептиду, который отделен от компонентов, связанных с ним в природном материале. Мономерный белок считается по существу очищенным, когда по крайней мере около 60-70% образца представляет собой определенную полипептидную последовательность. По существу очищенный белок обычно составляет от 60 до 90% по весу в образце белка, предпочтительно 95%, а еще более предпочтительно около 99%.
Чистоту и гомогенность белка определяют многими хорошо известными способами, такими как электрофорез в полиакриламидном геле с последующим визуальным выявлением определенной полипептидной полосы после окрашивания геля. Для некоторых целей более высокая чистота может быть обеспечена жидкостной хроматографией высокого разрешения или другими методами очистки, известными специалистам.
MTS-белок по существу свободен от ассоциированных с ним в природном образце компонентов, когда он отделен от нативных примесей, содержащихся в природном образце. Таким образом, полипептид, химически синтезированный или синтезированный в клеточной системе, отличной от той, с которой он ассоциирован в природе, может быть по существу свободен от природных компонентов, ассоциированных с данным белком. Белок также может быть по существу очищен от ассоциированных с ним природных компонентов с помощью методов очистки белков, известных из уровня техники.
Полипептид, получаемый как продукт экспрессии выделенной генетической или сконструированной последовательности, обозначается используемым здесь термином "выделенный полипептид", даже если он экспрессируется в гомологичной клеточной системе. Полипептиды, полученные химическим путем, или экспрессированные в гетерологичной клеточной системе, по своей сущности представляют собой выделенные молекулы.
Понятие "рекомбинантная нуклеиновая кислота" означает нуклеиновую кислоту неприродного происхождения или молекулу, полученную искусственной комбинацией двух различных фрагментов. Такая искусственная комбинация часто осуществляется методами химического синтеза или путем манипуляций с выделенными фрагментами нуклеиновых кислот, например методами генной инженерии. Так, часто заменяют кодон вырожденным кодоном, кодирующим ту же самую аминокислоту или консервативную аминокислоту, создавая или удаляя при этом сайт узнавания. Напротив, при соединении фрагментов нуклеиновых кислот с определенными функциями можно получить желаемую комбинацию функций.
"Регуляторные последовательности" обозначают те последовательности, которые обычно расположены в пределах 10 килобаз от кодирующей области локуса и которые влияют на экспрессию гена (включая транскрипцию гена, а также трансляцию, сплайсинг, стабильность и другие характеристики матричной РНК).
"Гомология или сходство по существу". Нуклеиновая кислота или ее фрагмент "гомологична по существу" (или "сходна по существу") другой нуклеиновой кислоте, если при оптимальном расположении (с соответствующими инсерциями или делециями нуклеотидов) обнаруживает идентичность нуклеотидной последовательности не менее чем на протяжении 60% нуклеотидов, обычно не менее 70%, более часто не менее 80%, предпочтительно не менее 90% и еще более предпочтительно около 95-98% нуклеотидов.
Альтернативно, гомология (или сходство) по существу имеет место, когда нуклеиновая кислота или ее фрагмент гибридизуется с другой нуклеиновой кислотой (или с комплементарной цепью) в определенных гибридизационных условиях. При гибридизации имеет место избирательность. Обычно избирательность гибридизации наблюдается при 55%-ной гомологии фрагментов не менее 14 нуклеотидов длиной, лучше около 65%, предпочтительно не менее 75% и еще более предпочтительно не менее 90%. См. Kanehisha, 1984. При этом длина гомологичного сопоставления может быть значительной, в отдельных случаях она может превышать девять нуклеотидов, обычно не менее 20 нуклеотидов, чаще не менее 24 нуклеотидов, лучше 28 нуклеотидов, еще лучше 32 нуклеотида и совсем предпочтительно 36 или более нуклеотидов.
На гибридизацию нуклеиновых кислот влияют такие условия, как концентрация солей, температура, наличие органических растворителей, а кроме того, состав оснований, длина комплементарных фрагментов, число несовпадений нуклеотидных оснований между гибридизующимися нуклеиновыми кислотами. Все эти факторы хорошо известны специалистам. Под жесткими температурными условиями понимают температуру выше 30oC, обычно выше 37oC и предпочтительно выше 45oC. Под жесткими солевыми условиями понимают концентрацию солей менее 1000 мМ, обычно менее 500 мМ и предпочтительно менее 200 мМ. Однако комбинация параметров более важна, чем величина одного из них. См., например, Wetmur & Davidson, 1968.
При определенных условиях пробы могут также гибридизоваться с дуплексными ДНК с образованием триплексов или комплексов ДНК более высокого порядка. Получение таких проб и подходящие условия гибридизации известны из уровня техники.
Термины "гомология по существу" или "идентичность по существу" применительно к полипептидам указывают на то, что исследуемый полипептид или белок проявляет по меньшей мере 30%-ную идентичность с полным природным белком или его частью, обычно не менее 70%-ной идентичности и предпочтительно не менее 95%-ной идентичности.
"По существу сходная функция" относится к функции модифицированной нуклеиновой кислоты или модифицированного полипептида по сравнению с нуклеиновой кислотой MTS дикого типа или полипептидом MTS дикого типа. Модифицированный полипептид будет по существу гомологичен полипептиду MTS дикого типа и, соответственно, будет иметь по существу ту же самую функцию, т.е. будет ингибировать Cdk, в особенности Cdk4. Модифицированный полипептид может иметь измененную аминокислотную последовательность и/или может содержать модифицированные аминокислоты. Помимо функции ингибирования Cdk, модифицированный полипептид может обладать другими полезными свойствами, такими как более длительный срок полужизни. Cdk-ингибиторная активность модифицированного полипептида может быть по существу той же самой, что и у полипептида MTS дикого типа. Напротив, Cdk-ингибиторная активность модифицированного полипептида может быть выше, чем активность полипептида MTS дикого типа. Модифицированный полипептид синтезируют с использованием обычных методов, или же он может быть кодирован модифицированной нуклеиновой кислотой и получен обычными методами. Модифицированную нуклеиновую кислоту получают обычными методами. Нуклеиновая кислота с функцией, по существу сходной с функцией гена MTS дикого типа, может служить для получения описанного выше модифицированного белка.
Применительно к полипептидам гомологию обычно определяют с использованием программного обеспечения для анализа последовательностей. См., например, Sequence Analysis Software Package компании Genetics Computer Group, University of Wisconsin Biotechnology Center, 910 University Avenue, Madison, Wisconsin 53705. С помощью компьютерных программ для анализа белков проводят сравнение сходных последовательностей, измеряя степень гомологии с учетом различных замен, делеций и других модификаций. К консервативным заменам обычно относятся замены следующих групп: глицин, аланин, валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серии, треонин; лизин, аргинин; фенилаланин, тирозин.
Полипептидный "фрагмент", "участок" или "сегмент" - это ряд аминокислотных остатков, состоящий по меньшей мере из пяти - семи последовательных аминокислот, часто из семи - девяти последовательных аминокислот, обычно из девяти - 13 последовательных аминокислот и наиболее предпочтительно - из 20-30 или более последовательных аминокислот.
Полипептиды, заявленные в настоящем изобретении, если они растворимы, могут быть связаны с твердым субстратом, например нитроцеллюлозой, нейлоном, материалами для заполнения колонок (например, частицами сефарозы), магнитными бусами, стеклянной ватой, пластиком, металлом, полимерными гелями, клетками или другими субстратами. Такие подложки могут иметь, например, форму бус, лунок, палочек или мембран.
"Область-мишень" обозначает область нуклеиновой кислоты, которая должна быть амплифицирована и/или обнаружена. Термин "последовательность-мишень" обозначает последовательность, с которой проба или праймер образуют стабильный гибрид при определенных условиях.
При воплощении настоящего изобретения использованы, если это не оговорено специально, обычные методы химии, молекулярной биологии, микробиологии, генной инженерии, генетики и иммунологии. См., например, Maniatis et al., 1982; Sambrook et al. , 1989; Ausubel et al., 1992; Glover, 1985; Anand, 1992; Guthrie & Fink, 1991. Общее обсуждение материалов и методов для картирования хромосом человека, включая картирование хромосомы 9p, приведено, например, White & Lalouel, 1988.
Получение рекомбинантных или химически синтезированных кислот: векторы, трансформация, клетки-хозяева
Большие количества заявленных в настоящем изобретении полинуклеотидов могут быть получены путем репликации в соответствующей клетке-хозяине. Природные или синтетические полинуклеотиды, кодирующие желаемый фрагмент, должны быть встроены в рекомбинантные полинуклеотидные конструкции, обычно ДНК-конструкции, способные к введению и репликации в прокариотических или эукариотических клетках. Обычно, полинуклеотидные конструкции разрабатывают для репликации в одноклеточном хозяине, таком как дрожжи или бактерии, но могут быть получены конструкции, предназначенные для введения (с интеграцией или без интеграции с геномом клетки) в культивируемые клетки млекопитающих, растений или эукариотические клетки другого происхождения. Очистку нуклеиновых кислот, заявленных в настоящем изобретении, проводят по методам, описанным, например, Sambrook et al., 1989 или Ausubel et al., 1992.
Заявленные в настоящем изобретении полинуклеотиды могут быть получены химическим синтезом, например фосфорамидитовым методом, как описано Beaucage & Carruthers, 1981, или триэфирным методом, как описано Matteucci et al., 1981. Синтез может осуществляться на коммерческих автоматических синтезаторах олигонуклеотидов. Двуцепочечный фрагмент может быть получен на основе одноцепочечного продукта химического синтеза или путем синтеза комплементарной цепи с последующим совместным отжигом обеих цепей в соответствующих условиях, или же достройкой второй комплементарной цепи ДНК-полимеразой с использованием соответствующих праймерных последовательностей.
Полинуклеотидные конструкции, предназначенные для введения в прокариотические или эукариотические клетки-хозяева, должны содержать узнаваемую хозяином репликативную систему, включающую целевой полинуклеотидный фрагмент, кодирующий нужный полипептид, а также регуляторные последовательности для инициации транскрипции и трансляции, функционально связанные с кодирующими последовательностями. В состав векторов экспрессии могут включаться, например, сайты начала репликации или автономно реплицирующиеся последовательности (ARS); последовательности, контролирующие экспрессию, промотор, энхансер; сайты, необходимые для процессинга, такие как сайт связывания рибосом, сайты сплайсинга РНК, сайты полиаденилирования, терминаторы транскрипции и последовательности стабилизации мРНК.
При необходимости могут быть включены сигналы секреции, взятые от нативного белка MTS, других рецепторов или других секретируемых полипептидов того же или родственных видов. Данные сигналы позволяют белку проходить через клеточные мембраны и/или закрепляться в них, сохраняя функциональную топологию, или же секретироваться из клетки. Указанные векторы могут быть получены стандартными методами рекомбинации, описанными, например, Sambrook et al., 1989, или Ausubel et al., 1992.
Выбор соответствующего промотора и других важных последовательностей вектора определяется требованиями функциональности в данном хозяине, и при определенных условиях могут быть выбраны последовательности, ассоциированные с MTS-геном в природе. Примеры полезных комбинаций клеточных линий и векторов экспрессии приведены Sambrook et al., 1989 или Ausubel et al., 1992; см. также, например, Metzger et al., 1988. Многие удобные векторы можно получить от таких поставщиков, как Stratagene, New England Biolabs, Promega Biotech и других. В прокариотических клетках-хозяевах могут использоваться такие промоторы, как trp, lac, фаговые промоторы, промоторы тРНК и промоторы гликолитических ферментов. Удобные дрожжевые промоторы включают промоторы металлотионеина, 3-фосфоглицерат киназы или других гликолитических ферментов, таких как енолаза или глицеральдегид-3-фосфат дегидрогеназа, промоторы ферментов, ответственных за утилизацию мальтозы и галактозы. Векторы и промоторы, удобные для использования в дрожжах, описаны Hitzeman et al., ЕР 73675A. В число промоторов, приемлемых для экспрессии в клетках млекопитающих, входят ранний и поздний промотор вируса SV40 (Fiers et al., 1978), промоторы вируса лейкоза мышей Молони, вируса рака молочной железы мышей, вирусов саркомы птиц, аденовируса II, вируса бычьей папилломы или вируса полиомы. Кроме того, в состав конструкции может быть включен амплифицируемый ген (например, ген дегидрофолатредуктазы, DHFR), что позволяет получить множественные копии вводимого гена. Описание приемлемых энхансеров и других последовательностей, влияющих на экспрессию, см. также в Enhancers and Eukaryotic Gene Expression, Cold Spring Harbor Press, Cold Spring Harbor, New York (1983).
При том, что подобные векторы экспрессии могут реплицироваться автономно, можно достичь их репликации в интегрированном состоянии в геноме клетки-хозяина.
Векторы экспрессии и клонирования должны содержать селективный маркер-ген, кодирующий белок, необходимый для выживания и роста клетки-хозяина, трансформированной вектором. Наличие этого гена дает возможность выживать только тем клеткам, которые экспрессируют вставку. Обычно селективные гены кодируют белки, которые а) придают устойчивость к антибиотикам или другим токсическим веществам, например к ампициллину, неомицину, метотрексату и др. ; b) комплементируют ауксотрофные дефициты, или с) поставляют важные питательные компоненты, не содержащиеся в среде, например ген, кодирующий D-аланин рацемазу бацилл. Выбор соответствующего селективного маркера зависит от типа используемых клеток-хозяев; хорошо известны приемлемые маркеры для различных хозяев.
Векторы, которые содержат представляющую интерес нуклеиновую кислоту, могут быть транскрибированы in vitro, и полученная РНК введена в клетку одним из известных методов, например микроинъекцией (см. Kubo et al., 1988), или же векторы могут быть прямо введены в клетки при помощи методов, зависящих от типа клеток, например электропорацией, трансфекцией с применением хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ. Могут быть применены бомбардировка клеток микрочастицами, липофекция, инфицирование (когда вектор представляет собой инфекционный агент, например, ретровирус) и другие методы. см. Sambrook et аl., 1989 и Ausubel et al. , 1992. Введение полинуклеотидов в клетку-хозяина любым из известных методов, включая inter alia, рассматривается как "трансформация". Под клетками, в которые введены описанные выше нуклеиновые кислоты, подразумевается также и потомство указанных клеток.
Большие количества заявленных в настоящем изобретении нуклеиновых кислот и полипептидов могут быть получены путем экспрессии нуклеиновых кислот MTS или их фрагментов при помощи векторов в соответствующих прокариотических или эукариотических клетках. Наиболее часто используемыми прокариотическими клетками-хозяевами являются клетки различных штаммов Escherichia coli, хотя могут быть использованы и другие прокариоты, такие как Bacillus subtilis или Pseudomonas.
Для получения заявленных в настоящем изобретении белков могут использоваться клетки млекопитающих и клетки других эукариот, например дрожжей, нитчатых грибов, растений, насекомых, амфибий или птиц. Наращивание клеток млекопитающих в культуре per se хорошо известно. См. Jakoby and Pastan (eds. ), 1979. Примерами широко используемых клеточных линий млекопитающих могут служить клетки VERO, HeLa, CHO (клетки яичника китайского хомячка), W138, BHK и COS, хотя в отдельных случаях клетки других линий могут оказаться более приемлемыми, например, из-за более высокого уровня экспрессии, желаемого характера гликозилирования или в силу других особенностей.
Клоны отбирают с использованием маркеров, введенных в состав конструкции. Маркерный ген может находиться в той же молекуле ДНК, что и экспрессируемый ген, а может и на другой. Первый вариант предпочтительней. В случае прокариотического хозяина трансформанты можно отобрать, например, по устойчивости к ампициллину, тетрациклину или другим антибиотикам.
Удобным маркером может служить образование конкретного продукта только при определенной температуре (температурочувствительная экспрессия).
Прокариотические и эукариотические клетки, трансформированные заявленными в настоящем изобретении полинуклеотидами, могут служить не только для получения нуклеиновых кислот и полипептидов, но также, например, для изучения свойств полипептидов MTS.
Антисмысловые полинуклеотидные последовательности полезны для предотвращения или снижения экспрессии локуса MTS, что очевидно для опытного исследователя. Например, полинуклеотидные векторы, содержащие целый локус MTS или его часть, или же другие последовательности из области MTS (в частности, фланкирующие MTS локус) могут быть помещены под контроль промотора в антисмысловой ориентации и введены в клетку. Экспрессия такого антисмыслового конструкта в клетке будет интерферировать с транскрипцией, и/или трансляцией, и/или репликацией MTS.
Циклин и Cdks являются убиквитарными элементами контроля клеточного цикла у эукариот. Эти белки были первоначально обнаружены у дрожжей, затем найдены у морских беспозвоночных, амфибий и млекопитающих, включая мышь, кролика и человека. Гомологичные гены, отвечающие за контроль клеточного цикла, обнаружены и у животных других видов с применением проб и/или праймеров, основанных на последовательности гена, установленной для одного биологического вида. Так, пробы и праймеры, основанные на последовательностях гена MTS, описанных в настоящем изобретении, использованы для идентификации гомологичных последовательностей гена MTS и белков у других видов.
Указанные белки и последовательности гена MTS использованы для диагностики/прогнозирования, терапии и скрининга лекарств применительно к тому биологическому виду, из которого они были выделены.
Способы применения: диагностика с помощью нуклеиновых кислот и диагностические наборы
Для того чтобы установить наличие аллеля MTS, обусловливающего предрасположенность индивидуума к раку, биологический образец, например пробу крови, анализируют на наличие или отсутствие чувствительных аллелей MTS. Для установления факта наличия опухоли, определения прогрессии в злокачественности или получения прогностического индикатора анализируют биологический образец из места повреждения на наличие или отсутствие неопластических аллелей MTS. Результаты этих анализов и их интерпретация направляются врачу для последующего сообщения больному. Данная диагностика может осуществляться в диагностических лабораториях или же диагностические наборы могут продаваться врачам или даже больным для самодиагностики.
Исходно методы скрининга подразумевали амплификацию значимых MTS-последовательностей, т. е. использование ПЦР, с последующим секвенированием ДНК. Другое, более предпочтительное воплощение данного изобретения предусматривает использование для скрининга стратегии, исключающей использование ПЦР. Эти методы скрининга подразумевают хорошо известный подход двухэтапной амплификации с меткой. Обе стратегии, с использованием ПЦР и исключающая ее, дают возможность обнаруживать искомые последовательности с высокой чувствительностью.
Наиболее популярным на сегодня методом является целевая амплификация. В этом случае целевая последовательность нуклеиновой кислоты амплифицируется полимеразами. Самым предпочтительным методом полимеразной амплификации является полимеразная цепная реакция (ПЦР). Основанная на использовании ПЦР стратегия и ее применение в контексте настоящего изобретения приведены в Примере 1. ПЦР и другие полимеразные методы амплификации могут дать более чем миллионнократное обогащение числа копий в ходе циклов амплификации. После амплификации полученная нуклеиновая кислота может быть секвенирована или использована как субстрат для ДНК-проб.
При использовании ДНК-проб для обнаружения целевых последовательностей (например, при скрининге на чувствительность к опухолям) биологический образец, предназначенный для анализа, например проба крови, должен быть соответствующим образом обработан с целью выделения нуклеиновых кислот. Для облегчения обнаружения целевой последовательности нуклеиновые кислоты, выделенные из пробы, могут быть обработаны различными способами, например денатурированы, рестрицированы, фракционированы электрофорезом или подвергнуты дот-блоттингу. Целевая область в анализируемой нуклеиновой кислоте должна быть по меньшей мере частично одноцепочечной, чтобы образовать гибриды с последовательностью пробы. Если эта последовательность исходно одноцепочечная, то денатурации не требуется. Однако, если последовательность двуцепочечная, ее необходимо денатурировать. Денатурацию проводят одним из известных способов.
Анализируемую нуклеиновую кислоту и пробу инкубируют в условиях, способствующих образованию стабильного гибрида между целевой последовательностью пробы и искомой последовательностью в образце. Та область пробы, которая используется для связывания с анализируемой нуклеиновой кислотой, может быть сделана полностью комплементарной целевой области хромосомы человека 9p. Для предотвращения псевдоположительных результатов гибридизацию следует проводить в жестких условиях. Однако жесткие условия гибридизации необходимы только в том случае, если пробы комплементарны тем областям хромосомы, которые уникальны в геноме. Жесткость условий гибридизации определяется рядом факторов, влияющих на этапах гибридизации и последующих отмывок. К ним относятся температура, ионная сила, состав оснований, длина пробы и концентрация формамида. Эти факторы описаны, например, Maniatis et al., 1982 и Sambrook et al. , 1989. При определенных условиях для обнаружения целевой последовательности желательным может быть образование гибридов высшего порядка, таких как триплексы, квадруплексы и т.д.
Обычно обнаружение образовавшихся гибридов упрощается применением меченых проб. Наоборот, проба может быть немеченой, но выявляться посредством прямого или непрямого связывания с меченым лигандом. Приемлемые метки, а также методы мечения проб и лигандов хорошо известны и включают, например, радиоактивные метки, включаемые известными методами (например, ник-трансляцией, случайным праймированием или кинированием), биотин, флуоресцентные группы, хемилюминесцентные группы (например, диоксиэтаны, частично триггированные диоксиэтаны), ферменты, антитела и др. Вариации этих основных схем многообразны и направлены в основном на облегчение отделения искомых гибридов от окружающего материала и/или усиление сигнала меченого компонента. Ряд таких вариаций описан, например Mattews & Kricka, 1988; Landegren et al., 1988; Mittin, 1989:; US Patent 4868105 и в публикации EPO N 225807.
Как указывалось выше, в настоящее изобретение включена стратегия скрининга, исключающая использование ПЦР. Примерная процедура, проводимая без ПЦР, приведена в Примере 15. Согласно данному подходу, пробу нуклеиновой кислоты (или ее аналог, например, метилфосфонатный каркас, заменяющий нормальный фосфодиэфир) гибридизуют с целевой ДНК. К пробе может быть ковалентно присоединен фермент, так чтобы эта ковалентная связь не нарушала специфичности гибридизации. Затем комплекс "фермент-проба- конъюгат-целевая нуклеиновая кислота" отделяют от свободного конъюгата "проба-фермент" и добавляют субстрат для выявления фермента. Об энзиматической активности судят по развитию окраски или по регистрации люминесценции, что в тысячу - миллион раз увеличивает чувствительность. В качестве примера приготовления конъюгата "полигонуклеотидщелочная фосфатаза" и его применения в качестве гибридизационной пробы можно указать работу Jablonski et al., 1986.
Известна также методология двухэтапной амплификации с меткой. Этот метод основан на том, что малый лиганд (например, дигоксигенин, биотин или подобный им) конъюгируют с нуклеотидной пробой, способной специфически связываться с MTS. Примером пробы на MTS1 может служить нуклеотидная проба, соответствующая нуклеотидам с 448 по 498 последовательности SEQ ID NO:4. Аллель-специфические пробы также включены в данный пример и перекрывают предрасполагающие мутации, суммированные в Табл.3, и соматические мутации в опухолях, суммированные в Табл.5.
В одном случае малый лиганд, конъюгированный с нуклеотидной пробой, специфически распознается конъюгатом антитело-фермент. Например, нуклеотидная проба конъюгирована с дигоксигенином. Гибридизацию обнаруживают посредством конъюгата антитело-щелочная фосфатаза, который активирует хемилюминесцентный субстрат. Методы мечения нуклеиновых кислот, уместные в контексте данного изобретения, описаны Martin et al., 1990.
В другом случае малый лиганд распознают посредством второго конъюгата лиганд-фермент, который способен образовывать специфический комплекс с первым лигандом. Хорошо известным воплощением этого подхода служат взаимодействия типа биотин- авидин. Методы мечения нуклеиновых проб и их использование в тестах, основанных на применении биотин-авидина, описаны Rigby et al., 1977 и Nguyen et al., 1992.
В контекст настоящего изобретения включено использование смеси нуклеотидных проб, способных обнаруживать гены MTS. Так, в одном из примеров для обнаружения MTS1 в клеточном образце использовали более чем одну пробу, комплементарную MTS1, в частности 2, 3 или 5 различных нуклеотидных проб. В другом примере для обнаружения мутаций в последовательностях гена MTS1 у больного использовали более чем одну комплементарную MTS1 пробу, в частности смесь проб, способных связываться с аллель-специфическими мутациями, идентифицированными в популяции больных с нарушениями MTS1. При этом подходе может быть использовано любое число проб, которые предпочтительно должны состоять из проб, соответствующих главным генным мутациям, предрасполагающим индивидуума к раку молочной железы. Некоторые возможные пробы, заявленные в настоящем изобретении, имеют аллель-специфические мутации, приведенные в Табл. 3 и Табл.5.
Способы применения: пептидная диагностика и диагностические наборы
Неопластические состояния можно диагностировать, исходя из изменений полипептида MTS дикого типа. Подобные изменения можно обнаружить секвенированием с применением стандартных методов. Предпочтительно использовать антитела (поликлональные или моноклональные) для обнаружения отличий (или их отсутствия) в MTS-пептидах. В предпочтительном воплощении данного изобретения антителами иммунопреципитируют белки MTS из раствора, или же эти антитела реагируют с MTS- белком на Вестерн- или иммуноблотах полиакриамидных гелей. В другом воплощении антитела распознают MTS-белок в парафиновых или замороженных срезах тканей при постановке иммуноцитохимических методов. Методы получения и очистки антител широко известны и любой из этих методов может быть выбран для достижения целей настоящего изобретения. Для обнаружения пептидов MTS и мутаций данных пептидов могут применяться фермент-связанный иммуносорбентный метод (ELISA), радиоиммунологический метод (RIA), иммунорадиометрический метод (IRMA) и иммуноэнзиматический метод (lEMA), включая сэндвич-метод с применением моноклональных и/или поликлональных антител. Примеры сэндвич-метода описаны David et al., в US Patent N.N. 43761100 и 4486530, включенных в качестве ссылок и приведенных в Примере 18.
Способы применения: скрининг соединений
Настоящее изобретение применимо для скрининга соединений с использованием полипептидов Cdk или их связывающихся фрагментов в любой из многообразных процедур скрининга препаратов.
Предпочтительно использовать Cdk4. Пептид Cdk или его фрагмент, используемые в данном тесте, могут быть в виде раствора, фиксироваться на твердом субстрате или находиться на клеточной поверхности. В одном из методов скрининга веществ, основанном на конкурентном связывании, используют эукариотические или прокариотические клетки-хозяева, стабильно трансформированные рекомбинантными полинуклеотидами и экспрессирующие полипептид или его фрагменты. Эти клетки в живом или фиксированном состоянии могут быть использованы в стандартных экспериментах по связыванию. Можно определить, например, образование комплексов между полипептидом Cdk или его фрагментом с анализируемым агентом, или определить в какой степени анализируемый агент влияет на образование комплекса между полипептидом Cdk (или его фрагментом) и полипептидом MTS (или его фрагментом).
Таким образом, в настоящем изобретении представлены методы скрининга препаратов, основанные на связывании тестируемого препарата с полипептидом Cdk и позволяющие определять: 1) наличие комплекса между тестируемым агентом и полипептидом Cdk или его фрагментом, или 2) наличие комплекса между полипептидом Cdk или его фрагментом и лигандом.
Измеряют также активность Cdk для установления способности тестируемого агента ингибировать Cdk и, соответственно, регулировать клеточный цикл. В таких конкурентных тестах полипептид Cdk или его фрагмент обычно метят. Свободный полипептид Cdk или его фрагмент отделяют от связанного в белок/белковом комплексе, и количество свободной (т.е. несвязанной) метки является показателем связывания тестируемого агента с Cdk или же показателем интерференции первого со связыванием Cdk:MTS. Небольшие участки полипептида MTS (пептиды -миметики) анализируют этим методом для идентификации тех пептидов, которые обладают ингибиторной активностью в отношении Cdk.
Другой высокопроизводительный метод скрининга соединений, обладающих аффинностью в отношении полипептидов Cdk, описан Гейзеном (Geysen, European Patent Application N 84/03664, опубликована 13 сентября 1984 г.). Кратко, большое число различных пептидов, которые должны быть проверены, синтезируют на твердом субстрате, например пластиковых палочках или какой-либо другой поверхности. Этим пептидам дают прореагировать с полипептидом Cdk и отмывают. Связанный полипептид Cdk затем выявляют известными методами.
Очищенный Cdk может быть нанесен на планшеты для использования в упомянутых выше методах скрининга лекарств. Однако можно использовать не-нейтрализующие антитела к полипептиду для иммобилизации Cdk на твердой фазе.
В настоящем изобретении заявлено также использование конкурентных тестов скрининга, в которых нейтрализующие антитела, способные специфически связывать полипептид Cdk, конкурируют с тестируемым соединением за связывание с полипептидом Cdk или его фрагментом. Таким образом, антитела используют для обнаружения любого пептида, имеющего одну или более общих антигенных детерминант с полипептидом Cdk.
Другие методы скрининга препаратов подразумевают использование линий эукариотических клеток или клеток (подобных описанным выше), имеющих нефункциональный ген MTS. Подобные клеточные линии или клетки дефектны в отношении контроля клеточного цикла на уровне Cdk. Такие клетки выращивают в присутствии тестируемого вещества. Определяют скорость роста клеток и на основе этих данных делают вывод о способности тестируемого вещества регулировать клеточный цикл. Один из способов определения скорости роста состоит в определении биологической активности отдельных Cdk, предпочтительно Cdk4.
Способы применения: рациональный дизайн лекарств
Целью рационального дизайна лекарств является создание структурных аналогов биологически активных полипептидов или малых молекул, с которыми они взаимодействуют (например, агонистов, антагонистов, ингибиторов) для получения препаратов, которые, например, представляют собой более активные или стабильные формы полипептидов, которые усиливают или же подавляют функцию полипептида in vivo. См., например, Hodgson, 1991.
При одном из подходов, сначала определяют трехмерную структуру представляющего интерес полипептида (например, p16 или Cdk4) или же комплекса Cdk4-pl6 при помощи рентгеновской кристаллографии, компьютерного моделирования или, чаще, сочетанием этих методов. Реже полезная информация относительно структуры полипептида может быть получена при моделировании структуры гомологичных белков. Примером рационального дизайна лекарств может служить разработка ингибиторов протеазы вируса иммунодефицита человека (HIV) (Erickson et al., 1990). Кроме того, пептиды могут быть анализированы в аланиновом тесте (Wells, 1991). Согласно данному методу остаток аминокислоты заменяют на Ala и определяют эффект такой замены на активность пептида. Таким образом анализируют каждую аминокислоту пептида для определения его важных областей.
Возможно также получение мишень-специфических антител, отобранных в функциональном тесте, с последующим определением их кристаллической структуры. В принципе, этот подход может дать основную информацию для рационального дизайна лекарств.
Кристаллографии белков можно избежать получением анти-идиотипических антител к функциональным, фармакологически активным антителам. Как двукратное зеркальное отражение сайт связывания анти-идиотипических антител должен являться аналогом оригинального рецептора. Затем анти- идиотипические антитела можно использовать для идентификации и выделения пептидов из банков химически или биологически полученных пептидов. Отобранные пептиды служат основой для конструирования лекарств.
Таким образом, могут быть сконструированы препараты, которые имеют, например, повышенную активность MTS или стабильность, или действующие как ингибиторы, агонисты, антагонисты и др. активности MTS. Благодаря доступности клонированных последовательностей MTS полипептид MTS может быть получен в количествах, достаточных для проведения таких аналитических процедур, как рентгеновская кристаллография. Кроме того, раскрытая в настоящем изобретении последовательность белка MTS позволяет использовать компьютерное моделирование вместе с рентгеновской кристаллографией или вместо нее.
Способы применения: генотерапия
Согласно данному изобретению предлагается способ восстановления функции MTS дикого типа в клетке, несущей мутантные аллели MTS. Восстановление такой функции должно супрессировать неопластический рост реципиентных клеток. Ген MTS дикого типа (или часть этого гена) может быть введен в клетку посредством вектора, обеспечивающего экстрахромосомальное персистирование гена в клетке. В этом случае ген будет экспрессироваться в клетке без интеграции в хромосому. Если фрагмент гена введен и экспрессирован в клетке, несущей мутантные аллели MTS, то этот фрагмент должен кодировать ту часть белка MTS, которая необходима для неопластического роста клетки.
Более предпочтительна такая ситуация, когда ген MTS дикого типа или его фрагмент введены в клетку таким способом, который обеспечивает рекомбинацию с имеющимся в клетке эндогенным мутантным геном MTS. Подобная рекомбинация требует двух рекомбинационных актов для коррекции мутантного гена MTS. Известны векторы как для введения генов с целью рекомбинации, так и для поддержания их в экстрахромосомном состоянии, и выбор подобных векторов достаточно широк. Такие методы введения ДНК в клетки как электропорация, кальций-фосфатная копреципитация и вирусная трансдукция хорошо известны и выбор конкретного метода введения находится полностью в компетенции исследователя. Клетки, трансформированные геном MTS дикого типа, могут служить модельной системой для изучения опухолевой ремиссии и терапевтических подходов, способствующих такой ремиссии.
Как уже обсуждалось ранее, ген MTS или его фрагмент могут быть использованы в генной терапии для увеличения количества продуктов экспрессии данных генов в опухолевых клетках. Подобный подход особенно применим как в случае раковых, так и предраковых клеток, в которых уровень полипептида MTS снижен по сравнению с нормальными клетками. Этот подход может применяться и для повышения уровня экспрессии MTS в тех опухолевых клетках, в которых мутантный ген экспрессирован на "нормальном" уровне, но продукт экспрессии не полностью функционален.
Генотерапия должна проводиться согласно общепринятым методам, например, как описано Фридменом в "Терапии генетических заболеваний", T.Friedman, ed. Oxford University Press (1991), pp. 105-121. Клетки из опухоли пациента должны быть первоначально проанализированы с использованием описанных выше методов для выяснения уровня продукции полипептида MTS в этих клетках. Подготавливается вирусный или плазмидный вектор, в котором копия гена MTS связана с элементами контроля экспрессии, и способный к репликации в опухолевых клетках. Приемлемые векторы описаны, например, в патенте США 5252479 и опубликованной заявке PCT WO 93/07282. Затем вектор вводят больному локально в опухоль или же системно, с тем чтобы он мог проникнуть в опухолевые клетки возможных метастазов. Если трансфицированный ген не встраивается на постоянной основе в геном каждой опухолевой клетки-мишени, лечение может периодически повторяться. Поскольку полипептиды MTS участвуют в контроле клеточного цикла, предпочтительно, чтобы ген MTS был введен вместе со своими собственными регуляторными элементами, чтобы избежать конститутивной экспрессии полипептидов MTS во всех клетках, которые получат этот ген в результате описанной процедуры.
Известные системы переноса генов могут быть использованы для осуществления заявленного изобретения в целях генотерапии. Эти системы включают как вирусные, так и невирусные методы переноса. Многие вирусы были использованы как векторы для доставки генов: паповавирусы (например, SV40, Madzak et al., 1992), аденовирус (Berkner, 1992; Berkner et al., 1988, Gorziglia and Kapikian, 1992; Quantin et al., 1992; Rosenfeild et al., 1992; Wilkinson et al. , 1992; Stratford-Perricaudet et al., 1990), вирус осповакцины (Moss, 1992), адено-ассоциированный вирус (Muzyczka, 1992; Ohi et al.,1990), герпес-вирусы, включая HSV и EBV (Margolskee, 1992; Johnson et al., 1992; Fink et al. , 1992; Breakfeild and Geller, 1987; Treese et al., 1990) и ретровирусы птичьего (Brandyopadhyay and Temin, 1984; Petropoulos et al., 1992), мышиного (Miller, 1992; Miller et al., 1985; Sorge et al., 1984; Mann and Baltimore, 1985; Miller et al., 1988) и человеческого происхождения (Shimada et al., 1991; Helseth et al., 1990; Page et al., 1990; Buchschacher and Panganiban, 1992). Большинство методов генотерапии человека основано на применении инактивированных мышиных ретровирусов.
Известные на сегодня невирусные способы переноса генов включают такие химические подходы, как кальций-фосфатная копреципитация (Graham and van der Eb, 1973; Pellicer et al., 1980); механические методы, например микроинъекция (Anderson et al., 1980; Gordon et al., 1980; Brinster et al., 1981; Constantini and Lacy, 1981); перенос при слиянии мембран посредством липосом (Felgner et al., 1987; Wang and Huang, 1989; Kaneda et al., 1989; Stewart et al. , 1992; Nabel et al., 1990; Lim et al., 1992); прямой захват ДНК и перенос ДНК при помощи рецепторов (Wollf et al., 1990; Wu et al., 1991; Zenke et al., 1990; Wu et al., 1989b; Wollf et al., 1991; Wagner et al., 1990; Wagner et al. , 1991; Gotten et al., 1990; Curiel et al., 1991a; Curiel et al., 1991b). Вирус-опосредованный перенос генов может быть комбинирован с прямым переносом генов in vivo при помощи липосом, что позволяет доставлять вирусные векторы в опухолевые клетки, а не в неделящиеся окружающие клетки.
Кроме того, клетки, продуцирующие ретровирусный вектор, могут быть инъецированы в опухоли (Culver et al., 1992), что создает постоянный источник вирусных частиц. Указанный метод был опробован на пациентах с неоперабельными опухолями мозга.
В подходе, комбинирующем биологические и физические методы переноса генов, плазмидная ДНК любого размера связывается с полилизин-конъюгированными антителами, специфичными к аденовирусному гексоновому белку, и полученный комплекс соединяют с аденовирусным вектором. Затем этим тримолекулярным комплексом инфицируют клетки. Аденовирусный вектор обеспечивает эффективное связывание, интернализацию и деградацию эндосомы, прежде чем произойдет деградация связанной ДНК.
Показано, что комплексы ДНК/липосомы могут быть использованы для прямого переноса генов in vivo. При том что в случае стандартного метода приготовления липосом процесс переноса генов in vivo неспецифичен, доказаны перенос ДНК in vivo и экспрессия в опухолях, например, при прямом введении in situ (Nabel, 1992).
Способы применения: пептидная терапия
Пептиды, имеющие активность MTS, могут быть доставлены в клетки с утраченными MTS аллелями или несущие мутантные MTS-аллели. Описаны последовательности белков MTS (SEQ ID NO:2, SEQ ID NO: 14 и SEQ ID NO: 16). Белок можно получить экспрессией кДНК в бактериях, например, с помощью известных векторов экспрессии. Альтернативно, MTS-полипептид можно экстрагировать из MTS-продуцирующих клеток млекопитающих. Кроме того, для синтеза MTS-белка можно применить подходы синтетической химии. Любой из указанных методов позволяет получить заявленный в настоящем изобретении препарат, состоящий из MTS-белка. Данный препарат в значительной степени свободен от примесей других белков человека. Эта цель наиболее просто достижима при синтезе in vitro и синтезе в микроорганизмах.
Активные молекулы MTS могут быть введены в клетки микроинъекцией или при помощи липосом. Некоторые из этих активных молекул могут захватываться клетками активно или путем диффузии. Внеклеточное применение продукта гена MTS может быть достаточным для оказания эффекта на рост опухоли. Доставка молекул с активностью MTS должна приводить к частичной реверсии неопластического состояния. Другие молекулы с активностью MTS (например, пептиды, лекарства или органические соединения) также могут быть использованы для достижения такой реверсии. Модифицированные пептиды, имеющие весьма сходную функцию, также применимы для пептидной терапии.
Способы применения: трансформированные хозяева
Клетки и животные, несущие мутантный аллель MTS, могут быть использованы в качестве модельных систем для изучения и проверки веществ, от которых можно ожидать потенциального терапевтического эффекта. Для культивирования обычно используют эпителиальные клетки. Соматические клетки или клетки зародышевой линии могут быть получены от пациентов с мутациями MTS.
Напротив, клеточная линия с мутацией MTS-аллеля может быть сконструирована, как описано выше. После того как проверяемое вещество добавлено к клеткам, определяют неопластический трансформированный фенотип клеток. Любой из параметров неопластической трансформации клеток, включая субстрат-независимый рост, туморогенность для голых мышей, инвазивность или зависимость от факторов роста, может быть охарактеризован. Методы для этого хорошо известны.
Животные для проверки терапевтических агентов могут быть отобраны после мутагенеза, осуществленного на целых животных, клетках зародышевой линии или же зиготах. Подобный мутагенез подразумевает введение мутантных аллелей MTS, обычно животного другого вида, или же введение поврежденных гомологичных генов. Напротив, эндогенный ген (гены) MTS животных может быть поврежден инсерцией или делецией или же введением других генетических повреждений при помощи известных методов (Capecchi, 1989; Valancius and Smithies, 1991; Hasty et al., 1991; Shinkai et al., 1992; Mombaerts et al., 1992; Philpott et al. , 1992; Snouwaert et al., 1992; Donehower et al., 1992). После введения животным проверяемых веществ должен контролироваться рост опухолей. Если проверяемые вещества предотвращают или подавляют рост опухолей, тогда эти вещества являются возможными кандидатами на роль терапевтических агентов в отношении указанных в настоящей заявке форм рака.
Настоящее изобретение иллюстрируют следующие примеры, которые ни в коей мере не ограничивают его применение. Использованы стандартные методы или методы, специально описанные ниже.
Пример 1. Материалы и Методы
А. Генеалогия MTS
На Фиг. 1A-1D показаны Родословные 3137, 3161, 3355 и 1771 соответственно. Частота заболеваний раком в этих родословных указана на чертежах. Во всех меланомах в родословной 3137 обнаружен чувствительный гаплотип, который встречался при анализе данной родословной и в опухолях другого происхождения.
Все меланомы в родословных 3161 и 3355 имели чувствительный гаплотип. Мутации MTS были идентифицированы в опухолях в родословной 1771.
В. Линии опухолевых клеток
Семьдесят шесть клеточных линий меланомы были получены из Людвиговского Онкологического Института (Memorial Sloan Kettering Cancer Center), 8 меланомных и 5 немеланомных клеточных линий были получены из Американской клеточной коллекции (АТСС).
С. Выделение и анализ ДНК из опухолевых клеточных линий
ДНК из опухолевых клеток выделяли, добавляя приблизительно к 10 миллионам клеток 3 мл лизирующего буфера (0.1M NaCl; 0.1 М Tris HCl pH 8.0; 5 mM EDTA; 0.5% SDS). Смесь перемешивали на шейкере Vortex и инкубировали при 65oC 30 минут. Затем добавляли 0.5 мл 8М КОАс, смесь перемешивали и инкубировали во
льду 30 мин. После центрифугирования (пять минут при 10 000 · g) супернатант осаждали равным объемом 95%-ного этанола и повторно центрифугировали (15 мин при 10 000 · g). ДНК ресуспендировали в 50-200 мл H2O.
D. Полимеразная цепная реакция (ПЦР)
50 нг матрицы добавляли к 30 пкМ каждого олигонуклеотидного праймера в 20 мл реакционной смеси, которая содержала 0.1 мМ dNTPs, 10 мМ Tris-HCl (pH 8.3), 50 мМ KCl, 2 мМ MgCl2, 0.01% желатина и 1 единицу полимеразы Amplitaq (Perkin-Elmer). Образцы подвергали 35 циклам на термосайклере Perkin-Elmer 9600 при 94oC 10 с, при 55oC 10 с и при 72oC 10 с. После электрофореза в 1.5%-ной агарозе (SeaKem) или 3%-ной агарозе NuSieve (3:1) (FMC BioProducts) продукт полимеразной цепной реакции визуально выявляли при окрашивании этидиум-бромидом.
E. Искусственные хромосомы дрожжей (YACs)
Искусственные хромосомы дрожжей (YACs), содержащие маркеры MTS-области, были получены путем скринирования библиотек СЕРН YAC при помощи зондов IFNA, D9A171 и D9S126 с использованием описанных выше условий ПЦР. Содержащие YACs штаммы дрожжей выращивали при 30oС в течение трех дней при интенсивном перемешивании в среде АНС (10 г/л кислого гидролизата казеина; 1.7 г/л основного дрожжевого азота; 5 г/л сульфата аммония; 20 мг/л аденин- гемисульфата; 2% глюкозы; pH 5.8). Дрожжевую ДНК выделяли, как описано Ausubel et al., 1992.
F. Создание фаговой библиотеки
Дрожжевую геномную ДНК, содержащую ДНК YAC, подвергали полному гидролизу рестриктазой BamHI, затем с помощью Т4-ДНК лигазы (Boehringer-Mannheim) лигировали с рестрицированными BamHI фаговыми плечами EMBL3 (Promega) и упаковывали in vitro при использовании экстрактов Gigapack II (Stratagene). Фаг выращивали в клетках E.coli штамма C600. Рекомбинантные фаги, содержащие ДНК человека, идентифицировали гибридизацией с человеческой Cot-1 ДНК, меченой 32-Р (GIBCO-BRL). Фаги, содержащие человеческие последовательности, включенные в YAC-вектор (концевые клоны), идентифицировали путем скрининга с ПЦР-фрагментами, содержащими левое или правое плечо искусственной дрожжевой хромосомы. Гибридизацию и отмывку проводили в стандартных условиях (Middleton et al. , 1991). Отбирали положительные бляшки, которые очищали трехкратным пересевом.
Фаговую ДНК выделяли на колонках Qiaex (Qiagen).
G. Создание космидной библиотеки
Дрожжевую геномную ДНК, содержащую ДНК YAC, подвергали частичному гидролизу рестриктазой Sau3A и фракционировали по размеру в линейном градиенте сахарозы (10-40%), как описано Maniatis et al., 1982. Космидный вектор SuperCos 1 (Stratagene) подготавливали согласно указаниям производителя, смешивали с ДНК-вставкой в соотношении 4:1 (вставка:вектор), обрабатывали лигазой и упаковывали in vitro, как описано выше.
Космиды вводили в клетки-хозяева DН57-альфа и рассевали с плотностью 02000 колоний на 15-сантиметровую чашку. Гибридизацию с колониями проводили, как указано выше и как описано Maniatis et al., 1982.
Н. P1 клоны
P1 клоны, перекрывающие область MTS, были получены от Genome Systems, Inc. , St. Louis, Missouri, путем скрининга при использовании STS, полученными, как описано в настоящей заявке. ДНК из этих клонов выделяли щелочным гидролизом (Birnboim and Doly, 1979), а затем очищали центрифугированием в градиенте плотности хлорида цезия (Maniatis et al., 1982).
I. Получение STS (site-tagged sequences)
STS получали секвенированием 1.0 мг P1, космиды или матричной ДНК с олигонуклеотидами, комплементарными последовательностям, которые фланкируют сайт клонирования в векторе P1 (pSacBII), векторе SuperCos 1 или векторе EMBL3. Секвенирование было выполнено с помощью системы секвенирования ABI 373A DNA с набором для секвенирования PRISM Ready Reaction DyeDeoxy Terminator Cycle (ABI). STS были сконструированы таким образом, чтобы по возможности иметь длину около 20 килобаз и Tm, близкую к 60oC.
J. Зародышевые мутации гена MTS1 в родословных, подверженных меланоме
Геномную ДНК индивидуумов-носителей выделяли из крови стандартными методами. Праймеры были сконструированы для амплификации кодирующих экзонов 1 или 2 гена MTS1 или же кодирующего экзона 2 гена MTS2 с использованием 20 нг ДНК в каждой пробе.
Для ПЦР использовали стандартный буфер с тем исключением, что DMSO добавляли до конечной концентрации 5%. Реакции циклического секвенирования проводили на амплифицированных продуктах с использованием альфа-Р32-dATP и применяя праймеры, расположенные в различных точках последовательности. Продукты секвенирования анализировали электрофорезом в 6%-ных денатурирующих полиакриамидных гелях, нанося на гель последовательно все реакционные смеси (A), затем все реакционные смеси (В) и т.д. Все полиморфизмы подтверждали анализом последовательности противоположной цепи.
Пример 2. Локализация MTS с использованием генетически сцепленных маркеров
Для анализа опухолевых клеточных линий на гомозиготные делеции в области 9p21 был использован набор маркеров, связанных с MTS. Эти маркеры первоначально применялись для того, чтобы показать предрасположенность к меланоме в 10 родословных в Юте и в одной родословной в Техасе (Cannon-Albright et al., 1992). Указанный набор маркеров включал последовательность из кластера гена альфа-интерферона (IFNA) (Kwiatkowski & Diaz, 1992), которая служила наиболее дистальным маркером; проксимальный маркер (D9S104) и четыре дополнительных промежуточных маркера (D9S171, D9S126, D9S161 и D9S169) (Cannon-Albright et al., 1992). Генетические исследования позволяют расположить эти маркеры в следующей последовательности: D9S171, D9S126, D9S161, D9S169. Маркер IFNA состоит из олигонуклеотидной праймерной пары, которая амплифицирует два фрагмента геномной ДНК дикого типа: полиморфный фрагмент размером 138-150 пар оснований, содержащий поли(CA) участок, и инвариантный фрагмент размером 120 пар оснований (IFNA-s). Локализация IFNA-s по отношению к IFNA-1 остается неизвестной.
С использованием генетических маркеров были проанализированы пять немеланомных опухолевых клеточных линий, имеющих делеции. В каждой из клеточных линий обнаружены гомозиготные делеции по меньшей мере одного из исследованных маркеров (Табл. 1). При использовании маркеров D9S161, D9S169 и D9S104 гомозиготных делеций не обнаружено. Минимальная область перекрывания выявленных делеций была фланкирована IFNA-1 и D9S171; это позволяет предположить, что в области между указанными двумя маркерами расположен ген (гены), участвующий(ие) в опухолевой супрессии, возможно MTS. Геномная область между D9S171 и IFNA-1, в особенности прилегающая к IFNA-s, в последующем была исследована более подробно.
Пример 3. Геномные клоны области MTS
Для получения геномных клонов прилегающей к IFNA-s области, были скринированы библиотеки СЕРН YAC (Cohen et al., 1993). Одиннадцать YAC клонов идентифицировали как содержащие маркер D9S171 и пять - как содержащие IFNA-s (Фиг. 2). Три YAC-клона (C9,C6,F9) субклонировали в фаг и один YAC-клон (C6) был субклонирован в космидный вектор. Не было получено YAC клонов, содержащих как D9S171, так и IFNA-s одновременно (Фиг.2). Указанные клоны позволили получить STSs, внутренние по отношению к известным генетическим маркерам, а также осуществить описанную ниже методику "прогулки по хромосоме".
Для создания независимого источника геномной ДНК в целях конструирования непрерывной геномной карты заданной области и облегчения создания STS была осуществлена "прогулка по хромосоме" в P1 клонах от IFNA-s по направлению к D9S171, затем в обратном направлении от D9S171 к IFNA-s, а также от концов YAC C6 в обоих направлениях. В результате были выделены всего 27 P1 клонов (Фиг. 2). Упорядоченные клоны P1 образовали ряд контигов, перекрывающих расстояние от INFA-s до D9S171 с двумя пропусками. Клоны P1 вместе с некоторыми фаговыми и космидными клонами были использованы для получения подробной карты области MTS.
Пример 4. Подробный анализ структуры области MTS
Для получения более подробной молекулярной карты области MTS требовались дополнительные маркеры. Последовательности ДНК, полученные из геномных клонов, были использованы для конструирования ПЦР-праймеров для STS. Эти STS служили в свою очередь для упорядочивания P1-клонов и YAC-клонов. Всего 54 STS из области между IFNA-s и D9S171 послужили основой для создания детальной физической карты области MTS (Фиг.2). Указанные первичные последовательности STS были депонированы в банке данных о геномных последовательностях Genome Database.
Набор новых маркеров, перекрывающих участки от IFNA-s до D9S171, был использован для анализа 84 меланомных клеточных линий на гомозиготные делеции в области MTS. Гомозиготные делеции обнаружены в 52-х линиях (Фиг. 3). Некоторые из делеций были обширными; например, в 13 линиях были утрачены области, включающие как 816.7, так и 760-L.
Для целей локализации MTS наиболее информативные клеточные линии были разделены на две группы (Фиг. 3): I) содержащие только делецию c5.1 (класс 11); и II) содержащие только делецию c5.3 (класс 12). В эти категории попали только 5 меланомных линий. Во всех обнаруженных случаях делеций эти делеции были простыми, то есть не было указаний на множественные делеционные акты в области между IFNA-s и D9S171. Если принять во внимание наличие линий, в которых делеции перекрываются возле маркеров c5.1 и c5.3, то отпадала необходимость создания полной физической карты области от IFNA-s до D9S171.
Пример 5. Идентификация космид c5 и P1, колоний P1062 и P1063 как содержащих MTS
A. Расположение генетических маркеров
Анализ YAC-клонов и делеций в опухолевых линиях дал результаты, совпадающие с генетическим положением маркеров: IFNA, D9S171, D9S126. Три YAC-клона содержали D9S171 и D9S126, а четыре YAC-клона содержали IFNA-1 и IFNA-s (Фиг. 2). Ни один из них не содержал вместе D9S171 и IFNA. Следовательно: 1) IFNA-1 и IFNA-s тесно связаны и 2) связаны D9S126 и D9S171. Эти результаты подтверждаются делециями в клеточных линиях. В большинстве клеточных линий, утративших D9S171, отсутствовал также и D9S126. Наоборот, линия U-87, положительная по маркерам D9S171 и D9S126, утратила IFNA-1 и IFNA-s (Табл. 1). В одной из меланомных клеточных линий, SK-mel-5, отсутствовали IFNA-s, D9S171 и D9S126, но обнаруживался IFNA-1. Таким образом, IFNA-1 должен быть удален от IFNA-s. В другой меланомной клеточной линии, SK-Mel-Zan, были делетированы IFNA-1, IFNA-s и D9S171, но не D9S126, что дает основание поместить D9S171 между IFNA-s и D9S126. В совокупности эти данные подтверждают расположение маркеров, приведенное в Табл. 1.
Генное семейство альфа-интерферона человека состоит из более чем 23 генов и псевдогенов, локализованных на хромосоме 9p. Этот кластер генов был клонирован и разделен на 10 групп связывания (Henco et al., 1985). Группы связывания были частично упорядочены посредством анализа делеций различных альфа-интерфероновых последовательностей в глиомных клеточных линиях (Olopade et al., 1992). В глиомной линии H4 утрачены IFNA-1 и IFNA-s. В ней также отсутствуют последовательности группы связывания IV (т.е. альфа 13, альфа 6 и альфа 20). В глиомной линии A172 имеются как IFNA-1, так и группа связывания IV, но утрачены последовательности из групп связывания I (т.е. альфа 1, альфа 19), III (т.е. альфа 8) и IX (т.е. альфа 2) и IFNA-s. Дистальная граница делеций в A172 была определена в пределах одной длины P1 от IFNA-s. Таким образом, группы связывания I, III и IX должны располагаться проксимально по отношению к точке, удаленной на 85 килобаз от IFNA-s.
В. Физическое расстояние между генетическими маркерами
Имеющиеся результаты не позволяют точно определить расстояние между IFNA-s и D9S171, поскольку не удалось выделить YAC-клон, содержащий оба маркера. Кроме того, на основе картирования с STS показано, что ни один из пяти YAC-клонов, перекрывающих последовательности, дистальные относительно IFNA-s, не совпадал ни с одним из 11 YAC-клонов, проксимальных относительно IFNA-s. Учитывая, что вставки СЕРН YAC в среднем составляют 500 килобаз, можно считать, что расстояние между IFNA-s и D9S171 не меньше этого значения.
Область между IFNA-s и c5.1 перекрывается девятью шагами в библиотеке P1. Если принять среднюю величину каждого шага равной половине P1-вставки, то расстояние между c5.1 и IFNA-s приблизительно составляет 400 килобаз. Таким образом, ген-супрессор опухолей тесно связан с c5.1, которая часто утрачивается в меланомных линиях, и расположен в 400 килобазах проксимально по отношению к IFNA-s.
С. Делеции в опухолевых линиях
Гомозиготные делеции области 9p21 обнаружены в 57% обследованных меланом. Четырнадцать опухолевых линий имели делеции, которые простирались в проксимальную сторону от 760-L, и 16 линий имели делеции, простирающиеся за 816.7 в дистальную сторону. Если принять каузальное значение делеций, то есть, что делеции гена (генов) в этой области участвуют в формировании опухолевого фенотипа, то ген-супрессор (или гены-супрессоры) должен лежать между 760-L и 816.7. Наименьшие делеции захватывают маркеры c5.1 и c5.3. Из всех исследованных маркеров c5.3 был делетирован в наибольшем числе линий, а именно в 51. Следовательно, наиболее вероятное местоположение гена-супрессора - возле c5.3, поскольку это наиболее часто делетируемый маркер. Четыре линии имели делеции только c5.3 (класс 12) и одна - только c5.1 (класс 11). Оба указанных маркера представлены в космиде c5. Таким образом, вероятно, что ген-супрессор включает последовательности, представленные в космиде c5. P1-клоны P1062 и P1063 содержали последовательности, обнаруживаемые в космиде c5 и соседствующие с ней. Таким образом, как будет показано ниже, P1062 и P1063 содержали полную область MTS.
Результаты, приведенные в Примерах, согласуются с предварительными генетическими исследованиями MTS, в которых показано, что область между IFNA-s и D9S126 является наиболее вероятной локализацией MTS (Cannon-Albright et al. , 1992). Недавние генетические исследования уточнили локализацию MTS с применением (CA)-полиморфного повтора, лежащего между IFNA-s и c5.3 на P1-452 (Фиг. 2). Анализ рекомбинантной хромосомы с применением этого маркера позволил поместить MTS проксимально по отношению к P1-453. Таким образом, MTS картирован в области гомозиготных делеций в меланомных клеточных линиях.
Эти результаты подтверждают предположение о том, что локус супрессора опухолей, MTS, расположен поблизости от c5.3.
Все линии с делециями утрачивали одни и те же последовательности ДНК при том, что набор делеций был ограничен c5.1 или c5.3 (классы 11 и 12). Не имеется указаний на перекрывающиеся делеции в использованном наборе клеточных линий, отличных от делеций, представленных в космиде c5. Таким образом, нет оснований для построения более сложной схемы, например, с участием второго локуса-супрессора в 9p21, удаленного от c5.1 и c5.3.
Тот факт, что гомозиготные делеции области 9p21 наблюдаются в опухолях многих различных типов, указывает на то, что локализованный в этой области ген или гены-супрессоры могут экспрессироваться в самых разных тканях. Ген-супрессор может быть аналогичен гену p53 в том отношении, что он может участвовать в развитии разных типов опухолей (см. ниже). В подверженных меланоме семьях обнаруживают и другие типы опухолей (Nancarrow et al., 1993; Bergman et al. , 1990). Тщательный делеционный анализ разнообразных типов опухолей с использованием c5.1 и c5.3 (показано ниже) подтвердил важность гена-супрессора опухолей при развитии неоплазий, отличных от меланомы.
Некоторые из наблюдаемых гомозиготных делеций удаляют несколько генетических маркеров. Fountain et al. описали гомозиготные делеции длиной в 2-3 мегабазы на хромосоме 9p21 в двух различных меланомных линиях (Bergman et al., 1990). В данном исследовании по меньшей мере одна линия, SK-MEL-5, имела делеции, простирающиеся от наиболее дистального из исследованных маркеров, IFNA-1, и захватывающие D9S126. Эта область слишком велика, чтобы быть представленной в одном YAC-клоне. Преобладание протяженных делеций указывает на то, что область, окружающая MTS, лишена генов, необходимых для жизнеспособности клеток.
Пример 6. Выделение генов-кандидатов MTS
В предыдущих Примерах описаны результаты "прогулки по хромосоме" в районе MTS с помощью YAC- и P1- клонов. Эксперименты по детальному картированию с помощью STS, полученных на основе последовательностей космиды c5, показали наличие малых неперекрывающихся делеций последовательностей c5 в пяти различных меланомных линиях. Эти результаты дают основание считать, что ген-супрессор опухолей, предположительно MTS, по меньшей мере частично находится в последовательностях c5.
Другое указание на то, что c5 содержит по меньшей мере один ген, было получено в результата анализа частоты (CpG) динуклеотидов в космиде c5 и соседствующих с ней космидах. У млекопитающих практически все "хаускипинг"-гены и почти половина тканеспецифических генов ассоциированы с областями, обогащенными (CpG) динуклеотидами (Bird, 1989; Larsen et al., 1992). Таким образом, наличие "CpG"- островков служит индикатором присутствия генов. Космиды c5, c12, c57 и c59 рестрицировали эндонуклеазами EagI, BssHI и SacII, т.е. ферментами, чьи сайты узнавания содержат две (CpG) пары. Только космиды c5 и c12 содержали сайты рестрикции данных ферментов. Космида c5 имела один сайт EagI, по меньшей мере 10 сайтов BssHI и не менее 12 сайтов Sacl. Наличие "CpG"-островков в космиде c12 и перекрывающейся с ней космиде c12 дает основание считать, что в космиде c5 имеется по меньшей мере один ген-кандидат MTS.
Для поиска MTS определяли нуклеотидные последовательности EcoRI-рестрикционных фрагментов космиды c5. Когда эти последовательности сопоставили с последовательностями, полученными из Генного банка, были идентифицированы две различные области c5, имеющие существенное сходство с последовательностью ранее идентифицированного гена-ингибитора циклин-зависимой киназы 4 человека, или p16 (Serrano et al., 1993). Эти два гена-кандидата MTS были обозначены MTS1 и MTS2. MTS1 был локализован возле конца космиды c5, ближайшего к теломере хромосомы 9p, а MTS2 был локализован возле центромерного конца c5 (См. Фиг.4B). Карты космиды с указанием положения MTS1 и MTS2, а также карты P1-клонов 1062, 1063 и 1069 приведены на Фиг.4A.
Подробное сравнение геномной последовательности MTS1 из космиды c5 с последовательностью мРНК p16 показало, что MTS1 содержит фрагмент в 307 пар оснований, идентичный части кодирующей последовательности p16. Этот фрагмент нуклеотидной последовательности MTS1 фланкирован узнаваемыми последовательностями сплайсинговых соединений. Далее было показано, что MTS1 содержит полную кодирующую последовательность p16 и еще два интрона (Фиг.5A и 5B и Фиг. 6A и 6B). Интрон 1 был локализован на 126 пар оснований "ниже" сайта начала трансляции; интрон 2 был локализован на 11 пар оснований "выше" сайта окончания трансляции. Два интрона делят кодирующую последовательность MTS1 на три области: 5'- область в 126 пар оснований (кодирующий экзон 1), среднюю область в 307 пар оснований (кодирующий экзон 2) и 3'-область в 11 пар оснований (кодирующий экзон 3). SEQ ID NO:3 представляет собой нуклеотидную последовательность 5'-области, экзона 1 и части интрона 1 MTS1. SEQ ID NO:4 представляет собой нуклеотидную последовательность части интрона 1, экзона 2 и части интрона 2 MTS1.
MTS2 содержит последовательность ДНК, почти идентичную p16, которая простирается от 5'-конца кодирующего экзона 2 приблизительно на 211 пар нуклеотидов по направлению к нитрону 2 (Фиг.7A). Однако сходство последовательностей снижается к 51-ой паре нуклеотидов "выше" интрона 2 MTS1, которая соответствует локализации последнего кодона MTS2 (Фиг. 8). Сравнение последовательностей MTS1 и MTS2 показывает, что сходство последовательностей этих генов обнаруживается приблизительно на 40 нуклеотидов "выше" 3'-сплайсингового соединения интрона 1. Таким образом, фрагменты некодирующей ДНК оказались более консервативными, чем некоторые области предположительно кодирующей ДНК. Для исключения возможности того, что дивергенция последовательностей явилась артефактом клонирования, были сконструированы праймеры для ПЦР с целью специфической амплификации последовательностей в точке дивергенции MTS2. При помощи этих праймеров амплифицировался фрагмент предсказанного размера из космид, P1-клонов и геномной ДНК. Таким образом, дивергированная последовательность, расположенная возле 3'-конца экзона 2 в MTS2, является bona fide геномной последовательностью. SEQ ID NO:5 представляет собой последовательность нуклеотидов части интрона 1, "экзон 2" и "интрон 2" MTS2. SEQ ID NO: 15 представляет собой последовательность кДНК MTS2.
Обнаружение двух близкородственных генов в космиде c5 дает основания предполагать наличие в этой области других родственных генов. Для проверки этой возможности был осуществлен блоттинг по Саузерну рестрикционных фрагментов космид c5, c12, c59, Pls 1063 и геномной ДНК человека. В качестве пробы в данных экспериментах был использован фрагмент, содержащий большую часть экзона 2 MTS1, включая общую с MTS2 область. В геномной ДНК и в клонированной ДНК было обнаружено два положительных EcoRI-фрагмента. Этот результат подтверждает наличие в геноме двух p16-подобных генов, MTS1 и MTS2. Он подтверждает также уже известное существование MTS1E1- бета, альтернативной формы MTS1, содержащей экзоны 2 и 3, но не экзон 1 MTS1.
Пример 7. Выделение и структура MTS1E1-бета
Выделение MTS1E1-бета
Клоны, содержащие MTS1E1-бета, были выделены путем отбора гибридов с использованием в качестве пробы полной кДНК MTS1 и с применением стандартной процедуры скрининга кДНКовых библиотек. Скрининг кДНК-овой библиотеки проводили с помощью пробы, полученной на основе экзона 2 MTS1. Из каждой библиотеки, полученной из эмбрионального мозга, нормальной молочной железы и лимфоцитов соответственно, скринировали по одному миллиону клонов. Гибридизующийся клон кДНК выделили из "лимфоцитной" библиотеки. Клон просеквенировали и показали наличие в нем E1-бета. Кроме того, он содержал экзон 2 (E2) и экзон 3 (E3) MTS1. Положительные по гибридизации клоны кДНК были выделены путем инкубации полученной из ткани яичника кДНК с космидой c5. Космиду метили биотином и "сделали" одноцепочечной. Далее создавали условия для образования гибридов между с5 и кДНК, а затем биотинилированную плазмиду "захватывали" с помощью магнитных частиц, покрытых стрептавидином. Отобранные таким образом кДНК отделяли от космиды, амплифицировали ПЦР, клонировали и секвенировали. Клоны кДНК были сходны с выделенными из кДНК-овых библиотек в том, что они содержали E1-бета, E2 и E3. Ни один из клонов не содержал ранее описанный экзон 1 (см.последовательность SEQ ID NO:3). Последовательность MTS1E1-бета приведена в описании под номером SEQ ID NO:13.
Структура MTS1E1-бета
MTS1 и MTS1E1-бета - это две формы одного гена: в обеих формах обнаружены экзоны 2 и 3, но они имеют различные первые экзоны. MTS1 содержит альфа форму (E1-альфа), которая кодирует первые 43 аминокислоты белка p16, кодируемого MTS1.
MTS1E1-бета содержит бета форму (E1-бета) экзона 1. Экзонная структура гена p16 была определена путем сравнения последовательностей композитных клонов кДНК с геномными областями, из которых они были получены (Фиг. 13). Комбинация геномных блотов, анализ последовательностей геномной области, содержащей P16, и протяженные ПЦР были использованы для определения положений экзонов P16 (Фиг. 13). Ген p16 занимает приблизительно 30 килобаз геномной ДНК. E1-бета наиболее близок к 5'-концу, а в целом порядок экзонов таков: E1-бета, E1-альфа, E2 и E3.
Трансляция E1-бета в рамке считывания p16 (экстраполированной из рамки считывания, используемой для экзонов 2 и 3) открывает стоп-кодон, находящийся всего на 10 кодонов "выше" сплайсингового соединения между E1-бета и E2. Положение стоп-кодона было подтверждено анализом последовательностей как геномной, так и кДНК. Первый возможный инициирующий кодон "ниже" этого стоп-кодона находится сразу за сплайсинговым соединением E1/E2 в 3' направлении. Этот потенциальный старт-кодон фланкирован последовательностями, которые не слишком напоминают консенсусную последовательность Козака (Kozak, 1989). При трансляции в рамке считывания p16 транскрипт E1-бета гена p16 кодировал бы белок в 105 аминокислот.
Последующий анализ кДНК-бета показал, что в ней заключена протяженная рамка считывания, отличная от используемой при кодировании p16. Указанная рамка считывания (ORF2) перекрывает E1-бета и простирается на 67 аминокислот в E2. Полная рамка считывания может кодировать белок в 180 аминокислот. Однако рамка считывания остается открытой с 5'-конца E1-бета и потому может быть неполной. Статистический анализ показывает, что ORF такого размера вряд ли встречается случайно в ДНК, состоящей из случайных последовательностей (P= 0.003). Однако при заданном составе бета-транскрипта вероятность гораздо выше (P= 0.16). Гипотетический полипептид не имеет сходства с каким-либо описанным белком.
Определение эволюционно консервативных частей E1-бета может объяснить, какие именно последовательности важны для выполнения функций данного белка. При помощи модифицированного метода RACE, названного "захват гибридов -RACE" (HCR) (см. Пример 12), были выделены мышиные кДНК p16, которые сравнили с человеческими кДНК p16. Один из типов мышиных кДНК p16 (бета-тип) имел экзоны, эквивалентные человеческим E1-бета и E2. Другой тип (альфа-тип) содержал эквивалент E1-альфа, соединенный с E2. Экзоны E1-альфа и E2 мыши оказались на 70% идентичны своим человеческим аналогам. Нуклеотидные последовательности экзонов E1-бета человека и мыши совпадали на 51% (Фиг. 14), а экзон E1-бета мыши также имел стоп- кодоны в рамке считывания p16. Полипептиды человека и мыши, предсказанные на основе нуклеотидной последовательности, расположенной в 5'-направлении от стоп-кодона, оказались совершенно различными. Поэтому маловероятно, что стоп-кодоны в рамке считывания p16 являются артефактами секвенирования.
Учитывая неопределенность роли El-бета, авторы проанализировали сходство между бета-транскриптами мыши и человека для всех трех рамок считывания. Бета-транскрипты мыши и человека содержали большую открытую рамку считывания (ORF2), отличную от используемой при кодировании p16 (ORF1). Предполагаемые полипептиды, кодируемые ORF2, были идентичны на 40%. Однако это совпадение снижалось до 28% при более строгом сравнении пептидов ORF2 в части, кодируемой E1-бета. Напротив, последовательности p16 мыши и человека совпадают на 67%. Кроме того, полипептиды предполагаемой ORF2 E2 совпадали в той же степени (42%), что и предполагаемые полипептиды третьей рамки считывания E2 (ORF3). Данные результаты свидетельствуют о том, что ORF2 не поддерживалась селективно и, по-видимому, не кодирует белка. Сравнивали также вторичную структуру бета РНК мыши и человека. Сходства обнаружено не было. В совокупности эти результаты показывают, что бета-транскрипт необходим для функционирования p16 у мыши и человека; если он транслируется, то кодируемый белок, по-видимому, начинается с первого метионина экзона 2.
Пример 8. Мутации MTS1 в зародышевых линиях
Для ответа на вопрос о том, соответствуют ли MTS1 или MTS2 генетически чувствительному локусу MTS, была проанализирована геномная ДНК восьми индивидуумов, предположительно несущих предрасполагающий к меланоме аллель MTS (Cannon-Albright et al. , 1992). Последовательности ДНК экзонов амплифицировали в каждом случае с использованием олигонуклеотидных праймеров (Табл. 2), полученных из интронных последовательностей, специфичных для MTSI или MTS2.
Экзон 1 гена MTS1 был амплифицирован с помощью праймеров 1F и 1108R и затем секвенирован с использованием праймера 1108R. Экзон 2 гена MTS1 амплифицировали с использованием праймеров 42F и 50R, реамплифицировали с использованием праймеров 89F и 50R, а затем секвенировали с помощью праймеров 89F и 50R.
Секвенирование ДНК указанных геномных фрагментов выявило полиморфизмы у двух из восьми индивидуумов. Подобные полиморфизмы не обнаружены ни в одном из других образцов, что указывает на их неширокую распространенность в популяции. Для того, чтобы показать связь полиморфизмов с MTS-хромосомой, а не с иным гомологом, проанализировали геномную ДНК других индивидуумов из каждой изучаемой родословной, несущих предрасполагающий к меланоме аллель. В каждом случае полиморфизмы сегрегировали вместе с предрасполагающим аллелем MTS. Мутация кодона 93 (gly---> trp) была обнаружена у индивидуума (12821) из родословной 3012. Она была также обнаружена у больного меланомой носителя-сибса (13183) и здорового носителя-кузена (14917), но не у здорового неносителя-сибса (13184). Мутация кодона 118 (val ---> asp) была обнаружена у индивидуума (15635) в родословной 1771. Она была также обнаружена у больного меланомой носителя-двоюродного племянника (10205), больного носителя-кузена (11414) и у подверженного носителя кузена индивидуума 10205 (10146), но не у неподверженного неносителя-дяди индивидуума 10205 (10120).
Полиморфизмы представляли собой единичные нуклеотидные замены, вызывающие замены аминокислот (Табл. 3), что приводило к заменам большого гидрофобного остатка на маленький гидрофильный или же заряженной аминокислоты на нейтральную.
Экзон 2 гена MTS2 не обнаружил полиморфизма в восьми тестированных образцах. Следовательно, по крайней мере в данной группе родословных, ген MTS2 не обусловливает предрасположенность к меланоме. Сходство MTS2 с MTS1 дает основание предполагать участие первого в развитии других видов рака. Возможно также, что MTS2 - нефункциональный ген.
Обнаружение мутаций MTS1 в зародышевых линиях, но не MTS2 у предрасположенных к меланоме индивидуумов согласуется с анализом гомозиготных делеций в меланомах.
Пример 9. Выявление MTS в клетках опухолевых линий
Поскольку в опухолях различных типов высока частота делеций в области 9p21, клеточные линии, полученные из 12 различных типов опухолей, были проанализированы на наличие или отсутствие MTS 1. Для анализа геномной ДНК из опухолевых клеточных линий на наличие или отсутствие искомого фрагмента (Фиг. 4A, 4B и 9) был использован набор STSs (sequence-tagged sites), покрывающих ген. Результаты этого исследования позволяют считать, что MTS1 делетирован в большом числе опухолевых линий (Табл. 4). Гомозиготные делеции обнаружены во всех проверенных типах опухолей за исключением опухолей прямой кишки и нейробластомы. Процент делеций варьировал от 25% в случае рака легких и лейкозов до 94% в астроцитомах. В целом, гомозиготные делеции были обнаружены в 135 из 290 проверенных клеточных линий. Этот результат соответствует минимальной оценке частоты гомозиготных делеций в опухолевых линиях, поскольку использованные для анализа STS не перекрывают весь ген целиком. Таким образом, отдельные малые делеции могли остаться необнаруженными. Кроме того, использованный подход не позволяет обнаружить такие повреждения как инсерции, делеции нескольких нуклеотидов или замены нуклеотидов.
Для более точной оценки общего числа клеточных линий, имеющих мутации MTS1, 34 линии, в которых не обнаружены очевидные гомозиготные делеции последовательности MTS1, были подвергнуты более тщательному анализу. Последовательности, составляющие ~ 97% кодирующей последовательности MTS1, амплифицировали и скринировали на полиморфизм. В 14 из 34 анализированных меланом (Табл. 5) обнаружено восемнадцать соматических мутаций в экзоне 2 или экзоне 1 гена MTS1. Три из этих мутаций были сдвигом рамки считывания, 7 -"нонсенс" мутациями, 4 - "миссенс" мутациями и 4 - молчащими мутациями. Три из четырех линий, содержащих молчащие мутации, имели дополнительные мутации и 16 из 18 мутаций были локализованы в кодирующем экзоне 2. Только одна линия имела исключительно геми- или гомозиготные полиморфизмы, а остальные гомологичные хромосомы имели невосстановленные делеции. Единственная гетерозиготная линия имела две различные немолчащие мутации. Это наблюдение подтверждает предположение о том, что каждый гомолог претерпевает независимое мутационное событие.
Исходя из последовательности ДНК и делеционного анализа гена MTS1, можно заключить, что минимум 75% меланомных линий содержат мутантный ген MTS1 или утратили оба гомолога гена.
Высокая частота повреждений MTS1 (делеции и нуклеотидные замены) указывает на то, что MTS1 или тесно связанный с ним локус участвуют в развитии опухолевого фенотипа. Клетки с такого рода повреждениями получают селективное преимущество по сравнению с клетками, не имеющими таковых нарушений. Альтернативное объяснение, состоящее в том, что подобные повреждения являются случайными и не имеют отношения к клеточному росту, представляется маловероятным по ряду причин. Во-первых, высокая корреляция между опухолевым фенотипом и мутациями MTS1 указывает на причинную связь между мутациями MTS1 и образованием опухоли. Во-вторых, MTS1 определяет чувствительность к меланоме и таким образом независимо функционирует как ген-супрессор опухолей. В-третьих, биохимическая функция p16 как мощного ингибитора Cdk хорошо совпадает с моделью, согласно которой p16 действует in vivo как общий ингибитор начала репликации ДНК.
Возможно, что мутации или утрата гена MTS1 является результатом роста клеток в культуре. Однако высокий процент первичных лейкозных клеток также имеет гомозиготные делеции в кластере гена альфа-интерферона, генном семействе, расположенном менее чем в 500 кб от MTS1 (Diaz et al., 1990). Ранние исследования делеции указывали на то, что делеции генов альфа-интерферона постоянно захватывают маркеры, расположенные за MTS1 по направлению к центромере (Weaver-Feldhaus et al., 1994). Поскольку гомозиготные делеции области MTS1 наблюдаются как в первичных опухолевых клетках, так и культивируемых клеточных линиях, маловероятно чтобы наблюдаемые в опухолевых клеточных линиях делеции были исключительно артефактом роста клеток в культуре. Тем не менее вопрос о том, происходят ли мутации MTS1 в ходе прогрессии опухолей, может получить дальнейшее разрешение при анализе образцов первичных опухолей.
Роль MTS1 in vivo
Для нормального деления эукариотическим клеткам необходим переход через две критические точки жизненного цикла: переход из фазы G1 в фазу S, когда начинается синтез ДНК, и переход из фазы G2 в фазу М, когда начинается митоз. У млекопитающих механизм контроля клеточного деления состоит из многих элементов, большей частью взаимосвязанных (см.Sherr, 1993). Основой контролирующего аппарата могут служить Cdk, поскольку они регулируют фосфорилирование ряда ключевых субстратов, которые в свою очередь включают переход из G1 в S и из G2 в М. Переход из G1 в S является, по-видимому, наиболее критической "точкой принятия решения", поскольку он происходит в клеточном цикле первым. Определены четыре типа Cdk (Cdk2-5), которые могут участвовать в контроле перехода из GI в S, а также ряд положительных регуляторов указанных Cdk (циклины С, D1-3, E). Недавно идентифицированы несколько отрицательных регуляторов: p16, p15, p18, p20, p21 и p27 (Xiong et al., 1993; Serrano et al., 1993; Gu et al., 1993; E1-Diery et al., 1993; Harper et al., 1993; Hannon and Beach, 1994; Polyak et al., 1994b; Toyshima and Hunter, 1994; Guan et al. , 1995). Эти отрицательные регуляторы, по-видимому, действуют путем ингибирования киназной активности Cdk.
Некоторые из регуляторов клеточного цикла участвуют в развитии опухолей у человека (см. Hunter and Pines, 1994). p20 ингибирует Cdk2 и, возможно, другие Cdk, тогда как p16 (называемый также MTS1, CDKN2 или INK4a) ингибирует Cdk4, но не ингибирует Cdk2 в опытах in vitro (Serrano et al., 1993).
Исследования in vitro и взаимодействие с p53 позволили считать p21 общим ингибитором всех Cdk (Xiong et al., 1993). Таким образом, in vitro p16 очевидно более специфичен, чем p21.
По-видимому, каждый из этих ингибиторов препятствует вступлению в S-фазу. Кроме того, циклин D1 или CDK4 экспрессируется выше нормы в некоторых карциномах молочной железы, а ген p16 мутирован или делецирован в большом числе клеточных линий и первичных опухолей (Buckley et al., 1993; Caldas et al. , 1994; Kamb et al., 1994b; Mori et al., 1994; Tam et al, 1994a). Из приведенных результатов следует, что отдельные циклины и CDK являются протоонкогенами, а p16 (MTS1) - геном-супрессором опухолей. Биохимические свойства p15, p18, p21 и p27 указывают на то, что они также могут быть опухолевыми супрессорами, но детальный мутационный анализ их генов в опухолях или клеточных линиях еще не проводился. Приведенные здесь результаты свидетельствуют о функционировании MTS1 in vivo как ингибитора клеточного деления.
Ген p16 (MTS1), локализованный в сегменте 9p21 девятой хромосомы человека, особенно интересен, поскольку он мутирован или гомозиготно делецирован во многих типах опухолей и опухолевых клеточных линиях (Caldas et al., 1994; Kamb et al., 1994b; Mori et al., 1994; Nobori et al., 1994). Кроме того, мутации MTS1 сегрегируют с предрасположенностью к меланоме в нескольких родословных, для которых показана сцепленная с 9p21 чувствительность к меланоме (Hussussian et al., 1994; Kamb et al., 1994а). Однако остается невыясненной роль MTS1 в возникновении наследственного и спорадического рака. В нескольких родословных с высокой частотой меланом и высокими значениями LOD для маркеров 9p21 не обнаружено мутаций в кодирующих последовательностях MTS1. Кроме того, преобладание гомозиготных делеций MTS1 в опухолях и клеточных линиях атипично для инактивации генов-супрессоров опухолей и может указывать на расположение поблизости от MTS1 другого гена (или генов), также участвующего в образовании опухоли.
Недавние исследования указывают на существование митогенных и антимитогенных сигналов, влияющих на клеточный цикл, по меньшей мере путем частичной регуляции активности ингибиторов CDK (Firpo et al., 1994; Hannon and Beach, 1994; Kato et al., 1994; Polyak et al., 1994а; Slingerland et al., 1994).
Например, остановка клеточного цикла, индуцированная бета-TGF, может быть обусловлена активацией p15 и p27. Наоборот, p27 может быть ингибирован в ходе индуцированной IL-2 митогенной активации покоящихся Т-лимфоцитов. Сравнительно мало известно о регуляции MTS1. Во многих недавних публикациях имеются указания на то, что уровни MTS1 могут определяться Rb-белком (Serrano et al. , 1993; Li et al., 1994а; Tam et al., 1994b; Parry et al., 1995). Эти и другие наблюдения (Serrano et al., 1995) позволяют построить модель действия MTS1, согласно которой MTS1 ингибирует CDK4/6 и тем самым предотвращает фосфорилирование Rb. Белок Rb, в свою очередь, участвует в обратной связи и ограничивает уровни MTS1.
Приведенные результаты служат генетическим доказательством важной роли MTS1 в регуляции клеточного цикла. Более того, из этих данных следует, что мишенью MTS1 in vivo служит один из главных факторов туморогенеза. Если MTS1 ингибирует Cdk4 in vivo и не ингибирует Cdk2, Cdk4 может быть весьма вероятным кандидатом в онкогены. Преобладание мутаций гена MTS1 указывает на то, что Cdk4 может функционировать как общий активатор клеточного деления в большинстве (если не во всех) клеток. Дальнейшие биохимические исследования эффектов MTS1 на различные Cdk помогут выяснить иерархию активности Cdk как в нормальных, так и в трансформированных клетках. По аналогии с p16, p21 действует как общий ингибитор различных Cdk и его ген может быть мутирован или утрачен в большом проценте опухолей.
Если MTS1 является общим супрессором опухолей, активным в большинстве нормальных клеток, зародышевые мутации этого гена должны предрасполагать к возникновению опухолей, отличных от меланомы. Например, зародышевая мутация гена p53, подобная обнаруживаемой при синдроме Ли-Фраумени, увеличивает вероятность возникновения опухолей многих типов, включая детскую саркому, рак молочной железы (Malkin et al., 1990). В ранних работах описана необычно высокая частота рака поджелудочной железы в некоторых семьях, подверженных меланомам (Bergman et al., 1990; Nancarrow et al., 1993). Эти наблюдения совпадают с данными о том, что в клеточных линиях рака поджелудочной железы обнаруживаются гомозиготные делеции MTS1.
Возможно, что генетика связанной с MTS1 предрасположенности к опухолям, может отличаться от генетики MTS1 соматических клеток. Например, протяженные делеции, которые могут удалить многие килобазы ДНК в окружающих MTS1 областях, скорее всего не будут закрепляться в генофонде в силу их селективного неблагоприятного воздействия. Однако подобные мутации могут быть благоприятны для трансформированных соматических клеток, возможно потому, что они удаляют много генов. Это предположение согласуется с существованием второго гена, весьма сходного с MTS1 и названного MTS2. MTS2 расположен приблизительно в 12 килобазах "выше" первого экзона MTS1, первый экзон MTS2 находится приблизительно в 2.5 килобазах "выше" второго экзона MTS2. MTS2 может функционировать подобно MTS1. Делеции, которые удаляют MTS1 и MTS2, могут обеспечить ростовое преимущество клеткам по сравнению с теми клетками, в которых инактивирован один из этих генов. Напротив, указанные гены могут действовать в "неперекрывающихся" или "частично перекрывающихся" типах. Эти возможности требуют дальнейшего тщательного изучения клеток.
Пример 10. Мутационный анализ MTS1E1-бета
Широкое распространение гомозиготных делеций, инактивирующих p16 в опухолевых клеточных линиях, а также отсутствие мутаций p16 в родословных с 9p21-ассоциированными меланомами дают основания предположить, что поблизости от p16 находится другой ген (или гены), также участвующий в формировании опухоли (Cairns et al., 1994; Spruck et al., 1994). Если E1-бета кодирует белок, регулирующий рост клеток, то эти гены в случае спорадических и/или семейных раков, возможно, содержат мутации, которые могли быть не обнаружены ранними исследованиями.
Генетическая характеристика родословных с высокой заболеваемостью меланомами опубликована ранее (Cannon-Albright et al., 1992). Описано и выделение геномной ДНК из меланом (Kamb et al., 1994а) и клеточных линий (Liu et al., 1995). Амплификация El-бета полимеразной цепной реакцией была осуществлена с прямым праймером (5'- AGTCTGCAGTTAAGG-3'SEQ ID NO:33) и обратным праймером (5'- GGCTAGAGGCGAATTATCTGT-3'SEQ ID NO:34) в течение 30 циклов в следующих условиях: 3 с при 97oC, 10 с при 65oC, 20 с при 75oC. Амплификационные смеси разводили в 100 раз и амплифицировали повторно в тех же условиях с тем же прямым праймером и другим обратным праймером (5'-CACCAAACAAAACAAGTGCCG- 3'SEQ ID NO:35). Продукты ПЦР фракционировали электрофорезом в 1%-ном геле агарозы и экстрагировали с помощью бус Qiagen (Qiagen,lnc.), а затем секвенировали с использованием набора Cyclist Sequencing (Stratagene) и указанного выше прямого праймера (SEQ ID NO:33).
Ни в 24 линиях клеток, полученных из опухолей 4 типов (Табл. 6), ни в шести "меланомных" родословных, у членов которых отмечено значительное совпадение гаплотипов (Cannon-Albright et al., 1992) и у которых ранее не выявлено мутаций P16 (Kamb et al., 1994а) не обнаружено вариантов последовательности E1-бета. Данные эксперименты показывают, что мутации E1-бета не обязательно сопровождают прогрессию опухолей и не ответственны за 9p21- ассоциированную чувствительность к меланомам в указанных родословных.
Пример 11. Скрининг мутаций MTS2
Скрининг мутаций MTS2 в клеточных линиях
Преобладание в полученных из опухолей клеточных линиях гомозиготных делеций, удаляющих MTS1 дает основания предполагать, что поблизости от MTS1 расположен другой ген или гены, которые также могут участвовать в развитии опухоли. Если ген MTS2 вовлечен в развитие спорадического рака, то в клеточных линиях опухолевого происхождения должны иметься мутации. Поэтому для выявления мутаций в кодирующих последовательностях MTS2 был исследован набор опухолевых клеточных линий.
Экзоны 1 и 2 MTS2 амплифицировали ПЦР, как описано Kamb et al. (1994а). Два праймера, а именно 2E1.F1 (5'-AGGGAGAGTGTCG-TTAAG-3' SEQ ID NO:19) и 2E1. R2 (5'- AGACTCCTGTACAAATCTAC-3' SEQ ID NO: 20) были использованы для получения экзона 1. Два праймера, а именно 89F (SEQ ID NO: 12) и 50R (SEQ ID NO: 11) использовались для получения экзона 2. После амплификации ДНКпродукты разделяли в 1%-ном геле агарозы и затем экстрагировали при использовании бус Qiagen (Qiagen, Inc.). Продукты секвенировали с помощью набора Cyclist Sequencing (Stratagene) с праймером 2E1.F1 для экзона 1 и 89F для экзона 2.
Кодирующие последовательности MTS2 скринировали на наличие мутаций в наборе клеточных линий, полученных из опухолей мочевого пузыря, легкого, почек, глиомы, астроцитомы и меланом. Все указанные типы опухолевых клеточных линий имели высокую частоту гомозиготных делеций MTS1 и MTS2 (Kamb et al., 1994b). Показано, что клеточные линии, полученные из меланомы, опухолей легкого, почек и мочевого пузыря, имеют точечные мутации MTS1 или мутации сдвига рамки считывания MTS1 (Liu et al., 1995). Глиомные и астроцитомные клеточные линии не имели подобных мутаций MTS2. Отдельные клеточные линии, использованные в настоящих экспериментах по скринингу, были отобраны из группы линий, для которых показано отсутствие гомозиготных делеций в последовательностях MTS1 и MTS2 (Kamb et al., 1994b).
Ни в одной из 58 исследованных клеточных линий в кодирующих последовательностях MTS2 не обнаружено мутаций (см. Табл.7). На основе предыдущих исследований MTS1 в данных клеточных линиях можно предположить, что использованный набор линий должен содержать около 8 мутаций MTS1, приходящихся на линии, полученные и опухолей мочевого пузыря, легкого, почек, а также меланомы (Liu et al. , 1995). Таким образом, при скрининге данного набора опухолевых клеточных линий не обнаружено соматических мутаций MTS2.
Скрининг мутаций MTS2 в родословных
Оставалась возможность того, что ген MTS2 отвечает за чувствительность к меланоме в тех подверженных меланоме родословных, в которых нет мутаций кодирующих последовательностей MTS1. Генетическая характеристика подверженных меланоме родословных была опубликована ранее (Cannon-Albright et al., 1992). Геномную ДНК членов указанных семей выделяли из лимфоцитов, которые получали из проб крови по стандартному методу (Kamb et al., 1994а). Скрининг проводили, как описано выше, для мутаций кодирующих последовательностей MTS2 в шести родословных с высокими значениями LOD для 9p21-ассоциированной предрасположенности к меланоме, но в которых не обнаружено мутаций MTS1 (см. Табл. 8) (Kamb et al., 1994а). Мутаций MTS2 обнаружено не было. Таким образом, данные эксперименты не подтвердили участие повреждений MTS2 в наследственном развитии меланомы, хотя только на основе этих экспериментов подобная возможность не может быть исключена полностью.
Пример 12. Экспрессия мРНК MTS1 и MTS1E1-бета
Два промотора p16
Две различные формы мРНК p16 могут быть получены двумя различными путями. Во-первых, транскрипция мРНК может начинаться с двух различных промоторов и, во-вторых, образовавшиеся при транскрипции с одного промотора мРНК могут затем подвергаться альтернативному сплайсингу с образованием двух различных транскриптов.
О существовании двух различных промоторов для транскриптов альфа и бета свидетельствует тот факт, что альфа-транскрипт образуется в клеточных линиях даже в том случае, когда делетирована E1-бета последовательность, расположенная "выше". Клеточные линии A375 и SK-mel 93 содержат делецию с одной точкой разрыва между E1-альфа и E1-бета (Фиг. 13). Четкое расположение проксимальной точки разрыва в обеих клеточных линиях не было установлено, но она находилась по крайней мере на 85 килобаз "выше" 5'-конца E1-бета. С помощью обратно-транскриптазной ПЦР при использовании альфа-специфических праймеров было показано, что в обеих указанных клеточных линиях экспрессируется альфа-транскрипт (Фиг. 15). Методика проведения обратно-транскриптазной ПЦР заключалась в следующем: кДНК синтезировали на основе тотальной РНК (Sambrook et al. , 1989), выделенной из Т-клеток, клеточных линий или тканей человека (Clonetech). Для инициации синтеза кДНК использовали случайным образом выбранные затравки из девяти нуклеотидов и обратную транскриптазу Superscript II (Bethesda Research Laboratories). Выход кДНК определяли по включению альфа-32P-дАТФ (Amersham) в процессе реакции синтеза (0,1 Ки/мМ) с последующим выявлением количества радиоактивного нуклеотида, содержащегося в конечном продукте. Уровень транскриптов p16 альфа и бета анализировали с помощью ПЦР при использовании альфа- и бета-специфических прямых праймеров и обратных праймеров из E2 в двух продуктивных циклах амплификации. В начальном цикле амплификации 2 нг кДНК амплифицировали с помощью альфа-специфического праймера AS. 1 (5'- CAACGCACCGAATAGTTACG-3' SEQ ID NO:26) и бета-специфического праймера BS. 1 (5'-TACTGAGGAGCCAGCGTCTA-3' SEQ ID NO:27) и X2R140' (5'-AGCACCACCAGCGTGTC-3' SEQ ID NO:22). Реакции осуществляли в термосайклере Perkin-Elmer 9600 в течение 20 циклов в следующих условиях: 97oC 0,43 с; 65oC 0,410 с и 75oC 0,420 с. Реакционные смеси разводили в 100 раз и повторно амплифицировали при использовании AS.1 или BS.1 и ОХ42В (5'-CGTGTCCAGGAAGCCC-3' SEQ ID NO:23). Олигонуклеотид OX42B радиоактивно метили по 5'-концу (Sambrook et al., 1989) с помощью гамма-32P-дАТФ (DuPont). Условия ПЦР были аналогичны описанным выше, за исключением того, что проводили 15 циклов. Для устранения загрязнения геномной ДНК продукты ПЦР перекрывали сплайсинговое соединение E1-альфа или E2/E2. Затем их разделяли электрофорезом в денатурирующем 5%-ном полиакриламидном геле. Высушенные гели экспонировали с пленкой X-Omat (Kodak) в течение ночи.
Результаты исследований позволяют предположить, что альфа транскрипт считывается с промотора, который не имеет отношения к 5'- последовательностям E1-бета. Альтернативное объяснение состоит в том, что делении сливают эктопические промоторные последовательности с E1-альфа. Однако это маловероятно, поскольку A375 и SK-mel 93 представляют собой независимо полученные клеточные линии. Точное расположение альфа-промотора неизвестно, однако тест защиты от РНКазы показывает, что транскрипция инициируется "выше" p16 инициирующего кодона, причем это расстояние составляет по крайней мере 440 килобаз. Таким образом, ген p16 человека имеет сложное строение: два независимых промотора P-альфа и P-бета инициируют синтез двух частично перекрывающихся транскриптов с различной кодирующей емкостью.
Характер экспрессии P16
Функциональная активность генов может быть определена по характеру их экспрессии в различных тканях. Для выявления характера экспрессии p16 набор образцов кДНК, полученных из 11 типов тканей, скринировали с помощью ПЦР при использовании альфа- и бета-праймеров (Фиг. 16A-D). Во всех изученных тканях обнаружили обе формы p16-транскрипта, однако имели место некоторые различия. Например, в селезенке соотношение между альфа- и бета-формами было сдвинуто в сторону бета. В противоположность этому указанное соотношение в тканях молочной железы смещалось в сторону альфа. Полученные результаты согласуются с исследованиями, которые обнаруживают делеции и точечные мутации p16 в клеточных линиях, происходящих из многих различных типов тканей (Kamb et al., 1994b; Liu et al. , 1995), что свидетельствует об определенной роли p16 в этих тканях.
Учитывая биохимическое значение p16 как ингибитора Cdk4 и Cdk6, показанное in vitro (Serrano et al., 1993; Li et al., 1994a; Perry et al., 1995), экспрессию p16 анализировали в клетках, прошедших клеточных цикл. Лимфоциты периферической крови человека (PBLs) стимулировали фитогемагглютинином (ФГА) и интерлейкином-2 (IL-2) и отбирали клетки в различное время после стимуляции. Затем клетки исследовали методом проточной цитометрии для определения стадии клеточного цикла, методом обратно-транскриптазной ПЦР для выявления относительного уровня экспрессии гена p16 и путем Вестерн-блоттинга для определения количества p16-белка. PBLs выделяли из крови, полученной от здоровых взрослых доноров и частично очищенной путем флотации в градиенте фиколл-гипака (Bogum, 1968). Затем лимфоциты очищали элютриацией во встречном потоке, как ранее описано Elstad et al., (1988). Указанные авторы определили, что полученная таким образом клеточная популяция содержит 98% очищенных Т- и В-клеток. Затем клетки выращивали в среде RPMI (Gibco) с добавлением 10% телячьей эмбриональной сыворотки.
Неделящиеся клетки стимулировали 10 мкг/мл ФГА (Sigma) и 10 Ед/мл IL-2 (Sigma). Прохождение клеточного цикла контролировали проточной цитометрией. РНК выделяли из первичных Т- клеток с помощью набора RNAzol В (CINNA/BIOTECX Laboratories, Inc. ) как рекомендовано изготовителем. Количественную оценку обратно-транскриптазной ПЦР проводили с помощью последовательных разведений кДНК Т-клеток, полученной после их стимулирования. Количество кДНК в неразведенном образце определяли по тому разведению, при котором мишень уже не амплифицировалась. Несмотря на то, что результаты различных экспериментов при использовании ПЦР согласовывались между собой, эксперименты по разведению показали, что изменения уровней РНК могут быть выявлены только в том случае, если они различаются более чем в четыре раза. Аналогичным образом исследовали образцы Rb+ и Rb- клеточных линий. Актин человека легко определялся и обнаруживался в сходных количествах в каждом образце кДНК (клеточные линии, ткани или Т- клетки).
Соотношение между двумя формами p16-транскрипта существенным образом изменяется по мере прохождения клеточного цикла (Фиг. 16B-C). Первоначально бета-форма обнаруживается в небольших количествах, но через 30-40 часов после стимуляции ее уровень начинает возрастать. В это время уровень экспрессии альфа-формы остается относительно постоянным, возможно незначительно возрастая. Проточная цитометрия показала, что изменение соотношения альфа- и бета-форм коррелирует с выходом клеток из фазы Go и вступлением в S-фазу. Количественную оценку обратно-транскриптазной ПЦР проводили в экспериментах по разведению матрицы. Было установлено, что обратно-транскриптазная ПЦР чувствительна более чем к четырехкратному увеличению уровня транскриптов. По оценкам, индукция бета-формы по крайней мере в десять раз превышала таковую альфа-формы.
Таким образом, по мере того, как Т-клетки вступают в клеточный цикл, в них изменяется относительное содержание двух форм транскрипта p16, так что это соотношение изменяется в сторону бета.
Кроме того, авторы исследовали уровень экспрессии p16 в Т-клетках, проходящих клеточный цикл. Белок выделяли из клеток в различное время после митогенной индукции и анализировали Вестерн-блоттингом. Уровень белка p16 определяли с помощью антител к p16, взаимодействующих с 20 терминальными аминокислотами целого полипептида. По мере выхода клеток из фазы Go содержание в них p16 оставалось относительно постоянным. Таким образом, во время прохождения клеточного цикла уровень транскрипта p16 (альфа-транскрипт) и белка p16 относительно не изменялся. Другими авторами отмечено умеренное увеличение содержания p16 во время S-фазы (Tam et al., 1994b). Авторы изобретения не отмечали накопления p16, что может отражать различия в регуляции p16 в разнообразных типах клеточных линий или же быть обусловлено существованием определенных проблем в выявлении двух- или трехкратного увеличения содержания белка или соответствующей кДНК.
Экспрессия p16 в опухолевых клеточных линиях
Предыдущие исследования позволили предположить, что Rb воздействует на экспрессию p16 (Serrano et al., 1993; Li et al., 1994a; Parry et al., 1995). Авторы изобретения исследовали влияние Rb-статуса клеток на экспрессию мРНК бета-формы (Фиг. 16 D). кДНК получали при использовании набора клеточных линий, пять из которых экспрессировали Rb-белок дикого типа, а в шести обнаруживался нефункциональный Rb-белок (Parry et al.,1995). Как и ожидалось, альфа-транскрипт выявлялся только в Rb-негативных линиях. Тем не менее бета-транскрипт присутствовал как в Rb- положительных, так в Rb-отрицательных линиях. Таким образом, в противоположность альфа-форме экспрессия мРНК бета-формы не зависит от мутационного процесса в гене Rb в опухолевых клеточных линиях.
Существует свидетельство в пользу того, что ген p16 принадлежит к мультигенному семейству (Guan et al., 1995). По аналогии с другими мультигенными семействами, составляющие указанного семейства должны бы отвечать за избыточную функциональную активность, а также за различные функции или же за функции, осуществляемые в различное время в различных тканях.
Таким образом, принимая во внимание низкий уровень белка p16 и очевидное отсутствие регуляции p16 со стороны Rb, можно предположить, что p16 не влияет на регуляцию клеточного цикла в Т-лимфоцитах. Однако поскольку образование бета-транскрипта существенным образом индуцируется при стимуляции Т-клеток и поскольку p16 делетирован в большом проценте опухолей Т-клеточного происхождения (Hebert et al., 1994) представляется вероятным, что p16 играет существенную роль в Т-клетках человека. Значительное влияние Rb на p16 наблюдается только в трансформированных и происходящих из опухолей клеточных линиях. Возможно, p16 регулируется в тканях дикого типа несколько иным образом.
E1-бета представляет собой консервативную и регулируемую область p16
Несмотря на то, что роль бета-транскрипта неясна, результаты исследований
позволяют предположить его важное значение для функционирования p16-локуса по некоторым причинам. Во-первых, E1-бета - это консервативная последовательность в геноме мыши; во-вторых, относительное содержание бета-транскрипта регулируется как на тканеспецифическом уровне, так и в зависимости от стадии клеточного цикла, и, в-третьих, две клеточные линии имеют гомозиготные делеции, которые удаляют E1-бета, но не E1-альфа. Приведенные данные свидетельствуют о том, что E1-бета необходим для функционирования p16 дикого типа.
кДНК бета-формы мыши выделяли и сравнивали с MTS1e1-бета-формой человека. кДНК-клоны мыши получали с помощью модифицированной методики селекции гибридов, называемой захватом гибридов RACE (HCR). Обогащенную поли A + РНК мыши выделяли из тканей тимуса и молочной железы. Первую цепь кДНК в реакции синтеза (Sambrook et al., 1989) получали при использовании случайных олигомеров из 12 нуклеотидов и обратной транскриптазы Superscript II (Bethesda Research Laboratories). После синтеза второй цепи кДНК "заякоривали" лигированием 5'-концов кДНК со специфическим двуцепочечным олигонуклеотидом dsRP.2 (5'-TGAGTAGAATTCTAACGGCCGTCATTGTTC-3' SEQ ID N0:28). 5'-конец второй цепи кДНК был единственным фосфорилированным ДНК-концом в реакции лигирования. После лигирования "заякоренную" кДНК очищали путем фракционирования на колонке с Сефарозой CL-4B. "Заякоренную" кДНК амплифицировали при использовании p16-специфического обратного праймера (5'- AGCGTGTCCAGGAAGCCTTC-3' SEQ ID NO:29) и набора RP.2 (RP.B) (5'-TGAGTAGAATTCTAACGGCCGTCATTG-3' SEQ ID NO:30) с последующим захватом биотинилированного геноспецифического олигонуклеотида (5'ACTGCGAGGACCCCACTACCTTCTCC-3' SEQ ID NO:31) "выше" обратного праймера, использованного в первой амплификации. Захваченную кДНК затем вновь амплифицировали с помощью RP. B и геноспецифического обратного праймера (5'-GAACGTTGCCCATCATCATC-3' SEQ ID NO:32) "выше" олигонуклеотида, используемого при "захвате". Полученный в результате описанных манипуляций продукт очищали электрофорезом в геле, клонировали и секвенировали. P16 олигонуклеотидов мыши определяли путем клонирования и секвенирования геномного клона мыши, который содержал последовательности, слабо гибридизующиеся с пробой на основе E2 человека.
Сравнение бета-транскриптов человека и мыши позволяет предположить, что E1-бета не кодирует белка. Только последовательность рамки считывания p16 в E2 была сильно консервативной. Таким образом, если бета- транскрипт транслируется, представляется вероятным, что синтез белка начинается в E2 и происходит в той же самой рамке считывания, что и p16. Гипотетический полипептид имеет вычисленную молекулярную массу порядка 10 кДа и сохраняет 2 3/4 из четырех шпилечных повторов, присутствующих в p16. Однако p16 содержит только 2 1/2 шпилечных повторов (Hannon and Beach, 1994) и другие белки укладываются и функционируют только с помощью одного или двух повторов. Существует ли молекула p10 in vivo и служит ли она ингибитором Cdk4/6, еще предстоит исследовать.
Функция РНК бета-формы
Если роль бета-транскрипта заключается в ингибировании клеточного роста, то следует ожидать наличия разрывающих E1-бета мутаций в клеточных линиях опухолевого происхождения. Подтверждением этому служит существование двух меланомных линий с делециями, которые удаляют E1-бета, но при этом продолжается образование альфа-транскрипта. В указанных клеточных линиях кодирующая последовательность p16 является последовательностью дикото типа. Тем не менее в 25 исследованных опухолевых клеточных линиях в локусе E1-бета не было найдено незначительных генетических повреждений (например, замен нуклеотидов). Таким образом, трудно заключить, что E1-бета является мишенью гомозиготных делеций. Если E1-бета экзон не кодирует белка, небольших генетических повреждений может оказаться недостаточно для нарушения его функции. Альтернативно, мишенью указанных выше делеций может быть какой-либо другой ген. Например, возможно, что ген p15 (MTS2) служит релевантной мишенью для делеций в упоминаемых выше меланомных клеточных линиях. С этой точки зрения, E1-бета может быть легко делетирован, поскольку он расположен ближе к p15, чем E1-альфа. Однако поскольку авторы изобретения не смогли выявить точечные мутации в гене p15 различных клеточных линий и поскольку они не имели клеточных линий, содержащих делеции, специфически удаляющие p15 (Kamb et al., 1994b), приведенное объяснение выглядит неправдоподобным.
Генетические исследования позволяют предположить, что p16 и Rb являются составляющими системы регуляции роста, которая часто инактивируется при прогрессии опухоли. Если роль бета-транскрипта заключается в негативной регуляции клеточного роста, возможно он входит в состав другой системы, которая мутирует независимо от p16 и Rb. Этим можно объяснить тот факт, что делеции, специфически разрывающие E1-бета, обнаруживаются только в Rb-негативных клеточных линиях. Основываясь на характере экспрессии E1-бета, с большой долей вероятности можно заключить, что E1-бета играет определенную роль в клетках, активно проходящих жизненный цикл. Определенное суждение о значении E1-бета можно будет сделать после исследований его экспрессии in vivo.
Пример 13. Экспрессия мРНК MTS2
РНК выделяли из клеточных линий или первичных Т-клеток с помощью набора RNAzol В (CINNA/BIOTECX Laboratories,Inc.), как рекомендовано изготовителем. кДНК синтезировали при использовании тотальной РНК (Sambrook et al., 1989) с помощью случайно выбранного праймера из девяти нуклеотидов. Выход кДНК определяли по включению альфа-32P-дАТФ (Amersham) в процессе реакции синтеза (0,1 Ки/мМ) с последующим выявлением количества радиоактивного нуклеотида, содержащегося в конечном продукте.
Экспрессию MTS2 определяли при помощи ПЦР с обратными праймерами в двух последовательных раундах амплификации. В первом раунде 2 нг кДНК амплифицировали при использовании E1F (5'TGAGGGTCTGGCCAGC-3' SEQ ID NO:21) и X2. R140' (5'-AGCACCACCAGC-GTGTC-3/SEQ ID NO:22). Реакции амплификации проводили в термосайклере Perkin-Elmer 9600 в течение 20 циклов в следующих условиях: 97oC, 3 с; 65oC, 10 с; 75oC, 20 с. Реакционные смеси разводили в 100 раз и реамплифицировали при использовании E1F и Х2В (5'-CGTGTCCAGGAAGCCC-3' SEQ ID NO:23). Олигонуклеотид Х2В радиоактивно метили по 3'-концу (Sambrook et al., 1989) гамма-32P-дАТФ (DuPont). Условия проведения ПЦР были аналогичны описанным выше, за тем исключением, что проводили 15 циклов. Полученные продукты разделяли электрофорезом в денатурирующем 5%-ном полиакриламидном геле. Высушенные гели экспонировали с пленкой X-Omat (Kodak) в течение ночи.
Экспрессия MTS2 в различных тканях
Обнаружено, что MTS2 экспрессируется во многих типах тканей, включая те, которые дают начало опухолям с гомозиготными делециями MTS2 (см. Фиг.10A). Однако имеются некоторые различия между указанными тканями. Например, в то время как транскрипт MTS2 легко выявляется в ткани легких, он не обнаруживается в тканях предстательной железы и мозга. В противоположность этому, экспрессия близко расположенного гена MTS1 определяется во всех исследованных тканях. Не известно, отражают ли тканеспецифические различия в уровнях РНК MTS2 потребности различных тканей в белке MTS2.
Экспрессия MTS2 по мере прохождения клеточного цикла
Если MTS2 регулирует важные переходные стадии в клеточном цикле, уровень его экспрессии изменяется по мере прохождения клеточного цикла. Например, в нормально делящихся клетках избыточность мРНК p21 варьирует как функция определенной фазы клеточного цикла (Li et al., 1994b). Для того чтобы определить, регулируется или нет транскрипция MTS2 по мере прохождения клеточного цикла, покоящиеся Т-клетки стимулировали ФГА и IL-2 и исследовали на различных этапах после стимуляции (см. Фиг. 10B). Не выявлялось очевидной связи между уровнем экспрессии MTS2 по мере выхода клеток из фазы Go и прохождения их через фазы клеточного цикла. В противоположность этому, как и ожидалось, экспрессия контрольного гена, Cdk4, изменялась (Matsushime et al., 1992). Таким образом, не было обнаружено свидетельства в пользу того, что уровень экспрессии мРНК MTS2 в нормально делящихся клетках по мере прохождения ими клеточного цикла неодинаков.
Предполагается, что белок MTS1 участвует в одном из путей регуляции роста, в котором задействован белок ретинобластомы Rb (Serrano et al., 1993; Guan et al., 1995; Serrano et al., 1995). В недавних работах были получены обстоятельные данные о том, что экспрессия MTS1 контролируется, по крайней мере частично, белком Rb (Li et al., 1994a; Parry et al., 1995). Биохимическое сходство между MTS1 и MTS2 позволяет предположить, что MTS2 также мог бы регулироваться Rb. Указанная возможность была исследована путем сравнения уровней мРНК MTS2 в Rb-позитивных и Rb-негативных клеточных линиях. Не было обнаружено какой-либо корреляции между Rb-статусом и уровнем РНК MTS2 (см. Фиг. 10C). Это позволяет предположить, что Rb-статус клеточной линии не оказывает существенного влияния на избыточность MTS2-транскрипта. Таким образом, в противоположность MTS1, экспрессия MTS2 может не зависеть от Rb.
Пример 14. Эктопическая экспрессия MTS1 и MTS2
При помощи полимеразной цепной реакции с праймером MTS1.F (5'AAA GGA ТСС ATT GCC ACC ATG GAG CCG GCG GCG GGG AGC AGC ATG GAG CCT TCG GCT 3') (SEQ ID NO: 17) и праймером E3.R (5'TTT GAA TTC AAT CGG GGA TGT CTG 3') (SEQ ID NO: 18) был получен фрагмент MTS1 длиной 483 пар оснований. Праймер MTS1.F был сконструирован таким образом, чтобы он содержал сайты рестрикции возле 5'-конца для последующего клонирования, а также консенсусную последовательность Козака (Kozak, 1987).
Матричной ДНК для этой реакции служила кДНК из молочной железы. Полученный фрагмент встраивали в вектор экспрессии pcDNA3 (In Vitrogen), который затем рестрицировали Eco RI и Bam HI. Вектор pcDNA3 содержит цитомегаловирусный промотор (CMV) и несет гены устойчивости к ампициллину и неомицину. Полученный рекомбинантный вектор pcDNApl6 при помощи электропорации был введен в клетки линии HS294T. Клетки HS294T получены из меланомы и имеют гомозиготную делецию как MTS1, так и MTS2. Клетки HS294T выращивали на среде DMEM (Gibco) с добавлением 10% эмбриональной телячьей сыворотки, не-необходимых аминокислот, пирувата натрия и L-глутамата. Клетки выращивали при 37oC в атмосфере 5% CO2. Клетки HS294T котрансформировали в соотношении 1:4 вектором pSS (Stratagene), сообщающим клеткам устойчивость к гигромицину, и вектором экспрессии pcDNA3 (Invitrogen), содержащим кодирующую последовательность MTS1 под контролем CMV промотора, или же вектором pcDNA3 без вставки.
Кодирующая область MTS2 была аналогичным образом клонирована в вектор pcDNA3 с образованием последовательности Козака и полученный рекомбинантный вектор pcDNApl5 был введен в клетки HS294T. В этих опытах использовали кДНК MTS2, полученную, как описано в Примере 13. Плазмида pSS (Stratagene), содержащая селективный маркер устойчивости к гигромицину, использовалась для котрансфекции с pcDNApl6 или pcDNAl5. Эту плазмиду в количестве 20 мкг на кювету добавляли при электропорации. Условия электропорации были следующими: 800 мкл суспензии клеток в концентрации 1,5 миллиона клеток в миллилитре; емкость конденсатора - 500 микрофарад; напряжение - 400 вольт. В контрольных экспериментах использовали смесь плазмид pcDNa3 и pSS. Электропорированные клетки (около 400 мкл) засевали на чашки Петри в среде с гигромицином (300 мкг/мл). Колонии (фокусы) подсчитывали на 14-й день. Результаты представлены в Табл. 9.
При введении в клетки HS294T конструкции, содержащей кодирующую последовательность MTS2 под контролем CMV промотора, образование колоний снижалось в семь раз, что сравнимо по эффекту с эктопической экспрессией MTS1. Этот результат показывает, что эктопической экспресии MTS2 достаточно для ингибирования роста клеток. Неясно, остановлены ли трансформированные клетки в G1- фазе, что явилось бы результатом эктопической экспресии MTS1, или же их рост остановлен другим образом. Из данных Табл. 9 можно заключить, что экспрессия p15 или p16 в клеточной линии, в которой до трансформации p15 или p16 не экспрессировались (в силу гомозиготной делеции), ингибирует рост клеток. Точный механизм этого явления неясен, но возможно, что экспрессия p15 или p16 останавливает клеточное деление или убивает клетку. Данные результаты свидетельствуют о действии p15 и p16 in vivo как белков-супрессоров опухолей bona fide и указывают на их возможное терапевтическое использование.
По многим причинам MTS2 является привлекательным кандидатом в качестве гена-супрессора опухолей. Он обладает значительным сходством по последовательности с MTS1, связывается с CDK и ингибирует их действие in vitro, а эктопическая экспрессия MTS2 ингибирует рост клеток in vivo. Данные результаты указывают на возможность того, что несмотря на биохимическое сходство между MTS2 и MTS1, функции этих двух белков in vivo могут существенно различаться. Две особенности MTS2 указывают на это: MTS2, а не MTS1 индуцируется TGF-beta (Hannon and Beach, 1994) и 2) в отличие от MTS1, транскрипция MTS2 не зависит от Rb. Возможно, что MTS2 вообще не участвует в туморогенезе. Напротив, MTS2 может участвовать в супрессии опухолей иным образом, чем MTS1. Составляющие этого процесса неизвестны, но можно полагать, что некоторые из них могут мутировать со значительно более высокой частотой, нежели MTS2 в соматических тканях.
Таким образом, отсутствие соматических мутаций MTS2 не исключает его важной роли в супрессии опухолей. Как указывалось выше, эктопическая экспрессия MTS2 ингибирует рост клеток, что совместимо с ролью MTS2 как опухолевого супрессора. Постоянный уровень экспресии MTS2 в ходе клеточного цикла, его индукция TGF-beta указывает на значение MTS2 в остановке G1 и необязательно на его участие в определении времени других событий клеточного цикла. Наоборот, регуляция экспрессии MTS1 посредством Rb указывает на возможную роль MTS1 как осциллятора клеточного цикла. Важно изучить in vivo функцию MTS2 как регулятора роста и установить способы его действия.
Пример 15. Двухступенчатый анализ присутствия MTS в пробе
Пробу ДНК больного обрабатывали согласно методу, описанному Antonarakis et al. (1985). ДНК фракционировали электрофорезом в 1%-ном геле агарозы и переносили на нейлоновый фильтр (Southern blot). ДНК "пришивали" к фильтру с помощью ультрафиолетового облучения при 150 mJ (GS Gene Linker, Bio-Rad).
Пробу MTS, соответствующую нуклеотидам 448-498 последовательности SEQ ID NO: 4, субклонировали в вектор pTZ18U. Фагемидами трансформировали клетки E. coli штамма MV1190, инфицированные фагом-помощником М13КO7 (Bio-Rad, Richmond, CA). Одноцепочечную ДНК выделяли стандартным методом (см. Sambrook, et al., 1989).
Блоты прегибридизовали 15-30 мин при 65oC в 7%-ном SDS в 0,5 М NaPO4. Использованные далее методы описаны Nguyen et al., 1992. Блоты гибридизовали в течение ночи при 65oC в 7%-ном SDS, 0,5 М NaPO4 с 25-50 нг/мл одноцепочечной ДНК-пробы. После гибридизации фильтры отмывали два раза по 30 мин в 5%-ном SDS, 40 мМ NaPO4 при 65oC и затем два раза по 30 мин в 1%-ном SDS, 40 мМ NaPO4 при 65oC.
Затем блоты ополаскивали в фосфатном буферном растворе (PBS, pH 6,8) в течение 5 мин при комнатной температуре и инкубировали в 0,2%-ном растворе казеина в PBS при комнатной температуре, а затем ополаскивали в PBS 5 мин. Затем следовала преинкубация 5-10 мин на качающейся водяной бане при 45oC с гибридизационным буфером следующего состава: 6M мочевина, 0,3 М NaCl и 5х раствор Денхардта (Sambrook et al., 1989). Буфер удаляли и заменяли свежим гибридизационным буфером (из расчета 50- 75 мкл на квадратный сантиметр фильтра), содержащим 2,5 нМ ковалентно связанного конъюгата олигонуклеотид-щелочная фосфатаза с нуклеотидной последовательностью, комплементарной универсальному праймерному сайту (UP-AP, BioRad). Гибридизация продолжалась 20-30 мин при 45oC, а после гибридизации блоты отмывали два раза по 10 мин в 6М мочевине, 1х стандартном цитратном растворе (SSC), 0.1% SDS при 45oC и один раз в течение 10 мин в 1х SSC, 0,1% Triton Х-100. Затем блоты ополаскивали 10 мин при комнатной температуре в 1х SSC.
Блоты инкубировали 10 минут при комнатной температуре при покачивании в субстратном буфере, состоящем из 0,1 М диэтаноламина, 1 мМ MgCl2, 0,02% азида натрия, pH 10,0. Отдельные фильтры помещали в запаиваемые пакеты с субстратным б у ф е р о м и 0.2 М А М P P D (3-(2'-спироадамантан)-4-метокси-4-(3'-фосфорилокси)фенил-1,2-диоксиэтан, двунатриевая coль, Bio-Rad). После 20 мин инкубации при комнатной температуре при покачивании, избыток раствора AMPPD удаляли. Блоты экспонировали с рентгеновской пленкой в течение ночи. Положительные полосы указывали на присутствие MTS.
Пример 16. Получение поликлональных антител против MTS
Сегменты кодирующей последовательности MTS экспрессировали в E.coli в виде слитого белка. Суперэкспрессированный белок очищали элицией из геля и использовали для иммунизации кроликов и мышей согласно протоколу, аналогичному описанному Harlow и Lane, 1988. Показано, что при таком способе иммунизации также образуются антитела и против различных других белков (см., например, Kraemer et al., 1993).
Кратко, фрагмент кодирующей последовательности MTS был клонирован в виде слитого белка в плазмиде РЕТ5A (Novagen Inc., Madison, WI). Клонированная последовательность MTS включала аминокислоты 448-498 последовательности SEQ ID NO:4. После индукции IPTG суперэкспрессия слитого белка с ожидаемой молекулярной массой была подтверждена методом SDS/PAGE. Белок выделяли из геля электроэлюцией. Идентификация белка как слитого продукта MTS была подтверждена белковым секвенированием с N-конца. Затем очищенный белок использовали для иммунизации кроликов. Животных иммунизировали 100 мкг белка в полном адъюванте Фрейнда и бустировали дважды с 3-недельными интервалами, первый раз 100 мкг иммуногена в неполном адъюванте Фрейнда, а второй - 100 мкг иммуногена в PBS. Содержащую антитела сыворотку собирали через две недели.
Согласно этому же протоколу получали антитела против мутантных форм MTS. Эти антитела вместе с антителами к MTS дикого типа использовали для обнаружения и определения относительного уровня мутантных форм в различных тканях и биологических жидкостях.
Пример 17. Получение моноклональных антител, специфичных по отношению к MTS
Моноклональные антитела получали согласно следующему протоколу. Мышей иммунизировали иммуногеном, состоящим из интактного MTS или пептидов MTS (мутантного или дикого типа), конъюгированного при помощи глутарового альдегида или EDC с гемоцианином моллюска фиссуреллы. Иммуноген смешивали с адъювантом. Каждой мыши вводили четырежды от 10 до 100 мкг иммуногена и после четвертой инъекции брали пробы крови для определения наличия антител к иммуногену в сыворотке. Титр сыворотки определяли с помощью ELISA или RIA. Мышей, в сыворотке крови которых были обнаружены антитела к иммуногену, отбирали для получения гибридом.
У иммунных мышей забирали селезенки и приготавливали из них одноклеточные суспензии (см. Harlow and Lane, 1988). Слияние клеток проводили, как описано Kohler и Milstein, 1975. Клетки миеломы P3.63.3 (Американская коллекция культур клеток, Rockville, MD) сливали с иммунными спленоцитами при использовании полиэтиленгликоля, как описано Harlow and Lane, 1988. Клетки засевали по 200 000 на лунку в 96-луночные культуральные планшеты. Супернатанты из тех ячеек, в которых был отмечен рост гибридных клеток, проверяли на наличие MTS-специфических антител при помощи ELISA или RIA с мутантным MTS или MTS дикого типа. Клетки из положительных ячеек подращивали и субклонировали для подтверждения моноклональности.
Клоны желаемой специфичности размножали и культивировали в виде асцитов в организме мышей или же на системах с полыми волокнами для получения количеств антител, достаточных для их характеристики и разработки теста.
Пример 18. Сэвдвич-метод для выявления MTS
Моноклональные антитела адсорбируют на твердофазном носителе (планшеты, пробирки, бусы или микроносители). Предпочтительно адсорбировать антитела на поверхности лунок 96-луночных планшетов для ELISA. Образец материала (сыворотка, моча, тканевой цитозоль) объемом 100 мкл, содержащий пептид/белок MTS (дикого типа или мутантный), добавляют к антителам, связанным на твердофазном носителе. Образцы инкубируют 2 часа при комнатной температуре. Затем образцы декантируют, а твердофазный носитель промывают буфером для удаления несвязавшегося материала. Затем к твердофазному носителю добавляют вторые антитела (к другой детерминанте пептида/белка MTS) в объеме 100 мкл. Вторые антитела, обычно меченные 125-1, ферментом, флуорофором или хромофором, наносят на твердую фазу и инкубируют 2 часа при комнатной температуре. Затем вторые антитела удаляют и твердую фазу промывают буфером для удаления несвязавшегося материала.
Определяют количество связавшейся метки, которое пропорционально количеству пептида/белка MTS, присутствующему в пробе. Отдельные определения проводят с использованием моноклональных антител, специфичных по отношению к MTS дикого типа, так же как и с моноклональными антителами, специфичными по отношению к MTS каждого мутантного типа.
Следует понимать, что охарактеризованные методы и композиции могут быть использованы в различных воплощениях заявленного изобретения, только часть из которых раскрыта в данном описании. Специалисту ясно, что могут иметь место другие воплощения изобретения, не изменяющие его сущности. Таким образом, приведенные примеры являются иллюстративными и не могут рассматриваться как ограничивающие заявленное изобретение.










































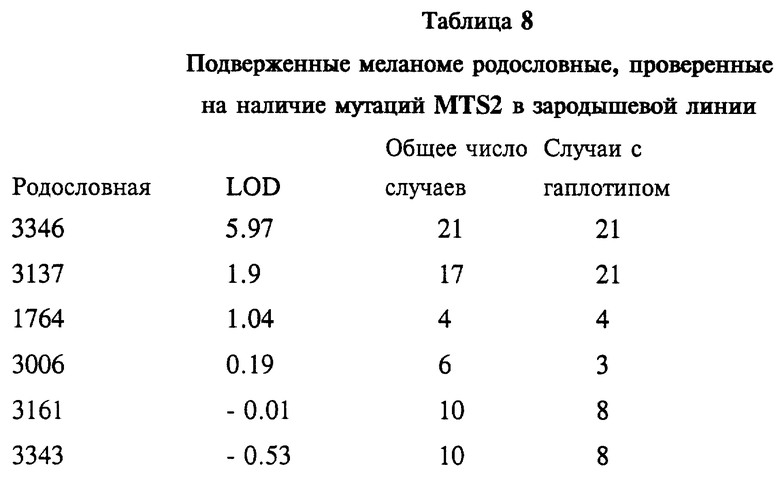

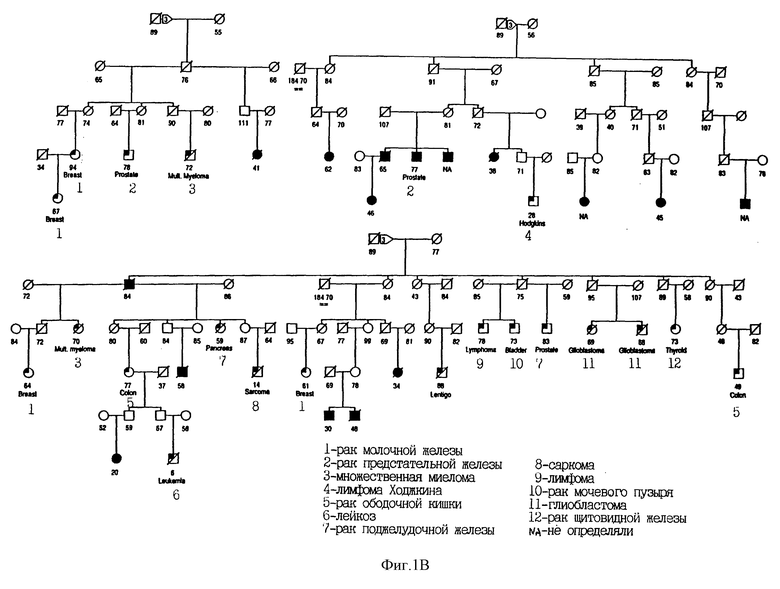
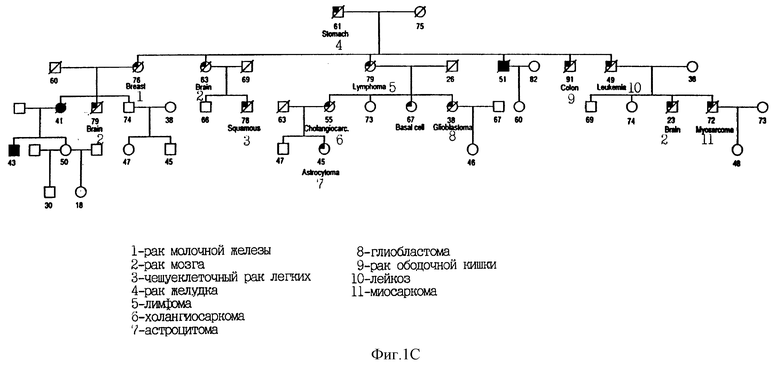
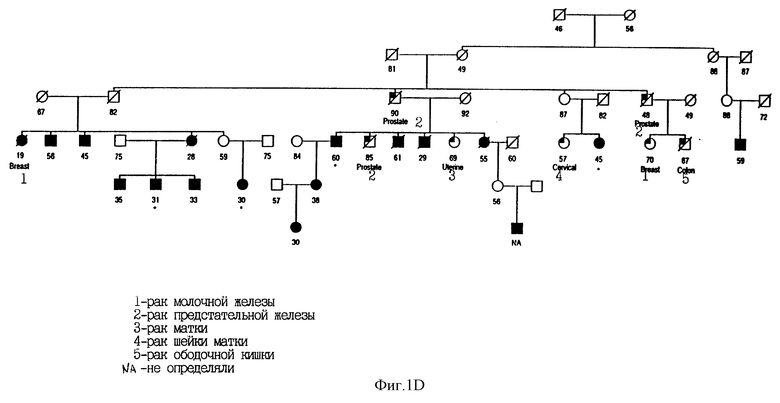
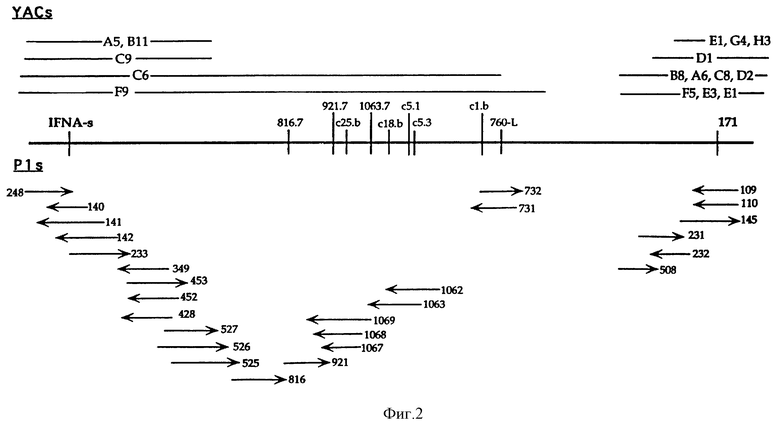
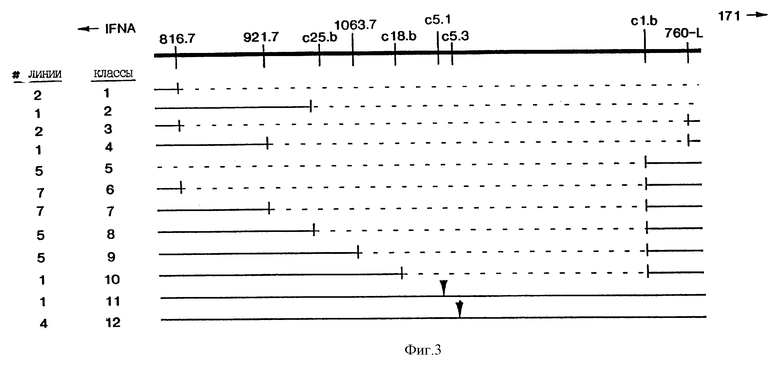
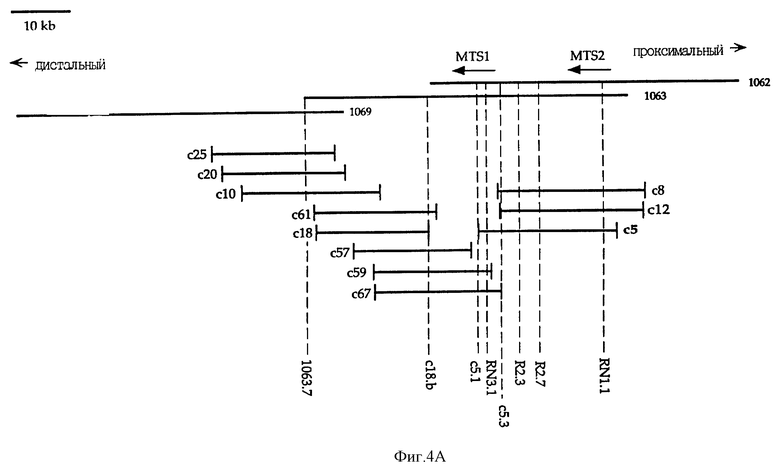
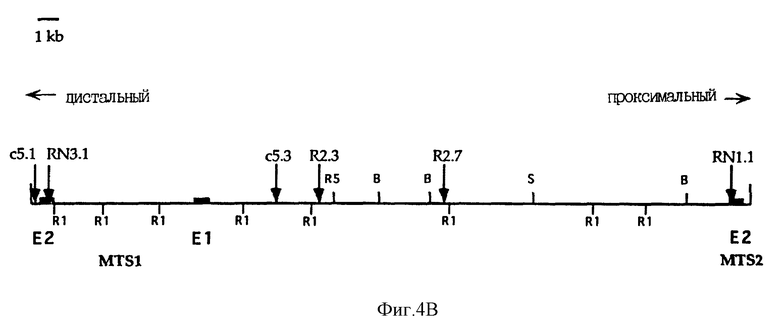


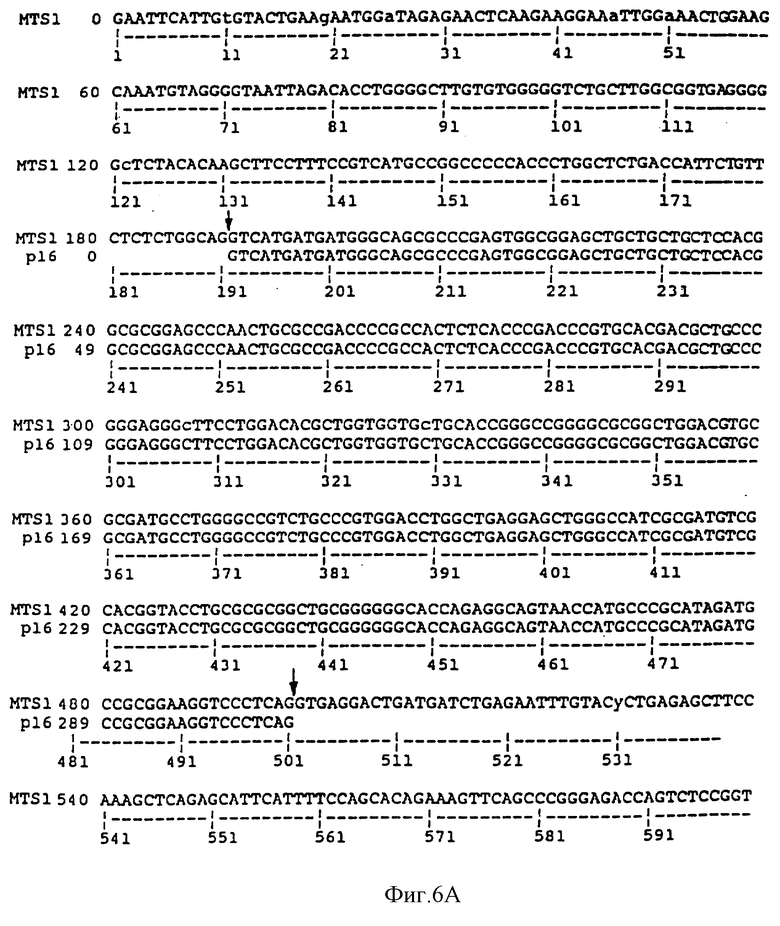
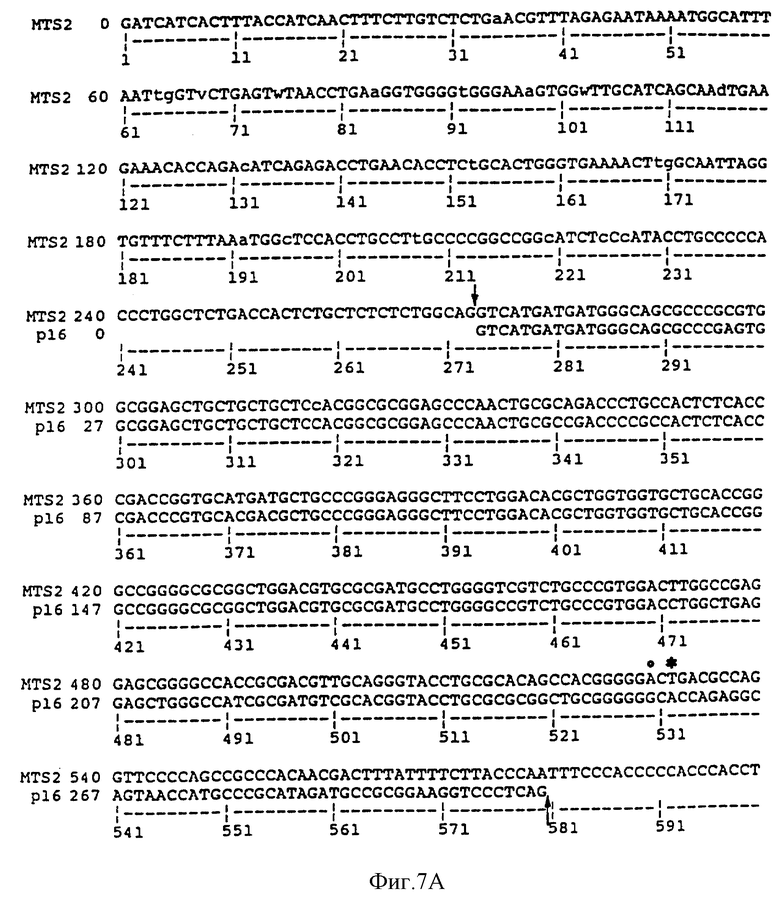

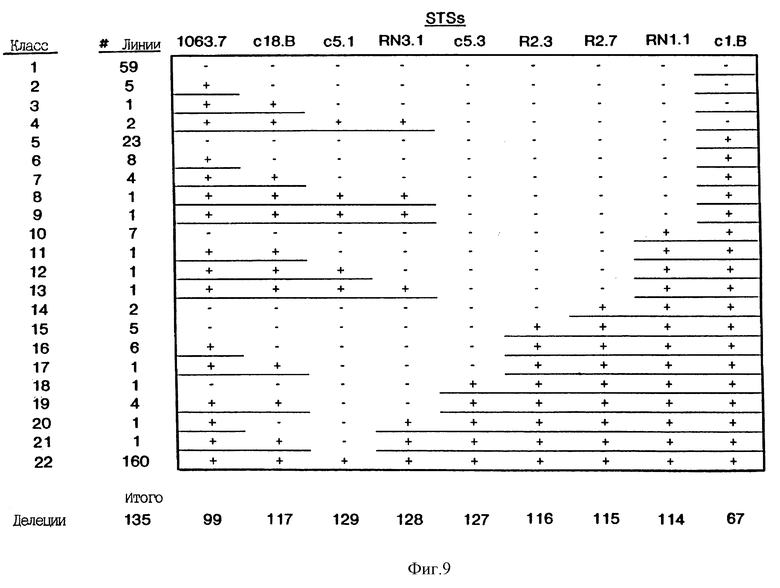




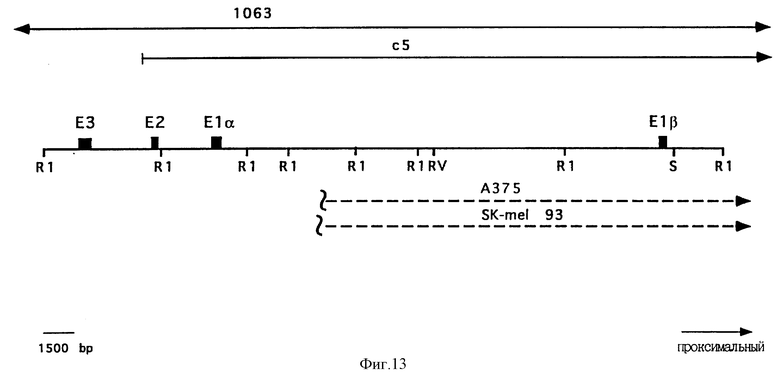
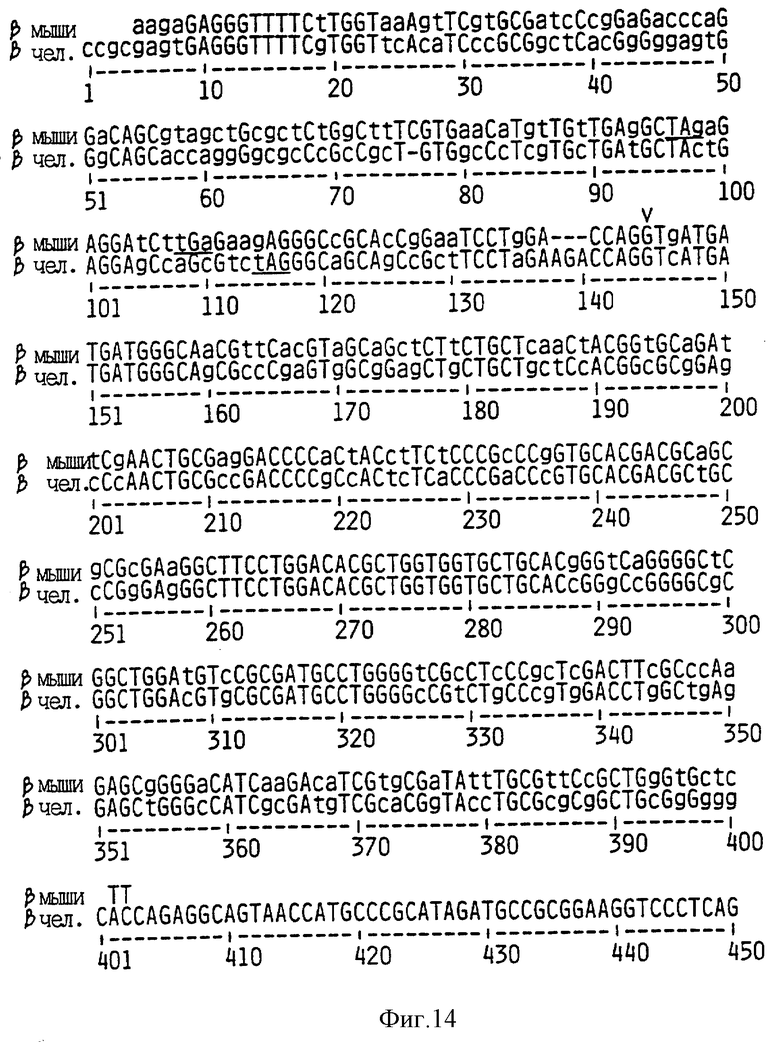
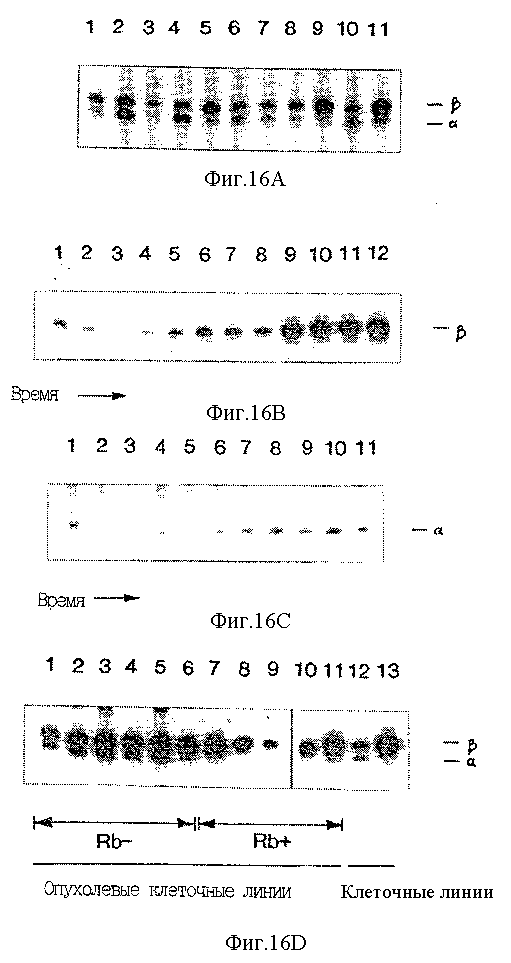

Изобретение относится к области медицины, а именно к соматическим мутациям в гене многофункционального опухолевого супрессора (MTS) в случае неоплазий человека и использованию этих мутаций для диагностики и прогнозирования онкологических заболеваний. Изобретение также относится к мутациям гена MTS в зародышевой линии и использованию данных мутаций для диагностики предрасположенности к таким формам рака, как меланома, окулярная меланома, лейкоз, астроцитома, глиобластома, лимфома, глиома, лимфома Ходжкина, множественная миелома, саркома, миосаркома, хлоангиосаркома, чешуеклеточная карцинома, хронический лимфоидный лимфолейкоз (CLL), а также опухоли поджелудочной железы, яичников, матки, семенников, почек, желудка, ободочной и прямой кишки. Изобретение также имеет отношение к терапии тех неоплазий человека, при которых произошла мутация в гене MTS, включая генотерапию, заменяющую белковую терапию и использование миметиков. Техническим результатом изобретения является расширение арсенала средств диагностики и терапии опухолей. 14 с. и 39 з.п. ф-лы, 17 ил., 9 табл.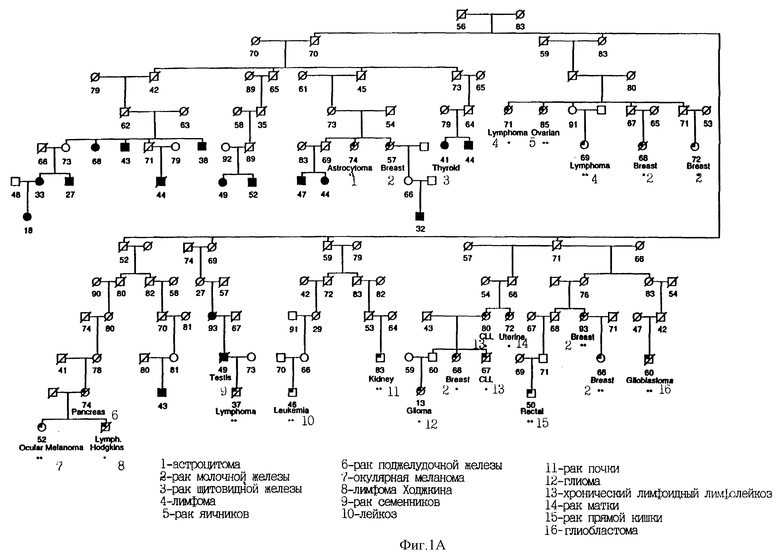
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Lewin Oncogenic conversion by regolatory chenges ....Cell | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| Автоматический тормоз к граммофону | 1921 |
|
SU303A1 |
| Adams et al | |||
| Transgenic model of tumor development | |||
| Science | |||
| Циркуль-угломер | 1920 |
|
SU1991A1 |
Авторы
Даты
2001-03-27—Публикация
1995-03-17—Подача