Настоящее изобретение относится к области биотехнологии и медицины, в частности к области лабораторной диагностики онкологических заболеваний, и описывает способ получения, выделения и способ детекции нового белка - маркера эпителиальных видов рака, что может быть использовано для ранней диагностики злокачественных новообразований эпителиального генеза. Конкретно, изобретение относится к использованию генетических и/или белковых маркеров для выявления рака, и еще более конкретно для использования генетических и/или белковых маркеров для применения в диагностике эпителиальных видов рака, в частности, выявления различных карцином молочной железы, предстательной железы, карцином желудка, карциномы легкого, карциномы яичников и карциномы кишки.
Изобретение позволяет получить новый опухолеспецифичный антиген для выявления злокачественных опухолей эпителиальных тканей, описывает способ получения, способ выделения и способ детекции белка-маркера эпителиальных видов рака, содержащий полисахаридный фрагмент, который образуется на поверхности переродившихся эпителиальных раковых клеток в результате специальной обработки биологического материала, который может использоваться для выявления злокачественных заболеваний эпителиального генеза. Согласно способу получения, новый белок - маркер эпителиальных видов рака образуется при подвергании биологических жидкостей пациентов (крови, или слюны) или опухолевых экстрактов последовательно специальной термической обработке и использовании кислой среды с низкой рН. Изобретение также относится к диагностическим способам и наборам и описывает способ детекции маркера.
Указанный раковый антиген представляет собой семейство N-гликопротеинов, обладающих идентичным N-гликозилированием, с молекулярной массой 55-85 кДа, который образуется в сыворотке пациентов на мембранной поверхности переродившихся раковых клеток эпителия в результате температурной обработки в диапазоне нагревания 50-65°С и создания кислой среды с низким значением рН в диапазоне от рН 2,5-5,0. Неопластические клетки не только продуцируют, но и поглощают Альфа-фетопротеин (АФП) в процессе ангиогенеза, для чего используется поверхностные гликопротеины с M.W. 55-85 кДа, с которыми АФП находится в постоянном взаимодействии. В нативном состоянии гликопротеин с M.W. 55-85 кДа не является дифференцировочным антигеном эпителиальных опухолей, а свою уникальную способность к дифференцировке здоровых клеток эпителия от клеток опухолей эпителиальной ткани, претерпевшей опухолевую трансформацию, приобретает лишь в процессе химических преобразований, являющихся результатом (или вызванных) описанной в данном изобретении обработки. В отличие от гемобластозов, опухоли эпителиальных тканей в процессе перерождения поэтапно теряют свою дифференцировку благодаря разрушению связей с микроокружением опухоли, что приводит к разной степени утраты дифференцировки клеток, вплоть до эпителиально-мезенхимального перехода с образованием опухолевых стволовых клеток и ре-экспрессии эмбриональных антигенов. Эпителиальные опухолевые клетки выделяют в кровь растворимую фракцию гликопротеина с M.W. 55-85 кДа, которая в результате описанной в данном изобретении обработки позволяет количественно измерить раковый антиген, что может быть использовано в качестве диагностического метода для раннего выявления эпителиальных карцином, скрининга пациентов группы риска и для мониторинга лечения эпителиального рака. Измерение уровня ракового антигена может проводиться наряду с другими инструментальными методами диагностики (УЗИ, Рентгенография, МРТ).
Рак - это злокачественное заболевание, начинающееся с мутации клеток и приводящее к тому, что атипичные клетки начинают бесконтрольно делиться и распространяться по всему организму, поражать различные ткани и органы, нарушать их нормальное функционирование. Рак является одной из основных причин заболеваемости и смертности во всем мире. Согласно Всемирной организации здравоохранения (WHO) около 40% людей в какой-то период своей жизни будут диагностированы раком, при этом около 40% заболевших умрет от этого заболевания.
Одной из главных причин недостаточной эффективности существующих в настоящее время методов лечения рака является то, что, как правило, рак выявляется уже на поздних стадиях, когда процент излечения минимальный. Раннее выявление злокачественных новообразований является главным фактором, определяющим общую выживаемость пациентов, больных раком, включающих рак эпителиальных тканей. При обнаружении рака у пациента на I стадии заболевания 5 - летняя выживаемость составляет около 90%, по сравнению с 12% для пациентов, диагностированных на IV стадии, которая является прогрессивной фазой заболевания. В отличие от распространенных или метастатических форм рака, ранние стадии злокачественных новообразований достаточно успешно поддаются лечению. Основной проблемой является большая сложность выявления ранних стадий рака, так как они протекают без каких-либо симптомов и клинических проявлений. Это приводит к более позднему выявлению онкологических патологий и задержке в лечении, когда клинический прогноз неблагоприятен и вызывает высокую смертность пациентов.
В связи со всем вышесказанным Всемирная Организация Здравоохранения (WHO) и Международная организация по контролю рака (IUCC) сделали раннюю диагностику рака приоритетной задачей врачей и ученых всего мира, поскольку максимальная выживаемость больных раком может быть достигнута только при выявлении самых ранних стадий болезни. В настоящий момент одним из способов раннего диагностирования онкологических заболеваний является выявление специфических биомолекул, так называемых "онкомаркеров", в биологических образцах, включающих кровь, слюну, тканях костного мозга или в опухолевой ткани, образующейся в процессе развития новообразования. Идентификация онкомаркеров в биологических жидкостях больного может обеспечить ценный подход для ранней диагностики рака, что приведет к раннему выявлению рака, своевременному лечению и, как результат, к улучшению прогноза. Кроме ранней диагностики рака, опухоль-ассоциированные маркеры могут использоваться в качестве аналитических инструментов для мониторинга прогрессирования заболевания, выявления рецидивов и мониторинга эффективности химиотерапии, радиотерапии или хирургического лечения. Однако большинство известных к настоящему времени онкомаркеров являются тканеспецифичными и не обладают при этом высокой чувствительностью при выявлении самых ранних стадий рака.
Например, наиболее часто используемые маркеры рака молочной железы СА 15-3 и рака простаты ПСА, рака желудка СА 19-9, СА 72-4 и раково-эмбрионального антигена (РЭА) обнаруживают от 20 до 60% опухолей разной степени распространенности, при этом лишь от 5 до 20% ранних стадий рака.
Таким образом, существующие онкомаркеры пропускают много случаев злокачественных новообразований, особенно на ранних стадиях их развития, что приводит к большому количеству ложноотрицательных результатов, которые не позволяют своевременно выявить рак и назначить эффективное лечение.
Новый ассоциированный с опухолями эпителиальных тканей раковый антиген, N-гликопротеин может в различной степени образовываться и выявляться в тканях этих опухолей, а также в различных биологических жидкостях человека (включая кровь и слюну) согласно способу, описанному в данном изобретении. Выявление маркера для эпителиальных карцином может быть использовано независимо в качестве уникального маркера для определения злокачественных новообразований эпителиального генеза, или в сочетании с другими известными опухолевыми маркерами для создания новых характерных диагностических инструментов для применения в ранней диагностике эпителиального рака.
Данное изобретение обеспечивает новый способ детекции опухолей эпителиальных тканей, включающих карциному молочной железы, карциному предстательной железы, карциному кишки, карциному легкого и карциному яичников, с использованием описываемого ракового антигена, карцином-специфичного маркера.
Суть данного изобретения состоит в том, что оно позволяет получить и выделить новый раковый антиген, маркер для эпителиальных видов рака, с использованием способа, включающего его термообработку и создания кислой среды, в крови бессимптомных онкологических больных, пациентов с местно-распространенными и метастатическими формами рака, что позволит детектировать (измерять) повышенный уровень его экспрессии в самом начале роста опухоли и выявить начало онкогенеза в организме человека еще до появления признаков наличия заболевания.
Способ получения ракового антигена, маркера эпителиальных видов рака, включает в себя: (а) получение образцов крови, опухолевой ткани, культуры раковых клеток, ткани костного мозга, слюны пациентов с подозрением на наличие злокачественных новообразований эпителия; (б) использование термического воздействия в диапазоне нагревания от 50 до 65°С на биологические жидкости пациентов (кровь, слюну) или суспензии опухолевых клеток; (в) использование кислой среды с низким значением рН в диапазоне от 2 до 5. Предварительные исследования показали, что указанный раковый антиген образуется при подвергании биологических жидкостей пациентов (крови или слюны) или опухолевых экстрактов последовательно специальной термической обработке и использовании кислой среды с низким значением рН. В нативном состоянии гликопротеин с M.W. 55-85 кДа не является дифференцировочным антигеном эпителиальных опухолей, а свою уникальную способность к дифференцировке здоровых клеток эпителия от клеток, претерпевших опухолевую трансформацию, приобретает лишь в процессе химических преобразований, являющихся результатом описанной в данном изобретении обработки. Исследованные нами образцы сыворотки крови пациентов, имеющих онкологические заболевания, и образцы сыворотки крови от контрольной группы здоровых людей, не имеющих злокачественные опухоли, не имеют отличий до использования способа, указанного в данном изобретении. Различие между образцами от здоровых людей и пациентов с онкологическими заболеваниями проявляется только после проведения обработки, описанной в данном изобретении. Согласно способу получения, исходный белковый комплекс подвергается гидролизу, при котором происходящие конформационные изменения белков и разрушение межмолекулярных связей приводят к образованию активной полисахаридной антигенной детерминанты, которая представляет собой новый раковый антиген. Указанный в изобретении раковый антиген содержит полисахаридный фрагмент с несколькими разветвленными фукозилированными антеннами и связан с белковой частью молекулы углеводородной связью через амидный азот аспарагина.
Способ выделения ракового антигена, маркера эпителиальных видов рака, с M.W. 55-85 кДа, включает в себя: (а) получение суспензии раковых клеток; (б) обработку суспензии клеток и получение клеточного экстракта; (в) выделение и очистку ракового антигена из клеточного экстракта методом иммуноаффинной хроматографии с использованием нативного свиного альфа-фетопротеина. Наши предварительные исследования показали, что использование рекомбинантного АФП человека и (или) свиньи не имеет специфического связывания с раковым антигеном и поэтому не может быть использовано для очистки указанного ракового антигена с помощью аффинной иммунохроматографии.
Последние два десятилетия АФП рассматривался в качестве перспективной молекулы-носителя противоопухолевого таргетного препарата, которую можно было бы использовать для специфического нацеливания на злокачественную опухоль. Как нативный, так и рекомбинантный АФП использовались в качестве векторов для доставки различных цитотоксических агентов и растительных токсинов к опухолевым клеткам (1, 2) Присутствие рецепторов АФП в злокачественных опухолях позволяет поражать их различными комплексами АФП и различными токсическими веществами. Однако, в другой работе нами было показано, что только нативный свиной АФП обеспечивает специфичность, необходимую для таргетных препаратов (3) Примером является AIMPILA, лекарственная форма для перорального применения, содержащая композицию нековалентного комплекса свиного АФП и агента, вызывающего апоптоз атрактилозида. Препарат предназначен для специфической доставки атрактилозида к раковым клеткам через рецепторы АФП на их поверхности (4).
Способ детекции ракового антигена для выявления пациентов с онкологическими заболеваниями эпителиального генеза по сравнению с контрольной группой здоровых людей заключается в:
(а) получении образцов крови, опухолевой ткани, культуры раковых клеток, ткани костного мозга, слюны пациентов с подозрением на наличие злокачественных новообразований эпителия;
(б) получении образцов крови, слюны от контрольной группы здоровых людей, не имеющих злокачественные опухоли;
(в) способе получения нового маркера эпителиальных видов рака, образующегося на поверхности раковых клеток эпителиального генеза;
(г) если уровень экспрессии маркера эпителиальных видов рака в обозначенных образцах в (а) превышает уровень экспрессии маркера эпителиальных видов рака в (б), то результат означает высокую вероятность наличие эпителиального рака.
При этом, набор для диагностики эпителиальных видов рака содержит: а) реагент захвата указанного ракового антигена, который может представлять собой олигонуклеотид или антитело, специфичное для особой последовательности N-полисахаридов указанного ракового антигена, самого белка или пептида белка; б) детектирующий реагент, способный обнаруживать указанный раковый антиген, связанный с указанным реагентом захвата, при его взаимодействии с указанным; в) детектирующий реагент, способный обнаруживать указанный раковый антиген, связанный с указанным реагентом захвата, может представлять собой люминесцентную, био-люминесцентную, ферментную, флуоресцентную, или радиоактивную метку, присоединенную к выделенному в чистом виде антигену.
Детали данного изобретения описывают способы получения и способы очистки нового ракового антигена, маркера эпителиальных видов рака, образующегося на поверхности раковых клеток эпителиального генеза в результате описанного способа обработки, которые могут обеспечить раннее выявление рака, а также снизить количество ложноположительных и ложноотрицательных результатов измерений. Изобретение также касается способа определения наличия и/или концентрации ракового антигена, для раннего выявления рака, посредством выполнения иммуноанализа любого типа (прямого или конкурентного связывания «антиген-антитело», или сэндвич-анализа с использованием антитела, имеющего иммунологическую реактивность против указанного антигена, и может быть использовано в медицине.
Изобретение также касается набора для диагностики рака, включающего указанный раковый антиген и антитела против указанного антигена.
Белки, которые секретируются раковыми клетками или находятся на поверхности мембраны перерожденных клеток, независимо друг от друга или в комбинации друг с другом, могут быть использованы в качестве маркеров сыворотки, опухолевой ткани, ткани костного мозга или жидкости организма для выявления рака или в качестве маркеров для мониторинга прогрессирования установленного злокачественного заболевания.
Обнаружение таких белковых маркеров может быть осуществлено с использованием способов, известных в данной области техники, и включает использование моноклональных антител, поликлональных антисывороток и тому подобного. Однако большинство известных к настоящему времени онкомаркеров являются тканеспецифичными и не обладают при этом высокой чувствительностью при выявлении самых ранних стадий рака. Результаты опубликованных клинических исследований с использованием широко распространенных онкомаркеров показывают, что они не обладают высокой чувствительностью и пропускают много случаев злокачественных новообразований, особенно на ранних стадиях их развития, что приводит к большому количеству ложноотрицательных результатов, которые не позволяют своевременно выявить рак и назначить эффективное лечение.
В отличие от широко распространенных опухолевых маркеров, новый раковый антиген, ассоциированный с опухолями эпителиальных тканей с самого начала онкогенеза, в результате описанного в данном изобретении способа обработки в различной степени образуется на мембранной поверхности этих опухолей, а также с кровотоком попадает в кровь онкобольных, что позволяет использовать описываемый раковый антиген в качестве уникального маркера для определения злокачественных новообразований эпителиального генеза на ранней стадии развития эпителиального рака.
В частности, настоящее изобретение предусматривает способ определения наличия и/или концентрации ракового антигена, маркера эпителиальных видов рака, включающий в себя:
(i) предоставление биологического образца;
(ii) обработку биологических жидкостей пациентов (крови, слюны) или опухолевых экстрактов последовательно термическим воздействием в диапазоне температур от 50 до 65°С и использованием кислой среды с низким значением рН;
(iii) определение уровня экспрессии белка-маркера эпителиальных видов рака в указанном образце.
В одном аспекте избыточная экспрессия белка-маркера эпителиальных видов рака у пациента является показателем того, что у пациента с большой вероятностью имеется в наличии рак эпителия.
Для определения уровня экспрессии ракового антигена, характерного для эпителиальных видов рака, может быть использован любой подходящий метод детекции, включающий иммуноферментный анализ, иммунохемилюминесцентный анализ, флуоресцентный анализ, или иммуно-химический анализ, с использованием характерной N-гликозидной последовательности полисахаридов, или комплементарного по большей части последовательности полисахаридов указанного ракового антигена, определяющие уровень ракового антигена, например, используя антитело, направленное против указанного ракового антигена для эпителиальных видов рака. Для определения концентрации указанного ракового антигена можно использовать любое подходящее антитело, при этом оно может быть моноклональным антителом или поликлональной антисывороткой. Способ определения концентрации ракового антигена может быть осуществлен с использованием метода иммуноанализа любого типа (прямого или конкурентного связывания, или сэндвич-анализа), или с использованием чипа антител. Настоящее изобретение также предусматривает набор для обнаружения ракового антигена, содержащее: захватывающий реагент указанного ракового антигена и детектирующий реагент, связанный с подложкой, способный обнаруживать указанный раковый антиген, связанный с указанным реагентом захвата.
Реагент захвата указанного ракового антигена может представлять собой олигопептид или антитело, специфичное для N-гликановой последовательности полисахаридов указанного ракового антигена, самого белка или пептида белка.
Детектирующий реагент, способный обнаруживать указанный раковый антиген, связанный с указанным реагентом захвата, может представлять собой люминесцентную, биолюминесцентную, ферментную, флуоресцентную, или радиоактивную метку, присоединенную к выделенному в чистом виде антигену.
Данное изобретение описывает способ раннего выявления эпителиальных видов рака на основе количественного определения концентрации ракового антигена, специфичного для эпителиальных видов рака, включающий в себя:
(а) получение образцов крови, опухолевой ткани, ткани костного мозга, слюны или мочи пациентов с подозрением на наличие злокачественных новообразований эпителия;
(б) обработку биологических жидкостей пациентов (крови или слюны) или опухолевых экстрактов последовательно термическим воздействием в диапазоне температур от 50 до 65°С и использованием кислой среды с низким значением рН;
(в) измерение уровня экспрессии указанного ракового антигена в тестируемом образце; и
(г) сравнение уровня экспрессии ракового антигена, маркера эпителиальных видов рака, в обозначенных образцах с уровнем его экспрессии в контрольных здоровых образцах.
Еще одним аспектом данного изобретения может быть его использование в качестве скринингового инструмента для выявления эпителиальных видов рака, включающий в себя:
(а) получение образцов крови, опухолевой ткани, ткани костного мозга, слюны пациентов с подозрением на наличие злокачественных новообразований эпителия;
(б) обработку биологических жидкостей пациентов (крови или слюны) или опухолевых экстрактов последовательно термическим воздействием в диапазоне температур от 50 до 65°С и использованием кислой среды с низким значением рН;
(в) измерение уровня экспрессии указанного ракового антигена в тестируемом образце;
(г) сравнение уровня экспрессии ракового антигена, маркера эпителиальных видов рака, в обозначенных образцах с уровнем его экспрессии в контрольных здоровых образцах;
(д) в соответствии с методикой, может быть использован любой подходящий метод детекции, включающий иммуноферментный анализ, иммунохемилюминесцентный анализ, флуоресцентный анализ, радиометрический анализ, или иммунохимический анализ;
Еще одним аспектом данного изобретения может быть его использование для мониторинга лечения уже выявленного эпителиального вида рака, включающий в себя:
(а) получение биологических образцов крови, опухолевой ткани, ткани костного мозга, слюны или мочи пациентов с подозрением на наличие злокачественных новообразований эпителия;
(б) обработку биологических жидкостей пациентов (крови, мочи, слюны) или опухолевых экстрактов последовательно термическим воздействием в диапазоне температур от 50 до 65°С и использованием кислой среды с низким значением рН;
(в) измерение начального уровня экспрессии указанного ракового антигена в тестируемом образце до начала лечения; и
(г) измерение уровня экспрессии указанного ракового антигена в тестируемых образцах пациента в ходе его лечения;
(д) сравнение уровней экспрессии ракового антигена, маркера эпителиальных видов рака, в обозначенных образцах в ходе лечения с начальным уровнем его экспрессии до начала лечения;
(е) в соответствии с методикой, может быть использован любой подходящий метод детекции, включающий иммуноферментный анализ, иммунохемилюминесцентный анализ, флуоресцентный анализ, радиометрический анализ или иммунохимический анализ;
(ж) тестируемый образец может быть получен из сыворотки крови, ткани костного мозга или слюны.
ЦЕЛЬ ИЗОБРЕТЕНИЯ
Основная цель настоящего изобретения заключается в том, чтобы предоставить способ определения, выделения и способ детекции нового ракового антигена, который представляет собой семейство N-гликопротеинов, обладающих идентичным N-гликозилированием, с молекулярной массой 55-85 кДа, ассоциированного с опухолями эпителиальных тканей, для выявления и скрининга карцином. В частности, раковый антиген ассоциирован с карциномой молочной железы, карциномой предстательной железы, карциномой желудка, карциномой легкого, карциномой яичников и карциномой кишки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ.
1. Фигура 1
Фигура 1 демонстрирует влияние времени термической обработки образцов сыворотки на дискриминацию здоровых контролей и больных раком мочевого пузыря.
2. Фигура 2
Фигура 2 демонстрирует характеристические ROC-кривые для исследованных образцов рака мочевого пузыря и здоровых контролей в зависимости от времени их термической обработки с использованием описанного ракового антигена.
3. Фигура 3
Фигура 3 демонстрирует влияние термической обработки образцов сыворотки на различие здоровых контролей и больных колоректальным раком (КРР).
4. Фигура 4
Фигура 4 демонстрирует характеристические ROC-кривые для исследованных образцов колоректального рака и здоровых контролей без предварительной термической обработки сыворотки с использованием разных концентраций описанного ракового антигена.
5. Фигура 5
Фигура 5 демонстрирует характеристическую ROC-кривую для исследованных образцов колоректального рака и здоровых контролей с предварительной термической обработкой сыворотки с использованием описанного ракового антигена.
6. Фигура 6
Фигура 6 демонстрирует характеристическую ROC-кривую парных образцов сыворотки крови и слюны для 14 пациентов с РМЖ и 58 здоровых контролей.
7. Фигура 7
Фигура 7 демонстрирует гель-электрофорез в полиакриламидном геле и Вестерн блоттинг, которые показывают гликопротеин с молекулярной массой 55-85 кDa, выделенный в чистом виде из суспензии раковых клеток К-562 хронической миелогенной лейкемии человека, узнается специфическими моноклональными антителами IgMEC против ракового антигена.
8. Фигура 8
Фигура 8 демонстрирует экспериментальных мышей Balb/c с подкожными ксенографтами опухолей человека, которые использовались в исследовании для получения экстрактов опухолевых клеток.
9. Фигура 9
Фигура 9 демонстрирует Вестерн блоттинг суспензий различных опухолевых гомогенатов (экстрактов гомогенизированных клеток) с моноклональными антителами IgMEC против указанного ракового антигена 60-65 кДа и козьими антителами против мышиного IgM-HRP.
10. Фигура 10.
Фигура 10 демонстрирует влияние периодатного окисления на связывание белков.
11. Фигура 11.
Фигура 11 демонстрирует кривые ингибирования для IgMEC и АФП после серийных разбавлений периодата на сорбированном экстракте раковых клеток аденокарциномы молочной железы MCF-7.
12. Фигура 12.
Фигура 12 демонстрирует характеристическую ROC-кривую образцов, подверженных периодатному окислению, по сравнению с контрольными необработанными образцами сыворотки.
13. Фигура 13.
Фигура 12 демонстрирует влияние периодатного окисления на различие больных от здоровых контрольных образцов.
14. Фигура 14.
Фигура 13 демонстрирует кривые ингибирования связывания АФП-Биотин с расщепленными пепсином белками.
15. Фигура 15.
Фигура 15 демонстрирует гель-электрофорез в полиакриламидном геле образцов сыворотки до и после расщепления пепсином.
16. Фигура 16
Фигура 16 демонстрирует влияние ферментативного расщепления белков пепсином на различие больных раком молочной железы (РМЖ) от здоровых контролей.
17. Фигура 17.
Фигура 17 демонстрирует связывание АФП с MCF-7 гомогенатами из клеток, обработанных или не обработанных Туникамицином, специфическим ингибитором N-гликозилирования.
18. Фигура 18.
Фигура 18 демонстрирует характеристическую ROC-кривую для исследованных клинических образцов.
19. Фигура 19.
Фигура 19 демонстрирует характеристическая ROC-кривую для исследованной выборки образцов (N=500). 20. Фигура 20.
Фигура 20 демонстрирует распределение панели исследованных образцов (больных различными карциномами и здоровых контролей) с использованием ракового антигена.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к области биотехнологии и медицине, конкретно к способу определения наличия и/или концентрации ракового антигена, маркера эпителиальных видов рака, в образце, для раннего выявления рака, способу его определения, способу его выделения, в котором антиген, подлежащий детекции, может находиться в связанном с альфа-фетопротеином состоянии на мембранной поверхности клеток эпителиальных опухолей, и активируется только при помощи температурной обработки и кислой рН. Новый опухоль-ассоциированный антиген представляет собой семейство N-гликопротеинов, обладающих идентичным N-гликозилированием, с молекулярной массой 55-85 кДа, который содержит N-гликозидную связь Asn-GlcNAc и несколько внешних высоко разветвленных антенн полисахаридов. Данный белок-маркер в больших количествах образуется на поверхности мембраны малигнизированных эпителиальных клеток в самом начале канцерогенеза, что делает его специфичным маркером, ассоциированным с эпителиальными карциномами. Эпителиальные опухоли предстательной железы, молочной железы или яичника развиваются из поверхностного или железистого эпителия, отличаются появлением атипичных эпителиальных клеток, их высокой пролиферацией, которая может прогрессировать и перерождаться в плоскоклеточную карциному. Процесс образования ракового антигена, ассоциированного с перерожденными эпителиальными клетками, начинается при злокачественной трансформации эпителия во время эпителиально-мезенхимального перехода и образования из многообразных эпителиальных клеток, обладающих различными морфологическими и эпигенетическими характеристиками, единообразных стволовых раковых клеток, на мембране которых образуется комплекс ракового антигена с альфа-фетопротеином, необходимый для осуществления питания клеток. Данное изобретение описывает способ активации и выделения ракового антигена для его использования в диагностике рака. Перед описанием способов применения данного изобретения будет полезным ввести некоторые определения терминов, которые будут использоваться в тексте.
Термин «раковый антиген» или «опухоль-ассоциированный антиген» означает ген, фрагмент гена, РНК, фрагмент РНК, гликопротеин или фрагмент гликопротеина, ассоциированного или идентифицирующего молекулу, ассоциированную со злокачественным новообразованием эпителиального генеза. Указанный раковый антиген как часть данного изобретения не включает молекулы, которые были известны ранее, и ассоциированы с различными видами эпителиального рака, в частности, рака молочной железы (раковый антиген СА 15-3), раком простаты (ПСА), раком желудка (раковый антиген СА 19-9 и СА 74-2, СЕА). Тем не менее, раковый антиген, указанный в данном изобретении, может быть использован в новых и инновационных комбинациях с ранее известными раковыми антигенами для конкретных видов рака.
Термин «маркер» относится к молекуле, которая качественно или количественно ассоциирована с присутствием биологического явления, например, присутствием трансформированных клеток эпителия на поверхности злокачественных опухолей. Примеры «маркеров» включают полинуклеотиды, такие как ген или фрагмент гена, РНК или фрагмент РНК, или генный продукт, включающий в себя полипептиды, такие как пептиды, олигопептиды, гликопротеины или фрагменты гликопротеинов; или какие-либо идентифицирующие молекулы, такие как антитела или фрагменты антител, связанные напрямую с маркером, или через механизм, определяющий биологическое явление.
Маркер данного изобретения включает в себя нуклеотидную последовательность, в частности последовательность всей длины белка, какие-либо кодирующие последовательности, какие-либо фрагменты, полисахаридную последовательность, связанную с белком, как описано выше.
Как указано в данном изобретении термин «антитела» и подобные этому термины относится к молекулам иммуноглобулинов и иммунологически активных частей молекул иммуноглобулинов (Ig), т.е. молекул, которые содержат антиген-связывающий фрагмент, который специфически связывается с разнообразными функциональными группами антигена через ароматические боковые цепи коротких гидрофильных остатков, что лежит в основе аффинности и специфичности распознавания комплекса антитело-антиген посредством накопления совокупности относительно слабых нековалентных взаимодействий. Это включает в себя, но не ограничено моноклональными, поликлональными, химерными, одну цепь антитела, Fc, Fab, Fab’ и Fab2 фрагментами, а также экспрессии Fab-фрагментов. Молекулы антител относятся к любому классу, такие как IgG, IgM, IgA, IgE и IgD, которые отличаются друг от друга природой тяжелой цепи, присутствующей в молекуле. Они также включают в себя подклассы, такие как IgG1, IgG2 и другие. Легкая цепь может представлять собой каппа-цепь или лямбда-цепь. Далее по тексту ссылка на антитела включает в себя ссылку на все классы, подклассы и типы антител. К классу антител также относятся химерные антитела, например, моноклональные антитела или их фрагменты, которые специфичны для более, чем одного источника, например последовательности мыши, кролика, козы или человека. Далее включены нанотела.
Термин «рак» или «раковый» описывает физиологическое состояние у млекопитающих, которое обычно характеризуется бесконтрольной пролиферацией опухолевых клеток. Рак и онкологическая патология может быть ассоциирована, например, с метастазами, может интерферировать с нормальным функционированием окружения опухолевых клеток, может выделять повышенный уровень цитокинов или других продуктов секреции опухолевых клеток, подавлять или, наоборот, провоцировать воспалительные процессы или иммунный ответ организма, неоплазию, онкогенез и предраковые состояния, злокачественные новообразования, инвазивные поражения окружения опухоли или отдаленных органов, таких как лимфоузлы и т.д. Особое внимание заслуживают меланомы, которые также относятся к термину «рак».
Термин «опухоль» относится к росту и пролиферации неопластических клеток, вне зависимости от того, являются ли они злокачественными или доброкачественными, и ко всем атипичным клеткам, демонстрирующим выраженный ядерный полиморфизм, и опухолевым клеткам и тканям.
Термин «эпителиальный вид рака» относится к виду злокачественных опухолей, развивающихся из клеток эпителиальной ткани различных органов (слизистых оболочек, кожи, многих внутренних органов). Этот вид опухоли называется карциномой. Эти виды опухолей обладают способностью к метастазированию.
Термин «экспрессия» включает продукцию гликопротеинов, полинуклеотидов или полипептидов, в частности, продукцию PFTK из гена или порции гена, и включает продукцию полипептида, кодируемого PECK или геном, и появление детектируемого антигена, ассоциированного с экспрессией. Например, образование комплекса при взаимодействии полипептид-полипептид или взаимодействии полипептид-нуклеотид или тому подобное, входит в рамки термина «экспрессия». Другим примером является образование в результате способа обработки данного изобретения количественно детектируемого ракового антигена, ассоциированного со злокачественными опухолями эпителиальных тканей.
Термин «пороговая величина» относится к уровню указанного ракового антигена, за пределами которого гликопротеин, олигопептид или полипептид служит маркером наличия злокачественного заболевания у пациента. Порог будет зависеть от установленной диагностической модели, полученной экспериментально из пилотных клинических исследований, таких как те, что описаны в Примерах ниже. В зависимости от используемой модели диагностики пороговое значение может быть установлено для достижения максимальной чувствительности или для максимальной специфичности, или для минимальной ошибки (максимальной степени классификации). Например, более высокий порог может быть установлен для достижения минимальных ошибок, но это может привести к более низкой чувствительности. Следовательно, для любой данной диагностической модели клинические исследования будут использоваться для установления порога экспрессии, который обычно достигает наибольшей чувствительности при минимальном уровне ошибок.
Термин «чувствительность» означает долю людей с заболеванием, у которых тест (по модели) положительный. Таким образом, повышенная чувствительность означает меньшее количество ложноотрицательных результатов теста.
Термин «специфичность» означает долю лиц без заболевания, у которых тест (по модели) отрицательный. Таким образом, повышенная специфичность означает меньшее количество ложноположительных результатов теста.
Термин «микрочип» относится к упорядоченному или неупорядоченному расположению агентов захвата, предпочтительно полинуклеотидов (например, зондов) или полипептидов на подложке.
Термин «гликопротеин» относится к соединениям, в молекулах которых остатки олиго- или полисахаридов ковалентно связаны О- или N-гликозидными связями с полипептидными цепями белка. В образовании О-гликозидной связи участвуют гидроксиаминокислоты. Известны комбинации галактоза (Оα1)-гидроксилизин, галактоза или арабинозагидроксипролин, серии или треонин. Известно присоединение остатков N-ацетилглюкозамина (GlcNAc), маннозы (Man) и галактозы к серину, фукозы (Fuc) - к треонину, однако подавляющее большинство таких гликопротеинов содержит в узле углевод-белковой связи один и тот же дисахаридный фрагмент, так называемый стержень, который состоит из остатков галактозы и N-ацетилгалактозамина (GalNAc) и имеет строение Galβ1-3GalNAcα1. В гликопротеинах, у которых углеводная и полипептидная цепи соединены N-гликозидными (гликозил-амидными) связями, остаток N-ацетилглюкозамина связан с атомом N амидной группы остатка аспарагина в полипептидной цепи.
Термин «олигонуклеотид» относится к полинуклеотиду, обычно к зонду или праймеру, включая, без ограничения, одноцепочечные дезоксирибонуклеотиды, одноцепочечные или двухцепочечные рибонуклеотиды, гибриды РНК: ДНК и двухцепочечные ДНК. Олигонуклеотиды, такие как олигонуклеотиды одноцепочечной ДНК-зонда, часто синтезируют химическими методами, например, с использованием автоматических синтезаторов олигонуклеотидов, которые являются коммерчески доступными, или различными другими методами, включая системы экспрессии in vitro, рекомбинантные методы и экспрессию в клетках и организмах.
«Полипептид» в контексте настоящего описания относится к последовательности олигопептида, пептида или гликопротеина или их фрагмента, а также к природным, рекомбинантным, синтетическим или полусинтетическим молекулам. Когда термин «полипептид» приведен в данном описании для обозначения аминокислотной последовательности, встречающейся в природе белковой молекулы, «полипептид» и подобные термины не предназначены для ограничения аминокислотной последовательности полной нативной аминокислотной последовательностью для описания полной длины, молекулы. Следует понимать, что каждая ссылка на «полипептид» или подобный термин в данном документе будет включать в себя полноразмерную последовательность, а также любые фрагменты, производные или их варианты.
Использование настоящего изобретения на практике будет основано на традиционных методах молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии и биохимии, которые известны специалистам в данной области. Описание этих методов в полном объеме приведено в литературе, такой как (5, 6).
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Обычно опухолевые маркеры дифференцированно экспрессируются в опухолевой ткани и в соответствующей здоровой ткани, что позволяет различать пациентов, больных раком, от здоровых людей. Тем не менее, вполне вероятно, что физиологические и морфологические характеристики опухолевых тканей могут приводить к различиям в накоплении маркеров в сыворотке и других биологических жидкостях, даже в отсутствии их гиперэкспрессии в опухолевой ткани. В частности, можно предположить, что аномальная полярность опухолевых клеток, высокая степень васкуляризации опухоли и высокое внутриопухолевое давление способствуют оттоку специфических маркеров из опухолевой ткани по сравнению с незлокачественной тканью. Следовательно, предполагается, что секретируемый раковый антиген или гликопротеин, который экспрессируется в большом количестве в тканях опухоли, но не экспрессирован в здоровой ткани эпителия, будет представлять собой полезный маркер злокачественных новообразований эпителия.
ИММУНОГИСТОХИМИЯ И ПРОТЕОМИКА
Иммуногистохимические методы также подходят для определения уровней экспрессии маркеров пролиферации по данному изобретению. Таким образом, антитела или антисыворотки, предпочтительно, поликлональные антисыворотки и, наиболее предпочтительно, моноклональные антитела, специфичные для указанного антигена, используют для выявления экспрессии. Антитела могут быть обнаружены путем прямого мечения самих антител, например, радиоактивными метками, флуоресцентными метками, люминесцентными и биолюминесцентными метками, гаптеновыми метками, такими как биотин, или ферментом, таким как пероксидаза хрена или щелочная фосфатаза. Альтернативно, немеченое первичное антитело используется в сочетании с меченым вторичным антителом, содержащим антисыворотку, поликлональную антисыворотку или моноклональное антитело, специфичное для первичного антитела. Протоколы и наборы иммуногистохимии хорошо известны в данной области и являются коммерчески доступными.
Протеомика может быть использована для анализа полипептидов, присутствующих в образце (например, сыворотке, ткани, организме или клеточной культуре) в определенный момент времени. В частности, протеомные методы могут быть использованы для оценки глобальных изменений экспрессии полипептида в образце (также называемый протеомикой экспрессии). Протеомный анализ обычно включает в себя:
(1) разделение отдельных полипептидов в образце с помощью 2-D гель-электрофореза (2-D PAGE);
(2) идентификация отдельных полипептидов, извлеченных из геля, например, с помощью масс-спектрометрии или N-концевого секвенирования, и
(3) анализ данных с использованием биоинформатики.
Протеомные методы являются ценными дополнениями к другим методам профилирования экспрессии генов и могут использоваться отдельно или в сочетании с другими методами для обнаружения продуктов маркеров пролиферации по настоящему изобретению. Применение магнитных частиц
Применение магнитных частиц в биоанализах с флуоресцентной меткой для включения проточной цитометрии (7). Разновидностью гибридизационной технологии является анализ QuantiGene Plexe (Genospectra, Fremont), который сочетает в себе поддержку флуоресцентных гранул с амплификацией разветвленных сигналов ДНК. Еще одним вариантом технологии гибридизации является анализ мРНК Quantikine® (R&D Systems, Миннеаполис). Методология соответствует описанию в инструкции производителя. Вкратце, в анализе используются зонды гибридизации олигонуклеотидов, конъюгированные с дигоксигенином. Гибридизацию обнаруживают с использованием антител против дигоксигенина, связанных с щелочной фосфатазой, в колориметрических анализах. Другие способы хорошо известны в данной области техники и не требуют дальнейшего описания в данном документе.
Связанные с ферментом иммунологические анализы (ИФА)
Вкратце, в сэндвич-анализах ИФА поликлональное или моноклональное антитело против указанного антигена связывается с твердой подложкой (8, 9), суспензионными или магнитными частицами. Другие способы хорошо известны в данной области техники и не требуют дальнейшего описания в данном документе. Моноклональные антитела могут быть получены из гибрид омы или выделены из библиотек фаговых антител. Сайты неспецифического связывания блокируются нецелевыми белковыми препаратами и поверхностно-активными веществами или детергентами. Затем захватывающее антитело инкубируют с образцом сыворотки или ткани от пациента, содержащего указанный антиген. Смесь промывают перед инкубацией комплекса антител о/антиген со вторым антителом, которое обнаруживает указанный антиген. Второе антитело обычно конъюгировано с пероксидазной меткой или флуоресцентной или люминесцентной молекулой или другой меченой молекулой, которая может быть обнаружена в ферментативной реакции, или с третьим антителом, конъюгированным с меткой. Альтернативно, в прямых ИФА методах, препарат, содержащий указанный раковый антиген, может быть связан с подложкой или гранулой, и целевой антиген может быть обнаружен непосредственно с помощью конъюгата антитело-антиген. Способы получения моноклональных антител и поликлональных антисывороток хорошо известны в данной области и не требуют дальнейшего описания в данном документе.
Иммунохемилюминесцентный анализ (ИХА)
Вкратце, в одностадийных конкурентных вариантах твердофазного иммунохемилюминесцентного анализа поликлональное или моноклональное антитело против указанного антигена связывается с твердой подложкой, суспензионными или магнитными частицами. Другие способы известны в данной области техники и не требуют дальнейшего описания в данном документе. Моноклональные антитела могут быть получены из гибридомы или выделены из библиотек фаговых антител. Сайты неспецифического связывания блокируются нецелевыми белковыми препаратами и поверхностно-активными веществами или детергентами. Затем захватывающее антитело инкубируют со смесью образца сыворотки или ткани от пациента, содержащего указанный антиген и люминесцентным конъюгатом антигена для осуществления конкурентного связывания. Несвязавшиеся компоненты удаляются во время отмывки, а образовавшийся иммуно-комплекс антител о/антиген с люминесцентной меткой, которое обнаруживает указанный антиген, считывается при помощи люминесцентного сигнала. Величина регистрируемого люминесцентного сигнала продукта окисления субстрата обратно пропорциональна содержанию указанного ракового антигена в анализируемом образце.
Иммунодетекция.
Описываемые способы также могут быть использованы для иммунодетекции указанного антигена в сыворотке или ткани пациентов, имеющих подозрение на наличие эпителиальных видов рака, для иммунодетекции указанного антигена в сыворотке или ткани пациентов, больных эпителиальными видами рака, взятой до и после операции по удалению опухоли, для иммунодетекции указанного антигена у пациентов, больных эпителиальными видами рака, до начала лечения и иммунодетекции указанного антигена в сыворотке, слюне и костном мозге больных эпителиальным раком, включая рак молочной железы, рак простаты, рак легкого, рак желудка, рак кишки, рак матки, рак яичников и др. Указанный антиген может детектироваться в образцах сыворотки или тканях с использованием стандартных методов иммунодетекции, таких как иммуноблоттинг или иммунопреципитация (9). При иммуноблоттинге белковые препараты из ткани или жидкости, содержащие указанный антиген, подвергают гель-электрофорезу в полиакриламидном геле в денатурирующих или в нативных (неденатурирующих) условиях. Затем белки переносятся на мембранную основу, такую как нитроцеллюлоза или нейлон. Затем указанный антиген реагирует прямо или косвенно с моноклональными или поликлональными антителами, как описано в стандартных методиках для иммуногистохимии. В другом случае в некоторых препаратах белки могут быть нанесены непосредственно на мембраны без предварительного электрофоретического разделения. Сигнал может быть определен количественно при помощи денситометрии. При иммунопреципитации растворимый препарат, содержащий указанный антиген, инкубируют с моноклональными или поликлональными антителами против указанного антигена. Затем реакцию инкубируют с инертными частицами, изготовленными из агарозы или полиакриламида, с ковалентно присоединенным белком А или белком G. Гранулы белка А или G специфически взаимодействуют с антителами, образуя иммобилизованный комплекс антитело-указанный антиген-антиген, связанный с частицей. После промывания связанный указанный антиген может быть обнаружен и количественно определен с помощью иммуноблоттинга или ИФА.
Определение порога
Для тестов с использованием указанного антигена будут получены пороговые величины, которые позволят назвать образец положительным или отрицательным на наличие эпителиального рака. Эти пороговые значения будут определены путем анализа когорт пациентов, которые исследуются на наличие эпителиальных видов рака, для каждого разработанного метода анализа. Пороговые значения могут различаться для разных тестовых приложений; например, пороговые значения для использования теста при популяционном скрининге будут определены с использованием когорт пациентов, которые являются условно-здоровыми и не имеют симптомов онкологических заболеваний, и эти пороги могут отличаться от тех, которые используются в тестах для пациентов, у которых поставлен онкологический диагноз и которые находятся под наблюдением врача. Пороговая величина может быть выбрана таким образом, чтобы обеспечить практический уровень специфичности теста в требуемой клинической обстановке; то есть специфичность, которая обеспечивает разумную чувствительность без чрезмерного количества ложноположительных результатов. Эта специфичность может находиться в диапазоне 90-95%. Альтернативный метод получения пороговой величины заключается в построении графика чувствительности к специфичности для различных порогов теста (ROC-кривые), а затем выбрать точку перегиба кривой.
В качестве альтернативы конкретным пороговым величинам в тесте могут быть использованы диапазоны теста, которые обеспечивают разную степень вероятности наличия заболевания и которые имеют различные клинические последствия, связанные с ними. Например, тест может иметь три диапазона: один связан с высоким (например, 90%) риском наличия эпителиального рака, второй - с низким риском эпителиального рака, а третий - с подозрением на онкозаболевание. Для диапазона «серой зоны» могут быть определены рекомендации для повторного проведения теста в определенный период времени.
Антитела к антигену, ассоциированному с эпителиальным раком
В дополнительных аспектах данное изобретение включает изготовление антител против указанного антигена, ассоциированного с эпителиальным раком. Как только раковый антиген - маркер выделен и идентифицирован, он может быть произведен в количестве, достаточном для того, чтобы вызывать иммунологический ответ. В некоторых случаях может быть использован полноразмерный указанный антиген, а в других пептидный фрагмент указанного антигена может быть достаточным в качестве иммуногена. Иммуноген может быть введен в виде инъекции подходящему хозяину (например, мыши, кролику и т.д.) и, при необходимости, адъювант, такой как полный или неполный адъювант Фрейнда, может быть введен для усиления иммунного ответа. Хорошо известно, что получение антител является обычным делом в области иммунологии и не требует дальнейшего описания. В результате можно продуцировать антитела, включая моноклональные или фаг-дисплейные антитела, против указанного антигена, идентифицированных с использованием способов, описанных здесь.
В еще других вариантах осуществления антитела могут быть получены против белка или гликанового фрагмента опухолевого маркера, ракового антигена, идентифицированного здесь, или против олигонуклеотидной последовательности, уникальной для указанного маркера. Хотя описанный белок является гликозилированным, различия в характере гликозилирования могут, при определенных обстоятельствах, приводить к неправильному обнаружению форм указанного антигена, которые не имеют обычных паттернов гликозилирования или имеют модификации в гликозилировании.
В определенных аспектах данного изобретения иммуногены указанного антигена могут включать отдельные гликозилированные фрагменты указанного антигена или характерную N-гликозидную последовательность полисахаридов, присоединенную или не присоединенную к белку-гаптену.
Можно получить векторы, содержащие в себе антиген-кодирующие олигонуклеотиды. Многие такие векторы могут быть основаны на стандартных векторах, известных в данной области. Векторы могут быть использованы для трансфекции множества клеточных линий с целью получения антиген-продуцирующих клеточных линий, которые можно использовать для продуцирования желаемых количеств указанного антигена для разработки специфических антител или других реагентов для обнаружения указанного антигена или для стандартизации разработанных анализов для указанного антигена.
ОПИСАНИЕ СПОСОБОВ ПРАКТИЧЕСКОГО ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение, описывает способ выделения белка-маркера эпителиальных видов рака, содержащий полисахаридный фрагмент, который экспрессируется на поверхности переродившихся эпителиальных раковых клеток, способный использоваться для выявления злокачественных заболеваний эпителиального генеза.
В одном из вариантов настоящее изобретение относится к способу получения ракового антигена, маркера эпителиальных видов рака, и включает в себя:
(а) получение образцов крови, опухолевой ткани, культуры раковых клеток, ткани костного мозга, слюны или мочи пациентов с подозрением на наличие злокачественных новообразований эпителия;
(б) использование термического воздействия в диапазоне нагревания от 50 до 65°С на биологические жидкости пациентов (кровь, мочу, слюну) или суспензии опухолевых клеток;
(в) использование кислой среды с низким значением рН в диапазоне от 2 до 5. Предварительные исследования показали, что указанный раковый антиген образуется только при подвергании биологических жидкостей пациентов (крови, мочи, слюны) или опухолевых экстрактов последовательно специальной термической обработке и использовании кислой среды с низким значением рН.
В одном из вариантов настоящее изобретение относится к способу выделения маркера эпителиальных видов рака, где способ включает в себя:
(a) получение линии раковых клеток;
(b) получение суспензии клеточного экстракта;
(c) выделение и очистка указанного антигена из суспензии клеточного экстракта методом иммуноаффинной хроматографии на подготовленной колонке с сорбированном антителом;
(d) определение концентрации и чистоты выделенного ракового антигена.
Для целей настоящего изобретения используют суспензионную линию клеток К-562, полученную из плевральной полости пациента с хронической миелоидной лейкемией в терминальной стадии заболевания. Клеточная линия может быть получена из коммерческих хранилищ или из новых первичных раковых клеток, полученных от пациента.
Новый раковый антиген 55-85 кДа, ассоциированный с опухолями эпителиальных тканей с самого начала онкогенеза, в результате описанного в данном изобретении способа обработки в различной степени образуется на мембранной поверхности этих опухолей, а также с кровотоком попадает в кровь онкобольных, что позволяет использовать описываемый раковый антиген в качестве уникального маркера для определения злокачественных новообразований эпителиального генеза для использования в ранней диагностике эпителиального рака.
В одном из вариантов осуществления ассоциированный с раком антиген выявляют с применением антител, специфически связывающихся с указанным раковым антигеном, ассоциированным с эпителиальным раком. Антитела против ассоциированного с раком антигена можно получать с применением известных в данной области способов.
Антитела, специфически реагирующие с указанным раковым антигеном, или его меченые производные, можно использовать для выявления ассоциированного с раком антигена в различных образцах (например, биологических материалах). Их можно использовать в качестве диагностических или прогностических реагентов, а также их можно использовать для выявления патологий уровня экспрессии белка или патологий структуры и/или патологий, связанных с временным, тканевым, клеточным или субклеточным расположением указанного антигена, ассоциированного с раком. Для оценки или наблюдения эффективности конкретных вариантов лечения можно также использовать иммуноанализы для in vitro диагностики.
Антитела можно использовать в любом из известных видов иммуноанализа, основанных на связывающем взаимодействии антигенной детерминанты указанного антигена, ассоциированного с раком, и специфических антител. Примеры таких видов анализа представляют собой радиоиммуноанализы, иммуноферментные анализы, иммунофлуоресценцию, иммунолюминесценцию, иммунохемилюминесценцию, иммунопреципитацию, агглютинацию с применением латекса, гемагглютинацию и гистохимические тесты. Антитела можно использовать для выявления и количественного определения ассоциированного с раком антигена в образце для выявления роли указанного антигена в раке и для выявления ранних стадий рака.
Антитело или образец можно сорбировать на носителе или твердой подложке, способной фиксировать клетки, антитела и т.д. Например, носитель или подложка могут представлять собой нитроцеллюлозу, полистирол, или стекло, полиакриламиды и магнетит. Вещество носителя может иметь любую возможную конфигурацию, включая шарообразную (например, гранула), цилиндрическую (например, внутренняя поверхность пробирки или лунки или внешняя поверхность зонда) или плоскую (например, лунка микропланшета, пластина, индикаторная полоска).
В одном из вариантов настоящее изобретение относится к способу выявления раковых клеток или мониторинга рака у индивида, который имеет рак, или у которого предполагают наличие рака, где способ включает в себя:
(a) получение образца от индивида;
(b) обработку биологических жидкостей пациентов (крови, мочи, слюны) или опухолевых экстрактов последовательно термическим воздействием в диапазоне температур от 50 до 65°С и использованием кислой среды с низким значением рН;
(c) приведение образца в контакт с антителом, которое связывается с указанным антигеном, ассоциированным с эпителиальным раком;
(d) определение в образце уровня ассоциированного с раком указанного антигена; и
(e) сравнение уровня ассоциированного с раком указанного антигена в образце с контрольным образцом, где повышенные в сравнении с контролем уровни ассоциированного с раком антигена указывают на наличие у индивида рака.
Термин "образец" может относиться к любому образцу сыворотки крови. Термин "контрольный образец" может относиться к любому образцу, который используется для установления исходного или нормального уровня указанного антигена и который представляет собой образец сыворотки крови от пациента.
В одном из вариантов осуществления изобретение относится к способу мониторинга лечения рака у индивида, где способ включает в себя:
(a) получение образца от индивида;
(b) обработку биологических жидкостей пациентов (крови, мочи, слюны) или опухолевых экстрактов последовательно термическим воздействием в диапазоне температур от 50 до 65°С и использованием кислой среды с низким значением рН;
(c) определение в образце уровня экспрессии ассоциированного с раком антигена;
(d) повторение стадий (а) и (b) в более поздний момент времени и сравнение результата на стадии (b) с результатом на стадии (с), где разница в уровне экспрессии ассоциированного с раком антигена показательна в отношении прогрессирования рака у индивида.
В частности, повышенные уровни ассоциированного с раком антигена в более поздний момент времени могут указывать на то, что рак прогрессирует и что лечение (если используется) не эффективно. В отличие от этого, сниженные уровни ассоциированного с раком антигена в более поздний момент времени могут указывать на то, что рак регрессирует и что лечение (если используется) является эффективным.
Мониторинг лечения онкологических больных является важной проблемой и необходим для оценки эффективности проводимого лечения и принятия своевременных решений по смене курса химиотерапии. В настоящее время для мониторинга заболевания, в основном, используются дорогостоящие инструментальные методы анализа, поскольку в наличии нет высоко чувствительных биомаркеров, способных корректно отражать ответ опухоли на проводимое лечение. Проведенные ранее пилотные клинические исследования на пациентах с солидными опухолями желудка и кишки показали, что указанный антиген, ассоциированный с эпителиальными злокачественными новообразованиями, может применяться для оценки эффективности проводимого лечения.
Таким образом, данное изобретение также можно использовать для мониторинга лечения и контроля прогрессирования роста опухоли, для контроля возникновения рецидива роста опухоли, а также для изучения эффективности конкретного варианта лечения. В частности, способ можно использовать для подтверждения устранения всей опухолевой ткани после хирургического вмешательства, эффективности проведенной противоопухолевой химиотерапии и/или лучевой терапии.
Следующие примеры иллюстрируют настоящее изобретение:
Пример 1: Способ получения нового ракового антигена в сыворотке пациентов, больных карциномой мочевого пузыря и карциномой кишки.
Все анализируемые образцы сыворотки крови пациентов с верифицированным онкологическим заболеванием эпителиального генеза проходили предварительную пробоподготовку, которая заключается в термическом нагревании всех образцов на водяной бане в температурном режиме от 50 до 65°С в течение 30 минут при объемах образца 0,5-1 мл. Термически обработанные образцы сыворотки крови сравнивались с аналогичными необработанными образцами с использованием конкурентного связывания с конъюгатом очищенного ракового антигена и моноклональных антител против указанного ракового антигена с использованием иммунотеста на основе конкурентного связывания. В конкурентном варианте твердофазного иммунохемилюминесцентного анализа использовали моноклональные антитела против указанного антигена, которое связывали с твердой подложкой лунок планшета. Сайты неспецифического связывания блокировали с помощью специального кислого буферного раствора на основе дикарбоновых кислот с содержанием полисорбата, неионогенного поверхностно-активного вещества. Затем захватывающее антитело инкубировали со смесью образца сыворотки, содержащего указанный антиген, и люминесцентным конъюгатом антигена для осуществления конкурентного связывания. Не связавшиеся компоненты удаляли во время отмывки, а образовавшийся иммуно-комплекс антител о/антиген с люминесцентной меткой, которое обнаруживает указанный антиген, считывали при помощи люминесцентного сигнала. Величина регистрируемого люминесцентного сигнала продукта окисления субстрата обратно пропорциональна содержанию указанного ракового антигена в анализируемом образце. Результаты этих экспериментов показаны ниже в Таблице 1 и на фигурах 1-5.
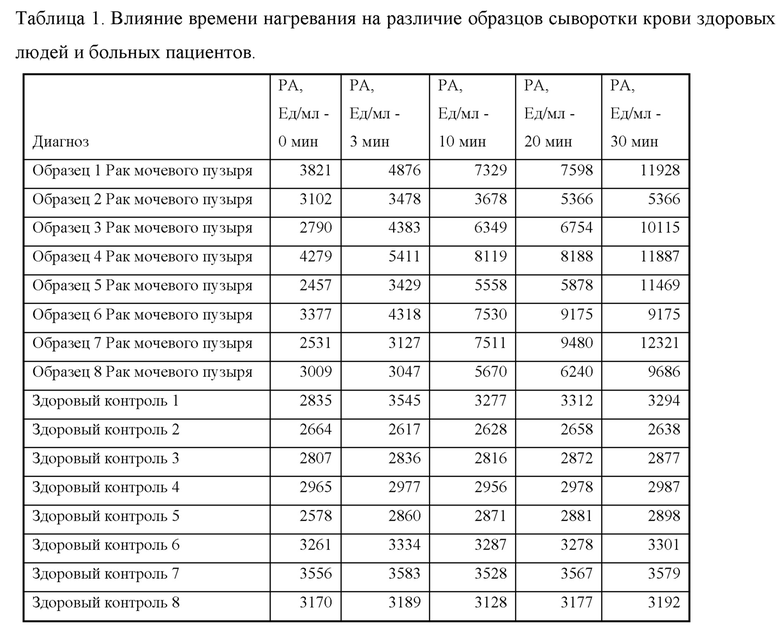
Вывод: Результаты, полученные в данном примере, доказывают, что новый раковый антиген образуется в результате способа обработки образцов сыворотки, поскольку без использования термической обработки и кислой реакционной среды не существует различия между здоровыми контролями и образцами от больных раком.
Пример 2
Кроме получения ракового антигена в сыворотке крови пациентов с карциномами, его также можно получить и в слюне способом, описанным в данном изобретении, как показано на Фигуре 6. Хотя точность иммунотеста по слюне ниже, чем по сыворотке, забор слюны имеет свои преимущества, так как является удивительно простым и недорогим способом забора биообразцов.
Замороженные образцы слюны пациентов в 1,5 мл Эппендорфах размораживали и доводили до комнатной температуры, после чего центрифугировали на микроцентрифуге при 16000 об/мин. Затем образцы подвергали термической обработке на водяной бане в диапазоне температур от 50 до 65°С в течение 30 минут. Иммунотест для слюны, основанный на конкурентном связывании, включал в себя основные параметры:
а) использование меньшего, чем для сыворотки крови количества люминесцентного конъюгата ракового антигена 55-85 кДа (~ 30-50 нг/мл против 100-200 нг/мл);
б) большую концентрацию образцов слюны {1/2; 1/5; 1/10; и 1/20}. Образцы слюны были разделены на 2 группы для исследования: 1 группу нагревали в течение 30 минут на водяной бане в диапазоне температур от 50 до 65°С (так же, как образцы сыворотки), а другую группу оставили не нагретыми.
Для выполнения иммуноанализа образцов слюны на планшеты сорбировали 9 мкг/мл моноклональных антител MAT IgMEC в ФСБ буфере рН 7,5. Планшеты инкубировали в течение ночи при 4°С, после чего промывали 3 раза дН20. Затем неспецифическое связывание планшетов с сорбированными антителами блокировали с помощью 200 мкл на лунку блокирующего буферного раствора на основе дикарбоновой кислоты, рН 4,0, инкубировали 2 часа при 37°С, промывали 3 раза dH20, замораживали и подвергали лиофильной сушке. В лунки лиофилизованного планшета №1 добавляли по 25 мкл аликвоты термически обработанных образцов слюны рака молочной железы и здоровых контролей и 25 мкл блокирующего буферного раствора рН 4,0. В лиофилизованный планшет №2 в лунки добавляли 25 мкл образцов слюны без нагрева и слюны от здоровых контролей, смешанных с 25 мкл блокирующего буфера. Наконец, во все лунки обоих планшетов добавляли по 50 мкл ракового антигена Серии №41 (ΡΑ-Акридин # 41) в конечной концентрации 30 нг/мл. Реакционные растворы тщательно перемешивали постукиванием всех сторон планшета, после чего инкубировали при комнатной температуре в течение 2 часов. После инкубирования все растворы аспирировали, промывали трижды дН20, результаты считывали на флэш-хемилюминометре. Полученные результаты: Для образцов слюны, которые прошли специальную термообработку, были получены хорошие результаты (AUC=0,894), сравнимые с результатами по сыворотке. Соотношение между больными и здоровыми контролями составило 4,6. Использование меньшего количества конъюгата ΡΑ-Акридин позволило различить образцы слюны лучше, чем обычный интервал концентраций 100-200 нг/мл, который использовали для сыворотки крови.
Вывод: Таким образом, тест по слюне может служить первичным методом отбора пациентов при использовании достаточно низкой пороговой величины с целью обнаружения большинства пациентов с подозрением на рак. Отобранные таким образом первичные пациенты с повышенным уровнем ракового антигена в слюне будут направляться на сывороточный тест с более высокой пороговой величиной для исключения ложноположительных результатов.
Пример 3. Способ выделения ракового антигена из экстракта раковых клеток миелоидной лейкемии.
Клеточную линию хронической миелогенной лейкемии человека К-562, полученных из американской коллекции клеточных культур АТТС, № CCL-243 помещали в 100 мл среды, содержащей 5×105 клеток/мл в 850 см3 роллерную бутыль. Далее раковые клетки суспендировали в подходящей среде для культивирования клеток, например по способу Дульбекко в модификации Исков. Бутыли выдерживали при 37°С без СО2 с вращением в интервале 0.25-1.0 об/мин. Клетки декантировали, промывали и ресуспендировали в 50 мМ ТБС буфера рН 7.4 с получением суспензии, содержащей 50×106 клеток/мл. Полученные пробирки с клетками замораживали при -20°С до приготовления клеточного экстракта.
Затем готовили клеточный экстракт. Вкратце клетки подвергали ультразвуковой сонификации до разрушения клеточных мембран с использованием ультразвукового сонификатора-гомогенизатора. Суспензия подвергалась УЗ-сонификации на льду, поскольку при этом происходит нагревание раствора. Полученную суспензию клеточного экстракта центрифугировали в эппендорфах при 16000g (об/мин) в роторе с фиксированным углом в течение 10 мин. Полученный супернатант представляет собой К-562 экстракт, который отбирали в чистую пробирку. Общая концентрация белка в клеточном экстракте определяли по стандартной методике Брэдфорд с использованием Comassie G250 и БСА стандарта. Концентрация белка и находилась в интервале 5-10 мг/мл. Затем проводили выделение ракового антигена на подготовленной Сефарозной колонке-4 В, С-9142 (Sigma-Aldrich) с иммобилизованным нативным свиным АФП методом аффиной хроматографии. D качестве носителя ис пользовали цианбромидную сефарозу. После удаления буферного раствора к колонке добавляли 30-40 мл супернатанта К-562 и оставляли в колонке в течение всей ночи при +40°С. Перемешивание супернатанта с иммобилизованным сорбентом проводили на специальном шейкере-качалке при постоянном наклонном перемешивании.
На следующий день колонку сливали, избавляя от неприсоединившегося белкового экстракта (который сохраняли до дальнейшего использования), после чего колонку промывали ТБС буфером до получения стабильного базового сигнала при А280. На перистальтическом насосе жидкостного препаративного хроматографа низкого давления устанавливали скорость от 1,5 до 2,0 мл/мин, предпочтительно 1,8 мл/мин. Процесс прохождения экстракта через колонку контролировался с использованием оптического УФ-детектирования при 280 нм.
Элюцию ракового антигена проводили с помощью буферного раствора Трис-KCl с концентрацией от 0,5 до 1,5 моль/л, предпочтительно 1 моль/л. Антиген собирали, когда оптический прибор регистрировал сдвиг с линии базового сигнала до достижения пика и до возвращения сигнала до базового уровня. После чего забор белка прекращали. После этого колонку уравновешивали при промывании 5-кратным объемом колонки с ТБС - буферным раствором. Затем не присоединившийся изначально к колонке экстракт вновь вносили в колонку с иммобилизованным лигандом и перемешивали в колонке с сорбентом при +40°С в течение ночи, после чего повторяли процедуру элюции ракового антигена, описанную выше. Эту процедура повторяли 3-4 раза до полного удаления ракового антигена из экстракта.
Все элюаты белка, полученные из одного экстракта, объединяли в одну препаративную фракцию, которую подвергали диализу против 1х фосфатно-солевого буфера. Полученный очищенный белок переносили во взвешенную 50 мл стерильную пластиковую пробирку типа Фалкон, замораживали при -20°С в течение 12 часов до глубокой заморозки образца, после чего замороженный образец лиофильно высушивали в течение 36 часов. Затем определяли концентрацию белка в лиофилизате методом Брэдфорд и чистоту выделенного антигена методом электрофореза в полиакриламидном геле (Фигура 7)·
Фигура 7. Гель-электрофорез в полиакриламидном геле и Вестерн блоттинг показывают гликопротеин с молекулярной массой 55-85 кГ)а, выделенный в чистом виде из суспензии раковых клеток К-562 хронической миелогенной лейкемии человека, узнается специфическими моноклональными антителами IgMEC против ракового антигена.
Вывод: Описанный способ очистки с использованием иммуно-аффинной хроматографии с нативным свиным АФП в качестве лиганда позволяет выделить в чистом виде раковый антиген, который узнается моноклональными антителами против указанного ракового антигена Пример 4.
Подтверждение наличия идентичного белка-маркера, N-гликопротеина с молекулярной массой 55-85 кДа в гомогенатах различных злокачественных опухолей (карцином) проводили при помощи Вестерн блоттинга с использованием МаТ (моноклональных антител) против N-гликопротеина. Наличие карцином-специфичного антигена, белка-маркера эпителиальных карцином было выявлено в различных эпителиальных опухолях человека приведено в Таблице 2:
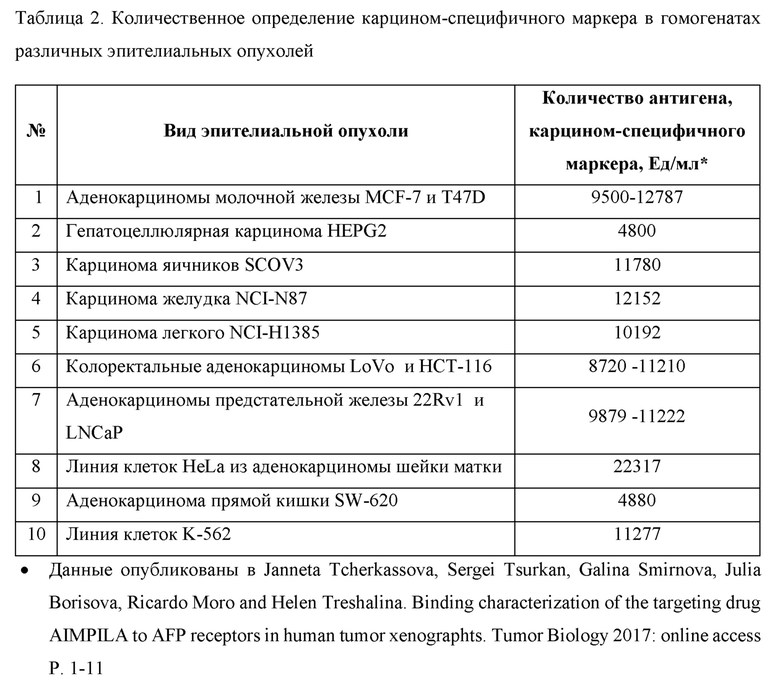
Из экстракта опухоли аденокарциномы молочной железы человека MCF при помощи аффинной хроматографии был выделен карцином-специфичный антиген с молекулярной массой 55-85 кDa. Иммунизация Balb/c мышей с помощью выделенного гликопротеина привела к созданию моноклональных антител острой фазы болезни MaT-IgM, узнающих полисахаридный фрагмент МЭК.
На основе выделенного антигена и моноклональных антител MaT-IgM впоследствии были разработаны иммунохимический сывороточный и суспензионный тесты для количественного определения маркера для эпителиальных карцином. Впервые было проведено количественное определение уровня маркера эпителиальных карцином МЭК на моделях перевиваемых опухолей человека, растущих в п/к ксенографтах, при помощи суспензионного ИХА теста на моноклональных антителах.
Получение гомогенатов опухоли человека: Фрагменты п/к опухолевого узла измельчали скальпелем, переносили в криопробирку и после добавления 1 мл ТБС буфера, производили ультразвуковую сонификацию опухолевой массы при помощи ультразвукового гомогенизатора фирмы BILON-150Y (КНР) при установленной мощности 60 Вт (40%). Сонификацию проводили на льду в течение 6 порций по 30 сек с двумя 30 сек остановками до получения однородной гомогенной смеси, после чего материал ультрацентрифугировали при 13000 об/мин в Эппендорфах в течение 10 мин при комнатной температуре. Полученный супернатант представлял собой гомогенат опухолевой ткани, готовый для анализа. Общая концентрация белка в образцах опухоли человека MCF-7, T47D, HEPG2, SCOV3, NCI-N87, LoVo и НСТ-116, 22Rvl и LNCaP, HeLa, SW-620 и К-562, определяли по стандартному методу Брэдфорд. Вестерн блот гомогенатов исследуемых опухолей показал наличие единого ракового антигена, специфически узнаваемого моноклональными антителами.
Вывод: Проверка специфичности карцином-специфичного антигена проведена с использованием различных эпителиальных опухолей человека, полученных из п/к ксенографтов у Balb/c мышей. Во всех изученных эпителиальных опухолях человека различных локализаций (карцином) присутствует идентичный N-гликопротеин с молекулярной массой 55-85 кДа, узнаваемый специфичными моноклональными антителами против указанного ракового антигена. Гликопротеин специфичен только для эпителиальных карцином.
Пример 5:
Подтверждение того, что новый маркер является гликопротеином, было получено в экспериментах с периодатным окислением полисахаридов, которое проводили при комнатной температуре 0,1н раствором периодата натрия в течение 2х часов. При периодатном окислении на 1 моль полисахарида расходуется 1,3 моль периодата натрия, при этом выделяется 0,5 моль муравьиной кислоты. После восстановления бор гидридом натрия NaB4 проводилось связывание с альфа-фетопротеином для подтверждения гипотезы о наличии гликозида, являющегося активным эпитопом связывания гликопротеина.
Проведенные нами эксперименты с периодатом натрия показали, что Альфа-фетопротеин присоединяется к N-гликозидному фрагменту, связанному с белковой частью молекулы гликопротеина. Лунки планшета для микротитрования были покрыты гомогенатом раковых клеток хронического миелоидного лейкоза К562 или сывороточным альбумином человека (ЧСА), после чего сорбированные белки обрабатывали различными концентрациями периодата натрия (от 1 до 100 ммоль/л). Последующая инкубация с биотинилированным АФП продемонстрировала эффект периодатного окисления на связывание с АФП. Активность связывания исследуемого гликопротеина тестировали с использованием 1 мкг/мл АФП-Биотин. Как показано на Фигуре 10 обработка гомогената раковых клеток периодатом натрия приводит к значительному уменьшению активного связывания (до 90%), причем это уменьшение пропорционально концентрации периодата.
В качестве контроля использовали сывороточный альбумин человека ЧСА, который не имеет полисахаридов. Контрольные лунки планшета по аналогии с гомогенатом раковых клеток ЧСА сорбировали в такой же концентрации, что и К-562, и обработали периодатом натрия. Контрольный эксперимент показал отсутствие снижения связывания альбумина с моноклональными антителами против ЧСА, независимо от концентрации использованного периодата натрия. Целостность контрольного белка альбумина была проверена с использованием моноклональных антител против альбумина человека. АФП-Биотин и МаТ против ЧСА детектировались при помощи связывания со стрептавидином-пероксидаза хрена и анти-IgG-HRP, соответственно.
Выводы: Как показано на Фигуре 10 связывание АФП-Биотин уменьшается с увеличением концентрации периодата, достигая плато выше 10 ммоль/л. При этом очевидно отсутствие влияние периодата на ЧСА, что указывает на то, что периодат натрия оказывает влияние не на пептидную цепь гликопротеина, а на его углеводородную часть (гликозиды).
5.1. Очищенные антитела против ракового антигена и АФП теряют способность связываться с активным эпитопом антигена в составе гомогената культуры клеток MCF-7 после его обработки периодатом натрия.
Лунки планшета сорбировали клетками гомогената раковых клеток аденокарциномы молочной железы MCF-7 при концентрации 100 мкг/мл. Лунки промывали ФСБ-0,02% Твин-20 и в лунки добавляли 11 двукратных разведений периодата натрия, начиная со 100 ммоль/л в 0,250 моль/л Малонатном буфере, рН 4. После 2х часов инкубации при комнатной температуре (в темноте) раствор периодата натрия аспирировали, после чего 150 мкл 2% глицина в ФСБ добавляли в лунки планшета для блокирования альдегидов и выдерживали раствор в лунках в течение 2х часов при комнатной температуре. Затем лунки планшета блокировали 250 мкл 1% БСА в ФСБ в течение ночи при 4°С. Лунки промывали 3 раза, после чего моноклональные антитела IgMEC, поликлональные кроличьи антитела против указанного ракового антигена или АФП-Биотин инкубировали в лунках в течение 1 часа при комнатной температуре. После промывки в лунки планшета добавляли соответствующее вторичное антитело или конъюгат стрептавидин-пероксидаза, и инкубировали в течение еще одного часа. Затем лунки промывали, добавляли АБТС субстрат (Диаммониевая соль 2,2'-Азино-бис-(3-этилбензотиазолин-6-сульфоновой кислоты), которая является водорастворимым субстратом пероксидазы хрена, который производит зеленое окрашивание конечного продукта реакции. Затем планшет считывали при 405 нм на стандартном ИФА планшетном ридере. Результаты эксперимента показаны на Фигуре 11.
Выводы: Моноклональные антитела IgMEC против ракового антигена, а также АФП не распознают гликопротеин на гомогенате MCF-7, который подвергали окислению периодатом натрия. Периодат натрия не изменил все сайты связывания на поликлональных антителах, которые все еще были способны распознавать сайты связывания на гомогенате MCF-7. В отличие от поликлональных антител, при увеличении концентрации периодата натрия наблюдалось уменьшение связывания АФП и IgMEC с гомогенатом клеток MCF-7. Это может объясняться только разрушением полисахаридов в результате периодатного окисления, что подтверждает то, что эпитоп связывания ракового антигена является гликозидом.
5.2. Периодатное окисление гликозидов в образцах сыворотки пациентов:
Для этого эксперимента использовали 32 образца сыворотки от 16 здоровых и 16 верифицированных больных раком простаты. В каждый образец сыворотки объемом 50 мкл добавляли 5 мкл 1 моль/л раствора (100 ммоль/л) периодата натрия NaIO4 (Молярная масса: 213,8918 г/моль). Инкубировали смесь в течение 60 минут при комнатной температуре. После этого для удаления избытка периодата в каждую лунку добавляли 10 мкл 0,5 моль/л раствора полиэтиленгликоля (ПЭГ). Иммуно-хемилюминесцентный анализ по принципу конкурентного связывания проводили с сорбированными на плашках МаТ IgMEC против ракового антигена, гликопротеина 55-85 кДа с использованием 100 нг/мл люминесцентного конъюгата ракового антигена-62-Акридин. Время инкубации: 2 часа при комнатной температуре. Полученные результаты представлены в Таблице 3
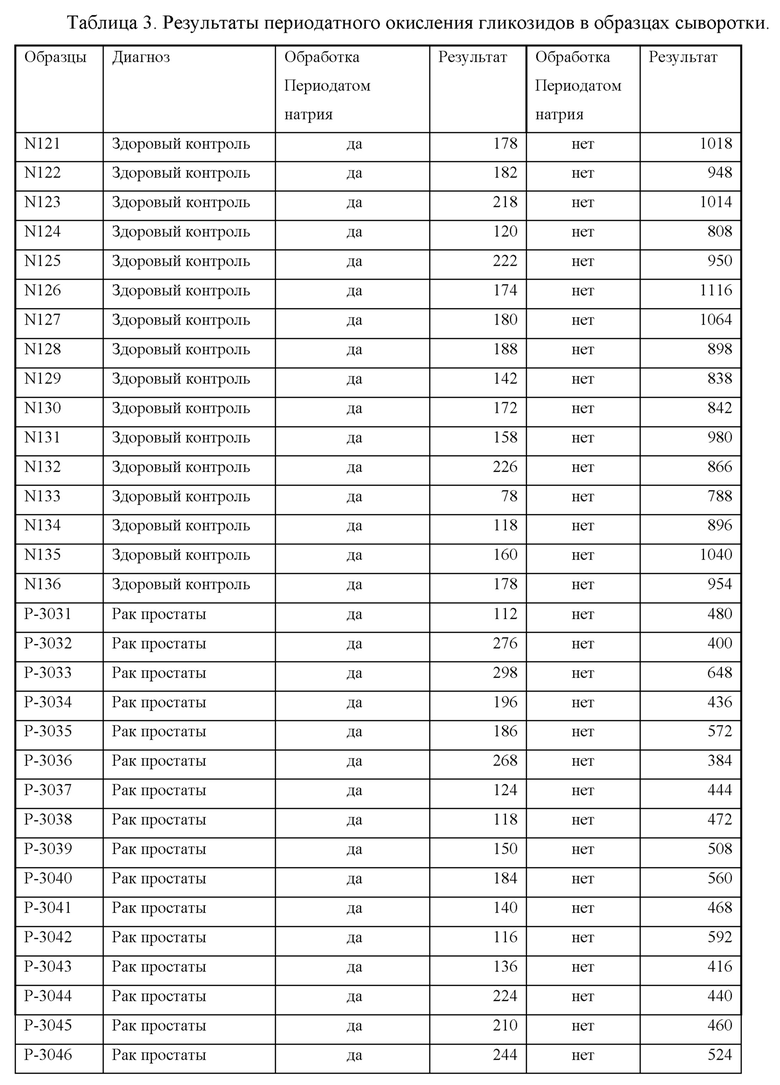
Результаты проведенного эксперимента показали, что образцы, подверженные периодатному окислению, которое уничтожает активность гликозидов, показали отсутствие различия между больными и здоровыми, в отличие от контрольных образцов, которые не обрабатывались периодатом натрия (Фигуры 12 и 13).
Вывод: Периодатное окисление полисахаридов, являющихся неотъемлемой частью белка-маркера, приводит к потере активности ракового антигена. Приведенные примеры подтвердили гипотезу о том, что активной детерминантой ракового антигена, гликопротеина с М.В 55-85 кДа, является именно углеводный фрагмент гликопротеина, ковалентно связанный с белком через гликозидную часть.
5.3. Ферментативный гидролиз пептидных связей в молекулах белка.
Для дополнительного подтверждения того, что в связывании участвует только полисахаридный фрагмент, а не пептидная цепь гликопротеина, был проведен следующий эксперимент: биоматериал, содержащий гликопротеин, был подвержен полному ферментативному расщеплению пепсином, после чего его активность оценивалась по ингибированию связывания. С наибольшей скоростью пепсин гидролизует пептидные связи, образованные ароматическими аминокислотами - тирозином и фенил ал анином, однако, в отличие от других протеолитических ферментов, трипсина и химотрипсина, строгой специфичностью не обладает. Поскольку расщепление гликопротеина, сорбированного в лунках планшета, приводит к расщеплению пептидных фрагментов, его проводили в течение 24 часов в растворе с использованием 0,04% пепсина при 37°С, рН 2,5 (контрольный ПААГ-гель электрофорез расщепленного биоматериала не показал никаких полос, кроме полосы самого пепсина). После повышения рН с использованием бор гидр ид а натрия NaB4 смешивали 1 мкг/мл раствор АФП-Биотин с различными концентрациями расщепленного пепсином экстракта MCF-7. Затем эту реакционную смесь добавляли в лунки, покрытые тем же экстрактом, но без расщепления пепсином. Таким образом, предполагалось, что в случае, если эпитопом связывания является пептидный фрагмент гликопротеина, концентрация присоединенного АФП-Биотин будет прямо пропорциональна количеству нерасщепленного гликопротеина. В качестве контроля использовали тот же препарат гликопротеина, обработанного аналогичным образом, описанным выше, но без пепсина. Другой контрольный эксперимент проводили с использованием альбумина человека и моноклональных антител против альбумина.
На Фигуре 14 показано, что кривая ингибирования, полученная с расщепленным пепсином гомогенатом раковых клеток MCF-7, была практически идентична кривой нерасщепленного гомогената. Расщепление пепсином MCF-7 гомогената не привело к различию в связывании с АФП-Биотин. Это не относится к контролю с сывороточным альбумином человека, который показал большую разницу в значениях оптической плотности между расщепленным пепсином и нерасщепленным белком.
Таким образом, проведенный эксперимент с ферментативным расщеплением белков однозначно подтвердил, что активным эпитопом связывания гликопротеина является сам полисахаридный фрагмент, а не белковая часть молекулы.
Вывод: Проведенный эксперимент подтвердил то, что анализируемый гликопротеин с M.W. 55-85 кДа в составе гомогената раковых клеток MCF-7 содержит полисахаридный фрагмент, который отвечает за специфическое связывание с Альфа-фетопротеином и не зависит от состава белка.
5.4. Ферментативное расщепление образцов сыворотки от здоровых контролей и больных раком.
Образцы сыворотки (8 образцов здоровых контролей и 8 образцов сыворотки больных раком) центрифугировали при 16000 об/минв течение 10 минут. К 100 мкл образца добавляли 100 мкл 500 ммоль/л Глицина-HCl, рН 3.0 с содержанием 0,08% пепсина. С помощью рН-индикаторной бумаги верифицировали, что в присутствии фермента сыворотка имеет рН 4.0 или ниже. Затем образцы помещали в инкубатор при 37°С на 18 часов. Ферментативный гидролиз был остановлен при добавлении 1 моль/л Трис-буфера рН 7.5, что было подтверждено присутствием нейтрального рН и увеличением первоначального объема образцов (100 мкл) до 250 мкл. Образцы сыворотки, подверженные ферментативному гидролизу пепсином, прогоняли на 10% ПААГ-гель электрофорезе белков в полиакриламидном геле в присутствии додецилсульфата натрия по методу Лэммли (англ. SDS PAGE) при неденатурирующих условиях. Для этого перед нанесением на гель образцы в объеме 20 мкл/лунку кипятили в присутствии додецилсульфата натрия (SDS) и 2-меркаптоэтанола. Для визуализации результатов электрофореза окрашивание белков в геле проводили с красителем Кумасси синим.
Гель-электрофорез в полиакриламидном геле с SDS показывает 6 образцов сыворотки до и после расщепления пепсином (3 образца РМЖ и 3 здоровых контроля). Очевидно, что большая часть белка исчезла, за исключением полосы, соответствующей пепсину. В том случае, если сайт связывания гликопротеина представляет собой гликозид, а не пептид, мы ожидали увидеть такое же различие между больными и здоровыми контролями, что и до расщепления пепсином (ожидаемые значения должны как-то отличаться из-за фактора разведения образцов). В приведенной ниже таблице 4 показаны численные значения RLU (относительные световые единицы), полученные с теми же образцами до и после их обработки пепсином.
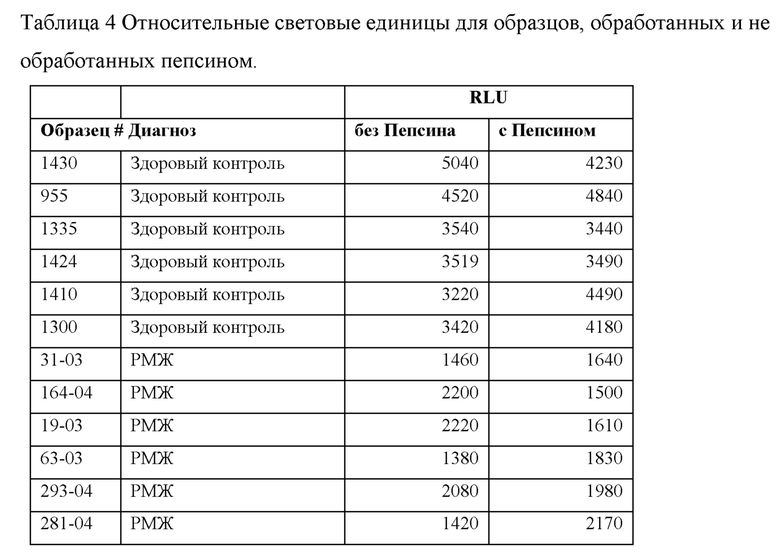
 Выводы:
Выводы:
1. Из Таблицы 5 и Фигуры 16 следует, что соотношение здоровых контролей к больным РМЖ, так же как и различие между образцами, остается неизменным в присутствии или отсутствии пепсина. Это подтверждает нашу гипотезу о том, что активным эпитопом ракового антигена является не белковая часть молекулы, а ее N-гликозидный фрагмент.
2. Обобщенный анализ результатов проведенных исследований по Периодатному окислению гликозидов и ферментативному расщеплению белков пепсином с использованием образцов сыворотки и других биологических материалов указывает на то, что:
а) Результаты, полученные с помощью иммуно-хемилюминесцентного анализа с использованием MAT IgMEC, согласуются с наблюдениями, сделанными в отношении связывания указанного ракового антигена с АФП, а также с IgMEC.
б) Иммуноанализ основывается на гликозидной части ракового антигена, а НЕ на пептидной цепи.
Последовательность белка в данном случае совершенно неактуальна, поскольку вне зависимости от того, какой белок или белки его содержат, количественно измеряется гликозидный фрагмент, который и является активной антигенной детерминантой указанного ракового антигена. В настоящее время уровень техники не позволяет определить структуру и последовательность разветвленной структуры N-гликозида, который связывается с антителом.
3. Таким образом, гликозидная природа гликопротеина, имеющего сродство к АФП и молекулярный вес 55-85 кДа, были установлены с использованием различных методов: периодатным окислением полисахаридов, уничтожающих их активность, и ферментативного гидролиза пептидных связей в молекулах белка при помощи протеолитического фермента пепсина с образованием более простых пептидов и свободных аминокислот.
Пример 6 Ингибирование N-гликозилирования с использованием туникамицина.
Для подтверждения N-гликозилирования ракового антигена, гликопротеина с M.W. 60-65 кДа в составе раковых клеток, гомогенаты раковых клеток инкубировали с туникамицином, который специфически блокирует N-связанное гликозилирование. Гомогенаты раковых клеток аденокарциномы молочной железы MCF-7 наносили в различных концентрациях в лунки планшета для ИФА с последующей инкубацией с 10 мкг/мл ΑΦΠ-HRP в течение 2х часов при комнатной температуре. Активность связывания АФП с раковыми клетками, обработанными туникамицином, была значительно ниже по сравнению с необработанными контрольными клетками, при этом для достижения тех же значений оптической плотности требовалось значительно более высокое количество сорбированного клеточного гомогената MCF-7 (Фигура 17.).
Из Фигуры 17 очевидно, что обработка указанного гликопротеина туникамицином привела к 90% снижению связывания АФП с гомогенатом клеток MCF-7. При этом, обработка клеток галактозамидом, который ингибирует связывание О-гликозидов, не привела к изменению связывания.
Вывод: Эти результаты однозначно подтверждают, что анализируемый гликопротеин с M.W. 55-85 кДа в составе гомогената раковых клеток MCF-7 содержит именно N-гликозид, который является эпитопом связывания с АФП.
Пример 7:
Для определения диагностической чувствительности и специфичности теста с использованием выделенного ракового антигена, специфичного для эпителиальных карцином в рамках ослепленных клинико-лабораторных исследований были проанализированы 300 верифицированных образцов сыворотки, включающих 58 образцов сыворотки крови от больных колоректальным раком, 25 образцов сыворотки от больных раком молочной железы, 32 образца сыворотки от больных раком легкого, 35 образцов сыворотки от больных раком предстательной железы и 150 верифицированных образцов сыворотки здоровых контролей соответствующего возраста и пола. Результаты проведенных исследований представлены на Фигуре 18.
Определение диагностической чувствительности
Диагностическая (клиническая) чувствительность определялась как доля, выраженная в процентах, истинно положительных результатов, подтвержденных гистологическими исследованиями образцов, в группе больных. Для расчета «истинного» значения клинической (диагностической) чувствительности использовалась формула в соответствии с ГОСТ Ρ 53022.3-2008 (Таблица 4, раздел 5.5) и ГОСТ Ρ ИСО 18113-1-2015 (Раздел А.3.15):
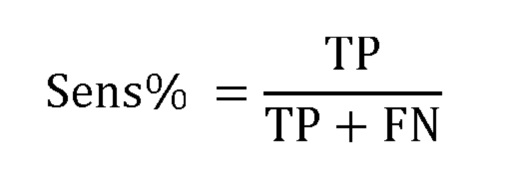
где
TP - истинно положительный результат анализа, подтвержденный гистологически,
FN - ложноотрицательный результат анализа, подтвержденный гистологически.
Таким образом, «истинное» значение диагностической чувствительности при 95% специфичности составило 93,7% (см. Таблицу 2).
Для расчета интервала, в котором находится «истинное» значение диагностической чувствительности и специфичности с доверительной вероятностью С=95%, то есть для определения показателя правильности исследований, использовалась формула в соответствии с ГОСТ Ρ 53022.3-2008 и теорией вероятности для независимых испытаний по распределению Бернулли*:
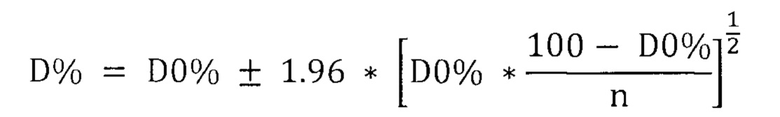
где Do% - целевое значение величины относительного смещения;
D% - целевое значение коэффициента общей аналитической вариации;
1,96 - квантиль стандартного нормального распределения для уровня значимости 0,05.
* Распределение Бернулли в теории вероятностей и математической статистике -дискретное распределение вероятностей, моделирующее случайный эксперимент произвольной природы, при известной вероятности успеха или неудачи. Положинцев Б.И. Теория вероятностей и математическая статистика. Введение в математическую статистику: Учебное пособие. - СПб.: Изд-во Политехи, ун-та, 2010. - 95 с.Интервал, в котором находится «истинное» значение диагностической чувствительности с доверительной вероятностью С=95%, составил 89,8-97,6%.
Определение диагностической специфичности
Диагностическая специфичность лабораторного теста определялась как доля, выраженная в процентах, истинно отрицательных образцов сыворотки здоровых людей, имеющих подтвержденное отсутствие онкологических заболеваний, к группе здоровых. Для расчета «истинного» значения клинической (диагностической) специфичности использовалась формула в соответствии с ГОСТ Ρ 53022.3-2008 (Таблица 4, Раздел 5.5) и ГОСТ Ρ ИСО 18113-1-2015 (Раздел А.3.16):
Sp%= TΝ * (TN+FP)
где
TN - истинно отрицательный результат анализа,
FP - ложно положительный результат анализа.
Таким образом, «истинное» значение диагностической специфичности составило 98,7% (см. Таблицу 6). Интервал, в котором находится «истинное» значение диагностической специфичности с доверительной вероятностью С=95%, составил 96,9-100,0%.

Выводы: Проведенные ранее исследования на различных группах образцов сыворотки, больных раком, с использованием способа обработки образцов, описанных в данном изобретении, позволило разделить образцы больных от здоровых контролей и больных различными доброкачественными заболеваниями (данные не показаны) с высокой чувствительностью и специфичностью. При этом для образцов сыворотки больных раком наблюдалась самая высокая концентрация указанного ракового антигена на самых ранних стадиях развития болезни, что отличает новый раковый антиген от других опухолевых маркеров. Именно эта особенность указанного ракового антигена может быть использована для скрининговых исследований среди условно-здоровой популяции.
СПИСОК ЛИТЕРАТУРЫ:
l.Severin SE, Moskaleva ΕΥ, Shmyrev II, et al. Alpha- fetoprotein-mediated targeting of anticancer drugs to tumor cells in vitro. Biochem Mol Biol Int 1995; 37: 385-392.
2. Pak V. Compositions of Alpha-fetoprotein and inducers of apoptosis for the treatment of cancer. Google Patents, 2008, http://www.google.com.na/patents/US 20080318840).
3. Janneta Tcherkassova, Sergei Tsurkan, Galina Smirnova, Julia Borisova, Ricardo Moro and Helen Treshalina. Binding characterization of the targeting drug AIMPILA to AFP receptors in human tumor xenographts. Tumor Biology 2017: online access P. 1-11).
4. Sergei Tsurkan, Janneta Tcherkassova, Vera Gorbunova, Helen Treshalina, Elena Yu. Grigorieva. New drug AIMPILA targeted to AFP receptor: Oral anticancer therapy and biodistribution in vivo. Journal of Clinical Oncology. 2018. Volume 36, Issue 15_suppl, p.e24232
5. D. M. Weir & CC. Blackwell, eds. Handbook of Experimental Immunology, 1987; 4th edition,., Blackwell Science Inc.,
6. F. M. Ausubel et al., eds.Current Protocols in Molecular Biology 1987.
7. Spiro, Α., Lowe, M. and Brown, D. A Bead-Based Method for Multiplexed Identification and Quantitation of DNA Sequences Using Flow Cytometry. Appl. Env. Micro. 66, 4258-4265 (2000).
8. Crowther, J. R. The ELISA guidebook. Humana Press: New Jersey (2000);
9. Harlow, E. and Lane, D., Using antibodies: a laboratory manual. Cold Spring Harbor Laboratory Press: Cold Spring Harbor (1999).
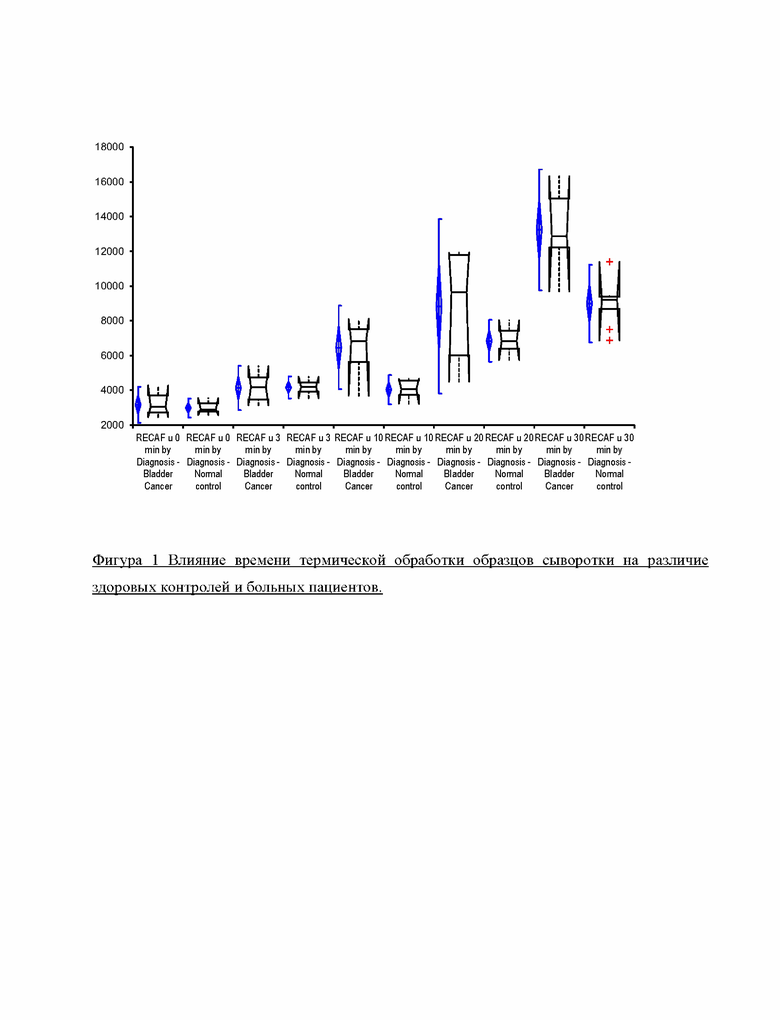
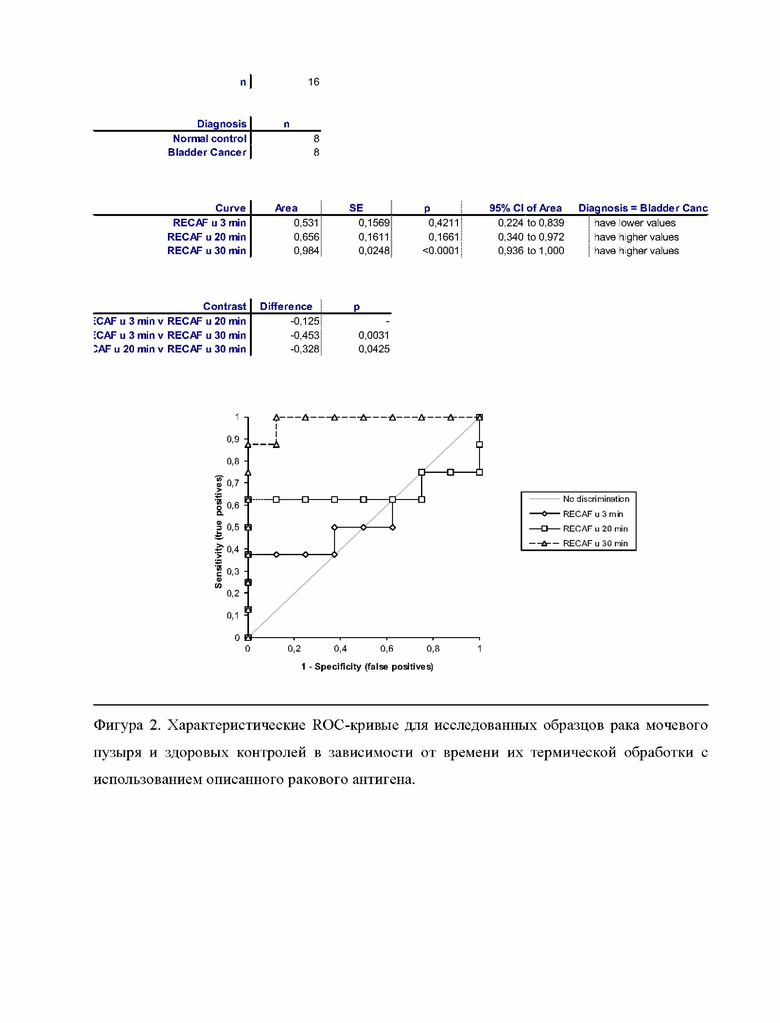
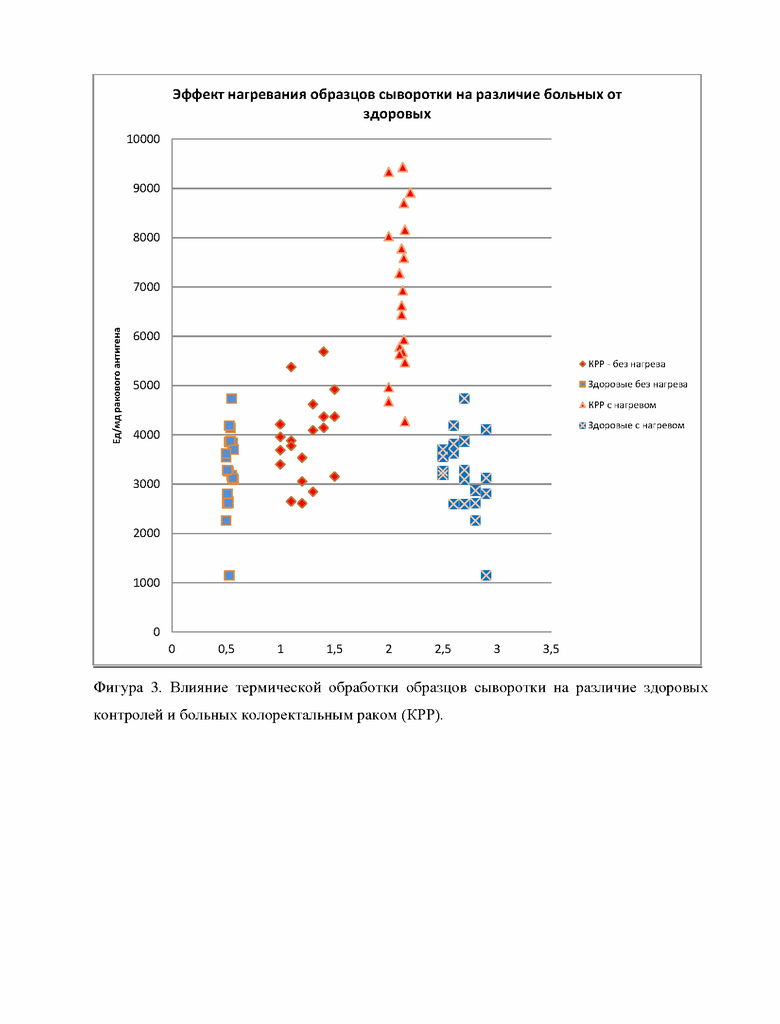
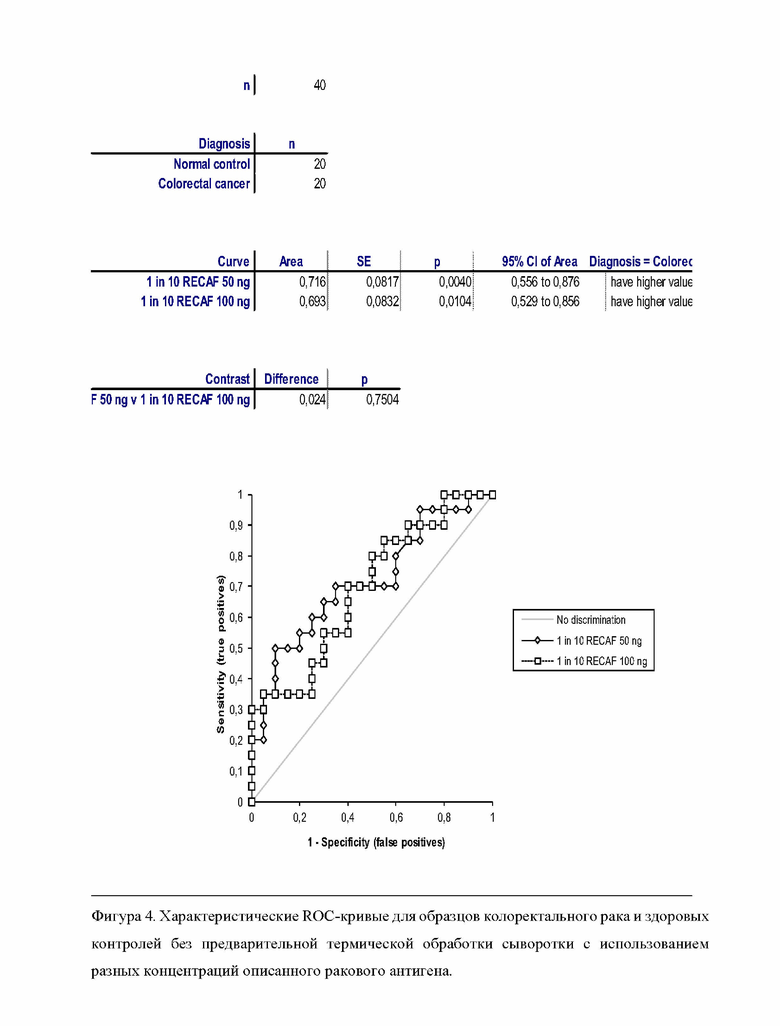
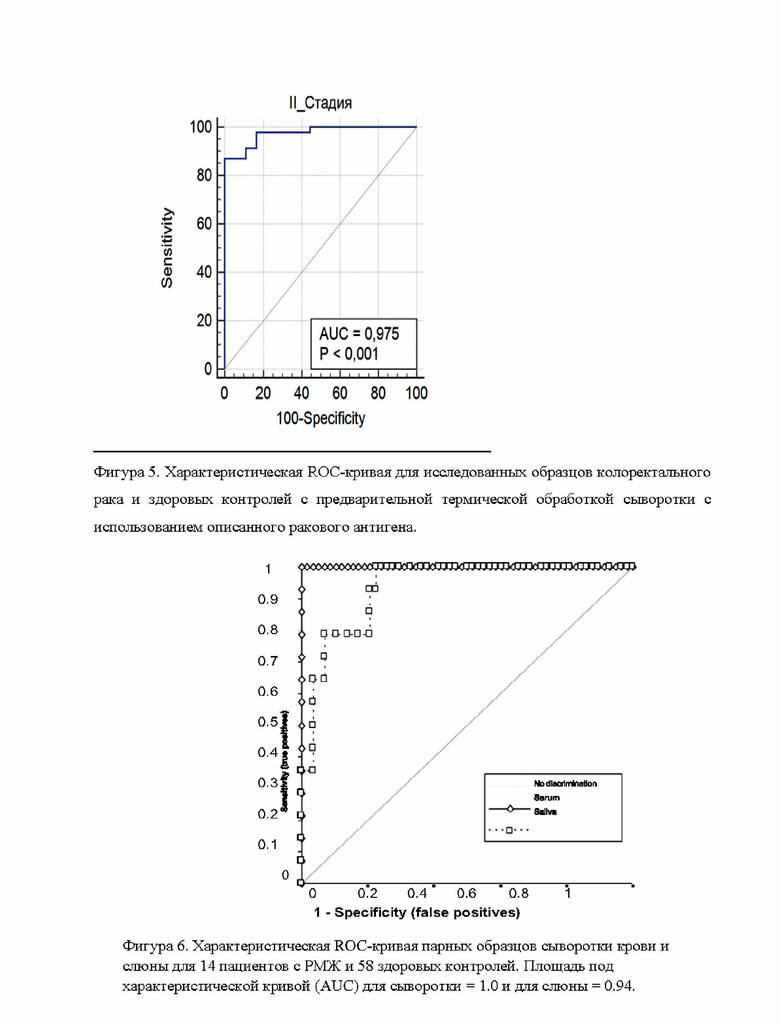
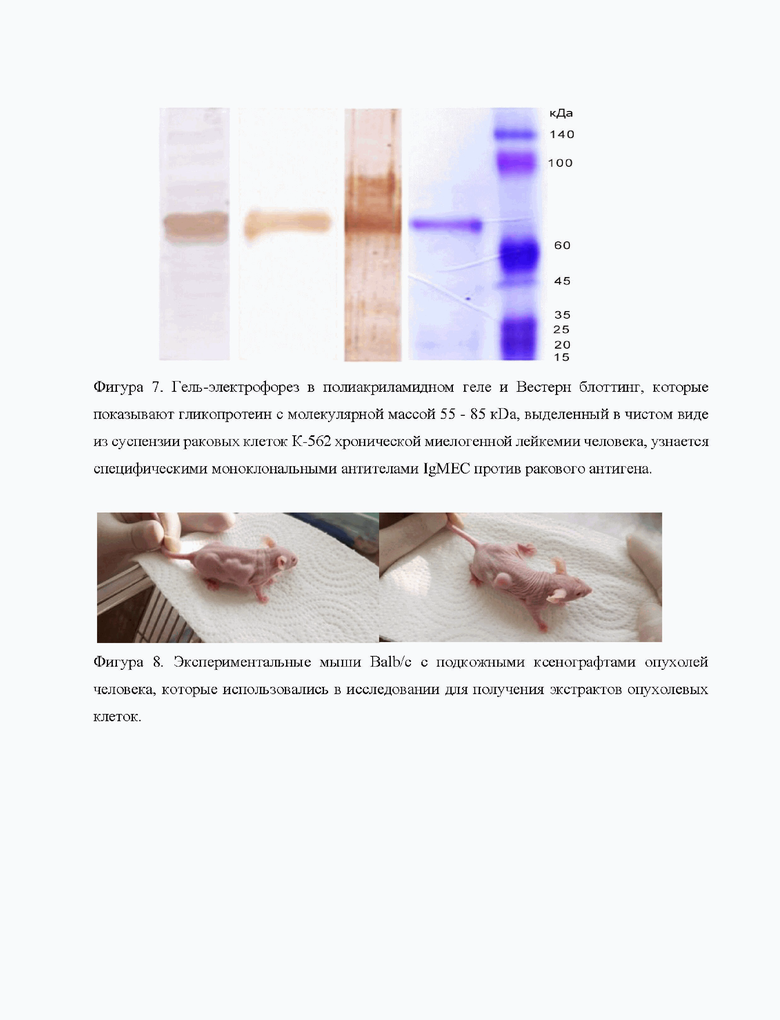
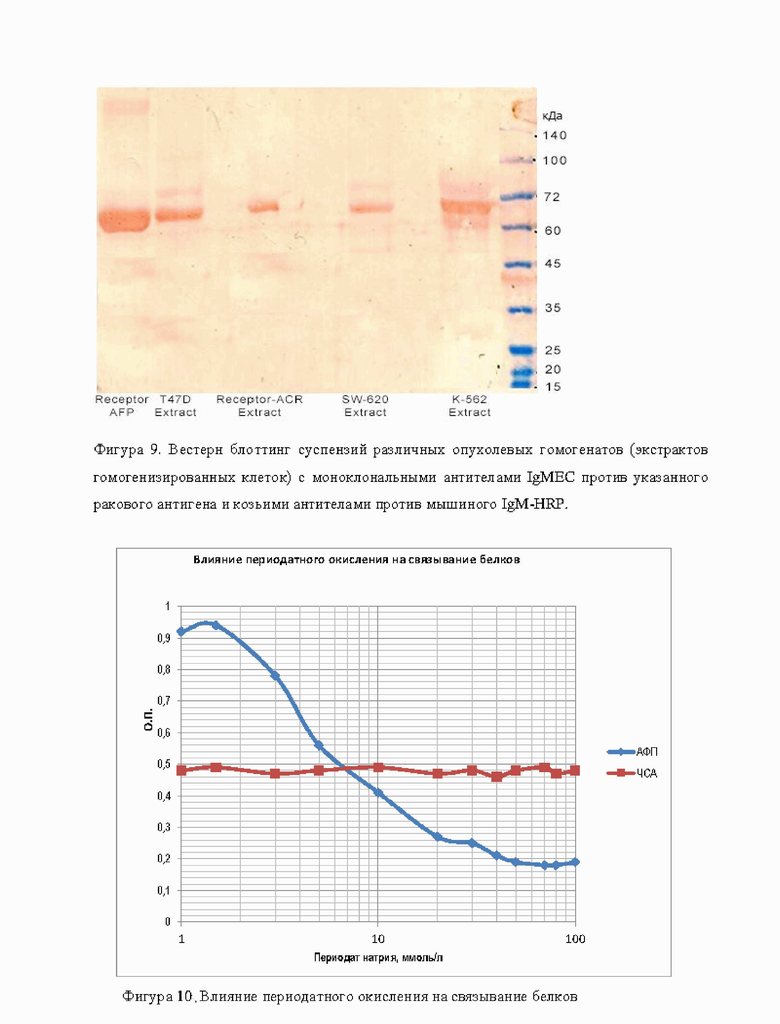
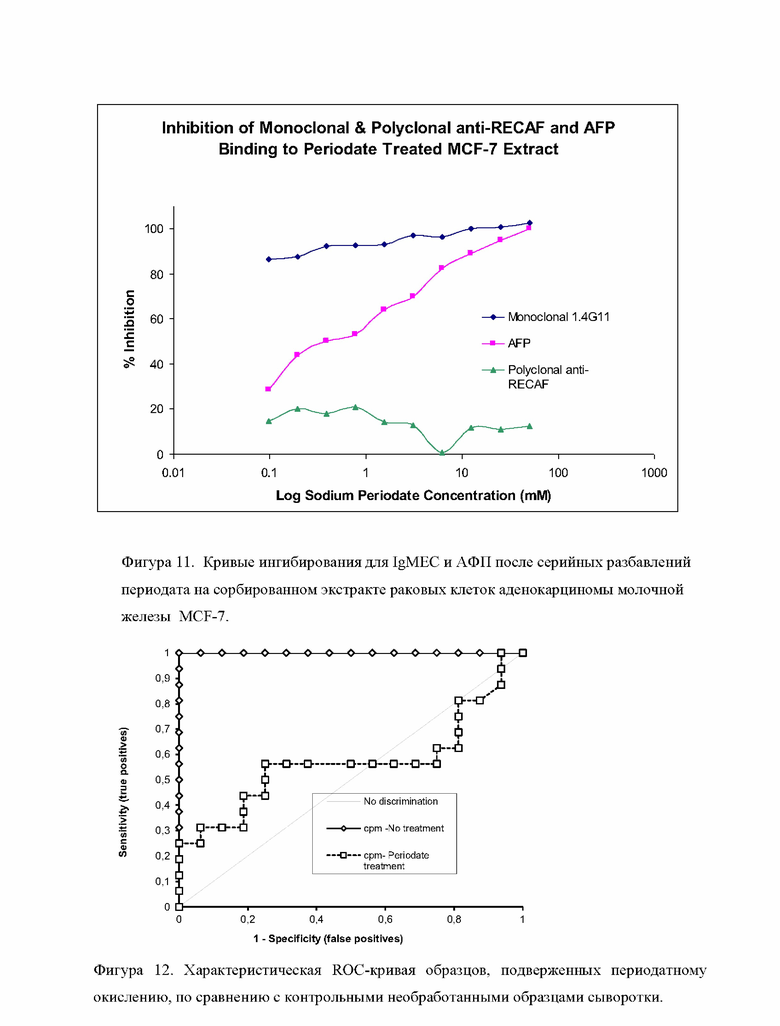
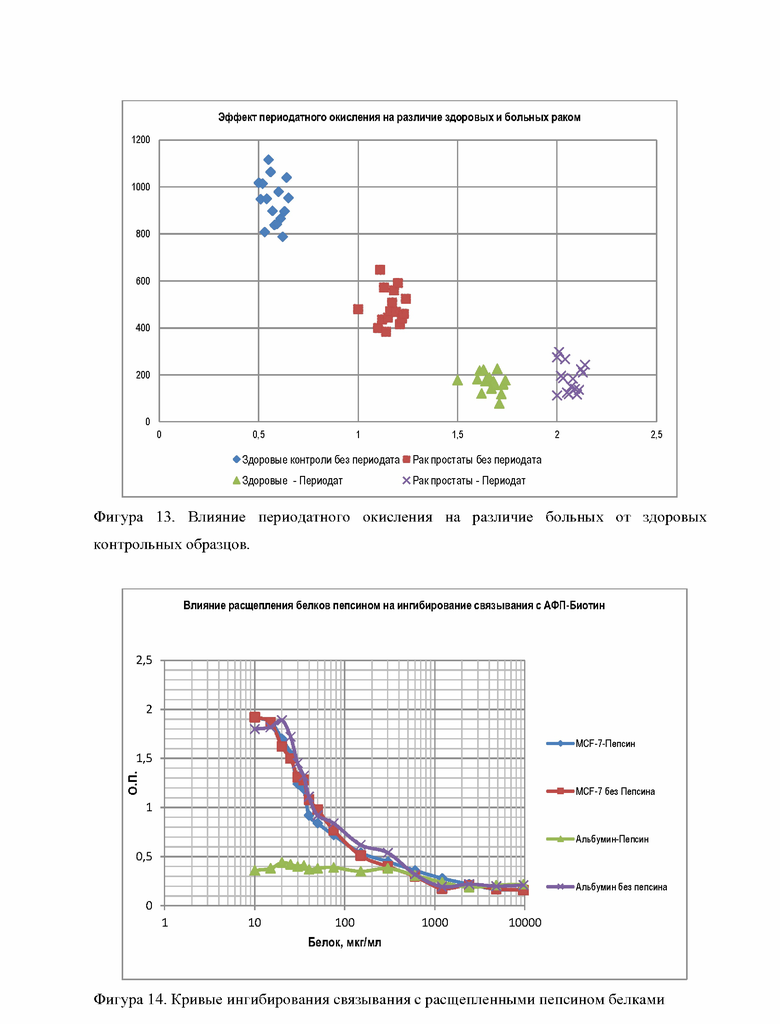
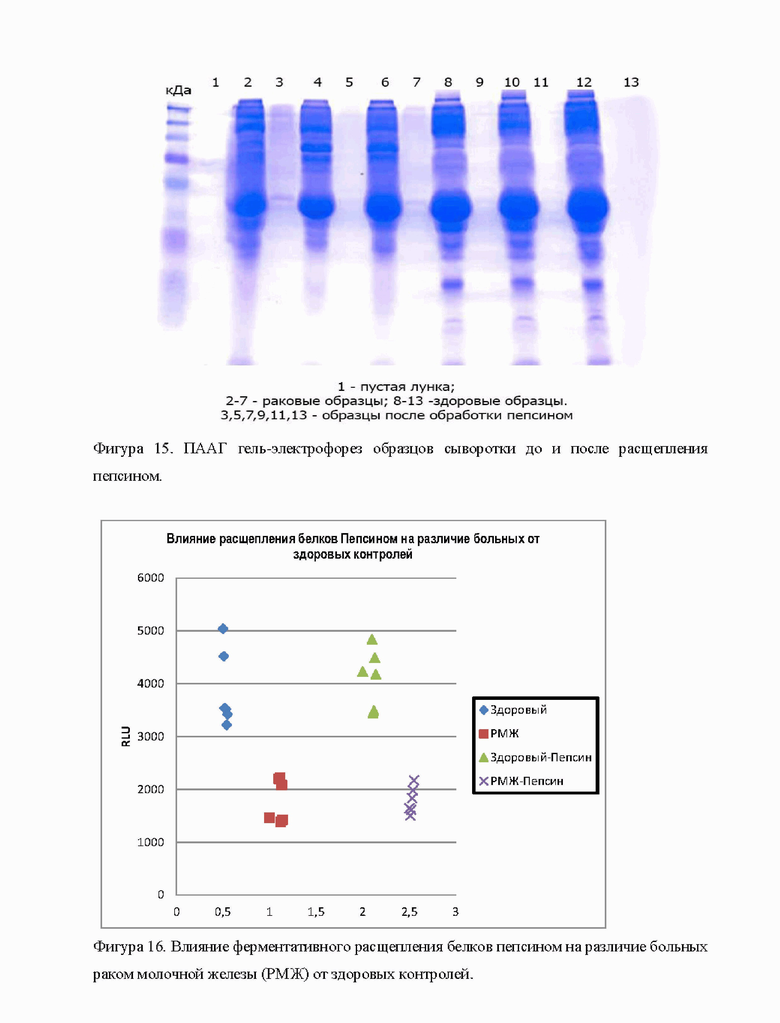
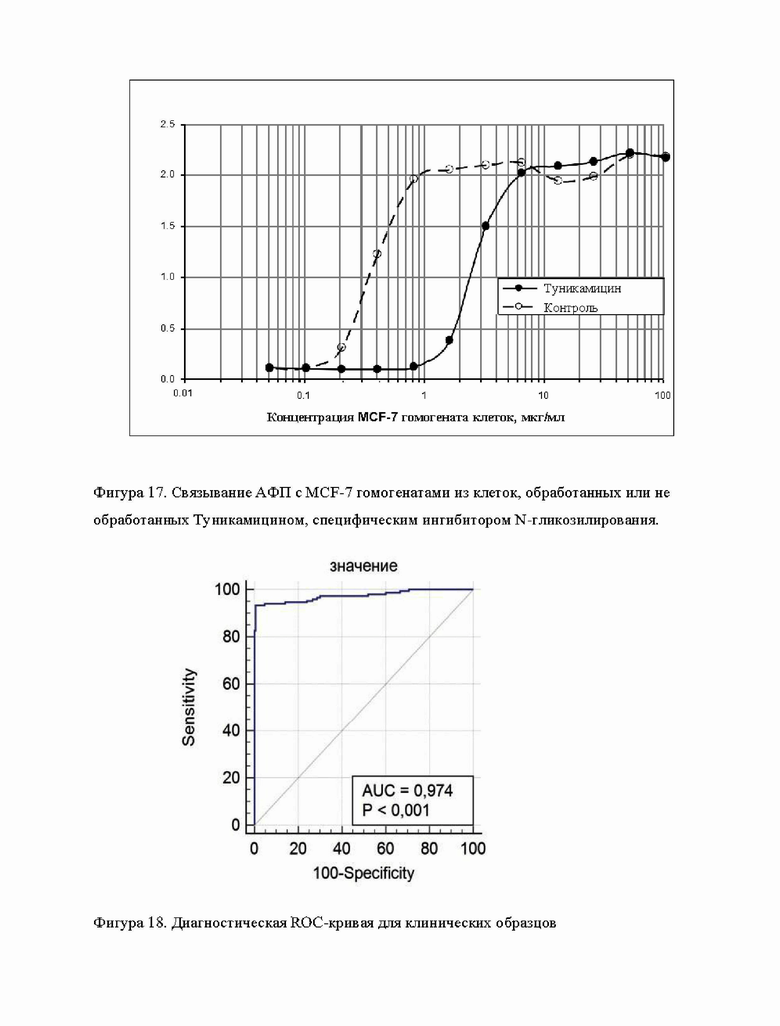
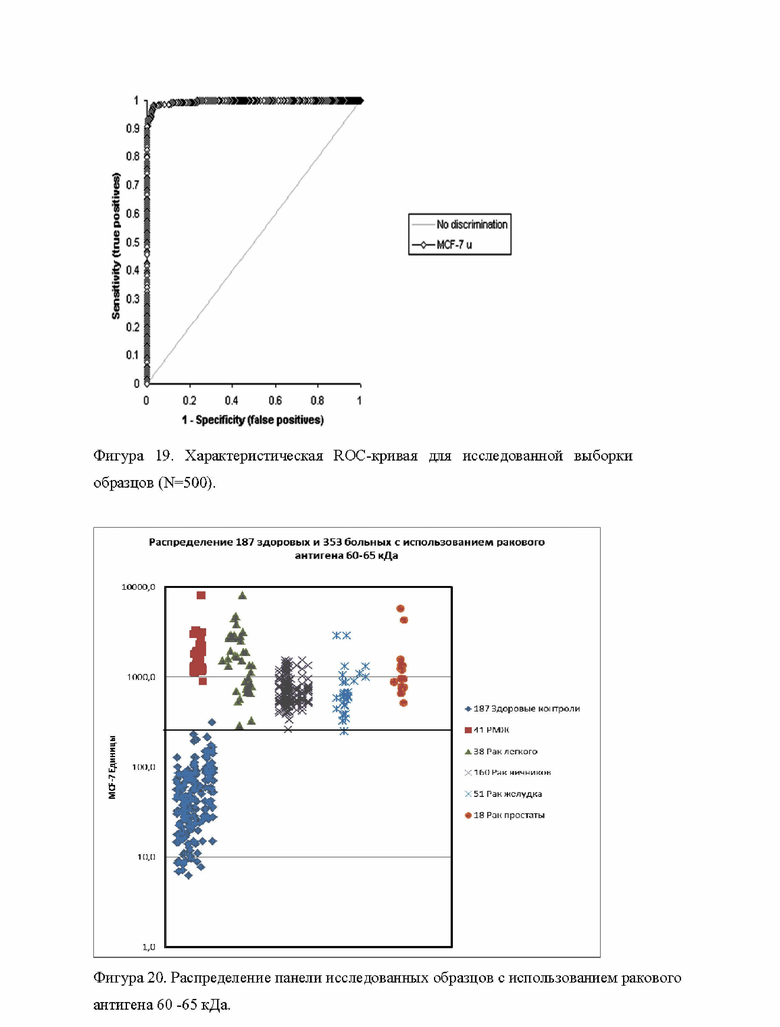
Группа изобретений относится к медицине, а именно к лабораторной диагностике и онкологии, включает раковый антиген, представляющий собой семейство N-гликопротеинов, обладающих идентичным N-гликозилированием, с молекулярной массой 60-85 кДа, и способ, который может быть использован для определения высокой вероятности наличия эпителиального рака путем определения концентрации ракового антигена - маркера эпителиальных видов рака, представляющего собой семейство N-гликопротеинов, обладающих идентичным N-гликозилированием. Получают образец крови, или опухолевой ткани, или слюны пациента с подозрением на наличие злокачественных новообразований эпителия. Получают образцы крови или слюны от контрольной группы здоровых людей, не имеющих злокачественных опухолей. Активируют раковый антиген - маркер эпителиальных видов рака - посредством термического воздействия в температурном режиме от 50°C до 65°C в течение 30 минут на биологическую жидкость пациента - кровь или слюну или на суспензию опухолевых клеток и на биологические жидкости здоровых людей - кровь или слюну. Определяют концентрацию маркера эпителиальных видов рака в полученных после термического воздействия образцах. Если концентрация маркера эпителиальных видов рака в полученном после термического воздействия образце биологической жидкости пациента превышает концентрацию маркера эпителиальных видов рака в полученных после термического воздействия образцах биологических жидкостей здоровых людей, то делают вывод о высокой вероятности наличия у пациента эпителиального рака. Способ обеспечивает возможность выявления и скрининга карцином за счет определения, выделения и детекции нового ракового антигена, который представляет собой семейство N-гликопротеинов, обладающих идентичным N-гликозилированием, с молекулярной массой 60-85 кДа, ассоциированного с опухолями эпителиальных тканей. 2 н. и 1 з.п. ф-лы, 20 ил., 6 табл., 7 пр.
1. Способ определения высокой вероятности наличия эпителиального рака путем определения концентрации ракового антигена - маркера эпителиальных видов рака, представляющего собой семейство N-гликопротеинов, обладающих идентичным N-гликозилированием, заключающийся в том, что: (а) получают образец крови, или опухолевой ткани, или слюны пациента с подозрением на наличие злокачественных новообразований эпителия; (б) получают образцы крови или слюны от контрольной группы здоровых людей, не имеющих злокачественных опухолей; (в) активируют раковый антиген - маркер эпителиальных видов рака - посредством термического воздействия в температурном режиме от 50°C до 65°C в течение 30 минут на биологическую жидкость пациента - кровь или слюну или на суспензию опухолевых клеток и на биологические жидкости здоровых людей - кровь или слюну; (г) определяют концентрацию маркера эпителиальных видов рака в полученных после термического воздействия образцах; (д) если концентрация маркера эпителиальных видов рака в полученном после термического воздействия образце биологической жидкости пациента превышает концентрацию маркера эпителиальных видов рака в полученных после термического воздействия образцах биологических жидкостей здоровых людей, то делают вывод о высокой вероятности наличия у пациента эпителиального рака.
2. Способ по п. 1, по которому определение концентрации маркера эпителиальных видов рака проводят методом иммуноанализа любого типа с использованием кислой среды в диапазоне рН 3-5 в течение 2 часов.
3. Раковый антиген, представляющий собой семейство N-гликопротеинов, обладающих идентичным N-гликозилированием, с молекулярной массой 60-85 кДа.
| НАБОР РЕАГЕНТОВ ДЛЯ ВЫЯВЛЕНИЯ МАРКЕРА ЭПИТЕЛИАЛЬНЫХ КАРЦИНОМ | 2018 |
|
RU2735918C2 |
| WO 2011003369 A1, 13.01.2011 | |||
| WO 2010016527 A1, 11.02.2010 | |||
| WO 2009126920 A2, 15.10.2009 | |||
| WO 2007031222 A3, 26.07.2007 | |||
| KIRWAN A | |||
| et al | |||
| Glycosylation-based serum biomarkers for cancer diagnostics and prognostics | |||
| Biomed Res Int | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| TUCCILLO F.M | |||
| et al | |||
| Aberrant glycosylation as biomarker for cancer: | |||
Авторы
Даты
2024-05-02—Публикация
2020-04-22—Подача