ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Область применения этого изобретения, в целом, относится к диагностическим методам анализа, наборам для видов терапии на основе использования рецептора фолиевой кислоты 1 и антителам, которые связываются с рецептором фолиевой кислоты 1 человека.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] Рак является одной из основных причин смерти более чем одного миллиона человек, у которых диагностируют рак, в развитых страна мира и 500000 случаев смерти в год только в Соединенных Штатах. В общем, предполагается, что у более чем 1 из 3 человек разовьется определенная форма ракового заболевания в течение их продолжительности жизни. Существует более 200 различных типов раковых заболеваний, четверо из которых - рак молочной железы, легких, колоректальный рак и рак простаты, отвечают за большую половину всех новых случаев заболеваний (Jemal et al., 2003, Cancer J. Clin. 53: 5-26).
[0003] Рецептор фолиевой кислоты 1 (FOLR1), также известный как рецептор фолиевой кислоты-альфа или фолатсвязывающий белок, представляет собой N-гликозилированный белок, экспрессируемый на плазматической мембране клеток. FOLR1 обладает высокой аффинностью к фолиевой кислоте и несколько пониженной к производным фолиевой кислоты. FOLR1 опосредует доставку физиологического фолата, 5-метилтетрагидрофолата, во внутреннее пространство клетки.
[0004] FOLR1 сверхэкспрессируется при подавляющем большинстве раковых заболеваний яичников, а также при множестве раковых заболеваний матки, эндометрия, поджелудочной железы, почек, легких и молочной железы, в то время как экспрессия FOLR1 в нормальных тканях ограничена апикальной мембраной эпителиальных клеток в проксимальных канальцах почек, альвеолярных пневмоцитах легких, мочевого пузыря, яичек, хориоидного сплетения и щитовидной железы (Weitman SD, et al., Cancer Res 52: 3396-3401 (1992); Antony AC, Annu Rev Nutr 16: 501-521 (1996); Kalli KR, et al. Gynecol Oncol 108: 619-626 (2008)). Этот профиль экспрессии FOLR1 делает его подходящей мишенью для FOLR1-направленной терапии рака.
[0005] Из-за того, что рак яичников, как правило, до поздней стадии протекает бессимптомно, то он часто диагностируется на поздней стадии и имеет неблагоприятный прогноз при лечении доступными в настоящее время процедурами, как правило, химиотерапевтическими лекарственными средствами после хирургической циторедукции (von Gruenigen V et al., Cancer 112: 2221-2227 (2008); Ayhan A et al., Am J Obstet Gynecol 196: 81 e81-86 (2007); Harry VN et al., Obstet Gynecol Surv 64: 548-560 (2009)). Поэтому, существует четкая нереализованная медицинская потребность в более эффективных методах диагностики раковых заболеваний яичников.
[0006] Некоторые предложенные раннее методы анализа, используемые для обнаружения сброшенного FOLR1, не являются достаточно специфическими для FOLR1. К примеру, в некоторых методах анализа не распознаются FOLR1 и другие представители семейства рецепторов фолиевой кислоты (FOLR2, 3 и 4) или определяются значения общего содержания FBP (фолатсвязывающего белка). В дополнение к этому, для некоторых методов анализа требуется, чтобы полученные у людей образцы (например, плазмы) предварительно обрабатывались с использованием стадии промывки слабой кислотой для диссоциации фолиевой кислоты от рецептора. Некоторые результаты анализов также могут давать неточности из-за конкурентных эффектов между терапией антителами и диагностическим антителом. В дополнение к этому, многие коммерчески доступные наборы традиционно являются ненадежными как из-за реактивов, так и из-за стабильности, изменяющейся от серии к серии. Оценки этих наборов дали очень неоднозначные результаты, а наборы предназначаются только для научно-исследовательских работ. Для многих наборов требуется, чтобы полученные у людей образцы, перед проведением анализа предварительно разбавлялись для уменьшения вероятности получения ложноположительных результатов вследствие «эффекта матрицы». Таким образом, существует четкая потребность в высокой чувствительности и точности диагностических методов анализа, которые могут выявлять клинически значимый динамический диапазон FOLR1 как сопутствующий метод для видов терапии на основе FOLR1.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] В данном документе представлено все, что касается анти-FOLR1 антител и их антигенсвязывающих фрагментов, а также способы для обнаружения FOLR1, диагностирования FOLR1-опосредованных заболеваний и нарушений (таких как рак), мониторинга эффективности анти-FOLR1 видов терапии, оптимизации анти-FOLR1 видов терапии и стратификации пациентов.
[0008] Анти-FOLR1 антитела, предложенные в данном документе, могут иметь диагностическое значение. К примеру, анти-FOLR1 антитела, предложенные в данном документе, применяются для различения опухолевых и неопухолевых клеток или тканей или для идентификации типов, подтипов или степеней злокачественности опухолей. В одном варианте реализации изобретения анти-FOLR1 антитело, предложенное в данном документе, и/или анализ для FOLR1-обнаружения, предложенный в данном документе, может использоваться для различения субтипов немелкоклеточного рака легких (НМРЛ), включая аденокарциному и плоскоклеточную карциному, как описано в данном документе. В другом варианте реализации изобретения анти-FOLR1 антитело, предложенное в данном документе, и/или анализ для FOLR1-обнаружения, предложенный в данном документе, может использоваться для исключения типа ракового заболевания (например, для определения того, что клетка или ткань не принадлежит к какому-либо типу ракового заболевания), к примеру, саркомы.
[0009] В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент, предложенный в данном документе, может специфически связываться с эпитопом FOLR1, причем эпитоп содержит по меньшей мере одну, по меньшей мере две или три N-гликозилированные аминокислоты. Гликозилирование может быть критически важным для мембранной локализации. См. например, Yan et al., J. Am. Soc. Nephol. 13: 1385-1389 (2002). Предпочтительно, антитела и антигенсвязывающие фрагменты в данном документе могут выявлять экспрессию FOLR1 на клеточной мембране и выявлять клинически значимый динамический диапазон FOLR1. Более адекватное окрашивание, полученное с антителами и антигенсвязывающими фрагментами, предложенными в данном документе, позволяет провести различение среди образцов, сгруппированных всех вместе как обладающих высокими уровнями экспрессии (с показателем 3), используя антитела, которые связываются с разными эпитопами FOLR1, без достаточной специфичности и/или без достаточной чувствительности.
[0010] В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент, предложенный в данном документе, может специфически связываться с таким же эпитопом FOLR1, как и антитело, выбранное из группы, состоящей из: (а) антитела, содержащего полипептид по SEQ ID №: 27 и полипептид по SEQ ID №: 28; (b) антитела, содержащего полипептид по SEQ ID №: 29 и полипептид по SEQ ID №: 30; (с) антитела, содержащего полипептид по SEQ ID №: 31 и полипептид по SEQ ID №: 32; (d) антитела, содержащего полипептид по SEQ ID №: 62 и полипептид по SEQ ID №: 63 или по SEQ ID №: 64, и (е) антитела, содержащего полипептид по SEQ ID №: 65 и полипептид по SEQ ID №: 66 или SEQ ID №: 67. В некоторых вариантах реализации изобретения эпитоп содержит N-гликозилированную аминокислоту.
[0011] В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент, предложенный в данном документе, может специфически связываться с FOLR1, причем указанное антитело или его фрагмент конкурентно ингибирует связывание с FOLR1 антитела, выбранного из группы, состоящей из: (а) антитела, содержащего полипептид по SEQ ID №: 27 и полипептид по SEQ ID №: 28; (b) антитела, содержащего полипептид по SEQ ID №: 29 и полипептид по SEQ ID №: 30; (с) антитела, содержащего полипептид по SEQ ID №: 31 и полипептид по SEQ ID №: 32; (d) антитела, содержащего полипептид по SEQ ID №: 62 и полипептид по SEQ ID №: 63 или SEQ ID №: 64, и (е) антитела, содержащего полипептид по SEQ ID №: 65 и полипептид по SEQ ID №: 66 или SEQ ID №: 67.
[0012] В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент содержит полипептидные последовательности VH CDR1-3 и VL CDR1-3, выбранные из группы, состоящей из: (a) SEQ ID №: 3-8, соответственно; (b) SEQ ID №: 9-14, соответственно; (с) SEQ ID №: 15-20, соответственно; (d) SEQ ID №: 21-26, соответственно; (е) SEQ ID №: 3-5, и SEQ ID №: 59, 7 и 8, соответственно; (f) SEQ ID №: 3, 60 и 5, и SEQ ID №: 6-8, соответственно; (g) SEQ ID №: 3, 61 и 5, и SEQ ID №: 6-8, соответственно; (h) SEQ ID №: 3, 60 и 5, и SEQ ID №: 59, 7 и 8, соответственно, и (i) SEQ ID №: 3, 61 и 5, и SEQ ID №: 59, 7 и 8, соответственно.
[0013] В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент, предложенный в данном документе, может специфически связываться с FOLR1, причем антитело или его фрагмент содержит полипептидные последовательности VH CDR1-3 и VL CDR1-3, выбранные из группы, состоящей из: (a) SEQ ID №: 3-8, соответственно; (b) SEQ ID №: 9-14, соответственно; (с) SEQ ID №: 15-20, соответственно; (d) SEQ ID №: 21-26, соответственно; (е) SEQ ID №: 3-5, и SEQ ID №: 59, 7 и 8, соответственно; (f) SEQ ID №: 3, 60 и 5, и SEQ ID №: 6-8, соответственно; (g) SEQ ID №: 3, 61 и 5, и SEQ ID №: 6-8, соответственно; (h) SEQ ID №: 3, 60 и 5, и SEQ ID №: 59, 7 и 8, соответственно, и (i) SEQ ID №: 3, 61 и 5, и SEQ ID №: 59, 7 и 8, соответственно, и (j) варианты от (а) до (i), включающие 1, 2, 3 или 4 консервативные аминокислотные замены.
[0014] В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент содержит полипептидные последовательности, которые являются по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентичными полипептидным последовательностям, выбранным из группы, состоящей из: (a) SEQ ID №: 27 и SEQ ID №: 28; (b) SEQ ID №: 29 и SEQ ID №: 30; (с) SEQ ID №: 31 и SEQ ID №: 32; (d) SEQ ID №: 62 и SEQ ID №: 63 или SEQ ID №: 64; (е) SEQ ID №: 65 и SEQ ID №: 66 или SEQ ID №: 67; (f) SEQ ID №: 68 и SEQ ID №: 69. В некоторых вариантах реализации полипептидные последовательности преимущественно состоят из аминокислот последовательностей, выбранных из группы, состоящей из: (a) SEQ ID №: 27 и SEQ ID №: 28; (b) SEQ ID №: 29 и SEQ ID №: 30; (с) SEQ ID №: 31 и SEQ ID №: 32; (d) SEQ ID №: 62 и SEQ ID №: 63 или SEQ ID №;64; (е) SEQ ID №: 65 и SEQ ID №: 66 или SEQ ID №: 67; (f) SEQ ID №: 68 и SEQ ID №: 69.
[0015] В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент, предложенный в данном документе, может специфически связываться с FOLR1, причем антитело или его фрагмент содержит гуманизированный вариабельный участок тяжелой цепи, содержащий участки CDR1, CDR2 и CDR3, содержащие аминокислоты SEQ ID №: 51, SEQ ID №: 52 или 53, и SEQ ID №: 54, соответственно, гуманизированный вариабельный участок легкой цепи, содержащий участки CDR1, CDR2 и CDR3, содержащие аминокислоты SEQ ID №: 48, SEQ ID №: 49 и SEQ ID №: 50, соответственно, и константный участок мыши. В некоторых вариантах реализации изобретения гуманизированный вариабельный участок тяжелой цепи содержит аминокислоты SEQ ID №: 45, а гуманизированный вариабельный участок легкой цепи содержит аминокислоты SEQ ID №: 47.
[0016] В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент получены рекомбинантным способом. В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент является мышиным, нечеловеческим, гуманизированным, химерным, с измененной поверхностью или человеческим. В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент связывается с FOLR1 человека, но не с FOLR2 или FOLR3. В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент является полноразмерным антителом. В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент является антигенсвязывающим фрагментом. В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент содержит, преимущественно состоит из или состоит из Fab, Fab', F(ab')2, Fd, одноцепочечного Fv или scFv, связанного дисульфидными связями Fv, домена V-NAR, IgNar, интратела, IgGΔCH2, минитела, F(ab')3, тетратела, тритела, диатела, однодоменного антитела, DVD-Ig, Fcab, mAb2, (scFv)2 или scFv-Fc.
[0017] В некоторых вариантах реализации изобретения полипептид, предложенный в данном документе, может специфически связывать FOLR.1, причем полипептид содержит последовательности, выбранные из группы, состоящей из: (a) SEQ ID №: 3-8, соответственно; (b) SEQ ID №: 9-14, соответственно; (с) SEQ ID №: 15-20, соответственно; (d) SEQ ID №: 21-26, соответственно; (е) SEQ ID №: 3-5 и SEQ ID №: 59, 7 и 8, соответственно; (f) SEQ ID №: 3, 60 и 5, и SEQ ID №: 6-8, соответственно; (g) SEQ ID №: 3, 61 и 5, и SEQ ID №: 6-8, соответственно; (h) SEQ ID №: 3, 60 и 5, и SEQ ID №: 59,7 и 8, соответственно, и (i) SEQ ID №: 3,61 и 5, и SEQ ID №: 59,7 и 8, соответственно, и (j) варианты от (а) до (i), включающие 1, 2, 3 или 4 консервативные аминокислотные замены. В некоторых вариантах реализации изобретения полипептид содержит последовательности, которые являются по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентичными последовательностям, выбранным из группы, состоящей из: (a) SEQ ID №: 27 и SEQ ID №: 28; (b) SEQ ID №: 29 и SEQ ID №: 30; (с) SEQ ID №: 31 и SEQ ID №: 32; (d) SEQ ID №: 62 и SEQ ID №: 63 или SEQ ID №: 64; (е) SEQ ID №: 65 и SEQ ID №: 66 или SEQ ID №: 67, и (f) SEQ ID №: 68 и SEQ ID №: 69. В некоторых вариантах реализации полипептид содержит аминокислоты (a) SEQ ID №: 27 и SEQ ID №: 28; (b) SEQ ID №: 29 и SEQ ID №: 30; (с) SEQ ID №: 31 и SEQ ID №: 32; (d) SEQ ID №: 62 и SEQ ID №: 63 или SEQ ID №: 64; (е) SEQ ID №: 65 и SEQ ID №: 66 или SEQ ID №: 67, или (f) SEQ ID №: 68 и SEQ ID №: 69.
[0018] В некоторых вариантах реализации изобретения антитело, его антигенсвязывающий фрагмент или полипептид связывается с FOLR1 с Kd от около 0,5 до около 10 нМ. В некоторых вариантах реализации изобретения антитело, его антигенсвязывающий фрагмент или полипептид связывается с FOLR1 с Kd около 1,0 нМ или лучше. В некоторых вариантах реализации изобретения аффинность связывания измеряют методом проточной цитометрии, методом Biacore, ИФА или радиоиммуноанализом.
[0019] В некоторых вариантах реализации изобретения антитело, его антигенсвязывающий фрагмент или полипептид связывается с эпитопом FOLR1, содержащим аминокислоту, которая является N-гликозилированной.
[0020] В некоторых вариантах реализации изобретения антитело, его антигенсвязывающий фрагмент или полипептид метят выявляемой меткой.
[0021] В некоторых вариантах реализации изобретения клетка, предложенная в данном документе, продуцирует антитело, его антигенсвязывающий фрагмент или полипептид. В некоторых вариантах реализации изобретения клетку выделяют.
[0022] В данном документе также предложены способы создания антитела, его антигенсвязывающего фрагмента или полипептида. Способы могут включать (а) культивирование клетки, предложенной в данном документе, и (b) выделение антитела, его антигенсвязывающего фрагмента или полипептида из культивированной клетки.
[0023] В данном документе также предложены композиции, содержащие антитело, его антигенсвязывающий фрагмент или полипептид. В некоторых вариантах реализации изобретения композиция содержит антитело, его антигенсвязывающий фрагмент или полипептид и буферный раствор, выбранный из группы, состоящей из: буферного раствора для FACS, буферного раствора для ИГХ и буферного раствора для ИФА.
[0024] В данном документе также предложены способы применения антитела, его антигенсвязывающего фрагмента или полипептида.
[0025] В некоторых вариантах реализации изобретения способ выявления экспрессии FOLR1 в образце включает приведение в контакт образца с антителом, его антигенсвязывающим фрагментом, полипептидом или композицией, предложенных в данном документе. В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент метят выявляемой меткой. В некоторых вариантах реализации изобретения метку выбирают из группы, состоящей из иммунофлуоресцентной метки, хемилюминесцентной метки, фосфоресцентной метки, ферментной метки, радиометки, авидина/биотина, коллоидных частиц золота, окрашенных частиц и магнитных частиц. В некоторых вариантах реализации изобретения экспрессию FOLR1 определяют методом радиоиммуноанализа, анализом вестерн-блот, цитометрией, иммунофлуоресцентным анализом, иммуноферментным анализом, анализом иммунопреципитации, хемилюминесцентным анализом или иммуногистохимическим анализом. В некоторых вариантах реализации изобретения цитометрия является проточной цитометрией. В некоторых вариантах реализации изобретения экспрессию FOLR1 определяют методом ИГХ.
[0026] В некоторых вариантах реализации изобретения способ увеличения эффективности терапии рака действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, включает введение действующего вещества субъекту, имеющему раковое заболевание, причем увеличенную экспрессию FOLR1 выявляют в злокачественном образце, полученном от субъекта, используя антитело, его антигенсвязывающий фрагмент, полипептид или композицию, предложенные в данном документе.
[0027] В некоторых вариантах реализации изобретения способ идентификации ракового заболевания, вероятно поддающегося лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент включает: (а) приведение в контакт биологического образца, содержащего клетки из раковой опухоли, с антителом, его антигенсвязывающим фрагментом, полипептидом или композицией, предложенными в данном документе; (b) выявление связывания антитела, фрагмента-антитела или полипептида с FOLR1 в биологическом образце из (а); (с) присвоение показателя связыванию из этапа (b), причем показатель присваивают на основании сравнения с одним или более эталонных образцов, и (d) сравнение показателя из этапа (с) с показателем эталонной ткани или клетки, причем показатель уровня FOLR1 злокачественного образца, который превышает показатель эталонного образца с нормальной или низкой экспрессией FOLR1, или показатель уровня FOLR1 злокачественного образца, который равен или превышает показатель эталонного образца с высокой экспрессией FOLR1, идентифицирует раковое заболевание как вероятно поддающееся лечению анти-FOLR1 антителом.
[0028] В некоторых вариантах реализации изобретения способ лечения пациента, имеющего раковое заболевание, включает: (а) определение показателя экспрессии FOLR1 при выявлении экспрессии FOLR1 в злокачественном образце, полученном от пациента, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (b) введение действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, пациенту, если показатель указывает, что пациент получит пользу от введения действующего вещества.
[0029] В некоторых вариантах реализации изобретения способ лечения пациента, имеющего раковое заболевание, включает (а) определение показателя экспрессии FOLR1 при выявлении экспрессии FOLR1 в злокачественном образце, полученном от пациента, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (b) предоставление указаний медицинскому работнику относительно введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, пациенту, если показатель указывает, что пациент получит пользу от введения действующего вещества.
[0030] В некоторых вариантах реализации изобретения способ лечения пациента, имеющего раковое заболевание, включает: (а) предоставление злокачественного образца, взятого у пациента, имеющего раковое заболевание, для определения показателя экспрессии FOLR1 для выявления экспрессии FOLR1 с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (b) введение действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, пациенту, если показатель указывает, что пациент получит пользу от введения действующего вещества.
[0031] В некоторых вариантах реализации изобретения способ лечения пациента, имеющего раковое заболевание, включает: (а) определение экспрессии FOLR1 в злокачественном образце, полученном от пациента, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе; (b) определение показателя экспрессии FOLR1 злокачественного образца и (с) введение действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, пациенту, если показатель указывает, что пациент получит пользу от введения действующего вещества.
[0032] В некоторых вариантах реализации изобретения способ лечения пациента, имеющего раковое заболевание, включает: (а) введение пациенту фиксированной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент; (b) выявление уровня FOLR1 у пациента относительно уровня FOLR1 в эталонном образце, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (с) увеличение количества или частоты введения последующих фиксированных доз, если уровень FOLR1 у пациента повышен.
[0033] В некоторых вариантах реализации изобретения способ оптимизации терапевтического режима с действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, для субъекта, имеющего раковое заболевание, включает: (а) введение увеличенной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, субъекту, имеющему раковое заболевание, причем увеличенную экспрессию FOLR1 у субъекта выявляли с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, или (b) введение уменьшенной дозы действующего вещества субъекту, имеющему раковое заболевание, при этом у субъекта выявляли уменьшенную экспрессию FOLR1.
[0034] В некоторых вариантах реализации изобретения способ оптимизации терапевтического режима с действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, для субъекта, имеющего раковое заболевание, включает: (а) выявление уровня экспрессии FOLR1 в злокачественном образце, полученном от субъекта с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе; (b) определение показателя экспрессии FOLR1 злокачественного образца и (с) введение увеличенной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, субъекту, если показатель является низким, или введение уменьшенной дозы действующего вещества субъекту, если показатель является высоким.
[0035] В некоторых вариантах реализации изобретения способ уменьшения FOLR1-экспрессирующих раковых клеток у больного раком пациента включает: (а) выявление уровня FOLR1 в злокачественном образце, взятом у пациента, по сравнению с уровнем FOLR1 в эталонном образце с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (b) введение пациенту фиксированной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, если уровень FOLR1 у пациента повышен по сравнению с эталонным образцом; причем введение действующего вещества уменьшает у пациента количество FOLR1-экспрессирующих раковых клеток. В некоторых вариантах реализации изобретения способ лечения ракового заболевания у пациента включает: (а) выявление уровня FOLR1 в злокачественном образце, взятом у пациента, по сравнению с уровнем FOLR1 в эталонном образце с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (b) введение пациенту фиксированной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, если уровень FOLR1 у пациента повышен по сравнению с эталонным образцом; причем введение действующего вещества уменьшает размер FOLR1-экспрессирующей опухоли или уменьшает уровни СА125.
[0036] В некоторых вариантах реализации изобретения способ уменьшения FOLR1-экспрессирующих раковых клеток у больного раком пациента включает: (а) введение пациенту, имеющему раковое заболевание, фиксированной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент; (b) выявление уровня FOLR1 у пациента относительно уровня FOLR1 в эталонном образце с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (с) увеличение количества или частоты введения последующих фиксированных доз, если уровень FOLR1 у пациента повышен по сравнению с эталонным образцом; причем введение действующего вещества уменьшает у пациента количество FOLR1-экспрессирующих раковых клеток. В некоторых вариантах реализации изобретения способ лечения ракового заболевания у пациента включает: (а) введение пациенту, имеющему раковое заболевание, фиксированной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент; (b) выявление уровня FOLR1 у пациента относительно уровня FOLR1 в эталонном образце с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (с) увеличение количества или частоты введения последующих фиксированных доз, если уровень FOLR1 у пациента повышен по сравнению с эталонным образцом; причем введение действующего вещества уменьшает размер FOLR1-экспрессирующей опухоли или уменьшает уровни СА125.
[0037] В некоторых вариантах реализации изобретения способ мониторинга терапевтической эффективности фиксированной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, у пациента включает: (а) выявление первого уровня FOLR1 в биологическом образце, полученном от пациента, имеющего раковое заболевание, с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе; (b) введение пациенту фиксированной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент; (с) выявление второго уровня FOLR1 в биологическом образце, полученном от пациента, после введения действующего вещества, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (d) сравнение второго уровня FOLR1 с первым уровнем FOLR1; при этом уменьшение между первым и вторым уровнем FOLR1 указывает на терапевтическую эффективность лечения.
[0038] В некоторых вариантах реализации изобретения способ идентификации субъекта, имеющего раковое заболевание, как вероятно поддающегося режиму низкодозового лечения анти-FOLR1 антителом, включает: (а) приведение в контакт биологического образца, содержащего клетки из раковой опухоли, с антителом, его антигенсвязывающим фрагментом, полипептидом или композицией, предложенными в данном документе; (b) выявление связывания антитела, антигенсвязывающего фрагмента или полипептида с биологическим образцом из (а); (с) присвоение показателя связыванию из этапа (b), причем показатель присваивают на основании сравнения с одним или более эталонных образцов, и (d) сравнение показателя из этапа (с) с показателем эталонной ткани или клетки, при этом показатель уровня FOLR1 злокачественного образца, который превышает показатель эталонного образца с нормальной или низкой экспрессией FOLR1, или показатель уровня FOLR1 злокачественного образца, который равен или превышает показатель эталонного образца с высокой экспрессией FOLR1, идентифицирует раковое заболевание как вероятно поддающееся низкодозовому лечению анти-FOLR1.
[0039] В некоторых вариантах реализации изобретения способ идентификации ракового заболевания, как чувствительного к лечению анти-FOLR1 действующим веществом, включает: (а) выявление уровня экспрессии FOLR1 в злокачественном образце из раковой опухоли с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, причем выявление включает применение способа, который различает интенсивность окрашивания или однородность окрашивания в экспрессирующем FOLR1 злокачественном образце по сравнению с интенсивностью окрашивания или однородностью окрашивания в одном или более эталонных образцов; (b) определение показателя интенсивности окрашивания или однородности окрашивания FOLR1 злокачественного образца и (с) сравнение показателя интенсивности окрашивания или однородности окрашивания FOLR1, определенного на этапе (b), с относительным значением, определенным измерением экспрессии белка FOLR1 в по меньшей мере одном эталонной образце, причем по меньшей мере один эталонный образец представляет собой образец ткани, клеток или осадка клеток, который не чувствителен к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель интенсивности окрашивания FOLR1 злокачественного образца, определенный на этапе (b), который выше относительного значения, идентифицирует раковое заболевание как чувствительное к лечению действующим веществом.
[0040] В некоторых вариантах реализации изобретения способ идентификации ракового заболевания, как чувствительного к лечению анти-FOLR1 действующим веществом, включает: (а) выявление уровня экспрессии FOLR1 в злокачественном образце из раковой опухоли с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, причем выявление включает применение способа, который специфически окрашивает мембранный FOLR1 в экспрессирующем FOLR1 злокачественном образце по сравнению с мембранным FOLR1 в одном или более эталонных образцов; (b) определение показателя FOLR1 злокачественного образца и (с) сравнение показателя FOLR1, определенного на этапе (b), с относительным значением, определенным измерением FOLR1 в по меньшей мере одном эталонной образце, причем по меньшей мере один эталонный образец представляет собой образец ткани, клеток или осадка клеток, который не чувствителен к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель FOLR1 злокачественного образца, определенный на этапе (b), который выше относительного значения, идентифицирует раковое заболевание как чувствительное к лечению действующим веществом.
[0041] В некоторых вариантах реализации изобретения способ идентификации ракового заболевания, как чувствительного к лечению анти-FOLR1 действующим веществом, включает: (а) выявление уровня экспрессии FOLR1 в злокачественном образце из раковой опухоли с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, причем выявление включает применение способа, который различает интенсивность окрашивания или однородность окрашивания в экспрессирующем FOLR1 злокачественном образце по сравнению с интенсивностью окрашивания или однородностью окрашивания в одном или более эталонных образцов; (b) определение показателя интенсивности окрашивания или однородности окрашивания FOLR1 злокачественного образца и (с) сравнение показателя интенсивности окрашивания или однородности окрашивания FOLR1, определенного на этапе (b), с относительным значением, определенным измерением экспрессии белка FOLR1 в по меньшей мере одном эталонной образце, причем по меньшей мере один эталонный образец представляет собой образец ткани, клеток или осадка клеток, который чувствителен к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель интенсивности окрашивания FOLR1 злокачественного образца, определенный на этапе (b), который больше или равен относительному значению, идентифицирует раковое заболевание как чувствительное к лечению действующим веществом.
[0042] В некоторых вариантах реализации изобретения способ идентификации ракового заболевания, как чувствительного к лечению анти-FOLR1 действующим веществом, включает: (а) выявление уровня экспрессии FOLR1 в злокачественном образце из раковой опухоли с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, причем выявление включает применение способа, который специфически окрашивает мембранный FOLR1 в экспрессирующем FOLR1 злокачественном образце по сравнению с мембранным FOLR1 в одном или более эталонных образцов; (b) определение показателя FOLR1 злокачественного образца и (с) сравнение показателя FOLR1, определенного на этапе (b), с относительным значением, определенным измерением FOLR1 в по меньшей мере одном эталонной образце, причем по меньшей мере один эталонный образец представляет собой образец ткани, клеток или осадка клеток, который чувствителен к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель FOLR1 злокачественного образца, определенный на этапе (b), который больше или равен относительному значению, идентифицирует раковое заболевание как чувствительное к лечению действующим веществом.
[0043] В некоторых вариантах реализации изобретения способ дополнительно включает введение действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, субъекту, от которого был получен злокачественный образец или биологический образец.
[0044] В некоторых вариантах реализации изобретения уровень FOLR1 у пациента выявляют в злокачественном образце или биологическом образце, полученном от пациента. В некоторых вариантах реализации изобретения злокачественный образец или биологический образец представляет собой физиологическую жидкость, клетку или образец ткани. В некоторых вариантах реализации изобретения клетка представляет собой циркулирующую опухолевую клетку. В некоторых вариантах реализации изобретения физиологическая жидкость представляет собой кровь, асцит, мочу, плазму, сыворотку или периферийную кровь.
[0045] В некоторых вариантах реализации изобретения FOLR1 представляет собой мембранолокализованный FOLR1 (т.е., мембранный FOLR1).
[0046] В некоторых вариантах реализации изобретения FOLR1 представляет собой сброшенный FOLR1.
[0047] В некоторых вариантах реализации изобретения обнаружение проводится методом иммуноферментного твердофазного анализа (ИФА).
[0048] В некоторых вариантах реализации изобретения обнаружение проводится методом иммуногистохимии (ИГХ). В некоторых вариантах реализации изобретения метод ИГХ представляет собой калиброванный метод ИГХ, который может различать разные уровни экспрессии FOLR1. В некоторых вариантах реализации изобретения при ИГХ анализе получается диапазон интенсивности окрашивания образцов, имеющих низкую экспрессию FOLR1 на клеточной поверхности, среднюю экспрессию FOLR1 на клеточной поверхности или высокую экспрессию FOLR1 на клеточной поверхности. В некоторых вариантах реализации изобретения при ИГХ анализе различается интенсивность окрашивания и однородность окрашивания в экспрессирующем FOLR1 злокачественном образце или биологическом образце по сравнению с эталонным образцом. В некоторых вариантах реализации изобретения ИГХ анализ выявляет мембранный FOLR1. В некоторых вариантах реализации изобретения ИГХ анализ выполняют вручную. В некоторых вариантах реализации изобретения ИГХ анализ выполняют, используя автоматизированную систему.
[0049] В некоторых вариантах реализации изобретения показатель FOLR1 определяют из результатов ИГХ анализа.
[0050] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 1, указывает на увеличенную экспрессию FOLR1 и идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
[0051] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких или рак эндометрия. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3, по меньшей мере 3 гомо (>75% однородности) или по меньшей мере 3 гетеро (25-75% однородности), идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0052] В некоторых вариантах реализации изобретения Η-показатель, равный по меньшей мере 50, идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения Н-показатель, равный по меньшей мере 75, идентифицирует рак яичников как вероятно поддающийся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения Η-показатель, равный по меньшей мере 50, идентифицирует НМРЛ как вероятно поддающийся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения Η-показатель, равный по меньшей мере 50, идентифицирует рак эндометрия как вероятно поддающийся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В одном варианте реализации изобретения Η-показатель определяют, используя антитело FOLR1-2.1.
[0053] В некоторых вариантах реализации изобретения по меньшей мере 25% экспрессии мембранного FOLR1 в образце опухоли яичников с интенсивностью по меньшей мере 3 идентифицирует рак яичников как вероятно поддающийся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения по меньшей мере 25% экспрессии мембранного FOLR1 в образце НМРЛ с интенсивностью по меньшей мере 2 идентифицирует НМРЛ как вероятно поддающийся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения по меньшей мере 25% экспрессии мембранного FOLR1 в образце опухоли эндометрия с интенсивностью по меньшей мере 2 идентифицирует рак эндометрия как вероятно поддающийся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В одном варианте реализации изобретения показатель экспрессии определяют, используя антитело FOLR 1-2.1.
[0054] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 1, указывает на увеличенную экспрессию FOLR1 и на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких или рак эндометрия. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3, по меньшей мере 3 гомо (>75% однородности) или по меньшей мере 3 гетеро (25-75% однородности), указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0055] В некоторых вариантах реализации изобретения Η-показатель, равный по меньшей мере 50, указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения Н-показатель, равный по меньшей мере 75, указывает на то, что пациент с раком яичников получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения Η-показатель, равный по меньшей мере 50, указывает на то, что пациент с НМРЛ получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения Η-показатель, равный по меньшей мере 50, указывает на то, что пациент с раком эндометрия получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В одном варианте реализации изобретения Η-показатель определяют, используя антитело FOLR1-2.1.
[0056] В некоторых вариантах реализации изобретения по меньшей мере 25% экспрессии мембранного FOLR1 в образце опухоли яичников с интенсивностью по меньшей мере 3 указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения по меньшей мере 25% экспрессии мембранного FOLR1 в образце НМРЛ с интенсивностью по меньшей мере 2 указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения по меньшей мере 25% экспрессии мембранного FOLR1 в образце опухоли эндометрия с интенсивностью по меньшей мере 2 указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В одном варианте реализации изобретения показатель экспрессии определяют, используя антитело FOLR1-2.1.
[0057] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 1, указывает на увеличенную экспрессию FOLR1. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), указывает на то, что следует вводить уменьшенную дозу действующего вещества. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких или рак эндометрия. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3, по меньшей мере 3 гомо (>75% однородности) или по меньшей мере 3 гетеро (25-75% однородности), указывает на то, что следует вводить уменьшенную дозу действующего вещества. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0058] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 1, указывает на увеличенную экспрессию FOLR1. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), идентифицирует раковое заболевание как вероятно поддающееся низкодозовому лечению анти-FOLR1. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких или рак эндометрия. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3, по меньшей мере 3 гомо (>75% однородности) или по меньшей мере 3 гетеро (25-75%) однородности), идентифицирует раковое заболевание как вероятно поддающееся низкодозовому лечению анти-FOLR1. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0059] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких или рак эндометрия. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3, по меньшей мере 3 гомо (>75% однородности) или по меньшей мере 3 гетеро (25-75% однородности), идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0060] В некоторых вариантах реализации изобретения Η-показатель, равный по меньшей мере 50, идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения Н-показатель, равный по меньшей мере 75, идентифицирует рак яичников как чувствительный к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения Η-показатель, равный по меньшей мере 50, идентифицирует НМРЛ как чувствительный к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения Η-показатель, равный по меньшей мере 50, идентифицирует рак эндометрия как чувствительный к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В одном варианте реализации изобретения Η-показатель определяют, используя антитело FOLR1-2.1.
[0061] В некоторых вариантах реализации изобретения по меньшей мере 25% экспрессии мембранного FOLR1 в образце опухоли яичников с интенсивностью по меньшей мере 3 идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения по меньшей мере 25% экспрессии мембранного FOLR1 в образце НМРЛ с интенсивностью по меньшей мере 2 идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения по меньшей мере 25% экспрессии мембранного FOLR1 в образце опухоли эндометрия с интенсивностью по меньшей мере 2 идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В одном варианте реализации изобретения показатель экспрессии определяют, используя антитело FOLR1-2.1.
[0062] В некоторых вариантах реализации изобретения эталонный образец представляет собой положительный эталонный образец или отрицательный эталонный образец. В некоторых вариантах реализации изобретения эталонный образец содержит клетки, осадки клеток или ткань.
[0063] В некоторых вариантах реализации изобретения антитело, его антигенсвязывающий фрагмент или полипептид содержит реактив для обнаружения, выбранный из группы, состоящей из: фермента, флуорофора, радиоактивной метки и люминофора. В некоторых вариантах реализации изобретения реактив для обнаружения выбран из группы, состоящей из: биотина, дигоксигенина, флуоресцеина, трития и родамина.
[0064] В некоторых вариантах реализации изобретения раковое заболевание представляет собой FOLR1-положительный рак. В некоторых вариантах реализации изобретения раковое заболевание выбрано из группы, состоящей из рака яичников, головного мозга, молочной железы, матки, эндометрия, поджелудочной железы, почек и легких. В некоторых вариантах реализации изобретения рак легких представляет собой немелкоклеточный рак легких или бронхиолоальвеолярную карциному. В некоторых вариантах реализации изобретения рак яичников представляет собой эпителиальный рак яичников. В некоторых вариантах реализации изобретения рак яичников является устойчивым к лечению препаратами платины, рецидивирующим или рефрактерным.
[0065] В некоторых вариантах реализации изобретения экспрессию FOLR1 выявляют, используя по меньшей мере одно дополнительное анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения экспрессию FOLR1 измеряют, используя два анти-FOLR1 антитела или их антигенсвязывающие фрагменты. В некоторых вариантах реализации изобретения по меньшей мере одно антитело или его антигенсвязывающий фрагмент связано с твердой подложкой. В некоторых вариантах реализации изобретения по меньшей мере одно антитело или его антигенсвязывающий фрагмент связано с планшетом для микротитрования.
[0066] В некоторых вариантах реализации изобретения по меньшей мере одно дополнительное антитело или его антигенсвязывающий фрагмент содержит агент для обнаружения. В некоторых вариантах реализации изобретения агент для обнаружения представляет собой хромогенный агент для обнаружения, флуорогенный агент для обнаружения, ферментный агент для обнаружения или электрохемилюминесцентный агент для обнаружения. В некоторых вариантах реализации изобретения агент для обнаружения представляет собой пероксидазу хрена (HRP).
[0067] В некоторых вариантах реализации изобретения ИФА представляет собой «сэндвич»-ИФА.
[0068] В некоторых вариантах реализации изобретения действующее вещество содержит FOLR1-антитело huMov19. В некоторых вариантах реализации изобретения действующее вещество представляет собой конъюгат антитело-майтанзиноид, содержащий FOLR1-антитело huMov19 (содержащее вариабельный участок тяжелой цепи SEQ ID №: 45 и вариабельный участок легкой цепи SEQ ID №: 47), майтанзиноид DM4 и расщепляемый сульфо-SPDB линкер (IMGN853).
[0069] В некоторых вариантах реализации изобретения способ идентификации ракового заболевания как вероятно поддающегося лечению конъюгатом антитело-майтанзиноид, содержащим FOLR1-антитело huMov19, майтанзиноид DM4 и сульфо-SPDB линкер (IMGN853), включает измерение FOLR1 с использованием антитела, содержащего тяжелую цепь, включающую аминокислоты SEQ ID №: 27, и легкую цепь, включающую аминокислоты SEQ ID №: 28, в ИГХ анализе, причем показатель, равный по меньшей мере 2 гетеро, указывает на то, что раковое заболевание вероятно поддается лечению.
[0070] В некоторых вариантах реализации изобретения способ идентификации ракового заболевания как вероятно поддающегося лечению конъюгатом антитело-майтанзиноид, содержащим FOLR1-антитело huMov19, майтанзиноид DM4 и сульфо-SPDB линкер (IMGN853), включает измерение FOLR1 с использованием антитела, содержащего тяжелую цепь, включающую аминокислоты SEQ ID №: 27, и легкую цепь, включающую аминокислоты SEQ ID №: 28, в ИГХ анализе, причем показатель, равный по меньшей мере 1 гетеро, указывает на то, что раковое заболевание вероятно поддается лечению.
[0071] В некоторых вариантах реализации промышленный препарат, предложенный в данном документе, включает терапевтическое действующее вещество, содержащее анти-FOLR1 антитело или его антигенсвязывающий фрагмент, описанные в данном документе, контейнер и листок-вкладыш или этикетку, указывающую, что действующее вещество может применяться для лечения ракового заболевания, характеризующегося увеличенной экспрессией FOLR1. В некоторых вариантах реализации промышленный препарат, предложенный в данном документе, включает терапевтическое действующее вещество, содержащее анти-FOLR1 антитело или его антигенсвязывающий фрагмент, описанные в данном документе, контейнер и листок-вкладыш или этикетку, указывающую, что действующее вещество может применяться для лечения ракового заболевания, характеризующегося экспрессией FOLR1 на уровне 2 или 3, измеренном с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе. В некоторых вариантах реализации изобретения анти-FOLR1 антитело действующего вещества конъюгировано с цитотоксином. В некоторых вариантах реализации изобретения листок-вкладыш или этикетка указывает, что действующее вещество может применяться для лечения ракового заболевания, характеризующегося экспрессией FOLR1 на уровне по меньшей мере 1. В некоторых вариантах реализации изобретения листок-вкладыш или этикетка указывает, что действующее вещество может применяться для лечения ракового заболевания, характеризующегося экспрессией FOLR1 на уровне по меньшей мере 2, по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности). В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких или рак эндометрия. В некоторых вариантах реализации изобретения листок-вкладыш или этикетка указывает, что действующее вещество может применяться для лечения ракового заболевания, характеризующегося экспрессией FOLR1 на уровне по меньшей мере 3, по меньшей мере 3 гомо (>75% однородности) или по меньшей мере 3 гетеро (25-75%) однородности). В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0072] В некоторых вариантах реализации изобретения комбинированный диагностический и фармацевтический набор, предложенный в данном документе, включает антитело или его антигенсвязывающий фрагмент, полипептид или композицию, предложенные в данном документе, для использования в диагностике, и действующее вещество, содержащее анти-FOLR1 антитело или его антигенсвязывающий фрагмент, для применения в терапии. В некоторых вариантах реализации антитело для обнаружения способно выявлять экспрессию FOLR1 методом ИГХ. В некоторых вариантах реализации антитело для обнаружения способно выявлять экспрессию FOLR1 методом ИФА. В некоторых вариантах реализации изобретения анти-FOLR1 антитело в действующем веществе конъюгировано с цитотоксином.
[0073] В некоторых вариантах реализации изобретения диагностический набор, предложенный в данном документе, включает антитело, его антигенсвязывающий фрагмент или полипептид, предложенные в данном документе, реагент для метода иммуногистохимии (ИГХ) и один или более стандартизированных эталонных образцов, причем стандартизированные эталонные образцы включают клетки, осадки клеток или фиксированные формалином залитые парафином образцы, и при этом один или более стандартизированных эталонных образцов получены из не экспрессирующих FOLR1, экспрессирующих FOLR1 на низком уровне или экспрессирующих FOLR1 на высоком уровне клеток, осадков клеток или тканей.
[0074] В некоторых вариантах реализации изобретения набор для иммуноанализа для выявления сброшенного FOLR1 в образце включает: (а) антитело, его антигенсвязывающий фрагмент, полипептид или композицию, предложенные в данном документе, и (b) реактив для обнаружения. В некоторых вариантах реализации изобретения набор дополнительно содержит твердую подложку для реактива для захвата. В некоторых вариантах реализации изобретения реактив для захвата иммобилизирован на твердой подложке. В некоторых вариантах реализации изобретения реактив для захвата нанесен на планшет для микротитрования. В некоторых вариантах реализации изобретения реактив для обнаружения представляет собой второе FOLR1-антитело. В некоторых вариантах реализации изобретения реактив для обнаружения выявляется с использованием видоспецифического антитела. В некоторых вариантах реализации изобретения набор дополнительно содержит средство для выявления реактива для обнаружения. В некоторых вариантах реализации изобретения средство для выявления является колориметрическим. В некоторых вариантах реализации изобретения набор дополнительно содержит FOLR1-полипептид в качестве стандарта антигена. В некоторых вариантах реализации изобретения FOLR1-полипептид представляет собой FOLR1-Fc.
[0075] В данном документе также предложены действующие вещества. В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, причем указанное действующее вещество вводится субъекту, имеющему раковое заболевание, при этом увеличенную экспрессию FOLR1 выявляют в злокачественном образце, полученном от указанного субъекта, с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе.
[0076] В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, включающем: (а) определение показателя экспрессии FOLR1 при выявлении экспрессии FOLR1 в злокачественном образце, полученном от пациента, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (b) введение действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, пациенту, если показатель указывает, что пациент получит пользу от введения действующего вещества.
[0077] В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, включающем: (а) определение показателя экспрессии FOLR1 для выявления экспрессии FOLR1 в злокачественном образце, полученном от пациента, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (b) предоставление указаний медицинскому работнику относительно введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, пациенту, если показатель указывает, что пациент получит пользу от введения действующего вещества.
[0078] В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, включающем: (а) предоставление злокачественного образца, полученного от пациента, имеющего раковое заболевание, для определения показателя экспрессии FOLR1 при выявлении экспрессии FOLR1 с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (b) введение действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, пациенту, если показатель указывает, что пациент получит пользу от введения действующего вещества.
[0079] В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, включающем: (а) выявление экспрессии FOLR1 в злокачественном образце, полученном от указанного пациента, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе; (b) определение показателя экспрессии FOLR1 указанного злокачественного образца и (с) введение действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, пациенту, если показатель указывает, что пациент получит пользу от введения действующего вещества.
[0080] В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, включающем: (а) введение пациенту фиксированной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент; (b) выявление уровня экспрессии FOLR1 в злокачественном образце, полученном от пациента, относительно уровня FOLR1 в эталонном образце, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (с) увеличение количества или частоты введения последующих фиксированных доз, если уровень FOLR1 у пациента повышен.
[0081] В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, включающем этап оптимизации терапевтического режима указанного действующего вещества, включающий: (а) введение увеличенной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, субъекту, имеющему раковое заболевание, причем увеличенную экспрессию FOLR1 в злокачественном образце, полученном от указанного субъекта, выявляли с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, или (b) введение уменьшенной дозы действующего вещества субъекту, имеющему раковое заболевание, при этом в злокачественном образце, полученном от указанного субъекта, выявляли уменьшенную экспрессию FOLR1.
[0082] В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, включающем этап оптимизации терапевтического режима указанного действующего вещества, включающий: (а) выявление уровня экспрессии FOLR1 в злокачественном образце, полученном от указанного субъекта, с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе; (b) определение показателя экспрессии FOLR1 указанного злокачественного образца и (с) введение увеличенной дозы действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент, субъекту, если показатель является низким, или введение уменьшенной дозы действующего вещества субъекту, если показатель является высоким.
[0083] В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, при котором количество FOLR1-экспрессирующих раковых клеток у больного раком пациента снижается, причем: (а) уровень FOLR1 в злокачественном образце, полученном от пациента, выявляют сравнивая его с уровнем FOLR1 в эталонном образце с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (b) вводят пациенту фиксированную дозу действующего вещества, если уровень FOLR1 у пациента повышен; при этом введение действующего вещества уменьшает у пациента количество FOLR1-экспрессирующих раковых клеток.
[0084] В некоторых вариантах реализации изобретения действующее вещество содержит анти-FOLR1 антитело или его антигенсвязывающий фрагмент для применения в способе лечения ракового заболевания, при котором количество FOLR1-экспрессирующих раковых клеток у больного раком пациента снижается, причем: (а) вводят пациенту, имеющему раковое заболевание, фиксированную дозу действующего вещества; (b) уровень FOLR1 в злокачественном образце, полученном от пациента, выявляют относительно уровня FOLR1 в эталонном образце с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (с) количество или частоту введения последующих фиксированных доз повышают, если уровень FOLR1 у пациента повышен по сравнению с эталонным образцом; причем введение действующего вещества уменьшает у пациента количество FOLR1-экспрессирующих раковых клеток.
[0085] В данном документе также предложены анти-FOLR1 антитела и их антигенсвязывающие фрагменты для применения в способах мониторинга и способах диагностирования. В некоторых вариантах реализации изобретения использование анти-FOLR1 антитела или его антигенсвязывающего фрагмента для применения в способе мониторинга терапевтической эффективности фиксированной дозы действующего вещества у пациента включает: (а) выявление первого уровня FOLR1 в биологическом образце, полученном от пациента, имеющего раковое заболевание, с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе; (b) введение пациенту фиксированной дозы действующего вещества; (с) выявление второго уровня FOLR1 в биологическом образце, полученном от пациента, после введения действующего вещества, причем выявление выполняется с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, и (d) сравнение второго уровня FOLR1 с первым уровнем FOLR1; при этом уменьшение между первым и вторым уровнем FOLR1 указывает на терапевтическую эффективность лечения.
[0086] В некоторых вариантах реализации изобретения использование анти-FOLR1 антитела или его антигенсвязывающего фрагмента для применения в способе диагностирования того, способен ли субъект, имеющий раковое заболевание, поддаваться режиму низкодозового лечения анти-FOLR1 антителом, включает: (а) приведение в контакт биологического образца, содержащего клетки из указанной раковой опухоли, с антителом, антигенсвязывающим фрагментом, полипептидом или композицией, предложенных в данном документе; (b) выявление связывания указанного антитела, антигенсвязывающего фрагмента или полипептида с указанным биологическим образцом из (а); (с) присвоение показателя указанному связыванию из этапа (b), причем указанный показатель присваивают на основании сравнения с одним или более эталонных образцов, и (d) сравнение указанного показателя из этапа (с) с показателем эталонной ткани или клетки, причем показатель указанного уровня FOLR1 злокачественного образца, который превышает показатель эталонного образца с нормальной или низкой экспрессией FOLR1, или показатель указанного уровня FOLR1 злокачественного образца, который равен или превышает показатель эталонного образца с высокой экспрессией FOLR1, идентифицирует указанное раковое заболевание как вероятно поддающееся лечению низкой дозой действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
[0087] В некоторых вариантах реализации изобретения использование анти-FOLR1 антитела или его антигенсвязывающего фрагмента для применения в способе диагностирования того, чувствительно ли раковое заболевание к лечению способом лечения анти-FOLR1 антителом, включает: (а) выявление уровня экспрессии FOLR1 в злокачественном образце из указанной раковой опухоли с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, причем указанное выявление включает применение способа, который распознает интенсивность окрашивания или однородность окрашивания в экспрессирующем FOLR1 злокачественном образце по сравнению с интенсивностью окрашивания или однородностью окрашивания в одном или более эталонных образцов; (b) определение показателя интенсивности окрашивания или однородности окрашивания FOLR1 указанного злокачественного образца и (с) сравнение показателя интенсивности окрашивания или однородности окрашивания FOLR1, определенного на этапе (b), с относительным значением, определенным измерением экспрессии белка FOLR1 в по меньшей мере одном эталонной образце, причем по меньшей мере один указанный эталонный образец представляет собой образец ткани, клеток или осадка клеток, который не чувствительный к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель интенсивности окрашивания FOLR1 указанного злокачественного образца, определенный на этапе (b), который выше указанного относительного значения, идентифицирует указанное раковое заболевание как чувствительное к лечению действующим веществом.
[0088] В некоторых вариантах реализации изобретения использование анти-FOLR1 антитела или его антигенсвязывающего фрагмента для применения в способе диагностирования того, чувствительно ли раковое заболевание к лечению способом лечения анти-FOLR1 антителом, включающем: (а) выявление уровня экспрессии FOLR1 в злокачественном образце из указанной раковой опухоли с использованием антитела, его антигенсвязывающего фрагмента, полипептида или композиции, предложенных в данном документе, причем указанное выявление включает применение способа, который распознает интенсивность окрашивания или однородность окрашивания в экспрессирующем FOLR1 злокачественном образце по сравнению с интенсивностью окрашивания или однородностью окрашивания в одном или более эталонных образцов; (b) определение показателя интенсивности окрашивания или однородности окрашивания FOLR1 указанного злокачественного образца и (с) сравнение показателя интенсивности окрашивания или однородности окрашивания FOLR1, определенного на этапе (b), с относительным значением, определенным измерением экспрессии белка FOLR1 в по меньшей мере одном эталонной образце, причем по меньшей мере один указанный эталонный образец представляет собой образец ткани, клеток или осадка клеток, который чувствителен к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель интенсивности окрашивания FOLR1 указанного злокачественного образца, определенный на этапе (b), который выше указанного относительного значения, идентифицирует указанное раковое заболевание как чувствительное к лечению действующим веществом.
[0089] В некоторых вариантах реализации изобретения применение действующих веществ или анти-FOLR1 антител или их антигенсвязывающих фрагментов дополнительно включает введение действующего вещества, содержащего анти-FOLR1 антитело или его фрагмент-антиген, субъекту, от которого был получен злокачественный образец или биологический образец.
[0090] В некоторых вариантах реализации изобретения злокачественный образец или биологический образец представляет собой физиологическую жидкость, клетку или образец ткани. В некоторых вариантах реализации изобретения клетка представляет собой циркулирующую опухолевую клетку. В некоторых вариантах реализации изобретения физиологическая жидкость представляет собой кровь, асцит, мочу, плазму, сыворотку или периферийную кровь.
[0091] В некоторых вариантах реализации изобретения с использованием действующих веществ или анти-FOLR1 антител или их антигенсвязывающих фрагментов обнаружение проводится методом иммуноферментного твердофазного анализа (ИФА) и/или методом иммуногистохимии (ИГХ). В некоторых вариантах реализации изобретения метод ИГХ представляет собой калиброванную ИГХ методику, которая может различать разные уровни экспрессии FOLR1. В некоторых вариантах реализации изобретения при ИГХ анализе получается диапазон интенсивности окрашивания образцов, имеющих низкую экспрессию FOLR1 на клеточной поверхности, среднюю экспрессию FOLR1 на клеточной поверхности или высокую экспрессию FOLR1 на клеточной поверхности. В некоторых вариантах реализации изобретения при ИГХ анализе различается интенсивность окрашивания и однородность окрашивания в экспрессирующем FOLR1 злокачественном образце или биологическом образце по сравнению с эталонным образцом. В некоторых вариантах реализации изобретения ИГХ анализ выполняют вручную. В некоторых вариантах реализации изобретения ИГХ анализ выполняют, используя автоматизированную систему. В некоторых вариантах реализации изобретения показатель FOLR1 определяют из результатов ИГХ анализа. В некоторых реализации изобретения при ИГХ анализе с антителом или антигенсвязывающем фрагментом, описанным в данном документе, получается диапазон окрашивания клеток, которые имеют увеличенную экспрессию FOLR1, в частности, тех клеток, которые находятся в пределах уровня окрашивания равного или превышающего 2.
[0092] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких или рак эндометрия.
[0093] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3, указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3 гомо (>75% однородности) или по меньшей мере 3 гетеро (25-75% однородности), указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0094] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), указывает на то, что пациент получит пользу от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0095] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, указывает на то, что следует вводить уменьшенную дозу действующего вещества. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), указывает на то, что следует вводить уменьшенную дозу действующего вещества. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0096] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, идентифицирует раковое заболевание как вероятно поддающееся низкодозовому лечению анти-FOLR1. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2 гомо (>75% однородности) или 2 гетеро (25-75%) однородности), идентифицирует раковое заболевание как вероятно поддающееся низкодозовому лечению анти-FOLR1. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких или рак эндометрия.
[0097] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3, идентифицирует раковое заболевание как вероятно поддающееся низкодозовому лечению анти-FOLR1. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3 гомо (>75% однородности) или по меньшей мере 3 гетеро (25-75% однородности), идентифицирует раковое заболевание как вероятно поддающееся низкодозовому лечению анти-FOLR1. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0098] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, идентифицирует раковое заболевание как вероятно поддающееся низкодозовому лечению анти-FOLR1. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75%) однородности), идентифицирует раковое заболевание как вероятно поддающееся низкодозовому лечению анти-FOLR1. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0099] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких или рак эндометрия.
[0100] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3, идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 3 гомо (>75% однородности) или по меньшей мере 3 гетеро (25-75% однородности), идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0101] В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2, идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения показатель, равный по меньшей мере 2 гомо (>75% однородности) или по меньшей мере 2 гетеро (25-75% однородности), идентифицирует раковое заболевание как чувствительное к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения раковое заболевание представляет собой рак легких, рак эндометрия или рак яичников.
[0102] В некоторых вариантах реализации изобретения эталонный образец представляет собой положительный эталонный образец или отрицательный эталонный образец. В некоторых вариантах реализации изобретения эталонный образец содержит клетки, осадки клеток или ткань.
[0103] В некоторых вариантах реализации изобретения использование действующего вещества или анти-FOLR1 антитела или его антигенсвязывающего фрагмента для применения, предложенного в данном документе, антитела, антигенсвязывающего фрагмента или полипептида, предложенных в данном документе, дополнительно содержит реактив для обнаружения, выбранный из группы, состоящей из: фермента, флуорофора, радиоактивной метки и люминофора. В некоторых вариантах реализации изобретения реактив для обнаружения выбран из группы, состоящей из: биотина, дигоксигенина, флуоресцеина, трития и родамина.
[0104] В некоторых вариантах реализации изобретения по использованию действующего вещества или анти-FOLR1 антитела или его антигенсвязывающего фрагмента для применения, предложенного в данном документе, подразумевает раковое заболевание являющееся FOLR1-положительным раком. В некоторых вариантах реализации изобретения раковое заболевание выбрано из группы, состоящей из рака яичников, головного мозга, молочной железы, матки, эндометрия, поджелудочной железы, почек и легких. В некоторых вариантах реализации изобретения рак легких представляет собой немелкоклеточный рак легких или бронхиолоальвеолярную карциному. В некоторых вариантах реализации изобретения рак яичников представляет собой эпителиальный рак яичников. В некоторых вариантах реализации изобретения раковое заболевание является устойчивым к лечению препаратами платины, рецидивирующим или рефрактерным.
[0105] В некоторых вариантах реализации изобретения использование действующего вещества или анти-FOLR1 антитела или его антигенсвязывающего фрагмента для применения, предложенного в данном документе, подразумевает экспрессию FOLR1, выявляемую с использованием по меньшей мере одного дополнительного анти-FOLR1 антитела или его антигенсвязывающего фрагмента. В некоторых вариантах реализации изобретения экспрессию FOLR1 измеряют, используя два анти-FOLR1 антитела или их антигенсвязывающие фрагменты. В некоторых вариантах реализации изобретения по меньшей мере одно антитело или его антигенсвязывающий фрагмент связано с твердой подложкой. В некоторых вариантах реализации изобретения по меньшей мере одно антитело или его антигенсвязывающий фрагмент связано с планшетом для микротитрования. В некоторых вариантах реализации изобретения по меньшей мере одно антитело или его антигенсвязывающий фрагмент содержит агент для обнаружения. В некоторых вариантах реализации изобретения агент для обнаружения представляет собой хромогенный агент для обнаружения, флуорогенный агент для обнаружения, ферментный агент для обнаружения или электрохемилюминесцентный агент для обнаружения. В некоторых вариантах реализации изобретения агент для обнаружения представляет собой пероксидазу хрена (HRP). В некоторых вариантах реализации изобретения ИФА представляет собой «сэндвич»-ИФА.
[0106] В некоторых вариантах реализации изобретения использование действующего вещества или анти-FOLR1 антитела или его антигенсвязывающего фрагмента для применения, предложенного в данном документе, включает действующее вещество, содержащее FOLR1-антитело huMov19, или являющееся FOLR1-антителом huMov19. В некоторых вариантах реализации изобретения действующее вещество вводят в виде конъюгата антитело-майтанзиноид, дополнительно содержащего майтанзиноид DM4 и расщепляемый сульфо-SPDB линкер (IMGN853).
[0107] В некоторых вариантах реализации изобретения антитело, его антигенсвязывающий фрагмент, полипептид или композиция, предложенные в данном документе, предназначены для применения как диагностические.
[0108] В некоторых вариантах реализации изобретения антитело, его антигенсвязывающий фрагмент, полипептид или композиция, предложенные в данном документе, предназначены для применения в способе диагностирования ракового заболевания у пациента, страдающего от него. В некоторых вариантах реализации изобретения раковое заболевание ассоциируют с повышенными уровнями FOLR1.
[0109] В некоторых вариантах реализации изобретения аффинность связывания антитела, антигенсвязывающего фрагмента или полипептида представляет собой аффинность связывания, полученную в примере 3 и/или показанную на фиг. 4, 5 и/или 6.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0110] На фиг. 1 представлены изображения ИГХ-окрашивания образцов НМРЛ и аденокарциномы эндометрия яичников с использованием антител 353.2-1 и 353.9-20.
[0111] На фиг. 2 представлены изображения ИГХ-окрашивания нормальных образцов слюнной железы и поджелудочной железы с использованием антител 353.2-1 и 353.9-20.
[0112] На фиг. 3 представлены изображения вестерн-блотов лизатов клеток с использованием антител 353.9-21, 353.2-1, 353.3-8 и 353.5-7.
[0113] На фиг. 4 показано связывание антител 353.2-1, 353.3-1, 353.5-7 и 353.9-21 с денатурированными клетками KB (А) и неденатурированными клетками T47D (В) с использованием сортера клеток с активацией флуоресценции (FACS).
[0114] На фиг. 5 показано связывание антител 353.2-1, 353.3-1, 353.5-7 и 353.9-21 с рекомбинантным FOLR1 человека с использованием ИФА.
[0115] На фиг. 6 показано связывание анти-FOLR2 антитела и антител 353.2-1, 353.3-1, 353.5-7 и 353.9-21 с FOLR2 (А) и связывание анти-FOLR3 антитела и антител 353.2-1, 353.3-1, 353.5-7 и 353.9-21 с FOLR3 (В) методом ИФА.
[0116] На фиг. 7 показано связывание анти-FOLR1 антител 2.1 и huMov19 с дегликозилированным и необработанным рекомбинантным FOLR1 человека методом ИФА.
[0117] На фиг. 8 показано связывание анти-FOLR1 антител 2.1, huMov19 и BN3.2 с дегликозилированными и необработанными лизатами клеток KB и Igrov-1 анализом вестерн-блот.
[0118] На фиг. 9 показаны аминокислоты для изменения поверхности анти-FOLR1 антитела FRIHC2-1 и положение по Кабату, соответствующее каждому остатку.
[0119] На фиг. 10 показано выравнивание последовательностей мышиного и гуманизированного антитела FRIHC2-1 по результатам изменения поверхности. Последовательности тяжелой и легкой цепи мыши соответствуют SEQ ID №: 27 и SEQ ID №: 28, соответственно. Последовательность гуманизированной тяжелой цепи с измененной поверхностью соответствует SEQ ID №: 62, а последовательности легкой цепи человека с измененной поверхностью версии 1.0 и версии 1.1 соответствуют SEQ ID №: 63 и SEQ ID №: 64, соответственно. Лидер «S» в последовательности легкой цепи (положение на каркасе -1) не рассматривается при проведении гуманизации и не используется в последовательности гуманизированного антитела, поэтому он не показан на фигуре.
[0120] На фиг. 11 показаны соответствующие аминокислоты CDR-прививания анти-FOLR1 антитела FRIHC2-1 и положение по Кабату, соответствующее каждому остатку.
[0121] На фиг. 12 показано выравнивание последовательностей мышиного и гуманизированного FRIHC2-1 для CDR-прививания. Последовательности тяжелой и легкой цепи мыши соответствуют SEQ ID №: 27 и SEQ ID №: 28, соответственно. Последовательность привитой гуманизированной тяжелой цепи соответствует SEQ ID №: 65, а последовательности привитой легкой цепи человека версии 1.0 и версии 1.1 соответствуют SEQ ID №: 66 и SEQ ID №: 67, соответственно. Лидер «S» в последовательности легкой цепи (положение на каркасе -1) не рассматривается при проведении гуманизации и не используется в последовательности гуманизированного антитела, поэтому он не показан на фигуре.
[0122] На фиг. 13 представлены изображения ИГХ-окрашивания тканей аденокарциномы легких с использованием антитела FOLR1-2.1 (353-2.1) при различных разведениях.
[0123] На фиг. 14 представлены изображения ИГХ-окрашивания положительной нормальной ткани (фаллопиева труба) (А) и клеток (FOLR1-трансфецированных клеток (В)) и отрицательных клеток (нетрансфецированных клеток (С)) с использованием антитела FOLR1-2.1 (353-2.1).
[0124] На фиг. 15 представлены изображения ИГХ-окрашивания образцов ткани опухоли яичника (А) и ткани аденокарциномы легких (В) с использованием антитела FOLR1-2.1 (353-2.1).
[0125] На фиг. 16 показано окрашивание мембран опухолевых клеток в образце опухоли эндометрия при анализе с FOLR1-2.1. Стромальные клетки не окрашиваются.
[0126] На фиг. 17 показано сравнение окрашивания и определение разницы показателей между (А) анализом с FOLR1-2.1 и (В) анализом с BN3.2.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0127] В данном описании представлены методы обнаружения рецептора фолиевой кислоты 1 (FOLR1) человека, включая мембранный FOLR1, сброшенный FOLR1 и FOLR1 на циркулирующих опухолевых клетках, и улучшения эффективности или возможности поддаваться лечению раковых заболеваний, характеризующихся сверхэкспрессией FOLR1. Методы обнаружения могут выявлять клинически значимый динамический диапазон FOLR1 и, следовательно, могут применяться для стратификации пациентов, для мониторинга или определения терапевтической эффективности или вероятности поддаваться лечению раковых заболеваний, характеризующихся сверхэкспрессией FOLR1. Описаны также новые FOLR1-связывающие полипептиды, такие как антитела, которые полезны для методов обнаружения FOLR1 (например, ИГХ анализ для мембраносвязанного и ассоциированного с клетками FOLR1). Предложены также родственные полипептиды и полинуклеотиды, композиции, содержащие FOLR1-связывающие агенты, и способы создания FOLR1-связывающих агентов.
I. Определения.
[0128] Для облегчения понимания данного изобретения ниже определены некоторые термины и фразы.
[0129] Термины «рецептор фолиевой кислоты 1 человека», «FOLR1» или «рецептор фолиевой кислоты альфа (FR-α)», как используются в данном документе, относятся к любому нативному FOLR1 человека, если не указано иное. Таким образом, все эти термины могут относиться или к белку или к последовательности нуклеиновой кислоты как указано в данном документе. Термин «FOLR1» охватывает «полноразмерный» непроцессированный FOLR1, а также любую форму FOLR1, которая получается в результате процессинга внутри клетки. Термин также охватывает встречающиеся в природе варианты белка или нуклеиновой кислоты FOLR1, например, сплайс-варианты, аллельные варианты и изоформы. Полипептиды и полинуклеотиды FOLR1, описанные в данном документе, могут выделяться из разнообразных источников, таких как типы тканей человека, или из другого источника или получаться рекомбинантными или синтетическими способами. Примеры последовательностей FOLR1 включают, но не ограничиваются номерами ссылок NCBI Ρ15328, NP_001092242.1, ААХ29268.1, ΑΑΧ37119.1, ΝΡ_057937.1 и ΝΡ_057936.1.
[0130] Термины «сброшенный антиген» и «сброшенный FOLR1» используются в данном документе взаимозаменяемо. Эти термины относятся к белку FOLR1, который является растворимым и который не ассоциируется с клетками. В некоторых вариантах реализации изобретения он включает внеклеточный домен (ECD) и линкер гликозилфосфатидилинозита (ГФИ). В одном варианте реализации изобретения сброшенный FOLR1 включает только ECD. Белок FOLR1 включает сигнальный пептид (аминокислоты 1-24), белковую цепь FOLR1 (аминокислоты 25-233 или 234) и пропептид, который может быть расщеплен (аминокислоты от 235 до 257). У зрелого белка FOLR1 отсутствует сигнальный пептид. Сброшенный FOLR1 может включать аминокислоты от 1 до 257, от 1 до 233, от 1 до 234, от 25 до 233, от 25 до 234 или их любые другие фрагменты. В некоторых реализациях изобретения сигнальный пептид расщепляется. В других вариантах реализации изобретения часть ECD и ГФИ может быть погружена в мембрану (например, растворимый липидный рафт). В одном варианте реализации изобретения сброшенный FOLR1 может включать аминокислоты 1-233 или их фрагмент.
[0131] Термин «антитело» означает иммуноглобулиновую молекулу, которая узнает и специфически связывается с мишенью, такой как белок, полипептид, пептид, углевод, полинуклеотид, липид или комбинации вышеназванных молекул посредством по меньшей мере одного сайта антигенного узнавания в пределах вариабельного участка молекулы иммуноглобулина. Как используется в данном документе, термин «антитело» охватывает интактные поликлональные антитела, интактные моноклональные антитела, фрагменты антител (такие как фрагменты Fab, Fab', F(ab')2 и Fv), одноцепочечные мутанты Fv (scFv), мультиспецифические антитела такие как биспецифические антитела, химерные антитела, гуманизированные антитела, антитела человека, белки слияния, содержащие определяющую антиген часть антитела и любую другую модифицированную иммуноглобулиновую молекулу, содержащую сайт узнавания антигена, при условии, что антитела проявляют требуемую биологическую активность. Антитело может быть любым из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM или их подклассов (изотипов) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), на основании идентичности их константных доменов тяжелой цепи, называемых как альфа, дельта, эпсилон, гамма и мю, соответственно. Разные классы иммуноглобулинов имеют разные и хорошо известные субъединичные структуры и трехмерные конфигурации. Антитела могут быть голыми или конъюгированными с другими молекулами, такими как токсины, радиоизотопы и т.п.
[0132] В некоторых вариантах реализации изобретения антитело представляет собой не встречающееся в природе антитело. В некоторых вариантах реализации изобретения антитело очищают от природных компонентов. В некоторых вариантах реализации изобретения антитело получают рекомбинантным способом. В некоторых вариантах реализации изобретения антитело получают с использованием гибридомы.
[0133] «Блокирующее» антитело или «антагонистическое» антитело представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, который оно связывает, такого как FOLR1. В конкретном варианте реализации изобретения блокирующие антитела или антагонистические антитела практически или полностью ингибируют биологическую активность антигена. Желательно, чтобы биологическая активность снижалась на 10%, 20%, 30%, 50%, 70%, 80%, 90%, 95% или даже 100%.
[0134] Термин «анти-FOLR1 антитело» или «антитело, которое связывается с FOLR1» относится к антителу, которое способно к связыванию FOLR1 с достаточной аффинностью, такой чтобы антитело было пригодным в качестве диагностического и/или терапевтического агента при таргетинге FOLR1. Если не указано иное, степень связывания анти-FOLR1 антитела с неродственным не-FOLR1-белком составляет менее чем около 10% связывания антитела с FOLR1, как измерено, например, радиоиммуноанализом (РИА). В некоторых вариантах реализации изобретения антитело, которое связывается с FOLR1, имеет константу диссоциации (Kd) равную ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ или ≤0,1 нМ. В одном варианте реализации изобретения анти-FOLR1 антитело не связывает FOLR2, FOLR3, FOLR4 или фолиевую кислоту. Примеры FOLR1-антител известны в данной области техники и описаны в опубликованных заявках США №2012/0009181 и 2012/0282175 и предварительных заявках США №61/695791 и 61/756254 и публикации РСТ WO 2011/106528, каждая из которых включена в данный документ посредством ссылки. Последовательности анти-FOLR1 антител и их антигенсвязывающих фрагментов представлены в табл. 1-8.
[0135] Термин «фрагмент антитела» относится к части интактного антитела и относится к антигенопределяющим вариабельным участкам интактного антитела. Примеры фрагментов антител включают, но не ограничиваются фрагментами Fab, Fab', F(ab')2 и Fv, линейными антителами, одноцепочечными антителами и мультиспецифическими антителами, сформированными из фрагментов антител. Термин «антигенсвязывающий фрагмент» антитела включает один или более фрагментов антитела, которые сохраняют способность специфически связываться с антигеном. Показано, что антигенсвязывающая функция антитела может выполняться определенными фрагментами полноразмерного антитела. Примеры связывающих фрагментов, охватываемые пределами термина «антигенсвязывающий фрагмент» антитела, включают (без ограничения): (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1 (например, антитело, расщепленное папаином, дает три фрагмента: два антигенсвязывающих фрагмента Fab и один фрагмент Fc, который не связывает антиген); (ii) фрагмент F(ab')2, бивалентный фрагмент, содержащий два фрагмента Fab, связанные дисульфидным мостиком в шарнирном участке (например, антитело, расщепленное пепсином, дает два фрагмента: бивалентный антигенсвязывающий фрагмент F(ab')2 и фрагмент pFc', который не связывает антиген) и родственную ему моновалентную единицу F(ab'); (iii) фрагмент Fd, состоящий из доменов VH и СН1 (т.е., та часть тяжелой цепи, которая включена в Fab); (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела, и родственного связанного дисульфидными связями Fv; (v) фрагмент dAb (доменное антитело) или sdAb (однодоменное антитело) (Ward et al., Nature 341: 544-546, 1989), который состоит из домена VH, и (vi) выделенный определяющий комплементарность участок (CDR).
[0136] «Моноклональное антитело» относится к гомогенной популяции антител вовлеченных в высокоспецифическое узнавание и связывание единственной антигенной детерминанты или эпитопа. Это свойство является противоположным поликлональным антителам, которые, как правило, включают разные антитела, направленные против разных антигенных детерминант. Термин «моноклональное антитело» охватывает как интактные, так и полноразмерные моноклональные антитела, а также фрагменты антител (такие как фрагменты Fab, Fab', F(ab')2, Fv), одноцепочечные мутанты (scFv), белки слияния, содержащие часть антитела и любую другую модифицированную молекулу иммуноглобулина, содержащую сайт узнавания антигена. Кроме того, «моноклональное антитело» относится к таким антителам, созданным всевозможными способами, включающими, но не ограниченными применением гибридомы, фаговой селекции, рекомбинантной экспрессии и трансгенных животных.
[0137] Термин «гуманизированное антитело» относится к формам нечеловеческих (например, мышиных) антител, которые являются специфическими иммуноглобулиновыми цепями, химерными иммуноглобулинами или их фрагментами, которые содержат минимальное количество нечеловеческих (например, мышиных) последовательностей. Как правило, гуманизированные антитела представляют собой иммуноглобулины человека, в которых остатки из определяющего комплементарность участка (CDR) заменены остатками из CDR биологических видов, не являющихся человеком (например, мыши, крысы, кролика, хомяка), которые имеют требуемую специфичность, аффинность и характеристику (Jones et al., 1986, Nature, 321: 522-525; Riechmann et al., 1988, Nature, 332: 323-327; Verhoeyen et al., 1988, Science, 239: 1534-1536). В некоторых случаях остатки Fv-каркасного участка (FR) иммуноглобулина человека заменяют соответствующими остатками антитела из биологического вида, не являющегося человеком, которое имеет требуемую специфичность, аффинность и характеристику. Гуманизированное антитело может быть дополнительно модифицированным заменой дополнительных остатков или в каркасном участке Fv и/или в пределах замененных остатков нечеловеческого организма, для улучшения и оптимизации специфичности, аффинности и характеристики антитела. В общем, гуманизированное антитело будет включать практически все из по меньшей мере одного, а как правило двух или трех, вариабельных доменов, содержащих все или практически все из участков CDR, которые соответствуют иммуноглобулину нечеловеческого организма, тогда как все или практически все из участков FR соответствуют консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело может также включать по меньшей мере часть иммуноглобулинового константного участка или домена (Fc), как правило, соответствующего иммуноглобулину человека. Примеры способов, используемых для создания гуманизированных антител, описаны в патентах США 5225539 и 5639641, Roguska et al., Proc. Natl. Acad. Sci., USA, 91(3): 969-973 (1994) и Roguska et al., Protein Eng. 9(10): 895-904 (1996). В некоторых вариантах реализации изобретения «гуманизированное антитело» представляет собой антитело с измененной поверхностью. В некоторых вариантах реализации изобретения «гуманизированное антитело» представляет собой CDR-привитое антитело.
[0138] «Вариабельный участок» антитела относится к вариабельному участку легкой цепи антитела или вариабельному участку тяжелой цепи антитела, или одному из них или в комбинации. Вариабельные участки тяжелой и легкой цепи каждый состоит из четырех каркасных участков (FR), связанных тремя определяющими комплементарность участками (CDR), также известными как гипервариабельные участки. CDR в каждой цепи удерживаются вместе в непосредственной близости посредством FR и с помощью CDR из другой цепи, принимая участие в образовании антигенсвязывающего сайта антител. Существует по меньшей мере две методики для определения CDR: (1) подход, основанный на вариабельности перекрестновидовых последовательностей (т.е. согласно Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.)), и (2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al (1997) J. Molec. Biol. 273: 927-948)). В дополнение к этому, в данной области техники для определения CDR иногда применяют комбинации этих двух подходов.
[0139] Система нумерации Кабат обычно применяется, когда обозначают остаток в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)).
[0140] Нумерация аминокислотных положений как определено по Кабату, относится к системе нумерации, применяемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи при сравнении антител в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991). При использовании этой системы нумерации действительная линейная аминокислотная последовательность может содержать меньшее количество или дополнительные аминокислоты, соответствующие сокращению или вставке в FR или CDR вариабельного домена. К примеру, вариабельный домен тяжелой цепи может включать единственную аминокислотную вставку (остаток 52а в соответствии с Кабат) после остатка 52 из Н2 и вставленные остатки (например, остатки 82а, 82b и 82 с и т.д. в соответствии с Кабат) после остатка 82 FR тяжелой цепи. Нумерация остатков Кабат может быть определена для данного антитела выравниванием в участках гомологии последовательности антитела со «стандартной» нумерованной по Кабату последовательностью. Нумерация Чотиа вместо этого касается расположения структурных петель (Chothia и Lesk J. Mol. Biol. 196: 901-917 (1987)). Конец петли CDR-H1 по Чотиа при нумерации с использованием правила нумерации Кабат варьирует между Н32 и Н34 в зависимости от длины петли (это происходит из-за того, что схема нумерации Кабат помещает инсерции в положение Н35А и Н35В; если и 35А и 35В отсутствует, то петля заканчивается на 32; если присутствует только 35А, то петля заканчивается на 33; если присутствует и 35А и 35В, то петля заканчивается на 34). Гипервариабельные участки по AbM представляют компромисс между CDR по Кабату и структурными петлями по Чотиа и используются программным обеспечением для моделирования антител AbM компании Oxford Molecular.

[0141] Термин «антитело человека» означает антитело, продуцированное организмом человека, или антитело, имеющее аминокислотную последовательность, соответствующую антителу, продуцированному организмом человека, созданным с использованием любой методики, известной в данной области техники. Это определение антитела человека включает интактные или полноразмерные антитела, его фрагменты и/или антитела, содержащие по меньшей мере один полипептид тяжелой и/или легкой цепи человека, такое как, к примеру, антитело, содержащее полипептиды легкой цепи мыши и тяжелой цепи человека.
[0142] Термин «химерные антитела» относится к антителам, в которых аминокислотная последовательность иммуноглобулиновой молекулы походит от двух или более биологических видов. Как правило, вариабельный участок и легкой и тяжелой цепей соответствует вариабельному участку антител, происходящих из одного вида млекопитающих (например, мыши, крысы, кролика и т.д.) с требуемой специфичностью, аффинностью и характеристикой, тогда как константные участки гомологичны последовательностям в антителах, происходящих из другого вида (обычно человека) для предупреждения проявления иммунного ответа у этого вида.
[0143] Термины «эпитоп» или «антигенная детерминанта» используются в данном документе взаимозаменяемо и относятся к той части антигена, которая способна узнаваться и специфически связываться конкретным антителом. Когда антиген представляет собой полипептид, эпитопы могут быть образованы как последовательными аминокислотами, так и непоследовательными аминокислотами расположенными рядом путем третичного фолдинга белка. Эпитопы, образованные из последовательных аминокислот, как правило, сохраняются при денатурировании белка, тогда как эпитопы, образованные путем третичного фолдинга, как правило, теряются при денатурировании белка. Эпитоп, как правило, включает по меньшей мере 3, и чаще, по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации.
[0144] «Аффинность связывания» обычно относится к силе полной совокупности нековалентных взаимодействий между одним связывающим сайтом молекулы (например, антитела) и ее партнером связывания (например, антигеном). Если не указано иное, как используется в данном документе, «аффинность связывания» относится к собственной аффинности связывания, которая отражает взаимодействие 1:1 между представителями пары связывания (например, антитела и антигена). Аффинность молекулы X для его партнера Y обычно может быть представлена константой диссоциации (Kd) или полумаксимальной эффективной концентрацией (ЕС50). Аффинность может быть измерена обычными методами, известными в данной области техники, включая описанные в данном документе. Антитела с низкой аффинностью обычно связывают антиген медленно и имеют склонность легко диссоциировать, тогда как антитела с высокой аффинностью обычно связывают антиген быстрее и имеют склонность оставаться связанными дольше. Разнообразные методы измерения аффинности связывания известны в данной области техники, любой из которых может применяться в целях данного изобретения. Специальные иллюстративные варианты реализации изобретения описаны в данном документе.
[0145] Фраза «или лучше», когда применяется в данном документе относится к аффинности связывания, касающейся более сильного связывания между молекулой и ее партнером связывания. Фраза «или лучше», когда применяется в данном документе, относится к более сильному связыванию, представленному меньшим числовым значением Kd. К примеру, антитело, которое обладает аффинностью к антигену равной «0,6 нМ или лучше», аффинность антитела к антигену составляет <0,6 нМ, т.е., 0,59 нМ, 0,58 нМ, 0,57 нМ и т.д. или любое значение менее 0,6 нМ. В одном варианте реализации изобретения аффинность антитела, как определено значением Kd, будет находиться между от около 10-3 до около 10-12 М, между от около 10-6 до около 10-11 М, между от около 10-6 до около 10-10 М, между от около 10-6 до около 10-9 М, между от около 10-6 до около 10-8 M или между от около 10-6 до около 10-7 М.
[0146] Фраза «практически сходный» или «практически такой же», как используется в данном документе, обозначает в достаточной мере высокую степень сходства между двумя числовыми величинами (обычно одно связано с антителом инверсии, а другое связано с эталонным антителом/антителом сравнения), так что специалист в данной области техники мог бы наблюдать, что разница между двумя величинами является малой или нет биологической и/или статистической значимости в контексте биологических свойств, измеренных указанными величинами (например, значениями Kd). Разница между указанными двумя величинами равна менее чем около 50%, менее чем около 40%, менее чем около 30%, менее чем около 20% или менее чем около 10% как функция значения для эталонного антитела/антитела сравнения.
[0147] Термин «иммуноконъюгат» или «конъюгат», как используется в данном документе, относится к соединению или его производному, которое связано со связывающим клетки агентом (т.е. анти-FOLR1 антителом или его фрагментом) и определенным общей формулой: A-L-C, где С = цитотоксин, L = линкер и А = связывающий клетки агент или анти-FOLR1 антитело или фрагмент антитела. Иммуноконъюгаты также могут быть определенны общей формулой в обратном порядке: C-L-A.
[0148] «Линкер» представляет собой любой химический фрагмент, который способен связывать соединение, обычно лекарственное вещество, такое как майтанзиноид, связывающий клетки агент, такой как анти-FOLR1 антитело или его фрагмент, стабильным ковалентным способом. Линкеры могут быть чувствительными или практически устойчивыми к кислотоиндуцированному расщеплению, светоиндуцированному расщеплению, пептидазоиндуцированному расщеплению, эстеразоиндуцированному расщеплению и расщеплению дисульфидных связей в условиях, в которых соединение или антитело остается активным. Подходящие линкеры хорошо известны в данной области техники и включают, к примеру, дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, пептидазолабильные группы и эстеразолабильные группы. Линкеры также включают заряженные линкеры и их гидрофильные формы, как описано в данном документе и известно в данной области техники.
[0149] Полипептид, антитело, полинуклеотид, вектор, клетка или композиция, которая является «выделенной» представляет собой полипептид, антитело, полинуклеотид, вектор, клетку или композицию, которая находятся в форме, не обнаруженной в природе. Выделенные полипептиды, антитела, полинуклеотиды, векторы, клетки или композиции включают те, которые были очищены до степени, в которой они больше не находятся в форме, в которой они обнаружены в природе. В некоторых вариантах реализации изобретения антитело, полинуклеотид, вектор, клетка или композиция, которая выделена является практически чистой.
[0150] Как используется в данном документе, «практически чистый» относится к веществу, которое является по меньшей мере на 50% чистым (т.е. свободным от контаминантов), по меньшей мере на 90% чистым, по меньшей мере на 95% чистым, по меньшей мере на 98% чистым или по меньшей мере на 99%» чистым.
[0151] Термин «повышенный» FOLR1, «увеличенная экспрессия» FOLR1 и «сверхэкспрессия» FOLR1 относится к образцу, который содержит повышенные уровни экспрессии FOLR1. FOLR1 может быть повышенным, увеличенным или сверхэкспрессированным по сравнению с контрольным значением (например, уровнем экспрессии в биологическом образце, ткани или клетки, полученной от субъекта без ракового заболевания, образце или при раковом заболевании, для которого не известна экспрессия или имеется низкий FOLR1, нормальном образце или раковом заболевании, для которого не отмечено наличие повышенных значений FOLR1). К примеру, образец с увеличенной экспрессией может содержать увеличение по меньшей мере 2-кратное, по меньшей мере 3-кратное или по меньшей мере 5-кратное относительно контрольных значений.
[0152] Экспрессия FOLR1 может измеряться методом иммуногистохимии и давать показатель интенсивности окрашивания или показатель однородности окрашивания путем сравнения с калиброванными контролями, проявившими определенные показатели (например, показатель интенсивности равный 3 дается для испытуемого образца, если интенсивность сравнима с уровнем 3 калиброванного контроля, или интенсивность равная 2 дается для испытуемого образца, если интенсивность сравнима с уровнем 2 калиброванного контроля). К примеру, показатель равный 1, 2 или 3 (3+), предпочтительно показатель равный 2 или 3 (3+), полученный методом иммуногистохимии, указывает на увеличенную экспрессию FOLR1. Однородность окрашивания, которая гетерогенна или гомогенна также является характерной для экспрессии FOLR1. Показатели интенсивности окрашивания и однородности окрашивания также могут быть использованы сами или в комбинации (например, 2 гомо, 2 гетеро, 3 гомо, 3 гетеро и т.д.). См. табл. 11. В другом примере, увеличение экспрессии FOLR1 может быть определено выявлением увеличения по меньшей мере 2-кратного, по меньшей мере 3-кратного или по меньшей мере 5-кратного относительно контрольных значений (например, уровня экспрессии в ткани или клетке, полученной от субъекта без ракового заболевания или с раковым заболеванием, при котором не отмечается повышенных значений FOLR1).
[0153] «Эталонный образец» может применяться для проведения корреляции и сравнения результатов, полученных в способах изобретения, с испытуемым образцом. Эталонные образцы могут быть клетками (например, линиями клеток, осадками клеток) или тканью. Уровни FOLR1 в «эталонном образце» могут быть выражены в абсолютном или относительном количестве, диапазоне количества, минимальном и/или максимальном количестве, среднем количестве и/или медианном количестве FOLR1. «Эталонный образец» также может служить в качестве исходного уровня экспрессии FOLR1, с которым сравнивается испытуемый образец. «Эталонный образец» может включать предварительный образец или образец исходного уровня, полученный от того же пациента, нормальный эталон с известным уровнем экспрессии FOLR1 или эталон, полученный от целевой популяции пациентов с известным уровнем экспрессии FOLR1. Уровни FOLR1 также могут выражены в виде величин на стандартной кривой. Стандартная кривая представляет собой метод количественного определения по расположенным на графике данным анализа для определения в образце концентрации FOLR1. В одном варианте реализации изобретения эталонный образец представляет собой стандарт антигена, содержащий очищенный FOLR1 или FOLR1-Fc. Диагностические способы по данному изобретению могут вовлекать сравнение между уровнями экспрессии FOLR1 в испытуемом образце и «эталонной величиной». В некоторых вариантах реализации изобретения эталонная величина представляет собой уровень экспрессии FOLR1 в эталонном образце. Эталонная величина может быть предварительно определенным значением, а также может быть определена по эталонным образцам (например, контрольным биологическим образцам или эталонным образцам), испытанным параллельно с испытуемыми образцами. Эталонная величина может быть единственным пороговым значением, таким как медианное или среднее, или диапазоном значений, таким как доверительный интервал. Эталонные величины могут быть установлены для различных подгрупп индивидов, таких как индивидов, предрасположенных к раковому заболеванию, индивидов, имеющих раннюю или позднюю стадию рака, индивидов мужского и/или женского пола или индивидов, проходящих терапию ракового заболевания. Примеры нормальных эталонных образцов или величин и положительных эталонных образцов или величин описаны в данном документе, а также описаны в примере 1 и примерах 8-10 заявки WO 2012/135675, включенной в данный документ посредством ссылки.
[0154] В некоторых вариантах реализации изобретения эталонный образец представляет собой образец здоровой ткани, в частности, соответствующей ткани, которая не поражена раковым заболеванием, или соответствующей ткани, которая не поражена раковым заболеванием, при котором сверхэкспрессируется FOLR1, или соответствующей здоровой ткани, которая как известно не экспрессирует выявляемые уровни FOLR. Эти типы эталонных образцов называются отрицательными контрольными образцами или «нормальными» эталонными образцами. В других вариантах реализации изобретения эталонный образец представляет собой образец из опухоли или здоровой ткани, которая экспрессирует выявляемый FOLR1. Эти типы эталонных образцов называются положительными контрольными или положительными эталонными образцами. Положительные контрольные образцы также могут использоваться как сравнительный индикатор для типа (гетеро по сравнению с гомо) и/или степени (0, 1, 2, 3) интенсивности окрашивания, которая коррелирует с уровнем экспрессии FOLR1. Положительные контрольные сравнительные образцы также называются калиброванными эталонными образцами. Эталоны, экспрессирующие низкий уровень или не экспрессирующие FOLR1, описаны в данном документе в примерах, а также включают все структуры пищевода, ацинарные клетки/островки поджелудочной железы, межальвеолярную соединительную ткань легких и ацинарные клетки слюнных желез. Для линий клеток типичные не экспрессирующие клетки включают ВхРС3, Panc-1 и ASPC1. Положительные эталоны FOLR1 описаны в данном документе, к примеру, в примерах, а также включают протоки поджелудочной железы, респираторный эпителий нормальных легких и промежуточные протоки слюнных желез. В некоторых вариантах реализации изобретения положительные эталоны FOLR1 включают протоки поджелудочной железы и промежуточные протоки слюнных желез. Для линий клеток типичные клетки с высокой экспрессией FOLR1 описаны в данном документе, к примеру, в примерах, а также включают KB, HeLa, трансфецированные FOLR1 клетки 30019, Igrov-1 и Wish, а типичные клетки с низкой экспрессией FOLR1 включают Ovcar-3, Caov-3, SW620, T47D и Skov-3. Другой положительный эталон с высоким FOLR1 представляет собой линию клеток, стабильно или транзиентно трансфецированную FOLR1. Дополнительные положительные и отрицательные образцы для FOLR1 описаны в табл. 13. Соответствующие положительные и отрицательные эталонные уровни FOLR1 для конкретного ракового заболевания могут быть определены измерением уровней FOLR1 в одном или более подходящих субъектов, и такие эталонные уровни могут быть привязаны к специфическим популяциям субъектов (например, эталонный уровень может быть определен по возрастной группе так, чтобы сравнения могли быть сделаны между уровнями FOLR1 в образцах, полученных от субъектов определенного возраста, и эталонными уровнями для конкретного болезненного состояния, фенотипа или их отсутствия в определенной возрастной группе). Такие эталонные уровни также могут быть привязаны к специфическим методикам, которые применяются для измерения уровней FOLR1 в биологических образцах (например, иммуноанализах и т.п.).
[0155] Как используется в данном документе «иммуногистохимия» относится гистохимическим и иммунологическим методам, используемых для анализа, к примеру, клеток или тканей. Таким образом, термины «иммуногистохимия», «иммуноцитохимия» и «иммунохимия» применяются взаимозаменяемо.
[0156] Термин «первичное антитело» в данном документе относится к антителу, которое специфически связывается в образце с целевым белковым антигеном. Первичное антитело обычно представляет собой первое антитело, применяемое в ИФА анализе или ИГХ методике. В одном варианте реализации изобретения первичное антитело представляет собой антитело применяемое только в ИГХ методике. Термин «вторичное антитело» в данном документе относится к антителу, которое специфически связывается с первичным антителом, тем самым образуя мостик или связь между первичным антителом и последующим реактивом, если он используется. Вторичное антитело обычно представляет собой второе антитело, применяемое в иммуногистохимической методике.
[0157] «Образец» или «биологический образец» по данному изобретению является биологического происхождения, в специальных вариантах реализации изобретения такой образец получен из эукариотических организмов. В некоторых вариантах реализации изобретения образец представляет собой образец, полученный из организма человека, но также могут использоваться образцы, полученные из животных. Неограничивающие источники для использования в данном изобретении включают, к примеру, плотную ткань, аспирационные биоптаты, асциты, жидкие экстракты, кровь, плазму, сыворотку, спинномозговую жидкость, лимфатическую жидкость, наружные срезы кожи, респираторный, кишечный и урогенитальный тракты, слезы, слюну, молоко, опухоли, органы, культуры клеток и/или компоненты культур клеток. «Злокачественный образец» представляет собой образец, который содержит злокачественные клетки. Способ может применяться для проверки аспекта экспрессии FOLR1 или состояния образца, включая, но не ограничиваясь, сравнением разных типов клеток или тканей, сравнением разных стадий развития и обнаружением или определением наличия и/или типа заболевания или отклонения.
[0158] Для целей данного документа «срез» образца ткани считается одной частью или фрагментом образца ткани, например, тонкий слой ткани или клеток, срезанный из образца ткани. Подразумевается, что могут быть взяты множественные срезы образцов тканей и подвергнуты анализу в соответствии с предложенным изобретением. В некоторых случаях отобранная часть или срез ткани содержит гомогенную популяцию клеток. В других случаях отобранная часть содержит участок ткани, например, полость, в качестве неограничивающего примера. Отобранная часть может быть настолько мала как одна клетка или две клетки или может представлять, к примеру, несколько тысяч клеток. В большинстве случаев, важно получить набор клеток и, когда в изобретении описано применение для обнаружения клеточных компонентов, то способ также может применяться для обнаружения неклеточных компонентов организма (например, растворимых компонентов в крови, в качестве неограничивающего примера).
[0159] Как используется в данном документе, термин «реактив для захвата» относится к реактиву способному к связыванию и захватыванию целевой молекулы в образце так, что при подходящих условиях комплекс реактив для захвата-целевая молекула может быть отделен от остального образца. В одном варианте реализации изобретения реактив для захвата иммобилизирован. В одном варианте реализации изобретения реактив для захвата в «сэндвич»-иммуноанализе представляет собой антитело или смесь разных антител против целевого антигена.
[0160] Как используется в данном документе термин «выявляемое антитело» относится к антителу, которое способно выявляться как прямо посредством метки, усиленной средством для обнаружения, или косвенно посредством, например, другого антитела, которое мечено. Для прямого внедрения метки антитело, как правило, конъюгируют с фрагментом, который выявляется каким-либо способом. В одном варианте реализации изобретения выявляемое антитело представляет собой биотинилированное антитело.
[0161] Как используется в данном документе, термин «средство для обнаружения» относится к фрагменту или методике, используемой для обнаружения присутствия выявляемого антитела и включает агенты для обнаружения, которые усиливают иммобилизированную метку, такую как метка, захваченная на планшете для микротирования. В одном варианте реализации средство для обнаружения представляет собой флуориметрический агент для обнаружения, такой как авидин или стрептавидин.
[0162] Зачастую при выполнении «сэндвич-ИФА» задействованы следующие стадии: (1) планшет для микротирования покрывается антителом для захвата; (2) добавляется образец и любой присутствующий антиген связывается с антителом для захвата; (3) выявляемое антитело добавляется и связывается с антигеном; (4) добавляется связанное с ферментом вторичное антитело и связывается с выявляемым антителом и (5) добавляется субстрат и конвертируется ферментом в выявляемую форму.
[0163] Слово «метка», при использовании в данном документе относится к выявляемому соединению или композиции, которая непосредственно или опосредованно конъюгирована с антителом так, чтобы создать «меченое» антитело. Метка может быть выявляемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментной метки, может катализировать химическое изменение соединения субстрата или композиции, которая является выявляемой.
[0164] Под термином «коррелировать» или «коррелирование» обозначается сравнение, тем или иным способом, характеристики и/или результатов первого анализа с характеристикой и/или результатами второго анализа. К примеру, кто-то может использовать результаты первого анализа для проведения второго анализа и/или кто-то может использовать результаты первого анализа для определения того, следует ли выполнять второй анализ и/или кто-то может сравнить результаты первого анализа с результатами второго анализа. В одном варианте реализации изобретения увеличенная экспрессия FOLR1 коррелирует с увеличенной вероятностью эффективности FOLR1-таргетированной противораковой терапии.
[0165] Термины «рак» и «злокачественный» относятся к или описывают физиологическое состояние млекопитающих, в котором популяция клеток характеризуется неконтролируемым ростом клеток. Примеры рака включают, но не ограничиваются, карциномой, лимфомой, бластомой, саркомой и лейкемией. Более конкретные примеры таких раковых заболеваний включают раковые заболевания эндотелиального, мезенхимального или эпителиального происхождения, такие как рак легких (например, плоскоклеточный рак, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарцинома легких, мезотелиома и плоскоклеточная карцинома легких), рак брюшной полости (например, первичный перитонеальный рак), гепатоклеточный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичников (серозный или эндометриоидный), рак печени, рак мочевого пузыря, гепатома, рак грудной железы, рак толстой кишки, колоректальный рак, эндометриоидная (например, аденокарцинома эндометрия) или карцинома матки, карцинома слюнных желез, рак почек, рак печени, рак простаты, рак вульвы, рак щитовидной железы, карцинома печени, рак головного мозга (например, глиобластома, опухоли хориоидного сплетения) и различные типы раковых заболеваний головы и шеи, а также опухоли кровеносных сосудов и фаллопиевых труб. Раковые заболевания также охватывают раковые заболевания, которые содержат клетки, имеющие повышенные уровни экспрессии FOLR1. Такие раковые заболевания с повышенным FOLR1 включают, но не ограничиваются раком яичников, немелкоклеточным раком легких (аденокарциномой), раком матки, эндометрия, поджелудочной железы, почек, легких и молочных желез.
[0166] «Опухоль» или «новообразование» относится к любой массе ткани, которая является результатом чрезмерного роста или пролиферации клеток, или доброкачественной (нераковой) или злокачественной (раковой) массой ткани, включая предраковые образования.
[0167] Термины «раковая клетка», «опухолевая клетка» и грамматические эквиваленты относятся к общей популяции клеток, происходящих из опухоли или предракового образования, включая как неопухолеобразующие клетки, которые содержат массив популяции опухолевых клеток, и опухолеобразующие стволовые клетки (раковые стволовые клетки). Как используется в данном документе, термин «опухолевая клетка» должен быть модифицирован термином «неопухолеобразующая», когда целиком относится к тем опухолевым клеткам, у которых отсутствует способность к возобновлению и дифференциации, чтобы различать такие опухолевые клетки и раковые стволовые клетки.
[0168] Термин «субъект» относится к любому животному (например, млекопитающему), включающему, но не ограниченному людьми, приматами кроме человека, грызунами и им подобными, которое должны быть реципиентом конкретного лечения. Как правило, термин «субъект» и «пациент» применяются в данном документе взаимозаменяемо касательно субъекта-человека.
[0169] Термин «фармацевтический состав» относится к препарату, который представлен в такой форме, чтобы обеспечить эффективное проявление биологической активности активного ингредиента, и который не содержит дополнительных компонентов, которые являются недопустимо токсичными для субъекта, которому должен вводиться состав. Такой состав должен быть стерильным.
[0170] «Эффективное количество» антитела или иммуноконъюгата, как описано в данном документе, представляет собой количество, достаточное для использования для специально заявленного предназначения. «Эффективное количество» может быть определено эмпирически и рутинным способом, по отношению к заявленному предназначению.
[0171] Термин «терапевтически эффективное количество» относится к количеству антитела или другого лекарственного вещества, эффективного для «лечения» заболевание или нарушения у субъекта или млекопитающего. В случае ракового заболевания терапевтически эффективное количество лекарственного вещества может уменьшить количество раковых клеток; уменьшить размер опухоли; ингибировать (т.е. в некоторой степени замедлить и, в конкретном варианте реализации изобретения, остановить) инфильтрацию раковых клеток в периферийные органы; ингибировать (т.е. в некоторой степени замедлить и, в конкретном варианте реализации изобретения, остановить) опухолевые метастазы; ингибировать в некоторой степени опухолевый рост; облегчить в некоторой степени один или более симптомов, связанных с раковым заболеванием, и/или привести к благоприятному ответу, такому как увеличенная выживаемость без прогрессирования (PFS), безрецидивная выживаемость (DFS) или общая выживаемость (OS), полный ответ (CR), частичный ответ (PR) или, в некоторых случаях, стабилизация заболевания (SD), уменьшение прогрессирования заболевания (PD), снижение времени до прогрессирования (ТТР), уменьшение CA125, в случае рака яичников, или к их любой комбинации. См. определение в данном документе для термина «лечение». В том случае, когда лекарственное вещество может предупреждать рост и/или убивать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. В некоторых вариантах реализации изобретения идентификация увеличенных уровней FOLR1 позволяет вводить уменьшенные количества FOLR1-таргетированных лекарственных средств для достижения такого же терапевтического эффекта, который наблюдается с более высокими дозами. «Профилактически эффективное количество» относится к количеству, эффективному в дозировках и в течение периодов времени, необходимых для достижения требуемого профилактического результата. Как правило, но не обязательно, поскольку профилактическая доза применяется у субъектов до заболевания или на ранней стадии заболевания, профилактически эффективное количество будет меньше чем терапевтически эффективное количество.
[0172] Термин «благоприятно отвечать» обычно относится к тому, что вызывает у субъекта благоприятное состояние. В отношении лечения рака термин относится к достижению субъектом терапевтического эффекта. Положительные терапевтические эффекты при раковом заболевании могут быть измерены различными способами (см. W.A. Weber, J. Nucl. Med. 50: 1S-10S (2009)). К примеру, ингибирование опухолевого роста, экспрессия молекулярного маркера, экспрессия сывороточного маркера и методики молекулярной визуализации - все могут применяться для оценки терапевтической эффективности противоракового лекарственного средства. В отношении ингибирования опухолевого роста в соответствии со стандартом NCI соотношение Т/С≤42% представляет собой минимальный уровень противоопухолевой активности. Соотношение Т/С<10% считается высоким уровнем противоопухолевой активности, где Т/С (%) = медианный объем пролеченной опухоли / медианный объем контроля × 100. Благоприятный ответ может оцениваться, к примеру, по увеличенной выживаемости без прогрессирования (PFS), безрецидивной выживаемости (DFS) или общей выживаемости (OS), полному ответу (CR), частичному ответу (PR) или, в некоторых случаях, стабилизации заболевания (SD), уменьшению прогрессирования заболевания (PD), снижению времени до прогрессирования (ТТР), уменьшению CA125, в случае рака яичников, или по их любой комбинации.
[0173] Показатели PFS, DFS и OS могут быть измерены по набору стандартов, установленных Национальным институтом рака и Управлением по контролю за продуктами и лекарствами США для одобрения новых лекарств. См. Johnson et al., (2003) J. Clin. Oncol. 21(7): 1404-1411.
[0174] «Выживаемость без прогрессирования» (PFS) относится к периоду времени от регистрации до прогрессирования заболевания или смерти. PFS обычно измеряется с использованием метода Каплана-Майера и стандартов определения критериев оценки ответа при солидных опухолях (RECIST) 1.1. Обычно, выживаемость без прогрессирования относится к ситуации, в которой пациент остается живым без усугубления ракового заболевания.
[0175] «Время до прогрессирования опухоли» (ТТР) определяют как период времени от регистрации до прогрессирования заболевания. ТТР обычно измеряют с использованием критериев RECIST 1.1.
[0176] «Полный ответ» или «полная ремиссия» или «CR» указывает на исчезновение всех признаков опухоли или ракового заболевания в ответ на лечение. Это не всегда означает, что раковое заболевание вылечено.
[0177] «Частичный ответ» или «PR» относится к уменьшению размера или объема одной или более опухолей или образований, или степени распространенности ракового заболевания в организме в ответ на лечение.
[0178] «Стабилизация заболевания» относится к заболеванию без прогрессирования или рецидива. При стабилизации заболевания не обнаруживается ни достаточного уменьшения размеров опухоли для классификации частичного ответа, ни достаточного увеличения размеров опухоли для классификации прогрессирования заболевания.
[0179] «Прогрессирование заболевания» относится к возникновению еще одного нового образования или опухоли и/или однозначного прогрессирования существующих нетаргетированных образований. Прогрессирование заболевания также может относиться к опухолевому росту на более чем 20 процентов от начала лечения как из-за увеличения массы, так и из-за распространения опухоли.
[0180] «Безрецидивная выживаемость» (DFS) относится к промежутку времени в течение и после лечения, в котором пациент остается избавленным от заболевания.
[0181] «Общая выживаемость» (OS) относится к периоду времени от регистрации пациента до смерти или цензурируется по последней дате, когда известно, что пациент оставался живым. OS включает пролонгирование продолжительности жизни по сравнению с не получавшими лечение или нелечеными индивидами или пациентами. Общая выживаемость относится к ситуации, в которой пациент остается живым в течение определенного периода времени, такого как один год, пять лет и т.д., например, от времени постановки диагноза до лечения.
[0182] «Уменьшение уровней CA125» может оцениваться в соответствии с наставлениями Международной интергруппы гинекологического рака (GCIG). К примеру, уровни CA125 могут быть измерены перед лечением для установления исходного уровня СА125. Уровни СА125 могут быть измерены один или более раз во время или после лечения, а снижение уровней СА125, по прошествии времени по сравнению с исходным уровнем, считается уменьшением уровней CA125.
[0183] Такие термины как «получение лечения» или «лечение» или «лечить» или «облегчение» или «облегчать» относятся к терапевтическим мерам по лечению, снижению скорости, уменьшению симптомов и/или остановке прогрессирования диагностированного патологического состояния или нарушения. Таким образом, те, кто нуждается в лечении включают тех, у кого уже диагностировано или есть подозрение на наличие нарушения. В некоторых вариантах реализации изобретения субъект успешно «излечивается» от ракового заболевания в соответствии со способами данного изобретения, если пациент проявляет одно или более из следующего: снижение количества или полное отсутствие раковых клеток; снижение размера опухоли; ингибирование или отсутствие инфильтрации раковых клеток в периферийные органы, включая, к примеру, распространение опухоли в мягкую ткань и кость; ингибирование или отсутствие опухолевых метастазов; ингибирование или отсутствие опухолевого роста; облегчение одного или более симптомов, связанных с конкретным раковым заболеванием; уменьшение тяжести заболевания и смертности; улучшение качества жизни; снижение онкогенности, онкогенной частоты или онкогенной способности опухоли; снижение количества или частоты образования раковых стволовых клеток в опухоли; дифференциация онкогенных клеток в неонкогенное состояние; увеличение выживаемости без прогрессирования (PFS), безрецидивной выживаемости (DFS) или общей выживаемости (OS), полный ответ (CR), частичный ответ (PR), стабилизация заболевания (SD), уменьшение прогрессирования заболевания (PD), снижение времени до прогрессирования (ТТР), уменьшение СА125, в случае рака яичников, или их любая комбинация.
[0184] Профилактические или превентивные меры относятся к терапевтическим мерам, которые предупреждают и/или замедляют развитие таргетируемого патологического состояния или нарушения. Таким образом, те, кто нуждается в профилактических или превентивных мерах включают тех, кто предрасположен к нарушению, и тех, у которых нарушение требуется предупредить.
[0185] Как используется в данном документе термин «медицинский работник» относится к индивидам или организациям, которые непосредственно взаимодействуют и оказывают помощь живым субъектам, например, пациентам-людям. Не ограничивающие примеры медицинских работников включают докторов, медсестер, лаборантов, терапевта, фармацевтов, консультантов, практикующих альтернативную медицину, медицинские учреждения, врачебные кабинеты, больницы, пункты скорой помощи, клиники, пункты неотложной помощи, клиники/учреждения альтернативной медицины и любой другой объект, обеспечивающий общее и/или специализированное лечение, оценивание, обслуживание, терапию, медикаментозное лечение и/или консультирование в отношении всех или любой части состояния здоровья пациента, включая, но не ограничиваясь, общим медицинским, специализированным медицинским, хирургическим и/или любым другим типом лечения, оценивания, обслуживания, терапии, медикаментозного лечения и/или консультирования.
[0186] В некоторых аспектах медицинский работник может оказывать помощь или инструктировать другого медицинского работника относительно назначения терапии для лечения рака. «Проведение» терапии, как используется в данном документе, включает назначение терапии субъекту, а также доставку, применение и предоставление терапии субъекту. Медицинский работник может проводить лечение или инструктировать другого медицинского работника или пациента относительно выполнения следующих действий: получение образца, обработку образца, передачу образца, получение образца, передачу образца, проведение анализа или измерение образца, количественное определение образца, предоставление результатов, полученных после анализа/измерения/количественного определения образца, получение результатов, полученных после анализа/измерения/количественного определения образца, сравнение/оценка результатов, полученных после анализа/измерения/количественного определения образца, предоставление сравнения/оценки для одного или более образцов, получение сравнения/оценки для одного или более образцов, проведение терапии или введение терапевтического агента (например, FOLR1-связывающего агента), инициирование проведения терапии, прекращение проведения терапии, продолжение проведения терапии, временное прекращение проведения терапии, увеличение количества назначенного терапевтического агента, уменьшение количества назначенного терапевтического агента, продолжение введения некоторого количества терапевтического агента, увеличение частоты введения терапевтического агента, уменьшение частоты введения терапевтического агента, поддержание такой же частоты дозировки терапевтического агента, замена терапии или терапевтического агента по меньшей мере другой терапией или терапевтическим агентом, комбинирование терапии или терапевтического агента по меньшей мере с другой терапией или дополнительным терапевтическим агентом. Эти действия могут выполняться медицинским работником автоматически, используя реализованный на компьютере способ (например, посредством веб-службы или автономной компьютерной системы).
[0187] Термины «полинуклеотид» или «нуклеиновая кислота», используемые в данном документе взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами, или любым субстратом, который может быть внедрен в полимер ДНК- или РНК-полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Если требуется, модификация в нуклеотидную структуру может быть внесена до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, таким способом как конъюгация с метящим компонентом. Другие типы модификаций включают, к примеру, «кэпы», замены одного или более встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, такие как, к примеру, нуклеотиды с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.п.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.п.), модификации, содержащие боковые фрагменты, такие как, к примеру, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, слоистый L-лизин и т.п.), модификации с интеркаляторами (например, акридином, псораленом и т.п.), модификации, содержащие хелатирующие агенты (например, металлы, радиоактивные металлы, бор, окисляющие металлы и т.п.), модификации, содержащие алкилирующие агенты, модификации, с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.п.), а также немодифицированные формы полинуклеотида(ов). Дополнительно, любая из гидроксильных групп, обыкновенно присутствующих в сахарах, может быть заменена, к примеру, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей для дополнительных нуклеотидов, или может быть конъюгирована с твердыми подложками. 5'- и 3'-концевой ОН может быть фосфорилирован или замещен аминами или органическими фрагментами, кэппирующими группы, из от 1 до 20 атомов углерода. Другие гидроксилы также могут быть дериватизированными для получения стандартных защитных групп. Полинуклеотиды также могут содержать аналогичные формы рибозных и дезоксирибозных Сахаров, которые обычно хорошо известны в данной области техники, включая, к примеру, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги Сахаров, альфа-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и неосновные нуклеозидные аналоги, такие как метилрибозид. Одна или более фосфодиэфирных связей могут быть заменены альтернативными связывающими группами. Эти альтернативные связывающие группы включают, но не ограничиваются, вариантами реализации изобретения, в которых фосфат заменен P(O)S («тиоат»), P(S)S («дитиоат»), (O)NR2 («амидат»), P(O)R, P(O)OR', СО или СН2 («формацеталь»), в которых каждый R или R' является независимо H или замещенным или незамещенным алкилом (1-20 С), необязательно содержащим любую эфирную (--О--) связь, арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не требуется, чтобы все связи в полинуклеотиде были идентичные. Предшествующее описание применимо ко всем полинуклеотидам, названным в данном документе, включая РНК и ДНК.
[0188] Термин «вектор» означает конструкцию, которая способна доставлять и экспрессировать один или более ген(ов) или последовательность(ей), представляющих интерес, в клетку-хозяина. Примеры векторов включают, но не ограничиваются, вирусными векторами, голой ДНК или РНК-экспрессионным вектором, плазмидой, космидными или фаговыми векторами, ДНК- или РНК-экспрессионными векторами, ассоциированными с катионными конденсирующими агентами, ДНК- или РНК-экспрессионными векторами, инкапсулированными в липосомы, и определенными эукариотическими клетками, такими как клетки-продуценты.
[0189] Термины «полипептид», «пептид» и «белок» применяются в данном документе взаимозаменяемо в отношении полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты и он может прерываться неаминокислотами. Термины также охватывают аминокислотный полимер, который модифицирован природным способом или внедрением; к примеру, образованием дисульфидной связи, гликозилированием, липидизацией, ацетилированием, фосфорилированием или любой другой манипуляцией или модификацией, такой как конъюгация с метящим компонентом. Определением также охвачены, к примеру, полипептиды, содержащие один или более аналогов аминокислот (включая, к примеру, неприродные аминокислоты и т.п.), а также другие модификации, известные в данной области техники. Подразумевается, что благодаря тому, что полипептиды по данному изобретению основываются на антителах, в некоторых вариантах реализации изобретения полипептиды могут встречаться в виде одноцепочечных или ассоциированных цепей. В некоторых вариантах реализации изобретения полипептид, пептид или белок не является встречающимися в природе. В некоторых вариантах реализации изобретения полипептид, пептид или белок очищают от других встречающихся в природе компонентов. В некоторых вариантах реализации изобретения полипептид, пептид или белок получены рекомбинантным способом.
[0190] Термины «идентичный» или процент «идентичности» в контексте двух или более нуклеиновых кислот или полипептидов относятся к двум или более последовательностям или подпоследовательностям, которые одинаковые или обладают установленным процентным содержанием нуклеотидов или аминокислотных остатков, которые одинаковые при сравнении и выравнивании (если требуется, внедряя гэпы) на максимальное соответствие, не рассматривая любые консервативные аминокислотные замены, как части идентичности последовательностей. Процент идентичности может измеряться с использованием программного обеспечения или алгоритмов или визуальной проверкой. Различные алгоритмы и программное обеспечение хорошо известны в данной области техники, они могут использоваться для получения результатов выравниваний аминокислотных или нуклеотидных последовательностей. Один такой не ограничивающий пример алгоритма выравнивания последовательностей представляет собой алгоритм, описанный в статье Karlin et al., 1990, Proc. Natl. Acad. Sci., 87: 2264-2268, в модифицированном виде в статье Karlin et al., 1993, Proc. Natl. Acad. Sri., 90: 5873-5877, и включен в программы NBLAST и XBLAST (Altschul et al., 1991, Nucleic Acids Res., 25: 3389-3402). В некоторых вариантах реализации изобретения, может использоваться BLAST с использованием гэпов, как описано в статье Altschul et al., 1997, Nucleic Acids Res. 25: 3389-3402. BLAST-2, WU-BLAST-2 (Altschul et al., 1996, Methods in Enzymology, 266: 460-480), ALIGN, ALIGN-2 (Genentech, г. Южный Сан Франциско, Калифорния) или Megalign (DNASTAR) представляют собой дополнительные общедоступные программные продукты, которые могут использоваться для выравнивания последовательностей. В некоторых вариантах реализации изобретения процент идентичности между двумя нуклеотидными последовательностями определяется с использованием программы GAP в программном обеспечении GCG (например, используя матрицу NWSgapdna. CMP и вес гэпа равный 40, 50, 60, 70 или 90 и вес длины равный 1, 2, 3, 4, 5 или 6). В некоторых альтернативных вариантах реализации изобретения программа GAP в программном пакете GCG, который включает алгоритм Нидлмана и Вунша (J. Mol. Biol. (48): 444-453 (1970)), может использоваться для определения процента идентичности между двумя аминокислотными последовательностями (например, используя или матрицу Blossum 62 или матрицу РАМ250 и вес гэпа равный 16, 14, 12, 10, 8, 6 или 4 и вес длины равный 1, 2, 3, 4, 5). Альтернативно, в некоторых вариантах реализации изобретения процент идентичности между нуклеотидными или аминокислотными последовательностями определяется с использованием алгоритма Майерса и Миллера (CABIOS, 4: 11-17 (1989)). К примеру, процент идентичности может определяться с использованием программы ALIGN (версия 2.0) и, используя РАМ120 с таблицей остатков, штрафом за продление гэпа равным 12 и штрафом за внесения гэпа равным 4. Подходящие параметры для максимального выравнивания конкретным программным обеспечением для выравнивания могут определяться специалистом в данной области. В некоторых вариантах реализации изобретения в программном обеспечении для выравнивания используются параметры по умолчанию. В некоторых вариантах реализации изобретения процент идентичности «X» первой аминокислотной последовательности относительно второй последовательности аминокислот рассчитывается как 100×(Υ/Ζ), где Y представляет собой количество аминокислотных остатков, рассчитанных как идентичные соответствия при выравнивании первой и второй последовательностей (при выравнивании путем визуальной проверки или конкретной программы для выравнивания последовательностей) и Ζ представляет собой общее количество остатков во второй последовательности. Если длина первой последовательности длиннее второй последовательности, то процент идентичности первой последовательности ко второй последовательности будет больше, чем процент идентичности второй последовательности относительно первой последовательности.
[0191] Не ограничивающий пример при условии, что любой конкретный полинуклеотид обладает определенным процентом идентичности последовательности (например, является по меньшей мере на 80% идентичным, по меньшей мере на 85% идентичным, по меньшей мере на 90% идентичным и, в некоторых вариантах реализации изобретения, по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичным) эталонной последовательности может, в некоторых вариантах реализации изобретения, определяться с использованием программы Bestfit (пакет анализа последовательностей Wisconsin, версия 8 для Unix, Genetics Computer Group, University Research Park, 575 Science Drive, Madison, WI 53711). Программа Bestfit использует алгоритм локальной гомологии Смита и Уотермана, Advances in Applied Mathematics 2: 482 489 (1981), для обнаружения наилучшего сегмента гомологии между двумя последовательностями. При использовании Bestfit или любой другой программы для выравнивания последовательностей для определения того, является ли конкретная последовательность, например, на 95% идентичной эталонной последовательности в соответствии с данным изобретением, параметры устанавливают таким образом, чтобы процент идентичности рассчитывался на полной длине эталонной нуклеотидной последовательности и чтобы допускались гэпы в гомологии до 5% от общего количества нуклеотидов в эталонной последовательности.
[0192] В некоторых вариантах реализации изобретения две нуклеиновые кислоты или полипептида по данному изобретению являются практически идентичными, что означает, что они обладают по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, и, в некоторых вариантах реализации изобретения, по меньшей мере 95%, 96%, 97%, 98%, 99% идентичности нуклеотидных или аминокислотных остатков, при сравнении и выравнивании на максимальное соответствие, измеренное с использованием алгоритма сравнения последовательностей или полученное визуальной проверкой. В некоторых вариантах реализации изобретения идентичность существует на протяжении участка последовательностей, который составляет по меньшей мере около 10, около 20, около 40-60 остатков в длину или любое целое значение между этими значениями или на протяжении более длинного участка, чем 60-80 остатков, по меньшей мере около 90-100 остатков или последовательностей практически идентичных на протяжении полной длины последовательностей, которых сравнивают, таких как кодирующий участок, к примеру, нуклеотидной последовательности.
[0193] «Консервативная аминокислотная замена» представляет собой замену, при которой один аминокислотный остаток заменен другим аминокислотным остатком, имеющим сходную боковую цепь. В данной области техники были определены семейства аминокислотных остатков, имеющих сходные боковые цепи, включающие основные боковые цепи (например, лизин, аргинин, гистидин), кислотные аминокислотные цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, аспарагин, глутамин, серии, треонин, тирозин, цистеин), неполярные боковые цепи (например, глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). К примеру, замена фенилаланина на тирозин является консервативной заменой. В некоторых вариантах реализации изобретения консервативные замены в последовательностях полипептидов и антител по данному изобретению не подавляют связывание полипептида или антитела, содержащего аминокислотную последовательность, с антигеном(ами), т.е. FOLR1, с которым связывается полипептид или антитело. Способы идентификации нуклеотидных и аминокислотных консервативных замен, которые не устраняют антигенное связывание хорошо известны в данной области техники (см., например, статьи Brummell et al., Biochem. 32: 1180-1 187 (1993); Kobayashi et al. Protein Eng. 12(10): 879-884 (1999) и Burks et al. Proc. Natl. Acad. Sci. USA 94:. 412-417 (1997)).
[0194] При использовании в данном описании и формуле изобретения, формы единственного числа включают формы множественного числа, если из контекста с очевидностью не следует обратное.
[0195] Подразумевается, что где бы не были описаны варианты реализации изобретения в данном документе со словом «содержащий», также предлагаются аналогичные варианты реализации изобретения описанные иным образом в терминах «состоящий из» и/или «состоящий преимущественно из».
[0196] Термин «и/или», как используется во фразе, такой как «А и/или В» в данном документе, подразумевает включение всех вариантов «А и В», «А или В», «А» и «В». Аналогичным образом, термин «и/или», как используется во фразе, такой как «А, В и/или С» подразумевается охватывает каждое значение из следующих: А, В и С; А, В или С; А или С; А или В; В или С; А и С; А и В; В и С; А (только); В (только) и С (только).
II. FOLR1-связывающие агенты.
[0197] В данном изобретении предложены агенты, которые специфически связывают FOLR1 человека. Эти агенты в данном документе называются «FOLR1-связывающими агентами». В некоторых вариантах реализации изобретения связывающие FOLR1 агенты являются антителами, иммуноконъюгатами или полипептидами. Аминокислотные и нуклеотидные последовательности FOLR1 человека известны в данной области техники, а также предложены в данном документе как представленные SEQ ID №: 1 и SEQ ID №: 2.
Рецептор фолиевой кислоты 1 человека:

Последовательность нуклеиновой кислоты рецептора фолиевой кислоты 1 человека:

[0198] Таким образом, в некоторых вариантах реализации изобретения, связывающие FOLR1 агенты могут связываться с эпитопом SEQ ID №: 1.
[0199] В некоторых вариантах реализации изобретения анти-FOLR1 антитело может специфически связываться с эпитопом FOLR1 (SEQ ID №: 1), причем эпитоп содержит N-гликозилированную аминокислоту. Поэтому, такие антитела будут связываться с FOLR1, когда он гликолизирован, и не будут связываться с FOLR1, когда он не гликолизирован. Другими словами, связывание этих антител является гликозависимым. Эти антитела обладают преимуществом в том, что они могут применяться для распознавания гликолизированных и негликолизированных форм FOLR1. Учитывая, что гликозилирование может потребоваться для мембранной локализации, антитела могут преимущественно использоваться для мембраноспецифического окрашивания.
[0200] В некоторых вариантах реализации изобретения анти-FOLR1 антитело может специфически связываться с эпитопом FOLR1, содержащим N-гликозилированную аминокислоту 69 FOLR1. В некоторых вариантах реализации изобретения анти-FOLR1 антитело может специфически связываться с эпитопом FOLR1, содержащим N-гликозилированную аминокислоту 161 FOLR1. В некоторых вариантах реализации изобретения анти-FOLR1 антитело может специфически связываться с эпитопом FOLR1, содержащим N-гликозилированную аминокислоту 201 FOLR1.
[0201] В некоторых вариантах реализации изобретения анти-FOLR1 антитело представляет собой антитело, полученное с использованием гибридомы, депонированной в Американской коллекции типовых культур (АТСС), расположенной по адресу 10801 University Boulevard, Manassas, VA 20110, 16 апреля 2013 г., согласно условий Будапештского договора, и имеющей №АТСС депонирования РТА-120196 («FOLR1-9.20», также называемая «IMGN 353.9-20», «353.9-20» или «9.20»). В некоторых вариантах реализации изобретения анти-FOLR1 антитело представляет собой антитело, полученное с использованием гибридомы, депонированной в АТСС 16 апреля 2013 г. и имеющей №АТСС депонирования РТА-120197 («FOLR1-2.1», также называемая «IMGN 353.2-1», «353.2-1», «2.1» или «muFRIHC2-1»).
[0202] FOLR1-связывающие агенты включают FOLR1-связывающие агенты, которые включают CDR последовательности тяжелой и легкой цепи (i) muFRIHC2-1, который также известен как «FOLR1-2.1», «IMGN 353.2-1», «353.2-1» или «2.1», (ii) muFRIHC5-7, который также известен как «IMGN 353.5-7», «353.5-7» или «5.7», (iii) «muFRIHC9-20», который также известен как «FOLR1-9.20», «IMGN 353.9-20», «353.9-20» или «9.20», (iv) huFRIHC2-1 с измененной поверхностью версии 1.0 или 1.01 или (v) CDR-привитый huFRIHC2-1 версии 1.0 или 1.01, которые представлены ниже в табл. 1 и 2. FOLR1-связывающие агенты также включают FOLR1-связывающие агенты, которые содержат последовательности CDR тяжелой и легкой цепи из составных CDR, представленные ниже в табл. 1 и 2.
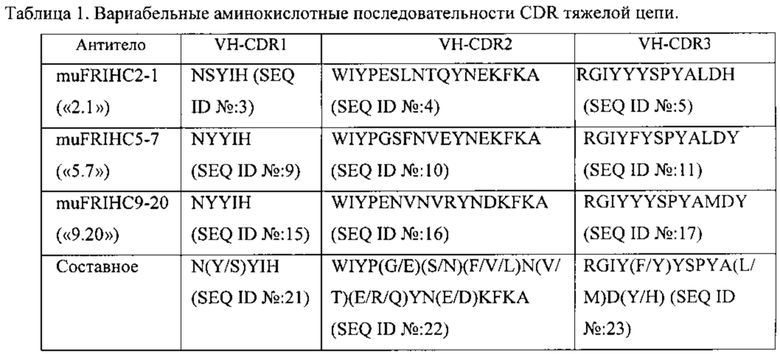

[0203] Связывающие FOLR1 молекулы могут быть антителами или антигенсвязывающими фрагментами, которые специфически связываются с FOLR1, которые содержат CDR антитела 2.1 (т.е. SEQ ID №: 3-8), 5.7 (т.е. SEQ ID №: 9-14), 9.20 (т.е. SEQ ID №: 15-20), с вплоть до четырьмя (т.е. 0, 1, 2, 3 или 4) консервативными аминокислотными заменами на один CDR. Связывающие FOLR1 молекулы могут быть антителами или антигенсвязывающими фрагментами, которые специфически связываются с FOLR1, которые содержат CDR из составной последовательности, показанной выше (т.е. SEQ ID №: 21-26), с вплоть до четырьмя (т.е. 0, 1, 2, 3 или 4) консервативными аминокислотными заменами на один CDR.
[0204] Связывающие FOLR1 молекулы могут быть антителами или антигенсвязывающими фрагментами, которые специфически связываются с FOLR1, которые содержат CDR из антитела, полученного с использованием гибридомы с №АТСС депонирования РТА-120196 или РТА-120197.
[0205] Полипептиды могут содержать один из индивидуальных вариабельных легких цепей или вариабельных тяжелых цепей, описанных в данном документе. Антитела и полипептиды также могут содержать как вариабельную легкую цепь, так и вариабельную тяжелую цепь. Последовательности вариабельной легкой цепи и вариабельной тяжелой цепи мышиных антител 2.1, 5.7 и 9.20 и гуманизированного 2.1 представлены ниже в табл. 3 и 4.
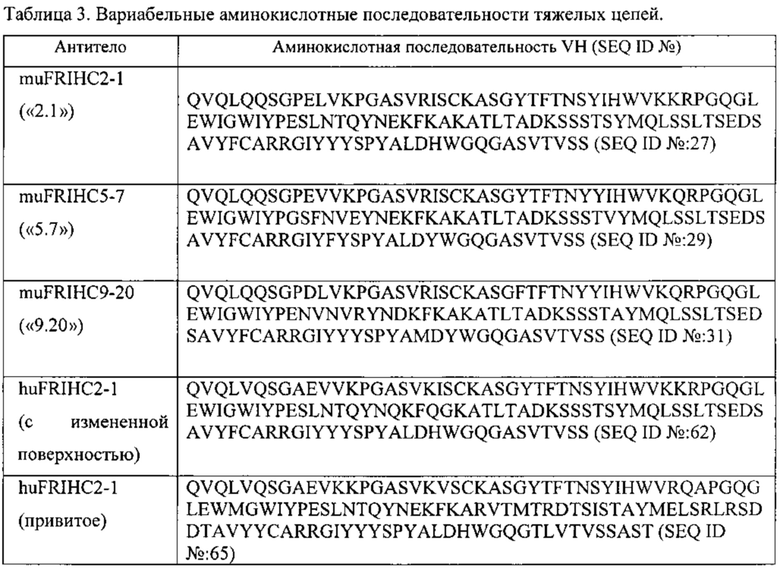


[0206] Предложены также полипептиды, которые содержат: (а) полипептид, обладающий по меньшей мере около 90% идентичности последовательности SEQ ID №: 27, 29, 31, 62 или 65, и/или (b) полипептид, обладающий по меньшей мере около 90% идентичности последовательности SEQ ID №: 28, 30, 32, 63, 64, 66 или 67. В некоторых вариантах реализации изобретения полипептид содержит полипептид, обладающий по меньшей мере около 95%, по меньшей мере около 96%, по меньшей мере около 97%, по меньшей мере около 98%, или по меньшей мере около 99% идентичности последовательности SEQ ID №: 27-32 или 62-67. Таким образом, в некоторых вариантах реализации изобретения полипептиды содержат (а) полипептид, обладающий по меньшей мере около 95% идентичности последовательности SEQ ID №: 27, 29, 31, 62 или 65, и/или (b) полипептид, обладающий по меньшей мере около 95% идентичности последовательности SEQ ID №: 28, 30, 32, 63, 64, 66 или 67. В некоторых вариантах реализации изобретения полипептид содержит (а) полипептид, обладающий аминокислотной последовательностью SEQ ID №: 27, 29, 31, 62 или 65, и/или (b) полипептид, обладающий аминокислотной последовательностью SEQ ID №: 28, 30, 32, 63, 64, 66 или 67. В некоторых вариантах реализации изобретения полипептид представляет собой антитело и/или полипептид, специфически связывающий FOLR1. В некоторых вариантах реализации изобретения полипептид является мышиным, химерным или гуманизированным антителом, которое специфически связывает FOLR1. В некоторых вариантах реализации изобретения полипептид, обладающий определенным процентом идентичности последовательностей SEQ ID №: 27-32 или 62-67, отличается от SEQ ID №: 27-32 или 62-67 только консервативными аминокислотными заменами.
[0207] Предложены также полипептиды, содержащие вариабельную легкую цепь, которая по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентична вариабельной последовательности легкой цепи антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0208] Предложены также полипептиды, содержащие вариабельную тяжелую цепь, которая по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентична вариабельной последовательности тяжелой цепи антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0209] Предложены также антитела и их антигенсвязывающие фрагменты, содержащие последовательности вариабельной тяжелой и вариабельной легкой цепи, которые по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентичны последовательностям вариабельной тяжелой и вариабельной легкой цепи антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0210] В некоторых вариантах реализации изобретения антитело или антигенсвязывающий фрагмент представляет собой антитело, полученное с использованием гибридомы, имеющей №АТСС депонирования РТА-120196, или его антигенсвязывающий фрагмент.
[0211] В некоторых вариантах реализации изобретения антитело или антигенсвязывающий фрагмент представляет собой антитело, полученное с использованием гибридомы, имеющей №АТСС депонирования РТА-120197, или его антигенсвязывающий фрагмент.
[0212] Полипептиды могут содержать одну из индивидуальных легких цепей или тяжелых цепей, описанных в данном документе. Антитела и полипептиды также могут содержать как легкую цепь, так и тяжелую цепь. Последовательности легкой цепи и тяжелой цепи антител 2.1, 5.7 и 9.20 представлены ниже в табл. 5 и 6.
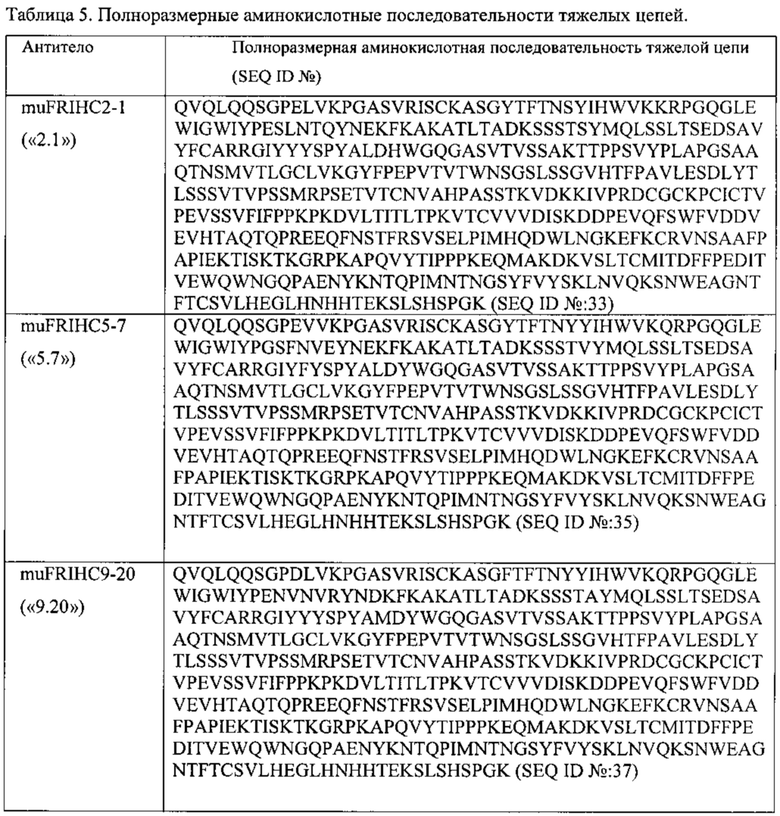

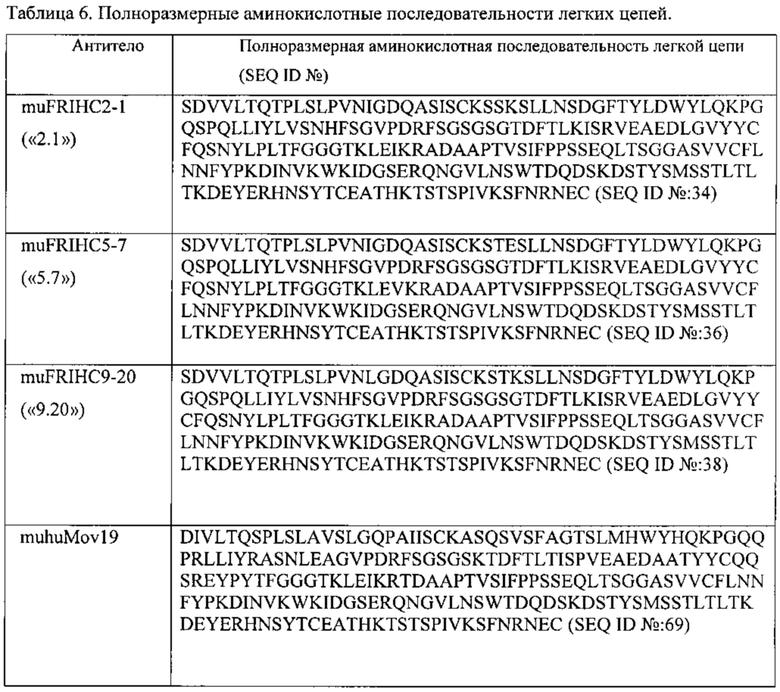
[0213] Предложены также полипептиды, которые содержат: (а) полипептид, обладающий по меньшей мере около 90% идентичности последовательности SEQ ID №: 33, 35 или 37, и/или (b) полипептид, обладающий по меньшей мере около 90% идентичности последовательности SEQ ID №: 34, 36 или 38. В некоторых вариантах реализации изобретения полипептид содержит полипептид, обладающий по меньшей мере около 95%, по меньшей мере около 96%, по меньшей мере около 97%, по меньшей мере около 98%, или по меньшей мере около 99% идентичности последовательности SEQ ID №: 33-38. Таким образом, в некоторых вариантах реализации изобретения полипептид содержит (а) полипептид, обладающий по меньшей мере около 95% идентичности последовательности SEQ ID №: 33, 35 или 37, и/или (b) полипептид, обладающий по меньшей мере около 95% идентичности последовательности SEQ ID №: 34, 36 или 38. В некоторых вариантах реализации изобретения полипептид содержит (а) полипептид, обладающий аминокислотной последовательностью SEQ ID №: 33, 35 или 37, и/или (b) полипептид, обладающий аминокислотной последовательностью SEQ ID №: 34, 36 или 38. В некоторых вариантах реализации изобретения полипептид представляет собой антитело и/или полипептид, специфически связывающий FOLR1. В некоторых вариантах реализации изобретения полипептид является мышиным, химерным или гуманизированным антителом, которое специфически связывает FOLR1. В некоторых вариантах реализации изобретения полипептид, обладающий определенным процентом идентичности последовательностей SEQ ID №: 33-38, отличается от SEQ ID №: 33-38 только консервативными аминокислотными заменами.
[0214] Предложены также полипептиды, содержащие легкую цепь, которая по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентична последовательности легкой цепи антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0215] Предложены также полипептиды, содержащие тяжелую цепь, которая по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентична последовательности тяжелой цепи антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0216] Предложены также антитела и их антигенсвязывающие фрагменты, содержащие последовательности тяжелой и легкой цепи, которые по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентичны последовательностям тяжелой и легкой цепи антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0217] Аффинность или авидность антитела к антигену может определяться экспериментально, используя любой подходящий хорошо известный в данной области техники метод, например, проточную цитометрию, твердофазный иммуноферментный анализ (ИФА), или радиоиммуный анализ (РИА), или кинетический анализ (например, анализ BIACORE™). Могут легко применяться анализы с прямым связыванием, а также форматы анализа с конкурентным связыванием. (См., к примеру, Berzofsky, et al., «Antibody-Antigen Interactions», в Fundamental Immunology, Paul, W.E., Ed., Raven Press: New York, N.Y. (1984); Kuby, Janis Immunology, W.H. Freeman and Company: New York, N.Y. (1992) и способы, описанные в данном документе. Измеренная аффинность конкретного взаимодействия антитело-антиген может изменяться при измерении в разных условиях (например, концентрация солей, рН, температура). Таким образом, измерения аффинности и других параметров связывания антигенов (например, KD или Kd, Kon, Koff) проводятся со стандартизированными растворами антитела и антигена и стандартизированным буферным раствором, как известно в данной области техники, и таким буферным раствором как описанный в данном документе.
[0218] В одном аспекте изобретения, анализы связывания могут выполняться с использованием проточной цитометрии на клетках, экспрессирующих на поверхности антиген FOLR1. К примеру, FOLR1-положительные клетки, такие как SKOV3, могут инкубироваться с различными концентрациями анти-FOLR1 антител с использованием 1×105 клеток на образец в 100 мкл буферного раствора для FACS (среда RPMI-1640 с 2% добавкой нормальной сыворотки козла). Потом, клетки могут осаждаться, промываться и инкубироваться в течение 1 ч со 100 мкл FITC-конъюгированного антитела козла против антитела мыши или антитела козла против IgG-антитела человека (такое как получаемое, к примеру, от компании Jackson Laboratory, 6 мкг/мл в буферном растворе для FACS). Потом клетки осаждают снова, промывают буферным раствором для FACS и ресуспендируют в 200 мкл PBS, содержащего 1% формальдегид. Образцы могут быть получены, к примеру, с использованием проточного цитометра FACSCalibur с многолуночным самплером HTS и проанализированы с использованием CellQuest Pro (все оборудование от компании BD Biosciences, г. Сан-Диего, США). Для каждого образца может экспортироваться средняя интенсивность флуоресценции (СИФ) для FL1 и строиться зависимость против концентрации антитела на полулогарифмическом графике для создания кривой связывания. Подбирается сигмоидальная кривая доза-отклик для кривых связывания и рассчитывают значения ЕС50 с использованием таких программ, как GraphPad Prism v4 с параметрами по умолчанию (программное обеспечение GraphPad, г. Сан-Диего, Калифорния). Значения ЕС50 могут использоваться в качестве показателя кажущейся константы диссоциации «Kd» или «KD» для каждого антитела.
[0219] Моноклональные антитела могут получать с использованием гибридомных способов, таких как описанные Kohler и Milstein (1975) Nature 256:495. Мышь, хомяка или другое подходящее животное-хозяин иммунизируют, используя гибридомный способ, чтобы вызвать продукцию лимфоцитами антител, которые будут специфически связываться с иммунизирующим антигеном. Лимфоциты также могут быть иммунизированы in vitro. После иммунизации, лимфоциты выделяют и сливают их с подходящей линией миеломных клеток с использованием, к примеру, полиэтиленгликоля для образования гибридомных клеток, которые потом могут быть отобраны от неслившихся лимфоцитов и миеломных клеток. Гибридомы, которые продуцируют моноклональные антитела, специфически направленные против выбранного антигена, как определено методом иммунопреципитации, иммуноблоттинга или анализом связывания in vitro (например, радиоиммуноанализом (РИА), твердофазным иммуноферментным анализом (ИФА)) потом могут быть размножены либо культивированием in vitro с использованием стандартных методов (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, 1986) либо in vivo в виде асцитных опухолей у животных. Моноклональные антитела потом могут быть очищены от культуральной среды или асцитной жидкости как описано для поликлональных антител.
[0220] Альтернативно, моноклональные антитела также могут быть получены, используя способы рекомбинантных ДНК как описано в патенте США 4816567. Полинуклеотиды, кодирующие моноклональное антитело, выделяют из зрелых В-клеток или гибридомных клеток, таким методом как ОТ-ПЦР с использованием олигонуклеотидных праймеров, которые специфически амплифицируют гены, кодирующие тяжелую и легкую цепи антитела, а их последовательности определяют с использованием традиционных процедур. Выделенные полинуклеотиды, кодирующие тяжелую и легкую цепи, потом клонируют в подходящие экспрессионные векторы, которые потом трансфецируют в клетки-хозяева, такие как клетки Е. coli, обезьяньи клетки COS, клетки яичника китайского хомяка (СНО) или миеломные клетки, которые в других случаях не продуцируют иммуноглобулиновый белок, и клетками-хозяевами синтезируются моноклональные антитела. Также, рекомбинантные моноклональные антитела или их фрагменты требуемого биологического вида могут быть выделены из библиотек фаговых дисплеев, экспрессирующих CDR требуемого биологического вида, как описано (McCafferty et al., 1990, Nature, 348: 552-554; Clackson et al., 1991, Nature, 352: 624-628 и Marks et al., 1991, J. Mol. Biol., 222: 581-597).
[0221] Полинуклеотид(ы), кодирующий моноклональное антитело может дополнительно модифицироваться несколькими разными путями с использованием технологии рекомбинантных ДНК для создания альтернативных антител. В некоторых вариантах реализации изобретения константные домены легкой и тяжелой цепей, к примеру, моноклональное антитело мыши, могут быть замещены 1) по таким участкам, к примеру, антителом человека для создания химерного антитела или 2) неиммуноглобулиновым полипептидом для создания антитела слияния. В некоторых вариантах реализации изобретения константные участки усечены или удалены для создания требуемого антительного фрагмента моноклонального антитела. Для оптимизации специфичности, аффинности и т.д. моноклонального антитела может применяться сайт-направленный мутагенез или мутагенез высокой плотности для вариабельного участка.
[0222] В некоторых вариантах реализации изобретения моноклональное антитело против FOLR1 человека представляет собой гуманизированное антитело. В некоторых вариантах реализации изобретения такие антитела применяют с терапевтической целью для уменьшения антигенности и реакций НАМА (появления антител человека против антител мыши) при введении субъекту-человеку.
[0223] Способы инженерии, гуманизации или изменения поверхности нечеловеческих или человеческих антител также могут использоваться и они хорошо известны в данной области техники. Гуманизированное антитело, антитело с измененной поверхностью или сходным образом сконструированное антитело может иметь один или более аминокислотных остатков из источника, который представляет собой нечеловеческий организм, например, но не ограничено, мышь, крысу, кролика, примата кроме человека или другое млекопитающее. Эти аминокислотные остатки нечеловеческих организмов заменяются остатками, что часто называются «импортированными» остатками, которые как правило взяты из «импортированного» вариабельного, константного или другого домена известной последовательности человека.
[0224] Такие импортированные последовательности могут применяться для снижения иммуногенности или снижения, усиления или модификации связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, периода полувыведения или любой другой подходящей характеристики, как известно в данной области техники. В общем, остатки CDR непосредственно и практически во своем большинстве вовлечены в оказании влияния на связывание FOLR1. Соответственно, сохраняются часть или все из нечеловеческих или человеческих последовательностей CDR, тогда как нечеловеческие последовательности вариабельных и константных участков могут заменяться человеческими или другими последовательностями аминокислот.
[0225] Антитела также могут необязательно быть гуманизированными, с измененной поверхностью, сконструированными или быть антителами человека, сконструированными с сохранением высокой аффинности к антигену FOLR1 и другими полезными биологическими свойствами. Для достижения этой цели гуманизированные (или человеческие) или сконструированные анти-FOLR1 антитела и антитела с измененной поверхностью могут необязательно быть получены в процессе анализа исходных последовательностей и различных концептуальных гуманизированных и сконструированных продуктов с использованием трехмерных моделей исходных, сконструированных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов повсеместно доступны и знакомы специалистам в данной области техники. Доступны компьютерные программы, которые иллюстрируют и изображают вероятные трехмерные конформационные структуры выбранных вероятных иммуноглобулиновых последовательностей. Проверка этих изображений позволяет провести анализ вероятной роли остатков в функционировании иммуноглобулиновой последовательности-кандидата, т.е. анализ остатков, которые влияют на способность иммуноглобулина-кандидата связывать свой антиген, такой как FOLR1. Таким путем могут быть отобраны каркасные остатки (FR) и скомбинированы консенсусная и импортированная последовательности таким образом, чтобы достичь требуемой характеристики антитела, такой как увеличенная аффинность к целевому антигену(ам).
[0226] Гуманизация, изменение поверхности или инжиниринг антител по данному изобретению может выполняться с использованием любых известных способов, таких как, но не ограниченных описанными в публикациях Winter (Jones et al., Nature 321: 522 (1986); Riechmann et al., Nature 332: 323 (1988); Verhoeyen et al., Science 239: 1534 (1988)), Sims et al., J. Immunol. 151: 2296 (1993); Chothia и Lesk, J. Mol. Biol. 196: 901 (1987), Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89: 4285 (1992); Presta et al., J. Immunol. 151: 2623 (1993), патенты США №5639641, 5723323; 5976862; 5824514; 5817483; 5814476; 5763192; 5723323; 5766886; 5714352; 6204023; 6180370; 5693762; 5530101; 5585089; 5225539; 4816567; PCT/: US 98/16280; US 96/18978; US 91/09630; US 91/05939; US 94/01234; GB 89/01334; GB 91/01134; GB 92/01755; WO 90/14443; WO 90/14424; WO 90/14430; ЕР 229246; 7557189; 7538195 и 7342110, каждый из которых включен в данный документ в полном объеме посредством ссылки, включая упомянутые здесь ссылки.
[0227] В некоторых альтернативных вариантах реализации изобретения антитело к FOLR1 представляет собой антитело человека. Антитела человека могут быть непосредственно получены с использованием различных методик, известных в данной области техники. Могут быть получены иммортализированные В-лимфоциты, иммунизированные in vitro или выделенные из иммунизированного индивида, которые продуцируют антитело, направленное против целевого антигена (см., например, статьи Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boemer et al., 1991, J. Immunol., 147 (1): 86-95 и патент США 5750373). Также, антитело человека может быть выбрано из фаговой библиотеки, если эта фаговая библиотека экспрессирует антитела человека, как описано, к примеру, в Vaughan et al., 1996, Nat. Biotech., 14: 309-314, Sheets et al., 1998, Proc. Nat'l. Acad. Sci., 95: 6157-6162, Hoogenboom и Winter, 1991, J. Mol. Biol., 227: 381 и Marks et al., 1991, J. Mol. Biol., 222: 581). Методики для создания и использования фаговых библиотек антител описаны также в патентах США №5969108, 6172197, 5885793, 6521404; 6544731; 6555313; 6582915; 6593081; 6300064; 6653068; 6706484 и 7264963 и статье Rothe et al., 2007, J. Mol. Bio., doi:10.1016/j.jmb.2007.12.018 (каждый из которых включен в полном объеме посредством ссылки). Принципы созревания аффинности и принципы перестановки цепей (Marks et al., 1992, Bio/Technology 10: 779-783, включена в полном объеме посредством ссылки) известны в данной области техники и могут применяться для создания высокоаффинных антител человека.
[0228] Гуманизированные антитела также могут быть получены на трансгенных мышах, содержащих иммуноглобулиновые локусы человека, которые способны при иммунизации продуцировать полный репертуар антител человека при отсутствии эндогенной продукции иммуноглобулинов. Этот подход описан в патентах США 5545807; 5545806; 5569825; 5625126; 5633425 и 5661016.
[0229] В некоторых вариантах реализации изобретения предложен фрагмент антитела, к примеру, для увеличения пенетрации в опухоль. В отношении продукции фрагментов антител известны различные методики. Традиционно считается, что эти фрагменты являются производными при протеолитическом расщеплении интактных антител (к примеру, Morimoto et al., 1993, Journal of Biochemical and Biophysical Methods 24: 107-117; Brennan et al., 1985, Science, 229: 81). В некоторых вариантах реализации изобретения фрагменты антител получают рекомбинантным способом. Все фрагменты антител Fab, Fv и scFv могут экспрессироваться и секретироваться Е. coli или другими клетками-хозяевами, таким образом позволяя продуцировать большие количества этих фрагментов. Такие фрагменты антител также могут быть выделены из фаговых библиотек антител. Фрагмент антитела также может быть линейным антителом, как описано в патенте США 5641870, к примеру, и может быть моноспецифическим или биспецифическим. Другие методики для продукции фрагментов антител будут очевидны квалифицированному практику.
[0230] Для целей данного изобретения следует учитывать, что модифицированные антитела могут содержать любой тип вариабельного участка, который обеспечивает ассоциацию антитела с полипептидами FOLR1 человека. В этой связи, вариабельный участок может включать или походить от любого типа антитела млекопитающего, которое может индуцироваться для подготовки гуморального ответа и синтеза иммуноглобулинов против требуемого ассоциированного с опухолью антигена. По существу, вариабельный участок модифицированных антител может, к примеру, происходить из организма человека, мыши, примата кроме человека (например, яванских обезьян, макак и т.д.) или волка. В некоторых вариантах реализации изобретения как вариабельные, так и константные участки модифицированных иммуноглобулинов являются человеческими. В других вариантах реализации изобретения вариабельные участки совместимых антител (обычно происходящих из нечеловеческого источника) могут быть сконструированными или специально разработанными для улучшения свойств связывания или уменьшения иммуногенности молекул. В связи с этим, вариабельные участки, пригодные для данного изобретения, могут быть гуманизированы или иным образом изменены посредством включения импортированных аминокислотных последовательностей.
[0231] В некоторых вариантах реализации изобретения вариабельные домены в обеих тяжелой и легкой цепях изменяются путем по меньшей мере частичной замены одного или более CDR и, при необходимости, путем частичной замены каркасных участков и изменения последовательностей. Хотя CDR могут походить из антитела того же класса или даже подкласса, что и антитело, из которого походят каркасные участки, предполагается, что CDR будут походить и из антитела другого класса, и в некоторых вариантах реализации изобретения - из антитела из другого биологического вида. Может не потребоваться замена всех CDR полными CDR из донорского вариабельного участка для переноса антигенсвязывающей способности из одного вариабельного участка к другому. Скорее, может быть необходимо только перенести те остатки, которые необходимы для поддержания активности антигенсвязывающего сайта. Данные объяснения изложены в пат. США №5585089, 5693761 и 5693762, они будут находиться в пределах компетенции специалиста в данной области техники, как относительно проведения рутинного эксперимента, так и проверки методом проб и ошибок для получения функционального антитела с уменьшенной иммуногенностью.
[0232] Изменения вариабельного участка, несмотря на то, что специалисты в данной области техники понимают, что модифицированные антитела по этому изобретению будут включать антитела (например, полноразмерные антитела или их иммунореактивные фрагменты), в которых по меньшей мере фракция одного или более доменов константных участков удалены или иным образом изменены так, чтобы обеспечить получение требуемых биохимических свойств, таких как увеличенная локализация в опухоли или уменьшенный период полувыведения из сыворотки при сравнении с антителом приблизительно такой же иммуногенности, содержащим нативный или неизмененный константный участок. В некоторых вариантах реализации изобретения константный участок модифицированных антител будет содержать константный участок человека. Модификации константного участка, совместимые с этим изобретением, включают добавления, делеции или замены одной или более аминокислот в одном или более доменов. То есть, модифицированные антитела, описанные в данном документе, могут содержать изменения или модификации в одном или более из трех константных доменов тяжелой цепи (CH1, СН2 или СН3) и/или в константном домене легкой цепи (CL). В некоторых вариантах реализации изобретения предполагаются модифицированные константные участки, в которых один или более доменов частично или полностью удалены. В некоторых вариантах реализации изобретения модифицированные антитела будут содержать конструкции с удаленными доменами или варианты, в которых удален целый домен СН2 (конструкции ΔСН2). В некоторых вариантах реализации изобретения пропущенный домен константного участка будет заменен коротким аминокислотным спейсером (например, из 10 остатков), который обеспечивает некоторую молекулярную гибкость, как правило, сообщаемую отсутствующим константным участком.
[0233] Необходимо отметить, что в некоторых вариантах реализации изобретения модифицированные антитела могут быть сконструированы для слияния домена СН3 непосредственно с шарнирным участком соответствующих модифицированных антител. В других конструкциях может потребоваться ввести пептидный спейсер между шарнирным участком и модифицированными доменами СН2 и/или СН3. К примеру, могут экспрессироваться совместимые конструкции, в которых домен СН2 удален, а оставшийся домен СН3 (модифицированный или немодифицированный) присоединен к шарнирному участку спейсером из 5-20 аминокислот. Такой спейсер может добавляться, к примеру, для обеспечения того, чтобы регуляторные элементы константного домена оставались свободными и доступными или чтобы шарнирный участок оставался гибким. Однако, следует отметить, что аминокислотные спейсеры могут, в некоторых случаях, оказаться иммуногенными и вызывают нежелательный иммунный ответ против конструкции. Соответственно, в некоторых вариантах реализации изобретения любой спейсер, добавленный к конструкции, будет относительно неиммуногенным или даже полностью пропущеным для того, чтобы обеспечить получение требуемых биохимических характеристик модифицированных антител.
[0234] Кроме делеции целых доменов константных участков, следует учитывать, что антитела по данному изобретению могут быть наделены частичной делецией или заменой нескольких или даже единственной аминокислоты. К примеру, мутация единственной аминокислоты в выбранных областях домена СН2 может быть достаточной для значительного уменьшения связывания Fc и, вследствие этого, увеличению локализации в опухоли. Сходным образом, может потребоваться просто удалить ту часть одного или более доменов константного участка, которая контролирует эффекторную функцию (например, связывания комплемента C1Q), которая нуждается в модуляции. Такие частичные делеции константных участков могут улучшить выбранные характеристики антитела (период полувыведения из сыворотки), в то же время сохраняя другие требуемые функции, связанные с интактным доменом константного участка субъекта. Более того, как упоминается выше, константные участки описанных антител могут модифицироваться посредством мутации или замены одной или более аминокислот, что усиливает профиль результирующей конструкции. В этой связи, может существовать возможность разрушить активность, которая обеспечивается сохраненным сайтом связывания (например, Fc-связывания), при практически полном обеспечении конфигурации иммуногенного профиля модифицированного антитела. Некоторые варианты реализации изобретения могут включать добавление к константному участку одной или более аминокислот для усиления требуемых характеристик, таких как уменьшение или увеличение эффекторной функции или обеспечение большего присоединения цитотоксина или углевода. В таких вариантах реализации изобретения может потребоваться вставка или репликация специфических последовательностей, происходящих из выбранных доменов константных участков.
[0235] Данное изобретение дополнительно охватывает варианты и эквиваленты, которые являются практически гомологичными химерным, гуманизированным и человеческим антителам или их антительным фрагментам, изложенным в данном документе. Они могут содержать, к примеру, консервативные мутации-замены, т.е. замены одной или более аминокислот сходными аминокислотами. К примеру, консервативная замена относится к замене аминокислоты другой в пределах того же общего класса, такой как, к примеру, одна кислотная аминокислота другой кислотной аминокислотой, одна основная аминокислота другой основной аминокислотой или одна нейтральная аминокислота другой нейтральной аминокислотой. То, что подразумевается под консервативной аминокислотной заменой хорошо известно в данной области техники.
[0236] Полипептиды по данному изобретению могут быть рекомбинантными полипептидами, природными полипептидами или синтетическими полипептидами, содержащими антитело или его фрагмент против FOLR1 человека. В данной области техники следует признать, что некоторые аминокислотные последовательности по данному изобретению могут быть изменены без значимого влияния на структуру и функцию белка. Таким образом, изобретение дополнительно включает вариации полипептидов, которые показывают значительную активность или которые включают участки антитела или его фрагмента против рецепторного белка фолиевой кислоты человека. Такие мутанты включают делеции, инсерции, инверсии, повторы и типичные замены.
[0237] Полипептиды и аналоги могут быть дополнительно модифицированы для того, чтобы содержать дополнительные химические фрагменты, обычно не являющиеся частью белка. Такие дериватизированные фрагменты могут улучшать растворимость, биологический период полувыведения или абсорбцию белка. Фрагменты также могут уменьшать или исключать любые требуемые побочные эффекты белков и тому подобное. Обзор таких фрагментов может быть найден в книге REMINGTON'S PHARMACEUTICAL SCIENCES, 20th ed., Mack Publishing Co., Easton, PA (2000).
[0238] Выделенные полипептиды, описанные в данном документе, могут быть получены любым подходящим способом, известным в данной области техники. Такие способы находятся в диапазоне от прямых белковых синтетических способов до конструирования последовательности ДНК, кодирующей последовательности выделенных полипептидов, и экспрессии этих последовательностей в подходящем трансформированном хозяине. В некоторых вариантах реализации изобретения последовательность ДНК конструируют с использованием рекомбинантной технологии выделением или синтезом последовательности ДНК, кодирующей представляющий интерес белок дикого типа. Необязательно, последовательность может пройти мутагенез путем сайт-специфического мутагенеза для получения своих функциональных аналогов. См., например, Zoeller et al., Proc. Nat'l. Acad. Sci. USA 81: 5662-5066 (1984) и пат. США №4588585.
[0239] В некоторых вариантах реализации изобретения последовательность ДНК, кодирующая представляющий интерес полипептид, может быть сконструирована методом химического синтеза с использованием олигонуклеотидного синтезатора. Такие олигонуклеотиды могут быть разработаны на основании аминокислотной последовательности требуемого полипептида и отбора таких кодонов, которые благоприятны для синтеза в клетке-хозяине, в которой будет продуцироваться представляющий интерес рекомбинантный полипептид. Для синтеза выделенной полинуклеотидной последовательности, кодирующей представляющий интерес выделенный полипептид, могут применяться стандартные способы. К примеру, для конструирования обратно-транслированного гена может применяться полная аминокислотная последовательность. Дополнительно, может быть синтезирован ДНК-олигомер, содержащий нуклеотидную последовательность, кодирующую конкретный выделенный полипептид. К примеру, могут быть синтезированы и потом лигированы несколько малых олигонуклеотидов, кодирующих части требуемого полипептида. Индивидуальные олигонуклеотиды, как правило, содержат 5'- или 3'-выступы для комплементарной сборки.
[0240] Сразу после сборки (синтезом, сайт-направленным мутагенезом или другим способом) полинуклеотидные последовательности, кодирующие конкретный представляющий интерес выделенный полипептид будет вставлен в экспрессионный вектор и функционально связан с последовательностью, контролирующей экспрессию, подходящей для экспрессии белка в требуемом хозяине. Правильная сборка может подтверждаться нуклеотидным секвенированием, рестрикционным картированием и экспрессией биологически активного полипептида в соответствующем хозяине. Как хорошо известно в данной области техники, для того, чтобы получить высокие уровни экспрессии трансфецированного гена в хозяине, ген должен быть функционально связан с транскрипционными и трансляционными последовательностями, контролирующими экспрессию, которые функциональны в выбранном экспрессионном хозяине.
[0241] В некоторых вариантах реализации изобретения рекомбинантные экспрессионные векторы применяются для амплификации и экспрессии ДНК, кодирующей антитела или их фрагменты против FOLR1 человека. Рекомбинантные экспрессионные векторы являются реплицируемыми ДНК-конструкциями, которые имеют синтетические или полученные из кДНК фрагменты ДНК, кодирующие полипептидную цепь анти-FOLR1 антитела или его фрагмента, функционально связанные с подходящими транскрипционными или трансляционными регуляторными элементами, полученными из генов млекопитающих, микроорганизмов, вирусов или насекомых. Транскрипционная единица обычно содержит сборку из (1) генетического элемента или элементов, обладающих регуляторной ролью для генной экспрессии, к примеру, транскрипционных промоторов или энхансеров, (2) структурной или кодирующей последовательности, которая транскрибируется в мРНК и транслируется в белок, и (3) соответствующие последовательности инициирования и терминации транскрипции и трансляции. Такие регуляторные элементы могут включать последовательность оператора для контроля транскрипции. Для облегчения распознавания трансформантов дополнительно может внедряться способность к репликации в организме хозяина, обычно сообщаемая точкой начала репликации, и ген селекции. Участки ДНК функционально связаны, когда они являются функционально соответствующими друг с другом. К примеру, ДНК сигнального пептида (секреторный лидер) функционально связана с ДНК полипептида, если она экспрессируется как предшественник, который принимает участие в секреции полипептида; промотор функционально связан с кодирующей последовательностью, если он контролирует транскрипцию последовательности, или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, что обеспечивает трансляцию. Структурные элементы, которые предполагаются к применению в дрожжевых системах экспрессии, включают лидерную последовательность, способную к внеклеточной секреции транслируемого белка клеткой-хозяином. Альтернативно, когда рекомбинантный белок экспрессируется без лидерной или транспортной последовательности, то он включает N-концевой остаток метионина. Этот остаток необязательно может впоследствии отщепляться от экспрессированного рекомбинантного белка для получения конечного продукта.
[0242] Выбор последовательности контроля экспрессии и экспрессионного вектора будет зависеть от выбора хозяина. Может использоваться большое разнообразие комбинаций хозяев/векторов. Пригодные экспрессионные векторы для эукариотических хозяев, включают, к примеру, векторы, содержащие последовательности контроля экспрессии из SV40, вируса папилломы быка, аденовируса и цитомегаловируса. Пригодные экспрессионные векторы для бактериальных хозяев, включают известные бактериальные плазмиды, такие как плазмиды из Escherichia coli, включая pCR 1, pBR322, рМВ9 и их производные, более широкий диапазон хозяев плазмид, таких как М13 и нитчатых фагов с одноцепочечной ДНК.
[0243] Подходящие клетки-хозяева для экспрессии FOLR1-связывающего полипептида или антитела (или белка FOLR1 для применения в качестве антигена) включают клетки прокариот, дрожжей, насекомых или высших эукариот под контролем соответствующих промоторов. Прокариоты включают грамотрицательные и грамположительные организмы, к примеру Е. coli или бациллы. Клетки высших эукариот включают стабильные линии клеток, происходящие из млекопитающих. Также могут применяться бесклеточные системы трансляции. Соответствующие клонирующие и экспрессионные векторы для применения вместе с бактериальными, грибковыми, дрожжевыми хозяевами и клетками-хозяевами млекопитающих описаны в публикации Pouwels et al. (Cloning Vectors: A Laboratory Manual., Elsevier, N.Y., 1985), соответствующее описание которой тем самым включено посредством ссылки. Дополнительная информация относительно способов продукции белков, включая продукцию антител, может быть найдена, например, в патентной публикации США №2008/0187954, патентах США №6413746 и 6660501 и международной патентной публикации №WO 04009823, каждая из которых тем самым включена в данный документ в полном объеме посредством ссылки.
[0244] Различные системы культивирования клеток млекопитающих или насекомых также предпочтительно применяются для экспрессии рекомбинантного белка. Экспрессию рекомбинантных белков в клетках млекопитающих могут проводить из-за того, что такие белки обычно корректно сворачиваются, надлежащим образом модифицируются и получаются полностью функциональными. Примеры подходящих линий клеток-хозяев млекопитающих включают HEK-293 и HEK-293Т, линии COS-7 клеток почки обезьяны, описанные автором Gluzman (Cell 23: 175, 1981), и другие линии клеток, включающие, к примеру, L-клетки, линии клеток С127, 3Т3, яичника китайского хомяка (СНО), HeLa и BHK. Экспрессионные векторы млекопитающих могут содержать нетранскрибируемые элементы, такие как точка начала репликации, подходящий промотор и энхансер, связанные с геном, который требуется экспрессировать, и другие 5'- или 3'-фланкирующие нетранскрибируемые последовательности и 5'- или 3'-нетранслируемые последовательности, такие как необходимые сайты связывания рибосом, сайт полиаденилирования, донорский и акцепторный сайты сплайсинга и транскрипционные последовательности терминации. Бакуловирусные системы для продукции гетерологичных белков в клетках насекомых представлены в обзоре Luckow и Summers, Bio/Technology 6: 47 (1988).
[0245] Белки, продуцируемые трансформированным хозяином, могут очищаться в соответствии с любым подходящим методом. Такие стандартные методы включают хроматографию (например, ионообменную, аффинною и эксклюзионную колоночную хроматографию), центрифугирование, дифференциальную растворимость или любую другую стандартную методику для очистки белка. Аффинные маркеры, такие как гексагистидин, мальтозосвязывающий домен, последовательность белка оболочки вируса гриппа и глутатион-S-трансфераза, могут присоединяться к белку для обеспечения легкой очистки пропусканием через подходящую аффинную колонку. Выделенные белки также могут быть охарактеризованы физическими методами, используя такие методики как протеолиз, ядерный магнитный резонанс и рентгеновскую кристаллографию.
[0246] К примеру, супернатанты из систем, которые секретируют рекомбинантный белок в культуральную среду, сначала могут быть сконцентрированы с использованием коммерчески доступного фильтра для концентрирования белков, к примеру, установки для ультрафильтрации Amicon или Millipore Pellicon. После стадии концентрирования концентрат может подаваться на подходящую матрицу для очистки. Альтернативно, может применяться смола для анионного обмена, к примеру, матрица или субстрат, имеющий выступающие диэтиламиноэтильные (ДЭАЭ) группы. Матрицы могут быть представлены акриламидом, агарозой, декстраном, целлюлозой и другими типами, обычно применяемыми при очистке белков. Альтернативно, может применяться стадия катионного обмена. Подходящие катионообменники включают различные нерастворимые матрицы, содержащие сульфопропильные или карбоксиметильные группы. Наконец, для дальнейшей очистки FOLR1-связывающего агента могут применяться одна или более стадий обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ), использующей ОФ-ВЭЖХ среду, такую как силикагель, имеющий выступающие метальные или другие алифатические группы. Некоторые или все из вышеизложенных стадий очистки, в различных комбинациях, также могут применяться для получения гомогенного рекомбинантного белка.
[0247] Рекомбинантный белок, продуцируемый в бактериальную культуру, может выделяться, к примеру, начальной экстракцией из осадков клеток, с последующей одной или более стадий концентрирования, высаливания, водного ионного обмена или эксклюзионной хроматографии. На конечных стадиях очистки может применяться высокоэффективная жидкостная хроматография (ВЭЖХ). Микробные клетки, применяемые для экспрессии рекомбинантного белка могут разрушаться любым удобным способом, включая циклы замораживания-оттаивания, обработку ультразвуком, механическое разрушение или использование агентов для лизирования клеток.
[0248] Способы, известные в данной области техники, для очистки антител и других белков также включают, к примеру, описанные в патентных публикациях США №2008/0312425, 2008/0177048 и 2009/0187005, каждая из которых тем самым включена в данный документ в полном объеме посредством ссылки.
III. Полинуклеотиды.
[0249] В некоторых вариантах реализации изобретение охватывает полинуклеотиды, содержащие полинуклеотиды, которые кодируют полипептид, что специфически связывает FOLR1-рецептор человека или фрагмент такого полипептида. К примеру, в изобретении предложен полинуклеотид, содержащий последовательность нуклеиновой кислоты, которая кодирует антитело к FOLR1 человека или кодирует фрагмент такого антитела. Полинуклеотиды по данному изобретению могут находиться в форме РНК или в форме ДНК. ДНК включает кДНК, геномную ДНК и синтетическую ДНК и может быть двухцепочечной или одноцепочечной и, в случае одноцепочечной, может быть кодирующей цепью или некодирующей (антисмысловой) цепью. В некоторых вариантах реализации изобретения полинуклеотид представляет собой кДНК или ДНК с отсутствием одного или более эндогенных интронов.
[0250] В некоторых вариантах реализации изобретения полинуклеотид представляет собой не встречающийся в природе полинуклеотид. В некоторых вариантах реализации изобретения полинуклеотид получен рекомбинантным способом.
[0251] В некоторых вариантах реализации изобретения полинуклеотиды являются выделенными. В некоторых вариантах реализации изобретения полинуклеотиды являются практически чистыми. В некоторых вариантах реализации изобретения полинуклеотид очищают от природных компонентов.
[0252] В изобретении предложен полинуклеотид, содержащий полинуклеотид, кодирующий полипептид, содержащий последовательность, выбранную из группы, состоящей из SEQ ID №: 3-38 и 59-67. Предложен также полинуклеотид, кодирующий полипептид, имеющий по меньшей мере около 95%, по меньшей мере около 96%, по меньшей мере около 97%, по меньшей мере около 98% или по меньшей мере около 99% идентичности последовательностей SEQ ID №: 3-38 и 59-67.
[0253] В изобретении дополнительно предложен полинуклеотид, содержащий последовательность, выбранную из показанных ниже в табл. 7 и 8.




[0254] Предложен также полинуклеотид, обладающий по меньшей мере около 95%, по меньшей мере около 96%, по меньшей мере около 97%, по меньшей мере около 98% или по меньшей мере около 99% идентичности последовательности любой из SEQ ID №: 39-44.
[0255] Предложены также полинуклеотиды, кодирующие вариабельную легкую цепь, которая по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентична вариабельной последовательности легкой цепи антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0256] Предложены также полинуклеотиды, содержащие вариабельную последовательность, кодирующую легкую цепь, которая по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентична вариабельной последовательности, кодирующей легкую цепь, которая кодирует вариабельную легкую цепь антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0257] Предложены также полинуклеотиды, кодирующие вариабельную тяжелую цепь, которая по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентична вариабельной последовательности тяжелой цепи антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0258] Предложены также полинуклеотиды, содержащие вариабельную последовательность, кодирующую тяжелую цепь, которая по меньшей мере на около 85%), по меньшей мере на около 90%, по меньшей мере на около 95% или по меньшей мере на около 99% или полностью идентична вариабельной последовательности, кодирующей тяжелую цепь, которая кодирует вариабельную тяжелую цепь антитела, полученного с использованием гибридомы, имеющей №АТСС депонирования РТА-120196 или РТА-120197.
[0259] В некоторых вариантах реализации изобретения полинуклеотиды содержат кодирующую последовательность зрелого полипептида, слитого в одной и той же рамке считывания с полинуклеотидом, который способствует, к примеру, экспрессии и секреции полипептида из клетки-хозяина (например, лидерная последовательность, которая функционирует как секреторная последовательность для управления транспорта полипептида из клетки). Полипептид, имеющий лидерную последовательность, представляет собой пребелок и может иметь лидерную последовательность, расщепленную клеткой-хозяином с образованием зрелой формы полипептида. Полинуклеотид также может кодировать пробелок, который представляет собой зрелый белок плюс дополнительные 5'-аминокислотные остатки. Зрелый белок, имеющий пропоследовательность, является пробелком и представляет собой неактивную форму белка. Как только пропоследовательность расщепляется, то остается активный зрелый белок.
[0260] В некоторых вариантах реализации изобретения полинуклеотиды содержат кодирующую последовательность зрелого полипептида, слитого в одной и той же рамке считывания с маркерной последовательностью, которая позволяет, к примеру, проводить очистку кодированного полипептида. К примеру, маркерная последовательность может быть гексагистидиновым маркером, поставляемый вектором pQE-9, для обеспечения очистки зрелого полипептида, слитого с маркером, в случае использования бактериального хозяина, или маркерная последовательность может быть гемагглютининовым (НА) маркером, происходящим из белка гемагглютинина вируса гриппа, когда используется хозяин-млекопитающее (например, клетки COS-7).
[0261] Данное изобретение дополнительно относится к вариантам вышеуказанных описанных полинуклеотидов, кодирующих, к примеру, фрагменты, аналоги и производные.
[0262] Полинуклеотидные варианты могут содержать изменения в кодирующих участках, некодирующих участках или обоих видах участков. В некоторых вариантах реализации изобретения полинуклеотидные варианты содержат изменения, которые создают молчащие замены, добавки или делеции, но не изменяют свойства или виды активности кодированного полипептида. В некоторых вариантах реализации изобретения нуклеотидные варианты создаются молчащими заменами благодаря вырожденности генетического кода. Полинуклеотидные варианты могут продуцироваться по различным причинам, например, для оптимизации экспрессии кодонов в конкретном хозяине (изменением кодонов в мРНК человека на те, которые предпочтительны бактериальному хозяину, такому как Е. coli).
[0263] Предложены также векторы и клетки, содержащие полинуклеотиды, описанные в данном документе.
IV. Биологические образцы.
[0264] Биологические образцы часто фиксируют фиксатором. Как правило, используются альдегидные фиксаторы, такие как формалин (формальдегид) и глутаральдегид. Образцы тканей фиксируют с использованием методик фиксации, таких как погружение в спирт (Battifora и Kopinski, J. Histochem. Cytochem. (1986) 34: 1095), также являющихся подходящими. Используемые образцы также могут заливать парафином. В одном варианте реализации изобретения образцы являются и фиксированными формалином и залитыми парафином (ФФЗП). В другом варианте реализации изобретения ФФЗП блок окрашивают гематоксилином и эозином перед отбором одной или более частей на анализ для того, чтобы отобрать определенную область(и) основного ФФЗП образца. Способы приготовления блоков с тканями из этих конкретных образцов использовались в предыдущих ИГХ исследованиях различных прогностических факторов и/или хорошо известны специалистам в данной области техники (см., к примеру, Abbondanzo et al., Am J Clin Pathol. 1990 May; 93(5): 698-702; Allred et al., Arch Surg. 1990 Jan; 125(1): 107-13).
[0265] Вкратце, любой интактный орган или ткань может быть разрезана на достаточно малые фрагменты и инкубирована в различных фиксаторах (например, формалине, спирте и т.п.) в течение различных периодов времени до тех пор, пока ткань станет «зафиксированной». Образцы могут быть фактически любой интактной тканью, хирургическим путем удаленной из организма. Образцы могут разрезаться до приемлемо малого фрагмента(ов), который подходит для оборудования, обычно используемого в гистопатологических лабораториях. Размер отрезанных фрагментов, как правило, находится в диапазоне от нескольких миллиметров до нескольких сантиметров. Биологический образец также может быть представлен жидкими экстрактами, кровью, плазмой, сывороткой, спинномозговой жидкостью, лимфатической жидкостью или препаратами селезенки.
V. Корреляции экспрессии FOLR1 и терапевтическая эффективность.
[0266] Конъюгат антитело-майтанзиноид (КАМ) IMGN853 содержит FOLR1-связывающее моноклональное антитело, huMov19 (М9346А), конъюгированное с майтанзиноидом, DM4 (N(2')-дезацетил-N2'-(4-меркапто-4-метил-1-оксопентил)-майтанзин), присоединенным через расщепляемый сульфо-SPDB (N-сукцинимидил 4-(2-пиридилдитио)-2-сульфобутаноат) линкер. Последовательности антитела IMGN853 (huMov19) представлены ниже как SEQ ID №: 45 и 47, a IMGN853 и huMov19 описаны в опубл. заявке США №2012/0009181 (сейчас 8557966), которая включена в данный документ в полном объеме посредством ссылки.
SEQ ID №: 45 - huMov19 vHC

SEQ ID №.46 - huMov19 vLCv1.00
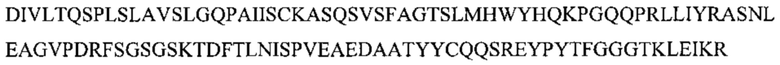
SEQ ID №: 47 - huMov19 vLCv1.60

SEQ ID №: 48 - huMov19 vLC CDR1
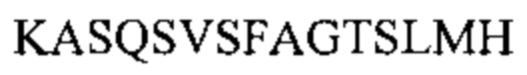
SEQ ID №: 49 - huMov19 vLC CDR2
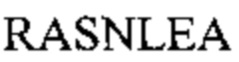
SEQ ID №: 50 - huMov19 vLC CDR3

SEQ ID №: 51 - huMov19 vHC CDR1
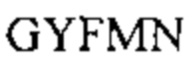
SEQ ID №: 52 - huMov19 vHC CDR2 - определена по Кабату

SEQ ID №: 53 - huMov19 vHC CDR2 - определена по Abm

SEQ ID №: 54 - huMov19 vHC CDR3
SEQ ID №: 55 - аминокислотная последовательность huMov19 НС

SEQ ID №: 56 - huMov19 LCv1.00

SEQ ID №: 57 - huMov19 LCv1.60

SEQ ID №: 58 - muMov19 vHC CDR2 - определена по Кабату
[0267] В настоящее время IMGN853 находится на клинических испытаниях для различных терапевтических показаний, которые включают FOLR1-положительный рак яичников, немелкоклеточный рак легких, рак эндометрия, рак почек и другие эпителиальные злокачественные образования. Раковые заболевания яичников проявляют наибольшую FOLR1-пенетрантность и считаются основными показаниями для лечения с помощью IMGN853 (Antony AC. Ann Rev Nutr 16: 501-21 (1996); Yuan Y et al. Hum Pathol 40(10): 1453-1460 (2009)). Измеренные уровни FOLR1 в образцах плазмы пациентов могут помочь идентифицировать популяции пациентов, которые с большей долей вероятности поддаются лечению КАМ.
[0268] В некоторых вариантах реализации в изобретении предложен способ идентификации субъектов, которые вероятно благоприятно поддаются FOLR1-таргетированным противораковым видам терапии, благодаря повышенным уровням экспрессии FOLR1, экспрессируемым у субъекта, в частности с использованием антител и их антигенсвязывающих фрагментов, приведенных в данном документе, которые могут выявлять динамический диапазон уровней экспрессии FOLR1, например, при ИГХ анализе.
[0269] Оценка образцов, полученных от пациентов, и корреляция с эффективностью in vivo с использованием моделей с ксенотрансплантатами демонстрирует возможности анализа экспрессии для выбора субъектов, которые с большей вероятностью поддаются лечению. При ИГХ анализе получают показатель экспрессии FOLR1 для опухолевых клеток: от 0 (экспрессии нет) до 3 (или 3+) (очень высокий уровень экспрессии). Данные in vivo с использованием моделей с ксенотрансплантатами демонстрируют, что образцы с показателями 2 или 3 (или 3+) по экспрессии FOLR1 имеют повышенную вероятность поддаваться FOLR1-таргетным противораковым видам терапии в клинически значимых дозах FOLR1-иммуноконъюгатов (см. например, предварительные заявки США№61/823 317 и 61/828 586 и международную заявку №PCT/US 2014/037911, все из которых включены в данный документ в полном объеме посредством ссылок). Таким образом, идентификация индивидов, имеющих повышенный показатель FOLR1, может помочь идентифицировать тех индивидов, которые могут отвечать на клинически значимую дозировку. Более того, экспрессия более однородных уровней FOLR1 обеспечивает лучшую корреляцию с терапевтическим действием. Таким образом, однородность гомогенного окрашивания или комбинация усиленного окрашивания с однородностью гетерогенного окрашивания может указывать на увеличенную экспрессию FOLR1. К примеру, показатель более чем 2 гетеро может использоваться как критерий отбора пациентов для лечения терапевтическим агентом к FOLR1 (см., например, опубликованную заявку США №2012/0282175, которая включена в данный документ в полном объеме посредством ссылки).
[0270] Анализ экспрессии FOLR1 также идентифицирует пациентов, у которых пониженные уровни препаратов FOLR1-таргетированной противораковой терапии («низкодозовая терапия») могут быть эффективными для реализации противоопухолевых ответов. Как принято в данной области техники, соединения обычно вводятся в наименьшей дозировке, которая достигает требуемого терапевтического ответа. Это особенно важно для терапевтических средств, которые вызывают клинические побочные эффекты. Способность распознавания таких субъектов с повышенными уровнями экспрессии FOLR1 позволяет провести минимизацию дозировки FOLR1-таргетированного терапевтического средства, таким образом, уменьшая вероятные побочные эффекты, при сохранении терапевтической эффективности.
[0271] Соответственно, антитела и антигенсвязывающие фрагменты, приведенные в данном документе, дают особые преимущества для применения в таких способах, благодаря тому, что они способны выявлять динамический диапазон уровней экспрессии FOLR1, например, при ИГХ анализе.
VI. Метод анализа сброшенных антигенов.
[0272] Измеренные уровни циркулирующего антигена в образцах плазмы пациентов (сброшенный антиген) могут помочь идентифицировать популяции пациентов, которые с большей долей вероятности поддаются лечению, например, лечению конъюгатом антитело-майтанзиноид (КАМ). Сообщалось, что высокие уровни сброшенного антигена заметно влияют на фармакокинетику терапевтических антител (Tolcher A. et al. 20th Symposium on Molecular Targets and Cancer Therapeutics; October 21-24, 2008; Geneva, Switzerland: EORTC-NCI-AACR, p163, №514; Baselga J, et al. J Clin Oncol 14: 737-744 (1996)). Вероятно, уровни сброшенного антигена в образцах плазмы, полученных от пациентов, будут вариабельными в зависимости от таких факторов как антигенная мишень, симптомы заболевания и течение заболевания. До настоящего времени уровни сброшенного антигена при симптомах заболевания для применения анти-FOLR1 иммуноконъюгата IMGN853 исследованы недостаточно, тогда как корреляция с экспрессией солидными опухолями является ограниченной. В то же время сообщалось о повышении уровня FOLR1 при аденокарциномах яичника, исходя из данных предполагается, что он не повышен при других симптомах FOLR1+ опухолей, таких как мелкоклеточная карцинома легких (Mantovani LT, et al. Eur J Cancer 30A(3): 363-9 (1994); Basal E, et al. PLoS ONE 4(7): e6292 (2009)). Данный метод позволяет проводить обнаружение FOLR1-рецептора в присутствие высокого уровня фолиевой кислоты с использованием антител и их антигенсвязывающих фрагментов, которые предложены в данном документе и способны выявлять динамические диапазоны сброшенного FOLR1. В предыдущих определениях для разработки метода анализа использовали Mov19. Поскольку IMGN853 содержит Mov19 и в одном варианте реализации предложена таргетная терапия по данному изобретению, жизненно важным является то, чтобы методом обнаруживался FOLR1 в присутствии или отсутствии Mov19. В предыдущих методах анализа, в которых использовали Mov19, имеют место конкурентные эффекты и FOLR1 будет выявляться в значительно меньшем количестве или не выявляться у пациентов, получающих лечение IMGN853.
[0273] В одном варианте реализации изобретения данный способ для обнаружения FOLR1 в жидких образцах, полученных у людей, используется традиционный формат «сэндвич»-ИФА. В одном варианте реализации изобретения в методе применяется агент для захвата (т.е. антитело) к FOLR1, присоединенный к твердой подложке. В одном варианте реализации изобретения твердая подложка представляет собой планшет для микротитрования. Для этого, образец (асцитные жидкости, плазма и т.п.) добавляют без разведения и проводят обнаружения другим агентом для обнаружения (другое антитело), которое не препятствует связыванию первого агента для захвата. Потом агент для обнаружения выявляют посредством использования вторичного агента для обнаружения (биотин/стрептавидин, античеловеческое вторичное моно- или поликлональное антитело и т.п.), которое может связываться более одного раза с первым агентом для обнаружения, таким образом, усиливая обнаружение сигнала. Потом вторичный агент для обнаружения количественно определяют использованием некоторых других методов (например, с ТМБ/пероксидазой, подсчетом сцинтилляций, флуоресцентными зондами и т.п.). В дополнение к этому, при анализе обнаруживается FOLR1 и на него не оказывает негативного влияния присутствие Mov19, IMGN853, других представителей семейства FOLR1 или фолиевой кислоты.
[0274] Анализы по данному изобретению включают анализы как для отбора пациентов, которые подходят как для получения терапии на основе FOLR1, так и для проведения анализов для мониторинга ответа организмов пациентов. Анализы для предсказания ответа проводят перед выбором терапии, а уровни FOLR1 могут влиять на решения по выбору терапии. Для мониторинга ответа организма пациента анализ проводят в начале терапии для определения исходных (или предварительно определенных) уровней FOLR1 в образце. Потом анализируют такой же образец и уровни FOLR1 сравнивают с исходными или предварительно определенными уровнями. Как используется в данном документе, термин «предварительно определенный уровень» обычно относится к предельному значению анализа, которое используется для оценки результатов диагностики сравнением результатов анализа с предварительно определенным уровнем, и когда предварительно определенный уровень уже связан или ассоциирован с различными клиническими параметрами (например, мониторингом того, достиг ли субъект, лечившийся лекарственным веществом, эффективного уровня лекарственного вещества в крови, мониторингом ответа субъекта, получающего лечение от ракового заболевания противораковым лекарственным веществом, мониторингом реакции опухоли у субъекта, получающего лечение от указанной опухоли и т.д.). Предварительно определенный уровень может быть или абсолютной величиной или величиной, нормализованной вычитанием значения, полученного для пациента, до начала проведения терапии. Пример предварительно определенного уровня, который может использоваться, представляет собой исходный уровень, полученный для одного или более субъектов, которые необязательно могут страдать от одного или более заболеваний или патологических состояний. Сравнение (или информационный анализ) уровня анализируемого биомаркера с исходным или предварительно определенным уровнем может проводиться автоматизированной системой, такой как программное обеспечение или интеллектуальная система, которая представляет часть или совместима с оборудованием (например, компьютерной платформой), на которой выполняется анализ. Альтернативно, это сравнение или информационный анализ может проводиться врачом. В одном варианте реализации изобретения, если уровни остаются такими же или уменьшаются, то терапия может быть эффективной и может быть продолжена. Когда происходит статистически значимое превышение исходного уровня (или предварительно определенного уровня), то организм пациента может не проявлять ответа. В другом варианте реализации изобретения увеличение уровней сброшенного FOLR1 может указывать на увеличенную гибель клеток и увеличенное высвобождение сброшенного FOLR1. В этом варианте реализации изобретения увеличение сброшенного FOLR1 указывает на терапевтическую эффективность.
[0275] Анализы по данному изобретению могут выполняться любыми методами анализа белков. Методы анализа белков, пригодные для данного изобретения, хорошо известны в данной области техники и включают методы иммуноанализа, включающие связывание специфического немеченого или меченого антитела или белка с экспрессированным белком или фрагментом FOLR1. Пригодные методы иммуноанализа, включающие анализы обеих растворимых фаз, проводятся с использованием любого формата, известного в данной области техники, такого как, но не ограниченного, анализа Biacore, резонансным переносом энергии флуоресценции с разрешением по времени (TR-FRET), форматом ИФА («сэндвич», прямого и обратного конкурентного ингибирования) или форматом флуоресцентной поляризации и анализами на твердой фазе, такими как иммуногистохимические анализы. FOLR1-антитела и их антигенсвязывающие фрагменты, приведенные в данном документе, особенно пригодны для этих методов иммуноанализа, благодаря тому, что они, к примеру, способны выявлять динамический диапазон FOLR1.
VII. Методы определения циркулирующих опухолевых клеток.
[0276] Анти-FOLR1 антитела, описанные в данном документе, также могут применяться для обнаружения FOLR1 при определении циркулирующих опухолевых клеток. Циркулирующие опухолевые клетки (ЦОК) представляют собой клетки, которые сброшены в сосудистое русло из опухоли и циркулируют в кровотоке. ЦОК присутствуют в системе кровообращения в очень малых количествах. В общем, ЦОК выделяют из крови или плазмы пациентов различными методиками, известными в данной области техники. ЦОК могут окрашиваться специфическими маркерами с использованием методов, известных в данной области техники, включающих, но не ограниченных, методами на основе проточной цитометрии и методами на основе ИГХ. ЦОК могут быть окрашены на наличие белковых маркеров, уникальных для опухолевых клеток, которые позволяют проводить идентификацию и отличить ЦОК от нормальных клеток крови. ЦОК также могут окрашиваться на наличие FOLR1 с использованием антител, предложенных в данном документе, включающих, но не ограниченных антителами 2.1, 5.7 и 9.20. Метод определения ЦОК также может включать количественный анализ числа ЦОК и/или числа FOLR1-положительных ЦОК. FOLR1-антитела, описанные в данном документе, могут применяться для окрашивания ЦОК, выделенных у субъекта, имеющего раковое заболевание, для измерения FOLR1, присутствующего в ЦОК. Увеличение FOLR1-экспрессирующих ЦОК может способствовать идентификации субъекта, как имеющего раковое заболевание, которое вероятно поддается терапии на основе FOLR1, или обеспечивать проведение оптимизации терапевтического режима с применением FOLR1-антитела или иммуноконъюгата. Количественное определение FOLR1 в ЦОК может давать информацию о стадии развития опухоли, ответе на терапию и/или прогрессировании заболевания. Оно может использоваться в качестве прогностического, прогнозного и фармакодинамического биомаркера. В дополнение к этому, окрашивание ЦОК на наличие FOLR1 с использованием антител, предложенных в данном документе, может применяться в качестве анализа жидкого биоптата как само по себе, так и в комбинации с дополнительным анализом определения опухолевых маркеров образцов солидных биоптатов.
VIII. Обнаружение.
[0277] В данном изобретении дополнительно предложены антитела против FOLR1, в основном моноклонального типа, которые связаны с по меньшей мере одним агентом с образованием конъюгата антитела для обнаружения. Для того, чтобы увеличить эффективность молекул антител в качестве диагностических принято их присоединять или ковалентно связывать или создавать комплекс с по меньшей мере одной требуемой молекулой или фрагментом. Такая молекула или фрагмент может быть, но не ограничиваться, по меньшей мере одной репортерной молекулой. Репортерную молекулу определяют как любой фрагмент, который может выявляться с использованием метода анализа. Не ограничивающие примеры репортерных молекул, которые конъюгируют с антителами включают ферменты, радиометки, гаптены, флуоресцентные метки, фосфоресцентные молекулы, хемилюминесцентные молекулы, хромофоры, люминесцентные молекулы, фотоаффинные молекулы, окрашенные частицы и/или лиганды, такие как биотин.
[0278] Определенные примеры конъюгатов антител представлены такими конъюгатами, в которых антитело или его антигенсвязывающий фрагмент, предложенный в данном документе, связан с выявляемой меткой. «Выявляемые метки» представляют собой соединения и/или элементы, которые могут обнаруживаться благодаря их специфическим функциональным свойствам и/или химическим характеристикам, использование которых позволяет выявлять антитело или антигенсвязывающий фрагмент, к которому они присоединены и который должен выявляться, и/или проводить, если требуется, дополнительное количественное определение.
[0279] В данной области техники известно множество соответствующих агентов для визуализации, как и способов их присоединения к антителам (см., например, пат. США №5021236, 4938948 и 4472509, каждый включен в данный документ посредством ссылки). Используемые фрагменты для визуализации могут быть парамагнитными ионами, радиоактивными изотопами, флуорохромами, ЯМР-выявляемыми веществами и/или, к примеру, веществами для рентгеновской визуализации.
[0280] Типичные флуоресцентные метки, которые предполагается использовать в качестве конъюгатов связывающего агента (например, антитела) включают, к примеру, Alexa 350, Alexa 430, Alexa 488, АМСА, BODIPY 630/650, BODIPY 650/665, BODIPY-FL, BODIPY-R6G, BODIPY-TMR, BODIPY-TRX, Cascade Blue, Су3, Cy5,6-FAM, Dylight 488, изотиоцианат флуоресцеина (FITC), зеленый флуоресцентный белок (GFP), HEX, 6-JOE, Oregon Green 488, Oregon Green 500, Oregon Green 514, Pacific Blue, фикоэритрин, REG, родаминовый зеленый, родаминовый красный, тетраметилродамин (TMR), ренографин, ROX, TAMRA, ΤΕΤ, тетраметилродамин, техасский красный и производные этих меток (т.е. галогенированные аналоги, модифицированные изотиоцианатом или другим линкером для конъюгирования и т.д.). Типичной радиометкой является тритий.
[0281] Конъюгаты для обнаружения антитела или антигенсвязывающего фрагмента, предполагаемые в данном изобретении, включают применяемые in vitro, когда антитело или фрагмент присоединен к вторичному связывающему лиганду и/или к ферменту (ферментному маркеру), который будет образовывать окрашенный продукт при контакте с хромогенным субстратом. FOLR1-антитела и их антигенсвязывающие фрагменты, приведенные в данном документе, особенно пригодны для методов с применением конъюгатов, благодаря тому, что они, к примеру, способны выявлять динамический диапазон FOLR1. Примеры подходящих ферментов включают уреазу, щелочную фосфатазу, гидрогенпероксидазу (хрена) и/или глюкозоксидазу. В некоторых вариантах реализации изобретения вторичные связывающие лиганды являются соединениями биотина и/или авидина и стрептавидина. Применение таких меток хорошо известно специалистам в данной области техники и описаны, к примеру, в пат. США №3817837, 3850752, 3939350, 3996345, 4277437, 4275149 и 4366241, каждый включен в данный документ посредством ссылки.
[0282] Молекулы, содержащие азидогруппы, также могут использоваться для образования ковалентных связей с белками посредством реакционно-способных нитреновых интермедиатов, которые образуются при ультрафиолетовом облучении низкой интенсивности (Potter и Haley, 1983). В частности, 2- и 8-азидные аналоги пуриновых нуклеотидов применяют как сайт-направленные фотозонды для идентификации нуклеотидсвязывающих белков в неочищенных экстрактах клеток (Owens и Haley, 1987; Atherton et al., 1985). 2- и 8-азидонуклеотиды также применяют для картирования нуклеотидсвязывающих доменов очищенных белков (Khatoon et al., 1989; King et al., 1989 и Dholakia et al., 1989) и их могут применять как антителосвязывающие агенты.
[0283] Несколько способов присоединения или конъюгации антитела с его конъюгатным фрагментом известны в данной области техники. Некоторые способы включают использование металлохелатного комплекса, использующего, к примеру, органический хелатирующий агент, такой как ангидрид диэтилентриаминпентауксусной кислоты (ДТПА), этилентриаминтетрауксусная кислота, N-хлор-п-толуолсульфонамид и/или тетрахлор-3α-6α-дифенилгликоурил-3, присоединенный к связывающему агенту (например, антителу) (пат. США №4472509 и 4938948, каждый включен в данный документ посредством ссылки). Моноклональные антитела также могут реагировать с ферментом в присутствии сшивающего агента, такого как глутаральдегид или перйодат. Конъюгаты, связывающие белки (например, антитела) с флуоресцеиновыми маркерами, получают в присутствии этих сшивающих агентов или реакцией с изотиоцианатом. В пат. США №4938948, визуализацию опухолей молочной железы, к примеру, достигают с использованием моноклональных антител, а выявляемые фрагменты для визуализации связывают с антителом, используя такие линкеры как метил-п-гидроксибензимидат или N-сукцинимидил-3-(4-гидроксифенил)пропионат.
[0284] В других вариантах реализации изобретения предполагается дериватизация иммуноглобулинов избирательным введением сульфгидрильных групп в Fc-участок иммуноглобулина с использованием условий реакции, которые не изменяют активный центр связывания антитела. Конъюгаты антител, получаемые в соответствии с этой методологией, описаны как проявляющие увеличенную длительность существования, улучшенную специфичность и чувствительность (пат. США №5196066, включенный в данный документ посредством ссылки). Сайт-специфическое присоединение эффекторной или репортерной молекул, при котором репортерная или эффекторная молекула конъюгирует с остатком углевода на Fc-участке, также описано в литературе (O'Shannessy et al., 1987).
[0285] В других вариантах реализации изобретения иммуноглобулины метят радиометками с нуклидами, такими как тритий. В дополнительных вариантах реализации изобретения применяются наночастицы золота (таких размеров как около 0,5 нм-40 нм) и/или частицы Quantum Dots (г. Хэйворд, Калифорния).
[0286] Когда используется формат «сэндвич»-анализа, антитело для захвата будет немеченым. Антитело для обнаружения будет или мечено непосредственно или выявляться опосредованно добавлением (после отмывки избыточного антитела для обнаружения) молекулярного избытка второго меченого антитела направленного против первого антитела.
[0287] Метка, используемая для обнаружения антитела, представляет собой любую выявляемую функциональную активность, которая не препятствует связыванию FOLR1-антител. Примеры подходящих меток представлены теми многочисленными метками, которые как известно применяются в иммуноанализе, включая фрагменты, которые могут выявляться непосредственно, такие как флуорохромные, хемилюминесцентные и радиоактивные метки, а также фрагменты, такие как ферменты, которые для обнаружения должны обеспечивать прохождение реакции или дериватизации. Примеры таких меток включают радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу жука-светляка и бактериальные люциферазы (пат. США №4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы, например, глюкозоксидазу, галактозоксидазу и глюкозо-6-фосфатдегидрогеназу, гетероциклические оксидазы, такие как уриказо- и ксантиноксидазу, связанные с ферментом, который использует пероксид водорода для окисления предшественника красителя, такого как HRP, лактопероксидазу или микропероксидазу, биотин/авидин, биотин/стрептавидин, биотин/стрептавидин-β-галактозидазу с МУГ, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и тому подобное. Как отмечено в данном документе, флуорометрическое обнаружение представляет собой один пример.
[0288] Общепринятые способы дают возможность ковалентно связывать эти метки с белками или полипептидами. К примеру, сшивающие агенты, такие как диальдегиды, карбодиимиды, дималеимиды,бис-имидаты, бис-диазотированный бензидин и им подобные, могут использоваться для маркирования антител с описанными в данном документе флуоресцентными, хемилюминесцентными и ферментными метками. См., к примеру, пат. США №3940475 (флуориметрия) и 3645090 (ферменты); Hunter et al. Nature 144: 945 (1962); David et al. Biochemistry 13: 1014-1021 (1974); Pain et al. J. Immunol. Methods 40: 219-230 (1981) и Nygren J. Histochem. and Cytochem. 30: 407-412 (1982). В некоторых вариантах реализации изобретения метки в данном документе являются флуоресцентными для увеличения усиления и чувствительности до 8 пг/мл, предпочтительнее использовать биотин со стрептавидин-β-галактозидазой и МУГ для усиления сигнала. В некоторых вариантах реализации изобретения используется колориметрическая метка, например, когда выявляемое антитело биотинилировано, а средство для обнаружения представляет собой авидин или стрептавидинпероксидазу и 3,3',5,5'-тетраметилбензидин.
[0289] Конъюгация такой метки, включающей ферменты, с антителом представляет собой стандартную манипулятивную процедуру для среднего специалиста по методикам иммуноанализов. См., например, O'Sullivan et al. «Methods for the Preparation of Enzyme-antibody Conjugates for Use in Enzyme Immunoassay», в Methods in Enzymology, ed. J. J. Langone и H. Van Vunakis, Vol. 73 (Academic Press, New York, N.Y., 1981), pp. 147-166.
[0290] После добавления последнего меченого антитела, количество связанного антитела определяется удалением избыточного несвязанного меченого антитела посредством промывания и последующего измерения количества присоединенной метки с использованием метода обнаружения, подходящего для метки, и определением корреляции измеренного количества с количеством сброшенного FOLR1 в биологическом образце. К примеру, в случае ферментов, величина окрашивания, которое развивается и измеряется, будет прямым измерением количества присутствующего сброшенного FOLR1. А именно, если меткой является HRP, окрашивание может выявляться с использованием субстрата 3,3',5,5'-тетраметилбензидина по поглощению при 450 нм.
IX. Субстраты и индикаторы.
[0291] Для обнаружения FOLR1 предполагается использование субстратов и индикаторов.
[0292] Пероксидаза хрена (HRP) представляет собой фермент, который сначала образует комплекс с пероксидом водорода, а потом вызывает его разложение, дающее в результате воду и атомарный кислород. Как для множества других ферментов, HRP и некоторые HRP-подобные виды активности могут ингибироваться избытком субстрата. Комплекс, образованный HRP и избытком пероксида водорода, является каталитически неактивным и в отсутствии донора электронов (например, хромогенного вещества) обратимо ингибируется. Именно избыток пероксида водорода и отсутствие донора электрона обуславливают подавление активности эндогенной HRP. При использовании в системах для анализа, HRP также может применяться для конверсии определенного субстрата в его активированный хромоген, таким образом, вызывая изменение цвета. Фермент HRP может быть конъюгирован с антителом, пептидом, полимером или другой молекулой несколькими способами, которые известны в данной области техники. Добавление глутаральдегида к раствору, содержащему смесь HRP и антитела, будет приводить к тому, что больше молекул антитела будут конъюгированы друг с другом, чем с ферментом. В двухстадийной процедуре HRP реагирует сначала с бифункциональными реагентами. На второй стадии с антителом смешивается только активированная HRP, что в результате приводит к намного более эффективному введению метки и отсутствию полимеризации. HRP также конъюгируют со (стрепт)авидином, используя двухстадийную процедуру с глутаральдегидом. Эта форма применяется в процедуре, в которой субстратами, к примеру, являются LAB и LSAB. Конъюгация с биотином также включает две стадии, так как биотин сначала должен пройти дериватизацию в биотинил-N-гидроксисукцинимидный эфир или в биотингидразид перед тем, как он может прореагировать с эпсилон-аминогруппами фермента HRP.
[0293] Субстратом для таких ферментов как HRP является 3,3-диаминобензидин (DAB), который образует коричневый конечный продукт, который в высшей степени нерастворим в спирте и других органических растворителях. Окисление DAB также вызывает полимеризацию, что дает возможность реагировать с тетраоксидом осмия, и, таким образом, увеличивать интенсивность окрашивания и электронную плотность. Из нескольких металлов и способов, используемых для интенсификации оптической плотности полимеризованного DAB, наиболее результативным оказывается хлорид золота в комбинации с сульфидом серебра.
[0294] Субстратом для таких ферментов как HRP является 3-амино-9-этилкарбазол (АБС), и при окислении он образует розово-красный конечный продукт, который растворим в спирте. Поэтому, образцы, обработанные АБС, не должны погружаться в спирт или спиртовые растворы (например, гематоксилин Харриса). Вместо этого следует использовать водное контрастирование и водную среду для заливки.
[0295] Субстратом для таких ферментов как HRP является 4-хлор-1-нафтол (CN), который осаждается в виде синего конечного продукта. Из-за того, что CN растворим в спирте и других органических растворителях, образцы не должны дегидратироваться, подвергаться спиртовым контрастированиям или покровные стекла помещаться в среду для заливки, содержащую органические растворители. В отличие от DAB, CN имеет склонность диффундировать из места осаждения.
[0296] Субстратом для таких ферментов как HRP является дигидрохлорид п-фенилендиамина/пирокатехин (реактив Ханкера-Яте), который дает сине-черный продукт реакции, нерастворимый в спирте и других органических растворителях. Как и полимеризованный DAB, этот продукт реакции может быть насыщен осмием. С использованием реактива Ханкера-Яте в иммунопероксидазных методиках могут получаться различающиеся результаты.
[0297] Щелочная фосфатаза кишечника теленка (АР) (молекулярная масса 100 кДа) удаляет (гидролизом) и переносит фосфатные группы из органических сложных эфиров, разрушением связи Р-0; при этом кратковременно образуется промежуточная связь фермент-субстрат. Основными активаторами-металлами для АР являются Mg++, Mn++ и Са++.
[0298] АР не использовалась активно в методах иммуногистохимии до публикации процедуры с немеченой щелочной фосфатазой-антителом к щелочной фосфатазе (АРААР). Растворимые иммунные комплексы, использующие эту процедуру, имеют молекулярные массы приблизительно 560 кДа. Главное преимущество процедуры АРΑΑΡ по сравнению с методикой с пероксидазой-антителом к пероксидазе (РАР) заключается в отсутствии влияния, возникающего из-за активности эндогенной пероксидазы. Эндогенная пероксидаза может блокироваться использованием разбавленного раствора пероксида водорода. Из-за потенциального неопределенного влияния активности эндогенной пероксидазы при РАР-окрашивании, методика АРΑΑΡ рекомендована для применения для мазков крови и костного мозга. Активность эндогенной щелочной фосфатазы из костей, почек, печени и некоторых белых клеток крови может ингибироваться добавлением 1 мМ левамизола к раствору субстрата, хотя оказалось, что 5 мМ раствор является более эффективным. Кишечные щелочные фосфатазы недостаточно ингибируются левамизолом.
[0299] В методе окрашивания с иммунощелочной фосфатазой фермент гидролизует сложные эфиры нафтолфосфата (субстрат) до фенольных соединений и фосфатов. Фенолы соединяются с бесцветными диазониевыми солями (хромоген) с образованием нерастворимых окрашенных азокрасителей. Успешно применяются несколько разных комбинаций субстратов и хромогенов.
[0300] Может использоваться субстрат АР - фосфат нафтола AS-MX в его кислотной форме или в виде натриевой соли. Хромогенные субстраты прочного красного TR и прочного синего ВВ образуют, соответственно, ярко-красный или синий конечный продукт. Оба они растворимы в спиртовых и других органических растворителях, поэтому должна использоваться водная среда для заливки. При окрашивании мазков клеток предпочтительно используют прочный красный TR.
[0301] Дополнительные типичные субстраты включают фосфат нафтола AS-BI, фосфат нафтола AS-TR и 5-бром-4-хлор-3-индоксилфосфат (BCIP). Другие возможные хромогены включают, к примеру, прочный красный LB, прочный Гарнета GBC, нитросиний тетразолий (ΝΒΤ) и йодонитротетразоловый фиолетовый (ΙΝΤ).
X. Методы иммунодетекции.
[0302] В дополнительных вариантах реализации данное изобретение касается методов иммунодетекции по связыванию, очистке, удалению, количественному определению и/или иному обычному обнаружению биологических компонентов, таких как лиганды, как предполагается данным изобретением. Могут применяться антитела, полученные в соответствии с данным изобретением. Некоторые методы иммунодетекции включают, упоминая некоторые, методы иммуногистохимии, проточную цитометрию, твердофазный иммуноферментный анализ (ИФА), радиоиммуноанализ (РИА), иммунорадиометрический анализ, флуороиммуноанализ, хемилюминесцентный анализ, биолюминесцентный анализ и вестерн-блот. Стадии различных пригодных методов иммунодетекции описаны в научной литературе, такой как, например, Doolittle M H и Ben-Zeev О, Methods Mol Biol. 1999; 109: 215-37; Gulbis В и Galand Ρ, Hum Pathol. 1993 Dec; 24(12): 1271-85 и De Jager R et al., Semin Nucl Med. 1993 Apr; 23(2): 165-79, каждая включена в данный документ посредством ссылки.
[0303] В общем, методы иммуносвязывания, в зависимости от случая, включают получение образца, предполагаемо содержащего лигандный белок, полипептид и/или пептид, и приведение в контакт образца с первым лигандсвязывающим агентом (например, антилигандным антителом) в соответствии с данным изобретением в условиях, эффективных для того, чтобы обеспечить образование иммунокомплексов.
[0304] В терминах обнаружения антигенов анализируемый биологический образец может быть любым образцом, в котором требуется выявить FOLR1, такой как жидкий экстракт, кровь, плазма, сыворотка, спинномозговая жидкость, лимфоидная жидкость, срез или образец ткани, экстракт гомогенизированной ткани, аспирационные биоптаты, клетка, выделенные и/или очищенные формы FOLR1-содержащих композиций или любая биологическая жидкость. В некоторых вариантах реализации изобретения используют образцы или экстракты крови, плазмы или лимфы.
[0305] Приведение в контакт выбранного биологического образца с антителом в эффективных условиях и в течение периода времени, достаточного для обеспечения образования иммунных комплексов (первичных иммунных комплексов), обычно представляет собой просто добавление композиции антитела к образцу и инкубирование смеси в течение достаточно долгого периода времени для того, чтобы антитела образовали иммунные комплексы, т.е. для связывания любых присутствующих лигандных белковых антигенов. По прошествии этого времени композиция образец антитело, такая как срез ткани, планшет ИФА, дот-блот или вестерн-блот, обычно будет промываться для удаления любых неспецифически связанных видов антител, обеспечивая сохранение только тех антител, которые специфически связываются с первичными иммунными комплексами, которых необходимо выявить.
[0306] В общем, обнаружение образования иммунокомплексов хорошо известно в данной области техники и может достигаться посредством применения многочисленных подходов. Эти способы обычно основаны на обнаружении метки или маркера, такого как любой из радиоактивных, флуоресцентных, биологических и ферментных маркеров. Патенты США, касающиеся применения таких меток включают пат. США №3817837, 3850752, 3939350, 3996345, 4277437, 4275149 и 4366241, каждый включен в данный документ посредством ссылки. Конечно, кто-то может найти дополнительные преимущества при использовании вторичного связывающего лиганда, такого как вторичное антитело и/или лигандсвязывающая комбинация биотин/авидин, как известно в данной области техники.
[0307] Антилигандное антитело, применяемое в обнаружении, само по себе может быть связано с выявляемой меткой, чтобы потом можно было просто выявлять эту метку, тем самым обеспечивая определение в композиции количества первичных иммунных комплексов. В альтернативном варианте, первое антитело, которое становится связанным в первичных иммунных комплексах, может выявляться с помощью второго связывающего агента, который обладает аффинностью связывания к антителу. В этих случаях, второй связывающий агент может быть связан с выявляемой меткой. Второй связывающий агент часто сам по себе является антителом, которое поэтому может называться «вторичным» антителом. Первичные иммунные комплексы приводят в контакт с меченым вторичным связывающим агентом, или антителом, в эффективных условиях и в течение периода времени, достаточного для образования вторичных иммунных комплексов. Далее вторичные иммунные комплексы обычно промывают для удаления любых неспецифически связанных меченых вторичных антител или лигандов, а потом выявляют оставшуюся метку во вторичных иммунных комплексах.
[0308] Дополнительные способы включают выявление первичных иммунных комплексов двухстадийной методикой. Второй связывающий агент, такой как антитело, которое обладает аффинностью связывания к антителу, используется для образования вторичных иммунных комплексов, как описано в данном документе. После промывки, вторичные иммунные комплексы приводят в контакт с третьим связывающим агентом или антителом, которое обладает аффинностью связывания со вторым антителом, снова в эффективных условиях и в течение периода времени, достаточного для образования иммунных комплексов (третичные иммунные комплексы). Третий лиганд или антитело связывается с выявляемой меткой, обеспечивая обнаружение третичных иммунных комплексов, образующихся таким способом. Эта система, если это требуется, может обеспечивать усиление сигнала.
[0309] В другом варианте реализации изобретения биотинилированное моноклональное или поликлональное антитело применяется для выявления целевого антигена(ов), а антитело второй стадии потом используется для выявления биотина, присоединяясь к биотину в образовавшемся комплексе. В этом способе образец, который требует исследования, сначала инкубируется в растворе, содержащем антитело первой стадии. Если присутствует целевой антиген, то некоторое количество антитела связывается с антигеном с образованием комплекса биотинилированное антитело/антиген. Потом комплекс антитело/антиген усиливается инкубацией в следующих друг за другом растворах стрептавидина (или авидина), биотинилированной ДНК и/или комплементарной биотинилированной ДНК, с добавлением на каждой стадии дополнительных биотиновых сайтов к комплексу антитело/антиген. Стадии усиления повторяются до достижения подходящего уровня усиления, при котором место присоединения образца инкубируется в растворе, содержащем антитело второй стадии против биотина. Это антитело второй стадии обозначают меткой, такой как, к примеру, фермент, который может применяться для выявления наличия комплекса антитело/антиген методом гистоэнзимологии с использованием хромогенного субстрата. При подходящем усилении может образовываться конъюгат в количестве, которое становится макроскопически видимым.
[0310] В одном варианте реализации изобретения для иммунологического выявления может использоваться метод иммуногистохимии (ИГХ). С использованием метода ИГХ, обнаружение FOLR1 в образце может достигаться таргетингом образца зондом, например, анти-FOLR1 антителом. Зонд может быть связан, непосредственно или опосредовано, с выявляемой меткой или может выявляться другим зондом, который связан, непосредственно или опосредовано, с выявляемой меткой.
[0311] В некоторых вариантах реализации изобретения метод ИГХ может различать разные уровни экспрессии белков, например, калиброванная методика ИГХ. В некоторых вариантах реализации изобретения метод ИГХ может различать интенсивность окрашивания образцов, которые имеют низкую экспрессию FOLR1, среднюю экспрессию FOLR1 или высокую экспрессию FOLR1.
[0312] В одном варианте реализации изобретения иммунологическое выявление (методом иммуногистохимии) FOLR1 учитывается как по интенсивности, так и однородности (процент окрашенных клеток - только мембран). Сравнительные уровни градации экспрессии FOLR1 по интенсивности коррелируют так: 0 - отрицательный результат, 0-1 - очень слабая, 1 - слабая, 1-2 - от слабой до умеренной, 2 - умеренная, 2-3 - от умеренной до сильной, 3 - сильная, 3+ - очень сильная. При количественной интерпретации, показатель 0 указывает, что окрашивание мембран не наблюдается. Показатель 1 указывает, что выявляется слабо/едва заметное окрашивание мембран. Для показателя 2 наблюдается окрашивание мембран от слабого до умеренно полного. Наконец, показатель 3 (или 3+) указывает, что наблюдается окрашивание мембран от умеренного до полного. Образцы с показателем 0 или 1 по экспрессии FOLR1 могут быть охарактеризованы, как не имеющие повышенной экспрессии FOLR1, в то время как образцы с показателями 2 или 3 могут быть охарактеризованы, как сверхэкспрессирующие или имеющие повышенную экспрессию FOLR1. В другом варианте реализации изобретения с использованием антител, их антигенсвязывающих фрагментов или полипептидов, предложенных в данном документе, образцы с показателем 0 по экспрессии FOLR1 могут быть охарактеризованы, как не имеющие повышенной экспрессии FOLR1, образцы с показателем 1 могут быть охарактеризованы, как имеющие повышенную экспрессии FOLR1, а образцы с показателями 2 или 3 могут быть охарактеризованы, как сверхэкспрессирующие или имеющие повышенный FOLR1.
[0313] Образцы, сверхэкспрессирующие FOLR1, также могут оцениваться по иммуногистохимическим показателям, соответствующим количеству копий экспрессируемых молекул FOLR1 на клетку, или числу связанных антител на одну клетку (ABC), и могут определяться биохимическим методом. Сравнительные уровни градации однородности FOLR1 (процент окрашивания мембран клеток) являются следующими: Отрицательный результат = 0%; фокальное = <25%; гетерогенное (гетеро) = 25-75% и гомогенное (гомо) = >75%.
[0314] В одном варианте реализации изобретения иммунологическое выявление (методом иммуногистохимии) FOLR1 учитывается с использованием Η-показателей. Н-показатели сочетают показатели интенсивности окрашивания (например, показатель от 0 до 3, причем 0 отвечает отсутствию окрашивания, а 3 отвечает сильному окрашиванию) с процентным содержанием клеток, которые положительные по окрашиванию мембран (т.е. однородность). Η-показатель может рассчитываться следующим образом:
H показатель = [0 * (процентное содержание клеток, окрашенных с интенсивностью 0)] + [1 * (процентное содержание клеток, окрашенных с интенсивностью 1)] + [2 * (процентное содержание клеток, окрашенных с интенсивностью 2)] + [3 * (процентное содержание клеток, окрашенных с интенсивностью 3)]. Соответственно, Η-показатель может находиться в диапазоне от 0 (отсутствует окрашивание мембран клеток) до 300 (все мембраны клеток окрашены с интенсивностью 3).
[0315] В одном варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 50. В одном варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 75. В одном варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 100. В одном варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 125. В одном варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 150. В одном варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 175. В одном варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 200. В другом варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 225. В другом варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 250. В другом варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет по меньшей мере 275. В другом варианте реализации изобретения субъект, имеющий раковое заболевание, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в опухолевом образце, полученном от субъекта, составляет 300.
[0316] В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет от 75 до 300. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет по меньшей мере 75. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет по меньшей мере 100. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет по меньшей мере 125. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет по меньшей мере 150. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет по меньшей мере 175. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет по меньшей мере 200. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет по меньшей мере 225. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет по меньшей мере 250. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет по меньшей мере 275. В другом варианте реализации изобретения субъект, имеющий рак яичников, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли яичников, полученном от субъекта, составляет 300.
[0317] В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет от 50 до 300. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 50. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 75. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 100. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 125. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 150. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 175. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 200. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 225. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 250. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет по меньшей мере 275. В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в образце опухоли НМРЛ, полученном от субъекта, составляет 300.
[0318] В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Н-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет от 50 до 300. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 50. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 75. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 100. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 125. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 150. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 175. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 200. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 225. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 250. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет по меньшей мере 275. В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом с анти-FOLR1 антителом (например, IMGN853), если Η-показатель экспрессии FOLR в образце опухоли эндометрия, полученном от субъекта, составляет 300.
[0319] В качестве примера, Η-показатель у субъекта, имеющего рак яичников, может быть рассчитан следующим образом:
H показатель = (75% с интенсивностью 0) + (0% с интенсивностью 1) + (0% с интенсивностью 2) + (25% с интенсивностью 3) = 75 или
H показатель = (0% с интенсивностью 0) + (75% с интенсивностью 1) + (0% с интенсивностью 2) + (25% с интенсивностью 3) = 150.
В другом примере, Η-показатель у субъекта, имеющего рак эндометрия, может быть рассчитан следующим образом:
H показатель = (75% с интенсивностью 0) + (0% с интенсивностью 1) + (25% с интенсивностью 2) + (0% с интенсивностью 3) = 50 или
H показатель = (0% с интенсивностью 0) + (75% с интенсивностью 1) + (25% с интенсивностью 2) + (0% с интенсивностью 3) = 125.
Во всех четырех вариантах реализации изобретения, приведенных выше, субъект может быть идентифицирован как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853).
[0320] В одном варианте реализации изобретения иммунологическое выявление (методом иммуногистохимии) FOLR1 учитывается с использованием процента положительной реакции и интенсивности во всем образце. В этом варианте реализации изобретения выбор лечения режимом лечения с анти-FOLR1 основан на процентном содержании клеток в образце, который выявлен как экспрессирующий мембранный FOLR1 на установленном уровне, что отражает как интенсивность окрашивания (например, 1, 2 или 3), так и однородность (например, гетерогенное или гомогенное (см. табл. 11)). К примеру, образец, имеющий по меньшей мере 25% (т.е. 25-75% или >75%) окрашивания клеток с положительным результатом FOLR1 равным 3, может быть охарактеризован как «3 гетеро» и «3 гомо» или, в совокупности, как «по меньшей мере 25% положительного результата равного 3».
[0321] В одном варианте реализации изобретения субъект, имеющий рак яичника, идентифицируется как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если по меньшей мере 25% экспрессии мембранного FOLR1 в опухолевом образце, полученном от субъекта, имеет показатель интенсивности 3, определенный методом ИГХ. В одном варианте реализации изобретения ИГХ анализ выполняют, используя антитело FOLR1-2.1.
[0322] В другом варианте реализации изобретения субъект, имеющий рак эндометрия, идентифицируется как кандидат на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если по меньшей мере 25% экспрессии мембранного FOLR в опухолевом образце, полученном от субъекта, имеет показатель интенсивности 2, определенный методом ИГХ. В одном варианте реализации изобретения ИГХ анализ выполняют, используя антитело FOLR1-2.1.
[0323] В другом варианте реализации изобретения субъект, имеющий НМРЛ, идентифицируют как кандидата на лечение режимом лечения с анти-FOLR1 антителом (например, IMGN853), если по меньшей мере 25% экспрессии мембранного FOLR в опухолевом образце, полученном у субъекта, имеет показатель интенсивности 2, определенный методом ИГХ. В одном примере ИГХ анализ выполняют, используя для ИГХ анализа антитело FOLR1-2.1.
[0324] ИГХ анализ может выполняться вручную или с использованием автоматизированной системы (например, используя автоматизированное устройство для окрашивания). ИГХ анализ может выполняться на клетках, осадках клеток, тканях, препаратах из крови, плазмы, сыворотки или лимфатической жидкости. В некоторых вариантах реализации изобретения образцы представляют собой фиксированные образцы. В некоторых вариантах реализации изобретения образцы представляют собой залитые парафином образцы. В некоторых вариантах реализации изобретения образцы представляют собой фиксированные формалином и залитые парафином образцы.
[0325] В одном варианте реализации изобретения для иммунологического выявления используется проточная цитометрия. Таким образом, к примеру, число связанных антител на одну клетку (ABC), может оцениваться с использованием проточной цитометрии. Большое количество анти-FOLR1 антител, связанных на одну клетку, может указывать на высокие уровни экспрессии FOLR1 и высокую вероятность восприимчивости к лечению анти-FOLR1 антителом или его иммуноконъюгатом.
XI. Композиции и наборы.
[0326] Изобретением также предложены композиции и наборы для практического применения по данному изобретению, как описано в данном документе. Такие наборы могут включать контейнеры, каждый содержит один или более различных реактивов (как правило, в концентрированной форме), используемых в способах, включая, к примеру, один или более связывающих агентов (антител) уже присоединенных к маркеру или, необязательно, с реактивами для сшивания связывающего агента с антителом (а также самим маркером), буферные растворы и/или реактивы и инструмент для выделения (необязательно микропрепарированием) для обеспечения практического применения изобретения. Описание меток или индикаторов, или последовательность инструкций по применению компонентов набора в методе обнаружения лигандов по данному изобретению, как правило также будут включены, причем инструкции могут быть ассоциироваться с листом-вкладышем и/или упаковкой набора или его компонентов.
[0327] В дополнительных вариантах реализации изобретения данное изобретение касается наборов для иммунодетекции для использования с методами иммунодетекции, описанными в данном документе. Так как антитела обычно применяются для обнаружения FOLR1, то антитела, как правило, будут включены в набор. Таким образом, наборы для иммунодетекции будут в подходящих контейнерах включать, первое антитело, которое связывается с FOLR1 и/или, необязательно, реактив для иммунодетекции и/или дополнительно, необязательно, белок FOLR1 или образец клеток, содержащих FOLR1.
[0328] Реактивы для иммунодетекции набора могут принимать любую из разнообразных форм, включая выявляемые метки, которые ассоциированы и/или связаны с данным антителом. Подразумевается также наличие выявляемых меток, которые ассоциированы с и/или присоединены к вторичному связывающему лиганду. Типичные вторичные лиганды представляют собой такие вторичные антитела, которые обладают аффинностью связывания к первому антителу.
[0329] Дополнительные соответствующие реактивы для иммунодетекции для использования в данном наборе включают двухкомпонентный реактив, который содержит вторичное антитело, которое обладает аффинностью связывания к первому антителу, вместе с третьим антителом, которое обладает аффинностью связывания ко второму антителу, третье антитело связано с выявляемой меткой. Как отмечено в данном документе, множество типичных меток известно в данной области техники и/или все такие метки могут надлежащим образом применяться в связи с данным изобретением.
[0330] Наборы могут дополнительно включать терапевтический агент, такой как анти-FOLR1 иммуноконъюгат, для лечения рака.
[0331] Набор может дополнительно включать реактив для обнаружения FOLR1, применяемый для измерения экспрессии FOLR1 у субъекта, включающий реактив для обнаружения FOLR1 и инструкции по применению. В одном варианте реализации изобретения реактив для обнаружения FOLR1 содержит FOLR1-связывающий пептид или анти-FOLR1 антитело. В другом варианте реализации изобретения набор дополнительно включает вторичное антитело, которое связывается с анти-FOLR1 антителом.
[0332] В одном варианте реализации изобретения FOLR1-специфическое антитело включено в концентрации от около 0,1 до около 20 мкг/мл, от около 0,1 до около 15 мкг/мл, от около 0,1 до около 10 мкг/мл, от около 0,5 до около 20 мкг/мл, от около 0,5 до около 15 мкг/мл, от около 0,5 до около 10 мкг/мл, от около 1 до около 20 мкг/мл, от около 1 до около 15 мкг/мл, от около 1 до около 10 мкг/мл, от около 2 до около 20 мкг/мл, от около 2 до около 15 мкг/мл или от около 2 до около 10 мкг/мл. В другом варианте реализации изобретения FOLR1-специфическое антитело включено в концентрации около 1,5 мкг/мл, около 2 мкг/мл, около 3 мкг/мл, около 4 мкг/мл, около 5 мкг/мл, около 6 мкг/мл, около 7 мкг/мл, около 8 мкг/мл, около 9 мкг/мл или около 10 мкг/мл. В другом варианте реализации изобретения FOLR1-специфическое антитело включено в концентрации около 2 мкг/мл. В другом варианте реализации изобретения FOLR1-специфическое антитело включено в концентрации около 10 мкг/мл.
[0333] В другом варианте реализации изобретения антитело содержится в концентрированном растворе с инструкциями по разведению для достижения конечной концентрации от около 1 до около 20 мкг/мл, от около 1 до около 15 мкг/мл, от около 1 до около 10 мкг/мл, от около 2 до около 20 мкг/мл, от около 2 до около 15 мкг/мл или от около 2 до около 10 мкг/мл. В другом варианте реализации изобретения антитело содержится в концентрированном растворе с инструкциями по разведению для достижения конечной концентрации около 1,5 мкг/мл, около 2 мкг/мл, около 3 мкг/мл, около 4 мкг/мл, около 5 мкг/мл, около 6 мкг/мл, около 7 мкг/мл, около 8 мкг/мл, около 9 мкг/мл или около 10 мкг/мл. В другом варианте реализации изобретения антитело содержится в концентрированном растворе с инструкциями по разведению для достижения конечной концентрации около 2 мкг/мл. В другом варианте реализации изобретения антитело содержится в концентрированном растворе с инструкциями по разведению для достижения конечной концентрации около 10 мкг/мл.
[0334] В другом варианте реализации изобретения набор дополнительно содержит реактив для обнаружения, выбранный из группы, состоящей из: фермента, флуорофора, радиоактивной метки и люминофора. В другом варианте реализации изобретения реактив для обнаружения выбран из группы, состоящей из: биотина, дигоксигенина, флуоресцеина, трития и родамина.
[0335] Набор также включает инструкции для выявления и определения показателя экспрессии FOLR1. Набор также включает контрольные или эталонные образцы. Неограничивающие примеры контрольных или эталонных образцов включают осадки клеток или линии культур клеток тканей, полученных из нормальных (нормальный контроль) или опухолевых (положительный контроль) образцов. Типичные линии клеток включают линии клеток стабильно или транзиентно трансфецированные экспрессионным вектором, который экспрессирует FOLR1. Дополнительные примеры включают осадки клеток и образцы тканей, описанные в примерах.
[0336] В некоторых вариантах реализации изобретения набор представляет собой комбинацию в упаковке, включающую основные элементы: (а) реактивы для захвата, содержащие моноклональные антитела против FOLR1 человека, и (b) реактивы для обнаружения, которые также могут содержать FOLR1-моноклональные антитела, но также могут содержать выявляемые (меченые или немеченые) антитела, которые связываются с FOLR1. Эти основные элементы определены в данном документе.
[0337] В одном варианте реализации изобретения набор дополнительно содержит твердую подложку для реактивов для захвата, которая может быть представлена как отдельный элемент или на нем уже иммобилизированы реактивы для захвата. Следовательно, антитела для захвата в наборе могут быть иммобилизированы на твердой подложке или они могут быть иммобилизированы на такой подложке, которая включена в набор или представлена отдельно от набора.
[0338] В одном варианте реализации изобретения реактив для захвата нанесен на планшет для микротитрования. Реактивы для обнаружения могут быть мечеными антителами, выявляемые непосредственно, или немечеными антителами, которые выявляются мечеными антителами, направленными против немеченых антител, индуцированных в другом биологическом виде. Когда метка представляет собой фермент, то набор обыкновенно будет включать субстраты и кофакторы, требуемые для фермента, а когда метка представляет собой флуорофор - то предшественник красителя, который обеспечивает выявляемый хромофор. Когда реактив для обнаружения является немеченым, то набор может дополнительно содержать средство для обнаружения выявляемых антител, такое как меченые антитела, направленные на немеченые антитела, например, в флуорометрически выявляемом формате. Когда метка представляет собой фермент, то набор обыкновенно будет включать субстраты и кофакторы, требуемые для фермента, а когда метка представляет собой флуорофор - то предшественник красителя, который обеспечивает выявляемый хромофором, а когда метка является биотином - то авидин в виде авидина, стрептавидина или стрептавидина, конъюгированного с HRP, или β-галактозидазой с МУГ.
[0339] В одном варианте реализации изобретения реактив для захвата представляет собой FOLR1-антитело 2.1, 5.7 или 9.20 или антитело, содержащее последовательности антител 2.1, 5.7 или 9.20. В одном варианте реализации изобретения реактив для обнаружения представляет собой FOLR1-антитело 2.1, 5.7 или 9.20 или антитело, содержащее последовательности антител 2.1, 5.7 или 9.20. В другом варианте реализации изобретения реактив для обнаружения представляет собой биотинилированное FOLR1-антитело 2.1, 5.7 или 9.20 или биотинилированное антитело, содержащее последовательности антител 2.1, 5.7 или 9.20.
[0340] Набор также, как правило, содержит инструкции для проведения анализа и/или белок FOLR1 или его фрагмент (например, внеклеточный домен FOLR1 или внеклеточный домен FOLR1 и весь или часть связывающего ГФИ домена) в качестве стандарта антигена, а также другие добавки, такие как стабилизаторы, буферные растворы для промывки и инкубации и тому подобное. В одном варианте реализации изобретения стандарт антигена FOLR1 представляет собой иммуноадгезин FOLR1-Fc. Набор также включает инструкции для выявления и определения показателя экспрессии FOLR1.
[0341] Компоненты набора могут поставляться в предварительно определенных соотношениях с относительными количествами различных реактивов, соответственно изменяемыми для обеспечения концентраций реактивов в растворе, которые значительно максимизируют чувствительность анализа. Конкретно, реактивы могут поставляться в виде сухих порошков, обычно лиофилизированных, включая вспомогательные вещества, которые при растворении будут обеспечивать получение раствора реактива, обладающего соответствующей концентрацией для соединения с образцом, который должен исследоваться.
[0342] Предложены также композиции, содержащие антитела или его антигенсвязывающие фрагменты, описанные в данном документе. В одном варианте реализации изобретения композиция содержит анти-FOLR1 антитело или антигенсвязывающий фрагмент, описанный в данном документе, и буферный раствор, например, буферный раствор, который может использоваться в анализе на обнаружение, таком как FACS, ИГХ или ИФА. Такие буферные растворы известны специалистам в данной области техники и включают растворители. В качестве примера, определенные буферные растворы для FACS предложены в данном документе, например, в демонстрационных примерах. Буферные растворы для FACS могут также содержать, к примеру, сыворотку или альбумин (такие как сыворотку теленка, сыворотку козла или БСА) и/или азид натрия. Буферные растворы для FACS могут также содержать PBS, ЭДТА и/или ДНКазу или их любую комбинацию. Буферные растворы для ИГХ анализа также предложены в данном документе и известны специалистам в данной области техники. Буферные растворы для ИГХ анализа могут содержать, к примеру, казеиновую сыворотку или альбумин (такие как сыворотку теленка, сыворотку козла или БСА), твин или тритон, PBS и/или азид натрия или любую их комбинацию. Буферные растворы для ИФА также предложены в данном документе и известны специалистам в данной области техники. Буферные растворы для ИФА могут содержать, к примеру, сыворотку или альбумин (такие как сыворотку теленка, сыворотку козла или БСА), обезжиренное сухое молоко, казеин и/или желатин или любую их комбинацию.
[0343] Варианты реализации по данному описанию могут дополнительно определяться посредством ссылки на следующие неограничивающие примеры, которые подробно описывают получение определенных антител по данному описанию и способы использования антител по данному описанию. Специалистам в данной области техники будет очевидно, что множество модификаций, как материалов, так и способов, может быть практически реализовано без отступления от объема данного описания.
ПРИМЕРЫ
[0344] Подразумевается, что примеры и варианты реализации изобретения, описанные в данном документе, приведены только с иллюстративными целями и что различные модификации или изменения в таком свете будут предполагаться специалистами в данной области техники и должны быть включены в существо и сферу действия этой заявки.
Пример 1. Получение FOLR1-гибридом.
[0345] Гибридомы, продуцирующие античеловеческие FOLR1-моноклональные антитела, которые подходят для иммуногистохимического (ИГХ) окрашивания (антител по данному изобретению), отбирали из более чем 16000 гибридом. Гибридомы получали иммунизацией мышей Balb/c дикого типа разными антигенами, включая: фиксированные формалином клетки 300-19, которых трансфецировали FOLR1 человека, рекомбинантный белок FOLR1 человека-IgG2a Fc мыши и рекомбинантный белок FOLR1 человека. Иммунизацию фиксированными клетками 300-19 проводили подкожной инъекцией трансфецированных клеток 300-19 в PBS (5Е6 клеток/мышь/инъекцию) в отсутствии какого-либо адъюванта. Иммунизацию рекомбинантными белками FOLR1 выполняли подкожной инъекцией белка, эмульгированного в полном адъюванте Фрейнда (ПАФ) или неполного адъюванта Фрейнда для стимуляции (Sigma) или мышином адъюванте Magic (Creative Diagnostics). Обычно, мышей иммунизировали пять раз с двухнедельными интервалами перед получением финальной стимуляции внутрибрюшинной инъекцией иммуногена за три дня до слияния.
[0346] Всего проводили 16 независимых слияний клеток (включая слияния 352, 353 и 354), используя клетки селезенки, которые походили из иммунизированных мышей Balb/c дикого типа, и клеток миеломы мыши P3X63Ag8.653 (клетки Р3). Слияние клеток проводили с использованием оборудования для электрослияния ЕСМ200 (ВТХ Harvard Apparatus) в соответствии со стандартными протоколами. Для каждого слияния на выходе получали более 1000 гибридом. Антитела, продуцированные этими гибридомами, подвергали скринингу и подтверждали анализом FACS, основанном на методе использования денатурированных FOLR 1-положительных и FOLR1-отрицательных клеток. Из более чем 16000 подвергшихся скринингу гибридом, обнаружили 14 гибридом, которые были положительные по результатам скрининга FACS. Все положительные гибридомы, походили из организмов мышей, иммунизированных рекомбинантным белком FOLR1 человека-IgG2a Fc мыши.
[0347] Из 14 гибридом, которые первоначально были положительными по результатам скрининга FACS, только десять показали достаточную концентрацию IgG для дальнейшего анализа.
Пример 2. Иммуногистохимическая оценка супернатантов гибридом.
[0348] Десять из первоначальных 14 гибридом проанализировали методом ИГХ. Анализ выполняли с использованием автоматизированного устройства для окрашивания Leica Bond RX и реактивов и условий, перечисленных в табл. 9.
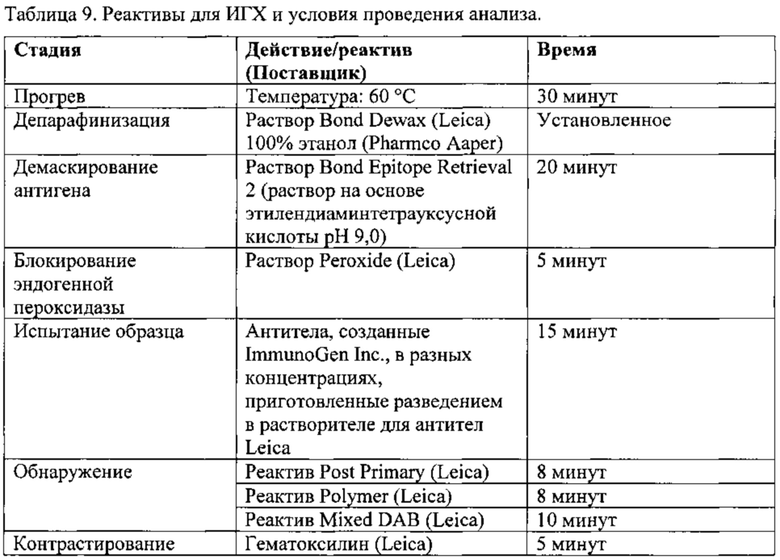
[0349] Слайды, содержащие фиксированные формалином залитые парафином (ФФЗП) клетки, нормальные ткани, биоптаты опухолей легких пациентов и биоптаты опухолей яичников пациентов прогревали при 60°С и депарафинизировали с использованием раствора Bond Dewax и 100% этанола. Индуцированное нагреванием демаскирование эпитопов с использованием раствора Bond Epitope Retrieval 2 (раствор на основе этилендиаминтетрауксусной кислоты рН 9,0) выполняли в течение 20 минут, а эндогенную пероксидазу блокировали раствором peroxide в течение 5 минут. Слайды инкубировали с антителами, созданными ImmunoGen Inc., или контрольными антителами muIgG1 Leica/Novocastra в разных концентрациях в течение 15 минут. Связанные антитела выявляли инкубацией с системой для обнаружения Leica Bond Refine. После нанесения антител, слайды инкубировали с реактивом Post Primary (антитело кролика-IgG мыши) в течение 8 минут, реактивом Polymer (полимер антител козла-кролика) в течение 8 минут и DAB (тетрагидрохлорид 3,3-диаминобензидина) в течение 10 минут, что привело к получению сигнала коричневого окрашивания. Слайды контрастировали гематоксилином в течение 5 минут.
[0350] ФФЗП образцы тканей происходили из блоков тканей человека, полученных от компании Proteogenex и Сети по вопросам тканей человека (CHTN), как отмечено ниже. ФФЗП образцы клеток происходили из линии клеток KB, поставляемой Американской коллекцией тканевых культур. Слайды, содержащие срезы образцов, готовили из ФФЗП блоков с использованием микротома, установленного на 5 мкм, и помещали на положительно заряженные слайды. Перед окрашиванием этим слайдам давали возможность высохнуть на воздухе в течение ночи.

[0351] Определяли показатели интенсивности окрашивания FOLR1 и профилей распределения относительно контрольного окрашивания IgG (неспецифическим). Показатели интенсивности определяли по шкале от 0 до 3, где 0 = окрашивания нет, 1 = слабое окрашивание, 2 = умеренное окрашивание и 3 = сильное окрашивание. Показатель однородности окрашивания определяли как отрицательный (клетки не проявили положительного окрашивания), фокальный (окрашено <25% клеток), гетерогенный (окрашено 25-75% клеток) и гомогенный (окрашено >75% клеток). Интенсивность окрашивания и шкалы определения показателей описаны ниже. Все результаты окрашивания оценивались сертифицированным патологом Комиссии.

Процесс отбора с использованием ИГХ для идентификации гибридом(ы) для ИГХ анализа ФФЗП FOLR1.
[0352] Методом ИГХ оценивали первичные клоны, положительные по результатам FACS на FOLR1-положительные денатурированные клетки (всего десять клонов). Два клона получены из слияния 352 (клоны 352.1 и 352.2). Шесть клонов получены из слияния 353 (клоны 353.1, 353.2, 353.3, 353.5, 353.9, 353.15), а два клона, получены из слияния 354 (клоны 354.1 и 354.2). Супернатанты гибридом собирали из культивированных клеток гибридом и использовали в анализе. Концентрации антител в супернатантах гибридом определяли методом ИФА с использованием антимышиного специфического к L-цепям поликлонального антитела для захвата мышиного моноклонального антитела из супернатанта и антимышиного Fc-специфического поликлонального антитела для обнаружения захваченного антитела; образец мышиного моноклонального IgG1 с известной концентрацией использовали в качестве стандарта для расчета концентрации IgG. Как показано, среда для культивирования клеток (неразбавленная) не мешала методам ИГХ окрашивания (когда среда использовалась вместо первичного антитела, то не было отмечено появление фонового/неспецифического окрашивания). Десять супернатантов (IMGN 352.1, 352.2, 353.1, 353.2, 353.3, 353.5, 353.9, 353.15, 354.1 и 354.2), разведенных в разных концентрациях вплоть до 10 мкг/мл в растворителе для антител Leica, окрашивали с использованием известных положительных контрольных образцов по FOLR1 (нормальное легкое человека, полученное от пациента с серозной папиллярной аденокарциномой, и клетки KB) и оценивали для идентификации потенциальных положительных клонов (клоны, отображающие на FOLR1-положительных образцах приемлемое мембранное окрашивание и специфичность). Пять из десяти клонов проявили приемлемое мембранное окрашивание в FOLR1-положительных образцах и хорошую специфичность. Подходящая концентрация для окрашивания была экспериментально определена для каждого из пяти потенциальных клонов следующим образом: 353.1 (0,7 мкг/мл), 353.2 (2,3 мкг/мл), 353.3 (2,3 мкг/мл), 353.5 (2 мкг/мл и 10 мкг/мл) и 353.9 (2 мкг/мл и 10 мкг/мл). Из оставшихся 5 клонов, клон 353.15 (окрашенный при 2 и 10 мкг/мл) проявил приемлемое мембранное окрашивание в клетках KB и ткани нормального легкого; однако, цитоплазматическое окрашивание наблюдалось только в испытуемой ткани опухоли яичника пациента. Клоны 352.1, 352.2 и 354.1 не проявили видимого окрашивания в любых образцах, а клон 354.2 проявил только явное неспецифическое цитоплазматическое окрашивание, все результаты признаны неприемлемыми.
[0353] Дополнительно клонировали пять потенциальных клонов. Успешно идентифицировали субклоны для четырех клонов (353.2, 353.3, 353.5 и 353.9), для клона 353.1 не было создано ни одного клона. Всего очистили восемь субклонов. Два субклона получены из клона 353.5 (353.5-7 и 353.5-10). Два субклона получены из клона 353.9 (353.9-20 и 353.9-21). Два субклона получены из клона 353.3 (353.3-8 и 353.3-9), и два субклона получены из клона 353.2 (353.2-1 и 353.2-12). (Следует отметить, что эти субклоны также названы, соответственно, 5.7, 5.10, 9.20, 9.21, 3.8, 3.9, 2.1 и 2.12). Определение ИГХ характеристик субклонов выполняли с использованием методик, описанных выше (табл. 9, реактивы для ИГХ и условия проведения анализа) при концентрациях антител 2 и 10 мкг/мл. Для восьми субклонов также провели секвенирование как описано в примере 3, ниже. Потенциальные субклоны дополнительно оценивали для идентификации и ранжирования оптимального мембранного окрашивания и специфичности следующим образом: [353.2-1, 353.2-12], [353.9-20, 353.9-21], [353.5-7,353.5-10] и [353.3-8, 353,3-9] и выбирали для дополнительного определения характеристик (субклоны заключены вместе в квадратные скобки в соответствии с идентичностью последовательностей, как описано в примере 3).
[0354] Два субклона отбирали для дополнительной оптимизации ИГХ анализа: 353.2-1 и 353.9-20. Оба антитела применяли для окрашивания нормального легкого человека, нормальной слюнной железы человека, нормальной поджелудочной железы человека, биоптатов рака яичников пациентов, биоптатов немелкоклеточного рака легких (НМРЛ) пациентов и биоптатов светлоклеточной карциномы почек пациентов. При оптимальных условиях (см. табл. 12 ниже и фиг. 13) оба субклона проявили специфическое и надлежаще чувствительное окрашивание как нормальных тканей человека, так и опухолевых тканей пациентов. Протоки поджелудочной железы, респираторный эпителий нормальных легких и промежуточные протоки проявили положительное ассоциированное с мембранами окрашивание. Ацинарные клетки/островки поджелудочной железы, межальвеолярная ткань легкого и ацинарные клетки слюнной железы, предположительно являясь отрицательными, не проявили положительного окрашивания с любым субклоном. Опухолевые клетки рака яичников, НМРЛ и светлоклеточной карциномы почек, предположительно являясь положительными, проявили положительное ассоциированное с мембранами окрашивание, которое было локализовано в опухолевых клетках. Субструктуры опухолей, предположительно являясь отрицательными (строма, сосуды и лимфоциты), не проявили положительного окрашивания с 353.2-1 или 353.9-20. Результаты дополнительного окрашивания нормальных тканей с помощью 353-2.1 (FOLR1-2.1) собраны в табл. 13 ниже и показаны на фиг. 14. В своей совокупности, данные по определению ИГХ характеристик предполагают, что антитела 353.2-1 и 353.9-20 являются специфическими к FOLR1 в ФФЗП тканях (см. фиг. 1 и фиг. 2).


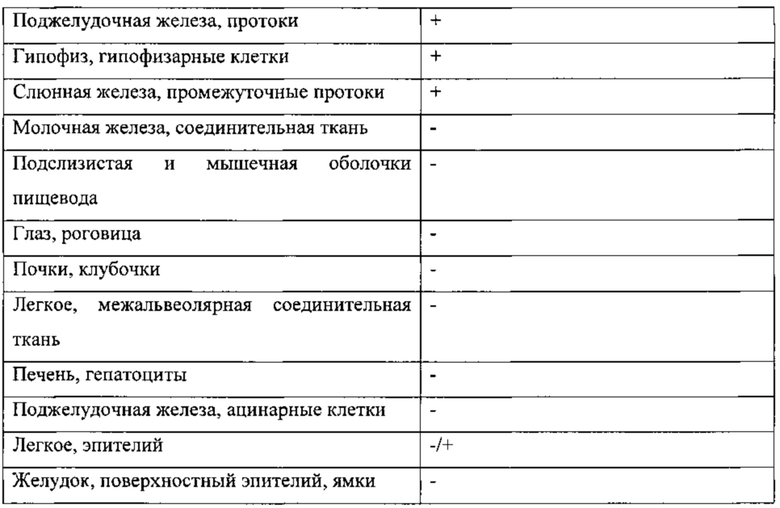
Пример 3. Определение характеристик выбранных анти-FOLR1 антител.
[0355] Как описано выше в примере 2 из четырнадцати клонов гибридом, выбранных на основе первичного и подтверждающего скрининга FACS, десять первичных клонов проанализировали иммуногистохимическим (ИГХ) анализом. Из десяти первичных клонов (т.е. 352.1, 352.2, 353.1, 353.2, 353.3, 353.5, 353.9, 353.15, 354.1 и 354.2) пять были положительными по результатам ИГХ анализа (т.е. 353.1, 353.2 и 353.3, 353.5 и 353.9) и все пять получены от одного и того же слияния (слияние 353). Четыре из пяти клонов успешно субклонировали. Выбрали один субклон первичного клона 353.2 и назвали его 353.2-1 («2.1»). Выбрали один субклон первичного клона 353.3 и назвали его 353.3-8 («3.8»). Выбрали один субклон первичного клона 353.5 и назвали его 353.5-7 («5.7»), и выбрали два субклона первичного клона 353.9 и назвали их 353.9-20 («9.20») и 353.9-21 («9.21»). Для субклонов 9.20 и 9.21 провели секвенирование и, как ожидалось, оба субклона имели одну и ту же последовательность. В дополнение к этому, двое из клонов, 2.1 и 9.20, депонировали в АТСС 16 апреля 2013 г., соответственно, как РТА-120197 и РТА-120196.
Специфичность анти-FOLR1 антител, определенная методом вестерн-блот.
[0356] Специфичность созданных антител проанализировали методом вестерн-блот с набором лизатов клеток, приготовленных из FOLR1-положительных (Igrov-1, Ovcar-3, Caov-3, Wish и Skov-3) и FOLR1-отрицательных (ВхРС3, Panc-1 и ASPC1) линий клеток. Для проведения анализа с лизатами проводили электрофорез в полиакриламидном геле с ДСН и результаты переносили стандартными процедурами на нитроцеллюлозную мембрану. Мембрану инкубировали с анти-FOLR1 антителами по данному изобретению и образовавшиеся комплексы антиген-антитело выявляли вторичными антимышиными антителами, конъюгированными с пероксидазой хрена (hrp) (фиг. 3). Все исследованные анти-FOLR1 антитела узнавали FOLR1 в линиях клеток с высокими уровнями экспрессии FOLR1 (т.е. Igrov-1 и Wish). FOLR1 в линиях клеток с низкой экспрессией Ovcar-3, Caov-3 и Skov-3 выявляли только анти-FOLR1 клонами 2.1 и 9.21; клоны 3.8 и 5.7 не окрашивали эти лизаты клеток, вероятно, из-за недостаточной чувствительности антител. Этими клонами не выявлено дополнительных неспецифических полос для FOLR1-положительных линий клеток; не наблюдалось окрашивания для FOLR1-отрицательных линий клеток.
Связывание анти-FOLR1 антител с денатурированными и неденатурированными клетками.
[0357] Способность анти-FOLR1 антител связываться с денатурированным и неденатурированным (нативная конформация) FOLR1 проанализировали методом опосредованного FACS с FOLR1-положительными клетками KB и T47D. Клетки собирали раствором Версена и промывали фосфатно-солевым буферным раствором (PBS). Денатурированные клетки получали инкубацией клеток в PBS, содержавшем 10% формальдегида, при 4°С в течение ночи с последующей промывкой PBS и инкубацией при 95°С в течение 30 мин. Потом денатурированные и неденатурированные клетки инкубировали с анти-FOLR1 антителами, разведенными в буферном растворе для FACS (среда RPMI-1640 с добавлением 2% нормальной сыворотки козла), на льду в течении 2 часов. Клетки центрифугировали, промывали PBS и инкубировали в течение 40 мин с FITC-конъюгированным антителом козла против антитела-IgG мыши. Клетки центрифугировали снова, промывали PBS и ресуспендировали в 0,2 мл PBS, содержавшего 1% формальдегид. Ассоциированную с клетками флуоресценцию измеряли с использованием проточного цитометра FACSCalibur с многолуночным самплером HTS и анализировали с использованием CellQuest Pro (BD Biosciences, г. Сан-Диего, США). Как показано на фиг. 4, все анти-FOLR1 антитела связывались как с денатурированными, так и с неденатурированными клетками.
Аффинность анти-FOLR1 антител, определенная методом ИФА.
[0358] Аффинность связывания анти-FOLR1 антител проверяли методом ИФА, в котором в качестве антигена использовали рекомбинантный белок FOLR1 человека-Fc2a мыши. Рекомбинантный белок иммобилизировали на планшетах для микротитрования и на планшеты в диапазоне концентраций добавляли антитела. Планшеты инкубировали в течение двух часов при комнатной температуре, промывали PBS с добавкой 0,05% Твин-20 и инкубировали с hrp-меченым антителом козла против вторичного антитела мыши в течение одного часа при комнатной температуре. Планшеты снова промывали PBS/Твин-20 и связанное hrp-конъюгированное антитело выявляли добавлением hrp-субстрата ТМБ (Bio-FX). Репрезентативные результаты показаны на фиг. 5. Анти-FOLR1 антитела имели сходную аффинность к FOLR1 человека при полумаксимальной эффективной концентрации (ЕС50) от 0,5 до 0,9 нМ.
Отсутствие перекрестной реактивности анти-FOLR1 антител с FOLR2 и FOLR3.
[0359] FOLR1 является представителем семейства рецепторов фолиевой кислоты. Перекрестную реактивность анти-FOLR1 антител с другими представителями семейства FOLR2 и FOLR3 проанализировали методом ИФА. Рекомбинантный белок FOLR2-His или FOLR3-His (R&D Systems) иммобилизировали с планшетами Ni-NTA (QIAGEN), на планшеты добавляли анти-FOLR1 антитела и инкубировали в течение 2 часов при комнатной температуре. В качестве положительных контролей для FOLR2 и FOLR3 применяли, соответственно, поликлональные анти-FOLR2 и FOLR3-антитела для ИФА (R&D systems). Образовавшиеся комплексы антитело-антиген выявляли с hrp-меченым антителом козла против вторичного антитела мыши. Как показано на фиг. 6, анти-FOLR1 антитела по данному изобретению не связывались с FOLR2 или FOLR3; только контрольные антитела выявили соответствующие антигены.
Пример 4. Определение характеристик антигенного эпитопа.
[0360] У FOLR1 человека имеется три потенциальных сайта для N-гликозилирования в положениях 69, 161 и 201 (UniProt) и, как сообщалось в литературе, все три сайта являются гликозилированными. Для определения характеристик природы эпитопа, узнаваемого анти-FOLR1 антителами, описанными в данном документе, эксперименты по связыванию выполняли с дегликозилированным и необработанным рецептором. Из созданных анти-FOLR1 клонов в исследовании использовали только клон 2.1 из-за того, что на основании данных секвенирования клоны являются родственными и вероятно связываются с одним и тем же эпитопом. В дополнение к клону 2.1, двое других анти-FOLR1 антител включали: huMov19 (WO 2011/106528) и клон BN3.2 (Leica). Для того, чтобы дегликозилировать FOLR1, рекомбинантный FOLR1 человека или лизаты FOLR1-положительных клеток KB или Igrov-1 обрабатывали смесью ферментов для дегликозилирования (ферментативный набор DeGlycoMX, QA-bio) в соответствии с протоколом производителя. Потом образцы обработанных и необработанных FOLR1 использовали в ИФА и анализе вестерн-блот. Для проведения ИФА дегликозилированные и необработанные FOLR1 иммобилизировали на планшеты для ИФА (Immulon) и добавляли анти-FOLR1 антитела FRIHC2-1 («2.1») или huMov19. Через 2 ч инкубации комплексы антитело-антиген выявляли с hrp-меченым антителом козла против антитела человека (для huMov19) или против вторичного антитела мыши (для 2.1) (фиг. 7). Для проведения анализа вестерн-блот образцы дегликозилированных и необработанных лизатов или рекомбинантного белка huFOLR1 разделяли электрофорезом в полиакриламидном геле с ДСН и переносили их стандартными процедурами на нитроцеллюлозную мембрану. Мембрану инкубировали с анти-FOLR1 антителами 2.1, huMov19 или BN3.2 и комплексы антиген-антитело выявляли соответствующими вторичными антимышиными или античеловеческими антителами, конъюгированными с пероксидазой хрена (фиг. 8). Как показано на фиг. 7 и 8 связывание антитела 2.1 с дегликозилированным по сравнению с необработанным FOLR1 было значительно уменьшено, из чего можно предположить, что антитело связывается с гликозависимым эпитопом. В противоположность этому, два других анти-FOLR1 антитела, huMov19 и BN3.2, сходным образом связывались с дегликозилированным и необработанным рецептором, что указывает на то, что (i) белок FOLR1 не был поврежден при процедуре дегликозилирования и (ii) huMov19 и BN3.2 узнают белковые эпитопы FOLR1.
Пример 5. Клонирование и секвенирование участков VL и VH античеловеческих FOLR1 -антител.
[0361] Суммарную клеточную РНК получали из 5×106 клеток FOLR1-гибридом, описанных в примере 1, с использованием набора RNeasy (QIAgen) в соответствии с протоколом производителя. После этого из суммарной РНК синтезировали кДНК восьми субклонов клонов (2.1, 2.12, 3.8, 3.9, 5.7, 5.10, 9.20 и 9.21) с использованием набора для синтеза кДНК Superscript II (Invitrogen).
[0362] Процедуры ПЦР для амплификации кДНК вариабельных участков антител, происходящих из клеток гибридом, основывались на способах, описанных в статьях Wang et al. ((2000) J Immunol Methods. 233: 167-77) и Co et al. ((1992) J Immunol. 148: 1149-54). Последовательности вариабельной легкой цепи (VL) и вариабельной тяжелой цепи (VH) амплифицировали с помощью вырожденных праймеров на 5'-конце и специфических праймеров, или мышиного каппа или константного участка IgG1, соответственно на 3'-конце. Потом проводили ПЦР-реакции на 1% легкоплавком агарозном геле с последующим вырезанием полос ампликонов от 300 до 400 п.н., которые впоследствии очищали с использованием миниколонок для ДНК компании Zymo. Очищенные ампликоны отправляли в компанию Beckman Coulter Genomics для секвенирования, используя такие же 5'- и 3'-праймеры ПЦР-реакций для того, чтобы создать последовательности кДНК вариабельных участков в обоих направлениях.
[0363] Поскольку для клонирования последовательностей кДНК VL и VH использовались вырожденные праймеры, изменяющие 5'-конец, то потребовались дополнительные исследования по секвенированию, чтобы проверить полные последовательности кДНК. Предварительные последовательности вводили в поисковый запрос на сайт IgBlast NCBI (www.ncbi.nlm.nih.gov/igblast/) для идентификации последовательностей мышиной зародышевой линии, из которой происходили последовательности антител. Потом конструировали ПЦР-праймеры для отжига со связанной с зародышевой линией лидерной последовательностью мышиного антитела так, чтобы эта новая ПЦР-реакция могла на выходе дать полную последовательность кДНК вариабельного участка, неизмененную применением ПЦР-праймеров. ПЦР-реакции, очищение полос и секвенирование выполняли, как описано выше.
Определение масс для подтверждения последовательностей.
[0364] Последовательности кДНК вариабельных участков, полученные для каждого из анти-FOLR1 антител, объединяли с последовательностями константного участка зародышевой линии для получения последовательностей кДНК полноразмерных антител. Потом рассчитывали молекулярные массы тяжелой и легкой цепей для результатов трансляций последовательностей кДНК и сравнивали их с молекулярными массами, полученными ЖХ/МС-анализами очищенных мышиных анти-FOLR1 антител. ЖХ/МС-анализ выполняли дегликозилированием и восстановлением антитела для выделения полных цепей пептидов легкой и тяжелой цепи. Наблюдаемые молекулярные массы для каждой из тяжелых цепей совпадали с ожидаемыми, но для каждой из легких цепей было несоответствие на приблизительно 85 Да. Последующий анализ фрагментации пептидов методом ЖХ/МС фрагментов легких цепей показал, что концевой серии лидерного пептида легкой цепи фактически сохранялся на зрелой легкой цепи, добавляя около 87 Да к ожидаемой ММ, следовательно, получено подтверждение последовательности кДНК для каждого из FOLR1-антител.
Составные последовательности CDR для анти-FOLR1 антител.
[0365] Выравнивания последовательностей антител для 8 субклонов выявили, что 3 из 4 исходных гибридом продуцировали близкородственные, но уникальные антитела. Как ожидалось, все из 4 пар дочерних субклонов были идентичными. В дополнение к этому два набора субклонов также дали идентичные результаты в виде 3 уникальных последовательностей антител (SEQ ID №: 27-32) (2.1, 5.7 и 9.20). Вариабельные каркасные последовательности легких и тяжелых цепей этих 3 уникальных антител являются близкородственными, но каждое антитело содержит уникальные CDR, вероятно в результате соматических аминокислотных замен (см. ниже табл. 14). Благодаря тому, что обнаружено, что эти варианты CDR мышиных анти-FOLR1 антител являются функционально идентичными, то они дают некоторое структурное понимание пластичности последовательностей CDR анти-FOLR1 антител по данному изобретению. CDR 2 и 3 легких цепей в каждом из антител были идентичными, что дает возможность предположить, что эти сильно консервативные CDR могут обеспечивать согласованную структурную основу для связывания FOLR1. С другой стороны, аминокислотные замены в оставшихся CDR, особенно в CDR 2 и 3 тяжелых цепей, позволяют предположить, что эти положения являются критическими для улучшения аффинности и специфичности этих антител. Специфические замены остатков в этих положениях CDR также представляют примеры остатков, которые могут включаться в конструируемые версии этих антител. В табл. 14 представлены перечни составных последовательностей CDR, скомпилированных из анти-FOLR1 антител по данному изобретению. Составные CDR, идентифицированные в данном документе, могут использоваться для разработки рекомбинантных антител, которые, как предполагается, могут сохранять функциональные атрибуты анти-FOLR1 антител по данному изобретению.


Гуманизация антител.
[0366] Антитела FRIHC2-1 гуманизировали, следуя описанным ранее способам изменения поверхности, таким как, к примеру, в статях Roguska et al., Proc. Natl. Acad. Sci., USA, 91(3): 969-973 (1994) и Roguska et al., Protein Eng. 9(10): 895-904 (1996), которые включены в данный документ в полном объеме посредством ссылки. Изменение поверхности включает идентификацию поверхностных остатков каркаса вариабельных участков в обеих тяжелой и легких цепях и замену их эквивалентами человеческого антитела. В антителе с измененной поверхностью сохраняли мышиные CDR. Типичные CDR антитела FRIHC2-1 определяли как указано в табл. 14. Для минимизации осложнений относительно влияния конъюгирующих лизинов, которые попадали в CDR, лизин 24 и лизин 27 в CDR1 легкой цепи мышиного антитела FRIHC2-1 заменяли для гуманизированной версии 1.0 аргинином (показано курсивом), таким образом даны обе версии LC CDR1. В дополнение к определению CDR2 тяжелых цепей по AbM, примененному для изменения поверхности, в таблице представлены типичные CDR2 тяжелых цепей, определенных по Кабату, для обеих мышиной и человеческой версий антитела FRIHC2-1. Подчеркнутая последовательность отмечает часть CDR2 тяжелой цепи по Кабату, которая не рассматривалась как CDR для изменения поверхности.
[0367] Положения поверхностных остатков определяли как любое положение с относительной доступностью равной 30% или больше (Pedersen J.T. et. Al, J. Mol. Biol. 1994; 235: 959-973). Рассчитанные поверхностные остатки потом подвергали выравниванию с поверхностными последовательностями зародышевой линии человека для идентификации наибольшей гомологичной поверхностной последовательности человека. В качестве замены поверхности для доменов VL антитела FRIHC2-1 использовали последовательность зародышевой линии человека IGKV2-30*01, тогда как для замены поверхности для VH антитела FRIHC2-1 использовали IHV1-69*10. Изменения специфических остатков каркасной поверхности для антитела FRIHC2-1 даны на фиг. 9. Поскольку в предпочитаемой версии легкая цепь с измененной поверхностью включала замены лизинов CDR1, также была создана версия с измененной поверхностью (v1.01) с лизинами антитела мыши, сохраненными в CDR-L1. На фиг. 10 показано выравнивание последовательностей измененных поверхностей для вариабельного домена FRIHC2-1 обеих легкой и тяжелой цепи с их мышиными эквивалентами последовательностей.
[0368] В дополнение к гуманизации путем изменения поверхности вариабельных доменов, антитело FRIHC2-1 также гуманизировали в соответствии с технологией прививания определяющих комплементарность участков (CDR) (Jones et al., Nature 321: 604-608 (1986) и Verhoeyen et al., Science 239: 1534-1536 (1988)). Способ CDR-прививания заключается в переносе CDR из образовавшегося в естественных условиях антитела мыши на каркасные участки Fv (FR) антитела человека. Для CDR-прививания антитела FRIHC2-1 использовали схему нумерации Кабат и определения CDR по Кабату. Типичные CDR FRIHC2-1 для CDR-прививания даны в табл. 14. Последовательность иммуноглобулина зародышевой линии человека с наибольшей гомологией к антителу FRIHC2-1 мыши идентифицировали с помощью интерактивного средства, V-QUEST, Международной информационной системы ImMunoGeneTics® (IMGT (http://imgt.cines.fr/), как описано в статье Lefranc, Nucleic Acids Res. 29: 207-209 (2001). В качестве акцепторных каркасов для VL- и VH-доменов антитела FRIHC2-1 использовали, соответственно, последовательности зародышевой линии человека IGKV2D-29*02 и IGHV1-2*02. Для минимизации осложнений относительно влияния конъюгирующих лизинов, которые попадали в CDR, лизин 24 и лизин 27 в CDR1 легкой цепи мышиного антитела FRIHC2-1 заменяли в CDR-привитых конструкциях аргинином (табл. 15). Изменения специфических каркасных остатков, а также замена в CDR-L1 в CDR-прививаемом антителе FRIHC2-1 даны на фиг. 11, а результаты выравниваний CDR-привитых последовательностей для вариабельных доменов антитела FRIHC2-1 с их мышиными эквивалентами последовательностей проиллюстрированы на фиг. 12.
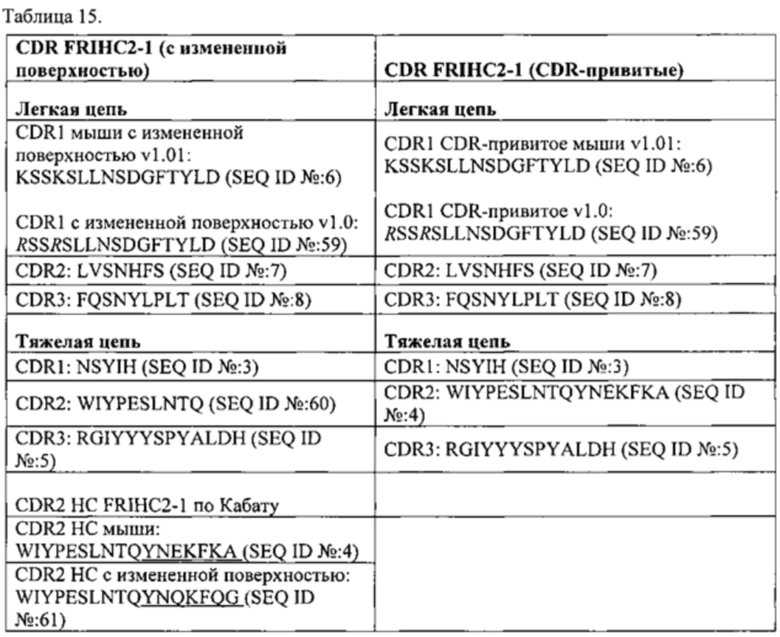
Пример 6. ИГХ оценка антитела 353-2.1 (FOLR1-2.1) с использованием опухолевых образцов человека.
[0369] Репрезентативные опухолевые образцы человека рака яичников (n=63), аденокарциномы легких (n=104) и аденокарциномы эндометрия (n=58) оценивали на экспрессию FOLR1 методом ИГХ с использованием антитела 353-2.1. Интенсивность окрашивания FOLR1 и распределение показателей собраны ниже в табл. 16. На фиг. 15 показан пример окрашивания ткани опухоли яичников и аденокарциномы легкого антителом 353-2.1. Эти результаты демонстрируют полезность 353-2.1 как специфического и чувствительного антитела для применения в ИГХ методах анализа для идентификации пациентов как потенциальных кандидатов для терапии FOLR1-таргетирующими агентами (например, IMGN853).

[0370] Уникальная антигенная специфичность и высокая аффинность связывания антитела FOLR1-2.1 (FOLR1 353-2.1) дополнительно продемонстрирована с использованием дополнительного ИГХ анализа. В этом ИГХ анализе использовали набор для обнаружения DAB OptiView на автоматизированном устройстве для окрашивания слайдов Ventana BenchMark XT для полуколичественного определения экспрессии белка FOLR1 в фиксированных формалином залитых парафином образцах тканей. Анализ оптимизировали и валидировали в отношении специфичности, чувствительности и прецизионности с использованием контролей нормальных и опухолевых тканей. В оптимизированных условиях на опухолевых клетках наблюдали четкое мембранное окрашивание, тогда как нормальные стромальные ткани были полностью отрицательными (фиг. 16). Дополнительно в этом анализе также достигнут более широкий динамический диапазон, что тем самым позволяет получить лучшее различение интенсивности умеренного окрашивания (уровень 2, коричневое окрашивание среды, фиг. 17) от наиболее сильной интенсивности окрашивания (уровень 3, темно-коричневое окрашивание среды, фиг. 17). Увеличенный динамический диапазон улучшает возможность ранжирования FOLR1-положительных образцов на основании интенсивности окрашивания и дает возможность проводить дополнительную идентификацию субпопуляции пациентов с наивысшим уровнем экспрессии FOLR1.
[0371] Сравнивали антитело BN3.2 (Leica) и антитело FOLR1-2.1 (FOLR1 353-2.1) с использованием микроанализа (ТМА) ткани опухоли яичников. Используя антитело BN3.2 (Leica) в ИГХ анализе (анализ с BN3.2) около 50% образцов (16 из 35) были отнесены к наивысшей категории (уровень 3 интенсивности окрашивания по меньшей мере 25% опухолевых клеток). В противоположность этому, применение антитела FOLR1-2.1 (FOLR1 353-2.1) в ИГХ анализе, описанном выше, при использовании набора для обнаружения DAB OptiView на автоматизированном устройстве для окрашивания слайдов Ventana BenchMark XT (анализ с FOLR1-2.1), позволило провести дополнительное разделение этих 16 образцов на 2 разные категории: 6 определено в наивысшую категорию (уровень 3 интенсивности окрашивания по меньшей мере 25% опухолевых клеток, табл. 17), а остальные 10 - во вторую наивысшую категорию (уровень 2 интенсивности окрашивания по меньшей мере 25% опухолевых клеток, табл. 17). Таким образом, более адекватное окрашивание, полученное с антителом FOLR 1-2.1 в анализе с FOLR1-2.1, позволяет различать сгруппированные все вместе образцы, определенные с использованием антител BN3.2 в анализе с BN3.2 как образцы с уровнем экспрессии 3.
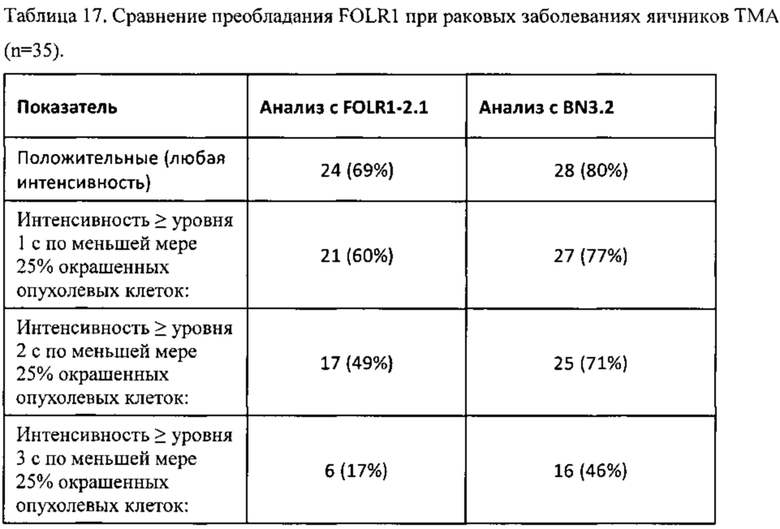
[0372] Все публикации, патенты, патентные заявки, интернет-сайты и номера доступа/последовательности баз данных (включая полинуклеотидные и полипептидные последовательности), цитируемые в данном документе, тем самым включены в полном объеме посредством ссылки во всех смыслах в той же степени, как если бы каждая индивидуальная публикация, патент, патентная заявка, интернет-сайт или номер доступа/последовательность баз данных была конкретно и самостоятельно указана для того, чтобы таким образом быть включенной посредством ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> IMMUNOGEN, INC. AB, OLGA TAVARES, DANIEL SETIADY, JULIANTO LADD, SHARRON CARRIGAN, CHRISTINA N RUI, LINGYUN
<120> АНТИТЕЛА И МЕТОДЫ АНАЛИЗА ДЛЯ ОБНАРУЖЕНИЯ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1
<130> 2921.044PC03/EKS/CLD
<140> Должен быть назначен
<141> 2014-08-29
<150> 61/940,184
<151> 2014-02-14
<150> 61/875,475
<151> 2013-09-09
<150> 61/872,407
<151> 2013-08-30
<160> 75
<170> PatentIn version 3.5
<210> 1
<211> 257
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Ala Gln Arg Met Thr Thr Gln Leu Leu Leu Leu Leu Val Trp Val
1 5 10 15
Ala Val Val Gly Glu Ala Gln Thr Arg Ile Ala Trp Ala Arg Thr Glu
20 25 30
Leu Leu Asn Val Cys Met Asn Ala Lys His His Lys Glu Lys Pro Gly
35 40 45
Pro Glu Asp Lys Leu His Glu Gln Cys Arg Pro Trp Arg Lys Asn Ala
50 55 60
Cys Cys Ser Thr Asn Thr Ser Gln Glu Ala His Lys Asp Val Ser Tyr
65 70 75 80
Leu Tyr Arg Phe Asn Trp Asn His Cys Gly Glu Met Ala Pro Ala Cys
85 90 95
Lys Arg His Phe Ile Gln Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn
100 105 110
Leu Gly Pro Trp Ile Gln Gln Val Asp Gln Ser Trp Arg Lys Glu Arg
115 120 125
Val Leu Asn Val Pro Leu Cys Lys Glu Asp Cys Glu Gln Trp Trp Glu
130 135 140
Asp Cys Arg Thr Ser Tyr Thr Cys Lys Ser Asn Trp His Lys Gly Trp
145 150 155 160
Asn Trp Thr Ser Gly Phe Asn Lys Cys Ala Val Gly Ala Ala Cys Gln
165 170 175
Pro Phe His Phe Tyr Phe Pro Thr Pro Thr Val Leu Cys Asn Glu Ile
180 185 190
Trp Thr His Ser Tyr Lys Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg
195 200 205
Cys Ile Gln Met Trp Phe Asp Pro Ala Gln Gly Asn Pro Asn Glu Glu
210 215 220
Val Ala Arg Phe Tyr Ala Ala Ala Met Ser Gly Ala Gly Pro Trp Ala
225 230 235 240
Ala Trp Pro Phe Leu Leu Ser Leu Ala Leu Met Leu Leu Trp Leu Leu
245 250 255
Ser
<210> 2
<211> 771
<212> ДНК
<213> Homo sapiens
<400> 2
atggctcagc ggatgacaac acagctgctg ctccttctag tgtgggtggc tgtagtaggg 60
gaggctcaga caaggattgc atgggccagg actgagcttc tcaatgtctg catgaacgcc 120
aagcaccaca aggaaaagcc aggccccgag gacaagttgc atgagcagtg tcgaccctgg 180
aggaagaatg cctgctgttc taccaacacc agccaggaag cccataagga tgtttcctac 240
ctatatagat tcaactggaa ccactgtgga gagatggcac ctgcctgcaa acggcatttc 300
atccaggaca cctgcctcta cgagtgctcc cccaacttgg ggccctggat ccagcaggtg 360
gatcagagct ggcgcaaaga gcgggtactg aacgtgcccc tgtgcaaaga ggactgtgag 420
caatggtggg aagattgtcg cacctcctac acctgcaaga gcaactggca caagggctgg 480
aactggactt cagggtttaa caagtgcgca gtgggagctg cctgccaacc tttccatttc 540
tacttcccca cacccactgt tctgtgcaat gaaatctgga ctcactccta caaggtcagc 600
aactacagcc gagggagtgg ccgctgcatc cagatgtggt tcgacccagc ccagggcaac 660
cccaatgagg aggtggcgag gttctatgct gcagccatga gtggggctgg gccctgggca 720
gcctggcctt tcctgcttag cctggcccta atgctgctgt ggctgctcag c 771
<210> 3
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VH-CDR1
<400> 3
Asn Ser Tyr Ile His
1 5
<210> 4
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VH-CDR2
<400> 4
Trp Ile Tyr Pro Glu Ser Leu Asn Thr Gln Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ala
<210> 5
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VH-CDR3
<400> 5
Arg Gly Ile Tyr Tyr Tyr Ser Pro Tyr Ala Leu Asp His
1 5 10
<210> 6
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VL-CDR1
<400> 6
Lys Ser Ser Lys Ser Leu Leu Asn Ser Asp Gly Phe Thr Tyr Leu Asp
1 5 10 15
<210> 7
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VL-CDR2
<400> 7
Leu Val Ser Asn His Phe Ser
1 5
<210> 8
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VL-CDR3
<400> 8
Phe Gln Ser Asn Tyr Leu Pro Leu Thr
1 5
<210> 9
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VH-CDR1
<400> 9
Asn Tyr Tyr Ile His
1 5
<210> 10
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VH-CDR2
<400> 10
Trp Ile Tyr Pro Gly Ser Phe Asn Val Glu Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ala
<210> 11
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VH-CDR3
<400> 11
Arg Gly Ile Tyr Phe Tyr Ser Pro Tyr Ala Leu Asp Tyr
1 5 10
<210> 12
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VL-CDR1
<400> 12
Lys Ser Thr Glu Ser Leu Leu Asn Ser Asp Gly Phe Thr Tyr Leu Asp
1 5 10 15
<210> 13
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VL-CDR2
<400> 13
Leu Val Ser Asn His Phe Ser
1 5
<210> 14
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VL-CDR3
<400> 14
Phe Gln Ser Asn Tyr Leu Pro Leu Thr
1 5
<210> 15
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VH-CDR1
<400> 15
Asn Tyr Tyr Ile His
1 5
<210> 16
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VH-CDR2
<400> 16
Trp Ile Tyr Pro Glu Asn Val Asn Val Arg Tyr Asn Asp Lys Phe Lys
1 5 10 15
Ala
<210> 17
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VH-CDR3
<400> 17
Arg Gly Ile Tyr Tyr Tyr Ser Pro Tyr Ala Met Asp Tyr
1 5 10
<210> 18
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VL-CDR1
<400> 18
Lys Ser Thr Lys Ser Leu Leu Asn Ser Asp Gly Phe Thr Tyr Leu Asp
1 5 10 15
<210> 19
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VL-CDR2
<400> 19
Leu Val Ser Asn His Phe Ser
1 5
<210> 20
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VL-CDR3
<400> 20
Phe Gln Ser Asn Tyr Leu Pro Leu Thr
1 5
<210> 21
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Составной VH-CDR1
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa может быть тирозином или серином
<400> 21
Asn Xaa Tyr Ile His
1 5
<210> 22
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Составной VH-CDR2
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa может быть глицином или глутаматом
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa может быть серином или аспарагином
<220>
<221> misc_feature
<222> (7)..(7)
<223> Xaa может быть фенилаланином или валином или лейцином
<220>
<221> misc_feature
<222> (9)..(9)
<223> Xaa может быть валином или треонином
<220>
<221> misc_feature
<222> (10)..(10)
<223> Xaa может быть глутаматом или аргинином или глутамином
<220>
<221> misc_feature
<222> (13)..(13)
<223> Xaa может быть глутаматом или аспартатом
<400> 22
Trp Ile Tyr Pro Xaa Xaa Xaa Asn Xaa Xaa Tyr Asn Xaa Lys Phe Lys
1 5 10 15
Ala
<210> 23
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Составной VH-CDR3
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa может быть фенилаланином или тирозином
<220>
<221> misc_feature
<222> (11)..(11)
<223> Xaa может быть лейцином или метионином
<220>
<221> misc_feature
<222> (13)..(13)
<223> Xaa может быть тирозином или гистидином
<400> 23
Arg Gly Ile Tyr Xaa Tyr Ser Pro Tyr Ala Xaa Asp Xaa
1 5 10
<210> 24
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Составной VL-CDR1
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa может быть треонином или серином
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa может быть лизином или глутаматом
<400> 24
Lys Ser Xaa Xaa Ser Leu Leu Asn Ser Asp Gly Phe Thr Tyr Leu Asp
1 5 10 15
<210> 25
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Составной VL-CDR2
<400> 25
Leu Val Ser Asn His Phe Ser
1 5
<210> 26
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Составной VL-CDR3
<400> 26
Phe Gln Ser Asn Tyr Leu Pro Leu Thr
1 5
<210> 27
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VH цепь
<400> 27
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Ser
20 25 30
Tyr Ile His Trp Val Lys Lys Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Glu Ser Leu Asn Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Ala Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ser Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Gly Ile Tyr Tyr Tyr Ser Pro Tyr Ala Leu Asp His Trp
100 105 110
Gly Gln Gly Ala Ser Val Thr Val Ser Ser
115 120
<210> 28
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VL цепь
<400> 28
Ser Asp Val Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Ile
1 5 10 15
Gly Asp Gln Ala Ser Ile Ser Cys Lys Ser Ser Lys Ser Leu Leu Asn
20 25 30
Ser Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln
85 90 95
Ser Asn Tyr Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg
<210> 29
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VH цепь
<400> 29
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Ser Phe Asn Val Glu Tyr Asn Glu Lys Phe
50 55 60
Lys Ala Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Val Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Gly Ile Tyr Phe Tyr Ser Pro Tyr Ala Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Ala Ser Val Thr Val Ser Ser
115 120
<210> 30
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VL цепь
<400> 30
Ser Asp Val Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Ile
1 5 10 15
Gly Asp Gln Ala Ser Ile Ser Cys Lys Ser Thr Glu Ser Leu Leu Asn
20 25 30
Ser Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln
85 90 95
Ser Asn Tyr Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Val
100 105 110
Lys Arg
<210> 31
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VH цепь
<400> 31
Gln Val Gln Leu Gln Gln Ser Gly Pro Asp Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Glu Asn Val Asn Val Arg Tyr Asn Asp Lys Phe
50 55 60
Lys Ala Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Gly Ile Tyr Tyr Tyr Ser Pro Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Ala Ser Val Thr Val Ser Ser
115 120
<210> 32
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VL цепь
<400> 32
Ser Asp Val Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu
1 5 10 15
Gly Asp Gln Ala Ser Ile Ser Cys Lys Ser Thr Lys Ser Leu Leu Asn
20 25 30
Ser Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln
85 90 95
Ser Asn Tyr Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg
<210> 33
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 полноразмерная тяжелая цепь
<400> 33
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Ser
20 25 30
Tyr Ile His Trp Val Lys Lys Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Glu Ser Leu Asn Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Ala Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ser Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Gly Ile Tyr Tyr Tyr Ser Pro Tyr Ala Leu Asp His Trp
100 105 110
Gly Gln Gly Ala Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro
115 120 125
Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met
130 135 140
Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Glu Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val
180 185 190
Pro Ser Ser Met Arg Pro Ser Glu Thr Val Thr Cys Asn Val Ala His
195 200 205
Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys
210 215 220
Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
245 250 255
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
260 265 270
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
275 280 285
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
290 295 300
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
305 310 315 320
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
340 345 350
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile
355 360 365
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
370 375 380
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asn Thr Asn
385 390 395 400
Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
405 410 415
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
420 425 430
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 34
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 полноразмерная легкая цепь
<400> 34
Ser Asp Val Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Ile
1 5 10 15
Gly Asp Gln Ala Ser Ile Ser Cys Lys Ser Ser Lys Ser Leu Leu Asn
20 25 30
Ser Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln
85 90 95
Ser Asn Tyr Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser
115 120 125
Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn
130 135 140
Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu
145 150 155 160
Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr
180 185 190
Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr
195 200 205
Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215 220
<210> 35
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 полноразмерная тяжелая цепь
<400> 35
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Ser Phe Asn Val Glu Tyr Asn Glu Lys Phe
50 55 60
Lys Ala Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Val Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Gly Ile Tyr Phe Tyr Ser Pro Tyr Ala Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Ala Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro
115 120 125
Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met
130 135 140
Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Glu Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val
180 185 190
Pro Ser Ser Met Arg Pro Ser Glu Thr Val Thr Cys Asn Val Ala His
195 200 205
Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys
210 215 220
Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
245 250 255
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
260 265 270
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
275 280 285
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
290 295 300
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
305 310 315 320
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
340 345 350
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile
355 360 365
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
370 375 380
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asn Thr Asn
385 390 395 400
Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
405 410 415
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
420 425 430
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 36
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 полноразмерная легкая цепь
<400> 36
Ser Asp Val Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Ile
1 5 10 15
Gly Asp Gln Ala Ser Ile Ser Cys Lys Ser Thr Glu Ser Leu Leu Asn
20 25 30
Ser Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln
85 90 95
Ser Asn Tyr Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Val
100 105 110
Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser
115 120 125
Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn
130 135 140
Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu
145 150 155 160
Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr
180 185 190
Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr
195 200 205
Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215 220
<210> 37
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 полноразмерная тяжелая цепь
<400> 37
Gln Val Gln Leu Gln Gln Ser Gly Pro Asp Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Glu Asn Val Asn Val Arg Tyr Asn Asp Lys Phe
50 55 60
Lys Ala Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Gly Ile Tyr Tyr Tyr Ser Pro Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Ala Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro
115 120 125
Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met
130 135 140
Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Glu Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val
180 185 190
Pro Ser Ser Met Arg Pro Ser Glu Thr Val Thr Cys Asn Val Ala His
195 200 205
Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys
210 215 220
Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
245 250 255
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
260 265 270
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
275 280 285
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
290 295 300
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
305 310 315 320
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
340 345 350
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile
355 360 365
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
370 375 380
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asn Thr Asn
385 390 395 400
Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
405 410 415
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
420 425 430
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 38
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 полноразмерная легкая цепь
<400> 38
Ser Asp Val Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu
1 5 10 15
Gly Asp Gln Ala Ser Ile Ser Cys Lys Ser Thr Lys Ser Leu Leu Asn
20 25 30
Ser Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln
85 90 95
Ser Asn Tyr Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser
115 120 125
Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn
130 135 140
Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu
145 150 155 160
Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr
180 185 190
Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr
195 200 205
Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215 220
<210> 39
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VH цепь
<400> 39
caggtccaac tgcagcagtc tggacctgag ctggtgaagc ctggggcttc agtgaggata 60
tcctgcaagg cttctggcta caccttcaca aactcctata ttcactgggt gaaaaagagg 120
cctggacagg gacttgagtg gattggatgg atttatcctg aaagtcttaa tactcaatac 180
aatgagaagt tcaaggccaa ggccacactg actgctgaca agtcctccag cacatcctac 240
atgcagctca gcagtctgac ctctgaggac tctgcggtct atttctgtgc aagaaggggt 300
atttattact actctcccta tgctctggac cactggggtc aaggagcctc agtcaccgtc 360
tcctca 366
<210> 40
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> muFRIHC2-1 VL цепь
<400> 40
agtgatgttg ttctgaccca aactccactc tctctgcctg tcaatattgg agatcaagcc 60
tctatctctt gcaagtcttc taagagtctt ctgaatagtg atggattcac ttatttggac 120
tggtacctgc agaagccagg ccagtctcca cagctcctaa tatatttggt ttctaatcat 180
ttttctggag ttccagacag gttcagtggc agtgggtcag gaacagattt cacactcaag 240
atcagcagag tggaggctga ggatttggga gtttattatt gcttccagag taactatctt 300
cctctcacgt tcggaggggg gaccaagctg gaaataaaac gg 342
<210> 41
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VH цепь
<400> 41
caggtccaac tgcagcagtc tggacctgag gtggtgaagc ctggggcttc agtgaggata 60
tcctgcaagg cttctggcta caccttcaca aactactata tacactgggt gaagcagagg 120
cctggacagg gacttgagtg gattggatgg atttatcctg gaagttttaa tgttgagtac 180
aatgagaagt tcaaggccaa ggccacactg actgcagaca aatcctccag cacagtctac 240
atgcaactca gcagcctgac ctctgaggac tctgcggtct atttctgtgc aagaaggggt 300
atttatttct actctcccta tgctttggac tactggggtc aaggagcctc agtcaccgtc 360
tcctca 366
<210> 42
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> muFRIHC5-7 VL цепь
<400> 42
agtgatgttg ttctgaccca aactccactc tctctgcctg tcaatattgg agatcaagcc 60
tctatctctt gcaagtctac tgagagtctt ctgaatagtg atggattcac ttatttggac 120
tggtacctgc agaagccagg ccagtctcca cagctcctaa tatatttggt ttctaatcat 180
ttttctggag ttccagacag gttcagtggc agtgggtcag gaacagattt cacactcaag 240
atcagcagag tggaggctga ggatttggga gtttattatt gcttccagag taactatctt 300
cctctcacgt tcggaggggg gaccaagctg gaagtaaaac gg 342
<210> 43
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VH цепь
<400> 43
caggtccaac tgcagcagtc tggacctgac ctggtgaagc ctggggcttc agtgaggata 60
tcctgcaagg cttctggctt caccttcaca aactactata tacactgggt gaagcagagg 120
cctggacagg gacttgagtg gattggatgg atttatcctg aaaatgttaa tgttaggtac 180
aatgacaagt tcaaggccaa ggccacactg actgcagaca aatcctccag cacagcctac 240
atgcagctca gcagcctgac ctctgaggac tctgcggtct atttctgtgc aagaaggggt 300
atttattact actctcccta tgctatggac tactggggtc aaggagcctc agtcaccgtc 360
tcctca 366
<210> 44
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> muFRIHC9-20 VL цепь
<400> 44
agtgatgttg ttctgaccca aactccactc tctctgcctg tcaatcttgg agatcaagcc 60
tctatctctt gcaagtctac taagagtctt ctgaatagtg atggattcac ttatttggac 120
tggtacctgc agaagccagg ccagtctcca cagctcctaa tatatttggt ttctaatcat 180
ttttctggag ttccagacag gttcagtggc agtgggtcag gaacagattt caccctcaag 240
atcagcagag tggaggctga ggatttggga gtttattatt gcttccagag taactatctt 300
cctctcacgt tcggaggggg gaccaagctg gaaataaaac gg 342
<210> 45
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vHC
<400> 45
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Phe Met Asn Trp Val Lys Gln Ser Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala His
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Phe Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Asp Gly Ser Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 46
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vLCv1.00
<400> 46
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Asn Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 47
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vLCv1.60
<400> 47
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 48
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vLC CDR1
<400> 48
Lys Ala Ser Gln Ser Val Ser Phe Ala Gly Thr Ser Leu Met His
1 5 10 15
<210> 49
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vLC CDR2
<400> 49
Arg Ala Ser Asn Leu Glu Ala
1 5
<210> 50
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vLC CDR3
<400> 50
Gln Gln Ser Arg Glu Tyr Pro Tyr Thr
1 5
<210> 51
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vHC CDR1
<400> 51
Gly Tyr Phe Met Asn
1 5
<210> 52
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vHC CDR2 – определен по Кабату
<400> 52
Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Lys Phe Gln
1 5 10 15
Gly
<210> 53
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vHC CDR2 – определен по Abm
<400> 53
Arg Ile His Pro Tyr Asp Gly Asp Thr Phe
1 5 10
<210> 54
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 vHC CDR3
<400> 54
Tyr Asp Gly Ser Arg Ala Met Asp Tyr
1 5
<210> 55
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 HC аминокислотная последовательность
<400> 55
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Phe Met Asn Trp Val Lys Gln Ser Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala His
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Phe Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Asp Gly Ser Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 56
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 LCv1.00
<400> 56
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Asn Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 57
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huMov19 LCv1.60
<400> 57
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 58
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muMov19 vHC CDR2 - Kabat Defined
<400> 58
Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Asn Phe Lys
1 5 10 15
Asp
<210> 59
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FRIHC2-1 с измененной поверхностью или с привитым v1.0 CDR1 легкой цепи
<400> 59
Arg Ser Ser Arg Ser Leu Leu Asn Ser Asp Gly Phe Thr Tyr Leu Asp
1 5 10 15
<210> 60
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FRIHC2-1 с измененной поверхностью CDR2 тяжелой цепи
<400> 60
Trp Ile Tyr Pro Glu Ser Leu Asn Thr Gln
1 5 10
<210> 61
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FRIHC2-1 с измененной поверхностью HC CDR2
<400> 61
Trp Ile Tyr Pro Glu Ser Leu Asn Thr Gln Tyr Asn Gln Lys Phe Gln
1 5 10 15
Gly
<210> 62
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 (с измененной поверхностью) VH цепь
<400> 62
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Ser
20 25 30
Tyr Ile His Trp Val Lys Lys Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Glu Ser Leu Asn Thr Gln Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ser Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Arg Gly Ile Tyr Tyr Tyr Ser Pro Tyr Ala Leu Asp His Trp
100 105 110
Gly Gln Gly Ala Ser Val Thr Val Ser Ser
115 120
<210> 63
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 v. 1.0 (с измененной поверхностью) VL цепь
<400> 63
Asp Val Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Asn Ser
20 25 30
Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Ser
85 90 95
Asn Tyr Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 64
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 v. 1.01 (с измененной поверхностью) VL цепь
<400> 64
Asp Val Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Lys Ser Leu Leu Asn Ser
20 25 30
Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Ser
85 90 95
Asn Tyr Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 65
<211> 125
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 (привитое) VH цепь
<400> 65
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Ser
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Glu Ser Leu Asn Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Ala Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Tyr Tyr Tyr Ser Pro Tyr Ala Leu Asp His Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
<210> 66
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 v. 1.0 (привитое) VL цепь
<400> 66
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Asn Ser
20 25 30
Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser
85 90 95
Asn Tyr Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 67
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 v. 1.01 (привитое) VL цепь
<400> 67
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Lys Ser Leu Leu Asn Ser
20 25 30
Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Asn His Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser
85 90 95
Asn Tyr Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 68
<211> 442
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muhuMov19 полноразмерная тяжелая цепь
<400> 68
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Phe Met Asn Trp Val Lys Gln Ser Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala His
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Phe Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Asp Gly Ser Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Tyr Pro
115 120 125
Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly
130 135 140
Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn
145 150 155 160
Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Glu
165 170 175
Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser Met
180 185 190
Arg Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser Ser
195 200 205
Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro
210 215 220
Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys
245 250 255
Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp
260 265 270
Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu
275 280 285
Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser
305 310 315 320
Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly
325 330 335
Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln
340 345 350
Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe
355 360 365
Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu
370 375 380
Asn Tyr Lys Asn Thr Gln Pro Ile Met Asn Thr Asn Gly Ser Tyr Phe
385 390 395 400
Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn
405 410 415
Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His Thr
420 425 430
Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 69
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> muhuMov19 полноразмерная легкая цепь
<400> 69
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln
115 120 125
Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr
130 135 140
Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln
145 150 155 160
Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg
180 185 190
His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro
195 200 205
Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 70
<211> 452
<212> ДНК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 (с измененной поверхностью) VH цепь
<400> 70
aagcttgcca ccatgggttg gagctgcatt atccttttcc ttgtggctac agctactggc 60
gttcactctc aggtacaatt ggttcagtca ggagccgagg tcgtaaagcc cggtgccagt 120
gtgaagatct catgcaaggc aagcggttat acttttacaa actcttacat tcattgggtg 180
aaaaagcggc ccggccaggg tctcgaatgg atcggctgga tctacccaga aagtctgaac 240
actcaataca accagaagtt tcagggtaag gcaactctca ctgccgacaa gagctctagc 300
acaagctata tgcagttgtc tagtttgaca agcgaggata gcgcagttta cttttgtgct 360
cggcgtggta tttattacta ctcaccttat gctctggatc actggggaca gggtgcctct 420
gttaccgttt ccagtgcatc caccaagggc cc 452
<210> 71
<211> 452
<212> ДНК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 (привитое) VH цепь
<400> 71
aagcttgcca ccatgggctg gagctgcata atcctcttcc tcgtagctac cgccactggg 60
gtgcattctc aagtacagtt ggtgcagtcc ggagctgaag tcaagaagcc aggggcttct 120
gttaaggtga gctgtaaggc ttccggatat accttcacaa acagttatat ccattgggtg 180
aggcaagctc caggccaggg tctcgaatgg atgggatgga tctaccccga gagtctgaac 240
acccagtaca acgagaagtt caaggcacgt gtgaccatga caagagacac ctccatcagt 300
acagcctata tggaattgag ccgtctcaga agtgatgata cagcagtgta ctactgcgcc 360
aggcggggca tctactacta cagcccatac gctctcgacc actggggaca aggaacactg 420
gtaaccgtaa gctcagcttc tacaaagggc cc 452
<210> 72
<211> 411
<212> ДНК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 v. 1.0 (с измененной поверхностью) VL цепь
<400> 72
gaattcgcca ccatgggttg gtcatgtata atacttttcc tggtagctac tgctactggt 60
gtgcattcag atgtggtgct gactcagtca cccttgtctc tcccagtcaa tcttgggcag 120
ccagcatcta tcagctgccg aagcagcagg tctctcctga actccgatgg ctttacttat 180
cttgactggt atctccagaa gccaggacag tccccccggc tgctcatcta cctggtttct 240
aatcatttta gtggcgtccc tgaccgcttc tctgggagtg gaagtgggac cgattttaca 300
ctgaagatct ccagggtcga agctgaggac cttggggttt actactgttt ccagagcaac 360
taccttccct tgacattcgg ccagggaacc aagctggaaa tcaagcgtac g 411
<210> 73
<211> 411
<212> ДНК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 v. 1.01 (с измененной поверхностью) VL цепь
<400> 73
gaattcgcca ccatgggttg gtcttgtatc attctgttcc tggtcgccac tgccacagga 60
gttcactcag acgtggtact cacacaatct cccctttccc tgcctgtgaa cctgggacag 120
ccagcctcaa tcagttgcaa gagctctaaa tctctgctca atagcgatgg ctttacctac 180
ttggattggt acctccagaa gcccggccag tctcctcggc tcctgattta ccttgtttca 240
aatcactttt caggcgtgcc tgaccggttc tccggatctg gctcagggac agacttcacc 300
ctgaagatct cccgcgtcga ggcagaggat ctcggcgtgt attactgttt ccaaagtaac 360
tacctgccat tgacttttgg acaaggaact aaactggaaa tcaaacgtac g 411
<210> 74
<211> 411
<212> ДНК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 v. 1.0 (привитое) VL цепь
<400> 74
gaattcgcca ccatgggatg gagttgtatt attctgttct tggtcgctac tgcaacaggc 60
gttcattctg acatcgtaat gacccagaca cctctgagtc tgagtgtcac tcccggccag 120
cccgcctcta tttcatgtcg tagctctcgc tccctgctca attccgacgg ttttacctac 180
ttggactggt atcttcagaa acctgggcag agccctcagc ttctgatcta tctggtgtcc 240
aatcacttca gtggcgtccc agaccgattt tccggaagcg gaagcggaac cgactttacc 300
ctgaagatat cccgcgtcga agcagaggac gtgggcgtgt attattgctt tcaaagcaat 360
tacttgccat tgactttcgg acaaggcaca aaactggaga ttaagcgtac g 411
<210> 75
<211> 411
<212> ДНК
<213> Искусственная последовательность
<220>
<223> huFRIHC2-1 v. 1.01 (привитое) VL цепь
<400> 75
gaattcgcca ccatgggctg gtcatgcatc atactgttcc tggtggctac agcaaccggg 60
gtgcacagcg atattgttat gacacagaca ccactgagtt tgtcagtgac ccccggccag 120
ccagcctcta tatcctgcaa gtcctcaaaa agtctcctga atagcgatgg ctttacctac 180
ctcgactggt atcttcagaa gcccggtcaa agccctcagc tgctgatata tctggtgtct 240
aaccatttta gcggagtccc cgaccgcttt tcaggctccg gcagtggcac cgacttcacc 300
cttaagattt ctcgcgtgga ggctgaagat gtaggggtct actactgttt ccagtcaaac 360
tacctgccac tgacctttgg tcaaggcact aagctcgaaa ttaagcgtac g 411
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ОБНАРУЖЕНИЯ ФОЛАТНОГО РЕЦЕПТОРА 1 В ОБРАЗЦЕ ПАЦИЕНТА | 2018 |
|
RU2759410C2 |
| ДИАГНОСТИЧЕСКИЕ АНАЛИЗЫ И НАБОРЫ ДЛЯ ДЕТЕКЦИИ ФОЛАТНОГО РЕЦЕПТОРА 1 | 2018 |
|
RU2788126C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ НА ОСНОВЕ АКТИВИРУЮЩИХ Т-КЛЕТКИ БИСПЕЦИФИЧЕСКИХ АНТИГЕНСВЯЗЫВАЮЩИХ МОЛЕКУЛ ПРОТИВ CD3 И ФОЛАТНОГО РЕЦЕПТОРА 1 (FOLR1) И АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С ОСЬЮ PD-1 | 2015 |
|
RU2753902C2 |
| АКТИВИРУЕМЫЕ ПРОТЕАЗОЙ СВЯЗЫВАЮЩИЕ Т-КЛЕТКИ БИСПЕЦИФИЧЕСКИЕ МОЛЕКУЛЫ | 2017 |
|
RU2830288C2 |
| АНТИТЕЛА В7-Н4 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2809243C2 |
| УЛУЧШЕННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ РЕЦЕПТОРЫ | 2018 |
|
RU2825816C2 |
| PD-L1 специфические антитела | 2017 |
|
RU2756236C2 |
| Анти-PD-L1 и IL-2 цитокины | 2017 |
|
RU2769282C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2740479C2 |
| МУЛЬТСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, МУЛЬТСПЕЦИФИЧЕСКИЕ АКТИВИРУЕМЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2815683C2 |
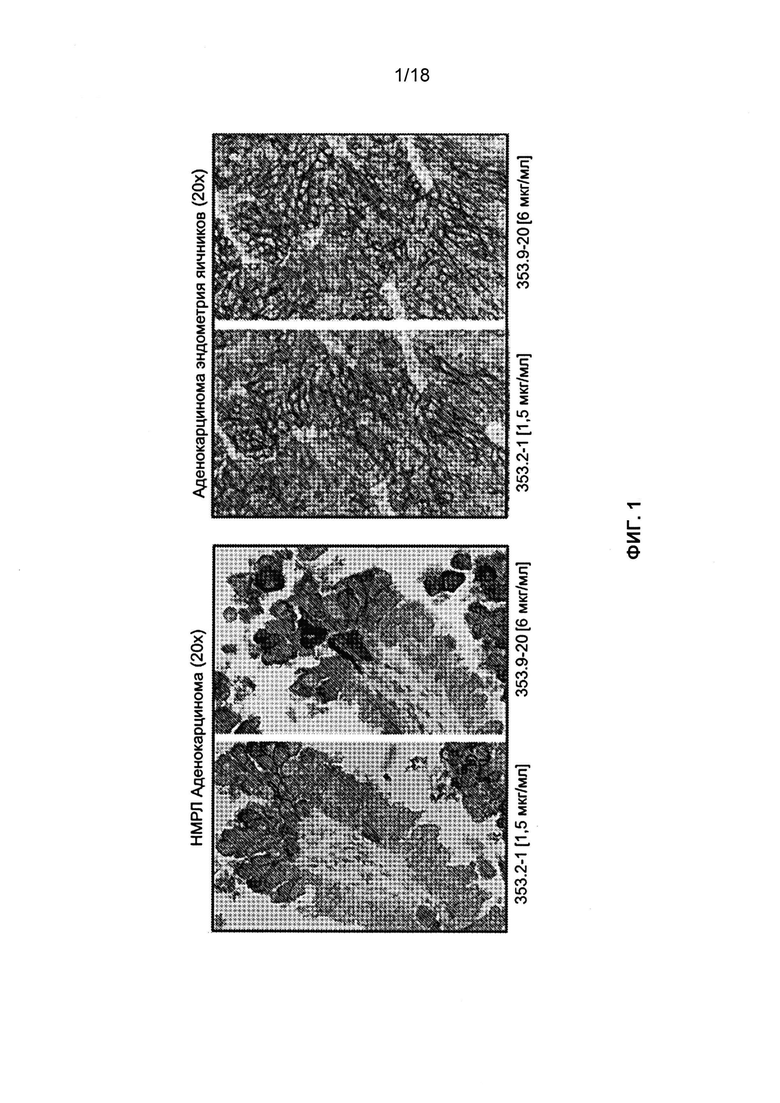
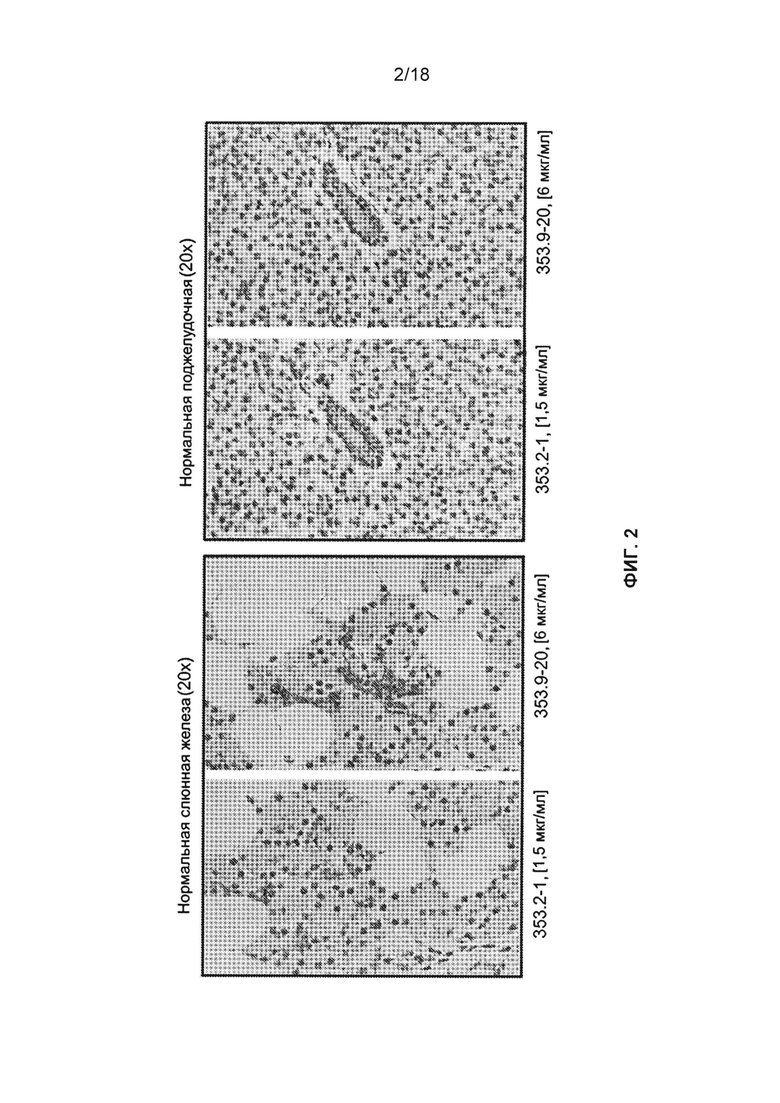



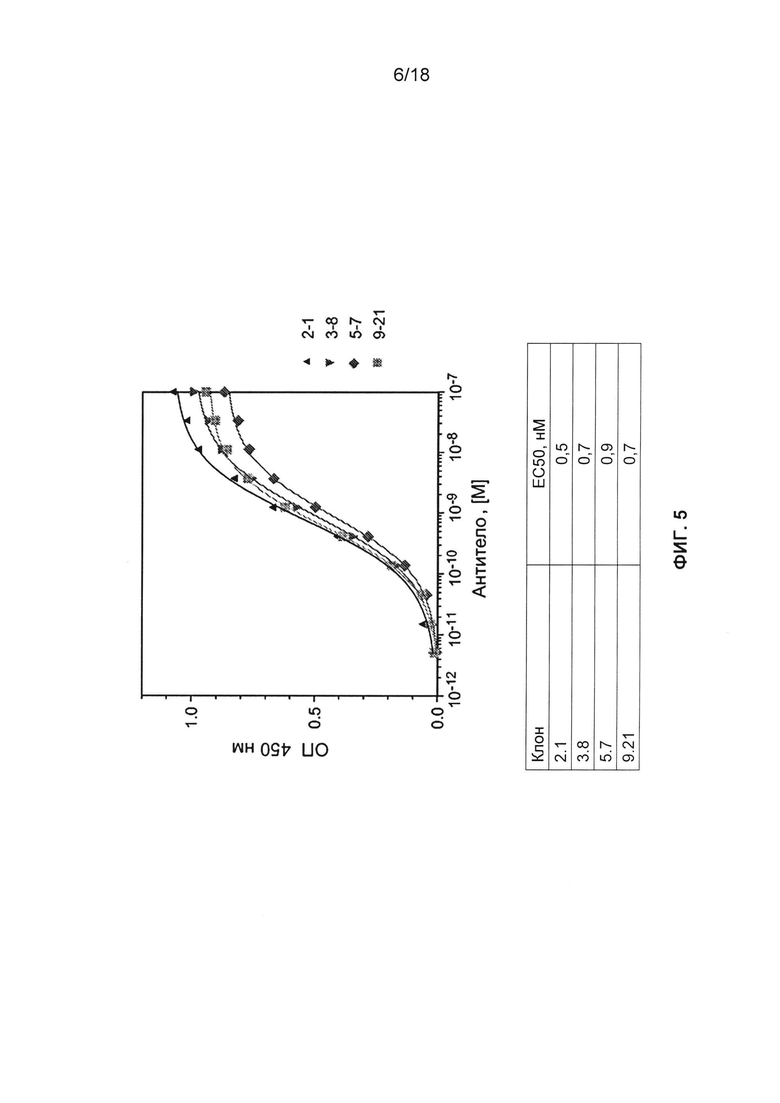
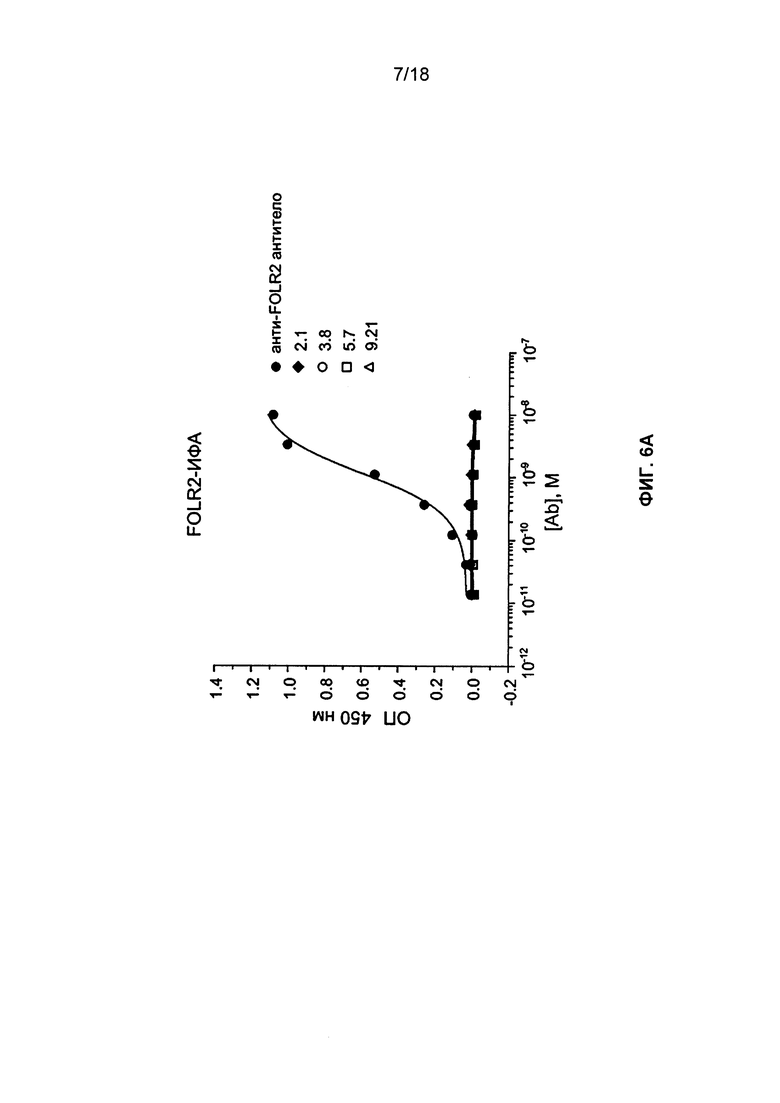
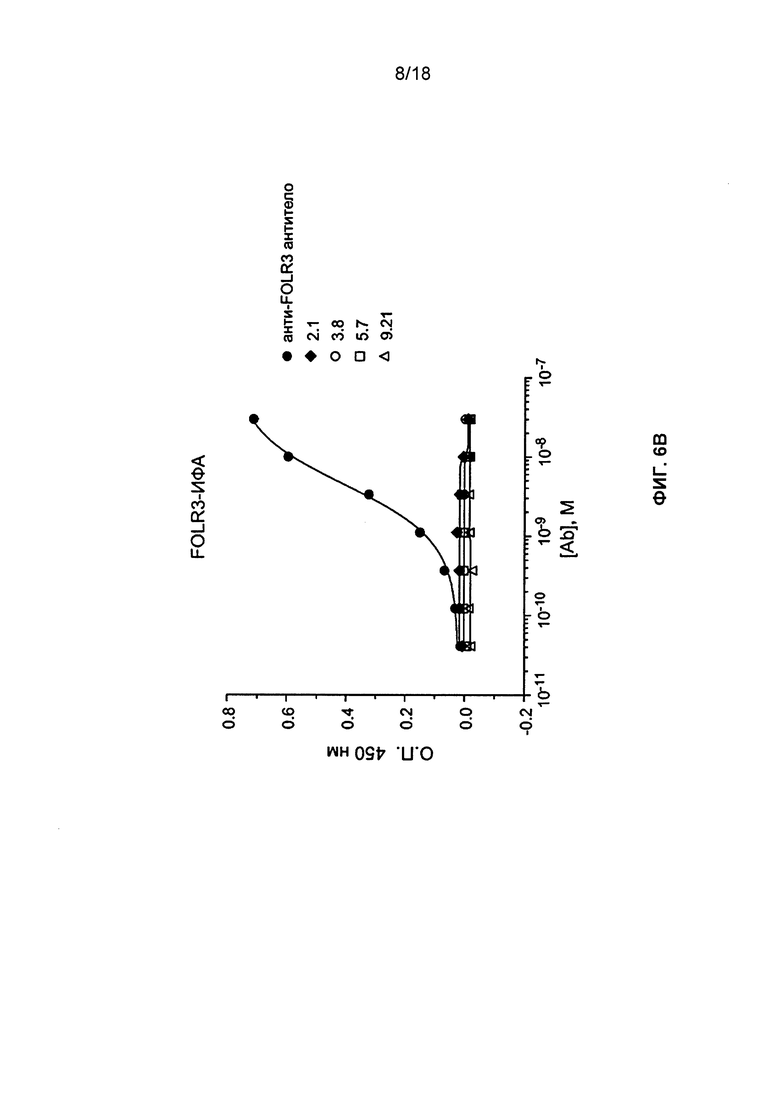
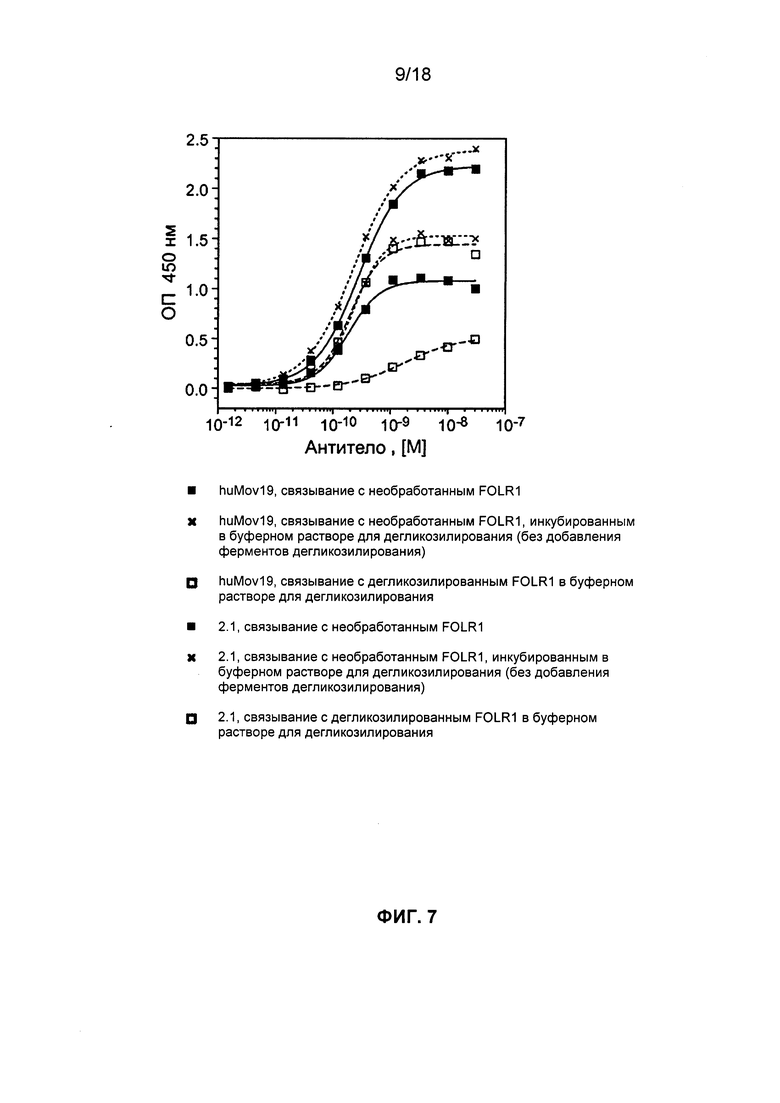
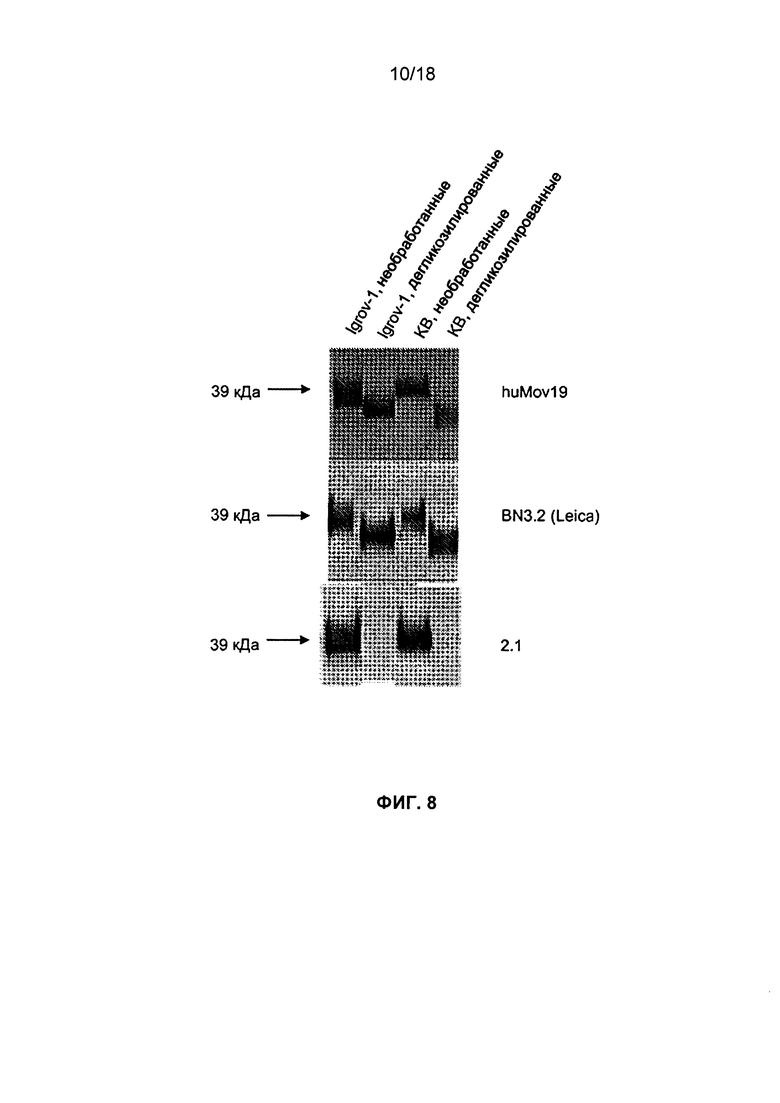
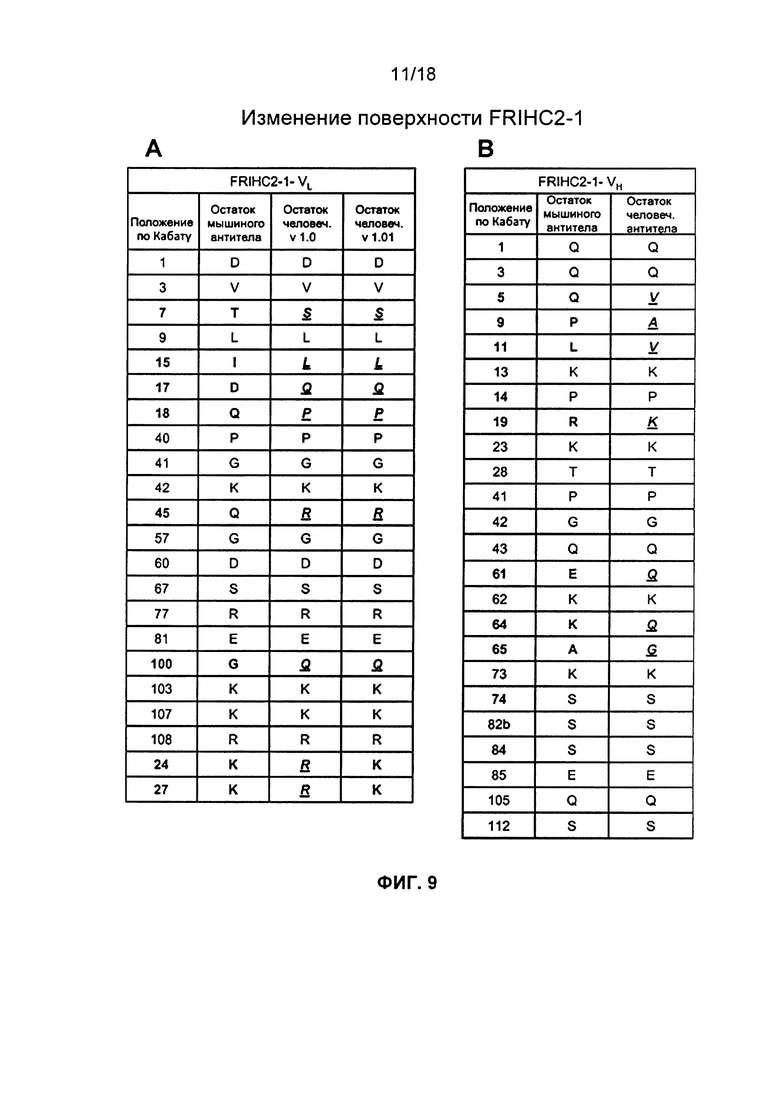

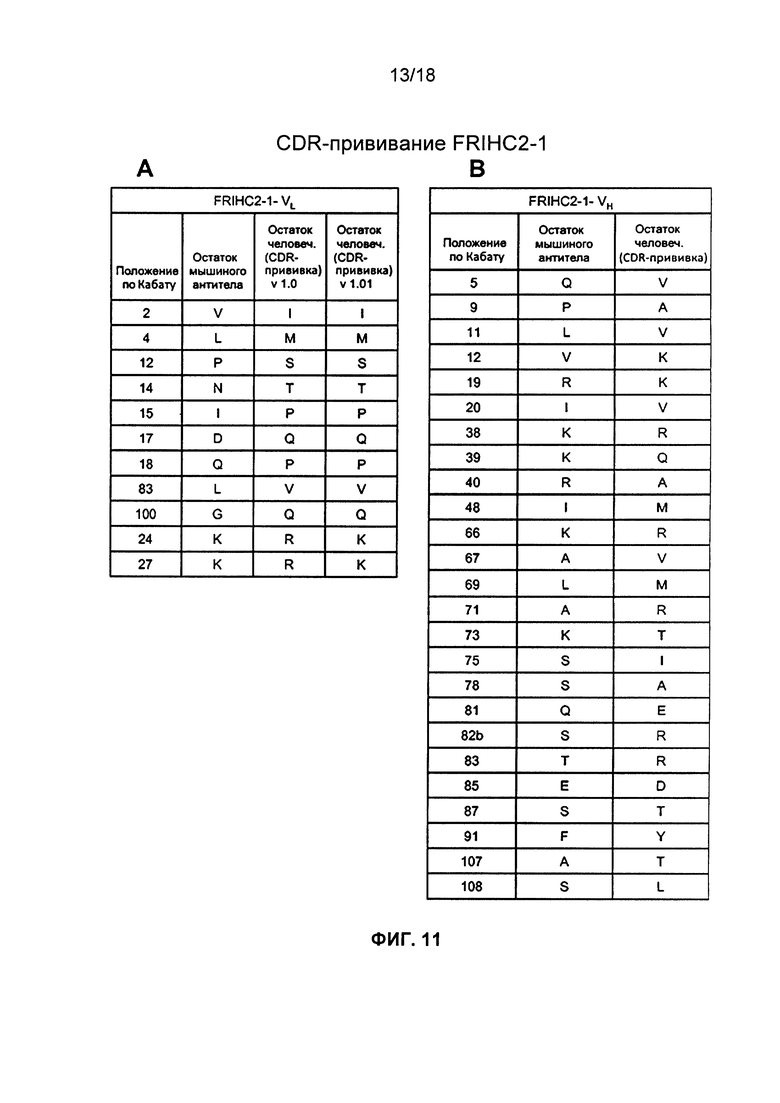


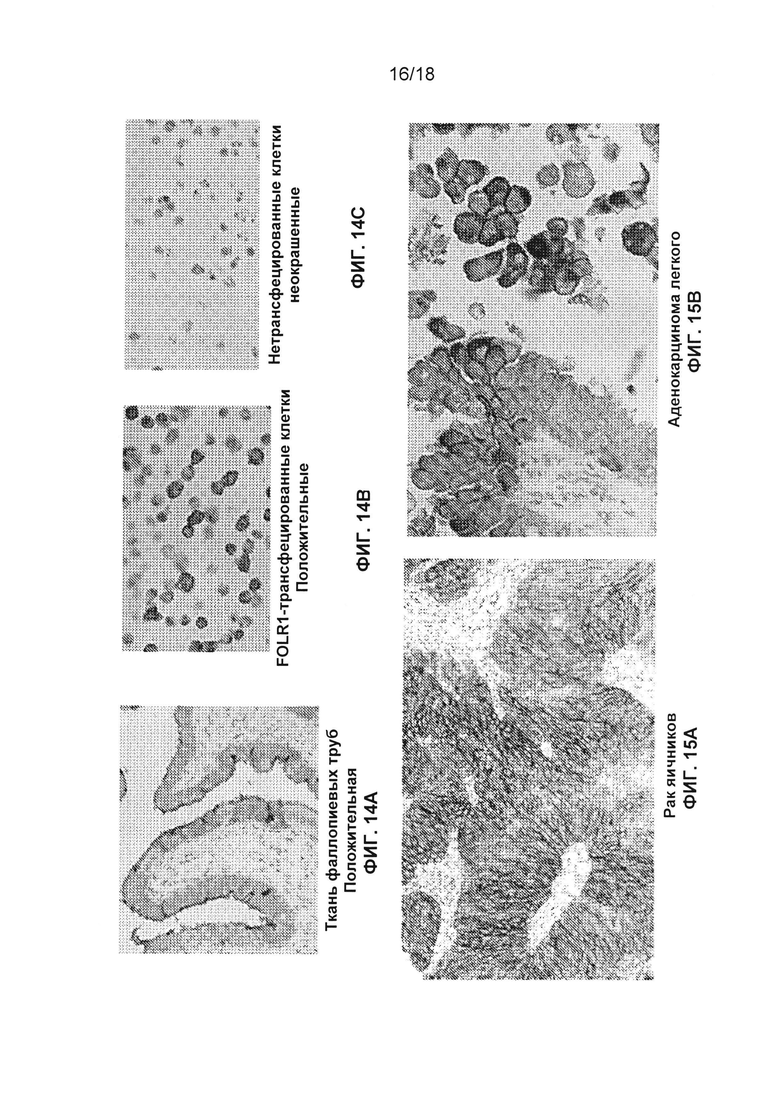
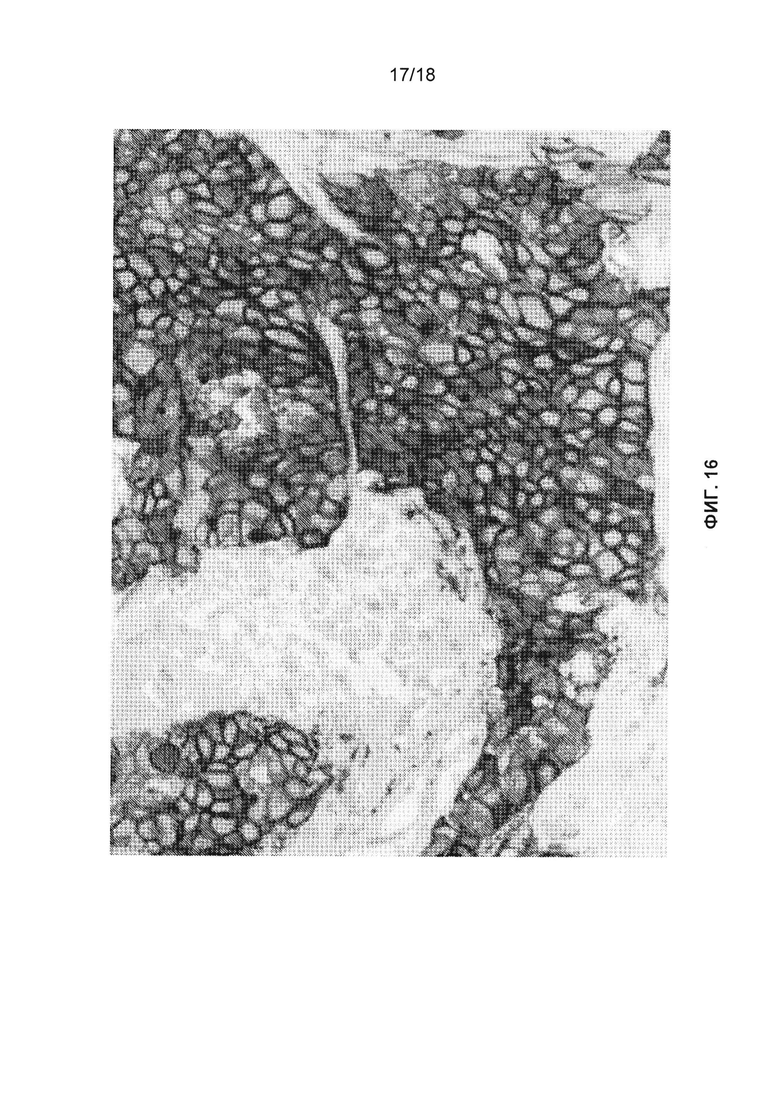
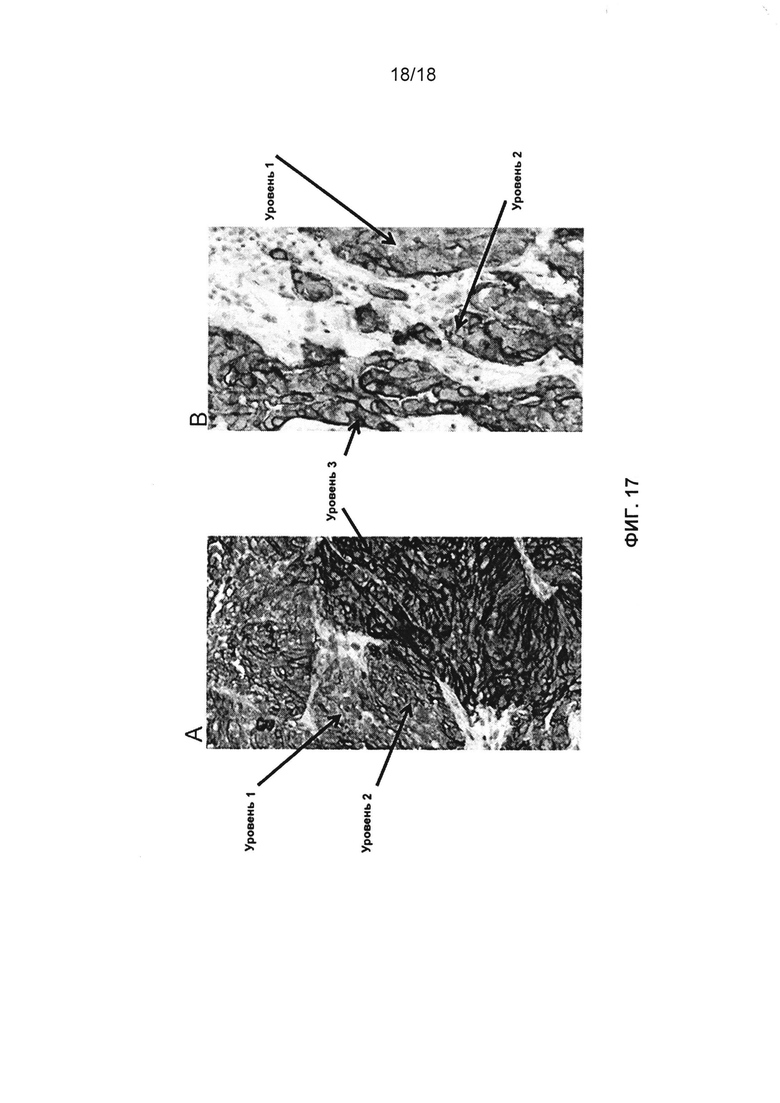
Данная группа изобретений относится к иммунологии. Предложены варианты антитела и антигенсвязывающих фрагментов антитела, которые специфически связываются с эпитопом рецептора фолиевой кислоты 1 (FOLR1). Описаны клетка и способ создания антитела по изобретению или его антигенсвязывающего фрагмента. Кроме того, представлены композиция и способ выявления экспрессии FOLR1 в образце, а также способ оценки эффективности терапии рака и способы идентификации ракового заболевания как вероятно поддающегося лечению или чувствительного к лечению. Данное изобретение может найти дальнейшее применение в диагностике рака. 16 н. и 62 з.п. ф-лы, 17 ил., 17 табл., 6 пр.
1. Антитело или его антигенсвязывающий фрагмент, которое специфически связывается с эпитопом FOLR1, причем указанное антитело или его фрагмент содержит полипептидные последовательности CDR1-3 VH и CDR1-3 VL, выбранные из группы, состоящей из:
(a) SEQ ID NO: 3-8, соответственно;
(b) SEQ ID NO: 9-14, соответственно;
(c) SEQ ID NO: 15-20, соответственно;
(d) SEQ ID NO: 21-26, соответственно;
(e) SEQ ID NO: 3-5 и SEQ ID NO: 59, 7 и 8, соответственно;
(f) SEQ ID NO: 3, 60 и 5, и SEQ ID NO: 6-8, соответственно;
(g) SEQ ID NO: 3, 61 и 5, и SEQ ID NO: 6-8, соответственно;
(h) SEQ ID NO: 3, 60 и 5, и SEQ ID NO: 59, 7 и 8, соответственно, и
(i) SEQ ID NO: 3, 61 и 5, и SEQ ID NO: 59, 7 и 8, соответственно.
2. Антитело или его антигенсвязывающий фрагмент по п. 1, где антитело или его фрагмент содержит полипептидные последовательности VH и VL, которые по меньшей мере на 90% идентичны, по меньшей мере на 95% идентичны или по меньшей мере на 99% идентичны полипептидным последовательностям, выбранным из группы, состоящей из:
(a) SEQ ID NO: 27 и SEQ ID NO: 28;
(b) SEQ ID NO: 29 и SEQ ID NO: 30;
(c) SEQ ID NO: 31 и SEQ ID NO: 32;
(d) SEQ ID NO: 62 и SEQ ID NO: 63 или SEQ ID NO: 64;
(e) SEQ ID NO: 65 и SEQ ID NO: 66 или SEQ ID NO: 67; и
(f) SEQ ID NO: 68 и SEQ ID NO: 69.
3. Антитело или его антигенсвязывающий фрагмент по п. 1 или 2, где полипептидные последовательности VH и VL содержат аминокислотные последовательности, выбранные из группы, состоящей из:
(a) SEQ ID NO: 27 и SEQ ID NO: 28;
(b) SEQ ID NO: 29 и SEQ ID NO: 30;
(c) SEQ ID NO: 31 и SEQ ID NO: 32;
(d) SEQ ID NO: 62 и SEQ ID NO: 63 или SEQ ID NO: 64;
(e) SEQ ID NO: 65 и SEQ ID NO: 66 или SEQ ID NO: 67; и
(f) SEQ ID NO: 68 и SEQ ID NO: 69.
4. Антитело или его антигенсвязывающий фрагмент по п.1, где полипептидные последовательности VH и VL содержат аминокислотные последовательности SEQ ID NO: 27 и SEQ ID NO: 28, соответственно.
5. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-4, где антитело или его антигенсвязывающий фрагмент получены рекомбинантным способом.
6. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-5, где указанное антитело или его антигенсвязывающий фрагмент является мышиным, гуманизированным, химерным, с измененной поверхностью или человеческим.
7. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-6, где указанное антитело или его антигенсвязывающий фрагмент связывается с FOLR1 человека, но не связывается с FOLR2 или FOLR3.
8. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-7, которое представляет собой полноразмерное антитело.
9. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-7, который представляет собой антигенсвязывающий фрагмент.
10. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-9, которые связываются с рецептором фолиевой кислоты 1 человека с Kd от около 0,5 до около 10 нM.
11. Антитело или антигенсвязывающий фрагмент по любому из пп. 1-10, которые связываются с рецептором фолиевой кислоты 1 человека с Kd около 1,0 нМ или лучше.
12. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-11, где антитело или его антигенсвязывающий фрагмент метят выявляемой меткой.
13. Клетка, содержащая экспрессионный вектор, содержащий нуклеиновую кислоту, кодирующую антитело или его антигенсвязывающий фрагмент по любому из пп. 1-12.
14. Способ создания антитела или его антигенсвязывающего фрагмента по любому из пп. 1-12, включающий (a) культивирование клетки по п. 13 и (b) выделение указанного антитела или его антигенсвязывающего фрагмента из указанной культивируемой клетки.
15. Композиция для выявления экспрессии FOLR1, содержащая эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп. 1-12 и буферный раствор, выбранный из группы, состоящей из: буферного раствора для FACS, буферного раствора для иммуногистохимии (ИГХ) и буферного раствора для ИФА.
16. Способ выявления экспрессии FOLR1 в образце, включающий приведение в контакт указанного образца с антителом или его антигенсвязывающим фрагментом по любому из пп. 1-12 или композицией по п. 15.
17. Способ по п. 16, отличающийся тем, что антитело или его антигенсвязывающий фрагмент метят выявляемой меткой.
18. Способ по п. 17, отличающийся тем, что указанную метку выбирают из группы, состоящей из иммунофлуоресцентной метки, хемилюминесцентной метки, фосфоресцентной метки, ферментной метки, радиометки, авидина/биотина, коллоидных частиц золота, окрашенных частиц и магнитных частиц.
19. Способ по любому из пп. 16-18, отличающийся тем, что экспрессию FOLR1 определяют радиоиммуноанализом, анализом вестерн-блот, цитометрией, иммунофлуоресцентным анализом, иммуноферментным анализом, анализом иммунопреципитации, хемилюминесцентным анализом или иммуногистохимическим анализом.
20. Способ по п. 19, отличающийся тем, что цитометрия представляет собой проточную цитометрию.
21. Способ по п. 19, отличающийся тем, что экспрессию FOLR1 определяют методом иммуногистохимии (ИГХ).
22. Способ оценки эффективности терапии рака действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, причем указанное действующее вещество вводят субъекту, имеющему раковое заболевание, при этом увеличенную экспрессию FOLR1 выявляют в раковом образце, полученном от указанного субъекта, используя антитело или его антигенсвязывающий фрагмент по любому из пп. 1-12 или композицию по п. 15.
23. Способ идентификации ракового заболевания как вероятно поддающегося лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, причем указанный способ включает:
(a) приведение в контакт биологического образца, содержащего клетки из указанной раковой опухоли, с антителом или его антигенсвязывающим фрагментом по любому из пп. 1-12 или композицией по п. 15;
(b) выявление связывания указанного антитела или его антигенсвязывающего фрагмента с FOLR1 в указанном биологическом образце согласно (a);
(c) присвоение показателя указанному связыванию из этапа (b), причем указанный показатель присваивают на основе сравнения с одним или более референсных образцов, и
(d) сравнение указанного показателя из этапа (c) с показателем референсной ткани или клетки, при этом показатель указанного уровня FOLR1 ракового образца, который превышает показатель референсного образца с нормальной или низкой экспрессией FOLR1, или показатель указанного уровня FOLR1 ракового образца, который равен или превышает показатель референсного образца с высокой экспрессией FOLR1, идентифицирует указанное раковое заболевание как вероятно поддающееся лечению анти-FOLR1 антителом.
24. Способ идентификации ракового заболевания как чувствительного к лечению анти-FOLR1 действующим веществом, причем указанный способ включает:
(a) выявление уровня экспрессии мембранного FOLR1 в раковом образце, полученном из указанной раковой опухоли, с использованием антитела или его антигенсвязывающего фрагмента по любому из пп. 1-12 или композиции по п. 15, причем указанное выявление включает использование способа, который различает интенсивность окрашивания или однородность окрашивания в экспрессиирующем FOLR1 раковом образце по сравнению с интенсивностью окрашивания или однородностью окрашивания в одном или более референсных образцах;
(b) определение показателя интенсивности окрашивания или однородности окрашивания FOLR1 указанного ракового образца и
(c) сравнение показателя интенсивности окрашивания или однородности окрашивания FOLR1, определенного на этапе (b), с относительным значением, определенным измерением экспрессии белка FOLR1 в по меньшей мере одном референсном образце, причем по меньшей мере один указанный референсный образец представляет собой образец ткани, клеток или осадка клеток, который не чувствителен к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель интенсивности окрашивания FOLR1 указанного ракового образца, определенный на этапе (b), который выше указанного относительного значения, идентифицирует указанное раковое заболевание как чувствительное к лечению действующим веществом.
25. Способ идентификации ракового заболевания как чувствительного к лечению анти-FOLR1 действующим веществом, причем указанный способ включает:
(a) выявление уровня экспрессии мембранного FOLR1 в раковом образце, полученном из указанного рака, с использованием антитела, или его антигенсвязывающего фрагмента по любому из пп. 1-12 или композиции по п. 15, по сравнению с мембранным FOLR1 в одном или более референсных образцах;
(b) определение показателя FOLR1 указанного ракового образца и
(c) сравнение показателя FOLR1, определенного на этапе (b), с относительным значением, определенным измерением мембранного FOLR1 в по меньшей мере одном референсном образце, причем по меньшей мере один указанный референсный образец представляет собой образец ткани, клеток или осадка клеток, который не чувствителен к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель FOLR1 указанного ракового образца, определенный на этапе (b), который выше указанного относительного значения, идентифицирует указанное раковое заболевание как чувствительное к лечению указанным действующим веществом.
26. Способ идентификации ракового заболевания как чувствительного к лечению анти-FOLR1 действующим веществом, причем указанный способ включает:
(a) выявление уровня экспрессии FOLR1 в раковом образце, полученном из указанного рака, с использованием антитела или его антигенсвязывающего фрагмента по любому из пп. 1-12 или композиции по п. 15, причем указанное выявление включает использование способа, который различает интенсивность окрашивания или однородность окрашивания в экспрессирующем FOLR1 раковом образце по сравнению с интенсивностью окрашивания или однородностью окрашивания в одном или более референсных образцах;
(b) определение показателя интенсивности окрашивания или однородности окрашивания FOLR1 указанного ракового образца и
(c) сравнение показателя интенсивности окрашивания или однородности окрашивания FOLR1, определенного на этапе (b), с относительным значением, определенным измерением экспрессии белка FOLR1 в по меньшей мере одном референсном образце, причем по меньшей мере один указанный референсный образец представляет собой образец ткани, клеток или осадка клеток, который чувствителен к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель интенсивности окрашивания FOLR1 указанного ракового образца, определенный на этапе (b), который больше или равен указанному относительному значению, идентифицирует указанное раковое заболевание как чувствительное к лечению указанным действующим веществом.
27. Способ идентификации ракового заболевания как чувствительного к лечению анти-FOLR1 действующим веществом, причем указанный способ включает:
(a) выявление уровня экспрессии мембранного FOLR1 в раковом образце, полученном из указанного рака, с использованием антитела или его антигенсвязывающего фрагмента по любому из пп. 1-12 или композиции по п. 15, по сравнению с мембранным FOLR1 одного или более референсных образцов;
(b) определение показателя FOLR1 указанного ракового образца и
(c) сравнение показателя FOLR1, определенного на этапе (b), с относительным значением, определенным измерением мембранного FOLR1 в по меньшей мере одном референсном образце, причем по меньшей мере один указанный референсный образец представляет собой образец ткани, клеток или осадка клеток, который чувствителен к лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, и при этом показатель FOLR1 указанного ракового образца, определенный на этапе (b), который больше или равен указанному относительному значению, идентифицирует указанное раковое заболевание как чувствительное к лечению указанным действующим веществом.
28. Способ по любому из пп. 23-27, где действующее вещество, содержащее анти-FOLR1 антитело или его антигенсвязывающий фрагмент, вводят субъекту, от которого был получен раковый образец или биологический образец.
29. Способ по любому из пп. 22 или 24-28, отличающийся тем, что указанный раковый образец или биологический образец представляет собой физиологическую жидкость, клетку или образец ткани.
30. Способ по п. 29, отличающийся тем, что указанная физиологическая жидкость представляет собой кровь, асцит, мочу, плазму, сыворотку или периферийную кровь.
31. Способ по любому из пп. 16-24, 26 и 28-30, отличающийся тем, что FOLR1 представляет собой мембранный FOLR1.
32. Способ по любому из пп. 16-23 и 28-30, отличающийся тем, что FOLR1 представляет собой сброшенный FOLR1.
33. Способ по любому из пп. 16-20, 22, 23 и 28-32, отличающийся тем, что выявление проводят методом иммуноферментного твердофазного анализа (ИФА).
34. Способ по любому из пп. 16-20, 22-29 или 31, отличающийся тем, что выявление проводят методом иммуногистохимии (ИГХ).
35. Способ по п. 34, отличающийся тем, что указанный метод ИГХ представляет собой калиброванный метод ИГХ, который может различать разные уровни экспрессии FOLR1.
36. Способ по п. 34 или 35, отличающийся тем, что при указанном ИГХ анализе получают диапазон интенсивности окрашивания образцов, которые имеют низкую экспрессию FOLR1 на клеточной поверхности, среднюю экспрессию FOLR1 на клеточной поверхности или высокую экспрессию FOLR1 на клеточной поверхности.
37. Способ по любому из пп. 34-36, отличающийся тем, что при указанном ИГХ анализе различается интенсивность окрашивания и однородность окрашивания в экспрессирующем FOLR1 раковом образце или биологическом образце по сравнению с референсным образцом.
38. Способ по любому из пп. 34-37, отличающийся тем, что ИГХ анализ выполняют вручную.
39. Способ по любому из пп. 34-37, отличающийся тем, что ИГХ анализ выполняют с использованием автоматизированной системы.
40. Способ по любому из пп. 34-39, отличающийся тем, что показатель FOLR1 определяется при ИГХ анализе.
41. Способ по п. 40, отличающийся тем, что показатель, равный по меньшей мере 2, идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
42. Способ по п. 40, отличающийся тем, что показатель, равный по меньшей мере 2 гомо, идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
43. Способ по п. 40, отличающийся тем, что показатель, равный по меньшей мере 2 гетеро, идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
44. Способ по любому из пп. 41-43, отличающийся тем, что раковое заболевание представляет собой рак брюшной полости, рак легких, рак эндометрия или рак яичников.
45. Способ по п. 40, отличающийся тем, что показатель, равный по меньшей мере 3, идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
46. Способ по п. 40, отличающийся тем, что показатель, равный по меньшей мере 3 гомо, идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
47. Способ по п. 40, отличающийся тем, что показатель, равный по меньшей мере 3 гетеро, идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
48. Способ по п. 40, отличающийся тем, что более чем 75% экспрессии мембранного FOLR1 с показателем, равным по меньшей 2, идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
49. Способ по п. 40, отличающийся тем, что более чем 75% экспрессии мембранного FOLR1 с показателем, равным по меньшей 3, идентифицирует раковое заболевание как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
50. Способ по любому из пп. 45-49, отличающийся тем, что раковое заболевание представляет собой рак брюшной полости, рак легких, рак эндометрия или рак яичников.
51. Способ по п. 40, отличающийся тем, что рак представляет собой рак яичников, и при этом меньшей мере 25% экспрессии мембранного FOLR1 с показателем, равным по меньшей 2, идентифицирует рак яичников как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
52. Способ по п. 40, отличающийся тем, что рак представляет собой рак брюшной полости, и при этом по меньшей мере 25% экспрессии мембранного FOLR1 с показателем, равным по меньшей 2, идентифицирует рак брюшной полости как вероятно поддающееся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
53. Способ по п. 40, отличающийся тем, что раковое заболевание представляет собой рак яичников, и при этом по меньшей мере 25% экспрессии мембранного FOLR1 с показателем по меньшей мере 3 идентифицирует рак яичников как вероятно поддающийся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
54. Способ по п. 40, отличающийся тем, что раковое заболевание представляет собой рак брюшной полости, и при этом по меньшей мере 25% экспрессии мембранного FOLR1 с показателем по меньшей мере 3 идентифицирует рак брюшной полости как вероятно поддающийся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
55. Способ по п. 40, отличающийся тем, что раковое заболевание представляет собой НМРЛ или рак эндометрия, и при этом по меньшей мере 25% экспрессии мембранного FOLR1 с показателем по меньшей мере 2 идентифицирует НМРЛ или рак эндометрия как вероятно поддающийся лечению действующим веществом, содержащим анти-FOLR1 антитело или его антигенсвязывающий фрагмент, или указывает на то, что пациент получит терапевтический эффект от введения действующего вещества, содержащего анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
56. Способ по любому из пп. 23-55, отличающийся тем, что указанный референсный образец представляет собой положительный референсный образец или отрицательный референсный образец.
57. Способ по любому из пп. 23-56, отличающийся тем, что референсный образец содержит клетки, осадки клеток или ткань.
58. Способ по любому из пп. 22-57, отличающийся тем, что антитело или его антигенсвязывающий фрагмент по любому из пп. 1-12, дополнительно содержит реактив для обнаружения, выбранный из группы, состоящей из: фермента, флуорофора, радиоактивной метки и люминофора.
59. Способ по п. 58, отличающийся тем, что указанный реактив для обнаружения выбран из группы, состоящей из: биотина, дигоксигенина, флуоресцеина, трития и родамина.
60. Способ по любому из пп. 22-59, отличающийся тем, что указанное раковое заболевание представляет собой FOLR1-положительный рак.
61. Способ по любому из пп. 22-43, 45-49 и 56-60, отличающийся тем, что указанное раковое заболевание выбрано из группы, состоящей из рака яичников, рака головного мозга, рака молочной железы, рака матки, рака эндометрия, рака поджелудочной железы, рака почек и рака легких.
62. Способ по пп. 44, 50 или 61, отличающийся тем, что рак легких представляет собой немелкоклеточный рак легких или бронхиолоальвеолярную карциному.
63. Способ по пп. 44, 50, 51, 53 или 61, отличающийся тем, что рак яичников представляет собой эпителиальный рак яичников.
64. Способ по п. 63, отличающийся тем, что раковое заболевание является устойчивым к лечению препаратами платины, рецидивирующим или рефрактерным.
65. Способ по любому из пп. 22-64, отличающийся тем, что указанную экспрессию FOLR1 выявляют, используя по меньшей мере одно дополнительное анти-FOLR1 антитело или его антигенсвязывающий фрагмент.
66. Способ по п. 65, отличающийся тем, что по меньшей мере одно антитело, или его антигенсвязывающий фрагмент, связано с твердой подложкой.
67. Способ по п. 65, отличающийся тем, что по меньшей мере одно антитело, или его антигенсвязывающий фрагмент, связано с планшетом для микротитрования.
68. Способ по любому из пп. 65-67, отличающийся тем, что по меньшей мере одно дополнительное антитело, или его антигенсвязывающий фрагмент, содержит агент для обнаружения.
69. Способ по п. 68, отличающийся тем, что агент для обнаружения представляет собой хромогенный агент для обнаружения, флуорогенный агент для обнаружения, ферментный агент для обнаружения или электрохемилюминесцентный агент для обнаружения.
70. Способ по п. 68 или 69, отличающийся тем, что агент для обнаружения представляет собой пероксидазу хрена (HRP).
71. Способ по п. 33, отличающийся тем, что указанный ИФА представляет собой «сэндвич»-ИФА.
72. Способ по любому из пп. 22-71, отличающийся тем, что действующее вещество содержит FOLR1-антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47.
73. Способ по п. 72, отличающийся тем, что действующее вещество представляет собой конъюгат антитело-майтанзиноид, содержащий FOLR1-антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47, майтанзиноид DM4 и расщепляемый сульфо-SPDB линкер.
74. Способ идентификации ракового заболевания как вероятно поддающегося лечению конъюгатом антитело-майтанзиноид, содержащим FOLR1-антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47, майтанзиноид DM4 и сульфо-SPDB линкер, причем способ включает измерение FOLR1 с использованием антитела, содержащего тяжелую цепь, содержащую аминокислоты из SEQ ID NO: 27, и легкую цепь, содержащую аминокислоты из SEQ ID NO: 28, в ИГХ анализе, при этом показатель, равный по меньшей мере 2 гетеро, указывает на то, что раковое заболевание вероятно поддается лечению.
75. Способ идентификации ракового заболевания как вероятно поддающегося лечению конъюгатом антитело-майтанзиноид, содержащим FOLR1-антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47, майтанзиноид DM4 и сульфо-SPDB линкер, причем способ включает измерение FOLR1 с использованием антитела, содержащего тяжелую цепь, содержащую аминокислоты из SEQ ID NO: 27, и легкую цепь, содержащую аминокислоты из SEQ ID NO: 28, в ИГХ анализе, при этом по меньшей мере 25% экспрессии мембранного FOLR1 с интенсивностью по меньшей мере 2 указывает на то, что раковое заболевание вероятно поддается лечению.
76. Способ идентификации ракового заболевания как вероятно поддающегося лечению конъюгатом антитело-майтанзиноид, содержащим FOLR1-антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47, майтанзиноид DM4 и сульфо-SPDB линкер, причем способ включает измерение FOLR1 с использованием антитела, содержащего тяжелую цепь, содержащую аминокислоты из SEQ ID NO: 27, и легкую цепь, содержащую аминокислоты из SEQ ID NO: 28, в ИГХ анализе, при этом показатель, равный по меньшей мере 2 гомо, указывает на то, что раковое заболевание вероятно поддается лечению.
77. Способ идентификации ракового заболевания как вероятно поддающегося лечению конъюгатом антитело-майтанзиноид, содержащим FOLR1-антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47, майтанзиноид DM4 и сульфо-SPDB линкер, причем способ включает измерение FOLR1 с использованием антитела, содержащего тяжелую цепь, содержащую аминокислоты из SEQ ID NO: 27, и легкую цепь, содержащую аминокислоты из SEQ ID NO: 28, в ИГХ анализе, при этом более чем 75% экспрессии мембранного FOLR1 с интенсивностью по меньшей мере 2 указывает на то, что раковое заболевание вероятно поддается лечению.
78. Способ идентификации ракового заболевания как вероятно поддающегося лечению конъюгатом антитело-майтанзиноид, содержащим FOLR1-антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 45, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47, майтанзиноид DM4 и сульфо-SPDB линкер, причем способ включает измерение FOLR1 с использованием антитела, содержащего тяжелую цепь, содержащую аминокислоты из SEQ ID NO: 27, и легкую цепь, содержащую аминокислоты из SEQ ID NO: 28, в ИГХ анализе, при этом по меньшей мере 25% экспрессии мембранного FOLR1 с интенсивностью по меньшей мере 3 указывает на то, что раковое заболевание вероятно поддается лечению.
| O'SHANNESSY D | |||
| J | |||
| et al | |||
| "Characterization of the human folate receptor alpha via novel antibody-based probes." Oncotarget, 2011, 2: 1227-1243 | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| RU 2464277 C2, 20.10.2012. | |||
Авторы
Даты
2020-07-06—Публикация
2014-08-29—Подача