Изобретение касается противоопухолевого средства, в частности действенного противоопухолевого лекарственного состава, содержащего S-( α, β -дикарбоксиэтил)глутатион, обнаруженный в тканях млекопитающих, или же сложноэфирное производное данного соединения, как в свободной форме, так и в виде фармацевтически приемлемой соли.
До настоящего времени для лечения злокачественных опухолей применяли ряд средств, например хемотерапевтические и иммунотерапевтические лекарственные средства. Однако установлено, что ни одно из них не является полностью удовлетворительным, так как все они недостаточно эффективны и/или вызывают тяжелые неблагоприятные последствия.
Авторами настоящего изобретения проведено интенсивное исследование в поисках соединения, обладающего хорошей противоопухолевой активностью при малом риске неблагоприятных последствий, и в результате найдено, что S-(α, β -дикарбоксиэтил)глутатион, представляющий собой вещество, содержащееся в тканях млекопитающих, а также сложноэфирные производные этого соединения неожиданно показали весьма перспективную потенциальную противоопухолевую активность и в то же время высокий уровень безвредности. На основе этих находок и было разработано настоящее изобретение.
Изобретение позволяет получать противоопухолевый лекарственный состав, содержащий в качестве активного ингредиента соединение общей формулы
HOOC-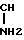 -CH2CH2-CONH-
-CH2CH2-CONH-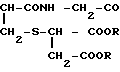 OH где два радикала R одинаковы или различны, причем каждый из них представляет собой атом водорода или группу низшего алкила, или же фармацевтически приемлемую соль данного соединения.
OH где два радикала R одинаковы или различны, причем каждый из них представляет собой атом водорода или группу низшего алкила, или же фармацевтически приемлемую соль данного соединения.
Среди активных ингредиентов, подлежащих применению в лекарственном составе согласно настоящему изобретению, S-(α, β-дикарбоксиэтил)глутатион представляет собой физиологическое вещество, которое обнаружили в хрусталике бычьего глаза Кэлем и Уэйли (Biochem. I., т. 86, 1963, с. 226). Однако в настоящее время о физиологических возможностях этого вещества известного немногое. Авторы настоящего изобретения прежде всего установили, что данное соединение активно подавляет свертывание крови и коагуляцию тромбоцитов, а также проявляет противовоспалительную и противоаллергическую активность (выложенная заявка Японии N 63-8337 и акцептованные заявки Японии N 1-79956 и 1-83484).
В приведенной выше формуле два радикала R одинаковы или различны, причем каждый из них представляет собой атом водорода или группу низшего алкила, предпочтительно содержащую 1-10 атомов углерода. Углеродная цепочка данной алкильной группы может быть прямой, разветвленной или циклической. Кроме того, данная цепочка может содержать циклическое звено. Таким образом, среди прочих можно назвать такие алкильные группы, как метил, этил, н-пропил, изопропил, циклопропил, н-бутил, трет-бутил, сек-бутил, н-пентил, 1-этилпропил, изопентил и бензил.
В противоопухолевом лекарственном составе, отвечающем настоящему изобретению, соединение, являющееся активным ингредиентом, может быть в свободной форме или же в виде фармацевтически приемлемой нетоксичной соли, например соли щелочного металла, такой как натриевая или калиевая соль, или же соли щелочноземельного металла, такой как соль кальция или магния. В тех случаях, когда упомянутое соединение взято в виде соли, присутствующие в данном соединении карбоксильные группы могут участвовать в солеобразовании полностью или частично. Для приготовления лекарственного состава согласно настоящему изобретению можно применять все допустимые соли.
Противоопухолевый лекарственный состав, отвечающий настоящему изобретению, может содержать одно соединение, являющееся основным ингредиентом, или же комбинацию из двух или более таких соединений, определяемых, как указано выше, в зависимости от поставленной цели и/или по мере необходимости.
Соединения, представляющие собой активный ингредиент и подлежащие применению в противоопухолевом лекарственном составе согласно настоящему изобретению, можно получить различными способами, например по следующей методике, а именно: S-(α, β-дикарбоксиэтил)глутатион можно экстрагировать, выделить и очистить из дрожжей (yrasts) или из хрусталика бычьего глаза, поскольку данное соединение там содержится. Другой путь состоит в том, что S-(α, β-дикарбоксиэтил)глутатион можно синтезировать, оставляя водный или водно-спиртовый раствор эквимолярной смеси исходных веществ, т.е. глутатиона и малеиновой кислоты, отстаиваться при комнатной температуре в течение 1-2 дней. Использование сложного моно- или диэфира малеиновой кислоты позволяет получить соответствующее сложноэфирное производное S-(α, β-дикарбоксиэтил)глутатиона. Так как соединения, синтезированные вышеуказанным способом, содержат в структуре своих молекул заново встроенный асимметричный атом углерода и, следовательно, образуют изомеры, эти изомеры, как и их смеси, пригодны для практического применения согласно настоящему изобретению.
Активное соединение, подлежащее использованию в противоопухолевом лекарственном составе, отвечающем настоящему изобретению, представляет собой вещество, присутствующее в живом организме, или же сложноэфирное производное такого вещества: следовательно, оно вряд ли может быть токсичным, как это доказывают данные, полученные и представленные в испытательном примере 2, описанном ниже. Таким образом, указанное вещество совершено безвредно и его можно применять с успехом в различных дозировочных формах против многих злокачественных опухолей.
Среди злокачественных опухолей, которые можно лечить с помощью лекарственного состава, отвечающего настоящему изобретению, следует, например, упомянуть твердые раковые опухоли, такие как рак желудка, рак печени, рак прямой кишки и рак легких, а также раковые поражения крови, такие как лейкемия и болезнь Ходжкина.
При лечении упомянутых злокачественных опухолей лекарственный состав, отвечающий настоящему изобретению, можно либо применять путем глотания, либо применять парентерально в зависимости от болезни, подлежащей лечению, и от общего состояния пациентов. Применяемые дозировочные формы представляют собой, например, твердые препараты, такие как таблетки, гранулы, порошки, капсулы и свечи, а также препараты в жидком виде, такие как микстуры, элексиры, растворы для инъекций. Все эти препараты можно приготовить методами, хорошо известными в фармакологии. По мере необходимости препараты могут содержать в своем составе инертные компоненты, вспомогательные вещества добавки, которые обычно применяют в фармацевтической практике, например эксципиенты (excipients), разбавители, связующие, загустители, увлажнители, смачиватели, противокомкающие добавки, смазки, дисперсанты, агенты, усиливающие реабсорбцию, корректирующие добавки, душистые вещества, буферные реагенты, поверхностно-активные вещества, реагенты, способствующие растворению, консервирующие реагенты, изотонирующие реагенты, стабилизаторы, реагенты, регулирующие рН, причем каждое из этих веществ берут в соответствующем количестве.
Доза вышеупомянутого соединения, представляющего собой активный ингредиент, может варьировать в зависимости от конкретного соединения, возраста и комплекции пациента, вида дозировки, симптома, подлежащего лечению, и других факторов. Однако, как правило, рекомендуется, чтобы, например, в случае инъекции назначали 10-500 мг в день для взрослого человека, а в случае приема внутрь путем глотания 10-1000 мг по несколько приемов в день на каждого взрослого, наконец, в случае применения свечей - 10-500 мг в день на одного взрослого.
Лекарственный состав, отвечающий настоящему изобретению, может содержать и другие противоопухолевые средства и/или другие агенты, способные проявлять другие фармакологические эффекты, если только эти средства и агенты не влияют на предмет изобретения.
Приведенные ниже примеры иллюстрируют настоящее изобретение.
Испытательный пример 1. Испытание фармакологической активности на мышах, зараженных саркомой-180.
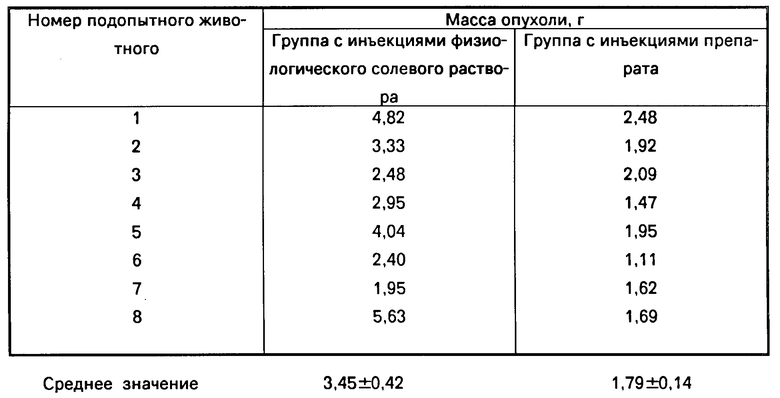
Группу самцов мышей племенной линии 8ddy в возрасте 5-6 недель заразили трансплантацией клеток саркомы-180 (1,16х107 клеток на животное) подкожно: на спину, с правой стороны туловища. В одной группе животным назначили инъекции: в брюшину соединения, представляющего собой S-(α, β-дикарбоксиэтил)глутатион, ниже для краткости обозначаемый DCE-GS, в виде удобного для инъекций 1,0% (мас. доли) раствора с рН 6,5 (изотонизированного хлоридом натрия), в количестве, соответствующем дозе 100 мг препарата DCE-GS на 1 кг живой массы в день, на протяжении 11 дней. Мышам контрольной группы вводили в брюшину такое же количество физиологического солевого раствора раз в день на протяжении того же периода. На 12-й день животных умерщвляли, из каждой особи вырезали и взвешивали опухолевое образование. Полученные результаты приведены в таблице.
Подавление роста опухоли = 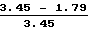 × 100 = 48,1 %
× 100 = 48,1 %
Приведенные выше данные ясно показывают, что испытуемое соединение обладает заметной противоопухолевой активностью.
Испытательный пример 2. Испытание на острую токсичность путем внутривенного назначения.
Испытание на острую токсичность проводили, назначив внутривенно препарат DCE-GS пяти самцам мышей группы племенной линии ddy массой по 20 г. Дозы составили 100, 200, 400, 800 и 1600 мг на 1 кг живой массы (общее отношение 2). Жидкость для инъекций была отрегулирована до рН 7 1н. раствором гидроксида натрия. В процессе наблюдения в течение 72 ч не было отмечено ни случаев гибели животных, ни отклонений их проведения от нормы.
П р и м е р 1 синтеза. S-(α, β-дикарбоксиэтил)глутатион.
Глутатион в количестве 9,2 и 5 г малеиновой кислоты растворяли в 150 мл воды. Раствор оставляли отстаиваться при комнатной температуре в течение 12 ч. Из реакционной пробы отбирали пробы (одна-две капли) и к каждой пробе добавляли одну каплю 0,01 н. испытуемого раствора I2. После того, как убеждались в том, что йод более не расходуется, в реакционную смесь добавляли 6,6 г моногидрата ацетата меди. В случае обнаружения осадка, которого было немного, его отфильтровывали. Фильтрат концентрировали приблизительно до 70 мл и добавляли к концентрату этиловый спирт. Полученный голубой осадок соли меди отбирали фильтрованием. Этот осадок подвергали рекристаллизации из системы вода - этиловый спирт. Полученную соль меди затем растворяли в 200 мл воды. Через раствор пропускали сероводород с целью осаждения сульфида меди. Осадок отфильтровывали. Фильтрат концентрировали при пониженном давлении и к остатку добавляли этиловый спирт, вследствие чего появились белые кристаллы. Эти кристаллы отбирали фильтрованием, промывали этиловым спиртом и подвергали рекристаллизации из системы вода - этиловый спирт для получения около 9 г искомого соединения в виде мелкокристаллической гигроскопичной массы белого цвета.
П р и м е р 2 синтеза. Натриевая соль S-( α, β-дикарбоксиэтил)глутатиона.
S-( α, β-дикарбоксиэтил)глутатион в количестве 2 г растворяли в 40 мл воды. Раствор регулировали до величины рН 7 1 н. раствором гидроксида натрия и затем концентрировали при пониженном давлении и температуре, не превышающей 30оС. К концентрату добавляли этиловый спирт; образовавшиеся белые кристаллы отбирали фильтрованием и подвергали рекристаллизации из системы вода - этиловый спирт. В результате получили 2,1 г искомого соединения в виде белого кристаллического порошка.
П р и м е р 3 синтеза. Кальциевая соль S-( α, β-дикарбоксиэтил)глутатиона.
S-( α, β-дикарбоксиэтил)глутатион в количестве 2 г растворяли в 40 мл воды. К раствору добавляли 1 г карбоната кальция. Смесь перемешивали при слабом нагревании. Когда более уже не наблюдалось выделения газообразного углерода, избыток кальциевого соединения отфильтровывали. Фильтрат концентрировали при пониженном давлении. К концентрату добавляли этиловый спирт. Образовавшийся белый кристаллический осадок отбирали фильтрованием и подвергали рекристаллизации из системы вода - этиловый спирт. В результате получили 2,2 г искомого соединения в виде белого кристаллического порошка.
П р и м е р 4 синтеза. Магниевая соль S-( α, β-дикарбоксиэтил)глутатиона.
S-( α, β-дикарбоксиэтил)глутатион в количестве 2 г обрабатывали тем же способом, что приведен выше для получения кальциевой соли, основным карбонатом магния в количестве 1 г. В результате получили 2,2 г магниевой соли.
П р и м е р 5 синтеза. Натриевая соль S-( α, β-дикарбоксиэтил)глутатиона.
Глутатион в количестве 9,2 и 5,6 г диэтилмалеата растворяли в 150 мл 30%-ного (об. доли) этилового спирта. Раствор регулировали до величины рН 6 2 н. раствором гидроксида натрия, после чего перемешивали при 50оС в течение приблизительно 5 ч. Из реакционной смеси готовили пробы (две капли) и к каждой пробе добавляли одну каплю испытательного 0,01 н. раствора йода. Когда обусловленная йодом окраска переставала обесцвечиваться, через реакционную смесь пропускали газообразный сероводород. Смеси давали постоять в течение ночи, а затем ее концентрировали, отгоняли при этом газообразный сероводород. С целью растворения образующегося осадка к нему добавляли 150 мл воды. В раствор добавляли также и в нем растворяли 6,6 г моногидрата ацетата меди. При этом соль меди постепенно выпадалa в осадок. Этот осадок отбирали фильтрованием, промывали водой и готовили его суспензию в 150 мл воды. Через суспензию попускали газообразный сероводород при одновременном перемешивании, с целью образования сульфида меди. Сульфид меди отфильтровывали, фильтрат концентрировали, к выпадающему осадку с целью его растворения добавляли 200 мл этилового спирта. Раствор регулировали до величины рН 6 постепенным введением раствора гидроксида натрия в этиловом спирте, до тех пор пока не происходило выпадения белых кристаллов. Эти кристаллы отбирали фильтрованием, промывали этиловым спиртом и растворяли в воде с целью последующей рекристаллизации. Раствор, насколько это было возможно, концентрировали и затем добавляли в него этиловый спирт. Получившийся кристаллический осадок отбирали фильтрованием и сушили. В результате получили 8,5 г натриевой соли S-(диэтил-α, β-дикарбоксиэтил)глутатиона. Результат тонкослойной хроматографии на геле кремнезема: Rf = 0,28 (н-бутил: уксусная кислота : вода = 4:1:1).
П р и м е р 6. Натриевая соль S-(ди-н-бутил- α, β -дикарбоксиэтил)глутатиона.
Глутатион в количестве 9,2 и 7,5 г ди-н-буталмалеата растворяли в 150 мл 50%-ного (об. доли) спирта и проводили реакцию тем же способом, что и в примере 5 синтеза. Затем растворитель отгоняли, а осадок растворяли в 150 мл воды. Дальнейшее добавление 200 мл 3,3%-ного водного раствора ацетата меди в вышеуказанный раствор приводило к выпадению в осадок нерастворимой в воде соли меди. Осадок отбирали фильтрованием, промывали водой и готовили из него суспензию в 300 мл 50%-ного (об. доли) этилового спирта. Через эту суспензию пропускали при непрерывном перемешивании сероводород с целью образования сульфида меди. Далее сульфид меди отфильтровывали и фильтрат концентрировали для удаления сероводорода. Концентрат снова растворяли в 150 мл 50%-ного этилового спирта. Раствор регулировали до величины рН 6 добавлением 2 н. раствора гидроксида натрия и затем снова концентрировали. К концентрату добавляли этиловый спирт, ацетон и простой изопропиловый эфир. Образовавшийся белый кристаллический осадок отбирали фильтрованием, промывали ацетоном и высушивали. В результате получили 9,7 г натриевой соли S-(ди-н-бутил- α, β-дикарбоксиэтил)глутатиона в виде гигроскопичных кристаллов. Результат трехслойной хроматографии на геле кремнезема: Rf = 0,40 (Н-бутиловый спирт:уксусная кислота:вода = 4:1:1).
П р и м е р 7. Кальциевая соль S-(ди-н-бутил- α, β-дикарбоксиэтил)глутатиона.
Были проведены операции примера 6 синтеза с последующим использованием карбоната кальция вместо 2 н. раствора гидроксида натрия. Добавление ацетона к остатку концентрата сопровождалось выпадением белых кристаллов. Они были подвергнуты рекристаллизации из системы этиловый спирт - ацетон. В результате было получено 7,5 г кальциевой соли S-(ди-н-бутил- α, β-дикарбоксиэтил)глутатиона.
П р и м е р 8. Натриевая соль S-(моноэтил- α, β-дикарбоксиэтил)глутатиона.
Глутатион в количестве 9,2 и 4,5 г моноэтилмалеата растворяли в 150 мл воды. Раствор регулировали до величины рН 6 2н.раствором гидроксида натрия. Реакцию проводили тем же способом, что и в примере 5 синтеза. Реакционную смесь концентрировали, к остатку добавляли этиловый спирт. Выпадающие в осадок белые кристаллы отбирали отфильтрованием и растворяли в воде с целью последующей рекристаллизации. Водный раствор концентрировали и вводили в него этиловый спирт, чтобы вызвать кристаллизацию вещества. Выход продукта составил 8,0 г. Результат тонкослойной хроматографии на геле кремнезема: Rf = 0,17 (н-бутиловый спирт:уксусная кислота:вода = 4:1:1).
П р и м е р 1 вида дозировки.
Таблетки для приема внутрь путем глотания, мг: Кальциевая соль 100 Лактоза 80 Крахмал 17 Стеарат магния 3
С использованием перечисленных веществ обычным методом готовили таблетки. Приведенные количества даны на одну таблетку. В случае необходимости таблетки могут иметь сахарное покрытие.
П р и м е р 2 вида дозировки.
Раствор для инъекций, мг: Натриевая соль 1,5 Хлорид натрия 0,6 Дистиллированная вода для инъекций 100 мл
Перечисленные ингредиенты перемешивали и стерилизовали методом бактериального фильтрования. Фильтрат распределяли порциями по 2 мл по стеклянным ампулам, после чего ампулы герметизировали.
П р и м е р 3 вида дозировки. Свечи, г Натриевая соль 2 Шоколадное масло 20
С использованием этих веществ обычным методом готовили свечи. Количества указаны на 10 шт. свечей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЕЩЕСТВО ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ИЛИ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 1990 |
|
RU2050156C1 |
| ПРОИЗВОДНЫЕ ГЛЮТАТИОНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2041201C1 |
| АНТИГЕПАТОПАТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2019993C1 |
| ПРОИЗВОДНЫЕ ГЛЮТАТИОН-S-НИЗШЕЙ ЖИРНОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2046798C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ВОДНОЙ СУСПЕНЗИИ И ВОДНЫЙ ГЛАЗНОЙ ПРЕПАРАТ | 1992 |
|
RU2098094C1 |
| ГЛУТАТИОНАЛКИЛОВЫЕ ЭФИРЫ ОКИСЛЕННОГО ТИПА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2043994C1 |
| ГЛАЗНЫЕ КАПЛИ | 1991 |
|
RU2068260C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГЛАУКОМЫ | 1993 |
|
RU2102069C1 |
| ПРОИЗВОДНЫЕ ГЛИЦИРРЕТОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2065864C1 |
| ОПТИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ ПИРИДОБЕНЗОКСАЗИНА ИЛИ ИХ СОЛИ | 1991 |
|
RU2029771C1 |
Изобретение относится к медицине. Цель изобретения - устранение побочного действия. Известное соединение формулы 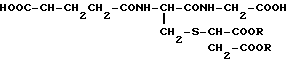 где R (одинаковые или различные) -водород или низшая алкильная группа с числом атомов 1 - 10, предлагается в качестве вещества, обладающего противоопухолевой активностью. 1 табл.
где R (одинаковые или различные) -водород или низшая алкильная группа с числом атомов 1 - 10, предлагается в качестве вещества, обладающего противоопухолевой активностью. 1 табл.
ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ.
Применение соединения общей формулы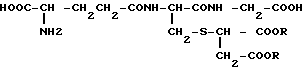
где R - одинаковые или различные, каждый водород или низшая алкильная группа с числом атомов 1 - 10,
в качестве вещества, обладающего противоопухолевой активностью.
| Biocher J., u86, 1963, р.226. |
Авторы
Даты
1995-01-27—Публикация
1990-09-26—Подача