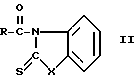
Изобретение относится к химии и технологии тиоэфиров и амидов карбоновых кислот, в частности к усовершенствованному способу получения тиоэфиров и амидов карбоновых кислот общих формул I и II соответственно
(I) 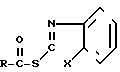
(II) 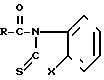 ,где
,где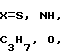
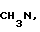
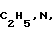 R - остаток карбоновой кислоты, которые находят применение в качестве полупродуктов при получении антибиотиков цефалоспоринового и пенициллинового рядов как в ряде индивидуальных веществ, так и в виде смесей.
R - остаток карбоновой кислоты, которые находят применение в качестве полупродуктов при получении антибиотиков цефалоспоринового и пенициллинового рядов как в ряде индивидуальных веществ, так и в виде смесей.
Известен способ получения тиоэфиров и (или) амидов карбоновых кислот взаимодействием смешанных ангидридов карбоновых кислот с тиолами и (или) аминами. Главным недостатком известного способа является то, что наличие в структуре кислоты таких функциональных групп, как гидроксильная или аминогруппа исключает его реализацию в одну стадию, т.к. указанные группы необходимо предварительно защищать, а после завершения процесса - снимать защиту, что обусловливает увеличение числа технологических стадий и снижение выхода продукта [1].
Известен способ получения тиоэфиров и (или) амидов карбоновых кислот взаимодействием последних с тиолами и (или) аминами в присутствии дициклогек- силкарбодиимида. Данный метод не обеспечивает высокого стабильного выхода целевых продуктов (на уровне 40-80%). Кроме того, данный способ предполагает использование дефицитного и дорогостоящего дициклогексилкарбодиимида, а также образование в качестве отхода производства дициклогексилмочевины [2-4].
Наиболее близким по своей технической сущности и достигаемому результату к заявленному является способ, описанный в [5, прототип].
В соответствии с прототипом [5], (1,3-бензтиазол-2-илтио)-2-)2-амино-1,3-тиазол-4-ил)-2-(син) метоксиаминоацетат получают взаимодействием 1 мол. ч. (2-амино-1,3-тиазол-4-ил)-2-(син)метоксииминоуксусной кислоты с 1,5 мол. ч. бис(1,3-бензтиазол-2-ил)дисульфида и трифенилфосфина в среде метиленхлорида при 0оС в течение 4 ч.
Недостатком способа-прототипа являются очень высокая стоимость трифенилфосфина, образование неутилизируемого и токсичного трифенилфосфиноксида, недостаточная универсальность способа.
Целью изобретения является уменьшение количества неутилизируемых отходов, повышение универсальности способа.
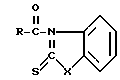
Заявленный способ совместного получения тиоэфиров карбоновых кислот и амидов карбоновых кислот общих формул (I) и (II) соответственно
(I) 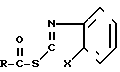
(II) 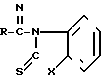 , где
, где 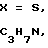
 , CH3N, C2H5N, R - остаток карбоновой кислоты осуществляют переработкой гетарилмеркаптанов общей формулы III
, CH3N, C2H5N, R - остаток карбоновой кислоты осуществляют переработкой гетарилмеркаптанов общей формулы III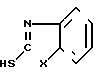 и карбоновой кислоты общей формулы IV
и карбоновой кислоты общей формулы IV
R-COOH, где Х и R имеют указанные значения в среде органического растворителя, отличительной особенностью которого является то, что исходный гетарилмеркаптан (III) подвергают взаимодействию с фосгеном в водно-органической среде в присутствии щелочи при температуре (-5)-(+10)оС и молярном соотношении (III):фосген = 2:(1,0-1,2), и полученный полупродукт подвергают взаимодействию с карбоновой кислотой при молярном соотношении исходный гетарилмеркаптан: карбоновая кислота = 2:1 с последующим выделением целевых продуктов и рециклируемого гетарилмеркаптана (III) известными приемами. Возможно также использование других гетарилмеркаптанов, аналогичных (III), без аннелированного бензольного кольца.
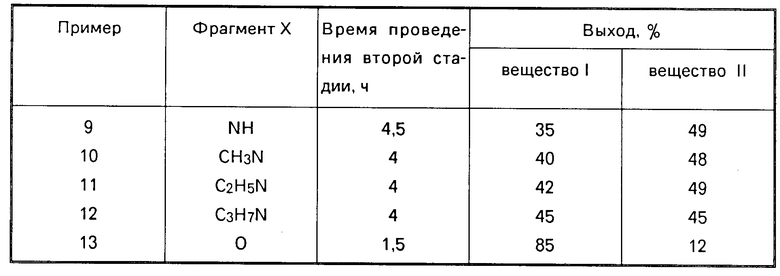
П р и м е р 1. (1,3-Бензотиазол-2-илтио)бензоат и 2,3-дигидро-2-тиокси-3-бензоил-1,3-бензотиазол (Х = S).
К раствору 16,7 г (0,1 моля) 2-меркапто-1,3-бензотиазола и 5,0 г (0,125 моля) едкого натра в 150 мл воды при температуре (0 ±2)оС добавляют охлажденный до этой же температуры раствор 4,95 г (0,05 моля) фосгена (молярное соотношение 2: 1) в 200 мл метиленхлорида. Реакционную массу перемешивают при указанной температуре в течение (1,0±0,1) ч, фильтруют. Осадок промывают на фильтре 25 мл охлажденного до 0±2оС изопропанола и сушат в вакууме при комнатной температуре. Органическую фазу сушат над хлоридом кальция, фильтруют и упаривают к вакууме на (80±5)%. Выпавший осадок фильтруют, промывают на фильтре 10 мл охлажденного до 0±2оС изопропанола и сушат в вакууме при комнатной температуре. В сумме получают 17,8 г (0,0494 моля) полупродукта. Выход 98,8%.
Выделенный полупродукт имеет следующий состав:
S,S-бис(1,3-Бензотиазол-2-ил)дитиока- рбоната 95%,
бис(2,3-Дигидро-2-тиоксо-1,3-бензотиа- зол-2-ил)карбонила 4,5%,
(1,3-Бензотиазол-2-илтио)-(2,3-дигидро- -2-тиоксо-1,3-бензотиазол- 3-ил)карбонила 0,5%.
Полученный полупродукт без какого-либо разделения в количестве 1,8 г (суммарно 0,005 моля) загружают в колбу, добавляют 0,6 г (0,005 моля) бензойной кислоты, 15 мл ацетона и кипятят при перемешивании 2 ч. Молярное соотношение исходный 2-меркапто-1,3-бензотиазол:бензойная кислота составляет 2: 1. Полученную смесь охлаждают, упаривают в вакууме водоструйного насоса, продукт смывают 20 мл охлажденного до 0оС бензола. После отгонки растворителя и кристаллизации из бензола получают 1,29 г продукта. Полученный продукт представляет собой смесь (1,3-бензотиазол-2-илтио)бензоата [вещество формулы (I)] и 2,3-дигидро-2-тиоксо-3-бензоил-1,3-бензо-тиазола [вещество формулы (II)], которую можно использовать далее при синтезе сложных эфиров, амидов и других производных бензойной кислоты без какого-либо разделения. Для получения веществ в индивидуальном виде смесь двукратно кристаллизуют из этилацетата. После упаривания маточника получают 1,15 г бензоата (выход 82% на данной стадии и 81% по обеим стадиям). Т.пл. 102-103оС.
Найдено,%: С 62,04; Н 3,32; N 5,13; S 23,58.
C14H9NOS2.
Вычислено,%: С 61,97; Н 3,34; N 5,16; S 23,63.
Спектр ИК (CHCl3), ν, см-1: 3060, 3000 (СН), 1730 (С=0), 1600, 1580 (СС аром.), 1450, 1415 (CN аром.).
Спектр ПМР (CDCl3), δ, м.д.: 7,50 (4Н, м, С3Н и С5Н фенила, С5Н и С6Н бензотиазола), 7,69 (1Н, т, С4Н фенила, J = 7,5 Гц), 7,95 (1Н, С4Н бензотиазола, J = 8 Гц), 8,07 (3Н, м, С2Н и С6Н фенила, С7Н бензотиазола).
Остаток после кристаллизации из этилацетата в количестве 0,13 г (выход 9,3% на данной стадии и 9,1% по обеим стадиям) представляет собой 2,3-дигидро-2-тиоксо-3-бензоил-1,3-бензотиазол.
Найдено,%: С 61,64; Н 3,38; N 5,22; S 23,27.
C14H9NOS2.
Вычислено,%: С 61,97, Н 3,34, N 5,16, S 23,63.
Спектр ИК (CHCl3), ν, см-1: 2950 (СН), 1675 (С=0), 1600, 1580 (СС аром. ), 1410 (СN аром.).
Суммарный выход обоих продуктов по обеим стадиям составляет 90%.
Твердый остаток после смыва смеси двух продуктов бензолом объединяют с бензольным маточным раствором после кристаллизации и экстрагируют 10 мл 5% -ного раствора едкого натра. Водный слой фильтруют через угольную подушку и обрабатывают концентрированной соляной кислотой до рН 5,0± 0,5. Осадок фильтруют, промывают на фильтре 10 мл воды и сушат на воздухе. Получают 0,96 г исходного 2-меркапто-1,3-бензотиазола. Возврат в рецикл составляет 98%.
Примеры 2-5 иллюстрируют влияние различных факторов на выход вещества (I) и вещества (II) на примере (1,3-бензотиазол-2-илтио)-бензоата I и 2,3-дигидро-2-тиоксо-3-бензоил-1,3-бензотиазола II.
П р и м е р 2. Фосгенирование 2-меркапто-1,3-бензотиазола ведут в растворе КОН по примеру 1 при -5оС и молярном соотношении 2:1,2. Остальные операции совпадают с примером 1. Выход вещества I - 77%, вещества II - 11%.
П р и м е р 3. Способ осуществляют по примеру 1 за исключением того, что температура фосгенирования составляет 10оС, молярное соотношение 2-меркапто-1,3-бензотиазол-фосген 2:1,1. Выход вещества I 66%, вещества II 21%.
П р и м е р 4 (сравнительный). Способ осуществляют по примеру 1, но фосгенирование ведут при 15оС при молярном соотношении 2:1,35. Выход вещества I 38%, вещества II 13%.
П р и м е р 5 (сравнительный). Способ осуществляют по примеру 1, но молярное соотношение 2-меркапто-1,3-безотиазол:бензойная кислота составляет 2:1,4. Выход вещества I 51%, вещества II 7%.
П р и м е р 6. (1,3-Бензотиазол-2-илтио)-2-(2-амино-1,3-тиазол-4-ил)-2-(син- метоксииминоацетат [вещество (I)] и 3-[2-(2-амино-1,3-тиазол-4-ил)-2-(син)-метоксииминоаце-тил] -2- тиоксо-2,3-дигидро-1,3-бензотиазол [вещество (II)] (X = S).
Фосгенирование 2-меркапто-1,3-бензотиазола и выделение полупродукта ведут по примеру 1. Полупродукт в количестве 2 г (0,005 моля) суспендируют в 15 мл ацетона, добавляют 1 г (0,005 моля) (2-амино-1,3-тиазол-4-ил)-2-(син)-метоксииминоуксусной кислоты и перемешивают 3 ч при 25оС. Смесь охлаждают до -15оС, фильтруют, осадок суспендируют в 15 мл охлажденного этилацетата, отфильтровывают, сушат в вакууме водоструйного насоса. Получают смесь двух веществ I и II в количестве 1,73 г. Суммарный выход составляет 95% по последней стадии, по обеим стадиям выход - 94% Данную смесь можно использовать при получении антибиотиков цефалоспоринового ряда (цефотаксима, цефтриаксона и т.п.) без разделения.
С целью идентификации индивидуальных соединений полученная смесь была разделена с помощью препаративной тонкослойной хроматографии (ТСХ) (элюент диэтиловый эфир). Выделено вещество I в количестве 1,55 г чистотой 99,3%, выход по обеим стадиям 84%. Т.пл. 128-130оС.
Найдено,%: С 44,38; Н 2,74; N 16,06; S 27,58.
C13H10N4O2S3.
Вычислено, % : С 44,52; Н 2,85; N 15, 99; S 27,45. Спектр ИК (KBr), ν, см-1: 3305 (NH), 3150, 3100 (СН), 1690 (С=0), 1630 (С=N метоксиимино), 1520 (СС аром.), 1440, 1400 (CN аром.). Спектр ПМР (CD2Cl2), δ, м.д.: 4,03 (3Н, с, ОСН3), 5,95 (2Н, с, NH2), 6,89 (1Н, с, С5Н тиазола), 7,65 (4Н, м, СН бензотиазола). Вещество II выделено в количестве 0,165 г, выход по обеим стадиям 9,3%.
Найдено,%: С 44,00; Н 2,90; N 15,82; S 27,38.
C13H10N4O2S3.
Вычислено,%: С 44,52; Н 2,85; N 15,99; S 27,45.
Спектр ИК (KBr), ν, см-1: 3310 (NH), 3115 (СН), 1660 (С=0), 1590 (С=N метоксимино), 1525 (СС аром.), 1440 (CN аром.).
Ацетоновый и этилацетатный маточники после отделения смеси целевых продуктов упаривают досуха, твердые остатки объединяют. Далее выделение 2-меркапто-1,3-бензотиазола осуществляют аналогично описанному в примере 1. Получают 0,94 г 2-меркапто-1,3-бензотиазола, возврат в рецикл 98%.
П р и м е р 7. (1,3-Бензотиазол-2-илтио)-(2-тиенил)ацетат [вещество (I)] и 3-(2-тиенилацетил)-2-тиоксо-2,3-дигидро-1,3-бензотиа- зол [вещество (II)] (X = S).
Фосгенирование 2-меркапто-1,3-бензотиазола и выделение полупродукта ведут по примеру 1. Далее к раствору 0,71 г (0,005 моля) 2-тиенилуксусной кислоты в 15 мл диметилформамида (ДМФА) при перемешивании добавляют 2 г (0,005 моля) выделенного полупродукта, выдерживают 20 мин при 25оС, охлаждают до -15оС и выливают в 100 мл охлажденной до 0оС воды. Выпавший осадок отфильтровывают, суспендируют в 20 мл бензола с 0,5 г СaCl2, фильтруют, упаривают в вакууме, продукт кристаллизуют и сушат в вакууме. Получают 0,82 г порошка яркого красно-коричневого цвета, который представляет собой смесь веществ I и II в соотношении 1:9. Суммарный выход на последней стадии 58%, по обеим стадиям - 57%. Данную смесь можно использовать при получении антибиотика цефалотина без разделения. Для идентификации смесь была разделена методом колоночной хроматографии на силикагеле (элюент хлороформ). Выделено 0,7 г вещества II, выход по обеим стадиям 49,3%. Т.пл. 173-175оС.
Найдено,%: C 53,49; H 3,53; N 4,85; S 32,75.
C13H9NOS3.
Вычислено,%: C 53,40; H 3,45; N 4,79; S 32,89.
Спектр ИК (KBr), ν, см-1: 1690 (С=0), 1580 (СС аром.), 1460, 1440 (CN аром.).
Спектр ПМР (CDCl3), ν, м.д.: 7,02 (2Н, м, С3Н и С4Н тиенила), 7,14 (1Н, дублет дублетов, С5Н тиенила, 3J = 4,8 Гц, 3J = 1,3 Гц), 7,63 (2Н, секстет дублетов, С5Н и С6Н бензотиазола, 3J = 7,8 Гц, 4J = 1,2 Гц), 7,82 (1Н, дублет дублетов, С7Н бензотиазола, 3J = 8,1 Гц, 4J = 0,86 Гц), 9,24 (1Н, дублет дублетов, С4Н бензотиазола 3J = 8,0 Гц, 4J = 0,96 Гц). Вещество (I) выделено в количестве 0,08 г, выход по обеим стадиям 8%.
Найдено,%: С 53,28; Н 3,61; N 4,59; S 32,65.
С13Н9NOS3.
Вычислено,%: С 53,40; Н 3,45; N 4,79; S 32,89.
Спектр ИК (KBr), ν, см-1: 1710 (С=0), 1575 (СС аром.), 1440 (CN аром.), 775 (СН).
Регенерация и количество рециркулируемого исходного гетарилмеркаптана совпадает с примером 1.
П р и м е р 8. (1,3-Бензотиазол-2-илтио)наноат [вещество (I)] и 3-нонаноил-2-тиоксо-2,3-дигидро-1,3-бензотиазол [вещество (II)] (X = S).
Фосгенирование исходного гетарилмеркаптана (III) и выделение полупродукта осуществляют по примеру 1.
В раствор, состоящий из 10 мл гексана, 10 мл метиленхлорида и 0,8 г (0,005 моля) нонановой кислоты при перемешивании добавляют 2 г (0,005 моля) выделенного полупродукта. Через 4 ч выдержки при 25оС смесь охлаждают до 10оС, отфильтровывают осадок 2-меркапто-1,3-бензотиазола, фильтрат упаривают наполовину в вакууме водоструйного насоса и охлаждают до -15оС. Выкристаллизовавшийся осадок отфильтровывают. После высушивания в вакууме получают 1,47 г продукта, представляющего собой смесь веществ (I) и (II). Суммарный выход 95% , по обеим стадиям - 94%. Вещества разделяют для идентификации аналогично примеру 6. Получают 1,3 г вещества (I), выход 84%, по обеим стадиям - 83%. Т.пл. 43-45оС.
Найдено,%: С 62,66; Н 6,71; N 4,39; S 20,67.
С16H21NOS2.
Вычислено,%: С 62,50; Н 6,89; N 4,56; S 20,85.
Спектр ИК (CHCl3), ν, см-1: 2920, 2875 (СН), 1710 (С=0), 1600, 1580 (СС аром.), 1450, 1415 (CN аром.).
Спектр ПМР (CDCl3), δ, м.д.: 0,88 (3Н, т, СН3, J = 7,08 Гц), 1,28 (10Н, м, С4-8Н2 наноата), 1,77 (2Н, м, С3Н наноата), 2,78 (2Н, т, С2Н наноата,J = 7,35 Гц), 7,46 (2Н, м, С5Н и С6Н бензотиазола), 7,90 (1Н, д, С4Н бензотиазола, J 7,7 Гц), 8,04 (1Н, д, С7Н бензотиазола, J = 7,7 Гц). Вещество II выделено в количестве 0,075 г, выход по обеим стадиям 5%.
Найдено,%: С 62,58; Н 7,04; N 4,77; S 20,70.
C16H21NOS2.
Вычислено,%: С 62,50; Н 6,89; N 4,56; S 20,85.
Спектр ИК (CHCl3), ν, см-1: 2930, 2865 (СН), 1665 (С=0), 1600 (СС аром. ), 1410 (CN аром.).
Осадок 2-меркапто-1,3-бензотиазола объединяют с метиленхлоридным маточным раствором и обрабатывают аналогично описанному в примере 1. Получают 0,95 г 2-меркапто-1,3-бензотиазола. Возврат в рецикл 98%.
Примеры 9-13 выполнены по примеру 1 и иллюстрируют влияние фрагмента Х на выход веществ I и II. Отличие в условиях синтеза от примера 1 заключается во времени проведения второй стадии. Результаты этих примеров представлены в таблице.
Спектры ИК сняты на приборах Specord М-80 и Perkin-Elmer 457. Регистрацию спектров ЯМР осуществляли на спектрометре Varian XL-400 (рабочая частота по протонам 400 МГц) в импульсном режиме с преобразованием Фурье. Анализ состава смесей соединений выполнен методом ВЭЖХ на приборе "Миллихром-1", колонка С-18 (7,5 мкм), УФ детектор 274 нм.
Как следует из примеров 1-13, заявляемый способ позволяет получать очень широкий спектр ценных гетероароматических органических веществ и свести к минимуму количество неутилизируемых отходов, представляющих в основном HCl или соли HCl, что обеспечивает универсальность способа и его промышленную применимость. Кроме того, помимо гетарилмеркаптанов сырьем для синтеза целевых продуктов является фосген, стоимость которого более, чем в 1000 раз ниже стоимости дициклогексилкарбодиимида и трифенилфосфина. Несоблюдение заявляемых условий приведет к падению выхода продуктов (примеры 4, 5). Особую привлекательность способу придает то, что в случае использования в качестве исходного реагента аминокислоты, амино-группа не требует предварительной защиты, как это продемонстрировано в примере 6.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 5-арил-4-тиоксо-3,4,5,6-тетрагидро-2H-пиридо[3,2-e][1,3]тиазин-7(8H)-онов | 2024 |
|
RU2831154C1 |
| ПРОИЗВОДНОЕ 2-ЗАМЕЩЕННОГО САХАРИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ ИНГИБИТОРНУЮ АКТИВНОСТЬ ПРОТИВ ЭЛАСТАЗЫ | 1992 |
|
RU2101281C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ТРИЦИКЛИЧЕСКОЕ СЕРУСОДЕРЖАЩЕЕ ПРОИЗВОДНОЕ 1,2-ДИГИДРОХИНОЛИНА ДЛЯ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ БЕТА-КОРОНАВИРУСОВ, ВКЛЮЧАЯ SARS-COV-2, И СПОСОБ ЕЕ ПРИМЕНЕНИЯ | 2021 |
|
RU2814434C1 |
| ПРИМЕНЕНИЕ ТРИЦИКЛИЧЕСКОГО СЕРУСОДЕРЖАЩЕГО ПРОИЗВОДНОГО 1,2-ДИГИДРОХИНОЛИНА ДЛЯ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ БЕТА-КОРОНАВИРУСОВ, ВКЛЮЧАЯ SARS-CoV-2 | 2021 |
|
RU2780247C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИЦИКЛИЧЕСКОГО СЕРУСОДЕРЖАЩЕГО ПРОИЗВОДНОГО 1,2-ДИГИДРОХИНОЛИНА ДЛЯ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ БЕТА-КОРОНАВИРУСОВ, ВКЛЮЧАЯ SARS-COV-2 | 2021 |
|
RU2819783C1 |
| ПРОИЗВОДНЫЕ ДИПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, АНТИГИПЕРТОНИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2098424C1 |
| ПРОИЗВОДНЫЕ КАРБАПЕНЕМА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2097383C1 |
| Синтез новых производных 2-меркаптобензтеллуразола, обладающих биологической активностью | 2017 |
|
RU2650516C1 |
| Способ получения активного тиоэфира производных (Z)-2-(2-амино-4-тиазолил)-2-алкоксикарбонилалкоксииминоуксусной кислоты | 1985 |
|
SU1380612A3 |
| Способ получения замещенных производных пенем-3-карбоновой кислоты или их сложных эфиров или их солей с щелочными металлами | 1983 |
|
SU1299512A3 |
Использование: в химии гетероциклических веществ, в частности в качестве полупродуктов для синтеза антибиотиков цефалоспоринового и пеницилинового рядов. Сущность изобретения: способ совместного получения тиоэфиров и амидов кислот ф-лы 1 и 2 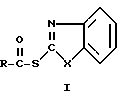
 , где х - сера, кислород, имин, метил (этил или пропил) имин, R-остаток карбоновой кислоты, ведут реакцией гетерилмеркаптана ф-лы 3
, где х - сера, кислород, имин, метил (этил или пропил) имин, R-остаток карбоновой кислоты, ведут реакцией гетерилмеркаптана ф-лы 3 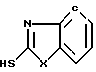 с фосгеном в водно-органической среде в присутствии шелочи при (-5) - (+10)°С и молярном соотношении гетарилмеркаптана и фосгена, равном 2:(1-1,2), и полученный продукт подвергают взаимодействию с карбоновой кислотой при ее молярном соотношении с гетерилмеркаптаном 1:2. 1 табл.
с фосгеном в водно-органической среде в присутствии шелочи при (-5) - (+10)°С и молярном соотношении гетарилмеркаптана и фосгена, равном 2:(1-1,2), и полученный продукт подвергают взаимодействию с карбоновой кислотой при ее молярном соотношении с гетерилмеркаптаном 1:2. 1 табл.
СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ ТИОЭФИРОВ И АМИДОВ КАРБОНОВЫХ КИСЛОТ общих формул I и II соответственно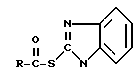
где X = S, NH, CH3N, C2H5N, C3H7N, O;
R - остаток карбоновой кислоты,
включающий переработку, гетарилмеркаптанов общей формулы III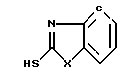
и карбоновых кислот общей формулы IV
R - COOH
где X и R имеют указанные значения, в среде органического растворителя, отличающийся тем, что, с целью уменьшения количества неутилизируемых отходов и обеспечения универсальности способа, исходный гетарилмеркаптан III подвергают взаимодействию с фосгеном в водно-органической среде в присутствии щелочи при (-5) - 10oС и молярном соотношении гетарилмеркаптана и фосгена 2 : 1,0 - 1,2 и полученный полупродукт подвергают взаимодействию с карбоновой кислотой при молярном соотношении исходного гетарилмеркаптана и карбоновой кислоты 2 : 1 с последующим выделением целевого продукта и рециркулируемого гетарилмеркаптана.
| ПРИБОР ДЛЯ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ЛЕТНЕЙ ДРЕВЕСИНЫ В ДЕРЕВЕ | 1933 |
|
SU37380A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-03-10—Публикация
1992-02-19—Подача