Изобретение относится к новым азотсодержащим гетероциклическим соединениям, имеющим ценные свойства, в частности к производным R(-)-3-хинуклидинола общей формулы I
R1-N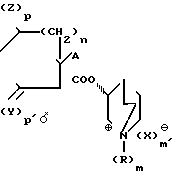 где R неразветвленный или разветвленный низший алкил, циклоалкилалкил с 3-7 атомами углерода в циклоалкильной части и 1-2 атомами углерода в алкильной части;
где R неразветвленный или разветвленный низший алкил, циклоалкилалкил с 3-7 атомами углерода в циклоалкильной части и 1-2 атомами углерода в алкильной части;
R1 водород, неразветвленный или разветвленный низший алкил или ацил формулы R2-СО, в которой R2 означает водород или неразветвленный или разветвленный низший алкил;
А циклоалкил с 5-7 атомами углерода, фенил, тиофен, пиридин;
Х анион органической или неорганической кислоты,
Y и Z оба означают кислород, или каждый из них означает кислород или серу;
m и m' одинаковы и означают целое число 0 или 1;
n целое число 1, 2 или 3;
р и р' одинаковы и означают l, или различны и означают 0 и 1, причем А и группа 3-хинуклидинового эфира находятся в геминальном положении, в виде смеси их диастереомеров или индивидуальных диастереомеров или их солей, обладающим, в частности, фармакологической активностью, в особенности антимускариновой активностью.
Новые соединения общей формулы I, где m и m' означают О, а A, Y, Z, R1, n, p и р' имеют указанные значения, получают, например, путем взаимодействия R(-)-хинуклидинола с получаемым, в случае необходимости, на месте соединением общей формулы II
R1-N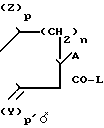 где R1, Z, Y, A, n, p и p' имеют указанные значения, а L означает пригодную удаляемую группу.
где R1, Z, Y, A, n, p и p' имеют указанные значения, а L означает пригодную удаляемую группу.
Пригодными удаляемыми группами являются, например, атом галогена, низший алкоксил, феноксигруппа, имидазол-1-ил, этилкарбонилокси-группа, мезилокси-группа, и (бензотриазол-1-ил)-окси-группа, предпочтительно атом хлора, этокси-группа, имидазол-1-ил.
Выход продукта реакции можно простым образом повысить путем добавления к реакционной смеси основного вещества, как, например, катализатора, например, кускового металлического натрия, гидрата натрия, 5-диметил-аминопиридина, триэтил- амина, 1,8-диазабицикло-[5,4,0]ундец-7-ена или пиридина. Реакцию осуществляют в среде безводного инертного растворителя, например, дихлорметана, хлороформа, бензола, толуола, этилацетата, тетрагидрофурана, диметилформамида или их смеси. Обычно реакцию проводят при температуре 0-100оС, предпочтительно при 50оС.
Соединения общей формулы I, где m и m' означают I, а R, X, R1, A, Y, Z, n, p и p' имеют указанные значения, получают путем взаимодействия с соединением общей формулы III
R1-N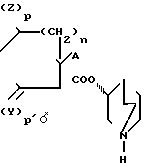 где R1, Y, Z, A, n, p и p' имеют указанные значения, с пригодным алкилирующим агентом, например, неразветвленным или разветвленным низшим алкилгалогенидом, галоидным циклоалкилом с 1-2 атомами углерода в алкильной части, алкилгалогенидом, аралкилгалогенидом или диметил- сульфатом, предпочтительно метилбромидом, метилбромидом циклопропила или диметилсульфатом. Реакцию осуществляют в среде полярного растворителя, напр. ацетонитрила, метанола, этанола, предпочтительно ацетонитрила, при 30-70оС, предпочтительно 50оС.
где R1, Y, Z, A, n, p и p' имеют указанные значения, с пригодным алкилирующим агентом, например, неразветвленным или разветвленным низшим алкилгалогенидом, галоидным циклоалкилом с 1-2 атомами углерода в алкильной части, алкилгалогенидом, аралкилгалогенидом или диметил- сульфатом, предпочтительно метилбромидом, метилбромидом циклопропила или диметилсульфатом. Реакцию осуществляют в среде полярного растворителя, напр. ацетонитрила, метанола, этанола, предпочтительно ацетонитрила, при 30-70оС, предпочтительно 50оС.
Соединения общей формулы I, где m и m' означают 0, в случае необходимости можно переводить в соответствующие физиологически переносимые кислотно-аддитивные соли, напр. путем реакции с неорганической или органической кислотой известным методом, напр. путем реакции соединений в виде основания с раствором или соответствующей кислоты в среде пригодного растворителя. Особенно предпочтительными кислотами является, напр. хлористоводородная кислота, бромоводородная кислота, серная кислота, метансульфокислота или винная кислота.
Радикалы А и сложные 3-хинуклидиниловые эфиры могут вводиться в соединения формулы I в любом положении кольца, свободным для замещения. Но они всегда находятся вместе на том же атоме углерода, чем получается геминальное замещение. Соединения формулы I согласно изобретению имеют второй центр хиральности, которым является атом углерода, с которым связаны геминальные заместители А и сложный 3-хинуклидиниловый эфир, и поэтому они могут иметься в виде смеси двух диастереомеров.
В случае наличия смеси диастереомеров ее можно разделять на чистые индивидуальные компоненты известными методами разделения на основе их различных физических и химических свойств, например, путем фракционной кристалли- зации или хроматографии с использованием соответствующей смеси растворителей.
Получение соединений формулы I поясняется следующими примерами.
П р и м е р 1. Пиперидин-2-оксо-4-фенил-4-[(R)-1-азабицикло(2.2.2)октил] -карбо-ксилат (соединение 1).
Раствор 1,09 г 2-оксо-4-фенил-2-пиперидинкарбоксильной кислоты и 0,81 г 1,1-карбонилдиимидазола в 12 мл безводного диметилформамида каплями добавляют к хорошо размешиваемому раствору 0,64 г R(-)-3хинуклидинола и 0,15 г 80% -ного раствора гидрида натрия в безводном диметилформамиде. Реакционную смесь размеши- вают при комнатной температуре в течение ночи, затем диметилформамид удаляют в вакууме. Остаток распределяют между водой и этилацетатом: органический слой промывают водой, сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток подвергают хроматографии на силикагеле (элюент: смесь метиленхлорида, метанола и гидроокиси аммония в соотношении 90:10:1). Целевой продукт получают в виде смеси диастереомеров в соотношении 1:1. Выход: 0,72 г. Т.п. 177-179оС (из простого диэтилового эфира). МС 329 m/e [М + Н]
Колоночная жидкостная хроматография под давлением (далее: "КЖХ"):
Диастереомер А. след 6.11. Диастереомер В= след 6,73.
[Элюенты: ацетонитрил и фосфат триэтиламмония в соотношении 60:40 при 40оС]
Вычислено, С 69,49; Н 7,37; N 8,53.
С19Н24N2O3
Найдено, С 69,41; Н 7,40; N 8,49.
Описанным в примере 1 образом получают еще следующее соединение:
Пирролидин-2-оксо-4-фенил-4-[(R)-1-аза- бицикло(2.2.2)октил]-карбоксилат (соединение 2).
Т. п. 90-94оС (разложение) (из простого диэтилового эфира). МС=315 m/е [М+Н]
КЖХ: Диастереомер А, след 8,67. Диастереомер В, след 9,08.
[Элюенты: ацетонитрил, фосфат триэтиламмония и вода в соотношении 15:40: 45, при температуре 40оС]
Вычислено, С 68,77; Н 7,05; N 8,91;
С18Н22N2O3.
Найдено, С 68,71; Н 7,12; N 8,90.
П р и м е р 2. Пирролидин-2-оксо-3-фенил-3-[(R)-1-азабицикло(2.2.2)октил]-карбо-ксилат (соединение 3).
1 г (R)(-)-хинуклидинола растворяют в 50 мл бензола и в течение 30 мин нагревают с обратным холодильником с целью полного удаления воды. Добавляют 0,18 г кускового металлического натрия и полученную суспензию нагревают с обратным холодильником в течение 60 мин. Добавляют раствор 1,6 г пирролидин-2-оксо-3-фенил-3-этилкарбоксилата в 20 мл сухого бензола, затем реакционную смесь нагревают с обратным холодильником в течение 6 ч. Охлажденный раствор в вакууме упаривают досуха, остаток поглощают этилацетатом и водой и промывают водой. Органический слой сушат над сульфатом натрия и упаривают досуха. Полученный при этом желтоватый остаток подвергают хроматографии на силикагеле (элюент: смесь метиленхлорида, метанола и гидроокиси аммония в соотношении 90: 10:1, Rf 0,27). Целевой продукт получают в виде смеси диастереомеров в соотношении 1:1. Выход 0,64 г, т.пл. 142-143оС.
МС 315 m/e [М + Н]
КЖХ: диастереомер А. след 9,25. Диастереомер В. след 11, 42.
[Элюенты: ацетонитрил, фосфат триэтиламмония и вода в соотношении 15:50: 35, при температуре 40оС]
Вычислено, С 68,77; Н 7,05; N 8,91.
С18Н22N2O3
Найдено, С 68,70; Н 7,21; N 8,83.
Описанным в примере 2 образом получают еще следующие соединения.
Пиперидин-2,6-диоксо-3-фенил-3-[(R)-1- азабицикло(2.2,2)октил] -карбоксилат (соединение 4).
Т.пл. 160-163оС.
МС 343 m/e [М+Н]
КЖХ: Диастереомер А, след 8,63. Диастереомер В, след 9,04.
[Элюенты: ацетонитрил, фосфат триэтиламмония и вода в соотношении 40:40: 20, при температуре 40оС]
Вычислено, С 66,65; Н 6,48; N 8,18.
С19Н22N2O3.
Найдено, С 66,57; Н 6,51; N 8,22. Пиперидин-2-оксо-6-фенил-[(R)-1-аза-бицикло(2,2,2)октил]-карбоксилат (соединение 5).
Т.пл. 144-150оС (разложение) (в виде хлористоводородной соли, из простого диэтилового эфира).
МС 329 m/e [М + Н]
КЖХ: диастереомер А, след 22,40. Диастереомер В, след 24,06.
[Элюенты: n-гексан, изопропанол и метанол в соотношении 88:10:2, при температуре 25оС]
Вычислено, С 62,54; Н 6,91; N 7,68.
С19Н25ClN2O3
Найдено, С 62,28; Н 6,99; N 7,60.
Пирролидин-2-оксо-5-фенил-5-[(R)-1-аза- бицикло(2.2.2)октил]-карбоксилат (соединение 6).
Т.пл. 125-127оС (разложение) (в виде хлористоводородной соли из простого диэтилового эфира).
МС 315 m/e [М + Н]
КЖХ: диастереомер А, след 4,40. Диастереомер В, след 4,90.
[Элюенты: ацетонитрил, 0,01 молярная фосфорная кислота с 0,02% триэтиламина (рН 3) и вода в соотношении 30:40:30 при температуре 40оС]
Вычислено, С 61,62; Н 6,61; N 7,98.
С18Н23ClN2O3
Найдено, С 61,03; Н 6,70; N 7,82.
Пиперидин-1-ацетил-3-фенил-3[(R)-1- азабицикло(2.2.2)октил]-карбоксилат (соединение 7).
Густое масло.
МС 357 m/e [М+Н).
КЖХ: диастереомер А, след 4,45. Диастереомер В, след 4,77.
[Элюенты: ацетонитрил, фосфорная кислота и вода в соотношении 40:40:20, при температуре 40оС]
Вычислено, С 70,76; Н 7,92; N 7,86.
С21Н28N2O3
Найдено, С 70,50; Н 7,97; N 7,72.
Пиперидин-2-оксо-5-(пиридин-2-ил)-5- [(R)-1-азабицикло(2.2.2)октил]-карбоксилат- (соединение 8).
Т.пл. 160-163оС.
МС 330 m/e [М+Н]
КЖХ: диастереомер А, след 6,93. Диастереомер В, след 7,51.
[Элюенты: ацетонитрил, фосфорная кислота и вода в соотношении 10:40:50, при температуре 40оС]
Вычислено, С 65,63; Н 7,04; N 12,76.
С18Н23N3O3
Найдено, С 65,48; Н 7,06; N 12,69.
Пиперидин-2-тиоксо-3-фенил-3-[(R)-1- азабицикло(2.2.2)октил]-карбоксилат (соединение 9).
Т.пл.111-113оС.
МС 345 m/e [М+Н]
КЖХ: диастереомер А, след 15,70. Диастереомер В, след 18,00;
[Элюенты: n-гексан, метанол и изопропанол в соотношении 85:7:8 при температуре 25оС]
Вычислено, С 66,24; Е 7,02; N 8,13.
С19Н24N2O2S.
Найдено, С 65,88; Н 6,95; N 8,00.
Пиперидин-2-оксо-3-(тиофен-2-ил)-3- [(R)-1-азабицикло(2.2.2)октил]-карбоксилат (соединение 10).
Т.пл. 132оС.
МС 335 m/e [М+Н]
КЖХ: диастереомер А, след 20,40. Диастереомер В, след 22,00;
[Элюенты: n-гексан, метанол и изопропанол в соотношении 88:6:6, при температуре 30оС]
Вычислено, С 61,05; Н 6,63; N 8,38.
С17Н22N32O3S.
Найдено, C 60,45; Н 6,67; N 8,17.
Пиперидин-2-оксо-3-фенил-3-[(R)-1-аза- бицикло(2.2.2)октил]-карбоксилат (соединение 11).
Т.пл. 153-156оС (из петролейного эфира).
МС 329 m/e [М+Н]
КЖХ: диастереомер А, след 14,8. Диастереомер В, след 16,5.
[Элюенты: n-гексан, изопропанол и метанол в соотношении 88:6:6 при температуре 25оС]
Вычислено, С 69,49; Н 7,37; N 8,53.
С19Н24N2O3.
Найдено, С 69,61; Н 7,41; N 8,44.
Пиперидин-2-оксо-5-фенил-5-[(R)-1-аза- бицикло(2.2.2)октил]-карбоксилат (соединение 12).
Т.пл. 181-184оС (из петролейного эфира).
МС 329 m/e [М+Н]
КЖХ: диастереомер А, след 9,6. Диастереомер В, след 11,1.
[Элюенты: ацетонитрил, фосфат триэтиламмония (рН 3) и вода в соотношении 15:50:35, при температуре 40оС]
Вычислено, С 69,49; Н 7,37; N 8,53.
С19Н24N2O3.
Найдено, С 69,80; Н 7,30; N 8,46.
П р и м е р 3. Азепин-2-оксо-6-фенил-6-[(R)-1-азабицикло(2.2.2)октил]-карбоксилат.
Суспензию 0,95 г R(-)-3-хинуклидинола и 0,17 г натрия в безводном тетрагидрофуране в течение 30 мин нагревают с обратным холодильником, затем охлаждают. Вводят раствор 1,6 г азепин-2-оксо-6-фенил-6-этилкарбоксилата и 1,1 г 1,1-карбонилдиимидазола в 30 мл безводного тетрагидрофурана, и полученную реакционную смесь в течение 4 ч нагревают с обратным холодильником. После охлаждения добавляют несколько капель ледяной уксусной кислоты и реакционную смесь упаривают досуха. Путем флеш-хроматографии на силикагеле с использованием в качестве элюента смеси метиленхлорида, метанола и гидроокиси аммония в соотношении 95:5:0,5 разделяют пару диастереомеров на чистый верхний (Rf 0,3) и чистый нижний (Rf 0,25) компоненты. Компоненты упаривают досуха, вследствие чего получают индивидуальные диастереомеры А и В в виде белого твердого вещества (после обработки простым диэтиловым эфиром).
Диастереомер А (соединение 13).
Т.пл. 171-175оС (разложение) (из простого диэтилового эфира).
МС 343 m/e [М+Н]
КЖХ: след 4,78.
[Элюенты: ацетонитрил, фосфат триэтиламмония и вода в соотношении 30:40: 30, при 40оС]
Вычислено, С 70,15; Н 7,65; N 8,18.
С20Н26N2O3.
Найдено, С 70,01; Н 7,67; N 8,24.
Диастереомер В (соединение 14).
Т.пл. 156-159оС (разложение) (из простого диэтилового эфира).
МС 343 m/e [М + Н]
КЖХ: след 5,63.
[Элюенты: ацетонитрил, фосфат триэтиламмония и вода в соотношении 30:40: 30, при 40оС]
Вычислено, С 70,15; Н 7,65; N 8,18.
С20Н26N2O3.
Найдено, С 70,24; Н 7,61; N 8,22.
П р и м е р 4. Пиперидин-1-метил-2-оксо-3-фенил-3-[(R)-1-азабицикло(2.2.2(октил] -карбоксилат (соединение 15).
0,4 г натрия и 7 мл метанола подают в 400 мл безводного гептана. Когда весь натрий растворен, отгоняют избыточным метанолом и добавляют 2,54 г R(-)-3-хинукли- динола и 4,98 г пиперидин-1-метил-2-оксо-3-фенил-3-этилкарбоксилата. Реакционную смесь нагревают и примерно 300 мл раствора в течение 3 ч перегоняют. После охлаждения каплями добавляют 40 мл хлористо- водородной кислоты (2 N), отделенный органический слой нейтрализуют 10%-ной гидроокисью натрия, экстрагируют этилацетатом и упаривают. Получают сырой целевой продукт в виде прозрачного масла, который подвергают очистку путем хроматографии на колонне с использованием в качестве элюента смеси метиленхлорида, метанола и гидроокиси аммония в соотношении 90:10:1. Выход: 2,8 г, т.пл. 58-64оС (разложение) (в виде лиофилизированной хлористоводородной соли).
МС 343 m/e [М + Н]
КЖХ: диастереомер А, след 13,53. Диастереомер В, след 14,76.
[Элюенты: n-гексан, изопропанол и метанол в соотношении 90:4:6, при 25оС]
Вычислено, С 63,39; Н 7,18; N 7,39.
С20Н27ClN2O3.
Найдено, С 63,20; Н 7,22; N 7,29.
П р и м е р 5. Пиперидин-2-оксо-3-циклогесил-3-[(R)-1-азабицикло(2.2.2)октил]-кар- боксилат (соединение 16).
1 г калиевой соли пиперидин-2-оксо-3-циклогексил-3-карбоновой кислоты порциями добавляют к охлаждаемому раствору 10 мл тионилхлорида в 10 мл безводного бензола. Суспензию размешивают при комнатной температуре в течение ночи, затем упаривают досуха. Полученный сырой остаток суспендируют в 20 мл безводного тетрагидрофурана, затем при размешивании добавляют 0,96 г R(-)-3-хинуклидинола. Реакционную смесь размешивают при комнатной температуре в течение 4 ч, затем упаривают досуха. Полученный сырой остаток подвергают очистке путем хроматографии на колонне на силикагеле с использованием в качестве элюента смеси метиленхлорида, метанола и гидроокиси аммония в соотношении 90:10:1 (Rf 0,22). Получают 0,6 г чистого целевого продукта в виде прозрачного густого масла. Т.пл. 58-62оС (разложение) (в виде лиофилизированной хлористоводородной соли).
МС 335 m/e [М + Н]
КЖХ: диастереомер А, след 8,73. Диастереомер В, след 10,28.
[Элюнты: n-гексан, изопропанол и метанол в соотношении 88:6:6, при 25оС]
Вычислено, С 61,52; Н 8,42; N 7,55.
С19Н31ClN2O3.
Найдено, С 61,41; Н 8,50; N 7,50.
П р и м е р 6. Метилбромид азепин-2-оксо-6-фенил-6-[(R)-1-азабицикло(2.2.2)октил] карбоксилата (соединение 17).
Раствор 0,5 г азепин-2-оксо-6-фенил-6-[(R)-1-азабицикло(2.2.2)октил]-карбоксилата и 1,53 мл метилбромида (2-молярного раствора в простом диэтиловом эфире) в 7 мл ацетонитрила размешивают при комнатной температуре в течение 2 дней. Полученный раствор упаривают досуха и путем лиофилизации получают 0,55 г чистого целевого продукта в виде прозрачного густого масла. Т.пл. 60-68оС (разложение) (после лиофилизации).
КЖХ: диастереомер А, след 3,80.
[Элюенты: ацетонитрил, 0,01-молярная фосфорная кислота с 0,02% триэтиламина и вода в соотношении 30:40:30, при температуре 40оС]
Вычислено, С 57,67; Н 6,68; N 6,40.
С21Н29BrN2O3.
Найдено, С 57,00; Н 6,89; N 6,15.
Описанным в примере 6 методом из соответствующих промежуточных соединений можно получать еще следующие соединения.
Циклопропилметилбромид пиперидин-2-оксо-5-фенил-5-[(R)-1-азабицикло(2.2.2)ок- тил]-карбоксилата (соединение 18).
Т.пл. 65-70оС (разложение) (после лиофилизации).
КЖХ: смесь диастереомеров, след 10,10.
[Элюенты: ацетонитрил, 0,01-молярная фосфорная кислота с 0,02% триэтиламина (рН 3) и вода в соотношении 20:60:20, при 40оС]
Вычислено, С 59,61; Н 6,74; N 6,05.
С23Н31BrN2O3.
Найдено, С 59,48; Н 6,79; N 6,00.
Метилбромид пиперидин-2-оксо-5-фенил-5-[(R)-1-азабицикло(2.2.2)октил]-карбо-ксилата. (соединение 19).
Т.пл. 112оС (разложение).
КЖХ: диастереомер А, след 8,85. Диастереомер В, след 9,34.
[Элюенты: ацетонитрил, фосфат триэтиламмония и вода в соотношении 15:50: 35 при 40оС]
Вычислено, С 56,74; Н 6,43; N 6,62.
С20Н27BrN2O3.
Найдено, С 56,80; Н 6,38; N 6,68.
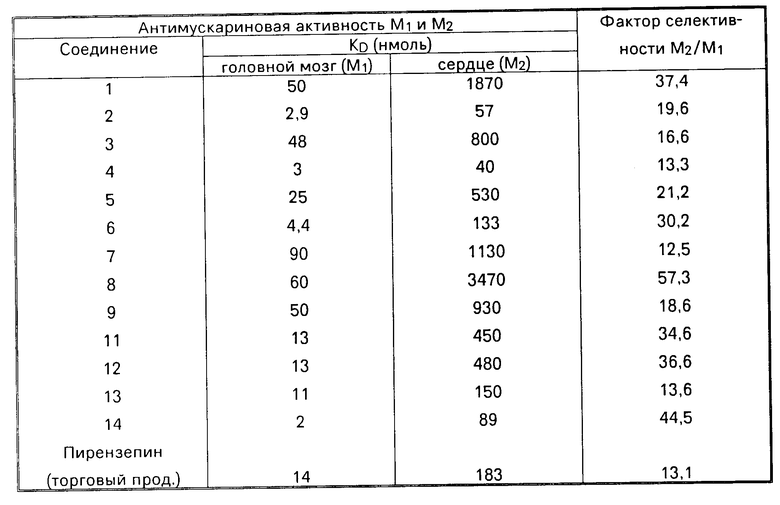
Фармакология
Антимускариновая активность и селективность.
Антимускариновую активность и селективность определяли in vitro в опытах по связыванию рецепторов на двух видах ткани, содержащей мускариновые рецепторы М1 м М2, а именно коры головного мозга и сердца, и в функциональных опытах на изолированных кишке и левом предсердце морской свинки.
Опыты in vitro по связыванию рецепторов.
Антимускариновую активность М1 определяли анализом вытеснения 3Н-пирензепина из гомогенизированной коры головного мозга, проведенным нижеследующим образом.
Для опыта использовали кору головного мозга крыс-самцов массой 220-250 г. Процесс гомогенизации осуществляли в среде натриево-магниевого HEPES с рН 7,4 (100 ммоль хлористого натрия, 10 ммоль хлористого магния и 20 ммоль HEPES) фильтрованием суспензии через двухслойную марлю. Кривые по активности исследуемых соединений составляли косвенно по результатам контрольного опыта с 0,5 нмоль 3Н-пирензепина, маркирующего мускариновые рецепторы коры головного мозга. 1 мл гомогенной массы инкубировали при температуре 30оС в течение 45 мин в присутствии маркирующего лиганда и холодных лигандов в разных количествах, в этих условиях достигали того равновесия, как и в соответствующих параллельных опытах. Инкубацию заканчивали центрифугированием (12000 об/мин в течение 3 мин). Для удаление свободной радиоактивности центрифугат дважды промывали 1,5 мл солевого раствора. Отрезали концы трубок, содержащих центрифугат, добавляли 200 мкл солюбилизатора ткани и оставляли стоять в течение ночи. Затем добавляли 4 мл сцинтиллирующей жидкости (димилум в толуоле в объемном соотношении 1:10) и измеряли радиоактивность.
Опыты проводили по три и четыре раза и неспецифическую связь определяли как связанную или заключенную в центрифугате радиоактивность, когда среда инкубации содержала 1 мкмоль сульфата атропина. Неспецифическая связь составляла в среднем менее 30% Значение КD (постоянную диссоциации) определяли анализом нелинейной регрессии согласно Г.Гайнцель, "Pharmacokinetics During Drug Development: Data Analysis and Evaluation Techniques", под ред. Г.Болцера и Ж.М. фан Россума, стр. 207, изд. Г.Фишер, Нью-Йорк, 1982.
Антимускариновую активность М2 определяли анализом вытеснения 3Н-NMS из гомогенизированного сердца в соответствии с описанной методикой.
Результаты исследований приведены в таблице.
Данные таблицы свидетельствуют о том, что новые соединения являются более селективными, чем торговый продукт пирензепин (5,II-дигидро-II-[(4-метил-I-пиперизинил)-ацетил]-6Н-пиридо[2,3-b][1,4] бензодиазепин-6-он), опубликованный в Rote Liste 1986, изд. Едитио контор, DE, стр.57, и препарат Nо 59123).
Новые соединения относятся к категории среднетоксичных веществ.
Использование: в фармакологии, в частности в качестве физиологически активных веществ. Сущность изобретения: продукт - производные R(-)-3-хинуклидинола ф-лы I (см. чертеж), где R - не- или разветвленный низший алкил, C3-C7 -цикло- C1-C2 -алкил; R1 - водород или не- или разветвленный низший алкил или ацил ф-лы: R2-C(O)-, где R2 - водород или не- или разветвленный низший алкил; А - C5-C7 - циклоалкил, фенил, тиенил, пиридил; Х - анион не- или органической кислоты; Y и Z - оба - кислород, или один из них кислород или сера; m и m′ = 0 или 1; n = 1-3; р = p′ = 1, или р и p′ различный равны 0 или 1, причем А и группа 3-хинуклидинового эфира находятся в геминальном положении. 1 з.п. ф-лы, 1 табл.
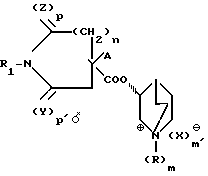
где R неразветвленный или разветвленный низший алкил, C3 - C7-цикло-C1-C2-алкилалкил;
R1 водород, неразветвленный или разветвленный низший алкил или ацил общей формулы R2 CO, где R2 водород или неразветвленный или разветвленный низший алкил;
A C5 C7-циклоалкил, фенил, тиенил, пиридил;
X анион органической или неорганической кислоты,
Y и Z оба кислород или один из них кислород или сера,
m и m′ одинаковы и означают целое число 0 или 1; n 1,2 или 3;
p и p′ одинаковы и означают 1 или различны и означают 0 и 1,
причем А и группа 3-хинуклидинового эфира находятся в геминальном положении,
в виде смеси их диастереомеров или индивидуальных диастереомеров или их солей.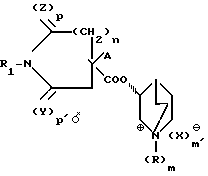
где R неразветвленный или разветвленный низший алкил, C3 - C7-цикло-C1 C2-алкилалкил;
R1 водород, неразветвленный или разветвленный низший алкил или ацил общей формулы R2 CO, где R2 водород или неразветвленный или разветвленный низший алкил;
A C5 C7 циклоалкил, фенил, тиенил, пиридил;
X -анион органической или неорганической кислоты;
Y и Z оба кислород или один из них кислород или сера;
m и m′ одинаковы и означают 0 или 1;
n 1,2 или 3;
p и p′ одинаковы и означают 1 или различны и означают 0 и 1,
причем A и группа 3-хинуклидинового эфира находятся в геминальном положении, в виде смеси их диастереомеров или индивидуальных диастереомеров или их фармакологически переносимых солей, обладающие антимускариновой активностью.
| Патент США N 4820715, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1995-05-10—Публикация
1992-03-10—Подача