Изобретение относится к новым азотсодержащим гетероциклическим соединениям, в частности к производным хиназолин- или бензодиазепинкарбоновой кислоты формулы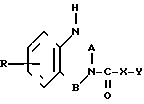 (I) где R водород, галоген, низший алкил или низшая алкоксигруппа;
(I) где R водород, галоген, низший алкил или низшая алкоксигруппа;
А группа С О или С S;
В группа -СН2-СН2- или -СНR1, где R1 означает водород, низший алкил или гидроксил;
Х кислород или группа NH
Y группа формулы 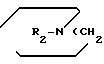 )q где R2 означает низший алкил, q равно 2 или 3, и их солям, в частности физиологически переносимым солям, которые обладают фармакологической активностью, в частности антимускариновой активностью, и поэтому могут использоваться для лечения болезней желудочно-кишечного тракта и дыхательных путей.
)q где R2 означает низший алкил, q равно 2 или 3, и их солям, в частности физиологически переносимым солям, которые обладают фармакологической активностью, в частности антимускариновой активностью, и поэтому могут использоваться для лечения болезней желудочно-кишечного тракта и дыхательных путей.
Соединения формулы (I) можно получать известными методами, например, путем взаимодействия соединения общей формулы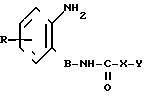 (II) где R, B, X и Y имеют вышеуказанное значение, с соединением формулы
(II) где R, B, X и Y имеют вышеуказанное значение, с соединением формулы
Q1- -Q2 (III), где Q1 и Q2 идентичны или различны и означают отщепляемую группу, например, атом галогена, незамещенную или замещенную галоидом низшую алкоксигруппу, имидазолил, незамещенную или замещенную феноксигруппу, предпочтительно хлорид, этоксигруппу, феноксигруппу, трихлорметоксигруппу или имидазолил.
-Q2 (III), где Q1 и Q2 идентичны или различны и означают отщепляемую группу, например, атом галогена, незамещенную или замещенную галоидом низшую алкоксигруппу, имидазолил, незамещенную или замещенную феноксигруппу, предпочтительно хлорид, этоксигруппу, феноксигруппу, трихлорметоксигруппу или имидазолил.
Реакцию можно осуществлять в среде апротонного растворителя, например, тетрагидрофурана, метилендихлорида, хлороформа, ацетона, ацетонитрила, в отсутствии или присутствии акцептора кислоты, например, триэтиламина, пиридина, карбоната натрия или калия, при 20-100оС, предпочтительно при комнатной температуре.
Получаемый целевой продукт можно переводить в другой целевой продукт формулы (I) известными приемами.
Новые соединения формулы (I) являются особенно пригодными для профилактики или лечения болезней, в которых роль играют мускариновые рецепторы, в частности для лечения болезней, связанных с чрезмерной секрецией кислот, неполадками кишечной перестальтики и закупоривающими спастическими явлениями в дыхательных путях, причем они не имеют никакого побочного эффекта на частоту сердечных сокращений.
Нижеследующие опыты показывают, что предлагаемые соединения имеют соответственные полезные свойства.
Фармакология. Антимускариновая активность и селективность.
Антимускариновую активность и селективность определяли in vitro в опытах по связыванию рецепторов на двух видах ткани, содержащей мускариновые рецепторы М1 и М2, а именно коры головного мозга и сердца, и в функциональных опытах на изолированных кишке и левом предсердце морской свинки.
Опыты in vitro по связыванию рецепторов.
Мускариновую М1 активность определяли анализом вытеснения 3Н-пирензепина из гомогенизированной коры головного мозга, проведенным нижеследующим образом.
Для опыта использовали кору головного мозга самцов крыс CD-COOBBS весом 220-250 г. Процесс гомогенизации осуществляли в аппаратуре Поттер-Эвельхьем в среде натриево-магниевого буфера НEPES с рН7,4 (100 ммоль хлористого натрия, 10 ммоль хлористого магния и 20 ммоль HEPES) фильтрованием суспензии через двухслойную марлю. Кривые по связыванию исследуемых соединений составляли косвенно по результатам контрольного опыта с 0,5 нмоль 3Н-пирензепина, маркирующего мускариновые рецепторы коры головного мозга. 1 мл гомогенной массы инкубировали при 30оС в течение 45 мин в присутствии маркирующего лиганда и холодного лиганда в разных количествах, и в этих условиях достигали того равновесия, как и в соответствующих параллельных опытах. Инкубацию заканчивали центрифугированием (12000 об/мин в течение 3 мин) при комнатной температуре в центрифуге Эппендорфа. Для удаления свободной радиоактивности центрифугат дважды промывали 1,5 мл солевого раствора. Отрезали концы трубок, содержащих центрифугат, добавляли 200 мкл солюбилизатора ткани и оставляли стоять в течение ночи. Затем добавляли 4 мл сцинтилирующей жидкости (смесь димилума и толуола в объемном соотношении 1:10) и измеряли радиоактивность.
Опыты проводили по три или четыре раза, и неспецифическую связь определяли как связанную или заключенную в центрифугат радиоактивность, когда среда инкубации содержала 1 мкмоль сульфата атропина. Неспецифическая связь составляла в среднем менее 30% Значение КD(постоянную диссоциации) определяли анализом нелинейной регрессии известным способом.
Мускариновую М2 активность определяли анализом вытеснения 3Н-NMS из всего гомогенизированного сердца в соответствии с методикой, описанной выше для мускариновой М1 активности.
Функциональные опыты in vitro
Опыт на кишке морской свинки.
Участок длиной 2 см конечной кишки препарировали по известному методу, его суспендировали в растворе Тироде и сокращали повышающимися количествами бетанхола (пределы концентрации 0,3-10 мкмоль, ЭК50 1,5 мкмоль). Реакцию зарегистрировали изотонически. Значения Кb рассчитывали согласно Арунлакшана и Шильд.
Опыт на левом предсердце морской свинки.
Ткани при 32оС подали в раствор Эвена (131,6 ммоль хлорида натрия, 5,6 ммоль хлорида калия, 2,16 ммоль хлорида кальция, 24,9 ммоль бикарбоната натрия, 1,03 ммоль динатрийфосфата, 11 ммоль глюкозы и 13 ммоль сахарозы) и возбуждали импульсами в виде квадратных волн продолжительностью 2 мс и частотой 3 Гц, лежащими на 100% выше порогового напряжения, подаваемыми через платиновые электроды. Инотропную активность определяли изометрически. Использовали повышающиеся количества бетанкола (1-30 мкмоль) для возбуждения отрицательного инотропного эффекта. Значения Кb оценивали вышеупомянутым методом.
Результаты опытов приведены в таблице.
Приведенные в таблице соединения 1-25 относятся к категории среднетоксичных веществ.
П р и м е р 1. Сложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 1).
Раствор 30,4 г (N-(аминобензил)-эндо-8-метил-8-азабицикло[3.2.1]окт-3-илкарбама- та и 12,74 г триэтиламина в 0,5 л метиленхлорида в течение 2,5 ч каплями добавляют к охлаждаемому до 3-6оС раствору 22,86 г трихлорметилхлороформата в 240 мл того же самого растворителя. Получаемый раствор продолжают перемешивать при комнатной температуре в течение часа, затем добавляют воду, и органический слой удаляют. Водный слой обрабатывают 10%-ным раствором гидроокиси натрия и экстрагируют метиленхлоридом. После сушки и удаления растворителя путем упаривания получают целевой продукт, который кристаллизует из этанола. Выход: 30,3 г указанного соединения в виде гидрохлорида. Точка плавления >260оС; точка плавления свободного основания 175-177оС.
Анализ C17H21N3O3 ˙ HCl:
Вычислено, С 58,03; Н 6,30; N 11,94
Найдено, C 59,28; H 6,36; N 11,68.
МС: 316 м/e [M+H]+
Аналогичным образом получают следующие соединения:
Cложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-6-метил-2(Н)-2-оксо-3-хинозолинкарбоновой кислоты (соединение 2).
Цитрат; точка плавления 158-160оС.
Анализ C18H23N3O3 ˙ C6H8O7:
Вычислено, C 55,27; H 5,99; N 8,05;
Найдено, С 54,72; Н 6,02; N 7,90.
Сложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-6-метокси-2(Н)-2-оксо-3-хиназолинкарбоно- вой кислоты (соединение 3).
Гидрохлорид; точка плавления >260оС.
Анализ C18H23N3O4 ˙HCl:
Вычислено, C 56,61; H 6,33; H 11,00;
Найдено, C 56,19; H 6,35; N 10,90.
Сложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 6-хлор-1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 4).
Гидрохлорид; точка плавления >260оС.
Анализ С17H20ClN3O3 ˙ HCl:
Вычислено, C 52,86; H 5,48; N 10,88;
Найдено, C 52,88; H 5,50; N 10,68.
N-(эндо-8-метил-8-азабицикло[3.2.1] окт-3-ил)-1,4-дигидро-2(Н)-2-оксо-3-хинозо- линкарбоксамид (соединение 5).
Гидрохлорид; точка плавления >260оС.
Анализ C17H22N4O4˙ HCl:
Вычислено, C 58,19; H 6,61; N 15,97;
Найдено, C 57,83; H 6,64; N 15,81.
Сложный эндо-9-метил-9-азабицикло[3.3.1]нон-3-иловый эфир 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 6).
Гидрохлорид; точка плавления 220-222оС.
Анализ С18H23N3O3 ˙ HCl:
Вычислено, С 59,09; H 6,61; N 11,49;
Найдено, C 58,74; H 6,65; N 11,41.
Сложный эндо-8-метил-8-азабицикло[3.2.1] окт-3-иловый эфир 7-хлор-1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 7).
Гидрохлорид; точка плавления >260оС.
Анализ С17H20ClN3O3 ˙ HCl:
Вычислено, C 52,86; H 5,48; N 10,88;
Найдено, C 51,55; H 5,47; N 10,66.
Сложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-6-фтор-2(Н)-оксо-3-хиназолинкарбоновой кислоты (соединение 8).
Гидрохлорид; точка плавления >260оС.
Анализ C17H20FN3O3 ˙ HCl:
Вычислено, C 55,21; H 5,72; N 11,36;
Найдено, C 54,96; H 5,79; N 11,24.
Сложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-4-метил-2(Н)-2-оксо-2-хиназолинкарбоновой кислоты (соединение 9).
Гидрохлорид; точка плавления >260оС.
Анализ C18H23N3O3 ˙ HCl:
Вычислено, C 59,09; H 6,61; N 11,49;
Найдено, C 58,73; H 6,65; N 11,38.
Сложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-7-фтор-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 10).
Гидрохлорид; точка плавления >260оС.
Анализ C17H20FN3O3 ˙ HCl:
Вычислено, C 55,21; H 5,72; N 11,36;
Найдено, C 54,76; H 5,79; N 11,29.
Сложный эндо-8-метил-8-азабицикло[3.2.1] окт-3-иловый эфир 5-хлор-1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 11).
Гидрохлорид; точка плавления >260оС.
Анализ C17H20ClN3O3 ˙ HCl:
Вычислено, C 52,86; H 5,48; N 10,88;
Найдено, C 52,67; H 5,47; N 10,83.
Сложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-5-мтил-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 12).
Гидрохлорид; точка плавления > 260оС.
Анализ C18H23N3O3 ˙ HCl:
Вычислено, C 59,09; H 6,61; N 11,49;
Найдено, C 58,53; H 6,67; N 11,38.
Сложный эндо-8-изопропил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-2(Н)-2-оксо-3-хиназолиновой кислоты (соединение 13).
Гидрохлорид; точка плавления 265-266оС.
Анализ C19H25N3O3 ˙ HCl:
Вычислено, C 60,07; H 6,90; N 11,06;
Найдено, C 59,90; H 6,97; N 10,98.
Сложный эндо-8-метил-8-азабицикло[3.2.1] окт-3-иловый эфир 2,3,4,5-тетрагидро-2-оксо-1(Н)-1,3-бензодиазепин-3-карбо- новой кислоты (соединение 14).
Точка плавления 144-145оС.
Анализ C18H23N3O3:
Вычислено, C 65,63; H 7,04; N 12,76;
Найдено, C 65,33; H 7,09; N 12,67.
Сложный эндо-8-этил-8-азабицикло[3.2.1] окт-3-иловый эфир 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 15).
Гидрохлорид; точка плавления >260оС.
Анализ C18H23N3O3 ˙ HCl:
Вычислено, C 59,09; H 6,61; N 11,49;
Найдено, C 58,88; H 6,64; N 11,34.
П р и м е р 2. Метобромид сложного эндо-8-метил-8-азабицикло[3.2.1] окт-3-ило- вого эфира 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 16).
Раствор 0,5 г сложного эндо-8-метил-8-азабицикло[3.2.1]окт-3-илового эфира 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоно- вой кислоты в 15 мл ацетона при 0оС каплями добавляют к смеси 15 мл ацетона и 15 мл 2 М раствора метилбромида в простом диэтиловом эфире. Реакционный сосуд закрывают и оставляют стоять при комнатной температуре в течение 20 ч. Сырой продукт получают путем упаривания растворителя, после чего он кристаллизует из этанола. Выход: 0,3 г целевого продукта. Точка плавления >260оС.
Анализ C18H24BrN3O3:
Вычислено, C 53,69; H 5,89; N 10,24; Br 19,47;
Найдено, C 52,44; H 5,87; N 10,14; Br 19,00.
Аналогичным образом получают следующие соединения:
Метобромид сложного эндо-8-изопропил-8-азабицикло[3.2.1] окт-3-илового эфира 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбо- новой кислоты (соединение 17).
Точка плавления 259-261оС.
Анализ С20H28BrN3O3:
Вычислено, C 54,79; H 6,44; N 9,59;
Найдено, C 54,22; H 6,46; N 9,43.
Циклопропилметобромид сложного эндо-8-метил-8-азабицикло[3.2.1]окт-3-илово- го эфира 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 18).
Точка плавления 257-258оС.
Анализ С21H28BrN3O3:
Вычислено, C 56,00; H 6,27; N 9,33;
Найдено, C 55,48; N 6,28; N 9,17.
Метобромид сложного эндо-8-этил-8-азабицикло[3.2.1]окт-3-илового эфира 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоно- вой кислоты (соединение 19).
Точка плавления 250-252оС.
Анализ C19H26BrN3O3:
Вычислено, C 53,78; H 6,18; N 9,90;
Найдено, C 53,19; H 6,22; N 9,63.
Этобромид сложного эндо-8-метил-8-азабицикло[3.2.1]окт-3-илового эфира 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоно- вой кислоты (соединение 20).
Точка плавления >260оС.
Анализ C19H26BrN3O3:
Вычислено, C 53,78; H 6,18; N 9,90;
Найдено, C 53,73; H 6,23; N 9,76.
П р и м е р 3. Сложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-4-окси-2(Н)-2-оксо-3-хиназолинкар- боновой кислоты (соединение 21).
Раствор 3,45 г гидрохлорида сложного эндо-8-метил-8-азабицикло[3.2.1] окт-3-ило- вого эфира 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты в 100 мл воды добавлением насыщенного карбоната натрия доводят до значения рН 7. Постепенным добавлением 0,1 N серной кислоты держат реакционную смесь при значении рН 7, в нижнюю часть реакционного сосуда медленно добавляют раствор 3,1 г перманганата калия в 100 мл воды. Как только с помощью тонкослойной хроматографии устанавливается исчезновение исходного соединения, добавляют 81 мл раствора перманганата калия. Затем реакционную смесь фильтруют, обрабатывают 10% -ным раствором гидроокиси натрия и экстрагируют этилацетатом. После сушки из органического слоя получают остаток, который кристаллизует из этилацетата. Выход: 1,55 г целевого продукта.
Точка плавления 178-180оС.
Анализ C17H21N3O4:
Вычислено, C 61,62; H 6,39; N 12,68;
Найдено, C 61,47; H 6,48; N 12,65.
Аналогичным образом получают следующие соединения:
Сложный эндо-8-метил-8-азабицикло[3.2.1] окт-3-илового эфира 1,4-дигидро-7-фтор-4-гидрокси-2(Н)-2-оксо-3-хиназолин карбоновой кислоты (соединение 22).
Точка плавления 169-170оС.
Анализ C17H20FN3O4:
Вычислено, C 58,45; H 5,77; N 12,03;
Найдено, C 58,03; H 5,81; N 11,84.
N-(Эндо-8-метил-8-азабицикло[3.2.1] окт- -3-ил)-1,4-дигидро-4-окси- 2(Н)-2-оксо-3-хиназоликарбоксамид (соединение 23).
Точка плавления 150-152оС.
Анализ C17H22N4O3:
Вычислено, C 61,80; H 6,71; N 16,96;
Найдено, C 61,45; H 6,77; N 16,84.
П р и м е р 4. Сложный эндо-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты (соединение 24).
Раствор 0,4 г гидрохлорида сложного эндо-8-бензил-8-азабицикло[3.2.1] окт-3-ило- вого эфира 1,4-дигидро-2(Н)-2-оксо-3-хиназолинкарбоновой кислоты в 10 мл этанола подвергают гидрированию при комнатной температуре и атмосферном давлении в присутствии 0,04 г 10%-ного палладия на угле. В результате обычной переработки получают 0,25 г целевого продукта в виде гидрохлорида.
Точка плавления >260оС.
Анализ C16H19N3O3 ˙ HCl:
Вычислено, C 56,89; N 5,97; N 12,44;
Найдено, C 55,81; H 6,04; N 12,24.
П р и м е р 5. Сложный эндо-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир 1,4-дигидро-2(Н)-2-тиоксо-3-хиназолинкарбоно- вой кислоты (соединение 25).
Раствор 2,0 г N-(2-аминобензил)эндо-8-метил-8-азабицикло[3.2.1]окт-3-илкарбамата и 1,2 мл триэтиламина в 30 мл метиленхлорида при размешивании и при комнатной температуре каплями добавляют к раствору 0,6 мл тиофозгена в 10 мл того же самого растворителя. В течение 10 мин выпадает твердое вещество. Продолжают перемешивать в течение еще одного часа, и затем твердое вещество выделяют фильтрацией. Данное твердое вещество суспендируют в 5 мл 1,2-дихлорбензола, и суспензию нагревают до 160-170оС в течение 15 мин. После охлаждения твердое вещество титруют с тем же самым растворителем с последующей фильтраций. В результате кристаллизации в ацетонитриле получают 0,28 г целевого продукта в виде гидрохлорида. Точка плавления 224-225оС (с разл.).
Анализ C17H21N3O2S ˙ HCl:
Вычислено, C 55,50; H 6,03; N 11,42; S 8,72;
Найдено, C 55,47; H 6,05; N 11,34; S 8,64.
Использование: в фармацевтической промышленности. Сущность изобретения: производные хиназолин- или бензодиазепинкарбоновой кислоты ф-лы I, где R водород, галоген, низший алкил, или низшая алкоксигруппа, А-группа C O, или C S, B-группа -CH2-CH2- -CHR, где R1 водород, низший алкил, или гидроксил, X кислород или группа NH, Y группа ф-лы II, где R2 низший алкил, q равно 2 или 3 и их соли, обладают антимускариновой активностью. Реагент 1: соединения ф-лы III. Реагент 2: соединения ф-лы IV, где Q1 и Q2 отщепляемые группы. Условия реакции 20 100°С, в среде апротонного растворителя, в присутствии акцептора кислоты. I  II
II 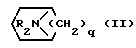 III
III 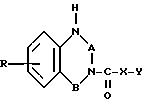 IV
IV  2 с.п. ф-лы, 1 табл.
2 с.п. ф-лы, 1 табл.

где R водород, галоген, низший алкил или низшая алкоксигруппа;
А группа С O или С= S;
В группа -CH2-CH2- или -CHR1, где R1 водород, низший алкил и гидроксил;
X кислород или группа NH;
Y -группа формулы 
где R2 низший алкил;
q 2 или 3,
и их соли.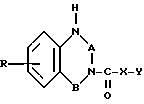
где R водород, галоген, низший алкил или низшая алкоксигруппа;
А группа С=O или С=S;
В группа -CH2-CH2- или -CHR1, где R1 водород, низший алкил или гидроксил;
Х кислород или группа NH;
Y группа формулы 
где R2 низший алкил;
q 2 или 3,
и их физиологически переносимые соли, обладающие антимускариновой активностью.
| Патент США N 4284768, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-07-25—Публикация
1992-05-08—Подача