Изобретение относится к новой тканевой трансплантационной композиции, проявляющей прочность, предохраняющей от раскрытия сосудов, устойчивость к инфекции, неиммуногенность, отсутствие тромбообразования и устойчивость к образованию аневризмы, превышающие многие синтетические трансплантационные материалы. Изобретение направлено на тканевые трансплантационные композиции, включающие подслизистую основу и базилярную слизистую части тонкой кишки и способы получения и использования таких композиций.
Тканевые трансплантационные материалы сегодня имеют существенное клиническое и экономическое значение. В 1986 г было затрачено 130 млн. долл. только на трансплантацию сосудов, не включая коронарные артериальные байпасные трансплантации. Успехи в сосудистой трансплантации еще очень малы по сравнению с другими хирургическими методами. Например, 5-летняя кумулятивная раскрываемость сосудов в 50% рассматривается как очень хорошая для трансплантации сосудов малого диаметра. Такие невысокие успехи большей частью являются результатом одной или более физической или функциональной недостаточности в трансплантационных материалах, которые непосредственно используются в клинических условиях.
Идентификация материалов, пригодных для тканевых трансплантатов, особенно, трудна из-за того, что эти материалы должны обладать множеством несопоставимых свойств. Например, трансплантационные материалы для сосудов должны не только проявлять механическую стабильность при непрерывном напряжении, но они также должны обладать пористостью, адекватной для капилляризации, полностью подобной этому свойству ткани хозяина, и высокими отрицательными Дзета потенциалами (так, чтобы быть нетромбогенным). Они дожны быть неаллергическим, неканцерогенными и предпочтительно не дорогими для производства.
Очень немногие тканевые трансплантационные материалы обладают всеми этими целевыми характеристиками. Литература сообщает об исследованиях и разработках в области сосудистой трансплантации, отражающих значительные усилия для преодоления недостатков, присущих известным трансплантационным материалам.
Для сосудистых трансплантаций используют как синтетические, так и аутогенные материалы. Среди синтетических обычно используется распространенный политетрафторэтилен (РТЕЕ) в качестве трансплантационного материала для сосудов, обычно для малых сосудов при байпассных операциях. Однако, распространенные трансплантаты из РТЕЕ восприимчивы к несинтемальной гиперплазии и позднему трансплантационному тромбозу (например, открытость сосудов через 6 лет приблизительно в 50% для феморропоплиетальных байпассов). РТЕЕ трансплантаты имеют пониженный успех при использвоании в венозном кровообращении.
Другой синтетический материал Дакрон часто используется для трансплантации сосудов большого диаметра (например, инфраренальные аортные трансплантаты). Плетеный Дакрон, однако, имеет относительно высокую пористость и должен быть предварительно свалян перед имплантацией для того, чтобы избежать обширного геморроя. Эта операция предварительного сваливания не всегда является практичной или успешной. Плетеный Дакрон, имея меньшую пористость, демонстрирует податливость только на 20% от того, что должно быть в нормальной аорте. Наконец, трансплантаты Дакрон неудачно исполняются для артерий малого диметра или вен, где поток крови является относительно низким.
Одной из более значительных проблем, связанных с использованием синтетики в качестве тканевых трансплантационных материалов, является тот факт, что синтетические материалы обладают низкой устойчивостью к инфекции. Возникновение инфекции, следующей после имплантации синтетического трансплантата, связано с 66% смертности. Синтетические материалы проявляют тенденцию к немигрирующим микроорганизмам в их материальных промежутках, и если загрязнены, то не поддаются бактерицидной терапии. Эксплантация инифицированных синтетических трансплантатов фактически неизбежна.
Недавно исследователи сообщили о получении синтетической кожи и эквивалентов сосудов для крови, использующих живые клетки человека.
Среди аутогенных материалов используются подкожная вена ноги, умбиликальная человеческая вена, инвертированная тонкая кишка и радиальная артерия, но каждый из этих материалов также обладает существенными недостатками. Подкожная вена ноги может быть неподходящего размера для некоторых операций или может быть недоступна из-за повреждения заболеванием. Подкожная вена ноги может иметь неприемлемую варикозность и подвержена ускоренному атерогенезу с последующей аретриолизацией. Умбиликальные трансплантаты и трансплантаты инвертированной малой кишки закупориваются ранним тромбозом и поздним образованием аневризмы. Наконец, радиальная артерия ограничена в применении из-за трудности ее хирургического выделения и может ухудшить последствия после имплантации.
Цель изоберетения создание способа получения нового тканевого трансплантационного материала из части тонкой кишки, а также способа использования нового многоцелевого тканевого трансплантационного материала в аутотрансплантации, аллотрансплантации и гетеротрансплантации, и способа использования новой тканевой трансплантационной композиции для замены контейнеров для крови.
На чертеже показана малая кишка.
Изобретение направлено на тканевую трансплантационную композицию, включающую, прежде всего, оболочку подслизистой основы сегмента тонкой кишки теплокровного позвоночного. Оболочка подслизистой основы отслаивается от мышечной оболочки и, по крайней мере полостной части слизистой оболочки части малой кишки. В то время как предлагаемая тканевая трансплантационная композиция проявляет очень хорошие функциональные характеристики при применениях в качестве сосудистых аутотрансплантатов и сосудистых аллотрансплантатов, тканевые трансплантационные композициии изобретения найдут широкое применение даже в качестве гетеротрансплантатов как для сосудов, так и для других тканевых трансплантаций. Предлагаемая тканевая трансплантационная композиция проявляет множество физических и биолоигческих характеристик, которые делают ее особенно адаптируемой для тканевых трансплантаций.
В предпочтительном воплощении изобретения тканевый трансплантационный материал включает подслизистую основу ткани и базилярную слизистую ткань, слойно отделенную от отрезка тонкой кишки, более предпочтительно тощей кишки, отделения тонкой кишки между двенадцатиперсной кишкой и подвздошной кишкой. Тонкая кишка перед обработкой ее (отслаиванием) с получением трансплантационного материала в соответствии с настоящим изобретением, делится на ряд отдельных слоев ткани.
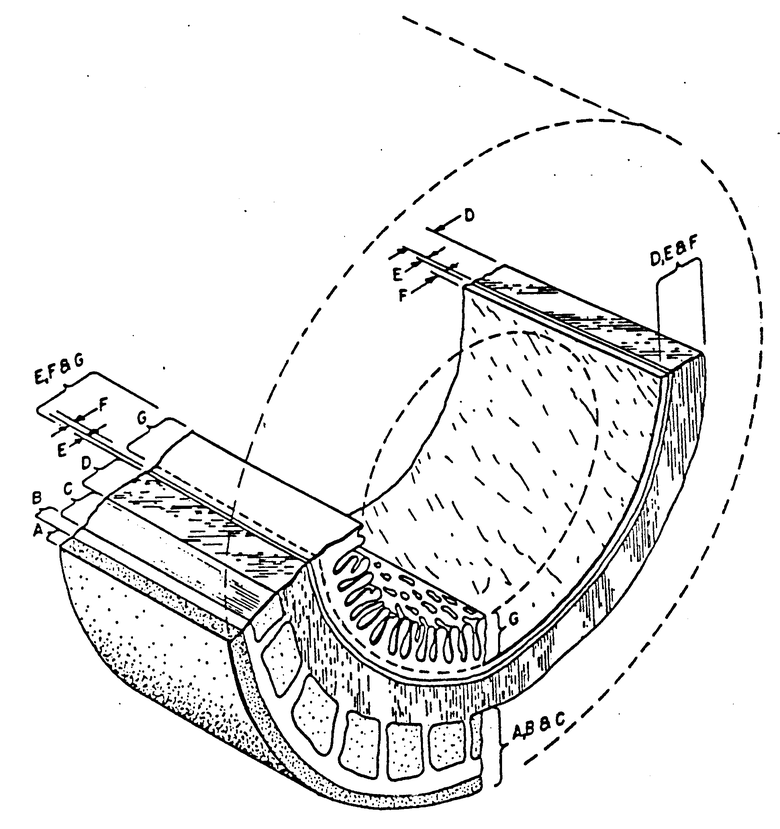
Сечение тонкой кишки показывает отдельные слои тканей помеченных от А до G (от внешнего до внутреннего), которые вместе определяют стенку кишки. Внешний тканевый слой А представляет собой мезентериальные ткани. Мезентериальные ткани показаны в виде отдельного слоя только для иллюстративных целей. Обычно такие тани не проявляются в виде отдельного слоя, а являются чем-то вроде дискретных тканевых отрезков. Слои В и С представляют собой серозную оболочку и мышечную оболочку. Слой D, оболочка подслизистой основы, является плотной нерегулярной, связанной коллагеном тканью, которая часто содержит ряд игольчатых клеток. Гепарин, полученный из этих игольчатых клеток, является по крайней мере частично ответственным за недостаток раннего тромбообразования трансплантационного материала.
Слои Е, F и G коллективно представляют собой так называемую слизистую оболочку. Слой Е является слоем из гладких мышечных клеток, известным как тонкий слой мышечной слизистой. Слой F, компактный слой, состоит из ацеллюлярного коллагена и эластичных волокон. Слой G состоит из тонкого слоя эпителиальной слизистой и форма слоя вместем с окмружающими ворсинками представляет собой ряд пальцеподобных выростов из слизистой мембраны.
Исходя из детально опасанной процедуры получения кишечного тканевого сегмента трансплантационного материала изобретения, гистологическая оценка показывает, что слой эпителиальной слизистой и его состав удаляются, поскольку он имеет мышечный слой и серозную оболочку. Предпочтительный трансплантационный материал изобретения включает оболочку подслизистой основы D вместе с базилярной частью слизистой оболочки, особенно слой мышечной слизистой Е и компактный слой F. Эти слои вместе далее называются малой кишечной подслизистой основой (SIS).
SIS аутотрансплантат в соответствии с настоящим изобретением может быть получен, например, первоначальной резекцией сегмента аутогенной проксимальной тощей кишки с последующим срединным лапаратомным рассечением. Отсеченный сегмент тощей кишки затем заворачивается в хирургический тампон и погружается в физиологический раствор. После завершения кишечного анастемоза иссеченный кишечный сегмент получают в соответствии с настоящим изобретением для использования в качестве тканевого трансплантационного материала. Подобно этому аллотрансплантаты получают из кишечной ткани, удаляемой из ткани доноров того же вида. Гетеротрансплантаты могут быть получены, например, из кишечной ткани кошачьих, свиней или коров, доступных из умерщвленных животных на бойне. До настоящего времени минимальные морфологические различия были найдены в кишечных тканях различных видов. Действительно, гистологическая форма трансплантантной ткани человека почти идентична таковой для собаки. Признанное морфологическое различие заключалось только в немного менее плотном слое в ткани человека.
Тканевый трансплантационный материал изобретения получают выскабливанием кишечной тк ани для удаления внешних слоев, включая как серозную оболочку, так и мышечную оболочку (слои В и С) и внутренние слои, включающие, по крайней мере, люминальную часть (слой G) слизистой оболочки (слои Е G). При условиях выскабливания слизистая оболочка отслаивается между тонким слоем (слой F) и частью слоя G. Более конкретно, после удаления мезентериальных тканей из кишечного сегмента с помощью, например, зажимов Адсона-Брауна и ножниц Метценбаума серозную оболочку и мышечную оболочку (внешние тканевые слои) отслаивают от кишечного отрезка путем выскабливания с помощью продольных протирочных движений скальпелем и влажной марлей. После выворота кишечного сегмента полостную часть слизистой оболочки отслаивают от нижних слоев ткани с помощью таких же протирочных движений. Следует быть осторожным, чтобы сохранить перфорацию подслизистой основы. Любые наросты на отслоенных слоях, остающиеся на поверхности трансплантата, удаляются. Не обязательно кишечный сегмент может быть сначала вывернут, затем проведено отслаивание полостных слоев, затем сегмет можно вернуть в его первоначальную ориентацию для удаления серозной оболочки и мышечной оболочки. Трансплантационный материал представляет собой белесую, полупрозрачную трубку из ткани примерно 0,1 мм толщины, обычно состоящую из оболочки подслизистой основы с подсоединенным слоем мышечной слизистой и компактным слоем. Для сосудистых трансплантационных препаратов приготовленный трансплантат выворачивают до его первоначальной ориентации так, что компактный слой служит в качестве полостной поверхности трансплантата.
Полученный трансплантационный материал обычно пропитывают соляным раствором и помещают в 10%-ный раствор неомицин сульфата в течение примерно 20 мин, после чего трансплантационный материал готов к использованию. Трансплантаты применяются с помощью рутинных хирургических методик, обычно применяемых для трансплантации тканей. Для использования в несосудистых тканевых трансплантациях трубчатый трансплантационный материал может быть разрезан продольно и свернут в виде бляшки из тканей. Действительно, полная процедура тканевого отслаивания, описанная выше, может быть осуществлена на бляшках кишечной ткани, полученной при разрезании кишечного сегмента продольно и без вращения его с образованием предтрансплантационной бляшки. Полученные трансплантационные тканевые бляшки могут быть использованы, например, в качестве кожного трансплантационного материала или для залечивания других тканей тела с помощью хирургических вмешательств для тканевой трансплантационной бляшки, имеющей физические и функциональные характеристики настоящей трансплантационной композиции.
Для использования в качестве сосудистого трансплантата диаметр трансплантата должен быть таким же, как диаметр кровеносного сосуда реципиента. Это производится манипуляцией тканевым трансплантатом для определения цилиндра, имеющего диаметр приблизительно такой же, как диаметр кровеносного сосуда реципиента и сшиванием или другой хирургической продольной операцией ткани трансплантата с образованием указанного сосудистого трансплантата. Таким образом, сосудистый трансплантат может быть приготовлен путем селекции стерильного стеклянного стержня, имеющего внешний диаметр, равный диаметру кровеносного сосуда реципиента, и введение стеклянного стержня в полость трансплантата. Затем излишняя ткань собирается, и целевой диаметр полости достигается прошиванием вдоль длины трансплантата (например, с помощью двух непрерывных швов или с помощью прерывистой прошивки) или с помощью других, признанных специалистами в этой области науки и медицины методик ушивания тканей.
Композиция 1 обладает механическими свойствами, желательными для тканевых трансплантационных материалов, включающих низкий индекс пористости, высокую податливость и высокое давление разрыва. Специалисты в этой области медицины считают, что тканевый трансплантационный материалл должен быть достаточно низкой пористости для предотвращения образования интраоперационного геморроя и достаточно высокой пористости, чтобы обеспечить распространение вновь образуемой среды сосуда проникнуть через материал трансплантата, чтобы снабжать новую внутреннюю оболочку и полостную поверхность. Пористость трансплантационного материала обычно измеряют в размерности мл воды, проходящей через см2 в минуту при давлении в начале в 120 мм рт.ст. Индекс пористости SIS трансплантационного материала равен 10, много меньше, чем для других трансплантационных материалов, известных в настоящее время. (Тканый Дакрон, например, имеет индекс пористости 50). Несмотря на этот низкий индекс пористости, SIS является еще достаточно пористым, чтобы позволить происходить неокапилляризации в пределах SIS трансплантата. В сосудистых трансплантационных применениях SIS композиции позволяют образовывать кровенаполненные капилляры в стенке трансплантата, распространяющегося в полостной поверхности, через четыре дня после хирургической операции.
Существует прямое соотношение между податливостью трансплантанта и прочностью на разрыв. В идеальном случае трансплантационный материал должен быть по крайней мере таким же податливым, как заменяемая ткань. Продольная податливость SIS трансплантационного материала измерялась с помощью использования простого теста на растяжение. Первоначальную длину отмеряли пометками на расстоянии 5 см. Удлинение и примененную силу измеряли при нагрузке образца со скоростью растяжения 32 см/см/мин, что привело к следующим резальтатам: податливость SIS трансплантата 0,045 см/Н на см длины, податливость нормальной аорты собаки 0,017 см/Н на см длины.
Таким образом, SIS трансплантационные материалы фактически проявляют податливость больше, чем соответствующее свойство нормальной аорты. Это является существенным преимуществом перед прототипом в области сосудистой трансплантации. Все доступные синтетические трансплантаты в 3-10 раз менее податливы, чем природная артерия, и пропорционально более устойчивы к образованию тромбов по сравнению с природными артериями. Способ прототипа для компенсации этой податливости заключается в использовании трансплантационного материала большего диаметра по сравнению с соответствующей природной артерией. Эта методика, тем не менее, приводит к дополнительным проблемам. Скорость крови меньше в трансплантационном сегменте большего диаметра. Следовательно, меньше сдвиговое напряжение на стенку трансплантата. При таких условиях отложение тромбоцитов и фибрин и последующее образование тромба более вероятно. В противоположность этому, так как SIS материал демонстрирует такую высокую податливость, изодиаметральные трансплантаты SIS могут быть использованы без возникновения таких проблем.
Представляемые SIS трансплантационные материалы, как было найдено, имеют пределы разрыва вне параметров, которые могут быть получены физиологически. Давление разрыва в виде теста было определено путем присоединения трубчатого отрезка трансплантата SIS к двум цилиндрам диаметром 25 мм и при подаче азота под давлением на трансплантат с постоянной скоростью. Две скорости потока были использованы. При пониженном потоке, давление, первоначально увеличенное, затем падало и постоянный поток газа проходил черзе стенку трансплантата, который находился в равновесии с входным потоком. При увеличенной скорости, давление создавали быстро до условий разрыва, приблизительно 400 мм ртутного столба, показывая, что трансплантационный материал может легко держать непрерывные пульсации давления, вызванные нормальным физиолоигческим функционированием сосудистого трансплантата.
П р и м е р 1. Подслизистая основа тонкой кишки в качестве артериального трансплантата большого диаметра. Был проведен ряд экспериментов, которые испытали способность трех различных конфигураций тонкой кишки служить в качестве сосудистого трансплантата в инфраренальной аорте собаки. Первый эксперимент использовал полную толщину неинвертированного сегмента тощей кишки либо с интактной мезентериальной нейрососудистой подложкой, либо со свободным, изолированным сегментом трансплантационного материала. Кишечная слизистая была в качестве промежуточной фазы между кровью и трансплантатом. Все 4 собаки в этом эксперименте умерли через 18 ч после операции от тромбоза трансплантированного отрезка и геморроя от швов.
Второй эксперимент использовал изолированный и инвертированный отрезок тощей кишки в качестве трансплантата с серозной оболочкой в качестве промежуточной фазы между кровью и трансплантатом. 2 собаки были испытаны в этом эксперименте. Трансплантат у первой собаки был поражен тромбозом через 4 ч после операции, и вторая собака умерла от острого геморроя при проксимальном анастемозе через 4 дня после операции.
Третий эксперимент испытал использование только части кишечной стенки в качестве трансплантационного материала. Свободный отрезок аутогенной верхней части тощей кишки был иссечен из собаки и затем основная часть слизистой была удалена соскабливанием внутриполостной поверхности вручную скальпелем. Затем по такой же методике были удалены оболочка мышчная и серозная оболочка. Ткань, которая осталась после этих манипуляций от отрезка, составляла часть толщиной 100 мкм подслизистой основы и базилярной слизистой. Этот трансплантат затем поместили в инфраренальную аорту 15 собакам и получили замечательные результаты.
13 и 15 собак сохранили функционирующие трансплантаты до времени умерщвления. 11 собак были умерщвлены в различное время после операции в течение от 4 дней до 1 года. Животные не показали симптомов инфекции трансплантата, образования аневризмы или тромбоза. Наблюдаемые неудачи у двух собак, имеющих трансплантат, были вызваны техническими ошибками, включающими ошибочное место для металлических зажимов и плохую анастомозную методику. Двое животных остались живы и контролировались на дительность сохранения свойств трансплантата.
Разрыв тарнсплантатов проверяли с помощью положительной контрастной радиографией в пределах от 4 до 7 дней после операции и каждые 6-8 недель после этого. Разрыв трансплантата контролировали клинически путем наблюдения наличия сильного феморального пульса и повреждения от отека задней конечности.
11 собак, сохраняющих функционирующие трансплантаты, были умерщвлены и разрезаны через различное время после операций (через 4, 7, 10 и 14 дней, и 9, 11, 13, 17, 26, 44 и 52 недели). Непосредственно перед умерщвлением животных дополнительно проверяли на подтверждение функционирования трансплантата и для обеспечения сравнения радиографий для оценки дилатации трансплантата, образования стеноза и аневризмы. Все 11 животных показали полное функционирование без признаков детриментальных люминальных изменений.
Патологическая оценка сечения этих трансплантационных сегментов показала глистеничную люминальную поверхность, усеянную красными и белыми областями без признаков образования тромба. Имелся окружающий рисунок, фиксирующий связи ткани со стенками трансплантата. Все образцы, проверенные вплоть до 6 мес после операции, показали отсутствие признаков эндотелиального роста клеток на поверхности трансплантата. Поверхность этих трансплантатов была покрыта пластинами средней плотности организованным слоем каллагена.
Гистопатологическая оценка образцов после 26, 44 и 52 недель показала наслоение эндотелиальноподобных клеток, которые частично покрывали тонкий (приблизительно 500 мкм) слой плотно организованных фибрин. В целом ткань была инфильтрована кровезаполненными капиллярами, и внешние границы первоначального трансплантационного материала нельзя было отличить от окружающих связанных тканей. Оценка с помощью сканирующей электронной микроскопии люминальной поверхности показала слой плоских клеток, не отличающихся от эндотелиальных клеток, которые распространяли псевдоподию. Оценка с помощью трансмиссионной электронной микроскопии этих трансплантационных сегментов также подтвердила наличие эндотелиальных клеток, покрывающих люминальную поверхность. Наличие фактора VIII: относительного антигена, обнаруженное иммунофлуоресцентными штаммами, дополнительно подтвердило эндотелиальное происхождение этих трансплантационных люминальных поверхностных клеток. Трансплантационный материал испытывали на наличие эндотелиальных клеток путем тестирования на присутствие релаксирующего фактора, выведенного из эндотелия. К поверхности образцов трансплантата применили ацетилхолин и эффлюент отбирали. Эффлюент, как было показано путем наблюдения релаксации гладкой мышцы в аорте крысы, содержит релаксирующий фактор, выведенный из эндотелия.
Давление крови цефалгическое, периферическое и в пределах трансплантата SIS определяли в каждой из 10 собак. Давления были идентичными для всех трех позиций у каждой из собак, отражая недостаточность ухудшенного гемодинамического эффекта, возникающего за счет использования трансплантационного материала 1.
Следующие лабораторные параметры были измерены перед операцией, через один день после операции, затем в дополнительное время в течение последующих месяцев для всех собак: время гематокрита, время протромбина, время активированного парциального тромбопластина, количество кровяных телец, полный состав крови, и укороченный профиль химии серума. Результаты показали, что все животные являются нормальными при этих лабораторных измерениях во все время. Эти животные были обработаны низкими дозами гепарина (600 единиц IV) в течение операции, но не наблюдали антикоагуляции в течение послеоперационного периода. Недостаточность любых изменений коагуляционных тестах и количество красных кровяных телец частично объяснима в свете относительно гиперактивной коагуляционной системы собак по сравнению с человеком.
П р и м е р 2. Подслизистая основа тонкой кишки в качестве артериального трансплантата малого диаметра. Этот эксперимент включал имплантацию 18 собакам 36 трансплантатов как в бедренную артерию, так и в сонную артерию. 33 из 36 трансплантатов сохранили свою функцию. Для этих животных были сделаны такие же лабораторные измерения, как в первом исследовании, и не наблюдали аномалий. Удобное двухмерное ультразвуковое изображение было использовано для измерения проходимости и диаметра поперечного сечения сосуда.
Патологическая оценка трансплантационной ткани для собаки, умерщвленной через 4 дня после операции, показала безтромбозную внутриполостную поверхность и слегка стенозированный проксимальный анастемоз. Гистологическая оценка обнаружила раннее наличие кровезаполненных капилляров в стенке трансплантата, потенциально природную защиту тела от инфекции. 5 из этих собак остались жить.
П р и м е р 3. Подслизистая основа тонкой кишки в качестве трансплантата вены. В этом эксперименте SIS трансплантат поместили в заднюю полую вену (аналогичную нижней полой вене в человека) двух собак и в переднюю полую вену (аналогично врехней полой вене в человеке) 5 собак. Хотя задние полые вены с трансплантатом оставались проходимыми в течение только 11 и 14 дней соответственно, патологическая оценка показала неудачу тарнсплантации за счет технических ошибок, за счет чего ухудшенный анастемоз этого места был стеноизированным (8 мм диаметр против присоединенного 16 мм диаметра природной полой вены и проксимального трансплантата). Более того, внутриполостные поверхности обоих трансплантатов были покрыты безтромбозным псевдоэнтелием, составленным из плотно упакованного фибрина и недоразвитого коллагена, соединенного с тканью.
Трансплантаты передней полой вены оставались проходимыми до умерщвления трех собак через 7, 14 и 21 день после операции соответственно. Проксимальная шовная линия во всех трех собаках показала доказательство раннего тромбоза, где трансплантат был инвертирован, что вызвало турбулентный поток крови, но остальная часть трансплантата не была тромбозной. Большие патологические и гистолоигческие оценки обнаружили, что трансплантат был линейным за счет гладкой красной поверхности, идентичной при появлении трансплантатов, изученных в предыдущих экспериментах.
П р и м е р 4. Подслизистая основа тонкой кишки в качестве аллотрансплантата артериального. SIS использовали в качестве аллотрансплантата большого диаметра для аорты собаки. Аллотрансплантаты были приготовлены таким же способом, как трансплантаты, описанные выше для исследования аутотрансплантатов аорты. Животные, прожившие 8 недель после операции, не показали признаков тромбоза, инфекции или аневризмы (что подтвреждено ангиограммами).
П р и м е р 5. Подслизистая основа тонкой кишки в качестве артериального гетеротрансплантата.
SIS был использован в качестве гетеротрансплантата для собаки. SIS трансплантат кошачьего происхождения был получен в соответствии с вышеописанными методиками и помещен в собаку.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ТКАНЕВОГО ТРАНСПЛАНТАТА; ТКАНЕВЫЕ КОМПОЗИЦИИ, СПОСОБ ХИРУРГИЧЕСКОГО ВОССТАНОВЛЕНИЯ КОЛЛАГЕНОВОГО МЕНИСКА, СПОСОБ СТИМУЛИРОВАНИЯ ЗАЖИВЛЕНИЯ РАН, КОНСТРУКЦИЯ ТКАНЕВОГО ТРАНСПЛАНТАТА, СПОСОБ ИНДУЦИРОВАНИЯ ОБРАЗОВАНИЯ ЭНДОГЕННОЙ ТКАНИ, СПОСОБ УСИЛЕНИЯ ФУНКЦИИ СФИНКТЕРА У ЖИВОТНОГО | 1993 |
|
RU2148379C1 |
| Способ пластики полых трубчатых органов | 1983 |
|
SU1146014A1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ДЕФЕКТА ТОНКОЙ КИШКИ ПОСРЕДСТВОМ ПРИМЕНЕНИЯ АЛЛОГЕННОГО ДЕЦЕЛЛЮЛЯРИЗИРОВАННОГО БИОМАТЕРИАЛА | 2024 |
|
RU2821237C1 |
| СПОСОБ ПЛАСТИКИ ГЕПАТИКОХОЛЕДОХА ТРУБЧАТЫМ ТОНКОКИШЕЧНЫМ ТРАНСПЛАНТАТОМ | 2003 |
|
RU2249434C1 |
| КОМПОЗИЦИЯ ДЛЯ КОНСЕРВАЦИИ И ХРАНЕНИЯ ОРГАНА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ИМПЛАНТАЦИИ ПАЦИЕНТУ | 1988 |
|
RU2019965C1 |
| СПОСОБ ПЛАСТИКИ ЦИРКУЛЯРНЫХ ДЕФЕКТОВ АОРТЫ В ЭКСПЕРИМЕНТЕ | 1998 |
|
RU2147419C1 |
| СПОСОБ ПЛАСТИКИ ОБЩЕГО ПЕЧЕНОЧНО-ЖЕЛЧНОГО ПРОТОКА ТОНКОКИШЕЧНЫМ АУТОТРАНСПЛАНТАТОМ ПЕРЕМЕННОГО ДИАМЕТРА | 2014 |
|
RU2559736C1 |
| Способ колэктомии | 1986 |
|
SU1333314A1 |
| СПОСОБ ФОРМИРОВАНИЯ ТОНКОКИШЕЧНОГО АУТОТРАНСПЛАНТАТА НА СОСУДИСТОЙ НОЖКЕ ДЛЯ ПЛАСТИКИ ТРАХЕИ И ПИЩЕВОДА | 2008 |
|
RU2372855C1 |
| СПОСОБ ПЛАСТИКИ ДОЛЕВЫХ ПЕЧЕНОЧНЫХ ПРОТОКОВ | 2007 |
|
RU2342082C1 |
Использование: для получения тканевой трансплантационной композиции из сегмента тонкой кишки. Тканевая трансплантационная композиция включает оболочку подслизистой основы отрезка тонкой кишки теплокровного позвоночного. Оболочка подслизистой основы слойно отделяется от мышечной оболочки и по крайней мере от полостной части слизистой оболочки. Тканевая трансплантационная композиция обладает отличными механическими характеристиками, она не аллергогенна и не образует тромбов при применении в качестве аутотрансплантата сосудов и гетеротрансплантата сосудов. 2 з.п. ф-лы, 1 ил.
| Am | |||
| S | |||
| Surgery, 1971, 122, 157-519. |
Авторы
Даты
1995-06-19—Публикация
1991-01-10—Подача