Изобретение относится к медицине, а именно к способам определения активности лейкоцитарной эластазы в плазме крови.
Известно, что многие заболевания или патологические состояния, сопровождающиеся воспалительной реакцией организма (перитониты, септицемии, дыхательный дистресс-синдром, множественная недостаточность органов и др.), протекает на фоне активации протеолитических ферментов как плазменного, так и клеточного происхождения. Наиболее мощным деструктивным фактором при воспалении является лейкоцитарная эластаза сериновая трипсиноподобная протеиназа с нейтральным оптимумом рН, способная расщеплять многие белки, глико- и липопротеиды: эластиновые и коллагеновые волокна, фибронектин, факторы свертывания, фибринолиза, калликреин-кининовой системы и системы комплемента. Прямым следствием дегрануляции лейкоцитов и выброса эластазы во внеклеточное пространство являются наиболее опасные осложнения: нарушение дыхательной функции легких и тромбогеморрагический синдром, обусловленные прямым повреждением эндотелия легочных капилляров и деструкции плазменных факторов.
Известны иммунологические способы определения количества освобожденной лейкоцитами эластазы, основанные на иммуноферментном методе анализа (ИФА) (Neuman S. G.Gunzer, N.Hennrich, H.Lаng PMN-elastase "assay": enzyme Immunoassay for Human Polymorphоnuclear Elastase Complexеd with α-1-Proteinase Inhibitor. J Clin Chem Clin Biochem, 1984, 22(10):693-697; Kramer D.D. M.Maeller. Bardor A. M.M.Simon, W.Tilgen, E.Sehichel, D.Petzoldt, Measurement of free human leukocyte elastase dnd human leukocyte elastase /α, proteinase inhibitor complexes by an ELISA. J.Immand. Method. 1990. 131(1). 41-48.
Эти способы основываются на количественном выявлении либо комплекса эластазы с ее специфическим плазменным ингибитором (α-1-протеиназным ингибитором, α-1ПИ), либо антигена эластазы как в свободном, так и в связанном с ингибитором состоянии.
Иммуноферментные твердофазные методы определения эластазы, использующиеся в настоящее время, очень длительны и не могут применяться в экспресс-диагностике. Длительность определения связана с многостадийной обработкой планшета, длительной его инкубацией и отмыванием на каждой стадии анализа. Продолжительность такого способа анализа от 5 до 8 ч.
Иммуноферментные методы требуют наличия дорогостоящих биологических препаратов: препарата лейкоцитарной эластазы, моно- и поливалентных ее антител, α-1ПИ и моно- или поливалентные антитела к этому ингибитору, конъюгата антител с репортерным ферментом. Кроме этого, требуются планшеты для ИФА и субстрат для проведения реакции с репортерным ферментом. В качестве прототипа принят способ спектрофотометрического определения активности свободной лейкоцитарной эластазы в плазме крови, включающий внесение в плазму крови субстрата, в качестве которого используют бис.Ala Tur-Leu-Val-pNA, и спектрофотометрическое определение скорости его расщепления в присутствии буферного раствора (Nagamatsy Y. I.Yamamoto, A.Fukuda, M.Ohta, Y.Tsuda, Y.Okada. Determinatiou of leukocyte elastase comcentration in plasma and serum. by a simple method using a specific cynthetic Substrate. Haemostasis 21(6); 338-345).
Однако известный способ имеет недостатки, так как не позволяет оценивать активность в ней присутствующей в плазме эластазы, свободной и связанной, а лишь некоторой части лейкоцитарной эластазы, не связанной с ингибитором.
Задачей изобретения является создание способа более быстрого и полного определения активности как свободной, так и связанной лейкоцитарной эластазы.
Сущность изобретения состоит в том, что в способе определения активности лейкоцитарной эластазы в плазме крови, включающем внесение в предварительно разведенную физиологическим раствором плазму крови буферного раствора и субстрата с последующим спектрофотометрическим определением скорости расщепления субстрата, плазму крови разводят в 15-30 раз, при этом в качестве буферного раствора используют трис-HCl, а в качестве субстрата Вос. Ala ONp, разведенной в ацетонитриле.
Способ позволяет определить активность как свободной, так и связанной с ингибиторами эластазы, т.е. до 80-100% всей эластазы, находящейся в биологической жидкости, например, в плазме крови. Это дает возможность уточнить диагноз, дать прогноз развития осложнений и своевременно принять меры, направленные на подавление активности этого фермента с помощью медикаментозных средств.
Время определения эластазы сокращается по сравнению с известными способами почти в 100 раз и составляет около 6 мин. При этом минимальное количество необходимого объема плазмы крови составляет 10 мкл.
Простота и скорость дают возможность использовать способ в экспресс-диагностике.
Стоимость определения сокращается в несколько тысяч раз, что делает способ экономически выгодным.
Способ может быть использован для определения активности эластазы в любой биологической жидкости, в том числе плазме крови, моче и др.
Способ осуществляется следующим образом.
Для работы используют двулучевой спектрофотометр с термостатированным кюветодержателем любого типа.
Отделенную от клеточного осадка путем центрифугирования плазму крови в количестве 0,1-0,3 мл разводят в 15-30 раз физиологическим раствором. В спектрофотомет- рическую кювету объемом 3 мл вносят 30-70 мкл разведенной плазмы, добавляют прогретый до 28-30оС трис-HCl буфер и растворенный в ацетонитриле субстрат Boc. Ala ONp. Пробу тщательно перемешивают непосредственно в кювете и начинают регистрацию увеличения ее плотности на спектрофотометре при длине волны 347,5-410,0 нм в течение 8-10 мин. Оптическим контролем служит проба, содержащая 30-70 мкл физиологического раствора и такой же, как и в опытной пробе объем трис-HCl буфера и субстрата.
Расчет активности фермента проводят по формуле: 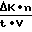 , где Δ прирост оптической плотности за минут;
, где Δ прирост оптической плотности за минут;
К пересчетный коэффициент;
n разведение плазмы;
t время измерения активности;
V объем разведенной плазмы крови.
П р и м е р 1. Больной Н. диагноз: хроническая почечная недостаточность на хроническом гемодиализе. Кровь для анализа брали через 2 ч после начала диализа.
К 100 мкл плазмы крови добавляли 1,4 мл физиологического раствора (разведение в 15 раз) и тщательно перемешивали. Затем в одну опытную кювету внесли 50 мкл разведенной плазмы и подогретый до 30оС трис-HCl буфер. В другую кювету, контрольную, внесли 50 мкл физиологического раствора и трис-HCl буфер в объеме, равном объему в опытной кювете. Содержание обеих кювет тщательно перемешивали. Через некоторое время выдерживания кювет в термостатированном кюветодержателе спектрофотометра одновременно в обе кюветы добавляли раствор субстрата Boc.Ala ONp. Содержимое кювет еще раз тщательно перемешивали и начали регистрацию плотности в опытной кювете против контрольной при длине волны 347,5 нм в течение 8-10 мин.
Расчет активности производили по максимальному приросту плотности по формуле: 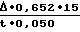 где Δ прирост плотности за 1 мин, равный 0,020;
где Δ прирост плотности за 1 мин, равный 0,020;
t время измерения, равное 1 мин;
15 разведение плазмы;
0,050 объем плазмы в опытной пробе.
Итак, 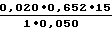 0,9 Е/мл
0,9 Е/мл
Если плазма крови больного была разведена в 30 раз, то максимальный прирост плотности опытной пробы составил 0,011.
Перерасчет по формуле: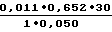 4,3 Е/мл
4,3 Е/мл
П р и м е р 2. Предлагаемым способом была измерена активность лейкоцитарной эластазы, предварительно связанной с α-1-протеиназным ингибитором.
Препарат лейкоцитарной эластазы с активностью 0,7 Е/мл (по MeOSuc Ala Pio ValpNA) и 2,9 Е/мл (по Вос Ala ONp),
5 мкл лейкоцитарной эластазы давали следующие приросты плотности: по MeOSuc Ala Ala PiO ValpNA за 1 мин 0,032 по Вос Ala ONp за 1 мин 0,022
Для подавления активности лейкоцитарной эластазы была приготовлена следующая инкубационная смесь:
25 мкл эластазы + 5 мкл трис-HCl буфера + 15 мкл α-1-ПИ. Смесь инкубировали 15 мин при 30оС. Остаточную активность эластазы оценивали по MeO Suc Ala Ala Pio ValpNA.
9 мкл инкубационной смеси, содержащей 5 мкл эластазы, давали прирост плотности 0,011, что соответствовало 33%-ной исходной активности. Таким образом, 3 мкл α-1 ПИ подавляли активность 5 мкл эластазы на 67%
Для выявления полной активности, связанной с α-1 ПИ эластазы в опытную кювету вносили 9 мкл инкубационной смеси, содержащей 5 мкл эластазы, и подогретый до 30оС трис-HCl буфер. В контрольную кювету внесли 9 мкл физиологического раствора и такой же, как в опытной пробе объем трис-HCl буфера. Контрольная и опытная кюветы выдерживались в термостатированном кюветодержателе при 30оС, после чего одновременно в обе кюветы вносили субстрат Boc Ala ONp. После тщательного перемешивания регистрировали прирост плотности в течение 8 мин.
Максимальный приросты оптической плотности за 1 мин составил 0,024, что соот- ветствовало 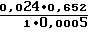 3/1 Е/мл
3/1 Е/мл
Таким образом, способ позволил выявить всю активность лейкоцитарной эластазы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ПРОЦЕССОВ ПРИ КОНТУЗИЯХ ГЛАЗА | 1998 |
|
RU2143912C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ТУБЕРКУЛЕЗНЫХ ИЗМЕНЕНИЙ В ЛЕГКИХ | 1999 |
|
RU2161313C1 |
| СПОСОБ ОЦЕНКИ ТЯЖЕСТИ ПОЗДНЕГО ГЕСТОЗА | 2002 |
|
RU2209438C1 |
| СПОСОБ ДИАГНОСТИКИ ГИПЕРЭЛАСТАЗЕМИИ | 2001 |
|
RU2195660C1 |
| СПОСОБ ДИАГНОСТИКИ ПЛАЦЕНТИТА | 2002 |
|
RU2213353C1 |
| СПОСОБ ДИАГНОСТИКИ ПОСЛЕРОДОВОГО ЭНДОМЕТРИТА | 2004 |
|
RU2276357C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ХРОНИЧЕСКОЙ АРТЕРИАЛЬНОЙ НЕДОСТАТОЧНОСТЬЮ НИЖНИХ КОНЕЧНОСТЕЙ | 2000 |
|
RU2162356C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ ЭТИЛОВОГО АЛКОГОЛЯ В ОРГАНИЗМЕ ЧЕЛОВЕКА | 2001 |
|
RU2198401C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ АСФИКТИЧЕСКОГО ЛЕГОЧНОГО КРОВОТЕЧЕНИЯ | 2000 |
|
RU2156109C1 |
| Способ оценки психического состояния пациентов с эндогенными психическими расстройствами при их клиническом обследовании и способ комплексной оценки состояния иммунной системы таких пациентов | 2016 |
|
RU2648745C1 |
Использование: медицина, медицинская диагностика, для определения активности лейкоцитарной эластазы в плазме крови. Сущность изобретения: плазму, отделенную от клеточного осадка, разводят физиологическим раствором в 15 20 раз, вносят в кювету спектрофотометра, добавляют прогретый до 28 30°С трис-HCl буфер, а затем субстрат Boc-Ala-O-Np, растворенный в ацетонитриле. После инкубации регистрируют увеличение оптической плотности пробы при длине волны 347,5 410,0 нм в течение 8 10 мин и производят расчет активности фермента по определенной формуле.
СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ЛЕЙКОЦИТАРНОЙ ЭЛАСТАЗЫ В ПЛАЗМЕ КРОВИ, включающий разведение плазмы крови физиологическим раствором, внесение в нее буферного раствора и субстракта с последующим спектрофотометрическим определением скорости расщепления субстрата, отличающийся тем, что плазму крови разводят в 15 20 раз, в качестве буферного раствора используют трис-HCI, а в качестве субстрата Вос Ala-O-Np, разведенный в ацетонитриле.
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
Авторы
Даты
1995-07-20—Публикация
1993-01-28—Подача