Изобретение относится к новым конденсированным гетероциклическим соединениям или их солям, их промежуточным соединениям, способу их получения и фунгициду на их основе для обработки сельскохозяйственных и садовых культур.
Известны некоторые виды амидных соединений, обладающих фунгицидной активностью в отношении патогенных грибов, вызывающих различные заболевания растений. Например соединения, раскрытые в опубликованной заявке N 135364/1988 на патент Японии, не прошедшей экспертизу на новизну, опубликованной заявке N 61836А на Европатент и опубликованной заявке N 2190375А на патент Великобритании, обладают активностью против грибов возбудителей ложной мучнистой росы виноградной лозы и огурцов и патогенных грибов томатов и картофеля. Однако такие соединения не оказывают достаточного регулирующего действие и не обеспечивают безопасности.
Необходимо создание соединений, которые обладают прекрасным эффектом для борьбы с заболеваниями растений, способа их получения и препарата на их основе для подавления заболеваний растений.
Ложная мучнистая роса и другие заболевания растений и фруктовых деревьев имеют тенденцию к возникновению и распространению во время выпадения обильных осадков. Исходя из этого, нужны соединения, которые не смываются дождем (дождеустойчивость), обладают хорошим действием для борьбы заболеваниями растений для их лечения, не повреждая культивируемые растения, и имеют низкую токсичность относительно теплокровных животных и рыбы.
Авторами изобретения проведены интенсивные исследования для решения указанных выше проблем и получили конденсированные гетероциклические соединения общей формулы I и их солей, которые как установлено, обладают превосходным эффектом для борьбы с различными видами заболеваний растений, особенно с ложной мучнистой росой наряду с прекрасной дождеустойчивостью, при этом не повреждая растения, и которые менее токсичны относительно теплокровных животных и рыбы. Эти соединения можно получить промышленным способом.
Таким образом, настоящее изобретение относится к конденсированному гетероциклическому соединению общей формулы
Q-CONH-CH I где Q конденсированная гетероциклическая группа, содержащая атом азота, замещенный или незамещенный в головной части мостика, Х атом водорода или группа, присоединяемая через С, О, S или N, а У группа, притягивающая электроны, или его соли.
I где Q конденсированная гетероциклическая группа, содержащая атом азота, замещенный или незамещенный в головной части мостика, Х атом водорода или группа, присоединяемая через С, О, S или N, а У группа, притягивающая электроны, или его соли.
Предлагаемое изобретение также относится к способу получения конденсированного гетероциклического соединения I или его соли при взаимодействии соединения общей формулы
Q-CO-Z II где Q имеет указанные выше в формуле I значения, а Z означает уходящую группу либо его соли с соединением общей формулы
H2N-CH III где Х и Y имеют указанные в формуле I значения, или с его солью.
III где Х и Y имеют указанные в формуле I значения, или с его солью.
Кроме того, предлагаемое изобретение относится к фунгициду для защиты сельскохозяйственных и садовых культур на основе конденсированного гетероциклического соединения общей формулы I или его соли.
В соответствии с еще одним вариантом настоящее изобретение предлагает конденсированное гетероциклическое соединение на основе карбоновых кислот общей формулы
Q1-CO-Z IV где Q1 означает конденсированную гетероциклическую группу, содержащую атом азота в головной части мостика, как следует в приведенных ниже формулах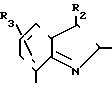 R1,
R1, 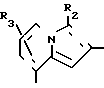 R1,
R1, 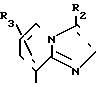 N
N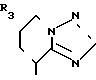 N, R
N, R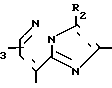 R1,
R1, 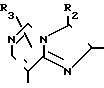 R1,
R1,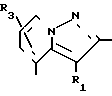 R2,
R2, 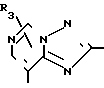 R1, или
R1, или 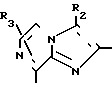 R1
R1
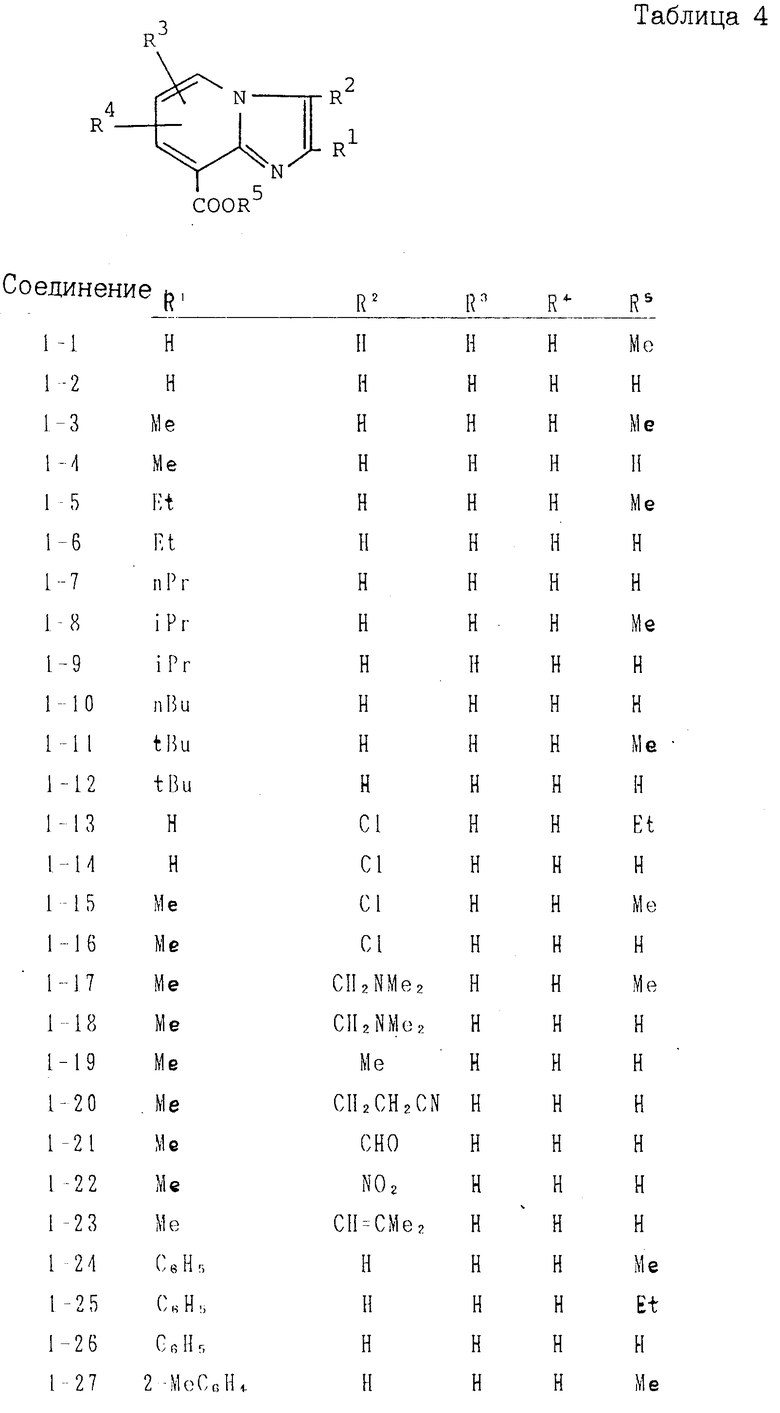
где R1 С1-6-алкил, галоген, С1-4-алкокси, С1-4-алкилтио, С6-10-арилокси, С6-10-арилтио, алкоксикарбонил, фенил, замещенный фенил или ароматическая гетероциклическая группа; R2 и R3 водород, С1-6-алкил, галоген, нитро-, аминосульфогруппа, моно- или двузамещенный алкилсульфамоил, алкоксикарбонил, формил, цианогруппа, фенил, замещенный фенил или ароматическая гетероциклическая группа, при условии, что, когда Q1 означает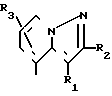 а R1 означает СООН2СН3, то либо одно из R2 и R1 представляет другую группу, кроме водорода, а Z означает уходящую группу, или его соль.
а R1 означает СООН2СН3, то либо одно из R2 и R1 представляет другую группу, кроме водорода, а Z означает уходящую группу, или его соль.
В соответствии с другим вариантом настоящее изобретение предлагает способ получения соединения общей формулы
Q2-CО-Z VIII где Q2 означает группу общей формулы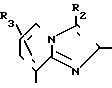 R1, R
R1, R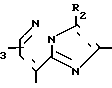 R1,
R1, 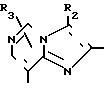 R1,
R1,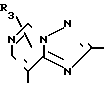 R1, или
R1, или 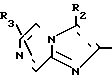 R1
R1
где R1, R2 и R3 имеют указанные выше значения, или его соль, заключающийся в том, что включает взаимодействие соединения общей формулы V где ядро
V где ядро  означает группу пиридина, пиридазина, пиримидина или пиразина, которая не замещена или замещена С1-6-алкилом, галогеном, нитро-, амино-, сульфо-, моно- или диалкилсульфамоилом, алкоксикарбонилом, формилом, циано-, фенилом, замещенным фенилом или ароматической гетероциклической группой, а Z означает уходящую группу, либо его соли с соединением общей формулы
означает группу пиридина, пиридазина, пиримидина или пиразина, которая не замещена или замещена С1-6-алкилом, галогеном, нитро-, амино-, сульфо-, моно- или диалкилсульфамоилом, алкоксикарбонилом, формилом, циано-, фенилом, замещенным фенилом или ароматической гетероциклической группой, а Z означает уходящую группу, либо его соли с соединением общей формулы
W-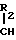 -CO-R1 VI или
-CO-R1 VI или
W-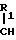 -NHOH VII где W атом галогена, а R1 и R2 имеют указанные выше значения.
-NHOH VII где W атом галогена, а R1 и R2 имеют указанные выше значения.
Соединение I или его соли предлагаемого изобретения имеет новую структуру, характеризуемую комбинированием конкретной группы, а именно конденсированной гетероциклической группы, содержащей атом азота в головной части мостика с карбонильной группой, которая отличается от известных амидных соединений. Преимущество предлагаемого соединения заключается в том, что оно обладает хорошим эффектом ингибирования ложной мучнистой росы и грибкового заболевания растений, прекрасной водоустойчивостью, не повреждают растения и менее токсично относительно теплокровных животных и рыбы.
Предпочтительный вариант осуществления изобретения.
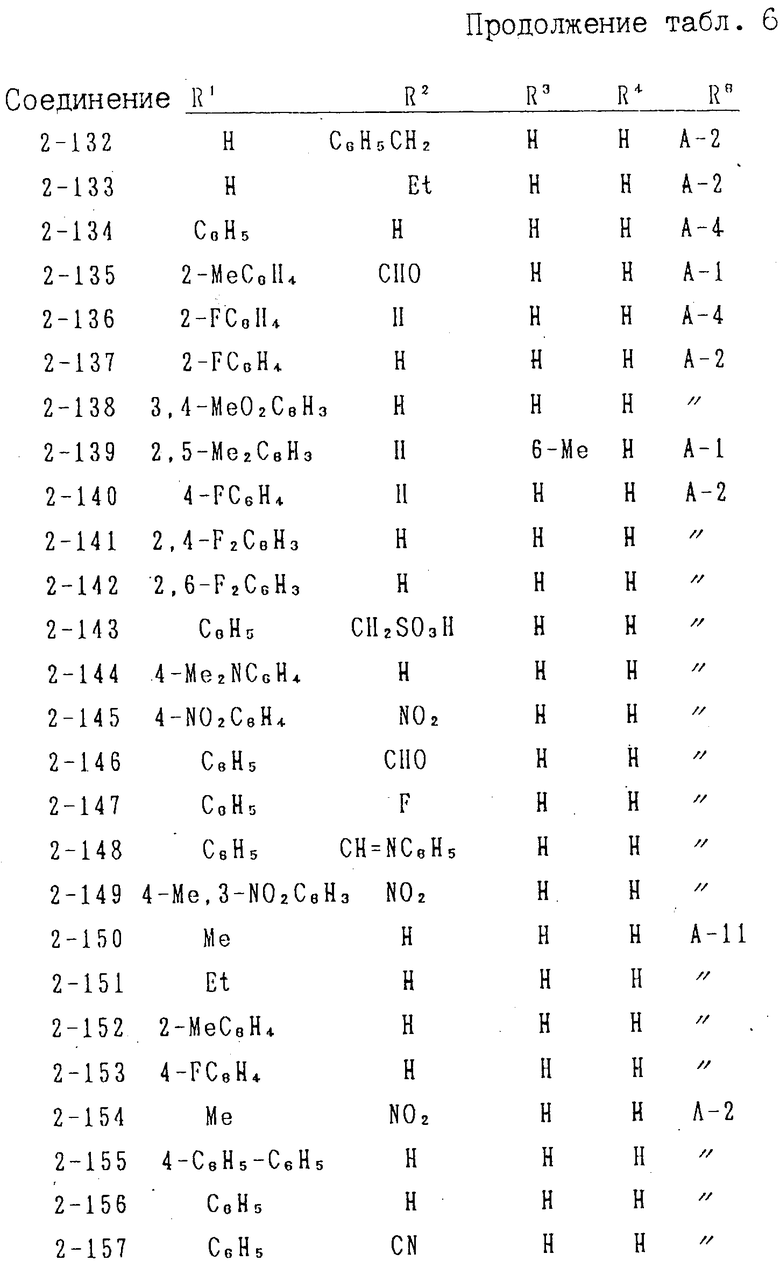
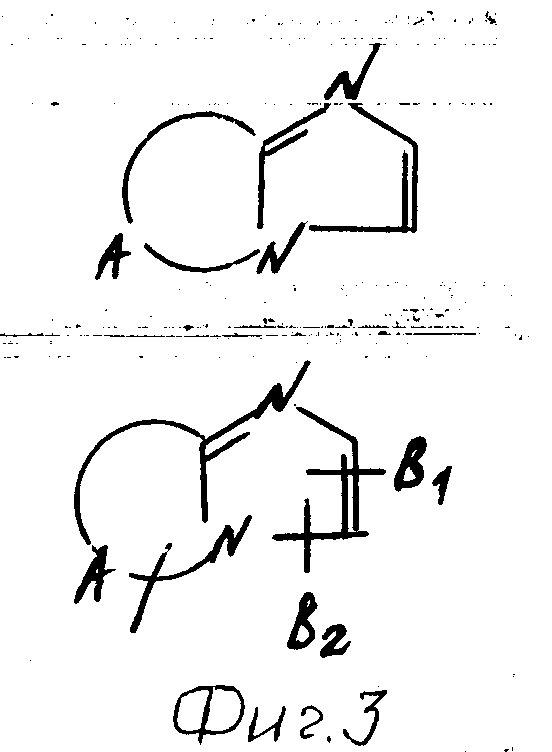
В формулах I и II Q обозначает конденсированную гетероциклическую группу, содержащую атом азота в головной части мостика, который замещен или незамещен. Конденсированная гетероциклическая группа, содержащая атом азота в головной части мостика, означает конденсированную гетероциклическую группу, где атом(ы) "головы" или "хвоста" мостиковой связи, а именно оба или любой из них является неионизированным атомом азота. Конденсированная гетероциклическая группа, содержащая атом в головной части мостика, обозначенная Q, представляет собой группу, образованную при удалении одного атома водорода, связанного с составляющим кольцо атомом углерода в положении, кроме головы мостика конденсированного гетероциклического соединения, представленную, например, общей формулой Г или Д (см. фиг. 1), где а и b представляют собой гетероциклическое ядро, содержащее гетероатом азота, который не замещен или замещен.
Указанные конденсированные гетероциклические группы могут быть представлены, например, общей формулой Е или Ж (см. фиг. 1).
Предпочтительной из них является группа, представленная в левой части указанной формулы.
N-содержащее гетероциклическое ядро, представленное кольцами а и b, означает 4-8-членный, предпочтительно 5-6-членный гетероцикл, содержащий от одного до четырех атомов азота, который, кроме того, может включать от одного до трех атомов кислорода и/или от одного до трех атомов серы, возможно моно- или диокисленных. Такое гетероциклическое ядро может быть дополнительно сконденсировано с 5-6-членным алифатическим циклом (например, циклопентаном, циклогексаном), ароматическим циклом (например, бензолом или нафталином), либо гетероциклом (предпочтительно 5-6-членным гетероциклом).
Среди этих конденсированных гетероциклических ядер, предпочтительны группировки, образованные конденсацией 5- и 6-членного ядра.
В указанной выше формуле ядро а предпочтительно представляет собой 5-членный гетероцикл, содержащий от одного до трех атомов азота, а ядро b 6-членный гетероцикл, содержащий от одного до двух атомов азота и один атом серы, возможно моно- или двуокисленный.
Ядра а и b могут быть замещены 1-3 заместителями (В1, В2, В3), имеющими одинаковые или разные значения, как указано ниже.
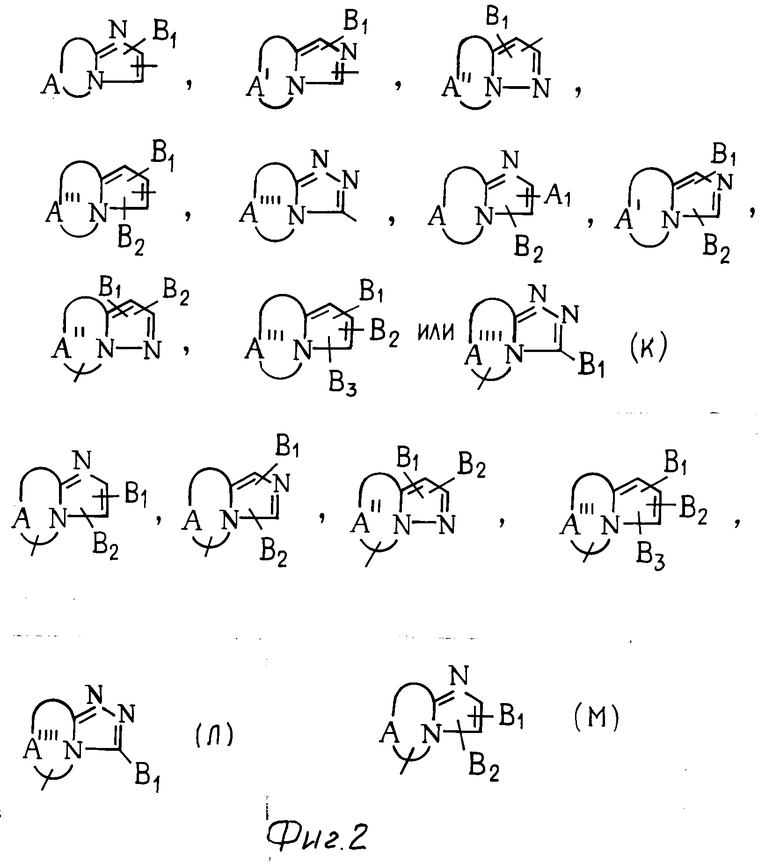
В частности, группировка, представленная общей формулой И (см. фиг. 1) включает группы, например, представленные общими формулами К (см. фиг. 2), где А' группа, образующая конденсированное кольцо в положениях [1, 2] имидазольного кольца; А'' группа, образующая конденсированное кольцо в положениях [1, 5] имидазольного кольца; А''' группа, образующая конденсированное кольцо в положениях [1, 5] пиразольного кольца; А'''' группа, образующая конденсированное кольцо в положениях (1, 2) пиррольного кольца; A'''' группа, образующая конденсированное кольцо в положениях (3, 4) триазольного кольца; В1, В2и В3 имеют приведенные ниже значения.
Группа А, А'', А''' или А'''' содержит от одного до четырех, предпочтительно от трех до четырех атомов углерода в качестве атома, образующего кольцо, и дополнительно могут содержать от одного до трех атомов азота, кислорода и/или серы (которые могут быть представлены в моно- или двуокисленной форме).
Среди указанных конденсированных гетероциклических групп предпочтительны группы, представленные общими формулами Л (см. фиг. 2).
Наиболее предпочтительна группа, представленная общей формулой М (см. фиг. 2).
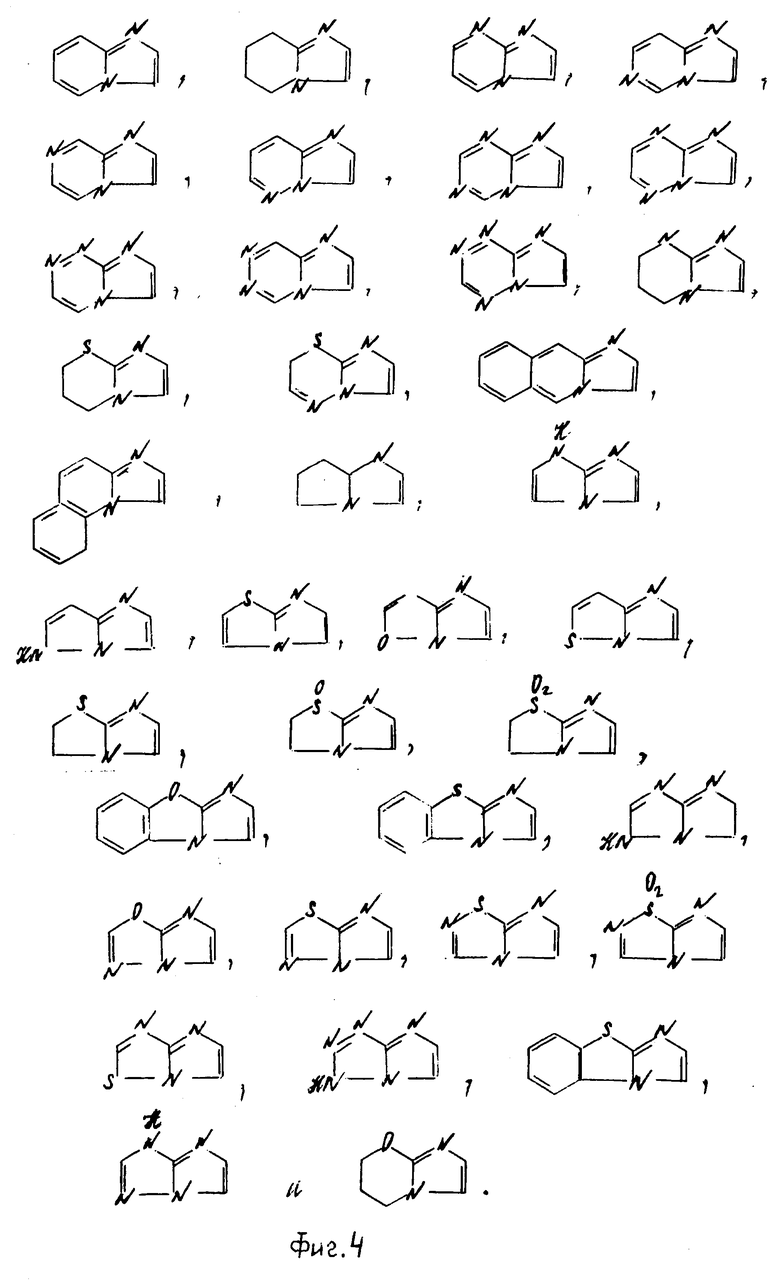
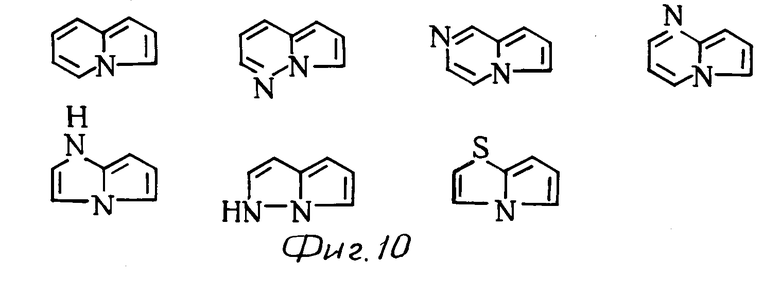
К примерам конденсированных колец, представленных в виде скелета общей формулы (см. фиг. 3), относятся следующие: (см. фиг. 4).
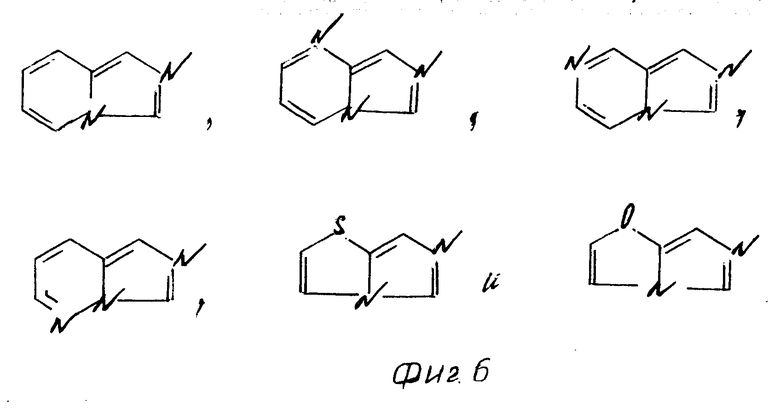
К примерам конденсированных колец, представленных в скелетах группы общей формулы (см. фиг. 5), относятся следующие: (фиг. 6).
К примерам конденсированных колец, представленных в виде скелета группы общей формулы (см. фиг. 7) относятся (см. фиг. 8).
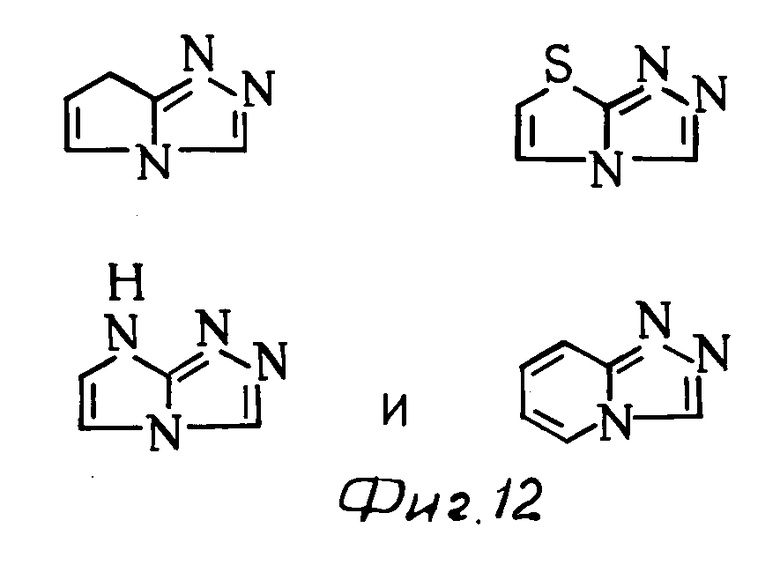
К примерам конденсированных колец, представленных в виде скелета группы общей формулы (см. фиг. 9) относятся (см. фиг. 10).
К примерам конденсированных колец, представленных в виде скелета группы общей формулы (см. фиг. 11) относятся (см. фиг. 12).
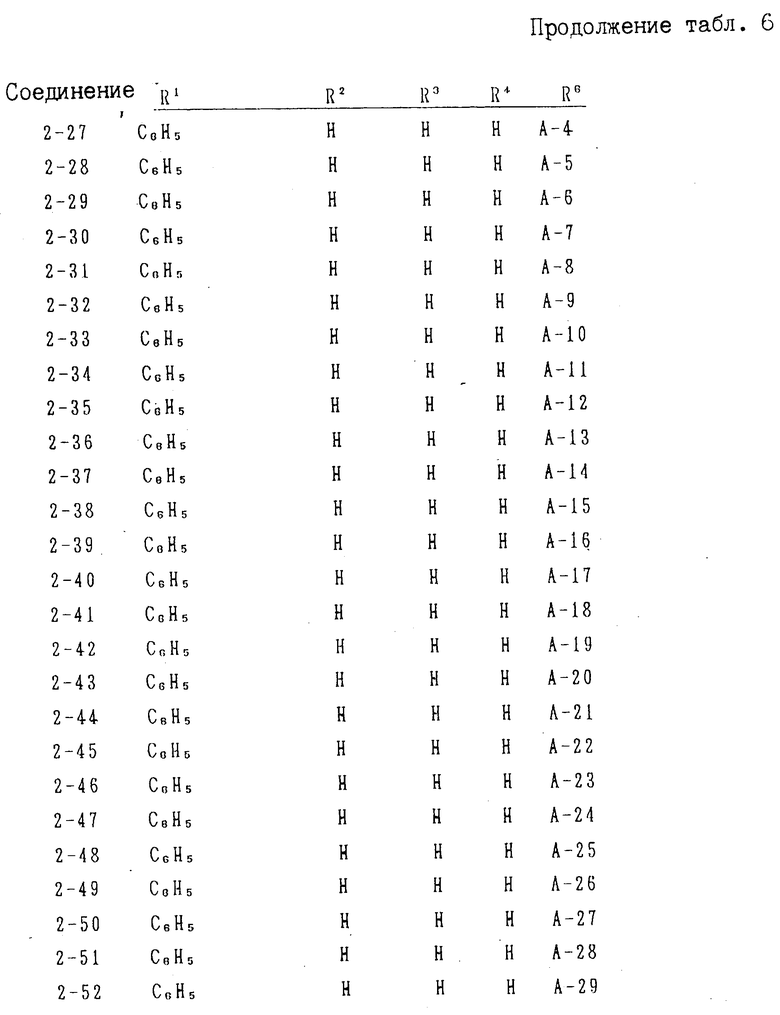
В частности к указанным конденсированным гетероциклическим группам относятся следующие:
имидазо[1,2-а]пиридин, имидазо[1,2-а]пиримидин, имидазо[1,2-с]пиримидин, имидазо[1,2-а] пиразин, имидазо[1,2-b] пиридазин, имидазо[1,2-b]-(1,2,4)-триазин, имидазо[2,1-a] имидазол, имидазо[1,2-b]пиразол, имидазо[2,1-b]тиазол, имидазо[2,1-b] -(1,3,4)-тиазол, 2,3-дигидроимидазо [2,1-b]тиазол, пиразоло[1,5-а] пиримидин, пиразоло[5,1-а] тиазол, пиразоло[1,5-а] пиридин, пирроло[1,3-b] пиридин, имидазо[1,5-а]пиридин и (1,2,4)-триазоло[3,4-b] тиазол.
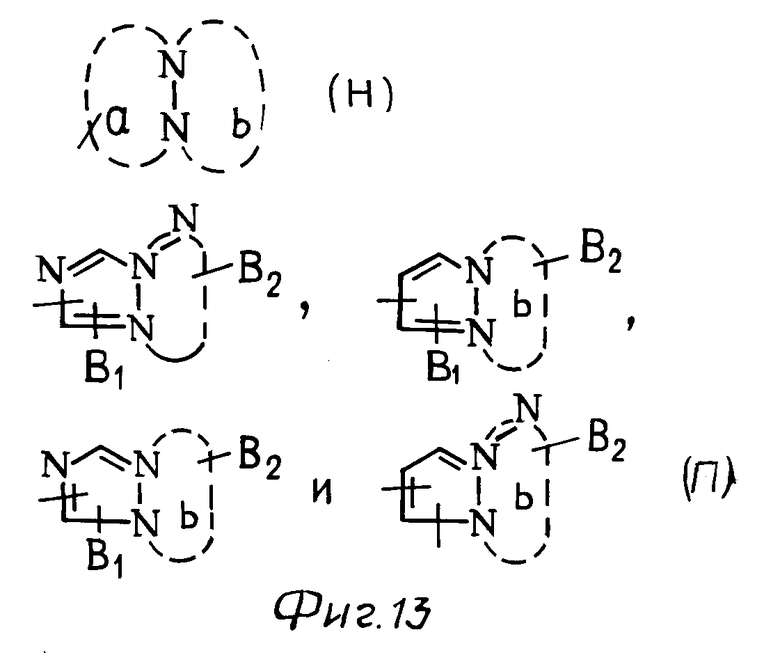
С другой стороны, группа, представленная общей формулой Н (см. фиг. 13) включает группы, представленные, например, общими формулами П (см. фиг. 13), где В1 и В2 каждое имеет приведенное ниже значение.
В частности в качестве примера можно привести 6Н-(1,2,4)-триазоло[1,2-b] -(1,2,3,4)-тетразил, 1Н-(1,2,4)триазоло[1,2-а] -(1,2,4)триазил, (1,2,3)-триазоло[2,1-а]-(1,2,3)- триази- ний-4, (1,2,4)-триазоло[1,2-а]пиридазиний-4 и 6Н-пиразоло[1,2-а]-(1,2,4,5)-тетразил.
Заместители В1, В2 и В3 у конденсированной гетероциклической группы для Q могут иметь одинаковые или разные значения. К примерам указанных заместителей относятся водород, нитро-, амино-, гидроксил, циано-, С1-3-ацил(формил и т.д.), карбамоил, карбоксил, алкоксикарбонил (например, С1-4 -алкоксикарбонил такой, как метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил и т. д.), сульфогруппа, галоген (хлор, бром, иод, фтор и т.д.), С1-4-алкокси (метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси и т.д.), С6-10-арилоксси (фенокси и т. д. ), С6-10-арилкарбонил (бензоил и т.д.), С6-10-арил (фенил, и т. д. ), С7-10-аралкил (бензил, фенэтил и т.д.), С3-7-циклоалкил (циклогексил и т. д. ), С1-4-алкилтио (метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, третбутилтио и т.д.), С6-10-арилтио (фенилтио и т.д.), С7-10-аралкилтио (бензилтио и т.д. ), моно- или диалкилсульфамоил (например, моно- или ди-С1-4-алкилсульфамоил, например моно- или диметилсульфамоил, моно- или диэтилсульфамоил, моно- или ди-н-пропил- сульфамоил), С1-6-алкил (метил, этил, пропил, изопропил, пентил, гексил и т.д.), замещенный фенил (моно-, ди-, три- или четырехгалоидный замещенный фенил, например 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-фторфенил, 4-бромфенил, 2,3-дихлорфенил, 2,4-дихлорфенил, 2,6-дихлорфенил, 2,4-дифторфенил, 2,6-дифторфенил и т.д.), моно-, ди-, три- или тетра-С1-4-алкилзамещенный фенил, например 2-метил- фенил, 3-метилфенил, 4-этилфенил, 4-изопропилфенил, 2,4-диметилфенил, 2,5-диметилфенил, 3,4-диметилфенил, 2,5-диэтил- фенил, 2,4,6-триметилфенил и т.д. моно-, ди-, три- или тетра-С1-4-алкоксизамещенный фенил, например 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 3,4-диметоксифенил и т.д. моно-, ди-, три- или тетра-С1-4- алкилтиозамещенный фенил, например 2-метилтиофенил, 3,4-диметилтиофенил и т. д. 2-хлор-4-нитрофенил, 4-нитрофенил, 2-метил-4-аминофенил, 2-бром-4-нитрофенил, 2-нитро-4-метилфенил и т.д.), ароматическая гетероциклическая группа (пяти- или шестичленная гетероциклическая группа, например пиридил, фурил, тиенил, тиазолил и т.д.). Особенно предпочтительно использование в качестве заместителей В1, А2 и В3 С1-6-алкила, фенила или замещенного фенила.
Q1 в формуле IV означает конденсированную гетероциклическую группу, содержащую атом азота в головной части мостика, представленную следующими формулами: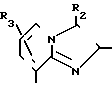 R1,
R1, 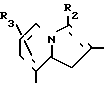 R1,
R1, 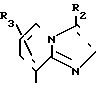 N
N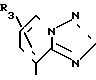 N, R
N, R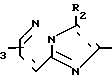 R1,
R1, 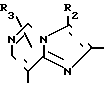 R1,
R1,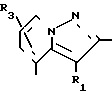 R2,
R2, 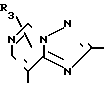 R1, или
R1, или 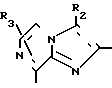 R1
R1
В качестве заместителей R1, R2 и R3 используют одинаковые или разные заместители, которые имеют указанные выше значения, но любой из R2 и R3 означает группу кроме атома водорода, если Q1 означает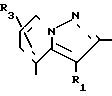 R2 а R1 означает СООСН2CH3.
R2 а R1 означает СООСН2CH3.
К примерам заместителя R1 относится С1-6-алкил, галоген, С1-4-алкокси, С1-4-алкилтио, С6-10-арилокси, С6-10-арилтио, алкоксикарбонил, фенил, замещенный фенил или ароматическая гетероциклическая группа, как указано в приведенных выше В1, В2 и В3. К примерам заместителей R2 и R3 относятся водород, нитро-, амино-, сульфогруппа, формил, циано или фенил, а также С1-6-алкил, галоген, моно- или ди-алкилсульфамоил, алкоксикарбонил, замещенный фенил или ароматические гетероциклические группы, как указано в приведенных выше В1, В2 и В3.
В качестве заместителя R1 предпочтительно используют фенил или замещенный фенил.
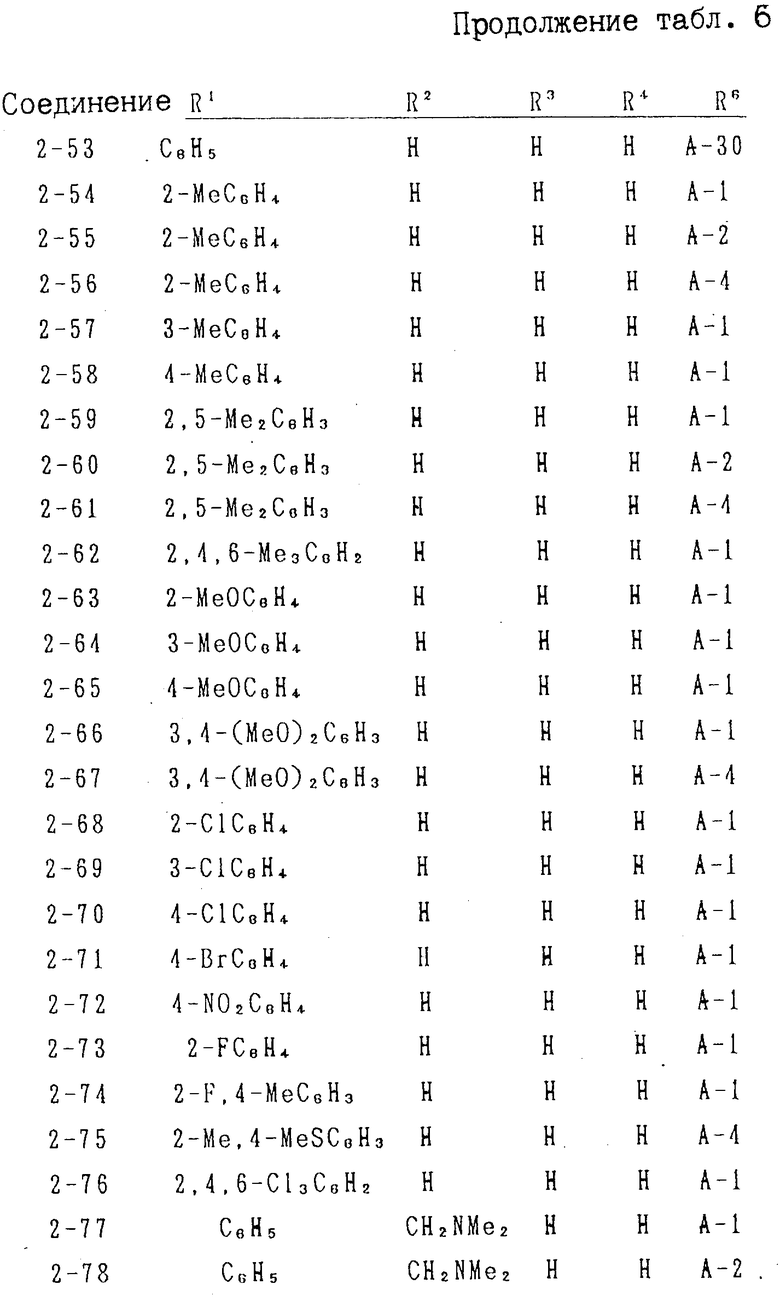
Предпочтительными группами Q1 являются Q' или Q'', которые описаны ниже.
Символ Х в общей формуле I означает атом водорода или группу, присоединенную через атом С, О, S или N. Группа, присоединенная через атом углерода может быть алкилом, алкенилом, галоидалкилом, циклоалкилом, циклоалкенилом, арилом или аралкилом, либо ароматической гетероциклической группой, содержащей химическую связь у атома углерода; группа, присоединенная через атом 0 может быть алкокси-, арилокси- или аралкилоксигруппой; группа, присоединяемая через атом S может быть алкилтио-, арилтио- или аралкилтиогруппой; и группа, присоединяемая через атом N может быть алкиламино-, ариламино- или аралкиламиногруппой, либо ароматической гетероциклической группой, имеющей химическую связь у атома N.
Указанная выше алкильная группа или алкильный остаток галоидалкильной, алкокси-, алкилтио- и алкиламиногрупп включает группу с прямой или разветвленной цепью, содержащую от одного до десяти атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, втор-пентил, изопентил, неопентил, н-гексил, изогексил, н-октил, н-децил и т.п.
В качестве указанной алкенильной группы может быть использована группа, содержащая 2-4 атома углерода, например винил, аллил, 2-металил, 3-металил, 3-бутенил или т.п.
В качестве циклоалкильной группы может быть представлена трех-шестичленная группа, например циклопропил, циклопентил, циклогексил или т.п.
В качестве циклоалкенильной группы может быть использована трех-четырехчленная группа, например циклопропенил, циклопентенил, циклогексенил или т. п.
В качестве арильной группы и арильного остатка арилокси-, арилтио- и ариламиногрупп может быть представлена группа, содержащая от шести до десяти атомов углерода, например фенил, толил, ксилил, нафтил или т.п.
В качестве аралкильной группы или аралкильного остатка аралкилокси-, аралкилтио-, и аралкиламиногрупп может быть группа, содержащая 7-10 атомов углерода, например бензил, фенэтил или т.п.
В качестве ароматической гетероциклической группы, имеющей химическую связь у атома С может быть представлена пяти- или шести членная ароматическая гетероциклическая группа, например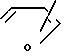 ,
, 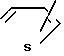 ,
, 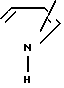 и
и  N
N
В качестве ароматической гетероциклической группы, имеющей химическую связь у атома N может быть представлена пяти- или шестичленная N-содержащая группа, например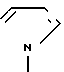 , N
, N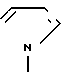 ,
, 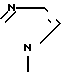 и N
и N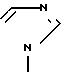
Каждая из указанных выше групп, присоединяемых через атом С, О, S или N, может дополнительно содержать от одного до четырех заместителей, например нитро-, амино-, гидроксил, циано-, карбоксил, сульфогруппу, галоген (фтор, хлор, бром и т.д.), алкоксигруппу, содержащую от одного до четырех атомов углерода (метокси, этокси, и т.д.), алкилтиогруппу, содержащую от одного до четырех атомов углерода (метилтио, этилтио и т.д.), фенилтиогруппу, бензилтиогруппу и т.п.
К подходящим примерам Х относятся атом водорода, С1-10-алкил, С2-4-алкенил, С1-10-алкоки, С1-10-алкилтио, фенил, галогензамещенный фенил, ароматическая гетероциклическая группа, содержащая химическую связь у атома С или N или т. п. К конкретным примерам указанных групп относятся такие, которые указаны в качестве примеров для приведенных выше В1, В2 и В3.
Символ Y в общей формуле I означает группу, притягивающую электроны, например циано-, карбамоильная, тиакарбамоильная или трихлорметильная группа или т.п.
К соединениям настоящего изобретения, которые представляют особенный интерес, относятся группы следующей формулы I':
Q′-CONH-CH I' где Q' означает группу формулы
I' где Q' означает группу формулы B
B (одно из значений В1' и В2' представляет собой С1-6-алкил, фенил или замещенный фенил, а другое значение представляет атом водорода), Х означает фенил, галоидзамещенный фенил или ароматическая гетероциклическую группу, имеющую химическую связь у атома С.
(одно из значений В1' и В2' представляет собой С1-6-алкил, фенил или замещенный фенил, а другое значение представляет атом водорода), Х означает фенил, галоидзамещенный фенил или ароматическая гетероциклическую группу, имеющую химическую связь у атома С.
К другой группе соединений I, представляющих интерес, относится группа следующей формулы I''
Q″-CONH-CH I'' где Q'' означает
I'' где Q'' означает B
B (В1'' означает фенил или замещенный фенил, В2'' атом водорода или С1-6-алкил), Х фенил, фторзамещенный фенил, тиенил или фурил.
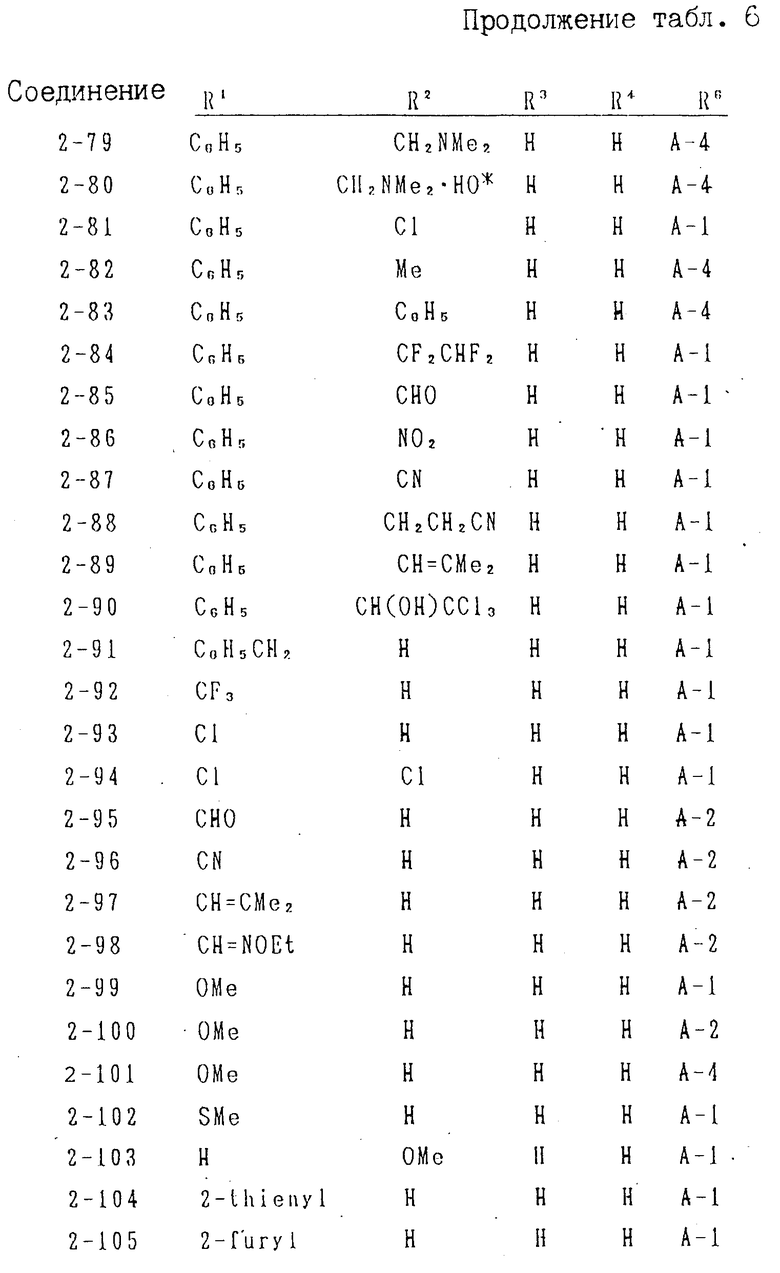
(В1'' означает фенил или замещенный фенил, В2'' атом водорода или С1-6-алкил), Х фенил, фторзамещенный фенил, тиенил или фурил.
С1-6-алкильная группа и замещенная фенильная группа, приведенные в качестве примеров для В1, В2 и В3 подходят для В1', В1'', В2' и В2'' формул I'и I''. Галоидзамещенный фенил для Х может представлять собой фенильную группу, замещенную 1-4 атомами галогена, выбранного из фтора, хлора, брома и т. д. В качестве фторзамещенной фенильной группы для Х'' можно использовать орто-, мета- или парафторфенил, орто-, мета-, пара-дифторфенил или 2,4,6-трифторфенил. Ароматические гетероциклические группы, имеющие химическую связь у атома С, указанные выше для символа Х, можно использовать в качестве групп для символа Х'.
К предпочтительному примеру символов Q' и Q'' относится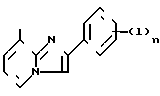 где n 0, 1, 2, 3 или 4, l С1-4-алкил, С1-4-алкокси, С1-4-алкилтиогруппу или галоген, имеющий одинаковые или разные значения. Замещенные фенильные группы, указанные выше для В1, В2 и В3 можно использовать для группы
где n 0, 1, 2, 3 или 4, l С1-4-алкил, С1-4-алкокси, С1-4-алкилтиогруппу или галоген, имеющий одинаковые или разные значения. Замещенные фенильные группы, указанные выше для В1, В2 и В3 можно использовать для группы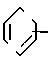 (l)n (n= 0). Символ Х' и
(l)n (n= 0). Символ Х' и  в предпочительном варианте означают 2-тиенил/ и т.д.
в предпочительном варианте означают 2-тиенил/ и т.д.
Соединения I предлагаемого изобретения содержат асимметрический атом углерода, и настоящее изобретение включает в свой объем каждый изомер благодаря асимметрическому атому углерода и их смесь.
В качестве соли соединений формулы I предлагаемого изобретения можно использовать соль, образованную при взаимодействии щелочного металла или щелочноземельного металла, например натрий, магний, калий, кальций и т.д. с кислотной группой (например, карбокигруппой и т.д.), содержащейся в качестве заместителя, либо соль, образованную при взаимодействии неорганической кислоты, например соляная, фосфорная, серная кислота и т.д. или органической кислоты, например щавелевая, уксусная, бензойная кислота с щелочной группой, содержащейся в заместителе (ях) или конденсированном гетероцикле.
Карбоновые кислоты формул II и IV c конденсированным гетероциклом, которые используют в качестве исходных материалов предлагаемого изобретения, или их соли можно получить по способу, аналогичному известным (см. жур. J. Org. Chem. т. 37, с. 3107, 1972; J. Org. Chem. т. 36, c. 2678, 1971; J. Org. Chem. т. 42, с. 4197, 1977; J. Med. Chem. т. 17, с. 645, 1974; J. Med. Chem. т. 20, с. 386, 1977; J. Med. Chem. т. 15, с. 982, 1972; J. Med. Chem. т. 28, с. 876, 1985; Tetrahedron Lett, т. 21, с. 2195, 1980, J. Chem. Soc. Perkin Trans I, с. 1159, 1887 и т.д.
В частности, некоторые из карбоновых кислот формулы II или IV, или их соли можно получить, например, при взаимодействии ароматической гетероциклической аминокарбоновой кислоты, ее реакционноспособного производного или соли с соединением формулы VI или VII.
В частности, соединение VII или его соль, которую часто используют среди новых соединений IV или их солей можно получить путем взаимодействия соединения формулы V или его соли с соединением VI или соединением VII.
В формулах II, IV, V и VIII, Z означает уходящую группу и соответственно группа СОZ может означать -СООН или ее реакционноспособное производное. Таким образом, соединение II или ее соль может быть представлено карбоновой кислотой формулы
Q COOH II' где Q' имеет указаное выше значения, или ее реакционноспособным производным, либо ее солью;
соединение V или его соль может быть представлено карбоновой кислотой формулы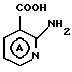 V' где кольцо
V' где кольцо  имеет указанные выше значения, или ее реакционно-способным производным или ее солью;
имеет указанные выше значения, или ее реакционно-способным производным или ее солью;
соединение VIII или его соль может быть представлено карбоновой кислотой формулы
Q2 COOH VIII' где Q2 имеет указанные выше значения, или ее реакционноспособным производным, либо ее солью, соответственно.
К примерам реакционноспособных производных у карбоксильной группы в ароматической гетероциклической аминокарбоновой кислоты и карбоновых кислот II', IV', V' и VIII' относятся ангидриды кислот, активные амиды, активные сложные эфиры или т.п.
Ниже приведены конкретные примеры таких реакционноспособных производных.
Ангидриды кислот могут быть представлены смешанными ангидридами с галоидзамещенными кислотами (например, соляной кислотой или бромистоводородной кислотой), эфирами угольной кислоты, алифатическими карбоновыми кислотами (например, уксусной, триметилуксусной, валериановой, изовалериановой или трихлоруксусной кислотами), или ароматическими карбоновыми кислотами (например, бензойной кислотой), симметрическими ангидридами кислот.
В качестве активных амидов могут быть амиды с пиразолом, имидазолом, 4-замещенным имидазолом, диметилпиразолом или бензтриазолом.
В качестве активных сложных эфиров могут быть представлены сложные метиловый, этиловый, метоксиметиловый, пропаргиловый, 4-нитрофениловый, 2,4-динитрофениловый, трихлорфениловый, пентахлорфениловый или метилсульфениловый эфиры, либо другие сложные эфиры с 1-гидрокси-1Н-2-пирролидоном, N-гидроксисукцинимидом или N-гидроксифталимидом.
Такие реакционно-способные производные у карбоксильной группы подбирают соответствующим образом и используют в зависимости от вида применяемых карбоновых кислот.
Кроме того, указанные выше ароматическая гетероциклическая аминокарбоновая кислота и карбоновые кислоты II', IV', V' и VIII' можно использовать в своей свободной форме (например, в форме карбоновой кислоты) предпочтительно в присутствии конденсирующего реагента, например N,N'-дициклогексилкарбодиимид, N-циклогексил-N'-морфолиноэтилкарбодиимид, N-циклогексил-N'-(4-диэтиламиноциклогексил)карбодиимид или N-этил-N'-(3-диметиламинопропил)карбодиимид. Кроме того, указанные выше карбоновые кислоты можно использовать в виде солей с щелочным или щелочноземельным металлом.
Символ W в формулах VI и VII означает атом галогена, например хлора, брома или фтора. Кольцо  в формуле V может быть пиридиновым, пиридазиновым, пиримидиновым или пиразиновым кольцом, которые могут быть замещены группой, упоминавшейся в R3, Q2, в предпочтительном варианте имеет значения Q' или Q''.
в формуле V может быть пиридиновым, пиридазиновым, пиримидиновым или пиразиновым кольцом, которые могут быть замещены группой, упоминавшейся в R3, Q2, в предпочтительном варианте имеет значения Q' или Q''.
Указанную реакцию можно проводить без использования растворителя либо в любом растворителе, а при необходимости в присутствии конденсирующего реагента, например основания. В качестве подходящих растворителей можно использовать спирты, например этанол, изопропанол и т.д. ароматические углеводороды, например бензол, толуол, ксилол, галоидзамещенные углеводороды, например хлористый метилен, хлороформ, тетрахлорметан и т.д. простые эфиры, например диэтиловый эфир, диоксан, тетрагидрофуран, диметоксиэтан и т.д. кетоны, такие как ацетон, метилэтилкетон и т.д. нитрилы, например ацетонитрил, пропионитрил и т.д. амиды, такой как диметилформамид, диметилацетамид и т.д. сложные эфиры, например метилацетат, этилацетат, бутилацетат и т.д. или их смеси. При необходимости можно использовать смешанный растворитель, состоящий из воды и ароматического, либо галоидзамещенного углеводорода. Растворитель обычно используют в количестве от 1 до 50 частей (по весу) предпочтительно от 5 до 10 частей относительно карбоновых кислот или их реакционноспособных производных либо солей.
Реакцию можно ускорить путем прибавления основания к растворителю. В качестве подходящего основания можно использовать третичные амины, например триэтиламин, пиридин, 4-диметиламинопиридин, ДБУ (1,8-диазабицикло(5,4,0)-ундецен-7) и т.д. гидроксид, карбонат или бикарбонат щелочных или щелочноземельных металлов, либо алкоголят щелочного металла, например карбонат натрия, карбонат калия, бикарбонат натрия, гидроокись натрия, гидроокись калия, алкоголят натрия, или металлоорганическую соль, например н-бутиллитий. Указанное основание используют обычно в количестве от 1 до 5 эквивалентов, предпочтительно от 1 до 3 эквивалентов относительно карбоновых кислот, либо их реакционно-способных производных или солей.
Соединение формулы VI или VII используют в количестве от 1,1 до 2,0 моль на 1 моль карбоновой кислоты или ее реакционно-способного производного, либо соли в указанной реакции. Эту реакцию можно проводить при комнатной температуре (например, в интервале 10 до 30оС), либо при повышенной температуре (например, от 30 до 100оС) для ускорения взаимодействия. Реакционное время зависит от температуры реакции, и обычно реакция продолжается от 15 мин до 24 ч, предпочтительно от 30 мин до 10 ч.
Таким образом, полученное соединение II или IV можно выделить и очистить в виде свободного основания известным методом, например хроматографией на силикагеле (кизельгель Р 60, производимого фирмой Merck and Co, Inc. используя в качестве элюента растворитель-хлороформ, этилацетат и т.д.), либо выделить и очистить в виде соли присоединения кислоты при использовании неорганической кислоты, например соляной, серной, фосфорной, либо органической кислоты такой как уксусная, бензолсульфокислота, пара-толуолсульфокислота, метансульфокислота, лимонная, винная, щавелевая, пропионовая, малеиновая, яблочная, малоновая, фумаровая, миндальная, аскорбиновая кислоты, традиционным способом при использовании известных приемов, например концентрацией, концентрацией при пониженном давлении, экстракцией, фазовым переносом, кристаллизацией, перекристаллизацией, или хроматографией. В случае, когда в указанном соединении содержится карбоксильная группа в качестве заместителя, указанное соединение можно превратить в соль при взаимодействии с щелочным или щелочноземельным металлом, как приводилось в качестве примера ранее в соответствии с традиционным методом, которую затем можно выделить и очистить известными средствами.
Конденсированные гетероциклические производные карбоновых кислот II или IV или их соль, полученные в соответствии с указанной выше реакцией, можно также превратить в нитрозамещенное соединение обычной реакцией нитрования либо в галоидзамещенное соединение при использовании галогенизирующего реагента, например N-бромсукцинимида (NBs), N-хлорсукцинимида (NCS) или т.п.
Амины III и их соли (соли с кислотами, о которых говорилось выше в соединениях II и IV, можно получить известным способом.
Соединение I или его соль можно обычно получить при взаимодействии соединения II или его соли без использования растворителя, либо в соответствующем растворителе в присутствии соответствующего основания или конденсирующего реагента. В качестве растворителя можно использовать ароматические углеводороды, например бензол, толуол, ксилол, галоидзамещенные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорметан, простые эфиры, например диэтиловый эфир диоксан, тетрагидрофуран, нитрилы, например ацетонитрил, пропионитрил, амиды, например диметилформамид, диметилацетамид, сложные эфиры, например метилацетат, этилацетат, бутилацетат или их смеси. При необходимости можно использовать смесь, состоящую из воды и ароматического или галоидзамещенного углеводорода.
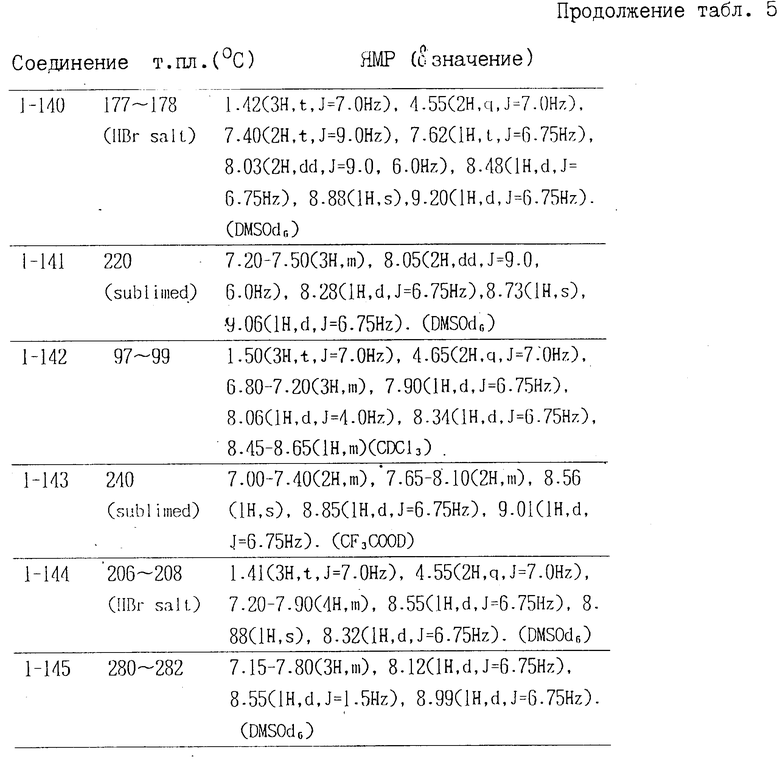
Растворитель обычно используют в соотношении от 1 до 50 частей (по весу), предпочтительно от 5 до 10 частей относительно соединения II или его соли. Указанную реакцию можно ускорить путем прибавления основания к растворителю. В качестве подходящего основания можно использовать третичные амины, например триэтиламин, пиридин, ДБУ (1,8-диазабицикло[5,4,0]ундец-7-ен), гидроксиды, карбонаты или бикарбонаты щелочных или щелочноземельных металлов, либо алкоголяты щелочных металлов, например карбонат натрия, калия, бикарбонат натрия, гидроокись натрия, калия, алкоголят натрия, или металлоорганическую соль, например н-бутиллитий и т.д. Такое основание обычно используют в количестве от 1 до 20 эквивалентов, предпочтительно от 2 до 5 эквивалентов относительно соединения II или его соли. В качестве подходящих конденсирующих реагентов можно использовать тионилхлорид, хлорангидрид фосфорной кислоты, карбонилдиимидазол, N-метил-2-бромпиридиния йодид, дициклогексилимид или их смесь. Такой конденсирующий реагент обычно используют в количестве от 1 до 10 эквивалентов, предпочтительно от 2 до 5 эквивалентов относительно соединения II или его соли.
При взаимодействии, соединение II или его соль используют в количестве от 1,1 до 1,5 моль на 1 моль соединения III или его соли. Реакцию можно проводить при охлаждении с доведением до комнатной температуры (в интервале от 20 до 30оС), или при повышенной температуре, например в интервале примерно от 30 до 100оС для ускорения взаимодействия. Хотя время реакции зависит от реакционной температуры, но обычно реакция продолжается от 15 мин до 15 ч, а в предпочтительном варианте примерно от 20 мин до 8 ч.
Полученное таким образом соединение I можно выделить и очистить в виде свободного основания известным способом, например хроматографией на силикагеле (кизельгель 60, производимый фирмой Merck and Co. Inc. используя в качестве элюента растворитель-хлороформ, этилацетат, либо выделить и очистить в виде соли присоединения кислоты при использовании неорганической кислоты, например соляной, серной, фосфорной кислот и т.д. либо органической кислоты, например уксусной бензолсульфокислоты, пара-толуолсульфокислоты, метансульфокислоты, лимонной, винной, щавелевой, пропионовой, малеиновой, яблочной, малоновой, фумаровой, миндальной, аскорбиновой кислот, традиционным способом. В случае, когда в указанном соединении содержится карбоксильная группа, или аналогичная ей в качестве заместителя, это соединение можно превратить в соль при использовании щелочного или щелочноземельного металла, которую затем можно выделить и очистить общеизвестными методами.
Полученные соединения формулы I предлагаемого изобретения обладают превосходным эффектом, предупреждающим и регулирующим различные виды заболеваний растений, вызванных патогенными грибами, особенно ложную мучнистую росу овощных культур, например огурцов, китайской капусты, лука, бобовых и фруктовых деревьев, например, виноградной лозы, цитрусовых, яблоневых деревьев, гнили томата, картофеля, баклажанов, зеленого перца, тыквы. Кроме того, предлагаемые соединения формулы I и их соли сохраняют устойчивый фунгицидный эффект в течение значительно продолжительного периода времени после нанесения их на растения (пролонгированный эффект), при этом их фунгицидная активность снижается в меньшей степени вследствие незначительного смывания их дождем после нанесения методом распыления (дождеустойчивость). Таким образом, предлагаемые соединения I или их соли проявляют достаточное воздействие даже в дождливое время, когда часто возникает ложная мучнистая роса, либо заболевание, сопровождаемое гнилью растений. К тому же предлагаемые соединения I и их соли обладают безопасностью и лучшей способностью в качестве сельскохозяйственного фунгицида, так как последействие на растения невысоко наряду с низкой их токсичностью в отношение рыбы.
Предлагаемые соединения формулы I или их соли можно использовать в качестве фунгицида в традиционной форме сельскохозяйственных ядохимикатов. В частности в зависимости от предназначаемой цели в предпочтительном варианте можно использовать один, два или несколько типов предлагаемых соединений I в форме эмульгируемого концентрата, маслянистого препарата, разбрызгиваемого раствора, смачивающегося порошка, порошка, гранул, мази, которые могут быть составлены с соответствующим носителем или носителями традиционным способом, например, путем растворения или диспергирования их в жидком носителе, смешивания с подходящим твердым носителем или адсорбирования на твердом носителе. При необходимости к указанным выше препаратам, которые можно получить любым общепринятым методом, можно прибавлять эмульгатор, суспендирующий агент, распылитель, смачивающий агент, увлажняющее средство, связующее, стабилизатор и т.д.
Предпочтительный расход соединения I предлагаемого изобретения или его соли на всю фунгицидную композицию составляет примерно от 1 до 80 мас. для эмульгируемого концентрата или смачивающегося порошка, примерно от 0,1 до 10 мас. для препарата в виде масла или порошка и примерно от 5 до 50 мас. для гранул, хотя концентрация активного компонента может варьировать в зависимости от предназначаемой цели. Эмульгируемые концентраты, смачивающиеся порошки и т.д. перед использованием в требуемой степени разводят и наполняют (например до 100-5000-кратного объема) водой или т.п. а затем их распыляют.
В качестве подходящего жидкого носителя (растворителя) можно использовать, например, воду, спирты (метанол, этанол, н-пропанол, изопропиловый спирт, этиленгликоль), простые эфиры (диоксан, тетрагидрофуран, монометиловый эфир этиленгликоля, монометиловый эфир диэтиленгликоля, монометиловый эфир пропиленгликоля), кетоны (ацетон, метилэтилкетон), алифатические углеводороды (керосин, осветительное масло, мазут, машинное масло), ароматические углеводороды (бензол, толуол, ксилол, сольвент-нафту, метилнафталин), галоидзамещенные углеводороды (хлористый метилен, хлороформ, тетрахлорметан), амиды кислоты (диметилформамид, диметилацетамид), сложные эфиры (этилацетат, бутилацетат, эфир глицерина и жирной кислоты), нитрилы (ацетонитрил, пропионитрил) или т.п. Указанные жидкие носители можно использовать как по отдельности, так и в виде произвольной их смеси.
В качестве подходящего основания для мази можно использовать, например, полиэтиленгликоль, пектин, сложные эфиры многоатомных спиртов высших жирных кислот, например глицериновый моностеарат, производные целлюлозы, например метилцеллюлоза, альгинат натрия, бентонит, высшие спирты, многоатомные спирты, например глицерин, вазелин, белый вазелин, жидкий парафин, лярд, различные виды растительных масел, ланолин, обезвоженный ланолин, твердую смазку, смолы и т.п. Указанные основания можно использовать как отдельно, так и в виде произвольной их смеси, либо в комбинации с поверхностно-активным веществом, приведенным далее в качестве примера.
В качестве поверхностно-активного вещества, используемого при необходимости в качестве эмульгатора, распылителя, смачивающего вещества, диспергатора и т. д. можно применять неионогенный или анионогенный ПАВ, например мыла, полиоксиалкилариловые эфиры (например Нональ®, производимый фирмой Jakemoto Gushi K. K. Япония), алкилсульфаты (например Emal 10 Emal 40®, производимые фирмой Као-Atlas K.K. Япония), алкилсульфонаты (например Неоген®, Неоген Т®, производимые фирмой Dai-ichi Kojyo Seiyaku K.K. Япония), Неопеллекся®, производимый фирмой Као-Atlas K.K. Япония, простые эфиры полиэтиленгликоля (например, Нонипол 85®, Нонипол 100®, Нонипол 160®, производимые фирмой Sanyo Kasli К.К. Япония) сложные эфиры многоатомных спиртов (например Твин 20®, Твин 80®, производимые фирмой Као-Atlas К.К. Япония) или т.п.
Фунгицид предлагаемого изобретения можно наносить в любое время, начиная с обработки семян, рассады (саженцев) до сбора урожая. Предлагаемый фунгицид можно использовать для предупреждения вспышки болезни растения при предварительном внесении препарата, а также для лечения болезни растения путем внесения его после появления болезни общеизвестным методом.
Количество соединения I предлагаемого изобретения или его соли, используемого в качестве сельскохозяйственного ядохимиката, может меняться в зависимости от условий, например стадия развития растения и места выращивания растения, в которое вносится ядохимикат, вида болезни растения, очага вспышки болезни, времени и способа внесения фунгицида и т.д. Соединение I или его соль используют обычно в количестве примерно от 3 до 300 г, предпочтительно примерно от 10 до 100 г на 10 ар. Концентрация вносимого активного ингредиента предпочтительно составляет от 10 до 1000 ч/млн. Фунгицид обычно вносят непосредственным разбрасыванием, опыливанием или поливом его прямо на растение либо опылением семян. Количество, концентрация и способ нанесения можно при желании менять для обеспечения надежного и эффективного использования фунгицида.
Предлагаемый фунгицид при необходимости можно использовать в произвольной комбинации с другими видами фунгицидов (например, фунгицид на основе хлорорганического соединения, фунгицид на основе фосфорорганического соединения, фунгицид на основе органического сернистого соединения, фунгицид бензимидазольного типа, медьсодержащий фунгицид, фенольный фунгицид, фунгицид триазольного типа, фунгицид пиримидинового типа, фунгицид типа акриловой кислоты, фунгицид типа сульфенамида, фунгицид типа аминокислот, фунгицид в виде антибиотика и т. д.), инсектицидами (например, природный инсектицид, инсектицид типа карбаматов, инсектицид на основе фосфорорганических соединений, инсектицид типа фитотоксина, синтетический пиретроид и т.д.), акарицидамин, нематицидами, гербицидами, гормональными препаратами для растений, регуляторами роста растений, стабилизаторами, синергистами, аттрактантами, реппелентами, отдушивающими веществами, пигментами, удобрениями, питательными веществами для растений, различными аминокислотами, низко- или высокомолекулярными фосфорными кислотами или т.п. Для получения синергетического эффекта можно также прибавлять соли металлов (например, хлорид меди, сульфат меди и т.д.).
Предлагаемые соединения I и их соли обладают превосходным защитным или профилактическим действием против ложной мучнистой росы и болезни овощных культур и плодовых деревьев, вызываемой патогенными грибами. Эти соединения или их соли не смываются, обладают прекрасной устойчивостью к дождю и исходя из этого демонстрируют превосходное защитное и профилактическое действие особенно в дождливый период. Соединения I или их соли снижают распространение болезни овощных культур и плодовых деревьев и их можно использовать в качестве предпочтительного фунгицида, не наносящего никакого значительного вреда урожаю.
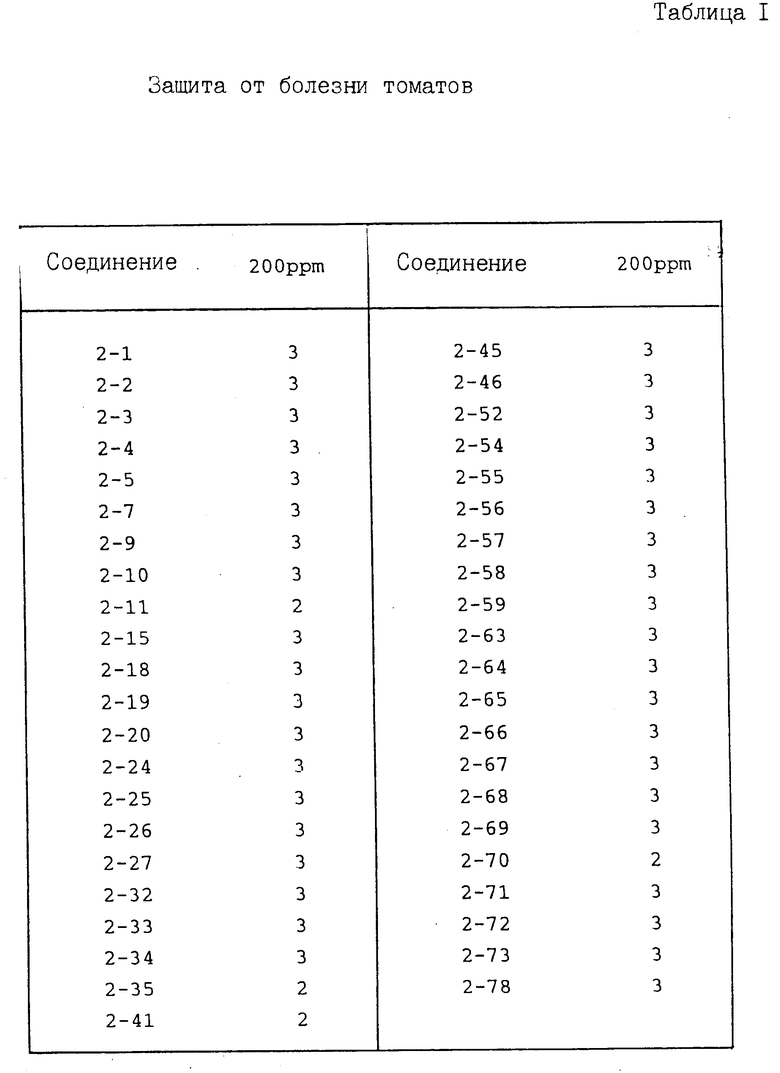
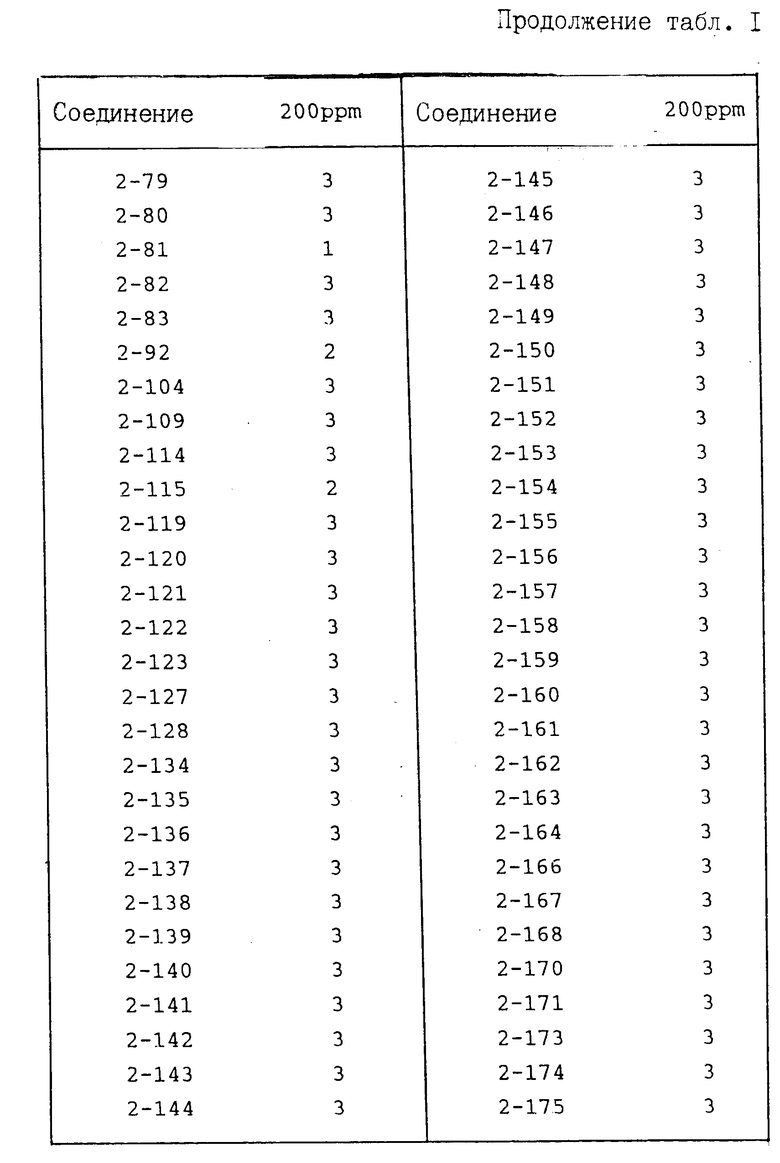
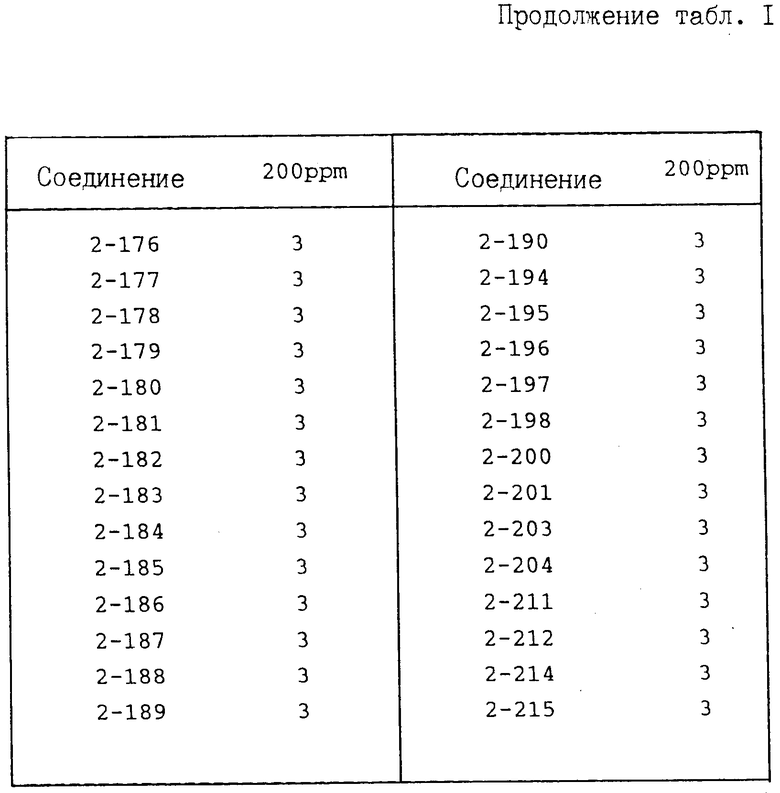
И с п ы т а н и е 1. Защита от болезни помидоров.
Соединение предлагаемого изобретения растворяют в диметилформамиде (концентрация 1 мас. ), затем к полученному раствору прибавляют ксилол (концентрация 0,2 мас.) и Твин 20 (концентрация 0,02 мас.). После этого полученную смесь разводят водой до заданной концентрации активного ингредиента. К указанному раствору прибавляют смачивающий агент, D yno
(концентрация 0,02 мас.). После этого полученную смесь разводят водой до заданной концентрации активного ингредиента. К указанному раствору прибавляют смачивающий агент, D yno производимый фирмой Takeda Chemical Industries, LTD, содержащий 20% (мас./мас) нонилфениловый эфир полиоксиэтилена и 12% лингинсульфоната кальция в количестве 0,05% (мас./мас), конечная концентрация с получением разбрызгивающего раствора. Этот раствор распыляют на рассаду помидоров (растения примерно четырехнедельного возраста) до стекания раствора каплями. После высыхания растений на воздухе осуществляют инокуляцию суспензией, содержащей зооспорангии возбудителя болезни томата (концентрация примерно 105/мд) путем ее разбрызгивания. После инокуляции растения выдерживают во влажном помещении при 17оС в течение 5 дн. После этого оценивают степень поражения заболеванием растения. Показатель защиты приведен в соответствии со следующими коэффициентами:
производимый фирмой Takeda Chemical Industries, LTD, содержащий 20% (мас./мас) нонилфениловый эфир полиоксиэтилена и 12% лингинсульфоната кальция в количестве 0,05% (мас./мас), конечная концентрация с получением разбрызгивающего раствора. Этот раствор распыляют на рассаду помидоров (растения примерно четырехнедельного возраста) до стекания раствора каплями. После высыхания растений на воздухе осуществляют инокуляцию суспензией, содержащей зооспорангии возбудителя болезни томата (концентрация примерно 105/мд) путем ее разбрызгивания. После инокуляции растения выдерживают во влажном помещении при 17оС в течение 5 дн. После этого оценивают степень поражения заболеванием растения. Показатель защиты приведен в соответствии со следующими коэффициентами:
Показатель защиты 3; площадь поражения 0-5%
Показатель защиты 2; площадь поражения 6-15%
Показатель защиты 1; площадь поражения 16-30%
Показатель защиты 0; площадь поражения 31% или более.
Полученные результаты представлены в табл. 1.
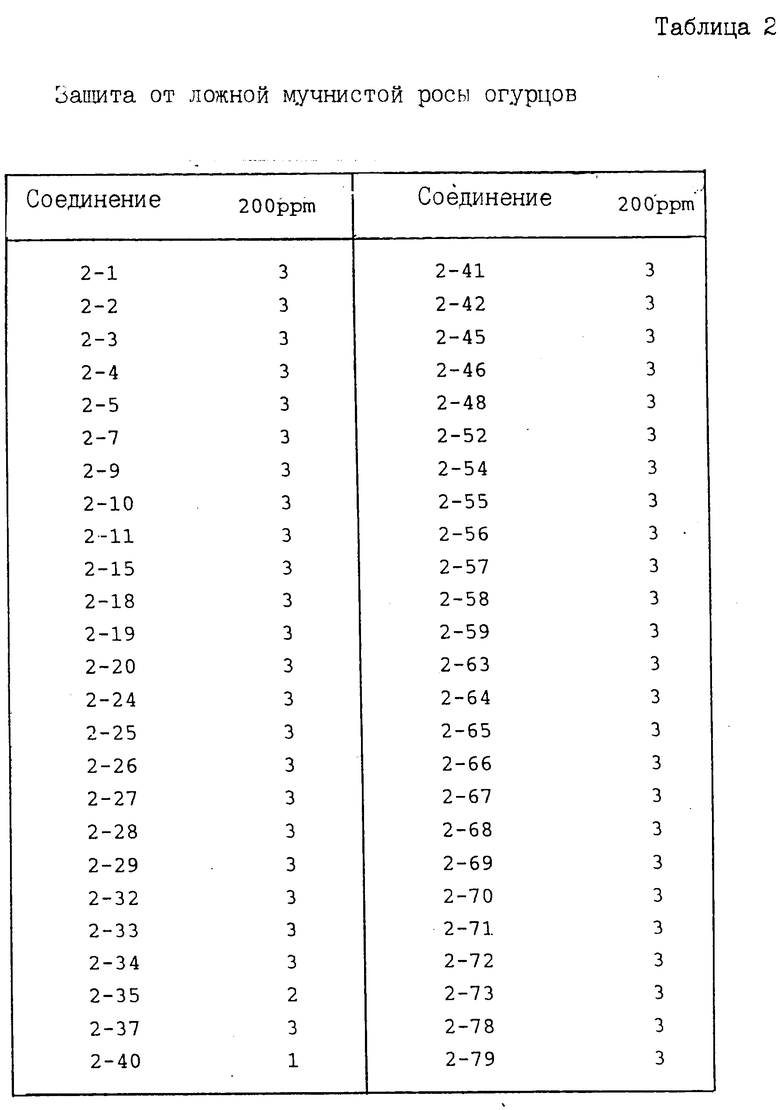
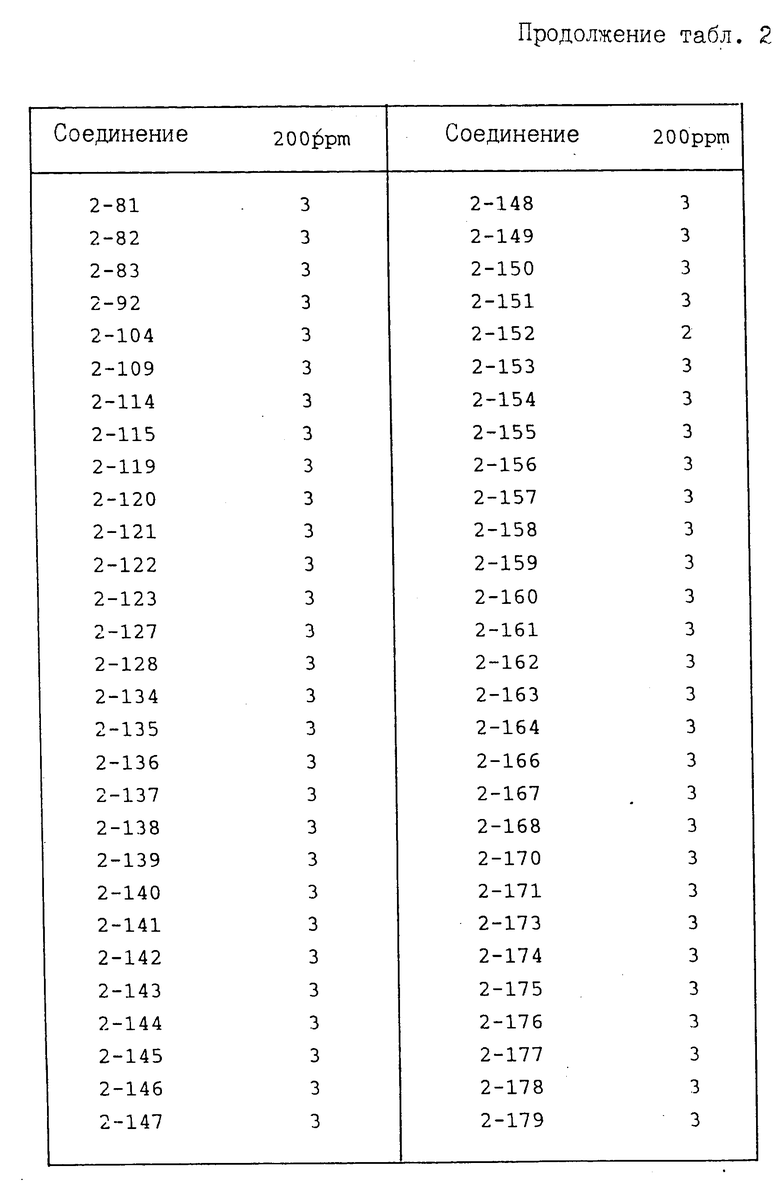
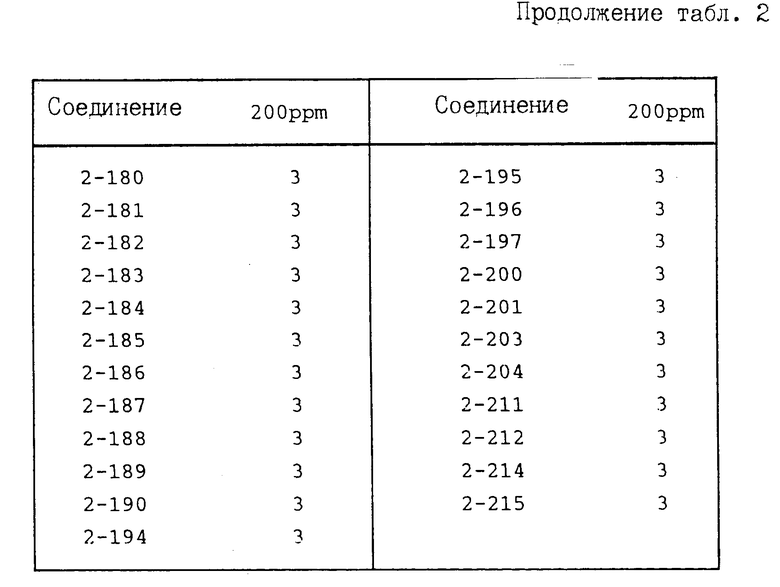
И с п ы т а н и е 2. Защита от ложной мучнистой росы огурцов.
По методике, описанной в испытании 1, получают раствор для разбрызгивания, содержащий соединение предлагаемого изобретения при заданной концентрации, который разбрызгивают на молодые проростки (примерно трехнедельного возраста) огурцов до стекания каплями указанного раствора. После высушивания растений на воздухе суспензию, содержащую зооспорангии возбудителя ложной мучнистой росы огурцов (концентрация примерно 105/мл) инокулируют путем разбрызгивания. После инокуляции растения выдерживают во влажном помещении в течение 6 дн. После этого оценивают площадь поражения растения болезнью, при этом показатель защиты представлен в соответствии со следующими коэффициентами:
Показатель защиты 3; площадь поражения 0-5%
Показатель защиты 2; площадь поражения 6-15%
Показатель защиты 1; площадь поражения 16-30%
Показатель защиты 0; площадь поражения 31% и более.
Полученные результаты приведены в табл. 2.
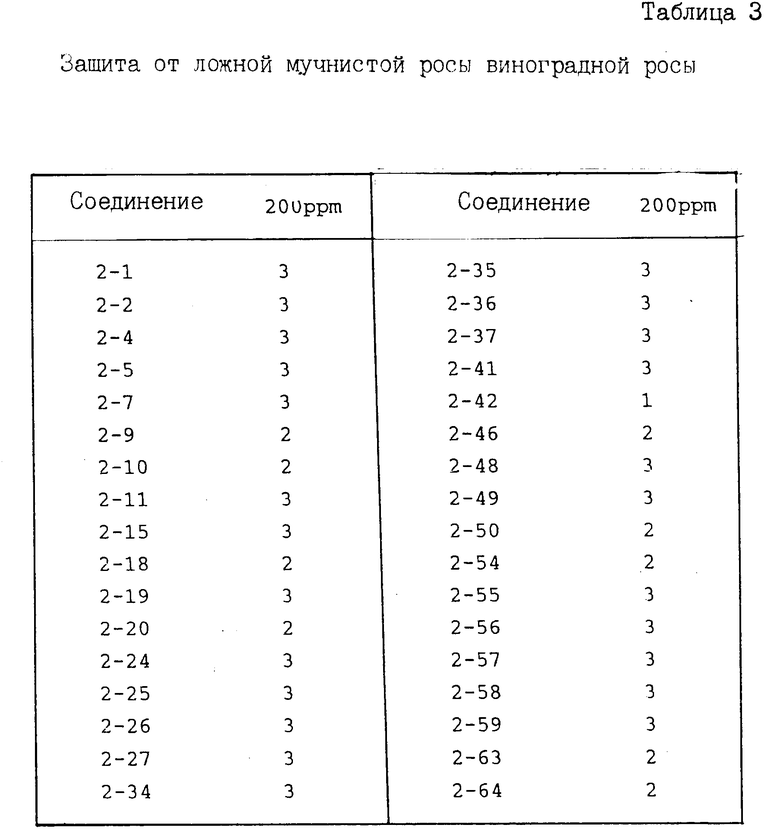
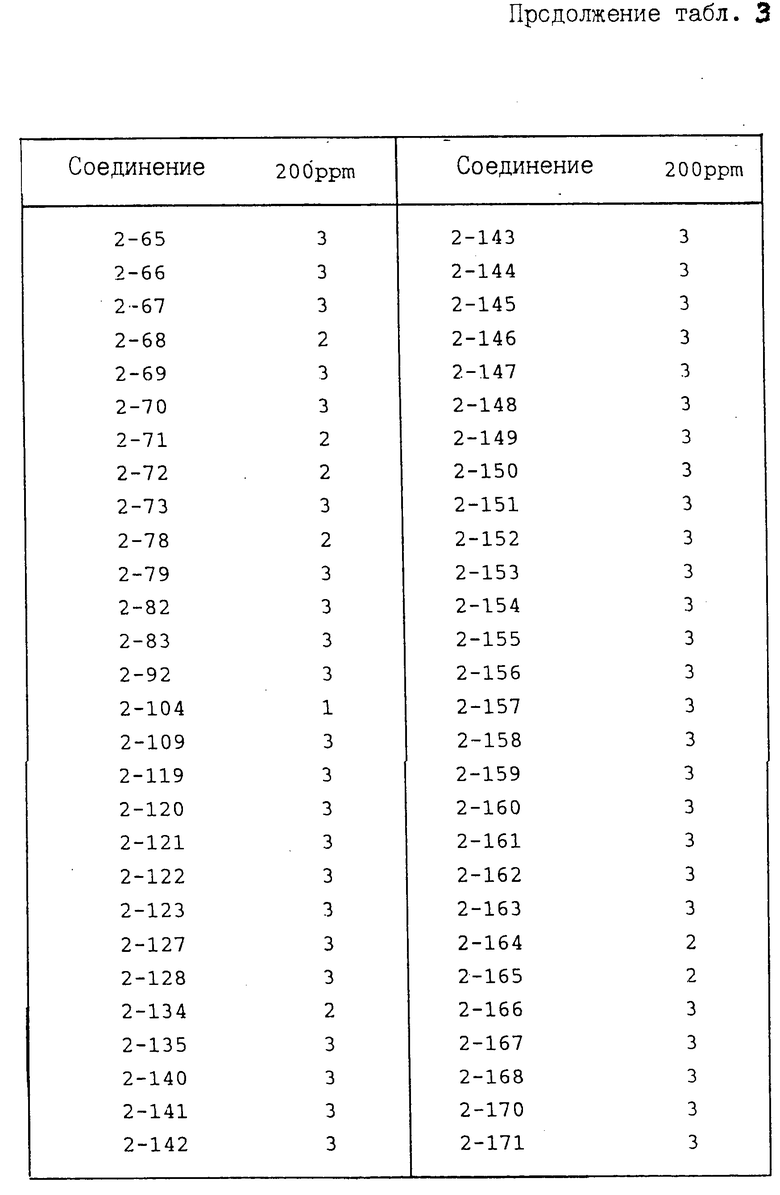
И с п ы т а н и е 3. Защита виноградной лозы от ложной мучнистой росы.
По методике, описанной в испытании 1, получают раствор для опрыскивания, содержащий соединение предлагаемого изобретения при заданной концентрации, который затем распыляют на молодые саженцы винограда (примерно шестинедельного возраста) до стекания указанного раствора каплями. После просушивания на воздухе суспензию, содержащую зоосспорангии возбудителя ложной мучнистой росы винограда (концентрация примерно 105/мл) инокулируют путем распыления. После инокуляции растения выдерживают во влажном помещении при 18оС в течение 10 дн. После этого оценивают степень поражения растения, при этом показатель защиты определяют исходя из следующих коэффициентов:
Показатель защиты 3; площадь поражения 0-5%
Показатель защиты 2; площадь поражения 6-15%
Показатель защиты 1; площадь поражения 16-30%
Показатель защиты 0; площадь поражения 31% и более.
Полученные результаты представлены в табл. 3.
В табл. 1-3 номера в колонке испытуемого соединения означают номер соединения, полученного в представленных далее в описании примерах.
Из приведенных выше результатов испытаний видно, что соединения I предлагаемого изобретения и их соли обладают превосходным эффектом для защиты от ложной мучнистой росы и предотвращения болезни овощных культур и фруктовых деревьев.
Изобретение более подробно объяснено в приведенных ниже примерах, однако оно не должно ограничиваться этими примерами. Элюирование в процессе колоночной хроматографии выполняли в условиях тонкослойной хроматографии (ТСХ). ТСХ проводили при использовании кезельгеля 60F 254 (Аrt. 5715), производимого фирмой Merck and Co. в качестве ТСХ пластины, аналогичного растворителя, используемого в качестве элюента колоночной хроматографии, который применяли как проявляющий растворитель и УФ-детектора в качестве средства для детектирования. В качестве силикагеля, заполняющего колонку использовали кезельгель 60 (70-230 меш. Art. 7734), производимый фирмой Merck and Со. Под спектром ЯМР имеется в виду ПЯМР (1Н ЯМР), а в качестве внутреннего и внешнего стандарта использовали тетраметилсилан. ЯМР-спектр измеряли спектрометром типа Varian bM 390 (90 Гц) в случае, если не оговорено особо. Каждое значение приведено в ч/млн. Численное значение в скобках означает скорость смешивания по объему каждого из растворителей, используемых в смеси растворителей в качестве элюента.
Каждое из сокращений, используемых в приводимых далее примерах и таблицах, имеет следующие значения:
S синглет, d дублет, m мультиплет, t триплет, br широкий, I константа связи, НZ ГЦ, CD Cl3 тяжелый хлороформ, DMSOd6 тяжелый диметилсульфоксид; (кроме выхода): мас./мас.
Под комнатной температурой имеется в виде температура в интервале от 15 до 25оС.
П р и м е р 1. Синтез метилового эфира имидазо[1,2-а]пиридин-8-карбоновой кислоты (соединение 1-1).
47% -ный бромводород (2,5 мл, 14,4 ммоль) прибавляют к диэтоксибромэтану (2,0 мл, 13,2 ммоль) и полученную смесь перемешивают при 50оС в течение 2 ч. Затем реакционную смесь охлаждают до комнатной температуры и добавляют в нее этанол (7,0 мл) и бикарбонат натрия (1,0 г, 11,9 ммоль). Смесь перемешивают и выпавший осадок отфильтровывают. К полученному фильтрату прибавляют метиловый эфир 2-аминоникотиновой кислоты (1,0 г, 6,6 ммоль), бикарбонат натрия (2,0 г, 13,8 ммоль) и этанол (7,0 мл), и полученную смесь нагревают с обратным холодильником в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры и прибавляют в нее насыщенный водный раствор бикарбоната натрия. Полученную смесь экстрагируют дихлорметаном (100 мл х 3), полученный экстракт промывают водой, сушат над безводным сульфатом магния MgSO4 и упаривают при пониженном давлении. Концентрат очищают методом колоночной хроматографии на силикагеле (элюент: хлороформ, а затем смесь хлороформа и метанола, 9:1), в результате получают целевое соединение (0,6 г, выход 55%) в виде желтых кристаллов, т.пл. 67-69оС.
П р и м е р 2. Синтез метилового эфира 2-метилимидазол[1,2-а]пиридин-8-карбоно- вой кислоты (соединение 1-3)
Бромацетон (6,5 г, 42,7 ммоль) и метиловый эфир 2-аминоникотиновой кислоты (4,8 г, 31,5 ммоль) прибавляют к этанолу (50 мл) и полученную смесь кипятят с обратным холодильником в течение 17 ч. Реакционную смесь охлаждают до комнатной температуры, растворитель отгоняют при пониженном давлении. К остатку прибавляют насыщенный водный раствор бикарбоната натрия (50 мл), и полученную смесь экстрагируют хлороформом (100 мл х 3). Экстракт промывают водой, сушат на MgSO4 и упаривают при пониженном давлении. Концентрат очищают колоночной хроматографией на силикагеле (элюент:хлороформ, а затем смесь хлороформа и метанола, 9:1). Получают целевое соединение (4,0 г, выход 85%) в виде маслянистого вещества.
П р и м е р 3. Синтез бромгидрата этилового эфира 2-фенил-имидазо[1,2-а] пиридин-8-карбоновой кислоты (соединение 1-25).
Бромистый фенацил (11,0 г, 55,3 ммоль) и этиловый эфир 2-аминоникотиновой кислоты (8,68 г, 52,2 ммоль) прибавляют к метилэтилкетону (100 мл) и полученную смесь кипятят с обратным холодильником в течение 5,5 ч. Реакционную смесь выдерживают при комнатной температуре в течение ночи и после сбора осажденных кристаллов фильтрованием получают целевое соединение (16,3 г, выход 89,96%) в виде кристаллов, т.пл. 174-176оС.
П р и м е р 4. Синтез метилового эфира 3-хлор-2-метилимидазо[1,2-а]пиридин- 8-карбоновой кислоты (соединение 1-15)
Метиловый эфир 2-метилимидазо[1,2-а]пиридин-8-карбоновой кислоты (5,3 г, 27,9 ммоль) растворяют в хлороформе (30 мл), и к полученному раствору прибавляют N-хлорсукцинимид (3,7 г, 27,9 ммоль), проводя взаимодействие при комнатной температуре в течение 40 мин. Затем к реакционной смеси прибавляют 10% -ный водный раствор бикарбоната натрия (80 мл), и полученную смесь перемешивают в течение 30 мин. Органический слой отделяют от реакционной смеси, а водный слой экстрагируют хлороформом (10мл х3). Экстракты объединяют, промывают водой, сушат над МgSO4 и концентрируют при пониженном давлении. Концентрат очищают колоночной хроматографией на силикагеле (элюент: хлороформ), в результате чего получают целевое соединение (3,6 г, выход 57%) в виде маслянистого вещества.
П р и м е р 5. Синтез метилового эфира 3-диметиламинометил-2-метилимидазо[1,2-а] пиридин-8-карбоновой кислоты (соединение 1-17).
К ацетонитрилу (10 мл) прибавляют 37%-ный формальдегид (0,3 мл) и уксусную кислоту, и 50%-ный водный раствор диметиламина (0,3 мл), медленно прибавляют к полученной смеси, перемешивая при 0оС. Затем к реакционной смеси прибавляют метиловый эфир 2-метилимидазо[1,2-а]пиридин-8-карбоновой кислоты и взаимодействие продолжают при температуре 50оС в течение 2 ч, а затем при комнатной температуре в течение 2,5 ч. Реакционную смесь упаривают при пониженном давлении, а затем нейтрализуют насыщенным водным раствором NaHСО3. Полученный раствор экстрагируют дихлорметаном, экстракт промывают водой, сушат над безводным сульфатом натрия, и после упаривания при пониженном давлении получают целевое соединение (0,48 г, выход 52%), т.пл. 123-124оС.
П р и м е р 6. Синтез 2-метилимидазо[1,2-а]пиридин-8-карбоновой кислоты (соединение 1-4).
Метиловый эфир 2-метилимидазо[1,2-а]пиридин-8-карбоновой кислоты (4,0 г, 21 ммоль) растворяют в смеси, состоящей из этанола (45 мл) и воды (20 мл), а затем прибавляют гидроксид натрия (2,5 г, 63 ммоль). Полученную смесь кипятят с обратным холодильником в течение 30 мин. Реакционную смесь охлаждают до комнатной температуры, а затем упаривают при пониженном давлении. К концентрату прибавляют воду, затем смесь доводят до рН 4 путем введения концентрированной соляной кислоты. Осажденные кристаллы собирают фильтрованием, в результате чего получают целевое соединение (2,3 г, выход 64%).
П р и м е р 7. Синтез 2-фенилимидазо[1,2-а]-пиридин-8-карбоновой кислоты (соединение 1-26).
Бромгидрат этилового эфира 2-фенилимидазо[1,2-а] пиридин-8-карбоновой кислоты (8,4 г, 24,2 ммоль) прибавляют к 20%-ному водному раствору NaOH (200 мл) и этанолу (100 мл), после чего полученную смесь кипятят с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, а спирт отгоняют при пониженном давлении. Остаток доводят до рН 4 введением концентрированной соляной кислоты. Осажденные кристаллы собирают фильтрованием, в результате чего получают целевое соединение (56,7 г, выход 98,4%) в виде кристаллов, т.пл. 226оС
П р и м е р 8. Синтез 2-хлорметилимидазо[1,2-а]пиридин-8-карбоновой кислоты (соединение 1-90).
Этиловый эфир 2-хлорметилимидазо[1,2-а]пиридин-8-карбоновой кислоты (8,4 г, 24,2 ммоль) прибавляют к концентрированной соляной кислоте (100 мл), и полученную смесь кипятят с обратным холодильником в течение 5 ч. Реакционную смесь охлаждают до комнатной температуры и устанавливают рН до 4 при введении насыщенного водного раствора бикарбоната натрия. Осаждающиеся кристаллы собирают фильтрованием с выходом целевого соединения (56,7 г, выход 98,4%) в виде кристаллов, т.пл. 250оС (разлож.).
П р и м е р 9. Синтез 3-нитро-2-(4-нитрофенил)-имидазо[1,2-а]пиридин-3-карбоновой кислоты (соединение 1-96).
Этиловый эфир 2-фенилимидазо[1,2-а]пиридин-8-карбоновой кислоты (2,9 г, 10 ммоль) растворяют в концентрированном растворе серной кислоты (5 мл), после чего к полученному раствору медленно прибавляют 70%-ную азотную кислоту (1,3 мл) при 10оС. После завершения введения полученную смесь перемешивают при комнатной температуре в течение 30 мин, затем выливают в воду со льдом и рН устанавливают до 7 путем прибавления 20% NaOH. Осажденные кристаллы собирают фильтрованием, представляющие собой сложный этиловый эфир названного соединения (3,6 г, выход 99,2%). Раствор указанных кристаллов в концентрированной соляной кислоте (35 мл) кипятят с обратным холодильником в течение 1,5 ч, после чего его охлаждают до комнатной температуры. После фильтрования осажденных кристаллов и высушивания получают целевое соединение (2,9 г, выход 87,3%), т.пл.>300оС.
П р и м е р 10. Синтез 3-нитроимидазо[1,2-а]пиридин-8-карбоновой кислоты (соединение N 1-125).
Этиловый эфир 2-этоксикарбонилимидазо[1,2-а]пиридин-8-карбоновой кислоты (3,8 г, 14,5 ммоль) растворяют в концентрированной серной кислоте (10 мл), и к полученному раствору постепенно прибавляют 70%-ную азотную кислоту (1,5 мл) при 10оС. Полученную смесь перемешивают при комнатной температуре в течение 30 мин, затем выливают в воду со льдом и устанавливают до рН 7 введением 20% гидроксида натрия. После фильтрования осажденных кристаллов получают этиловый эфир 2-этоксикарбонил-3-нитроимидазо[1,2-а]пиридин-8-карбо- новой кислоты (2,4 г, выход 53,8%) в виде кристаллов, т.пл. 139-140оС. Раствор указанных кристаллов в концентрированной соляной кислоте (35 мл) кипятят с обратным холодильником в течение 1,5 ч и охлаждают затем до комнатной температуры. Осажденные кристаллы собирают фильтрованием и после высушивания получают целевое соединение (1,2 г, выход 74,3%), с т.пл. 300о.
П р и м е р 11. Синтез этилового эфира 3-формил-2-фенилимидазо[1,2-а] пиридин-8-карбоновой кислоты (соединение 1-119).
К раствору, содержащему бромгидрат этилового эфира 2-фенилимидазо[1,2-а] пиридин-8-карбоновой кислоты (14,7 г, 4 ммоль) в диметилформамиде (8 мл) по каплям прибавляют хлорангидрид фосфорной кислоты (2 мл), удерживая температуру реакции ниже 15оС. Затем реакцию проводят при комнатной температуре в течение 30 мин и еще 2 часа при 70оС. После завершения реакции реакционную смесь охлаждают, выливают в воду со льдом, и доводят рН до 7 при введении 20% -ного едкого натра. Осажденные кристаллы собирают фильтрованием и после перекристаллизации из этанола получают целевое соединение (1,0 г, 85,5% выход) в виде бесцветных кристаллов, т.пл. 139оС.
П р и м е р 12. Синтез этилового эфира 3-циано-2-фенилимидазо[1,2-а]пиридин-8-карбоновой кислоты (соединение 1-121).
Бромгидрат этилового эфира 2-фенилимидазо[1,2-а] пиридин-8-карбоновой кислоты (1,96 г, 5,35 ммоль) и триэтиламин (0,55 г, 5,44 ммоль) прибавляют к ацетонитрилу (20 мл). Затем к полученному раствору по каплям прибавляют раствор, содержащий хлорсульфонилизоцианат (СlSO2NCO) (0,8 мл, 9,19 ммоль) в ацетонитриле (5 мл) при внутренней температуре реакции от 0 до 20оС. Затем смесь выдерживают при комнатной температуре в течение 1 ч. По окончании реакции смесь концентрируют при пониженном давлении. Полученный концентрат, в который прибавляют воду, затем экстрагируют дихлорметаном, экстракт промывают водой, сушат над безводным сульфатом натрия и упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: хлороформ) с получением целевого соединения (1,06 г, выход 67,9%) в виде кристаллов, т.пл. 87-89оС.
П р и м е р 13. Синтез этилового эфира 2-этоксикарбонилимидазо[1,2-а] пиридин-8-карбоновой кислоты (соединение 1-123).
Смесь, состоящую из этилового эфира бромпировиноградной кислоты (2,3 г, 10,2 ммоль) и этилового эфира 2-аминоникотиновой кислоты (1,7 г, 10 ммоль) в метилэтилкетоне (17 мл) кипятят в течение 5 ч. После завершения реакции смесь охлаждают до комнатной температуры и для удаления растворителя отгоняют при пониженном давлении. Остаток, к которому прибавляют насыщенный водный раствор бикарбоната натрия (50 мл, экстрагируют хлороформом. Экстракт промывают водой, сушат над MgSO4 и упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент:этилацетат) с получением целевого соединения (0,7 г, выход 26,7%) в виде кристаллов, т.пл. 97оС.
П р и м е р 14. Синтез этилового эфира 2-метил-3-сульфоимидазо[1,2-а] имидазо[1,2-а]пиридин-8-карбоновой кислоты (соединение 1-127).
К раствору, содержащему этиловый эфир 2-метилимидазо[1,2-а]пиридин-8-карбоновой кислоты (1,2 г, 5,9 ммоль) в хлороформе (15 мл) прибавляют хлорсульфокислоту (0,6 мл). Смесь кипятят с обратным холодильником в течение 3 ч, а затем упаривают при пониженном давлении. Осаждение кристаллы собирают фильтрованием, промывают достаточным количеством воды и после высушивания получают целевое соединение (1,2 г, выход 71,4%) в виде кристаллов, т.пл. 247-250оС (разлож.).
П р и м е р 15. Синтез этилового эфира 2-метил-3-N-метилсульфамоилимидазо[1,2-а]-пи- ридин-8-карбоновой кислоты (соединение 1-129).
Этиловый эфир 2-метил-3-сульфоимидазо[1,2-а]пиридин-8-карбоновой кислоты (1,7 г) и три-н-пропиламин (2,6 г) прибавляют к ацетонитрилу (17 мл). Затем к полученной смеси прибавляют хлорангидрид фосфорной кислоты (1,1 мл), поддерживая внутреннюю температуру реакции в интервале 50-60оС. После этого смесь выдерживают при этой же температуре еще в течение 1 ч. После завершения реакции, смесь упаривают при пониженном давлении, и к остатку прибавляют воду. Осажденные кристаллы собирают фильтрованием, промывают водой и после высушивания получают этиловый эфир 2-метил-3-хлорсульфонилимидазо[1,2-а] пиридин-8-карбоновой кислоты (1,2 г, 66,3%) в виде кристаллов, т. пл. 182-183оС.
Полученные кристаллы (1,2 г) растворяют в ацетонитриле (12 мл), и к полученному раствору по каплям прибавляют 40% водный раствор метиламина (0,75 г) в ацетонитриле (3 мл) при внутренней температуре реакции от 0 до 10оС. Затем полученную смесь выдерживают при комнатной температуре в течение 1 ч. После завершения реакции, смесь упаривают при пониженном давлении. Концентрат, к которому прибавлена вода, доводят до рН 7 путем введения разбавленной соляной кислоты. Осажденные кристаллы собирают фильтрованием, промывают водой и после высушивания получают целевое соединение (1,1 г, выход 93,2%) в виде кристаллов, т.пл. 184-185оС.
П р и м е р 16. Синтез 2-хлоримидазо[1,2-а]пиридин-8-карбоновой кислоты (соединение 1-135).
Смесь, состоящую из диэтилового эфира бромзамещенной малоновой кислоты (26 мл) и этилового эфира 2-аминоникотиновой кислоты (13,3 г) подвергают взаимодействию при 80-90оС в течение 6 ч в атмосфере азота. После завершения реакции смесь охлаждают до комнатной температуры и добавляют к ней ацетон (100 мл). Осажденные кристаллы собирают фильтрованием с выходом бромгидрата 3,8-диэтоксикарбонил-2-гидроксиимидазо[1,2-а]пиридина (9,98 г, выход 34,8%).
Смесь кристаллов (6,6 г) в хлорангидриде фосфорной кислоты (30 мл) подвергают взаимодействию при 160оС в течение 2 ч в автоклаве. После окончания реакции избыток хлорангидрида фосфорной кислоты отгоняют при пониженном давлении. К остатку прибавляют этанол и полученную смесь упаривают при пониженном давлении. Концентрат очищают колоночной хроматографией на силикагеле (элюент: хлороформ) с получением 2-хлор-3,8-диэтоксикарбонилимидазо[1,2-а] пиридина (соединение 1-133) (2,2 г, выход 40,3%) в виде кристаллов, т.пл. 105-106оС.
Полученные кристаллы (0,9 г) растворяют в этаноле (10 мл), и к полученному раствору прибавляют 10% гидроокись натрия (5 мл). Смесь выдерживают при комнатной температуре в течение 1 ч, а затем доводят ее до рН 4 прибавлением концентрированной соляной кислоты. Кристаллы, выпавшие в осадок, собирают фильтрованием, промывают водой и после высушивания получают 2-хлоримидазо[1,2-а] пиридин-3,8-дикарбо- новой кислоты (0,73 г, выход 100%) в виде кристаллов, т. пл. 210-212оС (разлож.). Затем смесь полученных кристаллов (0,73 г) в концентрированной соляной кислоте (5 мл) кипятят с обратным холодильником в течение 2 ч. Реакционный раствор доводят до рН 4 добавлением насыщенного водного раствора бикарбоната натрия с образованием кристаллов целевого соединения (0,5 г, выход 83,9%), т.пл. 237оС.
П р и м е р 17. Синтез α-(имидазо[1,2-а] пиридин-8-илкарбониламино)-(2-фурил)аце- тонитрил (соединение 2-1).
α-(2-Фурил)-α-аминоацетонитрил (0,7 г, 5,5 ммоль) растворяют в ацетонитриле (20 мл) и к полученному раствору при перемешивании прибавляют хлорангидрид имидазо[1,2-а] пиридин-8-карбоновой кислоты (1,0 г, 5,5 ммоль). Полученную смесь подвергают взаимодействию при комнатной температуре в течение 2 ч. После завершения реакции растворитель отгоняют из реакционной смеси при пониженном давлении. К остатку прибавляют воду (20 мл), насыщенный водный раствор бикарбоната натрия (50 мл) и хлороформ (50 мл) и полученную смесь перемешивают. Органический слой отделяют, сушат над безводным сульфатом магния и концентрируют. Концентрат очищают колоночной хроматографией на силикагеле (элюент: этилацетат/н-гексан, 2:1). Получают целевое соединение (0,16 г, выход 11%) в виде кристаллов, т.пл. 149-151оС.
П р и м е р 18. Синтез α-(имидазо[1,2-а]пиридин-5-илкарбониламино-(2-фурил) ацетонитрил (соединение 2-134).
α-(2-Фурил)-α-аминоацетонитрил (0,7 г, 5,5 ммоль) растворяют в ацетонитриле (20 мл) и к полученному раствору прибавляют хлорангидрид имидазо[1,2-а] пиридин-5-карбоновой кислоты (1,0 г, 5,5 ммоль). Полученную смесь подвергают взаимодействию при комнатной температуре в течение 2 ч. После завершения реакции растворитель удаляют из реакционной смеси. К остатку прибавляют воду (20 мл), насыщенный водный раствор бикарбоната натрия (50 мл) и хлороформ (50 мл) и полученную смесь перемешивают. Органический слой отделяют, сушат над безводным сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент:метанол/хлороформ, 1:9) с получением целевого соединения (0,9 г, выход 64%) в виде аморфного твердого вещества.
П р и м е р 19. Синтез α-(2-фенилимидазо[1,2-a]пиридин-8-илкарбониламино)-(2- фурил)ацетонитрил (соединение 2-24).
2-Фенил-имидазо[1,2-а] пиридин-8-кар- боновую кислоту (1,5 г, 5,5 ммоль) прибавляют к сухому тетрагидрофурану (100 мл), а затем к полученной смеси медленно прибавляют карбонилдиимидазол (1,5 г, 5,5 ммоль) при перемешивании при комнатной температуре в атмосфере азота. Смесь перемешивают при комнатной температуре в течение 8 ч, и затем прибавляют α-(2-фурил)- α-аминоацетонитрил (0,7 г, 5,5 ммоль) и реакцию проводят при комнатной температуре в течение 5 ч. Растворитель отгоняют из реакционной смеси при пониженном давлении, к полученному остатку прибавляют воду (20 мл) и этилацетат (50 мл), после чего перемешивают. Органический слой отделяют, сушат над безводным сульфатом магния, а затем упаривают. Концентрат очищают колоночной хроматографией на силикагеле (элюент: этилацетат/н-гексан, 1:1), получают целевое соединение (0,9 г, выход 64%) в виде кристаллов, т.пл. 197-199оС.
П р и м е р 20. Синтез α-(3-хлор-имидазо[1,2-а]пиридин-8-илкарбониламино)-(2- фурил)ацетонитрил (соединение 2-10).
3-Хлоримидазо[1,2-а] пиридин-3-карбо- новую кислоту (1,8 г, 9,2 ммоль) прибавляют к тионилхлориду (20 мл) и полученную смесь кипятят с обратным холодильником в течение 30 мин при перемешивании, после чего упаривают при пониженном давлении. Полученный неочищенный хлорангидрид и α-(2-фурил)- α-аминоацетонитрил (1,1 г, 8,5 ммоль) прибавляют к ацетонитрилу (50 мл) и взаимодействие осуществляют при комнатной температуре в течение 1 ч при перемешивании. Растворитель удаляют из реакционной смеси при пониженном давлении. После этого к остатку прибавляют воду (20 мл), насыщенный водный раствор бикарбоната натрия (50 мл) и хлороформ и затем перемешивают. Органический слой отделяют, сушат над безводным сульфатом магния, а затем упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент:этилацетат/н-гексан, 1: 2), в результате получают целевое соединение (0,6 г, выход 22%) в виде кристаллов, т.пл. 142-143оС.
П р и м е р 21. Синтез α-(2-фенилимидазо[1,2-а]пиридин-8-илкарбониламино)-(3-хлорфенил)ацетонитрил (соединение 2-35).
2-Фенилимидазо[1,2-а] пиридин-8-кар- боновую кислоту (1,0 г, 4,2 ммоль), α-(3-хлорфенил)аминоацетонитрил (0,77 г, 4,5 ммоль) и NaHCO3(1,1 г, 13,1 ммоль) прибавляют к ацетонитриду (10 мл). Хлорангидрид фосфорной кислоты (0,7 мл, 7,51 ммоль, растворенный в 5 мл ацетонитрила) медленно прибавляют к полученной смеси при перемешивании, охлаждая льдом. Полученную смесь выдерживают прои комнатной температуре в течение 10 ч, растворитель удаляют из реакционной смеси при пониженном давлении, после чего к остатку прибавляют воду (50 мл) и доводят смесь до рН 7 насыщенным водным раствором бикарбоната натрия. Затем смесь экстрагируют смесью растворителей дихлорметан/этилацетат (10:1), (100 млх2). Полученный экстракт сушат над безводным сульфатом магния и упаривают. К остатку прибавляют ацетонитрил (5 мл) и осаждающиеся кристаллы собирают фильтрованием. В результате получают целевое соединение (0,44 г, выход 27,2%) в виде кристаллов, т.пл. 210-211оС.
П р и м е р 22. Синтез α-(3-диметиламиноэтил-2-фенилимидазо[1,2-а]пиридин-8- инкарбониламино-(3-фторфенил) ацетонитрил (соединение 2-79).
К ацетонитрилу (10 мл) прибавляют 37%-ный формальдегид (0,3 мл) и уксусную кислоту (0,4 мл), после чего к полученной смеси медленно прибавляют 50% -ный водный раствор диметиламина (0,3 мл) при 0оС с перемешиванием. К полученной смеси прибавляют α-(2-фенилимидазо[1,2-а]пиридин-8-илкарбониламино)-(3-фторфенил)ацетонитрил (1,0 г, 2,7 ммоль) и перемешивают смесь при 50оС в течение 2 ч, а затем еще в течение 2,5 ч при комнатной температуре. После этого реакционную смесь упаривают при пониженном давлении, остаток нейтрализуют насыщенным водным раствором NaHCO3. Раствор экстрагируют дихлорметаном, и экстракт промывают водой, сушат над безводным сульфатом натрия с последующим упариванием при пониженном давлении. Полученный концентрат очищают колоночной хроматографией на силикагеле (элюент:хлороформ с получением целевого соединения (0,47 г, выход 40,8%) в виде кристаллов, т.пл. 123-124оС.
П р и м е р 23. Синтез α-(3-метилсульфинилметилимидазо[1,2-а]пиридин-8-илкар-бониламино)-(2-фурил) ацетонитрил (соединение 2-122).
α-(2-Метилтиометилмидазо[1,2-а] пи- ридин-8-илкарбониламино)-(2-фурил)ацето- нитрил (0,33 г, 1 ммоль) прибавляют к хлороформу (10 мл), после чего к указанной смеси прибавляют м-хлорнадбензойной кислоты (0,25 г, 1,1 ммоль) при температуре 5оС. Затем смесь перемешивают при комнатной температуре в течение 2,5 часов, а затем обрабатывают реакционную смесь насыщенным водным раствором бикарбоната натрия. Хлороформный слой отделяют, промывают водой, сушат над безводным сульфатом натрия, а затем концентрируют при пониженном давлении. Концентрат очищают колоночной хроматографией, или на силикагеле (элюент:этилацетат) с получением целевого соединения (0,1 г, выход 30,3%) в виде кристаллов, т.пл. 214-216оС.
П р и м е р 24. Синтез α-(2-трифторметилимидазо[1,2-а]пиридин-8-илкарбонила- мино)-(3-фторфенил) ацетамид (соединение 2-169).
Смесь, состоящую из α-(2-трифторметилимидазо[1,2-а]пиридин-8-илкарбонилами- но)- (3-фторфенил)ацетонитрила (1,26 г) и хлорсульфокислоты (0,5 мл) в хлороформе (13 мл) кипятят с обратным холодильником в течение 1,5 ч. Реакционный раствор сгущают при пониженном давлении и к остатку прибавляют воду. Осажденные кристаллы собирают фильтрованием и после перекристаллизации из этанола получают целевое соединение (0,45 г, выход 34,1%) в виде кристаллов, т.пл. 118-120оС.
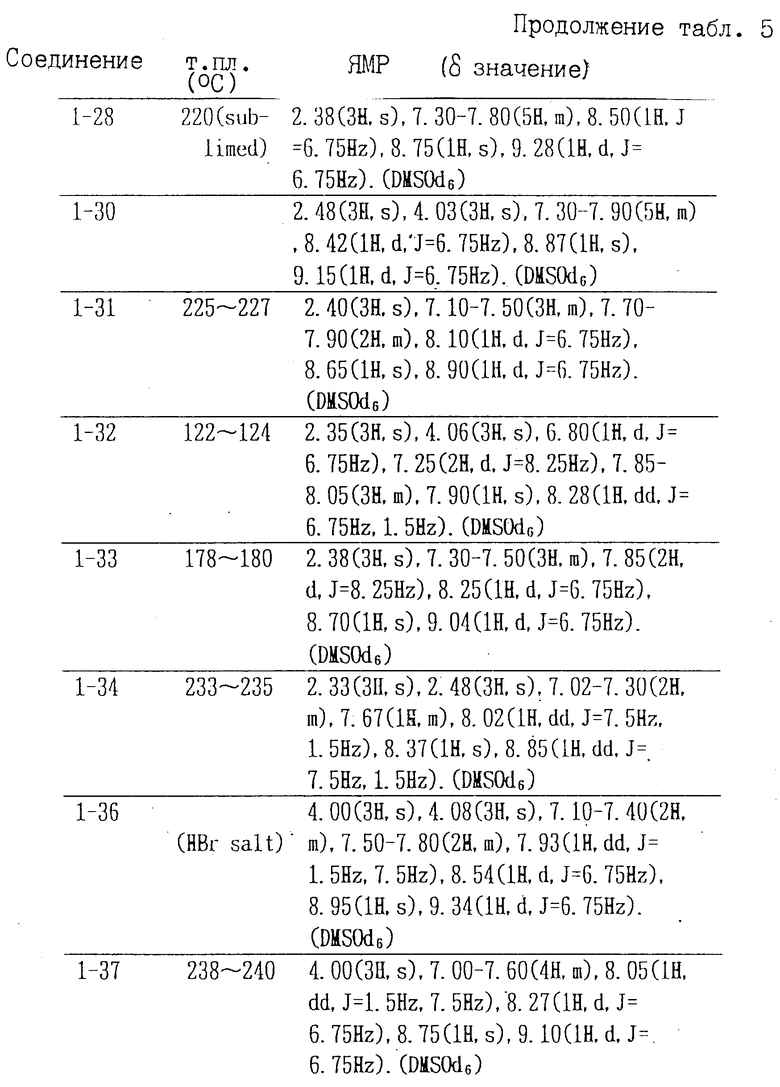
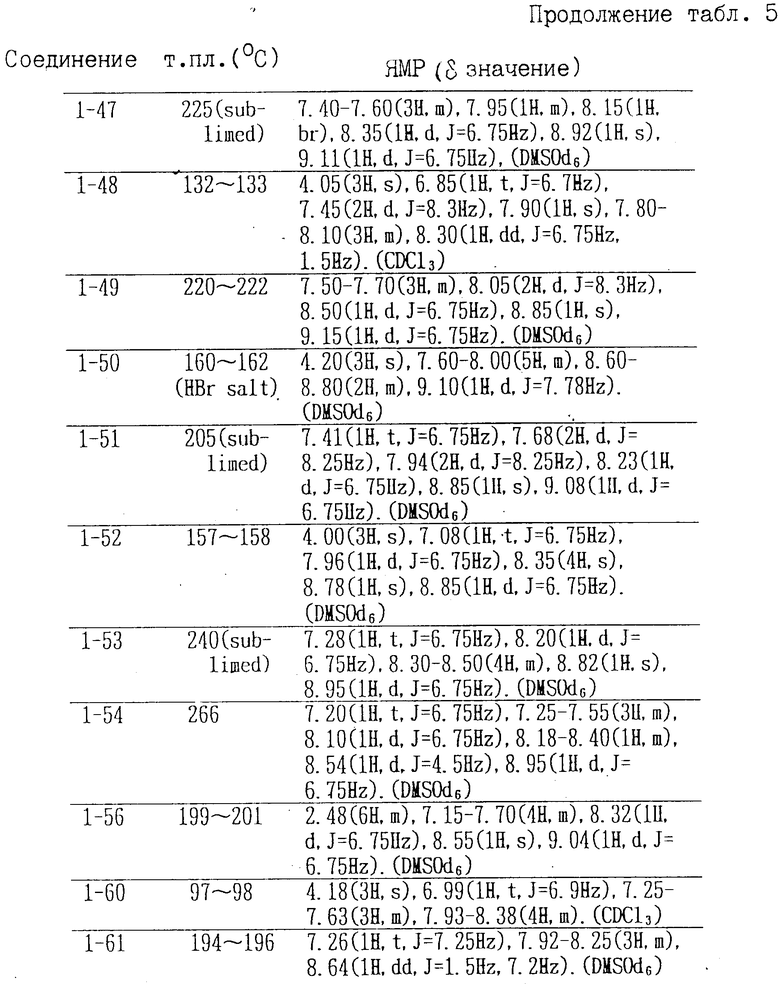
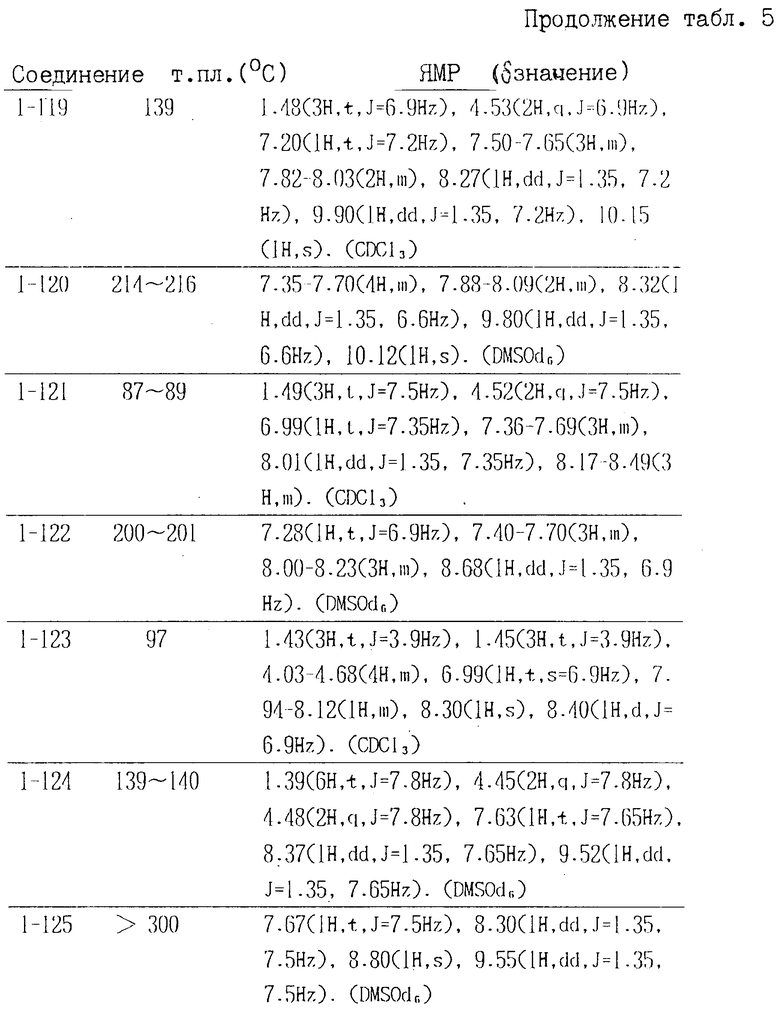
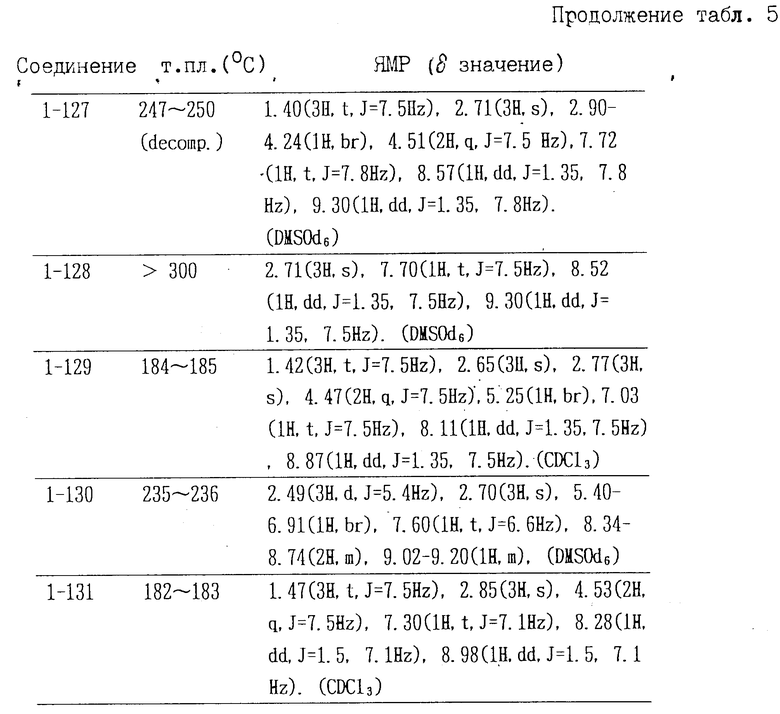
Соединения формулы II, полученные аналогичными способами, описанными в примерах 1-16, приведены в табл. 4, их точки плавления и данные анализа ЯМР в табл. 5.
Соединения формулы I, полученные аналогичными методами, описанными в примерах 17-24 приведены в табл. 6, их точки плавления и данные анализа ЯМР в табл. 7.
Состав 1. Эмульгируемые концентраты, приготовленные смешиванием следующих компонентов, мас. Соединение 2-2 20 Ксилол 75 Полиоксиэтиленалкил- ариловый эфир (Нонипол 85 ) 5
) 5
Состав 2
Смачиваемые порошки, приготовленные смешиванием и измельчением следующих компонентов, мас. Соединение 2-24 50 Диатомовая земля 44 Полиоксиэтиленалкил- ариловый эфир 6 Нонипол 85 )
)
Состав 3.
Порошки, приготовленные смешиванием следующей смеси, мас. Соединение 2-27 3 Глина 40 Тальк 57











































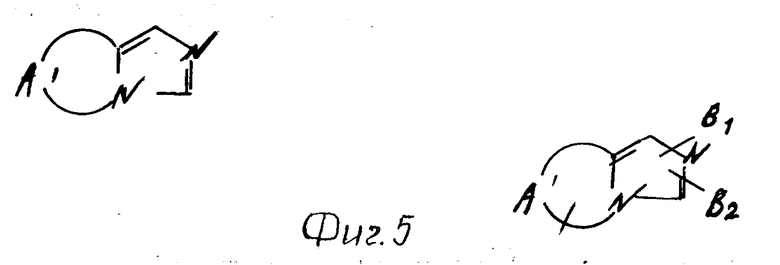
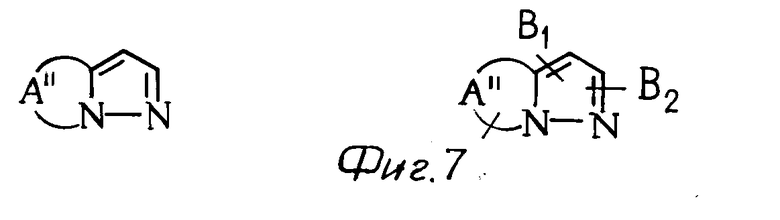
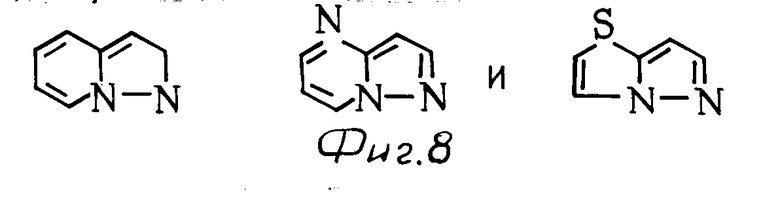
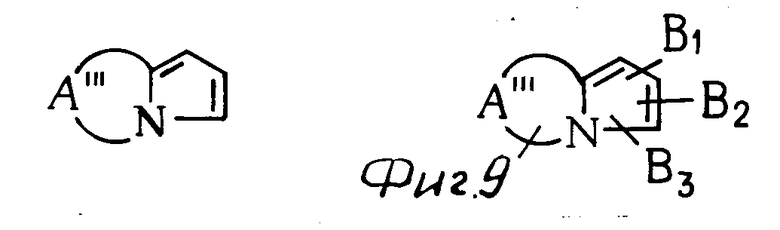
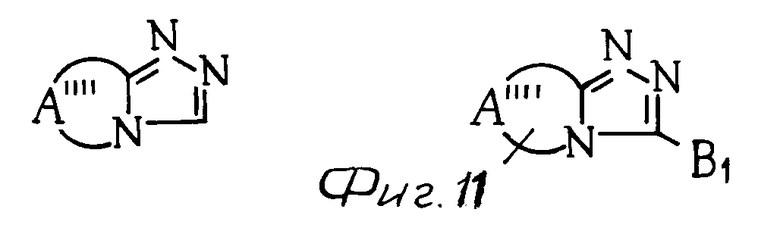
Использование: в сельском хозяйстве. Сущность изобретения: амидное производное ф-лы I, где X1, R1, R2, R3 соответствующие значения, и фунгицидный состав на его основе. Структура соединения ф-лы I 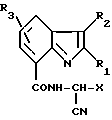 . 1 з.п. ф-лы, 7 табл. 13 ил.
. 1 з.п. ф-лы, 7 табл. 13 ил.
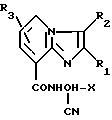
где Х фурил, метилфурил, тиенил, фенил, который может быть замещен однократно галогеном, метилом, метокси, трифторметилом, двукратно-галогеном, метилтиенил, метилпирролил, пиридил, бензил, метил;
R1 водород, тиенил, фенокси, нафтил, C1 C6-алкил, трифторметил, метил, замещенный хлором, метокси, метилтио, метилсульфонилом, фенокси, фенилтио; фенил, возможно однократно замещенный C1 C3-алкилом, C1 - C3-алкокси, галогеном, нитро, диметиламино, фенилом, сульфо, гидрокси, фенил, двукратнозамещенный одинаковыми или разными группами, выбранными из C1 C4-алкила, метокси, галогена, нитро, метилтио, метилсульфенил, метилсульфонил, тетраметилфенил, фенилтио, циклогексил; тиазолил;
R2 водород, галоген, амино, фенил, формил, нитро, циано, сульфо, метил, который может быть замещен диметиламино, морфолино, сульфо, SO2NHCH3, N= CHC6H5;
R3 водород, метил,
или его соли, такие, как гидрохлорид или оксалат, при следующем содержании ингредиентов, мас.
Активный ингредиент 3-50
Целевые добавки Остальное
2. Амидное производное общей формулы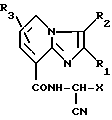
где Х фурил, тиенил, метилфурил, фенил, который может быть замещен однократно галогеном, метилтиенил и метилпирролил, пиридил, бензил, метил;
R1 водород, тиенил фенокси, нафтил C1 C4-алкил, трифторметил, замещенный хлором, метокси, метилтио, метилсульфенилом, фенокси, фенилтио, фенил, возможно однократно замещенный C1 C3-алкилом, C1 - C3-алкокси, галогеном, нитро, диметиламино, фенилом, сульфогидрокси, фенил, двукратно замещенный одинаковыми или разными группами, выбранными из C1 - C4-алкила, метокси, галогена, нитро, метилтио, метилсульфенил, метилсульфонил, тетраметилфенил, фенилтио, циклогексил, тиазолил;
R2 водород, галоген, амино, фенил, формил, нитро, циано, сульфо, метил, который может быть замещен диметиламино, морфолино, сульфо, SO2NHCH, N CHC6H5;
R3 водород, метил,
или его соли, такие, как гидрохлорид или оксалат.
| КЕРАМИЧЕСКИЙ ЭНДОПРОТЕЗ СУСТАВА ПАЛЬЦА | 2001 |
|
RU2190375C1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-09-20—Публикация
1990-06-22—Подача