Изобретение относится к медицине, в частности к препаратам, обладающим противоотечным действием, и может быть использовано для лечения отека-набухания головного мозга.
Известно, что "нет нейрохирургического заболевания головного мозга, при котором на определенной фазе его развития, или послеоперационного течения не развивалась бы та или иная степень и форма этой реакции мозга". Согласно современным представлениям выделяют 4 патогенетических формы отека-набухания головного мозга: вазогенный, цитотоксический, осмотический, гидростатический.
Основными по своим драматическим последствиям при тяжелой черепно-мозговой травме (ЧМТ) являются первые две формы. Сущность морфологических изменений при них связана с накоплением межклеточной жидкости (свободной воды) при вазогенном отеке и с накоплением внутриклеточной жидкости и связанной межклеточной при цитотоксическом отеке. Наиболее неблагоприятным, трудно поддающимся современным методам интенсивной терапии, является цитотоксический отек, сопровождающийся набуханием клеток головного мозга. Отмечена четкая корреляция между тяжестью клинического течения травмы головного мозга и выраженностью набухания мозга, преобладающего в первые 2 суток после травмы.
В основе развития отека-набухания головного мозга при тяжелой ЧМТ лежит нарушение нейрогуморальных, метаболичес- ких физико-химических процессов в клетке головного мозга в совокупности с изменением тонуса церебральных сосудов и нарушением транспорта кислорода в клетку.
Известны способы лечения отека-набухания головного мозга улучшением реологических свойств крови (применение низкомолекулярных декстранов), увеличением доставки кислорода в клетку (ингаляции кислорода, гипеpбарическая оксигенация). Недостатками их является низкая противоотечная активность, выражающаяся в медленном восстановлении основной функции мозга сознания, высокой летальности.
Из известных противоотечных препаратов наиболее близким к предлагаемому является маннит (базовый объект). Однако недостатками известного противоотечного средства являются неравномерная дегидратация различных участков мозга. Причем нормальная ткань дегидратируется в большей степени, чем отечная, что способствует дислокации и вклиниванию мозга.
Ухудшается микроциркуляция в головном мозге, связанная с нарушением реологических свойств крови (повышением вязкости, ускорением агрегатообразования форменных элементов), которая происходит в связи с уменьшением объема внутрисосудистой жидкости. Это может приводит к дополнительной ишемизации ткани мозга. Кроме того, увеличивается проницаемость сосудистой стенки и усиливается приток жидкости в ткань мозга в областях мозга с нарушенным гематоэнцефалическим барьером.
Цель изобретения расширение ассортимента средств, обладающих противоотечным действием.
Это достигается тем, что в качестве противоотечного средства применяют перфторан, который вводят больному с момента поступления в стационар и исключения внутричерепной гематомы, внутривенно медленно в дозе 3-5 мл/кг массы тела со скоростью не более 3 мг/мин. Одновременно и на протяжении 12-24 ч от начала лечения осуществляется ингаляция кислорода (8-10 л/мин). Повторное введение перфторана возможно не более двух раз в такой же дозе с интервалом между введением не менее 24 ч.
Применение перфторана в качестве противоотечного средства в патентной и научной литературе не выявлено, что доказывает новизну и существенное отличие предлагаемого технического решения.
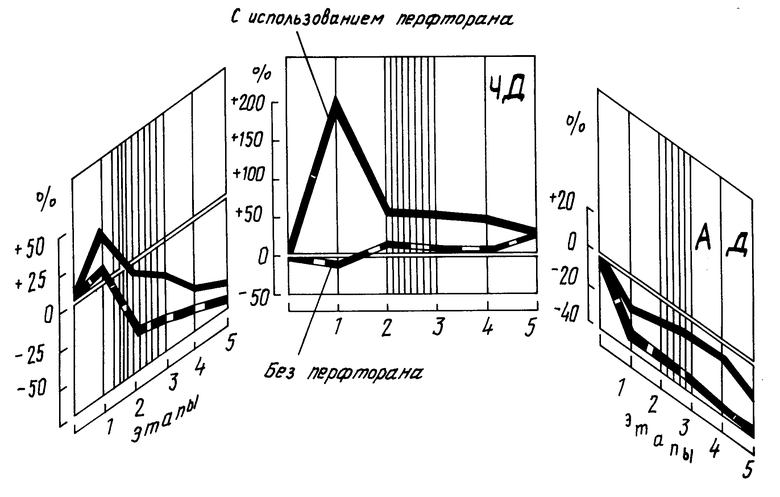
На чертеже проиллюстрировано изменение частоты (RR), дыхания (4Д), артериального давления у собак с экспериментальной черепно-мозговой травмой при использовании в лечении перфторана и без него, где 1-5 этапы обследования, а штрих соответствует времени ингаляции кислородом.
Противоотечное действие перфторана было выявлено в эксперименте при моделировании тяжелой черепно-мозговой травмы на 60 ненаркотизированных собаках-самцах со средней массой тела 18,07 кг. 11 животных составили 1-ю интактную группу и наблюдались при фиксации в подопытном положении время, равное продолжительности эксперимента. 22 животных вошли во II-ю группу с нелеченной ЧМТ. У 10 животных III-ей группы лечение острого посттравматического периода проводили ингаляцией кислорода в течение 60 мин после травмы. 17 животным, составившим IV-ю группу, лечение проводилось внутривенным капельным введением фторуглеродной эмульсии перфторан в указанных выше режимах.
В ходе эксперимента осуществлялся непрерывный контроль за витальными функциями животного с периодической графической регистрацией их через 30 мин. Одновременно изучались функциональное состояние надпочечников, щитовидной железы, симпатоадреналовой, гистаминореактивной, серотонинэргической систем, реологические свойства крови (ее вязкость, скорость агрегации эритроцитов и тромбоцитов, кислотные эритрограммы). По окончании эксперимента животные выводились из опыта, ткань мозга подвергалась гистохимическому и морфометрическому анализу.
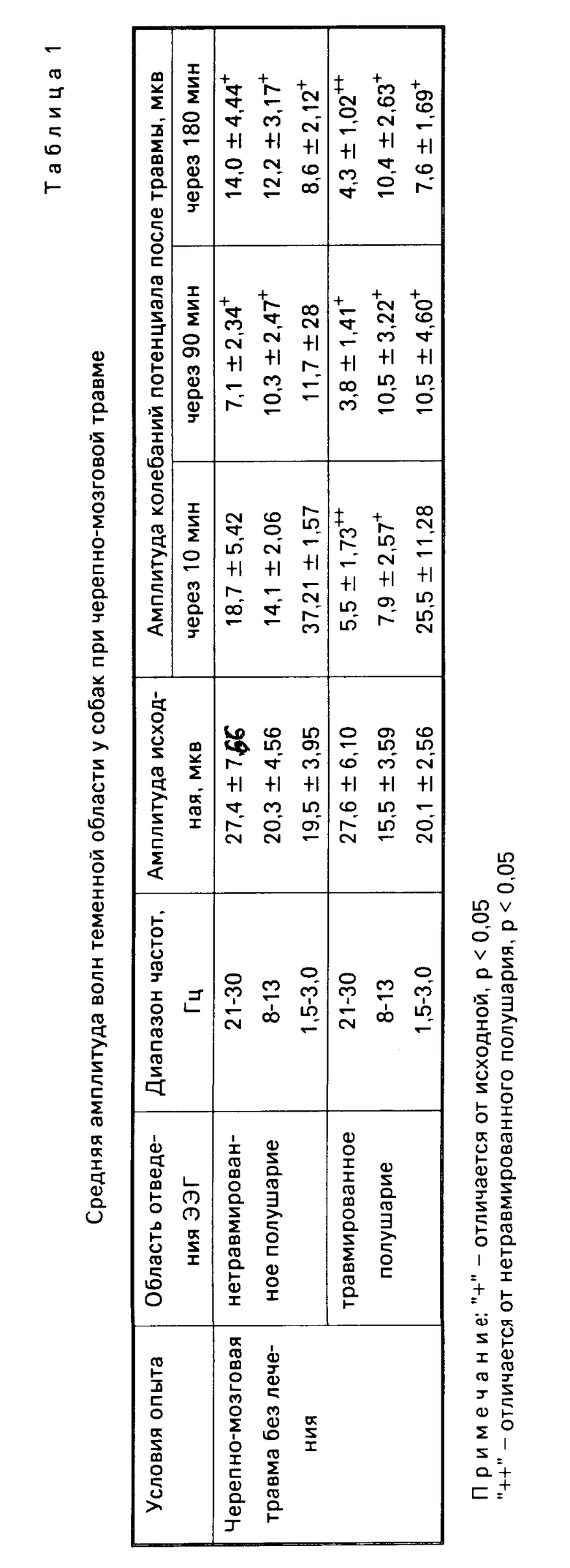
Для большинства животных с нелеченной ЧМТ с первых мгновений после травмы были характерными апное и резкая брадикардия, изменение тонуса скелетной мускулатуры, непроизвольные мочеиспускание и дефекация. Поэтому возникли необходимость в комплексных мерах срочной реанимации, включающих проведение закрытого массажа сердца, интубацию животного и перевод его на искусственную вентиляцию легких. Неврологически у них отмечались грубые органические выпадения, длительная утрата защитных рефлексов, нарушение зрачковых реакций, анизокория, спонтанный нистагм, явления децеребрации с клонико-тоническими судорогами. В ходе эксперимента отмечалось прогрессирующее нарастание тяжести состояния нелеченных животных, выражавшееся не только в декомпенсации гемодинамики, отсутствии самостоятельного дыхания, но практически у всех животных и в углублении коматозного состояния, свидетельствующем о нарастании отека-набухания головного мозга. Это находило подтверждение на ЭЭГ, при регистрации которой (табл.1) отмечалось снижение амплитуды колебаний потенциала в диапазоне α, β волн в травмированном полушарии. Угнетение волнового процесса захватывало в травмированном полушарии к 90-й минуте и диапазон низкочастотных γ-колебаний. Наряду с этим к 90-й минуте после травмы снижались амплитуда α- и β-колебаний потенциала в нетравмированном полушарии. К третьему часу с момента травмы биоэлектрическая активность угнеталась во всех частотных диапазонах обоих полушарий, составляя на травмированной стороне 15-67% а на нетравмированной 44-60% от исходной.
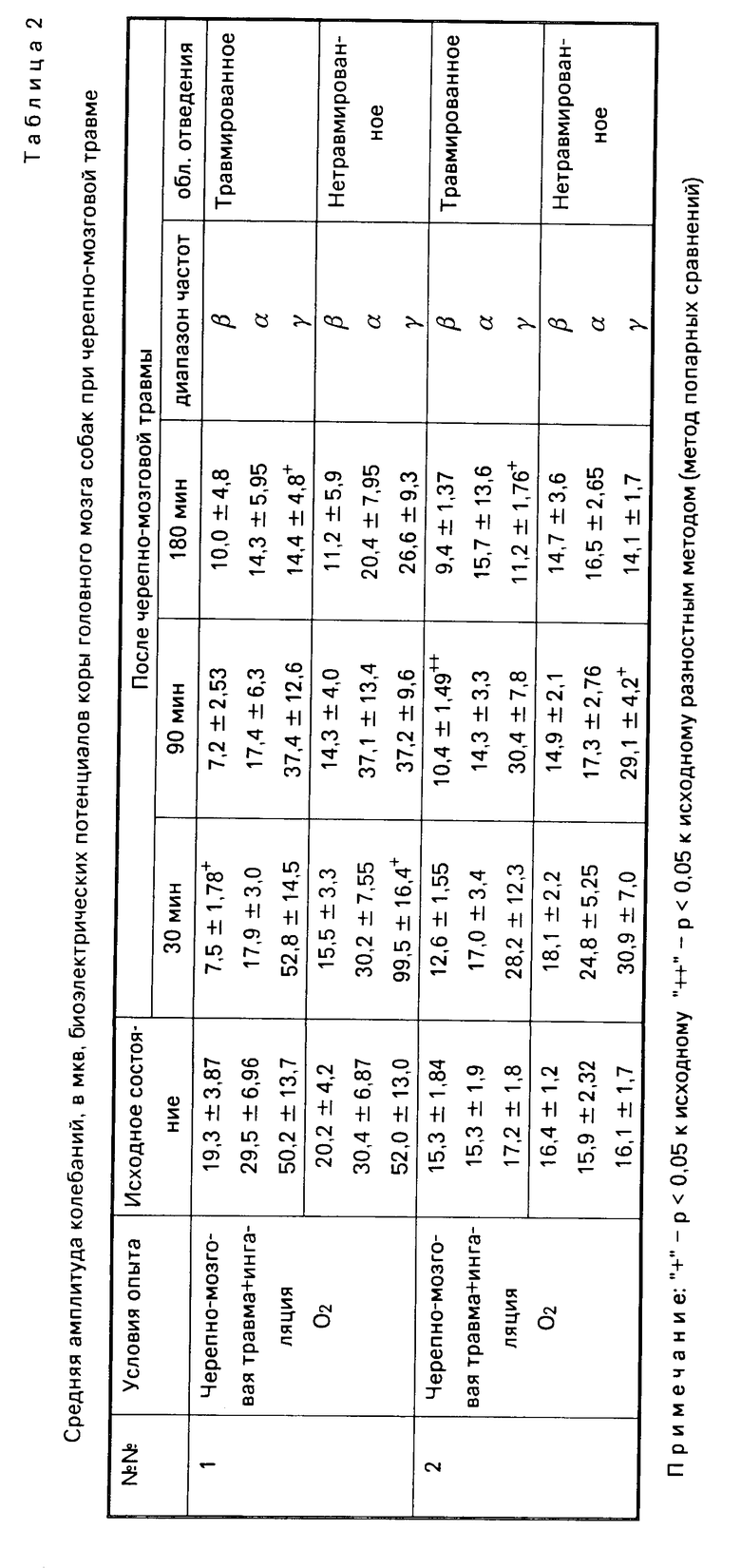
В то же время при использовании для лечения острой ЧМТ ингаляции чистого кислорода в течение 60 мин после травмы головного мозга установлено, что в ответ на лечение угнетение амплитуды потенциалов происходит только в травмированном полушарии и проявляется в области высокочастотных α β-колебаний. Амплитуда низкочастотных γ-колебаний снижается только к третьему часу после нанесения травмы (табл.2). И действительно, животные на фоне ингаляции кислородом становились активнее двигательно, у них частично восстанавливались зрачковые и защитные рефлексы, снижалась судорожная активность. У 7 из 10 животных восстановилось самостоятельное дыхание. Уровень артериального давления первоначально снижался на 35% от исходного, в дальнейшем оставался стабильным не только на фоне ингаляции кислородом, но и в течение 1,0-1,5 ч после прекращения ее. Гипотония резко нарастала к 3-му часу после травмы. В ответ на развивающуюся гипотонию происходило компенсаторное увеличение числа сердечных сокращений (RR составил 67,5% от исходного состояния), на 34% возрастало тахипноэ.
Об ухудшении реологических свойств и угрозе ДВС-синдрома свидетельствовали рост тромбоцитов в периферической крови на 27% от исходного, ускорение процесса их агрегации (на 62,5% от первоначального) и полное отсутствие процесса их дезагрегации у большинства животных при замедлении на 72,9% скорости агрегации эритроцитов.
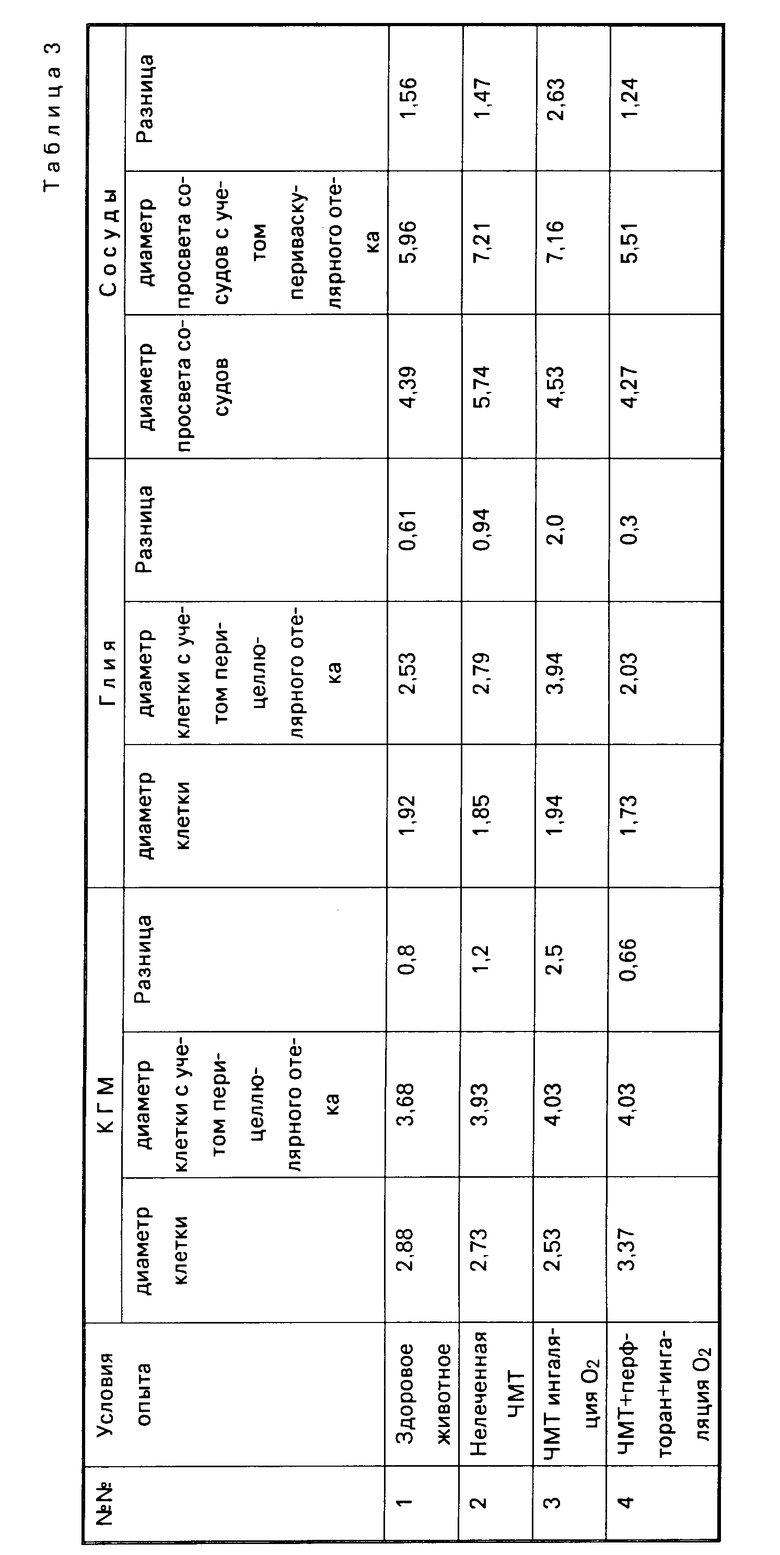
При лечении капельным введением перфторана в указанном режиме с одновременной ингаляцией кислорода через катетер, введенный в интубационную трубку, получены следующие результаты. Уровень артериального давления практически возвращался к норме уже через 15 мин от начала введения перфторана и удерживался не только весь период введения препарата но и в течение 60 мин после прекращения введения. Величина пульса также практически не отличалась от исходной на протяжении 2 ч эксперимента. Некоторая дестабилизация гемодинамики отмечалась только к 3-му часу с момента травмы. На фоне введения перфторана у всех животных восстанавливалось самостоятельное дыхание с частотой близкой к исходной. Неврологически у большинства животных, леченных перфтораном, восстанавливались сознание, зрачковые, корнеальные рефлексы. Этому соответствовал факт восстановления до исходного значения биоэлектрической активности коры обоих полушарий головного мозга (табл.2) в период введения перфторана и ингаляции кислорода. Вышеперечисленное свидетельствовало о противоотечном действии препарата и подтверждалось данными сравнительной морфометрии клеток идентичных зон коры головного мозга (табл.3), проводимых с помощью окуляр-микрометра. Измерялся диаметр клеток коры, глии, а также общий диаметр клетки с учетом периваскулярного и перециллюлярного отека. Указанная разница характеризует степень выраженности отека в микрометрах и доказывает противоотечное действие препарата на глиальные клетки головного мозга с одновременным противоотечным периваскулярным действием.
Клиника течения раннего посттравматического периода соответствовала изменени- ям, изучаемых нами нейрогумулярно-гормо- нальных систем. Так, отмечается повышение выделения с мочой адреналина и норадреналина на 25,8 и 30% соответственно, причем величина отношения А/НА оставалась на неизменном уровне, равняясь исходной, что говорило о способности симпато-адреналовой системы и к восстановлению. Об уменьшении стрессовой реакции организма на травму свидетельствовали более низкий уровень концентрации кортизола и альдостерона в плазме крови животных. Так, рост кортизола составил 165% против исходного, что на 148% ниже, чем у животных, получавших в лечении только кислород. В то же время альдостерон увеличился на 90,4% против исходного, что на 50,6% меньше предыдущей группы. Это свидетельствовало тканевой гипоксии и подтверждалось динамикой изменения лактата и пирувата сыворотки крови при значительном отличии возрастного состава эритроцитов. Так, количество старых, малоустойчивых к кислоте эритроцитов увеличилось на 128% при параллельном уменьшении на 46,5% количества зрелых и отсутствии высокоустойчивых их форм. Скорость дезагрегации красных кровяных клеток с альцианом голубым (а, следовательно, и величина их электрокинетического потенциала) увеличивается на фоне лечения перфтораном на 13,5% от исходного уровня и на 40,4% против группы животных, в лечении которых использован только кислород, Об улучшении реологических свойств крови говорит не только близкое к исходному количество эритроцитов и тромбоцитов ее, но и отмеченная динамика изменений скоростей агрегации и дезагрегации последних. Так, процесс агрегации тромбоцитов замедлился на 31% от исходного и на 93,5% по сравнению с предыдущей группой. В то же время скорость дезагрегации их ускорилась более, чем в 4 раза.
Таким образом экспериментальными данными было установлено противоотечное действие препарата.
Установленное противоотечное действие препарата было подтверждено при клинических испытаниях препарата.
Для клинического испытания противоотечного действия перфторана был отобран контингент больных, нуждающихся в применении перфторана по известным показаниям.
Перфторан был включен в комплексную терапию 15 больных с тяжелой черепно-мозговой травмой (продолжительность коматозного периода не менее 6 ч с момента травмы). Лечение перфтораном этим больным было показано в связи с известным свойством лекарственного препарата уменьшать выраженность тканевой гипоксии любого генеза.
Больные получали перфторан внутривенно капельно в дозе 3-5 мл/кг массы тела со скоростью не более 3 мл/мин при одновременной ингаляции кислорода (газоток 8-10 л/мин) в течение 12-24 ч.
Параллельное исследование церебральной гемодинамики (по данным реоэнцефалографии), функционального состояния клеток коры головного мозга (ЭЭГ) позволило подтвердить противоотечное действие перфторана при его клиническом применении.
Достижение противоотечного действия перфторана контролировалось путем записи РЭГ, ЭЭГ на 1-е, 3-и, 5-е, 7-е, 10-е и 14-е сутки с момента травмы головного мозга. Кроме того, определяли показатели КЩС, газов крови, реологические свойства крови, ее кислородотранспортную функцию, состояние симпатоадреналовой, калликреин-кининовой, гистаминореактивной и серотонинэргической систем (по уровню выделяемых с мочой биогенных аминов, их предшественников и метаболитов).
Анализируя полученные результаты, можно подчеркнуть, что ни у одного больного введение перфторана не сопровождалось осложнениям или побочными реакциями. Из 15 больных с тяжелой травмой головного мозга умерло 5 в связи с поражениями мозга, несовместимыми с жизнью. Летальность в этой группе больных составила 33,3% что на 8,3% ниже контрольной группы. Это наряду с высокой степенью восстановления и сохранности основной функции мозга сознания полностью связано с противоотечным действием перфторана. Положительная динамика клинического течения нейротравмы обуславливалась противоотечным характером возникающих под влиянием перфторана изменений в состоянии центральной нервной системы. Так, уже к 5 суткам после травмы по данным РЭГ отмечалась у большинства больных практическая нормализация мозговой гемодинамики, отсутствие венозного застоя в гемисферах головного мозга. Одновременно резко уменьшалось количество модельных патологических волн в сдвиге частотного спектра в сторону более быстрых β -колебаний, появлялся α -ритм, улучшались устойчивость модуляции, зональные различия.
Стабилизация функционального состояния мозга и церебральной гемодинамики, обусловлена характером обмена биогенных аминов. Установлена выраженная нормализация экскреции адреналина и норадреналина при сохранении их резервов в виде дофамина и ДОФА. Ей сопутствовала значительная активация серотонинэргической системы, проявляющаяся ростом экскреторного серотонина, что свидетельствовало о повышении устойчивости организма к травме в целом и отсутствии прогрессирующего отека головного мозга. Одновременно на фоне перфторана значительно улучшался газовый состав крови, снижался уровень лактата крови, что говорило об уменьшении тканевой гипоксии в сравнении с традиционным лечением. А также улучшались реологические свойства крови, уменьшалась вязкость крови в сосудах малого диаметра на фоне нормализации процессов агрегации и дезагрегации тромбоцитов.
П р и м е р 1. Больная М. 42 лет (история болезни N 13412) доставлена с места происшествия через 1 ч 10 мин. Механизм травмы падение с высоты 3-го этажа. Состояние тяжелое. Кома I-II. Глазные рефлексы угнетены, вызываются не постоянно. Периодически имеет место двигательное возбуждение. Положительный менингеальный симптомокомплекс. Анизорефлексии нет. Цереброспинальная жидкость окрашена кровью. Пpи люмбальной пункции вытекает под давлением 200 мм водного столба. Диагноз: Сочетанная травма. Тяжелая черепно-мозговая травма. Ушиб головного мозга. Субарахноидальное кровоизлияние. Открытый перелом ср/3 левого бедра. Через 9 ч после травмы начата в/в инфузия перфторана на фоне ингаляции кислородом. После ее окончания через 1,5 ч больная пришла в сознание. Доступна словесному контакту. В течение ближайших двух суток восстановились правильные поведенческие реакции, критика, адекватный двусторонний словесный контакт. К пятым суткам адекватна, достаточно активна. Очаговой неврологической симптоматики нет. Менингеальный синдром, нарушения терморегуляции отсутствуют. На седьмые сутки после травмы больная переведена в травматологическое отделение по месту жительства.
Таким образом, противоотечный эффект перфторана проявился уже через 1,5 ч после его введения.
Учитывая молодой возраст пострадавших с ЧМТ ясно, что возвращение к общественной жизни, труду является одной из важнейших и гуманных задач. Поражение мозга в силу его высокой значимости в целостном организме человека ведет к тяжелейшим нарушениям психических процессов, таких как речь и понимание, память и восприятие, счет и конструктивная деятельность. В сохранении под влиянием противоотечного действия перфторана этих процессов большая социальная ценность препарата.
Таким образом, сравнительный анализ показывает, что перфторан оказывает выраженный противоотечный эффект в силу того, что препарат
дегидратирует преимущественно глиальные клетки головного мозга и уменьшает явления перицеллюлярного отека, препятствуя отеку и дислокации стволовых и среднемозговых отделов мозга;
улучшает реологические свойства крови за счет снижения вязкости и уменьшения периваскулярного отека, т.е. уменьшения полнокровия головного мозга, что устраняет явления ишемии головного мозга в отдаленных от травмы участках и препятствует развитию отека головного мозга в непораженных зонах.
Вышеуказанное позволяет рекомендовать использовать препарат в нейрореанимационной практике.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ГИДРАТАЦИИ МОЗГОВОЙ ТКАНИ | 1990 |
|
RU2013986C1 |
| СПОСОБ ЛЕЧЕНИЯ ОТЕКА МОЗГА У БОЛЬНЫХ ХРОНИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ ПЕЧЕНИ | 2014 |
|
RU2539139C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРЫХ ОЧАГОВЫХ ПОРАЖЕНИЙ ГОЛОВНОГО МОЗГА | 2001 |
|
RU2188674C1 |
| СПОСОБ ЛЕЧЕНИЯ ПОСТТРАВМАТИЧЕСКОГО ИММУНОДЕФИЦИТА В ОСТРОМ ПЕРИОДЕ ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ ГОЛОВНОГО МОЗГА | 1999 |
|
RU2141325C1 |
| Способ лечения гипоксии мозга | 1982 |
|
SU1138163A1 |
| Способ лечения черепно-мозговой травмы и средство для его осуществления | 2023 |
|
RU2826364C1 |
| Способ лечения больных с посттравматическим поражением головного мозга в раннем периоде заболевания | 2017 |
|
RU2666121C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ В ОСТРОМ ПЕРИОДЕ ТЯЖЕЛОЙ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ | 2010 |
|
RU2441681C1 |
| СПОСОБ ЛЕЧЕНИЯ ОТЕКА ГОЛОВНОГО МОЗГА У БОЛЬНЫХ С ЧЕРЕПНО-МОЗГОВОЙ ТРАВМОЙ | 2000 |
|
RU2170581C1 |
| Способ коррекции морфологических изменений при травматическом повреждении головного мозга | 2021 |
|
RU2758545C1 |
Изобретение относится к медицине, а именно к препаратам противоотечного действия. Цель изобретения расширение ассортимента средств, обладающих противоотечным действием. В качестве противоотечного средства применяют перфторан. Противоотечное действие перфторана обнаружено в эксперименте при моделировании тяжелой черепно-мозговой травмы на собаках и подтверждено при клиническом испытании. Перфторан обладает способностью уменьшать отек клеток глии коры головного мозга, уменьшать периваскулярный отек сосудов в головном мозге, действуя на пораженные клетки мозга. Он предупреждает дислокацию стволовых отделов мозга. В то же время, улучшая реологические свойства крови, он предупреждает развитие ишемии в отдаленных от зоны поражения участках. Изобретение может быть использовано при лечении отека-набухания головного мозга. 1 ил. 3 табл.
Применение перфторана в качестве противоотечного средства.
| Г.Р | |||
| Иваницкий и Ф.Ф | |||
| Белоярцев - в кн | |||
| Медико-биологические аспекты применения эмульсий перфторуглеродов, Пущино, 1983, с.34-37. |
Авторы
Даты
1995-12-10—Публикация
1988-08-01—Подача