Изобретение относится к биотехнологии и касается получения иммунных препаратов молозива, а именно специфического лактоглобулина.
Известен способ получения специфического лактоглобулина путем иммунизации глубокостельных коров корпускулярной коли формолвакционной многократно внутримышечно и внутривыменно с последующим сбором молозива, отделением лактосыворотки, выделением иммунных комплексов осаждением сульфатом аммония и стерилизующим фильтрованием (см. например: Шулюмова Е.С. Барабаш А.Ф. Барабаш В. С. и др. Опыт применения специфических лактоглобулинов Ветеринария, 1973, N 1, с.60-61). Вместо внутривыменной иммунизации возможно проведение скорификации с последующим 5-6-кратным введением массированных доз вакцины в ганглии ретромолочной железы (патент Франции N 1599671, кл. А 61 К, 1970).
Известен также способ получения специфического лактоглобулина, предусматривающий иммунизацию глубокостельных коров корпускулярным микробным антигеном (коли-протейной вакциной, содержащей энтеропатогенные кишечные палочки серотипов 0111:В4, 026:В6, 0119:В14 и бактерии протея Р. mirabilis и P. vulgaris) двукратно внутримышечно и трижды внутривыменно с последующим сбором молозива, отделением лактосыворотки, выделением иммунных комплексов путем осаждения этанолом, стерилизующим фильтрованием и лиофильным высушиванием (Иванов Н.Р. Ермолов В.И. Иммунные препараты молока и их применение при острых кишечных инфекциях у детей. Изд-во Саратовского ун-та, 1985, с. 36-42).
Указанные способы трудоемки и не удобны в эксплуатации из-за необходимости внутривыменной иммунизации. Внутривыменная иммунизация в 20 - 25% случаев вызывает мастит, что приводит к потере молокоотдачи коров. Кроме того, в указанных способах имеет место низкий выход целевого продукта.
Наиболее близким к заявленному является способ получения специфического лактоглобулина путем трехкратной внутримышечной иммунизации глубокостельных коров корпускулярным или корпускулярным и растворимым микробными антигенами с последующим сбором молозива, отделением лактосыворотки, выделением и стерилизацией иммунных комплексов (Соболева С.В. Лактоглобулины направленного действия /микробиологические аспекты разработки и клинического применения препаратов/. Дисс. докт. мед. наук в форме научного доклада. Ростов н/Д: Ростовский мед. ин-т, 1991).
Однако в способе-прототипе имеет место низки выход целевого продукта. Это объясняется отсутствием в его описании сведений о режимах проведения стадии иммунизации. Нами установлено, что осуществленное в прототипе изъятие внутривыменной иммунизации эффективно лишь в узких диапазонах доз антигена и интервалов между циклами иммунизации, что доказывается ниже.
Кроме того, получаемые известными способами лактоглобулины обладают только коли, протейными, синегнойными, клебсиеллезными и сальмонеллезными антителами.
Целью изобретения является повышение выхода лактоглобулина.
Дополнительной целью является расширение спектра действия препарата.
Для повышения выхода целевого продукта в способе получения специфического лактоглобулина путем многократной внутримышечной иммунизации глубокостельных коров корпускулярным или корпускулярным и растворимым микробными антигенами с последующим сбором молозива, отделением лактосыворотки, выделением и стерилизацией иммунных комплексов:
а) коров иммунизируют с 1 2-недельным интервалом;
б) разовую дозу корпускулярного антигена устанавливают равной 20 30 млрд. м.т. на корову;
в) при иммунизации коров антигеном, дополнительно содержащим растворимый антиген, разовую дозу последнего устанавливают из расчета 10 15 чел/доз на корову;
г) кратность иммунизации устанавливают по формуле:
n 3 + t (1),
где
n количество циклов иммунизации;
t число недель до растела, определяемое после третьей иммунизации.
Для расширения спектра действия в качестве растворимого антигена используют химическую холерную вакцину. В этом варианте способа достигается не известный ранее синергический эффект выработки противохолерных антител, что поясняется примером 5.
В приводимых ниже примерах осуществления способа режимные признаки указаны по результатам иммунизации групп из 10 15 коров.
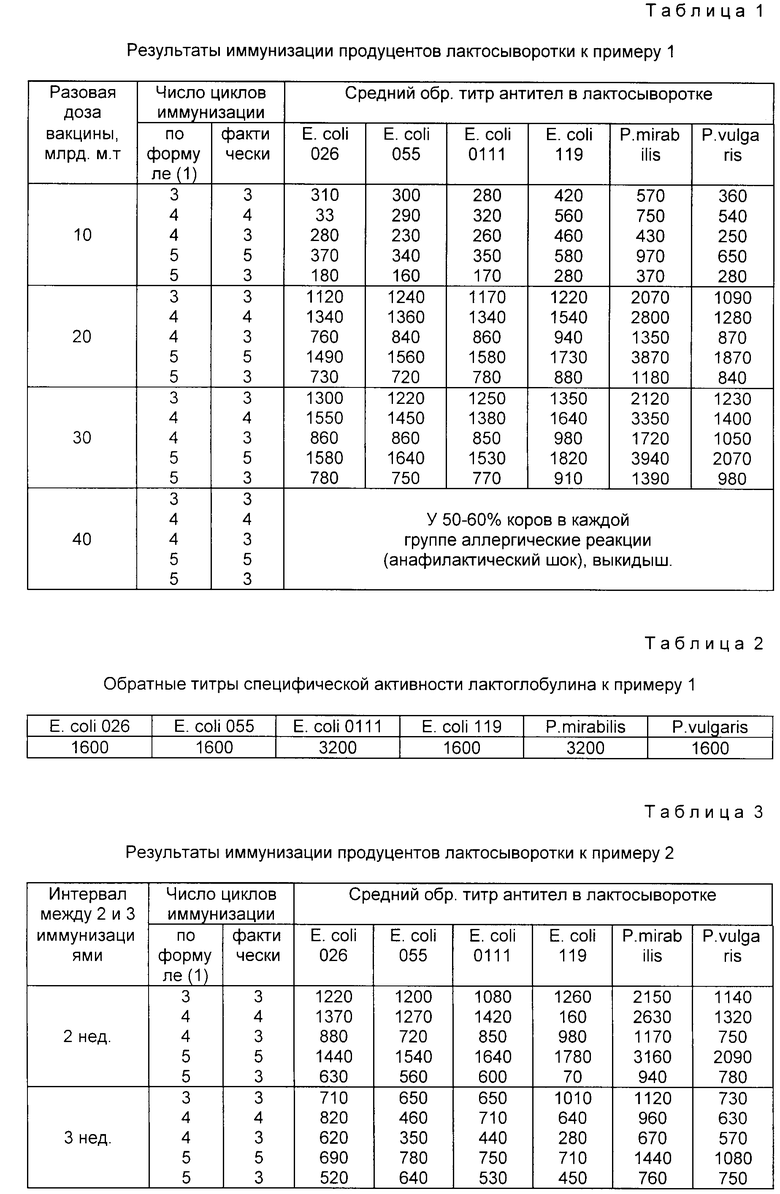
Пример 1. Глубокостельных коров иммунизируют внутримышечно ассоциированной корпускулярной коли-протейной вакциной, включающей моновакцины из равного количества микробных тел культур Е. coli сероваров 026, 055, 0111, 0119; Proteus mirabilis и Proteus vulgaris.
Разовые дозы ассоциированной вакцины устанавливают от 10 до 40 млрд.м.т. на корову. Интервал между циклами иммунизации 1 нед. После третьей иммунизации уточняют срок растела, в зависимости от которого проводят или не проводят дополнительные циклы иммунизации, количество которых устанавливают по формуле (1). Контрольным группам нерастелившихся после третьей иммунизации коров дополнительные циклы иммунизации не проводят.
В течение 5 7 суток после отела от коров собирают молозиво и удаляют жир на сепараторе. Обезжиренное молозиво подогревают до 37oC, обрабатывают 0,1 мас. пепсина в течение 18 ч при комнатной температуре, сливают лактосыворотку, и фильтруют ее через ватно-марлевый фильтр.
В лактосыворотке определяют активность специфических антител (АТ) титованием в реакции пассивной гемагглютинации (РПГА). Результаты получения лактосыворотки приведены в табл. 1.
Вариация приведенных в табл. 1 средних значений обратных титров АТ лактосывороток, в пределах от 3 до 15%
Как видно из таблицы, активность специфических АТ существенно выше в лактосыворотках, полученных при иммунизации коров в заявленном режиме (выделены в таблице). Выход за верхний предел заявленных дозировок приводит к тяжелым аллергическим реакциям и выкидышу у 50 60% коров.
Высокотитражные (выделенные) лактосыворотки объединяют и подвергают седиментационной обработке в проточной суперцентрифуге при факторе разделения F= 15250 для удаления остатка казеина. Кислотность лактосывороток доводят pH до 5,8 с помощью NaOH.
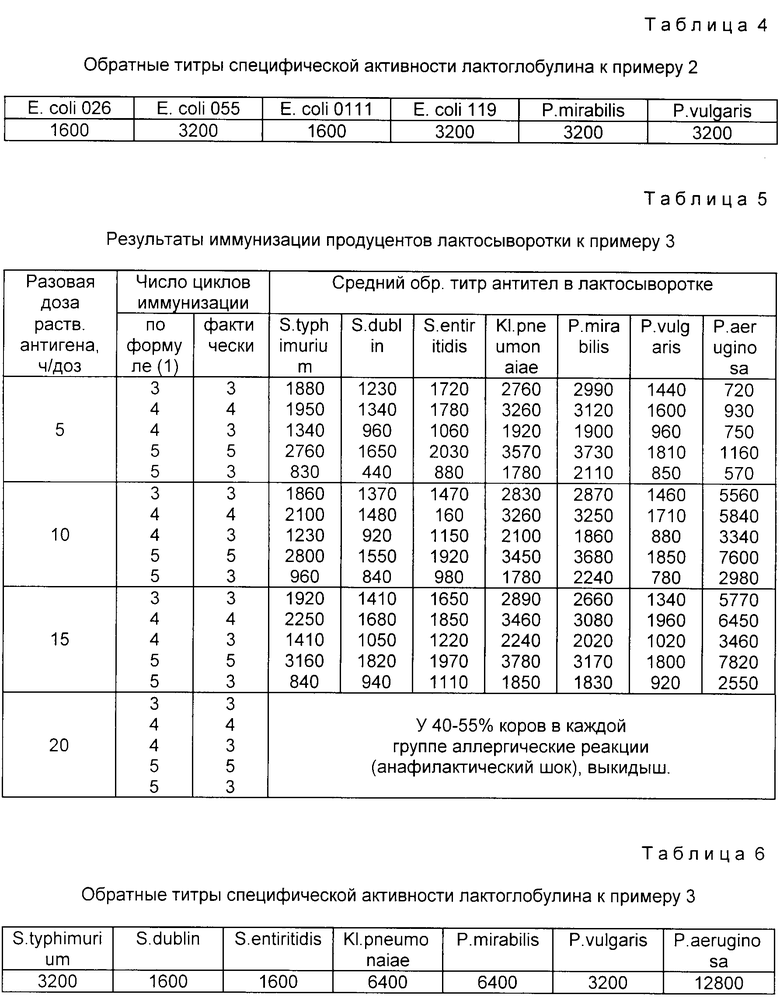
Из данных лактосывороток выделяют комплекс иммуноглобулинов осаждением равным объемом 50%-ного этанола на холоде в течение 5 ч, затем через 2,5 ч доводят кислотность до pH 6,2 с помощью NaOH и перемешивают в течение 12 ч до полного формирования осадка. Осадок отделяют суперцентрифугированием в вышеуказанном режиме, растворяют в 400 мас. физраствора, осветляют на суперцентрифуге при F= 13000 и фильтруют через асбестовые и стерилизующие пластины. Далее проводят лиофильное высушивание целевого продукта.
В полученном специфическом лактоглобулине содержится 97 мас. молозивных иммуноглобулинов. Среди них IgG 66% IgA 22% IgM остальное. Специфическая активность АТ данного препарата в РПГА указана в табл. 2.
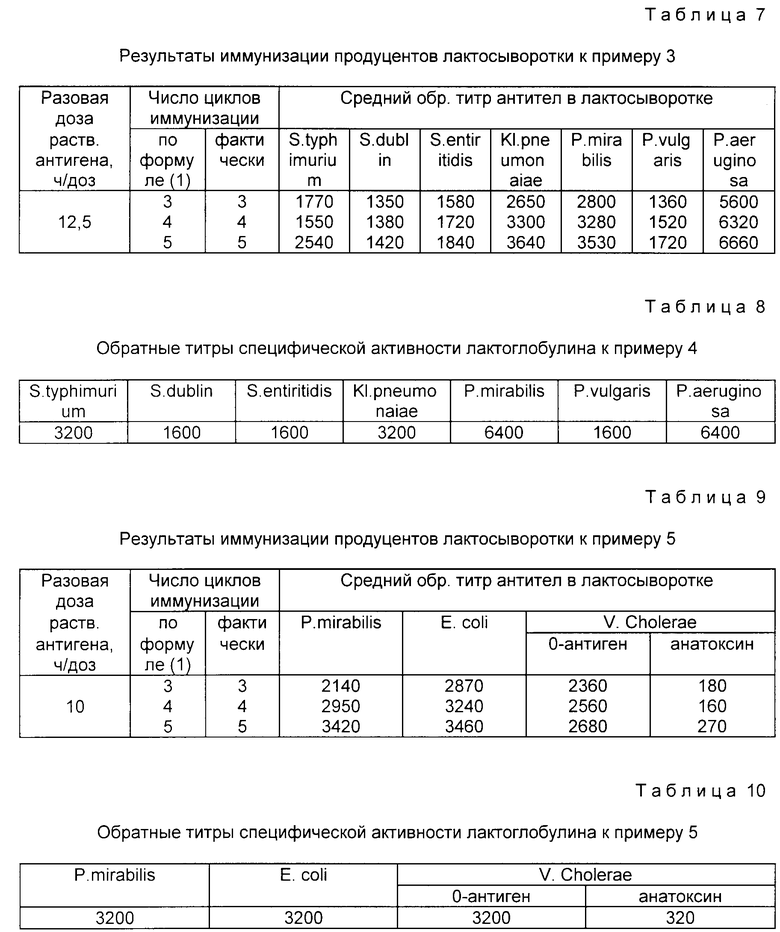
Пример 2. Глубокостельных коров иммунизируют внутримышечно ассоциированной корпускулярной коли-протейной вакциной, включающей моновакцины из равного количества микробных тел культур Е. coli сероваров 026, 055, 0111, 0119; Proteus mirabilis и Proteus vulgaris. Схема иммунизации: разовая доза ассоциированной вакцины 25- млрд.м.т. на корову; интервал между первыми двумя иммунизациями 2 нед. перед третьей иммунизацией 2 или 3 нед. (для соответствующих групп), далее уточняют срок растела, в зависимости от которого проводят или не проводят дополнительные циклы иммунизации, количество которых устанавливают по формуле (1). Дополнительные иммунизации не проводят также в контрольных группах.
Сбор молозива и отделение лактосыворотки проводят, как в примере 1. Результаты контроля специфической активности содержащихся в ней АТ приведены в табл. 3.
Из табл. 3 видно, что отклонение от заявленных режимов как по интервалу между циклами иммунизации, так и по числу циклов, приводит к снижению специфической активности АТ в лактосыворотке. Лактосыворотки, полученные при заявленной схеме иммунизации (выделены), объединяют. Последующие технологические операции получения лактоглобулина проводят, как в примере 1.
В полученном лактоглобулине содержится 98 мас. молозивных иммуноглобулинов, среди которых IgG 69% IgA 20% IgM остальное. Активность АТ препарата в РПГА указана в табл. 4.
Пример 3. Глубокостельных коров иммунизируют внутримышечно ассоциированной вакциной, включающей равные объемы корпускулярных моновакцин из культур Proteus mirabilis, Proteus vulgaris, Salmonella typhimurium, Salmonella enteritidis, Salmonella dublin, Klebsiella pneumoniae и растворимую химическую вакцину из Pseudomonas aeruginosa серотипов 02, 05 и 011. Схема иммунизации: разовая доза из расчета суммарного количества корпускулярных антигенов 20 млрд. м.т. химической вакцины (растворимого антигена) 5, 10, 15 и 20 чел/доз на корову; интервал между иммунизациями 1 нед. число иммунизаций устанавливают по формуле (1) (расчет проводят после третьей иммунизации). В контрольных группах проводят только 3 иммунизации.
Сбор молозива и отделение лактосыворотки проводят, как в примере 1. Результаты контроля специфической активности содержащихся в ней АТ приведены в табл. 5.
Как видно из таблицы, запредельно низкая доза растворимого антигена (5 чел/доз) приводит к резкому снижению активности АТ к возбудителю синегнойной инфекции P. aeruginosa, а запредельная высокая доза этого антигена (20 чел/доз) вызывает аллергические реакции и выкидыш у коров-продуцентов (при соблюдении заявленных режимов иммунизации таковые реакции не наблюдаются).
Лактосыворотки, полученные по заявленной схеме иммунизации (выделены в таблице), объединяют. Последующие технологические операции проводят, как в примере 1.
В полученном лактоглобулине содержится 98 мас. молозивных иммуноглобулинов, среди которых IgG 67% IgA 21% IgM-ос-остальное. Активность АТ препарата в РПГА указана в табл. 6.
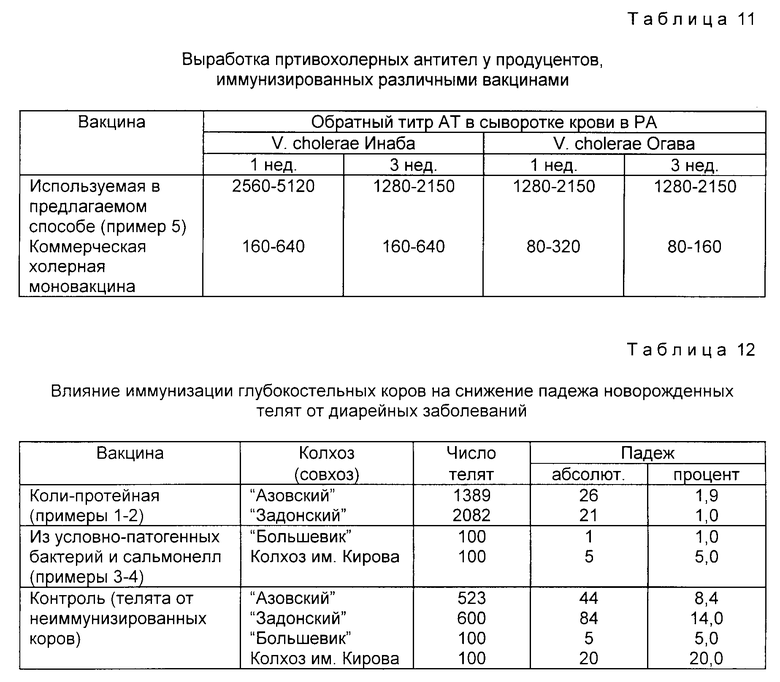
Пример 4. Глубокостельных коров иммунизируют внутримышечно ассоциированной вакциной, описанной в примере 3. Схема иммунизации: разовая доза корпускулярных антигенов 25 млрд.м.т. растворимых антигенов 12,5 чел/доз на корову; интервал между иммунизациями 1 нед. количество иммунизаций уточняют после третьего цикла по формуле (1). Молозиво собирают, отделяют лактосыворотку, контролируют активность АТ в различных сериях лактосывороток, объединяют их, и выделяют иммуноглобулины, как в примере 1.
Результаты контроля лактосывороток и лактоглобулина приведены в табл. 7 и 8.
Пример 5. Глубокостельных коров иммунизируют внутримышечно ассоциированной вакциной, включающей корпускулярные моновакцины из культур E.coli 0114 и P.mirabilis и растворимую холерную вакцину, содержащую два основных антигена холерного вибриона Инаба 569-В: анатоксин и основной соматический O-антиген. Для иммунизации используют разовую дозу корпускулярных антигенов 20 млрд. м. т. (по 10 млрд.м.т. E.coli 0114 и P.mirabilis) и 10 чел/доз растворимых антигенов (холерной вакцины). Интервал между циклами иммунизации 1 нед. Количество циклов уточняют после третьей иммунизации по формуле (1).
Контрольную группу продуцентов иммунизируют с теми же интервалами и в той же дозировке (10 чел/доз) коммерческой химической холерной вакциной (тот же холерный антиген, но без корпускулярных коли-протеиных антигенов).
Молозиво собирают, отделяют лактосыворотку, контролируют активность АТ в различных сериях лактосывороток, объединяют, их и выделяют иммуноглобулины, как в примере 1. Активность АТ к O-антигену V.Cholerae определяют в РА, а к холерному токсину в реакции нейтрализации токсина.
Результаты контроля лактосывороток и лактоглобулина приведены в табл. 9 и 10. Вариация средних значений 6 17%
Синергическое действие использованной для иммунизации продуцентов ассоциированной вакцины проиллюстрировано в табл. 11.
Как видно из таблицы, титр антител при иммунизации продуцентов в предлагаемом способе на порядок выше, чем в контрольной группе, что, в частности, имеет следствием повышение выхода целевого продукта.
Использование предлагаемого способа по сравнению с прототипом позволяет получить следующие виды положительного эффекта.
1. Обеспечение возможности практического осуществления способа, поскольку в описании прототипа полностью отсутствует схема иммунизации продуцентов.
2. Повышение выхода целевого продукта. Достижение этого эффекта обусловлено двумя факторами:
повышением титров специфических АТ при иммунизации продуцентов по вышеуказанной схеме, что проиллюстрировано приведенными примерами;
исключением тяжелых постиммунизационных реакций животных (анафилактического шока, выкидыша, которые, как указано в примерах 1 и 3, имели место в 40 60% случаев превышения установленного нами верхнего предала диапазона дозировки антигена).
В варианте способа по п. 3 имеет место синергический эффект повышения титра противохолерных АТ у продуцентов, что также приводит к повышению выхода целевого продукта.
3. Получение нового препарата противоколи-протейно-холерного лактоглобулина.
4. Обеспечение универсальности способа. Этот вид положительно эффекта вытекает из того, что заявленным способом можно получать не только известные препараты лактоглобулинов (примеры 1 4), но и впервые полученный описанный в примере 5 противоколи-протейно-холерный лактоглобулин.
5. Несмотря на то, что целевой продукт имеет медицинское назначение, самостоятельный интерес в процессе технического осуществления предлагаемого способа представляет попутно осуществляемая иммунизация поголовья коров, используемых в качестве продуцентов. Иммунизация глубокостельных коров способствует повышению сохранности новорожденных телят за счет колострального иммунитета. По данным испытаний в совхозах Ростовской области падеж от диарейных заболеваний новорожденных телят, иммунизированных указанными в примерах 1 4 антигенами, снижен в 4 14 раз (табл. 12).
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛАКТОСЫВОРОТКА ИММУННАЯ СПЕЦИФИЧЕСКАЯ ПРОТИВ HELICOBACTER PYLORI И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2000 |
|
RU2201256C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВОГО ПРЕПАРАТА | 1995 |
|
RU2108794C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОЛИЗАТА ТВОРОГА ДЛЯ ПРИГОТОВЛЕНИЯ ПИТАТЕЛЬНЫХ СРЕД | 1994 |
|
RU2078811C1 |
| ШТАММ РОТАВИРУСА ЧЕЛОВЕКА ДЛЯ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКИХ И ПРОФИЛАКТИЧЕСКИХ СЫВОРОТОК | 1991 |
|
RU2026345C1 |
| СПОСОБ ПРОФИЛАКТИКИ ЖЕЛУДОЧНО-КИШЕЧНЫХ БОЛЕЗНЕЙ ТЕЛЯТ | 2005 |
|
RU2295975C1 |
| CПОСОБ ПОЛУЧЕНИЯ НИЗКОМОЛЕКУЛЯРНЫХ ПЕПТИДОВ, ОБЛАДАЮЩИХ ИНТЕРФЕРОН-СТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2009 |
|
RU2409678C1 |
| СПОСОБ ПРОФИЛАКТИКИ КОЛИБАКТЕРИОЗА ТЕЛЯТ | 2005 |
|
RU2276994C1 |
| СПОСОБ ИММУНОПРОФИЛАКТИКИ ВИРУСНЫХ РЕСПИРАТОРНЫХ БОЛЕЗНЕЙ ТЕЛЯТ | 2005 |
|
RU2287992C1 |
| ШТАММ Stenotrophomonas maltophilia, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ АНТИГЕНА ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К Stenotrophomonas maltophilia В БИОЛОГИЧЕСКИХ СРЕДАХ | 2015 |
|
RU2566554C1 |
| ВАКЦИНА ДЛЯ ИММУНОПРОФИЛАКТИКИ И ИММУНОТЕРАПИИ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА И ЖИВОТНЫХ, ВЫЗВАННЫХ ПАТОГЕННЫМИ И УСЛОВНО-ПАТОГЕННЫМИ ГРАМОТРИЦАТЕЛЬНЫМИ МИКРООРГАНИЗМАМИ КИШЕЧНОЙ ГРУППЫ И ИХ ЭКЗОТОКСИНАМИ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ИММУНОГЛОБУЛИНОВЫЙ ПРЕПАРАТ (ВАРИАНТЫ) И СПОСОБ ЕГО ПОЛУЧЕНИЯ, ИММУНОБИОЛОГИЧЕСКИЙ ПРЕПАРАТ, ПОЛИКОМПОНЕНТНАЯ ВАКЦИНА | 2003 |
|
RU2262350C2 |
Изобретение относится к биотехнологии и касается получения иммунных препаратов молозива, а именно специфического лактоглобулина. Цель изобретения - повышение выхода целевого продукта. Способ осуществляют путем многократной внутримышечной иммунизации глубокостельных коров корпускулярным или корпускулярным и растворимым микробными антигенами с последующим сбором молозива, отделением лактосыворотки, выделением и стерилизацией иммунных комплексов. Новой в способе является схема иммунизации, предусматривающая введение корпускулярного антигена из расчета разовой дозы 20 - 30 млрд. м.т. , а растворимого антигена - 10 - 15 чел/доз на корову с 1 - 2- недельным интервалом при числе циклов, рассчитываемых: n = 3 + t, где n - количество циклов иммунизации; t - число недель до растела, определяемое после третьей иммунизации. Для расширения спектра действия в качестве растворимого антигена используют химическую холерную вакцину. В этом варианте способа достигается не известный ранее синергический эффект выработки противохолерных антител. 2 з.п. ф-лы, 12 табл.
n 3 + t,
где n количество циклов иммунизации;
t число недель до растела, определяемое после третьей иммунизации.
| Соболева С.В | |||
| Лактоглобулины направленного действия | |||
| Диссерт | |||
| на соиск | |||
| Степени д.м.н | |||
| - Ростов-на-Дону, 1991. |
Авторы
Даты
1997-09-20—Публикация
1993-11-22—Подача