Изобретение относится к улучшенному способу получения концентрированных растворов хлорноватистой кислоты. Хлорноватистая кислота известна как отбеливающее средство и как реагент для получения органических соединений, таких как хлоргидрины и хлорамины. Она выпускается только в виде относительно разбавленных растворов, содержащих 20 мас. или меньше HOCl.
В патенте США N 4146578 от 27.03.79 (Дж. П. Бреннан и др.) описан способ, в котором хлорноватистую кислоту получают разбрызгиванием водного гидроксида щелочного металла в форме капель в газообразный хлор. В результате реакции получают газовую смесь хлора, паров хлорноватистой кислоты и оксида хлора и твердые частицы хлорида щелочного металла. Газовую смесь промывают водой для получения концентрированного водного раствора хлорноватистой кислоты. Однако из-за разбавления газообразного продукта водой образующиеся растворы хлорноватистой кислоты были менее концентрированными, чем нужно, например для получения неорганических солей кислоты.
Дальнейшее развитие этого способа описано в W.O. 90/05111 от 17.05.90 (Дж. К. Мелтон и др.). В этом способе газовую смесь хлорноватистой кислоты, хлора и оксида хлора и воду конденсируют для получения концентрированного раствора хлорноватистой кислоты, содержащего 35-60 мас. HOCl. После конденсации несконденсированную смесь хлора и оксида хлора удаляют из конденсора и после нагревания возвращают в реактор получения хлорноватистой кислоты. Мелтон и соавторы применяли мольное отношение хлора к гидроксиду щелочного металла, по меньшей мере, 20:1. Использование таких высоких концентраций хлора приводит к увеличению эффективности способа, а также к разбавлению несконденсированной газовой смеси с оксидом хлора, удаляемой из конденсора. Несконденсированную газовую смесь нагревали до высоких температур, так как она служит первичным источником тепла для реакции. Однако использование высоких концентраций хлора увеличивает материальные и эксплуатационные расходы способа.
В дальнейшем промышленное производство хлорноватистой кислоты с концентрацией больше 50 мас. HOCl в известных способах не было достигнуто. Получение хлорноватистых кислот с концентрацией больше 50 мас. HOCl требует газовых смесей, содержащих очень высокие концентрации оксида хлора. Немногочисленные известные исследования утверждают, чтобы предотвратить взрывы газовые смеси должны иметь концентрацию оксида хлора меньше 25 об. и температуру меньше 120oC. Эти условия, однако, существенно ограничивают производительность. При использовании больших объемов разбавляющих газов и низкой реакционной температуры увеличение производительности требует увеличения размеров оборудования и возрастания капитальных, энергетических и эксплуатационных затрат.
Таким образом, существует необходимость в способе получения растворов хлорноватистой кислоты с концентрацией больше 50 мас. HOCl, который обеспечивает высокие концентрации оксида хлора при пониженных объемах разбавляющих газов.
Цель изобретения обеспечить способ получения растворов хлорноватистой кислоты с высокими концентрациями HOCl при существенном снижении объема разбавляющих газов.
Дополнительная цель изобретения обеспечить способ получения высококонцентрированных водных растворов хлорноватистой кислоты, имеющий повышенную производительность без увеличения размеров оборудования.
Следующая цель изобретения обеспечить способ получения высококонцентрированных водных растворов хлорноватистой кислоты, имеющий улучшенные выходы.
Следующая цель изобретения обеспечить способ получения высококонцентрированных водяных растворов хлорноватистой кислоты, имеющий низкие энергетические потребности.
Следующая цель изобретения обеспечить способ получения высококонцентрированных водных растворов хлорноватистой кислоты, имеющий низкие материальные и эксплуатационные расходы.
Еще одна цель изобретения обеспечить способ получения хлорноватистой кислоты с концентрацией HOCl больше 50 мас. в безопасных условиях.
Эти и другие преимущества обеспечены в способе получения водного раствора хлорноватистой кислоты реакцией капелек раствора гидроксида щелочного металла, содержащих больше 50 мас. гидроксида щелочного металла, с хлором с образованием реакционной смеси, содержащей газовую смесь оксида хлора, хлора, паров хлорноватистой кислоты и паров воды, и твердых частиц хлорида щелочного металла, и конденсацией от -33 до -5oC.
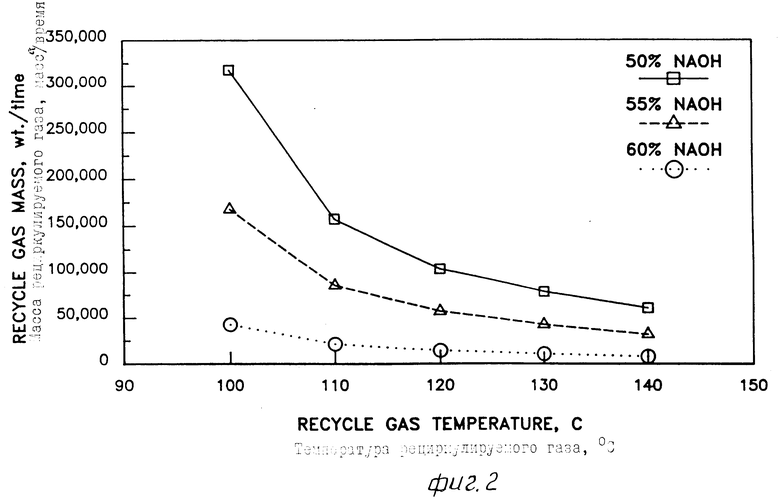
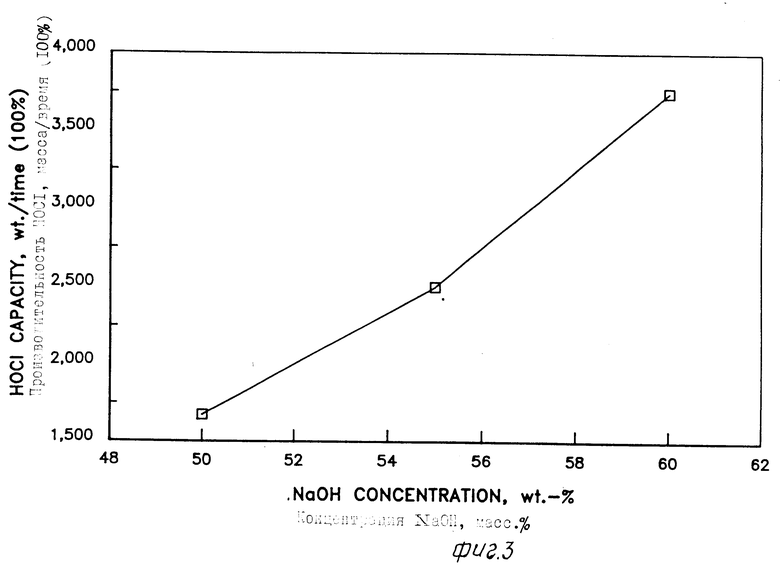
На фиг. 1 дано графическое представление, полученное на компьютере на основе термодинамических моделей, связывающих температуру конденсора и концентрацию Cl2O (мол.) в несконденсированной газовой смеси, отводимой от конденсора, когда работают при атмосферном давлении, используя 50% NaOH и 60% NaOH; на фиг. 2 -графическое представление, полученное на компьютере на основе термодинамических моделей, связывающих рециркулируемую массу с температурой несконденсированной рециркулируемой газовой смеси, требуемой для поддержания температуры реактора 90oC при концентрации NaOH в реакторе 50, 55 и 60% на фиг. 3 графическое представление, созданное компьютером из термодинамических моделей, показывающих зависимость производительности растворов HOCl в расчете на 100% от концентрации NaOH в интервале 50-60%
Более подробно способ осуществляют в реакторе, снабженном устройством для разбрызгивания дискретных капелек водного раствора гидроксида щелочного металла в реактор, устройством для подачи газообразного хлора в реактор, устройством для удаления твердого хлорида щелочного металла из реактора и устройством для отвода газовой смеси, содержащей оксид хлора, непрореагировавший хлор, пары хлорноватистой кислоты и пары воды из реактора.
Дискретные капли раствора гидроксида щелочного металла, используемые в реакции, получают с помощью, по меньшей мере, одного разбрызгивателя, предпочтительно размещенного в верхней части реактора.
В способе можно использовать любой гидроксид щелочного металла, способный реагировать с газообразным хлором с образованием гипохлористой кислоты. Типичные примеры подходящих гидроксидов щелочного металла включают гидроксид натрия, гидроксид калия, гидроксид лития и их смеси. Гидроксид натрия является предпочтительным реагентом, так как образующийся в качестве побочного продукта хлорид натрия более легко удаляем, чем другие хлориды щелочных металлов. Для простоты способ изобретения будет описан с использованием гидроксида натрия в качестве гидроксида щелочного металла.
Так как нужна высокая концентрация хлорноватистой кислоты, то применяют водные растворы гидроксида натрия, имеющие концентрацию больше 50 мас. Предпочтительно концентрация гидроксида натрия составляет 52-70% более предпочтительно 53-65 мас. NaOH. Размер капелек водных высококонцентрированных растворов гидроксида натрия выбирают таким, чтобы обеспечить существенно полную реакцию капелек при разбрызгивании в атмосферу газообразного хлора. Например, капельки размером 50-200 мкм реагируют почти мгновенно, образуя продукт реакции с высокой концентрацией оксида хлора.
В способе настоящего изобретения используют избыток газообразного хлора над стехиометрическим количеством гидроксида натрия, необходимым по уравнению:
Cl2+ NaOH ___→ HOCl + NACl
Избытки газообразного хлора приводят к повышению выходов хлорноватистой кислоты. В дополнение, использование избытка газообразного хлора помогает поддерживать температуру реакции внутри нужного интервала.
Реакция требует достаточного тепла для поддержания оксида хлора, хлорноватистой кислоты и воды в паровой фазе и получения существенно сухих твердых частиц хлорида натрия. Температуру реакции регулируют, чтобы предотвратить значительное термическое разложение присутствующего оксида хлора. Например, температуру реакции поддерживают в интервале 80-120oC. При этих температурах возможно достичь высоких выходов гипохлористой кислоты как продукта, так как они существенно устраняют наличие воды в жидкой фазе в реакционной смеси. Жидкая вода в образующейся твердой соли в присутствии газов в реакционной смеси приводит к образованию хлоратов в качестве примеси в соли. Значительные потери оксида хлора и паров гипохлористой кислоты из реакционной смеси приводят к значительному снижению выходов, о чем свидетельствует снижение концентрации HOCl в образующихся растворах хлорноватистой кислоты. Твердый хлорид натрия, образующийся в способе изобретения, имеет низкую концентрацию влаги, например меньше 5% предпочтительно меньше 3% более предпочтительно меньше 1 мас. В результате образование хлората сведено к минимуму и его концентрация в частицах хлорида натрия меньше 10 мас. предпочтительно меньше 6 мас.
В непрерывном способе газовую смесь паров хлорноватистой кислоты, паров воды, газообразного хлора и газообразного оксида хлора, образующихся в реакторе, удаляют из реактора и пропускают через сепаратор твердых частиц для удаления любых тонких частиц хлорида натрия, которые могут присутствовать. Полученную газовую смесь, не содержащую твердых частиц, с высокими концентрациями Cl2O можно использовать в качестве источника газообразного оксида хлора, например применять в качестве газообразного отбеливателя. Предпочтительно газовую смесь ожижают для получения водного раствора хлорноватистой кислоты.
Ожижение осуществляют конденсацией газовой смеси. Предпочтительные температуры конденсации те, при которых конденсируется газовая смесь с получением растворов хлорноватистой кислоты, имеющих концентрацию, по меньшей мере, 45 мас. HOCl без образования значительной концентрации твердых веществ. Выбирают температуры конденсации ниже -5oC, например температуры в интервале от -33 до -5oC, предпочтительно от -30 до -7oC, более предпочтительно от -25 до -8oC, и наиболее предпочтительно от -15 до -10oC. Существенно все пары воды газовой смеси конденсируются и газообразный оксид хлора и пары кислоты растворяются в конденсированной воде для получения водного раствора хлорноватистой кислоты, содержащего, по меньшей мере, 45 мас. HOCl, например 48-70% и, предпочтительно 52-65 мас. HOCl.
Конденсацию можно проводить при атмосферном давлении или давлении выше атмосферного. Поскольку отсутствуют полные данные по свойствам высокоактивных высококислотных растворов хлорноватистой кислоты с концентрацией больше 50 мас. HOCl, то может оказаться желательным добавлять в конденсор воду, чтобы поддержать концентрацию полученных растворов ниже 60 мас. HOCl.
Вслед за конденсацией при этих очень низких температурах поразительно снижается концентрация оксида хлора в несконденсированной смеси хлора и оксида хлора до безопасных для нагревания и рециркулирования в реактор уровней при получении газовой смеси. Как показано на фиг. 1, концентрация оксида хлора в несконденсированной газовой смеси много ниже 20 об. уровня. Это обеспечивает повышение безопасности при работе по способу изобретения.
Несконденсированную газовую смесь хлора и оксида хлора, существенно свободную от паров воды, регенерируют для рециркулирования в реактор для получения хлорноватистой кислоты.
Рециркулируемые газы, регенерированные из конденсора, пропускают через теплообменник и подают снова в реактор в качестве нагретой газовой среды. Рециркулируемые газы при температуре от 100 до около 130oC используют как газы-реагенты в получении хлорноватистой кислоты и, вместе с теплотой реакции, в качестве первичного источника тепла. Низкая концентрация оксида хлора в рециркулируемых газах значительно снижает опасность взрыва при нагревании.
В новом способе согласно данному изобретению, если применяют концентрации гидроксида натрия больше 50% то объем и масса рециркулируемых газов также существенно уменьшаются. Фиг. 2 графически показывает уменьшение массы в зависимости от температуры рециркулируемых газов и концентрации NaOH. Рециркулируемая масса это масса, требуемая при данной температуре рециркулируемого газа, для поддержания нужной температуры реактора. Например, при использовании 60% NaOH в реакторе требуемая рециркулируемая масса рециркулируемых газов при 100oC составляет 50000 ед. мас./ед. времени. Для сравнения: применение 50% NaOH в реакторе требует рециркулируемой массы при 100oC в 300000 ед. мас. /ед. времени. Так как рециркулируемые газы содержат непрореагировавший оксид хлора, то желательно поддерживать температуру рециркулируемых газов возможно более низкой, чтобы ограничить термическое разложение Cl2O. Это можно легко достичь в способе изобретения, так как концентрации оксида хлора в рециркулируемом газе много ниже концентраций, считающихся взрывоопасными.
Способ для осуществления изобретения приводит к повышенным выходам хлорноватистой кислоты и обеспечивает экономическую основу для повышенной производительности (фиг. 3). Полученные водные растворы хлорноватистой кислоты являются высоко чистыми и, как результат, обладают значительно улучшенной стабильностью. Концентрированный раствор хлорноватистой кислоты не содержит водных примесей, таких как ионы щелочного металла, хлорид-и хлорид-ионы. Например, концентрация хлорид-ионов меньше 0,005% концентрация ионов щелочного металла меньше 0,005% концентрация хлорат-ионов не больше 0,01% Концентрация растворенного хлора в растворе хлорноватистой кислоты настоящего изобретения замечательно низка и составляет меньше 3% предпочтительно меньше 2 мас.
Концентрированный водный раствор, полученный данным способом, можно использовать в качестве отбеливающего средства и средства санитарной обработки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРИРОВАННЫХ РАСТВОРОВ ХЛОРНОВАТИСТОЙ КИСЛОТЫ | 1991 |
|
RU2015103C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИОКСИДА ХЛОРА (ВАРИАНТЫ) | 1992 |
|
RU2104247C1 |
| СПОСОБ ГАЗОВОЙ ДЕЛИГНИФИКАЦИИ ДРЕВЕСНОЙ ПУЛЬПЫ | 1994 |
|
RU2097461C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРАТОВ ГИПОХЛОРИТОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ | 1992 |
|
RU2026808C1 |
| СПОСОБ ПРОИЗВОДСТВА ПЕРОКСИДА ВОДОРОДА И ХЛОРАТА | 2006 |
|
RU2375500C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИНИТРОТОЛУОЛА | 1993 |
|
RU2106338C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРАТА ЩЕЛОЧНОГО МЕТАЛЛА | 2003 |
|
RU2317351C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДВУОКИСИ ХЛОРА | 1991 |
|
RU2069167C1 |
| СПОСОБ ПОЛУЧЕНИЯ АРИЛТРИАЗОЛИНОНА | 1990 |
|
RU2060994C1 |
| УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ ПРОДУКТОВ ЭЛЕКТРОЛИЗА РАСТВОРА ХЛОРИДА ЩЕЛОЧНОГО МЕТАЛЛА | 2018 |
|
RU2769053C2 |
Использование: изобретение может быть использовано для получения концентрированных растворов хлорноватистой кислоты, известных как отбеливающее средство и как реагент для получения органических соединений, таких как хлорамины и хлоргидрины. Сущность: способ заключается во взаимодействии капелек раствора гидроксида щелочного металла с концентрацией более 50 мас.% с газообразным хлором. Полученная газообразная смесь содержит оксид хлора, хлор, пары хлорноватистой кислоты, пары воды и твердые частицы хлорида щелочного металла. Твердые частицы хлорида щелочного металла отделяют, газообразную смесь конденсируют при температуре от -33oC до -5oC с получением высокочистого раствора хлорноватистой кислоты концентрацией 50-60 мас.% и неконденсированной смеси, содержащей хлор и дихлороксид, с последующим их разделением. 6 з.п. ф-лы, 3 ил.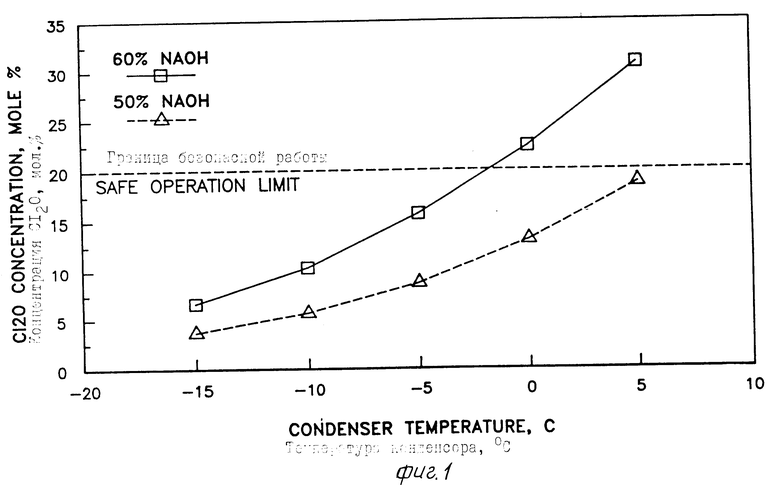
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Патент США N 4146578, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1997-09-27—Публикация
1992-08-03—Подача