Настоящее изобретение относится к способу производства хлората щелочного металла в диафрагменной электрохимической ячейке.
Хлорат щелочного металла и особенно хлорат натрия является важным химическим реагентом, особенно в целлюлозно-бумажной промышленности в качестве сырья для производства диоксида хлора, широко используемого при отбеливании. Традиционно хлорат щелочного металла производят электролизом хлоридов щелочных металлов в открытых бездиафрагменных электролитических ячейках, оснащенных катодами выделения водорода. Общая химическая реакция, протекающая в таких ячейках, следующая:
MCl + 3H2O → MClO3 + 3H2,
где М - щелочной металл.
Этот способ очень эффективен, хотя выделяющийся на катоде газообразный водород создает некоторое перенапряжение, увеличивающее энергопотребление.
Пероксид водорода также широко используется в целлюлозно-бумажной промышленности, и его обычно производят антрахиноновым способом с чередующимся гидрированием и окислением антрахинонов и/или тетрагидроантрахинонов в рабочем растворе. Этот способ, хотя и является очень эффективным, сложен в эксплуатации и требует разнообразного оборудования. До сих пор не было предложено альтернативных конкурентоспособных способов, за исключением относящихся к очень специальным случаям.
В WO 2004/005583 описывается производство хлората щелочного металла в электролитической ячейке, разделенной катионселективным сепаратором на анодную камеру, в которой находится анод, и катодную камеру, в которой находится газодиффузионный электрод. Кислород подают в катодную камеру и подвергают электролизу с образованием гидроксида щелочного металла.
Электрохимическое производство щелочного раствора пероксида водорода путем восстановления кислорода на катоде описывается, например, в US 6322690.
Электрохимическое производство щелочного раствора пероксида водорода путем восстановления кислорода на катоде с одновременным получением хлората натрия описывается в работе E.E. Kalu и C. Oloman «Одновременный электросинтез щелочного пероксида водорода и хлората натрия» ("Simultaneous electrosynthesis of alkaline hydrogen peroxide and sodium chlorate"), Journal of Applied Electrochemistry, 20 (1990), 932-940.
E.L. Gyenge и C.W. Oloman в работах «Электросинтез пероксида водорода в кислых растворах путем опосредованного восстановления кислорода в трехфазной (водной/органической/газовой) системе, Часть I: Структура эмульсии, кинетика электродных процессов и периодический электролиз» ("Electrosynthesis of hydrogen peroxide in acidic solutions by mediated oxygen reduction in a three-phase (aqueous/organic/gaseous) system Part I: Emulsion structure, electrode kinetics and batch electrolysis"), Journal of Applied Electrochemistry, (2003), 33(8), 655-663; и «Электросинтез пероксида водорода в кислых растворах путем опосредованного восстановления кислорода в трехфазной (водной/органической/газовой) системе, Часть II: Эксперименты в проточных электрохимических ячейках с неподвижным слоем и трехфазным потоком» ("Electrosynthesis of hydrogen peroxide in acidic solutions by mediated oxygen reduction in a three-phase (aqueous/organic/gaseous) system. Part II: Experiments in flow-by fixed-bed electrochemical cells with three-phase flow"), Journal of Applied Electrochemistry, (2003), 33(8), 665-674, описывают производство пероксида водорода путем электролитического восстановления 2-этил-9,10-антрахинона до соответствующего антрагидрохинона, растворенного в органической фазе, эмульгированной в воде. Этот антрагидрохинон подвергается реакции с газообразным кислородом с получением пероксида водорода.
В JP 61-284591 и US 4067787 описано производство пероксида водорода путем восстановления водорастворимого производного антрахинона в водном растворе с последующей реакцией с кислородом.
A. Huissoud и P. Tissot в работе «Электрохимическое восстановление 2-этил-9,10-антрахинона на сетчатом стекловидном углероде и опосредованное образование пероксида водорода» ("Electrochemical reduction of 2-ethyl-9,10-anthraquinone on reticulated vitreous carbon and mediated formation of hydrogen peroxide"), Journal of Applied Electrochemistry (1998), 28(6), 653-657, описывают электрохимическое восстановление 2-этил-9,10-антрахинона в диметоксиэтане, содержащем 5% воды и 0,1 моль/литр тетрафторбората тетраэтиламмония.
Электрохимическое восстановление кислорода на углеродном катоде с привитым антрахиноном описано, например, в WO 02/02846, Mirkhalaf, Fakhradin; Tammeveski, Kaido; Schiffrin, David J., «Влияния заместителей на электрокаталитическое восстановление кислорода на модифицированных хиноном стеклоуглеродных электродах» ("Substituent effects on the electrocatalytic reduction of oxygen on quinone-modified glassy carbon electrodes"), Phys. Chem.Chem.Phys.(2004), 6(6), 1321-1327 и Vaik, Katri; Schiffrin, David J.; Tammeveski, Kaido, «Электрохимическое восстановление кислорода на предварительно анодно обработанных и химически привитых стеклоуглеродных электродах в щелочных растворах» ("Electrochemical reduction of oxygen on anodically pre-treated and chemically grafted glassy carbon electrodes in alkaline solutions"), Electrochemistry Communications (2004), 6(1), 1-5.
Vaik, Katri; Sarapuu, Ave; Tammeveski, Kaido; Mirkhalaf, Fakhradin; Schiffrin, David J. в работе «Восстановление кислорода на модифицированных фенантренхиноном стеклоуглеродных электродах в 0,1 М КОН» ("Oxygen reduction on phenanthrenequinone-modified glassy carbon electrodes in 0.1 M KOH"), Journal of Electroanalytical Chemistry (2004), 564(1-2), 159-166, описывают использование катода с привитым фенантренхиноном.
В WO 03/004727 описан электросинтез органических соединений путем электрохимического превращения соединения в присутствии электролита, содержащего ионную жидкость комнатной температуры, и извлечения продукта.
Задачей изобретения является обеспечение эффективного способа производства хлората щелочного металла.
Еще одной задачей изобретения является обеспечение способа, обеспечивающего возможность одновременного производства хлората щелочного металла и пероксида водорода.
Изобретение относится к способу производства хлората щелочного металла, включающему в себя:
обеспечение электрохимической ячейки, содержащей анод и катод в отдельных анодной и катодной камерах;
контактирование катода с католитом, содержащим по меньшей мере один органический медиатор и одну или более органическую или неорганическую кислоты;
реагирование органического медиатора на катоде с образованием по меньшей мере одной восстановленной формы этого медиатора;
реагирование упомянутой по меньшей мере одной восстановленной формы медиатора с кислородом с образованием пероксида водорода;
контактирование анода с анолитом, содержащим хлорид щелочного металла;
реагирование хлорида на аноде с образованием хлора, который гидролизуется; и
реагирование гидролизованного хлора с образованием хлората.
Предпочтительно пероксид водорода отделяют от католита в качестве продукта или используют в качестве реагента для производства других химикатов без выделения из электролита. Однако в случае, если пероксид водорода на данной производственной площадке не нужен, можно также просто уничтожить его, например, путем каталитического разложения.
Анолит может иметь концентрацию хлорид-ионов вплоть до насыщения, предпочтительно от примерно 30 до примерно 300 г/л, более предпочтительно от примерно 50 до примерно 250 г/л, наиболее предпочтительно от примерно 80 до примерно 200 г/л, в расчете на хлорид натрия. Обычно анолит также содержит, по меньшей мере, некоторое количество хлората, предпочтительно от примерно 1 до примерно 1200 г/л, в расчете на хлорат натрия. В одном из вариантов осуществления его предпочтительное содержание составляет от примерно 300 до примерно 650 г/л, наиболее предпочтительно от примерно 500 до примерно 650 г/л, в расчете на хлорат натрия. В другом варианте осуществления его предпочтительное содержание составляет от примерно 1 до примерно 50 г/л, наиболее предпочтительно от примерно 1 до примерно 30 г/л, в расчете на хлорат натрия.
Для стимулирования гидролиза хлора рН в объеме анолита предпочтительно составляет, по меньшей мере, примерно 4, наиболее предпочтительно от примерно 4 до примерно 10. Следует понимать, что могут иметь место локальные отклонения величины рН и, в частности, могут существовать локальные зоны со значительно более низким рН, так как образуются протоны.
Для подавления нежелательных побочных реакций возможно вводить в анолит хромат, дихромат щелочного металла или другой подходящий рН буфер. Если в анолите присутствует хромат или дихромат, его содержание предпочтительно составляет от примерно 0,01 до примерно 10 г/л, наиболее предпочтительно от примерно 0,01 до примерно 6 г/л, в расчете на хромат натрия. Однако также возможно работать, по существу, в отсутствие хромата в анолите.
Если не указано иное, все концентрации в г/л даны относительно объема реального раствора.
Температура анолита предпочтительно составляет от примерно 20 до примерно 100°С, наиболее предпочтительно от примерно 40 до примерно 90°С.
Соответственно, большая часть хлора, образовавшегося в анодной камере, растворяется в растворе-анолите. Растворенный хлор самопроизвольно претерпевает частичный гидролиз с образованием хлорноватистой кислоты в соответствии с уравнением
Cl2 + H2O → HClO + HCl
Хлорноватистая кислота претерпевает диспропорционирование (в некоторых литературных источниках именуемое «автоокислением») до хлората в соответствии с общим уравнением
2HClO + ClO- → ClO3 - + 2Cl- + 2H+
Диспропорционирование может иметь место в данной ячейке, в отдельном хлоратном реакторе или и там, и там.
Предпочтительно анолит из анодной камеры, также именуемый «хлоратным электролитом» и обычно содержащий хлор и/или хлорноватистую кислоту, подают в хлоратный реактор для осуществления реакций диспропорционирования с получением хлората. Хлоратный реактор может быть обычного типа, например, как описанный в US 5419818, и может включать в себя одну или несколько хлоратных емкостей.
Когда диспропорционирование в достаточной мере завершено, хлоратный электролит может быть подан в кристаллизатор для осаждения и извлечения твердого хлората щелочного металла. Маточный раствор из кристаллизатора, обычно содержащий непрореагировавшие хлорид-ионы, гипохлорит и хлорат, затем предпочтительно рециркулируют в анодную камеру электрохимической ячейки для образования анолита вместе со свежедобавленным хлоридом щелочного металла. Также можно использовать хлоратный электролит как таковой без проведения кристаллизации, например, в качестве сырья, подаваемого в генератор диоксида хлора. Такой вариант осуществления является выгодным в интегрированном процессе, в котором обедненный в генераторе раствор из производства диоксида хлора возвращают в анодную камеру электрохимической ячейки для производства хлората.
Производство хлората щелочного металла может быть осуществлено непрерывно, периодически или в смешанном режиме.
Органический медиатор в католите предпочтительно растворен в преимущественно водной или преимущественно органической сплошной жидкой фазе, предпочтительно обладающей удельной электропроводностью при условиях процесса по меньшей мере, примерно 0,1 См/м, более предпочтительно по меньшей мере примерно 1 См/м, наиболее предпочтительно по меньшей мере примерно 3 См/м. Однако возможно также, чтобы органический медиатор был растворен в преимущественно органической фазе, эмульгированной в сплошной, преимущественно водной, фазе.
Органический медиатор представляет собой вещество, способное электрохимически реагировать на катоде с образованием одной или нескольких восстановленных форм, которые, в свою очередь, способны реагировать с предпочтительно молекулярным кислородом и преобразовываться обратно в свою первоначальную форму, тем самым обеспечивая возможность циклического процесса. Реакция восстановленных форм медиатора с кислородом предпочтительно происходит в присутствии протонов. Однако в отсутствие подходящего источника протонов возможно образование пероксидных солей, например Na2O2, которые впоследствии могут быть гидролизованы с получением пероксида водорода. Вне рамок какой-либо теории предполагается, что схема реакции образования пероксида водорода включает перенос двух электронов и двух протонов, происходящий в отдельных или комбинированных одновременных реакциях, и, как предполагается, с участием в качестве промежуточных частиц О2 -·, НОО· и НОО-.
Примеры классов органических веществ, образующих окислительно-восстановительные системы и применимых в качестве медиаторов, включают хиноны, флавохиноны, производные пиридина, такие как никотинамиды, и кетоны.
Подходящие хиноны включают молекулы, содержащие (бензо)хиноновый фрагмент (орто- или пара-формы), среди которых предпочтительными являются антрахиноны, тетрагидрохиноны, нафтохиноны, бензохиноны и их производные. Антрахиноны, нафтохиноны и бензохиноны являются предпочтительно замещенными, например, алкилзамещенными, как 2-алкил-9,10-антрахиноны. Конкретные примеры включают 2-этил-9,10-антрахинон, 2-третбутил-9,10-антрахинон, 2-гексенил-9,10-антрахинон, эвтектические смеси алкил-9,10-антрахинонов, смеси 2-амил-9,10-антрахинонов, причем все они имеют высокую стабильность. Конкретные примеры алкилзамещенных нафтохинонов включают 2-метил-1,4-нафтохинон, 2-этил-1,4-нафтохинон, 2-пропил-1,4-нафтохинон, 2-третбутил-1,4-нафтохинон, 2-третамил-1,4-нафтохинон, 2-изоамил-1,4-нафтохинон, 2,3-диметил-1,4-нафтохинон. Другие примеры заместителей, пригодные для управления реакционной способностью и растворимостью хинонов, включают -SO3H/-SO3 -, -PO2R-, -OPO3R-, -NO2, -OCH3, -SO2CH3, -OPh, -SPh, -SO2Ph, -COOH/-COO-, -CN, -OH, -COCH3, -F, -Cl, -Br, -CF3, -NH2/-NH3 +, -NRH/-NRH2 +, -NR2/-NR2H+, -NR3 +, -PH2/-NH3 +, -SR2 +, -PRH/-PRH2 +, -PR2/-PR2H+ и -PR3 +, где R предпочтительно представляют собой, независимо друг от друга, необязательно замещенный алкил, алкенил, или арил, или водород. Антрахинон может быть одно- или многозамещенным некоторой комбинацией из вышеуказанных и/или других заместителей. Также можно использовать производные хинона с несущими общий заряд заместителями, придающими молекуле ионный характер. Конкретные примеры замещенных не алкилами производных хинона включают антрахинон-2-сульфонат, 5,6,7,8-тетрагидро-9,10-антрахинон-2-сульфонат, антрахинон-2,6-дисульфонат, нафтохинон-2-сульфонат, 2-метокси-1,4-нафтохинон, 2-этокси-1,4-нафтохинон, 2-аминоантрахинон, 2-аминонафтохинон, 2-(алкиламино)-антрахинон, 2-(диалкиламино)-антрахинон, 2-(триалкиламоний)-антрахинон, 2-(алкиламино)-нафтохинон, 2-(диалкиламино)-нафтохинон, 2-(триалкиламмоний)-нафтохинон. Нафтохиноны могут, например, быть замещены в любом положении на боковом кольце, например нафтохинон-6-сульфонат или 6-триалкиламмонийнафтохинон. Также может быть выгодным один заместитель на каждом кольце, как, например, в 6-амилнафтахинон-2-сульфонате или 6-этил-2-триэтиламмонийнафтохиноне. Соответствующими примерами для бензохинона являются бензохинон-2-сульфонат и 2-(этил,диметил)аммоний. Также могут быть использованы антрахиноны и нафтохиноны с частично гидрированными боковыми кольцами, например 1,2,3,4-тетрагидроантрахинон, 5,6,7,8-тетрагидро-2-этилантрахинон, 5,6,7,8-тетрагидронафтохинон. Это также относится к замещенным антра- и нафтохинонам, включая те, которые соответствуют указанным выше типам.
В случае, когда хинон является замещенным и содержит одну или более необязательно замещенную алкильную, алкенильную или арильную группы, является предпочтительным, чтобы эти группы, независимо друг от друга, имели от 1 до 12 атомов углерода, наиболее предпочтительно от 1 до 8 атомов углерода. Если имеется более чем одна такая группа, то они предпочтительно имеют смешанную длину цепей. Алкильные, алкенильные и арильные группы также могут быть замещенными, например, одной или более гидроксильной группой.
Хиноны, включая антрахиноны, тетрагидроантрахиноны, нафтохиноны, бензохиноны и их производные, могут быть восстановлены до соответствующих гидрохинонов путем последовательного присоединения двух электронов и двух протонов. Наряду с хиноном и гидрохиноном, как полагают, присутствуют и являются активными ряд промежуточных форм, таких как семихиноновый радикал и семихиноновый анион, а также основные формы кислого гидрохинона. Все эти восстановленные формы могут реагировать с кислородом и вносить вклад в общую реакцию образования пероксида водорода и исходного хинона.
Другие медиаторные системы, способные восстанавливать кислород до супероксида и впоследствии пероксида водорода, включают флавохиноны, например флавин (см., например, H. Tatsumi и др. в работе «Механистическое исследование автоокисления восстановленных соединений флавина и хинона» ("Mechanistic study of the autooxidation of reduced flavin and quinone compounds") в Journal of Electroanalytical Chemistry (1998), 443, 236-242) и производные пиридина, такие как никотинамид, и их производные.
Другие медиаторные системы образованы кетонами и соответствующими им спиртами. Кетон может быть электрохимически восстановлен до соответствующего спирта, который реагирует с кислородом с образованием пероксида водорода и исходного кетона. Предпочтительными являются вторичные спирты и в особенности фенильные. Пригодные спирты включают изопропиловый спирт, бензиловый спирт, дифенилметанол, метилфенилметанол. Также могут быть использованы вторичные спирты, дополнительно содержащие несущую заряд группу.
Содержание органического медиатора, включая его восстановленные формы, в католите предпочтительно составляет по меньшей мере примерно 0,1 мас.%, более предпочтительно по меньшей мере примерно 1 мас.%, наиболее предпочтительно по меньшей мере примерно 3 мас.%. Оно ограничивается сверху только растворимостью, которая зависит от используемого медиатора и состава жидкой фазы, однако во многих случаях может достигать примерно 10 мас.% или примерно 20 мас.% или даже более. В одном варианте осуществления, в котором значительная часть пероксида водорода образуется вне ячейки, содержание органического медиатора предпочтительно составляет по меньшей мере примерно 1 мас.%, более предпочтительно по меньшей мере примерно 3 мас.%, наиболее предпочтительно по меньшей мере примерно 10 мас.%.
Если католит содержит преимущественно водную сплошную фазу, в которой растворен органический медиатор, эта фаза предпочтительно содержит по меньшей мере примерно 50 мас.%, наиболее предпочтительно по меньшей мере примерно 80 мас.% воды и других неорганических компонентов. Тогда является предпочтительным, чтобы медиатор выбирался из тех, которые обладают высокой растворимостью в воде, например хинонов, имеющих одну или более гидрофильную группу, такую как -SO3H/-SO3 -, -NO2, -COOH/-COO-, -ОН, -NH2/-NH3 +, -NRH/-NRH2 +, -NR2/-NR2H+, -NR3 +, -PH2/-NH3 +, -PRH/-PRH2 +, -PR2/-PR2H+ и -PR3 +, где R предпочтительно представляет собой, независимо друг от друга, водород или необязательно замещенный алкил или алкенил.
Если католит содержит преимущественно органическую сплошную фазу, в которой растворен органический медиатор, эта фаза предпочтительно содержит по меньшей мере примерно 50 мас.%, наиболее предпочтительно по меньшей мере примерно 80 мас.%, органических компонентов и в крайних случаях может, по существу, не содержать неорганических компонентов. Однако является предпочтительным, чтобы содержались по меньшей мере примерно 5 мас.%, наиболее предпочтительно по меньшей мере примерно 20 мас.%, неорганических компонентов. Этими неорганическими компонентами могут быть, например, неорганические ионы солей, образованных как органическими, так и неорганическими ионами.
Сплошная жидкая фаза католита предпочтительно содержит по меньшей мере частично органическую соль, содержащую по меньшей мере один вид органического катиона и/или органического аниона. Ее содержание в сплошной жидкой фазе предпочтительно составляет от примерно 20 мас.% до примерно 99 мас.%, более предпочтительно от примерно 40 мас.% до примерно 95 мас.%, наиболее предпочтительно от примерно 60 мас.% до примерно 90 мас.%.
Сплошная жидкая фаза католита предпочтительно имеет рН меньше 7. Если эта жидкая фаза является преимущественно органической, то этот рН соответствует рН, полученному в воде, поддерживаемой в равновесии с преимущественно органической жидкой фазой.
По меньшей мере частично органическая соль может быть выбрана из группы солей, именуемых ионными жидкостями, т.е. широкого класса жидкостей, по существу, состоящих из ионов. Ионная жидкость может быть простой и содержать один вид анионов и один вид катионов или же может быть сложной и содержать смесь различных анионов и/или различных катионов. Некоторые ионные жидкости имеют низкую температуру плавления и пренебрежимо малое давление паров вблизи или ниже комнатной температуры и часто называются ионными жидкостями комнатной температуры. Такие ионные жидкости обычно остаются жидкими в широком диапазоне температур.
По меньшей мере частично органическая соль может быть также выбрана из солей, которые сами по себе не могут быть классифицированы как ионные жидкости, но обладают такими свойствами, когда присутствуют вместе с нейтральным сорастворителем, таким как вода или низкомолекулярный спирт типа метанола, этанола или пропанола, из которых предпочтительным является вода. Массовое отношение соли к сорастворителю предпочтительно составляет от примерно 1:1 до примерно 1000:1, более предпочтительно от примерно 2:1 до примерно 100:1, наиболее предпочтительно от примерно 5:1 до примерно 20:1.
Предпочтительно использовать такую по меньшей мере частично органическую соль, которая сама по себе или в сочетании с нейтральным сорастворителем образует жидкую фазу при атмосферном давлении ниже примерно 130°С, предпочтительно ниже примерно 100°С, наиболее предпочтительно ниже примерно 80°С. Кроме того, парциальное давление этой соли при 100°С предпочтительно составляет ниже примерно 10 кПа, более предпочтительно ниже примерно 1 кПа, наиболее предпочтительно ниже примерно 0,1 кПа (исключая парциальное давление необязательного нейтрального сорастворителя).
Жидкость с подходящими физическими свойствами может содержать одну по меньшей мере частично органическую соль или смесь двух или более по меньшей мере частично органических солей, предпочтительно в сочетании с одним или более нейтральными сорастворителями, из которых предпочтительным является вода. Она также может содержать анионы и катионы, которые сами по себе не образуют солей с подходящими свойствами.
Такая по меньшей мере частично органическая соль может быть образована различными сочетаниями катионов и анионов, среди которых по меньшей мере один вид иона является органическим. Эти ионы предпочтительно являются одновалентными. Примеры катионов включают 1-алкил-3-метилимидазолий, 1-бутил-3-метилимидазолий [BMIM], 1-этил-3-метилимидазолий [EMIM], 1,2,3-триметилимидазолий, н-алкилпиридиний, н-бутилпиридиний [BPY], пирролидиний, гуанидиний и алкилгуанидиний, изоуроний, PR4 +, NR4 +, SR3 +, тетраметиламмоний, холин, кокомоний и их смеси, где R предпочтительно представляют собой, независимо друг от друга, необязательно замещенный алкил, алкенил, или арил, или водород. Другие примеры включают замещенные хиноны, обозначаемые здесь [Q-NR3 +] и [Q-PR3 +], где Q означает хинон, такой как антрахинон, нафтохинон или бензохиноны, а R - то же, что и выше. Примеры анионов включают гексафторфосфат [HFP], тетрафторборат [TFB], фторсульфонат, гексафторантимонат, гексафторарсенат, хлоралюминат, бромалюминат, бис(трифторметилсульфонил)имид, трис(трифторметилсульфонил)метид, трицианометид, дицианамид, нонафторбутансульфонат, трифторметансульфонат, 2,2,2-трифторэтансульфонат, нитрат, сульфат, фосфат, RPO4 2-, R2PO4 -, R2PO2 - (например, диалкилфосфинат), перхлорат, ацетат, алкилсульфонат, бис(2-этилгексил)натрия сульфосукцинат, диэтиленгликольмонометилэфирсульфат, алкилолигоэфирсульфат, пивалат, тетраалкилборат, пропионат, сукцинат, сахаринат, гликолят, стеарат, лактат, малат, тартрат, цитрат, аскорбат, глютамат, бензоат, салицилат, метансульфонат, толуолсульфонат и их смеси, где R означает то же, что и выше. Другие примеры включают замещенные хиноны, обозначаемые здесь [Q-(O)-SO3 -] и [Q-(O)-PO3R-], где Q означает хинон, такой как антрахинон, нафтохинон или бензохиноны, (О) обозначает необязательный кислород (например, сульфат/сульфонат и фосфат/фосфонат), а R означает то же, что и выше.
В случае, когда любой катион или анион содержит одну или более необязательно замещенную алкильную, алкенильную или арильную группы, предпочтительно, чтобы эти группы, независимо друг от друга, имели от 1 до 12 атомов углерода, наиболее предпочтительно от 1 до 8 атомов углерода. Если имеется более чем одна такая группа, то они предпочтительно имеют смешанную длину цепей. Алкильные, алкенильные и арильные группы также могут быть замещенными, например, одной или более гидроксильной группой.
Примеры солей, применимых в настоящем изобретении, включают любую комбинацию следующих катионов: [1,3-диалкилимидазолий], [триалкиламмоний], [тетраалкиламмоний], [триалкилфосфоний], [тетраалкилфосфоний], [алкилпиридиний], [холин], [Q-NR3 +] и [Q-PR3 +], в сочетании с любым из следующих анионов: [сульфат], [фосфат], [алкилсульфат], [алкилсульфонат], [диалкилфосфат], [алкилфосфонат], [Q-(O)-SO3 -] и [Q-(O)-PO3R-], где Q, (О) и R означают то же, что и выше.
Конкретные комбинации групп включают в себя [1,3-диалкилимидазолий][алкилсульфонат], такой как любой из следующих: [1-бутил-3-метилимидазолий][метил-SO3 -], [1-этил-3-метилимидазолий][этилсульфонат], [1-гексил-3-метилимидазолий][тозилат], [1-бутил-3-метилимидазолий][антрахинон-2-сульфонат] или [1-бутил-3-метилимидазолий][5-третамилнафтохинон-2-сульфонат]; [тетраалкиламмоний][Q-(O)-SO3 -], такие как любой из следующих: [метил,триэтиламмоний][5-третамилнафтохинон-2-сульфонат], [метил,диэтил,бутиламмоний][антрахинон-2-сульфонат] или [холин][5-амилбензохинон-2-сульфонат]; или [Q-NR3 +][алкилсульфонат], такой как [5,6,7,8-тетрагидроантрахинон-2-аминий, н,н,н-(метил,диэтил)][метилсульфонат]; [тетраалкилфосфоний][диалкилфосфат], такой как любой из следующих: [этилтрибутилфосфоний][диэтилфосфат], [фенилтриэтилфосфоний][диизобутилфосфат].
Вне связи с конкретными комбинациями групп возможно множество комбинаций, таких как любая из следующих: [триизобутил(метил)фосфоний][тозилат], [тригексил(тетрадецил)фосфоний][бис-2,4,4-триметилпентилфосфинат] [тетрабутиламмоний][метансульфонат][1-этил-3-метилимидазолий] [HFP], [трипентилсульфоний][дипентил,бензиламмоний], [бензохинон-2-аминий-н,н,н-диэтил,фенил][5,6,7,8-тетрагидро-9,10-антрахинон-2-сульфонат], [холин][5-этокси-1,4-нафтохинон-6-сульфат], [н-пропилпиридиний][сахаринат].
Кроме упомянутых выше, могут быть использованы также и другие виды имеющихся в продаже или иным образом известных ионных жидкостей или солей, обладающих такими свойствами в сочетании с нейтральным сорастворителем.
Также можно использовать соль, в которой по меньшей мере один из ионов также действует в качестве медиатора, который подвергается реакции на катоде с образованием восстановленной формы и таким образом участвует в циклическом процессе получения пероксида водорода. В этом случае используемый медиатор может частично или полностью состоять из ионов такой соли. Примеры включают соли, содержащие катион или анион замещенного хинона или производного никотинамида, такого как упомянутые выше.
Использование по меньшей мере частично органической соли, как описано выше, в составе сплошной фазы электролита обеспечивает преимущества комбинирования высокой растворимости органических медиаторов, таких как хиноны, с хорошей электропроводностью. Другим преимуществом является очень низкая воспламеняемость, что дает возможность безопасно осуществлять реакцию с кислородом при более высоких концентрациях кислорода и более высокой температуре, чем было бы возможно при использовании обычных воспламеняющихся растворителей. Также облегчается отделение от него пероксида водорода, например, путем выпаривания или экстракции и тем самым получение пероксида водорода либо высокой чистоты, либо в подлежащей дальнейшей переработке смеси с выбранным соединением, например водой. Другим примером является смесь метанол/пероксид водорода для использования в качестве реагента в реакции эпоксидирования. Использование ионных жидкостей для образования пригодной для проведения реакций с участием пероксида водорода среды было описано в работе B. Chhikara и др. «Окисление спиртов пероксидом водорода, катализируемое новым ионом имидазолия на основе фосфорновольфраматного комплекса в ионной жидкости» ("Oxidation of alcohols with hydrogen peroxide catalyzed by a new imidazolium ion based phosphotungstate complex in ionic liquid"), Journal of Catalysis 230 (2005, 436-439).
Католит дополнительно содержит одну или более органическую или неорганическую кислоты, такие как муравьиная кислота, уксусная кислота, монохлоруксусная кислота, бензойная кислота, сульфоновые кислоты, фосфоновые кислоты, азотная кислота, серная кислота, хлористоводородная (соляная) кислота, йодистоводородная кислота, бромистоводородная кислота, хлорная кислота или фосфорная кислота.
Католит также может содержать и другие компоненты. Например, преимущественно органическая сплошная жидкая фаза может содержать, как упоминалось ранее, нейтральный сорастворитель, предпочтительно воду. Количество нейтрального сорастворителя предпочтительно составляет вплоть до примерно 50 мас.%, наиболее предпочтительно от примерно 1 до примерно 20 мас.%. Особенно предпочтительное содержание нейтрального сорастворителя может составлять, например, от примерно 1 до примерно 5 мас.% или от примерно 5 до примерно 10 мас.%. Примеры других необязательных добавок включают стабилизаторы пероксида водорода, эмульгаторы, ингибиторы коррозии, противовспениватели, буферы, усилители проводимости, понизители вязкости и т.д. Примеры стабилизаторов пероксида водорода включают широко используемые для этой цели стабилизаторы, такие как фосфорная кислота, комплексообразующие вещества на основе фосфоновой кислоты, защитные коллоиды типа станната щелочного металла и поглотители радикалов типа пиридинкарбоновых кислот. К примерам комплексообразующих веществ на основе фосфоновой кислоты относятся 1-гидроксиэтилиден-1,1-дифосфоновая кислота, 1-аминоэтан-1,1-дифосфоновая кислота, аминотри(метиленфосфоновая кислота), этилендиаминтетра(метиленфосфоновая кислота), гексаметилендиаминтетра(метиленфосфоновая кислота), диэтилентриаминпента(метиленфосфоновая кислота), диэтилентриамингекса(метиленфосфоновая кислота), 1-аминоалкан-1,1-дифосфоновые кислоты (такие как морфолинметандифосфоновая кислота, н,н-диметиламинодиметилдифосфоновая кислота, аминометилдифосфоновая кислота), продукты их реакции и их соли, предпочтительно соли натрия.
Предпочтительно, чтобы преимущественно органическая жидкая фаза в католите имела вязкость при рабочих условиях ниже примерно 100 мПа·с, более предпочтительно ниже примерно 30 мПа·с, а наиболее предпочтительно ниже примерно 10 мПа·с. Кроме того, из-за опасностей, с которыми сопряжено обращение с, по существу, чистым пероксидом водорода, извлекаемый продукт предпочтительно представляет собой смесь пероксида водорода с водой или низкомолекулярными спиртами, например метанолом. Парциальное давление при 100°С жидких компонентов, которые не составляют часть смеси-продукта, должно предпочтительно быть ниже примерно 10 кПа, более предпочтительно ниже примерно 1 кПа, наиболее предпочтительно ниже 0,1 кПа.
Электрохимическая ячейка может включать в себя только одну камеру для анода и одну для катода или же может дополнительно включать в себя одну или несколько камер в промежутке между ними, например электродиализный пакет, позволяющий осуществлять любой известный электродиализ. Средство для разделения этих камер может представлять собой неселективный физический барьер, например пористую мембрану или диафрагму, или же оно может быть селективно проницаемым для некоторых частиц, таких как катионы или анионы. Также может быть использовано сочетание мембран, такое как биполярные мембраны, позволяющие разделять воду на протоны и гидроксид-ионы. Неселективные барьеры могут быть изготовлены, например, из асбеста, керамики, стекла, полиолефинов, политетрафторэтилена (ПТФЭ), поливинилхлорида (ПВХ) и т.д. Катионселективные мембраны могут быть изготовлены, например, из органических полимеров, таких как ПТФЭ, полистирол, стирол/дивинилбензол или винилпиридин/дивинилбензол, модифицированный кислотными группами, такими как сульфонат, карбоксилат или фосфонат. Анионселективные мембраны могут быть изготовлены, например, из органических полимеров, таких как ПТФЭ, полистирол, стирол/дивинилбензол или винилпиридин/дивинилбензол, модифицированный основными группами, такими как четвертичный аммоний. Биполярные мембраны могут содержать проницаемую для анионов мембрану и проницаемую для катионов мембрану, наслоенные вместе, необязательно - со слоем катализатора между ними. Ионселективные и биполярные мембраны имеются в продаже, например, под товарными знаками Nafion™, Flemium™, Neosepta bipolar®.
Электролит в катодной камере может содержать одну, две или более жидких фаз. В системе с одной жидкой фазой имеется только преимущественно органическая или преимущественно водная жидкая фаза электролита. В системе с двумя жидкими фазами несплошная фаза может быть эмульгирована или просто смешана в сплошной жидкой фазе. Если имеется более чем одна жидкая фаза, то компоненты в электролите будут распределяться между этими фазами в зависимости от их свойств растворимости. Помимо жидкой фазы или фаз также могут присутствовать газ и/или твердые вещества.
Температура и давление в катодной камере могут быть такими же, как в анодной камере, или отличающимися от анодной камеры и предпочтительно задаются так, что католит является жидкостью. Высокая температура способствует низкой вязкости, высокой электропроводности и высоким скоростям массопереноса, тогда как низкая температура способствует стабильности пероксида водорода и компонентов в электролите. Обычно температура предпочтительно составляет от примерно 0 до примерно 200°С, более предпочтительно от примерно 40 до примерно 150°С, наиболее предпочтительно от примерно 60 до примерно 100°С. Давление предпочтительно составляет от примерно 10 до примерно 30000 кПа, более предпочтительно от примерно 80 до примерно 2000 кПа, наиболее предпочтительно от примерно 100 до примерно 800 кПа.
Реакция одной или более восстановленных форм медиатора и кислорода с образованием пероксида водорода может происходить внутри ячейки или в отдельной емкости или и там, и там, обычно приводя к образованию пероксида водорода в католите и повторному образованию медиатора для участия в другом реакционном цикле. Обычно к электролиту, содержащему восстановленный медиатор, добавляют молекулярный кислород, но часть его может происходить из кислорода, образовавшегося в ходе анодных реакций и перенесенного через электролит в ячейке, необязательно - через мембрану, или выделенного в виде отдельного потока и повторно введенного в ячейку. Молекулярный кислород может быть добавлен растворенным в жидкости или в виде любого кислородсодержащего газа, такого как воздух, обогащенный кислородом воздух или, по существу, чистый кислород. Добавление по меньшей мере части кислорода в виде газа непосредственно в ячейку обеспечивает преимущество улучшения перемешивания, а также может создавать газлифт для переноса электролита из ячейки, альтернативно вносить вклад в отгонку пероксида водорода из электролита. Добавление кислорода непосредственно в ячейку может позволить завершить полный каталитический цикл медиатора внутри ячейки, по существу, устраняя необходимость выводить поток, содержащий восстановленную форму медиатора, и подавать поток, содержащий медиатор. Реакции, в результате которых образуется пероксид водорода, облегчаются благодаря присутствию протонов, которые могут происходить из любого доступного источника, такого как вода, гидрохинон, протоны, образующиеся на аноде, или любая кислота, которая была добавлена к электролиту. Если реакция с кислородом происходит в отдельной емкости, условия в ней типа температуры, давления и т.д. могут быть такими же самыми, как и преобладающие в ячейке, или отличающимися от них. Температура предпочтительно составляет от окружающей, например, примерно 20°С, до верхнего предела, определяемого либо воспламеняемостью растворителя, либо стабильностью пероксида водорода, например, до примерно 70°С. Давление предпочтительно составляет от примерно атмосферного до примерно 5 бар манометрического давления. Обычно, предпочтительным является использование барботажной колонны либо насадочной, либо с ситчатыми тарелками. Кислородсодержащий газ подают предпочтительно снизу, а жидкость протекает либо снизу вверх, либо сверху вниз.
Для отделения пероксида водорода от электролита могут быть использованы различные способы, такие как выпаривание, экстракция или мембранные технологии. Такое разделение может происходить в ячейке, в отдельном оборудовании, из которого оставшийся электролит затем рециркулируют назад в ячейку, или и там, и там.
В одном варианте осуществления пероксид водорода выпаривают из преимущественно органической фазы электролита, предпочтительно вместе с водой и, необязательно, с другими летучими веществами, которые могут присутствовать. Выпаривание может осуществляться непосредственно из ячейки или из отдельной емкости, например, путем отгонки с любым газом, например кислородом, воздухом или азотом, либо путем дистилляции при атмосферном давлении или давлении ниже атмосферного. Низкое давление паров упомянутой по меньшей мере частично органической соли и других органических веществ, необязательно присутствующих в электролите и не являющихся частью желательной смеси-продукта, содействует применению технологий выпаривания для отделения пероксида водорода. В этом варианте осуществления возможно получить содержащий пероксид водорода поток продукта высокой чистоты без сложных стадий очистки.
В другом варианте осуществления пероксид водорода экстрагируют из преимущественно органической жидкой фазы любым подходящим растворителем, таким как вода или метанол. Могут быть применены все широко используемые технологии экстракции, такие как в одном или нескольких смесителях-отстойниках, колоннах с ситчатыми тарелками, колоннах со слоем насадки. Если используется электролит, также содержащий преимущественно водную фазу, то пероксид водорода будет автоматически обогащаться в этой фазе, которая может быть извлечена в качестве продукта, альтернативно подвергнута дистилляции или другому виду очистки и рециркулирована обратно в ячейку.
В еще одном варианте осуществления используется мембранное разделение. Примеры таких способов включают мембранную экстракцию, первапорацию (испарение через полупроницаемую мембрану) и нанофильтрацию.
В еще одном варианте осуществления медиатор и его восстановленные формы растворены в преимущественно водной фазе. Если окисление восстановленных форм медиатора также происходит в преимущественно водной фазе, то пероксид водорода может быть отделен путем, например, дистилляции. Другой вариант состоит в том, чтобы сохранять преимущественно водную фазу, по существу, свободной от кислорода и перевести, например, путем экстракции восстановленные формы медиатора в преимущественно органическую фазу и затем осуществить окисление.
В еще одном варианте осуществления пероксид водорода не извлекают из электролита, а используют непосредственно в качестве реагента при производстве других химикатов. Электролит, оставшийся после таких реакций, может затем быть рециркулирован в ячейку.
Такое производство пероксида водорода предпочтительно осуществляют непрерывно, либо с протеканием электролита через ячейку, либо при непрерывном выделении пероксида водорода из электролита в ячейке. Предпочтительно обеспечить надлежащее перемешивание, особенно вокруг катода, например, продувки газом, механического перемешивания, циркуляции электролита или их комбинаций. Продувку газом предпочтительно проводят кислородом или кислородсодержащим газом, таким как воздух. В ячейке с, по существу, вертикальным потоком продувка газом может также создавать газлифт, усиливающий перенос электролита через ячейку, альтернативно отгонке пероксида водорода, необязательно вместе с водой или любым другим компонентом, который при температуре и давлении эксплуатации является летучим.
Чтобы избежать вредного накопления примесей из исходных химикатов или продуктов разложения, образующихся в результате побочных реакций, в некоторых случаях может оказаться целесообразным выпускать из системы часть электролита и/или очистка различными способами, как то электродиализ, адсорбция, перекристаллизация, осаждение, промывка, ионный обмен, выпаривание или отгонка с газом-носителем, реакционная регенерация с кислотно/основной или восстановительно/окислительной стадиями.
Поскольку в результате побочной реакции на катоде может образовываться газообразный водород, может оказаться полезным наличие газоанализатора и устройства для продувки инертным газом.
Температура может регулироваться любыми подходящими средствами, например, при помощи теплообменников при любом соответствующем потоке. Охлаждение также может быть осуществлено путем выпаривания, например, в электрохимической ячейке с последующей конденсацией пара. Если охлаждение выпариванием осуществляется при помощи воды, может быть целесообразным добавлять воду специально с этой целью.
Анод может быть изготовлен из любого пригодного материала, например титана, титанового сплава. Анод предпочтительно имеет покрытие, например, из RuO2/TiO2, RuO2/TiO2/IrO2 или Pt/Ir. Особенно предпочтительными анодами являются DSA™ (размеростабильный анод).
Могут быть использованы различные виды катодов. Предпочтительно, чтобы катод был изготовлен из материала, подавляющего паразитные реакции, такие как выделение водорода, прямое восстановление кислорода до воды и разложение органического медиатора, ионной жидкости или образовавшегося пероксида водорода. В большинстве случаев предпочтительно использовать катод с гидрофобной поверхностью. Примеры материалов для изготовления катода включают материалы на основе углерода, такие как легированный бором алмаз, графит, стеклоуглерод, высокоориентированный пиролитический графит, сетчатый углерод и проводящие полимеры. Примеры проводящих полимеров включают поли(пара)фенилен, полипиррол, политиофен и полианилин. Проводящий полимер может быть нанесен в виде тонкой пленки с предпочтительной толщиной от примерно 0,1 до примерно 100 мкм на любую подходящую подложку, такую как Pt или нержавеющая сталь. Такая полимерная пленка может быть получена путем химического синтеза или предпочтительно электросинтеза. Конкретным примером является катод, полученный путем электросинтеза пленки полипиррола на нержавеющей стали. Другие примеры материалов катода включают металлы, такие как железо, сталь, свинец, никель, титан или платина, или проводящие оксиды металлов, такие как PbO2, NiO2, Ti4O7, NiCo2O4 или RuO2. Другие примеры включают электрокаталитические катоды из материала типа титана или титанового сплава, покрытого, полностью или частично, частицами благородных металлов, таких как золото, платина, палладий, или с привитыми катализаторами для антрахинонов.
Катод и анод могут быть изготовлены с различными геометрическими формами и могут, например, принимать вид плоского листа или пластины, искривленной (неплоской) поверхности, криволинейной поверхности, перфорированной пластины, тканой проволочной сетки, растянутого сетчатого листа, стержня или трубки. Однако предпочтительно анод и катод имеют плоскую форму, наиболее предпочтительно в виде листа, сетки или пластины.
Может быть использована любая традиционная конструкция ячейки, предпочтительно с наименьшим возможным расстоянием между анодом и катодом. Разделенная ячейка может, например, относиться к типу ячеек «с нулевым зазором», в которых по меньшей мере один из электродов прижат к мембране, разделяющей ячейку.
Обычная производственная установка включает в себя множество ячеек для достижения нужной производительности. Эти ячейки могут быть скомпонованы по монополярному или биполярному принципу в электролизер в соответствии с любой традиционной конструкцией.
Далее будут дополнительно описаны некоторые варианты осуществления изобретения в связи с прилагаемыми схематичными чертежами. Однако объем изобретения этими вариантами осуществления не ограничивается. На фиг.1 показана принципиальная схема катодной части способа, а на фиг.2, 3 и 4 приведены схематичные конструкции различных электрохимических ячеек.
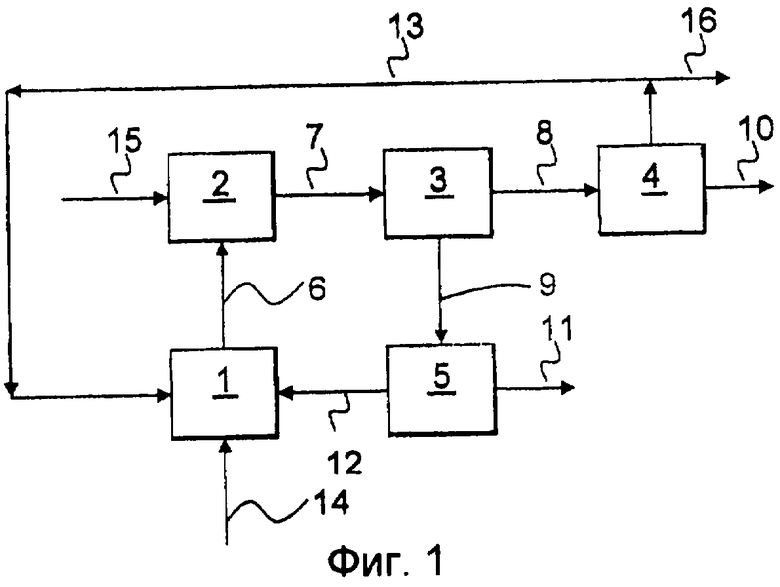
Обращаясь к фиг.1, электрохимическое восстановление медиатора происходит в преимущественно органической сплошной фазе электролита в камере 1 ячейки, которая может быть катодной камерой или однокамерной ячейкой. Исходный поток 14 снабжает камеру 1 ячейки любыми веществами, которые расходуются в этом процессе, такими как кислород, или отводятся в любом нерециркулируемом потоке продукта, такими как вода или инертный газ, такой как азот. Если присутствует кислород, то в камере 1 ячейки также может происходить реакция между восстановленной формой или формами медиатора и кислородом с образованием пероксида водорода или пероксида щелочного металла. Если эта реакция протекает в достаточной большой степени, то достаточно отводить пероксид водорода вместе с, например, водой в виде потока 6. Если реакция с образованием пероксида водорода или пероксида щелочного металла идет не до конца, то электролит выводят и эту реакцию завершают до нужной степени в реакторе 2 окисления, куда может быть подан дополнительный кислород 15. Образующийся в результате поток 7 содержит пероксид водорода или пероксид щелочного металла в одной или нескольких формах в зависимости от используемых условий, например, в виде пара или растворенный в жидкой фазе. Если имеется и газовая, и по меньшей мере одна жидкая фаза, то их направляют в газожидкостный сепаратор 3, из которого газовый поток 8 направляют в конденсатор 4. Продукт пероксид водорода 10 отводят из конденсатора 4, а оставшийся газ 13, например кислород, водяной пар и другие необязательные компоненты, либо рециркулируют в любое место, где может быть использован кислород, как то камера 1 ячейки или реактор 2 окисления, либо выпускают через 16. Поток 9 жидкости из сепаратора 3 рециркулируют в камеру 1 ячейки. Если поток 9 жидкости содержит пероксид водорода, то сначала его направляют в сепаратор 5, который может представлять собой, например, установку экстракции или установку мембранного разделения. Здесь этот поток 5 разделяется на поток 11 продукта 11, содержащий пероксид водорода, и рециркулируемый поток 12, содержащий преимущественно органический электролит.
Различные установки, показанные на фиг.1, могут быть скомбинированы множеством способов. Например, кислород может быть введен в камеру 1 ячейки различными способами, например, отдельно или вместе с любым жидким исходным или рециркулируемым потоком. Кислород может быть также введен в некотором месте выше электродов с целью разделения электрохимических реакций и окисления. Реактор 2 окисления и газожидкостный сепаратор 3 могут быть совмещены, например, путем использования барботажной колонны. Если условия эксплуатации заданы так, что газ не образуется, и из камеры 1 ячейки отводится только жидкая фаза, то газожидкостный сепаратор 3 и конденсатор 4 могут быть исключены.
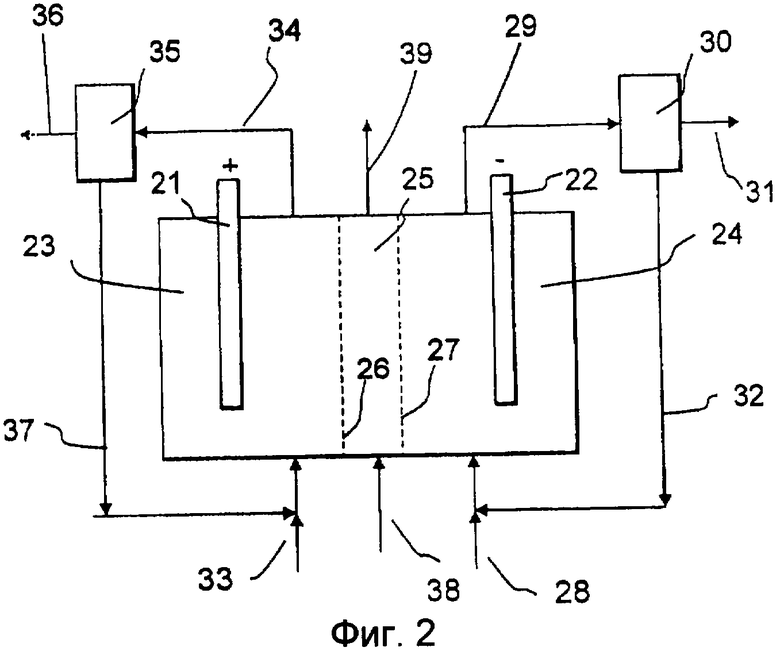
Обращаясь к фиг.2, электрохимическая ячейка, функционирующая согласно изобретению, включает в себя анод 21 в анодной камере 23 и катод 22 в катодной камере 24. Эта ячейка также включает в себя среднюю камеру 25, отделенную от анодной и катодной камер 23 и 24 ионоселективными мембранами 26 и 27. В одном варианте осуществления мембрана 26 является проницаемой для анионов, а мембрана 27 - проницаемой для катионов. В другом варианте осуществления обе мембраны 26 и 27 являются проницаемыми для катионов. В катодной камере 24 содержится католит, содержащий органический медиатор согласно изобретению. Кислородсодержащий газ подают с помощью входящего потока 28 в катодную камеру 24, а выходящий поток 29, содержащий пероксид водорода и/или восстановленный медиатор, направляют в установку 30, где происходит дальнейшая переработка. Такая дальнейшая переработка может включать в себя окисление восстановленного медиатора с получением пероксида водорода и его отделение, приводящее к образованию потока 31 продукта, содержащего пероксид водорода и, необязательно, другие вещества, такие как вода, которые могут оставаться в конечном продукте, и другие, которые могут быть выделены позже, и рециркулируемого потока 32, содержащего, например, католит с органическим медиатором, полученным при окислении его восстановленных форм. В анодную камеру 23 подают входящий поток 33, который может иметь различные составы в зависимости от желательных реакций. Анолит, содержащий продукты реакции, выводят в виде выходящего потока 34 в сепаратор 35 продукта, из которого отводят продукт 36, а оставшийся электролит 37 рециркулируют в анодную камеру 23. В среднюю камеру 25 подают входящий поток 38 с предпочтительно водным раствором, состав которого зависит от желательных общих реакций. Выходящий из средней камеры 25 поток 39 может быть рециркулирован или использован любым другим образом.
Если ячейка по фиг.2 используется в варианте осуществления, в котором мембрана 26 является анионселективной, мембрана 27 является катионселективной, а хлорид подвергается реакции на аноде с образованием хлора, который может быть гидролизован далее с образованием хлорноватистой кислоты и в итоге хлората, то анолит предпочтительно является водным раствором, содержащим NaCl, NaClO3 или соответствующие соли калия KCl или KClO3 и, необязательно, буфер, такой как хромат, дихромат или любая другая подходящая соль. Поток 34 продукта-анолита отводят и направляют в сепаратор 35 продукта, где хлорат щелочного металла кристаллизуют и отводят 36, а оставшийся электролит рециркулируют 37 в анодную камеру 23. Также возможно предусмотреть установку (не показана), например хлоратный реактор, для осуществления дальнейших реакций с образованием хлората диспропорционированием хлорноватистой кислоты в отводимом потоке 34 продукта до кристаллизации. В одном из вариантов в среднюю камеру 39 предпочтительно подают с помощью входящего потока 38 растворитель типа воды, содержащий HCl или NaCl, и хлорид-ионы переносятся сквозь анионселективную мембрану 26 в анодную камеру 23, где они расходуются на аноде 21 с образованием хлора на первой стадии. Затем в катодную камеру 23 подают Na+ или K+ с помощью входящего потока 33, например, в форме NaOH или KOH. В другом варианте в среднюю камеру с помощью входящего потока 38 подают OH-, например, в виде NaOH или KOH, гидроксид-ионы будут переноситься сквозь анионселективную мембрану 26, а затем с помощью входящего потока 33 подают хлорид-ионы, например, в виде NaCl. В любом из этих вариантов катионы, обычно Na+ или H+, переносятся из средней камеры 25 через катионселективную мембрану 27 в катодную камеру 24.
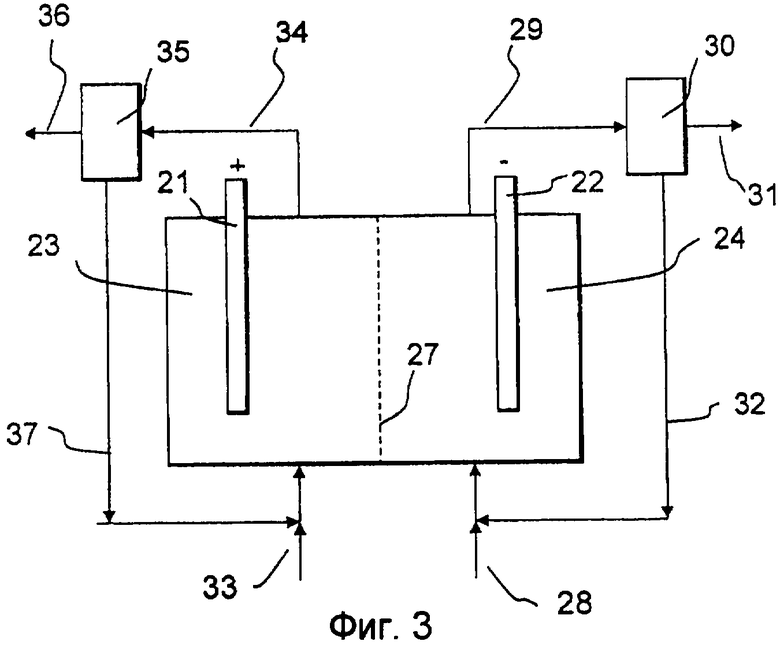
Обращаясь к фиг.3, электрохимическая ячейка, функционирующая согласно изобретению, включает в себя анод 21 в анодной камере 23 и катод 22 в катодной камере 24. Однако в отличие от ячейки по фиг.2 здесь имеется только одна ионоселективная мембрана 27, которая предпочтительно является катионселективной, а средняя камера отсутствует. Во всех других отношениях эта ячейка идентична ячейке по фиг.2, к описанию которой отсылается читатель.
Если ячейка по фиг.3 снабжена катионселективной мембраной 27 и используется в варианте осуществления, в котором хлорид реагирует на аноде 21 с образованием хлора, который гидролизуется далее с образованием хлората, то анолит предпочтительно является водным раствором, содержащим NaCl, NaClO3 или соответствующие соли калия KCl или KClO3 и буфер, такой как хромат, дихромат или любая другая подходящая соль. NaCl или KCl подают в анодную камеру 23 с помощью входящего потока 33, при этом катионы, такие как Na+ или H+, переносятся сквозь мембрану 27 в катодную камеру 24. Чтобы компенсировать убыль Na+ или K+ через мембрану 27 и нейтрализовать H+, образующийся в ходе анодных реакций, может оказаться целесообразным добавить в любое подходящее место некоторое количество NaOH или KOH, например, во входящий поток 33 или рециркулируемый поток 37. Во всех остальных отношениях, таких как манипулирование потоком 34 продукта и рециркулируемым потоком 37, функционирование эквивалентно соответствующему варианту осуществления, реализованному в ячейке по фиг. 2, к описанию которой отсылается читатель.
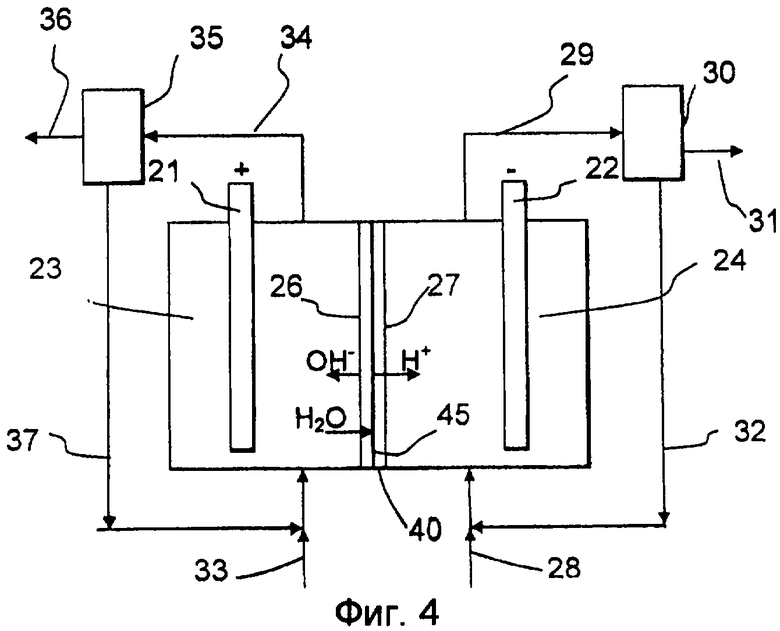
Обращаясь к фиг.4, электрохимическая ячейка, функционирующая согласно изобретению, включает в себя анод 21 в анодной камере 23 и катод 22 в катодной камере 24. Однако в отличие от ячейки по фиг.2 средняя камера здесь заменена биполярной мембраной 40, разделяющей камеры 23 и 24 ячейки. Биполярная мембрана 40 включает анионселективную мембрану 26 и катионселективную мембрану 27, наслоенные вместе с двух сторон слоя 45 катализатора. Вода из анолита проходит в слой катализатора, где она расщепляется на протоны, проходящие в катодную камеру 24, и гидроксид-ионы, проходящие в анодную камеру 23. Во всех остальных отношениях данная ячейка идентична ячейкам по фиг.2 и 3, к описанию которых отсылается читатель.
Если ячейка по фиг.4 используется в варианте осуществления, в котором хлорид реагирует на аноде 21 с образованием хлора, который подвергается реакции далее в хлорат, то анолит предпочтительно является водным раствором, содержащим NaCl, NaClO3 или соответствующие соли калия KCl или KClO3 и буфер, такой как хромат, дихромат или любая другая подходящая соль. NaCl или KCl подают в анодную камеру 23 с помощью входящего потока 33. Внутри биполярной мембраны вода расщепляется на протоны и гидроксид-ионы. Протоны перемещаются в катодную камеру 24 и содействуют окислению восстановленного медиатора с образованием пероксида водорода, а гидроксид-ионы перемещаются в анодную камеру 23, содействуя гидролизу хлора. Во всех остальных отношениях, таких как манипулирование потоком 34 продукта и рециркулируемым потоком 37, функционирование эквивалентно соответствующему варианту осуществления, реализованному в ячейке по фиг.2, к описанию которой отсылается читатель.
Во всех вариантах осуществления, описанных со ссылкой на фиг.2-4, катодный процесс может быть идентичным, то есть заключаться в восстановлении медиатора на катоде 22 и переносе катионов типа Na+ или H+ из средней камеры 25 или анодной камеры 23 через катионселективную мембрану 27.
Далее изобретение будет дополнительно описано с помощью следующего примера. Если не указано иное, все доли и процентные содержания выражаются как доли и проценты по массе.
Пример
Раствор, содержащий 50 мл ионной жидкости 1-бутил-3-метилимидазолий гексафторфосфата [BMIM][HFP] с 0,8 г 2-этил-9,10-антрахинона (EAQ), залили в катодную камеру небольшого реактора. Этот раствор в течение 30 мин продували насыщенным водой газообразным азотом для растворения газов в растворе и для насыщения раствора водой до расчетного содержания примерно 3-5 мас.%. Поверх органической фазы добавили водную фазу из 40 мл 0,5М H2SO4 для подачи протонов. Катод в виде круглой платиновой сетки диаметром 3 см поместили в органическую фазу, а анод из платиновой сетки поместили в отдельную камеру, содержащую 10 мМ водный раствор NaOH. Анодная и катодная камеры были разделены неселективной керамической мембраной (диафрагмой). Католит перемешивали при помощи магнитного стержня, расположенного в органической фазе в катодной камере. Для контроля катодного потенциала в катодной камере недалеко от катода поместили каломелевый электрод сравнения. В анодной камере содержался водный раствор 150 г/л NaCl и 10 г/л дихромата натрия. При температуре 68°С между катодом и анодом пропустили ток 0,2 А. В ходе этого эксперимента в анолит добавили несколько капель NaOH (1М) с целью поддержания рН между 6 и 7. В катодной камере образовывался пероксид водорода. В анодной камере хлорид окислялся до хлора, который в итоге образовывал хлорат. Через 20 минут эксперимент завершили и вычислили выход по току для образования хлората, составивший 59%.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭЛЕКТРОСИНТЕЗ ПЕРОКСИДА ВОДОРОДА | 2006 |
|
RU2380460C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЩЕЛОЧНОГО РАСТВОРА ПЕРОКСИДА ВОДОРОДА И ДИОКСИДА ХЛОРА | 2000 |
|
RU2221741C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРЕКИСИ ВОДОРОДА | 2010 |
|
RU2494960C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНОГО ПОДКИСЛЕННОГО РАСТВОРА, СОДЕРЖАЩЕГО ХЛОРАТНЫЕ ИОНЫ, СПОСОБ ЭЛЕКТРОХИМИЧЕСКОЙ ОБРАБОТКИ ВОДНОГО РАСТВОРА СМЕСИ СОЛЕЙ ЩЕЛОЧНЫХ МЕТАЛЛОВ, СПОСОБ ПОЛУЧЕНИЯ ДВУОКИСИ ХЛОРА | 1991 |
|
RU2108413C1 |
| ЭЛЕКТРОПРЕОБРАЗОВАТЕЛЬНАЯ ЯЧЕЙКА | 1996 |
|
RU2186442C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ДИОКСИДА ХЛОРА | 1991 |
|
RU2112817C1 |
| СПОСОБЫ ОДНОВРЕМЕННОГО ЭЛЕКТРОЛИТИЧЕСКОГО ДЕКАРБОКСИЛИРОВАНИЯ И ВОССТАНОВЛЕНИЯ САХАРОВ | 2014 |
|
RU2694908C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДВУОКИСИ ХЛОРА | 1994 |
|
RU2084557C1 |
| ЭЛЕКТРОЛИЗНАЯ СИСТЕМА ДЛЯ ЭЛЕКТРОХИМИЧЕСКОЙ УТИЛИЗАЦИИ ДИОКСИДА УГЛЕРОДА С ПРОТОНОДОНОРНЫМ БЛОКОМ И СПОСОБ ВОССТАНОВЛЕНИЯ | 2016 |
|
RU2685421C1 |
| Электрохимический способ получения двуокиси хлора | 1988 |
|
SU1836492A3 |
Изобретение относится к способу производства хлората щелочного металла, включающему в себя: обеспечение электрохимической ячейки, содержащей анод и катод в отдельных анодной и катодной камерах; контактирование катода с электролитом, содержащим по меньшей мере один органический медиатор и одну или более органическую или неорганическую кислоты; реагирование органического медиатора на катоде с образованием по меньшей мере одной восстановленной формы этого медиатора; реагирование упомянутой по меньшей мере одной восстановленной формы медиатора с кислородом с образованием пероксида водорода; контактирование анода с анолитом, содержащим хлорид щелочного металла; реагирование хлорида на аноде с образованием хлора, который гидролизуется; и реагирование гидролизованного хлора с образованием хлората. Способ обеспечивает повышение эффективности производства хлората щелочного металла. 18 з.п. ф-лы, 4 ил.
1. Способ производства хлората щелочного металла, включающий в себя:
обеспечение электрохимической ячейки, содержащей анод и катод в отдельных анодной и катодной камерах;
контактирование катода с электролитом, содержащим по меньшей мере один органический медиатор и одну или более органическую или неорганическую кислоты;
реагирование органического медиатора на катоде с образованием по меньшей мере одной восстановленной формы этого медиатора;
реагирование упомянутой по меньшей мере одной восстановленной формы медиатора с кислородом с образованием пероксида водорода;
контактирование анода с анолитом, содержащим хлорид щелочного металла;
реагирование хлорида на аноде с образованием хлора, который гидролизуется; и
реагирование гидролизованного хлора с образованием хлората.
2. Способ по п.1, в котором концентрация хлорид-ионов в анолите составляет от примерно 30 до примерно 300 г/л в расчете на хлорид натрия.
3. Способ по п.1, в котором рН в объеме анолита составляет от примерно 4 до примерно 10.
4. Способ по любому из пп.1-3, в котором электрохимическая ячейка содержит по меньшей мере одну камеру между анодной и катодной камерами.
5. Способ по любому из пп.1-3, в котором органический медиатор выбирают из группы, состоящей из хинонов, флавохинонов, производных пиридина и кетонов.
6. Способ по п.5, в котором органический медиатор выбирают из группы, состоящей из хинонов, содержащих (бензо)хиноновый фрагмент.
7. Способ по п.6, в котором органический медиатор выбирают из группы, состоящей из антрахинонов, тетрагидроантрахинонов, нафтохинонов, бензохинонов и их производных.
8. Способ по любому из пп.1-3, в котором содержание органического медиатора, включая его восстановленные формы, в католите составляет, по меньшей мере, примерно 1 мас.%.
9. Способ по любому из пп.1-3, в котором католит содержит по меньшей мере частично органическую соль, включающую по меньшей мере один вид органического катиона и/или органического аниона.
10. Способ по п.9, в котором содержание упомянутой по меньшей мере частично органической соли в католите составляет от примерно 20 мас.% до примерно 99 мас.%.
11. Способ по п.9, в котором упомянутая по меньшей мере частично органическая соль присутствует вместе с нейтральным сорастворителем, и массовое отношение соли к сорастворителю составляет от примерно 1:1 до примерно 1000:1.
12. Способ по п.9, в котором в католите присутствует нейтральный сорастворитель в количестве вплоть до примерно 50 мас.%.
13. Способ по п.9, в котором упомянутая по меньшей мере частично органическая соль, сама по себе или в сочетании с нейтральным сорастворителем образует жидкую фазу при атмосферном давлении ниже примерно 130°С.
14. Способ по п.9, в котором упомянутая по меньшей мере частично органическая соль при 100°С имеет парциальное давление менее примерно 10 кПа.
15. Способ по п.9, в котором упомянутая по меньшей мере частично органическая соль содержит катион, выбранный из группы, состоящей из 1-алкил-3-метилимидазолия, 1-бутил-З-метилимидазолия [BMIM], 1-этил-3-метилимидазолия [EMIM], 1,2,3-триметилимидазолия, н-алкилпиридиния, н-бутилпиридиния [BPY], пирролидиния, гуанидиния и алкилгуанидиния, изоурония, PR4 +, NR4 +, SR3 +, тетраметиламмония, холина, кокомония и их смесей, R представляют собой, независимо друг от друга, необязательно замещенный алкил, алкенил или арил, или водород.
16. Способ по п.9, в котором упомянутая по меньшей мере частично органическая соль содержит катион, выбранный из группы, состоящей из замещенных хинонов.
17. Способ по п.9, в котором упомянутая по меньшей мере частично органическая соль содержит анион, выбранный из группы, состоящей из гексафторфосфата [HFP], тетрафторбората [TFP], фторсульфоната, гексафторантимоната, гексафторарсената, хлоралюмината, бромалюмината, бис(трифторметилсульфонил)имида, трис(трифторметилсульфонил)метида, трицианометида, дицианамида, нонафторбутансульфоната, трифторметансульфоната, 2,2,2-трифторэтансульфоната, нитрата, сульфата, фосфата, RPO42-, R2PO4 -, R2PO2 - (например, диалкилфосфинат), перхлората, ацетата, алкилсульфоната, бис(2-этилгексил)натрий сульфосукцината, диэтиленгликольмонометилэфирсульфата, алкилолигоэфирсульфата, пивалата, тетраалкилбората, пропионата, сукцината, сахарината, гликолята, стеарата, лактата, малата, тартрата, цитрата, аскорбата, глютамата, бензоата, салицилата, метансульфоната, толуолсульфоната и их смесей, R представляют собой, независимо друг от друга, необязательно замещенный алкил, алкенил или арил, или водород.
18. Способ по п.9, в котором упомянутая по меньшей мере частично органическая соль содержит анион, выбранный из группы, состоящей из замещенных хинонов.
19. Способ по п.9, в котором упомянутая по меньшей мере частично органическая соль содержит катион, выбранный из группы, состоящей из [1,3-диалкилимидазолия], [триалкиламмония], [тетраалкиламмония], [триалкилфосфония], [тетраалкилфосфония], [алкилпиридиния], [холина], [Q-NR3 +] и [Q-РR3 +], и анион, выбранный из группы, состоящей из [сульфата], [фосфата], [алкилсульфата], [алкилсульфоната], [диалкилфосфата], [алкилфосфоната], [Q-(O)-SO3 -] и [Q-(O)-РО3R-], где Q представляет собой хинон, (О) представляет собой необязательный кислород, R представляет собой, независимо друг от друга, необязательно замещенный алкил, алкенил или арил, или водород.
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРАТА НАТРИЯ | 1999 |
|
RU2154125C1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2009-12-10—Публикация
2006-06-02—Подача