Изобретение касается фосфоновых кислот и их использования в процессах разделения.
Хорошо известны неорганические комплексообразующие агенты, которые широко использовались в различных отраслях промышленности. Обычно комплексообразующие агенты используются для того, чтобы способствовать удалению металлических ионов из раствора или способствовать растворению металлических ионов в растворе. Комплексообразующие агенты используются, например, для очистки сточных вод промышленных производств. Другим примером является тот случай, когда один или несколько вредных для окружающей среды и/или токсичных металлических ионов, таких как ионы радиоактивного металла или ионы такого металла, как кадмий или цинк, перемешиваются с одним или несколькими безвредными и/или нетоксичными металлическими ионами. Избирательное удаление кадмия или цинка снижает стоимость утилизации. Следующим примером является ситуация, когда отходящий поток содержит несколько различных видов металлических ионов, из которых лишь один или два вида металлических ионов являются достаточно ценными для того, чтобы оправдать необходимость отделения металлических ионов от отходящего потока для их возможного выделения, регенерации и повторного использования. В каждом случае желательно удаление выбранных металлических ионов и извлечение или концентрирование их для удаления.
К числу наиболее нежелательных побочных продуктов можно отнести радиоактивные отходы. Наиболее токсичными компонентами радиоактивных отходов являются высоко радиоактивные трансурановые элементы, то есть искусственно получаемые элементы более тяжелых, чем уран, которые имеют чрезвычайно длительный срок полураспада и сохраняют токсичность ядерных отходов в течение миллионов лет. В настоящее время удаление таких высокотоксичных радиоактивных отходов требует превращения радиоактивных отходов в стекловидное состояние посредством остеклования, с последующим захоронением этого стекловидного продукта в глубоких геологических шахтах или хранилищах. В настоящее время миллионы галлонов отходов, которые содержат трансурановые элементы, требуют такой обработки.
Различные виды комплексообразующих агентов, которые были ранее разработаны, показывают, что ни один из этих комплексообразующих агентов или классов комплексообразующих агентов не имел удовлетворительных характеристик в промышленных условиях для удаления и/или солюбилизации всех металлических ионов во всех областях применения. Ввиду этого были разработаны специфические комплексообразующие агенты для решения специфических проблем промышленного применения. Однако, эти специфические образующие металлический комплекс агенты обычно имеют недостатки низкий эффективный диапазон значений pH, длительное сохранение в окружающей среде и/или нежелательное воздействие на окружающую среду.
Известным классом хелатообразующих агентов являются фосфоновые кислоты и дифосфоновые кислоты, но они имеют недостатки, в частности, прекрасную термодинамическую стойкость. Хотя термодинамическая стойкость является свойством желательным для промышленных соединений, эта стойкость может причинить определенный вред после того, как комплексообразующее действие уже более нежелательно, например, когда требуется извлечение комплексованного металла из раствора.
В данной заявке описаны фосфоновые кислоты и их производные, которые могут иметь пониженную стойкость и, следовательно, могут легко разлагаться, когда их комплексообразующее действие уже больше не нужно.
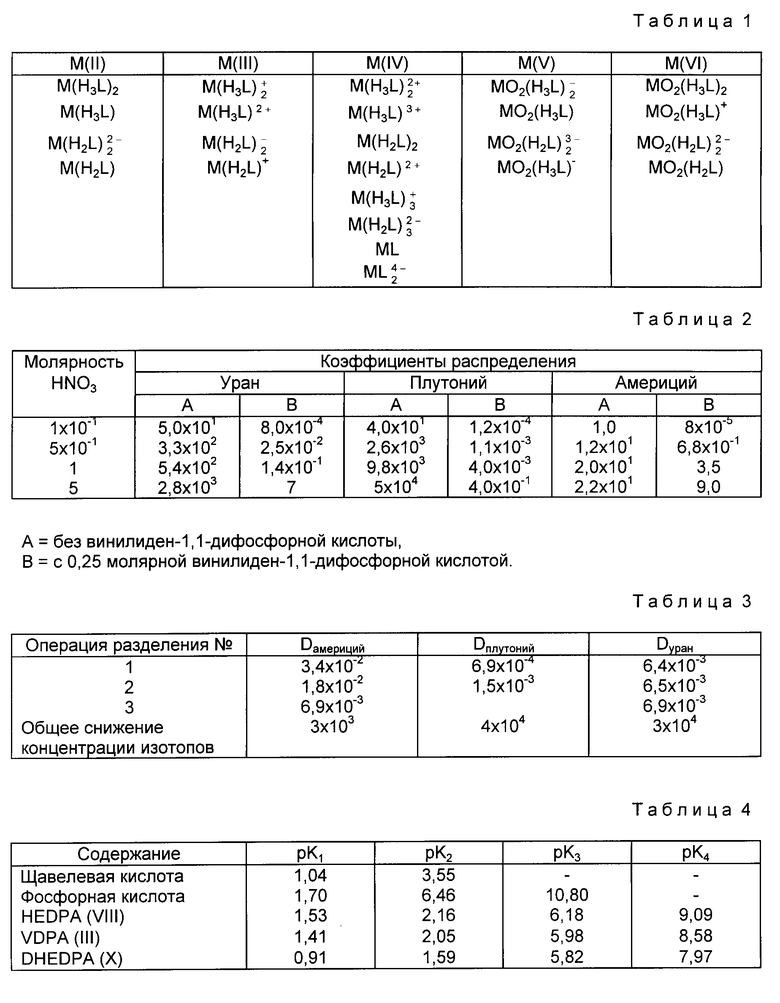
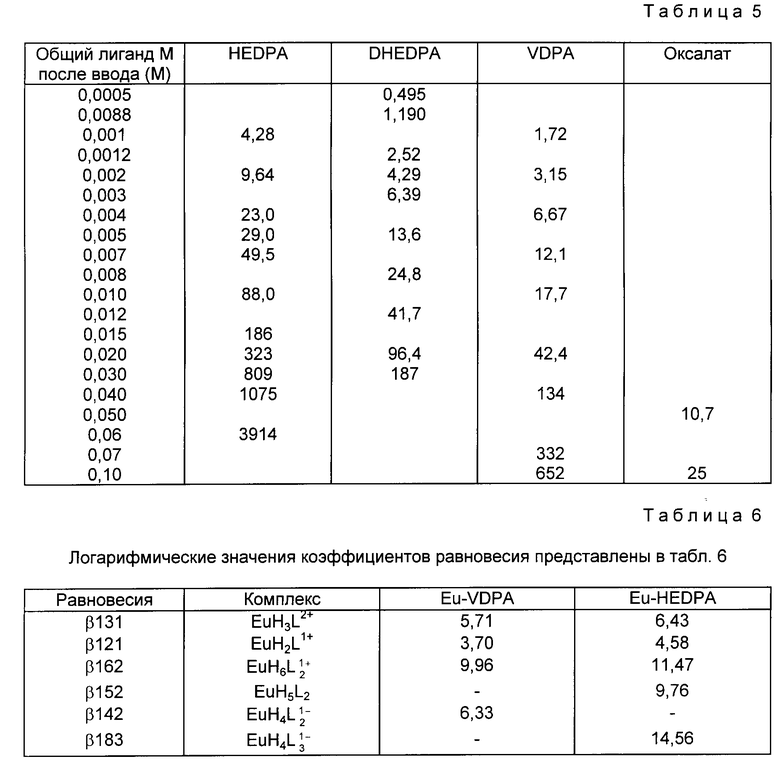
Настоящее изобретение охватывает также способ выделения металлического иона из неводной среды, содержащий этот металлический ион и компонент, который должен быть от него отделен, причем этим компонентом является второй металлический ион. Способ включает обработку данной неводной среды комплексообразующим средством, представляющим собой фосфоновую кислоту, ее соль, сложный эфир, сложный тиоэфир или конденсат, где указанная фосфоновая кислоты имеет одну из нижеследующих структур: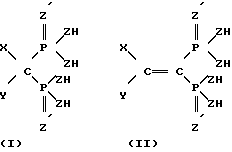
где
заместители X и Y каждый выбран из числа следующих: -H, галоген, -Z''H, -CO2H, -CH3, -CH2CH3, -CONH2, -CONHR, -CONR2, -CH2A, (где А представляет собой -Z''H, NH2, Cl, Br, F, I, NO2, CN, OR, SR, или OOCR), -CH2-CO-OR, -CH2CONHR, -CH2-CONR2, -CH2-CONH2, -CH2-COOH, -CH2-S(O)R, -CH2S(O)2R, - CH2SO3H, -CH2-SO2OR, -PO(OH)2, -CH2PZ'(ZH)2 и CH(PO3H2)2,
где
R представляет собой группу алкила с одним или тремя атомами углерода, и Z, Z', Z" представляют собой атом кислорода или серы, с целью образования водорастворимого комплекса из указанного металла и указанного комплексообразующего агента, и отделение указанного водорастворимого комплекса (предпочтительно в водной среде) от указанного компонента, и последующее разложение комплекса для высвобождения металлического иона. Водная среда вводится, предпочтительно, до, вместе или после ввода комплексообразующего средства. Желательно, чтобы была введена неводная среда, если этот компонент уже не растворен в ней, и отделение комплекса осуществляется путем отделения водной среды, содержащей этот комплекс, от органической среды, содержащей данный компонент. После отделения металл в комплексе превращается в подходящую форму, например, в свободную от органики форму, для его извлечения и удаления путем разложения или разрушения комплекса и/или комплексообразователя, например, в мягких режимах процесса, в результате чего он разрушается и выделяется металлический ион, который удаляется из водного раствора, предпочтительно, путем экстракции из фазы жидкость-жидкость или путем осаждения нерастворимой соли, например, фосфатной соли. Разложение обычно осуществляется в водном растворе, предпочтительно, при величине pH в пределах от 10 до pH, соответствующего 7 Мол. сильной кислоте, например, в кислотном растворе с величиной pH от 2 до pH, соответствующего 7 Мол. сильной кислоте, так чтобы данный комплекс содержал предпочтительно не менее, чем один кислотный атом водорода. Разложение может осуществляться путем нагрева при умеренно повышенных температурах, например, примерно до 50oC, и вплоть до точки кипения водной среды и/или путем окисления в мягких режимах, например, при контактировании с окисляющим агентом в мягких условиях процесса или путем электролитического окисления. Продолжительность разложения может составлять не менее, чем примерно 5 мин и, предпочтительно, вплоть до 24 ч. Окисляющий агент обычно является мягким и предпочтительно, свободным от металла, такого как переходный металл, хотя последний может использоваться в каталитических количествах с перекисью водорода, например, в количестве 0,01-10 мол. особенно предпочтительные свободные от галогена агенты. Окисляющим агентом является, предпочтительно, перекись водорода или азотная кислота, но могут использоваться также азотистая кислота, озон, пероксикарбоновые кислоты, такие как надуксусная кислота или алкилгидроперекиси; гипохлоритный ион, двуокись хлора или персульфаты. Количество окисляющего агента обычно составляет не менее половины и, предпочтительно, не менее, чем стехиометрическое количество, например, 1-20-кратное стехиометрическое количество. В некоторых случаях комплекс может быть самопроизвольно разлагающимся с полупериодом существования примерно от 5 мин до 30 дн; такое самопроизвольное разложение может происходить при комнатной температуре в течение одного или двух дней. Разложение с выделением металлического иона вызывает разложение или расщепление соединений дифосфоновой кислоты на соединения с более низкой комплексообразующей силой, например, по меньшей мере до соединений монофосфоновой кислоты и, в частности, далее до фосфорной кислоты и безвредных побочных продуктов из комплексообразователя, которые обычно свободны от органических соединений, но могут содержать одну или несколько карбоновых кислот, например уксусную кислоту.
Металлические комплексы, образованные из металла и комплексообразователя, представлены в табл.1.
где H4L один из четырех основных комплексообразователей, представленных выше;
M представляет собой актинид, например, уран, плутоний, нептуний или америций, лантанид, например, европий, неодимий или торий, стронций, молибден или цирконий. Однако, могут быть образованы комплексы и из других металлических ионов, включая, например, железо, алюминий, ванадий, хром, цинк, скандий или титан.
Комплексообразователи, используемые согласно данному изобретению, как впервые установлено, обладают свойствами водорастворимости, образуя очень сильные водорастворимые комплексы с металлическими ионами, включающими металлические ионы в окисленных состояниях II, III, IV, V и VI, в средах от умеренно щелочной до сильно кислотной, при величине pH, например, примерно от 10 до значения, соответствующего 7 Мол. сильной кислоте, например, 7 Мол. азотной кислоте. Они обладают также способностью либо до, либо после комплексообразования с металлическим ионом легко разлагаться в мягких условиях, обычно, до образования неорганических и/или невредных для окружающей среды и нетоксичных соединений и выделяют металлический ион.
Данные комплексообразователи образуют очень сильные комплексы, но сами, как таковые, предпочтительно, термодинамически неустойчивы, например, в мягких условиях окисления и/или нагрева или самопроизвольного разложения, описанного выше, и относительно быстро разлагаются до образования невредных для окружающей среды соединений.
Так, металлический ион может быть выделен из сильного комплекса путем разложения комплексообразующего агента.
Понятие безвредное для окружающей среды соединение, как оно используется в данном контексте и ниже, относится к безвредным соединениям типа воды, двуокиси углерода и уксусной кислоты и соединениям, которые полностью разлагаются, таким как фосфорная кислота или серная кислота, и, следовательно, они не вызывают проблем длительного хранения отходов и проблем удаления отходов. Кроме того, данные продукты разложения могут быть безвредными для людей при употреблении их в небольших количествах, что разрешает проблемы при использовании комплексообразователей для обработки материалов, предназначенных для людей (или животных).
Комплексообразующие агенты, обладающие всеми этими свойствами, не были ранее предусмотрены, поскольку, обычно, в высококислой среде, например, при значениях pH от 2 до величины, соответствующей 7 Мол. сильной кислоте, такой как азотная кислота, комплексообразование металла неэффективно или невозможно ввиду того, что большинство комплексообразующих агентов неспособны к предпочтительному комплексообразованию с металлическим ионом, но не с ионами водорода в растворе.
Впервые установлено, что комплексообразователи, используемые согласно способу данного изобретения, имеют преимущество перед большинством известных комплексообразующих агентов в высоко кислотной среде, и их использование особенно полезно в средах с величиной pH 2 или менее, например, до pH, соответствующего примерно 7 Мол. сильной кислота, например, азотной кислоте, серной кислоте, надфосфорной кислоте или соляной кислоте. Известные ранее в данной области комплексообразующие агенты, которые могут образовывать металлические комплексы при низких значениях pH, обычно образуют водонерастворимые металлические комплексы и, следовательно, затрудняют отделение комплексованного металлического иона от раствора ввиду того, что требуются способы разделения в фазах жидкость твердое тело в противоположность более эффективным и экономичным способам экстракции в фазах жидкость -жидкость. Комплексообразователи, используемые в способе данного изобретения, являются термодинамически или кинетически неустойчивыми, так что как в их некомплексованном состоянии, так и после комплексообразования с металлом или и в том, и в другом случае они могут подвергаться воздействию условий, разрушая любой избыток комплексообразующего агента в растворе и выделяя комплексованный металлический ион обратно в раствор для более легкого и более эффективного последующего отделения и удаления, или регенерации и рецикла металлического иона.
Предпочтительными комплексообразователями являются соединения формулы I и формулы II, которые являются метилен-бис-фосфоновыми кислотами и винилиден-1,1-дифосфоновыми кислотами и их производными. Группы X и Y определены выше, но они выбираются, предпочтительно, таким образом, что доводят до нужной чувствительность C-P связей к окислению и/или термическому разложению и/или самопроизвольному разложению. Они могут также изменяться с увеличением кислотности групп фосфоновой кислоты и увеличивая водорастворимость комплексообразователей и их металлических комплексов.
Когда одним из значений Z, Z' и Z" может быть сера, все другие значения этих групп представляют собой кислород. Группы X и Y имеют, предпочтительно, иное значение, чем галоген и этил, и, в частности, они не включают серу. Обычно, по меньшей мере одна из групп или обе группы X и Y в формуле I содержат по меньшей мере один атом, отличный от водорода и углерода (если он присутствует); этим другим атомом (или атомами) является, предпочтительно, кислород, но может быть также азот, галоген или сера. Когда Y представляет собой группу метила или этила, то X имеет, предпочтительно, иное значение, чем водород и является, в частности, гидроксильной группой. Очень важными являются соединения формулы I, в которой X и Y имеют различные значения и, особенно, значения, в которых X представляет собой OH, и Y имеет значение иное, чем водород, галоген, метил или этил, но, предпочтительно, имеет значение CH2A. В других предпочтительных соединениях формулы I Y представляет собой группу карбоксила или амида, X представляет собой, предпочтительно, водород или особенно гидроксил. Особенно важными соединениями формул I и II являются такие, в которых X и Y имеют одинаковые значения и особенно представляют собой водород, а именно метилен-дифосфоновая кислота и винилиден-1,1-дифосфоновая кислота, как таковые, и их соли и их сложные эфиры, особенно моноэфиры.
Наиболее предпочтительными комплексообразователями являются винилиден-1,1-дифосфоновая кислота III и соединения формулы I, в которых X представляет собой OH, и при этом Y представляет собой CO2H (VII), CH2OH (X), CH3 (VIII), CH2NH2, CH2Cl, CH2NO2 или водород (XX), и в которой X представляет собой водород и при этом Y представляет собой CH2OH (XVIII).
Следует отметить, что стойкость кислотных комплексообразователей, например, соединений формулы II и, особенно, соединений формулы I, обычно увеличивается в результате превращения свободной кислотной группы в соль, например, в соль металла из группы IA или аммониевую соль, особенно соль натрия или калия. Таким образом, соединение с умеренной степенью нестойкости в свободной кислотной форме может быть превращено в соединение, отличающееся прекрасной стойкостью в форме соли. Следовательно, превращение кислоты в соль замедляет или предотвращает самопроизвольное разложение продукта, так что стойкость его при хранении увеличивается. Таким образом, превращение солевой формы соединения обратно в кислотную форму дает потребителю дифосфоновой кислоты достаточно времени, например, несколько дней, например, не менее 2-3 дн, для использования данного соединения, например, в процессе экстракции до его самопроизвольного разложения. Таким образом, в случае соединения VII в виде свободной кислоты имеется по меньшей мере 2-3 дн (продолжительность жизни), которые достаточны для осуществления процесса экстракции в фазах жидкость-жидкость для отделения металлического иона от отработанного потока.
1,2-диоксиэтан-1,1-дифсофоновая кислота (X), которая является соединением формулы (I), в котором Y представляет собой оксиметилен и X представляет собой оксигруппу, является неограниченно стойкой в форме натриевой соли и может храниться в этой форме. Однако, в форме свободной кислоты 1,2-диоксиэтан-1,1-дифосфоновая кислота разлагается до воды, двуокиси углерода и фосфорной кислоты, либо в результате самопроизвольного разложения, либо в кипящей HNO3, либо в присутствии перекиси водорода.
Винилидендифосфоновая кислота (III) стойка как в форме свободной кислоты, так и в форме соли, образует очень хорошо растворимые комплексы металлического иона в кислотной среде, но разлагается в течение часов в кипящей азотной кислоте или водной перекисью водорода при умеренно высоких температурах. Винилидендифосфоновая кислота VDPA (III) после комплексообразования с металлическим ионом, например, ионом, имеющим состояние окисления, например, не менее 3, может разлагаться до фосфорной кислоты и других продуктов разложения, включая двуокись углерода и воду, в очень слабых условиях процесса, например, при воздействии перекиси водорода, особенно при температуре от комнатной до 100oC, например, в интервале от 50 до 100oC, в присутствии солей ванадия, вольфрама, рутения или молибдена. Это легкое разложение показывает, что после комплексообразования с металлом комплексообразователи могут далее снижать свою стойкость, так что такое разложение происходит в значительно более мягких условиях процесса.
Следовательно, для увеличения термодинамической стойкости соединения общей структурой I, заместители X и Y выбираются таким образом, чтобы дифосфоновая кислота все еще могла самопроизвольно разлагаться, но с более длительным периодом полураспада, или так, чтобы дифосфоновая кислота была стойка при комнатной температуре и при несколько повышенной температуре, например, при температуре, которая имеет место при изготовлении и при использовании, например, в процессах экстракции в фазах жидкость жидкость, но так, чтобы она разлагалась при умеренно повышенных температурах, например, примерно от 60 до 100oC, и/или в присутствии слабо окисляющих агентов.
Некоторые дифосфоновые кислоты структурных формул I и II уже известны, в частности, 1-оксиэтан-1,1-дифосфоновая кислота (VIII), винилиден-1,1-дифосфоновая кислота (III) и другие, как указывалось выше, получены посредством нуклеофильных аддитивных продуктов эпоксида (IX) соединения (III) с водой (например, 1,2-диоксиэтан-1,1-дифосфоновой кислоты (X)), аммиаком, хлоридным ионом и нитрилом, в результате чего получаются соответственно соединения формулы I, где X представляет собой гидроксил и Y представляет собой CH2A, где A представляет собой OH, NH2, Cl и NO2 (патент США N 3705191). Эпоксид, как указывалось, взаимодействует с образованием комплексообразователей формулы I с нуклеофильными соединениями формулы HA, такими как вода, соляная кислота (HCl), бромистоводородная кислота (HBr), иодистоводородная кислота (HI), фтористоводородная кислота (HF), азотистая кислота (HNO2), цианистый водород (HCN), аммиак, спирты (ROH), амины (RNH2 и R2NH), сероводород (H2S) и меркаптаны (RSH), где R представляет собой алкильную группу, включающую от 1 до 3 атомов углерода. Продукты нуклеофильного присоединения обычно содержат наибольшую часть соединений формулы AH2C(HO)C(PO3H), но могут также содержать наибольшую часть соединений формулы HOCH2(A)C(PO3H2)2.
Некоторые соединения формул I-VI являются новыми продуктами.
Настоящее изобретение охватывает также фосфоновые кислоты формул I-IV, как определено выше, и их соли, сложные эфиры и тиоэфиры, не считая винилиден-1,1-дифосфоновой кислоты формулы II, 1,2-диоксиэтан-1,1-дифосфоновой кислоты и 1-оксиэтан-1,1-дифосфоновой кислоты формулы I. Оно охватывает также 1,2-диоксиэтан-1,1-дифосфоновую кислоту со значением химического сдвига 31Р ЯМР в 0,2 Мол. D2O, равным 14,59 ч./млн. относительно 85% H3PO4, или ее соль, например, натриевую соль; эта кислота или соль представляет, предпочтительно, наибольшую часть продукта, наименьшую часть которого составляет фосфоновая кислота или ее соль.
Примерами такого соединения формулы I является карбокси-оксиметан-дикарбоновая кислота HOOC(HO)C(PO3H2)2 (VII), которая является соединением формулы I, в которой X представляет собой гидроксил и Y представляет собой карбоксил. Она получается новым способом синтеза, включая реакцию мононизшего алкил (например, метил или этил) оксалилхлорида с тринизшим алкилфосфитом (например, метил или этилфосфитом) с последующей реакцией с динизшим алкилфосфитом, например, диэтил или диэтилфосфитом. Полученный пентаалкиловый (например, пентаэтиловый или пентаметиловый) сложный эфир формулы VII затем превращается в свободную кислоту путем деэтерификации триметилсилилиодидом (CH3)3SiI, в результате чего получается дифосфоновая кислота формулы VII. Это соединение дифосфоновая кислота формулы VII обладает кислотностью, водорастворимостью и комплексообразующими свойствами, а также умеренной термодинамической нестойкостью, как это проявляется по ее самопроизвольному разложению до двуокиси углерода, воды и фосфорной кислоты при комнатной температуре со сроком полураспада примерно от двух до трех дней.
Очень важным промежуточным продуктом для получения соединений формулы I является винилиден-1,1-дифосфоновая кислота (III). Было установлено, что это соединение может быть получено путем дегидратации коммерчески доступного соединения 1-оксиэтан-1,1-дифосфоновой кислоты (HEDPA VIII).
Настоящее изобретение охватывает способ получения винилиден-1,1-дифосфоновой кислоты (VDPA), включающий дегидратацию тетранатриевой соли 1-оксиэтан-1,1-дифосфоновой кислоты путем нагрева, охлаждение дегидратированной тетранатриевой соли 1-оксиэтан-1-дифосфоновой кислоты, растворение дегидратированной тетранатриевой соли 1-оксиэтан-1,1-дифосфоновой кислоты в воде с образованием водной реакционной смеси, добавление метанола до помутнения, охлаждение водной метанольной реакционной смеси, при котором происходит осаждение тетранатриевой соли винилиден-1,1-дифосфоновой кислоты, отделение осажденной соли VDPA от водной реакционной смеси, и затем подкисление тетранатриевой соли VDPA с образованием VDPA.
Тетранатриевая соль 1-оксиэтан-1,1-дифосфоновой кислоты, предпочтительно, нагревается в течение примерно от 1 до 5 ч, например, в течение примерно от 2 до 4 ч, при температуре в пределах примерно от 250 до 500oC, например, примерно 450oC. Нагрев осуществляется, предпочтительно, при давлении ниже атмосферного, например, 5-100 или 5-50 мм рт.ст. или в инертной атмосфере для того, чтобы снизить разложение, вызываемое кислородом воздуха. Подкисление осуществляется, предпочтительно, путем ионообмена из водного раствора или из тетранатриевой соли VDPA.
Затем VDPA может превращаться в 1,2-диоксиэтан-1,1-дифосфоновую кислоту или другие соединения формулы I, в которой X представляет собой OH и Y представляет собой CH2A, путем осуществления следующего нового способа.
Настоящее изобретение охватывает также способ получения 1,2-окси-1,1-дифосфоновой кислоты (DHEDPA), включающий получение водного раствора винилиден-1,1-дифсофоновой кислоты, например, путем растворения ее в воде или ионообмена раствора соли VDPA, с вводом достаточного количества окиси металла, как катализатора, или его соли и перекисного соединения в раствор винилиден-1,1-дифосфоновой кислоты для образования реакционного раствора; нагревание реакционного раствора в течение достаточного времени, например, примерно от 1 до 5 ч и при достаточно высокой температуре, например, примерно от 40 до 80oC для образования 1,2-окси-1,2-дифосфоновой кислоты. DHEDPA может быть выделена в виде ее натриевой соли. Соль VDPA, предпочтительно, частично нейтрализуется, например, 1-3 атомами натрия на молекулу.
Предусматривается также способ получения комплексообразователя, имеющего формулу: AH2C(HO)C(PO3H2) или HOH2C(A)C(PO3H2)2 или их смесь, включающий получение раствора винилидена-1,1-дифсофоновой кислоты (VDPA) или ее соли в достаточном количестве растворителя, предпочтительно, путем растворения в растворителе, ввод достаточного количества окиси металла, как катализатора, или его соли и перекисного соединения в раствор VDPA с образованием реакционного раствора, ввод нуклеофильного соединения формулы HA в реакционный раствор, в котором A представляет собой галогенид, NO2, CN, NH2, OH, RNH, R2N, SH или SR и R представляет собой алкил, содержащий 1-3 атома C; нагревание реакционного раствора, содержащего нуклеофильное соединение HA в течение достаточного времени, например, в течение примерно от 1 до 5 ч и при достаточно высокой температуре, например, от 40 до 80oC для образования комплексообразователя, и последующее отделение комплексообразователя от реакционного раствора. Растворителем может быть вода или полярный органический растворитель, такой как диметилформамид, диметилсульфоксид, диоксан или полностью этерифицированные гликоли (включая полигликоли).
В этих двух процессах катализатор окись металла или его соль представляет собой, предпочтительно, вольфрамат натрия, хотя могут использоваться также и окиси ванадия (V) или окиси молибдена (VI) или их соли. Перекисное соединение представляет собой, предпочтительно, перекись водорода, но это может быть и гидроперекись кумола, третбутилгидроперекись, надуксусная кислота и надбензойная кислота; используется примерно один эквивалент перекисного соединения.
Когда HA представляет собой H2S или RSH, то продукт может быть дополнительно окислен перекисью водорода с образованием комплексообразователя формулы I, представляющего собой сульфоксид, сульфон или сульфоновую кислоту.
кроме того, дифосфоновая кислота формулы I или формулы II может быть превращена в производное дифосфоновой кислоты, например, в этерифицированное до сложного эфира или до тиоэфира соединение, либо от группы фосфоновой кислоты, либо от карбокси-группы, если она присутствует, спиртом или меркаптаном, содержащим от 1 до примерно 4 атомов углерода. Степень этерификации до сложного эфира или тиоэтерификации, например, моноэтерификации, диэтирификации или триэтерификации, может быть до любого уровня при условии, что дифосфоновая кислота или производные дифосфоновой кислоты структурных формул I и II сохраняют их водорастворимость в состоянии комплекса с металлом и в некомплексованном состоянии; могут эффективно образовывать комплекс с металлическими ионами, включая металлические ионы окисленных состояний II, III, IV, V и VI, в средах от умеренно щелочной до высоко кислой; и самопроизвольно разлагаются и/или легко разлагаются при умеренно повышенных температурах и/или в присутствии слабо окисляющих агентов. Кроме того, тиопроизводные соединения структурных формул I и II, дитиофосфоновые кислоты, такие как тиопроизводные комплексообразователя (X) и винилидендифосфоновая кислота (III), как показано в структурных формулах XII и XIV, соответственно, также могут использоваться при осуществлении способа данного изобретения, как и различные производные этих дитиофосфоновых кислот, такие как сложные эфиры и тиоэфиры.
HCH2C(HO)C[PS(SH)2]2 (XIII) и CH2=C[PS(SH)2]2 (XIV)
Получение других соединений дифосфоновых кислот структурной формулы I может осуществляться другими способами синтеза. Так, например, получение 2-оксиэтан-1,1-дифосфоновой кислоты HOH2CCH(PO3H2)2 (XVII) может осуществляться путем конденсации натриевой соли тетраэтилметилендифосфоната (XVI) газообразным формальдегидом, с последующей деэтерификацией с использованием триметилсилилиодида. Анион XVI может быть получен из метилендибромида и триэтилфосфита с образованием диэтилбромэтилфосфоната, который в свою очередь реагирует с мононатриевой солью диэтилфосфита с образованием тетраэтилметилендифосфоната.
Аналогичным образом оксиметандифосфоновая кислота HOCH(PO3H2)2 (XVII) может быть получена путем реакции Арбузова, т.е. реакции триэтилфосфита с фосгеном, с последующим восстановлением промежуточного соединения OC(PO3Et2)2 подходящим боргидридным реагентом и в конечном итоге деэтерификацией триметилсилилиодидом.
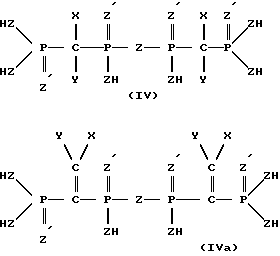
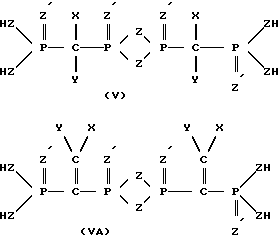
Могут использоваться также и другие производные дифосфоновой кислоты формулы I-VI, имеющие более низкие константы кислотной диссоциации и образующие более стойкие комплексы, чем дифосфоновые кислоты и производные дифосфоновых кислот, описанные выше. Такие соединения включают моно- и дипиродифосфоновые кислоты, например, соединения формул IV и V. Примерами являются бис-[метилен-пиродифосфоновая кислота] и бис-[метилендипиродифосфоновая кислота] которые представляют собой соединения формул IV и V соответственно, в которых X и Y оба представляют собой водород, которые могут быть получены путем нагревания тринатриевой и динатриевой солей метандифосфоновой кислоты CH2(PO3H2)2 (XIX), соответственно, до температуры примерно 300-400oC, в вакууме, в результате чего получается соответственно соединение IV или V.
Соединение IV также может образовывать очень сильные комплексы через группы пирофосфоновой кислоты. Соединение V имеет менее благоприятную структуру для комплексообразования металлического иона, и его получение пирохимическим способом также может привести к частичному образованию полимера, например, соединения формулы (VI) наряду с образованием соединения V.
[-OP(O)(OH)-CXY-P(O)(OH)-O-P(O)(OH)-CXY-P(O)(OH)-]n (VI)
Способность обоих соединений XIX и VI функционировать в качестве подходящих комплексообразователей для использования в способе данного изобретения может быть еще больше увеличена путем ввода гидроксильного заместителя к углероду метилена. Окси-замещенные соединения IV и V могут быть получены пирохимически из подходящих натриевых солей, например, солей оксиметандифосфоновой кислоты.
Комплексообразователи для использования согласно данному изобретению испытываются на их водорастворимость, на их способность к образованию высокостойких или очень прочных водорастворимых комплексов с металлическими ионами, включая металлические ионы в окисленных состояниях III, IV и V, в растворах от умеренно щелочного до высококислотного, таких как 0,1 Мол. HNO3, для 3+ ионов и 7 Мол. HNO3 для 4+ ионов, и на их стойкость к быстрому разложению на невредные для окружающей среды вещества, такие как двуокись углерода, вода и фосфорная кислота, в описанных выше условиях.
В частности, измерения на способность к комплексообразованию с металлом осуществлялись, как измерения степени снижения коэффициента распределения, то есть отношения концентрации металлического иона в фазе органического растворителя к концентрации металлического иона в водном растворе, америция III или европия III, в экстракциях от 0,1 Мол. HNO3 и 0,01 Мол. HNO3, с использованием бис(2-этилгексил)фосфорной кислоты (HDEHP) в качестве органического экстракционного растворителя.
Испытание на термическое разложение осуществляли путем нагрева комплексообразователя в 8 Мол. HNO3 при температуре 100oC с последующим анализом методами 1Н ЯМР, 13С ЯМР и 31Р ЯМР (ядерного магнитного резонанса) спектроскопии. Водорастворимость комплексов металлического иона, образующихся с комплексообразователями, определяли, используя макроколичества неодимия (III), тория (IV) и урана (VI), как типичных трехвалентных актинидов, плутония (IV) и нептуния (IV) и актинидных (VI) ионов, а также с осуществлением испытаний с железом (III) и цирконием; эти испытания осуществлялись с различными отношениями комплексообразователя к концентрации металлического иона и с различными значениями pH. Значения силы кислот, как показателей констант диссоциации рКа комплексообразователей, определяли стандартными методами потенциометрического титрования.
Комплексообразователи могут использоваться в водном растворе для образования водорастворимого комплекса с первым металлическим ионом и незначительного комплекса со вторым металлическим ионом, который затем может отделяться от растворимого комплекса. Это отделение может осуществляться путем осаждения второго металлического иона, так, что первый металлический ион будет оставаться в растворе, или может осуществляться методом обменного распределения в фазах жидкость жидкость.
Комплексообразующие агенты, отвечающие данному изобретению, могут использоваться, как агенты водной экстракции или агенты для удержания. Они находят особенно полезное применение в процессах экстракции в растворителе в фазах жидкость жидкость, где они могут служить в качестве агентов обратной задержки для улучшения избирательности действия органического растворителя экстракции при удалении одного или нескольких металлических ионов, или какого-либо другого органически экстрагируемого компонента из водного раствора, который включает различные типы металлических ионов в смеси металлических ионов с другими органическими экстрагируемыми растворителями компонентами. Металлобразующий комплекс затем может быть выделен, например, путем разложения этого комплекса. Соединения, образующиеся при разложении комплексообразователя, очень часто являются неорганическими, легкими в транспортировке или легкоудаляемыми соединениями. Выделенные металлические ионы могут быть легко экстрагированы для концентрирования или, в зависимости от концентрации и условий, могут быть удалены в форме осаждения фосфатной соли. Эти свойства особенно полезны для концентрирования и удаления радиоактивных металлов.
Таким образом, настоящее изобретение позволяет осуществлять обработку химических растворов, таких как водные ядерные отходы, водный питательный раствор для гидрометаллургических процессов и отходы солевых растворов процессов нефтепереработки, комплексообразователями, включая вредное влияние какого-либо металлического иона или ионов на раствор при нормальном осуществлении процесса. В частности, настоящее изобретение касается использования таких комплексообразователей, которые стойки при нормальных рабочих температурах, но нестойки при несколько повышенных температурах, вызывая разложение комплекса металлического иона на определенной стадии процесса.
Таким образом, комплексообразователи, используемые согласно данному изобретению, используются в операциях обработки, для образования металлических комплексов с определенными типами металлических ионов в промышленном растворе. Следовательно, желаемые операции обработки могут осуществляться с комплексом металлического иона, легко разлагаемого в слабых условиях на поздней стадии процесса с выделением определенного образующего комплекса металлического иона обратно в промышленный раствор для окончательного извлечения или удаления.
Таким образом, настоящее изобретение позволяет осуществлять обработку раствора, содержащего по меньшей мере один металлический ион, который влияет на обработку раствора. Такая обработка включает образование водорастворимого комплекса интерферирующего металлического иона с комплексообразователем, последующую обработку раствора с отделением и удалением вредных или представляющих ценность металлических ионов из раствора при температуре ниже температуры разложения комплексообразователя, последующий нагрев раствора до достаточно высокой температуры и/или ввода слабо окисляющего агента для разложения металлического комплекса и комплексообразователя.
Комплексообразователь для использования в способе данного изобретения может служить для экстракций в фазах жидкость-жидкость или в процессах с жидкой мембраной для разделения металлических ионов в растворе. Он может быть использован как реагент обратной задержки для улучшения избирательности экстракционных растворителей за счет сильного комплексования специфическими ионами многовалентного металла, в результате чего предотвращается их экстракция и обеспечивается более избирательная экстракция других видов металлических ионов (которые образуют менее стойкие комплексы с реагентом обратной задержки) из раствора. Экстрагируемый или удерживаемый металлический ион может представлять собой интерес. Примером использования комплексообразователя, как реагента обратной задержки, является способ обработки высококонцентрированного ядерного отхода, включающего ионы америция, кюрия, плутония и нептуния. В аналогичном применении используется щавелевая кислота для предпочтительного комплексообразования продуктов деления (циркония и молибдена), увеличивая тем самым избирательность экстракционного растворителя для иона америция, который образует менее стойкий оксалатовый комплекс, чем ионы циркония и молибдена. Однако, щавелевая кислота не вызывает эффективного комплексообразования ионов циркония и молибдена в растворах, имеющих кислотность более, чем 2-молярная HNO3. Следовательно, применение щавелевой кислоты, как комплексообразующего агента, является ограниченным. Однако, комплексообразователи, отвечающие настоящему изобретению, имеют более низкие константы кислотной диссоциации (величины рКа), и являются более сильными кислотами, чем щавелевая кислота, и являются лучшими комплексообразующими агентами, и их нестойкость к слабым условиями разложения, которая определена выше, исключает проблемы последующего удаления и загрязнения окружающей среды, которые создают более стойкие комплексообразующие агенты, например, щавелевая кислота и аминополикарбоновая кислота.
Обычно, при использовании данных комплексообразователей в качестве реагентов задержки комплексообразователь вводится в водный раствор, предпочтительно при pH примерно от 10 до значения, соответствующего 7 Мол. сильной кислоты, содержащей первый и второй металлические ионы, для получения комплекса растворимого металлического иона с первым металлическим ионом и осуществляется экстракция второго металлического иона из раствора экстрагентом в среду, которая несмешиваема в данной водной среде, и затем осуществляется разделение экстрагента и водной среды.
Обычно используемые здесь несмешиваемые с водой экстракционные растворители представляют собой хорошо известные органические растворимые вещества, обычно используемые в экстракциях в фазах жидкость жидкость, как требуется в данном случае. Они отличаются от водорастворимых комплексообразователей, отвечающих настоящему изобретению, и представляют собой органические соединения, такие как нейтральные и кислотные фосфорорганические соединения, алкиламины, хлориды четвертичного аммония. Примерами таких экстракционных растворителей являются моно(2-этилгексил)-2-этилгексилфосфоновая кислота, бис(2,4,4-триметилпентил)фосфиновая кислота, трибутилфосфат, триоктиламин, бис(2-этилгексил)фосфорная кислота и октил(фенил)-N,N-диизобутилкарбамоилметилфосфиноксид и их смеси. Другие алкиламины, диалкиламины, триалкиламины и соединения фосфорорганических кислот, таких как алкилфосфоновая кислота или ее сложный эфир, диалкилфосфиновая кислота или ее сложный эфир, сложный эфир фосфорной кислоты или триалкилфосфиноксид, также известны, как органические экстракционные растворители. Этот известный класс органических растворимых комплексообразующих агентов может использоваться индивидуально, как таковой, или в растворе в органическом растворителе, обычно в углеводородном растворителе.
В другом примере комплексообразователь, используемый согласно настоящему изобретению, применяется, как агент обратной задержки, в процессе экстракции/регенерации кобальта. Трехвалентное железо является повсеместным составляющим компонентом в питательных растворах для извлечения кобальта, никеля и железа. Следовательно, трехвалентное железо должно быть либо превращено в комплекс, либо осаждено для исключения влияния иона железа на процесс экстракции. Имеющиеся в настоящее время комплексообразующие агенты либо не проявляют эффективного действия при кислотностях, типичных для питательного потока, либо создают серьезные проблемы загрязнения окружающей среды и/или удаления отходов. Обычно ион железа осаждается в виде гидроокиси, но это осаждение требует утомительной, дорогостоящей и длительной операции разделения фаз твердое тело жидкость. Однако, комплексообразователи, отвечающие настоящему изобретению, могут избирательно комплексовать ион железа, оказывающий интерферирующее влияние, и задерживать этот ион железа в растворе, обеспечивая таким образом экстракцию кобальта из никеля путем стандартных процедур или экстракцию как Co2+, так Ni2+ при очень низких значениях pH. Затем комплексообразователь может быть в основном разрушен с выделением иона железа обратно в раствор для разделения жидкость - жидкость или для удаления, при этом исключаются проблемы загрязнения окружающей среды и удаления отходов, связанные с комплексообразователем, первоначально используемым для комплексования иона железа. Комплексообразователь может использоваться также для перевода железа в водный раствор из органического раствора железа с кобальтом и/или никелем.
Комплексообразователи, отвечающие настоящему изобретению, могут также использоваться в процессах экстракции 90Sr (стронция) и 137Cs (цезия) из кислотных высоко радиоактивных сточных растворов, содержащих многовалентные металлы. Комплексообразователь может использоваться для комплексования ионом многовалентного металла в 2-3 Мол. HNO3, что приводит к значительному повышению избирательности эфирных экстрагентов для ионов стронция и цезия или избирательности сильно кислотных фосфорорганических экстрагентов стронция. Использование данных комплексообразователей значительно снижает необходимость в избирательности растворителя экстракции, используемого в экстракционной системе.
Таким образом, первым металлическим ионом может быть плутоний и/или нептуний, или другой актинид, в то время как вторым ионом может быть америций и/или стронций, и/или цезий, или же первым металлическим ионом является железо или алюминий и вторым является кобальт и/или медь, и/или никель.
Комплексообразователь, отвечающий данному изобретению, может использоваться так же, как удаляющий агент для удаления экстрагированных металлических ионов из органического экстракционного растворителя или в качестве реагента очистки экстракционного растворителя, в частности, реагента, используемого для обработки ядерных отходов, для извлечения побочных продуктов из ядерных отходов и для регенерации ядерного топлива. В данном применении водный раствор комплексообразователя, отвечающего настоящему изобретению, используется для экстракции металлических ионов из органического экстракционного растворителя, так, что этот экстракционный растворитель может использоваться повторно, и может быть снижен объем обработанного материала, содержащего металлические ионы.
Обычно в данной операции извлечения металлические ионы в неводной среде реагируют с комплексообразователем, отвечающим данному изобретению, в водной среде с образованием водорастворимого металлического комплекса, в результате чего металлические ионы удаляются из неводной среды в водный раствор и затем осуществляется отделение неводного раствора от водного раствора. Примеры подходящей неводной среды описываются для экстрагента, используемого в процессах обратного задержания.
Комплексообразователи усиливают обратную экстракцию всех актинидов из экстракционного растворителя, используемого в способе жидкостной экстракции для очистки кислотного отработанного потока из ядерных установок. Способность комплексообразователей, отвечающих настоящему изобретению, к образованию сильного комплекса с металлическими ионами, особенно в сильной кислоте, в сочетании с высокой водорастворимостью комплексов металлических ионов, приводит к повышению эффективности обратной экстракции, то есть эффективности удаления металлического иона, например, всех актинидов, из органического экстракционного растворителя данным водным раствором. Кроме того, предпочтительное последующее разложение комплекса металлического иона и любого свободного комплексообразователя облегчает последующую конверсию металлического иона в более желаемую химическую форму, такую как стекло, образуемую в результате перехода в стекловидное состояние фракции трансурановых элементов, для эффективного удаления. Разложение комплексообразователя приводит к образованию продуктов, которые не влияют на образование стекловидного состояния, либо на хранение отходов и не создают дополнительных осложнений и трудностей обработки отработанных потоков.
Кроме того, данная операция, осуществляемая при очень кислых значениях pH, исключает разбавление отработанного потока, который эти соединения очень сильно концентрирует. Данные металлы могут быть также удалены из неводной среды с мембранным носителем. Обычно водный раствор, содержащий металлические ионы, контактирует с одной стороной пористой мембраны, имеющей две стороны и несущей в своих порах органический растворимый комплексообразующий агент для экстракции металлических ионов из водного раствора в органический комплексообразующий агент; другая сторона пористой мембраны контактирует с водным раствором комплексообразователя, экстрагируюя металлы из органического растворимого комплексообразующего агента, содержащегося в порах мембраны, и водный раствор отделяется от мембраны.
Водные растворы комплексообразователей, отвечающих данному изобретению, могут использоваться в промышленно доступных модулях с жидкостной мембраной для удаления загрязняющих металлических ионов из водного раствора. Могут использоваться также другие устройства с применением разделяющей пористой мембраны. Так, например, водный раствор, содержащий уран, контактирует с одной стороной пористой мембраны, и водный раствор комплексообразователя контактирует с другой ее стороной. Известный органический экстрагент, например, такой какой определен выше для использования в процессе удерживания, проникает в поры мембраны для переноса металлических ионов с одной стороны к другой. Водный раствор комплексообразователя удаляет металлические ионы из органического экстрагента в порах, перемещая "реакцию" экстракции в направлении удаления металлических ионов из раствора, который должен быть очищен от загрязнений.
Комплексообразователи, отвечающие настоящему изобретению, благодаря их уникальной способности образовывать металлические комплексы в высококислотных условиях, могут быть использованы для очистки кислот или высококислотных растворов. Полезным использованием является очистка фосфорной кислоты. Ввиду того, что фосфорная кислота обычно промышленно изготавливается из природно добываемого фосфатного материала (фосфатной руды), то в ней обычно присутствуют различные металлические ионы, являющиеся загрязнителями этой кислоты. Эти загрязнители включают, например, железо и алюминий. Для получения высокочистой фосфорной кислоты из загрязненной водной смеси, полученной в результате конверсии фосфатной руды в фосфорную кислоту, в различных промышленных процессах используется органический растворитель, который экстрагирует фосфорную кислоту из загрязнений водной смеси. В результате металлические ионы и примеси остаются в водной фазе. Затем фосфорная кислота может быть извлечена из органического растворителя, обычно путем отгонки растворителя или путем обратной экстракции фосфорной кислоты водной средой.
Хотя при осуществлении данных способов получается практически чистая фосфорная кислота, все же имеет место унос металлических ионов в органическую фазу, и когда органический растворитель удаляется, металлические ионы остаются в очищенной фосфорной кислоте. При использовании фосфорной кислоты, например, пищевого качества, желательно, чтобы, в основном, все ионы металла были удалены. Комплексообразователи, отвечающие данному изобретению, позволяют осуществлять несколько способов такого удаления простым путем с использованием современного промышленного оборудования.
В первом способе осуществляется простой ввод комплексообразователя в загрязненную фосфорную кислоту для воздействия ее как агента обратного задерживания металлических ионов. Этот комплексообразующий агент будет действовать, образуя комплекс металлических ионов, придавая им более высокое сродство к неорганической (или водной) фазе, оказывая тем самым эффект снижения количества металлических загрязняющих ионов, которые проходят в органическую фазу в процессе экстракции. В остальном данный процесс осуществляется, как обычно.
Во втором способе, который близок к первому, осуществляется обычный процесс экстракции и затем осуществляется экстракция металлических ионов из органической фазы, как дополнительный этап. Описанный выше первый способ имеет преимущество в том, что не требует дополнительного оборудования или осуществления дополнительного этапа. Второй способ требует осуществления второго этапа экстракции, который обычно осуществляется в отдельной экстракционной колонке или смешивающем сосуде. Сначала загрязненная фосфорная кислота экстрагируется органическим растворителем, как обычно, а затем органический растворитель в свою очередь экстрагируется водным раствором комплексообразователя, отвечающим настоящему изобретению.
Комплексообразователи в фосфорной кислоте обычно могут легко разлагаться либо в результате их выдержки с самопроизвольным разложением, либо в условиях их нагрева или слабого окисления. При осуществлении этих способов комплексообразователь, отвечающий данному изобретению, может превращаться в безвредные продукты, которые могут оставаться в фосфорной кислоте пищевого качества или могут удаляться простыми способами, например, путем отгонки при слабом нагревании. По всей вероятности, в органическую фазу будет проходить лишь небольшое количество комплексообразующего агента, отвечающего данному изобретению.
Комплексообразующая способность комплексообразователей может использоваться в комбинации с катионообменными смолами для осуществления очистки. Так, семь ионов первого металла, образующих комплекс с комплексообразователем, и ионов второго металла может вводиться в катионообменную смолу в протонированной форме, и ионы второго металла удерживаются, в то время как комплексованные металлические ионы быстро или медленно элюируются после определенной степени их удерживания, в зависимости от их загрузки; затем ионы второго металла могут быть элюированы сильной кислотой. В частности, при разделении аналогичных металлических ионов, таких как ионы лантанидов или актинидов, оба металлических иона могут образовывать комплекс, но в различной степени при различных значениях pH, так что после их ввода в смолу осуществляется дифференциальное элюирование растворами с повышающейся концентрацией сильной кислоты. Может использоваться анионообменная смола с задерживанием анионных комплексов первого металла и элюированием некомплексованных ионов второго металла и любых катионных комплексов первого металла. Обычно при осуществлении этих процессов водный раствор ионов первого металла, образующих комплекс с комплексообразователем, и ионы второго металла разделяются на ионообменной смоле, например, на смоле, с которой связывается по меньшей мере один из металлов, и по меньшей мере один другой металл отделяется от этой смолы.
При использовании комплексообразователей при обогащении и других условиях, в которых образуется осадок фосфатной (аналога серной) соли с металлическими ионами, выделенными в результате разложения, водная фаза может легко возвращаться в рецикл. Необходимо лишь использование резервуара для осаждения (или другого разделительного устройства), осуществлять удаление водной фазы и повторно использовать ее с вводом комплексообразующего агента.
Пример 1. 1-Оксиэтан-1,1-дифосфоновая кислота (HEDPA) (VIII) (70%-ный водный раствор) сначала очищается путем кристаллизации из раствора уксусной кислоты, полученной путем ввода 3 об.ч. ледяной уксусной кислоты в 1 ч. раствора HEDPA.
Затем получается тетранатриевая соль HEDPA путем ввода 4 эквивалентов 1 Мол. гидрата натрия (NaOH) в очищенную HEDPA в воде. После перемешивания в течение 30 мин водный растворитель удаляется в вакууме при 50oC, в результате чего получается твердая тетранатриевая соль HEDPA.
Эта тетранатриевая соль гидрата HEDPA (240 г) затем вводится в стеклянную пробирку 6,5x75 см двумя порциями. Эта стеклянная пробирка присоединяется к вращающемуся мотору, который вращает ее со скоростью 5 об/мин. Затем к вращающемуся мотору подсоединяются конденсатор и вакуумная система. После установления вакуума примерно 25 мм рт.ст. пробирка вставляется в трубчатую печь диаметром 7,8 см (3 дюйма). Температура в печи повышается примерно до 400oC, и пробирка поддерживается при этой температуре в течение 3 ч. После охлаждения до комнатной температуры полученный окрашенный в рыжевато-коричневый цвет твердый продукт (180 г), включающий 60 мас. VDPA, растворяется в 330 мл воды при температуре 95oC. Медленно вводится метанол до тех пор, пока горячий водный раствор не становится мутным. Нагрев осуществляется до тех пор, пока этот водный раствор не становится снова прозрачным. Этот теплый раствор затем накрывают и, не перемешивая его, медленно охлаждают до комнатной температуры. Полученный белый твердый продукт извлекают путем фильтрации и в результате получается 185,5 г тетранатриевой соли VDPA. Эта соль VDPA имеет степень чистоты более, чем 95% как показывает ионная хроматография и методы 1Н ЯМР и 31Р ЯМР спектроскопии.
Свободная VDPA кислота получается путем растворения натриевой соли и кислотного ионообмена, как описано в нижеследующем примере 2(а). Смещение спектра 31Р ЯМР кислоты в 0,2 Мол. D2O составляет 12,11 м.д. (относительно 85% H3PO4, как внешнего стандарта). Свободная кислота VDPA разлагается в течение нескольких часов в кипящей азотной кислоте и в водном растворе перекисью водорода при 60oC в присутствии ванадата натрия.
Пример 2 (а). Раствор, содержащий 36,7 г тетранатриевой соли VDPA (II) в 100 мл воды, медленно пропускается через колонку, содержащую 133 г BIORAD AG МР-50, ионообменной смолы, выпускаемой BiO Rad. После ввода в колонку дополнительно вводится 100 мл воды для завершения элюирования мононатриевой соли VDPA.
(b) В полученный раствор вводится 1,6 г вольфрамата натрия и 54 мл 30% -ной перекиси водорода, затем раствор нагревается до 60oC в течение 3 ч. После охлаждения до комнатной температуры продукт HEDRA (X) извлекается одним из двух способов:
Способ А.
Разбавленный водный раствор гидрата окиси натрия (NaOH) вводится по каплям в указанный выше охлажденный раствор до тех пор, пока не достигается величина pH, равная 6,2. Водный растворитель затем концентрируется в вакууме с образованием белого сиропообразного продукта. Вводится примерно 50 мл ацетона, и полученная смесь механически перемешивается в течение примерно одного часа. Ацетоновый растворитель декантируется и в смесь вводится еще 50 мл свежего ацетона. После повторной декантации ацетонового растворителя получаемая соль DHEDPA (25 г, выход 90% степень чистоты 85%) высушивается в вакууме в течение ночи при 50oC. Полученный продукт DHEDPA соль (X) идентифицируется путем анализа методами 1Н ЯМР и 31Р ЯМР спектроскопии. 15% присутствующих примесей составляют фосфат натрия и пирофосфат натрия.
Способ В.
Карбонат натрия (22,2 г) медленно вводится в указанный выше раствор с одновременным перемешиванием. Объем этого раствора снижается примерно наполовину с использованием вращающегося испарителя при комнатной температуре. В раствор вводится ацетон (200 мл) и затем полученная смесь перемешивается в течение примерно одного часа. Ацетоновый растворитель декантируется и затем данная процедура повторяется. Полученный белый твердый продукт высушивается в вакууме при 50oC, в результате получается соль DHEDPA (X) с выходом 90%
Свободная кислота DHEDPA получается из водного раствора натриевой соли способом А или В путем элюирования катионообменной смолы в кислотной форме. Свободная кислота DHEDPA (0,2 Мол. в D2O) имеет химическое смещение спектра 31Р ЯМР, равное 14,59 ч./млн. но загрязнена незначительным количеством фосфорной кислоты (химическое смещение 3,10 ч./млн.), причем оба эти смещения относительно внешнего стандарта 85% H3PO4.
Свободная кислота DHEDPA, самопроизвольно разлагающаяся при комнатной температуре с полупериодом разложения примерно 15 дн, разлагается полностью в течение 3 ч в кипящей 8 Мол. азотной кислоте и в водном растворе в присутствии перекиси водорода при температуре примерно 60oC.
Пример 3. Метилоксалилхлорид (10 мл, 110 ммоль) охлаждается до 0oC в азоте и затем в него по каплям вводится триметилфосфат (12,8 мл, 100 ммоль) в течение 45 мин, в результате чего получается раствор, который медленно нагревают до комнатной температуры в течение 2 ч, в результате чего получается триметиловый сложный эфир оксалофосфоната (выход 98%), структура которого подтверждается путем анализа методами 13С ЯМР и 31Р ЯМР спектроскопии. Полученный продукт растворяют в простом диэтиловом эфире (30 мл), в результате чего получается раствор, который охлаждают до 0oC. В этот раствор вводят по каплям в течение 2 ч раствор диметилфосфита (9,8 мл, 100 ммоль) и ди-н-бутиламина (1,4 мл, 8,5 ммоль) в простом диэтиловом эфире (50 мл), и затем этот раствор медленно нагревается до комнатной температуры. Эфирный растворитель выпаривается с использованием азота, в результате чего остается масло (26 г, выход 70%) пентаметилового сложного эфира карбоксиоксиметандифосфоновой кислоты, структуру которой подтверждают спектры 13С ЯМР и 31Р ЯМР.
В перемешанный раствор этого сложного эфира (5 г, 16,3 ммоль) в четыреххлористом углероде (10 мл), охлажденном до 0oC, медленно вводят раствор иодотриметилсиламина (8,2 мл, 58,1 ммоль) в четыреххлористом углероде (10 мл), после чего полученный раствор тщательно перемешивают с одновременным нагревом до комнатной температуры. Вводят воду (6 мл) и перемешивание продолжается в течение 1 ч, в результате чего образуется водная и органическая фазы, которые разделяются. Водная фаза промывается четыреххлористым углеродом (2 x 15 мл). Водная фаза содержит карбоксиоксиметандифосфоновую кислоту (выход 60%). Спектры 13С ЯМР и 31Р ЯМР соответствуют данной структуре (в углеродном спектре) с синглетом при 161,44 м.д. (карбоксилат) и с триплетом при 19,5 м.д. (четвертичный углерод метана) (Ip-c-p 536 Гц) и (в спектре фосфора) с сигналом при 10,5 м. д. с загрязняющей фосфорной кислотой при 3,10 м.д. (относительно 85% H3PO4, как внешнего стандарта). Свободная карбоновая кислота разлагается при комнатной температуре с полупериодом разложения примерно 2-3 дн.
Пример 4. Данные комплексообразователи находят особенно полезное применение для "очистки" растворителей, используемых в процессах TRUEX для удаления радиоактивных отходов.
Раствор процесса TRUEX, содержащий 0,2 Мол. октил-(фенил)-N,N-диизобутилкарбамоилфосфиноксид и 1,2-молярный трибутилфосфат в додекане, содержит уран (VI), плутоний (VI) и америций (III). Аликвотные порции этого раствора контактируют при 25oC с водными растворами азотной кислоты различных концентраций в присутствии и в отсутствии VDPA. В таком случае органический и водный растворы перемешиваются друг с другом, и затем фазы разделяются и анализируются на уран, плутоний и америций с определением коэффициентов распределения между органической и водной фазами. Результаты представлены в табл.2.
В случае водных фаз 10-1 и 5•10-1 Мол. HNO3 и VDPA, VDPA очень эффективна в отношении удаления металлических ионов из органического растворителя.
В случае водной фазы мол. HNO3 и VDPA, VDPA избирательно удаляет уран и плутоний и оставляет америций в органической фазе. В случае водной фазы 5 Мол. HNO3 и VDPA, VDPA, предпочтительно, удаляет плутоний по сравнению с ураном и америцием.
После разделения водные фазы, содержащие азотную кислоту и VDPA, и комплекс VDPA кипятятся в течение ночи, в результате чего происходит разложение комплекса и комплексообразующего агента с образованием фосфорной кислоты, двуокиси углерода и воды и с выделением металлических ионов.
Пример 5. Осуществляются процессы, как и в примере 4, с раствором процесса TRUEX, как и в примере 4, который подвергнут гидролитическому и радиолитическому разложению. Подвергнутый разложению раствор, содержащий америций, уран и плутоний, контактирует при температуре 25oC с водным 0,25 Мол. раствором VDPA в объемном отношении 5 1, в результате чего получаются органическая и водная фазы, которые разделяются и анализируются. Затем это контактирование, разделение и анализ повторяются еще два раза со свежими порциями водных растворов VDPA, в результате чего получаются две дополнительные водные отделяемые фазы. Коэффициенты разделения представлены в табл.3.
Таким образом, данный процесс очень эффективен в отношении удаления изотопных загрязнений из подвергнутого разложению раствора процесса, в результате чего остается очищенный раствор.
После этого разделения водные фазы разлагаются с выделением металлических ионов путем ввода перекиси водорода в виде двух порций, в результате чего получаются 1-молярные растворы в каждом случае и небольшое количество ванадата натрия, и осуществляется нагревание при 60oC в течение 16 ч. Комплекс VDPA разлагается с выделением металлических ионов и образованием фосфорной кислоты, воды и двуокиси углерода.
Пример 6. В качестве удаляющих агентов используют водные растворы комплексообразователя, описанного в данной патентной заявке, с осуществлением процесса с использованием жидкостной мембраны на носителе, для удаления урановых загрязнений из почвенной воды. При осуществлении данного процесса почвенная вода, содержащая 10 моль урана, подкисляется до значения pH 2 путем ввода небольших количеств серной кислоты, и она проходит через пористые полипропиленовые полые волокна в модуле с жидкостной мембраной на носителе. Поры мембраны заполняются 0,1 Мол. бис(2,4,4-триметилпентил)фосфиновой кислотой в н-додекане. Удаляющий раствор, содержащий 0,25 моль VDPA, циркулирует к наружной части полых волокон и взаимодействует с органическим экстрагентом в порах с удалением из них металлических ионов.
Содержание урана в почвенной воде снижается до 10-8 Мол. Удаляющий раствор, как обнаружено, содержит 10-1 Мол. урана. VDPA разлагается в результате смешивания удаляющего раствора с избытком водной перекиси водорода и небольшим количеством ванадата натрия и нагревания этого удаляющего раствора до 60-70oC в течение ночи (примерно 15 ч), в результате чего получается содержащий уран продукт для извлечения или удаления, а также двуокись углерода, вода и фосфорная кислота.
Пример 7. Путем осуществления такой же общей процедуры, как описано в примере 4, получают водный удаляющий раствор 0,25 Мол. VDPA и 0,25 Мол. щавелевой кислоты, содержащий 0,005 Мол. плутония (IV). В этот раствор вводят перекись водорода до концентрации 0,1 Мол. и ванадат натрия до концентрации 0,002 Мол. Полученный раствор нагревается в течение полутора часов при 80oC, затем вводится дополнительно такое же количество перекиси водорода, и нагревание продолжается еще в течение полутора часов при 80oC, в результате чего получается объемный белый осадок. При дальнейшем нагревании этот белый осадок превращается в зернистый светло-розовый твердый продукт. Радиометрический анализ всплывшего раствора показывает, что осаждается 99,6% плутония. Комплекс VDPA разлагается с выделением иона плутония, который образовывал нерастворимый оксалат плутония.
Пример 8. Таким же образом, как описано в примере 4, раствор неодимия (III) в растворителе процесса TRUEX образовывается водным удаляющим раствором VDPA для удаления неодимия, в результате чего получается органическая фаза, которая отделяется от водного раствора 0,2 Мол. Nd и 0,25 Мол. VDPA. В последний водный раствор вводится ванадат натрия (0,002 Мол.) и перекись водорода до концентрации 0,1 Мол. и полученный раствор нагревается в течение полутора часов при 80oC, после чего вводится второе такое же количество перекиси водорода и осуществляется дополнительный нагрев в течение полутора часов при 80oC. Образуется зернистый осадок фиолетового цвета; при дальнейшем нагреве в течение шести часов больше осадка не образуется. Этот осадок отделяется и идентифицируется, как NdPO4•1/2H2O, в то время, как анализ поверхностного раствора показал, что выпало в осадок 98% неодимия.
Пример 9. Органическая фаза, содержащая Co (III) и Fe (III) и 2-этил-гексилфосфонат в додекане, контактирует с водным раствором 1,2-диоксиэтан-1,1-дифосфоновой кислоты (DHEDPA) при 25oC, в результате чего получается органическая фаза, содержащая CO (II), фаза водного раствора, содержащая Fe (III) комплекс DHEDPA, которые разделяются.
Водный раствор комплекса Fe (III) DHEDPA с величиной pH менее 2 выдерживается при комнатной температуре в течение одной недели, и в течение этого периода времени образуется некоторое количество осадка, и затем выдерживается в течение еще трех недель, и в течение этого времени образуется еще большее количество осадка. Анализ поверхностного раствора не обнаружил никаких признаков присутствия DHEDPA, подтверждая его разложение, в то время, как осадок представлял собой фосфат трехвалентного железа.
Пример 10. Константы кислотной диссоциации (рКа) указанных ниже комплексообразователей определялись путем потенциометрического титрования. В приведенной ниже таблице суммированы константы трех замещенных дифосфоновых кислот, отвечающих данному изобретению, которые были определены в NaNO3 с ионной силой 2 Мол. и сопоставлены с константами щавелевой кислоты и фосфорной кислоты, определенными в растворе с ионной силой 1 Мол.
Результаты представлены в табл.4.
Данные табл. 4 показывают, что дифосфоновые кислоты, отвечающие данному изобретению, являются сильными кислотами, особенно DHEDPA, имеющими структурную формулу (X). Низкие константы кислотной диссоциации имеют очень важное значение для комплексообразователей, отвечающих данному изобретению, для действия их, как эффективных агентов комплексования металлических ионов при низких значениях pH.
Исследовали комплексообразование металлических ионов данными комплексообразователями, используя метод коэффициента распределения экстракционного растворителя. Среда, используемая во всех исследованиях процессов протонирования и комплексообразования, представляла собой 2,0 Мол. NaNO3/HNO3. Были получены данные снижения коэффициента распределения (Do/D) при измерении концентрации свободного лиганда, и данные  (среднее протонное число) при потенциометрических титрованиях.
(среднее протонное число) при потенциометрических титрованиях.
Измерения констант устойчивости комплексов иона редкоземельного металла и актинида с комплексообразователем осуществляли одним из двух способов в зависимости от типа комплексуемого металлического иона. Для нерадиоактивных металлических ионов или ионов с низкой удельной активностью, таких как редкоземельные элементы, например, для ионов европия, тория и урана, константы устойчивости определяли методами обычного потенциометрического титрования в сочетании с расчетным анализом методом наименьших квадратов. Такой подход требует осуществления кислотно-щелочного титрования смесей металлического иона и комплексообразователя. Титрование осуществлялось при изменяющихся условиях, например, при различных отношениях металла к лиганду и общей концентрации металла, что позволяло точно определить все подходящие константы распределения (обычно 2-6 в зависимости от структуры комплексообразователей, как многоосновных кислот, образующих комплексные продукты общей формулы MHhLI, где M представляет собой металлический ион, H ионы водорода, h число ионов водорода, L комплексообразователь и I число лигандов комплексообразователя).
Осуществляли экспериментальный способ выбора Am и Pu для определения влияния комплексообразующего агента на коэффициент распределения при выбранных экстракционных системах в фазах жидкость жидкость. Так, например, коэффициент распределения DAm или DPu измеряли, используя в качестве экстракционного растворителя бис(2-этилгексил)фосфорную кислоту (HDEHP), как функцию концентрации комплексообразующего лиганда в водных фазах при изменяющихся значениях pH. По мере увеличения концентрации комплексообразующего агента коэффициент распределения уменьшался. Это снижение коэффициента распределения математически связно с концентрацией комплексообразующего агента, и константы устойчивости этих комплексов определяли путем операций подгонки методом наименьших квадратов. Многоосновный характер термодинамически неустойчивых комплексообразующих агентов требует осуществления экспериментов с различными значениями коэффициентов распределения, как функции, как концентрации комплексообразующего агента, так и величины pH, для точного определения типа комплексов металлического иона.
При условии обратной экстракции и равновесия комплексообразования нижеследующие уравнения демонстрируют влияние водного комплексообразования на коэффициенты распределения. Если коэффициенты распределения представить как:
D [M]орг/[M]вод,
где [M]орг концентрация металлического иона в органической фазе;
[M]вод концентрация металлического иона в водной фазе,
то коэффициент распределения металлического иона в присутствии и отсутствии водного хелатообразующего агента будет определен следующим образом: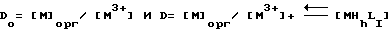
где [M3+] концентрация M3+ в водном растворе, и
[MHhLI] представляет собой сумму концентраций комплексов металлического иона, и где MHhLI моноядерные протонированные комплексы металлического иона с комплексообразующим агентом. Если считать, что комплексы металлического иона MHhLI не экстрагируются в органическую фазу, то "фактор удаления", [(Do/D)-1] определяется, как показатель способности комплексообразующего агента удалять или задерживать металлический ион в водной фазе. Фактор удаления является показателем, определяющим степень снижения коэффициентов распределения в условиях, имеющих место в водной фазе. Обычно фактор удаления относится в равной степени к нейтральным и кислотным экстрагентам.
В табл. 5 показаны факторы удаления [(Do/D)-1] для концентрации комплексообразующего агента европия III, для 3-дифосфонатных комплексообразователей и щавелевой кислоты. Концентрация водородного иона во всех водных фазах составляла 0,1 Мол. Данные для щавелевой кислоты приведены для сравнения, поскольку она в настоящее время известна, как очень эффективный удаляющий агент, но обычно действие ее ограничивается до следовых концентраций металлического иона ввиду низкой растворимости многих оксалатных комплексов. Фактор удаления Do/D-1 при общей концентрации кислоты 0,1 Мол.
Табл. 5 показывает, что при заданной концентрации комплексообразующего агента каждая дифосфоновая кислота, отвечающая данному изобретению, имеет значительное преимущество перед щавелевой кислотой, и эти различия изменяются по мере изменения кислотности водной фазы.
Из данных табл.5 и из дополнительных данных, найденных при значениях концентрации водородного иона H+ вплоть до 0,01 Мол. получены различные водные равновесия с различными значениями h и I в комплексах формулы MHhLI.
Выведенные коэффициенты равновесия представлены в таблице, в которой, как указано, требуются четыре равновесия, чтобы прийти к соответствию с данными Eu-VDPA, и требуется пять равновесий, чтобы прийти к соответствию с данными Eu-HEDPA.
Следовательно, для системы Eu-HEDPA соотношение компонентов комплексов, то есть стехиометрическое отношение металла к комплексообразующему агенту в комплексе металлического иона, составляет 1 3, в то время как для VDPA стехиометрическое отношение металла к комплексообразующему агенту не превышает 1 2.
Константы кислотной диссоциации и константы устойчивости металлического иона комплексообразователей могут использоваться в качестве руководства для использования комплексообразователей, как агентов обратного задерживания и реагентов удаления. Такая корреляция имеет очень важное значение, поскольку обычно невозможно экспериментально подтвердить все возможные условия, в которых может использоваться комплексообразователь.
В каждом указанном выше случае с Eu (III) органические растворы Eu (III) в HEDEHP смешиваются с водными растворами с различной концентрацией каждого комплексообразователя для удаления Eu из органической фазы в водную фазу. Водная и органическая фазы разделяются и анализируются и определяются факторы удаления.
Водные растворы Eu дифосфонатных комплексов VDPA и HEDPA в 8 Мол. азотной кислоте кипятятся в течение ночи, и в результате происходит разложение комплексообразователя и выделение иона Eu (III).
Пример 11. Осуществляя общую процедуру примера 4, органический раствор нитрата урана (VI) в растворителе TRUEX смешивают с водным раствором 1-оксиэтан-1,1-дифосфоновой кислоты (HEDPA), и в результате получается органическая фаза и удаленный водный раствор, содержащий 0,1 Мол. уранилового комплекса с 0,25 Мол. HEDPA, которые разделяются.
В удаленный водный раствор вводят перекись водорода до концентрации 4 Мол. и ванадат натрия до концентрации 10-3 Мол. Полученный раствор нагревают до 80oC в сосуде с мешалкой, обратным холодильником и поглотителем гидрата окиси натрия и выдерживают при этой температуре с перемешиванием в течение пяти часов. По прошествии примерно полутора часов начинает образовываться желтый осадок и это образование осадка продолжается и далее. В процессе нагревания газообразная двуокись углерода удаляется и собирается в скруббере. После пяти часов нагрева полученная суспензия фильтруется, и в результате получается твердый продукт и фильтрат, который подвергается анализу; фильтрат свободен от HEDPA и других фосфорорганических соединений, но содержит фосфорную кислоту (как показывает спектр 31Р ЯМР) и уксусную кислоту. Твердый продукт представляет собой фосфат урана.
| название | год | авторы | номер документа |
|---|---|---|---|
| СМЕСЬ ДЛЯ РАСТВОРЕНИЯ ОКИСЛОВ МЕТАЛЛОВ И СПОСОБ ИХ РАСТВОРЕНИЯ | 1991 |
|
RU2096499C1 |
| СПОСОБЫ ИЗВЛЕЧЕНИЯ ЦЕННЫХ МЕТАЛЛОВ ИЗ ТАНТАЛ-НИОБИЕВЫХ РУД, СОДЕРЖАЩИХ НЕРАСТВОРИМЫЕ ФТОРИДЫ | 1997 |
|
RU2180927C2 |
| ВОДНЫЙ РАСТВОР ДЛЯ ВЫЩЕЛАЧИВАНИЯ БЛАГОРОДНЫХ МЕТАЛЛОВ (ВАРИАНТЫ) | 1990 |
|
RU2102507C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-( 4'- ИЗОБУТИЛФЕНИЛ)ПРОПИОНОВОЙ КИСЛОТЫ (ИБУПРОФЕНА) (ЕГО ВАРИАНТЫ) | 1988 |
|
RU2005715C1 |
| ХИМИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ ДИОКСИДА ХЛОРА | 2000 |
|
RU2220092C2 |
| СПОСОБ БЕЗВОДНОГО ПОЛУЧЕНИЯ АЛЬДЕГИДОВ C-C | 1989 |
|
RU2024481C1 |
| СПОСОБ ГИДРОФОРМИЛИРОВАНИЯ | 2015 |
|
RU2674698C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ МЕТАЛЛА ИЗ ЕГО ОРГАНИЧЕСКОГО КОМПЛЕКСА | 1994 |
|
RU2125477C1 |
| КАТАЛИТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ГИДРОФОРМИЛИРОВАНИЯ ЭТИЛЕНОКСИДА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ 1,3-ПРОПАНДИОЛА И 3-ГИДРОКСИПРОПИОНОВОГО АЛЬДЕГИДА | 1991 |
|
RU2038844C1 |
| ЛЮМИНЕСЦЕНТНЫЕ НАНОЧАСТИЦЫ С ЯДРОМ И ОБОЛОЧКОЙ | 2004 |
|
RU2346022C2 |
Дифосфоновые кислоты и их производные, такие как винилиден-1,1-дифосфоновая кислота и 1,2-диоксиэтан-1,1-дифосфоновая кислота, комплексуют ионы металлов, особенно в II-IV окисленных состояниях, в результате чего образуются водорастворимые комплексы, особенно в сильно кислотной среде. После комплексообразования металлический комплекс отделяют и затем металл извлекают путем разложения в мягких условиях, предпочтительно и/или окисления, с высвобождением металла для его удаления или извлечения и с образованием, в основном, безвредных для окружающей среды побочных продуктов. 23 з.п. ф-лы, 6 табл.
или I
где заместители Х и Y выбраны из группы Н, галоген,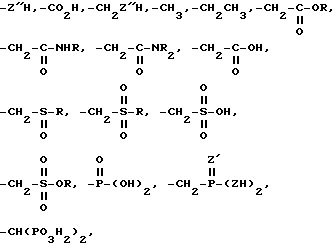
где R C1 C3-алкильная группа;
Z, Z', Z" кислород или сера;
заместители R' H, С1 С4-алкил, металл группы IA, NH
и проводят разложение комплекса металл комплексообразователь с получением иона металла в водной фазе с последующим выделением иона металла из водной фазы.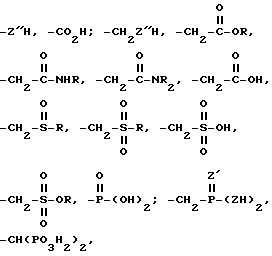
где R, Z, Z', Z" имеют указанные значения.
Приоритеты по пунктам:
01.11.88 по пп. 2,4,7;
12.05.89 по пп.1, 3, 5, 6, 8 24.
Приоритет по признакам:
01.11.88 по признакам: в пп.1,3,6, где замесители Z кислрод;
2.05.89 остальные признаки.
| УСТРОЙСТВО ИЗМЕРЕНИЯ КРОВЯНОГО ДАВЛЕНИЯ | 2009 |
|
RU2515862C2 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1997-09-27—Публикация
1989-10-31—Подача