Изобретение относится к новым замещенным циклическим производным 1,3-оксатиолана, обладающим фармакологической активностью, к способам их получения и промежуточным соединениям, используемым при их получении, к содержащим эти производные фармацевтическим композициям и к использованию этих производных для лечения вирусных заболеваний млекопитающих.
Ретровирусные инфекции являются серьезной причиной заболеваний и что примечательно синдрома приобретенного иммунодефицита (СПИД). Вирус иммунодефицита человека (ВИЧ) признан этиологическим агентом СПИДа и в связи с этим ведется активный поиск соединений, оказывающий ингибирующее действие на мультипликацию ВИЧ.
Mitsuya et al. с сотр. сообщает о "3'-Азидо-3'-дезокситимидине (В W 509U) как о противовирусном средстве, ингибирующем инфекционность и цитопатичное действие лимфотропного вируса типа 111 Т-лимфоцитов человека, связанного с лимфоденопатией вируса in vitro", Proc. Natl. Acad. Sci. США, 82, с. 7096 7100 (1985) и ссылается на соединение формулы (А) (3'-азидо-2',3'-дидезокситимидин, обычно называемый АЗТ. Это соединение, как указано, может быть использовано для некоторой защиты носителей СПИДа от цитопатогенного действия вируса иммунодефицита (ВИЧ).

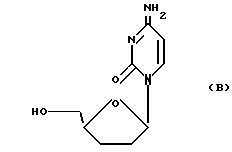
В работе Mitsuya с сотр. "Ингибирование инфекционности и цитопатического действия лимфотропного вируса типа 111 Т-лимфоцитов человека, связанного с лимфоденопатией вируса (HTLB-111/LAV) с помощью 2', 3'-дидезоксинуклеозидов", Proc. Natl. Acad. Sci. США, 86, стр. 1911 15( 1986) также ссылается на группу 2',3'-дидезоксинуклеотидов, отраженных формулой (B),которые, как указано, обладают защитной активностью по отношению к вызванной ВИЧ цитопатогенности.
В работе Balgarini с сотр. "Сильное и селективное анти-HTLV-111-LAV действие 2',3'-дидезоксицитидинена-2',3'-незамещенного производного 2',3'-дидезоксицитидина", Biochem. Biophys. Res. Comm. 140, стр. 735 742 (1986) ссылается на ненасыщенный аналог таких нуклеозидов (2',3'-дидезоксицитидин, отраженный формулой (C), как характеризующих противоретровирусной активностью.

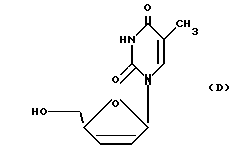
В работе Baba с сотр. "2',3'-дидезокситимидин и его 2',3'-ненасыщенное производное сильные и селективные ингибиторы репликации вируса иммунодефицита человека in vitro", Biochem. Biophys. Res. Comm. 142, стр. 128 34 (1987) ссылаются на 2',3'-незамещенный аналог, представленный формулой (D), 2', 3'-дидезокситимидина. Этот аналог, как указано, является селективным ингибитором репликации ВИЧ.
Аналоги АЗТ, известные как 3'-азидо-2',3'-дидезоксиуридины, представленные формулой (E), в которой Y представляет бром или йод, как указано, обладают ингибирующим действием по отношению к лейкемии Молони мышей. См. T. S. Lin с сотр. "Синтез и противовирусная активность различных 3'-азидо, 3'-амино, 2', 3'-ненасыщенных и 2',3'-дидезокси аналогов пиримидина, дезоксирибонуклеозидов по отношению к ретровирусам" J. Med. Chem. 30, стр. 440 41 (1987).

И, наконец, 3'-фтораналоги 2',3'-дидезоксицитидина /формула (G)/, указаны в работе Herdewijn с сотр. "3'-замещенные аналоги 2',3'-дидезоксинуклезидорв в качестве потенциальных анти-ВИЧ (HTLV-III/LAV) агентов", J.Med. Chem. 30, стр. 1270 1278 (1987), как обладающие сильной противовирусной активностью.

Таким образом, наиболее сильными из вышеперечисленных анти-ВИЧ соединений являются 2',3'-дидезоксинуклеозиды, более конкретно 2',3'-дидезоксицитидин (ddCyd) и 3'-азидо-2',3'-дидезокситимидин (AzddThd или АЗТ). Эти же соединения активны и по отношению к другим видам ретровирусов, таким как вирус лейкемии Молони мышей. Вследствие роста случае заболевания СПИДОм с угрозой для жизни расширяются усилия, направленные на открытие и создание новых нетоксичных и мощных ингибиторов ВИЧ и веществ, блокирующих инфекционность ВИЧ. Таким образом, целью изобретения является создание эффективности анти-ВИЧ соединений с низкой токсичностью, а также создание легко доступного способа синтеза таких соединений.
Нами открыт структурно определенный класс соединений, а именно 2-замещенных-5-замещенных-1,3-оксатиоланов, для которых обнаружена противоретровирусная активность. В частности, было найдено, что эти соединения действуют как нетоксичные ингибиторы репликации ВИЧ-1 в Т-лимфоцитах продолжительные периоды времени.
Таким образом, в первом аспекте изобретения дается соединение формулы (1)
где R1 представляет водород; R2 представляет радикал, выбранный из формул, приведенных в конце описаний.
Специалисту понятно, что соединения формулы (1) имеют по меньшей мере два хиральных центра (обозначены в формуле (1) знаком *), вследствие чего существуют в виде двух пар оптических изомеров (т.е. энантиомеров) и их смесей, в том числе и рецемических смесей. Кроме того, соединения формулы (1) могут являться либо цис-изомерами (формулы II), либо транс-изомерами (формула III) или смесью этих изомеров. Каждый из цис- и транс-изомеров может существовать как один из двух энантиомеров или в виде смеси энантиомеров, в том числе и в виде рацемической смеси. Все эти изомеры и их смеси, включая рацемические смеси, включены в объем изобретения.
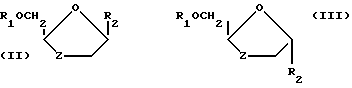
Соединения формулы (1) предпочтительно существуют в виде цис-изомеров.
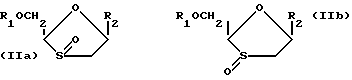
Также понятно, что если z представляет s 0, то соединения существуют в двух дополнительных изомерных формах, представленных формулами (IIa) и (IIb), отличающихся друг от друга конфигурацией оксидного атома кислорода относительно 2,5-заместителей. Соединения изобретения дополнительно охватывают такие изомеры и их смеси.
Предпочтительно R2 представляет радикал формулы ,
,
где R3 и R4 принимают вышеуказанные значения.
Под "фармацевтически приемлемым производным" имеется ввиду любая фармацевтически приемлемая соль, сложный эфир или соль такого сложного эфира соединения формулы (1) или иного соединения, способного при введении реципиенту образовывать прямо или косвенно соединение формулы (1) или его противовирусно активный метаболит или остаток.
Для специалиста очевидно, что соединения формулы (1) могут быть модифицированы с образованием его фармацевтически приемлемых производных по функциональным группам как в фрагменте основания R2, так и в гидроксиметильной группе оксатиоланового цикла. Модификации по этим функциональным группам включены в объем изобретения. Однако особый интерес представляют фармацевтически приемлемые производные (напр. сложные эфиры), полученные модифицированием 2-гидроксиметильной группы оксатиоланового цикла.
Рекомендуемые сложные эфиры соединений формулы (1) включают соединения, в которых R1 заменена карбоксильной функцией  , где некарбонильную часть R сложноэфирной группы выбирают из водорода, алкила нормального или изо-строения (например, метила, этила, н-пропила, трет-бутила, н-бутила), алкоксиалкила (например, метоксиметила), аралкила, (например, бензила), арилоксиалкила (напр. феноксиметила), арила (напр. фенила, возможно замещенного галогеном, C1-C4-алкилом C1-C4-алкокси-группой); замещенного дигидропиридинила (напр. N-метилдигидропиридинила); сульфонатных эфиров, таких как алкил или аралкилсульфонил (напр. метансульфонил); сульфатных эфиров; аминокислотных эфиров (напр. L-валила или L-изолейцила) и моно-, ди- и трифосфатных эфиров.
, где некарбонильную часть R сложноэфирной группы выбирают из водорода, алкила нормального или изо-строения (например, метила, этила, н-пропила, трет-бутила, н-бутила), алкоксиалкила (например, метоксиметила), аралкила, (например, бензила), арилоксиалкила (напр. феноксиметила), арила (напр. фенила, возможно замещенного галогеном, C1-C4-алкилом C1-C4-алкокси-группой); замещенного дигидропиридинила (напр. N-метилдигидропиридинила); сульфонатных эфиров, таких как алкил или аралкилсульфонил (напр. метансульфонил); сульфатных эфиров; аминокислотных эфиров (напр. L-валила или L-изолейцила) и моно-, ди- и трифосфатных эфиров.
В число таких эфиров также включены эфиры, образованные из полифункциональных кислот, таких как карбоновые кислоты, содержащие более одного карбоксила, например дикарбоновые кислоты формулы HO2C(CH2)nCO2OH, где n 1 10 (например, янтарная кислота) или фосфорные кислоты. Способы получения таких эфиров хорошо известны. См. например, Hahn с сотр. "Димеры нуклеотидов в качестве средств, направленных на вирус иммуннодефицита человека", Nucleotide Analogues, стр. 156 159 (1989г.) и Busso с сотр. "Димеры нуклеотидов, подавляющих экспрессию ВИЧ in vitro", AIDS Research and Human Retroviruses, 4 (6), стр. 449 455 (1988г.). При образовании эфиров из таких кислот каждая кислотная группа предпочтительно этерифицирована соединением формулы (I) или другими нуклеозидами, или их аналогами и производными с образованием сложных эфиров формулы (IV)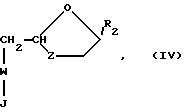
где W представляет PO
Что касается вышеописанных сложных эфиров, если нет особых указаний, то любой алкильный фрагмент преимущественно содержит 1 16 атомов углерода, предпочтительно 1 4 атома углерода и может содержать одну или несколько двойных связей. Любой арильный фрагмент, присутствующий в таких эфирах, преимущественно представляет собой фенил.
В частности, это может быть C1-C16-алкиловый эфир, незамещенный бензоиловый эфир или бензоиловый эфир, замещенный по меньшей мере одним галогеном (бромом, хлором, фтором или йодом), насыщенным или ненасыщенным C1-C6-алкилом, насыщенной или ненасыщенной C1-C6-алкоксигруппой, нитрогруппой или трифторметилом.
Фармацевтически приемлемые соли соединений формулы (I) включают соли, образованные с фармацевтически приемлемыми органическими или неорганическими кислотами и основаниями. Примеры приемлемых кислот включают хлористоводородную, бромистоводородную, серную, азотную, перхлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, п-толуолсульфоновую, винную, уксусную, лимонную, метансульфоновую, бензойную, малоновую, нафталин-2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, такие как щавелевая, хотя и не являются фармацевтически приемлемыми, могут быть использованы для получения солей, применимых в качестве промежуточных продуктов для получения соединений изобретений и их фармацевтически приемлемых солей с кислотами.
Соли, образованные с соответствующими основаниями, включают щелочнометаллические соли (напр. натриевые), соли щелочноземельного металла (напр. магниевые), аммониевые соли и соли иона NR
В последующем ссылки на соединение изобретения включают как соединения формулы (I), так и их фармацевтически приемлемые производные.
Конкретные примеры соединений формулы (I) включают
цис-2-гидроксиметил-5-(цитозин-1'-ил)-1,3-оксатиолан;
транс-2-гидроксиметил-5-(итозин-1'-ил)-1,3-оксатиолан и их смеси;
цис-2-бензоилоксиметил-5-(цитозин-1'-ил)-1,3-оксатиолан;
транс-2-бенхоилоксиметил-5-(цитозин-1'-ил)-1,3-оксатиолан и их смеси;
цис-2-гидроксиметил-5-(N'4-ацетил- цитозин-1'-ил)-1,3-оксатиолан;
транс-2-гидроксиметил-5-(N'4-ацетил- цитозир-1'-ил)-1,3-оксатиолан и их смеси;
цис-2-бензоилоксиметил-5-(N'4-ацетил- цитозин-1'-ил)-1,3-оксатиолан;
транс-2-бензоилоксиметил-5-(N'4-ацетил- цитозин-1'-ил)-1,3-оксатиолан и их смеси;
цис-2-гидроксиметил-5-(цитозин-1-ил)-3-оксо-1,3-оксатиолан;
цис-2-гидроксиметил-5-(N-диметиламино- метиленцитозин-1'-ил)-1,3-оксатиолан;
бис-цис-2-сукциеилоксиметил-5-(цитозин-1'-ил)-1,3-оксатиолан;
цис-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиолан;
транс-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиолана и их смеси;
цис-2-гидроксиметил-5(6'-гидроксипурин-N-9'-ил)-1,3-оксатиолан;
цис-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолан;
транс-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолан и их смеси;
цис-2-гидроксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолан;
цис-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолан;
транс-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолан и их смеси;
цис-2-гидроксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолан;
цис-2-гидроксиметил-5-(5'-фторцитозин-1'-ил)-1,3-оксатиолан и их фармацевтически приемлемые производные.
Соединения изобретения или сами обладают противовирусной активностью и/или способны к метаболизму в такие соединения. В частности, эти соединения эффективны в ингибировании репликации ретровирусов, включая ретровирусы человека, такие как вирусы иммунодефицита человека (ВИЧ), являющихся причиной возникновения СПИДа.
Таким образом, в качестве еще одного аспекта изобретения дается соединение формулы (I) или его фармацевтически приемлемое производное, предназначенное для применение в качестве активного терапевтического средства, в частности противовирусного средства, например для лечения ретровирусных инфекций.
В еще одном или альтернативном аспекте изобретении дается способ лечения вирусных заболеваний, в частности вызванных ретровирусом инфекций, таким как ВИЧ у млекопитающих, в том числе и человека, способ заключается в введении эффективного количества противовирусного соединения формулы (I) или его фармацевтически приемлемого производного.
Кроме того, еще в одном или альтернативном аспекте изображения дается применение формулы (I) или его фармацевтичевки приемлемого производного для приготовления лекарства, предназначенного для борьбы с вирусными инфекциями.
Соединения изобретения также применимы для лечения связанных со СПИДом состояний, таких как родственный СПИДу комплекс (ARC), стойкая генерализованная лимфоденопатия (PGL), связанные со СПИДом невралогические состояния (такие как слабоумие), состояния с антиВИЧ положительными антителами и состояния с ВИЧ-положительной реакцией, саркома, Капоси, тромбоцитопениа пурпура и условно патогенные инфекции.
Соединения изобретения также применимы для профилактики или развития до клинического заболевания отдельных лиц, имеющих анти-ВИЧ антитела или ВИЧ-положительный антиген, а также для профилактики состояний после заражения ВИЧ.
Соединения формулы (I) или их фармацевтически приемлемые производные могут быть также использованы для предотвращения заражения вирусом биологических жидкостей, таких как кровь или семенная жидкость in vitro.
Отдельные соединения формулы (I) также применимы в качестве промежуточных соединений при получении других соединений изобретения.
Для специалиста очевидно, что ссылки здесь на лечение распространяются и на профилактику, также как на лечение выявленных инфекций и симптомов.
Также понятно, что количество соединения изобретения, необходимое для лечения, будет меняться не только в зависимости от выбранного соединения, но также от пути введения, природы подвергаемому лечению состояния, возраста и состояния больного, и полностью находится в компетенции лечащего врача или ветеринара. Как правило, однако, приемлемая дозировка будет составлять интервал 1-750 мг/кг массы тела в день, например, 3-120 мг/кг массы тела реципиента в день, предпочтительно 6-90 мг/кг/день, наиболее предпочтительно 15-60 мг/кг/день.
Целевая дозировка может быть дана в виде разовой дозы или в виде раздельных доз, вводимых через соответствующие интервалы, например в виде двух, трех, четырех и более субдоз ежедневно.
Соединение обычно вводят в единичной дозировочной форме, содержащей, например 10-1500 мг, обычно 20-1000 мг, более обычно 50-700 мг активного компонента в единичной дозировочной форме.
В идеальном случае активный компонент необходимо ввести таким образом, чтобы пиковая концентрация активного компонента в плазме была 1-75 мкм, предпочтительно 2-50 мкм, наиболее предпочтительно 3-30 мкМ. Этого можно достигнуть, например, внутривенной инъекцией 0,1-5%-ного солевого раствора активного компонента, возможно в солевом растворе или введением в виде болюса, содержащего 0,1-110 мг/кг активного компонента. Целевые концентрации в крови могут быть достигнуты непрерывным вливанием с обеспечением 0,01-5 мн/кг/ч или прерываемыми вливаниями, содержащими 0,4-15 мг/кг активного компонента.
Хотя в лечебных целях и возможно введение соединения изобретения в виде сырого химиката, тем не менее рекомендуется давать активный компонент в виде фармацевтического состава.
Таким образом, изобретением кроме того дается фармацевтический состав, содержащий соединение формулы (I) или его фармацевтически приемлемое производное в смеси с одним или несколькими фармацевтически приемлемыми носителями и возможно другими лечебными и/или профилактическими компонентами. Носитель(и) должен быть "приемлемым" в смысле совместимости с другими компонентами состава и не оказывать вреда реципиенту.
Фармацевтические составы включают составы, пригодные для перорального, ректального, назального, местного (в том числе трансбуккального и подъязычного), вагинального или парентерального (в том числе внутримышечного, подкожного и внутривенного) введения или в форме, приемлемой для введения ингаляцией или инсуффляцией. Составы могут быть введены там, где это необходимо, в отдельных дозировочных формах и приготовлены любым хорошо известным в фармации способом. Все способы включают стадию смешивания активного соединения с жидкими носителями или мелко измельченными твердыми носителями, или с тем и другим с последующим, если необходимо формованием продукта в целевой состав.
Фармацевтические составы, пригодные для перорального введения, могут представлять собой дискретные единичные формы, такие как капсулы, области, таблетки, в каждой из которых содержится заданное количество активного компонента, порошков или гранул в виде растворов, суспензий или эмульсий. Активный компонент может также присутствовать в болюсе, электуария или пасте. Таблетки и капсулы для перорального введения могут содержать обычные добавки, такие как связующие средств, наполнители, смазки, размельчители или смачивающие средства. На таблетки может быть нанесено хорошо известными способами покрытие. Пероральные жидкие препараты могут иметь вид, например, водных или масляных суспензий, растворов, эмульсий, сиропов или элексиров или могут представлять собой сухой продукт, предназначенный для разбавления водой или другим приемлемым носителем перед употреблением. Такие жидкие препараты могут включать обычные добавки, такие как суспендирующие средства, эмульгаторы, неводные носители (в том числе и пищевые масла) или консерванты.
Соединения изобретения могут быть также введены в парентеральны составы (например, для инъекции, такой как болюсная инъекция или непрерывное вливание), могут присутствовать в единичной дозировочной форме в ампулах, предварительно заполненных шприцах, вливаний небольшого объема или комплекте с несколькими дозами с добавленным консервантом. Композиции могут представлять собой суспензии, растворы или эмульсии в масляном или водном носителе и могут включать вспомогательные средства, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Или же активный компонент может представлять собой порошок, приготовленный асептическим выделением стерильного твердого компонента путем лиофилизации раствора с последующим разбавлением перед употреблением приемлемых носителем, например стерильной, не содержащей пирогена водой.
Для местного нанесения на эпидермий соединения изобретения могут быть в виде мазей, кремов, лосьонов или пластырей. Мази и кремы могут быть приготовлены, например, на водной или масляной основе с добавлением приемлемого загустителя и/или гельобразующего средства. Лосьоны могут быть приготовлены на масляной или водной основе и, кроме того, как правило, включают один или несколько эмульгаторов, стабилизаторов, диспергирующих средств, суспендирующих средств, загустителей или красителей.
Составы, пригодные для местного употребления в ротовой полости, включают ложиджис, содержащий активный компонент во вкусовой основе, обычно сахарозе, камеди акации или тригиканте; пастилки, содержащие активный компонент в инертной основе, такой как желатин и глицерин или сахароза и камедь акации; и средство для полоскания рта, содержащее активный компонент в приемлемом жидком носителе.
Фармацевтические составы, пригодные для ректального введения и содержащие твердый носитель, наиболее предпочтительно имеют вид свеч с единичной дозой. Приемлемые носители включают масло какао и другие материалы, обычно применяемые для этой цели, и свечи обычно готовят смешиванием активного соединения с размягченным или расплавленным носителем(ями) с последующим охлаждением и формованием в форме.
Составы для вагинального введения могут иметь вид пессария, тампона, крема, геля, пасты, пены или состава для опрыскивания, содержащих кроме активного компонента такие носители, которые подходят для данной конкретной цели.
Для внутриназального введения соединения изобретения могут быть использованы в виде состава для впрыскивания или диспергируемого порошка, или в капельной форме.
Капельная форма может быть приготовлена на водной или неводной основе, содержащей, кроме того, одно или несколько диспергирующих средств, солюбилизирующих средств или суспендирующих средств. Жидкие составы для впрыскивания обычно поступают из находящихся под давлением контейнеров.
При введении путем ингаляций соединения изобретения обычно поступают из инсуффлятора, распылителя или находящегося под давлением контейнера, или иного обычного устройства для подачи аэрозольного состава. Находящиеся под давлением контейнеры могут содержать приемлемый пропеллант, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, двуокись углерода или другой приемлемый газ. В случае находящегося под давлением аэрозоля единичная дозировка может быть задана с помощью предусмотренного клапана, подающего отмеренное количество смеси.
Или же для введения ингаляцией или инсуффляцией соединения изобретения могут иметь вид сухой порошковой композиции, например порошковый смеси соединения и приемлемого порошкового основания, такого как лактоза или крахмал. Порошковая композиция может представлять собой единичную дозировочную форму, например капсулы или патрона или, например, желатиновых или пузырьковых упаковок, из которых порошок может быть введен с помощью ингалятора или инсуффлятора.
При желании вышеописанные составы могут быть преобразованы в составы с продленным выделением активного компонента.
Фармацевтические композиции изобретения могут включать и другие активные компоненты, такие как противомикробные средства или консерванты.
Соединения изобретения могут быть также использованы в сочетании с другим лечебными средствами, к примеру с другими противоинфекционными средствами. В частности, соединения изобретения могут приниматься вместе с известными противовирусными средствами.
Таким образом, еще одним аспектом изобретения дается комбинация, включающая соединения формулы (1) или его физиологически приемлемое производное в смеси с другими терапевтически активным средством, в частности противовирусным средством.
Указанные комбинации обычно предназначены для применения в виде фармацевтического состава и таким образом фармацевтические составы, содержащие вышеуказанные комбинации в смеси с фармацевтически приемлемым носителем, представляют еще один аспект изобретения.
Приемлемые терапевтические средства, предназначенные для таких комбинаций, включают ациклические нуклеозиды, такие как ацикловир, ганцикловир, интерфероны, такие как альфа-, бета- и гамма-интерферон; глюкуронационные ингибиторы, такие как пробеницид; ингибиторы переноса нуклеозида, такие как дипиридамол; аналоги нуклиозидов, такие как: 3'-азидо-2', 3'-дидезокситимидин, 2', 3'-дидезоксицитидин, 2', 3'-дидезоксиаденозин, 2', 3'-дидезоксиинозин, 2', 3'-дидезокситимидин, 2', 3'-дидезокси -2', 3'-дидегидротимидин и 2', 3'-дидезокси-2', 3'-дидегидроцитидин, а также рибавирин, иммуномодуляторы, такие как интерлейкин 11(IL2) и фактор, стимулирующий колонию гранулоцитных макрофагов (GM-CSF), эритропойэтин, амплиген, тимомодулин, тимопентин, фоскарнет, ингибиторы, такие как 2-дезокси-D-глюкоза, кастаноспермин, 1-дезоксинойиримицин, ингибиторы связывания ВИЧ с рецепторами CD4, такие как растворимые CD4, фрагменты CD4 и гибридные молекулы CD4.
Отдельные компоненты таких комбинаций могут быть введены или по отдельности или одновременно в виде отдельных или смешанных фармацевтических составов.
При использовании соединения формулы (1) или его фармацевтически приемлевого производного в сочетании со вторым терапевтическим средством, активным к тому же вирусу, доза каждого соединения может быть той же самой или отличаться от дозы, применяемой при отдельном использовании соединения. Необходимая доза может быть легко определена специалистом.
Соединения формулы (1) и их фармацевтически приемлемые производные могут быть синтезированы любым применяемым способом получения соединений аналогичного строения.
Символы R1 и R2 в нижеследующих формулах вышеприведенные значения, если нет особых указаний.
В одном из таких способов (А) используют реакцию 1,3-оксатиолана формулы (VIII)
где R1 представляет водород или защитную для гидроксила группу и L является способной к замещению или атомом с соответствующим основанием R2-H; применяемые группы L включают алкоксикарбонил, такой как этоксикарбонил или галогены, например йод, бром или хлор, или радикал -OR, в котором R представляет замещенный или незамещенный, насыщенный или ненасыщенный алкил, например, C1-C6-алкил, такой как метил или R представляет замещенный или не замещенный, алифатический или ароматический ацил, напр. алифатический C1-C6-ацил, такой как ацетил и ароматический ацил, такой как бензоил.
Соединение формулы (VIII) вводят в реакцию с соответствующим пуриновым или пиримидиновым основанием формулы R2-H, (предварительно силилированным с помощью силилирующего агента, такого как гексаметилдисилазан) в приемлемом растворителе, таком как хлористый метилен, в присутствии кислоты Льюиса (такой как четыреххлористый титан или хлорид олова (IV) или триметилсилилтрифлата.
1,3-оксатиолан формулы (VIII) может быть приготовлен, например, реакцией альдегида формулы (VII) с меркаптоацеталем формулы (VI) в приемлемом органическом растворителе, таком как толуол, в присутствии кислотного катализатора, такого как п-толуолсульфокислота или кислота Льюиса, например хлористый цинк.
(VI) HSCH2CH(OC2H5)2; C6H5COOCH2CHO (VII)
Меркаптоацеталь формулы (VI) может быть синтезирован известными способами. См. например, G. Hesse and J. Torder, "Меркаптоацетальдегид и диокси -1,4-дитиан", Chem. Ber. 85, стр.924-932 (1952).
Альдегид формулы (VII) может быть получен известными способами. См. например, E. G. Halloquist and H.Hibbert, "Исследования в области связанных с углеводами и полисахаридами. Часть XLIV. Синтез изомерных бициклических ацетальных простых эфиров", Can. J. Research, 8, стр.129-136 (1933).
Полученное соединение формулы (1) превращают в другое соединение формулы (1) путем взаимопревращения оснований. Подобное взаимопревращение может быть осуществлено либо простым химическим превращением (напр. превращением урацилового основания в цитозин) или путем использования, например дизоксирибозилтрансферазы. Такие способы и условия их осуществления хорошо известны в области химии нуклеозидов.
В другом способе соединения формулы (1) могут быть получены реакцией соединения формулы (IX)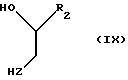
с соединением формулы (X)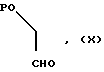
где P представляет защитную группу с последующим удалением защитной группы.
Соединение формулы (IX) может быть синтезировано реакцией приемлемого эпоксида формулы (XI)
с соответствующим серосодержащим соединением, например тиоацетатом натрия. Соединения формулы (XI) либо известны, либо могут быть синтезированы по аналогичным методикам.
Многие из вышеупомянутых реакций имеют обширную литературу в контексте синтеза пуриновых нуклеозидов. См. например, "Аналоги нуклеозидов: химия, биология и применение в медицине", под ред. R.T.Walker et al. Пленум Пресс, Нью-Йорк, стр. 193-223, текст данной публикации вводится здесь в качестве ссылки.
Очевидно, что вышеприведенные реакции могут потребовать применения защитных групп или могут быть осуществлены с использованием исходных соединений с защищенными функциональными группами, вследствие чего для получения целевого соединения может оказаться необходимым удаление на промежуточной или конечной стадии защитной группы. Защита и снятие защиты с функциональных групп могут быть осуществлены с помощью обычных средств. Примеры приемлемых защитных для гидроксила групп включают алкил (например, метил, трет-бутил или метоксиметил), аралкил (например, бензил, дифенилметил или трифенилметил), гетероциклические группы, такие как тетрагидропиранил, ацил (например, ацетил или бензоил) и силильные группы, такие как триалкилсилил (например, трет-бутилдиметилсилил). Защищающие гидроксил группы могут быть удалены обычными методами. Так, например, алкил, силил, ацил и гетероциклические группы могут быть удалены сольволизом, например гидролизом в присутствии кислоты или основания. Аралкильные группы, такие как трифенилметил, могут быть так же удалены сольволизом, например кислотным или щелочным гидролизом. Аралкильные группы, такие как бензил, могут быть отщеплены, например, обработкой эфиратом BF3 и уксусным ангидридом с последующим удалением ацетатных групп, образующихся на соответствующих стадиях синтеза. Силильные группы могут бать легко удалены использованием источника фторид-ионов, такого как тетра-н-бутиламмонийфторид.
В вышеописанных способах соединения формулы (1), как правило, образуются в виде смеси цис- и транс-изомеров.
Эти изомеры могут быть разделены, например, ацетилированием, например обработкой уксусной ангидридом с последующим разделением физическими методами, например хроматографией на силикагеле и дезацетилированием, например обработкой метанольным раствором аммиака или же фракционной кристаллизацией.
Фармацевтически приемлемые соли соединений изобретения могут быть получены так, как описано в патенте США N 4383414, описание которого вводится здесь в виде ссылки. Так, например, если необходимо получить соль соединения формулы (1) с кислотой, продукт, полученный по любому из вышеприведенных способов, может быть превращен в соль обработкой полученного свободного основания кислотой использованием обычных методик. Фармацевтически приемлемые соли с кислотами могут быть получены реакцией свободного основания с соответствующей кислотой, возможно в присутствии приемлемого растворителя, такого как сложный эфир (например, этилацетат), спирта (напр. метанол, этанол или изопропанол). Соли с неорганическими основаниями могут быть получены реакцией свободного основания соединения формулы (1) с соответствующим основанием, таким как алкоксид (например, метоксид натрия), возможно в присутствии растворителя, такого как спирт (например, метанол). Фармацевтически приемлемые соли могут быть также получена из других солей, в том числе других фармацевтически приемлемых солей соединений формулы (1) использованием обычных методик.
Соединение формулы (1) может быть превращено в фармацевтически приемлемый фосфат или иной сложный эфир в реакции с фосфорилирующим агентом, таким как POCl3 или приемлемым этерифицирующим агентом, таким как галоидангидрид кислоты или ангидрид. Сложный эфир или соль соединения формулы (1) могут быть превращены в исходное соединение, например, гидролизом.
Так, где соединение формулы (1) желательно иметь в виде отдельного изомера, тот может быть получен либо разделением конечного продукта, либо стереоспецифичным синтезом из изомерно чистого исходного соединения или любого обычного промежуточного соединения.
Разделение конечного продукта, исходных или промежуточных соединений на изомеры, может быть осуществлено любым известным способом. См. например, стереохимию соединений углерода, E.L. Eliel (МасГроу Хилл, 1962), а также таблицу разделяющих средств, S.H.Wilen.
Далее изобретение иллюстрируется нижеследующими примерами, которые ни в коей мере не предназначены для его ограничения. Все температуры даны в градусах Цельсия.
Пример 1. Диэтилацеталь 2-тиобензоилацетальдегида
C6H5COS-CH2CH(OC2H5)2 (Y)
К раствору трет бутоксида калия (11,5 г, 0,11 моль) в ДМФА (100 мл) добавляют тиобензойную кислоту (17 г, 0,11 моль) и раствор частично испаряют в вакууме, двумя последовательными порциями добавляют бензол (2•30 мл) и каждый раз испаряют в вакууме. К остаточному раствору ДМФА добавляют диэтилацеталь бромацетальдегида (20,3 г, 0,1 моль) и смесь перемешивают 15 ч при 120oС. После охлаждения смесь переносят в воду (500 мл), экстракт промывают водным раствором NaHCO3, затем водой, сушат и растворитель удаляют в вакууме. Остаток разгоняют в вакууме и получают 17,2 г чистого соединения (V), т. кип. 131-133oС/0,07 мм.
1H-ЯМР σ (ч/мин, CDCl3): 7,97 (д, 2H, -ароматические), 7,47 (м, 2H, ароматические), 4,59 (т, 1H,-CH(OC2 H5)2), 3,66 (м, 4H, 2•OCH2 CH3), 3,3 (д, 2H, SCH2), 1,23 (т, 6H, 2•OCH2CH3).
Пример 2. Диэтилацеталь меркаптоацетальдегида
HSCH2CH(OC2H5)2 (YI)
Описанное в предыдущем тиобензоилпроизводное (V) (17,2 г) растворяют в 100 мл ТГФ, после чего добавляют 6 г NaOH в 20 мл H2O. Смесь кипятят в атмосфере N2 15 ч, затем охлаждают, разбавляют водой (200 мл) и продукт экстрагируют эфиром (3•200 мл). Экстракт сушат, растворитель удаляют в вакууме и перегонкой остатка в вакууме получают 7,1 г чистого соединения (VI), т.кип. 60-62oC/18 мм.
1H-ЯМР s (ч/мин, CCl3): 4,51 (т, 1H, CH(OC2H5)2), 3,51 (м, 4H, 2• OCH2CH3), 2,65 (дв. д, 2H, H-CH2), 1,54 (т, 1H,HS), 1,23 (т, 6H, 2•OCH2CH3).
Пример 3. Бензоилоксиацетальдегид
C6H5COOCH2CHO (YII)
Заглавное известное промежуточное соединение синтезировано ранее не описанным способом на основе известного 1-бензоилглицерина. А именно 50 г последнего в смеси 500 мл CH2Cl2 и 25 мл H2O обрабатывают порциями 80 г NaIO4 (интенсивное перемешивание при комнатной температуре). По окончании прибавления перемешивание продолжает 2 ч, после чего добавляют 100 г MgSO4 и перемешивание продолжают еще 30 мин. Смесь фильтруют, фильтрат испаряют в вакууме и перегонкой остатка в вакууме получают 26 г чистого соединения (VII), т.кип. 92-94oC (0,25 мм).
1H-ЯМР (200 МГц, CDCl3, ТМС-внутренний стандарт) s (ч/млн) 9,71 (с, 1H, -C HO), 8,11 (ж, 2H, ароматические ), 7,6 (м, 1H, ароматические), 7,46 (м, 2H, ароматические), 4,88 (с, 2H, -CH2CHO).
Пример 4. 2-Бензоилоксиметил-5-этокси-1,3-оксатиолан
Ранее описанный ацеталь меркаптоацетальдегида (VI) (7 г) смешивают в 100 мл толуола с 7 г вышеописанного бензоилоксиацетальдегида (VII), несколькими кристаллами п-толуолсульфокислоты и смесь нагревают в атмосфере N2 на масляной бане при 120oC. Образующемуся этанолу позволяют отгоняться, смесь выдерживают при 120oC еще 30 мин, затем охлаждают, промывают водным раствором NaHCO3, сушат и испаряют в вакууме. Перегонкой остатка в вакууме получают 9,8 г чистого соединения (XIII) в виде смеси цис- и транс-изомеров, т. кип. 140 143oC /0,1 мм, Rf 0,51 (гексан-EtOaC).
σ (ч/млн, CDCl3) 8,05 (м, 2H, ароматические), 7,57 (м, 1H, ароматический), 7,43 (м, 2H, ароматические), 5,55 (м, 2H, C2-H C5-H), 4,55 (м, 2H, C2-C6H5CO2CH2), 3,8 (м, 1H, C5-C6H5CO2CH2), 3,76 (м, 1H, C5-OCH2 CH3), 3,17 (м, 2H, C4-H2), 1,21 (т, 3H, C5-OCH2CH3).
Пример 5. Цис- и транс-2-Бензоилоксиметил-5- цитозин-1'-ил-1,3-оксатиолана
Смесь 2,7 г цитозина, 30 мл гексаметилдисилазана (ГМДС) и триметилсилилхлорида (ТМСХ) кипятят в сухом N2 до образования прозрачного раствора (3 ч) и избыток реагентов испаряют в вакууме. Оставшиеся летучие компоненты удаляют в глубоком вакууме (15 мин), твердый остаток переносят в 250 мл 1,2-дихлорэтана и в сухом аргоне добавляют 5 г вышеописанного ключевого промежуточного соединения (XIII) в 50 мл дихлорэтана и затем 4,7 мл триметилсилилтрифлата (ТМСТФ). После трехдневного кипячения в токе аргона смесь охлаждают и переносят в 300 мл насыщенного водного раствора NaHCO3. Органический слой отделяют, водную фазу экстрагируют CH2Cl2 (2•100 мл), объединенные экстракты промывают водой, сушат и испаряют в вакууме. Остаток очищают хроматографией на силикагеле с применением в качестве элюента CH2Cl2-CH3OH (9 1) и получают 2,5 г чистой смеси цис-/транс-(XIV) в отношении 1 1, что подтверждено данными 1Н-ЯМР. Смесь разделена в виде N -ацетилпроизводных по методике, описанной в нижеследующем примере.
Пример 6. Цис- и транс-изомеры 2-бензоилоксиметил-5-(N'4- ацетилцитозин-1'-ил)-1,3-оксатиолана
Описанную в предыдущем примере смесь (XIV) (2,5 г) в 100 мл сухого пиридина, содержащего 0,1 г 4 диметиламинопиридина (ДМАП), обрабатывают уксусным ангидридом (7 мл) при комнатной температуре и спустя 6 ч смесь переносят в холодную воду, после чего экстрагируют CH2Cl2 (3•150 мл). Экстракт промывают водой, сушат и испаряют в вакууме. К остатку добавляют толуол, затем испаряют в вакууме, остаточное масло очищают хроматографией на силикагеле (EtOAc-CH3OH 99 1) и получают 1,35 г чистого транс- (XV) в виде более быстро вымываемого продукта и 1,2 г чистого цис-(XV) в виде медленно вымываемого продукта. Оба охарактеризованы 1Н-ЯМР спектроскопией. Транс-(XV), т. пл. 158 160o, Rf 0,48 (EtOAc-CH3OH 95 5).
УФ (CH3OH) λmax: 297 нм
σ (ч/млн, CDCl3): 9 (уш. 1H, C'4-H-Ac), 8,06 (м, 2H, ароматические), 7,74 (д, 1H, C'6-H), 7,56 (м, 1H, ароматические), 7,47 (д, 1H, C'5-H), 7,45 (м, 2H, ароматические), 6,53 (дв. д, 1H, C5-H), 5,89 (дв. д, 1H, C2-H), 4,46 (дв. д, 2H, C2-CH2 OCOC6H5), 3,66 (дв. д, 1H, C4-H), 3,32 (дв. д, 1H, C4-H), 2,25 (с, 3H, NH-COCH3).
Цис-(XV), т. пл. 150 152oС, Rf 0,4 (EtOAc-MeOH 95 5).
УФ (CH3OH) lmax: 297 нм.
1Н-ЯМР δ (ч/млн, CDCl3) 9,03 (уш. 1H, NH-Ac), 8,21 (д, 1H, C'6- H ), 8,05 (м, 2H, ароматические), 7,6 (м, 1H, ароматический), 7,5 (м, 2H, ароматические), 7,29 (д, 1H, C'5-H), 6,34 (дв. д, C5-H), 5,52 (дв. д, 1H, C2-H), 4,48 (дв. д, 2H, C2-CH2OCOC6H5), 3,66 (дв. д, 1H, C4-H), 3,24 (дв. д, 1H, C4-H), 2,23 (с, 3H, NH-COCH3).
Пример 7. Цис- и транс-2-гидроксиметилш-5- (цитозин-1'-ил)-1,3-оксатиоланы
a) транс-(XVI). В 100 мл метального раствора аммиака при 24oС растворяют 375 мг ранее полученного транс-(XV) и перемешивают 16 ч, после чего растворитель удаляют в вакууме, а остаток кристаллизуют из эфира и после перекристаллизации из смеси этанола с эфиром получают 1741 мг чистого продукта, т.пл. > 220oС (разл.), охарактеризованного 1H- и 13C-ЯМР спектрами.
1H-ЯМР σ (ч/млн), ДМСО-d6): 7,57 (д, 1H, C'6-H,7,18 (д, 2H, C'4N H2, 6,30 (дв. д, 1H, C'5- H, 5,48 (1, 1H, C2 H5,18 (т, 1H C2-CH2OH, 5,45 (м, 3H, C2-CH2+ C4-H), 3,06 (дв. д, 1H, C4-H).
УФ (CH3OH) lmax 270 нм.
13C-ЯМР (ДМСО-d6, Вариант XL-300) σ (ч/млн):
C'2; C'3; C'5; C'6; C5; C4; C2; CH2OH
154,71; 165,7; 93,47; 140,95; 87,77; 36,14 86,80; 64,71
b) цис-(XVI). Обработкой по вышеприведенной методике 375 мг цис-(XV) получают 165 мг чистого продукта, перекристаллизованного из смеси этанола с эфиром, т.пл. 171-173o, охарактеризованного 1H- и 13C-ЯМР спектрами.
1H-ЯМР- s (ч/млн, ДМСО- d6): 7,8 (дж, 1H, C'6-H), 7,2 (д, 2H, C'4NH2), 6,18 (т, 1H, C5 H), 5,7 (д, 1H, C'5 H), 5,14 (т, 1H, C2CH2OH), 3,71 (м, 2H C2C H2OH), 3,4 (дв. д, 1H, C4-H), 2,99 (дв. д, 1H, C4-H).
УФ (CH3OH) lmax270 нм.
13C-ЯМР σ (ч/млн, ДМСО-d6):
C'2; C'4; C'5; C'6; C5; C4; C2 CH2OH
154,63; 165,59; 93,86; 140,91; 86,47; 36,22; 85,75; 62,79
Пример 8. Цис-2-Гидроксиметил-5-(цитозин-1'-ил)-3-оксо-1,3-оксатиолан
Ранее полученный изомер цис-(XVI) (100 мг) в 30 мл охлажденного льдом метанола обрабатывают 93 мг м-хлорнадбензойной кислоты. После 15-ти минутного перемешивания выделяется белый осадок, который отделяют и промывают 10мл метанола с получением чистого изомера a сульфоксида. Метанольный фильтрат испаряют с вакууме, твердый остаток промывают 15 мл смеси этанола с эфиром (1:) и затем 30 мл эфира с получением чистого изомера b сульфоксида. Оба изомера охарактеризованы 1H-ЯМР спектрами.
Изомер (XVII)a.
Т. пл. > 270oС (разл.), Rf= 0,3 (CH2Cl2-MeOH 3:1). УФ (CH3OH) λmax 270 нм.
σ (ч/мл, ДМСО-D6): 7,68 (д, 1H, C'6-H), 7,36 (с, 2H, C4'-NH2), 6,69 (дв. д, 1H, C5- H), 5,76 (д, 1H, C5'- H), 5,47 (т, 1H, C2 CH2OH), 4,63 (дв. д, 1H, C2-H), 3,88 (м, 1H, C2-CH-OH), 3,72 (м, 1H, C2-CH2-OH), 3,36 (дв. д, 1H, C4-H), 3,05 дв. д. 1H, C4-H).
Изомер (XVII)b.
Т.пл. > 220oС (разл.), Rf 0,32 (CH2Cl2-MeOH 3 1) s (ч/млн/ ДМСО-d6) 7,76 (д, 1H, 66'- H), 7,28 (д, 2H, C4-NH2), 6,66 (дв. д, 1H,C5- H ), 5,77 (д, 1H, C5'- H), 5,45 (т, 1H, C2-CH2OH), 4,64 (т, 1H, C2-H), 3,77 (т, 2H, C2-CH2 OH), 3,65 (дв. д, 1H, C4- H), 3,17 (дв. д, 1H, C4-H).
Пример 9. Цис-2-гидроксиметил-5- (N-диметиламинометиленцитозин-1'-ил)-1,3-оксатиолан.

В 10 мл N-диметилфомамид-диметилацеталя (ДМФА-диметилацеталь) суспендируют 300 мг цис-2-гидроксиметил -5- (цитозин-1'-ил)-1,3-оксатиолана и смесь перемешивают при комнатной температуре около суток (18ч). Летучие компоненты удаляют испарением при пониженном давлении и перекристаллизацией остатка из смеси этанола с эфиром получают 345 мг (93%) чистого продукта, т. пл. 162-164oС; Rf=0,56 (CH2Cl2-MeOH 4:1).
УФ λmax 325 нм.
1E-ЯМР σ (ч/млн, ДМСО-d6): 8,64 (1H, N=CH-N), 8,04 (д, 1H, д, 1H, C6'-H, J=7,2 Гц), 6,22 (т, 1H, C5-H, J=4,9 Гц), 5,97 (д, 1H, C5'-H, J=7,2 Гц), 5,37 (т,1H, -OH, J=5,8 Гц, D2O-обмен), 5,22 (т, 1H, C2-H, J=4,4 Гц), 3,77 (т, 2H, C2CH2OH, J=4,9 Гц), 3,5 (дв. д, 1H, C4-H, J=4,9 и 9,9 Гц), 3,17 (с, 3Hz, -CH3), 3,12 (дв, д, 1H, C4-H, J=4,2 и 11,9 Гц), 3,04 (с, 3H,-CH3).
Пример 10. Бис-цис-2-сукцинилоксиметил-5- (цитозин-1'-ил)-1,3-оксатиолан
В 10 мл сухого пиридина растворяют 284 мг цис-2- гидроксиметил-5-(N,N-диметиламинометиленцитозин-1'-ил)-1,3-оксатиолана и охлаждают в бане со льдом до 0oC. Шприцем прибавляют 60 мкл сукцинилхлорида и перемешивают около суток (18 ч). Затем смесь переносят в 50 мл насыщенного раствора NaHCO3, экстрагируют хлористым метиленом (3•50 мл), объединенный раствор CH2Cl2 промывают водой (2•50 мл) и сушат над MgSO4. После фильтрования растворитель удаляют испарением при пониженном давлении. Пенистый остаток растворяют в 10 мл CH2Cl2, содержащих 5 мл метанола, добавляют 2 мл 80%-ной водной уксусной кислоты и смесь перемешивают около суток при комнатной температуре. Затем смесь испаряют досуха и после очистки твердого остатка на силикагеле (CH2Cl2-MeOH 4: 1) получают 145 мг (54%) чистого продукта, т.пл. > 230oC (разл.) Rf=0,23 (CH2Cl2-MeOH 4:1).
УФ (MeOH) λmax 271 нм.
1-H-ЯМР σ (ч/млн, ДМСО-d6: 7,69 (д, 2H, 2•C6'-H, J=7,6 Гц), 7,28 (д, 4H, 2• NH2, 24,9 Гц, D2O-обмен), 6,24 (т, 2H, 2• C5-H, J=5,6 Гц), 5,76 (д, 2H, 2•C5'-H, J= 7,4 Гц), 5,35 (т, 2H, 2•C2-H, J=4,5 Гц), 4,37 (д, 2•C2-CH2O-), 3,42 (дв. д, 2•C4-H, J=5,5 и 10,9 Гц), 3,1 (дв. д, 2H, 2•C4-H, J=5,6 и 11,7 Гц), 2,6 (с, 4H, 2•-CH2-C-O).
Пример 11. Цис- и транс-2- бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиоланы
В 50 мл гексаметилдисилазана (ГМДС), содержащих 50 мг (NH4)2SO4 кипятят 1,7 г 6-хлорпурина до момента образования прозрачного раствора (1 ч). Избыток ГМДС удаляют при пониженном давлении, маслянистый остаток сушат 1 ч в глубоком вакууме и затем растворяют в 100 мл сухого 1,2-дихлорэтана.
В круглодонной колбе на 500 мл двукратным испарением с 50 мл бензола сушат 2,7 г 2-бензоилксиметил-5-этокси-1,3-оксатиола (XIII) и затем растворяют в 200 мл сухого 1,2-дихлорэтана.
Затем с помощью канюли в атмосфере аргона переносят раствор силилированного 6-хлорпурина в раствор 1,3-оксатиолана. В реакционную колбу добавляют 11 мл ТМС-трифлата (триметилсилилтрифторметансульфоната), кипятят 5 ч и охлаждают до комнатной температуры. Затем смесь переносят в 300 мл насыщенного раствора бикарбоната натрия (раствор NaHCO3) при перемешивании, органический слой отделяют, а водную фазу экстрагируют CH2Cl2Cl2 (2•100 мл). Объединенную органическую фазу промывают водой, сушат над MgSO4, фильтруют и испаряют при пониженном давлении. Очисткой и разделением остатка на силикагеле (гексан-этилацетат 7:3) получают 1,5 (26%) менее полярного продукта в виде пены, идентифицированного как альфа или транс-изомер, и 710 мг другого компонента, идентифицированного как бета- или цис-изомер. Общий выход 46,1% отношение цис-/транс-1:1,4.
транс-изомер ( α - -изомер): Rf=0,43 (гексан-EtOAc 1:1)
УФ (MeOH) λmax264,7 нм
1H-ЯМР (CDCl3): 8,76 (c, 1H, C8'-H), 8,48 (с, 1H C2'-H), 8,06 (м, 2H, ароматические), 7,56 (м, 1Н, ароматический), 7,45 (м, 2Н, ароматические), 6,9 (дв.д, 1Н, C5- H, J=5 Гц), 5,78 дв. д, 1Н, C2- H, J=6 Гц), 4,56 (м, 2Н, C2-CH2 OCOC6H5), 3,74 (m, 2H, C4-H).
цис-изомер β --изомер): Rf=0,35 (гексан-EtOAc 1:1)
УФ (MeOH) λmax:264,7 нм
1H-ЯМР (CDCl3): 8,72 (c, 1H, C8'-H), 8,51 (c,1H, C2'-H), 8(м, 2H, ароматические), 7,56 (м, 1H, ароматический), 7,44 (м.2H, ароматические), 6,61 (т, 1H, C5-N, J=4,7 Гц), 5,62 (т,1H, C2-H, J=4,9 Гц), 4,69 (м, 2Н, C2CH2OCOC6H5), 3,66 (м. 2H, C4-H).
Пример 12. Цис-2-Гидроксиметил-5-(6'-гидроксипурин- -9)-ил)-1,3-оксатиолан (производное инозина)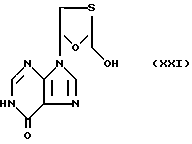
В 25 мл метанола растворяют 533 мг цис-2- бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиолана, к раствору добавляют 5 г гидроксида натрия (NaOH) и 3 мл воды и смесь кипятят 5 ч. Охлажденную до комнатной температуры смесь затем разбавляют 100 мл воды, нейтрализуют пиридиниевой смолой и фильтруют. Остаток смолы промывают 100 мл метанола, объединенный фильтрат испаряют при пониженном давлении. Очисткой остатка на силикагеле (CH2Cl2-MeOH 4: 1) получают 183 мг (51%) чистого продукта, идентифицированного как производное инозина, т.пл. 208-210oC. Rf=0,27(EtOAc-MeOH 4:1).
УФ (MeOH) λmax: 246 нм.
1H-ЯМР σ (ч./млн, ДМЦО-d6): 12,42 (с, 1H, -NH, D2O-обмен), 8,36 (с, 1Н, C8'-H), 8,07 (c, 1H, C'2-1H), 6,37 (т, 1H, C5-H, J=5,1 Гц), 5,29(т, 1Н, -OH, J= 6 Гц, D2O-обмен), 5,24 (т, 1Н, C2-H, J=4,9 Гц), 3,63 (м, 4Н, 2Н от C4-H и 2Н от CH2-OH).
Пример 13. Цис- и транс -2- бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-октиолан
В 30 мл ГМДС в присутствии 50 мг (NH4)2SO4 кипятят 760 мг урацила до момента, потока раствор не станет прозрачным. Затем смесь испаряют при пониженном давлении, остаток сушат 1 ч в высоком вакууме и растворяют в 100 мл сухого 1,2-дихлорэтана.
В круглодонной колбе на 500 мл двукратным испарением с 50 мл бензола сушат 1,5 г 2-бензоилоксиметил -5- этокси-1,3-оксатиолана и растворяют в 150 мл сухого 1,2-дихлорэтана.
С помощью канюли в атмосфере аргона раствор силилированного урацила переносят в раствор оксатиолана, добавляют 1,5 мл ТМС-трифлата и реакционную смесь кипятят 48 ч в атмосфере аргона. Охлажденную до комнатной температуры смесь переносят в насыщенный раствор NaHCO3 (30мл), органический слой отделяют, водную фазу дважды экстрагируют CH2Cl2 (2•100 мл). Объединенный органический слой промывают водой (2•200 мл), один раз раствором NaCl (1•150мл) и сушат над MgSO4.
После фильтрования растворитель удаляют в вакууме и очисткой остатка на силикагеле (гексан- EtOAc 1:1) получают 594 мг (32%) чистого продукта.
Продукт только одно пятно в ТСХ. Однако, 1H-ЯМР спектр показывает присутствие двух изомеров (цис- и транс-) в отношении 1:1,2, которые не были разделены на данной стадии. Rf=0,35 (гексан-EtOAc 3:7).
УФ (MeOH) λmax 261 нм.
1Н-ЯМР σ (ч/млн, CDCl3): 8,88 (уш, с, 1Н, N3'-Н), 8,05 (м, 2Н, ароматические), 7,71 (д, 1Н, C6'-H-цис, J=8,2 Гц), 7,57 (м, 1Н, ароматический), 7,45 (м, 3Н, ароматические и N3'-H), 6,55 (дв. д, 1Н, C5-H-транс, J=2,4 и 5,4 Гц), 6,35 (дв. д, 1Н, C5-H-цис, J=4,1 и 5,6 Гц), 5,79 (т, 1Н, C2-H-транс, J= 5,4 Гц), 5,73 (д, 1Н, C5'-H, J=8,2 Гц), 5,57 (д, 1Н, C5'-H, J=8,2 Гц), 5,46 (т, 1Н, C2-H-цис, J=3,9 Гц), 4,73 (д,2Н,-CH2O-COC6H5), 4,45 (т, 2Н, -CH2OCOC6H5), 3,57 (м, 1Н, C4-H), 3,17 (м, 1Н).
Пример 14. Цис-2-Гидроксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолан
В 75 метанольного раствора аммиака растворяют 300 мг смеси цис-и транс-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана и смесь перемешивают около суток при комнатной температуре. После испарения растворителя досуха остаток очищают и разделяют на два изомера хроматографией на силикагеле (EtOAc-MeOH 98:2).
Преобладающий продукт, выделенный в качестве твердого вещества, идентифицирован как цис-изомер.
Цис-изомер. Т.пл. 162-164oC. Rf=0,57 (EtOAc-MeOH 95:5).
УФ (MeOH) λmax 261,4 нм.
1Н-ЯМР σ (ч/млн, ДМСО-d6): 11,36 (с, 1Н, N3'-Н), 7,88 (д, 1Н, C6'-H, J= 8,1 Гц), 6,18 (т, C5-H, J=4,8 Гц), 5,62 (д, 1Н, C5-H, J=8,1 Гц), 5,33 (т, 1Н, C2-H, J=5,7 Гц), 5,17 (т, 1Н,-OH, D2O-обмен), 3,72 (т, 2Н, C2-CH2OH, J= 4,6 Гц), 3,41 (дв. д, 1Н, C4-H, J=5,7 и 12 Гц), 3,2 (дв. д, 1H, С4-H, J=4,6 и 9,8 Гц).
Пример 15. Цис-и транс-2-Бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиоланы
В 50 мл ГМДС, содержащих 50 мг (NH4)2SO4, кипятят 1,7-тимина до момента, пока раствор не станет прозрачным. Затем смесь испаряют при пониженном давлении. Остаток сушат 1 ч в глубоком вакууме и растворяют в 150 мл 1,2-дихлорэтана.
Двукратным испарением с 75 мл бензола сушат 3 г 2-бензоилоксиметил-5-этокси-1,3-оксатиолана и растворяют в 150 мл сухого 1,2-дихлорэтана.
Раствор силилированного тимина через канюлю в атмосфере аргона переносят в раствор оксатиолана и в реакционную смесь через канюлю в атмосфере аргона вводят 3,3 мл ТМС-трифлата (триметилсилил-трифата в 30 мл сухого 1,2-дихлорэтана. Раствор кипятят в атмосфере аргона 36 ч, охлаждают до комнатной температуры и переносят в 30 мл насыщенного водного раствора NaHCO3. Органический слой отделяют и водную фазу дважды экстрагируют хлористым метиленом (2•100 мл). Объединенную органическую фазу дважды промывают водой (2•200 мл), один раз раствором NaCl (1•150 мл) и сушат над MgSO4. Раствор фильтруют, фильтрат испаряют в вакууме и хроматографией остатка на силикагеле (гексан-EtOAc 1:1) получают 1,3 г (35%) чистого продукта.
Продукт дает только одно пятно в ТСХ, но 1Н-ЯМР спектр показывает наличие двух изомеров (цис- и транс) в отношении 1:1,2. Rf=0,3 (гексан-EtOAc).
УФ (MeOH) 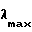 266 нм.
266 нм.
1Н-ЯМР (ч/млн, CDCl3): 8,6 (уш, с, N3'-Н), 8,06 (м, 2Н, ароматические), 7,59 (м, 1Н, ароматический), 7,49 (м, 2Н, ароматические), 7,38 (д, 1Н, C6'-цис, J= 1,3 Гц), 7,28 (д, 1Н, C6'-транс, J=1,3 Гц), 6,55 (дв. д, 1Н, C5-H-транс-изомер. J= 1,3 Гц), 6,55 (дв. д, 1Н, C5-H-цис-изомер, J=5,5 Гц), 5,78 (дв. д, 1Н, C2-H-транс, J=4,4 и 6,4 Гц), 5,46 (т, 1Н, C2-H-цис-изомер, J=4,3 Гц), 4,49 (д, 2Н, C2-CH2OCOC6H5, J=4,2 Гц), 4,45 (м, 2Н, C2-CH2OCOC6H5), 3,58 (м, 1Н, C4-H), 3,13 (м, 1Н, C4-H), 1,93 (д, 1Н, C5'-CH3-транс-изомер, J=1,2 Гц), 1,78 (д, 1Н, C5'-CH3-цис-изомер, J=1,2 Гц).
Пример 16. Чис-2-Гидроксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолан
В 100 мл насыщенного метанольного раствора аммиака растворяют 500 мг смеси цис- и транс-2-бензолоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиоланов (XXIV) и смесь перемешивают около суток (18 ч) при комнатной температуре. После испарения смеси при пониженном давлении остаток разделяют на силикагеле (EtOAc-MeOH 98:2).
Менее полярный продукт идентифицирован как цис-изомер, т. пл. 167-168oC. Rf 0,66 (EtOAc-MeOH 95:5).
УФ (MeOH), λmax 266 нм
1H-ЯМР σ (ч/млн, ДМСО-d6) 11,38 (с, 1H, N'3 - H), 7,73 (д, 1H, C'-H, J 1,1 Гц), 6,16 (т, 1H, C5-H, J 5,5 Гц), 5,31 (т, 1H, C2-H, J 5,9 Гц), 5,14 (т, 1H, OH, D2O-обмен), 3,7 (т, 2H, C2-CH2OH, J 5,1 Гц), 3,36 (дв. д. 1H, C4-H, J 5,7 и 1,7 Гц), 3,16 (дв. д, 1H, C4-H, J 5,5 и 11,7 Гц), 1,75 (д, 3H, C'5- CH3, J 1,7 Гц).
Пример 17. Малеат цис-5-(4-амино-1,2- дигидро-2-оксо-1-пиримидинил)-1,3-оксатиолан-2-метанола
Смесь цис-5-(4-амино-1,2-дигидро-2-оксо-1- пиримидинил)-1,3-оксатиолан-2-метанола (1,0 г, 4,6 ммоля) и малеиновой кислоты (506 мг, 4,36 ммоля) в промышленном метилированном спирте (IMS 320 мл) нагревалась до температуры дефлегмации. Получающийся в результате прозрачный раствор концентрировался с помощью перегонки из 140 мл растворителя, а затем охлаждался до 5oC. С помощью фильтрования отделялось белое кристаллическое твердое вещество, промывалось IMS (15 мл) и сушилось в вакууме при 40oC, давая цис-5- (4-амино-1,2-дигидро-2-оксо-1-пиридимидинил)-1,3-оксатиолан-2-метанол малеат (1,22 г), т. пл. 187oC.
Найдено: C 41,7; H 4,4; N 12,1% C8H11N3O3• C4H4O4
Вычислено: C 41,7; H 4,4; N 12,2%
Пример 18. Хлоргират цис-5-(4- амино-1,2-дигидро-2-оксо-1-пиримидинил)-1,3-оксатиолан-2-метанола.
Раствор цис-5-(4-амино-1,2-дигидро-2-оксо-1-пиримидинил) 1,3-оксатиолан-2-метанола (1,0 г, 4,6 ммоля) в промышленном метилированном спирте (IMS 320 мл) обрабатывался при дефлегмации раствором концентрированной соляной кислоты (160 мг, 4,36 ммоля) в IMS (8 мл). Смесь затем охлаждалась до 0oC. Получающееся в результате белое кристаллическое твердое вещество отделялось с помощью фильтрования, промывалось IMS (5 мл) и сушилось в вакууме при 40oC, давая хлоргидрат цис-5- (4-амино-1,2-дигидро-2-оксо-1-пиримидинил)-1,2-оксатиолан (912 г.), т. пл. 192oC.
Найдено: C 36,2; H 4,7; N 15,9%C8H11N3O3 • HCl.
Вычислено: C 36,2; H 4,55; N 15,8%
Пример 19. Цис- и транс -2- бензоилоксиметил-5-(5'-азацитозин-N-1'-ил)-1,3-оксатиоланы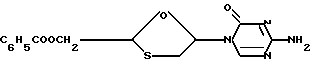
5-азацитозин (2:0 г) нагревали с обратным холодильником в HMDS (50 мл), содержащем каталитическое количество (NH4)2SO4 (50 мг) до тех пор, пока раствор не становился чистым. Смесь выпаривали досуха. Остаток высушивали в высоком вакууме в течение 1 ч и растворяли в сухом дихлорметане (100 мл).
2-бензоилоксиметил-5-этокси-1,3-оксатиолан высушивали путем двухкратного совместного выпаривания с бензолом (2•50 мл) в 500-мл колбе с круглым дном и растворяли в сухом дихлорметане (150 мл).
Силилированный раствор 5-азацитозина переносили в раствор оксатиолана посредством канюли в атмосфере аргона с последующим добавлением раствора триметилсилилтрифторметансульфоната (TMS-трифлат, 3,5 мл) в дихлорметане (20 мл). Смесь нагревали с обратным холодильником 24 ч, охлаждали до комнатной температуры и выливали в насыщенный водный раствор NaHCO3 (300 мл). Органическую фазу собирали. Водную фазу экстрагировали метиленхлоридом (2•100 мл). Объединенные экстракты промывали водой (2•200 мл), один раз раствором NaCl (100 мл) и высушивали сульфатом магния. После фильтрации, фильтрат выпаривали при пониженном давлении. Остаток очищали на силикагеле, в качестве элюента используя EtOAc-MeOH (95:5). Получали 1,6 г (34%) чистого твердого продукта, который обнаруживал только одно пятно на ТСХ, но 1H-ЯМР-спектр показал присутствие цис- и транс-изомеров в отношении 1:1,2.
1H-ЯМР (CDCl3) σ (ppm):
8,41 (с, 1H, C6-H, цис-изомер),
8,26 (с, 1H, C6, транс-изомер),
7,95 (м, ароматич.),
7,54 (м, ароматич.),
6,36 (дд, 1H, C5-H транс-изомер, J 1,9 и 5,0 Гц),
6,17 (т, 1H, C5-H цис-изомер),
6,05 (т, 1H, C2-H транс-изомер),
5,53 (т, 1H, C2-H цис-изомер),
4,68 (м, 2H, C2 CH2OCOC6H5 цис-изомер),
4,42 (м, 2H, C2OCOC6H5 транс-изомер),
3,54 (м, 2H, C1-H цис и транс),
3,36 (м, 2H, C4-H цис и транс).
Пример 20. Цис- и транс-2-гидроксиметил -5- (5'-азацитозин-N-1'-мл)-1,3-оксатиоланы
Смесь цис- и транс -2- бензоилоксиметил-5-(5'-азацитозин-N-1'-ил)-1,3-оксатиоланов (505 мг) растворяли в метанольном аммиаке (100 мл) и перемешивали при комнатной температуре в течение 18 ч. Раствор выпаривали досуха. Остаток обрабатывали дважды диэтиловым эфиром (2•50 мл) и декантировали. Твердый остаток перекристаллизировали в метаноле и кристаллы собирали путем фильтрации. Продукт идентифицировали как чистый цис-изомер.
Цис-изомер:
Т.пл. > 210oC (разлож.)
УФ: λmax (MeOH):243 нм
1H-ЯМР (ДМСО-d6): σ (ppm):
8,62 (c, 1H, C6-H,
7,53 (шс, 2H,-NH2),
6,12 (дд, 1H, C5-H),
5,40 (т, 1H, -OH),
5,20 (т, 1H, C2-H, J=3,9 Гц),
3,75 (м, 2H, C2-CH2OH),
3,45 (дд, 1H, C4-H, J=5,3 Гц),
3,25 (дд, 1H, C4-H, J=3,5 Гц),
Другой продукт был получен в виде пенистого вещества и идентифицирован как транс-изомер.
Транс-изомер:
1H-ЯМР (ДМСО-d6): s (ppm):
8,25 (c, 1H, C6-H),
7,58 (шс, 2H,-NH2),
6,29 (дд, 1H, C5H, J=3,1 и 4,9 Гц),
5,65 (т, 1H, C2-H, J=5,2 Гц),
5,44 (шс, 1H, -OH),
3,49 (м, 3H, 2H от C2-CH2OH и 1H от C4-H),
3,24 (м, 1H, C4-H).
Пример 21. Цис- и транс 2-бензоилоксиметил-5- (8'-азаденин-N-9'-ил)-1,3-оксатиоланы и цис- и транс 2-бензоилоксиметил -5-(8'-азааденин-N-8'-ил)-1,3-оксатиоланы
Суспензию 8-азааденина (1,00 г, 7,348 мМ) и сульфата аммония (30 мг) в HMDS (30 мл) нагревали в течение ночи (16 ч). Прозрачный раствор концентрировали при пониженном давлении. Белый твердый остаток высушивали в высоком вакууме в течение 2 ч, растворяли в свежедистиллированном 1,2-дихлорэтане (30 мл) и переносили в атмосфере аргона посредством канюли в раствор 2-бензоилокси- метил-5-метилкарбонат-1,3 оксатиолана (1,461 г, 4,90 мМ) в безводном 1,2-дихлорэтане (50 мл). Затем добавляли TMS-трифлат (1,42 мл, 7,348 мМ) и полученную смесь нагревали с обратным холодильником в атмосфере аргона в течение 2 дней, затем охлаждали до комнатной температуры и выливали в насыщенный водный раствор NaHCO3 (100 мл). Органическую фазу отделяли, а водную фазу экстрагировали метиленхлоридом (3•50 мл). Объединенные органические экстракты промывали солевым раствором (50 мл), осушали безводным сульфатом магния, фильтровали, и концентрировали при пониженном давлении. Остаток очищали путем флеш-хроматографии на силикагеле, элюируя CH2Cl2:MeOH (98: 2), в результате чего получали 0,875 г (49,6%) светло-желтого твердого вещества, который обнаруживал только одно пятно на ТСХ, но 1H-ЯМР спектр показал присутствие двух N-9'-изомеров, цис- и транс-2-бензоилоксиметил-5-(8'-азааденин-N-9'-ил)-1,3-оксатиолан.
N-9'-региоизомеры:
УФ: λmax (EtOH):280,19 нм;
1H-ЯМР (SDCl3: σ (ppm):
8,50 (c, 1H, C2H, цис-изомер),
8,46 (c, 1H, C2H, транс-изомер),
8,03 (м, 4H, ароматич.),
7,57 (м, 2H, ароматич.),
7,44 (м, 4H, ароматич.),
7,08 (дд, 1H, C5-H, J=2,97 и 6,14 Гц, транс-изомер),
6,73 (дд, 1H, C5-H, J=5,53 и 6,53 Гц, цис-изомер),
6,64 (шс, 4H,-NH2),
5,89 (дд, 1H, C2-H, J=4,15 и 5,59 Гц, транс-изомер,
5,72 (т, 1H, C2-H, J=5,37 Гц, цис-изомер),
4,64 (т, 2H, C2 CH2OCOC6H5, C 5,76, цис-изомер),
4,60 (д, 2H, C2 CH2OCOC6H5, J 5,32, транс-изомер),
4,37 (дд, 1H, C4 H, J 6,53 и 11,42 Гц, цис-изомер),
4,04 (дд, 1H, C4 H, J 3,14 и 11,81 Гц, транс-изомер),
3,79 (дд, 1H, C4 H, J 6,14 и 11,6 Гц, цис-изомер),
3,61 (дд, 1H, C4 H, J 5,52 и 11,45 Гц, транс-изомер).
Другой продукт получали в виде желтого маслянистого продукта (0,313 г, 17,7% ) и идентифицировали как два N-8'-региомера, цис- и транс-2-бензоилоксиметил-5-(8'-азааденин-N-8'-ил)-1,3-оксатиолан.
N-8'-региоизомеры:
УФ: lmax (EtOH): 295 нм,
1H-ЯМР (CDCl3): σ (ppm):
8,50 (с, 1H, C2-H, цис-изомер),
8,46 (с, 1H, C2-H, транс-изомер),
8,03 (м, 4H, ароматич.),
7,57 (м, 2H, ароматич.),
7,44 (м, 4H, ароматич.),
7,04 (дд, 1H, C5-H, J 2,97 и 6,14 Гц, транс-изомер),
6,73 (дд, 1H, C5-H, J 5,53 и 6,53 Гц, цис-изомер),
6,64 (шир. с. 4H, -NH2),
5,89 (дд, 1H, C2H, J 4,15 и 5,59 Гц, транс-изомер),
5,72 (т, 1H, C2-H, J 5,37 Гц, цис-изомер),
4,64 (т, 2H, C2 CH2OCOC6H5, J 5,76 Гц, цис-изомер),
4,60 (дд, 2H, C2 CH2OCOC6H5, J 5,32 Гц, транс-изомер),
4,37 (дд, 1H, C4 H, J 6,33 и 11,42 Гц, цис-изомер),
4,04 (дд, 1H, C4 H, J 3,14 и 11,81 Гц, транс-изомер),
3,79 (дд, 1H, C4 H, J 3,14 и 11,6 Гц, цис-изомер),
3,61 (дд, 1H, C4 H, J 5,52 и 11,45 Гц, транс-изомер).
Пример 22. Цис- и транс-2- гиддроксиметил-5-(8'-азааденил-N-9'-ил)-1,3-оксатиоланы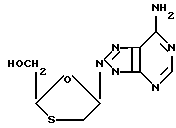
Раствор цис- и транс-2- бензоилоксиметил-5-(8'-азааденин-N-9'-ил)-1,3-оксатиоланов (0,285 г, 0,7908 мМ) в метаноловом аммиаке (50 мл) размешивали в течение 1 дня при комнатной температуре. Эту смесь концентрировали при пониженном давлении, и твердый остаток очищали с помощью флеш-хроматографии на силикагеле, элюируя градиентом MeOH (1% 6%) в CH2Cl2, в результате чего получали 0,079 г цис-изомера и 0,084 г транс-изомера в виде белых твердых веществ. Полный выход составлял 81%
Цис-изомер:
Т.пл. 203 204oC, УФ: λmax (MeOH) 278 нм,
Rf: 0,31 (CH2Cl2:MeOH 9:1),
1H-ЯМР (ДСМО-d6) σ (ppm):
8,54 (шир.с. 1H, -NH2),
8,33 (с, 1H, C2-H),
8,20 (шир.с. 1H, -NH2),
7,69 (т, 1H, C5-H, J 6,68 Гц),
5,34 (т, 1H, C2-H, J 5,53 Гц),
5,22 (т, 1H, -OH, J 5,74 Гц),
4,05 (дд, 1H, C4-H, J 6,93 и 11,05 Гц),
3,63 (м, 2H, C2-CH2OH),
3,50 (дд, 1H, C4-H, J 5,44 и 11,32 Гц),
13C-ЯМР (ДМСО-d6): s (ppm): 157,153; 156,119; 149,049; 126,631; 87,674; 85,339; 64,137; 32,846.
Транс-изомер:
Т.пл. >213 214oC, УФ: lmax (MeOH): 278 нм,
Rf: 0,24 (CH2Cl2:MeOH 9:1)
1H-ЯМР (ДМСО-d6) σ (ppm):
8,53 (шир.с. 1H, -NH2),
8,33 (с. 1H, C2-H),
8,18 (шир.с. 1H, -NH2),
7,01 (дд, 1H, C5-H, J 3,24 и 6,54 Гц),
5,35 (т, 1H, C2-H, J 4,97),
5,55 (т, 1H, -OH, J 6,05),
3,89 (дд, 1H, C4-H, J 3,24 и 11,53 Гц),
3,67 (м,3H, C2)-CH2OH и C4-H).
Пример 23. Цис- и транс-2- гидроксиметил-5-(8'-азааденин-N-8'-ил)-1,3-оксатиолан
Раствор цис- и транс-2- бензилоксиметил-5-(8'-азааденин-N-8'-ил)-1,3-оксатиоланов (0,300 г, 0,8324 мМ) в метаноловом аммиаке (50 мл) размешивали 30 ч при комнатной температуре. Смесь концентрировали при пониженном давлении, и твердый остаток очищали с помощью флеш-хроматографии на силикагеле, используя в качестве элюента градиент MeOH (2% 6%) в CH2Cl, в результате чего получали 0,037 г цисизомера, 0,058 г трансизомера, и, 0,095 г смеси изомеров в виде бледно-желтых твердых продуктов. Полый выход составлял 90%
Цис-изомер: т.пл. 182 183oC, Rf: 0,44 (CH2Cl2- MeOH 9:1),
УФ: λmax (MeOH) 296 нм,
1Н-ЯМР (ДМСО-d6): σ (ppm):
8,38 (шир. с. 1H, NH2),
8,30 (с, 1H, C'2H),
8,17 (шир.с. 1H, NH2),
6,77 (дд, 1H, C5-H, J 4,12 и 5,28 Гц), 5,41 (т, 1H, C2-H, J 6,04 Гц),
5,17 (т, 1H, -OH, J 5,77 Гц),
3,92 (дд, 1H, C4-H, J 4,15 и 12,05 Гц),
3,70 (м, 3H, C4-H, и C2CH2OH),
Транс-изомер: т.пл. 206 207oC, Rf: 0,38 (CH2Cl2 MeOH 9:1),
УФ: lmax. (MeOH): 196 нм,
1H-ЯМР (ДМСО-d6): σ (ppm):
8,38 (шир.с. 1H, NH2),
8,30 (с, 1H, C2-H),
8,16 (шир.с. 1H, -NH2),
7,04 (дд, 1H, C5-H, J 1,92 и 5,76 (Гц),
5,46 (т, 1H, C2-H, J 5,01 Гц),
5,24 (т, 1H, -OH, C 5,77 Гц),
3,85 (дд, 1H, C4-H, J 1,98 и 12,96 Гц),
3,62 (м, 3H, C4-H и C2-CH2OH).
Пример 24. Цис- и транс-2- бензоилоксиметил-5-(8'-азагуанин-9'-ил)-1,3-оксатиолан
8-азагуанин (1,0 г, 6,58 мМ) подвергали персилилированию посредством нагревания с обратным холодильником с 1,1,1,
3,3,3-гексаметилдисилазаном (HMDS, 50 мл) в присутствии каталитического количества сульфата аммония (50 мг) в течение ночи (16 ч). Прозрачный раствор выпаривали досуха при пониженном давлении. Остаток осушали в высоком вакууме в течение 1 ч и растворяли в безводном 1,2-дихлорэтане (100 мл).
2-бензоилоксиметил-5-метилкарбонат-1,3-оксатиолан (1,96 г, 6,58 мМ) осушали путем двухкратного выпаривания с бензолом (2•50 мл) в 500-мл колбе с круглым дном, и растворяли в безводном 1,2-дихлорэтане (150 мл).
Раствор силилированного 8-азагуанина вводили посредством канюли в раствор оксатиолана в атмосфере аргона с последующим добавлением TMS-Трифлата (1,3 мл, 6,58 мМ). Реакционную смесь нагревали с обратным холодильником в атмосфере аргона в течение 5 ч, охлаждали до комнатной температуры, и выливали в насыщенный водный раствор NaHCO3 (100 мл). Органический слой собирали. Водную фазу экстрагировали CH2Cl2 (3•100 мл). Объединенный органический слой промывали водой (2•100 мл), один раз раствором NaCl (100 мл) и осушали сульфатом магния. После фильтрации растворитель удаляли путем выпаривания в вакууме, и остаток очищали на силикагеле, элюируя EtOAc:MeOH=97:3. В результате получали 712 мл (29%) целевого продукта в виде смеси цис- и транс-изомеров в отношении 1:1.
Rf:0,40 (CH2Cl2:MeOH 95:5)
1H-ЯМР (ДМСО-d6): σ (ppm):
11,06 (ш.с. 1H, NH),
7,92 (м, 2H, ароматич.),
7,66 (м, 1H, ароматич.),
7,55 (м, 2H, ароматич),
7,05 (ш.с. 2H, NH2-),
6,74 (дд, 1H, H-5, транс-изомер, J 3 и 6 Гц),
6,45 (т, 1H, H-5, цис-изомер, J 6 Гц),
5,68 (м, 1H, H-2),
4,55 (м, 2H, CH2OBr),
3,65 (м, 2, H-4).
Пример 25. Цис- и транс-2-гидроксиметил-5- (8'-азагунин-9'-ил)-1,3-оксатиолан
Раствор цис- и транс-2-бензоилоксиметил-5- (8'-азагуанин-9'-ил)-1,3-оксатиолана (350 мг) в метаноле (100 мл) охлаждали до 0oC в ледяной бане, и аммиачный газ барбатировали через раствор в течение 15 мин. Реакционную смесь перемешивали при комнатной температуре в течение ночи (16 ч). Раствор выпаривали досуха. Остаток очищали, а два изомера частично разделяли на силикагеле, элюируя CH2Cl2 MeOH 9 1, в результате чего получали чистый целевой продукт, который идентифицировали как цис-изомер (30 мг).
Цис-изомер:
Т. пл. >260oC (разлож.)
Rf 0,26 (CH2Cl2 MeOH 9 1),
УФ: λmax (pH 14) 278 нм,
1Н-ЯМР (ДМСО-d6) σ (ppm):
11,08 (ш.с. 1H, NH-), 7,05 (ш.с. 2H, NH2),
6,33 (дд, 1H, C2-H, J 6 и 7 Гц),
5,26 (т, 1H, C2-H, J 6 Гц),
5,17 (т, 1H, OH- J 6 Гц),
3,93 (дд, 1H, C4-H, J 7 и 11 Гц),
3,47 (м, 3H, 1H, C4-H и 2H, C2-CH2OH),
13С-ЯМР (ДМСО-d6) s (ppm):
155,81; 155,46; 151,79; 124,35; 86,73; 84,94; 64,22 и 32,42.
Другие фракции объединяли и концентрировали досуха. Остаток очищали с помощью ЖХВД (жидкостная хроматография высокого давления), в результате чего получали 72 мг трансизомера.
Транс-изомер:
Т. пл. 220 222oC (разлож.):
УФ: lmax (rH 14): 280 нм.
1Н-ЯМР (ДМСО-d6): σ (ppm):
11,0 (ш.с. 1H, -NH),
7,06 (ш.с. 2H, -NH2),
6,67 (дд, 1H, C5-H, J 3 и 7 Гц),
5,28 (т, 1H, C2-H, J 5 гц),
5,20 (ш.т. 1H, -OH, J 6 Гц),
3,78 (дд, 1H, 1H, C4-H, J 3 и 12 Гц),
3,67 (м, 1H, C4-H и 2H-CH2OH),
13С-ЯМР (ДМСО-d6): сигма(ppm):
155,8; 155,6; 151,4; 124,3; 86,7, 86,4; 63,6; 34,4.
Пример 26. Цис- и транс-2-бензоилоксиметил -5- (3'-карбоэтокси-1',2'-4'-триазол-1'-ил)-1,3 оксатиолан
3-карбоэтокси-1,2,4-триазол (400 мг, 2,83 ммоля) грели в сосуде с обратным холодильником в HMDS (1,1,1,3,3,3-гексаметилдисилазан, 20 мл), содержащем каталитическое количество сульфата аммония (20 мг) в течение 2 ч. Прозрачный раствор упаривали до сухого состояния при пониженном давлении, и остаток растворяли в сухом дихлорэтане (50 мл). Раствор 2-бензоилоксиметил-5-ацетокси-1,3-оксатиолана (1,2 г, 4,20 ммоля) в сухом дихлорэтане (100 мл) добавляли к силированному триазольному производному, делая это через трубку в атмосфере аргона, после чего добавляли 1 М дихлорэтановый раствор триметилсилилтрифторметансульфоната (TMSOTf) (5 мл).
Реакционную смесь грели в сосуде с обратным холодильником в атмосфере аргона в течение 2 ч, охлаждали до комнатной температуры и выливали в насыщенный раствор бикарбоната натрия (100 мл). Органический слой собирали. После этого водный раствор экстрагировали метиленхлоридом (2 раза по 50 мл).
Объединенную органическую фазу промывали водой (2 раза по 100 мл), сушили над сульфатом магния и фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали на силикагеле с использованием смеси гексана с этилацетатом при соотношении 1 1 в качестве элюента, в результате чего получали требуемый продукт (800 мг) с выходом 77% в виде смеси цис- и трансизомеров в соотношении 3 2.
Спектр ЯМР на 1Н (300 МГц, CDCl3) был следующим: величина σ в миллионных долях составляла 8,57 (синглет, 1H, H'-5, цис-изомер), 8,43 (синглет, 1H, H'-5, трансизомер), 8,04 (мультиплет, 4H, бензольное кольцо, цис- и трансизомеры), 7,57 (мультиплет, 2H, бензольное кольцо, цис- и трансизомеры), 7,47 (мультиплет, 4H, бензольное кольцо, цис- и трансизомеры), 6,57 (дублет из дублета, 1H, H-5, транс-изомер, J 1,6 и 4,8 Гц), 6,37 (дублет из дублета, 1H, H-5, цис-изомер, J 3,2 и 7,8 Гц), 5,79 (дублет из дублета, 1H, H-2, трансизомер, J 4 и 6,1 Гц), 5,63 (дублет из дублета, 1H, H-2, цис-изомер, J 3,6 и 5,3 Гц), 4,71 (мультиплет, 2H, -CH2OC(C 6H5)), 4,50 (мультиплет, 6H, 2H, из -CH 2OC(C6H5) и 4H из COO(C2H5), цис- и трансизомеры), 3,65 (мультиплет, 4H, H-4, цис- и трансизомеры) и 1,43 (триплет, 6H, COO(C2H5), цис- и трансизомеры).
Пример 27. Цис- и транс-2- гидроксиметил-5-(3'-карбоксамид-1',2',4'-триазол-1'-ил)-1,3-оксатиолан
Смесь цис- и транс-изомеров 2- бензоилоксиметил-5-(3'-карбоэтокси-1',2', 4'-триазол-1'-ил)-1,3 оксатиолана (800 мг, 2,2-ммоля) растворяли в метанольном аммиаке (80 мл). Раствор перемешивали в герметичной колбе при комнатной температуре в течение 4 дней. Растворитель удаляли выпариванием при пониженном давлении, и маслянистый остаток распирали с простым эфиром (3 раза по 30 мл). Остаток после этого очищали на силикагеле при использовании смеси этилацетата с метанолом в соотношении 95:5 в качестве элюента, в результате чего в чистой твердой форме получали оба цис- и транс-изомера.
Цис-изомер. Температура плавления 119-120oC. Спектр ЯМР на 1H (300 МГц, диметилсульфоксид-d6): величина σ в миллионных долях 8,85 (синглет, 1Н, C5'-H), 7,81 (широкий синглет, 1H, CONH2-, D2O (способная обмениваться)), 7,59 (широкий синглет, 1H, (способная обмениваться)), 6,38 (триплет, 1H, C5-H), 5,27 (триплет, 2H, C2-H и OH), 3,56 (мультиплет, 4H, C4-H и C2-CH2OH).
Транс-изомер. Температура плавления 215-216oC. Спектр ЯМР на 1H (300 МГц, диметилсульфоксид-d6: величина s в миллионных долях 8,83 (синглет, 1H, C5'-H), 7,87 (широкий синглет, 1H, CONH2-, D2O (способная обмениваться)), 7,65 (широкий синглет, 1H, CONH2-, D2O (способная обмениваться)), 6,69 (дублет из дублета, 1H, C5-H, J=3 и 4,2 Гц), 5,43 (триплет, 1H, C2-H, J=5,1 Гц), 5,23 (триплет, 1H, OH, D2O (способная обмениваться)), 3,60 (мультиплет, 4H, C4-H и C2-CH2OH).
Пример 28, Цис- и транс-2- бензоилоксиметил-5-(2'-амино-6'-хлорпурин-9'-ил)-1,3-оксатиолан
6-хлор-2-аминопурин (3,96 г, 23,35 ммоля) грели в сосуде с обратным холодильником в HMDS (1,1,1,3,3,3 -гексаметилдисилазане, 100 мл), содержащем каталитическое количество сульфата аммония (20 мг) в течение ночи (16 ч). Прозрачный раствор упаривали досуха при пониженном давлении, и остаток растворяли в дихлорэтане (60 мл). Раствор добавляли к смеси 2 -бензоилоксиметил-5-ацетокси-1,3-оксатиолана (5,98 г, 21,33 ммоля) в сухом дихлорэтане (30 мл) с молекулярными ситами 4  (2 г), после чего добавляли триметилсилилтрифторметансульфонат (TMS- triflate 4,1 мл). Реакционную смесь грели в сосуде с обратным холодильником в атмосфере аргона в течение 10 ч и выпивали в насыщенный водный раствор бикарбоната натрия (100 мл). Органический слой собирали. Водный раствор затем эксрагировали метиленхлоридом (2 раза по 60мл). Объединенную органическую фазу промывали водой (2 раза по 100 мл), сушили над сульфатом магния и фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали на силикагеле, используя смесь из гексана и этилацетат при соотношении 1:1 в качестве элюента, в результате чего получали требуемые цисизомер (2 г, 24%) и транс- изомер (3,10 г, 37,38%) с общим выходом 61%
(2 г), после чего добавляли триметилсилилтрифторметансульфонат (TMS- triflate 4,1 мл). Реакционную смесь грели в сосуде с обратным холодильником в атмосфере аргона в течение 10 ч и выпивали в насыщенный водный раствор бикарбоната натрия (100 мл). Органический слой собирали. Водный раствор затем эксрагировали метиленхлоридом (2 раза по 60мл). Объединенную органическую фазу промывали водой (2 раза по 100 мл), сушили над сульфатом магния и фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали на силикагеле, используя смесь из гексана и этилацетат при соотношении 1:1 в качестве элюента, в результате чего получали требуемые цисизомер (2 г, 24%) и транс- изомер (3,10 г, 37,38%) с общим выходом 61%
Цис-изомер. Температура плавления 137-138oC. Величина Rf составляла 0,29 (смесь гексана с этилацетатом при соотношении 1:1).
Спектр ЯМР на 1H (300 МГц, CDCI3): величина σ в миллионных долях составляла 8,11 (синглет, 1H, C'8-H), 8,02 (мультиплет, 2H, бензольное кольцо), 7,55 (мультиплет, 1H, бензольное кольцо), 7,44 (мультиплет, 2H, бензольное кольцо), 6,38 (триплет, 1H, C5-H, J=5,2 Гц), 5,60 (дублет из дублета, 1H, C2-H, J= 4,2 и 5,4 Гц), 5,32 (широкий синглет, 2H, NH2), 4,66 (мультиплет, 2H, -CH2OC(C6 H5)), 3,58 (Мультиплет, 2H, C4-H).
Транс-изомер. Температура плавления составляла 152-153oC. Величина Rf составляла 0,29 (смесь гексана с этилацетатом при соотношении 1:1).
Спектр ЯМР на 1H (300 МГц, CDCl3): величина s в миллионных долях составляла 8,15 (синглет, 1H, C'8-H), 8,02 (мультиплет, 2H, бензольное кольцо), 7,56 (мультиплет, 1H, бензольное кольцо), 7,43 (мультиплет, 2H, бензольное кольцо), 6,67 (дублет из дублета, 1H, C5-H, J 1,7 и 5,2 Гц), 5,69 (дублет из дублета, 1H, C2-H, J 4,1 и 6,0 Гц), 5,50 (широкий синглет, 2H, NH2), 4,57 (мультиплет, 2H, -CH2OC(C6H5)), 3,66 (дублет из дублета, 1H, C4-H, J 5,3 и 12,0 Гц) и 3,55 (дублет из дублета, 1H, C4-H, J 2,8 и 12 Гц).
Пример 29. Цис-2-гидроксисетил-5-(гуанин-9'-ил)-1,3-оксатиолан
К 10% -ному водному метанольному раствору цис-2- бензоилоксиметил-5-(2'-амино-6'-хлорпурин-9'-ил)-1,3-оксатиолана (200 мг, 0,73 ммоля) добавляли в виде одной порции гидроксид натрия (3 г, 75 ммолей). Реакционную смесь грели в сосуде с обратным холодильником в течение 16 ч, затем охлаждали до комнатной температуры, и растворители удаляли при пониженном давлении. Остаток вновь растворяли в воде (100 мл), раствор нейтрализовали пиридиниевой смолой и фильтровали. Фильтрат упаривали досуха при пониженном давлении, и остаток очищали высокопроизводительной жидкостной хроматографией на колонке с обращенной фазой, в результате чего получали названное соединение (146 мг) с выходом 74%
Температура плавления превышала 258oC (идет разложение).
Величина Rf составляла 0,54 (смесь этилацетата с метанолом при соотношении 4:1).
Ультрафиолетовый спектр: величина λmax (в воде) составляла 254 и 275 (коротковолновая область) нм.
Спектр ЯМР на 1H (300 МГц, диметилсульфоксид -d6): величина σ в миллионных долях составляла 7,89 (синглет, 1Н, C8'-H), 7,00 (широкий синглет, 2Н, NH2), 6,15 (триплет, 1Н, C5-H, J=5,6 Гц), 5,50 (широкая линия, 1Н, ОН), 5,22 (триплет, 1Н, C2-H, J=4,7 Гц), 3,62 (мультиплет, 4Н, C4-H и C2-CH2OH).
Спектр ЯМР на 13C (75,46 МГц, диметилсульфоксид -d6): величина s в миллионных долях составляла 162,25 157,79, 151,72, 134,33, 117,18, 85,52, 85,22, 64,18 и 34,81.
Пример 30. Цис-2-гидроксиметил-5- (2'-6'-диаминопурин-9'-ил)-1,3-оксатиолан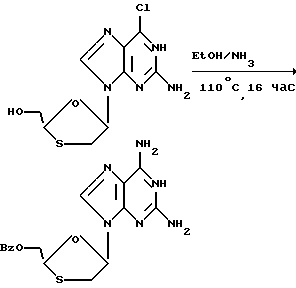
Аммиак пробулькивали через раствор цис-2- бензолоксиметил-5-(2'-амино-6'хлорпурин-9'-ил)1,3-оксатиолана (185 мг, 0,64 ммоля) в этаноле (25 мл) при 0oC в течении 20 мин. Раствор помещали в стальную бомбу и грели при 110oC в течение 16 ч. Бомбу охлаждали до комнатной температуры и затем освобождали. Растворители удаляли при пониженном давлении, и остаток очищали на силикагеле с использованием смеси этилацетата с метанолом при соотношении 9:1 в качестве элюента, в результате получали требуемый продукт (125 мг) с выходом 73%
Температура плавления составляла 120-122oC (разложение). Величина Rf составляла 0,48 (смесь этилацетата с метанолом при соотношении 4:1).
Ультрафиолетовый спектр: величина λmax (в воде) составляла 256 и 280 нм.
Спектр ЯМР на 1H (300 МГц, диеметилсульфоксид-d6): величина σ в миллионных долях составляла 8,31 (синглет, 1Н, C8', 6,86 (широкий синглет 2Н, -NH2), триплет, 1Н, C5-H, J= 5,2 Гц), 5,90 (широкая линия, 3Н, NH2), 5,40 (триплет, 1Н, OH), 5,22 (триплет, 1Н, C2-H), 3,62 (мультиплет, 4Н, C4-H и C2-CH2OH).
Спектр ЯМР на 13C (75,46 МГц, диметилсульфоксид -d6): величина s в миллионных долях составляла 160,70, 156,44, 151,65, 135,91, 113,07, 85,47, 85,39, 63,83 и 34,92.
Транс-2-гидроксиметил-5-(2',6'-диаминопурин-9'-ил)-1,3-оксатиолан
Аммиак прбулькивали через раствор цис-2- бензоилоксиметил-5-(2'-амино-6'-хлорпурин-9'-ил)1,3-оксатиолана (200 мг, 0,69 ммоля) в этаноле (25 мл) при 0oC в течение 20 мин. Раствор помещали в стальную бомбу и грели при 110oC в течение 16 ч. Бомбу охлаждали до комнатной температуры и освобождали. Раствор удаляли при пониженном давлении, и остаток очищали на силикагеле с использованием смеси из этилацетата и метанола при соотношении 9:1 в качестве элюента, в результате чего получали требуемый продукт (136 мг с выходом 72%).
Температура плавления превышала 220oC (идет разложение). Величина Rf составляла 0,40 (смесь этилацетата с метанолом при соотношении 4:1).
Ультрафиолетовый спектр величина λmax (в воде) составляла 256 и 280 нм.
Спектр ЯМР на 1H(300 МГц, диметилсульфоксид-d6): величина σ в миллионных долях 7,90 (синглет, 1Н, C8'-H), 6,76 (широкий синглет, 2Н, -NH2), 6,49 (дублет из дублета, 1Н, C5-H, J=3,0 и 5,4 Гц), 5,88 (широкая линия, 2Н, NH2), 5,32 (триплет, 1Н, C2-H, J= 4,7 Гц), 5,21 (триплет, 1Н, OH), 3,62 (мультиплет, 4Н, C4-H и C2-CH2OH).
Спектр ЯМР на 13C (75,46 МГц, диметилсульфоксид-d6): величина s в миллионных долях 160,90, 156,64, 151,81, 135,27, 113,35, 86,00, 85,31, 64,50 и 35,23.
Пример 31. Цис- и транс-2-бензоилоксиметил-5-(N4'-ацетил- 5'-фторцитозин-1'-ил)-1,3-оксатиолан
5-фторцитозин (4,30 г, 33,3 ммол), гексаметилдисилозан (25 мл) и сульфат аммония (120 мг) кипятили с обратным холодильником до растворения цитозина (3 ч) и затем кипятили еще в течение 2 ч. Гексаметилдисилозан испаряли в вакууме и к остатку добавляли толуол (100 мл) для совместного испарения растворителей. Образующийся раствор, бис(триметилсилил)-фторцитозин в дихлорметане (40 мл) добавляли в атмосфере аргона к раствору 2-бензоилоксиметил -5- ацетокси-1,3-оксатиолана (8,537 г, 30,3 ммол) в сухом дихлорметане (100 мл) и к молекулярным ситам (4  2 г), предварительно охлажденный до 0oC и выдерживали в атмосфере аргона в течение 20 мин.
2 г), предварительно охлажденный до 0oC и выдерживали в атмосфере аргона в течение 20 мин.
К этой смеси добавляли (трифторметан-сульфонил)окси триметилсилан (6 мл, 31 ммол) при 0oC и образующийся раствор перемешивали при 25oC в течение приблизительно 18 ч. Затем реакционную смесь обрабатывали 300 мл насыщенного раствора бикарбоната натрия и перемешивали при комнатной температуре в течение 2 ч. Фильтрат дважды встряхивали с 300 мл солевого раствора и один с дистиллированной водой. Органический слой высушивали над сульфатом магния, фильтровали и выпаривали до сухого состояния. Это давало неочищенное производное 5-фторцистозина (10,1 г). Rf 0,57 (EtOAc:MeOH 9:1).
Этот остаток подвергали ацетилированию на следующем этапе без дальнейшей очистки. Неочищенное вещество растворяли в сухом дихлорметане (120 мл) в атмосфере аргона в 500-миллилитровой круглодонной колбе. К раствору добавляли триэтиламин (1,27 мл, 91,1 ммол) и диметиламинопиридин (0,9 ммол). Затем колбу погружали в ледяную баню на 1 ч при создании в ней атмосферы аргона. В охладительную колбу впрыскивали уксусный ангидрид (4,3 мл, 45 ммол), очищенный над ацетатом натрия. Смесь перемешивали в течение ночи и затем тщательно декантировали в эрленмейеровской колбе, содержащей насыщенный раствор бикарбоната натрия. Затем полученный продукт промывали дистиллированной водой, за которой следовал соляной раствор. Метиленхлоридные порции сушили и выпаривали в высоком вакууме до сухого состояния, образуя ацетилированную смесь в виде бесцветной пены, имеющей после высушивания вес 9,6 г. Флеш-хроматография этого вещества при использовании смеси этилацетат-метанол (9: 1) дала 3,1 г, 7,8 ммол (46%) чистого транс (L1) и 3,5 г, 8,9 ммол (30%) чистого цис-(L1).
Транс-изомер: Rf: 0,65 в смеси этилацетат: метанол 9:1
У.Ф. (MeOH) Лямбда максим. 309 нм.
1H-ЯМР σ (мил.д. в CDCl3)
8,77 (уш. 1H, C'4-NH-Ac)
8,06 (м, 2H; аромат)
7,70 (д, 1H; C'6-H, J6, F=6,3 Гц)
7,62 (м, 1H; аромат)
7,49 (м, 2H;аромат)
6,51 (дд, 1H; C5H)
5,91 (дд, 1H; C2-H)
4,48 (дд, 2H; C2-CH2OCOC6H5)
3,66 (дд, 1H; C4-H)
3,44 (дд, 1H; C4-H)
2,56 (с, 3H; NH-COCH3)
Цис-изомер: Rf: 0,58 в смеси этилацетат метанол 9:1
У.Ф. (MeOH) Лямбдаmax 309 нм
1H-ЯМР s (мил.д. в CDCl3)
8,72 (уш. 1H; C'4-NH-Ac)
8,06 (м, 2H; аромат.)
7,87 (д, 1H; C'6-H, I6, F=6,2 Гц)
7,60 (м, 1H; аромат)
7,49 (м, 1H; аромат.)
6,32 (дд, 1H; C5-H)
5,47 (дд, 1H; C2-H)
4,73 (дд, 2H; C2CH2OCOC6H5)
3,62 (дд, 1H; C4-H)
3,19 (дд, 1H; C4-H)
2,55 (с, 3H; H-COCH3)
Пример 32. Цис- и транс-гидроксиметил-5-(5'-фторцитозин-1'-ил)- 1,3-оксатиолан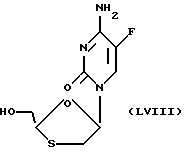
1,0 г (2,54 ммол) транс-2-бензоилоксиметил-5- (N'4-ацетил-5'-фтор-цитозин-1'-ил)-1,3-оксатиолана перемешивали в 25 мл метанольного раствора аммиака при 0oC в течение 1 ч и затем в течение ночи при комнатной температуре. Смесь выпаривали при пониженном давлении, остаток дважды растирали (2•30 мл) с безводным эфиром. Твердый остаток перекристаллизовывали в абсолютном этаноле, образуя 484 мг (1,95 ммол, 77%) желаемого продукта транс (LII): т. пл. 219-221oC; Rf 0,21 в смеси этилцетат: метанол (9:1), который был идентифицирован с применением 1H, 13C-ЯМР и У.Ф. Лямбдаmax (H2O) 280,9 нм.
1,2 г (3,05 ммол) цис-2-бензоилоксиметил -5-(N4'-ацетил-5'-фтор-цитозин-1'-ил)-1,3-оксатиолана перемешивали в 30 мл метанольного раствора аммиака при 0oC в течение 1 ч и затем в течение ночи при комнатной температуре. Смесь выпаривали при пониженном давлении. Остаток дважды растирали (2х30 мл) с безводным эфиром. Твердый остаток перекристаллизовывали в абсолютном этаноле с образованием 655 мг (2,64 ммол. 87%) чистого продукта цис- (LII): т.пл. 204-206oC; Rf=0,21 в смеси этилацетат-метанол (9:1). Нужное соединение было идентифицировано с применением 1H, 13C-ЯМР и У.Ф.Лямбдаmax (H2O) 280,9 нм.
Транс-изомер:
1H-ЯМР σ (мил.д в ДМСО-d6):
7,85 (д, 1H; C6'-H, J=7,01 H2)
7,83 (д, 2H; C-NH2)
6,30 (дд, 1H; C5-H)
5,60 (т, 1H; C2-H)
5,18 (т, 1H; C2-CH2-OH)
3,49 (м, 3H; C2-CH2-OH+ C4H )
3,17 (дд, 1H; C4 H
13С-ЯМР (ДМСО-d6 ( Varian XL 300) s в мил.д.
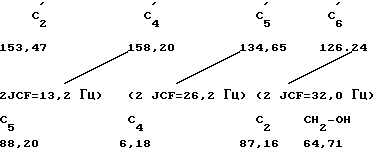
Цис-изомер
1H-ЯМР σ (мил. д. в ДМСО-d6):
8,22 (д, 1H; C'6 H, J 7,26 Гц)
7,84 (д, 2H; C'4- NH2)
6,16 (т, 1H; C5H)
5,43 (т, 1H; C2-CH2-OH)
5,19 (т, 1H; C2- H)
3,77 (м, 2H; C2-СH2 OH)
3,35 (дд, 1H; C4- H )
3,12 (дд, 1H; C4- H )
13C ЯМР (ДИСО-d6)
Пример 33. Хиральное БЭЖХ разделение энантиомеров (+) - цис-2-гидроксиметил-5-(5'-фторцитозин-1'-ил)-1,3-оксатиолана.
Рацемические продукты примера 35 могут быть разделены с применением хиральной ВЭЖХ при следующих условиях:
Колонка: Astec Cyclobond I ацетилированная β - циклодекстрином, 4,6 • 250 мм
Элюент: 0,1% триэтиламина в воде, содержащей 0,1% ацетонитрила при pH 7,3 (изократический режим)
Скорость: 1 мл/мин
(-) и (+) энантиомеры элюировали с временем удерживания 492 и 538 с соответственно. Хиральная ВЭЖХ разделяет рацемический цис-изомер на его, главным образом, чистые энантиомеры. В основном, чистая (-)-энантиомерная смесь содержит менее 1% (+)-энантиомера. В основном, чистый (+)-энантиомер содержит менее 2% (-) энантиомера.
Противовирусная активность
Для определения ингибирующих свойств отдельных соединений изобретения проведены их испытания in vitro. Полученные результаты приведены в табл. 1 и 2. Указанные концентрации (мкг/мл) в инкубационной среде соответствуют концентрациям, оказывающим влияние на восприимчивость непрерывно линии Т-лимфоцитов, создаваемых в Институте медицинских исследований лэди Дэвис (Монреаль) и др. Dr. Mar K.A. Wainberg по отношению к инфекции ВИЧ-1 по методике, аналогичной методике H.Mitsuya and S.Broder, "Ингибирование in vitro инфекционности и цитопатического действия Т-лимфотропного вируса типа III человека/вируса лимфоденопатии (HTLV III/LAV) 2', 3' - дидезоксинуклеозидами", Proc. Natl. Acad. Sci. США, 83, стр. 1911-15 (1986). Защиту клеточной линии от инфекции осуществляют их окрашиванием моноклональными антителами к вирусным белкам обычным образом (табл.1). Во всех опытах сравнение ведется с лекарством АЗТ в качестве контроля. Для подтверждения результатов действие лекарства выявляют измерением активности обратной транскриптазы (ОТ) в моноцитных клетках человека линии V 937 в испытании обычным образом с применением тритиированного тимидинтрифосфата (ТТФ) (табл.2). И, наконец, выявляют приемлемым способом действия лекарства на жизнеспособность клеток измерением хорошо известного цитолитического действия ВИЧ-1 на клеточную линию МТ-4 (табл.2).
Токсичность
Ни какого токсичного действия не отмечено в вышеописанных испытаниях.
Были также проведены испытания по определению антивирусной активности для ряда соединений настоящего изобретения. Для изучения антивирусной активности в качестве контрольного образца использовался AZT. Испытания Dot и Southern относящиеся к активности против человеческого вируса HBV гепатита B, осуществлялись в основном, как описано в работе E. Mathes и др. Antimicrob. Agents. Cnamotherap. 34 (10), 1986 1990 (1990).
Противовирусная активность в отношении вируса HTV-1 определялась на клетках МТ-4. Суспензия клеток (приблизительно 106 клеток/мл) в RPM1 1640 среде роста была инфицирована штаммом RF вируса HIV 1 при М.О.1. в 10-3 инфицированных единиц/клетку. Суспензия термостатировалась в течение 90 мин при комнатной температуре. Испытуемые соединения серийно разбавлялись с десятикратным снижением от 100 мкг/мл до 0,01 мкг/мл (конечные концентрации в двух 96-ячеечных микротитрованных чашках), 20 мкл инфицированной клеточной суспензии термостатировалось в каждой ячейке чашки. Затем чашка термостатировалась при 37oC в течение 7 дней. После термостатирования во всей ячейки было добавлено 10 мкл 3-(4,50 диметилтиазол-2-ил)-2,5-дифенилтетразол бромида (МТТ) при 20 мг/мл и чашки термостатировались еще 90 мин при 37oC.
Затем было добавлено 150 мкл 10% (по объему) спиртового раствора Triton X-100 и клетки повторно суспендировались. Спустя 15 мин пребывания чашек при комнатной температуре их содержимое анализировалось на Multiskan MC с записывающим устройством при 405 нм. Конверсия желтого ММТ в его формазановое производное показывает максимум в клетках, не подвергнутых инфицированию, и отсутствует в необработанных инфицированных клетках. Значения оптической плотности для цитотоксических контрольных образцов и для клеток, обработанных антивирусными веществами, вычерчивались графически и вычислялась доза соединений, требуемая для ингибирования конверсии МТТ в 50% по отношению к необработанным неинфицированным контрольным образцам. Таким путем могут быть определены как 50% цитотоксическая доза, CD 50%), так и 50% антивирусная доза (ID 50%).
Результаты представлены в табл. 3.
Пример рецептуры 1
Таблетированные составы
A. Нижеприведенный состав получен влажным гранулированием компонентов с водным раствором повидона, высушиванием, просеиванием и последующим добавлением стеарата магния и прессованием. мг/таблетку
(a) Активный компонент 250
(b) Лактоза В.П. 210
(c) Повидон В.Р. 15
(d) Гликолят натрийкрахмала 20
(e) Стеарат магния 5 500
B. Нижеследующий состав получен непосредственным прессованием; лактоза относится к типу, предназначенному для прямого прессования. мг/таблетку
Активный компонент 250
Лактоза 145
Авицель 100
Стеарат магния 5 500
C. (Состав продленного действия). Данный состав получен влажным гранулированием компонентов (приведены ниже) с водным раствором повидона, высушиванием и просеиванием с последующим добавлением стеарата магния и прессованием. мг/таблетку
(a) Активный компонент 500
(b) Гидроксипропилметилцеллюлоза (Метоцель К4М премиум) 112
(c) Лактоза В.Р. 53
(d) Повидон В.Р. 25
(e) Стеарат магния 5 700
Пример рецептуры 2
Капсулированный состав
Капсулированный состав получают смешиванием нижеприведенных и заполнением полученной смесью твердых желатиновых капсул, состоящих из двух частей.
мг/капсулу
Активный компонент 125
Лактоза 72,5
Авицель 50
Стеарат магния 2,5 250
Пример рецептуры 3
Состав для инъекций
Активный компонент 0,2 г
Раствор гидроксида натрия; 0,1 MgS До pH 11
Стерильная вода достаточное количество До 10 мл
Активный компонент суспендируют в некотором количестве воды (которая может быть подогрета) и добавлением раствора гидроксида натрия устанавливают pH около 11. Полученную смесь затем доводят до необходимого объема и фильтруют через стерилизованный мембранный фильтр в стерильные стеклянные пузырьки на 10 мл, которые закупоривают стерильными крышками с уплотнением.
Пример рецептуры 4
Свечи мг/свечу
Активный компонент 250
Твердый жир 1770 2020
Одну пятую часть твердого жира расплавляют в кастрюле с рубашкой для пара при максимальной температуре 45oC. Активный компонент просеивают через сито на 200 мкм и при перемешивании добавляют к расплавленной основе с помощью мешалки с высокой сдвиговой деформацией до момент образования ровной дисперсии. При температуре смеси 45oC добавляют остальную часть твердого жира и перемешивают до образования гомогенной смеси. Полученную суспензию целиком пропускают через сито из нержавеющей стали на 250 мкм и при непрекращающемся перемешивании охлаждают до 40oC. При 38-40oC смесью в количестве 2,02 г заполняют соответствующие пластиковые формы на 2 мл. Полученные свечи оставляют охлаждаться до комнатной температуры.




Описаны соединения формулы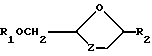
где R1 представляет водород; R представляет пуриновое или пиримидиновое основание, его аналог или производное; Z представляет S, S = 0 или SO2, и их фармацевтически приемлемые производные. Кроме того, описано применение этих соединений в качестве противовирусных средств, фармацевтические составы и способы получения таких соединения. 5 с. и 20 з.п. ф-лы, 3 табл.

его геометрические и оптические изомеры, смеси этих изомеров
где R1 водород;
R2 радикал, выбираемый из
где R3 водород;
R4 водород, С1 С6-алкил или фтор;
R5 водород или С1 С6-алкил;
R6 карбамоил или тиокарбамоил;
X и Y независимо водород, бром, хлор, фтор, йод, аминогруппа или гидроксильная группа;
Z S, SO или SO2,
и его фармацевтически приемлемые соли или эфиры.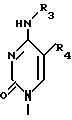
где R3 водород;
R4 водород, насыщенный С1 С6-алкил или фтор. ацетил-цитозин-1'-ил)-1,3-оксатиолана и их смесей, цис-2-бензоилоксиметил-5-(
ацетил-цитозин-1'-ил)-1,3-оксатиолана и их смесей, цис-2-бензоилоксиметил-5-( ацетил-цитозин-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(
ацетил-цитозин-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-( ацетил-цитозин-1'-ил)-1,3-оксатиолана и их смесей и цис-2-гидроксиметил-5-(цитозин-1'-ил)-3-оксо-1,3-оксатиолана, цис-2-гидроксиметил-5-(N-диметиламино-метиленцитозин-1'- ил)-1,3-оксатиолана, бис-цис-2-сукцинилоксиметил-5-(цитозин-1'-ил)-1,3- оксатиолана, цис-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиолана, транс-2- бензоилоксиметил-5-(6'-хлорпурин-N-9'- ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(6'-гидроксипурин-N-9'-ил)- 1,3-оксатиолана, цис-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана, цис-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана, цис-2-гидроксиметил-5-(5'-фторцитозин-1'-ил)-1,3-оксатиолана и его фармацевтически приемлемых производных.
ацетил-цитозин-1'-ил)-1,3-оксатиолана и их смесей и цис-2-гидроксиметил-5-(цитозин-1'-ил)-3-оксо-1,3-оксатиолана, цис-2-гидроксиметил-5-(N-диметиламино-метиленцитозин-1'- ил)-1,3-оксатиолана, бис-цис-2-сукцинилоксиметил-5-(цитозин-1'-ил)-1,3- оксатиолана, цис-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиолана, транс-2- бензоилоксиметил-5-(6'-хлорпурин-N-9'- ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(6'-гидроксипурин-N-9'-ил)- 1,3-оксатиолана, цис-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана, цис-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана, цис-2-гидроксиметил-5-(5'-фторцитозин-1'-ил)-1,3-оксатиолана и его фармацевтически приемлемых производных.
его геометрические и оптические изомеры и смеси таких изомеров,
где R1 водород или гидроксилзащитная группа;
Z S, SO или SO2;
L алкоксикарбонильная группа, йод, бром, хлор или -ОR, где R - алифатическая или ароматическая ацильная группа.
где W PO
R2 и Z имеют указанные значения;
J остаток оксо- или аминопиримидинона, который может быть замещен низшим алкилом, или остаток 6'-хлор- или 6'- гидроксипурина.
где R2 и Z имеют указанные значения.
их геометрических или оптических изомеров, или их смесей, или их фармацевтически приемлемых солей и эфиров,
где R1 водород,
R2 и Z имеют значения по п. 1,
отличающийся тем, что осуществляют реакцию соединения формулы VIII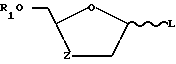
где R1 водород или гидроксилзащитная группа;
Z имеет значения, указанные в п. 1;
L способный к замещению атом или группа,
с основной группой R2 Н, и, если это необходимо, полученное соединение подвергают одной или двум дальнейшим реакциям, включающим (i) удаление любых защитных групп; (ii) превращение соединения формулы I или его соли в его фармацевтически приемлемую соль.
l8. Способ получения оксатиоланов в виде их геометрических или оптических изомеров или их смесей формулы I, или их фармацевтически приемлемых солей или эфиров, отличающийся тем, что осуществляют взаимодействие соединения формулы IX
с соединением формулы Х
где Р защитная группа,
и если необходимо, полученное соединение подвергают одной или двум дальнейшим реакциям, включающим (i) удаление любых защитных групп, (ii) превращение соединения формулы I или его соли в его фармацевтически приемлемую соль.
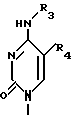
 ацетил-цитозин-1-ил)-1,3-оксатиолана и их смесей, цис-2-бензоилоксиметил-5-(
ацетил-цитозин-1-ил)-1,3-оксатиолана и их смесей, цис-2-бензоилоксиметил-5-( ацетил-цитозин-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(N-ацетил-цитозин-1'-ил)-1,3- оксатиолана и их смесей, цис-2-гидроксиметил-5-(цитозин-1-ил)-3-оксо-1,3-оксатиолана, цис-2-гидроксиметил-5-(N-диметиламино-метилен-цитозин-1'-ил)-1,3-оксатиолана, бис-цис-2-сукцинилоксиметил-5-(цитозин-1'-ил)-1,3- оксатиолана, цис-2-бензоилоксиметил-5-(6'-хлjрпурин-N-9'-ил)- 1,3-оксатиолана, транс-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиолана и их смесей, цис-1-гидроксиметил-5-(6'-гидроксипурин-N-9'-ил)-1,3-оксатиолана, цис-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана, цис-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана, и их фармацевтически приемлемых производных.
ацетил-цитозин-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(N-ацетил-цитозин-1'-ил)-1,3- оксатиолана и их смесей, цис-2-гидроксиметил-5-(цитозин-1-ил)-3-оксо-1,3-оксатиолана, цис-2-гидроксиметил-5-(N-диметиламино-метилен-цитозин-1'-ил)-1,3-оксатиолана, бис-цис-2-сукцинилоксиметил-5-(цитозин-1'-ил)-1,3- оксатиолана, цис-2-бензоилоксиметил-5-(6'-хлjрпурин-N-9'-ил)- 1,3-оксатиолана, транс-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиолана и их смесей, цис-1-гидроксиметил-5-(6'-гидроксипурин-N-9'-ил)-1,3-оксатиолана, цис-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана, цис-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана, транс-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана и их смесей, цис-2-гидроксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана, и их фармацевтически приемлемых производных.| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| B.Townsend | |||
| Chemistry of Heterocyclic Moiety of Purine Nucleosides and some Closeley Related Analogues | |||
| - Plenum Press, с.193-209, 1979 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Синтез и свойства пуриновых нуклеозидов и нуклеотидов, Химия нуклеозидов и нуклеотидов | |||
| L.B.Townsend Plemun | |||
| Press | |||
| Устройство для вытяжки и скручивания ровницы | 1923 |
|
SU214A1 |
Авторы
Даты
1997-10-10—Публикация
1990-02-07—Подача