Изобретение относится к новому пептидному соединению и его фармацевтически приемлемой соли, а именно к новому пептидному соединению и его фармацевтически приемлемой соли, которые имеют фармакологическую активность, например эндотелинантагонистическую и так далее, к способам их получения, к фармацевтической композиции, содержащей их, и к способу использования их терапевтически при лечении и предотвращении эндотелинопосредованных заболеваний, таких как гипертензия и так далее.
Целью изобретения является получение нового и полезного пептидного соединения и его фармацевтически приемлемой соли, которые имеют фармакологическую активность, например эндотелинантагонистическую и так далее.
Целью изобретения также является создание способов получения указанного пептидного соединения и его соли.
Другой целью изобретения является получение фармацевтической композиции, содержащей в качестве активного компонента указанное пептидное соединение или его фармацевтически приемлемую соль.
Еще одной целью изобретения является создание способа использования указанных веществ для лечения и предотвращения эндотелинопосредованных заболеваний, таких как гипертензия и тому подобное.
Искомое соединение изобретения может быть представлено следующей общей формулой I:
где R1 водород или ацил;
R2 низший алкил, по выбору замещенный ар(низший)алкил, цикло(низший)алкил(низший)алкил или по выбору замещенный гетероциклический (низший) алкил;
R3 по выбору замещенный гетероциклический (низший)алкил или по выбору замещенный ар(низший)алкил;
R4 водород или по выбору замещенный низший алкил;
R5 карбокси, замещенный карбокси, карбокси(низший)алкил или замещенный карбокси(низший)алкил;
R6 водород или по выбору замещенный низший алкил;
R7 водород или низший алкил;
A -O-, -NH-, низший алкилимино или низший алкилен, при условии, что когда R2 обозначает (S)-изобутил, R3 обозначает N-(дихлорбензилоксикарбонил)индол-3-илметил, R4 обозначает метил, R5 обозначает метоксикарбонил, R6 обозначает водород, R7 обозначает водород и A обозначает -NH-, тогда частичная формула
имеет абсолютную конфигурацию
В частности, соединение, представленное следующей формулой I', является более пригодным в качестве антагониста эндотелина и так далее:
где R1, R2, R3, R4, R5, R6, R7 и A имеют вышеприведенные значения.
Кроме того, соединение I, имеющее наиболее сильную активность, может быть представлено следующей формулой:
где R1, R4, R5, R7 и A имеют вышеприведенные значения, а Rc 2 обозначает низший алкил и Rc 3 обозначает по выбору N-замешенный индолилметил.
В соответствии с изобретением новое пептидное соединение I и его соль можно получить способами, которые приведены в следующих схемах:









где R1, R2, R3, R4, R5, R6, R7 и А имеют вышеприведенные значения;
R
R
R
R
R
R
R4 амино(низший)алкил или имино, содержащий гетероциклический(низший)алкил, по выбору замещенный пригодным заместителем(ями);
R
R
R
R
R
R
Некоторые из исходных соединений, используемых в вышеописанных способах, являются новыми и могут быть получены в соответствии со следующими методами и/или с применением способов, описанных в следующих получениях, или общепринятым способом:

где R1, R2, R3, R4, R5, R6, R7 и А имеют вышеприведенные значения;
R8 аминозащитная группа;
R9 защищенный карбокси.
В данном описании аминокислоты, пептиды, защитные группы, конденсирующие агенты и так далее указаны сокращениями в соответствии с IUPAC-IUB (Комиссия по биологической терминологии), которые обычно употребляются в данной области техники.
Кроме того, если не указано что-либо иное, аминокислоты и их остатки (когда показаны под такими сокращениями) подразумевают L-конфигурационные соединения и остатки, тогда как D-конфигурационные соединения и остатки показаны приставкой D-.
Пригодными фармацевтически приемлемыми солями целевого соединения I могут быть традиционные нетоксичные соли и они включают кислую аддитивную соль, такую как соль органической кислоты, например ацетат, трифторацетат, малеат, тартрат, фумарат, метансульфонат, бензолсульфонат, формиат, толуолсульфонат и так далее, соль неорганической кислоты, например хлоргидрат, бромгидрат, иодогидрат, сульфат, нитрат, фосфат и так далее, или соль с основанием, например аминокислота, например аргинин, аспарагиновая кислота, глутаминовая кислота и так далее, соль щелочного металла, например натриевая соль, калиевая соль и так далее, соль щелочноземельного металла, например калиевая соль, магниевая соль и так далее, соль аммония, соль органического основания, например, соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, соль дициклогексиламина, соль N,N'-дибензилэтилендиамина и так далее.
В вышеприведенном и последующем описаниях пригодные примеры и иллюстрации различных определений, попадающих в объем изобретения, объяснены более подробно следующим образом.
Термин "низший" подразумевает 1-6, предпочтительно 1-4 атома углерода, а термин "высший" подразумевает более, чем 6, предпочтительно 7 12 атомов углерода, если не указано что-либо иное.
Пригодный "ацил" может включать алифатический ацил, ароматический ацил, гетероциклический ацил и алифатический ацил, замещенный ароматической или гетероциклической группой(ами), имеющей происхождение от кислот, таких как карбоновые, угольные, карбаминовые, сульфоновые кислоты.
Алифатический ацил может включать насыщенный или ненасыщенный, ациклический или циклический ацил, например карбамоил, низший алканоил, например формил, ацетил, пропионил, бутурил, изобутурил, 3,3-диметилбутурил, 4,4-диметилвалерил, валерил, изовалерил, пивалоил, гексаноил, 3-метилвалерил и так далее, низший алкансульфонил, например мезил, этансульфонил, пропансульфонил и так далее, низший алкоксикарбонил, например метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил и так далее, низший алкеноил, например акрилоил, метакрилоил, кротоноил и так далее, (C3-C7) циклоалканкарбонил, например циклогексанкарбонил и так далее, (C3-С7)циклоалкил(низший)алканоил, например циклогексилацетил и так далее, амидино, защищенный карбоксикарбонил, такой как низший алкоксалил, например метоксаил, этоксаил, трет-бутоксалил и так далее, C3-C7-циклоалкилоксикарбонил, например циклогексилоксикарбонил и так далее, (гетероциклический ацил) (низший)алканоил, причем указанный гетероциклический ацил является таким же, что и упоминаемый ниже, например морфолинокарбонил(низший)алканоил, например 3-морфолинокарбонилпропаноил и так далее, низший или высший алкилкарбамоил, например метилкарбамоил, этилкарбамоил, пропилкарбамоил, изопропилкарбамоил, бутилкарбамоил, 2- метилбутилкарбамоил, пентилкарбамоил, 1,3-диметилбутилкарбамоил, гексилкарбамоил, гептилкарбамоил, октилкарбамоил, нонилкарбамоил и так далее, ди(низший)алкилкарбамоил, например, N-метил-N -этилкарбамоил, диметилкарбамоил, диэтилкарбамоил, дипропилкарбамоил, диизопропилкарбамоил, дибутилкарбамоил, диизобутилкарбамоил, диизобутилкарбамоил, дигексилкарбамоил и так далее, C3-C7-циклоалкилкарбамоил, например циклопропилкарбамоил, циклобутилкарбамоил, циклобутилкарбамоил, циклопентилкарбамоил, циклопентилкарбамоил, циклогексилкарбамоил, циклогептилкарбамоил и так далее, N-низший алкил-N-(C3-C7)циклоалкилкарбамоил, например N-метил-N-циклопропилкарбамоил, N-метил-N-циклогексилкарбамоил, N-этил-N-циклогексилкарбамоил, N-пропил-N-гексилкарбамоил и так далее, ди(C3-C7)циклогексилкарбамоил, например дициклопропилкарбамоил, дициклопентилкарбамоил, дициклогексилкарбамоил и так далее, N-[ди(низший)алкилкарбамоил(C3-C7) циклоалкил]карбамоил, например N-(1-(или 4-)диметилкарбамоилциклогексил)карбамоил и так далее), N- [ди(низший)алкилкарбамоил (низший)алкил(C3- C7)циклоалкил] карбамоил, например, N-[1-(или 4-) (диметилкарбамоилметил)-циклогексил] карбамоил и так далее, N- [карбамоил(низший)-алкил] карбамоил, например N-(1-карбамоил-2- метилбутил)-карбамоил и так далее, N-[N-(низший) алкилкарбамоил(низший)-алкил] карбамоил, например N-N-(1-изопропилкарбамоил-2-метилбутил)карбамоил и так далее), N-[N,N-низший алкиленкарбамоил(низший)алкил]карбамоил, например N-[2-метил-1-(пиперидинкарбонил)бутил] карбамоил и так далее, N -[N,N-ди-(низший)алкилкарбамоил(низший)алкил [карбамоил, например N- (диметилкарбамоилметил)карбамоил, N-[1-(или 2-) (диметилокарбамоил)этил]карбамоил, N-[(диметилкарбамоил)-2-метилпропил] карбамоил, N-[2,2-диметил-1- (диметилкарбомоил)пропил] карбамоил, N-[2-метил-1-(диметилкарбамоил) бутил] карбамоил, N-[2-метил-1-(диэтилкарбамоил)бутил] карбамоил, N-[3-метил-1-(диметилкарбамоил)бутил] карбамоил, N-(1-диметилкарбамоилпентил)карбамоил и так далее, N-(низший)алкил-N-[N,N-ди(низший)алкилкарбамоил](низший) алкилкарбамоил, например N-метил-N-[1-диметилкарбамоил--2-метилбутил] -карбамоил, N-метил-N-[диметилкарбамоил-3-метилбутил] -карбамоил и так далее, N-[N-(низший)циклоалкилкарбамоил-(низший)алкил] карбамоил, например N-(1-циклогексилкарбамоил)-2-метил-бутил)карбамоил и так далее и тому подобное.
Ароматический ацил может включать (C6- C10)ароил, например бензоил, толуоил, ксилоил, нафтоил и так далее, (C6-C10)аренсульфонил, например бензолсульфонил, тозил и так далее, (C6-C10)арилкарбамоил, например фенилкарбамоил, толилкарбамоил и так далее, (C6-C10)арилоксалил, например фенилоксалил и так далее, и тому подобное.
Гетероциклический ацил, в котором указанная гетероциклическая группа может быть такой, которая упомянута ниже, может включать гетероциклокарбонил, например фуроил, теноил 2- (или 3- или 4-) пиридилкарбонил, тиазолилкарбонил, тиадиазолилкарбонил, тетразолилкарбонил, пиперазинилкарбонил, морфолинокарбонил, тиоморфолинокарбонил, индолилкарбонил и так далее, низший или высший алкиленаминокарбонил, например азиридин-1-илкарбонил, азетидин -1-илкарбонил, пирролидин-1-илкарбонил, пиперидин-1-илкарбонил, гексагидро-1H-азепин-1-илкарбонил, октагидроазоцин-1-илкарбонил, тетрагидрохинолинкарбонил, тетрагидроизохинолинкарбонил, дигидропиридинкарбонил, тетрагидропиридинкарбонил и так далее, гетероциклический карбамоил, в котором указанная гетероциклическая группа может быть такой, которая упоминается ниже, например пиридилкарбамоил, пиперидилкарбамоил, гексагидро-1H-азепинилкарбомоил и так далее, и тому подобное.
Алифатический ацил, замещенный ароматической группой (группами) может включать (C6-C10)ар(низший)алканоил, такой как фенил(низший)алканоил, например фенилацетил, фенилпропионил, фенилгексаноил, нафтилацетил и так далее, (C6-C10)-ар(низший)алкоксикарбонил, такой как фенил(низший)алкоксикарбонил, например бензилоксикарбонил, фенетилоксикарбонил и так далее, фенокси(низший)алканоил, например феноксиацетил, феноксипропионил и так далее, (C6-C10)ар(низший) алкоксалил, такой как фенил(низший)алкоксалил, например бензилоксалил и так далее, (C6-C10) ар(низший)алкеноил, такой как фенил (низший) алкеноил, например циннамоил и так далее, (C6-C10)ар (низший)алкилсульфонил, например бензилсульфонил и так далее, и тому подобное.
Алифатический ацил, замещенный гетероциклической группой(ами), может включать гетероциклический (низший) алканоил, в котором указанная гетероциклическая группа может быть такой, которая упоминается ниже, например тиенилацетил, имидазолилацетил, фурилацетил, тетразолилацетил, тиазолилацетил, тиадизолилацетил, тиенилпропионил, тиадиазолилпропионил, пиридилацетил и так далее), гетероциклический (низший)-алкилкарбамоил, в котором указанная гетероциклическая группа может быть такой, которая упоминается ниже, например пиридилметилкарбомоил, морфолиноэтилкарбомоил, и так далее, и тому подобное.
Эти ацильные группы могут быть далее замещены одним или более, предпочтительно 1-3, пригодными заместителями, таким как гидрокси, низший алкил, например метил, этил, пропил, изопропил, бутил, трет-бутил, пентил, гексил и так далее, галоген, например хлор, бром, иод, фтор, карбамоил, оксо, ди(низший)алкилкарбамоил, амино, защищенный амино, такой как низший алканоиламино, например формамидо, ацетамидо, пропионамидо и так далее, низший алкоксикарбониламино, например третбутоксикарбониламино и так далее, низший алкилсульфонил, например метилсульфонил и так далее, арилсульфонил, например фенилсульфонил, тозил и так далее, ар(низший) алкил например бензил и так далее, низший алкокси наример метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси и так далее, карбокси, защищенный карбокси, упоминаемый ниже, карбокси(низший) алкил, например карбоксиметил, карбоксиэтил и так далее, защищенный карбокси(низший)алкил, например трет-бутоксикарбонилметил и так далее).
Пригодными примерами вышеприведенных ацильных групп, которые замещены одним или более, предпочтительно 1-3, пригодными заместителями, могут быть галофенил (низший)алканоил, например 2-хлорфенилацетил и так далее, (аминофенил) (низший)алканоил, например 4-аминофенилацетил и так далее, [(низший алкоксикарбониламино)фенил] (низший)алканоил, например 4-(трет-бутоксикарбониламино) фенилацетил и так далее, амино (низший) алканоил, например 2-амино-3- метилпентаноилю и так далее, (низший алкоксикарбониламино) (низший)алканоил, например 2-(трет-бутоксикарбониламино)-3-метилпентаноил и так далее, низший алканоил, замещенный пригодным заместителем(ями), например фенил, амино, низший алкоксикарбониламино и так далее, например 2-амино-2-фенилацетил, 2-(трет-бутоксикарбониламино)-2-фенилацетил и так далее, ди(низший)алкилпиперидинилкарбонил, например 2,6- (или 3,5-)- диметилпиперидин-1-илкарбонил и так далее, [ди(низший)алкилкарбамоил] пиперидинилкарбонил, например 4-(диметилкарбамоил)-пиперидин-1-илкарбонил и так далее, [ди(низший)алкилкарбамоил] пирролидинилкарбонил, например 2-(диметилкарбамоил)-пирролидин-1-илкарбонил и так далее, пиперазинилкарбонил, замещенный пригодным заместителем(ями), например низший алкил, оксо и так далее, например 4-метил-3-оксо-2-(1-метилпропил)пиперазин-1-илкарбонил и так далее, N-(низший)-алкил-N-[гидрокси(низший)алкил]карбамоил, например N -метил-N-(2-гидроксиэтил)карбамоил и так далее, N- [гидрокси(низший)алкил]карбамоил, например N-[1-(гидроксиметил)-3- метилбутил]карбамоил и так далее, N-[(C3-C7) циклоалкил-(низший) алкил]карбамоил, например N-(циклогексилметил)-карбамоил и так далее, N-[карбокси(низший)алкил]карбамоил, например N-(1-карбокси-2-метилбутил)карбамоил и так далее, N-[(низший)алкоксикарбонил(низший)алкил] карбамоил, например N-(1-метоксикарбонил-2-метилбутил) карбамоил и так далее, (оксогетероциклический) карбамоил, в котором указанная гетероциклическая группа может быть такой, которая упоминается ниже, например [оксо(гексагидро-1H-азепинил)]карбамоил, например E-капролактам-3-ил и так далее, N-[N-(низший)алкоксикарбонилпиперидинил] карбамоил, например N-(N- этоксикарбонилпиперидин-4-ил)карбамоил и так далее, N-[N,N- ди(низший)алкилкарбамоил(низший)алкил] карбамоил, замещенный фенилом или цикло(низший)алкилом, например N-[1-(N,N-диметилкарбамоил)-1-фенилметил] карбамоил, N-[1-(N, N- диметилкарбамоил)-1-циклошексилметил]карбамоил и так далее, N-[гидрокси(C3-C7)циклоалкил]карбамоил, например N-(4-гидроксициклогексил)карбамоил и так далее, N-(низший)алкоксифенилкарбамоил, например N-(4- метоксифенил)-карбамоил и так далее, N-(низший алканоиламино)карбамоил, например N-(2-метилпропаноиламино)карбамоил и так далее.
Предпочтительным примером ацила может быть карбамоил, низший алканоил, например формил, ацетил, пропионил, бутурил, изобутурил, 3,3- диметиобутурил, 4,4-диметилвалерил, валерил, изовалерил, пивалоил, гексаноил, 3-метилвалерил и так далее, низший алкоксикарбонил, например метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, т- бутоксикарбонил и так далее, низший алкеноил, например акрилоил, метакрилоил, кротоноил и так далее, (C3-C7)-циклоалканкарбонил, например циклогексанкарбонил и так далее, (C3-C7) циклоалкил(низший)алканоил, например циклогексилацетил и так далее, C3-C7-циклоалкилоксикрабонил, например циклогексилоксикарбонил и так далее, морфолинокарбонил(низший)алканоил, например 3-морфолинокарбонилпропаноил и так далее, низший или высший алкилкарбамоил, например метилкарбамоил, этилкарбамоил, пропилкарбамоил, изопропилкарбамоил, бутилкарбамоил, 2-метилбутилкарбамоил, пентилкарбамоил, 1,3-диметиобутилкарбамоил, гексилкарбамоил, гептилкарбамоил, оксилкарбамоил, нонилкарбамоил и так далее, ди(низший)алкилкарбамоил, например N-метил-N-этилкарбамоил, диметилкарбамоил, диэтилкарбамоил, дипропилкарабамоил, диизопропилкарабамоил, дибутилкарабамоил, диизобутилкарбамоил, дигексилкарбамоил и так далее, C3-C7-циклоалкилкарбамоил, например циклопропилкарабамоил, циклобутилкарабамоил, циклопентилкарабамоил, циклогексилкарбамоил, циклогептилкарбамоил и так далее, N-низший алкил-N-(C3- C7)циклоалкилкарбамоил, например N-метил-N-циклопропилкарбамоил, N-метил-N- циклогексилкарбамоил, N-этил-N-циклогексилкарбамоил, N-пропил-N -гексилкарбамоил и так далее, ди(C3- C7)циклогексилкарбамоил, например дициклопропилкарбамоил, дициклопентилкарабамоил, дициклогексилкарбамоил и так далее, N-[ди-(низший)алкилкарбамоил(C3-C7) циклоалкил] карбамоил, например N-(1- (или 4-)-диметилкарбамоилциклогексил) карабамоил и так далее, N-[ди(низший)алкилкарбамоил(низший) алкил(C3-C7)-циклоалкил] карбамоил, например N-[1-(или 4-) (диметилкарбамоилметил)циклогексил] карбамоил и так далее, N-[карбамоил(низший)алкил] карбамоил, например N-(1-карбамоил-2-метилбутил)карбамоил и так далее, N-[N-(низший алкилкарбамоил (низший)алкил] карбамоил, например N-(1-изопропилкарбамоил-2- метилбутил)карбамоил и так далее, N-[N,N-низший алкиленкарбамоил(низший)алкил] карбамоил, например N-[2-метил-1- (пиперидинокарбонил)бутил] карбамоил и так далее, N-[N, N-ди(низший алкилкарбамоил(низший)алкил]карбамоил, например N- (диметилкарабамоилметил)карбамоил, N-[1-(или 2-) (диметилкарабамоил)этил] карбамоил, N-[1-(диметилкарбамоил)-2-метилпропил] карбамоил, N-[2,2-диметил-1- (диметилкарбамоил)пропил]карбамоил, N-[2-метил-1- (диметилкарбамоил)бутил] карбамоил, N-[2-метил-1-(диэтилкарбамоил)бутил] карбамоил, N-[3-метил-1-(диметилкарбамоил)бутил] карбамоил, N-(1-диметилкарбамоилпентил)карбамоил и так далее, N-(низший)-алкил-N-[N,N-ди(низший)алкилкарбамоил] (низший)алкилкарбамоил, например N-метил-N-(1-диметилкарбамоил-2-метилбутил)карбамоил, N-метил-N-(1-диметилкарбамоил-3-метилбутил-карбамоил и так далее, N-[N-(низший) циклоалкилкарбамоил(низший)алкил] карбамоил, например N-(1-циклогексилкарбамоил-2-метилбутил)карбамоил и так далее, (C6-C10)ароил, например бензоил, толуоил, ксилоил, нафтоил и так далее, (C6-C10) арилкарбамоил, например фенилкарбамоил, толилкарбамоил и так далее, (C6-C10)арилоксалил, например фенилоксалил и так далее, фуроил, теноил, 2-(или 3-, или 4-)-пиридилкарбонил, тиазолилкарбонил, тиадиазолилкарбонил, тетразолилкарбонил, пиперазинилкарбонил, морфолинокарбонил, тиоморфолинокарбонил, индолилкарбонил, низший алкиленаминокарбонил, например азиридин-1-илкарбонил, азетидин-1-илкарбонил-пирролидин-1-илкарбонил, пиперидин-1-илкарбонил, гексагидро-1Н-азепин-1-илкарбонил, октагидроазоцин-1-илкарбонил, тетрагидрохинолинкарбонил, тетрагидропиридинкарбонил и так далее, пиридилкарбамоил, пиперидилкарбамоил, гексагидро-1Н-азепинилкарбамоил, (C6-C10)ар(низший)алканоил, например фенил(низший)алканоил, например фенилацетил, фенилпропионил, фенилгексаноил, нафтилацетил и так далее, (C6-C10)ар(низший)алкоксикарбонил, такой как фенил(низший)алкоксикарбонил, например бензилоксикарбонил, фенетилоксикарбонил и так далее, (C6-C10)ар(низший)алкоксалил, такой как фенил(низший)алкоксалил, например бензилоксалил и так далее, (C6-C10)ар(низший)алкеноил, такой как фенил(низший)алкеноил, например циннамоил и так далее, (C6-C10)ар(низший)алкилсульфонил, например бензилсульфонил, и так далее, тиенилацетил, имидазолилацетил, фурилацетил, тетразолилацетил, тиазолилацетил, тиадиазолилацетил, тиенилпропионил, тиадиазолилпропионил, пиридилацетил, пиридилметилкарбамоил, морфолиноэтилкарбамоил, галофенил(низший)алканоил, например 2- хлорфенилацетил и так далее, (аминофенил)(низший)алканоил, например 4- аминофенилацетил и так далее, [(низший алкоксикарбониламино)фенил](низший) алканоил, например 4- (третбутоксикарбониламино)фенилацетил и так далее, амино(низший)-алканоил, например 2-амино-3-метилпентаноило, и так далее, (низший алкоксикарбониламино)(низший)алканоил, например 2-(трет-бутоксикарбониламино)-3-метилпентаноил и так далее, низший алканоил, замещенный пригодным заместителем(ями), например фенил, амино-, низший алкоксикарбониламино, например 2-амино-2-фенилацетил, 2-(трет-бутоксикарбониламино)-2-фенилацетил и так далее, ди(низший)алкилпиперидинилкарбонил, например 2,6-(или 3,5-)диметилпиперидин-1-илкарбонил и так далее, [ди(низший)алкилкарбамоил] пиперидинилкарбонил, например 4- (диметилкарбамоил)пиперидин-1-илкарбонил и так далее, [ди(низший)алкилкарбамоил] пирролинилкарбонил, например 2- (диметилкарбамоил)пирролидин-1-илкарбонил и так далее, пиперазинилкарбонил, замещенный пригодным заместителем (заместителями), например низший алкил, окcо и так далее, например 4-метил-3- оксо-2-(1-метилпропил)пиперазин-1-илкарбонил, и так далее, N-(низший)алкил-N-[гидрокси(низший)алкил] карбамоил, например N-метил-N-(2-гидроксиэтил)-карбамоил и так далее, N- [гидрокси(низший)алкил] карбамоил, например N-[1-(гидроксиметил)-3- метилбутил]карбамоил и так далее, N-[(C3-C7) циклоалкил(низший)алкил]карбамоил, например N-(циклогексилметил)карбамоил и так далее, N-[карбокси(низший) алкил] карбамоил, например N-(1-карбокси-2-метилбутил)карбамоил и так далее, N-[(низший)алкоксикарбонил(низший)алкил] карбамоил, например N-(1-метоксикарбонил-2-метилбутил)карбамоил и так далее, (оксогетероциклический)карбамоил, такой как [оксо(гексагидро-1H- азепинил)]-карбамоил (например, E-капролактам-3-ил и так далее, N-[N-(низший)алкоксикарбонилпиперидинил] карбамоил, например N-(N-этоксикарбонилпиперидин-4-ил)карбамоил и так далее, N-[N-N-ди (низший)алкилкарбамоил(низший)алкил] карбамоил, замещенный фенилом или цикло (низший)алкилом, например N-[1-(N,N- диметилкарбамоил)-1-фенилметил]карбамоил, N-[1-(N, N-диметилкарбамоил)-1-циклогексилметил] карбамоил и так далее, N-[гидрокси(C3-C7) циклоалкил] карбамоил, например N-(4-гидроксициклогексил)карбамоил и так далее, N-(низший)алкоксифенил)карбамоил, например N-/4- метоксифенил)карбамоил и так далее, N-(низший алканоиламино)карбамоил, например N-(2-метилпропаноиламино)карбамоил и так далее и тому подобное.
Пригодный "низший алкил" может включать прямоцепочечный или разветвленный низший алкил, такой как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил и так далее, где наиболее предпочтительным примером является изобутил, 1-метилпропил, н-бутил, и 2,2-диметилпропил для R2, а также метил для R7.
Пригодный "низший алкилен" может включать прямоцепочечный или разветвленный, такой как метилен, этилен, пропилен, триметилен, тетраметилен, пентаметилен, гексаметилен и так далее, где наиболее предпочтительным примером является метилен.
Пригодный "защищенный карбокси" может включать эстерифицированный карбокси и амидированный карбокси, как указано выше. "Эстерифицированный карбокси" может быть из числа упоминаемых ниже.
Пригодными примерами части сложного эфира эстерифицированного карбокси могут быть сложный низший алкиловый эфир, например метиловый эфир, этиловый эфир, пропиловый эфир, изопропиловый эфир, бутиловый эфир, изобутиловый эфир, т-бутиловый эфир, пентиловый эфир, гексиловый эфир и так далее, который может иметь по крайней мере один пригодный заместитель(и), например сложный низший алканоилокси(низший) алкиловый эфир, например сложный ацетоксиметиловый эфир, сложный пропионилоксиметиловый эфир, сложный бутурилоксиметиловый эфир, сложный валерилоксиметиловый эфир, сложный пивалоилоксиметиловый эфир, сложный гексаноилоксиметиловый эфир, сложный 1- (или 2-, или 3-, или 4-) ацетоксибутиловый эфир, сложный 1-(или 2-) пропионилоксиэтиловый эфир, сложный 1-(или 2-, или 3-) пропионилоксипропиловый эфир, сложный 1-(или 2-) бутурилоксиэтиловый эфир, сложный 1-(или 2-) изобутурилоксиэтиловый эфир, сложный 1- (или 2-) пивалоилоксиэтиловый эфир, сложный 1-(или 2-) гексаноилоксиэтиловый эфир, сложный изобутурилоксиметиловый эфир, сложный 2-этилбутурилоксиметиловый эфир, сложный 3,3-диметилбутурилоксиметиловый эфир, сложный 1-(или 2-) пентаноилоксиэтиловый эфир и так далее, ароил (низший) алкиловый сложный эфир, такой как бензоил (низший) алкиловый эфир, например фенациловый эфир, и так далее, сложный низший алкансульфонил (низший) алкиловый эфир, например 2-мезилэтиловый эфир и так далее, сложный моно (или ди, или три ) гало (низший) алкильный эфир, например 2-иодоэтиловый эфир, 2,2,2-трихлорэтиловый эфир и так далее, сложный низший алкоксикарбонилокси (низший) алкиловый эфир, например метоксикарбонилоксиметиловый эфир, этоксикарбонилоксиметиловый эфир, пропоксикарбонилоксиметиловый эфир, трет-бутоксикарбонилоксиметиловый эфир, 1-(или 2-) метоксикарбонилоксиэтиловый эфир, 1-(или 2-) этоксикарбонилоксиэтиловый эфир, 1-(или 2-) изопропоксикарбонилоксиэтиловый эфир и так далее, сложный фталидилиден (низший), алкиловый эфир или сложный (5-низший алкил-2-оксо-1,3-диоксол-4-ил) (низший) алкиловый эфир, например (5-метил-2-оксо-1,3-диоксол-4-ил) метиловый эфир, (5-этил-2-оксо-1,3-диоксол-4-ил- метиловый эфир, (5-пропил-2-оксо-1,3-диоксол-4-ил) этиловый эфир и так далее, сложный низший алкениловый эфир, например виниловый эфир, аллиловый эфир и так далее, сложный низший алкиниловый эфир, например этиниловый эфир, пропиниловый эфир и так далее, сложный ар(низший) алкиловый эфир, который может иметь по крайней мере один пригодный заместитель, например бензиловый эфир, 4-метоксибензиловый эфир, 4-нитробензиловый эфир, фенетиловый эфир, тритиловый эфир, бензгидриловый эфир, бис(метоксифенил)метиловый эфир, 3,4- диметоксибензиловый эфир, 4-гидрокси-3,5-ди-т-бутилбензиловый эфир и так далее, сложный ариловый эфир, который может иметь по крайней мере один пригодный заместитель(и), например фениловый эфир, 4-хлорфениловый эфир, толиловый эфир, трет-бутилфениловый эфир, ксилиловый эфир, кумениловый эфир и так далее, сложный фталиниловый эфир и так далее.
Предпочтительными примерами определенного таким образом эстерифицированного карбокси могут быть низший алкоксикарбонил, фенил(замещенный) алкоксикарбонил и бензоил (низший) алкоксикарбонил, а наиболее предпочтительными могут быть метоксикарбонил, этоксикарбонил, бензилоксикарбонил и фенацилоксикарбонил.
Пригодный "карбокси(низший)алкил" обозначает вышеупомянутый низший алкил, который замещен карбокси, где предпочтительными примерами могут быть карбоксиметил, карбоксиэтил, карбоксипропил и карбоксибутил для R5.
Пригодный "защищенный карбокси(низший)алкил" обозначает вышеупомянутый низший алкил, который замещен вышеупомянутым "защищенным карбокси", при этом более предпочтительным примером может быть низший алкоксикарбонил(низший)алкил, фенил(низший)алкоксикарбонил(низший) алкил и бензоил(низший)алкоксикарбонил, и более предпочтительными примерами являются метоксикарбонилметил, метоксикарбонилэтил, метоксикарбонилпропил, метоксикарбонилбутил, фенацилоксикарбонилметил, фенацилоксикарбонилэтил, фенацилоксикарбонилпропил и фенацилоксикарбонилбутил для R5.
Указанный "амидированный" карбокси" может относиться к упоминаемым ниже.
Пригодные примеры амидированного карбокси включают карбамоил; моно (или ди) (низший)алкилкарбамоил, где низшая алкильная группа может быть такой, которая упоминается ниже, например метилкарбамоил, этилкарбамоил, изопропилкарбамоил, бутилкарбамоил, 3-метилбутилкарбамоил, изобутилкарбамоил, пентилкарбамоил, диметилкарбамоил, диэтилкарбамоил и так далее, а кроме того указанный низший алкил может быть замещен группой, состоящей из карбокси, защищенного карбокси, например низшего алкокосикарбонила, например метоксикарбонила, этоксикарбонила и так далее, ар(низший)алкоксикарбонила, предпочтительно фенил(низший)алкоксикарбонила, например бензилоксикарбонила, и так далее, ароил(низший)алкоксикарбонила, предпочтительно бензоил (низший)алкоксикарбонила, например фенацилоксикарбонила и так далее; арила, например, фенил, нафтил и так далее; гетероциклической группы, упоминаемой ниже, например насыщенная или ненасыщенная 5- или 6-членная гетеромоноциклическая группа, содержащая 1 4 атома азота, например пиридил, пирролидинил и так далее, при этом указанная гетероциклическая группа может быть замещена пригодным заместителем(ями), такими как оксо, карбокси, защищенный карбокси и карбомоил, например оксопирролидинил, замешенный карбокси, низшим алкоксикарбонилом, например 2-оксо-5-карбокси-пирролидинил, 2-оксо-5-карбамоилпирролидинил и так далее; C3-C7-циклоалкила, по выбору замещенного карбокси или защищенным карбокси, например низший алкоксикарбонил, например карбоксициклогексил, этоксикарбонилциклогексил и так далее; (C3-C7)циклоалкилкарбомаил, например циклогексилкарбамоил и так далее; карбамоил, замещенный амино или ди(низший)алкиламино, например N-аминокарбамоил, N- (диметиламино)карбамоил и так далее; -N-(по выбору замещенный гетероциклический)карбамоил, где гетероциклическая часть является такой же, что и упомянутая выше, например насыщенная или ненасыщенная 5- или 6-членная гетеромоноциклическая группа, содержащая 1 2 атома кислорода и 1 - 3 атома азота, ненасыщенная 5- или 6- членная гетеромоноциклическая группа, содержащая 1 2 атома серы и 1 3 атома азота, ненасыщенная конденсированная 7 12-членная гетероциклическая группа, содержащая 1 2 атома серы и 1 3 азота, при этом каждая из указанных гетероциклических групп может быть замещена пригодным заместителем(ями), такими как гидрокси, защищенный гидрокси, галоген, низший алкокси, низший алкил, амино, нитро и циано, например тиазолилкарбамоил, бензотиазолилкарбамоил, морфолинокарбамоил N-(низший алкилтиадиазолил)карбамоил, например метилтиадиазолилкарбамоил и так далее; низший алкиленаминокарбамоил, например пирролидин-1-илкарбонил, гексагидро-1Н-азепин-1-илкарбонил и так далее, причем указанный алкилен по выбору замещен карбокси или замещенным карбокси, например низший алкокси карбонил, например карбоксипирролидин-1-илкарбонил, (метоксикарбонил)пирролидин-1-илкарбонил, (этоксикарбонил)-1-илкарбонил, и так далее, или указанный алкилен по выбору разорван другим гетероатомом(ами), например азотом, кислородом или серой, например морфонилокарбонил и так далее; низший алкилсульфонилкарбамоил, например метилсульфонилкарбамоил и так далее; аренсульфонилкарбамоил, например бензосульфонилкарбамоил и так далее и тому подобное.
Предпочтительными примерами определенного таким образом амидированного карбокси могут быть: карбамоил; моно-(или ди) низший алкил карбамоил, например метилкарбамоил, этилкарбамоил, изопропилкарбамоил, бутилкарбамоил, 3-метилбутилкарбамоил, изобутилкарбамоил, пентилкарбамоил, диметилкарбамоил, диэтилкарбамоил и так далее; N-(низший)алкил-N- [карбокси(низший)алкил] каробамоил, например N-метил-N-(карбоксиметил)карбамоил и так далее; N- (низший)алкил-N-[защищенный карбокси(низший) алкил] карбамоил, такой как N-(низший)алкил-N-[низший алкоксикарбонил(низший)алкил] карбамоил, например N- метил-N-(метоксикарбонилметил) карбамоил и так далее; N-[карбокси (низший)алкил] карбамоил, например N-(карбоксиметил)карбамоил, N-(2- карбоксиэтил)карбамоил, N-(3-карбоксипропил)карбамоил, N-(4- карбоксибутил)карбамоил, N-(5-карбоксипентил)карбамоил, N-(1 -карбоксиэтил)карбамоил, N-(1-карбокси-2-метилпропил)карбамоил, N-(1-карбокси-3-метилбутил)карбамоил, N-(1,2 -дикарбоксиэтил)карбамоил и так далее; N-[защищенный карбокси (низший) -алкил]карбамоил, такой как N-[низший алкоксикарбонил(низший)алкил] карбамоил, например N- (метоксикарбонилметил)карбамоил, N-(2-метоксикарбонилэтил)карбамоил, N-(3-метоксикарбонилпропил)карбамоил, N-(4-метоксикарбонилбутил) карбамоил, N-(5-метоксикарбонилпентил)карбамоил, N-[1,2- бис(метоксикарбонил)этил] карбамоил и так далее, N-[ар(низший)-алкоксикарбонил(низший)алкил] карбамоил, предпочтительно N-[фенил(низший) алкоксикарбонил(низший)алкил] карбомаил, например N- (бензилоксикарбонилметил)карбамоил, N-(2-бензилоксикарбониэтил)карбамоил, N-(3-бензилоксикарбонилпропил)карбамоил, N-4- бензилоксикарбонилбутил)карбамоил, N -(5-бензилоксикарбонилпентил)карбомаил и так далее, N- [ароил(низший)алкокси] (низший)алкил} карбамоил, предпочтительно бензоил(низший)алкокси(низший) алкилкарбамоил, например N- (фенацилоксикарбонилметил)карбамоил, N-(2-фенацилоксикарбонилэтил)карбамоил, N- (3-фенацилоксикарбонилпропил)карбамоил, N-(4-фенациклоксикарбонилбутил) карбамоил, N-(5-фенациклоксикарбонилпентил) карбамоил, N-(1-фенациклоксиэтил)карбамоил, N-(1-фенацилокси-2-метилпропил)карбамоил, N-(1-фенацилокси-3-метилбутил)карбамоил и так далее; N-[карбокси(низший)алкил]карбамоил, замещенный арилом, например N-[карбокси(низший)алкил]карбамоил, замещенный фенилом или нафтилом, например N-(1-карбокси-2-фенилэтил)-карбамоил и так далее; N-защищенный карбокси(низший)алкилкарбамоил, замещенный арилом, например N-{ [низший алкоксикарбонил](низший)алкил}карбомаил, замещенный фенилом или нафтилом, например N-(1-этоксиикарбонил-2- фенилэтил)карбамоил и так далее; N-[карбокси(низший)алкил] карбомаил, замещенный гетероциклической группой, например пирролилом, пирролинилом, имидазолином, пиразолином, пиридилом и его N-оксидом, пиримидилом, пиразинилом, пиридазинилом, триазолилом, 2H-1,2,3-триазолилом и так далее, тетразолилом и дигидротриазинилом, например N-[1-карбокси-2-(пиридин -2-ил)этил] карбомаил и так далее; N-[защищенный карбокси(низший)алкил]карбамоил, замещенный гетероциклической группой, такой как N-[низший алкоксикарбонил(низший)алкил] карбамоил, замещенный пирролилом, пирролинилом, имидазолилом, пиразолилом, пиридилом и его N-оксидом, пиримидилом, пиразинилом, пирадазинилом, триазолилом, тетразолилом или дигидротриазинилом, например N-[1-этоксикарбонил-2-(пиридин-2- ил)этил]карбамоил и так далее; N-арил(низший)алкилкарбомаил, например N-бензилкарбамоил и так далее; N-[карбокси(C3-C7) циклолалкил](низший)алкил} карбамоил, например N-(4- карбоксициклогексилметил)карбомаил и так далее; N-{[защищенный карбокси(C3-C7) циклоалкил](низший)алкил} карбомаил, такой как N-{[низший алкоксикарбонил (C3-C7) циклоалкил](низший)-алкил}карбамоил, такой как N-{[низший алкоксикарбонил(C3- C7)циклоалкил](низший)алкил}карбамоил, например N- (4-этоксикарбонилциклогексилметил)карбамоил и так далее; N- [гетероциклический(низший)алкил] карбамоил, причем указанная гетероциклическая группа является азетидинилом, пирролидинилом, имидазолидинилом, пиперидинилом, пиразолидинилом и пиперазинилом, например N-[пирролидинил(низший)алкил] карбамоил, например N-[2-(пирролидин-1-ил)этил] карбамоил и так далее, причем указанная гетероциклическая группа может быть замещена пригодным заместителем(ями), такими как оксо, карбокси, защищенный карбокси и карбомоил, например оксопирролидинил, замещенный карбокси, низшим алкоксикарбонилом или карбамоилом, например 2-оксо-5-карбоксипирролидинил, 2-оксо-5-этоксикарбонилпирролидинил, 2-оксо-5-карбомаилпирролидинил и так далее; (C3- C7) циклоалкилкарбамоил, например циклогексилкарбомаил и так далее; карбамоил, замещенный амино или ди (низший)алкиламино, например N-аминокарбамоил, N-(диметиламино)карбамоил и так далее; N- (по выбору замещенный гетероциклический)карбамоил, причем гетероциклической частью является тиазолил, 1,2-тиазолил, тиазолинил, тиадиазолил, тиазолидинил, бензотиазолил, бензотиадиазолил, морфолинил, например тиазолилкарбамоил, бензотиазолилкарбамоил и морфолинилкарбамоил и так далее, при этом каждая из указанных гетероциклических групп может быть замещена низшим алкилом, например N-(низший алкилтиадиазолил)карбамоил, например метилтиадиазолил и так далее; низший алкиленаминокарбонил, например пирролидин-1-илкарбонил, гексагидро-1Н-азепин-1-илкарбонил и так далее; низший алкиленаминокарбонил, замещенный карбокси или защищенным карбокси, например, низший алкоксикарбонил, например 2-карбоксипирролидин-1-илкарбонил, 2-(метоксикарбонил)пирролидин-1-илкарбонил, 2-(этоксикарбонил)-пирролидин-1-илкарбонил и так далее; низший алкиленаминокарбонил, в котором указанный низший алкилен прерывается кислородом, например морфолинокарбонил и так далее; низший алкилсульфонилкарбамоил, например метилсульфонилкарбамоил и так далее; (C6-C10) аренсульфонилкарбамоил, например бензолсульфонилкарбамоил и так далее и тому подобное.
Пригодный "по выбору замещенный гетероциклический(низший)-алкил" означает вышеуказанный низший алкил, который замещен насыщенной или ненасыщенной, могоциклической или полициклической гетероциклической группой, содержащей по меньшей мере один гетероатом, такой как кислород, сера и так далее.
Более предпочтительной гетероциклической частью может быть такая гетероциклическая группа, как ненасыщенная 3 8-членная, предпочтительно 5- или 6-членная, гетеромоноциклическая группа, содержащая 1 4 атома азота, например пирролил, пирролинил, имидазолил, паразолил, пиридил и его N-оксид, пиримидил, пиразинил, пиридазинил, триазолил, например 1Н -1,2,4-триазолил, 1Н-1,2,3-триазолил, 2Н-1,2,3-триазолил и так далее, дигидротриазинил, например 4,5-дитгидро-1,2,4-триазинил, 2,5-дигидро -1,2,4-триазинил и так далее); ненасыщенная 3 8-членная, предпочтительно 5- или 6-членная гетеромоноциклическая группа, содержащая 1 4 атома азота, например азетидилин, пирролидинил, имидазолидин, пиперидинил, пиразолидинил, пиперазинил и так далее; ненасыщенная конденсированная 7 12-членная гетероциклическая группа, содержащая 1 5 атомов азота, например индолил, изоиндолил, индолизинил, бензимидазолил, хинолил, изохинолил, индазолил, бензотриазолил, тетразолопиридил, тетразолопиридазинил, например тетразоло(1,5-в)пиридазинил, и так далее, дигидротриазолопиридазинил и так далее; ненасыщенная 3 8-членная, предпочтительно 5- или 6-членная гетеромоноциклическая группа, содержащая 1 2 атома кислорода и 1 3 атома азота, например оксазолил, изоксазолил, оксадиазолил, например 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оскадиазолил и так далее; ненасыщенная 3 8-членная, предпочтительно 5- или 6-членная, гетеромоноциклическая группа, содержащая 1 2 атома кислорода и 1 3 атома азота, например морфолил и так далее; ненасыщенная конденсированная 7 - 12-членная гетероциклическая группа, содержащая 1 2 атома кислорода и 1 3 атома азота, например бензоксазолил, бензоксадиазолил и так далее; ненасыщенная 3 8-членная, предпочтительно 5- или 6-членная гетеромоноциклическая группа, содержащая 1 2 атома серы и 1 3 атома азота, например тиазолил, 1,2-тиазолил, тиазолинил, тиадиазоил, например 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, 1,2,3-тиадиазолил, и так далее; ненасыщенная 3 8-членная, предпочтительно 5- или 6-членная, гетеромоноциклическая группа, содержащая 1 2 атома серы и 1 3 атома азота, например тиазолидинил и так далее; ненасыщенная 3 8-членная, предпочтительно 5- или 6-членная, гетеромоноциклическая группа, содержащая атом серы, например тиенил и так далее; ненасыщенная конденсированная 7 12-членная гетероциклическая группа, содержащая 1 2 атома серы и 1 3 атома азота, например бензотиазолил, бензотиадиазолил, и тому подобное; причем указанная гетероциклическая группа может быть замещена одним или более, предпочтительно одним или двумя, заместителем(ями), такими как: гидрокси; защищенный гидрокси, в котором гидроксильная группа защищена общепринятой гидроксизащитной группой, такой как ацил, три(низший)алкилсилилокси, например трет-бутилдиметилсилилокси и так далее и тому подобное; галоген, например хлор, бром, иод и фтор; низший алкокси, который может быть прямоцепочечным или разветвленным алкокси, таким как метокси, пропокси, изопропокси, бутокси, пентилокси, гексилокси и так далее, более предпочтительно, C1-C4-алкокси, например метокси и так далее; низший алкил, упомянутый выше, более предпочтительно C1-C4-алкил, например метил и так далее; амино-; -нитро; -циано и так далее.
И кроме того, когда указанная гетероциклическая группа имеет в своем кольце имино-часть (части), последняя(ие) может быть замещена пригодным заместителем(ями), такими как: низший алкил, упомянутый выше, например метил, этил, пропил, изобутил и так далее; иминозащитная группа, упоминаемая ниже, более предпочтительно низший алканоил оксикарбонил, например формил и так далее, аренсульфонил, например тозил и так далее и тому подобное.
Предпочтительным примером "по выбору замещенного гетероциклический(низший) алкила" может быть: низкий алкил, замещенный ненасыщенной 5- или 6-членной гетеромоноциклической группой, содержащей 1 4 атома азота, такой как пиридил(низший) алкил, имидазолил(низший)алкил и так далее низший алкил, замещенный ненасыщенный конденсированный 7 12-членной гетероциклической группой, содержащей 1 5 атомов азота, такой как индолил(низший)алкил и так далее; низший алкил, замещенный ненасыщенный 5- или 6-членный гетеромоноциклической группой, содержащей 1 2 атома серы и 1 3 атома азота, такой как тиазоил(низший)алкил и так далее, причем указанная гетероциклическая группа может быть замещена пригодным заместителем(ями), таким как низший алкил, например метил, этил, пропил, изобутил и так далее, низший алканоил, например формил, и так далее, (C6-C10) аренсульфонил, например тозил и так далее и тому подобное.
Более предпочтительным примером может быть: пиридил(низший)алкил, например 2-(или 3-, или 4-)пиридилметил и так далее; имидазолил(низший)алкил, например имидазол-1(или 3-)илметил и так далее; индолил(низший)алкил, например индол-3-илметил и так далее; тиазолил(низший)алкил, например тиазол-3-илметил и так далее; Nаренсульфонилимидазолил(низший)алкил (например, 1-тозилимидазол-3-илметил и так далее); -N-(низший) алканоилиндолил(низший)алкил, например N-формилиндол-3-илметил и так далее); -N-(низший)алкилиндолил(низший)алкил, например N-метил(или этил или пропил или изобутил)индол-3-илметил и так далее, для R3, а также пиридил(низший)алкил, например, 2-пиридилметил и так далее; имидазолил(низший)алкил, например имидазол-1(или 3-)илметил и так далее и -N-арен-сульфонилмимидазолил(низший)алкил, например 1-тозилимимидазол-3-илметил и так далее, для R2, и наиболее предпочтительно, -индолил(низший)алкил, N-(низший)алканоилиндолил(низший)алкил и N- (низший)алкилиндолил(низший)алкил для R3, а также пиридил(низший)алкил и имидазолил(низший)алкил и имидазолил(низший) алкил для R2.
Пригодный "ар(низший)алкил" может включать C6- C10-ар-(низший) алкил, такой как фенил(низший)алкил (например, бензил, фенетил и так далее), толил(низший)алкил, ксилил(низший)алкил, нафтил (низший)алкил, например нафтилметил и так далее, и тому подобное, где указанный ар(низший)алкил может быть замещен пригодным заместителем(ями), такими, которые упомянуты в объяснении "по выбору замещенного гетероцикелического(низший)алкила", как указано выше.
Предпочтительным примером по выбору замещенного ар(низший) алкила может быть фенил(низший)алкил и нафтил(низший)алкил, и наиболее предпочтительно бензил и нафтилметил для R2 и бензил для R3.
Пригодный "низший алкилимино" обозначает иминогруппу, замещенную вышеупомянутым низшим алкилом, причем наиболее предпочтительным примером может быть метилимино.
Пригодный "цикло(низший)алкил(низший)алкил" обозначает вышеупомянутый низший алкил, который замещен C3-C7-цикло(низший) алкилом, таким как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и так далее, причем наиболее предпочтительным примером может быть C4-C6-цикло(низший)алкил, в наиболее предпочтительным является циклогексилметил.
Пригодный "по выбору замещенный низший алкил" может включать вышеупомянутый низший алкил, например метил, этил, изопропил, бутил, изобутил и так далее, который по выбору замещен пригодным заместителем(ями), таким как по выбору замещенная гетероциклическая группа, упоминаемая ниже, например пиридил, тиазолил, имидазолил, N-тозилимидазолил и так далее; C6-C10-арил, упоминаемый ниже, например фенил, нафтил и так далее; амино; защищенный амино, упоминаемый ниже, например бензилоксикарбониламино и так далее; карбокси; защищенный карбокси, упоминаемый выше, например бензилоксикарбонил и так далее и тому подобное.
Предпочтительным примером "по выбору замещенного низшего алкила" может быть: низший алкил, например изопропил, изобутил и так далее, пиридил(низший)алкил, например 2-(или 3, или 4-)пиридилметил, 2-(2-пиридил)этил и так далее, тиазолил(низший)алкил, например 3-тиазолилметил и так далее, имидазолил(низший)алкил, например 2-(или 3-)имидазолилметил и так далее, N-защищенный имидазолил(низший)-алкил, такой как N- (аренсульфонил)имидазолил(низший)алкил, например N-толил-2-(или 3-) имидазолилметил и так далее, C6-C10 ар(низший) алкил, такой как фенил(низший)алкил, например бензил, нафтилметил и так далее, амино(низший)алкил, например, 4-аминобутил и так далее, защищенный амино(низший)алкил, такой как C6-C10-ар(низший)алкоксикарбонил, например 4- (бензилоксикарбониламино)бутил и так далее, карбокси(низший)алкил, например карбоксиметил, 2-карбоксиэтил и так далее, защищенный карбокси(низший)алкил, такой как C6-C10-ар(низший)алкоксикарбонил(низший)алкил, например бензилоксикарбонилметил, 2-бензилоксикарбонилэтил и так далее и тому подобное.
Наиболее предпочтительным примером "по выбору замещенного низшего алкила" могут стать: изопропил, изобутил, 2-(или 3-, или 4-)пиридилметил, 2-(2-пиридил)этил, 3-тиазолилметил, 2-(или 3-) имидазолилметил, N-тозил-2-(или 3-)-имидазолилметил, бензил, нафтилметил, 4-аминобутил, 4-(бензилоксикарбониламино)бутил, карбоксиметил, 2-карбоксиэтил, бензилоксикарбонилметил и 2-бензилоксикарбонилэтил для R4, а также 2-пирилилметил и 2-(2-пиридил)этил для R6.
Пригодная "по выбору замещенная гетероциклическая группа" может включать ту же гетероциклическую часть, которая упомянута выше, например пирролил, пирролинил, имидазолил, пиразолил, пиридил и его N-оксид, пиримидил, пиразинил, пиридазинил, триазолил, например 4H-1,2,4-триазолил, 1H-1,2,3-триазолил, 2H-1,2,3-триазолил и так далее, тетразолил, например 1H-тетразолил, 2H-тетразолил и так далее, дигидротриазинил, например 4,5-дигидро-1,2,4-триазинил, 2,5-дигидро-1,2,4-триазинил и так далее, тиазолил, 1,2-тиазолил, тиазолинил, тиадиазолил, например 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, 1,2,3-тиадиазолил, и так далее, при этом указанная гетероциклическая группы по выбору замешена теми же заместителями, которые упомянуты выше, например имино-защитной группой, например аренсульфонилом и так далее.
Пригодный "арил" может включать C6- C10-арил, такой как фенил, толил, ксилил, куменил, нафтил и так далее, причем более предпочтительными примерами могут быть фенил и нафтил.
Пригодная амино- или иминозащитная группа для защищенного амино или защищенного имино может включать ацил, упомянутый выше, при этом более предпочтительным примером может быть низший алканоил, (C6- C10)ар (низший)алкоксикарбонил и (C6-C10) аренсульфонил, а наиболее предпочтительным примером может быть бензилоксикарбонил.
Пригодный "иминосодержащий гетероциклический(низший)алкил, по выбору замещенный пригодным заместителем(ями)" означает соединение, приведенное для "по выбору замещенного гетероциклического(низшего)алкила", упомянутого выше, причем гетероциклическое кольцо содержит иминогруппу (-NH-), например индолил(низший)алкил, имидазолили(низший)алкил и так далее.
Пригодный "защищенный иминосодержащий гетероциклический(низший)алкил, по выбору замещенный пригодным заместителем (заместителями)" обозначает вышеупомянутый "иминосодержащий гетероциклический(низший)алкил, по выбору замещенный пригодным заместителем(ями)", при этом иминогруппа защищена традиционной иминозамещитной группой, упомянутой ниже.
"Ацил, замещенный защищенной аминогруппой" обозначает ацил, который пояснен выше, и он замещен защищенным амино, как упомянуто выше.
"Ацил, замещенный аминогруппой" обозначает ацил, поясненный выше, который замещен аминогруппой.
Пригодная "иминозащитная группа" может включать традиционные группы, используемые в химии пептидов, такие, которые представлены для аминозащитной группы в защищенном амине.
Предпочтительные варианты каждого определения могут быть представлены следующим образом:
R1 обозначает ацил, такой как карбамоил, органический карбоновый, органический угольный, органический сульфоновый или органический карбаминовый ацил, например низший алканоил, например ацетил, пропионил, 3,3-диметилбутурил, пивалоил, 4-метилпентаноил и так далее; амино(низший)алканоил, например 2-амино-3-метилпентаноил и так далее; защищенный амино(низший)алканоил, например ациламино(низший)алканоил, такой как низший алкоксикарбониламино(низший)алканоил, например 2-трет-бутоксикарбониламино-3-метилпентаноил и так далее, C3-C7-циклоалкилуреидо(низший)алканоил, например, 2-(3-циклогексилуреидо)-3-метилпентаноил и так далее; низший алкоксикарбонил, например трет-бутоксикарбонил и так далее; C3-C7-циклоалкил(низший)алканоил, например циклогексилацетил и так далее; C3-C7-циклоалкилкарбонил, например циклогексилкарбонил и так далее; C3-C7- циклоалкилоксикарбонил, например циклогексилоксикарбонил и так далее; ароил, такой как C6-C10, например бензоил 1- или 2-нафтоил и так далее; ар(низший)алканоил, такой как C6-C10- ар(низший)алканоил, например фенилацетил, 1- или 2-нафтилацетил, 3-фенилпропионил и так далее; аминозамещенный ар(низший)алканоил, например аминозамещенный, например аминозамещенный (C6-C10)ар(низший) алканоил, такой как аминозамещенный фенил(низший)алканоил, например 2-амино-2-фенилацетил и так далее; защищенный аминозамещенный ар(низший)алканоил, например ациламинозамещенный (C6- C10)ар(низший)алканоил, такой как низший алкоксикарбониламинозамещенный фенил(низший)алканоил, например 2-(4-трет-бутокси-карбониламинофенил)ацетил, 2-третбутоксикарбониламино-2-фенилацетил и так далее; галоар(низший)алканоил, например гало (C6- C10)ар(низший)алканоил, такой как галофенил(низший)алканоил, например 2-хлорофенил)ацетил и так далее; ар(низший)алкеноил, например C6-C10-ар(низший)алкеноил, такой как фенил(низший)алкеноил, например циннамоил и так далее; арилглиоксилоил, такой как C6-C10-арилглиоксилоил, например фенилглиоксилоил и так далее; ар(низший)алкилглиоксилоил, такой как C6-C10-ар(низший)алкилглиоксилоил, например бензилглиоксилоил и так далее; пиридилкарбонил, например 2-, или 3-, или 4-пиридилкарбонил и так далее; тетрагидропиридилкарбонил, например 1,2,3,6-тетрагидропиридин-1-илкарбонил и так далее; тетрагидрохинолилкарбонил, например 1,2,3,4-тетрагидрохинолин-1-илкарбонил и так далее; тетрагидроизохинолилкарбонил, например 1,2,3,4-тетрагидрохинолин-2-илкарбонил и так далее; морфолинилкарбонил, например морфолинокарбонил и так далее; тиоморфолинилкарбонил, например тиоморфолинокарбонил и так далее; индолилкарбонил, например 2-индолилкарбонил и так далее; пиперазинилкарбонил, замещенный 1-3 заместителями, выбранными из оксо и низшего алкила, например 4-метил-2-(1-метилпропил)-3-оксопиперазин-1-илкарбонил и так далее; пиридил(низший)алканоил, например 2-, или 3-, или 4-пиридилацетил и так далее; морфолинилкарбонил(низший)алканоил, например, 3- (морфолинокарбонил) пропионил и так далее; ар(низший)алкилсульфонил, например C6-C10-ар(низший) алкилсульфонил, такой как фенил(низший)алкилсульфонил, например бензилсульфонил и так далее; N- или N, N-ди(низший или высший)алкилкарбамоил, такой как N- или N,N-ди(C1-C10)алкилкарбамоил, например изопропилкарбамоил, 2-метилбутилкарбамоил, гептилкарбамоил, диметилкарбамоил, диэтилкарбамоил, дипропилкарбамоил, диизопропилкарбамоил; дибутилкарбамоил, диизобутилкарбамоил и так далее; гидрокси(низший)алкилкарбамоил, например 1-гидроксиметил-3-метилбутилкарбамоил и так далее; карбокси(низший)алкилкарбамоил, например 1-карбокси-2-метилбутилкарбамоил и так далее; защищенный карбокси(низший)алкилкарбамоил, например эстерифицированный карбокси(низший)алкилкарбамоил, такой как низший алкоксикарбонил(низший)алкилкарбамоил, например 1-метоксикарбонил-2- метилбутилкарбамоил и так далее, карбамоил(низший)алкилкарбамоил, например 1-карбамоил-2-метилбутилкарбамоил и так далее; [N- или N,N- ди(низший)алкилкарбамоил] (низший)алкилкарбамоил, например 1-изопропилкарбамоил-2-метилбутилкарбамоил, диметилкарбамоилметилкарбамоил, 1-(диметилкарбамоил) этилкарбамоил, 2- (диметилкарбамоил)этилкарбамоил, 1-(диметилкарбамоил)-2-метилпропилкарбамоил, 1- (диметилкарбамоил)-2,2-диметилпропилкарбамоил, 1-(диметилкарбамоил)-3-метилбутилкарбамоил, 1- (диэтилкарбамоил)-2-метилбутилкарбамоил, 1-(диметилкарбамоил)пентилкарбамоил и так далее; N-низший алкил-N-[гидрокси(низший)алкил] карбамоил, например N-(2-гидроксиэтил)-N-метилкарбамоил и так далее; N-низший алкил-N-[ди(низший)алкилкарбамоил(низший)алкил] карбамоил, например N-[1-диметилкарбамоил-2-метилбутил)-N-метилкарбамоил, N-(1-диметилкарбамоил-3-метилбутил] -N-метилкарбамоил и так далее; низший или высший алкиленаминокарбонил, такой как C3-C10-алкиленаминокарбонил, например пирролидин-1-илкарбонил, пиперидин-1-илкарбонил, 3,5- или 2,6-диметилпиперидин-1-илкарбонил, гексагидро-1H-азепин-1-илкарбонил, октагидроазоцин-1-илкарбонил и так далее); ди(низший)алкилкарбамоил(низший) алкиленаминокарбонил, например 2-(диметилкарбамоил)пирролидин-1-илкарбонил, 4-(диметилкарбамоил)пиперидин-1- илкарбонил и так далее; N-низший алкил-N-(C3-C7)циклоалкиларбамоил, например N-циклогексил-N-метилкарбамоил и так далее; моно- или ди(C3-C7)циклоалкилкарбамоил, например циклогексилкарбамоил, дициклогексилкарбамоил и так далее; гидрокси- или ди(низший)алкилкарбамоил- или ди(низший)алкилкарбамоил (низший)алкил-замещенный (C3-C7) циклоалкилкарбамоил, например 4- гидроксициклогексилкарбамоил, 1- или 4-(диметилкарбамоил)циклогексилкарбамоил, 1- или 4-(диметилкарбамоилметил) циклогексилкарбамоил и так далее; C3-C7- циклоалкил(низший)алкилкарбамоил, например циклогексилметилкарбамоил и так далее; ди(низший)алкилкарбамоил-замещенный C3-C7-циклоалкил (низший)алкилкарбамоил, например, [1-циклогексил-1- (диметилкарбамоил) метил]карбамоил и так далее; ди(низший)алкилкарбамоил-замещенный ар(низший)алкилкарбамоил, такой как ди(низший)алкилкарбамоил-замещенный фенил(низший)алкилкарбамоил, например [1-фенил-1-(диметилкарбамоил)метил] карбамоил и так далее; арилкарбамоил, предпочтительно C6-C10-арилкарбамоил, в котором арильная группа может быть замещена 1-3 заместителями, выбранными из галогена, низшего алкила и низшего алкокси, например фенилкарбамоил, 2-, или 3-, или 4-хлорфенилкарбамоил, 4-толилкарбамоил, 4-метоксифенилкарбамоил и так далее; пиридилкарбамоил и так далее; N-защищенный пиперидилкарбонил, например N-ацилпиперидилкарбонил, такой как N-низший алкоксикарбонилпипередилкарбонил, например 1- этоксикарбонилпиперидин-4-илкарбонил и так далее; морфолинил(низший)алкилкарбамоил, например 2-(морфолино)этилкарбамоил и так далее; низший алканоилкарбазоил, например 3-изобутурилкарбазоил и так далее; низший алкиленаминокарбамоил, например пиперидин-1-илкарбамоил и так далее; N-(C3-C7) циклоалкилкарбамоил(низший) алкилкарбамоил, например 1- циклогексилкарбамоил-2-метилбутилкарбамоил и так далее; низший алкиленаминокарбонил (низший)алкилкарбамоил, например 1-(пиперидин-1-илкарбонил)-2-метилбутилкарбамоил, и так далее; пиридил(низший)алкилкарбамоил, например 2-пиридилметилкарбамоил и так далее, или оксо-замещенный гексагидроазепинилкарбамоил, например 2-оксо-гексагидро-1H-азепин-3-илкарбамоил и так далее; в особенности N,N- ди(низший)алкилкарбамоил; моно- или ди(C3- C7)циклоалкилкарбамоил; N-(низший)алкил-N-(C3- C7)циклоалкилкарбамоил; N-(низший)алкил-N-[ди(низший)алкилкарбамоил (низший)алкил] карбамоил; C6-C10-арилкарбамоил; низший или высший алкиленаминокарбонил, такой как C3-C10-алкиленаминокарбонил, или N-низший алкил-N-[гидрокси(низший)-алкил] карбамоил;
R2 обозначает низший алкил, например бутил, изобутил, 1-метилпропил, 2,2-диметилпропил и так далее; в особенности изобутил;
R3 обозначает индолил(низший)алкил, например 3-индолилметил и так далее; N-(низший)алкилиндолил (низший)алкил, например 1-метил-3-индолилметил, 1-этил-3-индолилметил, 1-пропил-3-индолилметил, 1-изобутил-3-индолилметил и так далее; N-ацилиндолил(низший)алкил, такой как N- (низший)алканоилиндолил(низший)алкил, например 1-формил-3-индолилметил и так далее, или ар(низший)алкил, такой как C6-C10 ар(низший)алкил, например бензил, 1- или 2-нафтилметил и так далее, в особенности N-(низший)алкилиндолил(низший)алкил, такой как 1-метил-3-индолилметил;
R4 обозначает водород, низший алкил, например изопропил, изобутил и так далее; амино(низший)алкил, например 4-аминобутил и так далее; защищенный амино (низший)алкил, например ациламино(низший)алкил, такой как моно- или ди- или трифенил(низший)алкоксикарбониламино (низший)алкил, например 4-бензилоксикарбониламинобутил и так далее; карбокси (низший)алкил, например карбоксиметил, 2-карбоксиэтил и так далее; защищенный карбокси (низший)алкил, например эстерифицированный карбокси(низший)алкил, такой как моно- или ди- или трифенил(низший)алкил, например бензилоксикарбонилметил, 2-бензилоксикарбонилэтил и так далее; ар(низший)алкил, такой как C6-C10 ар(низший)алкил, например бензил, 1- или 2 -нафтил и так далее; пиридил(низший)алкил, например 2- или 3- или 4-пиридилметил и так далее; имидазолил (низший)алкил, например 1H-4- имидазолилметил и так далее; или тиазолил(низший)-алкил, например 4-тиазолилметил и так далее; в особенности C6-C10 ар(низший)алкил, такой как бензил; или пиридил(низший)алкил, такой как 2-пиридилметил;
R5 обозначает карбокси; эстерифицированный карбокси, такой как низший алкоксикарбонил, например метоксикарбонил, этоксикарбонил и так далее, ар(низший)алкоксикарбонил, такой как моно- или ди- или трифенил(низший)алкоксикарбонил, например бензилоксикарбонил и так далее, пропил(низший)алкоксикарбонил, такой как бензоил(низший)алкоксикарбонил, например фенацил и так далее; амидированный карбокси, такой как карбамоил, N- или N, N-ди(низший)алкилкарбамоил, например метилкарбамоил, этилкарбамоил, пропилкарбамоил, изопропилкарбамоил, бутилкарбамоил, N,N-диметилкарбамоил, N, N-диэтилкарбамоил и так далее, низший алкилкарбамоил, замещенный одним или двумя заместителями, выбранными из карбокси и защищенного карбокси, предпочтительно эстерифицированного карбокси, более предпочтительно низшего алкоксикарбонила, моно-, или ди-, или трифенил(низший)алкоксикарбонила или бензоил(низший)алкоксикарбонила, например карбоксиметилкарбамоил, 1- или 2-карбоксиэтилкарбамоил, 4-карбоксибутилкарбамоил, 5-карбоксипентилкарбамоил, 1-карбокси-2-метилпропилкарбамоил, 1-карбокси-3- метилбутилкарбамоил, 1,2-дикарбоксиэтилкарбамоил, бензилоксикарбонилметилкарбамоил, 2-бензилоксикарбонилэтилкарбамоил, 1- или 2-фенацилоксикарбонилэтилкарбамоил, 4-фенацилоксикарбонилбутилкарбамоил, 5-фенацилоксикарбонилпентилкарбамоил, 1-метоксикарбонил-2-метилпропилкарбамоил, 1-метоксикарбонил-3- метилбутилкарбамоил, 1,2-бис-(метоксикарбонил)этилкарбамоил и так далее, N-(низший) алкил-N-[карбокси- или защищенный карбокси (предпочтительно эстерифицированный карбокси, более предпочтительно низший алкоксикарбонил) (низший)алкил]карбамоил, например N- метил-N-(карбоксиметил)карбамоил, N-метил-N-(метоксикарбонилметил)карбамоил и так далее, ар(низший)алкилкарбамоил, например C6-C10 ар(низший)алкилкарбамоил, такой как фенил(низший)алкилкарбамоил, например бензилкарбамоил, и так далее, карбокси- или защищенный карбокси, предпочтительно эстерифицированный карбокси, замещенный ар(низший)алкилкарбамоил, такой как карбокси- или низший алкоксикарбонил- замещенный фенил(низший) алкилкарбамоил, например 1-карбокси-2-фенилэтилкарбамоил, 1-этоксикарбонил-2-фенилэтилкарбамоил и так далее, C2-C7 циклоалкилкарбамоил, например циклогексилкарбамоил и так далее, N-[карбокси- или защищенный карбокси- замещенный C3-C7 циклоалкил(низший)алкил/карбамоил, например, карбокси (C3-C7) циклоалкил(низший)алкил]карбамоил, например 4- карбоксициклогексилметилкарбамоил и так далее, эстерифицированный карбокси- замещенный C3-C7 циклоалкил(низший)алкилкарбамоил, такой как низший алкоксикарбонил (C3-C7)циклоалкил(низший)алкилкарбамоил, например, 4-(этоксикарбонил) циклогексилметилкарбамоил и так далее, ацилкарбамоил, такой как низший алкилсульфонилкарбамоил, например метилсульфонилкарбамоил и так далее, арилсульфонилкарбамоил, например C6-C10 арилсульфонилкарбамоил, например фенилсульфонилкарбамоил и так далее, карбокси- или защищенный карбокси (предпочтительно эстерифицированный карбокси)-замещенный пиридил (низший)алкилкарбамоил, такой как карбокси- или низший алкоксикарбонил-замещенный пиридил (низший)алкилкарбамоил, например 1-карпбокси-2-(2-пиридил) этилкарбамоил, 1-этоксикарбонил-2-(пиридил)этилкарбамоил и так далее, низший алкиленаминокарбонил, например пирролидин-1-илкарбонил, пиперидин-1-илкарбонил и так далее, низший алкиленаминокарбонил, замещенный карбокси или замещенный карбокси, предпочтительно эстерефицированным карбокси, более предпочтительно низшим алкоксикарбонилом, например 2-карбоксипирролидин-1-илкарбонил, 2-метоксикарбонилпирролидин-1-илкарбонил и так далее, [низший алкиленамино(низший)алкил] карбамоил, замещенный одним-двумя заместителями, выбранными из карбокси, защищенного карбокси, предпочтительно эстерифицированного карбокси, более предпочтительно низшего алкоксикарбонила, и карбамоила, например 2-(2-карбокси-5-оксопирролидин-1-ил)этилкарбамоил, 2-(2-этоксикарбонил-5-оксопирролидин-1-ил)этилкарбамоил, 2-(2-карбамоил-5-оксопирролидин-1-ил)этилкарбамоил и так далее, морфолинокарбонил, морфолинокарбамоил и так далее, пиридилкарбамоил, например 2- пиридилкарбамоил и так далее, тиазолилкарбамоил, например 2-тиазолилкарбамоил и так далее, низший алкилтиадиазолилкарбамоил, такой как 5-(низший)алкил-1,3,4- тиадиазолилкарбамоил, например 5-метил-1,3,4-тиадиазолилкарбамоил и так далее, бензотиазолилкарбамоил, например 2-бензотиазолилкарбамоил и так далее, морфолинил(низший)алкилкарбамоил, например 2-морфолиноэтилкарбамоил и так далее, пиридил(низший)алкилкарбонил, например 2-пиридилметилкарбонил и так далее, карбазоил, например, 3,3- диметилкарбазоил и так далее, карбокси(низший) алкил, например карбоксиметил, 2-карбоксиэтил, 3-карбоксипропил, 4-карбоксибутил и так далее, или защищенный карбокси(низший) алкил, например эстерифицированный карбокси(низший)алкил, такой как низший алкоксикарбонил(низший)алкил, например метоксикарбонилметил, 2-метоксикарбонилэтил, 3- метоксикарбонилпропил, 4-метоксикарбонилбутил и так далее, ароил(низший)алкоксикарбонил (низший)алкил, например фенацилоксикарбонилметил, 2-фенацилоксикарбониэтил, 3- фенацилоксикарбонилпропил, 4-фенацилоксикарбонилбутил и так далее; в особенности карбокси; низший алкоксикарбонил или карбонил; N- или N,N -ди(низший) алкилкарбамоил;
R6 обозначает водород или пиридил(низший)алкил, например 2-пиридилметил, 2(2-пиридил)этил и так далее; в особенности водород;
R7 обозначает водород или низший алкил, например метил или так далее, в особенности водород;
А обозначает низший алкилен, например метилен и так далее; -O-; -NH-; или низший алкиламино, например метиламино и так далее, в особенности метилен или -NH-.
Способ 1.
Искомое соединение I или его соль можно получить путем взаимодействия соединения II или его реакционноспособного производного у карбоксигруппы, или его соли, с соединением III или его рекционноспособным у аминогруппы, или его солью.
Пригодное реакционноспособное производное у аминогруппы соединения III может включать основание Шиффа (тип имино) или его таутомерный изомер типа энамина, образованный путем взаимодействия соединения III с карбонильным соединением, таким как альдегид, кетон или тому подобное; производное силила, образованное путем взаимодействия соединения III с соединением силила, таким как бис(триметилсилил)ацетамид, моно(триметилсилил)ацетамид, бис(триметилсилил)мочевина или тому подобное; производное, образованное путем взаимодействия соединения III с треххлористым фосфором или фосфогеном, и тому подобное.
Пригодные соли соединения III и его реакционноспособного производного могут упоминаться как кислые аддитивные соли, что касается соединения I.
Пригодное реакционноспособное производное у карбоксигруппы соединения I может включать галоангидрид, ангидрид кислоты, активированный амид, активированный сложный эфир и так далее. Пригодными примерами реакционноспособных производных могут быть хлорангидрид, азид кислоты, смешанный ангидрид кислоты с кислотой, такой как замещенная фосфорная кислота, например диалкилфосфорная кислота, фенилфосфорная кислота, дифенилфосфорная кислота, дибензилфосфорная кислота, галоидзамещенная фосфорная кислота и так далее, диалкилфосфорная кислота, сернистая кислота, тиосерная кислота, серная кислота, сульфокислота, например метансульфокислота и так далее, алифатическая карбоновая кислота, например уксусная кислота, пропионовая кислота, масляная кислота, изомасляная кислота, триметилуксусная кислота, пентановая кислота, изопентановая кислота, 2-этилмасляная кислота, трихлоруксусная кислота и так далее, или ароматическая карбоновая кислота, например бензойная кислота и так далее; симметричный ангидрид кислоты; активированный амид с имидазолом, 4-замещенный имидазол, диметилпиразол, триазол или тетразол; или активированный сложный эфир, например сложный цианометиловый эфир, сложный метоксиметиловый эфир, диметилиаминометиловый [(CH3)2 +N CH-] сложный эфир, сложный виниловый эфир, сложный пропаргиловый эфир, сложный п-нитрофениловый эфир, сложный 2,4-динитрофениловый эфир, сложный трихлорфениловый эфир, сложный пентахлорфениловый эфир, сложный мезилфениловый эфир, сложный фенилазофениловый эфир, сложный фениловый тиоэфир, сложный п-нитрофенильный тиоэфир, сложный п-крезиловый тиоэфир, сложный карбоксиметиловый тиоэфир, сложный пираниловый эфир, сложный пиридиниловый эфир, сложный пиперидиловый эфир, сложный 8-хинолиловый эфир и так далее, или сложный эфир с N-гилроксисоединением, например N,N-диметилгидроксиламин, 1-гидрокси-2-(1H)-пиридон, N-гидроксисукцинимид, N-гидроксифталимид, 1-гидрокси-1H-бензотриазол и так далее, и тому подобное. Эти реакционноспособные производные могут быть по выбору отобраны в соответствии с типом используемого соединения II.
Пригодными солями соединения II и его реакционноспособного производного может быть соль основания, такая как соль щелочного металла, например соль натрия, соль калия и так далее, соль щелочноземельного металла, например соль кальция, соль магния и так далее, соль аммония, соль органического основания, например соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, соль дициклогексиламина, соль N,N'-дибензилэтилендиамина и так далее, и тому подобное.
Реакцию обычно осуществляют в традиционном растворителе, таком как вода, спирт, например метанол, этанол и так далее, ацетон, диоксан, ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран, этилацетат, N,N-диметилформамид, пиридин или любой другой органический растворитель, который не оказывает отрицательного воздействия на реакцию. Эти традиционные растворители могут использоваться в смеси с водой.
В данной реакции, когда соединение II используют в форме свободной кислоты или в форме ее соли, реакцию предпочтительно осуществляют в присутствии традиционного конденсирующего агента, такого как N,N'-дициклогексилкарбодиимид, N-циклогексил-N'-морфолиноэтилкарбодиимид, N-циклогексил-N'-(4-диэтиламиноциклогексил) карбодиимид, N,N'-диэтилкарбодиимид, N,N'-диизопропилкарбодиимид, N-этил-N'-(3- диметиламинопропил) карбодиимид, N,N'-карбонилбис(2-метилимидазол), пентаметиленкетен-N-циклогексилимин, дифенилкетен-H-циклогексилимин, этоксиацетилен, 1-алкокси-1-хлороэтилен, триалкилфосфит, этилполифосфат, изопропилполифосфат, хлорокись фосфора (хлористый фосфорил), треххлористый фосфор, дифенилфосфорилазид, тионилхлорид, оксалилхлорид, низший алкилгалоформиат, например этилхлорформиат, изопропилхлорформиат и так далее, трифенилфосфин, 2-этил-7-гидркосибензизоксазолиевая соль, 2-этил-5-(м-сульфофенил)изоксазолиевая гидроокисная внутримолекулярная соль, N- гидроксибензотриазол, 1-(п-хлорбензолсульфонилокси)-6-хлор-1Н- бензотриазол; так называемый реагент Вильсмайера, полученный путем взаимодействия N, N-диметиоформамида с тионилхлоридом, фосгеном, трихлорметил-хлорформиатом, хлорокисью фосфора и так далее, и тому подобное.
Реакцию также можно осуществлять в присутствии неорганического или органического основания, такого как бикарбонат щелочного металла, три(низший)алкиламин, пиридин, N-(низший)алкилморфолин, N,N - ди(низший)алкилбензиламин или тому подобное.
Температура реакции не является критической и реакцию обычно осуществляют в условиях от охлаждения до нагревания.
Способ 2.
Искомое соединение Ib или его соль можно получить путем взаимодействия соединения Ia или его реакционноспособного производного у аминогруппы, или его соли, с соединением IV или его реакционноспособным производным у карбоксигруппы, или его солью.
Пригодные соли соединения Ia и его реакционноспособного производного могут быть теми, которые приведены в отношении соединения III. Пригодные соли соединения IV и его реакционноспособного производного могут быть теми, которые приведены в отношении соединения II. Пригодные соли соединения Ib могут быть теми, которые приведены в отношении соединения I.
В случае, если ацил символа "R1" имеет происхождение от карбаминовых кислот, исходное соединение IV обычно используют в форме изоцианатов.
Данную реакцию можно осуществлять в основном так, как в cпособе 1, и поэтому реакционный режим и реакционные условия, например реакционноспособные производные, растворители, реакционная температура и так далее, данной реакции можно взять из описания способа 1.
Способ 3.
Искомое соединение I или его соль можно получить путем взаимодействия соединения V или его реакционноспособного производного у карбоксигруппы, или его соли, с соединением VI или его реакционноспособным производным у аминогруппы, или его солью.
Пригодные соли соединения V и его реакционноспособного производного могут быть взяты из описания соединения II.
Пригодные соли соединения VI и его реакционноспособного производного могут быть взяты из описания соединений I и III, соответственно.
Данную реакцию можно осуществлять в основном так, как описано для способа 1, и поэтому реакционный режим и реакционные условия, например реакционноспособные производные, растворители, реакционная температура и так далее, данной реакции можно взять из описания способа 1.
Способ 4.
Целевое соединение Id или его соль можно получить, подвергая соединение Ic или его соль реакции отщепления карбоксизащитной группы в R
Пригодные соли соединений Ic и Id можно взять из описания соединения I.
Данную реакцию осуществляют в соответствии с традиционным методом, таким как сольволиз, включая гидролиз, восстановление или тому подобное.
Сольволиз предпочтительно осуществляют в присутствии основания или кислоты, включая кислоту Льюиса.
Пригодное основание может включать неорганическое основание и органическое основание, такое как щелочной металл, например натрий, калий и так далее, щелочноземельный металл, например магний, кальций и так далее, его гидроксид, или карбонат, или бикарбонат, а также гидразин, триалкиламин, например триметиламин, триэтиламин и так далее, пиколин, 1,5-диазабицикло(4.3.0)нон-5-ен, 1,4-диазабицикло(2.2.2)октан, 1,8-диазабицикло(5.4.0)ундец -7-ен или тому подобное.
Пригодная кислота может включать органическую кислоту, например муравьиную кислоту, уксусную кислоту, пропионовую кислоту, трихлоруксусную кислоту, трифторуксусную кислоту и так далее, неорганическое основание, например хлористоводородная кислота, бромистоводородная кислота, серная кислота, хлороводород, бромоводород, фтороводород и так далее.
Реакцию отщепления с использованием кислоты Льюиса, такой как тригалоуксусная кислота, например трихлоруксусная кислота, трифторуксусная кислота и так далее, предпочтительно осуществляют в присутствии катион-улавливающих агентов, например, анизол, фенол и так далее.
Реакцию обычно осуществляют в растворителе, таком как вода, спирт, например метанол, этанол и так далее, метиленхлорид, хлороформ, четыреххлористый углерод, тетрагидрофуран, N,N-диметилформамтд, их смесь или любой другой растворитель, который не оказывает отрицательного воздействия на проведение реакции. В качестве растворителя также можно использовать жидкое основание или кислоту. Температура реакции не является критическим фактором и реакцию обычно осуществляют в условиях от охлаждения до нагревания.
Метод восстановления, применимый для реакции отщепления, может включать химическое восстановление и каталитическое восстановление.
Пригодными восстановителями, используемыми при химическом восстановлении, являются комбинация металла, например олова, цинка, железа и так далее, или металлического соединения, например хлористого хрома, ацетата хрома и так далее, и органической или неорганической кислоты, например муравьиной кислоты, уксусной кислоты, пропионовой кислоты, трифторуксусной кислоты, п-толуолсульфокислоты, хлористоводородной кислоты, бромистоводородной кислоты и так далее.
Пригодными катализаторами, используемыми при каталитическом восстановлении, являются традиционные катализаторы, такие как платиновые катализаторы, например губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и так далее, палладиевые катализаторы, например губчатый палладий, палладиевая чернь, оксид палладия, палладированный уголь, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и так далее, никелевые катализаторы, например восстановленный никель, оксид никеля, скелетный никелевый катализатор гидрирования и так далее, кобальтовые катализаторы, например восстановленный кобальт, скелетный кобальтовый катализатор гидрирования и так далее, железные катализаторы, например восстановленное железо, скелетный железный катализатор гидрирования и так далее, медные катализаторы, например восстановленная медь, скелетный медный катализатор гидрирования и так далее, и тому подобное.
Восстановление обычно осуществляют в традиционном растворителе, который не оказывает отрицательного воздействия на проведение реакции, таком как вода, метанол, этанол, пропанол, N,N-диметилформамид или их смесь. Кроме того, в случае использования вышеупомянутой кислоты в жидкой форме в химическом восстановлении, ее можно использовать в качестве растворителя. Помимо этого, пригодным растворителем, используемым при каталитическом восстановлении, может быть вышеупомянутый растворитель, а также другие традиционные растворители, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран и так далее, а также их смеси. Температура реакции данного восстановления не имеет решающего значения и реакцию обычно осуществляют в условиях от охлаждения до нагревания.
Способ 5.
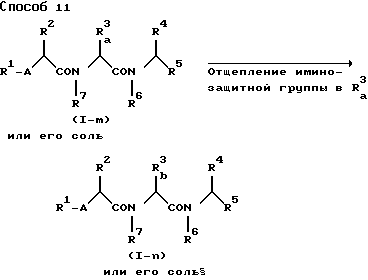
Искомое соединение If или его соль можно получить, подвергая соединение Ie или его соль реакции отщепления имино- или аминозащитной группы (групп) в R
Пригодные соли соединений Ie и If можно взять из описания соединения I.
Данную реакцию отщепления можно осуществлять традиционным способом, известным в химии пептидов, таким как сольволиз, восстановление и тому подобное, и подробности данного способа можно найти в описании способа 4.
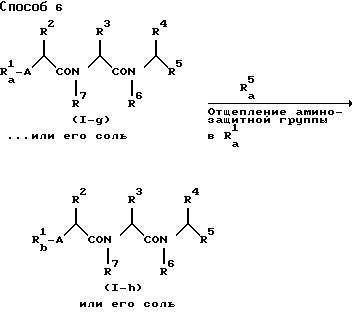
Способ 6.
Искомое соединение Ih или его соль можно получить, подвергая соединение Ig или его соль реакции отщепления аминозащитной группы в R
Пригодные соли соединений Ig и Ih можно найти в описании соединения I.
Данную реакцию отщепления можно осуществлять традиционным в химии пептидов способом, подробности которого можно найти в описании способа 4.
Способ 7.
Искомое соединение Ij или его соль можно получить путем взаимодействия соединения Ii или его реакционноспособного производного у карбоксигруппы, или его соли, с необязательно замещенным амином или его солью.
Пригодные соли соединения Ii и его реакционноспособного производного можно найти в описании соединения II.
Пригодные соли соединения Ij можно найти в описании соединения I.
Пригодные по выбору замещенные амины означают амины, которые могут образовывать вышеупомянутый амидированный карбокси R
Данную реакцию можно осуществлять в основном так, как описано в способе 1, и поэтому реакционный режим и реакционные условия, например реакционноспособные производные, растворители, температура реакции и так далее, данной реакции можно найти в описании способа 1.
Способ 8.
Соединение Ig или его соль можно получить путем ацилирования аминогруппы в R
Пригодные соли соединений Ig и Ih могут быть теми же самыми, которые приведены для соединения I.
Пригодным ацилирующим агентом, используемым в данной реакции, может быть традиционный ацилирующий агент, который способен интродуцировать ацильную группу, упомянутую выше, такой как карбоновая кислота, угольная кислота, сульфокислота и их реакционноспособные производные, например галоидангидрид карбоновой кислоты, ангидрид кислоты, активированный амид, активированный сложный эфир и так далее. Предпочтительным примером такого реакционноспособного производного может быть хлорангидрид, бромангидрид, смешанный ангидрид кислоты с кислотой, такой как замещенная фосфорная кислота, например диалкилфосфорная кислота, фенилфосфорная кислота, дифенилфосфорная кислота, дибензилфосфорная кислота, галоидзамещенная фосфорная кислота и так далее, диалкилфосфористая кислота, сернистая кислота, тиосерная кислота, серная кислота, эфир угольной кислоты, например метилкарбонат, этилкарбонат, пропилкарбонат и так далее, алифатическая карбоновая кислота, например триметилуксусная кислота, пентановая кислота, изопентановая кислота, 2-этилмаляная кислота, трихлоруксусная кислота и так далее, ароматическая карбоновая кислота, например бензойная кислота и так далее, симметричный ангидрид кислоты, активированный амид кислоты с гетероциклическим соединением, содержащим иминофункцию, таким как имидазол, 4-замещенный имидазол, диметилпиразол, триазол и тетразол, активированный сложный эфир, например сложный п-нитрофениловый эфир, сложный 2,4-динитрофениловый эфир, сложный трихлорфениловый эфир, сложный пентахлорфениловый эфир, сложный мезилфениловый эфир, сложный фенилазофениловый эфир, сложный фениловый тиоэфир, сложный п-нитрофениловый тиоэфир, сложный п-крезиловый тиоэфир, сложный карбоксиметиловый тиоэфир, или сложный эфир с N-гидроксисоединением, таким как N,N-диметилгидроксиламин, 1-гидрокси-2-(1Н-)пиридон, N-гидроксисукцинимид, N-гидроксифталимид, 1-гидроксибензотриазол, 1-гидрокси-6-хлорбензотриазол и так далее, и тому подобное.
Данную реакцию можно осуществлять в присутствии органического или неорганического основания, такого как щелочной металл, например литий, натрий, калий и так далее, щелочноземельный металл, например кальций и так далее, гидрид щелочного металла, например гидрид натрия и так далее, гидрид щелочноземельного металла, например гидрид кальция и так далее, гидроксид щелочного металла, например гидроксид натрия и так далее, гидроксид щелочноземельного металла, например гидроксид кальция и так далее, карбонат щелочного металла, например карбонат натрия, карбонат калия и так далее, бикарбонат щелочного металла, например бикарбонат натрия, бикарбонат калия и так далее, алкоксид щелочного металла, например метилат натрия, этилат натрия, третбутилат калия и так далее, алкановая кислота щелочного металла, например ацетат натрия и так далее, триалкиламин, например триэтиламин и так далее, соединение пиридина, например пиридин, лутидин, пиколин, 4-диметиламинопиридин и так далее) хинолин и тому подобное.
В том случае, если ацилирующий агент используют в свободной форме или в форме его соли, реакцию предпочтительно осуществляют в присутствии конденсирующего агента, такого как соединение карбодиимида, например N,N-дициклогексилкарбодиимид, N-циклогексил-N-(4-диэтиламиноциклогексил)карбодиимид, N, N'-диэтилкарбодиимид, N, N'-диизопропилкарбодиимид, N-этил-N'-(3-диметиламинопропил)карбодиимид и так далее, соединение кетенимина (например, N,N'-карбонилбис(2-метилимидазол), пентаметиленкетен-N-циклогексилимин, дифенилкетен-N-циклогексилимин и так далее, соединения олефинового или ацетиленового простого эфира, например этоксиацетилен, бета-хлорвинилэтиловый эфир, сложный эфир сульфокислоты N-гидроксибензотриазолового производного, например 1-(4-хлорбензолсульфонилокси)-6-хлор-1H-бензотриазол и так далее, комбинация триалкилфосфита или трифенилфосфина и четыреххлористого углерода, дисульфида или диазендикарбоксилата, например диэтилдиазендикарбоксилат и так далее, соединение фосфора, например этилполифосфат, изопропилполифосфат, фосфорилхлорид, треххлористый фосфор и так далее, тионилхлорид, оксалилхлорид, N-этилбензисоксазолиевая соль, N-этил-5-фенилисоксазолий-3-сульфонат, реагент (упоминается как "реагент Вильсмайера"), образованный взаимодействием амидного соединения, такого как N,N-ди(низший) алкилформамид, например диметилформамид и так далее, N-метилформамид и так далее с соединением галогена, таким как тионилхлорид, фосфорилхлорид, фосген или тому подобное.
Реакцию обычно осуществляют в традиционном растворителе, который не оказывает отрицательного воздействия на проведение реакции, например вода, ацетон, дихлорметан, спирт, например метанол, этанол и так далее, тетрагидрофуран, пиридин, N,N-диметилформамид и так далее, а также их смеси.
Температура реакции не имеет критического влияния и реакцию обычно осуществляют в условиях от охлаждения до нагревания.
Способ 9.
Искомое соединение Ia или его соль можно получить, подвергая соединение Ib или его соль реакции отщепления ацильной группы R
Данную реакцию отщепления можно проводить традиционным способом в химии пептидов, таким как сольволиз, восстановление и тому подобное, и подробности данного способа можно найти в описании способа 4.
Способ 10.
Искомое соединение Il или его соль можно получить, подвергая соединение Ik или его соль реакции отщепления карбоксизащитной группы в R
Пригодные соли соединений Ik и Il можно найти в описании соединения I.
Данную реакцию отщепления можно осуществлять традиционным в химии пептидов способом, таким как сольволиз, восстановление и так далее, и подробности данного способа можно найти в описании способа 4.
Способ 11.
Искомое соединение In или его соль можно получить, подвергая соединение Im или его соль реакции отщепления иминозащитной группы в R
Пригодные соли соединений Im и In можно найти в описании соединения I.
Данную реакцию отщепления можно осуществлять традиционным способом в химии пептидов, таким как сольволиз, восстановление и тому подобное, и подробности данного способа можно найти в описании способа 4.
Способ 12.
Искомое соединение Ip или его соль можно получить, подвергая соединение Io или его соль реакции отщепления амино- или иминозащитной группы в R
Пригодные соли соединения Io и соединения Ip можно найти в описании соединения I.
Данную реакцию отщепления можно осуществлять традиционным способом в химии пептидов, таким как сольволиз, восстановление и тому подобное, и подробности данного способа можно найти в описании способа 4.
Соединения, полученные вышеприведенными способами, можно выделять и очищать традиционным методом, таким как пульверизация, перекристаллизация, колоночная хроматография, переосаждение или тому подобное. Искомое соединение I может быть превращено в его соль общепринятым способом. Способ получения новых исходных соединений объясняется далее более подробно.
Метод 1 (стадия 1).
Соединение IIIa или его соль можно получить путем взаимодействия соединения VII или его реакционноспособного производного у карбоксигруппы, или его соли, с соединением VI или его реакционноспособным производным у аминогруппы, или его солью. Пригодные соли соединения VII и его реакционноспособные производные можно найти в описании соединения II. Пригодные соли соединения VIII и его реакционноспособное производное можно найти в описании соединения III. Данную реакцию можно осуществлять в основном так, как описано для способа 1, и поэтому реакционный режим и реакционные условия, например реакционноспособные производные, растворители, температура реакции и так далее, данной реакции можно найти в описании способа 1.
Стадия 2.
Соединение II или его соль можно получить, подвергая соединение IIIa или его соль реакции отщепления аминозащитной группы R8 традиционным способом, который описан относительно способа 4.
Метод 2.
Стадия 1.
Соединение IX или его соль можно получить путем взаимодействия соединения II или его реакционноспособного производного у карбоксигруппы, или его соли, у аминогруппы, или его солью.
Пригодные соли соединения IX можно найти в описании соединения I. Данную реакцию можно осуществлять в основном так, как описано для способа 1, и поэтому реакционный режим и реакционные условия, например реакционноспособные производные, растворители, температура реакции и так далее, данной реакции можно найти в описании способа 1.
Стадия 2.
Соединение V или его соль можно получить, подвергая соединение IX или его соль реакции отщепления карбоксизащитной группы R9 традиционным способом, таким, который приведен в отношении способа 4.
Следует отметить, что соединение I и другие соединения могут включать один или более стереоизомеров вследствие асимметрических атомов углерода, и все такие изомеры и их смеси включены в объем изобретения.
Искомое соединение I и его фармацевтически приемлемые соли имеют фармакологическую активность, такую как эндотелинантагонистическая активность, например релаксационная активность кровеносного сосуда и так далее, и пригодны для терапевтического лечения и предупреждения эндотелинопосредованных заболеваний, таких как гипертензия, заболевание сердца, такое как стенокардия, кардиомиопатия, инфаркт миокарда или тому подобное, церебральный приступ, как церебральный артериальный спазм, церебральная ишемия, цереброваскулярная конвульсия или тому подобное, позднефазовый церебральный спазм после субарахноидального кровоизлияния, астма, такая как бронхостеноз или тому подобное, почечная недостаточность, такая как острая почечная недостаточность, почечная недостаточность, вызванная приемом лекарственных препаратов, например цисплатина, циклоспоринов и так далее, недостаточность периферического кровообращения, такая как болезнь Рейно, т.е. симметричная гангрена, болезнь Бюргера и так далее, артериосклероз, диабетическая нефропатия, диабетическая ретинопатия, шок, такой как геморрагический шок, шок, вызванный эндотоксинами и так далее, гемангиоэндотелиома, органопатия после повторной перфузии, например после трансплантации органов и тканей, чрескожной транслуминальной коронарной ангиопатии (PTCA) или чрескожной транслуминальной коронарной реканализации (PTCR) и так далее, расстройство кровообращения после операции, язва, синдром раздраженной толстой кишки (слизистый колит), дизурия, ретинопатия, дисменорея, преждевременные роды, угрожающий аборт, глаукома, осложнения после операции PTCA и так далее.
Для терапевтических целей пептидное соединение I и его фармацевтически приемлемая соль в соответствии с изобретением могут быть использованы в форме фармацевтического препарата, содержащего одно из указанных соединений в качестве активного ингредиента в смеси с фармацевтически приемлемым носителем, таким как органический или неорганический твердый или жидкий наполнитель, пригодный для перорального, парентерального или наружного введения. Фармацевтическими препаратами могут быть капсулы, таблетки, драже, гранулы, раствор, суспензия, эмульсия, сублингвальная таблетка, суппозиторий, мазь, аэрозоль, настой, офтальмические растворы, вагильная свеча и тому подобное. При желании в эти препараты могут быть включены вспомогательные вещества, стабилизаторы, смачиватели и эмульгаторы, буферные растворы и другие обычно используемые добавки.
Доза соединения I варьируется в зависимости от возраста и состояния пациента, однако в случае внутривенного введения суточная доза 0,01 100 мг активного ингредиента на 1 кг массы тела пациента, в случае внутримышечного введения суточная доза 0,05 100 мг активного ингредиента на 1 кг массы тела пациента (человека), в случае перорального введения суточная доза 0,1 100 мг активного ингредиента на 1 кг массы тела человека назначается для лечения эндотелинопосредованных заболеваний.
С целью иллюстрации полезности искомого соединения I приведены данные фармакологического испытания некоторых характерных соединений общего соединения I.
Испытание I.
Метод меченых атомов с использованием радиоактивного лиганда.
1. Испытываемые соединения:
a. Соединение A (соединение примера 7-2).
b. Соединение B (соединение примера 296).
c. Соединение C (соединение примера 325).
d. Соединение D (соединение примера 319).
e. Соединение E (соединение примера 379).
2. Метод испытания.
a. Получение мембраны сырого рецептора.
Свиную аорту получают из Пель-Фриз Байолоджикалз (США) и сохраняют при температуре -80oC перед использованием. Свиную аорту (50 г) оттаивают и освобождают от жировой ткани, разрезают ножницами и затем гомогенизируют политроном (Бринкманн PT-20, максимальная скорость 3 • 10 с) в 100 мл буфера (0,25 М сахароза, 10 мМ Трис-HCl, 0,1 мМ ЭДТК). Гомогенат центрифугируют при 10000 г в течение 20 мин при температуре 4oC. Супернатант, содержащий мембранную фракцию плазмы, центрифугируют при 100000 г в течение 60 мин при температуре 4oC, после чего полученные осадки рассматривают как неочищенные мембранные фракции. Осадок после центрифугирования расуспендируют в 25 мл буферного раствора (50 мМ Трис-HCl, 100 мМ NaCl, 5 мМ MgCl2, 1,5 мкг/мл фенилметилсульфонилфторида (ФМСФ), 120 мкг/мл бацитрацина, 12 мкг/мл лейпепцина, 6 мкг/мл химостоина, 0,1 бычьего сывороточного альбумина (БСА), pH 7,5). Мембранные фракции аорты сохраняют при температуре -80oC вплоть до использования.
b. Метод определения 125I-эндотелин-1-связующей способности.
1252-Эндотелин-1 (1,67 • 10-11 M) (Амершам, Япония; удельная активность 2000 куб. дюйм/ммоль) инкубируют с 50 мкл мембраны аорты, полученной в буферном растворе, при комнатной температуре (20 22oC) в течение 60 мин в конечном объеме, равном 250 мкл. После инкубирования инкубационную смесь фильтруют через стекловолокнистый фильтр GF/C (предварительно обработанный 0,1 полиэтиленимином в течение 3 ч перед использованием), применяя харвестер клеток (Брандель M-24S). Затем фильтры промывают десять раз общим объемом 3 мл промывочного буферного раствора (50 мМ Трис-HCl, pH 7,5) при 0oC. Фильтры считывают в счетчике гамма-квантов (Пакард Ауто Гамма Модель 5660).
3. Результаты испытаний.
Результаты приведены в табл. 1.
Испытание 2.
Воздействие на аорту кролика или сократительную реакцию эндотелина.
1. Испытываемое соединение: соединение A.
2 Метод испытания.
Торакальную аорту выделяют из только что убитых самцов кроликов-альбиносов (возраст 11 недель) и разрезают на 25 мм полоски с денудированной внутренней оболочкой. После удаления жировой ткани эти артериальные сегменты шириной 2 мм и длиной 25 мм суспендируют в 25 мл камерах для органов, наполненных раствором Кребса-Рингера (113 мМ NaCl, 4,8 мМ KCl, 2,2 мМ CaCl2, 1,2 мМ MgCl2, 25 мМ NaHCO3, 1,2 мМ KH2PO4, 5,5 мМ глюкозы), поддерживая температуру 37oC, и наполняют 95 O2/5 CO2. Предварительную загрузку 0,5 г осуществляют после кондиционирования аорты путем введения возрастающей концентрации KCl. Сокращения измеряют в виде повышения в величине изометрического давления.
Испытываемое соединение испытывают в отношении сократительной реакции аорты кроликов, индуцированной эндотелином (3,2•10-9 М). Синтетический эндотелин получают из Пептид Инститъют Инк. (Осака, Япония). Испытываемое соединение прибавляют после того, как получена полная реакция на сокращение, индуцированная эндотелином.
3. Результаты испытания.
Активность испытываемого соединения выражают в виде значения ИК50 максимальной реакции на сокращение, индуцированной эндотелином, как показано в табл. 2.
Испытание 3.
Воздействие на эндотелин-1-прессорный ответ.
1. Испытуемое соединение: соединение A.
2. Метод испытания.
Крыс wistar весом 200-250 г анестезируют простым эфиром и брюшинную аорту канюлируют полиэтиленовой трубкой через бедренную артерию и вену для измерения кровяного давления и внутривенной инъекции эндотелина-1. Животных локализуют для восстановления в течение 3 ч и привязывают в каждой клетке. Кровяное давление непосредственно регистрируют посредством датчика давления (РТ-200Т, изготовлен Нихон Кохден) и записывают на самописце (CWT685G, изготовлен Нихон Кохден). Получают прессорный ответ на внутривенную инъекцию эндотелина-1 (3,2 мкг/кг). Эта дозировка продуцирует длительный прессорный ответ, который продолжается свыше 1 ч.
Эффект внутривенного вливания испытываемого соединения исследуют на крысах через 20 мин после начала внутривенного введения эндотелина-1.
3. Результаты испытания.
Потенцию испытываемого соединения на крысах выражают следующим показателем:
++: полностью антагонизированный (почти 100);
+: умеренно антагонизированный (около 50);
-: отсутствие эффекта.
Испытываемое соединение (A): доза 10 мг/кг, реакция ++.
Из результатов вышеприведенного биологического исследования ясно, что соединение I имеет эндотелин-антагонистическую активность, поэтому данное соединение пригодно для лечения и предупреждения эндотелинопосредованных заболеваний, например гипертензии, кардиомиопатии, инфаркта миокарда или тому подобного, церебрального приступа, такого как церебральный артериальный спазм, церебральная ишемия, цереброваскулярной конвульсии или тому подобного, позднефазового церебрального спазма после субарахноидального кровоизлияния, астмы, такой как бронхостеноз или тому подобное, почечной недостаточности, такой как острая почечная недостаточность, почечная недостаточность, вызванная приемом лекарственных препаратов, например цисплатина, циклоспоринов и так далее, или тому подобное.
Исследование токсичности при многократном пероральном введении в течение двух недель.
1. Метод испытания.
Пять крыс Спрейг-Доули в каждой группе получали перорально исследуемое соединение (мг/кг) один раз в день в течение 14 дней.
2. Исследуемое соединение: натриевая соль соединения примера 16.
3. Результаты испытания.
В течение двух недель выраженных изменений на наблюдалось.
Результаты испытаний соединения I C50(M)(•10-8) по примерам 28 425 приведены в табл. 4.
Следующие примеры приведены для иллюстрации изобретения в деталях. В примерах используются следующие сокращения, которые введены в добавление к сокращениям, принятым IUPAC-IUB:
Ac Ацетил
Boc Трет-бутоксикарбонил
BU Бутил
Bzl Бензил
DMF Диметилформамид
DMSO Диметилсульфоксил
Et Этил
HOBT N-гидроксибензотриазол
Me Метил
NMM N-метилморфолин
Pac Фенацил
D-Pya D-(2-пиридил)аланин
D-4Pya D-(4-пиридил)аланин
TFA Трифторуксусная кислота
TEA Триэтиламин
TS или ToS Тозил
WSCD 1-этил-3(3-диметиламинопропил)карбодиимид
Z Бензилоксикарбонил
DMAP Диметиламинопиридин
Пропись 1-1. К смеси Boc-D-Trp(CH3)-OH (1,59 г) HCl•H-D-Phe-OCH3 (1,08 г) и HOBT (0,81 г) в ДМФ (20 мл) добавляли при охлаждении на ледяной бане WSCD (0,93 г). После перемешивания в течение 2 ч при комнатной температуре смесь упаривали в вакууме и остаток растворяли в этилацетате (50 мл). Раствор последовательно промывали 0,5 и соляной кислотой (20 мл), водой (20 мл), насыщенным раствором бикарбоната натрия (20 мл) и водой (дважды по 20 мл), высушивали над сульфатом магния и упаривали в вакууме. Остаток растирали с эфиром, получая в результате Boc-D-Trp (CH3)-Phe-OCH3 (1,45 г). Т. пл. 95-96oC; Rf 0,83 (CHCl3: MeOH 9:1).
Пропись 1-2. Раствор Boc-D-Trp (CH3)-D-Phe-OCH3 (1,40 г) в смеси анизола (1,4 мл) и TFA (14 мл) перемешивали в течении 1 ч при 0oC. Смесь концентрировали в вакууме и растворяли в 4 н. HCl в 1,4-диоксане (10 мл). Полученный раствор концентрировали в вакууме. Остаток растирали с эфиром, получая в результате HCl•H-D-Trp-(CH3)-D-Phe-OCH3 (1,09 г). Т. пл. 188-192oC; Rf=0,51 (CHCl3:MeOH 9:1).
Пропись 1-3. К смеси TSOH•H-L-Leu-OBzI (14,5 г) и TEA (12 мл) в дихлорметане (300 мл), охлаждаемой на ледяной бане, добавляли по каплям фенацетилхлорид (4,7 мл). После перемешивали в течении 10 мин при этой же температуре смесь концентрировали в вакууме и остаток растворяли в этилацетате (300 мл). Раствор промывали 1 н. HCl (100 мл), водой (100 мл), 1 М водным раствором бикарбоната натрия (100 мл) и рассолом (дважды порциями по 100 мл), высушивали над сульфатом магния и упаривали, получая в результате N-фенацетил-L-Leu-OBzl (14 г). Полученный продукт без дополнительной очистки использовали на следующей стадии. Rf 0,50 (CHCl3:MeOH 9:1)
Пропись 1-4. Раствор N-фенацетил-L-Leu-OBzI (14 г) в метаноле (140 мл) подвергали гидрированию в течении 2 ч на 10-ном палладии на угле (1,4 г) при давлении водорода 3 ат. После удаления катализатора с помощью фильтрования фильтрат концентрировали в вакууме. Остаток растирали с диизопропиловым эфиром, получая в результате N-фенацетил-L-Leu-OH (7,7 г). Т. пл. 135-136oC; Rf 0,17 (CHCl3:MeOH 9,1).
Пропись 2-1. Boc-D-Trp(CH3)-D-Phe-OBzI получали с выходом 87,2% таким же образом, как и в случае прописи 1-1. Rf 0,77 (CHCl3:MeOH 9:1).
Пропись 2-2. HCl•H-D-Trp(CH3)-D-Phe-OBzT получали количественно таким же образом, как и в случае прописи 1-2. Т. пл. 147-150oC; Rf 0,57 (CHCl3:MeOH 9:1).
Пропись 3-1. Boc-L-Leu-OH (1,30 г), HCl•H-D-Trp(CH3)-OBzI (1,76 г), WSCD (950 мг) и HOBT (827 мг) в ДМФ (30 мл) подвергали взаимодействию при 5oC в течении ночи таким же образом, как это описано в прописи 1-1, получая в результате Boc-L-Leu-D-Rp (CH3)-OBzI (2,48 г). Т. пл. 124-126oC; Rf 0,87 (CHCl3:MeOH 9:1).
Пропись 3-2. Boc-L-Leu-Trp (CH3-OBzI в MeOH (50 мл) и в воде (1 мл) подвергали гидрированию на 10-ном палладии на угле, таким же образом, как это описано в прописи 1-4, получая в результате Boc-L-Leu-D-Trp (CH3)-OH (1,95 г). Т. пл. 64-67oC; Rf 0,57 (CHCl3:MeOH:AcOH 16:1:1).
Пропись 4-1. N-фенацетил-L-Leu-D-Trp(CH3)-OBrI (5,96г) получали из N-фенацетил-L-Leu-OH (2,96 г), HCl•H-D-Trp(CH3)-OBzI,(3,9 г), HOBT (1,68 г) и WSCD (1,93 г) таким же образом, как это описано в прописи 1-1. Т. пл. 152-155oC; Rf 0,72 (CHCl3:MeOH 9:1).
Пропись 4-2. К раствору N-фенацетил-L-Leu-D-Trp(CH3)-OBzI (5,9 г) в смеси метанола (60 мл), уксусной кислоты (60 мл) и ДМФ (100 мл) добавляли 10 -ный палладий на активированном угле (0,6 г). Смесь перемешивали в течении 5 ч при давлении водорода 3 ат и комнатной температуре. Раствор фильтровали и фильтрат концентрировали в вакууме. Остаток растирали со смесью эфира и этилацетата, получая в результате N-фенацетил-L-Leu-D-trp(CH3)-OH (4,69 г). Т. пл. 76-79oC; Rf 0,50 (CHCl3:MeOH:AcOH 16:1:1).
Пропись 5. Boc-D-Trp(CH3)-ON (6,0 г), D-Pya-OC2H5• 2HCl (5,54 г), WSCD (3,51 г), HOBT (3,05 г) и ТЕА (2,09 г) подвергали взаимодействию в ДМФ (200 ил) таким же образом, как и в случае прописи 1-1, получая в результате Boc-D-Trp(CH3)-D-Pya-OC2H5 (6,18 г). Т. пл. 99-101oC; Rf 0,67 (CHCl3: MeOH 9:1).
Пропись 6. Реакцию между Boc-D-Trp (CH3)-D-Pya-OC2H5 (4,50 г), TFA (50 мл) и анизолом (5 мл) проводили таким же образом, как это описано в прописи 1-2. В результате получали 2HCl•H-D-Trp (CH3)-D-Pya-OC2H5 (4,15 г). Т. пл. 81-83oC, Rf 0,22 (CHCl3:MeOH:AcOH 8:1:1).
Пропись 7. К раствору (S)-α- бензилоксикарбонил-j-метилбутилизоциатана (1,50 г) в этилацетате (60 мл) добавляли при комнатной температуре гексагидро-1H-азепин (722 мг). После перемешивания в течение 30 мин при этой же температуре раствор промывали последовательно 5 HCI, 1 M раствором бикарбоната натрия и насыщенным раствором хлорида натрия и высушивали над безводным сульфатом магния. Раствор концентрировали в вакууме, получая в результате бензиловый эфир N-(гексагидро-IH-азепин-I-илкарбонил)-L-лейцина (2,06 г) в виде кристаллического вещества. Т. пл. 79-82oC; Rf 0,64 (н-гексан EtOAc 1:1).
Пропись 8. Реакцию между (2S)-2-амино-3,3-диметил-N,N -диметилбутирамидгидрохлоридом (0,20 г), (S)-альфа-бензилоксикарбонил-j-метилбутилизоцианатом (0,25 г) и TEA (0,1 мл) в этилацетате (10 мл) проводили таким же образом, как это описано в прописи 7, получая в результате N-[(1S)-2,2-диметил-1-(N, N-диметилкарбамоил)пропил]карбамоил] -L-L-OBzI(0,40г). Rf 0,59 (гексан:EtOAc 2:1).
Пропись 9. Реакцию между (S)-a-бензилоксикарбонил-g-метилбутилизоцианатом (500 мг) и октагидроазоцином (275 мг) проводили таким же образом, как это описано в прописи 7, получая в результате N-(октагидроазоцин-1-илкарбонил)-L-Leu -OBZI(680 мг). Т. пл. 87-89oC; Rf 0,65 (н-гексан:EtOAc 1:1).
Пропись 10. Реакцию между (2S)-2-амино-3,3-диметил-N,N-диметилбутирамидгидрохлоридом (0,25 г), бензиловым эфиром (2S)-2-хлоркарбонилокси-4-метилвалериановой кислотой (0,36 г) и ТЕА (0,31 г) в этилацетате (10 мл) проводили таким же образом, как это описано в примере 4-1, получая в результате бензиловый эфир (2S)-2-[N-[(S)-2,2-диметил-1-(N,N-диметилкарбамоил)пропил]карбамоилокси] -4- метилвалериановой кислоты (0,44 г). Rf 0,41 (гексан:EtOAc 2: 1).
Пропись 11. Реакцию между (2R)-2-карбоксиметил-4-метилвалератом (1,35 г) гексагидро-1H-азепином (0,610 г) и WSCD•HCI (1,18 г) в метиленхлориде (30 мл) проводили таким же образом, как это описано в прописи 1-1, получая в результате (2R)-2-(гексагидро-1H-азепин-1-илкарбонилметил)-4-метилвалерат (1,65 г). Rf 0,87 (бензол:EtOAc:AcOH 20:20:1).
Пропись 12. Каталитическим восстановлением соответствующих бензиновых эфиров, проводимым таким же образом, как это описано в прописи 4-2, получали следующие соединения:
1) N-[(1S)-2,2-диметил-1-(N, N- диметилкарбамоил-)пропил]карбамоил]-L-Leu-OH; Т. п. 90-93oC; Rf 0,50 (CHCI3: MeON:AcOH 16:1:1);
2) (2S)-2-[N-[(1S)-2,2-диметил-1-(N, N- диметилкарбамоил) пропил]карбамоилокси]-4-метилвалериановую кислоту; Т. пл. 146-148oC; Rf 0,20 (CHCI3:MeOH 9:1);
3) N-(гексагидро-1H-азепин-1- илкарбонил)-L-Leu-OH; Rf 0,40 (бензол:EtOAc:AcOH 20:20:1);
4) N-(окстагидроаэоцин-1-илкарбонил)-L-Leu-OH; Rf 0,45(бензол: EtOAc: AcOH 20:20:1).
Пропись 13. Взаимодействием соответствующих исходных соединений с 2HCl•H- D-Pya-OC2H5 в присутствии NMM, проводимым таким же образом, как это описано в прописи 1-1, были получены следующие соединения:
Boc-D-Trp(изо-C4H9)-D-Pya-OC2H5; Т. пл. 60-62oC; Rf 0,62 (CHCl3:MeOH 9: 1);
2) Boc-D-Trp(CHO)-D-Pya-OC2H5; Т. пл. 131-134oC; Rf 0,60 (CHCl3:MeOH 9: 1);
3) Boc-D-Trp(C2H5)-D-Pya-OC2H5; Т. пл. 64-67oC; Rf 0,60 (CHCl3:MeOH 9: 1);
4) Boc-D-Trp(н-C3H7)-D-Pya-OC2H5; Т. пл. 62-63oC; Rf 0,60 (CHCl3:MeOH 9: 1).
Пропись 14. Путем удаления третбутокcикарбонильных групп из соответствующих исходных соединений при взаимодействии их с TFA и анизолом, провидимым таким же образом, как это описано в прописи 1-2, были получены следующие соединения:
1) 2HCl•H-D-Trp(изо-C4-H9)-D-Pya-OC2H5; Rf 0,09 (CHCl3:MeOH 9:1);
2) 2HCl•H-D-Trp(CHO)-D-Pya-OC2H5; Rf 0,15 (CHCl3: MeOH 9:1);
3) HCI•H-D-Trp(C2H5)-D-Pya -OC2H5; Rf 0,15 (CHCl3:MeOH 9:1);
4) HCl•H-D-Trp(н-C3H7)-D-Pya-OC2H5; Rf 0,13 (CHCl3:MeON 9:1).
Пропись 15. Путем взаимодействия (S)-a-бензилоксикаронил-g- метилбутилизоцианата с соответствующими аминами, проводимого таким же образом, как это описано в прописи 7, были получены следующие соединения:
N-(тиоморфолинокарбонил)-L-Leu-OBzI; Т. пл. 89-91oC; Rf 0,53 (н-гексан: AcOEt 1:1);
2) N-(1,2,3,4-тетрагидроизохинолин-2-илкарбонил)-L-Leu-ОВ; Rf 0,71 (н-гексан:AcOEt 1:1);
3) N-(1,2,3,4-тетрагидрохинолин-I-илкарбонил)-L Leu-BOzI; Rf 0,62 (н-гексан:AcOEt 2:1);
4) N-(N,N-дибутилкарбамоил)-L-Leu-BOzI; Rf 0,70 (н-гексан:AcOEt 2:1);
5) N-(N,N-дипропилкарбамоил)-L-Leu-ОВzI; Rf 0,69 (н-гексан:AcOEt 2:1);
6) N-(N-гептилкарбамоил)-L-Leu-BOzI; Rf 0,63 (н-гексан-AcOEt 2:1);
7) N-(N,N-диизобутилкарбамоил)-L-Leu-OBzI; Rf 0,76 (н-гексан:AcOEt 2:1);
8) N-(N-циклогексил-N-метилкарбамоил)-L-Leu-BOzI; Rf 0,82 (н-гексан:AcOEt 1:1);
9) N[4-(N, N-диметилкарбамоил) пиперидинокарбонил]-L-Leu-BOzI; Rf 0,53 (CHCl3:MeOH:AcOH 16:1:1);
10) N-(2-пиридикарбамоил)-L-Leu-OBzI; Rf 0,61 (CHCl3:MeOH 9:1);
11) N-[(2)-2-(N,N-диметилкарбамоил) пирролидин-1-илкарбонил]-L-Leu-OBzI; Rf 0,47(CHCl3:MeON 9:1);
12) N-[(2R)-2-(N,N-диметилкарбамоил)пирролидин-1- илкарбонил]-L-Leu-BOzI; Rf 0,51 (CHCl3:MeOH 9:1);
13) N-[1-(N, N-диметилкарбамоил) циклогексилкарбамоил]-L- Leu-OBzI; Т. пл. 145-148oC; Rf 0,61 (CHCl3:MeOH 9:1);
14) N-[(1S,2S)-2-(N,N-диэтилкарбамоил)-2-метилбутилкарбамоил]-L-Leu-OBzI; Rf 0,31 (н-гексан:AcOEt 2:1);
15) N-(1,2,3,6-тетрагидропиридин-1-илкарбонил)-L-Leu-OBzI; Rf 0,49 (н-гексан AcOEt 2:1);
16) N-(2,6-диметилпиперидинокарбонил)-L-Leu-OBzI; Т. пл. 81-83oC; Rf 0,53 (н-гексан:AcOEt 2:1);
17) N-(3,5-диметилпиперидинокарбонил)-L-Leu-OBzI; Rf 0,60 (н-гексан:AcOEt 2:1);
18) N-(N,N-дициклогексилкарбамоил)-L-Leu-OBzI; Т. пл. 100-103oC; Rf 0,80 (н-гексан:AcOEt 2:1);
19) N-(N,N-диэтилкарбамоил)-L-Leu-OBzI; Rf 0,45 (H-гексан:AcOEt 2:1);
20) N-(N,N-диизопропилкарбамоил)-L-Leu-OBzI; Rf 0,65 (н-гексан:AcOEt 2: 1);
21) N-[N-метил-N-[(1S)-3-метил-1-(N,N-диметилкарбамоил)-бутил]карбамоил] -L-Leu-OBzI; Т. пл. 183-187oC; Rf 0,38 (CHCl3:MeOH:AcOH 16:1:1);
22)N-[(1S)-1-(N, N-диметилкарбамоил)пентилкарбамоил] -L-Leu OBzI; Т. пл. 133-136oC; Rf 0,59 (н-гексан:AcOEt 2:1);
23) N-[N-метил-N-[1S,2S)-1-(N,N-диметиокарбамоил)-2-метилбутил]карбамоил]-L-Leu-OBzI; Rf 0,60 (н-гексан-AcOEt 2:1);
24) N-[(1S)-1-N,N-диметилкарбамоил) этилкарбамоил)]-L-Leu OBzI; Rf 0,55 (н-гексан:AcOEt 2:1).
Пропись 16. К раствору бензил-(2S)-2-хлоркарбонилокси-4-метилвалерата (0,56 г) в тетрагидрофуране (11 мл) добавляли при комнатной температуре циклогексиламин (0,40 г). После перемешивания в течение 10 мин растворитель отгоняли при пониженном давлении и остаток растворяли в этилацетате (30 мл). Раствор последовательно промывали 1 н. HCl, водой и рассолом. Органический слой высушивали над сульфатом магния и концентрировали в вакууме. Твердый остаток растирали с гексаном, получая в результате бензил-(2S)-2-циклогексилкарбамоилокси-4-метилвалерат (0,45 г). Т. пл. 89-90oC; Rf 0,70 (н-гексан: AcOEt 2:1).
Пропись 17. Путем взаимодействия бензил-(2S)-2-хлоркарбонилокси-4-метилвалерата с соответствующими аминами, проводимого таким же образом, как это описано в прописи 16, были получены следующие соединения:
1) бензил-(2S)-4-метил-2-[(2S)-2- метилбутилкарбамоилокси] валерат; Т. пл. 48-49oC; Rf 0,69 (н-гексан:AcOEt 2:1);
2) бензил-(2S)-4-метил-2-[(1S,2S)-2- метил-1-(N,N-диметилкарбамоил) бутилкарбамоилокси]валерат; Rf 0,91 (CHCl3:MeOH 9:1);
3) бензил-(2)-4-метил-2-[(1R,2S)-2- метил-1-(N,N-диметилкарбамоил) бутилкарбамоилокси]валерат; Rf 3,36 (н-гексан:AcOEt 2:1);
4) бензил-(2S)-4-метил-2-[(1S)-2-метил-1-(N, N-диметилкарбамоил) пропилкарбамоилокси]валерат; Rf 0,66 (н-гексан:AcOEt 2:1);
5) бензил-(2S)-4-метил-2-[(1S)-3-метил-1-(N, N-диметилкарбамоил) бутилкарбамоилокси]валерат; Rf 0,67 (н-гексан:AcOEt 2:1);
6) бензил-(2S)-4-метил-2-[(1S,2S)-2-метил-1-(пиперидинокарбонил) бутилкарбамоилокси]валерат; Rf 0,36 (н-гексан:AcOEt 2:1);
7) бензил-(2S)-4-метил-2-[1S,2S)-1-карбамоил-2- метилбутилкарбамоилокси] валерат; Т. пл. 140-141oC; Rf 0,13 (н-гексан:AcOEt 2:1);
8) бензил-(2S)-2-[1S, 2S)-1-(изопропилкарбамоил)-2- метилбутилкарбамоилокси]-4-метилвалерат; Т. пл. 90-92oC; Rf 0,67 (н-гексан:AcOET 2:1);
9) бензил-2(S)-4-метил-2-(пиперидинокарбонилокси)-валерат; Rf 0,70 (н-гексан:AcOEt 2:1);
10) бензил-(2S)-2-[(1S, 2S)-1- (циклогексилкарбамоил)-2-метилбутилкарбамоилокси]-4-метилвалерат; Т. пл. 98-100oC; Rf 0,55 (н-гексан: AcOEt 2:1);
11) бензил-(2S)-2-(гексагидро-1-н- азепин-1-илкарбонилокси)-4-метилвалерат; Rf 0,78 (н-гексан:AcOEt 2:1);
12) бензил-(2S)-2-(1,2,3,4-тетрагидроизохинолин-2-илкарбонилокси)-4-метилвалерат; Rf 0,68 (н-гексан:AcOEt 2:1).
Пропись 18. К раствору бензил-(2R)-2-карбоксиметил-4-метилвалерата (527 мг) и циклогексиламина (238 мг) в метиленхлориде (10 мл) добавляли при комнатной температуре WSCD•HCl (460 мг). После перемешивания в течение ночи смесь концентрировали в вакууме и остаток растворяли в этилацетате (30 мл). Раствор промывали 5% HCl, водой, насыщенным раствором бикарбоната натрия и водой, высушивали над сульфатом магния и упаривали в вакууме. Остаток растирали с н-гексаном, получая в результате бензил-(2R)-2-(циклогексилкарбамоилметил-4-метилвалерат (410 мг). Т. пл. 99-102oC: Rf 0,84 (бензол:AcOEt:AcOH 20:20:1).
Пропись 19. Реакцию между бензил-(2R)-2-карбоксиметил-4-метилвалератом (320 мг), октагидроазоцином (165 мг) и WSCD•HCl (280 мг) в метиленхлориде (20 мл) проводили таким же образом, как это описано в прописи 18. В результате получали бензил-(2R)-2-(октагидроазоцин-1-илкарбонилметил)-4-метилвалерат (378 мг). Rf 0,83 (бензол:AcOEt:AcOH 20:20:1).
Пропись 20. Путем восстановления соответствующих бензиловых эфиров в присутствии 10-ного палладия на угле, проводимого таким же образом, как это описано в прописи 1-4, получены следующие соединения:
1) N-(1,2,3,4-тетрагидроизохинолин-2-илкарбонил)-L-Leu-OH; Т. пл. 93-85oC; Rf 0,32 (бензил:AcOEt:AcOH 20:20:1);
2) N-(1,2,3,4-тетрагидрохинолин-1-илкарбонил)-L-Leu-OH; Rf 0,46 (бензил: AcOEt:AcOH 20:20:1);
3) N-(N,N-дибутилкарбамоил)-L-Leu-OH; Т. пл. 121-123oC; Rf 0,51 (бензол: AcOEt:AcOH 20:20:1);
4) N-(N,N-дипропилкарбамоил)-L-Leu-OH; Rf 0,41 (бензол:AcOEt:AcOH 20:20: 1);
5) N-(N-гептилкарбамоил)-L-Leu-OH; Rf 0,48 (бензол:AcOEt:AcOH 20:20:1);
6) N-(N, N-диизобутилкарбамоил)-L-Leu-OH; Т. пл. 116-118oC; Rf 0,39 (бензол:AcOEt:AcOH 20:20:1);
7) N-(N-циклогексил-N-метилкарбамоил)-L-Leu-OH; Rf 0,51 (бензол:AcOEt-AcOH 20:20:1);
8) N-[4-(N, N-диметилкарбамоил) пиперидинокарбонил] -L-Leu-OH; Rf 0,10 (CHCl3:MeOH:AcOH 16:1:1);
9) N-(2-пиридилкарбамоил)-L-Leu-OH; Rf 0,18 (CHCl3:MeOH:AcOH 16:1:1);
10) N-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1- илкарбонил]-L-Leu-OH; Rf 0,34 (CHCl3:MeOH:AcOH 16:1:1);
11) N-[(2R)-2-(N,N-диметилкарбамоил)пирролидин-1- илкарбонил)-L-Leu-OH; Rf 0,34 (CHCl3:MeOH:AcOH 16:1:1);
12) N-[1-(N, N-диметилкарбамоил) циклогексилкарбамоил]-L-Leu-OH; Т. пл. 191-192oC; Rf 0,35 (CHCl3:MeOH:AcOH 16:1:1);
13) N-[(1S,2S)-1-(N,N-диметилкарбамоил)-2- метилбутилкарбамоил]-L-Leu-OH; Rf 0,35 (CHCl3:MeOH:AcOH 16:1:1);
14) N-(2,6-диметилпиперидинокарбонил)-L-Leu-OH; Rf 0,53(CHCl3:MeOH:AcOH 16:1:1);
15) N-(3,5-диметилпиперидинокарбонил)-L-Leu-OH; Rf 0,53 (CHCl3:MeOH:AcOH) 16:1:1;
16) N-(N, N-дициклогексилкарбамоил)-L-Leu-OH; Т. пл. 62-73oC; Rf 0,50 (CHCl3:MeOH:AcOH 16:1:1);
17) N-(N,N-диэтилкарбамоил)-L-Leu-OH; Т. пл. 106-107oC; Rf 0,36 (CHCl3: MeOH:AcOH 16:1:1);
18) N-(N,N-диизопропилкарбамоил)-L-Leu-OH; Rf 0,38 (CHCl3:MeOH:AcOH 16: 1:1);
19) N-[(N-метил-N-[(1S)-3-метил-1-(N, N- диметилкарбамоил)-бутил]карбамоил]-L-Leu-OH; Rf 0,38 (CHCl3:MeOH:AcOH 16:1:1);
20) N-[(1S)-1-(N, N-диметилкарбамоил)пентилкарбамоил] -L-Leu-OH; Т. пл. 155-160oC; Rf 0,34 (CHCl3:MeOH:AcOH 16:1:1);
21) N-[N-метил-N-[(1S,2S)-1-(N,N-диметилкарбамоил)-2- метилбутил]карбамоил]-L-Leu-OH; Rf 0,52 (CHCl3:MeOH:AcOH 16:1:1);
22) N-[(1S)-1-(N, N-диметилкарбамоил)этилкарбамоил)] -L-Leu-OH; Rf 0,46 (CHCl3:MeOH:AcOH 16:1:1);
23) (2S)-2-циклогексилкарбамоилокси-4-метилвалериановая кислота; Rf 0,45 (CHCl3:MeOH 9:1);
24) (2S)-4-метил-2-[(2S)-2-матилбутилкарбамоилокси]-валериановая кислота; Rf 0,40 (CHCl3:MeOH 9:1);
25) (2S)-4-метил-2-[(1S,2S)-1-(N,N-диметилкарбамоил)бутилкарбамоилокси]- валериановая кислота; Rf 0,50 (CHCl3:MeOH:AcOH 16:1:1);
26) (2S)-4-(метил-2-[(12 )-2-метил-1-(N,N- диметилкарбамоил)-бутилкарбамоилокси]-валериановая кислота; Rf 0,33 (CHCl3:MeOH:AcOH 16:1:1);
27) (2S)-4-метил-2-[(1S)-2-метил-1-(N,N-диметилкарбамоил)- пропилкарбамоилокси]-валериановая кислота; Rf 0,31 (CHCl3MeOH:AcOH 16:1:1);
28) (2S)-4-иетил-2-[(1S)-3-метил-1-(N,N-диметилкарбамоил)- бутилкарбамоилокси]валериановая кислота; Rf 0,35 (CHCl3:MeOH:AcOH 16:1:1);
29) (2S)-4-метил-2-[(1S,2S)-4-карбамоил-2-метилбутилкарбамоилокси]- валериановая кислота; Т. пл. 170-175oC; Rf 0,50 (CHCl3:MeOH:AcOH 16:1:1);
30) (2S)-2-[(1S, 2S)-1-(изопропилкарбамоил)-2- метилбутилкарбамоилокси] -4-метилвалериановая кислота; Т. пл. 179-180oC; Rf 0,37 (CHCl3:MeOH:AcOH 16: 1:1);
31) (2S)-4-метил-2-(пиперидинокарбонилокси)-валериановая кислота; Rf 0,56 (CHCl3:MeOH:AcOH 16:1:1);
32) (2S)-2-[(1S,2S)-1-(циклогексилкарбамоил)-2- метилбутилкарбамоилокси] -4-метилвалериановая кислота; Т. пл. 193-195oC; Rf 0,43 (CHCl3:MeOH:AcON 16: 1:1);
33) (2S)-2-(гексагидро-1H-азепин-1-илкарбонилокси)-4-метилвалериановая кислота; Т. пл. 86-88oC; Rf 0,53 (бензол:AcOEt:AcOH 20:20:1);
34) (2S)-2-(1,2,3,4-тетрагидроизохинолин-2-илкарбонилокси-4-метилваленриановая кислота; Rf 0,48 (бензол:AcOH 20:20:1);
35) (2R)-2-(циклогексилкарбамоилметил)-4-метилвалериановая кислота; Т. пл. 86-88oC; Rf (бензол:AcOEt:AcOH 20:20:1);
36) (2R)-2-(октагидроазоцин-1-илкарбонилметил)-4-метилвалериановая кислота; Т. пл. 79-81oC; Rf 0,56 (бензол:AcOEt:AcOH 20:20:1);
37) N-циклогекчиокарбамоил-L-Leu-OH; Т. пл. 105-108oC; Rf 0,32 (CHCl3: MeOH 9:1);
38) N[1-(N,N-диметилкарбамоилметил) циклогексилкарбамоил]-L-Leu -OH; Rf 0,35 (CHCl3:MeOH:AcOH 16:1:1);
39) N-циклогексилкарбамоил-L-Leu-D-Trp(CH3-OH); Т. пл. 202-206oC; Rf 0,51 (CHCl3:MeOH:AcOH 8:1:1);
40) N-(пиперидинокарбамоил)-L-Leu-OH; Т. пл. 185-187oC; Rf 0,70 (CHCl3: MeOH 9:1);
41) N-[(2S)-2-метилбутилкарбамоил]-L-Leu-OH; Rf 0,22 (CHCl3:MeOH:AcOH 8: 1:1);
42) N-(2-пиридилметилкарбамоил)-L-Leu-OH; Т. пл. 183-185oC; Rf 0,23 (CHCl3:MeOH:AcOH 8:1:1);
43) H-[(1S,2S)-1-(N,N-диметилкарбамоил)-2- метилбутилкарбамоил]-L-Leu-OH; Т. пл. 185-187oC; Rf 0,27 (CHCl3:MeOH:AcOH 8:1:1).
Пропись 21. К раствору N-(1,2,3,6-тетрагидропирин-1-илкарбонил)-L-Leu -OBzI (0,58 г) в MeOH (6 мл) добавляли при комнатной температуре 1 н. NaOH (3,5 мл). Через 1 ч смесь подкисляли 1 н. HCl (5 мл) и растворитель удаляли путем отгонки в вакууме. Остаток растворяли в этилацетате (20 мл) и промывали водой (20 мл) и рассолом (20 мл). Органический слой высушивали над сульфатом магния и концентрировали в вакууме, получая в результате N-(1,2,3,6-тетрагидропирин-1-илкарбонил)-L-Leu-OH (0,31 г) в виде маслянистой жидкости. Rf 0,41 (CHCl3:MeOH:AcOH 16:1:1).
Пропись 22. Путем гидролиза соответствующих бензиловых эфиров 1 н. NaOH, осуществляемого таким же образом, как это описано в прописи 21, получали следующие соединения:
1) N-(тиоморфолинокарбонил)-L-Leu-OH; Rf 0,31 (бензол:AcOEt:AcOH 20:20: 1);
2) (2S)-2-[(1S, 2S)-1-пиперидинокарбонил)-2-метилбутилкарбамоилокси] - 4-метилвалериановая кислота; Rf 0,47 (CHCl3:MeOH:AcOH 16:1:1).
Пропись 23. L-Leu-OH (10,0 г) растворяли в воде (150 мл), содержащую концентрированную серную кислоту (3,2 мл), при 0oC. К полученному раствору добавляли по каплям в течение 1 ч раствор нитрита натрия (7,9 г) в воде (50 мл). Смесь насыщали хлоридом натрия и подвергали экстракции этилацетатом (500 мл). Органический слой высушивали над сульфатом магния и концентрировали в вакууме. Твердый остаток растирали с гексаном, получая в результате (2S)-2-окси-4-метилвалериановую кислоту (6,51 г). Т. пл. 70 72oC; Rf 0,80 (н-BuOH:AcOH:H2O 4:1:1).
Пропись 24. К перемешиваемому раствору (2S)-2-окси -4- метилвалериановой кислоты (5,0 г) и бензилбромида (4,95 мл) в ДМФ (50 мл) добавляли при комнатной температуре карбонат калия (3,13 г). После перемешивания в течение 12 ч растворитель отгоняли в вакууме. Остаток растворяли в этилацетате (100 мл) и промывали последовательно водой, 1 н. HCl и рассолом. Органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток в виде маслянистой жидкости подвергали очистке с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь гаксана и этилацетата. В результате получали бензил-(2S)-2-окси-4-метилвалерат (8,2 г) в виде бесцветной маслянистой жидкости. Rf 0,67 (CHCl3:MeOH:AcOH 16:1:1).
Пропись 25. К раствору бензил-(2S)-2-окси -4- метилвалерата (1,00 г) в тетрагидрофуране (20 мл) добавляли при комнатной температуре трихлорметилхлорформиат (0,55 мл). Раствор кипятили в течение 11 ч с обратным холодильником, после чего растворитель отгоняли при атмосферном давлении, получая в результате (2S)-2-хлоркарбонилокси -4-метлвалерат (1,26 г) в виде маслянистой жидкости. Rf 0,81 (н-гексан-AcOEt 2:1).
Пропись 26. Раствор бензил-(2R)-2-третбутоксикарбонилметил-4-метилвалериата (3,40 г) в TFA (60 мл) перемешивали в течение 1 ч при охлаждении на водяной бане. После отгонки TFA получали бензил-(2R)-2- карбоксиметил-4-метилвалерат (2,72 г) в виде маслянистой жидкости. Rf 0,73 (бензол:AcO0Et:AcOH 20:20:1).
Пропись 27. Путем взаимодействия соответствующих исходных соединений с фенилизоцианатом в Et3N или HMM, осуществляемого таким же образом, как это описано в прописи 7, получали следующие соединения:
1) H-циклогексилкарбамоил-L-Leu-OBzI; Т. пл. 120-125oC; Rf 0,73 (CHCl3: MeOH 9:1).
2) N-циклогексикарбамоил-L-Leu-D-Trp (CH3)- BZI; Т. пл. 190-193oC; Rf 0,74(CHCl3:MeOH 9:1).
Пропись 28. Путем взаимодействия TSOH•H-L-Leu-OBzI с соответствующими аминами в присутствии трихлорметилхлорформиата, осуществляемого таким же образом, как это описано в примере 72, получали следующие соединения:
1) N-[I-(N,N-диматиламинокарбонилметил) циклогексилкарбамоил]-L- Leu-OBzI; Rf 0,70 (CHCl3:MeOH 9:1);
2) N-[(1S, 2S)-1-(N, N-диметилкарбамоил)-2-метилбутилкарбамоил]-L-Leu-OBzI; Т. пл. 95-98oC; Rf 0,32 (н-гексан:AcOEt 1:1);
3) N-(пиперидинокарбамоил)-L-Leu-OBzI; Rf 0,43 (н-гексан:AcOEt 1:1);
4) N-(2-пиридилметилкарбамоил)-L-Leu-OBzI; Rf 0,50(AcOEt);
5) N-[(2)-2-метилбутилкарбамоил] -L-Leu-OBzI; Т. пл. 73-75oC; Rf 0,29 (н-гексан:AcOEt 3:1).
Пропись 29. 1) Смесь TSOH•H-L-Leu-OBzI (12,0 г), этилацетат (150 мл) и IM раствора бикарбоната натрия (150 мл) перемешивали при комнатной температуре в течение 20 мин. Органическую фазу после отделения промывали 1 M раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и затем высушивали над сульфатом магния. К полученному раствору добавляли 4 н. раствор хлористого водорода в этилацетате (15,3 мл) и перемешивали смесь в течение 5 мин, охлаждая ее льдом. После удаления растворителя получали HCl•H-L-Leu-OBzI (7,66 г).
2) К раствору полученного продукта (7,6 г) в толуоле (228 мл) добавляли древесный уголь (380 мг) и раствор трихлорметилхлорформиата (3,6 мл) в толуоле (7,6 мл) и смесь перемешивали в течение 2 ч при 120oC, а затем фильтровали. После удаления растворителя из фильтрата остаток растворяли в толуоле (152 мл). Полученный раствор упаривали, получая в результате (S)-a-бензилоксикарбонил-g-метилбутилизоцианат (7,58 г).
3) К раствору полученного продукта в этилацетате (114 ил) добавляли при охлаждении льдом гексагидро-1H-азепин (3,5 г) и смесь перемешивали при этой же температуре в течение 30 мин. Полученный раствор промывали 5% HCl, водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, после чего высушивали над сульфатом магния. После удаления растворителя получали N-(гексагидро-1H-азепин-1-илкарбонил)-L-Leu-OBZI (9,96 г). Rf 0,71 (н-гексан:EtOAc 2:1).
4) К раствору N-(гексагидро-1H-азепин-1-илкарбонил)-L-Leu-OBzI (9,0 г) в этаноле (69 мл) добавляли 10% палладий на угле (0,692 г) и проводили каталитическое восстановление в течение 30 мин при давлении водорода 3 ат. После этого катализатор отфильтровывали и фильтрат упаривали досуха. Остаток растворяли в этилацетате (138 мл), раствор промывали 5% HCl и насыщенным водным раствором хлорида натрия и высушивали. После удаления растворителя остаток перекристаллизовывали из этилацетата и гексана, получая в результате N-(гексагидро-1H-азепин-1-илкарбонил)-L-Leu-OH (5,7 г). Т. пл. 90 92oC; Rf 0,43 (бензол:EtOAc:AcOH 20:20:1).
Пропись 30.
1) К раствору Boc-D-Trp-OH (15,0 г) в ДМФ (150 мл) добавляли при охлаждении льдом третбутоксид калия (13,8 г) и метилиодид (10,5 г). После перемешивания в течение 30 мин при охлаждении льдом и в течение 15 мин при комнатной температуре реакционную смесь выливали в охлаждаемый льдом 0,24 н. HCl и подвергали экстракции этилацетатом. Экстракт промывали 5% NaHSO3 и насыщенным водным раствором хлорида натрия. После удаления растворителя получали остаток, который перекристаллизовывали из диизопропилового эфира. В результате получали Boc-D-Trp (CH3)-OH (9,18 г). Rf 0,61 (CHCl3:MeOH 8:2).
2) К раствору полученного продукта (6,84 г) в дихлорметане (137 мл) добавляли при -30oC NMM (2,17 г) и изобутилхлорформиат (2,93 г). К смеси добавляли при -15 10oC 2HCl•H-D-Pya- OC2H5 (6,0 г) и при -20oC NMM (4,54 г), после чего смесь перемешивали при этой температуре в течение 30 мин. Затем ее промывали 1 M раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и обрабатывали древесным углем. Растворитель удаляли путем упаривания и остаток перекристаллизовывали из этилацетата и гексана, получая в результате Boc-D-Trp(CH3)-D-Pya-OC2H5 (7,88 г). Т. пл. 99-101oC; Rf 0,80 (CHCl3:MeOH 9:1); (α
3) К раствору полученного продукта (7,8 г) в этилацетате (61,7 мл) добавляли при охлаждении людом 4 и раствор хлористого водорода в этилацетате (30,8 мл) и смесь перемешивали в течение часа при комнатной температуре. Целевой продукт собирали путем декантации и растирания с этилацетатом. В результате получали 2HCl•H-D-Tp(CH3)-D-Pya-OC2H5 (7,4 г).
Пропись 31-1. Путем взаимодействия Nα -Boc- Nα -метил-Nin-метил-D-Trp-OH (0,65 г), 2HCl•H-D-Pya-OEt (0,52 г), HOBt (0,32 г) WSCD (0,36 г) Et3N (0,20 г) и ДМФ (20 ил), осуществляемого таким же образом, как это описано в прописи 1-1), получали Nα-Boc-Nα-метил-Nin-метил-D-Trp-D-Pya-OEt (0,78 г). Rf 0,81 (CHCl3:MeOH 9:1).
Пропись 31-2. Путем взаимодействия Boc-D-Trp(CHO)-OH (2,0 г), 2HCl•H-D-Pya-OEt (0,16 г), WSCD (1,03 г), HOBt (0,90 г),NMM (0,61 г) и ДМФ (20 мл), осуществляемого таким же образом, как это описано в прописи 1-1, получали Boc-D-Trp-(CHO)-D-Pya-OEt (2,23 г). Т. пл. 136-137 oC; Rf 0,65 (этилацетат).
Пропись 31-3. К раствору Boc-D-Trp(CHO)-OH (0,79 г) и N-метилморфолина (0,13 мл) в метилхлориде (20 мл) добавляли при -15oC по каплям изобутилхлорфомиат (0,31 мл). Через 15 мин к приготовленному раствору добавляли при -30oC N-метилформофлин (0,13 мл) и HCl•H-D-Gly(OBzI)-OPac (0,85 г). После перемешивания в течение часа смесь промывали 0,5 М соляной кислотой (10 мл), водой (10 мл) и 1 M раствором гидрокарбоната натрия (10 мл), высушивали над сульфатом магния и концентрировали в вакууме. Твердый остаток растирали с этиловым эфиром, получая в результате Boc-D-Trp(CHO)-D-Cl(OBzI)-OPac (1,31 г). Т. пл. 142-144oC; Rf 0,79 (хлороформ:метанол 9:1).
Пропись 31-4. Boc-D-Trp(CHO)-D-Phe-OPac получали таким же образом, как и в случае прописи 1-1. Т. пл. 142 146oC; Rf 0,78 (хлороформ:метанол 9:1).
Пропись 31-5. Путем взаимодействия Boc-D-Trp(CHO)-OH (1,0 г), HCl•H-βAIa-OPac (0,81 г), HOBT (0,49 г), WSCD (0,56 г) и ДМФ (10 мл), осуществляемого таким же образом, как это описано в прописи 1-1, получали Boc-D-Trp(CHO)-bAla-OPac (3,15 г). Т. пл. 153 155oC; Rf 0,58 (хлороформ:метанол 9:1).
Пропись 31-6. Путем взаимодействия Boc-D-Trp(CHO)-OH (10,0 г), HCl•H-бета-Ala-OMe (4,41 г), HOBt (4,47 г), WSCD (5,14 г) и ДМФ (100 мл), осуществляемого таким же образом, как это описано в прописи 1-1, получали Boc-D-Trp (CHO)-бета-Ala-Ome (8,77 г). Т. пл. 134-135oC; Rf 0,54 (CHCl3:MeOH 9:1).
Пропись 31-7. Путем взаимодействия Boc-D-Phe-OH (265 мг), 2HCl•H-D-Pya-OEt(267 мг), HOBt(0,16 г), WSCD(0,19 г), N-метилморфолина (0,10 г) и ДМФ (6 мл), осуществляемого таким же образом, как это описано в прописи 1-1, получали Boc-D-Phe-D-Pya-OEt (0,32 г). Т. пл. 97-99oC; Rf 0,58 (CHCl3:MeOH 9: 1).
Путем отщепления третбутоксикарбонильных групп от соответствующих исходных соединений, осуществляемого таким же образом, как это описано в прописи 1-2, были получены следующие соединения.
Пропись 32-1. HCl•H-D-Trp(Me)-L-Leu-OBz1; Т. пл. 85-90oC; Rf 0,27 (CHCl3:MeOH 9:1).
Пропись 32-2. 2HCl•N-альфа-метил-D-Trp(Me)-D-Pay-OEt; Т. пл. 100-110oC: Rf 0,50 (CHCl3:MeOH 9:1).
Пропись 32-3. 2HCl•H-D-Trp(CHO)-D-Pay-OEt; Rf 0,16 (CHCl3:MeOH:AcOH 8:1: 1, объемн.).
Пропись 32-4. HCl•H-D-Trp(CHO)-D-Glu-(OBzI)-OPac; Т. пл. 80-89oC; Rf 0,50 (хлороформ:метанол 9:1).
Пропись 32-5. HCl•H-D-Trp(CHO)-D-Phe-OPac; Т. пл. 185oC (с разлож.); Rf 0,37 (хлороформ:метанол:уксусная кислота 16:1:1).
Пропись 32-6. HCl•H-D-Trp(CHO)-b Ala-OPac; Т. пл. 157-164oC; Rf 0,17 (хлороформ:метанол:уксусная кислота 16:1:1).
Пропись 32-7. HCl•H-D-Trp(CHO)-бетаAla-OMe; Т. пл. 168-169oC; Rf 0,53 (10% MeOH в CHCl3).
Пропись 32-8. 2HCl•H-D-Phe-D-Pya-OEt; Rf 0,12 (10% MeOH в CHCl3).
Путем взаимодействия (S)-a- бензилоксикарбонил-g-метилбутилизоцианата с соответствующими аминами, осуществляемого таким же образом, как это писано в прописи 7, были получены следующие соединения.
Пропись 33-1. N-(пирролидин-1-илкарбонил)-L-Leu-OBzI; Rf 0,14 (EtOAc: гексан 1:2).
Пропись 33-2. N-(пиперидин-1-илкарбонил)-L-Leu-OBzI; Т. пл. 75-76oC; Rf 0,27 (EtOAc:гексан 1:2).
Пропись 33-3. N-[(2S)-4-метил-2-(1-метилпропил)-3-оксопиперидин-1-илкарбонил]L-Leu-OBzI; Rf 0,13 (EtOAc:гексан 1:1, объемн.).
Пропись 33-4. N-[{ (1S)-1-(N, N-диметилкарбамоил)-1-циклогексиметил} карбамоил]-L-Leu-OBzI; Rf 0,26 (EtOAc: гексан 1:1, объемн.).
Пропись 33-5. N[{(1S)-1-(N,N-диметилкарбамоил)-1-фенилметил} карбамоил] -L-Leu-OBzI; Rf 0,08 (EtOAc: гексан 1:2, объемн.).
Пропись 33-6. N[{ цис-5-(N,N-диметилкарбамоилметил)циклогексил} карбамоил]-L-Leu-OBzI; Rf 0,25 (этилацетат).
Пропись 33-7. N[{цис-5(N,N-диметилкарбамоил)циклогексил]карбамоил}-L-Leu-OBzI; Rf 0,34 (этилацетат).
Пропись 33-8. N-(N,N-диметилкарбамоилметил)карбамоил-L-Leu-OBzI; Rf 0,23 (этилацетат).
Пропись 33-9. N-[{2-(N,N-диметилкуарбоил)этил}карбамоил]-L-Leu-OBzI; Rf 0,33 (этилацетат).
Пропись 33-10. N-[(транс-4-оксициклогенсил)карбамоил]-L-Leu-OBzI; Т. пл. 169-171oC; Rf 0,53 (этилацетат).
Пропись 33-11. N-[{(1S)-1-(оксиметил)-3-метилбутил} карбамоил]-L-Leu-OBzI; Rf 0,38 (н-гексан:этилацетат 1:1).
Пропись 33-12. N-[{ 2-морфолино)этил} карбамоил] -L-Leu-OBzI; Rf 0,46 (CHCl3:MeOH:AcOH 8:2:1).
Пропись 33-13.
N-(E-капролактам-3-илкарбамоил)-L-Leu-OBzI; Т. пл. 148-150oC; Rf 0,52 (этилацетат).
Пропись 33-14. N-(N'-изобутирилгидразинокарбонил)-L-Leu-OBzI; Т. пл. 93-96oC, Rf 0,16 (н-гексан:этилацетат 1:1).
Пропись 33-15. N-[(1-этоксикарбонилпиперидин-4-ил)карбамоил]-L-Leu-OBzI; Rf 0,35 (н-гексан:этилацетат 1:1).
Путем отщепления бензильных групп от соответствующих исходных соединения, осуществляемого таким же образом, как это описано в прописи 1-4, были получены следующие соединения.
Пропись 34-1. N-(пирролидин-1-илкарбонил)-L-Leu-OH; Rf 0,18 (10 MeOH в CHCl3).
Пропись 34-2. N-(пиперидинокарбонил)-(L-Leu-OH); Rf 0,17 (10% MeOH в CHCl3).
Пропись 34-3. N-(2-хлорфенилкарбамоил)-L-Leu-OH; Rf 0,20 (10% MeOH в CHCl3).
Пропись 34-4. N-(o-хлорфенилацетил)-L-Leu-OH; Т. пл. 145-146oC; Rf 0,21 (10% MeOH в CHCl3).
Пропись 34-5. (2R)-2-[{(1S)-1-(N,N-диметилкарбамоил)-2,2-диметилпропил} карбамоил]-метил-4-метилфалериановая кислота; Rf 0,43 (10% MeOH в CHCl3).
Пропись 34-6. N-[(2S)-4-метил-2-(1-метилпропил)-3- оксопиперазин-1-илкарбонил]-L-Leu-OH; Т. пл. 180oC (с разлож.); Rf 0,20 (10% MeOH в CHCl3).
Пропись 34-7. N-[{(1S)-1-(N,N-диметилкарбамоил)-1-циклогексиметил} карбамоил]-L-Leu-OH; Т. пл. 210-211oC; Rf 0,20 (10% MeOH в CHCl3).
Пропись 34-8. N-[{(1S)-1-(N,N-диметилкарбамоил)-1-фенилметил} карбамоил] -L-Leu-OH; Rf 0,38 (CHCl3:MeOH:AcOH 16:1:1, объемн.).
Пропись 34-9. N-(гексагидро-1H-азепин-1-илкарбонил)-N-метил-Leu-OH; Rf 0,58 (бензол:этилацетат:уксусная кислота 20:20:1, об.).
Пропись 34-10. N-[{цис-4-(N,N-диметилкарбамоилметил)циклогексил} карбамоил]-L-Leu-OH; Rf 0,57 (CHCl3:MeOH:AcOH 8:1:1).
Пропись 34-11. N-[{цис-4-(N,N-диметилкарбамоил)циклогексил} карбамоил] -L-Leu-OH; Rf 0,52 (CHCl3:MeOH:AcOH 8:1:1).
Пропись 34-12. N-(N,N-диметилкарбамоилметил)карбамоил-L-Leu-OH; Rf 0,73 (CHCl3:MeOH:AcOH 8:2:1).
Пропись 34-14. N-[(транс-4-оксициклогексил)карбамоил]-L-Leu-OH; Rf 0,78 (CHCl3:MeOH:AcOH 8:1:1).
Пропись 34-13. N-[{2-(N,N-диметилкарбамолил)этил}карбамоил]-L-Leu-OH; Rf 0,77 (CHCl3:MeOH:AcOH 8:2:1).
Пропись 34-15. N-[N-(2-оксиэтил)-N-метилкарбамоил] -L-Leu-OH; Rf 0,65 (CHCl3-MeOH:AcOH 8:1:1).
Пропись 34-16. N-[{(1S)-(1-оксиметил)-3-метилбутил} карбамоил]-L-Leu-OH; Rf 0,68 (бензол:этилацетат:уксусная кислота 20:20:1).
Пропись 34-17. N-[2-(морфолино)этил карбамоил]-L-Leu-OH; Rf 0,21 (CHCl3: MeOH:AcOH 8:2:1).
Пропись 34-18. N-(E-капролактам-3-илкарбамоил)-L-Leu-OH; Rf 0,67 (CHCl2: MeOH-AcOH 8:2:1).
Пропись 34-19. N-(N'-изобутирилгидразинокарбонил)-L-Leu-OH; Rf 0,45 (CHCl3:MeOH:AcOH 8:1:1).
Пропись 34-20. N-[(1-этоксикарбонилпиперидин-4-ил)карбамоил]-L-Leu-OH; Rf 0,48 (CHCl3:MeOH-AcOH 8:1:1).
Пропись 35. Проводя реакцию между гексагидро-1H-азепином (0,3 г), (S)-a-бензилоксикарбонил-g,γ-диметилбутилизоцианатом (0,48 г) и EtOAc (10 мл) таким же образом, как описано в прописи 7, получали N-(гексагидро-1H)-азепин-1-илкарбонил)-g- метил-L-Leu-OH. Полученный продукт, 10% Pd на C (60 мг), MeOH (10 мл) и H2O (1 мл) подвергали взаимодействию таким же образом, как это описано в прописи 1-4). В результате получали N-(гексагидро-1H-азепин-1-илкарбонил)-гамма-метил-L-Leu-OH (0,43 г). Т. пл. 64 66oC; Rf 0,20 (10 MeOH в CHCl3).
Пропись 36-1. Проводя реакцию между Boc-D-I-Nal-OH (0,50 г), метансульфонамидом (0,18 г), DMAP (0,23 г), WSCD•HCl (0,37 г) и CH2Cl2 (10 мл) таким же образом, как это описано в прописи 1-1, получали Boc-D-I-Nal-метансульфонамид (0,63 г). Rf 0,48 (10 MeOH в CHCl3).
Пропись 36 2. Проводя реакцию между Boc-D-Phe-OH (0,20 г), метансульфонамидом (0,79 мг), DMAP (0,11 г), WSCD•HCl (0,17 г) и ДМФ (4 мл) таким же образом, как описано это в прописи 1-1, получали Boc-Phe-метансульфонамид (0,21 г). Т. пл. 73 75oC; Rf 0,80 (CHCl3MeOH:AcOH 8:1:1, объемн.).
Пропись 36-3. Проводя реакцию между Boc-D-Phe-OH (0,20 г), бензолсульфонамидом (0,13 г), DMAP (0,11 г), WSCD•HCl (0,17 г) и CH2Cl2 (4 мл) таким же образом, как это описано в прописи 1-1, получали Boc-D-Phe-бензолсульфонамид (0,32 г); Rf 0,83 (CHCl3:MeOH:AcOH 8:1:1, объемн.).
Пропись 36-4. Проводя реакцию между Boc-D-Pya-OH (0,20 г), диэтиламином (66 мл), HOBt (0,12 г), WSCD•HCl (0,17 г) и ДМФ (2 мл) таким же образом, как это описано в прописи 1-1, получали Boc-D-Pya-диэтиламид (45 мг). Т. пл. 133 135oC; Rf 0,32 (EtOAc).
Пропись 37-1. Проводя реакцию между Boc-D-I-Nal-метансульфонамидом (0,60 г), 4 н. HCl-EtOAc (10 мл) и EtOAc (3 мл) таким же образом, как это описано в прописи 1-2, получали HCl•H-D-I-Nal-метансульфонамид. Т. пл. 250oC (с разлож.); Rf 0,42 (CHCl3:MeOH:AcON 8:2:1, объемн.).
Пропись 37-2. Проводя реакцию между Boc-D-Phe-метансульфонамидом (0,19 г) и 4 н. HCl EtOAc (10 мл) таким же образом, как это описано в прописи 1-2, получал HCl•H-D-Phe-метансульфонамид (0,13 г); т. пл. 243oC (с разлож.); Rf 0,12 (CHCl3:MeOH:AcOH 8:1:1, объемн.).
Пропись 37 3. Проводя реакцию между Boc-D-Phe-бензолсульфонамидом (0,30 г) и 4 н HCl-EtOAc (10 мл) таким же образом, как это описано в прописи 1-2, получали HCl•H-D-Phe-бензолсульфонамид (0,22 г). Т. пл. 230oC (с разлож.); Rf 0,22 (CHCl3:MeOH:AcOH 8:1:1; объемн.).
Пропись 37-4. Проводя реакцию между Boc-D-Pya-диэтиламидом (45 мг) и 4 н HCl-EtOAc (1 мл) таким же образом, как это описано в прописи 1-2, получали 2HCl•H-D-Pya-диэтиламин (41 мг); Rf 0,18 (10% MeOH в CHCl3).
Пропись 38-1. Проводя реакцию между о-хлорфенилизоцианатом (1,54 г), ToSOH•H-L-Leu-OBzI (3,94 г), N-метилморфолином (1,1 г) и EtOAc (50 мл) таким же образом, как это описано в прописи 7, получали N-(2-хлорфенилкарбамоил)-L-Leu-OBzI (4,30 г); Rf 0,86 (10 MeOH в CHCl3).
Пропись 38-2. Проводя реакцию между о-хлорфенилуксусной кислотой (0,73 г), HCl•H-L-Leu-OBZI (1,0 г), WSCD (0,66 г) и CH2Cl2 (20 мл) таким же образом, как это описано в прописи 1-1, получали N-(о-хлорфенилацетил)-L-Leu-OBzI (1,4 г); Т. пл. 75 77oC; Rf 0,86 (10 MeOH в CHCl3).
Пропись 39. К перемешиваемому раствору N-Boc-N-метилглициналя (2,0 г) и HCl•H-L-Lle-OMe (2,0 г) в MeOH добавляли при комнатной температуре цианоборгидрит натрия (0,87 г). Через 30 мин растворитель отгоняли в вакууме, остаток растворяли в этилацетате (50 мл) и промывали раствор гидрокарбонатом натрия. Органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток подвергали очистке с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана в соотношении (1 3) (3 1). В результате получали N-[2-(N-Boc-N-метиламино)этил] -L-Leu-OMe (1,67 г); Rf 0,78 (EtOAc: гексан 2:1, объемн.).
Пропись 40. Проводя реакцию между N-[2-(N-Boc-N-метиламино)этил]-L-Leu-OMe (1,60 г) и 4 н HCl-EtOAc (20 мл) таким же образом, как это описано в прописи 1-2, получали 2HCl•N-[2-(N-метил- амино)этил]-L-Ile-OMe (1,40 г). Т. пл. 148 150oC; Rf 0,19 (10 MeOH в CHCl3).
Пропись 41. Растворяли 2HCl•N-[2-(N-метиламино)этил]-L-Ile-OMe (1,30 г) в 24 н. HN3-MeOH (20 мл) при комнатной температуре и оставляли раствор стоять на 5 дней. После этого растворитель отгоняли в вакууме и остаток растворяли в EtOAc (30 мл). Раствор промывали гидрокарбонатом натрия (20 мл). Органический слой высушивали над сульфатом магния и концентрировали в вакууме, получая в результате (3S)-1-метил-3-(1-метилпропил)-2-оксопиперазин (0,69 г); Rf 0,57 (10% MeOH в CHCl3).
Пропись 42. К перемешиваемой суспензии Na-Boc-Nin-метил-D-Trp-OH (1,0 г) и NaH (0,31 г, 60% в масле) в тетрагидрофуране добавляли при комнатной температуре метилиодид (1,34 г). Через 8 дней смесь упаривали в вакууме и остаток суспендировали в EtOAc (30 мл). Реактор промывали 1 н. HCl и рассолом. Органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток подвергали очистке с помощью колоночной хроматографии на силикагеле, используя в качестве элюента 20 г, 2% MeOH в CHCl3. В результате получали Nα-Boc-Nα-метил-Nin-метил-D-Trp-OH (0,70 г).
Пропись 43. Тонкий порошок карбоната калия (5,8 г) суспендировали в растворе 2-(аминометил)пиридина (3,0 г) и этилбромацетата (3,1 мл) в диметилформамиде (30 мл). Смесь перемешивали при комнатной температуре в течение ночи и затем выливали в ледяную воду, подвергали экстракции этилацетатом (50 мл • 2), органический слой дважды промывали насыщенным раствором хлорида натрия, высушивали над сульфатом магния и упаривали в вакууме. Остаток подвергали очистке с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь MeOH и CHCl3 при соотношении 1 99. В результате получали N-(этоксикарбонилметил)-N-(пиридин-2-илметил)амин (2,30 г); Rf 0,27 (MeOH:CHCl3 1:19).
Пропись 44. Раствор 2-[2 (третбутоксикарбониламино)этил]пиридина (2 г) в диметилформамиде (10 мл) добавляли при 0oC к суспензии гидрида натрия (0,54 г) в диметилформамиде (10 мл). Смесь перемешивали в течение часа при 0oC и еще в течение часа при комнатной температуре, после чего добавляли к ней раствор этилбромацетата (1,5 мл) в диметилформамиде (5 мл) и перемешивали в течение 2 ч при комнатной температуре. Раствор выливали затем в насыщенный раствор хлорида аммоний (50 мл) и смесь подвергали экстракции этилацетатом (30 мл • 2). Объединенные органические соли промывали насыщенным раствором хлорида натрия, высушивали над сульфатом магния и упаривали в вакууме. Остаток подвергали очистке с помощью колоночной хроматографии на силикагеле, используя в качестве элюента смесь MeOH и CHCl3 при соотношении 1 99. В результате получали 2-[2-{N-(третбутоксикарбонил)-N-(этоксикарбонилметил) амино}этил]пиридин; Rf 0,47 (CHCl3:MeOH 1:19).
Пропись 45. Проводя реакцию между 2-[2-N-(третбутоксикарбонил)-N-(этоксикарбонилметил) амино} этил] пиридином (430 мг) и 4 н. HCl-1,4- диоксаном (5 мл) таким же образом, как это описано в прописи 1-2, получали N-(этоксикарбонилметил)-N-[2-(пиридин-2- ил)-этил]аминдигидрохлорид (400 мг). Rf 0,24 (MeOH:CHCl3 1:19).
Пропись 46. Проводя реакцию между N-метил-L-Leu-OBzI-гидрохлоридом (600 мг), трихлорметилхлорформиатом (0,54 мл) и гексаметиленимином (877 мг) таким же образом, как это описано в прописях 29-2 и 29-3, получали N- (гексагидро-1H-азепин-1-илкарбонил)-N-метил-L-Leu-OBzI (515 мг); Rf 0,44 (н-гексан:этилацетат 3:1).
Пропись 47. Проводя реакцию между Boc-L-Asp(OBzI)-OH (1,0 г), 2-аминопиридином (0,35 г), HOBT (0,50 г), WSCD (0,71 г) и ДМФ (20 мл) таким же образом, как это описано в прописи 1-1, получали Boc-L-ASp (OBzI)-2-пиридиламид; Rf 0,52 (CHCl3:MeOH:AcOH 16:1:1).
Пропись 48. Таким же образом, как это описано в прописи 1-2, получали H-L-ASp(OBzI)-2-пиридиламид. 2HCl. Т. пл. 170-178oC; Rf 0,23 (хлороформ:метанол:уксусная кислота 8:1:1).
Пропись 49. Проводя реакцию между HCl•H-L-трет.-Leu-диметиламидом (0,22 г), бензил-(2R)-2-(карбоксиметил)-4-метилвалератом (0,30 г) WSCD (0,21 г) и CH2Cl2 (8 мл) таким же образом, как это описано в прописи 1-1, получали бензил-(2R)-2- [{ (1S)-1-(N, N-диметилпропил карбамоил)метил-4-метилвалерат (0,40 г); Rf 0,71 (10% MeOH в CHCl3).
Пример 1-1. К смеси N-фенилацетил-L-Leu-OH (0,25 г), HCl•H-D-Trp-(CH3)-D-Phe-OCH3 (0,48 г) и HOBT (0,16 г) в ДМФ (8 мл) добавляли при охлаждении на ледяной бане WSCD (0,19 г). После перемешивания в течение 4,5 ч при этой же температуре смесь концентрировали в вакууме и остаток растворяли в этилацетате (50 мл). Раствор промывали последовательно 0,5 н. HCl (10 мл), насыщенным водным раствором бикарбоната натрия (10 мл) и рассолом (10 мл), после чего высушивали над сульфатом магния и концентрировали в вакууме. Остаток растирали с эфиром, получая в результате целевое соединение (0, 90 г). Т. пл. 185-188oC; Rf 0,52 (CHCl3:MeOH 9:1).
Пример 1-2. К раствору N-фенилацетил-L-Leu-D-Trp(CH3)-D-Phe-OCH3 (0,85 г) в ДМФ (7 мл) добавляли при 0oC 1 н. NaOH (1,5 мл). После перемешивания в течение 20 мин при этой же температуре смесь подкисляли 1 н. HCl (2 мл) и концентрировали в вакууме. Остаток растворяли в этилацетате (20 мл) и раствор промывали 0,5 н. HCl (10 мл) и рассолом (10 мл). Органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток растирали с эфиром, получая в результате целевое соединение (0,50 г). Т. пл. 177-185oC; FAB-MS m/z 598 (M + H)+; Rf 0,52 (CHCl3:MeOH AcOH 16:1:1).
Пример 2-1. Проводя реакцию между 3-фенилпропиновой кислотой (33 мг), HCl•H-L-leu-D-Trp(CH3)-D-Phe-OBzI (0,12 г), HOBT (32 мг) и WSCD (37 мг) в ДМФ (2 мл) таким же образом, как это описано в примере 1-1, получали целевое соединение (0,13 г). Т. пл. 218-220oC: Rf 0,74 (CHCl3:MeOH 9:1).
Пример 2-2. N-(3-фенилпропионил)-L-Leu-D-Trp (CH3)-D-Phe-OBzI (0,1 г) в ДМФ (1,5 мл) подвергали гидролизу 1 н. NaOH (0,5 мл) таким же образом, как это описано в примере 1-2. В результате получали целевое соединение (68 мг). Т. пл. 175-180oC; Rf 0,51 (CHCl3:MeOH:AcOH 16:1:1); FAB-M m/z 611 (M + H)+.
Проводя реакцию между циклогексилуксусной кислотой (31 мг), HCl•H-L-Leu-D-Trp (CH3)-D-Phe-OBzI (0,12 г), HOBT (32 мг) и WSCD (37 мг) таким же образом, как это описано в примере 1-1, получали целевое соединение (0,12 г). Т. пл. 191-194oC; Rf 0,74 (CHCl3:MeOH 9:1).
Пример 3-2. Проводя реакцию между N-циклогексилацетил-L-Leu-D-Trp(CH3)-D-Phe-OC2H5 (0,1 г) и 1 н. NaOH в ДМФ (1,5 мл) таким же образом, как это описано в примере 1-2, получали целевое соединение (63 мг). Т. пл. 225-228oC; Rf 0,51 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z 603 (M + H)+.
Пример 4-1. К раствору HCl•H-L-Leu-D- Trp(CH3)-D-Phe-OBzI (120 мг) и Et3N (22 мг) в ДМФ (5 мл) добавляли при комнатной температуре фенилизоцианат (26 мг). Смесь перемешивали при этой же температуре в течение 30 мин, после чего отгоняли растворитель, остаток растворяли в AcOEt (20 мл) и раствор промывали последовательно 5% HCl, 1 M водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Затем его высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток перекристаллизовывали из эфира, получая в результате целевое соединение (115 мг). Т. пл. 222-224oC; Rf 0,77 (CHCl3:MeOH 9:1).
Пример 4-2. Проводя гидролиз N -фенилкарбамоил-L-Leu-D-Trp(CH3)-D-Phe-OBzI (115 мг) в ДМФ (2 мл) 1 н. NaOH (0,3 мл) таким же образом, как это описано в примере 1-2), получали целевое соединение (93 мг). Т. пл. 248-251oC; Rf 0,60 (CHCl3:MeOH:AcOH 16:1:1).
Пример 5-1. Проводя реакцию между HCl•H-L-Leu-D-Trp(CH3)-D-Phe-OBzI (300 мг), Et3N (50,2 мг) и циклогексилизоцианатом (68,2 мг) в ДМФ (10 мл) при комнатной температуре в течение 30 мин таким же образом, как это описано в примере 4-1, получали целевое соединение (325 мг). Т. пл. 218-220oC; Rf 0,67 (CHCl3:MeOH 9:1).
Пример 5-2. Проводя гидролиз N-циклогексилкарбамоил-L-Leu-D-Trp-(CH3)-D-Phe-OBzI (300 мг) в ДМФ (10 мл) 1 н. NaOH (2,2 мл) при комнатной температуре в течение 30 мин таким же образом, как это описано в примере 1-2, получали целевое соединение (246 мг). Т. пл. 219-221oC; Rf 0,52 (CHCl3:MeOH:AcOH 16: 1:1).
Пример 6-1. Проводя реакцию между N - фенацетил-L-Leu-D-Trp(CH3)-OH (0,20 мг), HOBT (72 мг), WSCD (83 мг) и NMM (54 мг) таким же образом, как это описано в примере 3-3, получали целевое соединение (0,21 г). Т. пл. 130 137oC; Rf 0,51 (CHCl3:MeOH 9:1); FAB-MS m/z:626 (M + H)+.
Пример 6-2. Проводя реакцию между N- фенацетил-L-Leu-D -Trp(CH3)-D-Pya-OC2H5•HCl (0,15 г) в ДМФ (2 мл) и 1 н. NaOH (1 мл) при 0oC в течение 20 мин таким же образом, как это описано в примере 1-2, получали целевое соединение (102 мг). Т. пл. 205oC (с разлож.); Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1); FAB-MS m/z:598 (M + H)+.
Пример 7-1. Проводя реакцию между 2HCl•H-L-Leu-D-Trp(CH3)-D-Pua-OC2H5 (350 мг), Et3N (122 мг) и циклогексилизоцианатом (91 мг) в ДМФ (10 мл) при комнатной температуре в течение 30 мин таким же образом, как это описано в примере 4-1, получали целевое соединение (284 мг). Т. пл. 216 218oC; Rf 0,61 (CHCl3:MeOH 9:1).
Пример 7-2. Проводя реакцию между N-циклогексилкарбамоил-L-Leu-D-Trp(CH3)-D-Pya-OC2H5 (230 мг) в MeOH (10 мл) и 1 н. NaOH (1,6 мл) при комнатной температуре в течение часа таким же образом, как это описано в примере 1-2, получали целевое соединение (125 мг). Т. пл. 207 210oC; Rf 0,45 (CHCl3: MeOH:AcOH 8:1:1).
Пример 8 1. Проводя реакцию между N-фенилацетил-L-Leu-D-Trp(CH3)-OH (90 мг), HCl•H-D-Phe-OEt (46 мг), WSCD (33 мг) и HOBT (27 мг) в ДМФ (2 мл) в течение ночи при 5oC, таким же образом, как это описано в примере 1-1, получали целевое соединение (87 мг). Т. пл. 207-209oC; Rf 0,38(CHCl3:AcOEt 3: 1).
Пример 8-2. Проводя реакцию между N-фенацетил-L-Leu-D-Trp(CH3)-D-Phe-OEt (64 мг) в ДМСО (2 мл) и 1 н. NaOH (0,2 мл) при комнатной температуре в течение 2 ч таким же образом, как это описано в примере 1-2, получали целевое соединение (48 мг). Т. пл. 172 - 175oC; Rf 0,30 (CHCl3:MeOH 5:1).
Пример 9. К раствору N-циклогексилкарбамоил-L-Leu-D-Trp(CH3)-D-Pya-OC2H5 (920 мг) в ДМФ (20 мл) добавляли при комнатной температуре 1 н. NaOH (7,3 мл). Через 10 мин к смеси добавляли 1 н. HCl (8,5 мл) и раствор упаривали в вакууме. Остаток растворяли в 1 н. HCl (50 мл) и воде (200 мл) и переносили в колонку с "Diaion HP-20" (торговое название, производство фирмы Mitsubishi Chemical Industries). Элюирование осуществляли MeOH (300 мл). Элюат концентрировали в вакууме. Остаток (750 мг) растворяли в 1 н. NaOH (1,24 мл) и лиофизилировали, получая в результате целевое соединение в виде белого порошка (728 мг); Rf 0,45 (CHCl3:MeOH:AcOH 8:1:1).
Пример 10. Проводя реакцию между N[(1S)-2,2-диметил-1-(N,N-диметилкарбамоил)пропил]карбамоил-L-Leu-OH (0,28 г), H-D-Trp(CH3)-D-Pya-OC2H5•2HCl (0,41 г), HOBT (0,14 г), WSCD (0,16 г) и ТЕА (89 мг) в ДМФ (7 мл) таким же образом, как это описано в примере 1-1, получали целевое соединение (0,40 г). Т. пл. 141 145oC; Rf 0,43 (CHCl3:MeOH 9:1). ЯМР (CDCl3, δ): 0,82 (3H, д, J 6,0 Гц), 0,87 (3H, д, J 6,0 Гц), 1,15 (3H, т, J 6,0 Гц), 1,35 (2H, т, J 6,0 Гц), 1,65 (1H, м), 2,58 (3H, с), 3,06 (3H, с), 3,1 3,3 (4H, м), 3,70 (3H, с), 4,06 (2H, кв, J 6,0 Гц), 4,34 (1H, кв. J 6,0 Гц), 4,75 (1H, д, J 10 Гц), 4,90 (1H, кв. J 6,0 Гц), 5,13 (1 H, кв. J 6,0 Гц), 6,20 (1H, д, J 10,0 Гц), 6,48 (1H, д, J 8,0 Гц), 6,58 (1H, д, J 7,5 Гц), 6,90 (1H, с), 6,95 7,30 (6H, м), 7,56 (1H, тд, J 7,5, 2,0 Гц), 7,65 (1H, д, J 7,5 Гц), 7,98 (1H, д, J 8,0 Гц), 8,34 (1H, д, J 5,0 Гц).
Пример 11. Проводя реакцию между (2S)-2-[N-[(1S)- 2,2-диметил-1-(N,N-диметилкарбамоил] карбамоилокси]-4-метилвалериановой кислотой (0,15 г), H-D-Trp (CH3)-D-Pya- OC2H5•2HCl (0,24 г), HOBT (77 мг), WSCD (88 мг) и NMM (53 мг) в ДМФ (4 мл) таким же образом, как это описано в примере 1-1, получали целевое соединение (0,33 г); Rf 0,73(CHCl3:MeOH 9:1).
Пример 12. Проводя реакцию между N-(гексагидро-1H-азепин-1-илкарбонил)-L-Leu-OH (1,51 г), 2HCl•H-D-Trp(CH3)-D-Pya-OC2H5 (2,50 г), WSCD (997 мг), HOBT (868 мг) и NMM (541 мг) в ДМФ (60 мл) таким же образом, как это описано в примере 1-1, получали целевое соединение (2,16 г); Rf 0,34 (этилацетат).
ЯМР (CDCl3, d): 0,82 (3H, д, J 6,0 Гц), 0,84 (3H, д, J 6,0 Гц), 1,18 (3H, т, J 7,5 Гц), 1,3 1,8 (11 H, м), 3,1 3,5 (7H, м), 3,68 (3H, с), 4,10 (2H, кв, J 7,5 Гц), 4,10 (1H, шир.), 4,7 4,9 (3H, м), 6,68 (1H, д, J 8,0 Гц), 6,96 (1H, с), 7,0-7,3 (5H, м), 7,5 (1H, тд, J 8,0, 2,0 Гц), 7,64 (2H, 1, J 8,0 Гц), 8,28 (1H, д, J 5,0 Гц).
Пример 13. Проводя реакцию между (2P)-2-(гексагидро-1H-азепин-1-карбонилметил)-4-метилвалериановой кислотой (982 мг), 2HCl•H-D-Trp-(CH3)-D-Pya-OC2H5 (1,54 г), WSCD (612 мг), HOBT (532 мг) и ТЕА (332 мг) в ДМФ (30 мл) таким же образом, как это описано в примере 1-1, получали целевое соединение (1,41 г); Rf 0,43 (CHCI3:MeOH 9:1).
Пример 14. Проводя реакцию между N-(октагидроазоцин-1-илкарбонил)-L -Leu-OH (191 мг), 2HCI•H-D-Trp(CH3)-D-Pya-OC2H5 (300 мг), WSCD (120 мг), HOBT (104 мг) и ТЕА (65 мг) в ДМФ (20 мл) таким же образом, как это описано в примере 1-1, получали целевое соединение (340 мг); Rf 0,60 (CHCl3:MeOH 9:1).
Пример 16. К раствору N-(гексагидро-IH-азепин-1-илкарбонил)-L-Leu-D-Trp(CH3)-D-Pya-OC2H5 (37 мг) в этаноле (740 мл) добавляли при охлаждении на ледяной бане 1 н. NaOH (146 мл). После перемешивания в течение 30 мин к реакционной смеси добавляли 1 н. HCl (150 мл) и растворитель отгоняли в вакууме. Остаток растворяли в 1 н. HCl (500 мл) и воде (5000 мл) и пропускали через хроматографическую колонку, заполненную неионогенной адсорбирующей смолой "Diaion HP-20" (3 л). Элюирование осуществляли метанолом (10 л). Элюат затем концентрировали в вакууме и остаток перекристаллизовывали из н-гексана, получая в результате целевое соединение (34,1 г). Т. пл. 113-118oC; Rf 0,34 (CHCl3: MeOH:AcOH 8:1:1).
ЯМР (CDCl3, d) 0,89 (6H, д, J 5,0 Гц), 1,32-1,80 (11H, м), 3,11 (2H, д, J 6,0 Гц), 3,16-3,53 (6H, м,), 3,78 (3H, с), 4,20 (1H, шир.), 4,22-4,48 (1H, м, ) 4,59 (1H, кв, J 6,0 Гц), 4,77 (1H,д, 7,5 Гц), 7,01 (1H, с), 7,04-7,52 (7H, м), 7,71 (1H, д, J 7,0 Гц), 7,82 (1H, т, J 8,0 Гц), 8,48 (1H, д, J 5,0 Гц).
Пример 17. Проводя реакцию между N-(гексагидро-1H-азепин-1-илкарбонил) L-Leu-D-Trp(CH3)-D-Pya-OC2H5 (1,35 г) и 1 н NaOH (6,4 мл) в этаноле (30 мл) таким же образом, как это описано в примере 9, получали целевое соединение (1,08 г); Rf 0,44 (CHCl3:MeOH:AcOH 8:1:1).
ЯМР (ДМСО-d6, d): 0,74 (3H, д, J 3,0 Гц), 0,79 (3H, д, J 3,0 Гц), 1,08-1,67 (11H, м), 2,72-3,12 (3H, м), 3,18-3,38 (5H, м), 3,69 (3H, с), 4,09-4,25 (2H, м), 4,28-4,43 (1H, м), 6,08 (1H, д, J 8,5 Гц), 6,92-7,15 (4H, м), 7,25 (1H, д, J 8,0 Гц), 7,49-7,62 (2H, м), 7,69 (1H, д, J 8,5 Гц), 8,03 (1H, д, J 9,0 Гц), 8,40 (1H, д, J 4,0 Гц).
Пример 18. Проводя реакцию между N-[N[(1S)-2,2-диметил -1-(N,N-диметилкарбамоил)пропил] карбамоил] -L-Leu- D-Trp(CH3)-D-Pya-OC2H5 (0,31 г) и 1 н. NaOH (1,5 мл) в ДМФ таким же образом, как это описано в примере 9, получали целевое соединение (0,25 г); Rf 0,31 (CHCl3:MeOH:AcOH 8:1:1).
ЯМР (ДМСО-d6, d) 0,66 (6H, д, J 6,0 Гц), 0,88 (9H, с), 1,0-1,3 (3H, м), 2,7-3,3 (4H, м), 2,8 (3H, с), 3,68 (3H, с), 4,08 (1H, кв, J 6,0 Гц), 4,20 (1H, кв, J 5,0 Гц), 4,38 (1H, м), 4,50 (1H, д, J 9,0 Гц), 6,37 (1H, д, J 9,0 Гц), 6,48 (1H, д, J 7,5 Гц), 6,9-7,15 (4H, м), 7,2 (1H, д, J 7,5 Гц), 7,2 (1H, д, J 7,5 Гц), 7,45-7,6 (2H, м), 7,66 (1H, д, J 7,5 Гц), 8,28 (1H, д, J 8,0 Гц), 8,38 (1H, д, J 4,0 Гц).
Пример 19. Проводя реакцию между N-[(2S)-2-[N-[(1S)-2,2-диметил -1-(N, N-диметилкарбамоил)пропил] карбамоилокси]-4-метилвалерил]-D-Trp(CH3)-D-Pya-OC2H5 (0,30 г) и 1 н. NaOH (1,3мл) в ДМФ (2,6 мл) таким же образом, как это описано в примере 9, получали целевое соединение (0,26 г); Rf 0,20 (CHCl3: MeOH:AcOH 8:1:1).
ЯМР (ДМСО-d6, d)0,78 (6H, д, J 6,5 Гц), 0,88 (9H, с), 1,2-1,6 (3H, м), 2,7-3,4 (4H, м), 2,83 (3Н, с),3,05 (3H, с), 3,66 (3H, с), 4,16 (Н, кв, J 6,0 Гц), 4,34-4,48 (2H, м), 4,75 (1H, кв, J 3,0 Гц), 6,9-7,7 (1OH, м), 8,16 (1H, д, J 10 Гц), 8,40 (1H, д, J 4,0 Гц).
Примеры 20. Проводя реакцию между N=[(2R)-2-(гексагидро-1H-азепин -1-илкарбонилметил)-4-метилвалерил] -D-Trp(CH3)-D- Pya-OC2H5 (1,10 г) и 1 н. NaOH (5,2 мл) в этаноле (20 мл) таким же образом, как это описано в примере 9, получали целевое соединение (783 мг); Rf 0,49 (CHCl3:MeOH:AcOH 8:1:1).
Пример 21. Проводя реакцию между N-(октагидроазоцин-1-млкарбонил-L -Leu-D-Trp(CH3)-D-Pya-OC2H5 (300 мг) и 1 н NaOH (2,4 мл) в этаноле (10 мл) таким же образом, как это описано в примере 9, получали целевое соединение (210 мг); Rf 0,68 (CHCl3:MeOH-AcOH 8:2:1).
ЯМР (ДМСО-d6, d): 0,75 (6H, д, J 5,5 Гц), 1,02 1,65 (16, м), 2,72 3,32 (5H, м), 3,68 (3H, с), 4,08 4,26 (2H, м), 4,29 4,45 (1H, м), 5,93 (1H, д, J 8,5 Гц), 6,92 7,18 (4H, м), 7,13 (1H, д, J 8,0 Гц), 7,32 (1H, д, J 9,0 Гц), 7,48 7,69 (3H, м), 7,97 (1H, д, J 9,0 Гц), 8,38 (1H, д, J 4,5 Гц).
Пример 22. К раствору N-(гексагидро-1H-азепин-1-илкарбонил-L -Leu-D-Trp(CH3-D-Pya-OC2H5 (800 мг) в этаноле (10 мл) добавляли при охлаждении на ледяной бане 4 н. раствор хлористого водорода в этилацетате (0,63 мл). После перемешивания в течение 5 мин при этой же температуре раствор концентрировали в вакууме, получая в результате целевое соединение (828 мг); Rf 0,64 (CHCl3:MeOH 9:1).
ЯМР (ДМСО-d6, d): 0,71 (3H, д, J 5,0 Гц), 0,77(3H, д, J 5,0 Гц), 1,14(3H, т, J 6,0 Гц), 1,15 1,66 (11H, м), 2,82 (1H, кв, J 11,0 Гц), 3,08 4,18 (8H, м), 3,72 (3H, с), 4,08 (2H, кв, J 7,5 Гц), 4,32 4,48 (1H, м), 4,63 4,80 (1H, м), 6,13 (1H, шир.), 7,02 (2H, т, J 7,0 Гц), 7,13 (1H, т, J 7,5 Гц), 7,37 (1H, д, J 8,0 Гц), 7,57 (1H, д, J 7,5 Гц), 7,82 (2H, т, J 7,0 Гц), 8,22 8,42 (2H, м), 8,78 (2H, д, J 5,0 Гц).
Пример 23. Проводя реакцию между N[(2R)-2-гексагидро-1H-азепин -1-илкарбонилметил)-4-метилвалерил] -D-Trp(CH3)-D-Pya -OC2H5 (300 мг) и 4 н. раствором хлористого водорода в этилацетате (0,36 мл) в этаноле (10 мл) таким же образом, как это описано в примере 22, получали целевое соединение (298 мг); Rf 0,43 (CHCl3:MeOH 9:1).
Подвергая соответствующие исходные соединения II и III взаимодействию таким же образом, как это описано в примере 1-1, получали целевые соединения в соответствии с примерами 24 71.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 24. Т. пл. 193 195oC; Rf 0,49 (CHCl3:MeOH 9:1).
Пример 25. Т. пл. 186-189oC; Rf 0,62 (CHCl3:MeOH 9:1).
Пример 26. Т. пл. 181 183oC; Rf 0,56(CHCl3:MeOH:AcOH 8:1:1).
Пример 27. Rf 0,49(CHCl3:CeOH 9:1).
Пример 28. Rf 0,77 (CHCl3:MeOH 9:1).
Пример 29. Rf 0,77 (CHCl3:MeOH 9:1).
Пример 30. Rf 0,57 (CHCl3:MeOH 9:1).
Пример 31. Rf 0,56 (CHCl3:MeOH 9:1).
Пример 32. Т. пл. 184 185oC; Rf 0,54 (CHCl3:MeOH 9:1).
Пример 33. Rf 0,77 (CHCl3:MeOH 9:1).
Пример 34. Rf 0,43 (CHCl3:MeOH 9:1).
Пример 35. Rf 0,53 (CHCl3:MeOH 9:1).
Пример 36. Rf 0,36 (CHCl3:MeOH 9:1).
Пример 37. Т. пл. 79 81oC; Rf 0,60 (CHCl3:MeOH:AcOH 16:1:1).
Пример 38. Т. пл. 69 71oC; Rf 0,43 (CHCl3:MeOH).
Пример 39. Т. пл. 54 55oC; Rf 0,41 (CHCl3:MeOH 9:1).
Пример 40. Т. пл. 100 105oC; Rf 0,41 (CHCl3:MeOH 9:1).
Пример 41. Rf 0,53 (CHCl3:MeOH 9:1).
Пример 42. Rf 0,55 (CHCl3:MeOH 9:1).
Пример 43. Т. пл. 62 68oC; Rf 0,52 (CHCl3:MeOH 9:1).
Пример 44. Т. пл. 60 67oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 45. Rf 0,58 (CHCl3:MeOH 9:1).
Пример 46. Т. пл. 80 83oC; Rf 0,53 (CHCl3:MeOH 9:1).
Пример 47. Rf 0,55 (CHCl3:MeOH 9:1).
Пример 48. Rf 0,48 (CHCl3:MeOH 9:1).
Пример 49. Т. пл. 140 142oC; Rf 0,43 (CHCl3:MeOH 9:1).
Пример 50. Rf 0,52 (CHCl3:MeOH 9:1).
Пример 51. Т. пл. 135-138oC; Rf 0,31 (CHCl3:MeOH 9:1).
Пример 52. Т. пл. 190-193oC; Rf 0,70 (CHCl3:MeOH 9:1).
Пример 53. Т. пл. 185-188oC; Rf 0,50 (CHCl3:MeOH 9:1).
Пример 54. Т. пл. 170-178oC; Rf 0,48 (CHCl3:MeOH 9:1).
Пример 55. Т. пл. 194-196oC; Rf 0,45 (CHCl3:MeOH 9:1).
Пример 56. Т. пл. 166-167oC; Rf 0,70 (CHCl3:MeOH 9:1).
Пример 57. Т. пл. 110-115oC; Rf 0,59 (CHCl3:MeOH 9:1).
Пример 58. Т. пл. 79-80oC; Rf 0,79 (CHCl3:MeOH 9:1).
Пример 59. Т. пл. 77-79oC; Rf 0,52(CHCl3:MeOH 9:1).
Пример 60. Rf 0,36 (CHCl3:MeOH 9:1).
Пример 61. Rf 0,53 (CHCl3:MeOH 9:1).
Пример 62. Rf 0,53 (CHCl3:MeOH 9:1).
Пример 63. Т. пл. 185-188oC; Rf 0,53 (CHCl3:MeOH 9:1).
Пример 64. Т. пл. 170-175oC; Rf 0,58 (CHCl3MeOH 9:1).
Пример 65. Rf 0,71 (CHCl3:MeOH 9:1).
Пример 66. Т. пл. 183 190oC; Rf 0,60(CHCl3:MeOH 9:1).
Пример 67. Rf 0,70 (CHCL3:MeOH 9:1).
Пример 68. Rf 0,79 (CHCl3:MeOH 9:1).
Пример 69. Т. пл. 159-161oC; Rf 0,62 (CHCl3:MeOH 9:1).
Пример 70. Rf 0.51(CHCl3:MeOH 9:1).
Пример 71. Т. пл. 148-150oC; Rf 0,78 (CHCl3:MeOH 9:1).
Пример 72. К раствору HCl•H-L-Ile-OMe (135 мг) и Et3N (50,2 мг) в сухом толуоле (10 мл) добавляли трихлорметилхлорформиат (0,055 мл). После кипячения раствора с обратным холодильником в течение 30 мин его концентрировали при пониженном давлении. Остаток растворяли в ДМФ (10 мл) и добавляли к нему при комнатной температуре смесь HCl•H-L-Leu-D-Trp(CH3)-D-Phe-OBzI (300 мг) и Et3N (50,2 мг) в ДМФ (10 мл). После перемешивания реакционной смеси в течение часа растворитель удаляли в вакууме. Остаток растворяли в этилацетате (30 мл) и раствор промывали последовательно 5 HCl, 1 M раствором бикарбоната натрия и насыщенным раствором хлорида натрия, высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток перекристаллизовывали из эфира, получая в результате целевое соединение (324 мг). Т. пл. 184-186oC; Rf 0,80 (CHCl3:MeOH 9:1).
Пример 73. К смеси HCl•H-L-Leu-D-Trp(CH3)-D-Phe-OBzI (0,12 г), 4-пиридилуксусной кислоты (38 мг) и NMM (24 мг) в ДМФ (2 мл) добавляли при охлаждении на ледяной бане WSCD (37 мг). После перемешивания в течение 3 ч при комнатной температуре смесь концентрировали в вакууме и остаток растворяли в этилацетате. Раствор промывали последовательно 0,5 н. HCl, водой, насыщенным раствором бикарбоната натрия и водой, высушивали над сульфатом магния и упаривали в вакууме. Остаток растирали с эфиром, получая в результате целевое соединение (107 мг). Т. пл. 122-125oC; Rf 0,46 (CHCl3:MeOH 9:1).
Подвергая соответствующие соединения Ia и IV взаимодействию таким же образом, как это описано в примере 73, получали соединения в соответствии с примерами 74 82.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 74. Т. пл. 105-110oC; Rf 0,50 (CHCl3MeOH 9:1).
Пример 75. Т. пл. 98-108oC; Rf 0,65 (CHCl3MeOH 9:1).
Пример 76. Т. пл. 173-175oC; Rf 0,84 (CHCl3MeOH 9:1).
Пример 77. Т. пл. 196-199oC; Rf 0,79 (CHCl3:MeOH 9:1).
Пример 78. Т. пл. 139-141oC; Rf 0,60 (CHCl3:MeOH:AcOH 8:2:1).
Пример 79. Т. пл. 90-96oC; Rf 0,36 (CHCl3:MeOH 9:1).
Пример 80. Т. пл. 206-209oC; Rf 0,45 (CHCl3:MeOH 9:1).
Пример 81. Т. пл. 124-128oC; Rf 0,56 (CHCl3:MeOH 9:1).
Пример 82. Rf 0,64 (CHCl3:MeOH 9:1).
Пример 83. К смеси бензилсульфонилхлорида (0,18 г) и HCl•N-L-Leu-D-Trp(CH3)-D-Pya-OC2H5 (0,50 г) в ДМФ (10 мл) добавляли при 0oC Et3N (0,42 мл). После завершения реакции раствор упаривали досуха в вакууме. Остаток растворяли в этилацетате и раствор промывали 0,5 н. HCl, высушивали над сульфатом магния и концентрировали в вакууме. Твердый остаток растирали с эфиром, получая в результате целевое соединение (0,29 г). Т. пл. 98-100oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 84. Проводя реакцию между морфолинкарбонилхлоридом (108 мг), 2HCl•H-L-Leu-D-Trp(CH3)-D-Pya-OC2H5 (350 мг) и Et3N (122 мг) таким же образом, как это описано в примере 83, получали целевое соединение. Rf 0,45 (CHCl3MeOH 9:1).
Подвергая соответствующее исходное соединение Ia взаимодействию с производным изоцианата IV таким же образом, как это описано в примере 4-1, получали целевые соединения в соответствии с примерами 85 91.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 85. Т. пл. 222-223oC; Rf 0,79 (CHCl3:MeOH 9:1).
Пример 86. Т. пл. 198-204oC; Rf 0,49 (CHCl3:MeOH 9:1).
Пример 87. Т. пл. 205-206oC; Rf 0,46 (CHCl3: MeOH 9:1).
Пример 88. Т. пл. 216-218oC; Rf 0,45 (CHCl3:MeOH 9:1).
Пример 89. Т. пл. 188-202oC; Rf 0,53 (CHCl3:MeOH 9:1).
Пример 90. Т. пл. 167-172oC; Rf 0,53 (CHCl3:MeOH 9:1).
Пример 91. Т. пл. 163-167oC; Rf 0,53 (CHCl3:MeOH 9:1).
Пример 92. К смеси N-циклогексилкарбамоил-L-Leu D-Trp(CH3)-OH (0,40 г), H-D-4-Pya-OC2H5•2HCl (0,26 г), NMM (0,10 г) и HOBT (0,14 г) в ДМФ (8 мл) добавляли при охлаждении на ледяной бане WSCD (0,16 г). После перемешивания при комнатной температуре смесь концентрировали в вакууме и остаток растворяли в этилацетате. Раствор промывали последовательно 0,5 н. HCl, водой, насыщенным раствором бикарбоната натрия и водой, высушивали над сульфатом магния и упаривали в вакууме. Остаток растирали с эфиром, получая в результате целевое соединение (0,45 г). Т. пл. 182-186C; Rf 0,32 (CHCl3:MeOH: AcOH 16:1:1).
Путем взаимодействия исходных соединений V и VI, проводимого таким же образом, как это описано в примере 92, получали целевые соединения в соответствии с примерами 93 98.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 93. Т. пл. 170-173oC; Rf 0,43 (CHCl3:MeOH 9:1).
Пример 94. Т. пл. 181-182oC; Rf 0,71 (CHCl3:MeOH 9:1).
Пример 95. Т. пл. 197-198oC; Rf 0,70 (CHCl3:MeOH 9:1).
Пример 96. Т. пл. 115-123oC; Rf 0,74 (CHCl3:MeOH 9:1).
Пример 97. Т. пл. 148-156oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 98. Т. пл. 154-158oC; Rf 0,51 (CHCl3:MeOH 9:1).
Путем гидролиза соответствующего этилового эфира (Ic) водным раствором NaOH, проводимого таким же образом, как это описано в примерах 1-2, 9 или 16, были получены целевые соединения в соответствии с примерами 99 145.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 99. Т. пл. 167-170oC; Rf 0,44 (CHCl3:MeOH:AcOH 8:1:1).
Пример 100. Т. пл. 173-178oC; Rf 0,62 (CHCl3:MeOH:AcOH 8:1:1).
Пример 101. Т. пл. 150-155oC; Rf 0.25 (CHCl3:MeOH:AcOH 8:1:1).
Пример 102. Rf 0,51 (CHCl3:MeOH:AcOH 8:1:1).
Пример 103. Rf 0,69 (CHCl3:MeOH:AcOH 8:1:1).
Пример 104. Rf 0,66 (CHCl3:MeOH:AcOH 8:2:1).
Пример 105. Rf 0,78 (CHCl3:MeOH:AcOH 8:2:1).
Пример 106. Rf 0.57 (CHCl3:MeOH:AcOH 8:1:1).
Пример 107. Rf 0,52 (CHCl3:MeOH:AcOH 8:1:1).
Пример 108. Rf 0,72 (CHCl3:MeOH:AcOH 8:1:1).
Пример 109. Rf 0,56 (CHCl3:MeOH:AcOH 20:20:1).
Пример 110. Rf 0,32 (CHCl3:MeOH:AcOH 8:1:1).
Пример 111. Rf 0,31 (CHCl3:MeOH:AcOH 8:1:1).
Пример 112. Т. пл. 150-155oC; Rf 0,29 (CHCl3:MeOH:AcOH 8:2:1).
Пример 113. Rf 0,31 (CHCl3:MeOH:AcOH 8:1:1).
Пример 114. Rf 0,31 (CHCl3:MeOH:AcOH 8:1:1).
Пример 115. Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1).
Пример 116. Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1).
Пример 117. Rf 0,34 (CHCl3:MeOH:AcOH 8:1:1).
Пример 118. Rf 0,32 (CHCl3:MeOH:AcOH 8:1:1).
Пример 119. Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1).
Пример 120. Rf 0,38 (CHCl3:MeOH:AcOH 8:1:1).
Пример 121. Rf 0,34 (CHCl3:MeOH:AcOH 8:1:1).
Пример 122. Rf 0,35 (CHCl3:MeOH:AcOH 8:1:1).
Пример 123. Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1).
Пример 124. Rf 0,31 (CHCl3:MeOH:AcOH 8:1:1).
Пример 125. Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1).
Пример 126. Rf 0,28 (CHCl3:MeOH:AcOH 8:1:1).
Пример 127. Rf 0,30 (CHCl3:MeOH:AcOH 8:1:1).
Пример 128. Rf 0,32 (CHCl3:MeOH:AcOH 8:1:1).
Пример 129. Rf 0,29 (CHCl3:MeOH:AcOH 8:1:1).
Пример 130. Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1).
Пример 131. Rf 0,29 (CHCl3:MeOH:AcOH 8:1:1).
Пример 132. Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1).
Пример 133. Rf 0,31 (CHCl3:MeOH:AcOH 8:1:1).
Пример 134. Rf 0,37 (CHCl3:MeOH:AcOH 8:1:1).
Пример 135. Rf 0,46 (CHCl3:MeOH:AcOH 8:1:1).
Пример 136. Rf 0,24 (CHCl3:MeOH:AcOH 8:1:1).
Примнр 137. Rf 0,38 (CHCl3:MeOH:AcOH 8:1:1).
Пример 138. Rf 0,29 (CHCl3:MeOH:AcOH 8:1:1).
Пример 139. Rf 0,32 (CHCl3MeOH:AcOH= 8:1:1).
Пример 140. Rf 0,31 (CHCl3:MeOH:AcOH 8:1:1).
Пример 141. Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1).
Пример 142. Rf 0,53 (CHCl3:MeOH:AcOH= 8:1:1).
Пример 143. Rf 0,57 (CHCl3:MeOH:AcOH 8:1:1).
Пример 144. Rf 0,50 (CHcl3:MeOH:AcOH 8:1:1).
Пример 145. Rf 0,62 (CHCl3:MeOH:AcOH 8:1:1).
ЯМР (ДМСО-d6, d): 0,54 (3H, д, J 6,0 Гц), 0,64 (3H, д, J 6,0 Гц), 0,72-1,02 (2H, м), 1,10-1,72 (13H, м), 2,2 4,04-4,010 (1H, м), 4,24-4,40 (IH, м), 6,94-7,18 (4H, м), 7,20-7,42 (2H, м), 7,46-7,68 (3H, м), 8,30 (1H, д, J 7,5 Гц), 8,41 (1H, д, J 4,0 Гц).
Путем гидролиза соответствующих бензиловых эфиров (Iс) водным раствором NaOH, проводимого таким же образом, как это описано в примерах 1-2, 9 или 16, были получены целевые соединения в соответствии с примерами 146-151.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 146. Т. пл. 120-124oC; Rf 0,85 (CHCl3:MeOH:AcOH 8:1:1).
Пример 147. Т. пл. 220-236oC; Rf 0,16 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 598 (M + H)+.
Пример 148. Т. пл. 214-218oC; Rf 0,20 (CHCl3:MeOH:AcOH 16:1:1); FAB MS m/z: 598 (M + H)+.
Пример 149. Т. пл. 174-180oC; Rf 0,32 (CHCl3:MeOH:AcOH 16:1:1); FAB MS m/z: 598 (M + H)+.
Пример 150. Т. пл. 194oC (с разлож.); Rf 0,51 (CHCl3:MeOH:AcOH 16:1:1); FAB MS m/z; 711 (M + H)+.
Пример 151. Т. пл. 195oC (разлож.); Rf 0,51 (CHCl3:MeOH:AcOH 16:1:1); FAB MS m/z: 711 (M + H)+.
Путем гидролиза соответствующих этиловых эфиров (Iс) водным раствором NaOH, проводимого таким же образом, как это описано в примерах 1-2, 9 или 16, были получены целевые соединения в соответствии с примерами 152-157.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 152. Т. пл. 127-145oC; Rf 0,29 (CHCl3:MeOH:AcOH 8:2:1); FAB MS m/z: 672 (M + H)+.
Пример 153. Rf 0,36 (CHCl3:MeOH:AcOH 8:1:1).
Пример 154. Rf 0,38 (CHCl3:MeOH:AcOH 8:1:1).
Пример 155. Rf 0,35 (CHCl3:MeOH:AcOH 8:1:1).
Пример 156. Rf 0,32 (CHCl3:MeOH:AcOH 8:1:1).
Пример 157. Rf 0,45 (CHCl3:MeOH:AcOH 8:1:1).
Пример 158. Изопропилкарбамоил-L-Leu-D-Trp(CH3)-D-Phe-OBzI (60 мг) подвергали взаимодействию с 1 н. NaOH (2 мл) в ДМФ (2 мл) при комнатной температуре в течение 30 мин таким же образом, как это описано в примере 1-1/2. В результате получили целевое соединение (48 мг). Т. пл. 211-213oC; Rf 0,54 (CHCl3:MeOH:AcON 16:1:1).
Путем гидролиза соответствующих этиловых эфиров (Iс) водным раствором NaOH, проводимого таким же образом, как это описано в примере 9, получали целевые соединения в соответствии с примерами 159-166.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 159. Т. пл. >250oC; Rf 0,12 (CHCl3:MeOH:AcON 16:1:1).
Пример 160. Т. пл. >250oC; Rf 0,10 (CHCl3: MeOH:AcOH 16:1:1).
Пример 161. Т. пл. >250oC; Rf 0,12 (CHCl3:MeOH:AcOH 16:1:1).
Пример 162. Т. пл. >250oC; Rf 0,13 (CHCl3:MeOH:AcOH 16:1:1).
Пример 163. Т. пл. 245oC (с разлож.); Rf CHCl3:MeOH:AcOH 16:1:1).
Пример 164. Т. пл. >250oC; Rf 0,13 (CHCl3:MeOH:AcOH 16:1:1).
Пример 165. Rf 0,37 (CHCl3:MeOH:AcOH 8:1:1).
Пример 166. Rf 0,33 (CHCl3:MeOH:AcOH 8:1:1).
Путем гидролиза соответствующих бензиловых эфиров (Iс) водным раствором NaOH, проводимого таким же образом, как это описано в примере 1-2 или 16, были получены целевые соединения в соответствии с примерами 167-169.
Ниже приведены физико-химический свойства этих целевых соединений.
Пример 167. Т. пл. 171-174oC; Rf 0,51 (CHCl3:MeON:AcOH 16:1:1:); FAB MS m/z: 563 (M + H)+.
Пример 168. Т. пл. 165-175oC; Rf 0,51 (CHCl3:MeOH:AcOH 16:1:1); FAB MS m/z: 549 (M + H)+.
Пример 169. Т. пл. 132-135oC; Rf 0,31 (CHCl3:MeOH:28%-ный водный раствор аммиака 65:25:4).
Пример 170. Проводя гидролиз N-фенацетил-L - Leu-D-Trp(CH3)-D-4-тиазолилаланин•HCl 1 н. NaOH таким же образом, как это описано в примере 1-2, получали целевое соединение. Т. пл. 112-116oC; Rf 0,33 (CHCl3:MeOH:AcOH 8:1: 1); FAB MS m/z: 604 (C + H)+.
Пример 171. Проводя гидролиз N-циклогексилкарбонил-L-Leu-D-Trp (CH3)-D-Pya-OC2H5 (0,25 г) 1 н. NaOH (1 мл) в ДМФ (3 мл) таким же образом, как это описано в примере 9, получали целевое соединение (0,16 г). Rf 0,36 (CHCI3: MeOH:AcOH 8:1:1).
Пример 172. N-фенилацетил-L-Leu-D-Trp(CHO)-D-Phe-OPac (0,20 г) растворяли в смеси ДМФ (2мл) и уксусной кислоты (2 мл) и добавляли к полученному раствору при комнатной температуре порошок цинка (0,20 г). После перемешивания в течение 3 ч при этой же температуре смесь фильтровали и концентрировали в вакууме. Остаток растворяли в этилацетате, раствор промывали 0,5 н. HCl, высушивали над сульфатом магния и концентрировали в вакууме. Остаток растирали с эфиром, получая в результате целевое соединение (0,16 г). Т. пл. 230oC(с разлож); Rf 0,51 (CHCl3:MeOH:AcOH16:1:1); FAB MS m/z: 611.
Пример 173. Проводя реакцию между Boc-D-AlloIle-L-Leu-D-Trp (CHO)-D-Phe-OPac (0,16 г), цинковым порошком (0,16 г) и уксусной кислотой (1,6 мл) в ДМФ (1,6 мл) таким же образом, как это описано в примере 172, получали целевое соединение (0,11 г). Т. пл. 197oC (с разлож.); Rf 0,49 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 707.
Пример 174. Раствор N-[1(S)-метоксикарбонил-2(S)-метилбутилкарбамоил]-L-Leu-D-Trp(CH3)-D-Phe-OBzI (270 мг) в ДМФ (20 мл) и воде (1 мл) подвергали гидрированию в присутствии 10-ного Pd на угле при давлении водорода 3 ат в течение часа при комнатной температуре. После этого раствор фильтровали, фильтрат концентрировали в вакууме, остаток перекристаллизовывали из этилацетата и эфира, получая в результате целевое соединение (198 мг). Т. пл. 210-212oC; Rf 0,48 (CHCl3:MeOH:AcOH 16:1:1).
Пример 175. Проводя реакцию между N -[1(S) - метоксикарбонил-2(S)-метилбутилкарбамоил] -L-Leu-D-Trp(CH3)-D-Phe-OBzI (70 мг) и 1 н. NaOH (1 мл) в ДМФ (2 мл) таким же образом, как это описано в примере 1-2, получали целевое соединение (50 мг). Т. пл. 221-225oC; Rf 0,42 (CHCl3:MeOH:AcOH 16:1:1).
Пример 176. К раствору циклогексанола (0,10 мл) и тетрагидрофуране (3 мл) добавляли при комнатной температуре трихлорметилхлорформиат (0,13 мл). Раствор кипятили в течение 11 ч с обратным холодильником, после чего отгоняли растворитель в вакууме. Остаток в виде маслянистой жидкости растворяли в ДМФ (10 мл) и добавляли к раствору 2HCl•H-Leu-D-Trp(CH3-D-Pya-OEt(0,50 г). pH смеси с помощью NMM (примерно 0,2 г) устанавливали равным примерно 7. Через 10 мин растворитель отгоняли в вакууме, остаток растворяли в этилацетате (20 мл), раствор промывали последовательно 1 н. HCl, насыщенным раствором бикарбоната натрия и рассолом, высушивали над сульфатом магния и концентрировали в вакууме. Твердый остаток растирали с этиловым эфиром, получая в результате целевое соединение (0,29 г). Т. пл. 128-130oC; Rf 0,50(CHCl3:MeOH 9: 1).
Пример 177. К раствору N-фенилацетил-L-Leu-D - Trp(CH3)-D-His(ToS)-OBzI (78 мг) в ДМФ добавляли при комнатной температуре пиридингидрохлорид (0,15 г). После перемешивания в течение 2 ч растворитель отгоняли в вакууме, остаток растворяли в этилацетате (20 мл), раствор промывали 1 M раствором бикарбоната натрия, высушивали над сульфатом магния и упаривали в вакууме, получая в результате целевое соединение (845 мг). Т. пл. 118-126oC; Rf 0,28 (CHCl3:MeOH 9:1).
Пример 178. Проводя реакцию между Boc-D - фенилглицил-L-leu-D-Trp(CH3)-D-Phe-OH (0,1г), трифторуксусной кислотой (1,5 мл) и анизолом (0,2 мл) таким же образом, как это описано в примере 1-2), получали соединение (90 мг). Т. пл. 135-165oC; Rf 0,20 (CHCl3:MeOH:AcOH 16:1:1:); FAB-MS m/z: 612 (M + H)+.
Пример 179. Проводя реакцию между Boc-L- фенилглицил-L-Leu-D-Trp(CH3)-D-Phe-OH(0,11 г), TEA (1,5 мл) и анизолом (0,2 мл) таким же образом, как это описано в примере 1-2, получали целевое соединение (107 г). Т. пл. 145-170oC; Rf 0,20 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 612 (M + H)+.
Пример 180. Путем взаимодействия соответствующих исходных соединений II и III, проводимого таким же образом, как это описано в примере 1-1, получали целевое соединение. Т. пл. 197-202oC; Rf 0,52 (CHCl3:MeOH 9:1).
Путем взаимодействия соответствующих исходных соединений II и III, проводимого таким же образом, как это описано в примере 1-1, предпочтительно в присутствии подходящего основания, получали целевые соединения в соответствии с примерами 181-215.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 216. К смеси фенацетилхлорида (0,27 г) и HCl•H-L-Leu-D-Trp-(CHO)-bAla-OPac (0.94 г) в ДМФ (10 мл ) добавляли при 0oC триэтиламин (0,54 мл). Через 30 мин растворитель отгоняли в вакууме, остаток растворяли в этилацетате (50 мл), раствор промывали 0,5 н соляной кислотой (30 мл), высушивали над сульфатом магния и концентрировали в вакууме. Твердый остаток растирали с этиловым эфиром, получая в результате целевое соединение (0,93 г). Т. пл. 163-171oC; Rf 0,45 (хлороформ:метанол 9:1).
Путем взаимодействия соответствующих исходных соединений Ia и IV, проводимого таким же образом, как это описано в примере 73, получали целевые соединения в соответствии с примерами 217 244.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 217. Т. пл. 152-153oC; Rf 0,48 (CHCl3:MeOH 9:1).
Пример 218. Т. пл. 180-181,5oC; Rf 0,57 (CHCl3:MeOH 9:1).
Пример 219. Т. пл. 197-199oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 220. Т. пл. 76-79oC; Rf 0,54 (CHCl3:MeOH 9:1).
Пример 221. Т. пл. 154-160oC; Rf 0,64 (CHCl3:MeOH 9:1).
Пример 222. Т. пл. 98-103oC; Rf 0,52 (CHCl3:MeOH 9:1).
Пример 223. Т. пл. 171-174oC; Rf 0,40 (CHCl3:MeOH 9:1).
Пример 224. Т. пл. 150-153oC; Rf 0,52 (CHCl3:MeOH 9:1).
Пример 225. Т. пл. 170-172oC Rf 0,53 (CHCl3:MeOH 9:1).
Пример 226. Т. пл.159-168oC Rf 0,38 (CHCl3:MeOH 9:1).
Пример 227. Т. пл. 77-88oC Rf 0,52 (CHCl3:MeOH 9:1).
Пример 228. Т. пл. 158-162oC Rf 0,55 (CHCl3:MeOH 9:1).
Пример 229. Т. пл. 191-193oC; Rf 0,43 (CHCl3:MeOH 9:1).
Пример 230. Т. пл. 158-162oC; Rf 0,43 (CHCl3:MeOH 9:1).
Пример 231. Т. пл. 123-126oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 232. Т. пл. 145-146oC; Rf 0,60 (CHCl3:MeOH 9:1).
Пример 233. Т. пл. 168-170oC; Rf 0,72 (CHCl3:MeOH 9:1).
Пример 234. Т. пл. 180-183oC; Rf 0,59 (CHCl3:MeOH 9:1).
Пример 235. Т. пл. 196-204oC; Rf 0,49 (CHCl3:MeOH 9:1).
Пример 236. Т. пл. 221-226oC; Rf 0,49 (CHCl3:MeOH 9:1).
Пример 237. Rf 0,47 (CHCl3:MeOH 9:1).
Пример 238. Т. пл. 198-199oC; Rf 0,65 (CHCl3:MeOH 9:1).
Пример 239. Т. пл. 104-107oC; Rf 0,59 (CHCl3:MeOH 9:1).
Пример 240. Т. пл. 228-230oC; Rf 0,57 (CHCl3:MeOH 9:1).
Пример 241. Т. пл. 196-199oC; Rf 0,53 (CHCl3:MeOH 9:1).
Пример 242. Т. пл. 207-212oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 243. Т. пл. 186-190oC; Rf 0,49 (CHCl3:MeOH 9:1).
Пример 244. Rf 0,49 (CHCl3:MeOH 9:1).
Путем взаимодействия соответствующих исходных соединений V и VI, проводимого таким же образом, как это описано в примере 92, получали целевые соединения в соответствии с примерами 245 263.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 245. Т. пл.145-148oC; Rf 0,68 (CHCl3:MeOH 9:1).
Пример 246. Т. пл. 156-160oC; Rf 0,56 (CHCl3:MeOH 9:1).
Пример 247. Т. пл. 143-147oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 248. Т. пл. 106-110oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 249. Т. пл. 116-119oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 250. Т. пл. 140-143oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 251. Т. пл. 156-160oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 252. Т. пл. 128-130oC; Rf 0,76 (CHCl3:MeOH:AcOH 8:1:1).
Пример 253. Т. пл. 120-130oC; Rf 0,85 (CHCl3:MeOH:AcOH 8:1:1).
Пример 254. Т. пл. 145-148oC; Rf 0,88 (CHCl3:MeOH:AcOH 8:2:1).
Пример 255. Т. пл. 165-167oC; Rf 0,91 (CHCl3:MeOH:AcOH 8:2:1).
Пример 256. Rf 0,37 CHCl3:MeOH:AcOH 8:1:1).
Пример 257. Rf 0,56 (CHCl3:MeOH 19:1).
Пример 258. Rf 0,45 (CHCl3:MeOH 19:1).
Пример 259. Т. пл. 69-70oC; Rf 0,53 (CHCl3:MeOH 9:1).
Пример 260. Rf 0,45 (CHCl3:MeOH 19:1).
Пример 261. Rf 0,71 (CHCl3:MeOH 9:1).
Пример 262. Т. пл. 120-130oC; Rf 0,85 (CHCl3:MeOH:AcOH 8:1:1).
Пример 263. Т. пл. 120-122oC; Rf 0,72 (CHCl3:MeOH 9:1).
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 264. К раствору N-фенилацетил-L-Leu-D-Trp(Me)-D-Lyz-(Z)-OBzI (0,10 г) в ДМФ (2 мл) добавляли при комнатной температуре 10-ный палладий на активированном угле (30 мг) и формиат аммония (0,2 г). Через 3 ч суспензию фильтровали и фильтрат упаривали в вакууме. Остаток растворяли в 1 н. соляной кислоте (1 мл) и подвергали очистке с помощью колоночной хроматографии на "Diaion HP-20" (торговое название, изготовитель: фирма Mitsubishi Chemical Industries), используя в качестве элюента MeOH. После лиофилизации получали целевое соединение (57,4 мг). Т. пл. 142 160oC; Rf 0,26 (хлороформ:метанол: 28-ный водный раствор аммиака 5:3:1), FAB-MS m/z: 578 (M+H).
Пример 265. Проводя реакцию между N-фенилацетил-L-Leu-D-Trp(CHO)-бета-Ala-OH (0,38 г) и 1 н. NaOH в ДМФ (10 мл) таким же образом, как это описано в примере 1-2, получали целевое соединение (0,23 г). Т. пл. 85 95oC; Rf 0,48 (хлороформ:метанол:уксусная кислота 16:1:1), FAB-MS m/z: 578 (M+H).
Пример 266. Проводя реакцию между N-фенилацетил-L-His(Tos)-D-Trp(CHO)-бета-Ala-OMe (0,32 г) и пиридингидрохлоридом в ДМФ (6 мл) таким же образом, как это описано в примере 177, получали целевое соединение (0,20 г). Т. пл. 160 166oC; Rf 0,30 (10% MeOH в CHCl3).
Пример 267. Проводя реакцию между Boc-D-alloIle-L-Leu-D-Trp-D-Pya-OEt (2,0 г) и 4 н. HCl в диоксане (35 мл) таким же образом, как это описано в примере 1-2, получали целевое соединение (1,82 г); Rf 0,62 (CHCl3:MeOH:AcOH 8:2:1).
Пример 268. Проводя реакцию между Boc-D-alloIle-L-Leu-D-Trp-(CHO)-D-Glu(OBzI)-OH (0,67 г), TFA (10 мл) и анизолом (1 мл), таким же образом, как это описано в примере 1-2, получали целевое соединение (0,60 г). Т. пл. 85-100oC; Rf 0,16 (хлороформ:метанол:уксусная кислота 16:1:1); FAB-MS m/z: 679 (M+H).
Путем взаимодействия соответствующих Рас-эфиров (Iс), цинкового порошка, уксусной кислоты и ДМФ, проводимого таким же образом, как это описано в примере 172, получали целевые соединения в соответствии с примерами 269 292 и 349.
Целевые соединения в соответствии с примерами 293 294, 297 330, 333 - 345, 347 348 и 350 355 были получены путем взаимодействия соответствующих метиловых, этиловых, бензиловых или Рас-эфиров (Iс) с водным раствором NaOH, проводимого таким же образом, как это описано в примерах 1-2, 9 и 16.
Целевые соединения в соответствии с примерами 295 296 и 331 332 были получены путем гидрирования соответствующих бензиловых эфиров (Iс), проводимого таким же образом, как это описано в прописи 1-4. Пример 346
Проводя реакцию между N-(e-капролактам-3 иламинокарбонил)-L-Leu-OH (298 мг), 2HCl•H-D-Trp(Me)-D-Pya-OEt (400 мг), WSCD (159 мг), HOBt (139 мг), Et3N (87 мг) и ДМФ (10 мл) таким же образом, как это описано в примере 1-1, получали целевое соединение (411 мг).
Ниже приведены физико-химические свойства целевых соединений в соответствии с примерами 269 355.
Пример 269. Т. пл. 165-168oC; Rf 0,52 (CHCl3:MeOH:AcOH 16:1:1).
Пример 270. Т. пл. 152-157oC; Rf 0,41 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 683 (M+H).
Пример 271. Т. пл. 150-153oC; Rf 0,52 (CHCl3:MeOH:AcOH 16:2:1); FAB-MS m/z: 719 (M+H).
Пример 272. Т. пл. 196-199oC; Rf 0,52 (CHCl3:MeOH:AcOH 16:2:1); FAB-MS m/z: 719 (M+H).
Пример 273. Т. пл. 90-100oC; Rf 0,50 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 649 (M+H).
Пример 274. Т. пл. 140-148oC; Rf 0,50 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 708 (M+H).
Пример 275. Т. пл. 95-105oC; Rf 0,44 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 670 (M+H).
Пример 276. Т. пл. 183-185oC; Rf 0,36 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 671 (M+H).
Пример 277. Т. пл. 145-150oC; Rf 0,46 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 664 (M+H).
Пример 278. Т. пл. 205-207oC; Rf 0,49 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 675 (M+H).
Пример 279. Т. пл. 90-130oC; Rf 0,41 (CHCl3:MeOH:AcOH 8:1:1).
Пример 280. Т. пл. 89-120oC Rf 0,40 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 678 (M+H).
Пример 281. Т. пл. 145-150oC; Rf 0,51 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 663 (M+H).
Пример 282. Т. пл. 165-170oC; Rf 0,49 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 733 (M+H).
Пример 283. Т. пл. 156-160oC; Rf 0,47 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 733 (M+H).
Пример 284. Т. пл. 165-200oC; Rf 0,29 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 616 (M+H).
Пример 285. Т. пл. 137-142oC; Rf 0,46 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 644 (M+H).
Пример 286. Т. пл. 155-157oC; Rf 0,48 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 658 (M+H).
Пример 287. Т. пл. 111-128oC; Rf 0,48 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 673 (M+H).
Пример 288. Т. пл. 80-108oC; Rf 0,47 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 817 (M+H).
Пример 289. Т. пл. 110-113oC; Rf 0,49 (CHCl3:MeOH:AcOH 16:1:1).
Пример 290. Т. пл. 196oC (dec. ); Rf 0,52 (CHCl3:MeOH:AcOH 16:1:1); FAB-MS m/z: 535 (M+H).
Пример 291. Т. пл. 165-169oC; Rf 0,45 (CHCl3:MeOH:AcOH=16:1:1); FAB-MS m/z: 630 (M+H).
Пример 292. Rf 0,32 (CHCl3:MeOH:AcOH 8:1:1).
Пример 293. Rf 0,32 (CHCl3:MeOH:AcOH 8:1:1).
Пример 294. Rf 0,68 (CHCl3:MeOH:AcOH 8:2:1).
Пример 295. Т. пл. 188-190oC; Rf 0,31 (CHCl3:MeOH:AcOH 8:1:1).
Пример 296. Т. пл. 202-205oC; Rf 0,29 (CHCl3:MeOH:AcOH 8:1:1).
Пример 297. Rf 0,10 (CHCl3:MeOH:AcOH 8:1:1).
Пример 298. Rf 0,07 (CHCl3:MeOH:AcOH 8:1:1).
Пример 299. Rf 0,10 (CHCl3:MeOH:AcOH 8:1:1).
Пример 300. Rf 0,09 (CHCl3:MeOH:AcOH 8:1:1).
Пример 301. Rf 0,11 (CHCl3:MeOH:AcOH 8:1:1).
Пример 302. Rf 0,25 (CHCl3:MeOH:AcOH 8:1:1).
Пример 303. Rf 0,22 (CHCl3:MeOH:AcOH 16:1:1)
Пример 304. Rf 0,29 (CHCl3:MeOH:AcOH 8:1:1).
Пример 305. Rf 0,33 (CHCl3:MeOH:AcOH=8:2:1)
Пример 306. Rf 0,45 (CHCl3:MeOH:AcOH 8:2:1)
Пример 307. Rf 0,29 (CHCl3:MeOH:AcOH 8:1:1).
Пример 308. Rf 0,33 (CHCl3:MeOH:AcOH 8:2:1).
Пример 309. Rf 0,53 (CHCl3:MeOH:AcOH 8:1:1).
Пример 310. Rf 0,28 (CHCl3:MeOH:AcOH 8:2:1).
Пример 311. Rf 0,25 (CHCl3:MeOH:AcOH 8:1:1).
Пример 312. Rf 0,62 (CHCl3:MeOH:AcOH 8:2:1).
Пример 313. Rf 0,64 (CHCl3:MeOH:AcOH 8:2:1).
Пример 314. Rf 0,46 (CHCl3:MeOH:AcOH 8:2:1).
Пример 315. Т. пл. 248oC (dec); Rf (CHCl3:MeOH:AcOH 8:1:1).
Пример 316. Rf 0,32 (CHCl3:MeOH:AcOH 8:1:1).
Пример 317. Т. пл. 142-147oC; Rf 0,34 (CHCl3:MeOH:AcOH 8:1:1).
Пример 318. Rf 0,31 (CHCl3:MeOH:AcOH 8:1:1).
Пример 319. Rf 0,37 (CHCl3:MeOH:AcOH 8:1:1).
Пример 320. Rf 0,37 (CHCl3:MeOH:AcOH 8:1:1).
Пример 321. Rf 0,20 (CHCl3:MeOH:AcOH 8:2:1).
Пример 322. Rf 0,32 (CHCl3:MeOH:AcOH 8:1:1).
Пример 323. Rf 0,36 (CHCl3:MeOH:AcOH 8:1:1).
Пример 324. Rf 0,36 (CHCl3:MeOH:AcOH 8:1:1).
Пример 325. Rf 0,36 (CHCl3:MeOH:AcOH 8:1:1).
Пример 326. Rf 0,54 (CHCl3:MeOH:AcOH 8:2:1).
Пример 327. Rf 0,54 (CHCl3:MeOH:AcOH 8:2:1).
Пример 328. Rf 0,53 (CHCl3:MeOH:AcOH 8:2:1).
Пример 329. Rf 0,53 (CHCl3:MeOH:AcOH 8:2:1).
Пример 330. Rf 0,53 (CHCl3:MeOH:AcOH 8:2:1).
Пример 331. Т. пл. 205-208oC; Rf 0,27 (CHCl3:MeOH:AcOH 8:1:1).
Пример 332. Т. пл. 200-210oC; Rf 0,34 (CHCl3:MeOH:AcOH 8:1:1).
Пример 333. Т. пл. 146-150oC; Rf 0,74 (CHCl3:MeOH:AcOH 8:1:1).
Пример 334. Т. пл. 138-141oC; Rf 0,70 (CHCl3:MeOH:AcOH 8:1:1).
Пример 335. Т. пл. 80-90oC; Rf 0,42 (CHCl3:MeOH:AcOH 16:1:1); Rf 0,72 (CHCl3:MeOH:AcOH 8:1:1).
Пример 336. Rf 0,61 (CHCl3:MeOH:AcOH 16:1:1).
Пример 337. Т. пл. 103-110oC; Rf 0,46 (CHCl3:MeOH:AcOH 16:1:1).
Пример 338. Т. пл. 128-137oC; Rf 0,47 (CHCl3:MeOH:AcOH 8:1:1).
Пример 339. Т. пл. 105-115oC Rf 0,48 (CHCl3:MeOH:AcOH 16:1:1).
Пример 340. Т. пл. 133-136oC; Rf 0,47 (CHCl3:MeOH:AcOH 8:1:1).
Пример 341. Т. пл. 158-162oC; Rf 0,42 (CHCl3:MeOH:AcOH 8:1:1).
Пример 342. Rf 0,64 (CHCl3:MeOH:AcOH 8:1:1).
Пример 343. Rf 0,56 (CHCl3:MeOH:AcOH 8:1:1).
Пример 344. Rf 0,30 (CHCl3:MeOH 9:1).
Пример 345. Rf 0,41 (CHCl3:MeOH:AcOH 8:2:1).
Пример 346. Т. пл. 210-212oC; Rf 0,44 (CHCl3:MeOH 9:1).
Пример 347. Rf 0,50 (CHCl3:MeOH:AcOH 8:2:1).
Пример 348. Т. пл. 129-135oC; Rf 0,37 (CHCl3:MeOH:AcOH 8:1:1).
Пример 349. Т. пл. 91-113oC; Rf 0,53 (CHCl3:MeOH:AcOH 16:1:1).
Пример 350. Т. пл. 162-167oC; Rf 0,12 (CHCl3:MeOH:AcOH 8:2:1).
Пример 351. Т. пл. 133-140oC; Rf 0,52 (CHCl3:MeOH:AcOH 8:1:1).
Пример 352. Т. пл. 208-210oC; Rf 0,72 (CHCl3:MeOH:AcOH 8:1:1).
Пример 353. Т. пл. 113-123oC; Rf 0,72 (CHCl3:MeOH:AcOH 8:1:1).
Пример 354. Т. пл. 160-164oC; Rf 0,80 (CHCl3:MeOH:AcOH 8:1:1).
Пример 355. Rf 0,30 (CHCl3:MeOH:AcOH 8:1:1).
Целевые соединения в соответствии с примерами 356 374, 376 377, 380 - 382, 384 392 и 300 были получены путем взаимодействия карбоновых кислот Ii с замещенными аминами, проводимого таким же образом, как это описано в примере 1-1.
Целевые соединения в соответствии с примерами 375, 378-379 и 393-399 были получены путем взаимодействия соответствующих карбоновых кислот или их этиловых эфиров Ii с незамещенными или замещенными аминами таким же образом, как это описано в примере 383.
Пример 383. N-(гексагидро-1H-азепин-I-илкарбонил)-L-Leu-D-Trp(Mt)-D-Pya-OEt(0,20 г) растворяли в 2,4 н. растворе аммиака в метаноле (10 мл) и смесь оставляли стоять в течение 3 дней при комнатной температуре. Затем ее концентрировали в вакууме и остаток растирали с диэтиловым эфиром, получая в результате целевое соединение (0,18 г).
Пример 401. Проводя реакцию между N-(гексагидро-1H-азепин-I-илкарбонил-L-Leu-D-Trp(Mt)-D-Pya-2-[(5S)-5-этоксикарбонил -2-оксопирролидин-1-ил] -этиламидом (0,70 г) и 2,4 н. NH3 в MeOH (5 мл) таким же образом, как это описано в примере 383, получали целевое соединение (42,7 мг).
Ниже приведены физико-химические свойства целевых соединений в соответствии с примерами 356 401.
Пример 356. Т. пл. 220-224oC; Rf 0,47 (CHCl3:MeOH 9:1).
Пример 357. Т. пл. 196-203oC; Rf 0,36 (CHCl3:MeOH 9:1).
Пример 358. Rf 0,61 (CHCl3:MeOH 9:1).
Пример 359. Т. пл. 140-145oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 360. Rf 0,56 (CHCl3:MeOH 9:1).
Пример 361. Rf 0,60 (CHCl3:MeOH 9:1).
Пример 362. Rf 0,60 (CHCl3:MeOH 9:1).
Пример 363. Rf 0,58 (CHCl3:MeOH 9:1).
Пример 364. Rf 0,58 (CHCl3:MeOH 9:1).
Пример 365. Rf 0,53 (CHCl3:MeOH 9:1).
Пример 366. Rf 0,53 (CHCl3:MeOH 9:1).
Пример 367. Rf 0,52 (CHCl3:MeOH 9:1).
Пример 368. Rf 0,83 (CHCl3:MeOH:AcOH=8:2:1)
Пример 369. Rf 0,83 (CHCl3:MeOH:AcOH=8:2:1)
Пример 370. Rf 0,83 (CHCl3:MeOH:AcOH=8:2:1)
Пример 371. Rf 0,83 (CHCl3:MeOH:AcOH=8:2:1)
Пример 372. Rf 0,83 (CHCl3:MeOH:AcOH=8:2:1)
Пример 373. Т. пл. 190-195oC; Rf 0,72 (CHCl3:MeOH 9:1).
Пример 374. Т. пл. 195-197oC; Rf 0,76 (CHCl3:MeOH 9:1).
Пример 375. Rf 0,41 (CHCl3:MeOH 9:1).
Пример 376. Rf 0,44 (CHCl3:MeOH 9:1).
Пример 377. Т. пл. 160-164oC; Rf 0,49 (CHCl3:MeOH 9:1).
Пример 378. Rf 0,44 (CHCl3:MeOH 9:1).
Пример 379. Т. пл. 200-203oC; Rf 0,51 (CHCl3:MeOH 9:1).
Пример 380. Т. пл. 76-78oC; Rf 0,54 (CHCl3:MeOH 9:1).
Пример 381. Т. пл. 75-78oC; Rf 0,49 (CHCl3:MeOH 9:1).
Пример 382. Rf 0,64 (CHCl3:MeOH 9:1).
Пример 383. Т. пл. 110-112oC; Rf 0,50 (CHCl3:MeOH 9:1).
Пример 384. Т. пл. 140-145oC; Rf 0,64 (CHCl3:MeOH 9:1).
Пример 385. Rf 0,65 (CHCl3:MeOH 9:1).
Пример 386. Rf 0,62 (CHCl3:MeOH 9:1).
Пример 387. Rf 0,62 (CHCl3:MeOH 9:1).
Пример 388. Rf 0,62 (CHCl3:MeOH 9:1).
Пример 389. Rf 0,64 (CHCl3:MeOH 9:1).
Пример 390. Rf 0,45 (CHCl3:MeOH 9:1).
Пример 391. Т. пл. 165-167oC; Rf 0,48 (CHCl3:MeOH 9:1).
Пример 392. Т. пл. 142-143oC; Rf 0,50 (CHCl3:MeOH 9:1).
Пример 393. Т. пл. 168oC; Rf 0,46 (CHCl3:MeOH 9:1).
Пример 394. Т. пл. 120-125oC; Rf 0,47 (CHCl3:MeOH 9:1).
Пример 395. Т. пл. 115-125oC; Rf 0,47 (CHCl3:MeOH 9:1).
Пример 396. Т. пл. 168oC; Rf 0,41 (CHCl3:MeOH 9:1).
Пример 397. Т. пл. 215oC; Rf 0,35 (CHCl3:MeOH 9:1).
Пример 398. Т. пл. 108-109oC; Rf 0,34 (CHCl3:MeOH=19:1).
Пример 399. Т. пл. 119-120oC; Rf 0,28 (CHCl3:MeOH=19:1).
Пример 400. Rf 0,49 (CHCl3:MeOH 9:1).
Пример 401. Т. пл. 195-197oC; Rf 0,26 (CHCl3:MeOH 9:1).
Пример 402. Проводя реакцию между N-(гексагидро-IH-азепин-I-илкарбонил-L-Leu-D-Trp(Me)- OH (400 мг), N-(этоксикарбометил)-N-(пиридин-2-илметил)амином (187 мг), HOBT (131 мг), WSLD-HCl (150 мг) и ДМФ (5 мл) таким же образом, как это описано в примере 1-1, получали целевое соединение (554 мг). Rf 0,37 (CHCl3:MeOH 20:1).
Пример 403. Проводя реакцию между N-(гексагидро-1H-азепин-1-илкарбонил-L-Leu-D-Trp(Me)- OH (400 мг), N-(этоксикарбнилметил)-N-[2-(пиридин-2-ил)этил]аминдигидрохлоридом, HOBT (131 мг), WSCD (150 мг), N-метилморфолином (98 мг) и ДМФ (5 мл) таким же образом, как это описано в примере 92, получали целевое соединение (288 мг). Rf 0,32 (CHCl3:MeOH 20:1).
Пример 404. Проводя реакцию между циклогексилизоцианатом (60 мг), 2HCl•H-D-alloIle-L-Leu-D-Trp(Me)-D-Pya-OEt (300 мг), Et3N (87 мг) и ДМФ (10 мл) таким же образом, как это описано в примере 4-1, получали целевое соединение (260 мг).
Т. пл. 235-237oC; Rf 0,45 (CHCl3:MeOH 9:1).
Пример 405. Целевое соединение с выходом 90,8 получали таким же образом, как это описано в примере 406. Т. пл. 111-115oC; Rf 0,46 (CHCl3:MeOH 9:1).
Пример 406. Boc-L-Leu-D-Trp(CH3-D-Pya-OC2H5 (1,70 г) в TFA (20 мл) и анизол (2 мл) подвергали взаимодействию при 0oC в течение часа. Полученный продукт подвергали взаимодействию с 4 н. раствором HCl в 1,4-диоксане таким же образом, как это описано в прописи 1-2. В результате получали целевое соединение (1,60 г). Т. пл. 141-145oC; Rf (CHCl3:MeOH 9:1).
Целевые соединения в соответствии с примерами 407 416 были получены путем отщепления третбутоксикарбонильных групп от соответствующих исходных соединений (1b) при взаимодействии их с TFA и анизолом, как это описано в прописи 1-2.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 407 Т. пл. 146-156oC; Rf 0,35 (CHCl3:MeOH 9:1).
Пример 408. Rf 0,26 (CHCl3:MeOH 9:1).
Пример 409. Rf 0,26 (CHCl3:MeOH 9:1).
Пример 410. Т. пл. 86-103oC; Rf 0,36 (CHCl3:MeOH 9:1).
Пример 411. Т. пл. 76-102oC; Rf 0,20 (CHCl3:MeOH:AcOH 16:1:1).
Пример 412. Т. пл. 152-165oC; Rf 0,32 (CHCl3:MeOH 9:1).
Пример 413. Rf 0,27 (CHCl3:MeOH 9:1).
Пример 414. Rf 0,26 (CHCl3:MeOH 9:1).
Пример 415. Т. пл. 194-202oC; Rf 0,26 (CHCl3:MeOH 9:1).
Пример 416. Rf 0,26 (CHCl3:MeOH 9:1).
Целевые соединения в соответствии с примерами 417 426 были получены путем взаимодействия соответствующих исходных соединений с 4 н. раствором хлористого водорода в этилацетате, проводимого таким же образом, как это описано в примере 22.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 417. Т. пл. 141-146oC; Rf 0,86 (CHCl3:MeOH:AcOH 8:1:1); FAB-MS m/z: 678 (M+H).
Пример 418. Т. пл. 103-120oC.
Пример 419. Rf 0,41 (CHCl3:MeOH 9:1).
Пример 420. Rf 0,44 (CHCl3:MeOH 9:1).
Пример 421. Rf 0,49 (CHCl3:MeOH 9:1).
Пример 422. Rf 0,44 (CHCl3:MeOH 9:1).
Пример 423. Rf 0,51 (CHCl3:MeOH 9:1).
Пример 424. Rf 0,65 (CHCl3:MeOH 9:1).
Пример 425. Т. пл. 110-135oC; Rf 0,50 (CHCl3:MeOH 9:1).
Пример 426. Т. пл. 105-145oC; Rf 0,49 (CHCl3:MeOH 9:1).
Соединения в соответствии с примерами 427 429 были получены путем взаимодействия соответствующих исходных соединений II и III таким же образом, как это описано в примере 1-1.
Ниже приведены физико-химические свойства этих целевых соединений.
Пример 427. Rf 0,44 (CHCl3:MeOH 9:1).
Пример 428. Rf 0,44 (CHCl3:MeOH 9:1).
Пример 429. Т. пл. 110-112oC; Rf 0,50 (CHCl3:MeOH 9:1).
Соединения в соответствии с примерами 430 432 были получены путем взаимодействия соответствующих исходных соединений V и VI таким же образом, как это описано в примере 92.
Ниже приведены физико-химические свойства этих целевые соединений.
Пример 430. Rf 0,44 (CHCl3:MeOH 9:1). Rf 0,44 (CHCl3:MeOH 9:1).
Пример 432. Т. пл. 110-112oC; Rf 0,50 (CHCl3:MeOH 9:1).
Целевые соединения, получение которых описано в вышеприведенных примерах, приведены в табл. 3.
В табл. 3 конфигурации, сопровождаемые приставками -цис- или -транс-, не означают абсолютные конфигурации, а только относительные конфигурации. Другие конфигурации означают абсолютные конфигурации.


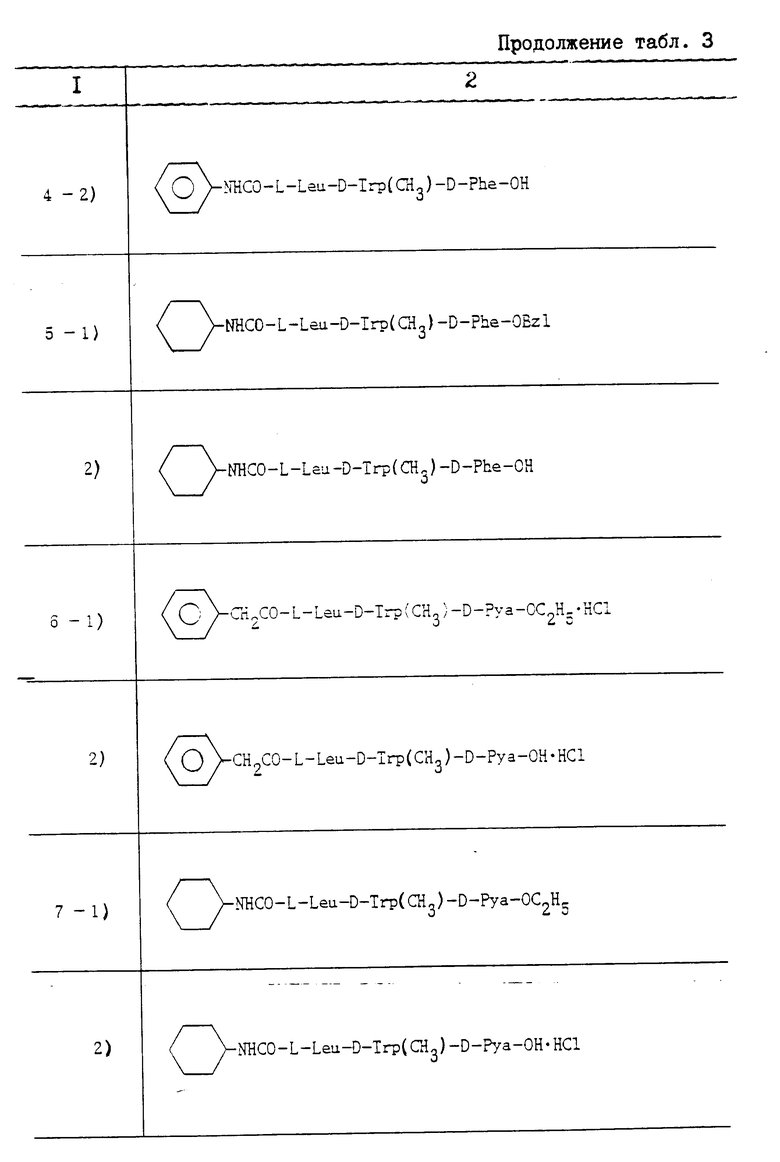
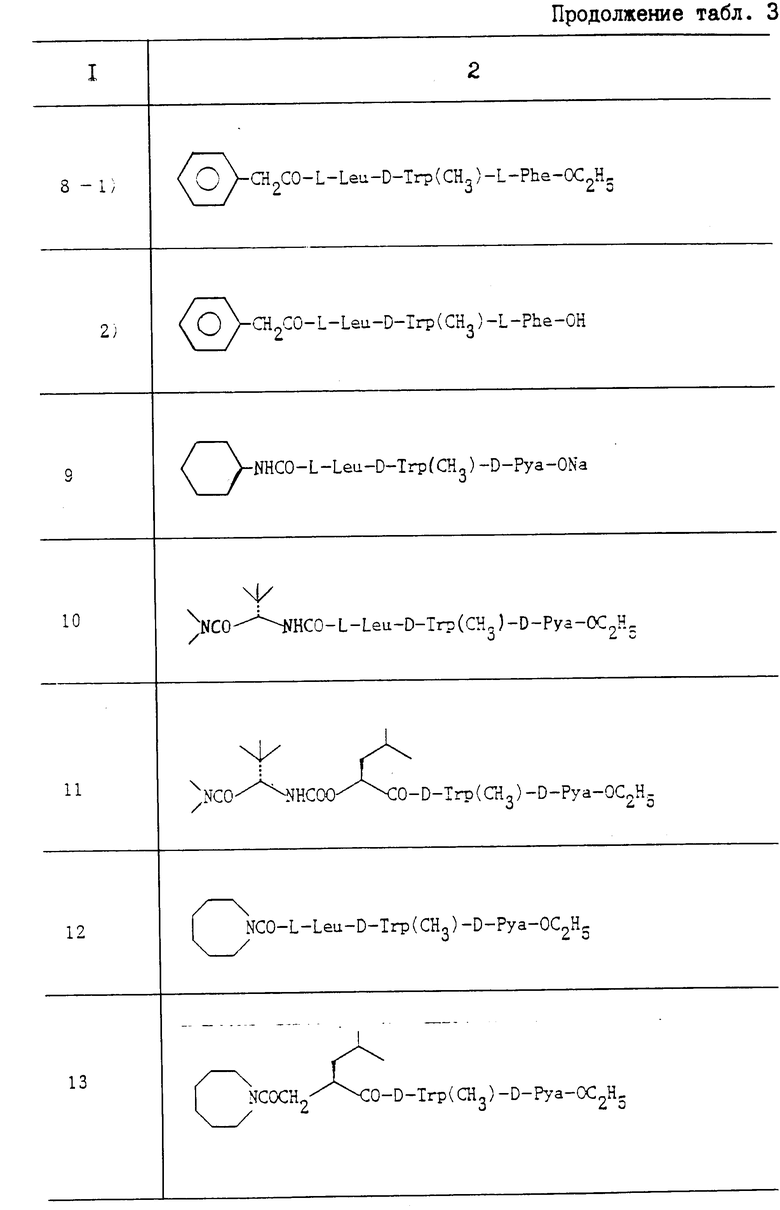
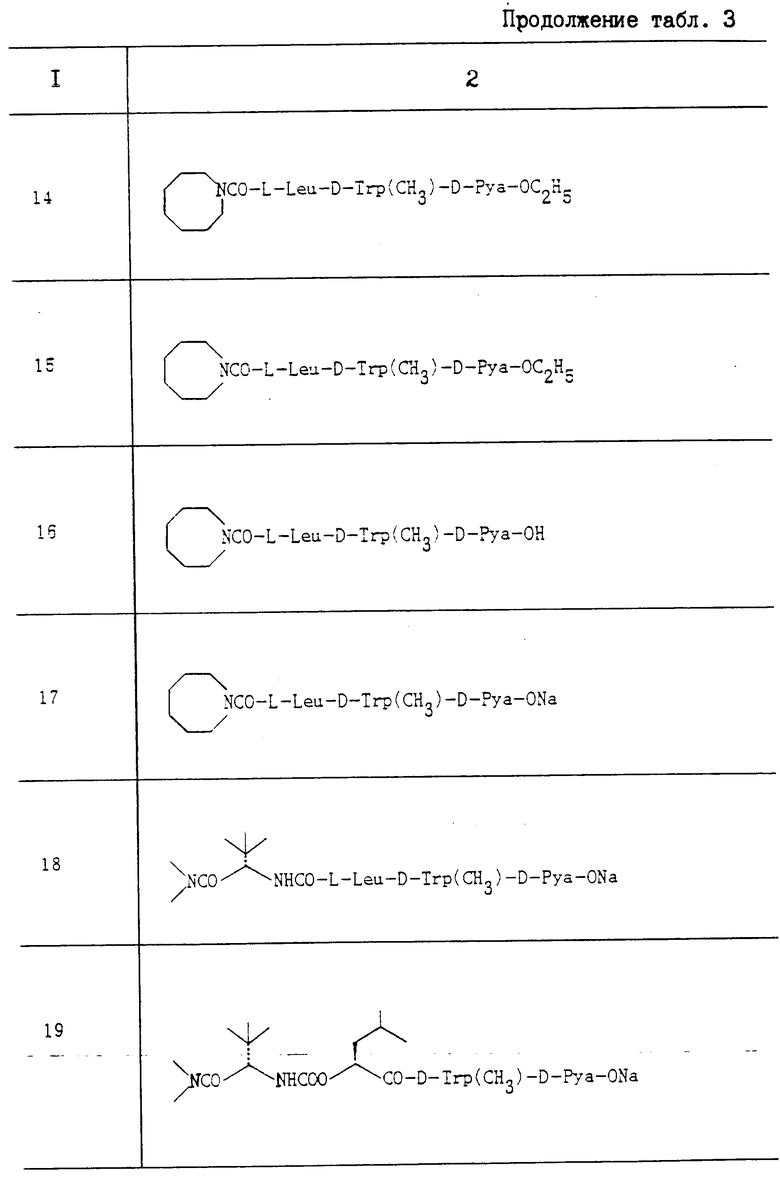




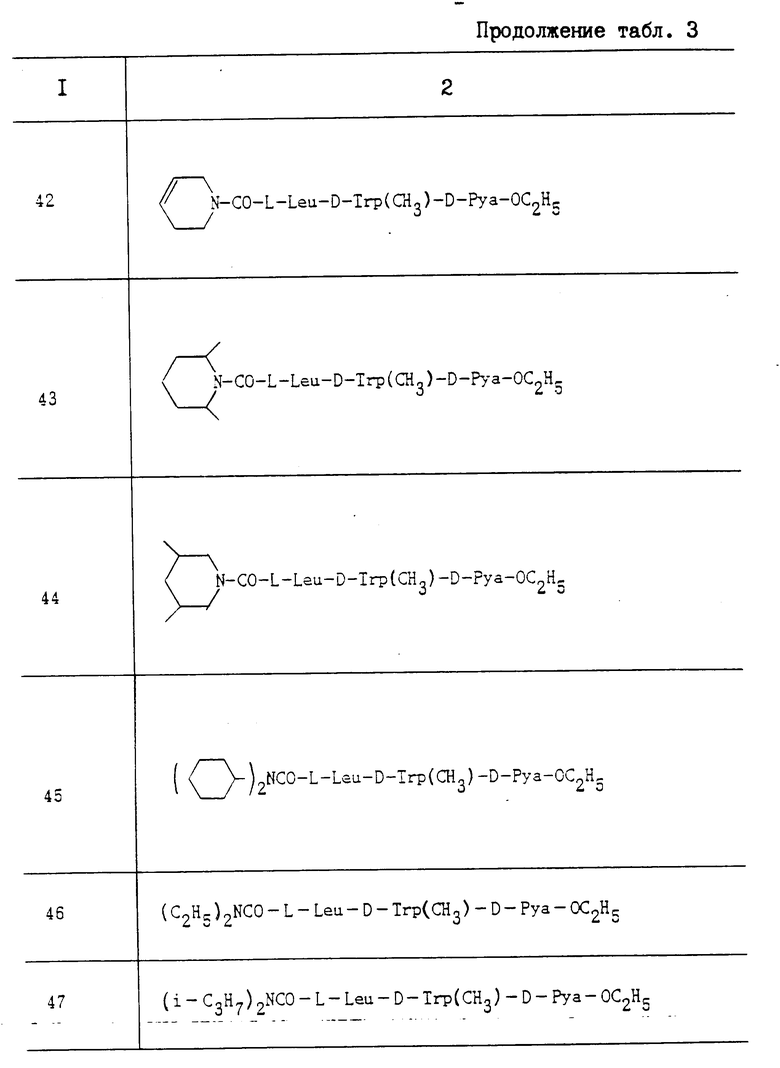

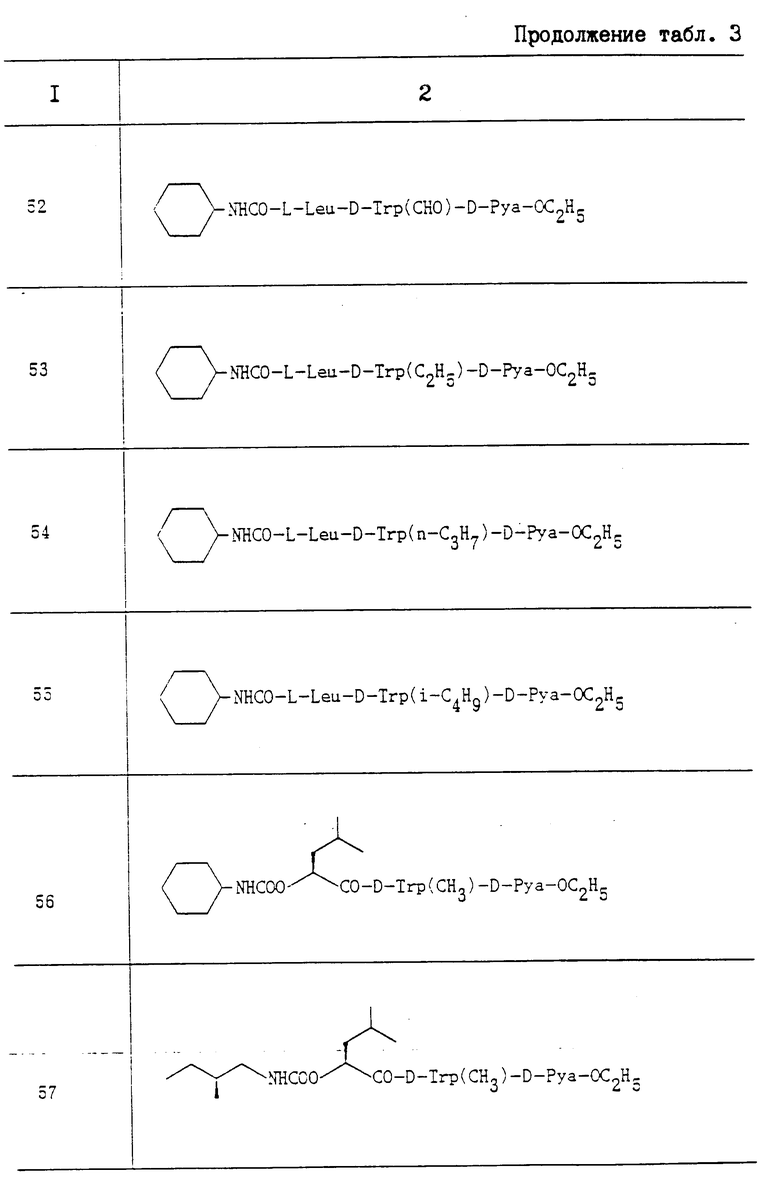




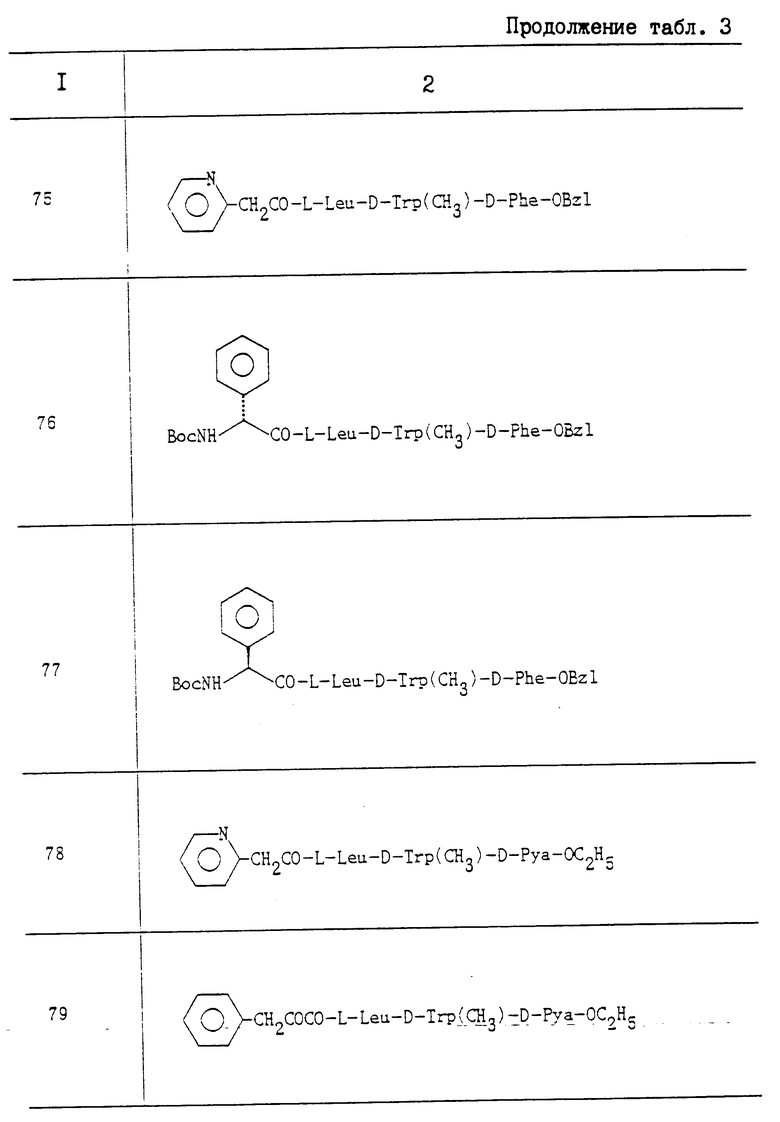



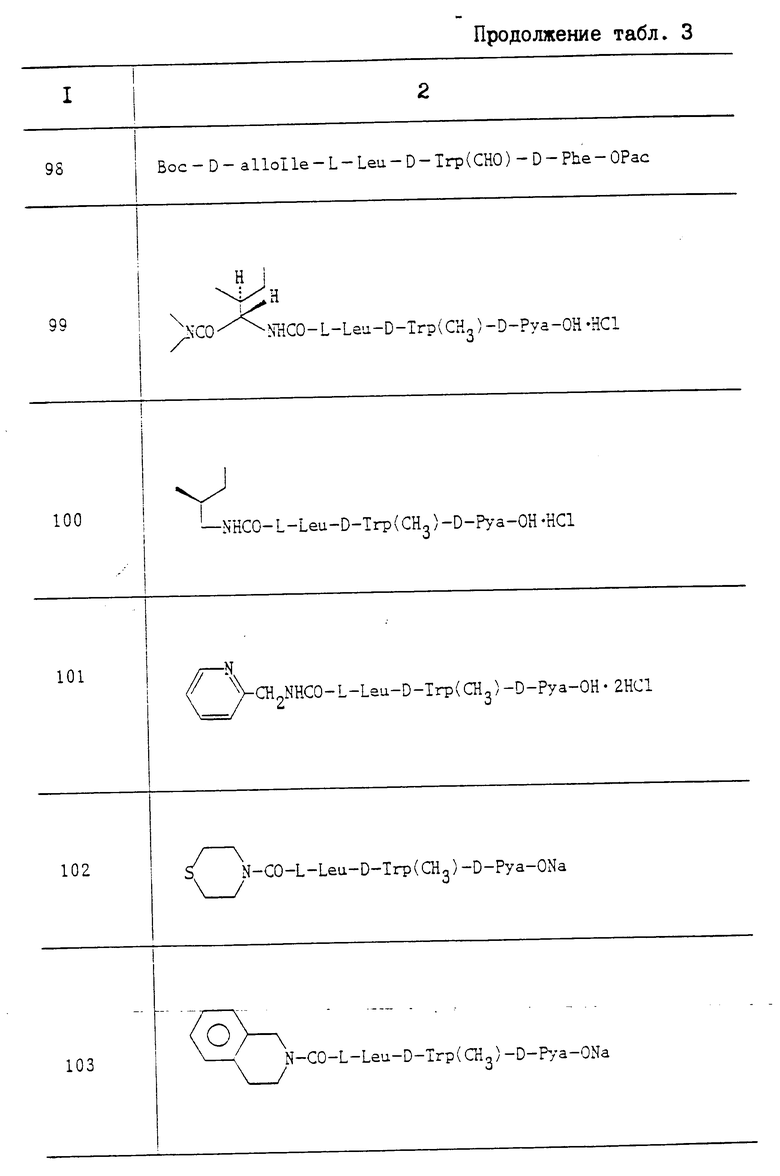



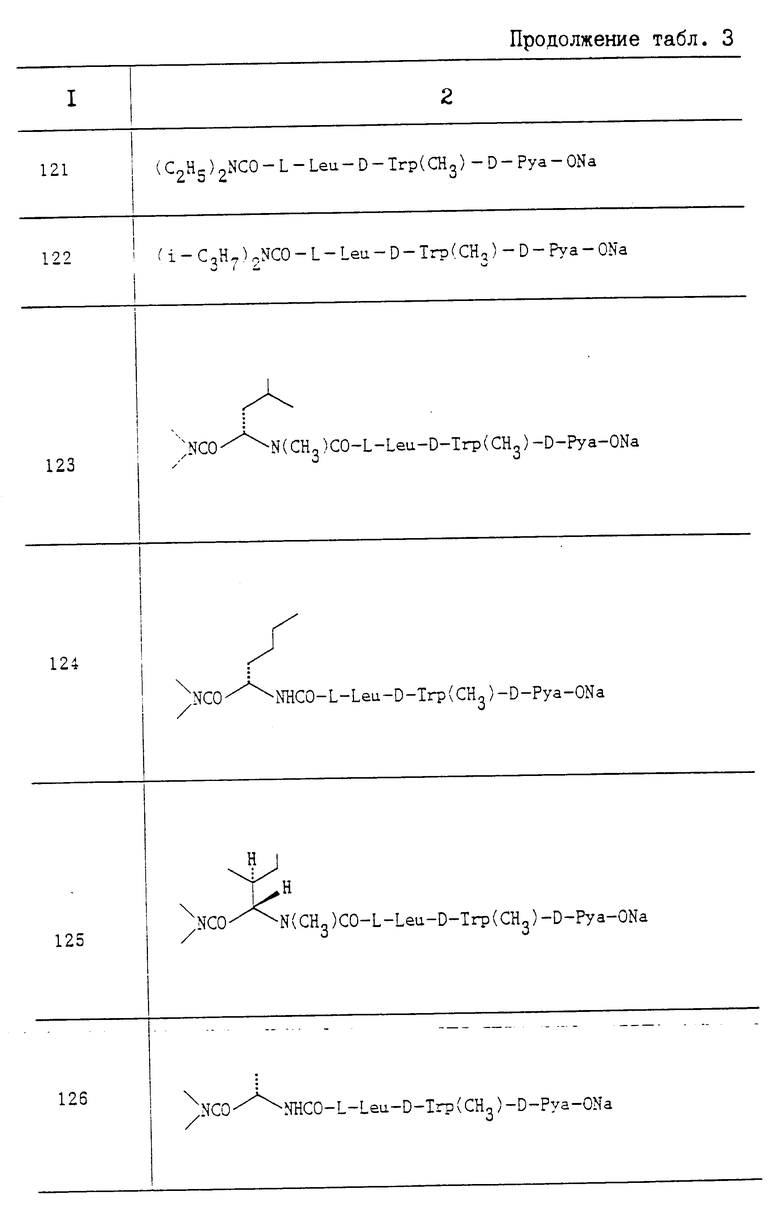

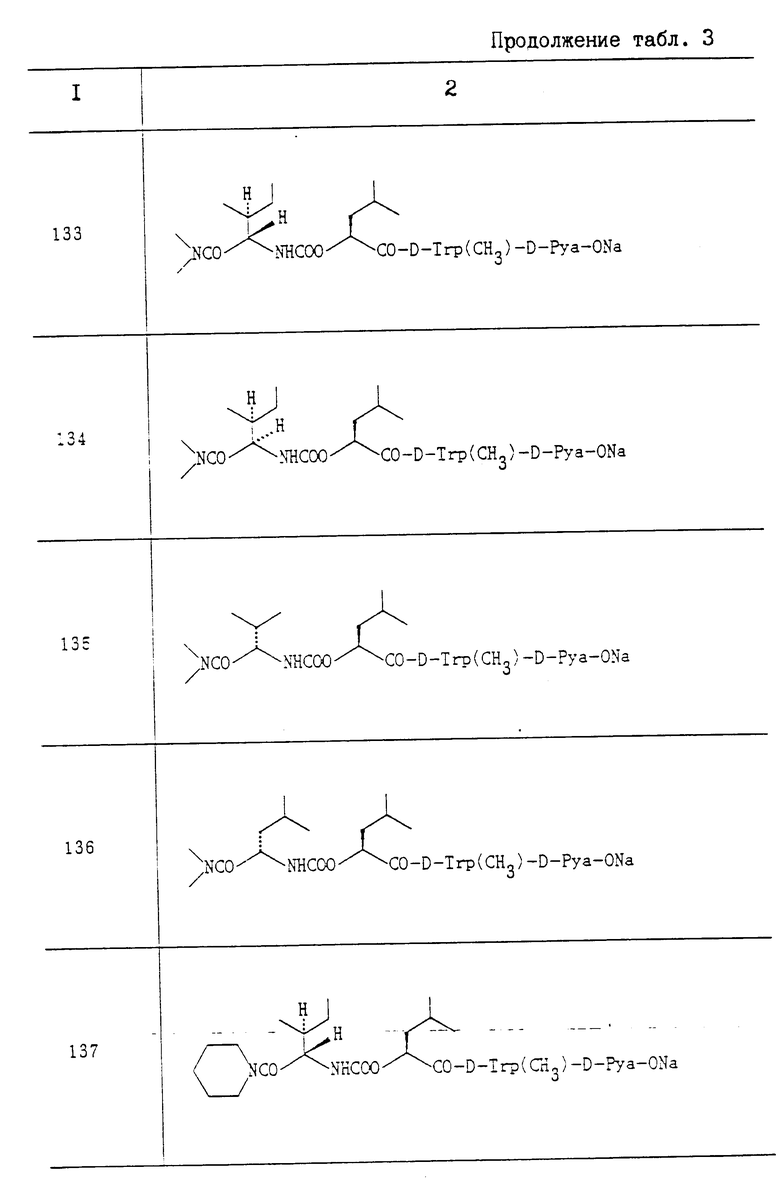



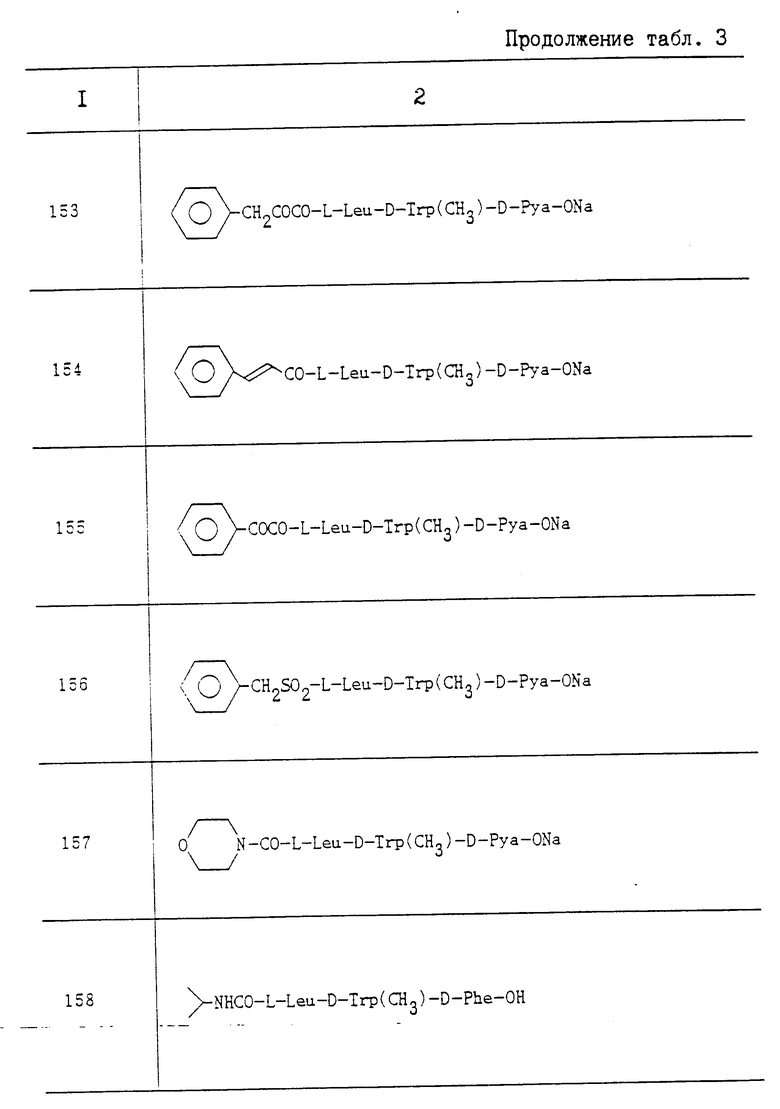
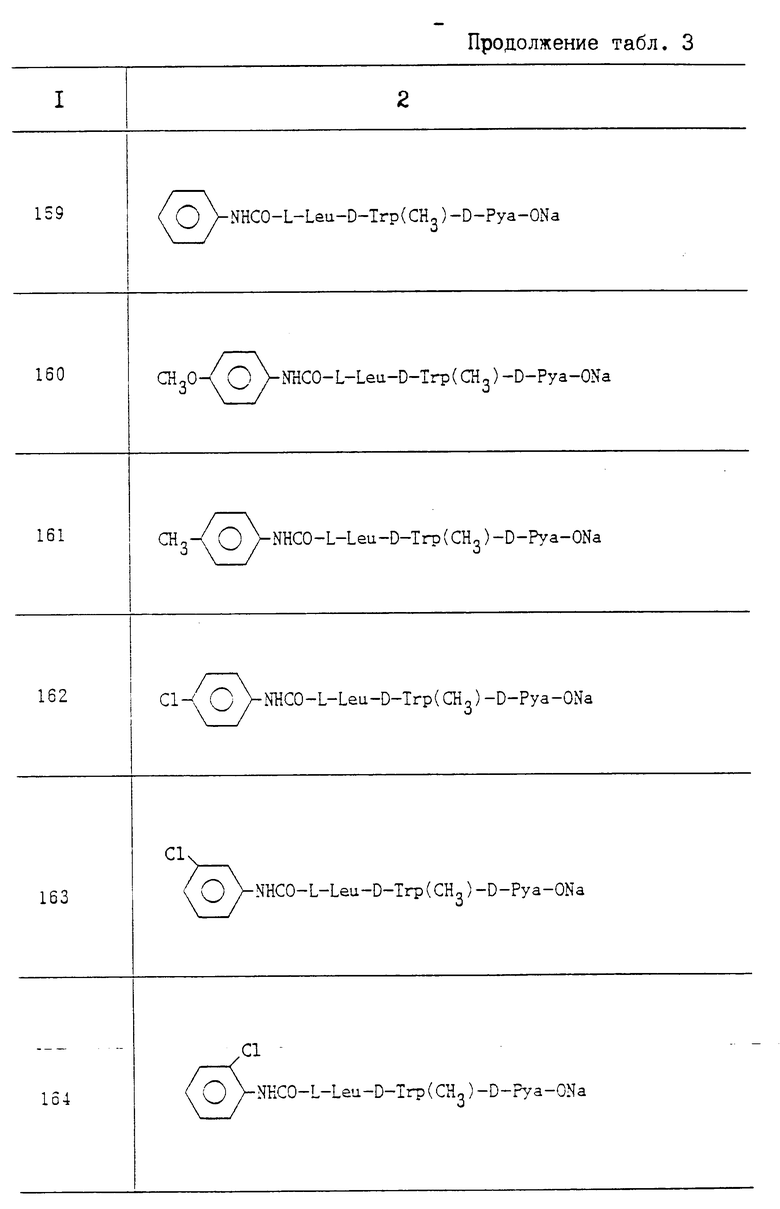



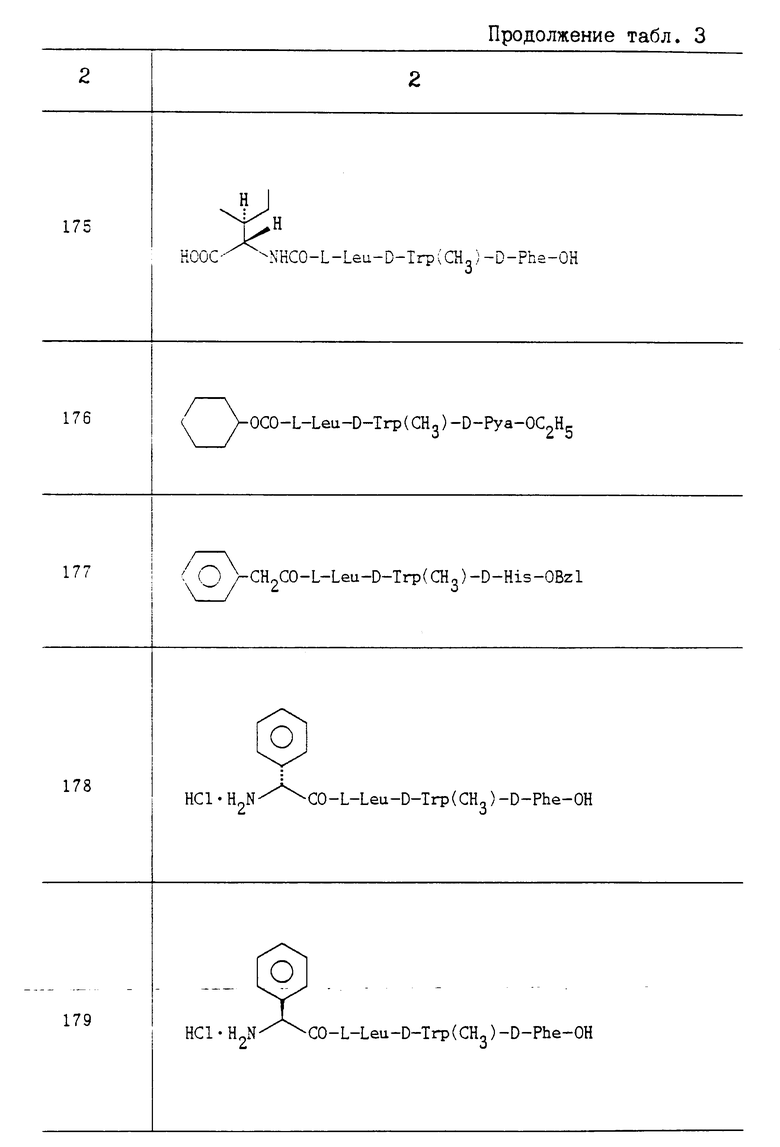


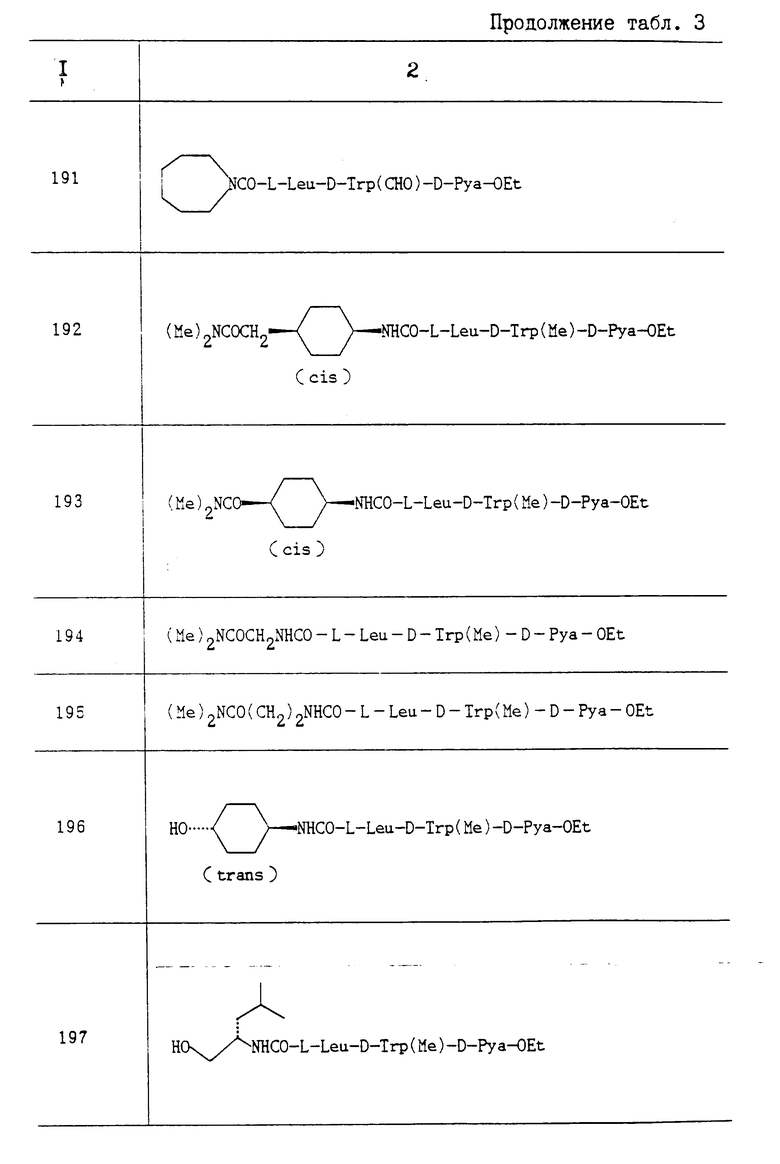
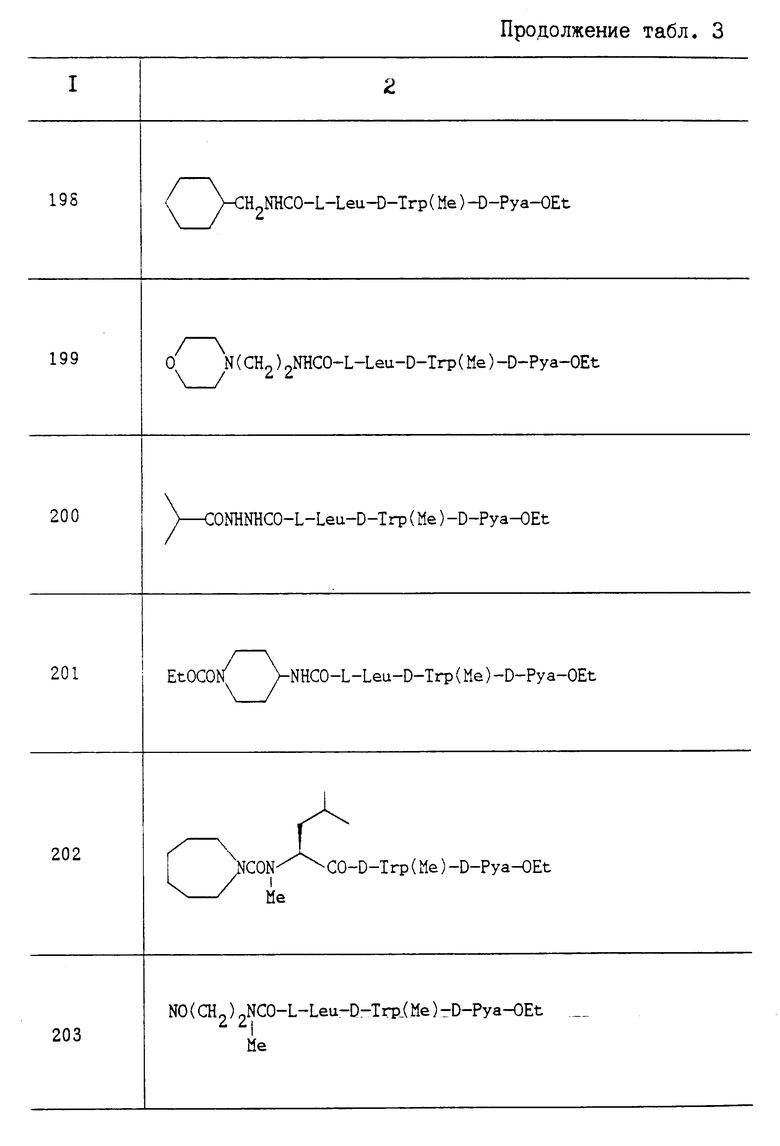






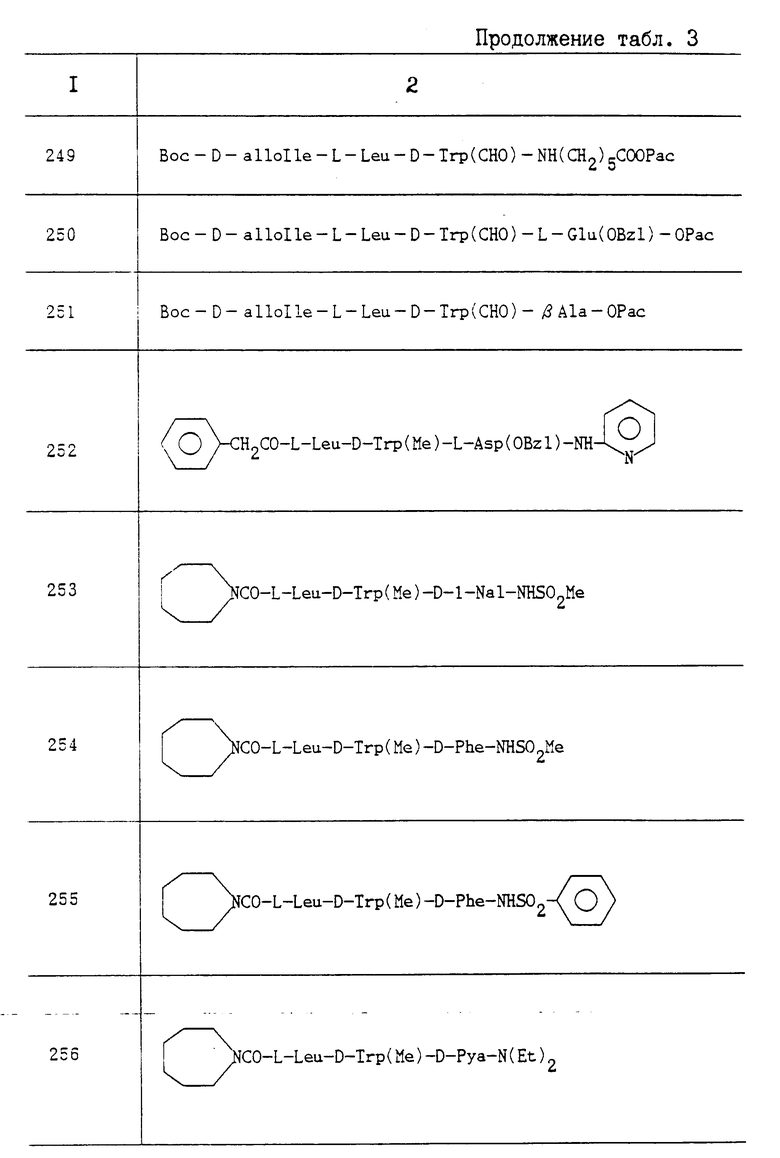
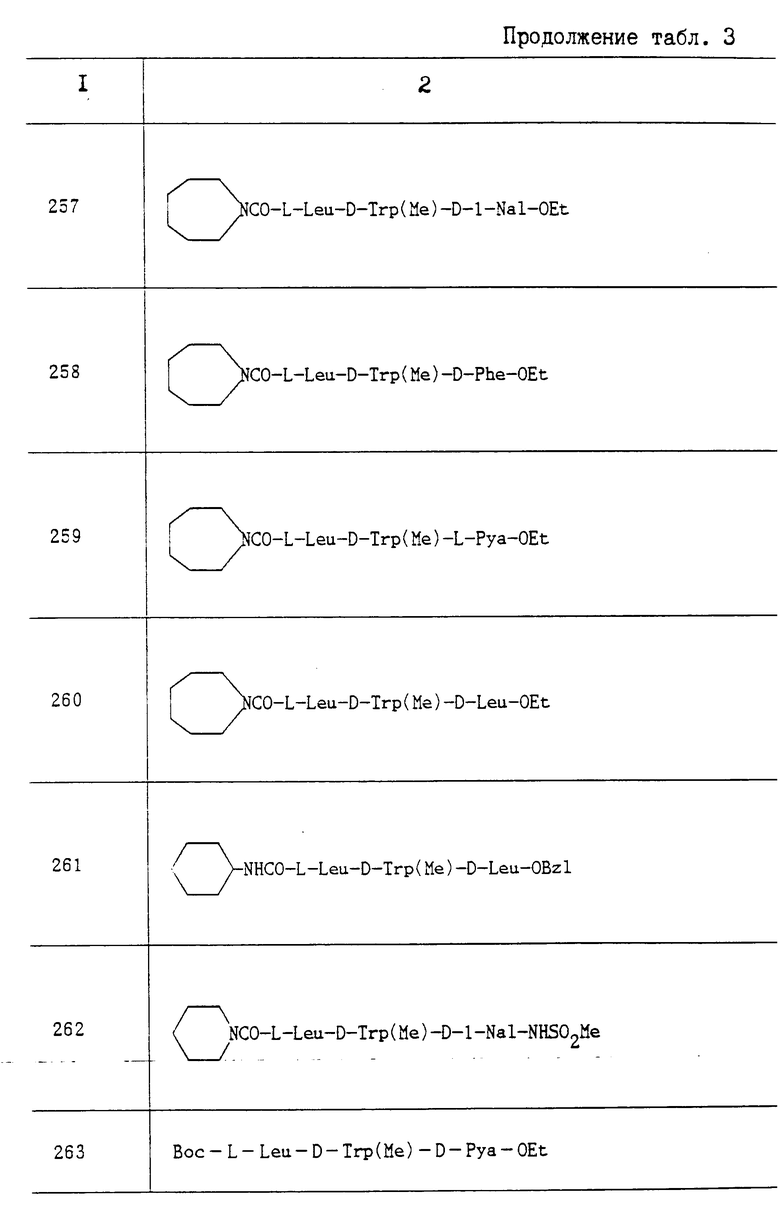
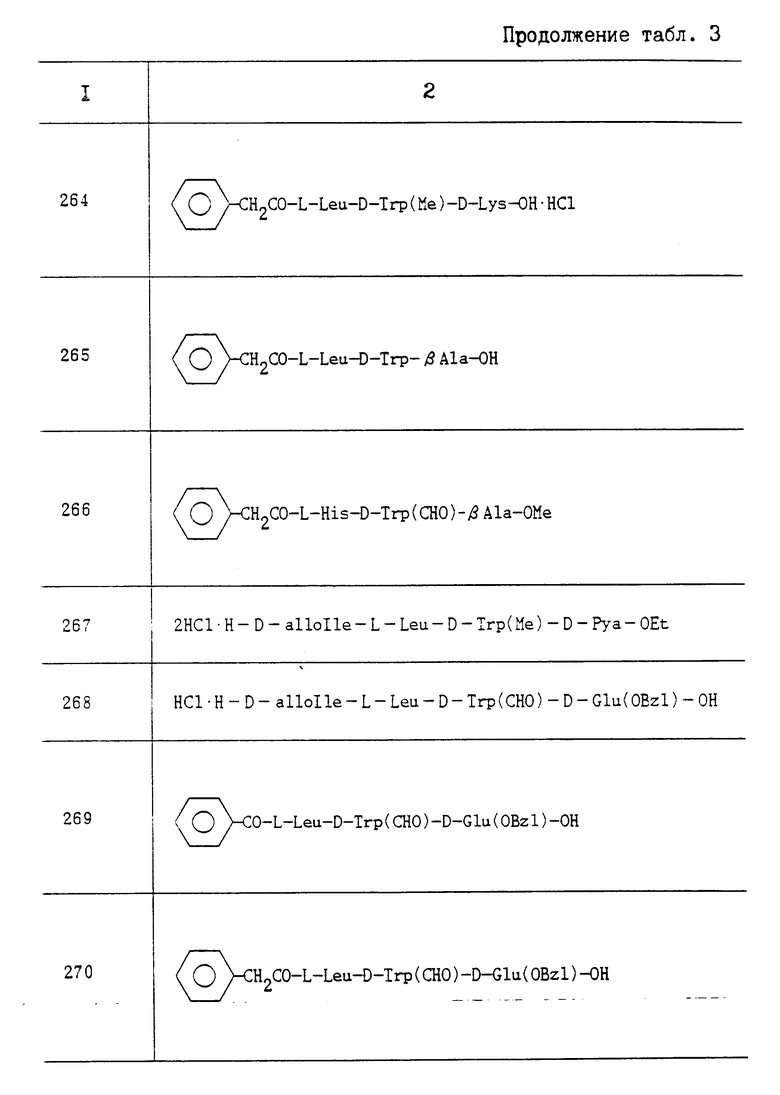
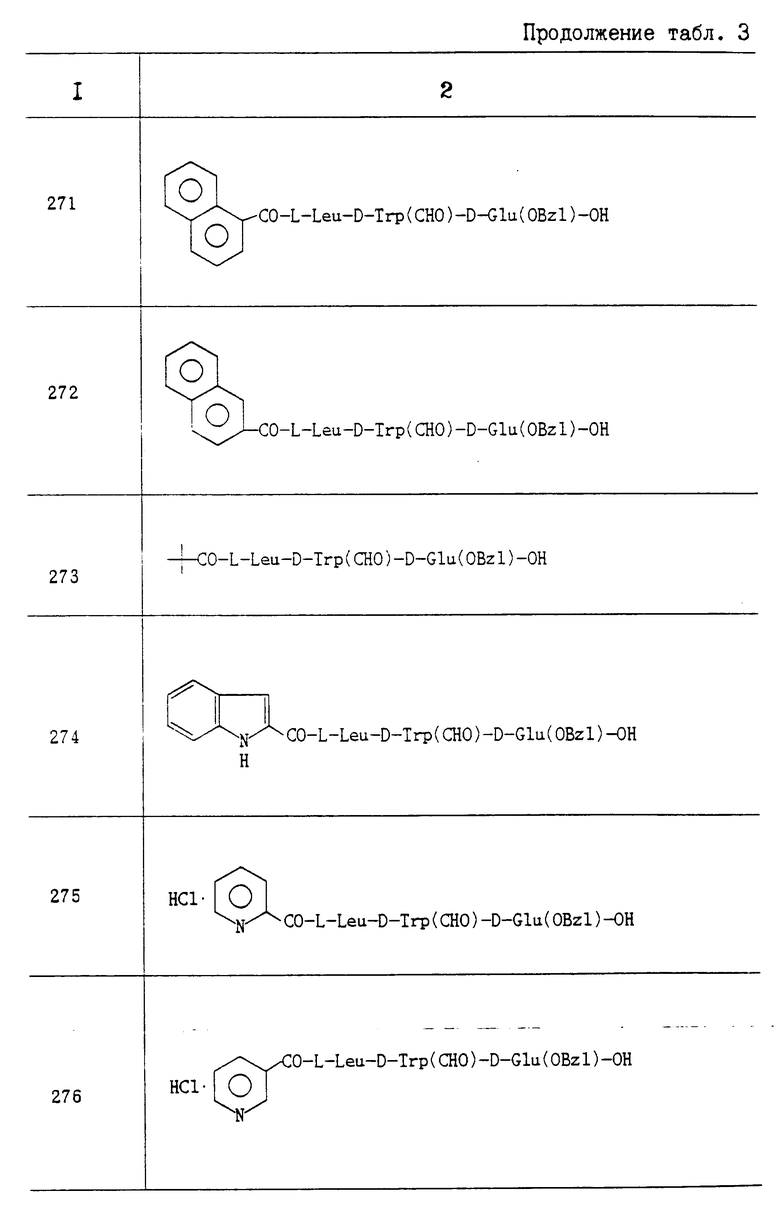

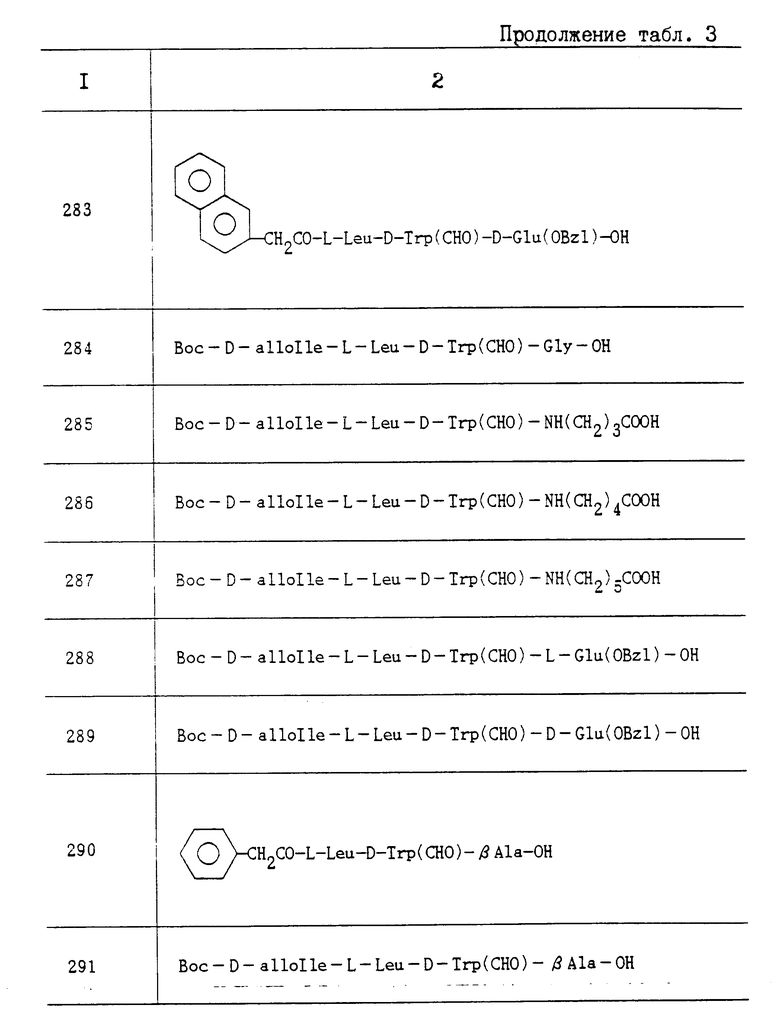

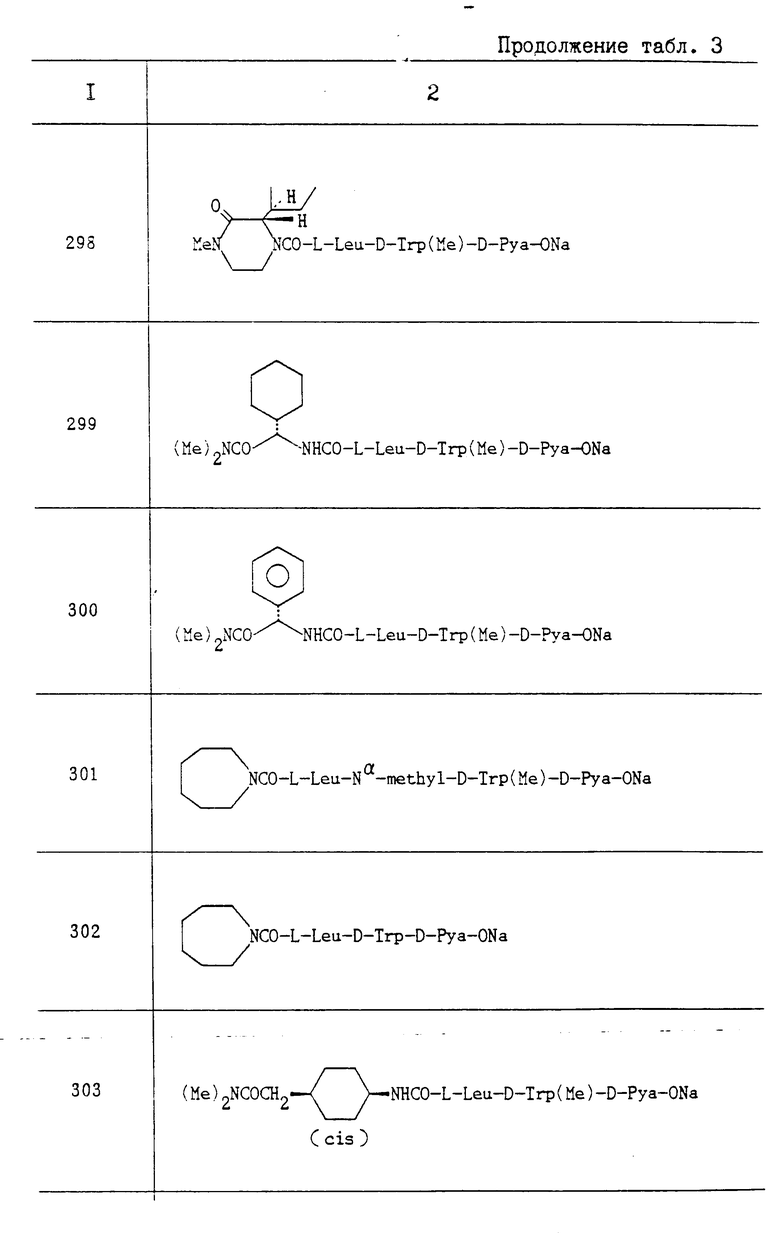
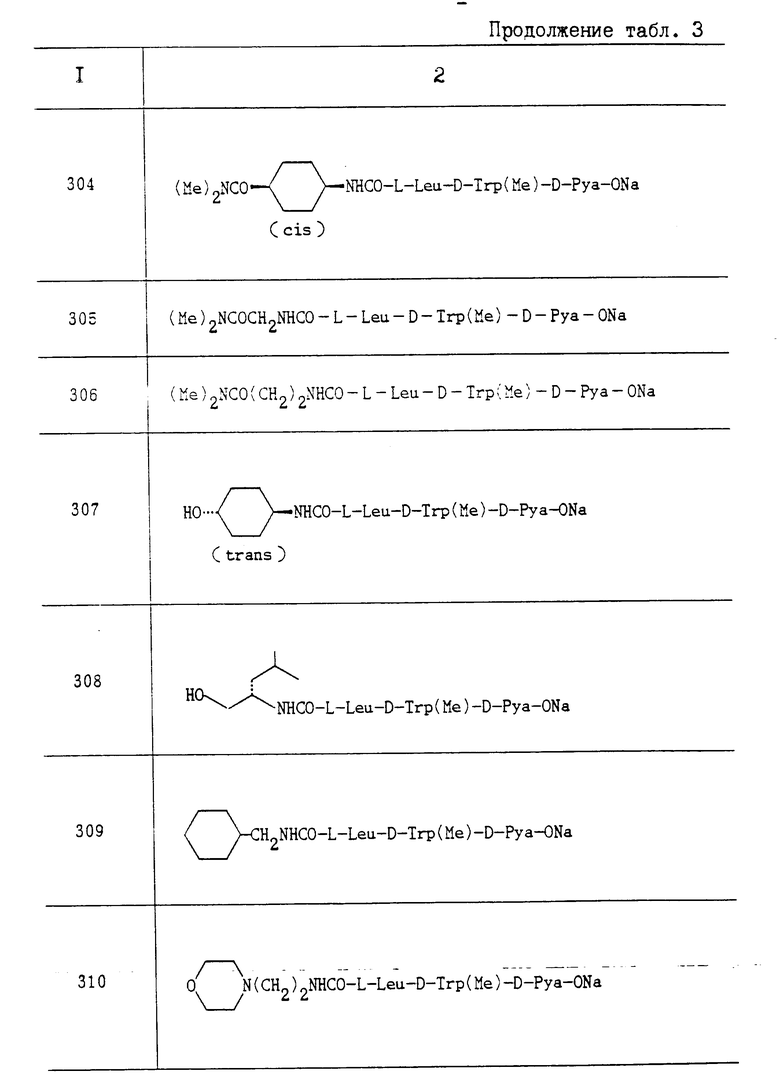

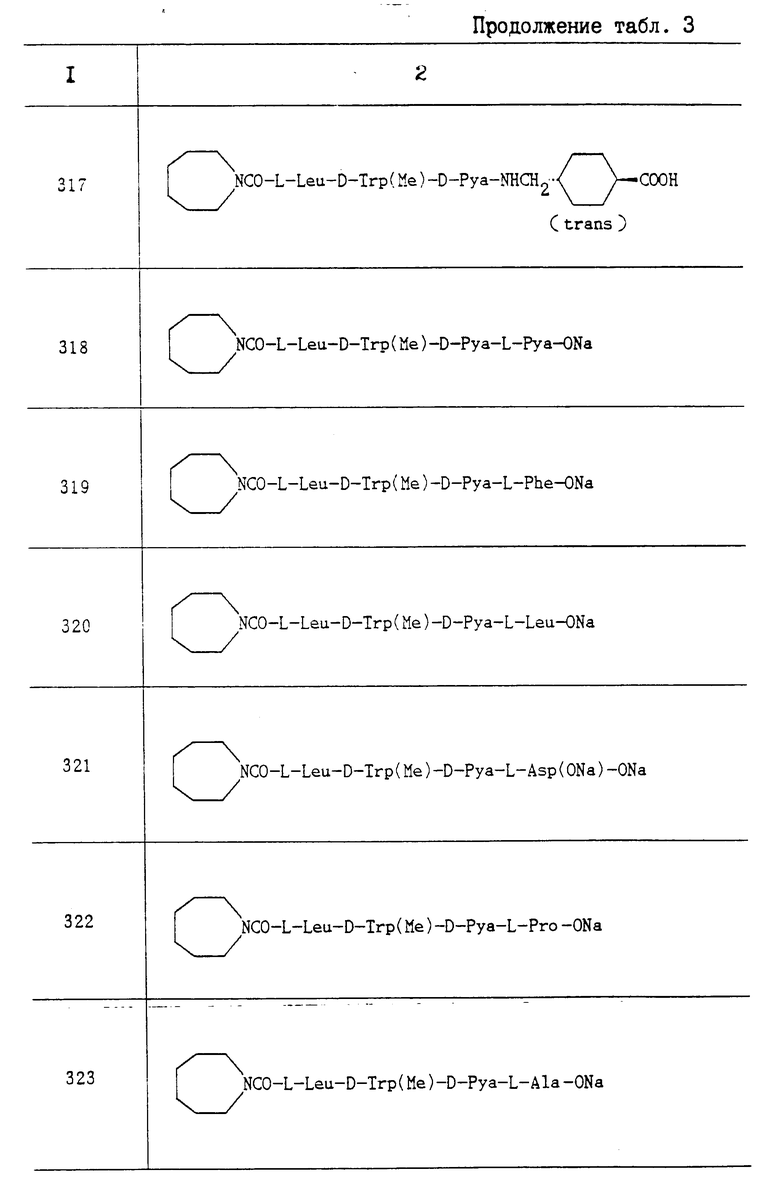
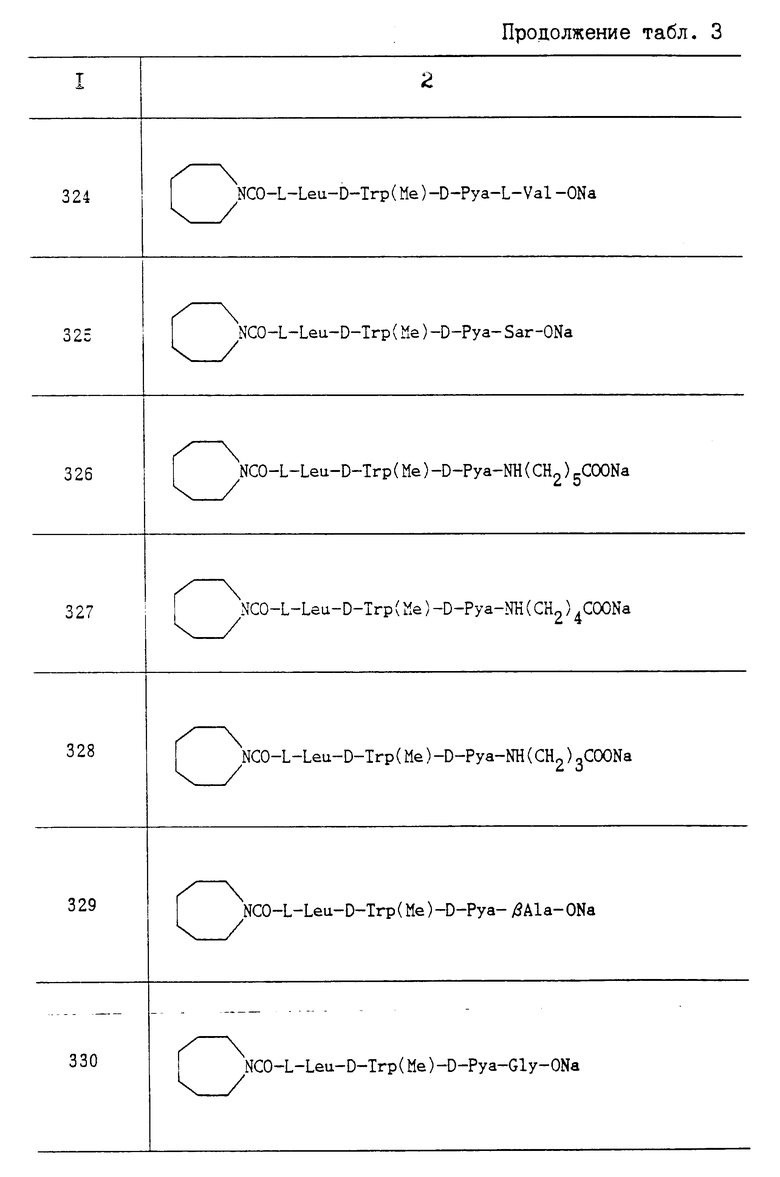
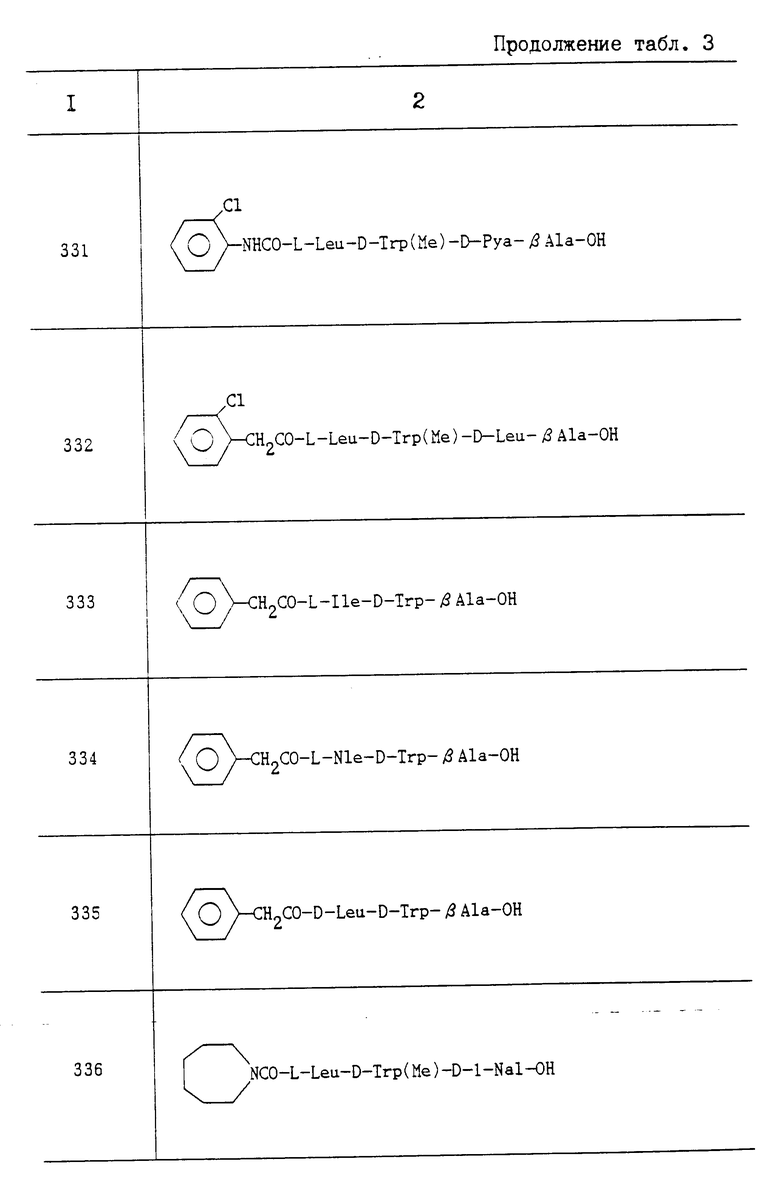

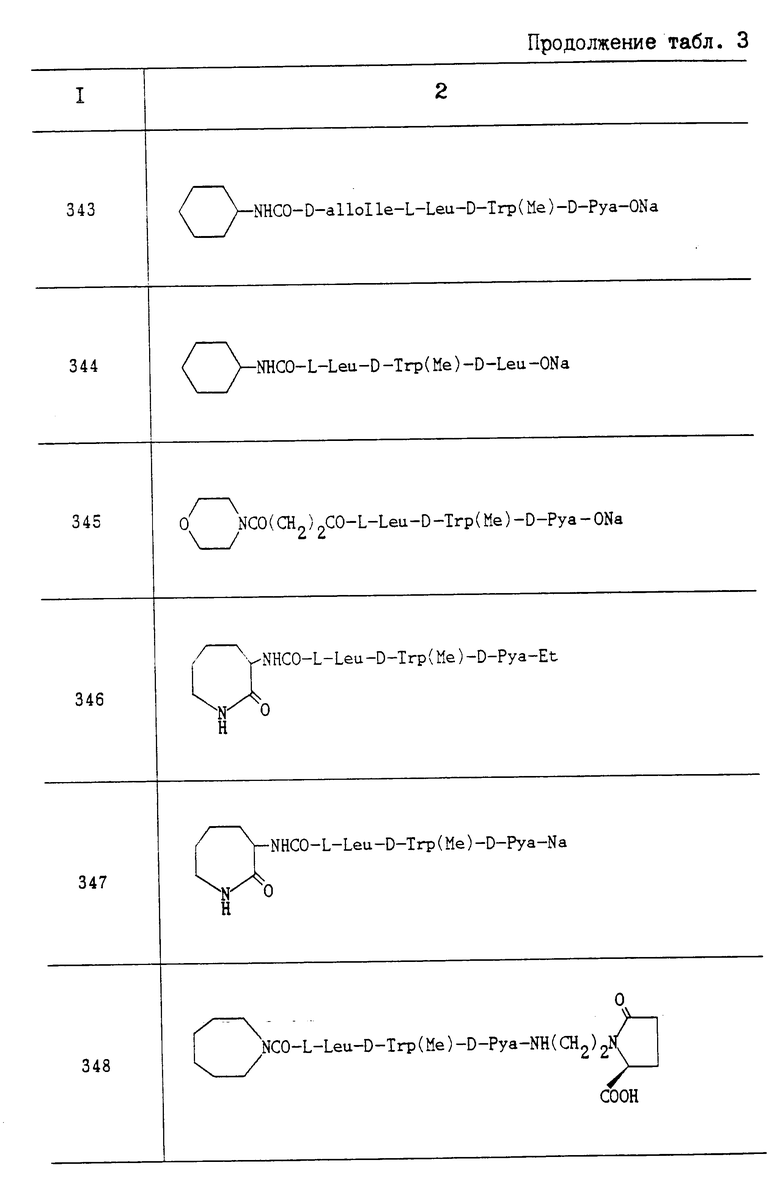



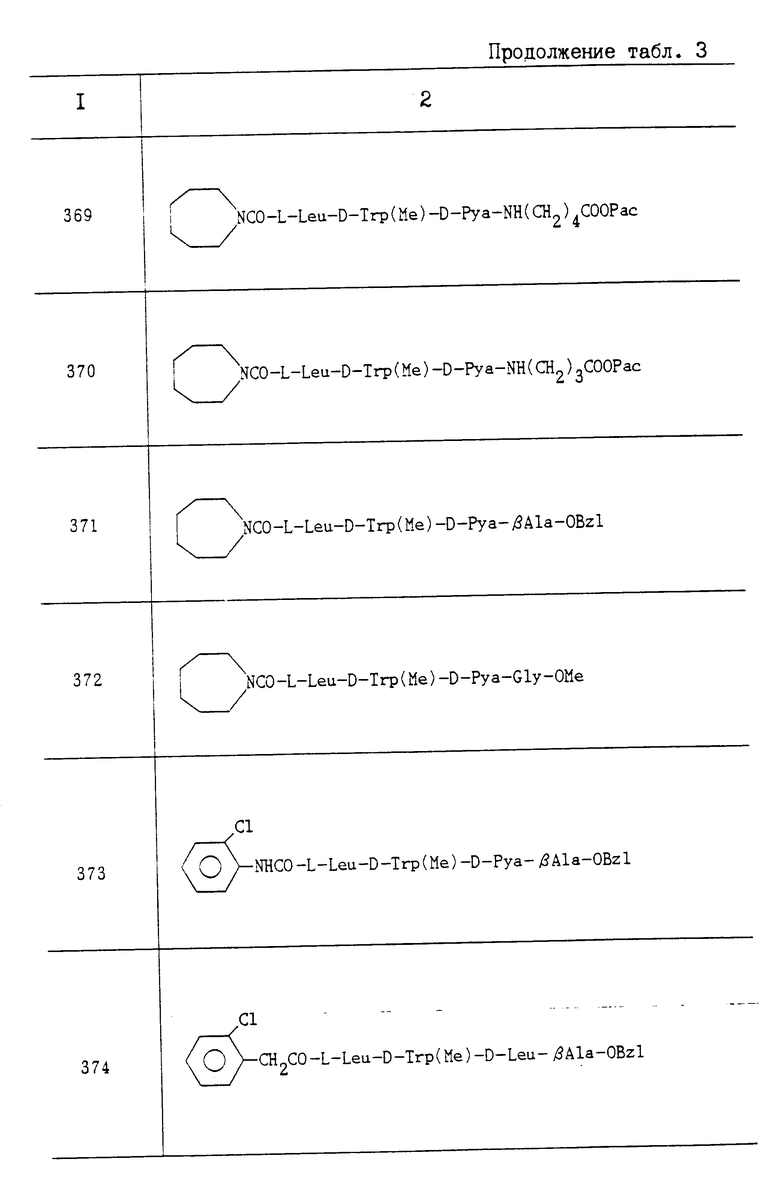


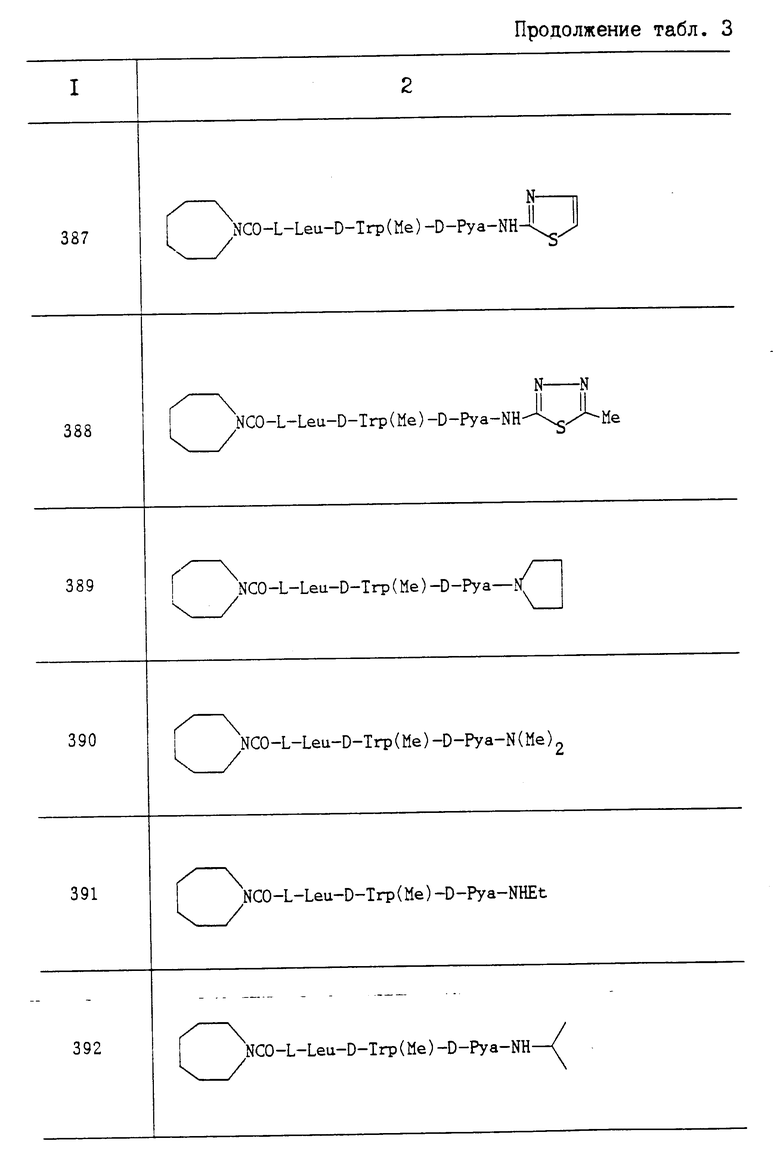


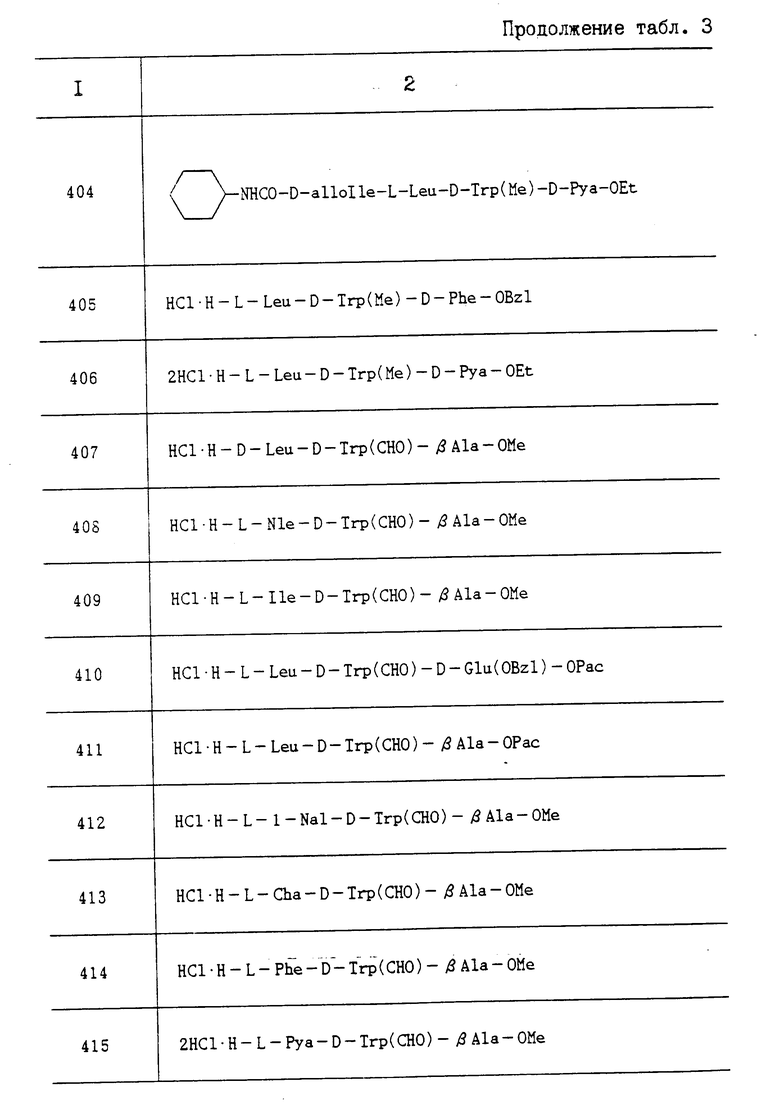
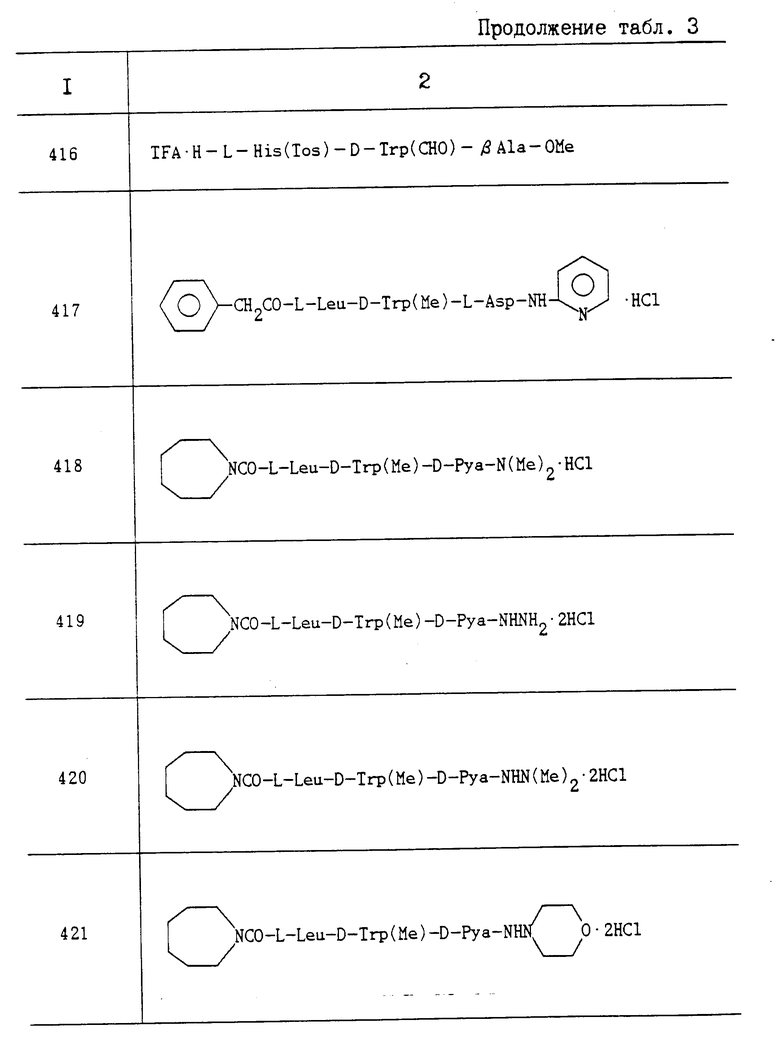

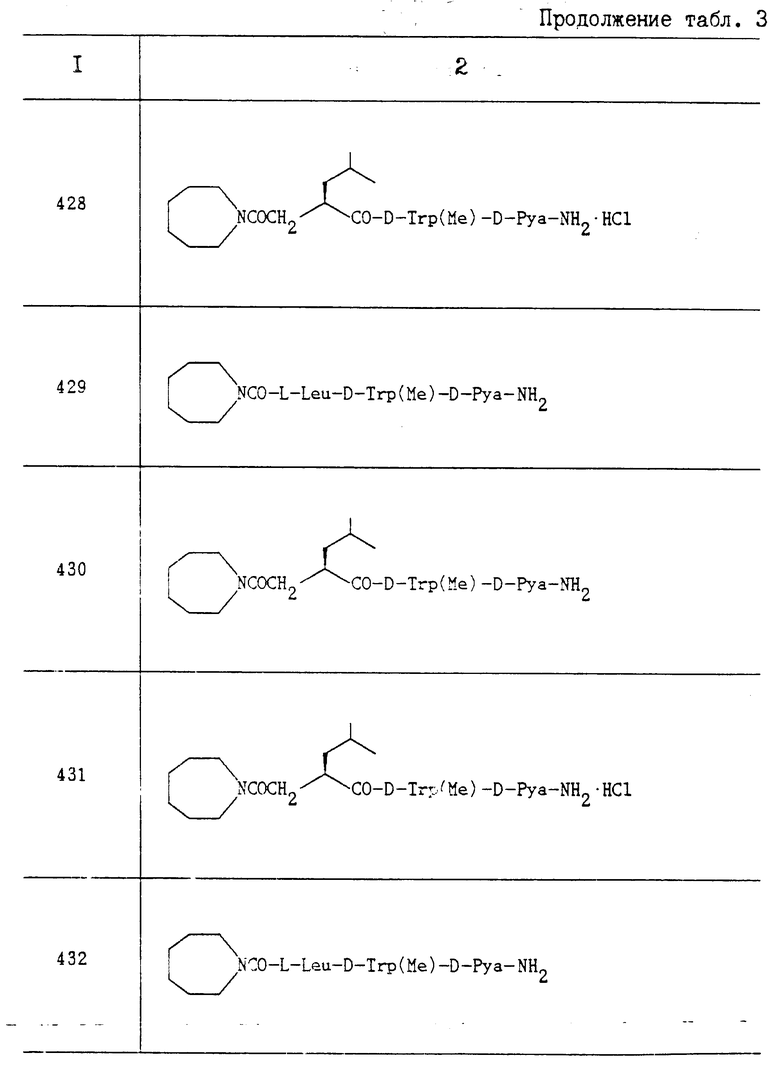
Использование - в медицине при лечении и предотвращении эндотеллинопосредственных заболеваний, таких как гипертензия. Сущность изобретения: производные пептидов общей формулы I: R1-A-CH2 (R2)-CON(R7)-CH2)(R3)- CON(R6)-CO(R4)R5, где R1 - водород или ацил; R2 - низший алкил, арил(низший)алкил, (C3 - C7) циклоалкил (низш.) алкил, гетероциклический (низший)алкил, в котором гетероциклическая группа является ненасыщенной 5,6-членной гетеромоноциклической группой, содержащей 1-2 атома азота, необязательно замещенной имино-защитной группой; R3 - гетероциклический (низший) алкил, гетероциклическая группа может быть ненасыщенной конденсированной 9-членной группой, содержащей 1 атом азота и необязательно замещенной подходящим заместителем, выбираемым из (низш.)алкила и иминозащитной группы, арил (низш.) алкил; R4 - H, арил (низш.) алкил, (низш.) алкил, амино (низш.) алкил, замещенный или незащищенный, карбокси (низший) алкил, защищенный или незащищенный, гетероциклический (низш.) алкил, причем гетероциклическая группа может быть ненасыщенной 5-6-членной, содержащей 1 или 2 атома азота или один атом серы и один атом азота и необязательно замещенной иминозащитной группой; R5 - карбокси, замещенный карбокси, карбокси (низший) алкил, незащищенный или защищенный; R6 - H, гетероциклический (низш.) алкил, где гетероциклическая группа является насыщенным 6-членным гетероциклом с одним атомом азота; R7 - H или (низш.) алкил; A - -O-, NH, (низш.) алкилимино, низший алкилен, или их фармацевтически приемлемые соли, способ получения соединений формулы I, заключающийся в конденсации 2-х фрагментов R1ACH2 (R2)COOH и R7NHCH(R3)CON(R6) CH(R4)R5, и фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента - пептидное производное формулы I в эффективном количестве. 3 с. и 5 з. п. ф-лы, 1 табл.
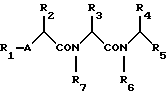
где R1 водород или ацил;
R2 низший алкил, арил(низший)алкил, С3 С7- циклоалкил(низший)алкил, гетероциклический(низший)алкил, в котором гетероциклическая группа является ненасыщенной 5,6-членной гетеромоноциклической группой, содержащей 1 2 атома азота и необязательно замещенной иминозащитной группой;
R3 гетероциклический(низший)алкил, причем гетероциклическая группа может быть ненасыщенной конденсированной 9-членной группой, содержащей 1 атом азота и необязательно замещенной подходящим заместителем, выбираемым из низшего алкила и иминозащитной группы, или арил(низший)алкил;
R4 водород, арил(низший)алкил, низший алкил, амино(низший)алкил, защищенный амино(низший)алкил, карбокси(низший)алкил, защищенный карбокси(низший)алкил, гетероциклический(низший)алкил, причем указанная гетероциклическая группа является ненасыщенной 5 6-членной гетеромоноциклической группой, содержащей 1 или 2 атома азота или 1 атом серы и 1 атом азота и необязательно замещенной иминозащитной группой;
R5 карбокси, защищенный карбокси, карбокси(низший)алкил, защищенный карбокси(низший)алкил;
R6 водород, гетероциклический(низший)алкил, где указанная гетероциклическая группа является ненасыщенной 6-членной гетеромонодиклической группой, содержащей 1 атом азота;
R7 водород или низший алкил;
А -О-, NH, низший алкилимино или низший алкилен, при условии, что когда R2 (S)-изобутил, R3 N- (дихлорбензилоксикарбонил)индол-3-илметил, R4 метил, R5 метоксикарбонил, R6 водород, R7 водород и А -NH-, тогда фрагмент формулы
имеет абсолютную конфигурацию
или их фармацевтически приемлемые соли.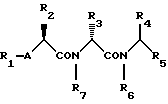
3. Соединение по п. 2, где R1 карбамоил, насыщенный или ненасыщенный, ациклический или циклический алифатический ацил, необязательно замещенный ароматической или гетероциклической группой(ами), ароматическим ацилом или гетероциклическим ацилом, каждый из которых получают из органической карбоновой или органической угольной или органической сульфоновой или органической карбаминовой кислоты; R2 низший алкил, С6 - С10-(низш.)алкил, С3 С7-циклоалкил(низш. )алкил, или 5- или 6-членный ароматический гетеромоноциклический(низший)алкил, где гетероциклическое кольцо содержит 1 или 2 атома азота; R3 9-членный конденсированный с бензолом гетероциклический(низш. )алкил, где гетероциклическая группа содержит 1 атом азота и может быть замещена низшим алкилом или органическим карбоксильным ацилом, или С6 - С10-ар(низш. )алкил; R4 водород, низший алкил, С6 - С10- ар(низш.)алкил, амино(низш. )алкил, защищенный карбокси(низш.)алкил, 5- или 6-членный ароматический гетеромоноциклический(низш. )алкил, где гетероциклическое кольцо содержит 1 или 2 атома азота, или 5- или 6- членный ароматический гетеромоноциклический(низш.)алкил, где гетероциклическое кольцо содержит 1 атом азота и 1 атом серы; R5 карбокси, этерифицированный карбокси, выбранный из низшего алкоксикарбонила, С6 С10- ар(низш.)алкоксикарбонила и С6 С10- ароил(низш. )алкоксикарбонила, амидированный карбокси, выбранный из карбамоила, N- или N, N-ди(низш.)алкилкарбамоила, низшего алкилкарбамоила, замещенного одним или двумя заместителями, выбранными из карбокси и защищенного карбокси, N-(низш.)алкил-N- (карбокси- или защищенный карбокси(низш. )алкилкарбамоила, С6 С10-ар(низш.)алкилкарбамоила, карбокси- или защищенного карбокси замещенного С6 С10- ар(низш.)алкилкарбамоила, С3 С7- циклоалкилкарбамоила, N-[карбокси- или защищенного карбокси замещенного С3 С7- циклоалкил(низший)алкил] карбамоила, низшего алкилсульфонилкарбамоила, С6 С10-арилсульфонилкарбамоила, карбокси- или защищенного карбоксизамещенного 5- или 6-членного ароматического гетеромоноциклического (низш. )алкилкарбамоила, где гетероциклическое кольцо содержит 1 3 атома азота; низшего алкиленаминокарбонила, низшего алкиленаминокарбонила, замещенного карбокси или защищенным карбокси, [низшего алкиленамино(низш.)алкил]карбамоила, замещенного 1 2 заместителями, выбранными из оксо, карбокси, защищенного карбокси и карбамоила, морфолинокарбонила, 5- или 6-членного насыщенного гетеромоноциклического карбамоила, где гетероциклическое кольцо содержит 1 атом азота и 1 атом кислорода, 5- или 6-членного ароматического гетеромоноциклического карбамоила, где гетероциклическое кольцо содержит 1 3 атома азота, 5- или 6-членного ароматического гетеромоноциклического карбамоила, где гетероциклическое кольцо содержит 1 2 атома азота и 1 атом серы и может быть замещено низшим алкилом, 9- или 10-членным конденсированным с бензолом гетероциклическим карбамоилом, где гетероциклическое кольцо содержит 1 2 атома азота и 1 атом серы, 5- или 6-членного насыщенного гетеромоноциклического(низш.)алкилкарбамоила, где гетероциклическое кольцо содержит 1 атом азота и 1 атом кислорода, 5- или 6-членного ароматического гетеромоноциклического (низш. )алкилкарбонила, где гетероциклическое кольцо содержит 1 3 атома азота, карбазоила, ди(низший)алкилкарбазоила, карбокси(низш. )алкила или защищенного карбокси(низш. )алкила; R6 водород или 6-членный ароматический гетеромоноциклический(низший)алкил, в котором гетероциклическое кольцо содержит 1 атом азота.
С7)циклоалкил(низший)алкилкарбамоил, низший алкилсульфонилкарбамоил, фенилсульфонилкарбамоил, карбокси- или низший алкоксикарбонилзамещенный пиридил(низший)алкилкарбамоил, низший алкиленаминокарбонил, низший алкиленаминокарбонил, замещенный карбокси или низшим алкоксикарбонилом, (низший алкиленамино(низший)алкил)карбамоил, замещенный 1 2 заместителями, выбранными из карбокси, низшего алкоксикарбонила и карбамоила, морфолинокарбонил, морфолинилкарбамоил, пиридилкарбамоил, тиазолилкарбамоил, низший алкилтиадиазолилкарбамоил, бензотиазолилкарбамоил, морфолинил(низший)алкилкарбамоил, пиридил(низший)алкилкарбонил, карбазоил, ди(низший)алкилкарбазоил, карбокси(низший)алкил, низший алкоксикарбонил(низший)алкил или бензоил(низший)алкоксикарбонил(низший)алкил; R6 и R7 водород.
где R1 R7 и A определены в п. 1,
или их солей, отличающийся тем, что включает в себя взаимодействие соединения общей формулы II
где R1, R2 и A имеют указанные значения,
или его реакционноспособность производного у карбоксигруппы, или его соли с соединением общей формулы III
где R3 R7 имеют указанные значения,
или его реакционноспособным производным у аминогруппы, или его солью, с получением соединения общей формулы I
где R1 R7 и A имеют указанные значения,
или его соли,
и при необходимости удаляют каждую защитную группу с последующим выделением целевых продуктов и получением соединений формулы I в свободной форме или в виде фармацевтически приемлемой соли.
Приоритеты по признакам:
14.05.90 при R2 изобутил, R3 - N-(низший)алкилиндол-6-ил-метил, R4 бензил, пиридилметил, А -NH-;
03.12.90 при R2 изобутил, R3 - (низший)алкилиндол-6-ил-метил, R4 бензил, пиридилметил, А -O- или низший алкилен;
27.02.91 при R2 низший алкил, кроме изобутила, R3 - индолил-метил, замещенный низшим алкилом или ацилом, R4 низший алкил, ар(низший)алкил или факультативно замещенный гетероциклический (низший)алкил, А -NH-, -О- или низший алкилен.
| Шредер Э., Любке К | |||
| Пептиды | |||
| - М.: Мир, 1967, ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения бензидиновых оснований | 1921 |
|
SU116A1 |
Авторы
Даты
1997-10-10—Публикация
1991-05-13—Подача