Изобретение относится к производным тетразола, проявляющим ингибирующую альдозоредуктазу активность, к способу их получения и к композиции, содержащей производное тетразола в качестве эффективного компонента.
Более конкретно, изобретение касается производных тетразола общей формулы I: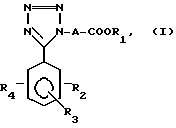
где A алкиленовая группа, имеющая 1-4 атома углерода;
R1 водород или низшая алкильная группа;
R2 водород, гидрокси, галоид, карбокси, C1-7 алкил, амидо, амино, C1-7 алкокси, фенил, фенилокси, низший алкилтио, низший алкилсульфинил, низший алкилсульфонил, нитрогруппа или группа формулы:
NHCOCOOR5
где R5 водород или низший алкил, моно или ди(низший) алкиламиносульфонил или группа формулы: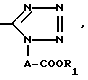
где A и R1 имеют указанные выше значения,
R3 водород, галоид, нитро, C1-7 алкил, C1-7 алкокси или гидрокси;
R4 водород, C1-7 алкил, C1-7 алкокси или группа
NHCOCOOR5
где R5 имеет указанные выше значения при условии, что соединение формулы I не включает следующей комбинации заместителей;
где A метиленовая группа, R2, R3 и R4 атомы водорода, и R1 атом водорода, метильная группа или этильная группа;
где A этилиденовая группа, R2, R3 и R4 атомы водорода, и R1 атом водорода или этильная группа;
где A изопропилиденовая группа, R2, R3 и R4 - атомы водорода, и R1 атом водорода или этильная группа;
где A метиленовая группа, R2 4-бром, 3- или 4-хлор, 3- или 4-метил, 3- или 4-нитро, или 3-трифторметильная группа, R3 и R4 атомы водорода, и R1 атом водорода или этильная группа; и
где A этиленовая группа, R2, R3 и R4 атомы водорода, и R1 атом водорода или этильная группа.
Ингибитор альдозоректазы является полезным в качестве профилактического средства и/или лекарственного средства при диабетических осложнениях. Диабетические осложнения проявляются в разнообразных формах, таких как невропатия, ретинопатия, нефропатия, катаракты и керотопатия. Известно, что эти заболевания вызываются гипергликемией и ненормальным повышением продуцирования сорбита в полиольном пути метаболизма, ненормально, чтобы накапливать большое количество сорбита в клетках.
Ингибитор альдозоредуктазы изобретения заметно и эффективно ингибирует активность альдозоредуктазы, которая катализирует продуцирование сорбита в полиольном пути метаболизма, чтобы предотвращать продуцирование сорбита. В результате, ингибитор альдозоредуктаэы изобретения действует в качестве полезного профилактического средства/лекарственного средства для диабетических осложнений.
Доктор Цуйоши Танимото (Отдел Биологической Химии и Контрольных Стандартов, Национальный Институт Гигиенических Наук) доложил, что ингибиторы альдозоредуктазы являются эффективными для профилактики/лечения диабетических осложнений FARUMASHIN 24, N 5, p. 459-463 (1988). Эта статья раскрывает химические структуры и величины IC50 (концентрации для ингибирования активностей на 50% ) характерных ингибиторов альдозоредуктазы, таких как Алрестатин, Толрестат, 4-изопропил-BPOC, Сорбинил, M-79175, Алконил, ADN-138, Эпалрестат, CT-112 и Статил.
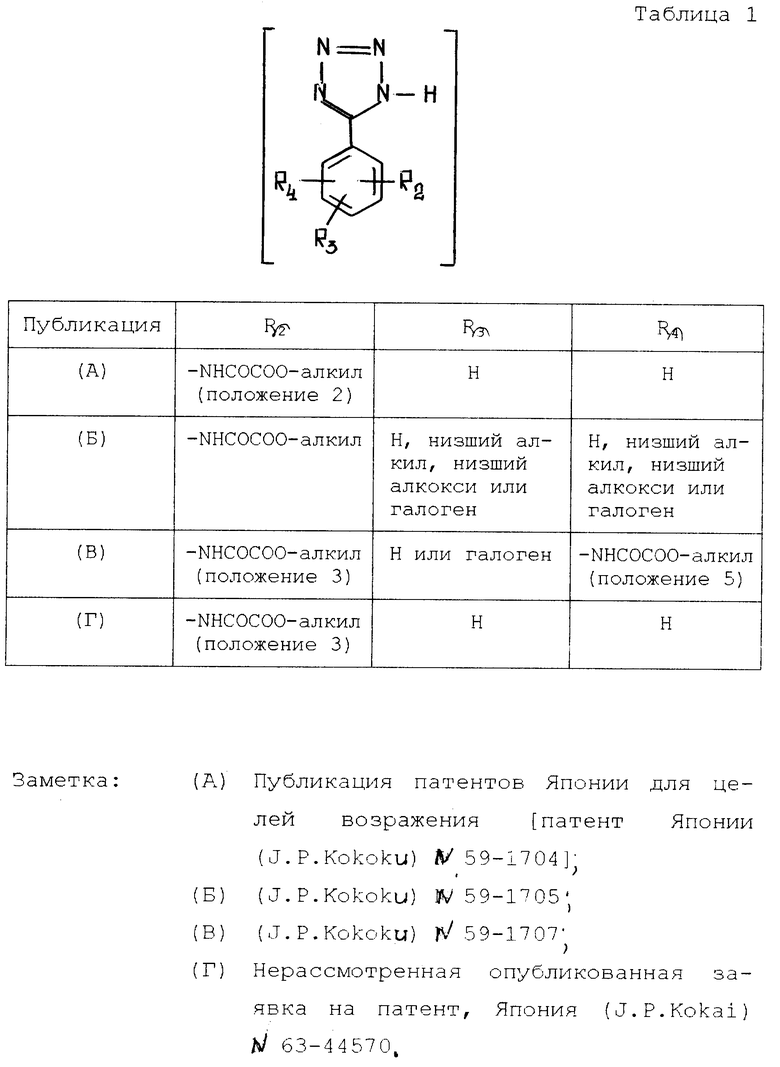
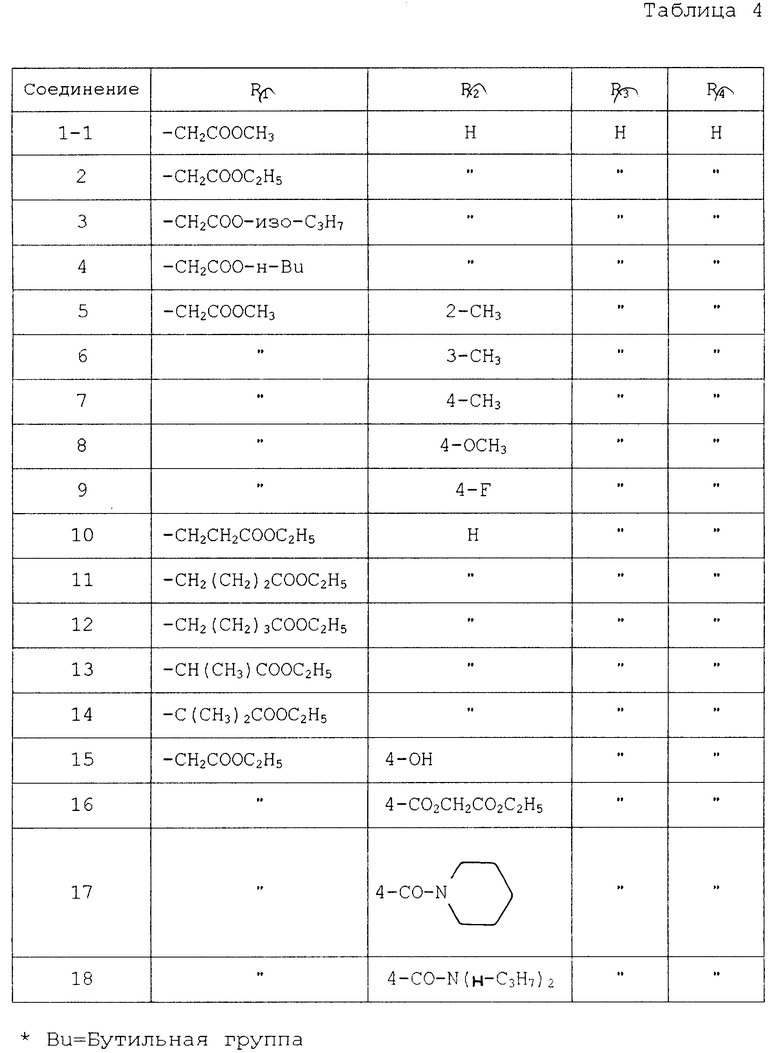
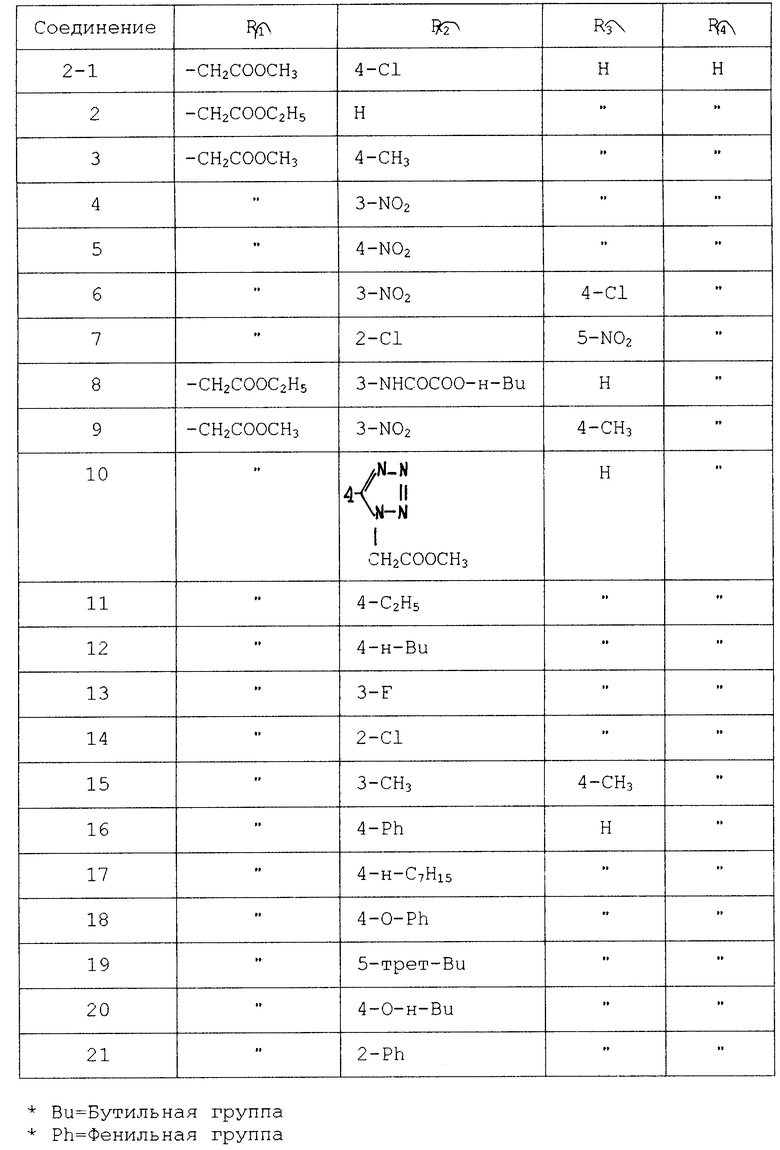
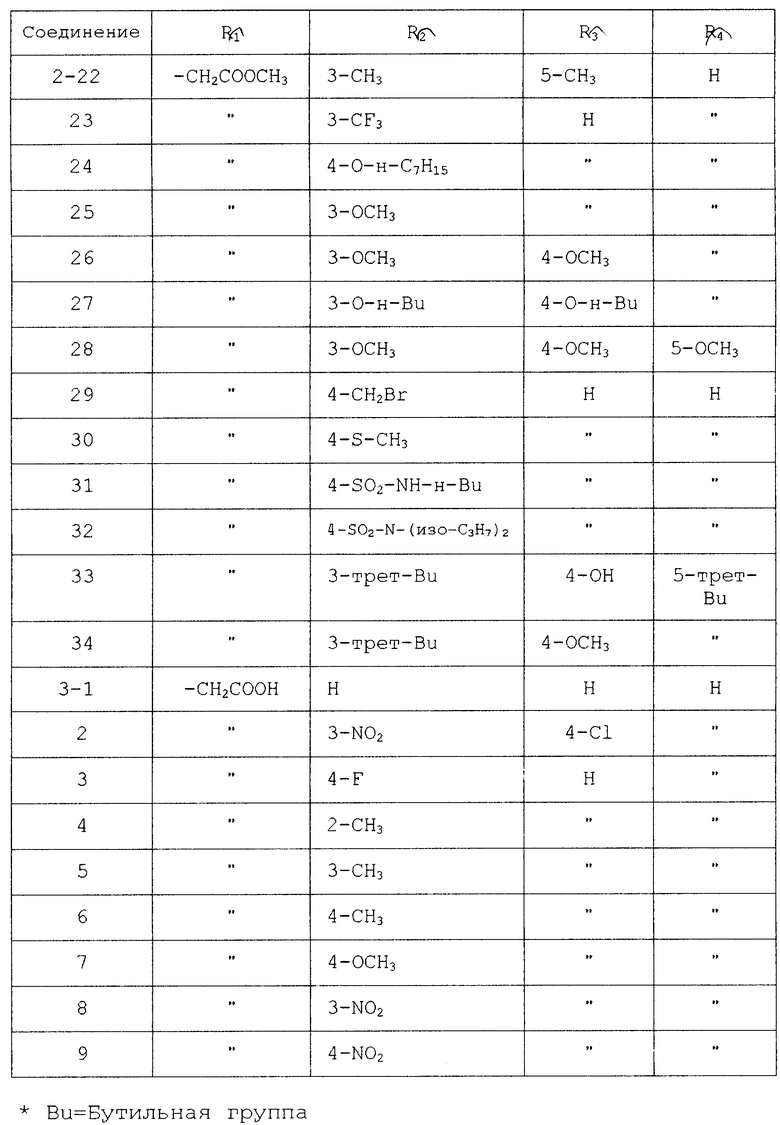
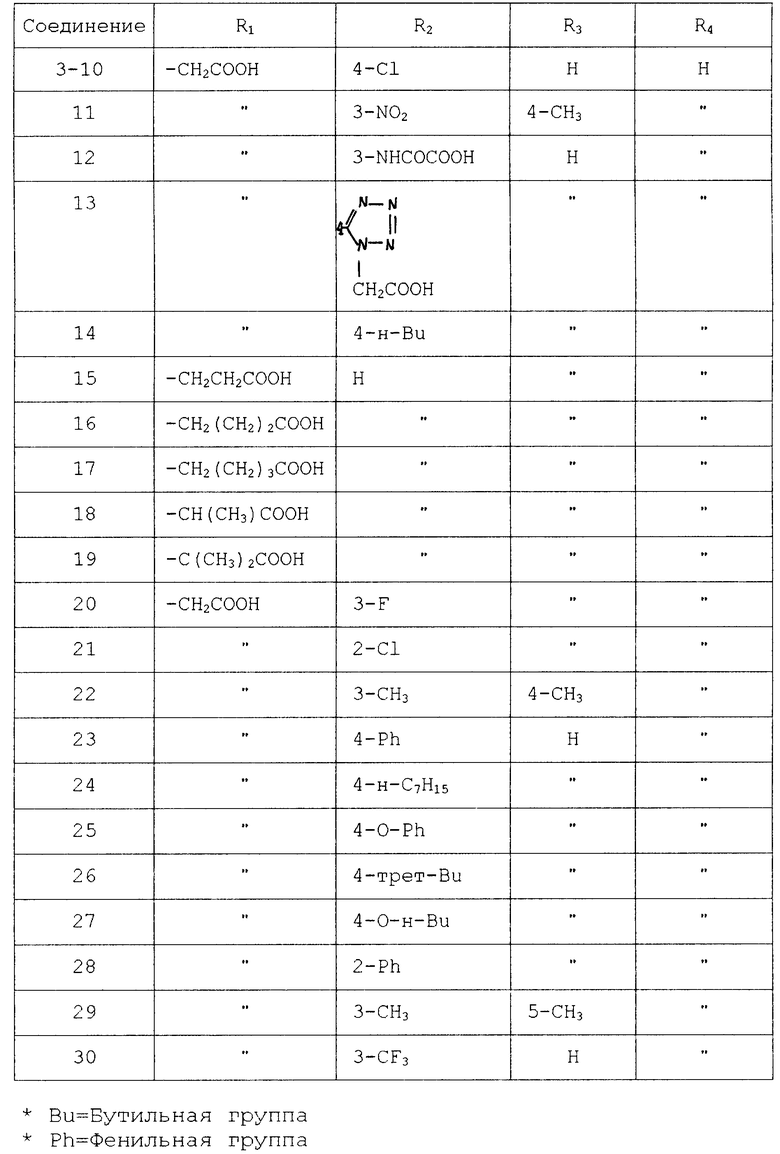
Среди производных тетразола соединения, перечисленные в табл. 1, являются известными и описываются в качестве противоаллергического средства.
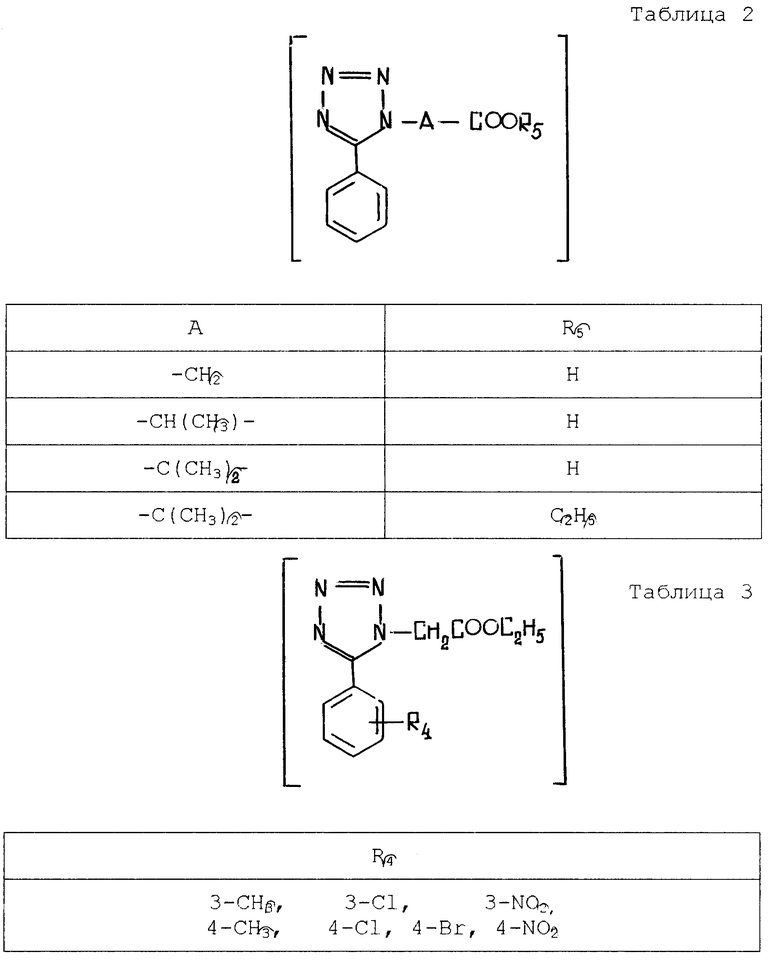
Соединения, перечисленные в табл. 2, описываются в журнале J. Org. Chem. 21, 311 (1956).
Соединения, перечисленные в табл. 3, также описываются в журнале органической химии 18, 1981 (1982).
Однако, до сих пор не было известно, что соединения изобретения имеют полезную ингибирующую альдозоредуктазу активность.
Цель изобретения обеспечение ингибитора альдозоредуктазы, который имеет превосходное ингибирующее действие на альдозоредуктазу и который является весьма эффективным в качестве профилактического средства и/или лекарственного средства при диабетических осложнениях с низкой токсичностью для организма человека.
В ходе интенсивного исследования производных аминофенилтетразола, представленных в табл. 1, которые, как было найдено, являются полезными в качестве противоаллергического средства (J. P. Kokoku N 59-1704, 59-1705, 59-1707 и J. P. Kokai N 63-44570), на предмет других фармакологических активностей, кроме противоаллергической, в настоящем изобретении обнаружено, что эти соединения имеют весьма полезную ингибирующую альдозоредуктазу активность.
Для того чтобы обнаружить наиболее превосходные соединения, в настоящем изобретении синтезировали много соединений, подобные известным соединениям, представленным выше, и провели интенсивные исследования на этих соединениях, включая скрининг. Новые соединения, имеющие общую формулу I, являются весьма превосходными ингибиторами альдозоредуктазы. Изобретение полностью основывается на этом открытии.
А именно, изобретение относится к ингибитору альдозоредуктазы, представленного следующей общей формулой I: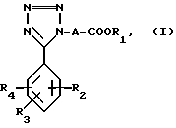
где значения R1, R2, R3, R4 и A указаны выше.
Фармацевтическая композиция изобретения может быть в виде любой из традиционных фармацевтических композиций, и способ ее применения практически на ограничивается, и она может применяться орально и парентерально. Примеры фармацевтических композиций, пригодных для орального применения, включают в себя таблетки, капсулы, порошки, мелкие гранулы, гранулы, жидкости и сиропы. Примеры фармацевтических композиций, пригодных для парентерального применения, включают в себя инъекции, суппозитории, препараты для ингаляции, мази и пластыри. При необходимости фармацевтическая композиция изобретения может содержать фармакологически и фармацевтически приемлемые добавки. Примерами таких добавок являются наполнители, дезинтеграторы, связующие, смазывающие агенты, покрывающие агенты, красящие добавки, разбавители, основания, растворители или растворяющие добавки, изотонизирующие агенты, регулирующие pH агенты, стабилизаторы, пропеллянты и добавки, повышающие клейкость.
Фармацевтические композиции, пригодные для орального и чрескожного применения или применения через слизистую оболочку, могут содержать фармацевтические добавки, включающие в себя наполнители, такие как глюкоза, лактоза, D-маннит, крахмал и кристаллическая целлюлоза; дезинтеграторы, такие как кармеллоза, крахмал и кальцийкармеллоза; связующие, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон и желатин; смазывающие вещества, такие как стеарат магния и тальк; покрывающие агенты, такие как гидроксипропилметилцеллюлоза, сахароза, полиэтиленгликоль и окись титана; основания, такие как вазелин, жидкий парафин, полиэтиленгликоль, желатин, каолин, глицерин, очищенная вода и твердый жир; пропеллянты, такие как фреоновые газы, диметиловый эфир и сжатые газы; добавки, повышающие клейкость, такие как полиакрилат натрия, поливиниловый спирт, метилцеллюлоза, полиизобутилен и полибутен; и слои основания, такие как хлопковая ткань и пластиковые листы (пленки). Фармацевтические композиции, пригодные для инъекций, могут содержать фармацевтические добавки, включающие в себя растворители или растворяющие добавки, такие как дистиллированная вода для инъекций, физиологический раствор и пропиленгликоль, которые могут составлять водные или растворяющиеся при использовании инъекции; изотонизирующие агенты, такие как глюкоза, хлористый натрий, D-маннит и глицерин; и регулирующие pH агенты, такие как неорганические кислоты, органические кислоты, неорганические основания и органические основания.
Дневная доза соединения изобретения зависит от степени болезни пациента. Вообще она составляет от 1 до 1000 мг на взрослого человека. Доза обычно вводится одноразово или несколько раз в день.
Введение может быть осуществлено в любой форме. Например, это можно сделать перорально, подкожно, внутривенно, внутримышечно или локально.
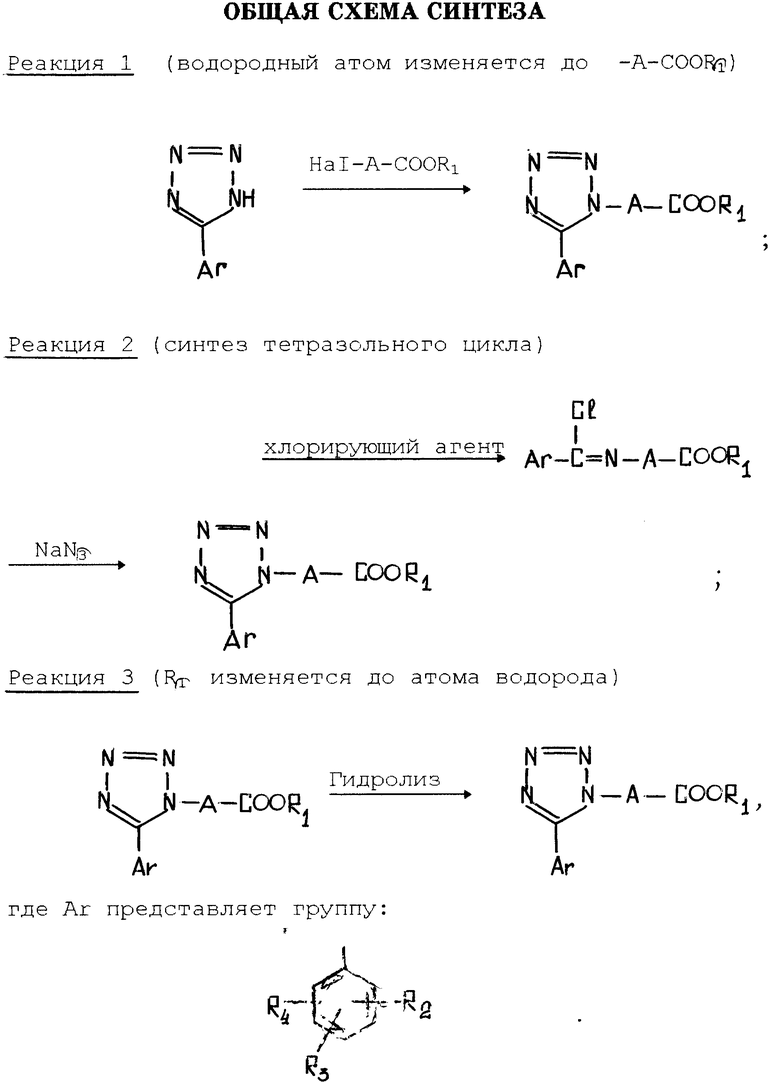
Соединение изобретения может быть синтезировано хлорированием соединения общей формулы II: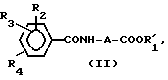
где A, R2, R3 и R4 имеют вышеуказанные значения, и R1 низшая алкильная группа. Полученное соединение общей формулы III: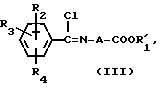
где A, R2, R3, R4 и R1 имеют вышеуказанные значения, подвергают взаимодействию с азидом натрия, и в случае необходимости, полученный целевой продукт общей формулы I, где R1 низший алкил, подвергают гидролизу с получением целевого продукта, где R1 водород.
Общая схема синтеза приведена в конце текста.
Реакция 1 предпочтительно проводится в растворителе, таком как метанол, этанол или пропанол, ниже точки кипения растворителя.
Реакция 2 соответствует реакции циклизации тетразола. В этой реакции N-арилоиламиноалкиловый эфир карбоновой кислоты подвергается взаимодействию с хлорирующим реагентом, таким как пятихлористый фосфор или хлористый тионил, чтобы получить имидоил-хлорид, который затем подвергается реакции с азидом натрия, чтобы получить целевое соединение. Реакция синтеза имидоила хлорида может быть проведена в растворителе, таком как бензол или толуол. Температура реакции предпочтительно является комнатной температурой или более низкой.
В реакции циклизации, промежуточный имидоилхлорид может быть использован без очистки его. Азид натрия предпочтительно используется в количествах от 1,5 до 3 раз (моль) от количества имидоилхлорида. Реакция предпочтительно проводится в диметилформамиде при комнатной температуре.
Реакция 3 показывает, что если соединение, в котором R1 является атомом водорода, должно быть получено, при необходимости, то получаемый карбоксилат по реакции 1 или 2 просто гидролизуется. Эта реакция гидролиза может быть проведена в присутствии основания, такого как гидроокись натрия или гидроокись калия, или кислоты, такой как хлористоводородная кислота, серная кислота, уксусная кислота или трифторуксусная кислота.
Получающееся соединение, имеющее формулу I, может быть выделено и очищено при помощи обычных химических приемов (процессов), таких, как экстракция, перекристаллизация или колоночная хроматография. Очищенное соединение используется в качестве эффективного компонента ингибитора альдозоредуктазы.
Пример 1 (Реакция 1).
(1-1) Метиловый эфир 5-фенил-1-тетразолуксусной кислоты
Два г 5-фенилтетразола (13,68 ммоль) медленно добавляют к 5 мл метанольного раствора, содержащего 770 мг (13,68 ммоль) гидроокиси калия при комнатной температуре. Два мл метанольного раствора, содержащего 1,48 г (13,68 ммоль) метилового эфира хлоруксусной кислоты, по каплям добавляют к полученному раствору при комнатной температуре. После завершения добавления реакционный раствор кипятят с обратным холодильником в течение 20 ч и охлаждают. Реакционный раствор разбавляют этилацетатом и промывают водой. Органическую фазу высушивают над безводным сульфатом магния и выпаривают при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюентом является хлороформ), чтобы получить 0,54 г метилового эфира 5-фенил-1-тетразолуксусной кислоты (выход: 18,1%).
ЯМР (CDCl3) дельта: 3,81 (с. 3H), 5,21 (с. 2H) 7,35-7,67 (м. 5H).
ИК, ν NaCl см-1: 2900, 1760, 1230.
Масс-спектр: m/z 200 (M+).
Следующие соединения получают тем же путем, что и в примере 1 (1-1).
(1-2) Этиловый эфир 5-фенил-1-тетразолуксусной кислоты.
Выход: 16,1%
Подаваемые вещества: 5-фенил-тетразол и этиловый эфир бромуксусной кислоты.
ЯМР (CDCl3) дельта 1,25 (т. 3H), 4,26 (кв. 2Н), 5,20 (с. 2Н), 7,52-7,68 (м. 5H).
ИК, n NaCl см-1: 2980, 1750, 1220, 1020.
Масс-спектр: m/z 232 (M+).
(1-3) Изопропиловый эфир 5-фенил-1-тетразолуксусной кислоты.
Выход: 16,6%
Подаваемые вещества: 5-фенилтетразол и изопропиловый эфир хлоруксусной кислоты.
ЯМР (CDCl3) дельта: 1,22 (д. 6H), 5,08 (д. кв. 1H), 5,17 (с. 2H), 7,52-7,69 (м. 5H).
ИК, n NaCl см-1: 2980, 1750, 1220.
Масс-спектр: m/z 246 (M+).
(1-4) н-Бутиловый эфир 5-фенил-1-тетразолуксусной кислоты.
Выход: 11,2%
Подаваемые вещества: 5-фенилтетразол и н-бутиловый эфир хлоруксусной кислоты,
ЯМР (CDCl3) дельта: 0,90 (т. 3H), 1,30 (д. кв. 2H), 1,57 (д. кв. 2H), 4,20 (т. 2H), 5,2 (с. 2H), 7,52-7,68 (м. 5H).
ИК, n NaCl см-1: 2950, 1750, 1220.
Масс-спектр: m/z 260 (M+).
(1-5) Метиловый эфир 5-(2-метилфенил)-1-тетразолуксусной кислоты.
Выход: 10,4%
Подаваемые вещества: 5-(2-метилфенил)-тетразол и метиловый эфир хлоруксусной кислоты.
ЯМР (CDCl3) дельта: 2,26 (с. 3H), 3,74 (с. 3H), 5,03 (с. 2H), 7,24-7,51 (м. 4H).
ИК, n NaCl см-1: 2950, 1760, 1220, 990.
Масс-спектр: m/z 232 (M+).
(1-6) Метиловый эфир 5-(3-метилфенил)-1- тетразолуксусной кислоты.
Выход: 11,4%
Подаваемые вещества: 5-(3-метилфенил)-тетразол и метиловый эфир хлоруксусной кислоты.
ЯМР (CDCl3) дельта: 1,63 (с. 3H), 3,81 (с. 3H), 5,20 (с. 2H), 7,39-7,44 (м. 4H), 7,49 (д. 1H).
ИК, n NaCl см-1: 2950, 1750, 1220.
Масс-спектр: m/z 232 (M+).
(1-7) Метиловый эфир 5-(4-метилфенил)-1-тетразолуксусной кислоты.
Выход: 10,4%
Подаваемые вещества: 5-(4-метилфенил)-тетразол и метиловый эфир хлоруксусной кислоты.
ЯМР (CDCl3) дельта: 2,45 (с. 3H), 3,81 (с.3H), 5,20 (с. 2H), 7,35(д. 2H), 7,53 (д. 2H).
Температура плавления: 106-107oC.
ИК, n KB r см-1: 3270, 1750, 1610, 1480, 1250, 1220, 990, 830.
Масс-спектр: m/z 232 (M+).
(1-8) Метиловый эфир 5-(4-метоксифенил)-1-тетразолуксусной кислоты.
Выход: 8,5%
Подаваемые вещества: 5-(4-метоксифенил)-тетразол и метиловый эфир хлоруксусной кислоты.
ЯМР (CDCl3) дельта: 3,82 (с. 3H), 3,88 (с. 3H), 5,20 (с. 2H), 7,05 (д. 2H), 7,59 (д. 2H).
ИК, n NaCl см-1: 3000, 2950, 1760, 1260, 840.
Масс-спектр: m/z 249 (M+).
(1-9) Метиловый эфир 5-(4-фторфенил)-1-тетразолуксусной кислоты.
Выход: 10,8%
Подаваемые вещества: 5-(4-фторфенил)-тетразол и метиловый эфир хлоруксусной кислоты.
Температура плавления: 101-102, 5oC.
ЯМР (CDCl3) дельта: 3,82 (с. 3H), 5,20 (с. 2H), 7,70 (дв.д. 2H), 7,27 (дв.д. 2H).
ИК, n KB r см-1: 2950, 1760, 1480, 1260, 610.
Масс-спектр: m/z 236 (M+).
(1-10) Этиловый эфир 3-(5-фенилтетразол-1-ил)-пропионовой кислоты.
Выход: 15,1%
Подаваемые вещества: 5-фенил-тетразол и этиловый эфир 3-бромпропионовой кислоты.
ЯМР (CDCl3) дельта: 1,23 (т. 3H), 3,09 (т. 2H), 4,12 (кв. 2H), 4,67 (т. 2H), 7,56-7,76 (м. 5H).
ИК, n NaCl см-1: 2980, 1730, 1460, 1200, 1020.
Масс-спектр: m/z 246 (M+).
(1-11) Этиловый эфир 4-(5-фенилтетразол-1-ил)-масляной кислоты.
Выход: 14,2%
Подаваемые вещества: 5-фенилтетразол и этиловый эфир 4-броммасляной кислоты.
ЯМР (CDCl3) дельта: 1,22 (т. 3H), 2,28 (д.кв. 2H), 2,39 (т. 2H), 4,08 (кв. 2H), 4,52 (т. 2H), 7,55-7,72 (м. 5H).
ИК, n NaCl см-1: 2980, 1720, 1470, 1200, 1010, 740,
Масс-спектр: m/z 260 (M+).
(1-12) Этиловый эфир 5-(5-фенилтетразол-1-ил)валериановой кислоты.
Выход: 13,2%
Подаваемые вещества: 5-фенилтетразол и этиловый эфир 5-бромвалериановой кислоты.
ЯМР (CDCl3) дельта: 1,24 (т. 3H), 1,64 (д.кв. 2H), 2,00 (дв.кв. 2H), 2,31 (т. 2H), 4,11 (кв. 2H), 4,44 (т. 2H), 7,56-7,68 (м. 5H).
ИК n NaCl см-1: 2980, 1730, 1470, 1180, 1030.
Масс-спектр: m/z 274 (M+).
(1-13) Этиловый эфир 2-(5-фенилтетразол-1-ил)-пропионовой кислоты.
Выход: 12,2%
Подаваемые вещества: 5-фенилтетразол и этиловый эфир 2-бромпропионовой кислоты.
ЯМР (CDCl3) дельта: 1,22 (т. 3H), 1,98 (л. 3H), 4,22 (кв. 2H), 5,23 (кв. 1H), 7,62-7,72 (м. 5H).
ИК n NaCl см-1: 2980, 1750, 1470, 1450, 1220, 690.
Масс-спектр: m/z 246 (M+).
(1-14) Этиловый эфир 2-(5-фенилтетразол-1-ил)-2-метилпропионовой кислоты.
Выход: 11,7%
Подаваемые вещества: 5-фенилтетразол и этиловый эфир a-бромизомасляной кислоты.
ЯМР (CDCl3) дельта: 1,20 (т. 3H), 2,08 (с. 6H), 4,20 (кв. 2H), 7,63-7,69 (м. 5H).
ИК, n NaCl см-1: 2990, 1750, 1450, 1280, 1020, 740.
Масс-спектр: m/z 260 (M+).
(1-15) Этиловый эфир 5-(4-оксифенил)-1-тетразол уксусной кислоты.
Выход: 22,0%
Подаваемые вещества: 5-(4-оксифенил)-тетразол и этиловый эфир бромуксусной кислоты.
ЯМР (CDCl3) дельта: 1,27 (т. 3H, J 7,3 гц), 4,30 (кв. 2H, J 7,3 гц), 5,19 (с. 2H), 7,01 (д. 2H, J 8,5 гц), 7,09 (уш.с. 1H), 7,52 (д. 2H, J 8,5 гц).
ИК, n NaCl см-1: 3190, 1750, 1610, 1480, 1220.
Масс-спектр: m/z 277 (M+).
(1-16) Этиловый эфир 5-(4-этоксикарбонил-метоксикарбонилфенил)-1-тетразолуксусной кислоты,
Выход: 20,0%
Подаваемые вещества: 5-(4-карбоксифенил)-тетразол и этиловый эфир бромуксусной кислоты.
ЯМР (CDCl3) дельта: 1,27 (т. 3H, J 7,3 гц), 1,32 (т. 3H, J 7,3 гц), 4,27 (кв. 2H, J 7,3 гц), 4,28 (кв. 2H, J 7,3 гц), 4,90 (с. 2H), 5,22 (с. 2H), 7,79 (дв.д. 2H, J 1,6 и 6,4 гц), 8,28 (дв.д. 2H, J 1,6 и 6,4 гц).
ИК n NaCl см-1: 3460, 2960, 1720, 1220, 1120, 1020.
Масс-спектр: m/z 382 (M+).
(1-17) Этиловый эфир 5-(4-пиперилинокарбонилфенил)-1-тетразолуксусной кислоты.
Выход: 19,0%
Подаваемые вещества: 5-(4-пиперидинокарбонилфенил)-тетразол и этиловый эфир бромуксусной кислоты.
ЯМР (CDCl3) дельта: 1,28 (т. 3H, J 7,25 гц), 1,55-1,71 (м. 6H), 3,34 (уш. с. 2H), 3,74 (уш.с. 2H), 4,27 (кв. 2H, J 7,25 гц), 5,18 (с. 2H), 7,56 (дв.д. 2H, J 2,0 и 6,45 гц), 7,70 (дв.д. 2H, J 2,0 и 6,45 гц).
ИК n NaCl см-1: 3470, 2940, 1750, 1630, 1440.
Масс-спектр: m/z 342 (M+).
(1-18) Этиловый эфир 5-(4-ди-н-пропиламино карбонил-фенил)-1-тетразолуксусной кислоты.
Выход: 15,4%
Подаваемые вещества: 5-(4-ди-н-пропиламинокарбонилфенил)-тетразол и этиловый эфир бромуксусной кислоты.
ЯМР (CDCl3) дельта: 0,77 (т. 3H, J 6,9 гц), 1,03 (т. 3H, J 6,9 гц), 1,28 (т. 3H, J 6,9 гц), 1,54-1,73 (м. 4H), 3,17 (т. 2H, J 7,7 гц), 3,49 (т. 2H, J 7,7 гц), 4,27 (кв. 2H, J 6,9 гц), 5,18 (с. 3H), 7,54 (д. 2H, J 8,1 гц), 7,69 (д. 2H, J 8,1 гц).
ИК, n NaCl см-1: 3420, 2950, 1750, 1620, 1440.
Масс-спектр: m/z 359 (M+).
Пример 2 (Реакция 2).
(2-1) Метиловый эфир 5-(4-хлорфенил)-1-тетразолуксусной кислоты.
Пятихлористый фосфор (500 мг, 2,88 ммoль) медленно добавляют к 13 мл безводного бензола, содержащего 520 мг (2,29 ммоль) сложного метилового эфира N-(4-хлорбензоил)-глицина при комнатной температуре. После перемешивания при комнатной температуре в течение 30 мин, реакционную смесь выпаривают при 40oC при пониженном давлении. Остаток растворяют в 5 мл диметилформамида. Раствор по каплям добавляют к 2 мл диметилформамидной суспензии, содержащей 300 мг (4,6 ммоль) азида натрия, при комнатной температуре в пределах от 40 до 60 мин, перемешивая эту смесь. После завершения добавления, смесь дополнительно перемешивают при комнатной температуре в течение 30 мин и выливают в ледяную воду. Выпадающие в осадок кристаллы собирают фильтрацией, промывают водой, высушивают при пониженном давлении, а затем перекристаллизовывают из метанола, чтобы получить 230 мг целевого продукта (выход: 40%).
Температура плавления: 156-158oC.
ЯМР (CDCl3) дельта: 3,81 (с. 3H), 5,38 (с. 2H), 7,96 (д. 2H), 8,42 (д. 2H).
ИК n KB r см-1: 3100, 2950, 1750, 1520, 1440, 1350, 1220.
Масс-спектр: m/z 252 (M+).
Следующие соединения получают таким же путем, что и в примере 2 (2-1).
(2-2) Этиловый эфир 5-фенил-1-тетразолуксусной кислоты.
Выход: 41,1%
Подаваемое вещество: сложный этиловый эфир N-бензоил-глицина.
Данные анализа соединения являются такими же, что и для соединения примера 1 (1-2).
(2-3) Метиловый эфир 5-(4-метилфенил)-1-тетразолуксусной кислоты,
Выход: 50,0%
Подаваемое вещество: сложный метиловый эфир N-(4-метил-бензоил)-глицина.
Данные анализа соединения являются такими же, что и для соединения примера 1 (1-7).
(2-4) Метиловый эфир 5-(3-нитрофенил)-1-тетразолуксусной кислоты.
Выход: 31,0%
Подаваемое вещество: сложный метиловый эфир N-(3-нитро-бензоил)-глицина.
Температура плавления: 122-123oC.
ЯМР (CDCl3) дельта: 3,86 (с. 3H), 5,53 (с. 3H), 7,80 (т. 1H), 8,47 (дв. л. 1H), 8,09 (д. 1H).
ИК n KB r см-1: 3000, 1750, 1540, 1520, 1340, 1220, 1000, 820, 710.
Масс-спектр: m/z 263 (M+).
(2-5) Метиловый эфир 5-(4-нитрофенил)-1-тетразолуксусной кислоты.
Выход: 51,0%
Подаваемое вещество: сложный метиловый эфир N-(4-нитро-бензоил)-глицина.
Температура плавления: 155-156oC.
ЯМР (CDCl3) дельта: 3,84 (с. 3H), 5,25 (с. 2H), 7,90 (л. 2H), 8,43 (д. 2H).
ИК n KB r см-1: 3100, 2950, 1750, 1520, 1440, 1350, 1220, 980, 850.
Масс-спектр: m/z 263 (M+).
(2-6) Метиловый эфир 5-(3-нитро-4-хлорфенил)-1-тетразолуксусной кислоты.
Выход: 30,0%
Подаваемое вещество: сложный метиловый эфир N-(3-нитро-4-хлорбензоил) глицина.
Температура плавления: 89-91oC.
ЯМР (CDCl3) дельта: 3,79 (с. 3H), 5,19 (с. 2H), 7,71 (д. 1H), 7,83 (д. 1H), 8,16 (д. 1H).
ИК, n KB r см-1: 3070, 3000, 2950, 1740, 1550, 1340, 1230, 1120.
Масс-спектр: m/z 297 (M+).
(2-7) Метиловый эфир 5-(2-хлор-5-нитрофенил)-1-тетразолуксусной кислоты.
Выход: 39,0%
Подаваемое вещество: сложный метиловый эфир N-(2-хлор-5-нитробензоил)-глицина,
Температура плавления: 128-130oC.
ЯМР (CDCl3) дельта: 3,75 (с. 3H), 5,17 (с. 2H), 7,79 (дв.д. 1H), 8,41 (дв.д. 1H), 8,45 (с. 1H).
ИК  KB r см-1: 3100, 3070, 3000, 2950, 1750, 1620, 1520, 1350, 1220.
KB r см-1: 3100, 3070, 3000, 2950, 1750, 1620, 1520, 1350, 1220.
Масс-спектр: m/z 297 (M+).
(2-8) Бутиловый эфир 3'-(1-этоксикарбонилметил-тетразол-5-ил)-оксаниловой кислоты.
Выход: 46,3%
Подаваемое вещество: сложный этиловый эфир N-[3-(бутоксиамидо)-бензоил] -глицина.
Температура плавления: 103-105oC.
ЯМР (CDCl3) дельта: 0,99 (т. 3H), 1,27 (т. 3H), 1,45 (дв.кв. 2H), 1,80 (дв. кв.2H), 4,30 (кв. 2H), 4,47 (т. 2H), 5,27 (с. 2H), 7,56 (д. 2H), 7,71-7,74 (м. 1H), 8,13 (д. 1H), 9,05 (уш. с. 1H).
ИК, n KB r см-1: 3100, 2950, 1740, 1700, 1600, 1280, 1220, 800.
Масс-спектр: m/z 375 (M+).
(2-9) Метиловый эфир 5-(3-нитро-4-метилфенил)-1-тетразолуксусной кислоты.
Выход: 51,0%
Подаваемое вещество: сложный метиловый эфир N-(3-нитро-4-метилбензоил)-глицина.
Температура плавления: 85-86oC.
ЯМР (CDCl3) дельта: 2,72 (с. 3H), 3,86 (с. 3H), 5,25 (с. 2H), 7,70 (д. 1H), 7,88 (дв.д. 1H), 8,29 (д. 1H).
ИК, n KB r см-1: 3000, 2950, 1750, 1520, 1340, 1230.
Масс-спектр: m/z 252 (M+).
(2-10) 1,4-бис-(1-метоксикарбонилметил-тетразол-5-ил)-бензол.
Выход: 40,0%
Подаваемое вещество: N,N'-бис-(метоксикарбонилметил)-терефтальамид.
Температура плавления: 182-183oC.
ЯМР (CDCl3) дельта: 3,68 (с. 6H), 5,73 (с. 4H), 8,0 (с. 4H).
ИК, n KB r см-1: 3080, 3000, 2950, 1750, 1730, 1440, 1220.
Масс-спектр: m/z 358 (M+).
(2-11) Метиловый эфир 5-(4-этилфенил)-1-тетразолуксусной кислоты.
Выход: 36,0%
Подаваемое вещество: сложный метиловый эфир N-(4-этил-бензоил)-глицина.
ЯМР (CDCl3) дельта: 1,29 (т. 3H), 2,74 (дв.д. 2H), 3,81 (с. 3H), 5,20 (с. 2H), 7,37 (д. 2H), 7,56 (д. 2H).
ИК, n NaCl см-1: 2950, 1750, 1620, 1480, 1440, 1220, 840.
Масс-спектр: m/z 246 (M+).
(2-12) Метиловый эфир 5-(4-н-бутилфенил)-1-тетразолуксусной кислоты.
Выход: 55,0%
Подаваемое вещество: сложный метиловый эфир N-(4-н-бутилбензоил)-глицина.
ЯМР (CDCl3) дельта: 0,94 (т. 3H), 1,39 (дв.кв. 2H), 1,64 (дв.д. 2H), 2,7 (т. 2H), 3,81 (с. 3H), 5,20 (с. 2H), 7,45 (д. 2H), 7,55 (д. 2H).
ИК n NaCl см-1: 2900, 1750, 1610, 1480, 1460, 1220.
Масс-спектр: m/z 272 (M+).
(2-13) Метиловый эфир 5-(3-фторфенил)-1-тетразолуксусной кислоты.
Выход: 40%
Подаваемое вещество: сложный метиловый эфир N-(3-фтор-бензоил)-глицина.
ЯМР (CDCl3) дельта: 3,83 (с. 3H), 5,22 (с. 2H), 7,28-7,60 (м. 4H).
ИК n NaCl см-1: 2950, 1760, 1590, 1480, 1230, 880, 800.
Масс-спектр: m/z 236 (M+).
(2-14) Метиловый эфир 5-(2-хлорфенил)-1-тетразолуксусной кислоты.
Выход: 45%
Подаваемое вещество: сложный метиловый эфир N-(2-хлор-бензоил)-глицина.
ЯМР (CDCl3) дельта: 3,71 (с. 3H), 5,13 (с. 2H), 7,27-7,59 (м. 4H).
ИК n NaCl см-1: 3600, 2950, 1760, 1460, 1220, 990, 800.
Масс-спектр: m/z 252 (M+).
(2-15) Метиловый эфир 5-(3,4-диметилфенил)-1-тетразолуксусной кислоты.
Выход: 50%
Подаваемое вещество: сложный метиловый эфир N-(3,4-диметилбензоил)-глицина.
ЯМР (CDCl3) дельта: 2,33 (с. 6H), 3,81 (с. 3H), 5,20 (с. 2H), 7,30-7,31 (м. 2H), 7,45 (с. 1H).
ИК n NaCl см-1: 2950, 1750, 1480, 1440, 1360, 1220, 990, 790.
Масс-спектр: m/z 246 (M+).
(2-16) Метиловый эфир 5-(4-бифенилил)-1-тетразолуксусной кислоты.
Выход: 46,4%
Подаваемое вещество: сложный метиловый эфир N-(4-бифеноил)-глицина.
Температура плавления: 146-147oC.
ЯМР (CDCl3) дельта: 3,84 (с. 3H), 5,26 (с. 2H), 7,36-7,80 (м. 9H).
ИК n KB r см-1: 2910, 1760, 1730, 1470, 1210.
Масс-спектр: m/z 294 (M+).
(2-17) Метиловый эфир 5-(4-н-гептилфенил)-1-тетразолуксусной кислоты.
Выход: 51%
Подаваемое вещество: сложный метиловый эфир N-(4-н-гептилбензоил)-глицина.
Температура плавления: 54-55oC.
ЯМР (CDCl3) дельта: 0,88 (т. 3H), 1,28-1,36 (м. 8H), 1,64 (м. 2H), 2,69 (т. 2H), 3,82 (с. 3H), 5,20 (с. 2H), 7,35 (л. 2H), 7,55 (д. 2H).
ИК, n KB r см-1: 2910, 2850, 1740, 1440, 1370, 1260, 1220.
Масс-спектр: m/z 316 (M+).
(2-18) Метиловый эфир 5-(4-феноксифенил)-1-тетразолуксусной кислоты.
Выход: 46%
Подаваемое вещество: сложный метиловый эфир N-(4-феноксибензоил)-глицина.
ЯМР (CDCl3) дельта: 3,82 (с. 3H), 5,20 (с. 2H), 7,10-7,25 (м. 5H), 7,42 (т. 2H), 7,62 (д. 2H).
ИК, n NaCl см-1: 3000, 2950, 1750, 1610, 1580, 1470, 1440, 1360, 1240, 750.
Масс-спектр: m/z 310 (M+).
(2-19) Метиловый эфир 5-(4-трет-бутилфенил)-1-тетразолуксусной кислоты.
Выход: 51%
Подаваемое вещество: сложный метиловый эфир N-(4-трет-бутилбензоил)-глицина.
ЯМР (CDCl3) дельта: 1,37 (с. 9H), 3,83 (с. 3H), 5,21 (с. 2H), 7,58 (с. 4H).
ИК, n NaCl см-1: 2950, 1750, 1610, 1480, 1440, 1360, 1260, 1220, 1110, 1000, 840.
Масс-спектр: m/z 274 (M+).
(2-20) Метиловый эфир 5-(4-н-бутоксифенил)-1-тетразолуксусной кислоты.
Выход: 46%
Подаваемое вещество: сложный метиловый эфир N-(4-н-бутоксибензоил)-глицина.
ЯМР (CDCl3) дельта: 0,99 (т. 3H), 1,47-1,61 (м. 2H), 1,78-1,82 (м. 2H), 3,82 (с. 3H), 4,03 (т. 2H), 5,19 (с. 2H), 7,03 (д. 2H), 7,58 (д. 2H).
ИК, n NaCl см-1: 2950, 1760, 1610, 1480, 1250, 1220, 840.
Масс-спектр: m/z 290 (M+).
(2-21) Метиловый эфир 5-(2-бифенилил)-1-тетразолуксусной кислоты.
Выход: 38%
Подаваемое вещество: сложный метиловый эфир N-(2-бифенилоил)-глицина.
ЯМР (CDCl3) дельта: 3,55 (с. 3H), 4,37 (с. 2H), 7,13-7,70 (м. 9H).
ИК, n NaCl см-1: 3000, 2950, 1760, 1430, 1220, 980.
Масс-спектр: m/z 294 (M+).
(2-22) Метиловый эфир 5-(3,5-диметилфенил)-1-тетразолуксусной кислоты.
Выход: 60%
Подаваемое вещество: сложный метиловый эфир N-(3,5-диметилбензоил)-глицина.
ЯМР (CDCl3) дельта: 2,39 (с. 6Н), 3,82 (с. 3H), 5,20 (с. 2H), 7,23 (с. 1H), 7,27 (с. 2H).
ИК, n NaCl см-1: 2960, 1760, 1470, 1440, 1240, 1220.
Масс-спектр: m/z 246 (M+).
(2-23) Метиловый эфир 5-(3-трифторметилфенил)-1-тетразолуксусной кислоты.
Выход: 61%
Подаваемое вещество: сложный метиловый эфир N-(3-трифторметилбензоил)-глицина.
Температура плавления: 75-76oC.
ЯМР (CDCl3) дельта: 3,84 (с. 3H), 5,22 (с. 2H), 7,70-7,96 (м. 4H).
ИК, n KB r см-1: 2970, 1750, 1440, 1340, 1230, 1120.
Масс-спектр: m/z 286 (M+).
(2-24) Метиловый эфир 5-(4-н-гептоксифенил)-1-тетразолуксусной кислоты.
Выход: 57,3%
Подаваемое вещество: сложный метиловый эфир N-(4-н-гептоксибензоил)-глицина.
Температура плавления: 51-52oC.
ЯМР (CDCl3) дельта: 0,90 (т. 3H, J 6,45 гц), 1,32-1,46 (м. 2H), 1,80 (м. 2H), 3,82 (с. 3H), 4,03 (т. 4H, J 6,45 гц), 5,19 (с. 2H), 7,03 (д. 2H, J 8,86 гц), 7,58 (д. 2H, J 8,86).
ИК, n KB r см-1: 2950, 2850, 1760, 1620, 1260, 840.
Масс-спектр: m/z 332 (M+).
(2-25) Метиловый эфир 5-(3-метоксифенил)-1-тетразолуксусной кислоты.
Выход: 42,8%
Подаваемое вещество: сложный метиловый эфир N-(3-метоксибензоил)-глицина.
ЯМР (CDCl3) дельта: 3,82 (с. 3H), 3,86 (с. 3H), 5,21 (с. 2H), 7,10-7,22 (м. 3H), 7,43-7,49 (м. 1H).
ИК n NaCl см-1: 3000, 2950, 1750, 1580, 1480, 1440, 1280, 1230, 1220, 1030.
Масс-спектр: m/z 249 (M+).
(2-26) Метиловый эфир 5-(3,4-диметоксифенил)-1-тетразолуксусной кислоты.
Выход: 63,7%
Подаваемое вещество: сложный метиловый эфир N-(3,4-диметоксибензоил)-глицина.
Температура плавления: 129,5-130,5oC.
ЯМР (CDCl3) дельта: 3,82 (с. 3H), 3,93 (с. 3H), 3,96 (с. 3H), 5,21 (с. 2H), 6,99 (д. 1H, J 8,48 гц), 7,15 (дв.д. 1H, J 2,02 и 8,46 гц), 7,27 (д. 1H, J 2,02 гц).
ИК n KB r см-1: 3000, 2950, 1750, 1610, 1500, 1440, 1240, 1020.
Масс-спектр: m/z 278 (M+).
(2-27) Метиловый эфир 5-(3,4-ди-н-бутоксифенил)-1-тетразолуксусной кислоты.
Выход: 74,5%
Подаваемое вещество: сложный метиловый эфир N-(3,4-ди-н-бутоксибензоил)-глицина.
Температура плавления: 77-78oC.
ЯМР (CDCl3) дельта: 0,99 (т. 3H, J 7,25 гц), 1,00 (т. 3H, J 7,25 гц), 1,48-1,55 (м. 6H), 1,79-1,85 (м. 4H), 3,82 (с. 3H), 4,03 (дв.д. 2H, J 6,45 и 10,48 гц), 5,20 (с. 2H), 6,97 (д. 1H, J 8,46, гц), 7,10 (дв.д. 1H, J 2,02 и 8,46 гц), 7,24 (д. 1H, J 2,02 гц).
ИК n KB r см-1: 2950, 1760, 1600, 1500, 1440, 1220.
Масс-спектр: m/z 362 (M+).
(2-28) Метиловый эфир 5-(3,4,5-триметоксифенил)-1-тетразолуксусной кислоты.
Выход: 73,5%
Подаваемое вещество: сложный метиловый эфир N-(3,4,5-триметоксибензоил)-глицина.
Температура плавления: 99,5-100,5oC.
ЯМР (CDCl3) дельта: 3,84 (с. 3H), 3,89 (с. 6H), 3,92 (с. 3H), 5,21 (с. 2H), 6,88 (с. 2H).
ИК, n KB r см-1: 2950, 1740, 1590, 1500, 1440, 1240, 1120, 1000.
Масс-спектр: m/z 308 (M+).
(2-29) Метиловый эфир 5-(4-бромметилфенил)-1-тетразолуксусной кислоты.
Выход: 41%
Подаваемое вещество: сложный метиловый эфир N-(4-бромметилбензоил)-глицина.
ЯМР (CDCl3) дельта: 3,82 (с. 3H), 4,66 (с. 2H), 5,20 (с. 2H), 7,58 (д. 2H, J 8,5 гц), 7,67 (д. 2H, J 8,5 гц).
ИК, n NaCl см-1: 3000, 2950, 1750, 1440, 1220, 990.
Масс-спектр: m/z 311 (M+).
(2-30) Метиловый эфир 5-(4-метилтиофенил)-1-тетразолуксусной кислоты.
Выход: 44%
Подаваемое вещество: сложный метиловый эфир N-(4-метилтиобензоил)-глицина.
ЯМР (CDCl3) дельта: 2,54 (с. 3H), 3,82 (с. 3H), 5,20 (с. 2H), 7,37 (д. 2H, J 8,5 гц), 7,57 (д. 2H, J 8,5 гц).
ИК, n NaCl см-1: 3000, 2950, 1750, 1600, 1440, 1220.
Масс-спектр: m/z 264 (M+).
(2-31) Метиловый эфир 5-(4-н-бутиламиносульфонил фенил)-1-тетразолуксусной кислоты.
Выход: 38%
Подаваемое вещество: сложный метиловый эфир N-(4-н-бутиламиносульфонилбензоил)-глицина.
ЯМР (CDCl3) дельта: 0,88 (т. 3H, J 7,2 гц), 1,23-1,39 (м. 2H), 1,44-1,54 (м. 2H), 3,00-3,06 (м. 2H), 3,84 (с. 3H), 4,55 (т. 1H, J 6,0 гц), 5,23 (с. 2H), 7,83 (дв.д. 2H, J 1,6 и 8,5 гц), 8,05 (дв.д. 2Н, J 1,6 и 8,5 гц).
ИК, n NaCl см-1: 3280, 2960, 1760, 1440, 1330.
Масс-спектр: m/z 353 (M+).
(2-32) Метиловый эфир 5-(4-диизопропиламино сульфонилфенил)-1-тетразолуксусной кислоты.
Выход: 46%
Подаваемое вещество: сложный метиловый эфир N-(4-диизопропиламиносульфонилбензоил)-глицина.
Температура плавления: 140-141oC.
ЯМР (CDCl3) дельта: 1,28 (с. 6H), 1,31 (с. 6H), 3,77 (кв. 1H, J 6,65 гц), 3,83 (с. 3H), 5,21 (с. 2H), 7,79 (дв.д. 2H, J 1,6 и 6,85 гц), 8,05 (дв. д. 2H, J 1,6 и 6,85 гц).
ИК n KB r см-1: 3420, 1750, 1330, 1150.
Масс-спектр: m/z 356 (M+).
(2-33) Метиловый эфир 5-(3,5-ди-трет-бутил-4-оксифенил)-1-тетразолуксусной кислоты.
Выход: 40%
Подаваемое вещество: сложный метиловый эфир N-(3,5-ди-трет-бутил-4-оксибенэоил)-глицина.
Температура плавления: 135-137oC.
ЯМР (CDCl3) дельта: 1,46 (с. 18H), 3,84 (с. 3H), 5,18 (с. 2H), 5,64 (с. 1H), 7,45 (с. 2H).
ИК n KB r см-1: 3600, 2950, 1750, 1420, 1220, 1100.
Масс-спектр: m/z 346 (M+).
(2-34) Метиловый эфир 5-(3,5-ди-трет-бутил-4-метоксифенил)-1-тетразолуксусной кислоты.
Выход: 40%
Подаваемое вещество: сложный метиловый эфир N-(3,5-ди-трет-бутил-4-метоксибензоил)-глицина.
Температура плавления: 110-111oC.
ЯМР (CDCl3) дельта: 1,44 (с. 18H), 3,74 (с. 3H), 3,84 (с. 3H), 5,18 (с. 2H), 7,52 (с. 2H).
ИК n KB r см-1: 2950, 1750, 1400, 1220, 1000.
Масс-спектр: m/z 360 (M+).
Пример 3 (Реакция 3).
(3-1) 5-фенил-1-тетразолуксусная кислота.
Смесь 100 мг метилового эфира 5-фенил-1-тетразолуксусной кислоты, 0,6 мл уксусной кислоты и 1 мл 4N соляной кислоты перемешивают при температуре от 80 до 90oC в течение 2 ч. Реакционный раствор выпаривают при пониженном давлении. Выпадающее в осадок твердое вещество фильтруют, промывают холодной водой и перекристаллизовывают из 50%-ного раствора этанола в воде, чтобы получить 64,1 мг (выход: 69,2%) 5-фенилтетразол-1-уксусной кислоты.
Температура плавления: 179-180oC (разложение).
ЯМР (DMCO-d6) дельта: 3,42 (уш.с. 3H), 5,51 (с. 2H), 7,59-7,78 (м. 5H).
ИК n KB r см-1: 3000, 2500, 1730, 1460, 1230.
Масс-спектр: m/z 204 (M+).
Следующие соединения получают таким же путем, что и в примере 3 (3-1).
(3-2) 5-(3-нитро-4-хлорфенил)-1-тетразолуксусная кислота.
Выход: 41%
Температура плавления: от 189 до 190oC (разложение).
Подаваемое вещество: метиловый эфир 5-(3-нитро-4-хлорфенил)-1-тетразолуксусной кислоты.
ЯМР (DMCO-d6) дельта: 3,35 (уш.с, 4H), 5,59 (с. 3H), 8,01 (д. 2H), 8,48 (д. 1H).
ИК n KB r см-1: 3080, 3050, 2950, 1720, 1530, 1440, 1360, 1210.
Масс-спектр: m/z 283 (M+).
(3-3) 5-(4-фторфенил)-1-тетразолуксусная кислота.
Выход: 50%
Подаваемое вещество: метиловый эфир 5-(4-фторфенил)-1-тетразолуксусной кислоты.
Температура плавления: от 159 до 160oC (разложение).
ЯМР (DMCO-d6) дельта: 3,34 (уш.с. 3H), 5,51 (с. 2H), 7,34 (дв.д. 2H), 7,84 (дв.д. 2H).
ИК n KB r см-1: 3000, 2570, 1760, 1740, 1610, 1480, 1240, 840.
Масс-спектр: m/z 222 (M+).
(3-4) 5-(2-метилфенил)-1-тетразолуксусная кислота.
Выход: 58,7%
Подаваемое вещество: метиловый эфир 5-(2-метилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 142-143oC (разложение).
ЯМР (DMCO-d6) дельта: 2,18 (с. 3H), 3,43 (уш.с. 3H), 5,25 (с. 2H), 7,35-7,55 (м. 4H).
ИК n KB r см-1: 3000, 2500, 1750, 1420, 1220, 1100, 820.
Масс-спектр: m/z 218 (M+).
(3-5) 5-(3-метилфенил)-1-тетразолуксусная кислота.
Выход: 61,2%
Подаваемое вещество: метиловый эфир 5-(3-метилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 140-141,5oC (разложение).
ЯМР (DMCO-d6) дельта: 2,40(с. 2H), 3,42 (уш.с. 3H), 5,50 (с. 2H), 7,44-7,58 (м. 4H).
ИК n KB r см-1: 2920, 1730, 1220, 1210, 800.
Масс-спектр: m/z 218 (M+).
(3-6) 5-(4-метилфенил)-1-тетразолуксусная кислота.
Выход: 80%
Подаваемое вещество: метиловый эфир 5-(4-метилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 171-172oC.
ЯМР (DMCO-d6) дельта: 2,40 (с. 3H), 3,44 (уш.с. 3H), 5,49 (с. 2H), 7,42 (д. 2H), 7,64 (д. 2H).
ИК n KB r см-1: 3000, 2550, 1760, 1740, 1610, 1480, 1230, 820, 740.
Масс-спектр: m/z 218 (M+).
(3-7) 5-(4-метоксифенил)-1-тетразолуксусная кислота.
Выход: 58,7%
Подаваемое вещество: метиловый эфир 5-(4-метоксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 139-140oC (разложение).
ЯМР (DMCO-d6) дельта: 3,56 (уш.с. 3H), 3,85 (с. 3H), 5,48 (с. 2H), 7,15 (д. 2H), 7,70 (д. 2H).
ИК n KB r см-1: 3550, 3420, 2510, 1730, 1610, 1480, 1270, 840.
Масс-спектр: m/z 234 (M+).
(3-8) 5-(3-нитрофенил)-1-тетразолуксусная кислота.
Выход: 70%
Подаваемое вещество: метиловый эфир 5-(3-нитрофенил)-1-тетразолуксусной кислоты.
Температура плавления: 215-219oC (разложение).
ЯМР (DMCO-d6) дельта: 3,35 (уш.с. 5H), 5,58 (с. 2H), 7,93 (т. 1H), 8,20 (д. 1H), 8,49 (дв.д. 1H), 8,56 (с. 1H).
ИК n KB r см-1: 2960, 1740, 1530, 1350, 1220.
Масс-спектр: m/z 249 (M+).
(3-9) 5-(4-нитрофенил)-1-тетразолуксусная кислота.
Выход: 70,4%
Подаваемое вещество: метиловый эфир 5-(4-нитрофенил)-1-тетразолуксусной кислоты.
Температура плавления: 226-227oC (разложение).
ЯМР (DMCO-d6) дельта: 3,40 (уш.с. 1H), 5,60 (с. 2H), 8,07 (д. 2H), 8,43 (д. 2H).
ИК n KB r см-1: 3100, 2970, 2940, 1730, 1600, 1520, 1440, 1330, 1230, 1000, 860.
Масс-спектр: m/z 249 (M+).
(3-10) 5-(4-хлорфенил)-1-тетразолуксусная кислота.
Выход: 50%
Подаваемое вещество: метиловый эфир 5-(4-хлорфенил)-1-тетразолуксусной кислоты.
Температура плавления: 225-226oC (разложение).
ЯМР (DMCO-d6) дельта: 3,34 (уш.с. 3H), 5,60 (с. 2H), 8,06 (д. 2H), 8,44 (д. 2H).
ИК n KB r см-1: 3100, 2970, 2950, 1740, 1520, 1440, 1340, 1240, 860.
Масс-спектр: m/z 238 (M+).2 (3-11) 5-(3-нитро-4-метилфенил)-1-тетразолуксусная кислота.
Выход: 68,5%
Подаваемое вещество: метиловый эфир 5-(3-нитро-4-метилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 199-200oC (разложение).
ЯМР (DMCO-d6) дельта: 2,61 (с. 3H), 3,30 (уш.с. 3H), 5,58 (с. 2H), 7,50 (д. 1H), 8,00 (дв.д. 1H), 8,35 (д. 1H).
ИК n KB r см-1: 3050, 2970, 1730, 1530, 1210.
Масс-спектр: m/z 263 (M+).
(3-12) 3'-(1-карбоксиметил-тетразол-5-ил)-оксаниловая кислота.
Выход: 66%
Подаваемое вещество: бутиловый эфир 3'-(1-этоксикарбонилметилтетразол-5-ил)-оксаниловой кислоты.
Температура плавления: 220-221oC (разложение).
ЯМР (DMCO-d6) дельта: 3,17 (с. 2H), 5,49 (с. 2H), 7,28-7,55 (м. 4H).
ИК n KB r см-1: 2900, 2600, 1740, 1240.
Масс-спектр; m/z 259 (M+).
(3-13) 1,4-бис-(1-карбоксиметил-тетразол-5-ил)-бензол.
Выход: 72,3%
Подаваемое вещество: 1,4-бис-(метоксикарбонилметил-тетразол-5-ил)-бензол.
Температура плавления: 263-264oC (разложение).
ЯМР (DMCO-d6) дельта: 3,54 (уш.с. 10H), 5,59 (с. 4H), 8,01 (с. 4H).
ИК n KB r см-1: 3000, 2950, 2570, 1760, 1730, 1460, 1230, 800.
Масс-спектр: m/z 300 (M+).
(3-14) 5-(4-н-бутилфенил)-1-тетразолуксусная кислота.
Выход: 52%
Подаваемое вещество: метиловый эфир 5-(4-н-бутилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 119-120oC.
ЯМР (DMCO-d6) дельта: 0,91 (т. 3H), 1,35 (дв.кв. 2H), 1,59 (дв.кв. 2H), 2,67 (т. 2H), 2,50 (уш. 3H), 5,50 (с. 2H), 7,43 (д. 2H), 7,67 (д. 2H).
ИК n KB r см-1: 3000, 2950, 2920, 1730, 1240.
Масс-спектр: m/z 260 (M+).
(3-15) 3-(5-фенилтетразол-1-ил)-пропионовая кислота.
Выход: 70,4%
Подаваемое вещество: этиловый эфир 3-(5-фенил-тетразол-1-ил)-пропионовой кислоты.
Температура плавления: 116-118oC.
ЯМР (DMCO-d6) дельта: 2,99 (т. 2H), 3,38 (уш.с.1H), 4,62 (т.2H), 7,64-7,83 (м. 5H).
ИК n KB r см-1: 2900, 1720, 1310, 1200, 700.
Масс-спектр: m/z 218 (M+).
(3-16) 4-(5-фенилтетразол)-1-ил)-масляная кислота.
Выход: 68,1%
Подаваемое вещество: этиловый эфир 4-(5-фенилтетразол-1-ил)-масляной кислоты.
Температура плавления: 131-132oC (разложение).
ЯМР (DMCO-d6) дельта: 2,04 (дв.кв. 2H), 2,30 (т. 2H), 3,34 (уш.с. 3H), 4,52 (т. 2H), 7,62-7,81 (м. 5H).
ИК n KB r см-1: 2950, 1730, 1460, 1200, 780.
Масс-спектр: m/z 232 (M+).
(3-17) 5-(5-фенилтетраэол-1-ил)-валериановая кислота.
Выход: 65,5%
Подаваемое вещество: этиловый эфир 5-(5-фенилтетразол-1-ил)-валериановой кислоты.
Температура плавления: 105-106oC (разложение).
ЯМР (DMCO-d6) дельта: 1,44 (дв.кв. 2H), 1,83 (дв.кв. 2H), 2,19(т. 2H), 3,34 (уш.с. 3H), 4,49 (т. 2H), 7,64-7,67 (м. 5H).
ИК n KB r см-1: 2950, 1720, 1460, 1210, 740.
Масс-спектр: m/z 246 (M+).
(3-18) 2-(5-фенилтетразол-1-ил)-пропионовая кислота.
Выход: 64,1%
Подаваемое вещество: этиловый эфир 2-(5-фенилтетразол-1-ил)-пропионовой кислоты.
Температура плавления: 187-188oC (разложение).
ЯМР (DMCO-d6) дельта: 1,83 (д. 3H), 3,35 (уш.с. 3H), 5,55 (кв. 1H), 7,62-7,72 (м. 5H).
ИК n KB r см-1: 2900, 2550, 1740, 1460, 1240, 1180, 740.
Масс-спектр: m/z 218 (M+).
(3-19) 2-(5-фенилтетразол-1-ил)-2-метилпропионовая кислота.
Выход: 66,9%
Подаваемое вещество: этиловый эфир 2-(5-фенилтетразол-1-ил)-2-метилпропионовой кислоты.
Температура плавления: 184-185oC (разложение).
ЯМР (DMCO-d6) дельта: 2,79 (с. 6H), 3,34 (уш.с. 3H), 7,63-7,78 (м. 5H).
ИК n KB r см-1: 2950, 1740, 1450, 1190, 990, 730, 680.
Масс-спектр: m/z 232 (M+).
(3-20) 5-(3-фторфенил)-1-тетразолуксусная кислота.
Выход: 60%
Подаваемое вещество: этиловый эфир 5-(3-фторфенил)-1-тетразолуксусной кислоты.
Температура плавления: 134-135oC (разложение).
ЯМР (DMCO-d6) дельта: 3,33 (уш.с. 3H), 5,56 (с. 2H), 7,49-7,72 (м. 4H).
ИК n KB r см-1: 3000, 2910, 2590, 1740, 1480, 1240, 880.
Масс-спектр: m/z 222 (M+).
(3-21) 5-(2-хлорфенил)-1-тетразолуксусная кислота.
Выход: 58%
Подаваемое вещество: метиловый эфир 5-(2-хлорфенил)-1-тетразолуксусной кислоты.
Температура плавления: 155-157oC (разложение).
ЯМР (DMCO-d6) дельта: 3,34 (уш. с. 3H), 5,30 (с. 2H), 7,58 (д. 1H), 7,64-7,75 (м. 2H).
ИК n KB r см-1: 3000, 2960, 2520, 1730, 1600, 1440, 1220, 810, 750.
Масс-спектр: m/z 238 (M+).
(3-22) 5-(3,4-диметилфенил)-1-тетразолуксусная кислота.
Выход: 60%
Подаваемое вещество: метиловый эфир 5-(3,4-диметилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 225-226oC (разложение).
ЯМР (DMCO-d6) дельта: 2,30 (с. 6H), 5,49(с. 2H), 7,36 (д. 1H), 7,47 (д. 1H), 7,54 (с. 1H).
ИК n KB r см-1: 2920, 1730, 1460, 1220, 840.
Масс-спектр: m/z 232 (M+).
(3-23) 5-(4-бифенилил)-1-тетразолуксусная кислота.
Выход: 76,8%
Подаваемое вещество: метиловый эфир 5-(4-бифенилил)-1-тетразолуксусной кислоты.
Температура плавления: 183-184oC (разложение).
ЯМР (DMCO-d6) дельта: 3,35 (уш.с. 2H), 5,51 (с. 2H), 7,41-7,94 (м. 9H).
ИК n KB r см-1: 3420, 2930, 1740, 1480, 1220.
Масс-спектр: m/z 280 (M+).
(3-24) 5-(4-н-гептилфенил)-1-тетразолуксусная кислота.
Выход: 81%
Подаваемое вещество: метиловый эфир 5-(4-н-гептилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 127-129oC (разложение).
ЯМР (CDCl3) дельта: 0,89 (т. 3H), 1,25-1,34 (м. 8H), 1,62-1.68 (м. 2H), 2,69 (т. 2H), 5,15 (с. 2H), 7,35 (д. 2H), 7,60 (д. 2H).
ИК n KB r см-1: 2910, 2850, 1760, 1740, 1240.
Масс-спектр: m/z 302 (M+).
(3-25) 5-(4-феноксифенил)-1-тетразолуксусная кислота.
Выход: 69%
Подаваемое вещество: метиловый эфир 5-(4-феноксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 161-161,5oC (разложение).
ЯМР (DMCO-d6) дельта: 5,16 (с. 2H), 7,10-7,45 (м. 7H), 7,66 (д. 2H).
ИК n KB r см-1: 3000, 2950, 1760, 1730, 1580, 1470, 1240.
Масс-спектр: m/z 296 (M+).
(3-26) 5-(4-трет-бутилфенил)-1-тетразолуксусная кислота.
Выход: 55%
Подаваемое вещество: метиловый эфир 5-4(4-третбутилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 186-187oC (разложение).
ЯМР (DMCO-d6) дельта: 1,33 (с. 9H), 5,50 (с. 2H), 7,66 (кв. 4H).
ИК n KB r см-1: 2950, 1740, 1730, 1480, 1430, 1220, 840.
Масс-спектр: m/z 260 (M+).
(3-27) 5-(4-н-бутоксифенил)-1-тетразолуксусная кислота.
Выход: 63%
Подаваемое вещество: метиловый эфир 5-(4-н-бутоксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 135-136oC (разложение).
ЯМР (DMCO-d6) дельта: 0,95 (т. 3H), 1,45 (кв. 2H), 1,72 (кв. 2H), 4,06 (т. 2H), 5,45 (с. 2H), 7,13 (д. 2H), 7,68 (д. 2H).
ИК n KB r см-1: 2920, 1760, 1730, 1620, 1480, 1250.
Масс-спектр: m/z 276 (M+).
(3-28) 5-(2-бифенилил)-1-тетразолуксусная кислота.
Выход: 50%
Подаваемое вещество: метиловый эфир 5-(2-бифенилил)-1-тетразолуксусной кислоты.
ЯМР (DMCO-d6) дельта: 4,36 (с. 2H), 7,06-7,64 (м. 9H), 7,84 (уш.с. 2H).
ИК n NaCl см-1: 3000, 2950, 1740, 1430, 1250.
Масс-спектр: m/z 280 (M+).
(3-29) 5-(3,5-диметилфенил)-1-тетразолуксусная кислота.
Выход: 76%
Подаваемое вещество: метиловый эфир 5-(3,5-диметилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 187-188oC (разложение).
ЯМР (DMCO-d6) дельта: 2,35 (с. 6Н), 3,33 (уш.с. 2H), 5,49 (с. 2H), 7,27 (с. 1H), 7,35 (с. 2H).
ИК  KB r см-1: 2920, 1730, 1220, 860.
KB r см-1: 2920, 1730, 1220, 860.
Масс-спектр: m/z 232 (M+).
(3-30) 5-(3-трифторметилфенил)-1-тетразолуксусная кислота.
Выход: 67%
Подаваемое вещество: метиловый эфир 5-(3-трифторметилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 169-170oC (разложение).
ЯМР (DMCO-d6) дельта: 3,35 (уш.с, 2H), 5,60 (с, 2H), 7,88-8,11 (м. 4H).
ИК n KB r см+: 3000, 1740, 1450, 1330, 1240, 1120.
Масс-спектр: m/z 272 (M+).
(3-31) 5-(4-оксифенил)-1-тетразолуксусная кислота.
Выход: 82%
Подаваемое вещество: этиловый эфир 5-(4-оксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 220-222oC (разложение).
ЯМР (DMCO-d6) дельта: 5,16 (с. 2H), 4,7-6,4 (уш.с. 1H), 7,00 (дв.д. 2H, J 2,6 и 9,2 гц), 7,52 (дв.д. 2H, J 2,6 и 9,2 гц), 9,70 (уш.с. 1H).
ИК n KB r см-1: 3140, 1730, 1600, 1470, 1280.
Масс-спектр: m/z 220 (M+).
(3-32) 5-(4-н-гептоксифенил)-1-тетразолуксусная кислота.
Выход: 70%
Подаваемое вещество: метиловый эфир 5-(4-н-гептоксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 131-132oC (разложение).
ЯМР (CDCl3+DMCO-d6) дельта: 0,90 (т. 3H, J 6,44 гц), 1,33-1,48 (м. 8H), 1,80 (м. 2H), 4,02 (т. 2H, J 6,60 гц), 5,13 (с. 2H), 7,02 (д. 2H, J 8,87 гц), 7,63 (д. 2H, J 8,46 гц).
ИК n KB r см-1: 3000, 2900, 1730, 1610, 1480, 1250, 1230, 740.
Масс-спектр: m/z 318 (M+).
(3-33) 5-(3-метоксифенил)-1-тетразолуксусная кислота.
Выход: 71,9%
Подаваемое вещество: метиловый эфир 5-(3-метоксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 179,5-180,5oC (разложение).
ЯМР (DMCO-d6) дельта: 3,86 (с. 3H), 5,21 (с. 2H), 7,12-7,44 (м. 3H), 7,47-7,55 (м. 1H).
ИК n KB r см-1: 3000, 2500, 1730, 1600, 1540, 1490, 1240, 1120, 1020, 800.
Масс-спектр: m/z 234 (M+).
(3-34) 5-(3,4-диметоксифенил)-1-тетразолуксусная кислота.
Выход: 72,4%
Подаваемое вещество: метиловый эфир 5-(3,4-диметоксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 193,5-194,5oC (разложение).
ЯМР(CDCl3+DMCO-d6) дельта: 3,92 (с. 3H), 3,96 (с. 3H), 5,17 (с. 2H), 7,01 (д. 1H, J 8,46 гц), 7,22 (дв.д. 1H, J 2,01 и 8,46 гц), 7,28 (д. 1H, J 2,42 гц).
ИК n KB r см-1: 3000, 1730, 1610, 1500, 1460, 1220, 1020, 820.
Масс-спектр: m/z 264 (M+).
(3-35) 5-(3,4-ди-н-бутоксифенил)-1-тетразолуксусная кислота.
Выход: 71,1%
Подаваемое вещество: метиловый эфир 5-(3,4-ди-н-бутоксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 141-142oC (разложение).
ЯМР (DMCO-d6) дельта: 0,99 (т. 3H, J 7,0 гц), 1,00 (т. 3H, J 7,0 гц), 1,45-1,60 (м. 4H), 1,76-1,89 (м. 4H), 4,01-4,10 (м. 4H), 6,98-7,38 (м. 4H).
ИК n KB r см-1: 3420, 2950, 1730, 1610, 1500, 1460, 1210, 1140, 810.
Масс-спектр: m/z 348 (M+).
(3-36) 5-(3,4,5-триметоксифенил)-1-тетразолуксусная кислота.
Выход: 87%
Подаваемое вещество: метиловый эфир 5-(3,4,5-триметоксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 234-235oC (разложение).
ЯМР (CDCl3+DMCO-d6) дельта: 3,89 (с. 3H), 3,92 (с. 3H), 5,18 (с. 2H), 6,94 (с. 2H).
ИК n KB r см-1 3000, 2950, 1730, 1590, 1490, 1420, 1220, 1120, 1000.
Масс-спектр: m/z 294 (M+).
(3-37) 5-(4-карбоксифенил)-1-тетразолуксусная кислота.
Выход: 85%
Подаваемое вещество: этиловый эфир 5-(4-этоксикарбонилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 271-273oC (разложение).
ЯМР (DMCO-d6) дельта: 2,7-4,8 (ш.сиг. 1H), 5,44 (с. 2H), 7,36 (д. 2H, J 8,4 гц), 8,16 (д. 2H, J 8,4 гц), 12,2-13,7 (ш.сиг. 1H).
ИК n KB r см-1: 3420, 1740, 1690, 1420, 1290, 1240.
Масс-спектр: m/z 248 (M+).
(3-38) 5-(4-пиперидинокарбонилфенил)-1-тетразол-уксусная кислота.
Выход: 88%
Подаваемое вещество: этиловый эфир 5-(4-пиперидинокарбонилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 226-227oC (разложение).
ЯМР (DMCO-d6) дельта: 1,56 (уш.с, 2H), 1,71 (уш.с. 2H), 3,36 (уш.с. 2H), 3,72 (уш. с. 2H) 3,2-5,0 (ш.сиг. 1H), 5,23 (с. 2H), 7,57 (д. 2H, J 8,4 гц), 7,77 (д. 2H, J 8,4 гц).
ИК n KB r см-1: 3430, 2930, 1740, 1570, 1450.
Масс-спектр: m/z 314 (M+).
(3-39) 5-(4-ди-н-пропиламинокарбонилфенил)-1-тетразолуксусная кислота.
Выход: 88%
Подаваемое вещество: этиловый эфир 5-(4-ди-н-пропиламинокарбонилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 188-189oС (разложение).
ЯМР (DMCO-d6) дельта: 0,77 (т. 3H, J 7,3 гц), 1,00 (т. 3H, J 7,3), 1,56 (кв. т. 2H, J 7,3 и 7,7 гц), 1,71 (кв. т. 2H, J 7,8 и 7,7 гц), 3,18 (т. 2H, J 7,7 гц), 3,47 (т. 2H, J 7,7 гц), 3,73 (ш.сиг. 1H), 5,22 (с. 2H), 7,53 (д. 2H, J 8,3 гц), 7,76 (д. 2H, J 8,3 гц).
ИК n KB r см-1: 3400, 2900, 1730, 1560, 1220.
Масс-спектр: m/z 331 (M+).
(3-40) 5-(4-аминофенил)-1-тетразолуксусная кислота.
Выход: 42,6%
Подаваемое вещество: метиловый эфир 5-(4-аминофенил)-1-тетразолуксусной кислоты.
Температура плавления: 183oC (разложение).
ЯМР (DMCO-d6) дельта: 5,03 (с. 2H), 6,66 (д. 2H, J 8,46 гц), 7,45 (д. 2H, J 8,86 гц).
ИК n KB r см-1: 3420, 1760, 1620, 1480, 1370, 830.
Масс-спектр: m/z 219 (M+).
(3-41) 5-(4-бромметилфенил)-1-тетразолуксусная кислота.
Выход: 75%
Подаваемое вещество: метиловый эфир 5-(4-бромметилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 171-173oC (разложение).
ЯМР (DMCO-d6) дельта: 4,56 (с. 2H), 5,48 (с. 2H), 7,54 (д. 2H, J 8,46 гц), 7,74 (д. 2H, J 8,46 гц).
ИК n KB r см-1: 3200, 2980, 1760, 1420, 1220.
Масс-спектр: m/z 297 (M+).
(3-42) 5-(4-метилтиофенил)-1-тетразолуксусная кислота.
Выход: 80%
Подаваемое вещество: метиловый эфир 5-(4-метилтиофенил)-1-тетразолуксусной кислоты.
Температура плавления: 160-163oC (разложение).
ЯМР (DMCO-d6) дельта: 2,55 (с. 2H), 3,44 (уш.с. 3H), 5,49 (с. 2H), 7,46 (д. 2H, J 8,46 гц), 7,69 (д. 2H, J 8,46 гц).
ИК n KB r см-1: 3400, 2900, 1740, 1600, 1200.
Масс-спектр: m/z 250 (M+).
(3-43) 5-(4-метилсульфинилфенил)-1-тетразолуксусная кислота.
Выход: 74%
Подаваемое вещество: метиловый эфир 5-(4-метилсульфинилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 238-240oC (разложение).
ЯМР (DMCO-d6) дельта: 2,82 (с. 3H), 5,43 (с. 2H), 7,91 (д. 2H, J 8,46 гц), 7,93 (д. 2H, J 8,46 гц).
ИК n KB r см-1: 3420, 2500, 1760, 1460, 1230, 1000.
Масс-спектр: m/z 301 (M+).
(3-44) 5-(4-метилсульфонилфенил)1-тетразолуксусная кислота.
Выход: 72%
Подаваемое вещество: метиловый эфир 5-(4-метилсульфонилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 214-216oC (разложение).
ЯМР (DMCO-d6) дельта: 3,19 (с. 3H), 5,34 (с. 2H), 8,00 (д. 2H, J 8,46 гц), 8,15 (д. 2H, J 8,46 гц).
ИК n KB r ni-1: 3000, 1730, 1300, 1240, 1150.
Масс-спектр: m/z 317 (M+).
(3-45) 5-(4-н-бутиламиносульфонилфенил)-1-тетразолуксусная кислота.
Выход: 78%
Подаваемое вещество: метиловый эфир 5-(4-н-бутиламиносульфонилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 148-149oC (разложение).
ЯМР (DMCO-d6) дельта: 0,87 (т. 3H, J 7,3 гц), 1,25-1,53 (м. 4H), 2,89-2,94 (м. 2H), 3,20-4,30 (ш.сиг. 1H), 5,23 (n. 2H), 7,11 (т. 1H, J 5,1 гц), 7,86 (д. 1H, J 8,7 гц), 8,05 (д. 1H, J 8,7 гц).
ИК n KB r см-1: 3560, 3270, 2950, 1740, 1440, 1320, 1240, 1160, 1090.
Масс-спектр: m/z 339 (M+).
(3-46) 5-(4-диизопропиламиносульфонилфенил)-1-тетразолуксусная кислота.
Выход: 87%
Подаваемое вещество: метиловый эфир 5-(4-диизопропиламиносульфонилфенил)-1-тетразолуксусной кислоты.
Температура плавления: 215-216oC (разложение).
ЯМР (DMCO-d6) дельта: 1,28 (с. 6H), 1,30 (с. 6H), 3,77 (кв. 1H, J 6,6 гц), 3,7-4,2 (ш.сиг. 1H), 5,26 (с. 2H), 7,88 (д. 2H, J 7,7 гц), 8,03 (д. 2H, J 7,7 гц).
ИК n KB r см-1: 3420, 2970, 1740, 1440, 1320.
Масс-спектр: m/z 367 (M+).
(3-47) 5-(3,5-ди-трет-бутил-4-оксифенил)-1-тетразолуксусная кислота.
Выход: 62%
Подаваемое вещество: метиловый эфир 5-(3,5-ди-трет-бутил-4-оксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 118-119oC (разложение).
ЯМР (DMCO-d6) дельта: 1,40 (с. 18H), 3,36 (ш.с. 1H), 5,09 (с. 2H), 7,53 (с. 2H), 7,63 (с. 1H).
ИК n KB r см-1: 3440, 2950, 1610, 1420, 1380, 1240.
Масс-спектр: m/z 332 (M+).
(3-48) 5-(3,5-ди-трет-бутил-4-метоксифенил)-1-тетразолуксусная кислота.
Выход: 78%
Подаваемое вещество: метиловый эфир 5-(3,5-ди-трет-бутил-4-метоксифенил)-1-тетразолуксусной кислоты.
Температура плавления: 164-165oC (разложение).
ЯМР (DMCO-d6) дельта: 1,41 (с. 18H), 3,35 (уш.с. 1H), 3,71 (с. 3H), 5,38 (с. 2H), 7,60 (с. 2H).
ИК n KB r см-1: 3440, 2950, 1740, 1450, 1410, 1230.
Масс-спектр: m/z 346 (M+).
Эксперимент 1.
Испытание ингибирования альдозоредуктазы.
(1) Методика испытания.
Самцов крыс SD шестинедельного возраста забивают под эфирным наркозом и их хрусталики немедленно удаляют и хранят при -80oC. Хрусталики гомогенизируют в 3-х объемах 135 мМ натрий-калий-фосфатного буфера (pH 7,0) и центрифугируют со скоростью 30.000 об./мин в течение 30 мин. Верхний слой подвергают диализу в течение ночи против 0,05 М раствора хлористого натрия, чтобы получить раствор альдозоредуктазы. Все операции проводят при 4oC. Раствор фермента хранят при -80oC.
Активность альдозоредуктазы определяют по частично модифицированному методу Киношита (J. H. Kinoshita et al. J. Biol. Chem. 240, 877 (1965). А именно, 0,1 мл DL-глицеринового альдегида (конечная концентрация: 10 мМ) добавляют к 0,9 мл 100 мМ натрий-калий фосфатного буфера (pH 6,2), который содержит сульфат лития (конечная концентрация: 400 мМ), восстановленный никотинамид-аденин-динуклеотидный фосфат (конечная концентрация: 0,15 мМ), раствор фермента и соединение, которое испытывают (конечная концентрация: 5•10-5 М или 10-6 М), а затем реакцию проводят при 30oC в течение 5 мин. Во время этой реакции наблюдают поглощение при 340 нм с течением времени. Определяют максимальную редуцирующую скорость поглощения (U) во время реакции. Вычитанием из этой величины максимальной редуцирующей скорости (U0) при 340 нм реакционного раствора до добавления субстрата (DL-глицеринового альдегида) вычисляют скорость реакции (V) (V U-U0) как истинную скорость реакции в присутствии испытуемого соединения.
Подобную методику повторяют при отсутствии испытуемого соединения. Истинная скорость реакции (V0), в случае, когда фермент не ингибирует, вычисляется 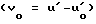 . Ингибирующую активность альдозоредуктазы определяют по следующей формуле:
. Ингибирующую активность альдозоредуктазы определяют по следующей формуле: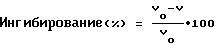
(2) Результаты эксперимента.
Результаты эксперимента 1 показаны в табл. 5.
Результаты показывают, что соединения изобретения обеспечивают превосходную ингибирующую активность альдозоредуктазы при концентрации 5•10-5 М или 1 x 10-6 М.
Эксперимент 2.
(1) Методика испытания.
Подобным путем, что и в эксперименте 1, вычисляют ингибирования при конечных концентрациях 10-6, 10-7 и 10-8 М для испытуемого соединения. На основе этих величин вычисляют концентрацию для ингибирования активности альдозоредуктазы на 50% (IC50 (М)). В качестве контроля проводят такой же эксперимент для известного ингибитора альдозоредуктазы, ONO-2235[(Е)3-карбоксиметил-5-(2Е)-метил-3-фенил-пропенилиден)роданина]
(2) Результаты эксперимента.
Результаты представлены ниже в табл. 6. Очевидно, что соединения изобретения обеспечивают ингибирующую активность альдозоредуктазы, которая эквивалентна или превосходит таковую известного ингибитора альдозоредуктазы (ONO-2235).
Эксперимент 3.
Испытание острой токсичности.
(1) Методика испытания.
Соединение, перечисленное в табл. 7 и суспендированное в 0,5%-ном растворе карбоксиметилцеллюлозы, перорально вводят самцам мышей MCH (шестинедельного возраста; 5 животных на испытуемую группу).
Признак болезни этих испытуемых животных наблюдают в течение 14 дн после приема и величину LD50 определяют из числа животных, погибших во время этого периода. Во время испытания мыши могли принимать пищу и воду свободно.
(2) Результаты эксперимента.
Результаты показаны в табл. 7. LD50 для каждого из соединений составляет выше 3.000 мг/кг.
Примеры фармацевтической композиции.
Пример 1. Таблетки.
Таблетки, состоящие из нижеследующих ингредиентов, получаются следующим образом, г:
Соединение (3-1) (В качестве соединения (3-1) используется 5-фенил-1-тетразол-уксусная кислота (см. с. 41) 50
Безводный двухосновный фосфат кальция 40
D-маннит 73
Кристаллическая целлюлоза 25
Кальцийкармеллоза 5
Гидроксипропилцеллюлоза 5
Стеарат магния 2
Ингредиенты, за исключением стеарата магния, смешиваются и гранулируются в смесителе и грануляторе с добавлением с 60 мл этилового спирта. После сушки в струе воздуха полученные гранулы измельчаются и обмазываются для того, чтобы иметь однородное распределение по размеру. Затем к гранулам добавляется стеарат магния, и гранулы спрессовываются в таблетки диаметром 8 мм и массой 200 мг на таблетку с получением таблетированной композиции.
Пример 2. Капсулы.
Капсулы, состоящие из нижеследующих ингредиентов, получаются следующим образом, г:
Соединение (3-1) 50
Безводный двухосновный фосфат кальция 33
Кристаллическая целлюлоза 70
Низкозамещенная гидроксипропилцеллюлоза 20
Гидроксипропилцеллюлоза 5
Стеарат магния 2
Ингредиенты, за исключением стеарата магния, смешиваются и гранулируются в смесителе и на грануляторе, куда загружаются с 80 мл этилового спирта. После сушки в струе воздуха полученные гранулы измельчаются и обмазываются для того, чтобы иметь однородное распределение по размеру. Затем к гранулам добавляется стеарат магния, и гранулы капсулируются в жесткие желатиновые капсулы размером 3 мм в количестве 180 мг на капсулу с получением капсулированной композиции.
Пример 3. Гранулы.
Гранулы, состоящие из нижеследующих ингредиентов, получаются следующим образом, г:
Соединение (3-1) 50
D-маннит 700
Кристаллическая целлюлоза 230
Гидроксипропилцеллюлоза 20
Гидроксипропилцеллюлоза растворяется в 200 мл этилового спирта с образованием раствора связующего. Соединение (3-1), маннит и кристаллическая целлюлоза смешиваются в смесителе с раствором связующего, а затем гранулируются на экструдере.
После сушки в струе воздуха полученные гранулы измельчаются и обмазываются для того, чтобы иметь однородное распределение по размеру и затем классифицируются с получением гранулированной композиции.
Пример 4. Глазной раствор.
Глазной раствор, состоящий из нижеследующих ингредиентов, получается следующим образом, г:
Соединение (3-1) 2,00
NaOH 0,42
ε-Aминoкaпpoнoвaя кислота 0,50
Метилпарабен 0,026
Пропилпарабен 0,014
Хлорбутанол 0,25
Пропиленгликоль 0,30
0,2N HCl до pH 5,5
Очищенная вода до 100 мл
Соединение (3-1) диспергируется в 10 мл очищенной воды и растворяется при добавлении NaOH при перемешивании с получением маточного раствора соединения (3-1). Метилпарабен, пропилпарабен и хлорбутанол добавляются к пропиленгликолю и растворяются при нагревании примерно при 50oC. Полученный раствор добавляется к 80 мл очищенной воды, предварительно нагретой до примерно 60oC, и перемешивается до получения раствора. Раствор охлаждается до комнатной температуры, после чего к нему добавляются e-аминокапроновая кислота и маточный раствор соединения (3-1) и растворяются. Значение pH раствора доводится до 5,5 добавлением 0,2 N HCl и раствор разбавляется 100 мл очищенной воды и фильтруется, после чего раствор стерилизуется с получением глазного раствора.
Пример 5. Инъекционный раствор.
Инъекционный раствор, состоящий из нижеследующих ингредиентов, получаются следующим образом, г:
Соединение (3-1) 2,00
NaOH 0,42
NaCl 0,14
0,2N HCl до pH 7,4
Вода для инъекций до 100 мл
Соединение (3-1) диспергируется в воде для инъекций (90 мл) и растворяется при добавлении NaOH с перемешиванием. NaCl добавляется с получением раствора, и pH раствора доводится до 7,4 добавлением 0,2N HCl. Раствор разбавляется до 100 мл водой для инъекций и фильтруется, а затем стерилизуется с получением инъекционного раствора.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИКЛОПЕПТИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБЫ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2108342C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2021990C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АЛКАНСУЛЬФОНАНИЛИДА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1988 |
|
RU2012557C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1993 |
|
RU2128172C1 |
| ПРОИЗВОДНЫЕ ЭТАНОЛАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1993 |
|
RU2125983C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2176640C2 |
| ПРОИЗВОДНЫЕ N-(3-ПИПЕРИДИНИЛКАРБОНИЛ)-БЕТА-АЛАНИНА В КАЧЕСТВЕ АНТАГОНИСТОВ ФАКТОРА АКТИВАЦИИ ТРОМБОЦИТОВ (ФАТ), СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2161155C2 |
| АНТИБИОТИЧЕСКАЯ КОМПОЗИЦИЯ | 1988 |
|
RU2029549C1 |
| ПРОИЗВОДНЫЕ ГУАНИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ NA/H - ОБМЕНА В КЛЕТКАХ | 1994 |
|
RU2141946C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ПОСРЕДНИКОМ КОТОРЫХ ЯВЛЯЕТСЯ ТАХИКИНИН | 1991 |
|
RU2073683C1 |



Использование: в медицине в качестве лекарственного средства для диабетических осложнений. Сущность изобретения: производные тетразола общей формулы: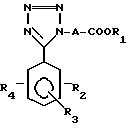
где A - алкиленовая группа, имеющая -1-4 атома углерода; R1 - водород или низшая алкильная группа, R2 - водород, гидрокси, галоид, карбокси C1-7 алкил, амидо, амино, C1-7 алкокси, фенил, фенилокси, низший алкилтио, низший алкилсульфинил, низший алкилсульфонил, нитрогруппа или группа формулы: NHCOCOOR5, где R5 - водород или низший алкил, моно- или ди/низший/алкиламиносульфонил или группа формулы: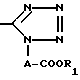
где A и R1 имеют указанные выше значения, R3 - водород, галоид, нитро, C1-7 алкил, C1-7 алкокси или гидрокси; R4 - водород, C1-7 алкил, C1-7 алкокси или группа -NHCOCOOR5, где R5 имеет указанные выше значения, при условии, что соединение формулы I не включает следующей комбинации заместителей; где A - метиленовая группа, R2, R3 и R4 - атомы водорода, и R1 - атом водорода, метильная группа или этильная группа; где A - этилиденовая группа, R2, R3 и R4 - атомы водорода, и R1 - атом водорода или этильная группа; где A - изопропилиденовая группа, R2, R3 и R4 атомы водорода, и R1 - атом водорода или этильная группа; где A - метиленовая группа, R2 - 4-бром, 3- или 4-хлор, 3- или 4-метил, 3 - или 4-нитро, или 3-трифторметильная группа, R3 и R4 - атомы водорода, и R1 атом водорода или этильная группа; и где A - этиленовая группа, R2, R3 и R4 - атомы водорода, и R1 - атом водорода или этильная группа. Соединение получают путем хлорирования соединения общей формулы II: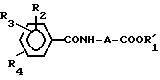
где R'1 низший алкил и полученное промежуточное соединение III: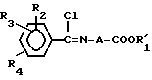
подвергают взаимодействию с азидом натрия. Возможна трансформация радикала R1; описанные соединения используют в эффективном количестве в фармацевтической композиции, ингибирующей альдозоредуктазу. 2 с. и 1 з.п. ф-лы, 7 табл.
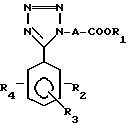
где А алкиленовая группа, имеющая 1 4 атома углерода;
R1 водород или низшая алкильная группа;
R2 водород, гидрокси, галоид, карбокси, С1 - С7-алкил, амидо, амино, С1 С7-алкокси, фенил, фенилокси, низший алкилтио, низший алкилсульфинил, низший алкилсульфонил, нитрогруппа или группа формулы
-NHCOCOOR5,
где R5 водород или низший алкил, моно или ди/низший алкиламиносульфонил или группа формулы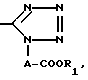
где А и R1 имеют указанные значения;
R3 водород, галоид, нитро, С1 С7-алкил, С1 С7-алкокси или гидркоси;
R4 водород, С1 С7-алкил, С1 - С7-алкокси или группа формулы
-NHCOCOOR5,
где R5 имеет указанные значения,
при условии, что соединение формулы I не включает следующей комбинации заместителей:
А метиленовая группа, R2, R3 и R4 атомы водорода и R1 атом водорода, метильная группа или этильная группа;
А этилиденовая группа, R2, R3 и R4 атомы водорода и R1 атом водорода или этильная группа;
А изопропилиденовая группа, R2, R3 и R4 атомы водорода и R1 атом водорода или этильная группа;
А метиленовая группа, R2 4-бром, 3- или 4-хлор, 3- или 4-метил, 3- или 4-нитро, или 3-трифторметильная группа, R3 и R4 атомы водорода и R1 атом водорода или этильная группа;
А этиленовая группа, R2, R3 и R4 атомы водорода и R1 атом водорода или этильная группа.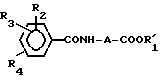
где А, R2, R3 и R4 имеют указанные значения;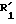 низшая алкильная группа,
низшая алкильная группа,
полученное соединение общей формулы III
где А, R2, R3, R4 и 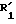 имеют указанные значения,
имеют указанные значения,
подвергают взаимодействию с азидом натрия, и в случае необходимости, полученный целевой продукт общей формулы I, где R1 низший алкил, подвергают гидролизу с получением целевого продукта общей формулы I, где R1 водород.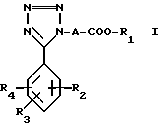
где R1, R2, R3, R4 и А имеют значения, указанные в п. 1,
в эффективном количестве.
| DЕ, патент, 3623681, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| SU, патент, 1433412, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1997-11-27—Публикация
1990-03-23—Подача