Изобретение относится к новому полипептидному соединению и к его фармацевтическим приемлемой соли.
Более конкретно изобретение относится к новому полипептидному соединению и к его фармацевтически приемлемой соли, которые обладают противомикробной активностью, в частности противогрибковой активностью, к способу его приготовления, к фармацевтическим композициям, включающим это соединение, и к способу лечения или предотвращения инфекционных заболеваний у людей и животных.
В соответствии с этим одной целью изобретения является предоставление полипептидного соединения и его фармацевтически приемлемой соли, которые обладают высокой активностью против патогенных микроорганизмов у людей и животных.
Другой целью изобретения является предоставление способа приготовления полипептидного соединения и его соли.
Дополнительной целью изобретения является обеспечение фармацевтической композиции, включающей в качестве активного компонента указанное полипептидное соединение или его фамацевтически приемлемую соль.
Еще одной целью изобретения является предоставление способа лечения или предотвращения инфекционных заболеваний, вызванных патогенными микроорганизмами, который включает назначение указанного полипептидного соединения людям или животным.
Целевое полипептидное соединение изобретения является новым и может быть представлено следующей общей формулой: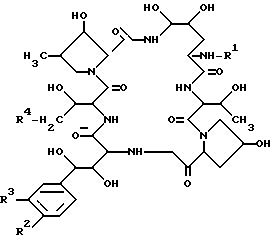 ,
,
где
R1 - атом водорода или ацильная группа;
R2 - гидрокси - или ацилокси-группой;
R3 - атом водорода или гидроксисульфонилокси-группа и
R4 -атом водорода или карбамоильная группа,
при условии, что:
а) R2 - ацилоксигруппа, когда R3 - атом водорода и
б) R1 не является пальмитоильной группой, когда R2 - гидроксигруппа,
R3 - гидроксисульфонилокси- и
R4 является карбамоильной группой.
Полипептидное соединения (1) может быть приготовлено с помощью способов, которые проиллюстрированы ниже: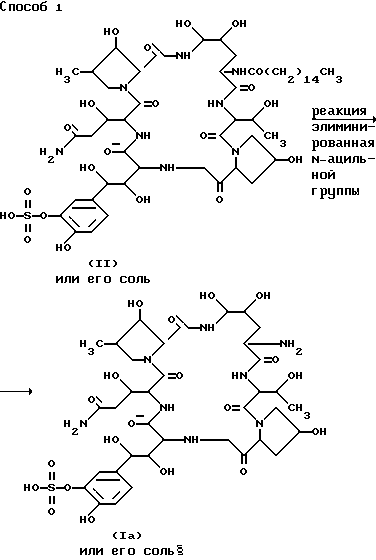
В этих формулах:
R3 и R4 такие как обозначено выше,
R
R1 - ар(низший)алканоил), который имеет высшую алкокси- и защищенную амино-группу,
R
R
R
R
R
R5 является ацильной группой.
Исходное вещество (II), или его соль, является новым и может быть приготовлено с помощью следующего ферментационного процесса.
 .
.
Некоторые из исходных соединений (IV) являются новыми и могут быть получены в соответствии со способами 1-4.
Подходящее фармацевтически приемлемые соли целевого соединения (I) являются традиционными нетоксичными моно- или ди- солями и включают соль металла, такого как соль щелочного металла (пример натрия, калия и др.) и соль щелочноземельного металла (например кальция, магния и др.) и соль аммония, и соль органического основания (например триметиламина, триэтиламина, пиридина, пиколина, дициклогексиламина, N, N - дибензилэтилендиамина и др.); аддитивную соль органической кислоты (например формиат, ацетат, трифторацетат, малеат, тартрат, метансульфонат, бензолсульфонат, толуолсульфонат и др.), соль с аминоксилотой (например аргинином, аспартиковой кислотой, глутаминовой кислотой и др.) и т.п.
Предполагается, что термин "низший" означает содержание 1 - 6 атомов углерода, если не указано иное; термин "высший" означает содержание 7 - 20 атомов углерода, если не указано иное.
Подходящий "ацильной группой" может быть алифатический ацил, ароматический ацил, гетероциклический ацил, арилалифатический ацил и гетероциклически-алифатический ацил, - произведенные из карбоксильной кислоты, карбоновой кислоты, карбаминовой кислоты, сульфоновой кислоты и т.п.
Подходящими примерами "ацильной группы" могут быть: низший алкеноил (например формил, ацетил, пропионил, бутирил, изобутирил, валерил, гексаноил, пивалоил и др.), который может иметь один или несколько (предпочтительно от 1 до 3) подходящих заместителей, таких как галоген (например фтор, хлор, бром, иод); арил (например фенил, нафтил, антраценил и др.), который может иметь один или несколько (предпочтительно 1-3) подходящих заместителей таких как гидрокси-, высшая алкокси-группа (пояснена ниже), упомянутый арил или т. п. ; защищенная амино-группа, предпочтительно ациламино-группа, так как низший алкоксикарбониламино- (например метоксикарбонпиламино-, этоксикарбониламино, пропоксикарбониламино, бутоксикарбониламино, трет-бутоксикарбониламино-, пентилоксикарбониламино, гексилоксикарбониламино- и др.) или им подобные; ди(низший)алкиламино-группа (например диметиламино-, -метилэтиламино-, диэтиламино-, N -пропилбутиламино-, дипентиламино-, дигексиламино- и др. ); низшая алкоксиимино-группа (например метоксиимино-, этоксиимино, пропоксиимино, бутоксиимино, трет-бутоксиимино, пентилоксиимино-, гексилоксиинино- и др.); ар-(низший)алкоксиимино-группа, такая как фенил(низший) алкоксиимино (например бензилоксиимино-, фенетилоксиимино-, бензигидрилоксиимино- и др.), которые могут иметь один или несколько (предпочтительно 1-3) подходящих заместителей, таких как высшая алкокси-группа (пояснена ниже), или т. п.; гетероциклическая тио-группа, предпочтительно пиридилтио-, которая может иметь один или несколько (предпочтительно 1-3) подходящих заместителей, подобных высшему алкилу (например гептил, октил, 2-этилгексил, ионил, децил, 3,7-диметилоктил, ундецил, додецил, тридецил, тетрадецил, пентадецил, 3-метил-10-этилдодецил, гексадецил, гепатадецил, октадецил, ионадецил, икозил и др.) или им подобные; гетероциклическая группа (например тиенил, имидазолил, пиразолил, фурил, тетразолил, тиазолил, тиадиазолил и др.), которые могут иметь один или несколько (предпочтительно 1-3) подходящих заместителей, подобных амино-, упомянутой защищенной амино-группе, упомянутым высшим алкилом и т.п.; или им подобными;
высший алканоил (например гептанил, окатноил, наноноил, деканоил, ундеканоил, луароил, тридеканоил, миристоил, пентадеканоил, пальмитоил, 10, 12-диметилтетралеканоил, гептадеканоил, пальмитоил, стеароил, нонадеканоил, икозаноил и др.);
низший алкеноил (например акрилоил, тетарилоил, кротоноил, 3-пептеноил, 5-гексоноил и др.), которые могут иметь один или несколько (предпочтительно 1-3) подходящих заместителей, таких как упомянутый арил, который может иметь один или несколько (предпочтительно 1-3) подходящих заместителей, подобных высшей алкокси-группе /пояснена ниже/ или им подобные;
высший алкенол (например, 4-гептеноил, 3-октеноил, 3,6-декадиеноил, 3,7,11-триметид-2,6,10-додекатриеноил, 4,10-гептадекадиеноил и др.);
низший алкоксикарбонил, (например метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил и др.);
высший алкоксикарбонил (например гептилоксикарбонил, октилоксикарбонил, 2-этилгексилкарбонил, нонилоксикарбонил, дециклоксикарбонил, 3,7-диметилоктилоксикарбонил, ундецилоксикарбонил, додецилоксикарбонил, тридецилоксикарбонил, тетрадецилоксикарбонил, пентадецилоксикарбонил, 3-метил-10-этилдодецилоксикарбонил, гексадецилоксикарбонил, гептадецилоксикарбонил, октадецилоксикарбонил, нонадецилоксикарбонил, икозилоксикарбонил и др.);
арилоксикарбонил (например феноксикарбонил, нафтилоксикарбонил и др.);
арилглиоксилоил (например фенилглиоксилоил, нафтилглиоксилоил и др.);
ар(низший)алкоксикарбонил, который может иметь один или несколько подходящих заместителей, такой как фенил(низший)-алкоксикарбонил, который может иметь нитро- или низшую алкокси-группу (например бензилоксикарбонил, фенетилоксикарбонил, п-нитробензилоксикарбонил, п-метоксибензилоксикарбонил и др.);
низший алкисульфонил (например метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, пентилсульфонил, бутилсульфонил и др.);
арилсульфонил (например фенилсульфонил, нафтилсульфонил и др.), который может иметь один или несколько подходящих заместителей (предпочтительно 1-3), таких как низший алкил, как пояснено ниже, высшая алкокси-группа, которая пояснена ниже или т.п.;
ар(низший)алкилсульфонил, такой как фенил(низший)алкилсульфонил (например бензилсульфонил, фенетилсульфонил, бензгидрилсульфонил и др.) и т. п.;
ароил (например бензоил, нафтоил, антранилкарбонил и др.), который может иметь один или несколько (предпочтительно 1-5) подходящих заместителей, таких как упомянутый галоген; низший алкил (например метил, этил, пропил, бутил, трет-бутил, пентил, гексил и др.); упомянутый алкил; низшая алкокси-группа (например метокси-, этокси-, пропокси-, бутокси, трет-бутокси, пентилокси, гексилокси- и др. ); который может иметь один или несколько (предпочтительно 1-10) подходящих заместителей, подобных упомянутым низшей алкоксигруппе, галогену, арилу или т.п.; высшая алкокси-группа (например гептилокси, октилокси, 2-этилгексилокси, нонилокси, децилокси, 3,7-диметилоктилокси, ундецилокси, додецилокси, тридецилокси, тетрадецилокси, пентадецилокси, 3-метил-10-этилдодецилокси, гексадецилокси, гептадецилокси, октадецилокси, нонадецилокси, икозилокси и др.), которая может иметь один или несколько (предпочтительно 1-17) подходящих заместителей, таких как упомянутый галоген; высшая алкенилокси-группа (например 3-гептенилокси, 7-октенилокси, 2,6-оксидиенилокси, 5-ноненилокси, 1-деценилокси, 3,7-диметил-2,6-октадиенилокси, 3,7-диметил-6-октенилокси, 8-ундеценилокси, 3,6,8-додекатриенилокси, 5-тридеценилокси, 7-тетрадеценилокси, 1,8-пентадекадиенилокси, 15-гексадеценилокси, 11-гептадеценилокси, 7-октадеценилокси, 10-нонадеценилокси, 18-икозенилокси и др.); карбокси; упомянутый выше арил, который может иметь один или несколько подходящих заместителей (предпочтительно 1-3), подобных упомянутой высшей алкокси-группе; арилокси (например фенокси, нафтилокси, антраценилокси и др.), который может иметь один или несколько (предпочтительно 1-3) подходящих заместителей, наподобие упомянутой низшей алкокси или высшей алкокси-8руппы; или т.п.
В упомянутой "ацильной группе" предпочтительной может быть низший алканоил; галоид(низший алканоил; ар(низший)алканоил, который может иметь один или несколько (предпочтительно 1-3) групп: гидрокси, низшая алкокси, высшая алкокси-группа, арил, амино-, защищенная амино-группа, ди(низший)алкил-амино, низшая алкоксиимино или ар(низший)алкоксиимино-группа, которая может иметь один или несколько (предпочтительно 1-3)высших алкокси-групп;
гетероциклический тио(низший)алканоил, который может иметь одну или несколько (предпочтительно 1-3) высших алкильных групп;
гетероциклический(низший)алканоил, который может иметь одну или несколько (предпочтительно 1-3) групп: низшая алкоксиимино, высший алкил, амино- или защищенная амино-группа;
ар(низший)алкоксиимино(низший) алканоил, который может иметь один или несколько (предпочтительно 1-3) высших алкоксигрупп;
высший алканоил;
ар(нзиший)алкеноил, который может иметь одну или несколько (предпочтительно 1-3) высших алкокси-групп;
высший алкеноил; низшая алкоксикарборнильная группа; высший алкоксикарбонил; арилоксикарбонил;
арилсульфонил, который может иметь одну или несколько (предпочтительно 1-3) низший алкильных или высших алоксил-групп;
ароил, который может иметь один или несколько (предпочтительно 1-5) атомов галогена, низших алкилов, высших алкилов, карбокси-групп, низших алкокси-групп, которые могут иметь один или несколько (предпочтительно 1-10) атомов галогена, низших алкокси(низший)алкокси-групп ар(низший)алкокси-, высших алкокси-групп, которые могут иметь один или несколько (предпочтительно 1-17) атомов галогена, высших алкенилокси-групп, арил, который может иметь одну или несколько (предпочтительно 1-3) высших алкокси- или арилокси-групп, которые могут иметь дну или несколько (предпочтительно 1-3) низших алкокси или высших алкокси- групп;
среди которых наиболее предпочтительными группами могут быть низшие алканоильные; галоид(низший)алканоил;
фенил(низший)алканоил или нафтил(низший)алканоил, каждый из которых может иметь 1-3 гидрокси-групп, низших алкокси-, высших алкокси-, фенильных, амино-, низших алкоксикарбониламино-, ди(низший)алкиламино-, низших алкоксиимино-, или фенил(низший)алкоксиимино-групп, которые могут иметь 1-3 высших алкокси-групп;
пиридилтио(низший)алканоил, который может иметь 1-3 высших алкильных групп;
имидазоил(низший)алканоил или тиазолил(низший)алканоил, каждый из которых может иметь 1-3 низших алкоксиимино, высших алкильных, амино- или низших алкоксикарбноиламино-групп;
фенил(низший)алкоксиимино(низший)алканоил, который может иметь 1-3 высших алкокси-групп;
высший алканоил;
фенил(низший)алкеноил, который может иметь 1-3 высших алкокси-групп;
высший алкеноил; низший алкоксикарбонил, высший алкоксикарбонил; феноксикарбонил;
фенилсульфонил или нафтилсульфонил, каждый из которых может иметь 1-3 высших алкильных или высших алкокси-групп;
бензоил, нафтоил или антраценилкарбонил, каждый из которых может иметь 1-5 атомов галогена, низших алкилов, высших алкилов, карбокси, низших алкокси-групп, которые могут иметь 6-10 атомов галогена, низших алкокси(низший)алкокси-групп, которые могут иметь 12-17 атомов галогена, высших алкенилокси-групп, фенильных групп, которые могут иметь 1-3 высших алкокси-группы, фенокси-групп, которые могут иметь 1-3 низших алкокси или высших алкокси-группы;
наиболее предпочтительной может быть группа (C1-C4)алканоил; галоид(C1-C4)алканоил;
фенил(C1-C4)алканоил, который может иметь 1-3 гидрокси-группы, (C1-C4)алкокси, (CV7-C16)алкокси, фенильных, амино-, (C1-C4)алкоксикарбониламино-, ди(C1-C4)алкиламино, (C1-C4)алкоксиимино-, или фенил(C1-C4)алкоксиимино-группы, которые могут иметь (C7-C16)алкокси-группы;
нафтил(C1-C4)алканоил, который может иметь 1-3 (C1-C4)алкоксикарбониламино-группы;
1-(C7-C16)алкилпиридиниотио (C1-C4)алканоил;
имидазолил(C1-C4)алканоил, который может иметь 1-3 (C7-C16)алкильных или (C1-C4) алкоксикарбониламино-группы;
тиазолил(C1-C4)алканоил, который может иметь 1-3 (C1-C4)алкоксиимино- или амино-группы;
фенил(C1-C4)алкоксиимино(C1-C4) алканоил, который может иметь 1-3 (C7-C16)алкокси-группы;
(C7-C17)алкил;
фенил(C1-C4)алкеноил, который может иметь 1-3 (C7-C16)алкокси-группы;
(C7-C18)алкеноил; C3-C6)алкоксикарбонил; (C7-C16)алкоксикарбонил; феноксикарбонил;
фенилсульфонил, который может иметь (C1-C4)алкил или (C7-C16)алкокси-;
нафтилсульфонил, который может иметь (C7-C16)алкокси-;
бензоил, который может иметь 1-5 атомов галогена, (C3-C6)-алкильных, (C7-C16)алкильных, карбокси, (C1-C6)алкокси-, который может иметь 6-10 атомов галогена, (C1-C4)алкокси-(C1-C4)алкокси, фенил(C3-C6)алкокси, (C7-C16)алкокси, который может иметь 12-17 атомов галогена, фенил, который может иметь 1-3 (C7-C16)алкокси-группы или фенокси-группа, которая может иметь 1-3 C3-C6 алкокси или (C7-C16)алкокси-группы;
нафтоил, который может иметь 1-3 (C3-C6)алкокси-группы, (C7-C16)алкокси- или (C7-C16)алкенилокси-группы;
антраценилкарбонил;
и наиболее предпочтительными могут быть ацетил, 2-бромацетил, 2-(4-деффинилил)ацетил, 2-(4-октилоксифенил)ацетил, 3-(4-октилоксиенил)пропионил, 2-амино-2-(4-октилоксифенил)ацетил, 2-(трет-бутоксикарбониламино)-2-(4-октилоксифенил)ацетил, 2-амино-3-(4-октилоксифенил)пропионил, 2-(трет-бутоксикарбониламино)-3-(4-октилоксифенил)пропионил, 2-диметиламино-3-(4-октилоксифенил)пропионил, 2-(трет-бутоксикарониламино)-2-(2-нафтил)ацетил, 2-метокси-2-(4-октилоксифенил)ацетил, 2-метоксиимино-2-(4-октилоксифенил)ацетил, 2-(4-октилоксибензилоксииимино)-2-(4-гидроксифенил)ацетил, 2-(4-октилоксибензилоксиимино)-2-фенилацетил, 2-(4-оксилоксибензилоксиимино)ацетил, 2-(1-октил-4-пиридинио)тиоацетил, 2-метоксиимино-2-(2-аминотиазол-4-ил)ацетил, 2-(терт-бутоксикарбониламино)-3-(1-октил-4-имидазолил)пропионил, 3-(4-октилоксиенил)акрилоил, 3,7,11-триметил-2,6,10-додекатриеноил, трет-бутоксикарбонил, октилоксикарбонил, феноксикарбонил, п-толилсульфонил, 4-октилоксифенилсульфонил, 6-октилокси-2-нафтилсульфонил, 4-(трет-бутил)бензоил, 4-октилбензоил, 2,3,5,6-тетрафтор-4-(2,2,3,3,4,4,5,5-октафторпентилокси)бензоил, 4-(2-бутоксиэтокси)бензоил, 4-(4-фенилбутокси)бензоил, 4-октилоксибензоил, 2-карбокси-4-октилоксибензоил, 3-метокси-4-октилоксибензоил, 4-(2,2,3,3,4,4,5,5,6,6,7,7,8,8-пентадекафтороктилокси)-2,3,5,6- тетраторбензоил, 4-(4-олктилоксиениол)бензоил, 4-(4-октилоксифеноксил)бензоил, 6-бутокси-2-нафтоил, 6-гексил-окси-2-нафтоил, 6-октилокси-2-нафтоил, 6-(2-этилгексилокси)-2-нафтоил, 6-децилокси-2-нафтоил, 6-(3,7-диметилоктилокси)-2-нафтоил, 6-додецилокси-2-нафтоил, 6-(3,7-диметил-6-октенилокси)-2-нафтоил, 6-(3,7-диметил-6-октадиенилокси)-2-нафтоил, и 2-антрилкарбонил, 4-(4-гептилоксифенил)-бензоил и 4-(4-гексилоксифенокси)бензоил.
Подходящая ацильная группа, исключая пальмиоил" может быть такой же, как указано в качестве примера для "ацильной группы" за исключением пальмитоила.
Подходящая функциональная группа "ар(низший)алканоил" в "ар(низший)алканоил, который имеет высшую алкокси-группу и защищенную амино-группу, и "ар(низший)алканоил, который имеет высшую алкокси-группу и защищенную амино-группу", может быть такой же, как указано в качестве примера для "ацильной группы" и подходящие примеры заместителя (заместителей) "высший алкокси" и "защищенная амино-группа" могут быть такими же, как указано в качестве примера для "ацильной группы".
Подходящая "галоид(низший)алканоильная группа" может быть такой же, как указано в качестве примера для "ацильной группы".
Подходящий "пиридилтио(низший)алканоил" в "пиридилтио(низший)алканоиле, который может иметь высший алкил" может быть таким же, как указано в качестве примера для "ацильной группы", и подходящие примеры заместителя "высший алкил" могут быть такими же, как указано в качестве примера для "ацильной группы".
Подходящая "ацилокси-группа" может включать гидроксисульфонилокси-, фосфоноокси и т.п.
В целевом соединении (1), обозначенном таким образом, особенно предпочтительным является следующее соединение /1h/.
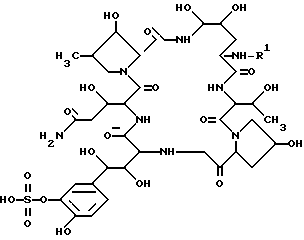 ,
,
в которой R1 является атомом водорода или ацильной группой, при условии, что R1 не является пальмитоилом.
Подходящим "ацилирующим агентом" для реакции ацилирования в способе 2 может быть кислотное соединение с ацильной группой, соответствующей той, которая должна быть введена, или его реакционноспособная производная при карбокси-группе, или его соль, и подходящий пример упомянутого ацилирующего соединения представляется формулой: R
Среди соединений (V) являются новыми следующие вещества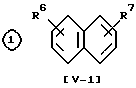 .
.
(V-I) или его реакционноспособная производная при карбокси-группе, или его соль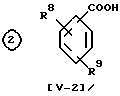 .
.
(V-2) или его реакционноспособная производная при карбоксигруппе, или его соль
в которой R6 является низшей алкокси-группой, высшей алкокси-группой, или высшей алкенилокси-группой, R7 является группой -COOH или SO3H, R8 соответствует 1-4 атомам галогена, R9 - высшая алкокси-группа, которая имеет один или несколько атомов галогена, низшая алкокси-группа, которая имеет один или несколько атомов галогена.
Вещества (V-1) и (V-2) могут быть получены следующими способами:
Способ B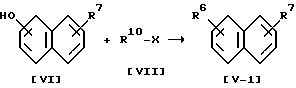 .
.
(VI) или его соль (VII) или его соль (V-1) или его соль
Способ C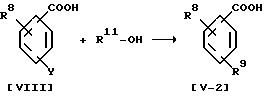 .
.
(VIII) или его соль (IX) или его соль (Y-2) или его соль в которых радикалы R6, R7, R8 и R9 каждый имеет указанное выше значение, R10 является низшим алкилом, высшим алкилом или высшим алкенилом, R11 является низшим алкилом, который имеет один или несколько атомов галогена, или высшим алкилом, который имеет один или несколько атомов галогена, и каждый X и Y является отщепляемой группой.
В приведенных определениях, подходящими группами "низшая алкокси", "высшая алкокси", "высшая алкенилокси", "атом галогена", "низший алкил" и "высший алкил", могут быть такими как указано выше, в качестве примера.
Подходящая "высшая алкенилокси-группа" может включать 3-гептенил, 7-октенил, 2,6-октадиенил, 5-ноненил, 1-деценил, 3,7-диметил-6-октенил, 3,7-диметил-2,6-октадиенил, 8-ундеценил, 3,6,8-додекатриенил, 5-тридеценил, 7-тетрадеценил, 1,8-пентадекадиенил, 15-гексадеценил, 11-гептадеценил, 7-октадеценил, 10-нонадеценил, 18-икозенил и т.п., в которых предпочтительными группами могут быть (C7-C16)алкенил.
Что касается радикала R9, "низшая алкокси-группа" имеет один или несколько (предпочтительно 1-10) атомов галогена и "высшая алкокси-группа" имеет один или несколько (предпочтительно 1-17, более предпочтительно 12-17) атомов галогена.
Что касается радикала R11, "низший алкил" имеет один или несколько (предпочтительно 1-10, более предпочтительно 6-10) атомов галогена и "высший алкил" имеет один или несколько (предпочтительно 1-17, более предпочтительно 12-17) атомов галогена.
Что касается R6, предпочтительной "низшей алкокси-группой" может быть (C4-C6)алкокси.
Подходящая "отщепляемая группа" может включать упомянутый атом галогена, низшую алканоилокси-группу (например ацетокси и др. ), сульфонилокси (например мезилокси, тозилокси и др.) и т.п.
Что касается подходящих солей и реакционноспособных производных при карбокси-группе соединений (Y-1) и (Y-2), то он могут быть такими же, как указано в качестве примера для соединения (V) ниже.
Реакции в способе B и C могут осуществляться согласно методам, которые раскрыты ниже в препаративной части заявки или аналогичными методами.
В соединении (V) имеются другие новые вещества, отличающиеся от соединений (Y-1) и (Y-2), и они могут быть приготовлены, например, с помощью методов, раскрытых в препаративной части.
Подходящий "пиридинтион" в способе 4 может включать 1,2-дигидроапиридин-2-тион, 1,4-дигидропиридин-4-тион и т.п., причем указанный "пиридинтион" может иметь упомянутый "высший алкил".
Способы приготовления целевого соединения (1) или его соли в изобретении подробно поясняются ниже.
Способ 1
Целевое соединение (1a) или его соль могут быть приготовлены путем вовлечения соединения (11) или его соли в реакцию элиминирования N-ацильной группы.
Эту реакцию проводят в соответствии с традиционной методикой, такой как гидролиз, восстановление, взаимодействие с ферментом или тому подобное.
Гидролиз предпочтительно осуществляют в присутствии основания или кислоты, включая Льюисовы кислоты. Подходящее основание может включать неорганическое основание и органическое основание, такое как щелочной металла (например натрий, калий и др.), щелочноземельный металл (например магний, кальций и др. ), их гидроксиды, карбонаты или бикарбонаты, триалкиламин (например триметиламин, триэтиламин и др. ), пиколин, 1,4-диазабицикло-(2,2,2)октан, 1,5-диазабицикло(4,3,0)но-5-ен, 1,8-диазабицикло-(5,4,0)ундец-7-ен или т.п.
Подходящая кислота может включать органическую кислоту (например муравьиную, уксусную, пропионовую, трихлоруксусную, трифторуксусную и др.) и неорганическую кислоту (например хлористоводородную, бромистоводородную кислоту, серную, хлористый водород, бромистый водород и др.). При элиминировании с использованием кислоты Льюиса, такой как тригалоидуксусная кислота (например трихлоруксусной, трифторуксусной и др.) или тому подобных, реакция предпочтительно проводится в присутствии агентов-акцепторов катионов Э, например анизола, фенола и др.).
Обычно реакцию элиминирования проводят в растворителе, таком как вода, спирт (например метанол, этанол и др.), хлористый метилен, тетрагидрофуран, их смеси, или любой другой растворитель, который не оказывает вредного воздействия на реакцию. В качестве растворителя также могут использоваться жидкое основание или кислота. Температура реакции не является критической, причем реакцию обычно проводят в условиях охлаждения или нагревания.
Способ восстановления, применимый для реакции элиминирования, может включать химическое восстановление и каталитическое восстановление.
Подходящие восстанавливающие агенты, которые могут использоваться при химическом восстановлении, представляют собой комбинацию металлов (например олово, цинк, железо и др.) или соединение металла (например хлористый хром, ацетат хрома и др.) и органическая или неорганическая кислоты (например муравьиная, уксусная, пропионовая, трифторуксусная, пара-толуолсульфоновая, хлористоводородная, бромистоводородная кислота и др.).
Подходящими катализаторами, которые могут использоваться в каталитическом восстановлении, являются традиционные катализаторы, такие как платиновые катализаторы (например в виде пластины, губчатой платины, платиновой черни, коллоидной платины, оксида платины, платиновой проволоки и др.), палладиевые катализаторы (например губчатый палладий, палладиевая чернь, оксид палладия, палладий на угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и др.), никелевые катализаторы (например восстановленный никель, оксид никеля, никель Ренея и др.) кобальтовые катализаторы (например восстановленный кобальт, кобальт Ренея и др. ) железные катализаторы (например восстановленное железо, железо Ренея и др.), медные катализаторы (например восстановленная медь, медь Ренея, медь Улльмана и др.) и т.п.
Обычно восстановление проводят в традиционном растворителе, который не оказывает вредного воздействия на ход реакции, таком как вода, метанол, этанол, пропанол, N,N-диметилформамид или их смеси. Кроме того, в том случае, с когда упомянутые кислоты, используемые при химическом восстановлении, являются жидкостями, они также могут использоваться как растворители. Далее используемые при каталитическом восстановлении подходящий растворитель, может быть упомянутым растворителем и другим традиционным растворителем, таким как диэтиловый эфир, диоксан, тетрагидрофуран и др. или их смеси.
Температура этой реакции восстановления не является критической, причем реакция может быть проведена при охлаждении или при нагревании.
Взаимодействие с ферментом может быть проведено путем взаимодействия соединения (1) или его соли с ферментом, который пригоден для реакции элиминирования N-ацильной группы.
Подходящий пример упомянутого фермента может включать фермент, продуцируемый некоторыми микроорганизмами Актинопланации, например, Актинопланес утагензис АТСС 12301, Актинопланес миссоуриензис NRRL 12053 и т.п.; и т.п.
Обычно эта реакция элиминирования проводится в растворителе, таком как фосфатный буфер, буфер Трис-HCl, или в любом другом растворителе, который не оказывает вредного влияния на реакцию. Температура реакции не является критической, причем элиминирование может быть осуществлено при температуре от комнатной до повышенной.
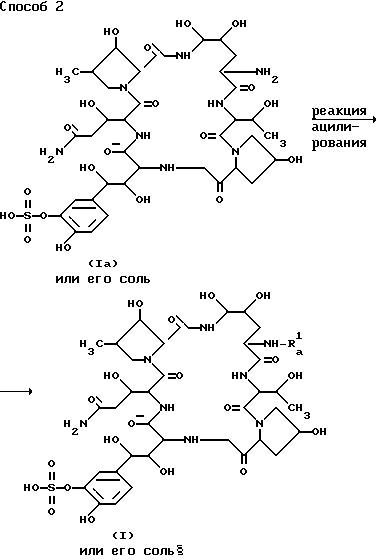
Способ 2.
Целевое соединение (1b) или его соль могут быть приготовлены путем вовлечения соединения (1) или его соли в реакцию ацилирования.
Реакция ацилирования этого способа может быть проведена путем взаимодействия соединения (1a) или его соли с упомянутым "ацилирующим агентом", например с соединением (V) или его реакционноспособной производной или карбокси-группе, или его солью.
Подходящая реакционноспособная производная при карбокси-группе соединения (V) моет включать галогенид кислоты, ангидрид кислоты, активированный амид кислоты, активированный сложный эфир и т.п. Подходящими примерами реакционноспособных производных могут быть хлорид кислоты; азид кислоты; смешанный ангидрид кислоты с такой кислотой, как замещенная фосорная кислота (например диалкилфосфорная кислота, фенилфосфорная кислота, дифенилфосфорная кислота, дибензилфосфорная кислота, галоидированная фосфорная кислота и др. ), диалкилфосфорная кислота, сернистая кислота, тиосерная кислота, серная кислота, сульфоновая кислота (например метансульфоновая кислота и др.), алифатическая карбоксильная кислота (например уксусная, пропионовая, масляная, изомасляная, триметилуксусная кислота, пентановая кислота, изопентановая кислота, 2-этилмасляная кислота, трихлоруксусная кислота и др.); или ароматическая карбоксильная кислота (например бензойная кислота и др.); или симметричный ангидрид кислоты; амид, активированный имидазолом, 4-замещенным имидазолом, диметилпиразолом, триазолом, тетразолом или 1-гидрокси-1H-бензотриазолом; или активированный сложный эфир (например сложный цианометиловый эфир, сложный метоксиметиловый эфир, диметилиминометиловый /(CH3)2= CH-/ сложный эфир, виниловый сложный эфир, пропаргиловый, п-нитрофениловый, 2,4-динитрофениловый, трихлорфениловый, пентахлорфениловый, мезилфениловый, фенилазофениловый эфир, сложный фенилтиоэфир, сложный тиоэфир п-нитрофенила, сложный паракрезилтиоэфир, сложный карбкосиметилтиоэфир, сложный пираниловый эфир, пиридиловый сложный эфир, пиперидиловый эфир, сложный тиоэфир 8-хинолина и др.), или сложный эфир с N-гидроксисоединением (например N,N-диметилгидроксиламином, 1-гидрокси-2-(1H)-пиридином, N-гидроксисукцинимидом, N-гидроксифтальимидом, 1-гидрокси-1H-бензотриазолом и др.) и т.п. Эти реакционные производные могут быть необязательно выбраны из перечисленных в соответствии с типом используемого соединения (V).
Подходящими солями соединения (V) и его реакционноспособными производными могут быть те, которые приведены в качестве примера для соединения (1).
Эта реакция обычно осуществляется в традиционном растворителе, таком как вода, спирт (например метанол, этанол, и др.) ацетон, диоксан, ацетонитрил, хлороформ, хлористый метилен, хлористый этилен, тетрагидрофуран, этилацетат, N, N-диметилформамид, пиридин или любой другой органический растворитель, который не оказывает вредного воздействия на ход реакции. Эти традиционные растворители также могут использоваться в смеси с водой.
В этой реакции, когда соединение (1) используется в виде свободной кислоты или в виде ее соли, тогда предпочтительно взаимодействие проводят в присутствии традиционного конденсирующего агента, такого как N,N-дициклогексилкарбодиимид, N-циклогексил-N морфолиноэтилкарбодиимид; N-циклогексил-(4-диэтиламиноциклогексил)карбодиимид; N,N-диэтилкарбодиимид, N,N-диизопропилкарбодиимид; N-этил-N-(3-диметиламинопропил)карбодиимид, N,N-карбониблис-(2-метиллимидазол); пентаметиленкетен-N-циклогексилимин; диенилкетен-N-циклогексилимин; этоксиацетилен; 1-алкокси-1-хлорэтилен; триалкилфосфит; этилиолифосфат; изопропилиолифосфат; оксихлорид фосфора (хлористый фосфорил); трихлорид фосфора; тионилхлорид; оксалилхлорид; низший алкилгалоидформиат (например, этилхлорформиат, изопропилхлорформиат и др.); триенилфосфин; соль 2-этил-7-гидроксибензизоксазолиума; соль внутримолекулярная 2-этил-5-(м-сульфенил) изоксазолиума гидроксида; 1-(п-хлорбензолсульфонилокси)-6-хлор-1H-бензотриазол; так называемый реагент Вильсмейера, получаемый взаимодействием N, N-диметилформамида с хлористым тионилом, фосгеном, трихлорметилхлорформиатом, оксихлоридом фосфора, метансульфонилхлоридом и др.; или т. п.
Эта реакция также может быть проведена в присутствии неорганического или органического основания, такого как карбонат щелочного металла, бикарбонат щелочного металла, три (низший)-алкиламин, пиридин ди(низший)алкиламинопиридин (например 4-диметиламинопиридин и др. ), N-(низший)алкилморфолин, N, N-(низший)алкилбензиламин и т.п.
Температура реакции не является критической и обычно реакцию можно проводить при охлаждении или при нагреве.
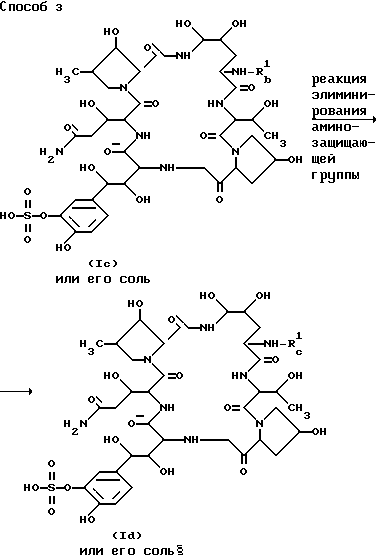
Способ 3.
Целевое соединение /Id/ или его соль могут быть приготовлены посредством вовлечения соединения /Ic/ или его соли в реакцию элиминирования аминозащищающей группы.
Подходящими солями соединений /Ic/ и /Id/ могут быть те, которые указаны для примера для соединения (I).
Эта реакцию элиминирования может быть проведена в соответствии с традиционным методом, как пояснено для процесса 1.
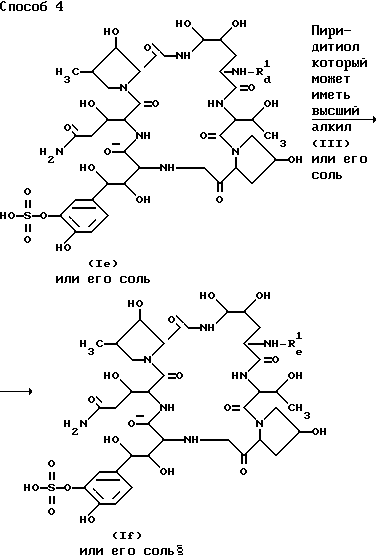
Способ 4.
Целевое соединения /If/ или его соль могут быть приготовлены посредством взаимодействия соединения /Iee/ или его соли с соединением /III/ или его солью.
Подходящая соль соединения /If/ может быть такой же как указано в качестве примера для соединения (1).
Подходящая соль соединения (III) может быть такой же аддитивной солью кислоты, как указано в качестве примера для соединения (I).
Настоящее взаимодействие может быть проведено в растворителе, такой как вода, фосфатный буфер, ацетон, хлороформ, ацетонитрил, нитрофензол, хлористый метилен, этилендихлорид, формамид, N, N-диметилформамид, метанол, этанол, диэтиловый эфир, тетрагидрофуран, диметилсуьфоксид или любой другой органический растворитель, который не оказывает нежелательного влияния на реакцию, предпочтительно в растворителях с сильной полярностью. А среди этих растворителей-гидрофильные могут использоваться в смеси с водой. Когда вещество (III) является жидкостью, оно также может использоваться в качестве растворителя.
Предпочтительно реакцию проводят в присутствии основания, например, неорганического основания, такого как гидроксид щелочного металла, карбонат щелочного металла, бикарбонат щелочного металла, органического основания, такого как триалкиламин, и т.п.
Температура реакции не является критической, и взаимодействие может быть проведено при охлаждении, при комнатной температуре, при нагреве или кипячении.
Настоящее взаимодействие предпочтительно проводят в присутствии галогенида щелочного металла (например иодида натрия, иодида калия и др.), тиоцианата щелочного металла (например тиоцината натрия, тиоцианата калия и др.) или т.п.
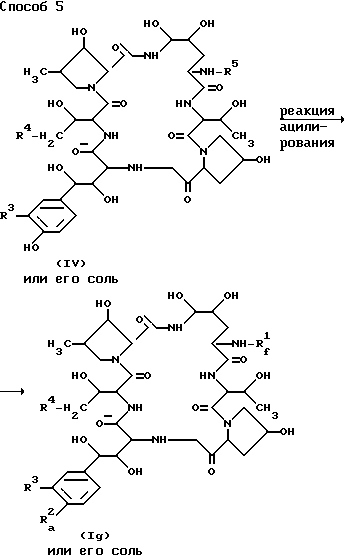
Способ 5.
Целевое соединение /Ig/ или его соль могут быть получены в результате вовлечения соединения (IV) ли его соли в реакцию ацилирования.
Подходящие соли соединений /Ig/ и (IV) могут быть такими же, которые указаны в качестве примера для вещества (I).
Подходящим "ацилирующим агентом" в Способе 5 может быть кислотное соединение, соответствующее ацильной группе, которая должна быть введена, например, фосфорная кислота и ее производные (например хлористый фосфорил, дифенилфосфорохлоридат и др.), серная кислота и ее производные (например, комплексы триоксида серы и пиридина, триоксида серы и три(низший)алкиламина (например триметиламин, триэтиламин и др.), хлорсульфоновая кислота и др.) или т.п.
Эта реакция может быть проведена традиционным образом.
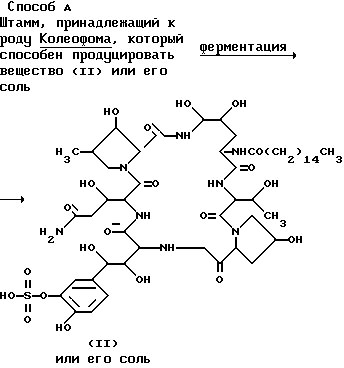
Способ получения исходного соединения (II) или его соли подробно поясняется ниже в описании изобретения.
Способ А.
Соединение (II) или его соль по этому изобретению могут быть получены посредством ферментации в питательной среде штаммов, принадлежащий к роду Колеофома и продуцирующих соединение (II) или его соль, например вид Колеофома F-11899.
Микроорганизм.
Особенности микроорганизма, применяемого для продуцирования соединения (II) или его соли, пояснены ниже.
Штамм F-11899 первоначально был извлечен из почвы образца, отобранного в городке Иваки, округ Фукушима, Япония. Этот организм рос довольно ограниченно на различных культурных средах и образовывал колонии от темно-серого до коричневато-серого цвета. Анаморфа (конидиомата) продуцирована на сегменте листа, стерилизованного паром, и прикрепленного на LCA пластину Миуры /I/ или на агаровую пластину из кукурузной муки, хотя на агаровой среде не формировались ни телеоморфа, ни анаморфа. Его морфологические характеристики на различных агаровых средах, а также культуральные и физиологические характеристики, обобщены в табл. 1.
Культуры на агаре картофельной декстрозы росли довольно быстро, достигая 3,5-4,0 см в диаметре, спустя 2 недели при 25oC. Поверхность этой колонии была плоской, сильно опущенной, отчасти морщинистой и коричневато-серой. Центр колонии был палево-серым (до коричневато-серого цвета) и был покрыт аэриальными гифами. Обратная сторона была темно-серой. Колонии на агаре солодового экстракта росли более ограниченно. Колонии на агаре солодового экстракта росли более ограниченно, достигая 2,5-3,0 см в диаметре при тех же самых условиях. Поверхность была плоской, слегка опущенной и оливково-коричневого цвета. Центр колонии был желтовато-серым и покрыт аэриальными гифами. Обратная сторона была коричневато-серой.
Морфологические характеристики определялись на основе культур на стерилизованном листе, прикрепленном к LCA пластине Миуры. Колонидиоматы образовывались только на сегменте листа. Они были кувшинообразными, поверхностными, раздельными, имели форму от дискоидной до ампулоподобной, уплощенными у основания, однокамерными, тонкостенными, черными; имели диаметр 90-160 (-200) мкм и высоту 40-70 мкм. Поры часто были одинарными, круглыми, центральными и покрытыми папиллами, 10-30 мкм в диаметре и 10-20 мкм высотой. Конидиофоры формировались из нижнего слоя внутренних стенок "кувшина". Они были стекловидными, простыми или редко разветвленными, разделенными перегородками и гладкими. Конидиогенные клетки были энетеробластичными, фиалидными, детерминированными, имели форму от грушевидной до ампулообразной, стекловидными, гладкими, размером 5-8х4-6 мкм с коллареттами. Эти колларетты были колокообразными (до цилиндрической формы) с размерами 14-18х3-5 мкм. Конидии были стекловидными, цилиндрическими, тонкостенными, без перегородок, гладкими с размерами 14-16(-18)х2-3 мкм.
Штамм F-11899 рос в температурном интервале от 0 до 31oC, причем оптимальны температуры от 23 до 27oC на агаре картофельной декстрозы.
Приведенные характеристики, что штамм F-11899 принадлежит к отряду Коеломицетов /1-4/. Таким образом, мы назвали этот штамм "Коеломицентный штамм F-11899".
Названная таким образом культура Коеломицетного штамма F-11899, была депонирована 26 Октября 1989 Исследовательским институтом ферментации, Агентство промышленной науки и технологии (1 - 3, Хигаши 1-чоум, г. Цукуба, пр. Ибараки 305, Япония) под номером FEEM BP-2635.
Однако после этого мы изучили дополнительную классификацию штамма F-11899 и обнаружили, что этот штамм напоминает Колеофому эмпетри (Роструп, Петрак 1929, /2-4/), принадлежащая к отряду Косломицетов, но отличающаяся в некоторых характеристиках "кувшинов" глобозные или уплощенные у основания, погруженные и без папиллята.
Обсудив эти характеристики, классифицировали этот штамм более детально и переименовали его на "Колеофома, вид F11899".
В этой связи уже предпринятые шаги, чтобы изменить название "Коэломицетный штамм F11899" на Колеофома, вид F11899, 21 сентября 1990 г. в Исследовательском институте ферментации, Агентство промышленной науки и технологии.
Производство соединения (II) или его соли.
В этом изобретении соединение (II) или его соль получаются, когда штамм, принадлежащий к роду Колеофома, продуцирует соединение (II) или его соль в питательной среде, содержащей источник усваиваемого углерода и азота в аэробных условиях (например встряхиваемые культуры, погруженные культуры и др.).
Предпочтительными источниками углерода в питательной среде являются углеводы, такие как глюкоза, сахароза, крахмал, фруктоза или глицерин, или т. п.
Предпочтительными источниками азота являются дрожжевой экстракт, пептон, глютеновая мука, измельченные семена хлопчатника, соевая мука, сироп из стебля кукурузы, высушенные дрожжи, ростки пшеницы и др., а также неорганические и органические соединения азота, такие как соли аммония (например нитрат аммония, сульфат аммония, фосфат аммония и др.), мочевина или аминокислоты, или т.п.
Хотя предпочтительно источники углерода и азота используются в сочетании, нет необходимости их использования в чистом виде, так как материалы с меньшей степенью очистки, которые содержат следы факторов роста и значительные количества минеральных питательных веществ, также пригодны для использования.
При желании они могут добавляться к среде минеральных соединений, таких как карбонаты натрия или кальция, фосфаты натрия или калия, хлориды натрия или калия, иодиды натрия или калия, соли магния, меди, цинка или кобальта, или т.п.
В случае необходимости, особенно когда культурная среда интенсивно пенится, можно добавлять антивспенивающий агент, такой как жидкий парафин, жировое масло, растительное масло, минеральное масло или силикон, или т.п.
Как и в случае предпочтительных способов, применяемых для производства других биологически активных веществ в больших количествах, для производства соединения (II) или его соли в больших количествах предпочтительными являются погруженные аэробные условия культивирования.
Для производства в небольших количествах используются культуры со встряхиванием или поверхностные в колбах или бутылях.
Кроме того, когда выращивание проводится в больших таках, предпочтительно использовать вегетативную форму организма для инокулирования в производственных емкостях, для того чтобы избежать латентного периода в процессе производства соединения (II) или его соли. Соответственно, желательно сначала получить вегетативный инокулят организма посредством инокуляции относительно небольшого количества культурной среды спорами или мицеллием организма и культивирования указанной инокулированной среды, и затем перенести культивированный вегетативный инокулят в большие емкости. Среда, в которой образуется вегетативный инокулят, является практически той же самой, что и среда, применяемая для производства соединения (II) или его соли, или отличается от этой среды.
Перемешивание и аэрирование культуральной смеси может осуществляться множеством способов. Перемешивание может обеспечиваться с помощью пропеллера или аналогичного механического перемешивающегося оборудования путем вращения или встряхивания ферментора, с помощью различного перекачивающего оборудования или посредством пропускания стерильного воздуха через среду. Аэрирование может осуществляться посредством пропускания стерильного воздуха через ферментационную смесь.
Обычно ферментацию проводят при температуре примерно между 10 и 40oC, предпочтительно 20 - 30oC, в течение периода примерно 50 - 150 ч., который может изменяться в соответствии с условиями ферментации и масштабом производства.
Когда ферментация завершена, затем культуральный бульон направляют на извлечение соединения (II) или его соли с помощью различных методик, которые традиционно используются для извлечения и очистки биологически активных веществ. например, экстракцией соответствующим растворителем или смесью нескольких растворителей, хроматографированием или перекристаллизацией из соответствующего растворителя или смеси нескольких растворителей, или т.п.
В соответствии с изобретением, в общем соединение (II) или его соль обнаружен как в культивируемом мицелии, тик и в культуральном бульоне. Соответственно, затем соединение (II) или его соль удаляются из всего бульона посредством экстракции с использованием соответствующего органического растворителя, такого как ацетон или этилацетат, или смеси этих растворителей, или т.п.
Экстракт обрабатывают традиционным способом, чтобы получить соединение (II) или его соль, например экстракт концентрируется посредством выпаривания или перегонки до меньшего объема и образовавшийся остаток, содержащий активный материал, т.е. соединение (II) или его соль, очищают с помощью традиционных методик очистки, например, хроматографически или перекристаллизацией из подходящего растворителя или смеси таких растворителей.
Когда целевое вещество выделяется в виде соли соединения (II), она может быть превращения в свободное соединение (II) или другую соль соединения (II) традиционными методами.
Биологические свойства полипептидного соединения (I) настоящего изобретения
Для того, чтобы продемонстрировать полезность полипептидного соединения (I) излагаются некоторые биологические данные представительных веществ.
Испытание 1. Противомикробная активность.
Противомикробная активность вещества примера 2, раскрытого ниже (в последующем оно именуется как вещество FR 131535), была измерена методом микроразбавления бульона в мультитарелочках с 96 ячейками с использованием основной декстрозной среды и азота из дрожжей. К 50 мкл образца раствора с последовательным двукратным разбавлением добавляют 50 мкл суспензии микроорганизмов в физиологическом растворе, чтобы получить окончательную концентрацию 1 • 105 образующих колонию единиц в 1 мл. Культура Кандида культивировали при 37oC в течение 22 ч. После культивации определяли рост микроорганизмов в каждой ячейке, измеряя ее мутность. Результаты представлены в виде значений IC50, в которых концентрационная мутность составляла половину от значения мутности в ячейке без образца. Результаты представлены ниже.
Организм - IC50
Кандида албиканс FR578 - 0,31
Кандида тропикалис YC118 - 0,47
Испытание 2. Острая токсичность вещества FR 131535.
Острую токсичность вещества FR 131535 определили на мышах IPC (самки, возраст 4 недели) посредством однократной внутривенной инъекции. При доже 500 мг/кг не наблюдали никаких симптомов токсичности.
Испытание 3. Противомикробная активность 2.
Противомикробная активность вещества примера 12, раскрытого ниже (в последующем именуется как вещество FR 139687), определяли вне организма посредством двукратного метода разбавления на агаровой пластине, как описано ниже.
Одну петлю культуры, выдержанной в течение ночи, для каждого испытания микроорганизмов в бульоне Сабоурауда, содержащем 2% Глюкозы (105/мл жизнеспособных клеток) встряхивали на декстрозном основании агара с азотом из дрожжей (Y ВДА), содержащем заданную концентрацию вещества FR139687 и минимальную ингибирующую концентрацию МИК) выражали в единицах мкг/мл после культивирования при 30oC в течение 24 ч.
Организм - МИК, мкг/мл
Кандида албиканс YU-1200 - 0,05
В табл. 2 и 3 приведены результаты испытаний, описываемых соединений. В табл. 2 - противомикробная активность, в табл.3 - действие против инфекций, вызванных Candida Albicans.
Из результатом испытания ясно, что полипептидное соединение (I) обладает противомикробной активностью (особенно противомикробной активностью).
Фармацевтическая композиция по изобретению может быть использована в форме фармацевтического препарата, например, в твердом, полутвердом или жидком виде. Этот препарат содержит полипептидное соединение (I) или его фармацевтически приемлемую соль, в качестве активного компонента в смеси с органическим или неорганическим носителем или средой для лекарства для ректального, легочного (носового или ротового вдувания), носового, глазного, внешнего (местного) орального или парентерального (включающая подкожное, внутривенное и внутримышечное) назначение или вдувание.
Капсулы, содержащие 100 мг соединения примера 2
Ингредиент - Кол-во мг на капсулу
Соединение - 100
Лактоза - 146
Стеарат магния - 4
Капсула (N. 1) - 250
Соединение с нейтральными компонентами измельчают в порошок, перемешивают и помещают в сухие желатиновые капсулы.
Таблетки
Ингредиент - Кол-во мг на капсулу
Соединение примера 2 - 150
Прежелатинизированный кукурузный крахмал - 60
Поливинилпирролидон - 36
Стеарат магния - 4
Соединение тонко измельчают и смешивают с также измельченными инертными ингредиентами согласно рецептуре, а затем прессуют в таблетки на стандартном оборудовании.
Активный компонент может быть компаундирован, например, с обычным нетоксичным, фармацевтически приемлемым носителем для таблеток, лепешек, драже, капсул, свечей, кремов растирок, аэрозолей, порошков для вдувания, растворов, эмульсий, суспензий и любых других форм, пригодных для использования. И в случае необходимости кроме того могут использоваться вспомогательные, стабилизирующие, загущающие и окрашивающие агенты и отдушки. Полипептидное вещество (I) или его фармацевтически приемлемая соль включаются в фармацевтическую композицию в количествах, достаточных для обеспечения противомикробного действия в ходе заболевания или в болезненном состоянии.
Для применения композиции для людей предпочтительно ее использовать внутривенным, внутримышечным, легочным или оральным назначением или вдуванием. Хотя дозировка терапевтически эффективного количества полипептидного вещества (I) изменяется и, кроме того, зависит от возраста и состояния каждого индивидуального пациента, подлежащего извлечению, в случае внутривенного назначения суточная доза полипептидного вещества (I) составляет 0,01 - 20 мг на 1 кг веса человека; в случае внутримышечного введения суточная доза вещества (I) составляет 0,1 - 20 мг на 1 кг веса человека и в случае орального назначения суточная доха составляет 0,5 - 50 мг соединения (I) на 1 кг веса человека. Это количество обычно задается для лечения или предотвращения инфекционных заболеваний.
Следующие препараты и примеры даны в целях иллюстрации изобретения более детально.
Препаративный пример 1. К метанолу /50 мл/ при -5oC добавляли хлористый тионил /8,73 мл/ и полученную смесь перемешивали в течение 10 минут после чего при охлаждении системы льдом добавляли 5 г Д-2-/п-гидроксифенил/глицина. Полученную смесь перемешивали в течение 12 ч. при комнатной температуре. Реакционную смесь выпаривали при пониженном давлении с образованием гидрохлорида метилового эфира д-2-/п-гидроксифенил/-глицина /6,3 г/.
ИК /Ньюол/: 3380, 1720, 1580, 1250 см-1
ЯМР /DMCO-d6, δ /: 3,70 /3H, синглет/, 5,11 /1H, синглет/, 6,83 /2H, дублет, J=8,6 Гц/, 7,28 /2H, дублет, J=8,6 Гц/, 8,91 /2H, синглет/, 9,93 /1H, синглет/.
Препаративный пример 2. К раствору гидрохлорида метилового эфира Д-2-/п-гидроксифенилглицина /6,3 г/ и триэтиламина /8,71 мл/ и тетрагидрофуране /100 мл/ добавляли ди-трет-бутил дикарбонат /6,82 г/. Смесь перемешивали в течение 2 ч. при комнатной температуре. Реакционную смесь добавляли к диэтиловому эфиру /1 л/ и нерастворенный материал отфильтровывали, после чего фильтрат выпаривали при пониженном давлении с образованием метилового эфира N-/трет-бутоксикарбонил/-D-2-/п-гидроксифенил/глицина/6,83 г/.
ИК /Ньюол/: 3420, 3350, 1720, 1660 см-1.
ЯМР /DMCO-d6, δ /: 1,38 /9H, синглет/, 3,59 /3H, синглет/, 5,05 /1H, дублет/, J= 7,9 Гц/, 6,70 /3H, дублет, J=8,5 Гц/, 7,16 /2H, дублет, J=8,5 Гц/, 7,60 /1H, дублет, J=7,9 Гц/, 9,48 /1H, синглет/.
Препаративный пример 3. К суспензии метилового эфира N-/трет-бутоксикарбонил/-D-2-/п-гидроксифенил/глицина /6,7 г/ и бикарбоната калия /1,84 г/ в N, N-диметилформамиде /34 мл/ добавляли бромистый октил /4,176 мл/. Смесь перемешивали в течение 6 ч. при 60oC. Реакционную смесь добавляли к смеси воды с этилацетатом. Органический слой отделяли и сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с образованием N-/трет-бутоксикарбонил-D-2/п-октилоксифенил/глицина, метилового эфира /6,96 г/.
ИК/Ньюол/: 1710, 1490, 1240, 1160 см-1.
ЯМР /DMCO-d6, δ /: 0,859 /3H, триплет, J=6,2 Гц/, 1,17-1,33 /10H, мультиплет/, 1,38 /9H, синглет/, 1,60-1,80 /2H, мультиплет/, 3,59 /3H, синглет/, 3,93 /3H, синглет/ 3,93 /2H, триплет, J=6,3 Гц/, 5,11 /1H, дублет, J=7,9 Гц/, 6,87 /2H, дублет, J=8,7 Гц/, 7,27 /2H, дублет, J=8,7 Гц/, 7,68 /1H, дублет, J=7,9 Гц/.
Препаративный пример 4. К водному раствору гидроксида натрия /8,77 мл/ добавляли метиловый эфир N-/трет-бутоксикарбонил/-D-2/п-октилоксифенил/глицина /6,9 г/ и смесь перемешивали в течение 1,5 ч. при комнатной температуре. Реакционную смесь добавляли к смеси воды с этилацетатом и добавляли 1н. хлористоводородную кислоту с целью установления pH смеси равным 3. Органический слой отделяли и сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с образованием N-/трет-бутоксикарбонил/-D-2/п-октилоксифенил/глицина /3,9 г/.
ЯМР /DMCO-d6, δ /: 0,860 /3H, триплет, J=6,8 Гц/, 1,17-1,33 /10H, мультиплет/, 1,38 /9H, синглет/, 1,60- 1,80 /2H, мультиплет/, 3,93 /2H, триплет, J=6 Гц/, 5,10 /1H, дублет, J=8,2 Гц/, 6,87 /2H, дублет, J=8,7 Гц/, 7,28 /2H, дублет, J=8,7 Гц/, 7,46 /1H, дублет, J=1,82 Гц/.
Препаративный пример 5. К раствору N-/трет-бутоксикарбонил/-D-2-/п-октилоксифенил/глицина /1 г/ в ацетонитриле /10 мл/ и пиридина /0,213 мл/ в ацетонитриле /10 мл/ добавляли N, N-дисукцинимидил карбонат /0,675 г/. Полученную смесь перемешивали 12 ч. при комнатной температуре. Реакционную смесь добавляли к смеси воды с этилацетатом. Органический слой выпаривали и сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с получением сукцинимидного эфира N-/трет-бутоксикарбонил/-D-2/п-октилоксифенил/глицина. /0,92 г/.
ИК/Ньюол/: 3350, 1810, 1730, 1680 см-1.
ЯМР /DMCO-d6, δ /: 0,862 /3H, триплет, J=6,7 Гц/, 1,17-1,33 /10H, мультиплет/, 1,40 /9H, синглет/, 1,60-1,80 /2H, мультиплет/, 2,77 /4H, синглет/, 3,97 /2H, триплет, J=6,5 Гц/, 5,54 /1H, дублет, J=8,1 Гц/, 6,91 /2H, дублет, J=8,7 Гц/, 7,39 /2H, дублет, J=8,7 Гц/, 8,05 /1H, дублет, J=8,1 Гц/.
Препаративный пример 6. Метиловый эфир N-/трет-бутоксикарбонил/-I-тирозина получали согласно тому же способу, что описан в препаративном примере 2.
ИК-спектр /Ньюол/: 3530, 3360, 1730, 1670, 1170 см-1.
ЯМР /DMCO-d6, δ /: 1,33 /9H, синглет/, 2,90 /2H, мультиплет/, 3,59 /3H, синглет/, 4,05 /1H, мультиплет/, 6,65 /2H, дублет, J=8,4 Гц/, 7,00 /2H, дублет, J=8,4 Гц/, 7,21 /1H, дублет, J=8,0 Гц/, 9,22 /1H, синглет/.
Препаративный пример 7. Метиловый эфир O4-октил-N-/трет-бутоксикарбонил/-I-тирозина получали согласно способу, аналогичному описанному в препаративном примере 3.
ИК /Ньюол/: 3350, 1735, 1685, 1250, 1170 см-1.
ЯМР /MDCO-d6, δ /: 0,859 /3H, триплет, J=6,7/, 1,20-1,30 /10H, мультиплет/, 1,68 /2H, квинтет, J=7,3 Гц/, 2,82 /2H, мультиплет/, 3,60 /3H, синглет/, 3,91 /2H, триплет, J=7,3 Гц/, 4,08 /1H, мультиплет/, 6,81 /2H, дублет, J=6,8 Гц/, 7,12 /2H, дублет, J=8,6 Гц/, 7,25 /1H, дублет, J=8,0 Гц/.
Препаративный пример 8. O4-октил-N-/трет-бутоксикарбонил/-I-тирозин получали согласно способу, аналогичному описанному в препаративном примере 4.
ИК /Ньюол/: 3400-2900 /широкая/, 1700, 1240, 1160 см-1.
ЯМР /DMCO-d6, δ / 0,859 /3H, триплет, J=6,8 Гц/, 1,20-1,30 /10H, мультиплет/, 1,32 /9H, синглет/, 1,68 /2H, Квинтет, J=7,0 Гц/, 2,67-2,95 /1H, мультиплет/, 3,90 /2H, триплет, J=7,0 Гц/, 4,01 /1H, мультиплет/, 6,81 /2H, дублет J=8,6 Гц/, 7,02 /1H, дублет, J=8,3 Гц/, 7,13 /2H, дублет, J=8,6 Гц/.
Препаративный пример 9. Сукцинимидный эфира 04-октил-N-/трет-бутоксикарбонил/-1-тирозина получали согласно способу, аналогичному описанному в препаративном примере 5.
ИК-спектр /Ньюол/: 3350, 1780, 1720, 1690 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,860 /3H, триплет, 1=6,7 Гц/, 1,20 - 1,30 /10H, мультиплет/, 1,32 /9H, синглет/, 1,68 /2H, квинтет, 1=7,0 Гц/, 2,82 /4H, синглет/, 2,80 - 3,20 /1H, мультиплет/, 3,92 /2H, триплет, 1=7,0 Гц/, 4,44 /1H, мультиплет/, 6,81 /2H, дуплет, 1=8,5 Гц/, 7,22 /2H, дуплет, 1=8,5 Гц/, 7,60 /1H, дуплет, 1=8,3 Гц/.
Препаративный пример 10. /1/ Посевную среду /160 мл/, включающую 4% сахарозы, 2 муки хлопкового семени, 1% высушенных дрожжей, 1% пептона, KH2PO4 /2%/, 0,2% CaCO3 и Твин 80 /выпускаемый Накараи Кэмиклс Лтд./ заливали в каждую из двух Эрленмейровских колб емкостью 500 мл и стерилизовали в течение 30 мин при 121oC. Полную петлю культуры на скошенном агаре разновидности Coloephoma Г-11899 инокулировали в каждой из сред и культивировали в условиях встряхивания в течение 4 дней при 25oC.
Продукционную среду /20 л/, содержащую 3% соснового декса /3/, выпускаемого компанией Матсутани Кэмикл Лтд./, 1% глюкозы, 1% пшеничных эмбрионов, 0,5% муки хлопкового семени, 2% KH2PO4, 1,5% Na2HPO4, 0,01% ZnSO4•7H2O и 0,05% Адеканола /антивспенивающий агент выпускаемый Асахи Денка Ко. Лтд./ заливали в 30-литровый ферментор и стрерилизовали в течение 30 мин при 121oC.
Полученный в результате посевной культурный бульон /320 мл/ инокулировали в продукционную среду и культивировали при 25oC в течение 4 дней, перемешивали со скоростью 200 об./мин и аэрировали со скоростью 20 л/мин. К полученному таким образом культурированному бульону /20 л/ добавляли равный объем ацетона. После необязательного перемешивания при комнатной температуре бульон отфильтровывали. Фильтрат концентрировали в вакууме с целью удаления ацетона. Водный фильтрат /10 л/ промывали двумя равными объемами этилацетата и дважды экстрагировали н-бутанолом /10 л/. Объединенный н-бутанольный слой концентрировали в вакууме и остаток применяли на колонке /300 мл/ с силикагелем 60/ полученным от Е.Мерка/ после этог7о осуществляли элюирование смесью органических растворителей, состоящей из дихлорметана и метанола. Фракции, обладающие анти-кандидной активностью элюировали в интервале смеси растворителей 3: 1 - 1:1. Активные фракции объединяли и концентрировали в вакууме досуха. Остаток растворяли в 50%-ном водном метаноле /15 мл/ и пропускали через колонку /250 мл/ с ОД УМС СЕЙ /выпускаемыми Ямамура Кэмикл Лаб./. Колонку промывали 50% водным метанолом и элюировали 80%-ным водным метанолом. Элюат концентрировали и дополнительно очищали методом распределительной хроматографии на центрифуге /СРС/ с использованием системы н-бутанол: метанол:вода /4:1:5/ в качестве верхней стационарной фазы и нижней мобильной фазы в последовательном режиме. Объединенные фракции, содержащие целевое соединение /основной компонент/, концентрировали в вакууме и пропускали через колонку /35 мл/ с силикагелем 60. Колонку проявляли смесью н-бутанол:уксусная кислота:вода /6:1:1/. Активные фракции объединяли и концентрировали в вакууме досуха и растворяли в небольшом объеме 50%-ного водного метанола. Раствор пропускали через колонку /3,5 мл/ с ОД УМС Cel. Эту колонку промывали 50%-ным водным метанолом и элюировали этим же растворителем. Элюат концентрировали досуха, растворяли в небольшом объеме воды и устанавливали pH равным 7,0 с помощью 0,01 н. NaOH. Раствор сушили вымораживанием с образованием белого порошка ук5азанного соединения в виде его натриевой соли /на которую далее в тексте ссылаются как на вещество FR 901379 //II мг/.
Полученное соединение FR 901379 обладает следующими физико-химическими свойствами.
Внешний вид: белый порошок. Природа - нейтральное соединение. Точка плавление: 215 - 221oC /разл./. Удельное вращение: (a)
Вычислено, %: C 51,17; H 6,77; N 9,36; S 2,68.
C51H81N8SO21Na.
Найдено, %: C 49,61; H 7,58; N 7,65; S 2,14/%/.;
мол/м. : HPFAB-M 1219, 5078 /вычислено для C51H82N8SO21 + 2Na - H: 1219, 5032/;
растворимость: растворим: метанол, вода; частично растворим: этилцетат; ацетон; нерастворим: хлороформ, н-гексан;
Цветная реакция: положительная: реакция с парами иода; реакция на сульфат церия; реакция на хлорное железо; нингидринования реакция;
отрицательная: реакция Драгендорфа, реакция Эрлиха.
Тонкослойная хроматография /TCX/ приведена в табл. 4.
УФ-спектр: λ
λ
ИК-спектр: ν
Спектр 1H-ЯМР /CD3OD, 400 МГц / δ : 7,30 /1H, дуплет, J=2 Гц/, 7,03 /1H, дуплет, J= Гц/, 7,03 /1H, дуплет, J-Гц/, 7,03 /1H, двойной дуплет, J=8 и 2 Гц/, 6,85 /1H, дуплет, J=8 Гц/, 5,23 /1H. дуплет, J=3 Гц/, 5,06 /1H, дуплет, J= 4 Гц/, 4,93 /1H, дуплет, J=3 Гц/, 4,59 - 4,51 /3H, мультиплет/, 4,47 - 4,34 /5H, мультиплет/, 4,29 /1H, двойной дуплет, J=6 и 2 Гц/, 4,17 /1H, мультиплет/, 4,07 /1H, мультиплет/, 3,95 - 3,89 /2H, мультиплет/, 3,76 /1H, широкий дуплет, J=11 Гц/, 3,36 /1H, мультиплет/, 2,75 /1H, двойной дуплет, J=16 и 4 Гц/, 2,50 /1H, мультиплет/, 2,47 /1H, двойной дуплет, J=16 и 9 Гц/, 2,38 /1H, мультиплет/, 2,21 /2H, мультиплет/, 2,03 - 1,93 /3H, мультиплет/, 1,57 /2H, мультиплет/, 1,45 - 1,20 /24H, мультиплет/, 1,19 /3H, дуплет, J=6 Гц/, 1,08 /3H, дуплет J=6 Гц/, 0,90 /3H, триплет, J=7 Гц/.
Из анализа приведенных, физических и химических свойств, а также в результате дополнительного исследования по идентификации химической структуре была идентифицирована следующая химическая структура соединения FR901379: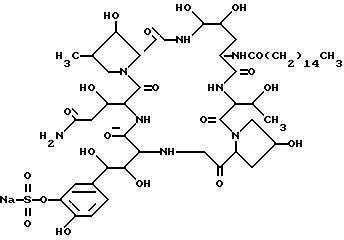 .
.
Пример 1. N-ациальную группу соединения FR 901379 удаляли по реакции с энзимом. Далее такой процесс элиминирования разъяснен более подробно.
/1/ Ферментация Actinoplanes utahensis. =Энзим, используемый для элиминирования N-ациальной группы соединения FR 901379, продуцируется некоторыми микроорганизмами Actinoplanaceal, предпочтительно, микроорганизмом Actinoplanes utahensis IFO-13244.
Штаммовая культура Actinoplanes Utahen IFO-13244 готовилась и выдерживалась на скосе агара. Полную петлю культуры на скошенном агаре инокулировали в посевную среду, содержащую 1% крахмала, 1% глюкозы муки хлопкового семени, 0,5% пептона, 0,5% соевой муки, и 0,1% CaCO3. Инокулированную растительную среду инкубировали в широкогорлой Эрленмейерской колбе емкостью 225 мл при 30oC в течение 22 ч. на роторной трясучке.
Такую инкубированную растительную среду использовали для непосредственной инокуляции продукционной среды, содержащей 2% сахарозы, 1% порошка земляного ореха, 0,12% K2HPO4, 0,05% KH2PO4 и 0,025% MgSO4•7H2O. Инокулированную продукционную среду ферментировали в ферменторе емкостью 30 л при 30oC в течение 80 ч. Ферментационную среду перемешивали обычными мешалками при скорости 250 об./мин и аэрировали со скорость 20 л/мин. Вегетативный мицелий собирали из ферментированного бульона фильтрацией и сразу промывали водой. Промытый мицелий непосредственно использовали для элиминирования N-ацильной группы соединения FR901379 в качестве источника энзима.
/2/ Условия элиминирования
Соединение FR901379 растворяли в 0,25М фосфатном буфере /pH 6,5/ с концентрацией 0,9 мг/мл. В 36 л раствора добавляли 2 кг в расчете на мокрый вес промытого мицелия Actinoplanes utahen IFO-13244. Реакцию элимирования проводили при 37oC в течение 23 ч. Уменьшение количества соединения FR901379 и увеличение деацилированного соединения FR901379 /далее в тексте - соединение FR13303/ измеряли методом жидкостной хроматографии высокого давления /HPIC/ с использованием колонки с обратимой фазой. Из 30 г соединения FR901379 в реакционной смеси образовывались 22,2 г соединения FR133303.
/3/ Выделение соединения FR133303.
Описанную реакционную смесь фильтровали с помощью фильтрующего средства. Мицелиальный остаток на фильтра отбрасывали. Полученный таким образом фильтрат пропускали через колонку с активированным углом /2 л/. колонку промывали 6 л воды и элюировали 12 л 50%-ного водного ацетона. Элюат выпаривали в вакууме с удалением ацетона и затем пропускали через колонку /4 л/ с УМС GEI ODS-AM 120-50 /Ямамура Кэмикл Лабс./ Такую колонку промывали водой и элюировали 2%-ным водным ацетонитрилом, содержащим 50 М NaH2PO4. За ходом элюирования следили аналитическим методом HPIC с использованием колонки с L. Chrospher 100 RP-18 /Кика-Мерк/ и системы растворителей из 3%-ного водного ацетонитрила, содержащего 0,5% NH4H2PO4 при объемной скорости 1 мл/мин с детекцией соединения FR133303 в УФ-области при длине волны 210 нм. Фракции, содержащие FR133303, объединяли и пропускали через колонку с активированным углем /400 мл/. Колонку промывали водой и элюировали 50%-ным водным ацетоном. Элюат концентрировали в вакууме с целью удаления ацетона и лиофилизировали с получением 16,4 г FR133303 в виде белого порошка. Соединение FR133303 имело следующие физико-химические свойства:
Внешний вид: порошок. Точка плавления: 150-160oC /разл./
Удельное вращение: (a)
Вычислено, %: C 43,84; H 5,36; N 11,69; S 3,34.
C35H51N8SO2Na.
Найдено,%: C 41,14; H 5,74; N 10,88; S 3,10.
Растворимость. Растворимо в воде; ограничено растворимо в метаноле; нерастворимо в н-гексане.
Цветная реакция: положительная с парами иода, реакция с сульфатом церия, Нингидриновая реакция. Отрицательная: реакция Молиша.
Тонкослойная хроматография /TIC/, приведена в табл. 5.
УФ-спектр: 
 201 /340/, 273 /18/, 224 /sh/, 281 /sh/ нм.
201 /340/, 273 /18/, 224 /sh/, 281 /sh/ нм.
 (E
(E
ИК-спектр: 3350, 2920, 1660, 1625, 1515, 1440, 1270, 1080, 1045, 800, 755, 715 см-1.
1H ЯМР-спектр: /H2O, 400 МГц/ δ : 7,31 /1H, дублет, 1=2 Гц/, 7,12 /1H, двойной дублет, 1=2 Гц и 8 Гц/, 7,06 /1H, дублет, 1=6 Гц/, 5,40 /1H, дублет, 1= 3 Гц/, 5,04 /1H, дублет, 1=3,5 Гц/, 4,94 /1H, дублет, 1-6 Гц/, 4,73-4,55 /3H, мультиплет/, 4,51-4,38 /4H, мультиплет/, 4,31-4,23 /3H, мультиплет/, 4,11-4,06 /2H, мультиплет/, 3,94-3,89 /2H, мультиплет/, 3,41 /1H, мультиплет/, 2,60-2,34 /5H, мультиплет/, 2,14 /1H, мультиплет/, 2,03 /1Р, мультиплет/, 1,28 /3H, дублет, 1=6 Гц/, 1,01 /3H, дублет, 1=6,5 Гц/.
Спектр ЯМР-С13/ D2O, 100 МГц/ δ : 178,3 /синглет/, 175,9 /синглет/, 174,3 /синглет/, 174,2 /синглет/, 174,0 /синглет/, 171,8 /синглет/, 171,3 /синглет/, 150,9 /синглет/, 141,5 /синглет/, 134,4 /синглет/, 128,2 /дублет/, 124,5 /дублет/, 120,3 /дублет/, 78,1 /дублет/, 77,0 /дублет/, 76,9 /дублет/, 76,6 /дублет/, 72,9 /дублет/, 72,8 /дублет/, 71,2 /дублет/, 69,3 /дублет/, 69,2 /дублет/, 63,7 /дублет/, 60,1 /дублет/, 58,3 /дублет/, 54,7 /триплет/, 41,8 /триплет/, 39,7 /дублет/, 39,5 /триплет/, 33,5 /триплет/, 21,4 /квинтет/, 13,3 /квинтет/.
Была идентифицирована следующая структура соединения FR133303: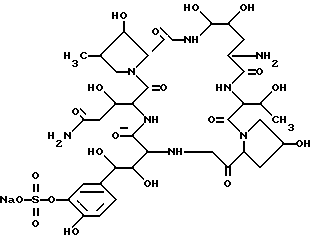 .
.
Пример 2. /1/ Раствор 4-гидроксибензойной кислоты /19,2 г/ в 10% NaOH /120 мл/ прикапывали к 480 мл диметилсульфоксида в течение 30 мин, в течение которых температура реакционной смеси контролировалась в интервале 30 - 40oC. После добавления раствор охлаждали до 17 - 20oC. К раствору в течение 30 мин прикапывали 1-бромоктан /28,95 г/ и реакционную смесь интенсивно перемешивали в течение 4 ч. при комнатной температуре. Реакционную смесь переливали в ледяную воду /1200 мл/ и подкисляли 40 мл конц. соляной кислоты. После интенсивного перемешивания в течение 1 ч. полученное в результате твердое вещество удаляли фильтрацией и растворяли в 60 мл ацетонитрила. Полученный раствор нагревали с обратным холодильником в течение 30 мин и выстаивали в течение ночи при комнатной температуре с образованием 4-октилоксибензойной кислоты /13,8 г/ в виде кристаллов /т.пл. 96oC.
Вычислено, %: C 71,97; H 8,86.
C15H22O3
Найдено, %: C 71,30; H 8,89.
К раствору 4-октилоксибензовной кислоты /13,8 г/ в диэтиловом эфире /552 мл/ добавляли 2,4,5-трихлорфенол /10,87 г/ и N,N-дициклогексилкарбодиимид /11,37 г/. Полученный раствор перемешивали в атмосфере азота в течение 18 ч. при комнатной температуре. Осадок удаляли фильтрацией и фильтрат концентрировали в вакууме. Остаток растворяли в петролейном эфире и выстаивали на бане с ледяной водой. Полученные в результате кристаллы /15,2 г/ отфильтровывали и растворяли в теплом н-гексане /150 мл/. После выстаивания в течение ночи при комнатной температуре полученные в результате кристаллы удаляли фильтрацией. Фильтрат концентрировали до состояния масла, которое очищали методом колонной хроматографии на силикагеле с использованием смеси этилацетата и н-гексана с получением 2,4,5-трихлорфенил 4-октиоксилоксиензоата /7,58 г/ /т.пл. 53oC, Элементный анализ для C21H23O3Cl3: Cl 24,75, найдено: Cl 24,05/.
К раствору соединения FR133303 /2,04 г/ в N,N-диметилформамиде /60 мл/ добавляли 2,4,5-трихлорфенил-4-октилоксибензоат /2,04 г/ и 4-диметиламинопиридин /0,283 г/. Полученный раствор перемешивали в атмосфере в течение 15 ч. К раствору добавляли 4-диметиламинопиридин /0,20 г/ и полученную смесь перемешивали еще в течение 24 ч. Реакционную смесь перемешивали в воду /600 мл/ и устанавливают pH равным 6,0. Смесь дважды промывали равными объемами этилацетата и концентрировали до объема в 30 мл. Концентрат пропускают через колонку /150 мл/ с DEAE-Тоубре /Cl-форма, выпускаемый Тосо/. Колонку промывали 50%-ным водным метанолом и проявляли 50%-ным водным метанолом, содержащим водный 1М раствор хлористого натрия. Процесс элюировали контролировали с помощью той же системы HPIC, чтобы описана в примере 1/3/ за исключением того, что концентрация ацетонитрила в растворителе составляла 40%. Фракции, содержащее целевое соединение, объединяли и выпаривали в вакууме с целью удаления метанола. С целью удаления соли раствор абсорбировали на колонке /1 л/ с УМС GEI ODS-AM 120 - 50. Колонку промывали водой и элюировали 30%-ным водным ацетонитрилом. Элюент выпаривали в вакууме с целью удаления ацетонитрила и лиофилизировали с получением целевого соединения /далее в тексте соединение FR131535/ /1,4 г/ в виде белого порошка.
Соединение FR131535 имело следующие физико-химические свойства:
Внешний вид: белый порошок. Точка плавления: 170 - 189oC /разл./
Удельное вращение: (a)
Вычислено, %: C 46,22; H 6,44; N 8,62; S 2,46; Na 1,77.
C50H71N8SO22Na • 6H2O.
Найдено, %: C 46,80; H 7,13; N 8,78; S 1,96; Na 1,81.
Растворимость: растворимо в метаноле, воде; ограниченно растворимо в ацетоне; нерастворимо в н-гексане.
Цветная реакция: положительная: реакция с парами иода, реакция с сульфатом натрия.
Тонкослойная хроматография /TCl/, приведена в табл.6.
ИК-спектр, ν
Спектр ЯМР-H1: /CD3OD, 200 МГц/: 7,78 /2H, дублет, J = 8 Гц/, 7,31 /1H, дублет, J = 2 Гц/, 7,03 /2H, двойной дублет, J = 2 Гц и 8 Гц/, 6,96 /2H, дублет, J = 6 Гц/, 6,87 /1H, дублет, J = 8 Гц/, 5,33 /1H, дублет, J = 3 Гц/, 5,08 /1H, дублет, J = 4 Гц/, 4,99 /1H, дублет, J = 3 Гц/, 4,80 - 3,20 /17H, мультиплет/, 2,83 /1H, мультиплет/, 2,65 - 2,30 /4H, мультиплет/, 2,22 - 1,90 /2H, мультиплет/, 1,79 /2H, мультиплет/, 1,56 - 1,25 /10H, мультиплет/, 1,19 /3H, дублет, J = 5 Гц/, 1,06 /3H, дублет, J = 6,5 Гц/, 0,90 /3H, триплет, J = 6,5 Гц/.
Идентифицированная химическая структура соединения FR131535 была следующей: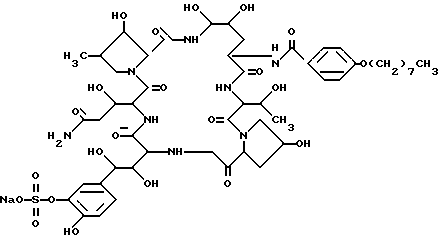 .
.
В табл.7 приведены структуры соединений примеров 3 - 11.
Пример 3. К раствору соединения FR 133303 /1 г/ и сукцинимидного эфира N-/трет. -бутоксикарбонил/-Д-2-/п-октилоксифенил/глицина /0,596 г/ в N,N-диметилформамиде /3 мл/ добавляли 4-диметиламинопиридин /0,165 г/. Смесь перемешивали в течение 12 ч. при комнатной температуре. Реакционную смесь добавляли к воде /30 мл/ и затем pH раствора устанавливали равным 6. Водный раствор промывали этилацетатом и подвергали ионообменной хроматографии на DEAE-Toyopearl /Cl-/ /60 мл/ и элюировали 50% метанолом в 1М водном растворе хлористого натрия. Фракции, содержащие целевое соединение, объединяли и выпаривали при пониженном давлении с целью удаления метанола. pH водного раствора устанавливали равным 4,5 с помощью 1 н. соляной кислоты и подвергали колонной хроматографии на Диаионе HP-20 /торговое наименование, выпускаемом Митсубиши Кэмикл Индастриез/ /130 мл/ и элюировали 80%-ным водным метанолом. Фракции, содержащие соединение, объединили и выпаривали при пониженном давлении с целью удаления метанола. Остаток лиофилизировали с получением целевого ацилированного соединения /далее в тексте соединение FR138260/ /0,77 г/.
ИК /Ньюол/: 3300, 1660, 1500, 1240, 1045, 800, 720 см-1.
ЯМР /CD3OD δ/: 0,92 /3H, триплет, J = 6,8 Гц/, 1,05 /3H, дублет, J = 6,8 Гц/, 1,17 -1,33 /13H, мультиплет/, 1,43 /9H, синглет/, 1,6 - 1,8 /2H, мультиплет/, 1,9 - 2,1 /3H, мультиплет/, 2,50 /3H, мультиплет/, 2,75 /1H, двойной дублет, J = 16 Гц и 4 Гц/, 3,35 /1H, мультиплет/, 3,7 - 3,8 /1H, мультиплет/, 3,93 /2H, триплет, J = 6,2 Гц/, 3,9 - 4,2 /5H, мультиплет/, 4,3 - 4,5 /5H, мультиплет/, 4,5 - 4,7 /3H, мультиплет/, 4,97 /1H, дублет, J = 3 Гц/, 5,05 /1H, дублет, J = 4 Гц/, 5,11 /1H, синглет/, 5,30 /1H, дублет, J = 3 Гц/, 6,85 /1H, дублет, J = 8 Гц/, 6,86 /2H, дублет, J = 8,6 Гц/, 7,02 /1H, дублет, J = 8,3 Гц/, 7,26 /2H, дублет, J = 8,6 Гц/, 7,31 /1H, синглет/.
FAB-масс-спектр: e/z = 1343 /M + Na/.
Пример 4. Соединение FR138260, полученное в примере 3 /0,25 г/, добавляли к трифторуксусной кислоте /1,25 мл/ и перемешивали в течение 10 мин. Реакционную смесь добавляли к воде /30 мл/ и затем устанавливали pH 45 с помощью насыщенного водного раствора бикарбоната натрия. Водный раствор подвергали колонной хроматографии на Диаионе HP-20 /100 мл/ и элюировали 80%-ным водным раствором метанола. Фракции, содержащие целевое соединение, объединяли и выпаривали при пониженном давлении с целью удаления метанола. Остаток лиофилизировали с получением целевого соединения /далее в тексте соединение FR138727/ /15 мг/.
ЯМР /CD3OD, δ /: 0,90 /3H, триплет, J = 6,8 Гц/, 1,05 /3H, дублет, J = 6,8 Гц/, 1,17 -1,33 /13H, мультиплет/, 1,6 - 1,8 /2H, мультиплет/, 1,9 - 2,1 /3H, мультиплет/, 2,50 /1H, мультиплет/, 2,75 /1H, двойной дублет, J = 16 Гц и 4 Гц/, 3,40 /1H, мультиплет/, 3,7 - 3,8 /1H, мультиплет/, 3,93 /2H, триплет, J = 6,2 Гц/, 3,9 - 4,2 /5H, мультиплет/, 4,97 /1H, дублет, J = 3 Гц/, 5,06 /1H, синглет/, 5,20 /1H, дублет, J = 3 Гц/, 5,40 /1H, дублет, J = 3 Гц/, 6,85 /1H, дублет, J = 8,3 Гц/, 6,95 /2H, дублет, J = 8,5 Гц/, 7,02 /1H, дублет, J = 8,3 Гц/, 7,30 /1H, дублет, J = 8,5 Гц/, 7,44 /1H, синглет/.
FAB-Масс-спектр: e/z = 1259 /M + K/.
Пример 5. Соединение FR138364 получали по реакции соединения FR133303 с сукцинимидным эфиром O4-октил-N-/трет-бутоксикарбонил/-1-тирозина в соответствии с методикой аналогичной описанной в примере 3.
ИК /Ньюол/: 3300, 1660, 1620, 1240, 1050 см-1.
ЯМР /CD3OD, δ /: 0,904 /3H, триплет, J = 6,8 Гц/, 1,06 /3H, дублет, J = 7,8 Гц/, 1,17 /3H, дублет, J = 6,7 Гц/, 1,20 - 1,30 /10H, мультиплет/, 1,35 /9H, синглет/, 1,74 /2H, квинтет, J = 6,5 Гц/, 1,9 - 2,1 /3H, мультиплет/, 2,45 /3H, мультиплет/, 2,76 /1H, двойной дублет, J = 16 Гц и 4 Гц/, 3,0 - 3,1 /2H, мультиплет/, 3,37 /1H, мультиплет/, 3,77 /1H, дублет, J = 11 Гц/, 3,92 /2H, триплет, J = 6,8 Гц/, 3,9 - 4,2 /7H, мультиплет/, 4,3 - 4,5 /5H, мультиплет/, 4,5 - 4,6 /3H, мультиплет/, 4,94 /1H, дублет, J = 3 Гц/, 5,05 /1H, дублет, J = 3,8 Гц/, 5,31 /1H, дублет, J = 3 Гц/, 6,79 /2H, дублет, J = 8,5 Гц/, 6,85 /1H, дублет, J = 8,3 Гц/, 7,03 /1H, двойной дублет, J = 8,3 Гц и 2 Гц/, 7,12 /2H, дублет, J = 8,5 Гц/, 7,31 /1H, дублет, J = 2 Гц/.
FAB-Масс-спектр: e/z = 1357 /M + Na/.
Пример 6. Раствор соединения FR133303 /0,5 г/ в смеси воды /5мл/ и тетрагидрофурана /5 мл/ доводили до pH 7 с помощью насыщенного водного раствора бикарбоната натрия и при комнатной температуре добавляли N,N-ди-трет-бутилкарбонат /0,114 г/. Полученную смесь перемешивали при комнатной температуре, поддерживая pH на значении 7 с помощью насыщенного водного раствора бикарбоната натрия. Реакционную смесь добавляли к воде и устанавливали pH на значении 6. Водный раствор промывали этилацетатом и подвергали ионообменной хроматографии на DEAE-Toyopearl /Cl-/ 30 мл/ и элюировали 50%-ный метанолом в IM водном растворе хлористого натрия. Фракции, содержащие целое соединение, объединяли и выпаривали при пониженном давлении с целью удаления метанола. pH водного раствора устанавливали на значении 4,5 с помощью IH соляной кислоты и далее подвергали колонной хроматографии на Диаионе HP-20 /100 мл/ и после проводили элюирование с помощью 80% водного метанола. Фракции, содержащие целевое соединение, объединяли и выпаривали при пониженном давлении с целью удаления метанола. Остаток лиофилизировали с получением целевого соединения в ацилированной форме /далее соединение ER138261/ /0.145 г/.
ИК-спектр Ньюол/: 3300, 1660, 1620, 1240, 1050 см -1.
ЯМР/ CD3OD, δ /: 1,06 / 3H, дублет, J=6,8 Г/, 1,18 /3H, дублет, 1=6,0/, 1,40 /9H, синглет/, 1,9-2,1/ 3H, мультиплет/, 2,44 /3H, мультиплет/, 2,82 /1H, двойной дублет, J= 16 Гц и 4 Гц/, 3,37 /1H, мультиплет/, 3,75 /1H, дублет, J = 11 Гц/, 3,89-4 /2H, мультиплет/, 4,10 /1H, мультиплет/, 4,15 /1H, мультиплет/, 4,29 /1H, двойной дублет, J = 6 Гц и 2 Гц/, 4,36-4,45 /5H, мультиплет/, 4,5-4,6 /3H, мультиплет/, 4,97 /1H, дублет, J = 3 Гц/, 5,06 /1H, двойной дублет, J = 8,2 Гц и 4 Гц/, 5,33 /1H, дублет, J = 3 Гц/, 6,85 /1H, дублет, J = 8,3 Гц/, 7,03 /1H, двойной дублет, J = 8,3 Гц и 2 Гц/, 7,30 /1H, дублет, J = 2 Гц/, 7,50 /1H, дублет, J = 8,2 Гц/.
FAB-масс-спектр- E/z = 1081 /M + Na/.
Пример 7 Соединение FR 138363 получали по реакции соединения FR 133303 с ацетил хлоридом согласно методике описанной в примере 6.
ИК-спектр /Ньюол/: 3300, 1620, 1250, 1040 см-1.
ЯМР CD3OD, δ /: 1,06 /3H, дублет, J= 6,8 Гц/, 1,20 /3H, дублет, J= 6 Гц/, 1,78-2,05 /3H, мультиплет/, 1,96 /3H, синглет/, 2,21-2,54 /3H, мультиплет/, 2,95 /1H, мультиплет/, 3,35-3,42 /1H, мультиплет/, 3,58-4,42 /11H, мультиплет/, 4,50-5,05 /5H, мультиплет/, 5,23 /1H, мультиплет/, 6,88 /1H, дублет, J = 8,3 Гц, 7,05 /1H, двойной дублет, J = 8,3 Гц/, 7,35 /1H, дублет, J = 2 Гц/.
FAB-масс-спекип /M + Na/ 5 1023.
Пример 8. Соединение FR 138728 получали по реакции соединения FR 133303 c 2-бромацетилом хлоридом согласно способу, аналогичному методом, описанным в примере 6.
ИК Ньюол/: 3300, 1660, 1620, 1500, 1220, 1040 см-1.
ЯМР CD3OD, δ /: 1,06 /3H, дублет, J = 6,9 Гц/, 1,17 /3H, дублет, J= 6,1 Гц/, 1,9-2,1 /3H мультиплет/, 2,50 /3H, мультиплет/, 2,80 /1H, двойной дублет, J= 16 Гц и 4 Гц/, 3,37 /1H, мультиплет/, 3,6-4,0 /5H, мультиплет/, 4,16 /1H, мультиплет/, 4,29 /1H, двойной дублет, J= 6 Гц и 2 Гц/, 4,36-4,45 5H, мультиплет/, 4,5-4,7 /3H, мультиплет/, 4,97 /1H, дублет, J = 3 Гц/, 5,04 /1H, двойной дублет, J = 8,6 Гц и 4 Гц/, 5,25 /1H, дублет, J = 3,1 Гц/, 6,85 /1H, дублет J = 8,3 Гц, 7,03 Гц /1H, двойной дублет, J = 8,3 Гц и 2,1 Гц/, 7,31 /1H, дублет, J = 2 Гц/, 7,52 /1H, дублет, J = 8,6 Гц/.
FAB-масс-спектр: e/z 1103 /M + Na/.
Пример 9. Соединение FR138538 получали по реакции FR133303 с хлористым бензоилом согласно способу, описанному в примере 6.
ИК /Ньюол/: 3300, 1640, 1240 см-1.
ЯМР /CD3OD, δ /: 1,05 /3H, дублет, J = 6,8 Гц/, 1,18 /3H, дублет, J = 6 Гц/, 1,89-2,12 /3H, мультиплет/, 2,31-2,53 /3H, мультиплет/, 2,75 /1H, двойной дублет, J= 12 Гц и 4 Гц/, 3,38 /1H, мультиплет/, 3,76 /1H, дублет, J = 11 Гц/, 3,87-3,98 /1H, мультиплет/, 4,02-4,18 /2H, мультиплет/, 4,22-4,32 /4H, мультиплет/, 4,37-4,40 /3H, мультиплет/, 4,49-4,62 /3H, мультиплет/, 4,98 /1H, мультиплет/, 5,02 /1H, мультиплет/, 5,37 /1H, дублет, J = 3 Гц/, 6,85 /1H, дублет, J = 8,3 Гц/, 7,04 /1H, двойной дублет, J = 8,3 Гц и 2 Гц/, 7,11-7,50 /6H, мультиплет/.
FAB-масс-спектр: e/z = 1101 /M + Na/.
Пример 10. Соединение FR138539 получали по реакции соединения FR133303 с 2-/2-аминотиазол-4-ил/-2-метоксииминоуксусной кислоты согласно способу, описанному в примере 6.
ИК-спектр /Ньюол/: 3300, 1650, 1620, 1520, 1260, 1040 см-1.
ЯМР-спектр /CD3OD, δ/: 1,05 /3H, дуплет, J=6,8 Гц/, 1,21 /3H, дуплет, J= 5,9 Гц/, 1,89-2,21 /3H, мультиплет/, 2,29-2,61 /3H, мультиплет/, 2,78-2,89 /1H, мультиплет/, 3,32-3,42 /1H, мультиплет/, 3,76-3,82 /1H, мультиплет/, 3,91-4,01 /2H, мультиплет/, 3,95 /3H, синглет/, 4,13 /1H, мультиплет/, 4,16 /1H, мультиплет/, 4,24-4,27 /1H, мультиплет/, 4,32-4,43 /5H, мультиплет/, 4,46-4,62 /3H, мультиплет/, 4,96-4,99 /1H, мультиплет/, 5,08 /1H, мультиплет/, 5,41 /1H, мультиплет/, 6,79 /1H, синглет/, 6,86 /1H, дублет, J=8,1 Гц/, 7,04 /1H, двойной дублет, J=81 Гц/, 7,31 /1H, дублет, J=2 Гц/, 7,51 /1H, дублет, J=7 Гц/.
FAB-масс-спектр: e/z = 1143 /M+/.
Пример 11. Соединение FR138365 получали по реакции соединения FR 133303 с хлористым тозилом согласно методике, описанной в примере 6.
ИК-спектр /Ньюол/: 3300, 1650, 1620, 1260, 1060 см-1.
ЯМР-спектр /CD3OD, δ /: 0,75 /3H, дублет, J=6,8 Гц/, 1,07 /3H, дублет, J=6,0 Гц/, 1,61-1,79 /1H, мультиплет/, 1,91-2,05 /3H, мультиплет/, 2,30-2,59 /3H, мультиплет/, 3,36 /1H, мультиплет/, 3,68 /1H, дублет, J=11 Гц/, 3,81-4,07 /4H, мультиплет/, 4,22 /1H, мультиплет/, 4,32-4,40 /5H,мультиплет/, 4,42-4,60 /3H, мультиплет/, 4,47 /1H, мультиплет/, 5,0 /1H, мультиплет/, 5,42 /1H, дублет, J=3 Гц/, 6,85 /1H, дублет, J=8,3 Гц/, 7,03 /1H, двойной дублет, J= 8,3 Гц и 2 Гц/, 7,29-7,33 /3H, мультиплет/, 7,55 /1H, дублет, J= 8,3 Гц/.
FAB-масс-спектр: e/z = 1135 /M+Na/.
Препаративный пример 11. К раствору 6-гидрокси-2-нафтойной кислоты /1 г/ в смеси из 10%-ного водного раствора гидроксида натрия /4,25 мл/ и диметилсульфоксида /17 мл/ добавляли бромистый октил /0,918 мл/. Смесь перемешивали в течение 6 ч. при 60oC.
Полученную реакционную смесь добавляли к смеси воды и этилацетата и устанавливали pH на значении 4 с помощью конц.соляной кислоты. Органический слой отделяли и сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с образованием 6-окстилокси-2-нафтойной кислоты /0,91 г/.
ИК-спектр /Ньюол/: 1607, 1620, 1210 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,7 Гц/, 1,2-1,6/1OH, мультиплет/, 1,78 /2H, мультиплет/, 4,1 /2H, триплет/, J=6,7 Гц/, 7,19 /1H, двойной дублет, J=2,3 Гц и 8,8 Гц/, 7,36 /1H, дублет, J=2,3 Гц/, 7,83 /1H, дублет, J=8,8 Гц/, 7,97 /2H, дублет, J=8,8 Гц/, 8,52 /1H, синглет/.
Препаративный пример 12. Гидрохлорид 1-этил-3-/3-диметиламинопропил/карбодиимида /0,703 г/ добавляли к раствору 6-октилокси-2-нафтойной кислоты /0,85 г/ и 1-гидрокси-1H-бензотриазола /0,382 г/ в этилацетате /26 мл/. Полученную смесь перемешивали в течение 2 ч. при комнатной температуре.
Полученную реакционную смесь добавляли к воде и отделяли органический слой, который далее промывали водой и водным раствором хлористого натрия. Затем органический слой сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с получением 1-/6-окстилокси-2-нафтоил/-1H-бензтриазол-3-оксида/0,74 г/.
ИК-спектр /Ньюол/: 1770, 1740, 1620, 1190, 1020, 740 см-1.
ЯМР-спектр /CDCl3, δ/: 0,90 /3H, триплет, J=6,8 Гц/, 1,2-1,6 /10H, мультиплет/, 1,89 /2H, мультиплет/, 4,14 /2H, триплет, J=6,8 Гц/, 7,1-7,3 /2H, мультиплет/, 7,4-7,6 /3H, мультиплет/, 7,8-8,0 /2H, мультиплет/, 8,1-8,2 /2H, мультиплет/, 8,80 /1H, синглет/,
В табл. представлена структура соединения из примера 12.
Пример 12. К раствору соединения FR133303 /0,5/ и 1-/6-октилокси-2-нафтолил/-IH-бензотриазол-3-оксида /0,271 г/ в N, N-диметилформамиде /1,5 мл/ добавляли 4-диметиламинопиридин /0,0828 г/. Полученную смесь перемешивали в течение 12 ч. при комнатной температуре.
Реакционную смесь добавляли в воду и устанавливала pH, равным 6. Водный раствор промывали этилацетатом и подвергали ионообменной обработке на DEAE-Toyoperl /Cl-/ /30 мл/ и элюировали 50%-ным раствором метанола в IM растворе хлористого натрия. Фракции, содержащие целевое соединение, объединяли и выпаривали при пониженном давлении с целью удаления метанола. pH водного раствора устанавливали равным 4,5 с помощью IH хлористоводородной кислоты и подвергали ионообменной обработке на хроматографической колонке с Диаионом HP-20 /65 мл/, проводя элюирование 80%-ным водным метанолом. Фракции, содержащие целевое соединение, объединяли и выпаривали при пониженном давлении с целью удаления метанола. Остаток диофилизировали с получением целевого соединения в ацилированной форме /далее соединение FR139687 /0,214 г/.
ИК-спектр /Ньюол/: 3300, 1620, 1500 см-1.
ЯМР-спектр /DMCO-d6+D2O, δ /: 0,86 /3H, триплет, J=6,8 Гц/, 0,97/3H, дублет, J= 6,8 Гц/, 1,06 /3H, дублет, J=6,8 Гц, 1,2-1,5 /10H, мультиплет/, 1,6-2,0 /5H, мультиплет/, 2,2-2,2-2,5 /3H, мультиплет/, 2,4-2,6 /1H, мультиплет/, 3,18 (1H, мультиплет/, 3,66 - 3,9 /1H, мультиплет/, 4,0-4,6 /15H, мультиплет/, 4,84 /1H, дублет, J=3 Гц/, 4,90 /1H, дублет, J=3 Гц/, 5,11 /1H, дублет, J= 3 Гц/, 6,76 /1H, дублет, J=8,3 Гц/, 6,93 /1H, дублет, J=8,3 Гц/, 7,13 /1H, синглет/, 7,25 /1H, дублет, J=8,3 Гц/, 7,39 /1H, синглет/, 7,8-8,0 /3H, мультиплет/, 8,44 /1H, синглет/.
FAB-масс-спектр: e/z=1264 /M+ Na/.
Следующие соединения /препаративные примеры 13-16/ получасти согласно методике описанной в примере 5.
Препаративный пример 13. N-/t-бутоксикарбонил/-L-2-/2-нафтил/глицин.
ИК-спектр /Ньюол/: 3350, 1800, 1770, 1730, 1680, 1500, 1200 см-1.
Препаративный пример 14. Сукцинимидо 2-/4-бифенилил/ацетат
ИК-спектр /Ньюол/ : 1800, 1770, 1720, 1200 см-1.
ЯМР-спектр /DMCO-d6, δ / : 2,82 /4H, синглет/, 4,17 /2H, синглет/, 7,30-7,50 /5H, мультиплет/, 7,45 /2H, дублет, J=8,1 Гц/, 7,67 /2H, дублет, J=8,1 Гц/.
Препаративный пример 15. Сукцинимидо 4-трет-бутилбензоат.
ИК-спектр /Ньюол/ : 1760, 1730, 1200, 1070, 990 см-1.
ЯМР /DMCO-d6, δ / : 1,33 /9H, синглет/, 2,89 /4H, синглет/, 7,68 /2H, дублет, J=8,5 Гц/, 8,03 /2H, дублет, J=8,5 Гц/.
Препаративный пример 16. Сункцинимидо 4-/4-фенилбутокси/бензоат.
ИК-спектр /Ньюол/ : 1730, 1600, 1240, 1170, 1070 см-1.
ЯМР-спектр /DMCO-d6, δ / : 1,75 /4H, мультиплет/, 2,65 /2H, мультиплет/, 4,14 /2H, мультиплет/, 7,15 /2H, дублет, J=8,9 Гц/, 7,13-7,35 /5H, мультиплет, 8,03 /2H, дублет, J=8,9 Гц/.
Препаративный пример 17. К 3,7-диметилоктанолу /5 мл/ добавляли трехбромистый фосфор /1,01 мл/. Полученную смесь перемешивали в течение 4 ч. при 60oC. Реакционную смесь добавляли к смеси воды с н-гексаном. Органический слой отделяли и сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с образованием 3,7-бромистого диметилоктила /4,40 г/.
ИК-спектр /чистый/ : 2900, 1450 см-1.
ЯМР-спектр /CDCl3,  / : 0,87 /6H, дублет, J=6,6 Гц/, 0,89 /3H, дублет, J= 6,4 Гц/, 1,1-1,3 /6H, мультиплет/, 1,5-1,9 /4H, мультиплет/, 3,3-3,5 /2H, мультиплет/.
/ : 0,87 /6H, дублет, J=6,6 Гц/, 0,89 /3H, дублет, J= 6,4 Гц/, 1,1-1,3 /6H, мультиплет/, 1,5-1,9 /4H, мультиплет/, 3,3-3,5 /2H, мультиплет/.
Следующие соединения /препаративные примеры 18-23/ получали согласно способу, аналогичному описанному в препаративном примере 1.
Препаративный пример 18. 4-/4-/Октилокси/фенокси/бензойная кислота.
ИК-спектр /Ньюол/: 1680, 1600, 1240, 840 см-1.
ЯМР-спектр /DVCO-d6, δ / : 0,87 /3H, триплет, J=6,7 Гц/, 1,1 - 1,6 /10H, мультиплет/, 1,71 /2H, мультиплет/, 3,96 /2H, триплет, J=6,4 Гц/, 6,9-7,1 /6H, мультиплет/, 7,92 /2H, дублет, J=8,7 Гц/, 12,8 /1H, широкий синглет/.
Препаративный пример 19. 6-/Бутокси/-2-нафтойная кислота.
ИК-спектр /Ньюол/ : 1660, 1610, 1205 см-1.
ЯМР-спектр /DVCO-d6, δ / : 0,96 /3H, триплет, J=7,29 Гц/, 1,48 /2H, квинтето-триплет, J= 7,29 Гц и 7 Гц/, 1,78 /2H, тройной триплет, J=7 Гц и 6,45 Гц/, 4,12 /2H, триплет, J=6,45 Гц/, 7,24 /1H, двойной дуплет, J=9,0 Гц и 2,3 Гц/, 7,40 /1H, дублет, J=2,3 Гц/, 7,86 /1H, дублет, J=8,7 Гц/, 7,94 /1H, дублет, J=8,7 Гц/, 8,01 /1H, дублет, J=9,0 Гц/, 8,52 /1H, синглет/.
Препаративный пример 20. 6-Децилокчи-2-нафтойная кислота.
ИК-спектр /Ньюол/: 1670, 1620, 1210 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,85 /3H, триплет, J= 6,7 Гц/, 1,2-1,6 /14H, мультиплет/, 1,78 /2H, мультиплет/, 4,11 /2H, триплет, J=6,4 Гц/, 7,23 /1H, двойной дублет, J=8,9 Гц и 2,4 Гц/, 7,39 /1H, дублет, J=2,4 Гц/, 7,86 /1H, дублет, J= 8,7 Гц/, 7,93 /1H, дублет, J=8,7 Гц/, 8,01 /1H, дублет, 8,9 Гц/, 8,5 /1H, синглет/.
Препаративный пример 21. 6-Гексилокси-2-нафтойная кислота.
ИК-спектр /Ньюол/: 1660, 1620, 1290, 1210 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,89 /3H, триплет, J=6,8 Гц/, 1,2-1,6 /6H, мультиплет/, 1,78 /2H, квинтет, J=6,5 Гц/, 4,11 /2H, триплет, J=6,5 Гц/, 7,23 /1H, двойной дуплет, J=9,0 Гц и 2,4 Гц/, 7,39 /1H, дублет, J=2,4 Гц/, 7,86 /1H, дублет, J=8,7 Гц/, 7,94 /1H, дублет, J=8,7 Гц/, 8,01 /1H, дублет, J=9,0 Гц/, 8,52 /1H,синглет/.
Препаративный пример 22. 6-Додецидлокси-2-нафтойная кислота
ИК-спектр /Ньюол/: 1670, 1620, 1210 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,7 Гц/, 1,20 - 1,60 /18H, мультиплет/, 1,78 /2H, мультиплет/, 4,11 /2H, триплет J=6,5 Гц/, 7,22 /1H, двойной дублет, J= 9 Гц и 2,4 Гц/, 7,39 /1H, дублет, J=2,4 Гц/, 7,85 /1H, дублет, J=8,7 Гц/, 7,93 /1H, дублет, J=8,7 Гц/, 8,00 /1H, дублет, J=9,0 Гц/, 8,51 /1H, Синглет/, 12,90 /1H, синглет/.
Препаративный пример 23. 6-/3,7-Диметилоктилокси/-2-нафтойная кислота.
ИК-спектр /Ньюол/: 1660, 1610, 1290, 1210 см-1.
ЯМР /DMCO-d6, δ /: 0,84 /6H, дублет, J=6,6 Гц/, 0,94 /3H, дублет, J=6,1 Гц/, 1,1-1,4 /6H, мультиплет/, 1,4-1,9 /4H, мультиплет/, 4,15 /2H, триплет, J= 6,7 Гц/, 7,22 /1H, двойной дуплет, J=9,0 Гц и 2,4 Гц/, 7,41 /1H, дублет, J=2,4 Гц/, 7,86 /1H, дублет, J=8,6 Гц/, 7,93 /1H, дублет, J=8 Гц/, 8,01 /1H, дублет, J=9,0 Гц/, 8,52 /1H, синглет/.
Следующие соединения /препаративные примеры 24-31/ получили согласно способу аналогичному описанному в препаративном примере 12.
Препаративный пример 24. 1-/4-(4-Октилокси)фенокси/бензоил-1H- бензотриазол-3-оксид
ИК /Ньюол/: 1770, 1730, 1600, 1500, 1230, 980 см-1.
Препаративный пример 25. 1-/6-Бутокси-2-нафтоил/-1H-бензотриазол-3-оксид.
ИК-спектр /Ньюол/: 1760, 1610, 1260, 1180, 1020 см-1.
Препаративный пример 26. 1-/6-Децилокси-2-нафтоил/-1h-бензотриазол-3-оксид.
ИК-спектр /Ньюол/: 1780, 1620, 1190, 1000 см-1.
Препаративный пример 27. 1-/6-Гексилокси-2-нафтоил/-1H-бензотиазол-3-оксид.
ИК-спектр /Ньюол/: 1780, 1610, 1190 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,89 /3H, триплет, J=6,7 Гц/, 1,2-1,6 /6H, мультиплет/, 1,79 /2H, мультиплет/, 4,12 /2H триплет, J=6,5 Гц/, 7,24 /1H, двойной дублет, J=9,0 Гц и 2,4 Гц/, 7,39 /1H, дублет, J=2,3 Гц/, 7,41 /1H, триплет, J= 8 Гц/, 7,54 /1H, триплет, J=8 Гц/, 7,72 /1H, дублет, J=8 Гц/, 7,88 /1H, дублет, J=8,7 Гц/, 7,90 /1H, дублет, J=8,7 Гц/, 7,97 /1H, дублет, J=8 Гц/, 8,02 /1H, дублет, J=9,0 Гц/, 8,51 /1H, синглет/.
Препаративный пример 28. 1-/6-Додециклокси-2-нафтоил/-1H- бензотриазол-3-оксид.
ИК-спектр /Ньюол/: 1770, 1620, 1190, 1030, 730 см-1.
ЯМР-спектр /DMCO-d6, δ / : 0,85 /3H, триплет, J=6,7 Гц/, 1,2-1,3 /18H, мультиплет/, 1,78 /2H, мультиплет/, 4,11 /2H, триплет, J=6,5 Гц/, 7,22 /1H, двойной дублет, J=9,0 Гц и 2,4 Гц/, 7,39 /1H, дублет, J=2,4 Гц/, 7,40 /1H, триплет, J= 8 Гц/, 7,55 /1H, триплет, J=8 Гц/, 7,73 /1H, дублет, J=8 Гц/, 7,85 /1H, дублет, J=8,7 Гц/, 7,93 /1H, дублет, J=8,7 Гц/, 7,99 /1H, дублет, J=8 Гц/, 8,00 /1H, дублет, J=8 Гц/, 8,51 /1H, синглет/.
Препаративный пример 29. 1-/6-(3,7-Деметилоктилокси)-2-нафтоил/1H-бензотриазол-3-оксид
ИК-спектр /Ньюол/: 1780, 1620, 1190 см-1.
Препаративный пример 30. 1-/(2Е, 6Е)-3,7,11-Триметил-2,6,10- додекатриеноил/-1H-бензотриазол-3-оксид.
ИК-спектр /чистое вещество/: 2900, 1780, 1620, 1420, 1070 см-1
Препаративный пример 31. 3,7-Диметил-6-щктенил бромид получали согласно способу, аналогичному описанному в препаративном примере 17.
ИК-спектр /чистое вещество/: 2900, 1440, 1380 см-1.
ЯМР-спектр /DMCO - d6, δ /: 0,86 /3H, дублет, 1=6,3 Гц/, 1,0-1,5 /2H, мультиплет/, 1,57 /3H, синглет/, 1,65 /3H, синглет/, 1,7-2,1 /5H, мультиплет/, 3,4-3,7 /2H, мультиплет/, 5,08 /1H, мультиплет/.
Препаративный пример 32. К суспензии гидрида натрия /2,04 г/ в N,N - диметилформамиде /50 мл/ добавляли 4-гидроксипиридин /5г/ при комнатной температуре. Добавляли бромистый октил /9,08 мл/. Смесь перемешивали в течение 2 ч. при 50oC. Реакционную смесь добавляли к смеси рассола /100 мл/, тетрагидрофурана /100 мл/ и этилацетата /100 мл/. Органический слой отделяли и сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с получением 1-октил-4-пиридона /14,7 г/.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6 Гц/, 1,1-1,4 /10H, мультиплет/, 1,4-1,8 /2H, мультиплет/ 3,81 /2H, триплет, J=7 Гц/, 6,05 /2H, дублет, J=8 Гц/, 7,63 /2H, дублет, J=8 Гц/.
Препаративный пример 33. К раствору 1-октил-4-пиридона /10,9 г/ в пиридине /100 мл/ добавляли пентасульфид фосфора /8,65 г/ при комнатной температуре. Смесь перемешивали в течение 3 ч. при 80oC. Реакционную смесь добавляли к смеси воды /200 мл/ с хлористым метиленом /200 мл/. Органический слой отделяли и сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с образованием 1-октил-1,4-дигидропиридин-4-тиона /5,27 г/.
ИК-спектр /чистое вещество/: 2910, 2850, 1620, 1460, 1110 см-1.
ЯМР-спектр /DMCO -d6, δ /: 0,86 /3H, триплет, J=6 Гц/, 1,1-1,4 /10H, мультиплет/, 1,5-1,9 /2H, мультиплет/, 3,95 /2H, триплет, J=7 Гц/, 7,13 /2H, дублет, J=7 Гц/, 7,60 /2H, дублет, J=7 Гц/.
Следующие соединения / препаративные примеры 34-36/ получали согласно способу, аналогичному описанному в препаративном примере 1.
Препаративный пример 34. Метил 2-/4-гидроксифенил/-2-метоксиацетат.
ИК-спектр /Ньюол/: 3350, 1740, 1610, 1600, 1220, 1100 см-1.
ЯМР-спектр /DMCO -d6, δ /: 3,23 /3H, синглет/, 3,60 /3H, синглет/, 4,73 /1H, синглет/, 6,72 /2H, дублет, J=8,9 Гц/, 7,15 /2H, дублет, J=8,9 Гц/.
Е1-Масс-спектр /e/z/=196 /M+.
Препаративный пример 35. Гидрохлорид метилового эфира D-тирозина.
ИК-спектр /Ньюол/: 3300, 1740, 1220 см-1.
ЯМР-спектр /DMCO-d6, δ /: 3,02 /2H, мультиплет/, 3,67 /3H, синглет), 4,16 /1H, триплет, J=6,7 Гц/, 6,72 /2H, дублет, J=8,4 Гц/, 7,01 /2H, дублет, J=8,4 Гц/, 8,58 /2H, синглет/, 9,47 /1H, синглет/.
Препаративный пример 36. Метил /4-гидроксифенил/глиоксилат.
ИК-спектр /Ньюол/: 3380, 1730, 1700, 1600, 1580, 1220 см-1.
ЯМР-спектр /DMCO-d6, δ /: 3,91 /3H, синглет/, 6,94 /2H, дублет, J=8,8 Гц/, 7,83 /2H, дублет, J=8,8 Гц/, 10,9 /1H, синглет/.
Препаративаный пример 37. Метиловый эфир N - /третбутоксикарбонил/D-тирозина получали согласно способу, аналогичному описанному в препаративном примере 2.
ИК-спектр /Ньюол/: 3360, 1700, 1680, 1290, 1270, 1250 см-1
ЯМР-спектр /DMCO-d6, δ /: 1,33 /9H, синглет/, 2,73 /2H, мультиплет/, 3,59 /3H, синглет/, 4,05 /1H, мультиплет/, 6,65 /2H, дублет J=8,4 Гц/, 7,00 /2H, дублет, J=8,4 Гц/, 7,23 /1H, дублет, J=7,9 Гц/, 9,23 /1H, синглет/.
Препаративный пример 38. К раствору гидрохлорида метилового эфира 1-тирозина /1 г/ в воде /1,5 мл/ добавляли бикарбонат натрия /0,363 г/ при охлаждении льдом и перемешивании в течение 10 мин и затем добавляли ацетонитрил /7 мл/ 37%-ный водный раствор формальдегида /0,637 мл/ и цианоборогидрид натрия /0,182 г/ при -5oC. Смесь перемешивали в течение 2 ч. при -5oC. Полученный в результате нерастворимый материал отфильтровывали и фильтрат экстрагировали этилацетатом. Органический слой отделяли и сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с получением метилового эфира N,N-диметил-1-тирозина /0,21 г/.
ИК-спектр /Ньюол/: 1730, 1260, 1010 см-1.
ЯМР-спектр /DMCO -d6, δ /: 2,24 /6H, синглет/, 2,72 /2H, мультиплет/, 3,34 /1H, мультиплет/, 3,53 /3H, синглет/, 6,64 /2H, дублет J=8,4 Гц/, 6,97 /2H, дублет, J=8,4 Гц/, 9,18 /1H, синглет/.
Следующие соединения /препаративные примеры 39-44/ получали согласно способу, аналогичному описанному в препаративном примере 3.
Препаративный пример 39. Метил 2-/4-октилоксифенил/ацетат.
ИК-спектр /чистое вещество/: 2910, 2850, 1730, 1240 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,3 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,9 /2H, мультиплет/, 3,58 /2H, синглет/, 3,59 /3H, синглет/, 3,92 /2H, триплет, J=6,4 Гц/, 6,85 /2H, дублет, J=8,7 Гц/, 7,15 /2H, дублет, J=8,7 Гц/.
Препаративный пример 40. Этил 3-/4-октилфенил/пропионат.
ИК-спектр /чистое вещество/: 2920, 2850, 1730, 1240 см-1.
ЯМР /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,7 Гц/, 1,15 /3H, триплет, J= 7,1 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,8 /2H,мультиплет/, 2,55 /2H, триплет, J=7,2 Гц/, 2,77 /2H, триплет, J=7,2 Гц/, 3,90 /2H, триплет, J=6,4 Гц/, 4,03 /2H, квинтет, J=7,1 Гц/, 6,81 /2H, дублет, J=8,6 Гц/, 7,11 /2H, дублет, J=6,8 Гц/.
Препаративный пример 41. Метил 2-/4-октилоксифенил/-2-метоксиацетат.
ИК-спектр /чистое вещество/: 2910, 2850, 1740, 1600, 1240, 1100 см-1.
ЯМР-спектр /DMCO= d6, δ /: 0,86 /3H, триплет, J=6,8 Гц/, 1,2-1,5 /1OH, мультиплет/, 1,6-1,8 /2H, мультиплет/, 3,26 /3H, синглет/, 3,62 /3H, синглет/, 3,94 /2H, триплет, J=6,4 Гц/, 4,83 /1H, синглет/, 6,91 /2H, дублет, J= 7,8 Гц/, 7,27 /2H, дублет, J=8,7 Гц/.
EI-масс-спектр /e/z/ = 308 /M+/.
Препаративный пример 42. Метиловый эфир O4октил-N-/трет-бутоксикарбонил/-Д-тирозина
ИК /Ньюол/: 3350, 1730, 1680, 1510, 1240, 1160 см-1
ЯМР-спектр /DMCO-d6 δ /: 0,86 /3H, триплет, J=6,7 Гц/, 1,2-1,3 /1OH, мультиплет/, 1,68 /2H, мультиплет/, 2,82 /2H, мультиплет/, 3,60 /3H, синглет/, 3,91 /2H, триплет, J=7,3 Гц/, 4,08 /1H, мультиплет/, 6,81 /2H, дублет, J=6,8 Гц/, 7,12 /2H, дублет, J=6,8 Гц/, 7,25 /1H, дублет, J=8 Гц/.
Препаративный пример 43. Метиловый эфир O4-оксил-N, N-диметил-1-тирозина.
ИК-спектр /чистое вещество/: 2930, 2860, 1730, 1250, см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,6 Гц/, 1,26 /1OH, мультиплет/, 1,68 /2H, мультиплет/, 2,80 /2H, мультиплет/, 3,33 /6H, синглет/, 3,37 /1H, мультиплет/, 3,53 /3H, синглет/, 3,89 /2H,триплет, J=6,4 Гц/, 6,79 /2H, дублет, J=6,8 Гц/, 7,08 /2H, дублет, J=6,8 Гц/.
Препаративный пример 44. Метил /4-октилоксифенил/глиоксилат.
ИК-спектр /чистое вещество/: 2930, 2850, 1730, 1670, 1600, 1260, 1210, 1160 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,3 Гц/, 1,2-1,5 /1OH, мультиплет/, 1,6-1,9 /2H, мультиплет/, 3,93 /3H, синглет/, 4,1 /2H, триплет, J=6,5 Гц/, 7,12 /2H, дублет, J=8,9 Гц/, 7,92 /2H, дублет, J=8,9 Гц/.
Следующие соединения /препаративные примеры 45-51/ получали согласно способу аналогичному описанному в препаративном примере 4.
Препаративный пример 45. 4-/2-Бутоксиэтокси/бензойная кислота.
ИК-спектр /Ньюол/: 1670, 1610, 1260 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,87 /3H, триплет, J=7,2 Гц/, 1,2-1,6 /4H, мультиплет/, 3,45 /2H, триплет, J=6,4 Гц/, 3,70 /2H, триплет, J=4,4 Гц/, 4,16 /2H, триплет, J=4,4 Гц/, 7,02 /2H, дублет, J=8,9 Гц/, 7,88 /2H, дублет, J=8,9 Гц/, 12,63 /1H, синглет/.
Препаративный пример 46. 2-/4-Ктилоксифенил/уксусная кислота.
ИК-спектр /Ньюол/: 1680, 1250, 820, 780 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,8 Гц/, 1,1-1,5 /1OH, мультиплет/, 1,6-1,8 /2H, мультиплет/, 3,47 /2H, синглет/, 3,92 /2H, триплет, J=6,4 Гц/, 6,84 /2H, дублет, J=8,6 Гц/, 7,14 /2H, дублет, J=6,8 Гц/.
Препаративный пример 47. 3-/4-Октилоксифенил/пропионовая кислота.
ИК-спектр /Ньюол/: 1680, 1500, 1200 см-1.
ЯМР /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,3 Гц/, 1,1-1,5 /1OH, мультиплет/, 1,6-1,8 /2H, мультиплет/, 2,47 /2H, триплет, J=6,4 Гц/, 6,81 /2H, дублет, J=8,6 Гц/, 7,11 /2H, дублет, J=8,6 Гц/, 12,10 /1H, широкий синглет/.
Препаративный пример 48. 2-/4-Октилоксифенил/-2-метоксиуксусная кислота.
ИК-спектр /Ньюол/: 1760, 1720, 1600, 1500, 1240, 1180, 1100, 830 см-1.
ЯМР /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,7 Гц/, 1,2-1,5 /10H, мультиплет/, 2,6-2,8 /2H, мультиплет/, 3,26 /3H, синглет/, 3,94 /2H, триплет, J= 6,4 Гц/, 4,67 /1H, синглет/, 6,90 /2H, дублет, J=8,6 Гц/, 7,27 /2H, дублет, J=8,6 Гц/.
Препаративный пример 49. O4-Октил-N-/трет-бутоксикарбонил/-Д-тирозин
ИК-спектр /Ньюол/: 3400-2900, 1700, 1500, 1240, 1160 см-1
ЯМР-спектр /DMCO-d6, δ /: 0,859 /3H, триплет, J=6,8 Гц/, 1,20-1,30 /10H, мультиплет/, 1,32 /9H, синглет/, 1,68 /2H, мультиплет/, 2,67-2,95 /1H, мультиплет/, 3,90 /2H, триплет, J=7 Гц/, 4,01 /1H, мультиплет/, 6,81 /2H, дублет, 7,02 /1H, дублет, J=8,3 Гц/, 7,13 /2H, дублет, J=8,6 Гц/.
Препаративный пример 50. O4-Октил-N, N-диметил-1-тирозин.
ИК-спектр /чистое вещество/: 2940, 2860, 2600, 1620, 1240 см-1
ЯМР /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,6 Гц/, 1,26 /10H, мультиплет/, 1,68 /2H, мультиплет/, 2,67 /6H, синглет/, 2,8-3,6 /3H, мультиплет/, 3,91 /2H, триплет, J=6,4 Гц/, 6,85 /2H, дублет, J=8,5 Гц/, 7,16 /2H, дублет, J= 8,5 Гц/.
Препаративный пример 51. O4-/Октилоксифенил/глиоксиловая кислота.
ИК-спектр /чистое вещество/: 1730, 1670, 1600, 1260, 1160 см-1.
ЯМР /DMCO-d6, δ /: 0,86 /3H, триплет, J = 6,8 Гц/, 1,2-1,5 /10H, мультиплет/, 1,65-1,85 /2H, мультиплет/, 4,09 /2H, триплет, J = 6,5 Гц/, 7,12 /2H, дублет, J = 8,9 Гц/, 7,89 /2H, дублет, J = 8,9 Гц.
Препаративный пример 52. N-Октил-N-/трет-бутоксикарбонил/-1-гистидин получали из N-/трет-бутоксикарбонил/-1-гистидина, метилового эфира, согласно способу аналогичному описанному в препаративных примерах 3 и 4.
ЯМР /DMCO-d6, δ /: 0,85 /3H, триплет, J = 6,3 Гц/, 1,23 /10H, мультиплет/, 1,35 /9H, синглет/, 2,83 /2H, мультиплет/, 3,90 /2H, триплет, J = 1,7 Гц/, 4,0-4,2 /1H, мультиплет/, 6,35 /1H, синглет/, 7,02 /1H, дублет, J = 1=8 Гц/, 7,75 /1H, синглет/.
Следующие соединения /препаративные примеры 53-60/ получали согласно способу, аналогичному описанному в препаративном примере 11.
Препаративный пример 53. 4-Октилоксифталевая кислота
ИК-спектр /чистое вещество/: 2930, 2860, 2500, 1700, 1600, 1260 см-1.
ЯМР /DMCO-d6, δ /: 0,86 /3H, триплет, J = 6,8 Гц/, 1,2-1,5 /10H, мультиплет/, 1,5-1,8 /2H, мультиплет/, 4,05 /2H, триплет, J = 6,2 Гц/, 7,03 /1H, дублет, J = 2,6 Гц/, 7,06 /1H, двойной дублет, J = 8,4 Гц и 2,6 Гц/, 7,72 /1H, дублет, J = 8,4 Гц/.
Препаративный пример 54. 3-Метокси-4-октилоксибензойная кислота.
ИК-спектр /Ньюол/: 2600, 1680, 1600, 1270, 1230 см-1 .
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J = 6,8 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,8 /2H, мультиплет/, 3,80 /3H, синглет/, 4,01 /2H, триплет, J = 6,5 Гц/, 7,03 /1H, дублет, J = 8,5 Гц/, 7,44 /1H, дублет, J = 1,9 Гц/, 7,54 /1H, двойной дублет, J=8,5 Гц и 1,9 Гц/.
Препаративный пример 55. 4-/4-Октилоксифенил/бензойная кислота.
ИК-спектр /Ньюол/: 1670, 1600, 830, 770 см-1 .
ЯМР-спектр /DMCO-d6, δ /: 0,87 /3H, триплет, J = 6,7 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,8 /2H, мультиплет/, 4,01 /3H, триплет, J = 6,4 Гц/, 7,04 /2H, дублет, J = 8,8 Гц/, 7,68 /2H, дублет, J = 8,8 Гц/, 7,75 /2H, дублет, J = 8,5 Гц/, 7,99 /2H, дублет, J = 8,5 Гц/.
Препаративный пример 56. 6-/2-Этилгексилокси/-2-нафтонйная кислота.
ИК-спектр /Ньюол/: 1660, 1610, 1280, 1200 см-1 .
ЯМР-спектр /DMCO-d6, δ /: 0,88 /3H, триплет, J = 7,3 Гц/, 0,92 /3H, триплет, J = 7 Гц/, 1,2-1,6 /8H, мультиплет/, 1,7-1,9 /1H, мультиплет/, 4,01 /2H, дублет, J = 5,7 Гц/, 7,23 /1H, двойной дублет, J = 8,9 Гц и 2,4 Гц/, 7,42 /1H, дублет, J = 2,4 Гц/, 7,86 /1H, дублет, J = 8,7 Гц/, 7,94 /1H, дублет, J = 8,7 Гц/, 8,01 /1H, дублет, J = 8,9 Гц/, 8,51 /1H, синглет/, 12,9 /1H, синглет/.
Препаративный пример 57. 6-/3,7-Диметил-6-октенилокси/нафтойная кислота.
ИК-спектр /Ньюол/: 1660, 1610, 1290, 1200 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,95 /3H, дублет, J = 6,1 Гц/, 1,1-1,5 /2H, мультиплет/, 1,57 /3H, синглет/, 1,64 /3H, синглет/, 1,6-2,1 /5H, мультиплет/, 4,15 /2H, триплет, J = 6,7 Гц/, 5,10 /1H, триплет, J = 7,1 Гц/, 7,22 /1H, двойной дублет, J = 8,9 Гц и 2,3 Гц/, 7,42 /1H, дублет, J = 2,3 Гц/, 7,86 /1H, дублет, J = 8,6 Гц/, 7,94 /1H, дублет, J = 8,6 Гц/, 8,01 /1H, дублет, J = 8,9 Гц/, 8,52 /1H, синглет/, 12,89 /1H, синглет/.
Препаративный пример 58. 6-/3,7-Диметил-2,6-октадиенилокси/ нафтойная кислота.
ИК-спектр /Ньюол/: 1660, 1620, 1210 см-1.
ЯМР-спектр /DMCO-d6, δ /: 1,57 /3H, синглет/, 1,60 /3H, синглет/, 1,76 /3H, синглет/, 2,07 /4H, мультиплет/, 4,70 /2H, дублет, J = 6,5 Гц/, 5,07 /1H, мультиплет/, 5,51 /1H, триплет, J = 6,5 Гц/, 7,24 /1H, двойной дублет, J = 8,9 Гц и 2,4 Гц/, 7,41 /1H, дублет, J = 2,4 Гц/, 7,85 /1H, дублет, J = 8,7 Гц/, 7,94 /1H, дублет, J = 8,7 Гц/, 8,01 /1H, дублет, J = 8,9 Гц/, 8,52 /1H, синглет/, 12,88 /1H, синглет/.
Препаративный пример 59. /2E/-3-/-Октилоксифенил/акриловая кислота.
ИК-спектр /Ньюол/: 1660, 1600, 1240 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J = 6,7 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,8 /2H, мультиплет/, 4,00 /2H, триплет, J = 6,4 Гц/, 6,36 /1H, дублет, J = 16 Гц/, 6,95 /2H, дублет, J = 8,7 Гц/, 7,54 /1H, дублет, J = 16 Гц/, 7,61 /2H, дублет, J = 8,7 Гц/, 12,20 /1H, широкий синглет/.
Препаративный пример 60.
6-Октилокси-2-нафталин сульфонат натрия.
ИК-спектр /Ньюол/: 1230, 1180, 860, 820 см-1.
ЯМР-спектр /DVCO-d6, δ /: 0,86 /3H, триплет, J=6 Гц/, 1,1 - 1,6 /10H, мультиплет/, 4,06 /2H, триплет, J=5 Гц/, 7,08 /1H, дуплет, J=9 Гц/, 7,21 /1H, синглет/, 7,79 /1H, дуплет, J=9 Гц/, 8,00 /1H, синглет/.
Препаративный пример 61. К раствору хлористого тионила /0,692 мл/. и N, N-диметилформамида /0,022 мл/ добавляли 6-октил-2-нафталинсульфонат натрия /1 г/ при охлаждении системы льдом и перемешивали 1,5 ч. при 95oC. Реакционную смесь выпаривали при пониженном давлении с получением 6-октилокси-2-нафтилсульфонил хлорида /1 г/.
ИК-спектр /Ньюол/: 1610, 1260, 1160 см-1
ЯМР-спектр /CDCI3, δ /:0,90 /3H, триплет, J=6,2 Гц/, 1,2 - 1,7 /10H, мультиплет/, 1,8 - 2,0 /2H, мультиплет/, 4,12 /2H, триплет, J=6,5 Гц/, 7,20 /1H, дуплет, J=2,2 Гц/, 7,32 /1H, двойной дуплет, J=9,0 Гц и 2,2 Гц/, 7,84 - 7,97 /3H, мультиплет/, 8,49 /1H, синглет/.
Следующие соединения /препаративные примеры 62 - 71/ получали согласно способу, аналогичному описанному в препаративном примере 12.
препаративный пример 62. 1-/4-Октилбензоил/-1H-бензотриазол-3-оксид.
ИК-спектр /чистое вещество/: 2930, 2850, 1780, 1610, 1240, 990 см-1.
Препаративный пример 63. 1-/4-/4-Октилоксифенил/бензоил/1H-бензотриазол-3-оксид.
ИК-спектр /Ньюол/: 1770, 1600, 980 см-1.
Препаративный пример 64. 1-/6-2-Этилгексилокси/-2-нафтоил/-1H, бензотриазол-3-оксид.
ИК-спектр /Ньюол/: 1770, 1620, 1270, 1180 см-1.
ЯМР /CDCI3, δ /: 0,93 /3H, триплет, J=7,1 Гц/, 0,98 /3H, триплет, J=7,4 Гц/, 1,3 - 1,7 /8H, мультиплет/, 1,7 - 2,0 /1H, мультиплет, 4,03 /2H, дуплет, J=5,7 Гц/, 7,22 /1H, дуплет, J=2,2 Гц/, 7,29 /1H, двойной дуплет, J=8,9 Гц, 2,2 Гц/, 7,4 - 7,7 /3H, мультиплет/, 7,87 /1H, дуплет, J=9,5 Гц/, 7,92 /1H, дуплет, J=9,5 Гц/, 8,1 - 8,2 /2H, мультиплет/, 8,80 /1H, синглет/.
Препаративный пример 65. 1-/6-/3,7-Диметил-6-октенилокси/2-2-нафтоил/-1H-бензотриазол-3-оксид.
ИК-спектр /чистое вещество/: 2900, 1770, 1620, 1180 см-1.
Препаративный пример 66, 1-/6//E/-3.7-Диметил-2,6-октадиенилокси/-2-нафтоил/-1H-бензотриазол-3-оксид.
Ик-спектр /Ньюол/: 1770, 1620, 1270, 1180 см-1.
Препаративный пример 67. 1-/2-Антрилкарбонил/-1H-бензотриазол-3-оксид.
ИК-спектр /Ньюол/: 1780, 1200, 720, 740 см-1.
препаративный пример 68, 1-/2-/4-Октилоксифенил/ацетил/-1H-бензотриазол-3-оксид
Ик-спектр /Ньюол/: 1730, 1460, 1420, 1250, 1130 см-1.
Препаративный пример 69, 1-/3-/4-Октилоксифенил/пропионил/-1H-бензотриазол-3-оксид.
Ик-спектр /Ньюол/: 1730, 1420, 1340, 1240, 950 см-1.
Препаративный пример 70, 1-//E/-3-/4-Октилоксифенил/акрилоил/-1H-бензотриазол-3-оксид
ИК-спектр /Ньюол/: 1770, 1600, 1260, 1080 см-1.
Препаративный пример 71, 1-/04-Октил-N, N,-диметил-1-тирозил/-1H-бензотриазол-3-оксид.
ИК-спектр /чистое вещество/: 2930, 2850, 1800, 1610 см-1.
Препаративный пример 72. К суспензии литий алюминий гидрида /4,05 г/ в тетрагидрофуране /475 мл/ прикапывали раствор 4-октилоксибензальдегида /25 г/ в тетрагидрофуране /25 мл/ при 55 - 60oC. Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 1 ч и добавляли фтористый натрий /35,84 г/ и воду /11,52 мл/ при охлаждении системы льдом. Полученную смесь перемешивали в течение 30 мин и фильтровали. Фильтрат выпаривали в вакууме с получением 4-октилоксибензилового спирта /25,1 г/ в виде кристаллов.
ИК-спектр /Ньюол/: 3200, 1605, 1510 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,7 Гц/, 1,26 - 1,38 /10H, мультиплет/, 1,62 - 1,72 /2H, мультиплет/, 3,92 /2H, триплет, J=6,5 Гц/, 4,40 /2H, дуплет, J=5,7 Гц/, 5,03 /1H, триплет, J=5,7 Гц/, 6,85 /2H, дуплет, J=8,6 Гц/, 7,20 /2H, дуплет, J=8,6 Гц/.
Препаративный пример 73. К суспензии 4-октилоксибензилового спирта /25 г/, N-гидроксифталимида /17,15 г/ и трифенилфосфина /27,74 г/ в тетрагидрофуране /250 мл/ прикапывали диэтилазодикарбоксилат /18,4 г/ при охлаждении системы льдом. Реакционную смесь перемешивали в течение 2 ч. при комнатной температуре и выпаривали в вакууме. Остаток очищали хроматографией на силикагеле с получением N-/4-октилоксибензилокси/фталимида /33,45 г/ в виде кристаллов.
ИК-спектр /Ньюол/: 1780, 1725, 1605, 1580, 1505 см-1.
ЯМР /DMCO-d6, δ /: 0,86 /3H, мультиплет/, 1,26 /10H, мультиплет/, 1,70 /2H, мультиплет/, 3,95 /2H, триплет, J=6,5 Гц/, 5,08 /2H, синглет, 6,93 /2H, дуплет, J=8,6 Гц/, 7,40 /2H, дуплет, J=8,6 Гц/, 7,85 /4H, синглет/.
Препаративный пример 74. К раствору N-/4-октилоксибензоилокси/фталимида /4,13 г/ в тетрагидрофуране /16 мл/ при комнатной температуре добавляли гидразин-гидрат /0,53 мл/. после перемешивания смеси при той же темпе6ратуре в течение 1 ч осадок отфильтровывали. К фильтрату добавляли воду /6 мл/ и 4-гидроксифенилгликоксиловую кислоту /1,5 г/ при комнатной температуре. pH смеси устанавливали равным 4 - 4,5 с помощью водного раствора бикарбоната натрия в течение 2 ч., добавляли этил ацетат и устанавливали pH, равной 2, с помощью 1H соляной кислоты. Отдельный органический слой промывали рассолом и сушили над сульфатом магния. Органический растворитель выпаривали в вакууме с получением 2-/4-гидроксифенил/2-/4-октилоксибензилоксиимино/уксусной кислоты /3,4 г/.
ИК-спектр /Ньюол/: 3400, 1715, 1605, 1590, 1505 см-1.
ЯМР /DMCO-d6, δ /: 0,86 /3H, мультиплет/, 1,25 /10H, мультиплет/, 1,69 /2H, мультиплет/, 3,94 /2H, триплет, J=6,4 Гц/, 5,07 /2H, синглет/, 6,82 /2H, дублет, J=8,7 Гц/, 6,90 /2H, дублет, J=6,8 Гц/, 7,29 /2H, дублет, J=6,8 Гц/, 7,35 /2H, дублет, J=8,7 Гц/.
Следующие соединения /препаративные примеры 75 и 76/ были получены согласно способу, аналогичному описанному в препаративном примере 74.
Препаративный пример 75, 2-Фенил-2-/4-октилоксибензилоксиимино/уксусная кислота.
ИК-спектр /Ньюол/: 1720, 1610, 1585, 1515 см-1
Спектр-ЯМР /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,7 Гц/, 1,26 /10H, мультиплет/, 1,69/2H, мультиплет/, 3,94 /2H, триплет, J=6,5 Гц/, 5,13 /2H, синглет/, 6,91 /2H, дублет, J=8,6 Гц/, 7,22-7,49 /7H, мультиплет/.
Препаративный пример 76, 2-/4-Октилоксибензилоксиимино/уксусная кислота.
ИК-спектр /Ньюол/: 1700, 1670, 1600 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,2 Гц/, 1,26 /10H, мультиплет/, 1,70-/2H, мультиплет/, 3,95 /2H, триплет, J=6,5 Гц/, 5,13 /2H, синглет/, 6,91 /2H, дублет, J=8,6 Гц/, 7,29 /2H, дублет, J=8,6 Гц/, 7,56 /1H, синглет/.
Препаративный пример 77. Раствор 4-октилоксифенилглиоксиловой кислоты при комнатной температуре добавляли в смесь воды /9 мл/ и тетрагидрофурана /18 мл/ и при комнатной температуре устанавливали pH, равным 3,5-4, с помощью 1H хлористоводородной кислоты и гидрохлорида метоксиамина /0,337 г/. Полученную смесь перемешивали в течение 2 ч. при комнатной температуре, поддерживая pH 3,5-4 с помощью 1H хлористоводородной кислоты. Реакционную смесь добавляли в этилацетат. Органический слой отделяли и сушили над сульфатом магния. Сульфат магния отфильтровывали и фильтрат выпаривали при пониженном давлении с получением 2-/4-октилфенил/-2-метоксииминоуксусной кислоты /0,57 г/.
ИК-спектр /Ньюол/: 1700, 1600, 1250, 1030 см-1.
ЯМР-спектр /DMCO-d6, δ/: 0,86 /3H, триплет, J=6,3 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,8 /2H, мультиплет/, 3,89 /3H, синглет/, 3,99 /2H, триплет/, J= 6,4 Гц/, 7,00 /2H, дублет, J=8,9 Гц/, 7,45 /2H, дублет, J=8,9 Гц/, 14,05 /1H, синглет/.
Препаративный пример 78. В смесь 2,3,4,5,6 - пентафторбензойной кислоты /1 г/ и 2,2,3,3,4,4,5,5,-октафторпентанола /1,18 г/ в N, N-диметилформамиде /5 мл/ добавляли 62% гидрид натрия /0,39 г/ при комнатной температуре. Смесь перемешивали при этой же температуре в течение 1 ч. и добавляли в ней смесь воды с этилацетатом. Отделявшийся органический слой промывали водой и рассолом, сушили над сульфатом магния и выпаривали в вакууме. Остаток очищали хроматографией на силикагеле с получением 4-/2,2,3,3,4,4,5,5-октафторпентилокси/-2,3,5,6-тетрафторбензойной кислоты /923,9 мг/.
ИК-спектр /Ньюол/: 1700, 1580 см-1.
ЯМР-спектр /DMCO-d6, δ/: 4,96 /2H, триплет, J= 14,2 Гц/, 7,10 /1H, тройной триплет, J=5,6 и 50,2 Гц/.
Препаративный пример 79. 4-/2,2,3,3,4,5,5,5,6,6,7,7,8,8,8-пентадекафтороктилокси/ -2,3,5,6-тетрафторбензойная кислота.
ИК /Ньюол/: 3400, 1640, 1560 см-1.
ЯМР-спектр /DMCO-d6 δ /: 4,95 /2H, триплет, J=14 Гц/.
Следующие соединения /препаративные примеры 80-90/ получали согласно способу, аналогичному описанному в препаративном примере 5.
Препаративный пример 80. Сукцинимидо 2-/4-гидроксифенил/-2-/4-октилоксибензилоксиимино/ацетат.
ИК-спектр /Ньюол/: 1800, 1770, 1700, 1600 см-1.
Препаративный пример 81. Сукцинимидо 2-фенил-2-/4-октилоксибензилоксиимино/ацетат
Ик-спектр /Ньюол/: 1780, 1730, 1605 см-1.
ЯМР /DMCO-d6, δ /: 0,86 /3H, мультиплет/, 1,26 /10H, мультиплет/, 1,69 /2H, мультиплет/, 2,90 /4H, мультиплет/, 3,94 /2H, триплет, J=6,4 Гц/, 5,30 /2H, синглет/, 6,91 /2H, дублет, J=8,6 Гц/, 7,25-7,56 /7H, мультиплет/.
Препаративный пример 82. Сукцинимидо 2-/4-Октилоксибензилоксиимино/ацетат.
ИК-спектр /Ньюол/: 1760, 1725, 1600, 1580 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,7 Гц/, 1,26 /10H, мультиплет/, 1,70 /2H, мультиплет/, 2,85 /4H, синглет, 3,96 /2H, мультиплет/, 5,28 /2H, синглет/, 6,91 /2H, дублет, J=8,6 Гц/, 7,33 /2H, дублет, J=8,6 Гц/, 8,12 /1H, синглет/.
Препаративный пример 83. Сукцинимидо 4-/2,2,3,3,4,4,5,5-октафторпентилокси/2,3,5,6-тетрафторбензоат.
ИК-спектр /Ньюол/: 3500, 1770, 1740, 1640 см-1
ЯМР-спектр /DMCO-d6, δ /: 2,90 /4H, синглет/, 5,23 /2H, триплет, J=13,8 Гц/, 7,11 /1H, тройной триплет, J=50,2 и 5,6 Гц/.
Препаративный пример 84. Сукцинимидо 4-/2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-пентадекафтороктилокси/ -2,3,5,6-тетрафторбензоат.
ИК /Ньюол/: 1735, 1620, 1600 см-1.
ЯМР-спектр /DMCO-d6, δ /: 2,90 /4H, синглет/, 5,12 /2H,триплет, J=13,8 Гц/.
Препаративный пример 85. Сукцинимидо 3-метокси-4-октилоксибензоат.
ИК-спектр /Ньюол/: 1760, 1730, 1600, 1280, 1200, 880 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J=6,7 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,9 /2H, мультиплет/, 2,88 /4H, синглет/, 3,84 /3H, синглет/, 4,09 /2H, триплет, J=6,5 Гц/, 7,19 /1H, дублет, J=8,6 Гц/, 7,49 /1H, дублет, J=2,0 Гц/, 7,73 /1H, двойной дублет, J=8,6 и 2 Гц/.
Препаративный пример 86. Сукцинимидо 4-/2-бутоксиэтокси/бензоат.
ИК-спектр /Ньюол/: 1730, 1600, 1250, 1060 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,87 /3H, триплет, J = 7,2 Гц/, 1,2 - 1,6 /4H, мультиплет/, 2,89 /4H, синглет/, 3,46 /2H, триплет, J=6,3 Гц/, 3,73 /2H, триплет, J= 4,4 Гц/, 4,25 /2H, триплет, J= 4,4 Гц/, 7,18 /2H, дублет, J=9,0 Гц/, 8,04 /2H, дублет, J = 9 Гц/.
Препаративный пример 87. Сукцинимидо 2-/4-Октилоксифенил/2-метоксиацетат.
ИК-спектр /Ньюол/: 1810, 1740, 1610, 1250, 1210, 1100 см-1,
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J = 6,7 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,8 /2H, мультиплет/, 2,80 /4H, синглет/, 3,35 /3H, синглет/, 3,97 /2H, триплет, J = 6,4 Гц/, 5,35 /1H, синглет/, 6,96 /2H, дублет, J = 8,7 Гц/, 7,38 /2H, дублет, J = 8,7 Гц/.
Препаративный пример 88. O4 Октил-N- /трет-бутоксикарбонил/-D-тирозин, сукцинимидный эфир.
ИК-спектр /Ньюол/: 3370, 1780, 1730, 1700, 1250, 1200 см-1.
Препаративный пример 89. Сукцинимидо 2-/4-октилоксифенил/-2-метоксииминоацетат.
ИК-спектр /Ньюол/: 1800, 1780, 1730, 1600, 1250, 1180, 1130 см-1.
ЯМР-спектр /DMCO-d6,  /: 0,86 /3H, триплет J = 6,6 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,8 /2H, мультиплет/, 2,89 /4H, синглет/, 4,01 /3H, синглет/, 4,03 /2H, триплет, J = 6,4 Гц/, 7,08 /2H, дублет, J = 8,9 Гц/, 7,68 /2H, дублет, J = 8,9 Гц/.
/: 0,86 /3H, триплет J = 6,6 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,8 /2H, мультиплет/, 2,89 /4H, синглет/, 4,01 /3H, синглет/, 4,03 /2H, триплет, J = 6,4 Гц/, 7,08 /2H, дублет, J = 8,9 Гц/, 7,68 /2H, дублет, J = 8,9 Гц/.
Препаративный пример 90. Nτ Октил-N- /трет-бутоксикарбонил/-1-гистидин, сукцинимидный эфир.
ИК-спектр /чистое вещество/: 1810, 1780, 1730, 1500, 1360, 1200, 1160 см-1.
Препаративный пример 91. 4-Октилоксифталиевый ангидрид получали из-4-октилоксифталевой кислоты согласно способу аналогичному описанному в препаративном примере 5.
ИК-спектр /чистое вещество/: 2910, 2850, 1840, 1760, 1640, 1610, 1290, 1260 см-1.
ЯМР-спектр /DMCO-d6, δ /: 0,86 /3H, триплет, J = 6,8 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-1,9 /2H, мультиплет/, 4,19 /2H, триплет, J= 6,5 Гц/, 7,47 /1H, двойной дублет, J = 8,4 и 2,2 Гц/, 7,57 /1H/, дублет, J = 2,2 Гц/, 7,98 /1H, дублет, J = 8,4 Гц/.
Препаративный пример 92. N- Октилкарбонилоксисукцинимид был получен по такому же способу, как и препарат 5.
ИК-сректр /в чистом виде/: 2960, 2850, 1780, 1740, 1260, 1230 см-1.
ЯМР-спектр /в дейтерохлороформе/, млн.доли: 0,89 /3H, триплет, J = 6,7 Гц/, 1,2-1,4 /10H, мультиплет/, 1,6-1,8 /2H, мультиплет/ 2,84 /4H, синглет/ 4,32 /2H, триплет, J = 6,7 Гц/.
Препаративный пример 93. К раствору октилфенилового эфира /1,53 г/ в 6 мл хлороформа добавляют при 0oC хлорсульфоновую кислоту. Смесь перемешивают при комнатной температуре 30 мин, затем ее выливают в смесь воды и тетрагидрофурана.
Отделившийся органический слой промывают водным раствором хлористого натрия, сушат над сульфатом магния и затем растворитель выпаривают в вакууме. Остаток подвергают хроматографированию на колонке с силикагелем, чтобы получить 1,25 г 4-октилоксифенилсульфонил хлорида.
ИК-спектр /в чистом виде/: 1600, 1580, 1500, 1380, 1180 см-1
ЯМР-спектр /в дейтерохлороформе/ млн.д.: 0,89 /3H, триплет, J = 6,6 Гц/, 1,20-1,50 /10H мультиплет/ 1,80 /2H, мультиплет/, 4,06 /2H, триплет, J = 6,4 Гц/, 7,03 / 2H, дублет, J = 9 Гц/, 7,96 /2H, дублет, J = 9,0 Гц/.
В табл. 8 представлены структуры соединений из примеров 13-53.
Пример 13. FR139835 получали по реакции соединения FR133303 с N-октилоксикарбонилоксисукцинимидом согласно способу, аналогично описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1
FAB-масс-спектр: e/z = 1137 /M + Na/.
Пример 14. Соединение FR139537 получали по реакции соединения FR133303 с сукцинимидо 4-трет-бутилбензоатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
ЯМР-спектр /D2O, δ /: 1,05 /3H, дублет, J = 6,9 Гц/, 1,15 /3H, дублет, J = 5,9 Гц/, 1,33 /9H, синглет/, 2,0 - 2,3 /3H, мультиплет/, 2,4 - 2,6 /3H, мультиплет/, 2,7 - 2,9 /1H, мультиплет/, 3,4 - 3,6 /1H, мультиплет/, 3,8 - 4,9 /12H, мультиплет/, 5,07 /2H, мультиплет/, 5,40 /1H, дублет, J = 3 Гц/, 7,06 /1H, дублет, J = 8,2 Гц/, 7,08 /1H, двойной дублет, J = 8,2 Гц и 2 Гц/, 7,27 /1H, дублет, J = 2 Гц/, 7,60 /1H, дублет, J = 8,6 Гц/, 7,75 /1H, дублет, J = 8,6 Гц/.
Пример 15. Соединение FR141145 получали по реакции соединения FR133303 с сукцинимидо 4-/2-бутоксиэтокси/бензоатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
ЯМР-спектр /DMCO-d6 δ /: 0,88 /3H, триплет, J = 7,3 Гц/, 0,93 /3H, дублет, J = 6,7 Гц/, 1,04 /3H, дублет, J = 5,7 Гц/, 1,2 - 1,6 /4H, мультиплет/, 1,7 - 2,0 /3H, мультиплет/, 2,1 - 2,65 /4H, мультиплет/, 3,16 /1H, мультиплет/, 3,7 - 4,5 /20H, мультиплет/, 4,78 /1H, дублет, J = 3 Гц/, 4,86 /1H, дублет, J = 3,8 Гц/, 5,02 /1H, дублет, J = 3 Гц/, 6,74 /1H, дублет, J = 8,2 Гц/, 6,79 /1H, дублет, J = 8,2 Гц/, 7,00 /2H, дублет, J = 8,9 Гц/, 7,06 /1H, синглет/, 7,87 /2H, дублет, J = 8,9 Гц/.
FAB-масс-спектр e/z = 1201 /M + Na/.
Пример 16. Соединение FR139538 получали по реакции соединения FR 133303 с сукцинимидо 4-/4-фенилбутокс/бензоатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
FAB-масс-спектр e/z = 1233 /M + Na/.
Пример 17. Соединение FR140215 получено по реакции соединения FR133303 с 4-октилоксифталиевым ангидридом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
FAB-масс-спектр e/z = 1257 /M + Na/.
Пример 18. Соединение FR140216 получали по реакции соединения FR 133303 с сукцинимидо 3-метокси-4-октилбензоатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
FAB-масс-спектр e/z = 1243 /M + Na/.
Пример 19. Соединение FR140727 получали по реакции соединения FR 133303 с сукцинимидо 4-/2,2,3,3,4,4,5,5-октафторпентилокси/-2,3,5,6-тетрфаторбензоатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1630 см-1.
FAB-масс-спектр e/z = 1387 /M + Na/.
Пример 20. Соединение FR143301 получали по реакции соединения FR 133303 с сукцинимидо 4-/2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-пентадекафтороктилокси/- 2,3,5,6-тетрфаторбензоатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1630 см-1.
FAB-масс-спектр e/z = 1534 /M + Na/.
Пример 21. Соединение FR140495 получено по реакции соединения FR133303 с сукцинимидо 2-/4-бифенилил/ацетатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
ЯМР-спектр /CD3OD, δ /: 1,0 - 1,1 /6H, мультиплет/, 1,9 - 2,2 /3H, мультиплет/, 2,3 - 2,6 /3H, мультиплет/, 2,7 - 2,85 /1H, мультиплет/, 3,35 /1H, мультиплет/, 3,58 /2H, синглет/, 3,65 - 4,7 /13H, мультиплет/, 4,93 /1H, дублет, J = 3 Гц/, 5,04 /1H, дублет, J = 3,8 Гц/, 5,25 /1H, дублет, J-3 Гц/, 6,85 /1H, дублет, J = 8,3 Гц/, 7,01 /1H, двойной дублет, J = 8,3 Гц и 2 Гц/, 7,3 - 7,6 /10H, мультиплет/.
Пример 22. Соединение FR139503 получали по реакции соединения FR133303 с сукцинимидо 2-/4-октилоксифенил/-2-метоксиацетатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3330, 1620 см-1.
FAB-мас-спектр e/z = 1257 /M+Na/.
Пример 23. Соединение АК139500 получали по реакции соединения FR 133303 с сукцинимидным эфиром O4-октил-N-/трет-бутоксикарбонил/-D-тирозина согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
ЯМР-спектр /CD3OD, δ /: 0,90 /3H, триплет, J=6,8 Гц/, 1,06 /3H, дублет, J=6,8 Гц/, 1,17 /3H, дублет, J=6,7 Гц/, 1,2-1,3 /10H, мультиплет/, 1,35 /9H, синглет/, 1,74 /2H, мультиплет/, 1,9-2,1 /3H, мультиплет/, 2,45 /3H, мультиплет/, 2,76 /1H, мультиплет/, 3,0-3,1 /1H, мультиплет/, 3,37 /1H, мультиплет/, 3,7-4,6 /18H, мультиплет/, 4,94 /1H, дублет, J=3 Гц/, 5,01 /1H, дублет, J=3,8 Гц/, 5,25 /1H, дублет, J=3 Гц/, 6,79 /2H, дублет, J=8,5 Гц/, 6,83 /1H, дублет, J= 8,3 Гц/, 7,03 /1H, двойной дублет, J=8,3 Гц и 2 Гц/, 7,12 /2H, дублет, J=8,5 Гц/, 7,31 /1H, дублет, J=2 Гц/.
Пример 24. Соединение FR139501 получали по реакции соединения FR133303 с N-/трет-бутоксикарбонил/-1-2-/2-нафтил/-глициновым сукцинимидным эфиром согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
Пример 25. Соединение FR139502 получили по реакции соединения FR133303 с Nτ -октил-N-/трет-бутоксикарбонил/-1-гистидиновым сукцинимидным эфиром согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
FAB масс-спектр e/z = 1330 /M+Na/.
Пример 26. Соединение FR139959 получали по реакции соединения FR133303 с сукцинимидо-2-/4-октилоксифенил/-2-метоксииминоацетатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
ЯМР-спектр /CD3OD, δ /: 0,91 /3H, триплет, J=6,7 Гц/, 1,06 /3H, дублет, J=6,8 Гц/, 1,25 /3H, дублет, J=6,3 Гц/, 1,25-1,6 /10H, мультиплет/, 1,65-1,9 /2H, мультиплет/, 1,9-2,2 /3H, мультиплет/, 2,3-2,65 /3H, мультиплет/, 1,75-1,9 /1H, мультиплет/, 3,3-3,5 /1H, мультиплет/, 3,95 /3H, синглет/, 3,7-4,75 /1H, мультиплет/, 5,03 /1H, дублет, J=3,0 Гц/, 5,11 /1H, дублет, J= 3,7 Гц/, 5,46 /1H, дублет, J=2,7 Гц/, 6,86 /1H, дублет, J=8,2 Гц/, 6,89 /2H, дублет, J= 8,9 Гц/, 7,01 /1H, двойной дублет, J=8,2 Гц и 2 Гц/, 7,31 /1H, дублет, J=2 Гц/, 7,54 /2H, дублет, J=8,9 Гц/.
FAB-масс-спектр e/z = 1270 /M+Na/.
Пример 27. Соединение FR140291 получали по реакции соединения FR133303 с сукцинимидо 2-/4-гидроксифенил/-2-/4- октилоксибензилоксиимино/ацетатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3250, 1650, 1620 см-1.
FAB масс-спектр e/z = 1363 /M+Na/.
Пример 28. Соединение FR141580 получали по реакции соединения FR133303 с сукцинимидо 2-фенил-2-/4-октилокчибензилоксиимино/ацетатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3300, 1646 см-1.
FAB масс-спектр e/z = 1346 /M+Na/.
Пример 29. Соединение FR141579 получили по реакции соединения FR133303 с сукцинимидо 2-/4-октилоксибензилоксиимино/ацетатом согласно способу, аналогичному описанному в примере 3.
ИК-спектр /Ньюол/: 3250, 1650 см-1.
FAB масс-спектр e/z = 1270 /M+Na/.
Пример 30. Соединение FR141146 получали по реакции соединения FR133303 с 1-/2E, 6E/-3,7,11-триметил-2,6,10-додекатриенил/-1H- бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1620, 1040 см-1.
ЯМР /CD3OD, δ /: 1,06 /3H, дуплет, J=6,8 Гц/, 1,19 /3H, дублет, J=5,9 Гц/, 1,60 /3H, синглет/, 1,62 /3H, синглет/, 1,66 /3H, синглет/, 1,9-2,2 /11H, мультиплет/, 2,05 /3H, синглет/, 2,3-2,6 /3H, мультиплет/, 2,7-2,9 /1H, мультиплет/, 3,35 /1H, мультиплет/, 3,7-5,0 /14H, мультиплет/, 5,08 /4H, мультиплет/, 5,27 /1H, дублет, J=2,8 Гц/, 5,77 /1H, синглет/, 6,86 /1H, дублет, J= 8,3 Гц/, 7,04 /1H, двойной дуплет, J=8,3 Гц и 1,9 Гц/, 7,32 /1H, дуплет, J=1,9 Гц/.
Пример 31. Соединение FR140731 получали по реакции соединения FR 133303 с 1-/4-октилбензоил/-1H-бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/ : 3300, 1620, 1040 см-1.
ЯМР-спектр /CD3OD, δ / : 0,86 /3H, триплет, J=6,8 Гц/, 1,06 /3H, дублет, J= 6,8 Гц/, 1,21 /3H, дублет, J=5,8 Гц/, 1,25-1,45 (10H, мультиплет/, 1,55-1,75 /2H, мультиплет/, 1,9-2,25 /3H, мультиплет/, 2,35-2,6 /3H, мультиплет/, 2,65 /2H, триплет, J=7,5 Гц/, 2,81 /1H, мультиплет/, 3,32 /1H мультиплет/, 3,7-4,8 /14H, мультиплет/, 4,98 /1H, дублет J=3 Гц/, 5,09 /1H, дублет, J=3,9 Гц/, 5,31 /1H, дублет, J= 3 Гц/, 6,86 /1H, дублет, J=8,3 Гц/, 7,03 /1H, двойной дублей, J=8,3 и 2 Гц/, 7,24 /2H, дублет, J=8,2 Гц/, 7,33 /1H, дублет, J=2 Гц, 7,74 /2H, дублет, J=8,2 Гц/.
FAB-масс-спектр e/z=1197 /M+Na/.
Пример 32. Соединение FR140217 получали по реакции соединения FR 1333303 с 1-/4-/4-октилокси/фенокси/бензоил/1H-бензотриазолом-3-оксилом согласно способу аналогичному описанному в примере 3.
ИК-спектр /Ньюол/ : 3300, 1620 см-1.
FAB масс-спектр e/z=1305 /M+Na/.
Пример 33. Соединение FR142472 получали по реакции соединения FR133303 c 1-/4-/4-/4-октилоксифенил/бензоил/-1H-бензотриазол-3- -оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/ : 3300, 1620 см-1.
ЯМР-спектр /CD3OD, δ / : 0,88 (3H, триплет, J=6,7 Гц/, 1,06 /3H, дублет, J= 6,8 Гц/, 1,23 /3H, дублет, J=6,1 Гц/, 1,3-1,6 (10H, мультиплет/, 1,8-1,9 /2H, мультиплет/, 1,9-2,3 /3H, мультиплет/, 2,3-2,7 /3H, мультиплет/, 2,9-3,0 /1H, мультиплет/, 3,39 (1H, мультиплет/, 3,7-4,7 /16H мультиплет/, 4,99 /1H, дублет, J=3,0 Гц/, 5,10 /1H, дублет, J=3,7 Гц/, 5,35 /1H, дублет, J=2,7 Гц/, 6,87 /1H, дублет, J=8,3 Гц/, 6,99 /2H, дублет, J=8,8 Гц/, 7,04 /1H, двойной дублет, J= 8,3 и 1,9 Гц/, 7,33 /1H, дублет, J=1,9 Гц/, 7,58 /2H, дублет, J=8,8 Гц, 7,62 /2H, дублет, J=8,4 Гц/, 7,87 /2H, дублет, J=8,4 Гц/.
FAB масс-спектр e/z=1289 /M+Na/.
Пример 34. Соединение FR140496 получали по реакции соединения FR 13303 с 1-6/6-тутокси-2-нафтоил/-1H-бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/ : 3300, 1620 см-1.
FAB-масс-спектр e/z=1207 /M+Na/.
Пример 35. Соединение FR140497 получали согласно реакции между соединением FR133303 и 1-/6-гексилокси-2-нафтоил/-1H-бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/, 3300, 1620 см-1.
Спектр-ЯМР /DMCO-d6, δ / : 0,89 /3H, триплет, J=6,6 Гц/, 0,97 /3H, дублет, J= 6,9 Гц/, 1,08 /3H, дублет, J=5,9 Гц/, 1,2-1,6 /6H, мультиплет/, 1,7-2,1 /5H, мультиплет/, 2,1-2,5 /3H, мультиплет/, 2,5 - 2,7 /1H, мультиплет/, 3,19 /1H, мультиплет/, 3,73 /2H, мультиплет/, 3,8-4,5 /12H, мультиплет/, 4,80 /1H, дублет, J= 3 Гц/, 4,88 /1H, дублет, J=3,8 Гц/, 5,08 /1H, дублет, J= 3 Гц/, 6,74 /1H, дублет, J=8,2 Гц/, 6,80 /1H, двойной дублет, J= 8,2 Гц и 2 Гц/, 7,08 /1H, J=2 Гц/, 7,26 /1H, двойной дублет, J=8,9 Гц и 2,4 Гц/, 7,39 /1H, дублет, J=2,4 Гц/, 7,85 /1H, дублет, J=8,7 Гц/, 7,89 /1H, дублет, J=8,7 Гц/, 7,93 /1H, дублет, J=8,9 Гц/, 8,44, синглет/.
FAB масс-спектр e/z=1235 /M+Na/.
Пример 36. Соединение FR143438 получали по реакции соединения FR133303 с 1-/6-/2-этилгексилокси/-2-нафтоил/-1H-бензотриазол-3- оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/ : 3250, 1620 см-1.
ЯМР /CD3OD, δ / : 0,93 /3H, триплет, J=7,4 Гц/, 0,98 /3H, триплет, J=7,4 Гц/, 1,06 /3H, дублет, J=6,8 Гц/, 1,24 /3H, дублет, J=6 Гц/, 1,3-1,7 /8H, мультиплет/, 1,7-1,9 /1H, мультиплет/, 1,9-2,3 /3H, мультиплет/, 2,3-2,7 /3H, мультиплет/, 2,8-3,0 /1H, мультиплет/, 3,39 /1H, мультиплет/, 3,7-4,7 (16H, мультиплет/, 5,0 /1H, дублет, J=4,4 Гц/, 5,11 /1H, дублет, J=3,7 Гц/, 5,37 /1H, дублет, J-2,6 Гц/, 6,87 /1H, дублет, J=8,3 Гц/, 7,04 /1H, двойной дублет, J=8,3 и 2 Гц/, 7,17 /1H, двойной дублет, J=8,9 и 1,9 Гц/, 7,22 /1H, дублет, H=2 Гц/, 7,33 /1H, дублет, J=1,9 Гц/, 7,7-7,9 /3H, мультиплет/, 8,29 /1H, синглет/,
FAB масс-спектр e/z = 1263 /M+Na/.
Пример 37. Соединения FR140728, получали по реакции соединения FR 133303 с 1-/6-децилокси-2-нефтоил/-1H-бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
ЯМР-спектр /DMCO-d6 + D2O, δ /: 0,86 /3H, триплет, J=6,6 Гц/, 0,97 /3H, дублет, J= 6,7 Гц/, 1,07 /3H, дублет, J=5,9 Гц/, 1,2-1,6 /14H, мультиплет/, 1,7-2,1 /5H, мультиплет/, 2,1-2,5 /3H, мультиплет/, 2,5-2,7 /1H, мультиплет/, 3,19 /1H, мультиплет/, 3,45 /1H, мультиплет/, 3,73 /2H, мультиплет/, 3,9-4,5 /12H, мультиплет/, 4,79 /1H, дублет, J=3 Гц/, 4,87 /1H, дублет, J= 3,8 Гц/, 5,07 /1H, дублет, J=3 Гц/, 6,74 /1H, дублет, J=8,2 Гц/, 6,79 /1H, двойной дублет, J=8,1 и 2 Гц/, 7,06 /1H, дублет, J=2 Гц/, 7,23 /1H, двойной дублет, J= 8,9 и 2,4 Гц/, 7,38 /1H, дублет, J=2,4 Гц/, 7,85 /1H, дублет, J= 8,7 Гц/, 7,89 /1H, дублет, J=8,7 Гц/, 7,98 /1H, дублет, J=8,9 Гц/, 8,45 /1H, синглет/.
FAB масс=спектр e/z = 1291 /M+Na/.
Пример 38. Соединение FR142172 получали по реакции соединение FR 133303 с 1-36/3,7-диметилоктилокси/-2-нефтоил/-1H-бензотриазол-3-оксидом согласно способу аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1610 см-1
ЯМР-спектр /DMCO-d6 + D2O, δ /: 0,85 /6H, дублет, J=6,6 Гц/, 0,95 /3H, дублет, J-5,9 Гц/, 0,97 /3H, дублет, J=6,7 Гц/, 1,08 /3H, дублет, J=5,9 Гц/, 1,1-1,4 /6H, мультиплет/, 1,4-2,1 /7H, мультиплет/, 2,1-2,5 /3H, мультиплет/, 2,5-2,7 /1H, мультиплет/, 3,19 /1H, мультиплет/, 3,74 /2H, мультиплет/, 3,9-4,6 /12H, мультиплет/, 4,81 /1H, дублет, J=3 Гц/, 4,87 /1H, дублет, J=3,8 Гц/, 5,07 /1H, дублет, J=3 Гц/, 6,74 /1H, дублет, J=8,2 Гц/, 6,83 /1H, двойной дублет, J= 8,1 и 2 Гц/, 7,06 /1H, дублет, J=2 Гц/, 7,23 /1H, двойной дублет, J=8,9 и 2,4 Гц/, 7,40 /1H, дублет, J=2,4 Гц/, 7,85 /1H, дублет J= 8,7 Гц/, 7,89 /1H, дублет, J=8,7 Гц/, 7,93 /1H, дублет, J=8,9 Гц/, 8,45 /1H, синглет/
FAB масс-спектр e/z = 1291 /M+Na/.
Пример 39. Соединение FR143326 получали по реакции соединения FR133303 с 1-/6-/3,7-диметил-6-октенилокси/2-нафтоил/-1H-бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1620, 1260, 1040 см-1.
ЯМР-спектр /CD3OD, δ /: 1,0/3H, дублет, J=6,2 Гц/, 1,06 /3H, дублет, J= 6,8 Гц/, 1,25 /3H, дублет, J=5,9 Гц/, 1,2-1,6 /2H, мультиплет/, 1,61 /3H, синглет/, 1,67 /3H, синглет/, 1,63-2,3 /8H, мультиплет/, 2,3-2,7 /3H, мультиплет/, 2,8-3,0 /1H, мультиплет/, 3,39 /1H, мультиплет/, 3,7-4,8 /16H, мультиплет/, 5,00 /1H, дублет, J=5,1 Гц/, 5,08-5,2 /2H, мультиплет/, 5,37 /1H, дублет, J=2,5 Гц/, 6,87 /1H, дублет, J=8,3 Гц/, 7,04 /1H, дублет, J=8,3 Гц/, 7,15 /1H, дублет, J=8,9 Гц/, 7,21 /1H, синглет/, 7,33 /1H, синглет/, 7,71 /1H, дублет, J=8,7 Гц/, 7,77-7,85 /2H, мультиплет/, 8,28 /1H, синглет/.
Пример 40. Соединение FR142390 получали по реакции соединения FR 133303 с 1-/6-//E/-3,7-диметил-2,6-окталиенилокси/-2-нафтоил/- 1H-бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
ЯМР-спектр /DMCO-d6D2O, δ /: 0,97 /3H, дублет, J=6,7 Гц/, 1,07 /3H, дублет, J= 6 Гц/, 1,57 /3H, синглет/, 1,61 /3H, синглет/, 1,76 /3H, синглет/, 1,8-2,5 /9H, мультиплет/, 2,5-2,7 /1H, мультиплет/, 3,19 /1H, мультиплет/, 3,45 /1H, мультиплет/, 3,73 /2H, мультиплет/, 3,9-4,6 /11H, мультиплет/, 4,70 /2H, дублет, J=5,6 Гц/, 4,80 /1H, дублет, J=3 Гц/, 4,87 /1H, дублет, J= 3,8 Гц/, 5,07 /2H, мультиплет/, 5,51 /1H, триплет, J=6,5 Гц/, 6,74 /1H, дублет, J= 8,3 Гц/, 6,83 1H, двойной дублет, J=8,3 Гц/ и 2 Гц/, 7,07 /1H, дублет, J=2 Гц/, 7,24 /1H, двойной дублет, J=8,9 и 2,4 Гц/, 7,40 1H, дублет, J= 2,4 Гц/, 7,8-8,0 /3H, мультиплет/, 8,45 /1H, синглет/.
FAB масс-спектр e/z = 1287 /M+Na/.
Пример 41. Соединения FR140729 получали по реакции соединения FR 133303 с 1-/5-додецилокси-2-нафтоил/-1H-бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1610 см-1.
ЯМР-спектр /DMCO-d6+D2O, δ /: 0,85 /3H, триплет, J=6,6 Гц/, 0,97 /3H, дублет, J= 6,7 Гц/, 1,07 /3H, дублет, J=5,9 Гц/, 1,2-1,6 /18H, мультиплет/, 1,7-2,1 /5H, мультиплет/, 2,1-2,5 /3H, мультиплет/, 2,5-2,7 /1H, мультиплет/, 3,19 /1H, мультиплет/, 3,45 /1H, мультиплет/, 3,73 /2H, мультиплет/, 3,9-4,5 /12H, мультиплет/, 4,79 /1H, дублет, J = 3 Гц/, 4,87 /1H, дублет, J = 3,8 Гц/, 5,07 /1H, дублет, J = 3 Гц/, 6,74 /1H, дублет, J = 8,1 Гц/, 6,78 /1H, двойной дублет, J = 8,1 и 2 Гц/, 7,06 /1H, дублет, J = 2 Гц/, 7,23 /1H, двойной дублет, J = 8,9 и 2,4 Гц/, 7,38 /1H, дублет, J = 2,4 Гц/, 7,85 /1H, дублет, J = 8,7 Гц/, 7,89 /1H, дублет, J = 8,7 Гц/, 7,93 /1H, дублет, J = 8,9 Гц/, 8,44 /1H, синглет/.
FAB масс-спектр e/z = 1320 /M+Na/
Пример 42. Соединение FR140730 получали по реакции соединения FP 133303 с 1-/2-антрилкарбонил/-1H-бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
FAB масс-спектр e/z = 1185 /M+Na/.
Пример 43. Соединение FR143020 получали по реакции соединения FP 133303 с 1-/2-октилоксифенил/ацетил/-1H-бензотриазол-3-оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
ЯМР-спектр /CD3OD, δ /: 0,87 /3H, триплет, J = 6,8 Гц/, 1,0-1,2 /6H, мультиплет/, 1,2-1,6 /10H, мультиплет/, 1,6-1,85 /2H, мультиплет/, 1,85-2,1 /3H, мультиплет/, 2,3-2,6 /3H, мультиплет/, 2,7-2,85 /1H, мультиплет/, 3,32 /1H, мультиплет/, 3,46 /2H, синглет/, 3,7-4,7 /16H, мультиплет/, 5,04 /1H, дублет, J = 3,7 Гц/, 5,23 /1H, дублет, J = 2,7 Гц/, 6,75-6,9 /3H, мультиплет/, 7,01 /1H, дублет, J = 8,3 Гц/, 7,15 /2H, дублет, J = 8,5 Гц/, 7,30 /1H, синглет/.
FAB масс-спектр = 1227 /M+Na/
Пример 44. Соединение FR143021 получали по реакции соединения FR 133303 с 1-/3-/4-октилоксифенил/пропионил/-1H-бензотриазол-3-оксидом согласно способу аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1620 см-1
FAB масс-спектр e/z= 1241 /M+Na/
Пример 45. Соединение FR141315 получали по реакции соединения FR 133303 с 1-//E/-3-/4-октилоксифенил/акрилоил/-1H-бензотриазол-3- оксидом согласно способу аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1620 см-1
ЯМР-спектр /DMCO-d6+D2O, δ /: 0,86 /3H, триплет, J = 6,7 Гц/, 0,97 /3H, дублет, J = 6,7 Гц/, 1,04 /3H, дублет, J = 5,4 Гц/, 1,2-1,5 /10H, мультиплет/, 1,6-2,0 /5H, мультиплет/, 2,1-2,5 /3H, мультиплет/, 2,5-2,6 /1H, мультиплет/, 3,17 /1H, мультиплет/, 3,3-4,5 /15H, мультиплет/, 4,79 /1H, дублет, J = 3 Гц/, 4,86 /1H, дублет, J = 3,8 Гц/, 5,01 /1H, дублет, J = 3 Гц/, 6,57 /1H, дублет, J = 15,8 Гц/, 6,74 /1H, дублет, J = 8,2 Гц/, 6,82 /1H, дублет, J = 8,2 Гц/, 6,97 /2H, дублет, J = 8,8 Гц/, 7,09 /1H, синглет/, 7,34 /1H, дублет, J = 15,8 Гц/, 7,52 /2H, дублет, J = 8,8 Гц/.
FAB масс-спектр e/z= 1239 /M+Na/
Пример 46. Соединение FR140105 получали по реакции соединения FR 0 133303 с 1-/O4-октил-N,N-диметил-1-тирозин/-1H-бензотриазол-3- оксидом согласно способу, аналогичному описанному в примере 12.
ИК-спектр /Ньюол/: 3300, 1620 см-1
ЯМР-спектр /CD3OD, δ /: 0,91 /3H, триплет, J = 6,8 Гц/, 1,06 /3H, дублет, J = 6,8 Гц/, 1,12 /3H, дублет, J = 6,1 Гц/, 1,33 /10H, мультиплет/, 1,74 /2H, мультиплет/, 1,98 /3H, мультиплет/, 2,40 /6h, синглет/, 2,3-2,6 /3H, мультиплет/, 2,8 /2H, мультиплет/, 2,9-3,1 /1H, мультиплет/, 3,3-3,5 /2H, мультиплет/, 3,6-4,7 /16H, мультиплет/, 5,06 /1H, дублет, J = 3,8 Гц/, 5,33 /1H, дублет, J = 3 Гц/, 6,77 /2H, дублет, J = 8,6 Гц/, 6,86 /1H, дублет, J = 8,3 Гц/, 7,03 /1H, двойной дублет, J = 8,3 и 2 Гц/, 7,07 /2H, дублет, J = 8,6 Гц/, 7,31 /1H, дублет, J = 2 Гц/.
Пример 47. Соединение FR141564 получали по реакции соединения FR 133303 с 4-октилоксифенилсульффонил хлоридом согласно способу, аналогичному описанному в примере 6.
ИК-спектр /Ньюол/: 3300, 1620 см-1
ЯМР-спектр /DMCO-d6+D2O, δ /: 0,87 /3H, триплет, J = 6,7 Гц/, 0,97 /3H, дублет, J = 6,8 Гц/, 1,04 /3H, дублет, J = 5,7 Гц/, 1,1-1,5 /10H, мультиплет/, 1,6-2,1 /5H, мультиплет/, 2,45 /3H, мультиплет/, 2,5-2,7 /1H, мультиплет/, 3,19 /1H, мультиплет/, 3,7-4,5 /16H, мультиплет/, 4,80 /1H, дублет, J = 3 Гц/, 4,88 /1H, дублет, J = 4 Гц/, 5,08 /1H, дублет, J = 3 Гц/, 6,74 /1H, дублет, J = 8,2 Гц/, 6,82 /1H, дублет, J = 8,2 Гц/, 6,84 /2H, дублет, J = 8,7 Гц/, 7,07 /1H, синглет/, 7,51 /2H, дублет, J = 8,7 Гц/.
FAB масс-спектр e/z = 1249 /M+Na/.
Пример 48. Соединение FR143170 получали по реакции соединения FR133303 с 6-октилокси-2-нафтилсульфонил хлоридом согласно способу, аналогичному описанному в примере 6.
ИК-спектр /Ньюол/: 3300, 1620 см-1
ЯМР-спектр /CD3OD δ /: 0,29 /3H, дублет, J = 6 Гц/, 0,91 /3H, триплет, J = 6,7 Гц/, 1,07 /3H, дублет, J = 6,9 Гц/, 1,25 - 1,6 /10H, мультиплет/, 1,7 - 2,2 /5H, мультиплет/, 2,2 - 2,6 /4H, мультиплет/, 3,37 /1H, мультиплет/, 3,55 - 4,65 /17H, мультиплет/, 4,97 /1H, мультиплет/, 5,54 /1H, мультиплет/, 6,84 /1H, дублет, J = 8,3 Гц/, 7,01 /1H, двойной дублет, J = 8,4 Гц и 2 Гц/, 7,15 - 7,3 /3H, мультиплет/, 7,75 - 8,0 /3H, мультиплет/, 8,35 /1H, синглет/.
FAB-масс-спектр: e/z = 1299 /M + Na/
Пример 49. К раствору соединения FR138364, полученного в примере 5 /0,25 г/ в ацетонитриле /5 мл/, добавляли п-толуолсульфокислоту /0,132 г/ и полученную смесь перемешивали в течение 8 ч. при комнатной температуре. Реакционную смесь добавляли в воду и в водном слое устанавливали pH 4,5 с помощью насыщенного водного раствора бикарбоната натрия. Водный раствор подвергали колонной хроматографии на Диаионе HP-20, проводят элюирование 80%-ным водным метанолом. Фракции, содержащие целевое соединение, объединяли и выпаривали при пониженном давлении с целью удаления метанола. Остаток лиофилизировали с получением соединения FR138912 /0,15 г/.
ИК-спектр /Ньюол/: 3300, 1620 см-1.
FAB-масс-спектр: e/z = 1272 /M + K/.
Пример 50. Смесь соединения FR138728, полученного в примере 8 /0,15 г/ и 1-окстил-1,4-дигидропиридил-4-тиона /0,0341 г/ в N,N-диметилформамиде перемешивали в течение 1,5 ч. при охлаждении системы льдом. В реакционной смеси распыляли диэтиловый эфир /50 мл/. Осадок фильтровали и сушили над пентоксидом фосфора при пониженном давлении. Порошок добавляли в воду /300 мл/ и устанавливали pH, равным 4,5. Водный раствор подвергали колонной хроматографии на Диаионе HP-20 /50 мл/, проводят элюирование 80%-ным водным раствором. Фракции содержащие целевое соединение, объединяли и выпаривали при пониженном давлении с целью удаления метанола. Остаток лиофилизировали с получением соединения FR138960 /0,15 г/.
ИК-спектр /Ньюол/: 3300, 1620 см-1
FAB-масс-спектр: e/z = 1222 /свободный M + Na/.
Следующие ниже соединения /Примеры 51 - 53/ получали согласно способу, аналогичному описанному в примере 3.
Пример 51. Соединение FR138727
Спектр-ЯМР /CD3OD δ /: 0,90 /3H, триплет, J = 6,8 Гц/, 1,05 /3H, дублет, J = 6,8 Гц/, 1,17 - 1,33 /13H, мультиплет/, 1,6 - 1,8 /2H, мультиплет/, 1,9 - 2,1 /3H, мультиплет/, 1,9 - 2,1 /3H, мультиплет/, 2,50 /1H, мультиплет/, 2,75 /1H, двойной дублет, J = 16 Гц и 4 Гц/, 3,40 /1H, мультиплет/, 3,7 - 3,8 /1H, мультиплет/, 3,98 /2H, триплет, J = 6,2 Гц/, 3,9 - 4,2 /5H, мультиплет/, 4,3 - 4,5 /5H, мультиплет/, 4,5 - 4,7 /5H, мультиплет/, 4,97 /1H, дублет, J = 3 Гц/, 5,06 /1H, синглет/, 5,20 /1H, дублет, J = 3 Гц/, 5,40 /1H, дублет, J = 3 Гц/, 6,85 /1H, дублет, J = 8,3 Гц/, 6,95 /2H, дублет, J = 8,5 Гц/, 7,02 /1H, дублет, J = 8,3 Гц/, 7,30 /1H, дублет, J = 8,5 Гц/, 7,44 /1H, синглет/.
Пример 52. Соединение FR139912.
ИК-спектр /Ньюол/: 3300, 1620 см-1
Пример 53. Соединение FR138960.
ИК-спектр /Ньюол/: 3300, 1620 см-1
Следующие соединения /получение 94 и 95/ были получены по способу, аналогичному способу примера получения 5.
Получение 94. Сукцинимидо 4-/4-гептилоксифенил/бензоат.
ИК-спектр /Нуйол/: 1760, 1740, 1600 см-1
ЯМР-спектр /CDCl3, δ /: 0,87 /3H, т., J = 6,8 Гц/, 1,2 - 1,7 /8H, м./, 1,7 - 1,9 /2H, м.,/, 2,92 /4H, с./, 4,01 /2H, м.,/, J = 6,5 Гц/, 7,00 /2H, д, /, J = 8,8 Гц/, 7,58 /2H, д,/, J = 8,8 Гц/, 7,69 /2H, д., J = 8,5 Гц/, 8,17 /2H, д., J = 8,5 Гц/.
Получение 95. Сукцинимидо 4-/4-гексидоксифенокси/бензоат.
ИК-спектр /Нуйол/: 1760, 1720, 1600 см-1
ЯМР /CDCl3, δ /: 0,92 /3H, т., J = 6,8 Гц/, 1,2 - 1,5 /6H, м./, 1,7 - 1,9 /2H, м.,/, 2,90 /4H, с./, 3,96 /2H, т., J = 6,5 Гц/, 6,9 - 7,1 /6H, м./, 8,07 /2H, д., J = 9 Гц/.
В табл.4 показаны структуры соединений примеров 54 и 55.
Следующие соединения /примеры 54 и 55/ получались по способу аналогичному способу примера 3.
Пример 54. FR 144274
ИК-спектр /Нуйол/: 3300, 1620 см-1.
Вычислено, %: C 48,53; H 6,29; N 8,23; S 2,35.
C55H73N8SO22Na•6H2O.
Найдено, %: C 48,36; H 6,34; N 8,15; S 2,30.
FAB-MC e/z 1275 /M + Na/.
Пример 55. FR144271
Вычислено, %: C 47,57; H 6,14; N 8,22; S 2,35.
C54H71N8SO23Na•6H2O.
Найдено, %: C 47,58; H 6,05; N 8,18; S 2,27.
FAB-MC e/z 1277 /M + Na/.
Реакция ацилирования
Экспериментальные данные
Исходное соединение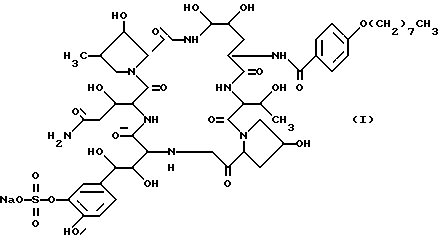 .
.
Заявляемое соединение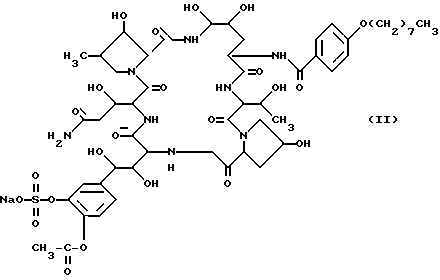 .
.
К раствору исходного соединения (0,5 г) в N,N-диметилформамиде (10 мл) в присутствии молекулярных сит 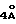 добавляют уксусный ангидрид (0,119 мл) и затем при охлаждении льдом добавляют триэтиламин (0,175 мл). Смесь перемешивают в течение 5 ч. при охлаждении льдом. Реакционную смесь обрабатывают этилацетатом (50 мл). Полученный осадок отфильтровывают и сушат при пониженном давлении. Полученный порошок добавляют в воду (20 мл) и подвергают ионообменной колоночной хроматографии на DOWEX-50Wx4 (Дау Кемикал) и элюируют водой. Фракции, содержащие заявляемое соединение, объединяют и подвергают колоночной хроматографии на ODS (YMC-гель ODS-AM S-50) (Ямамура Кемикал) и элюируют 40%-ным водным раствором метанола. Фракции, содержащие заявляемое соединение, упаривают при пониженном давлении для удаления метанола. Остаток лиофилизируют и получают заявляемое соединение (104 мг).
добавляют уксусный ангидрид (0,119 мл) и затем при охлаждении льдом добавляют триэтиламин (0,175 мл). Смесь перемешивают в течение 5 ч. при охлаждении льдом. Реакционную смесь обрабатывают этилацетатом (50 мл). Полученный осадок отфильтровывают и сушат при пониженном давлении. Полученный порошок добавляют в воду (20 мл) и подвергают ионообменной колоночной хроматографии на DOWEX-50Wx4 (Дау Кемикал) и элюируют водой. Фракции, содержащие заявляемое соединение, объединяют и подвергают колоночной хроматографии на ODS (YMC-гель ODS-AM S-50) (Ямамура Кемикал) и элюируют 40%-ным водным раствором метанола. Фракции, содержащие заявляемое соединение, упаривают при пониженном давлении для удаления метанола. Остаток лиофилизируют и получают заявляемое соединение (104 мг).
NMR (CD3OD, δ ): 0,90 (t, 3H, J = 6,7 Гц), 1,07 (d, 3H, J = 6,8 Гц), 1,20 (d, 3H, J = 6,1 Гц), 1,3 - 1,6 (m, 10H), 1,7 - 1,9 (m, 2H), 1,9 - 2,2 (m, 3H), 2,29 (s, 3H), 2,2 - 2,6 (m, 3H), 2,7 - 2,9 (m, 1H), 3,39 (m, 1H), 3,7 - 4,7 (m, 16H), 4,98 (s, 1H), 5,10 (d, 1H, J = 3,5 Гц), 5,32 (d, 1H, J = 2,8 Гц), 6,93 (d, 2H, J = 8,9 Гц), 7,09 (d, 1H, J = 8,3 Гц), 7,19 (dd, 1H, J = 8,3; 1,7 Гц), 2,60 (d, 1H, J = 1,7 Гц), 7,80 (d, 2H, J = 8,9 Гц).
1R (Nujol): 3300, 1740, 1600, 1040 см-1
FAB-MS : e/z = 1255 (M + Na).
Вычислено, %: C 46,56; H 6,38; N 8,35;
C52H73N5NaO33•6H2O.
Найдено, %: C 46,62; H 6,38; N 8,32.

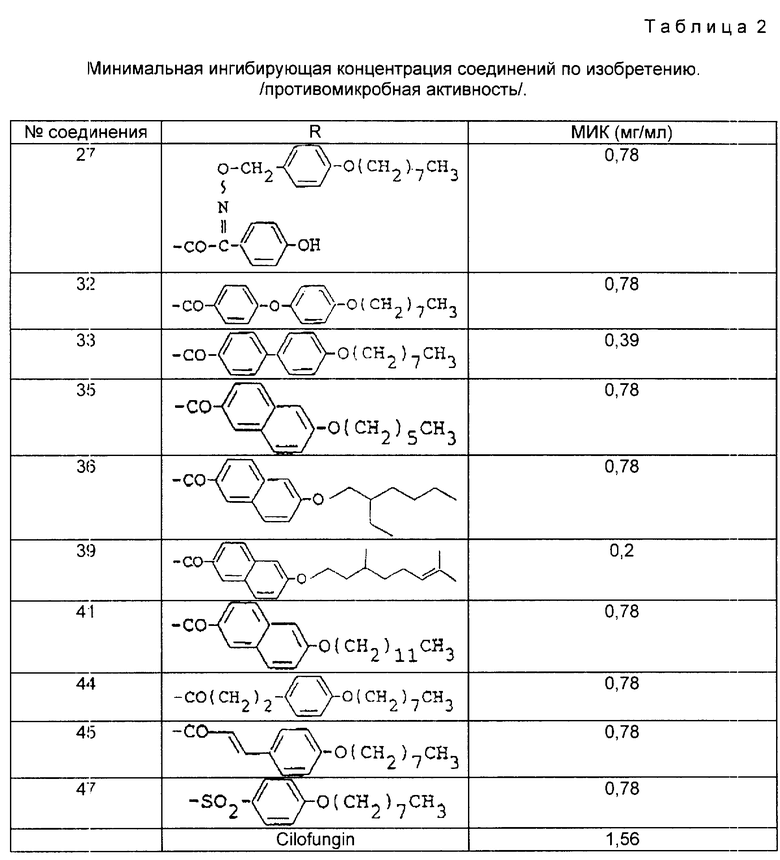
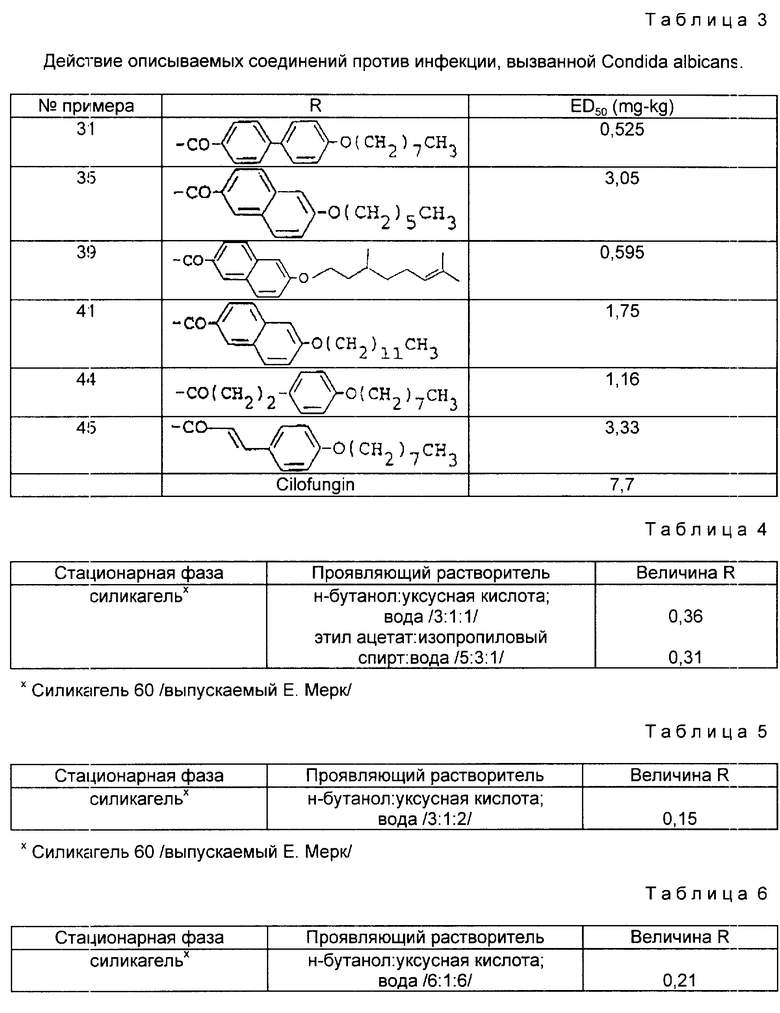
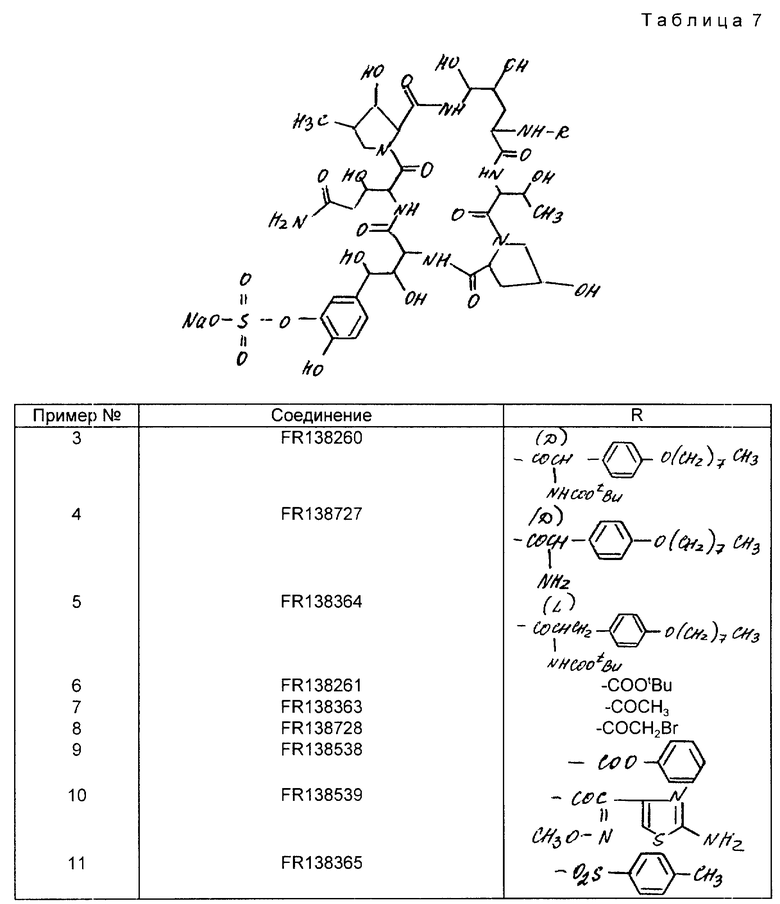
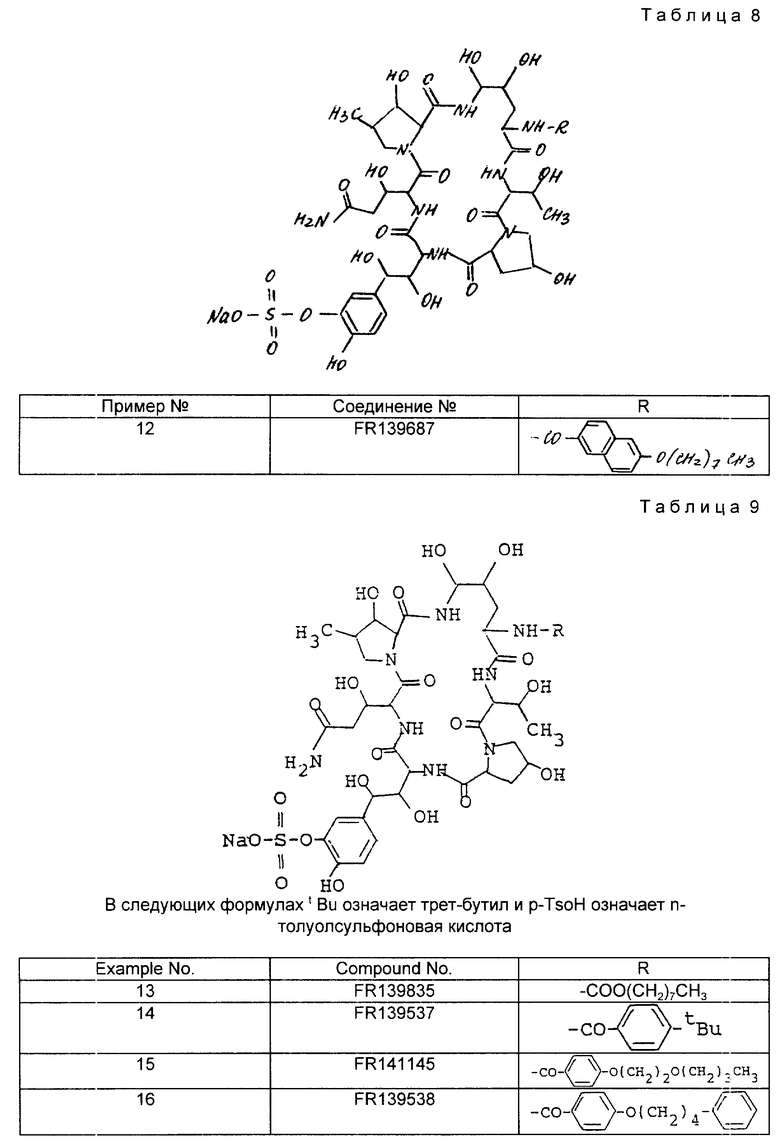
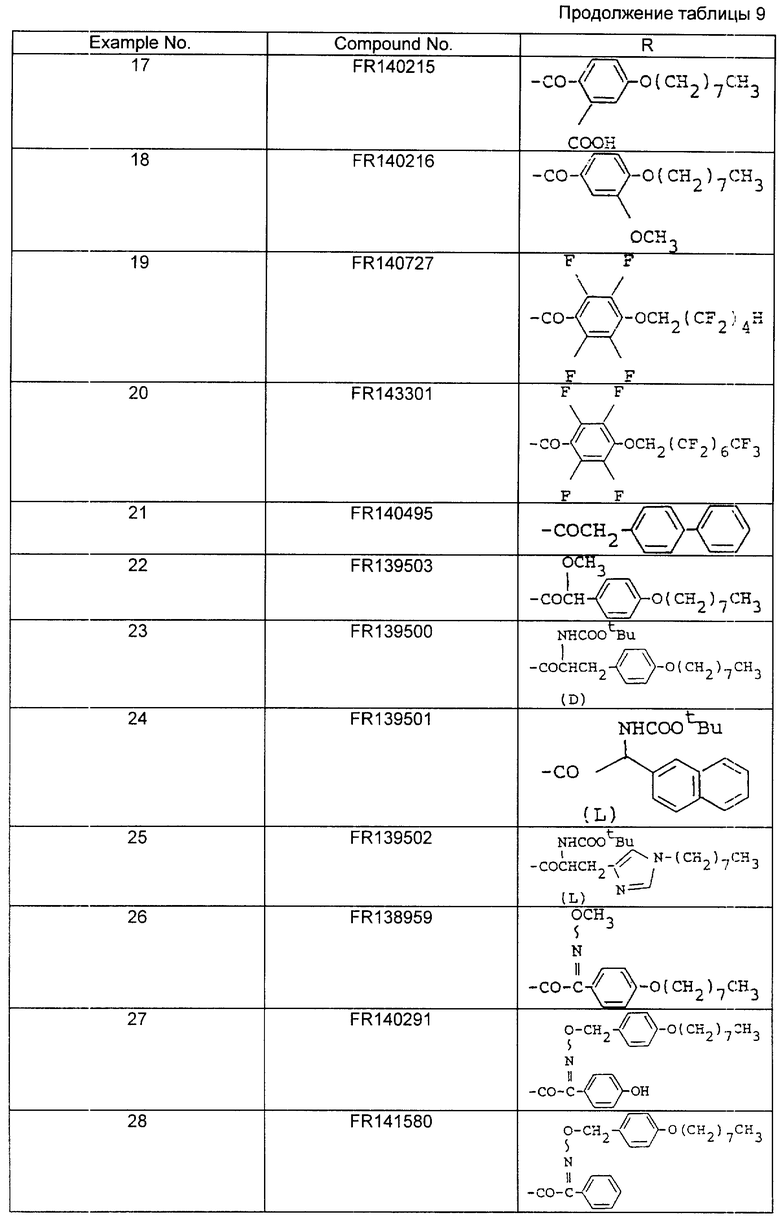
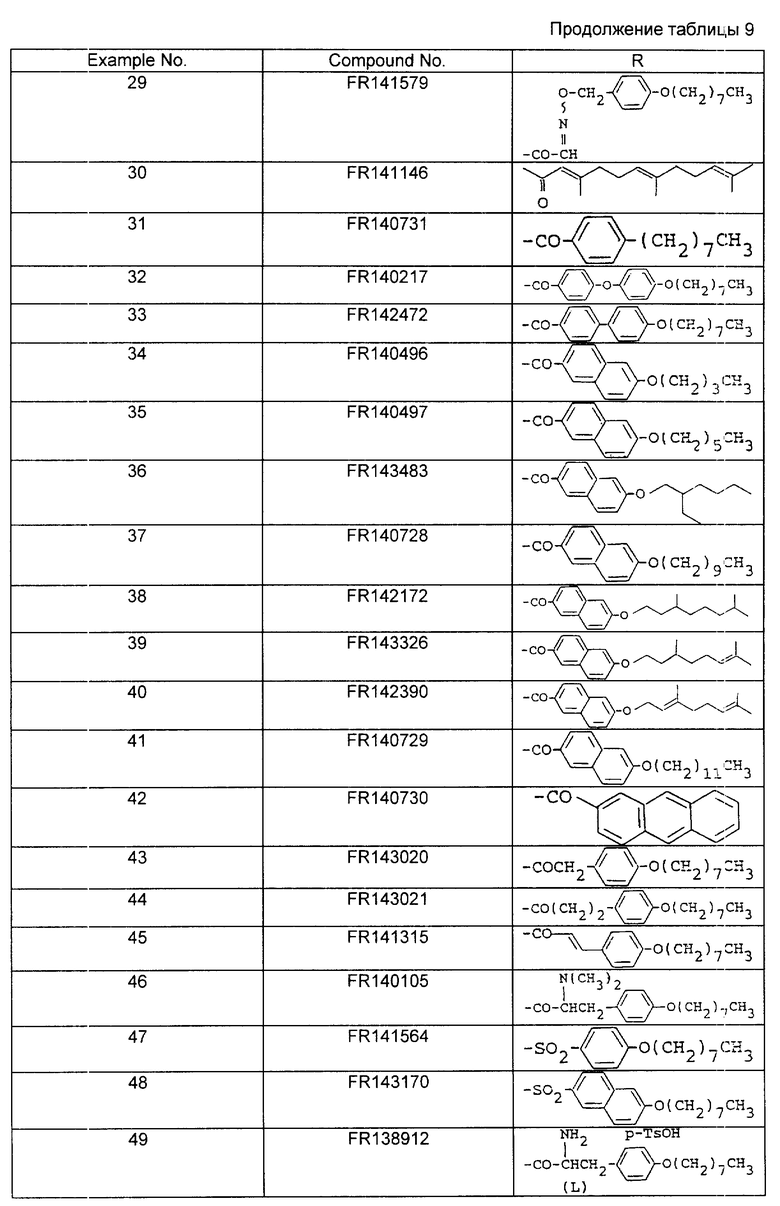
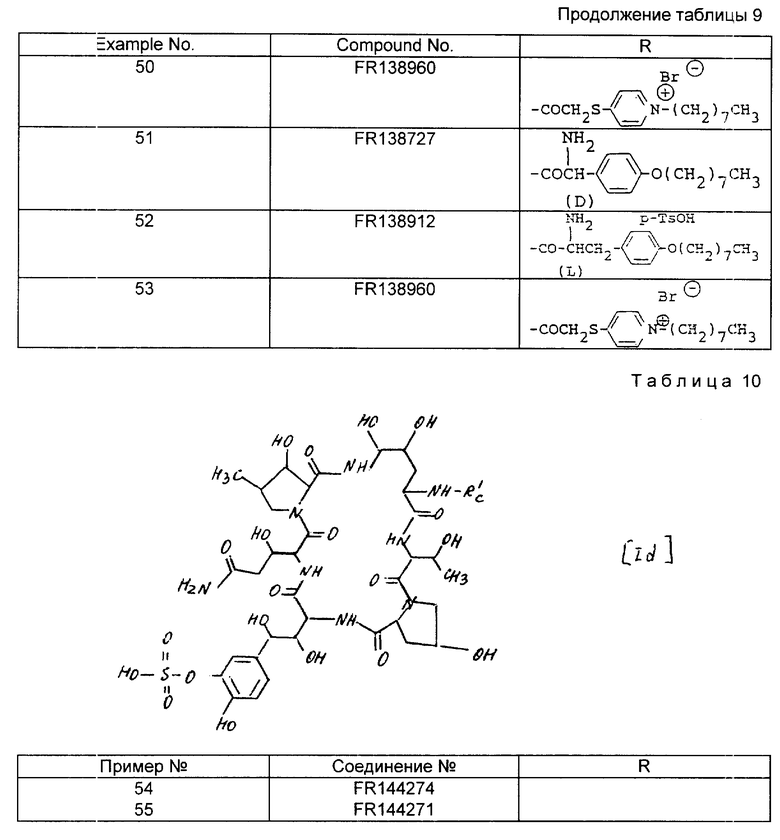
Использование: в медицине. Сущность изобретения: циклопептиды I: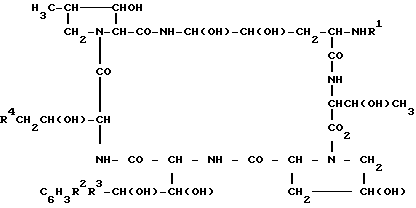
где R1 - водород или ацил; R2 - гидрокси- или ацилоксигруппа; R3 - гидроксисульфонилокси группа; R4 - карбамоил, при условии, что R1 не может быть пальмитоилом, когда R2 - гидрокси, R3 - гидроксисульфонилокси группа или их фармацевтически приемлемые соли; способы их получения: а) путем отщепления R1, б) получения соединений I, где R1 - ацил, путем ацилирования I, где R1 - Н; в) получения I, где R1 - ар(низший)алканоил, путем деблокирования аминогрупп и г) получение соединений I, где R1 - пиридилтио(низший)алканоил, путем взаимодействия I, где R 1 галоген(низший) алканоил с пиридинтионом; д) получение I, где R2 - ацилокси, путем ацилирования I, где R2 - гидроксигруппа; фармацевтическая композиция, обладающая противомикробной активностью, содержащая в качестве активного ингредиента I в эффективном количестве. 7 с. и 1 з.п. ф-лы, 10 табл.
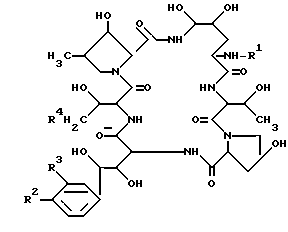
где R1 - атом водорода или ацильная группа;
R2 - гидрокси- или ацилоксигруппа;
R3 - водород, гидроксисульфонилоксигруппа;
R4 - водород, карбамоил, при условии, что R1 не представляет собой пальмитоил, когда R2 - гидроксигруппа, а R3 - гидроксисульфонилоксигруппа,
или его фармацевтически приемлемая соль.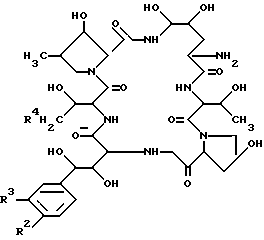
где R2 - гидроксигруппа;
R3 - водород, гидроксисульфонилоксигруппа;
R4 - водород, карбамоил,
или его фармацевтически приемлемой соли, отличающийся тем, что от соединения общей формулы II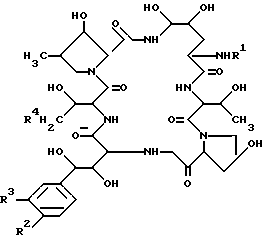
где R1 - пальмитоил;
R2 - гидроксигруппа;
R3 - водород, гидроксисульфонилоксигруппа;
R4 - водород, карбамоил,
или его фармацевтически приемлемой соли, отщепляют группу R1.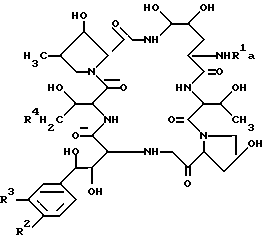
где R
R2 - гидроксигруппа;
R3 - водород, гидроксисульфонилоксигруппа;
R4 - водород, карбамоил,
или его фармацевтически приемлемой соли, отличающийся тем, что соединение общей формулы Iа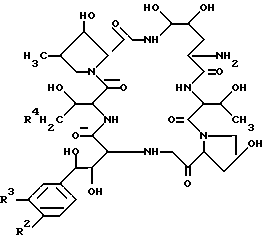
где R2 - гидроксигруппа;
R3 - водород, гидроксисульфонилоксигруппа;
R4 - водород, карбамоил,
или его фармацевтически приемлемую соль подвергают ацилированию.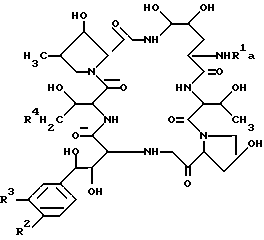
где R
R2 - гидроксигруппа;
R3 - водород, гидроксисульфонилоксигруппа;
R4 - водород, карбамоил,
или его фармацевтически приемлемой соли, отличающийся тем, что от соединения общей формулы Iс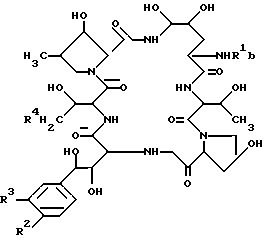
где каждый R2, R3 и R4 имеет указанные значения;
R
или его фармацевтически приемлемой соли отщепляют аминозащитную группу R
5. Способ получения циклопептида общей формулы Id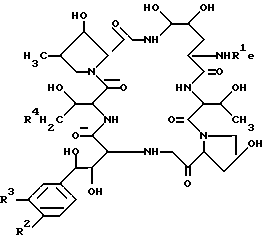
где R
R2 - гидроксигруппа;
R3 - водород, гидроксисульфонилоксигруппа;
R4 - водород, карбамоил,
или его фармацевтически приемлемой соли, отличающийся тем, что соединение общей формулы Ie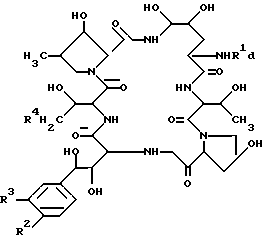
где каждый из R2, R3 и R4 имеет указанные значения;
R
или его фармацевтически приемлемую соль вводят во взаимодействие с пиридином, который содержит высший алкил, или его солью.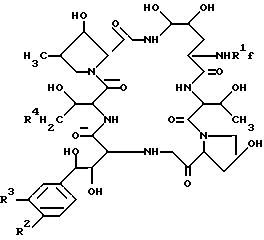
где R
R2 - ацилоксигруппа;
R3 - водород, гидроксисульфонилоксигруппа;
R4 - водород, карбомоил,
или его фармацевтически приемлемой соли, отличающийся тем, что соединение общей формулы IV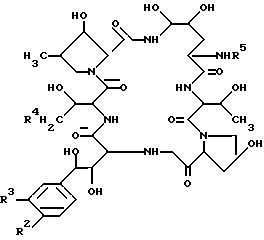
где каждый из R3 и R4 имеют указанные значения;
R2 - гидроксигруппа;
R5 - ацильная группа,
или его фармацевтически приемлемую соль подвергают ацилированию.
Приоритет по признакам и пунктам:
18.06.90 по пп.1 и 2, соединение I, где R1 - Н, ацил, R2 - ОХ;
31.10.90 по п.4;
24.01.91 по п.6.
| Шредер Э., Любке К | |||
| Пептиды, ч.I | |||
| - М.: Мир, 1967, с.116. |
Авторы
Даты
1998-04-10—Публикация
1991-06-17—Подача