Настоящее изобретение относится к новым производным этаноламина и их фармакологически приемлемым солям, которые могут быть использованы в качестве лекарств.
Известны некоторые производные этаноламина, проявляющие антиспазматическую активность и обладающие расслабляющим воздействием при сокращении гладких мышц, как это описано, например, в Европейских патентах с номерами 0211721, 0225415 и 0383686.
Настоящее изобретение относится к новым производным этаноламина и их фармакологически приемлемым солям.
Более конкретно, оно относится к новым производным этаноламина и их фармакологически приемлемым солям, которые обладают по отношению к кишечнику селективной симпатомиметической активностью и активностью против учащенного мочеиспускания, способу их получения, содержащим их фармакологическим композициям и способу их терапевтического использования для лечения и/или профилактики расстройств желудочно-кишечного тракта, вызванных сокращением гладких мышц человека или животных, а еще более конкретно, к способу лечения и/или профилактики спазма повышенной перистальтики желудочно-кишечного тракта в случае синдрома раздражения кишечника, гастрита, язвы желудка, язвы двенадцатиперстной кишки, воспаления тонкой кишки, воспаления желчного пузыря, воспаления желчных протоков, мочекаменной болезни и т.п. и к способу лечения и/или профилактики расстройств мочеиспускания, таких как учащенное мочеиспускание, недержание мочи и т.п. в случае нервного учащенного мочеиспускания, нейрогенной дисфункции мочевого пузыря, ночной полиурии, нестабильного мочеиспускания, спазма мочевого пузыря, хронического цистита, хронического простатита и т.п. Ожидается также, что заявляемые соединения могут быть использованы в качестве терапевтических и/или профилактических средств против ожирения и глаукомы.
Первая цель настоящего изобретения состоит в том, чтобы предложить новые и полезные производные этаноламина и их фармакологически приемлемые соли, которые обладают по отношению к кишечнику селективной симпатомиметической активностью и активностью против учащенного мочеиспускания.
Еще одна цель настоящего изобретения состоит в том, чтобы предложить фармацевтическую композицию, которая включает указанные производные этаноламина и их фармакологически приемлемые соли в качестве активных ингредиентов.
Наконец, еще одна цель настоящего изобретения состоит в том, чтобы предложить терапевтический метод для лечения и/или профилактики указанных выше заболеваний человека или животных, с использованием указанных производных этаноламина и их фармакологически приемлемых солей.
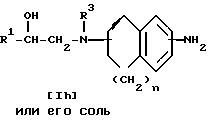
Заявляемые производные этаноламина могут быть представлены следующей общей формулой I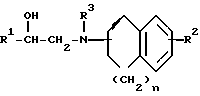
где R1 - арильная или гетероциклическая группа, каждая из которых может содержать такие заместители, как галоген, оксигруппа, защищенная оксигруппа, арилоксигруппа, низшая алкоксигруппа, галоид (низшая) алкоксигруппа, нитрогруппа, цианогруппа, аминогруппа или ациламиногруппа;
R2 - атом водорода, атом галогена, нитрогруппа, гидроксигруппа, низшая алкильная группа, дополнительно замещенная ацильной группой, низшая алкенильная группа, дополнительно замещенная ацильной группой, низшая алкоксигруппа, дополнительно замещенная ацильной группой, или аминогруппа, дополнительно замещенная ацил (низшей) алкильной группой;
R3 - атом водорода, N-защитная группа или низшая алкильная группа, дополнительно замещенная низшей алкилтио-группой;
n - целое число от 0 до 3;
жирная линия означает простую связь или двойную связь,
при этом, если n = 1, то 1) R1 - конденсированная ароматическая углеводородная группа или гетероциклическая группа, каждая из которых может содержать такие заместители, как галоген, оксигруппа, защищенная оксигруппа, арилоксигруппа, низшая алкоксигруппа, галоид (низшая) алкоксигруппа, нитрогруппа, цианогруппа, аминогруппа или ациламиногруппа, 2) R2 - атом галогена, нитрогруппа, низшая алкильная группа, дополнительно замещенная ацильной группой, низшая алкенильная группа, дополнительно замещенная ацильной группой, низшая алкоксигруппа, дополнительно замещенная ацильной группой, или аминогруппа, дополнительно замещенная ацил (низшей) алкильной группой; 3) R3 - N-защитная группа или низшая алкильная группа, дополнительно замещенная низшей алкилтиогруппой, 4) жирная линия означает двойную связь,
и их фармацевтически приемлемые соли.
Заявляемое соединение I или его соли могут быть получены по следующим процессам:
Стадия 1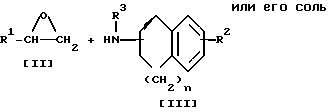
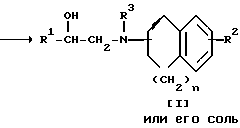
Стадия 2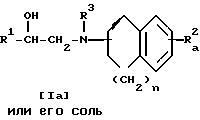
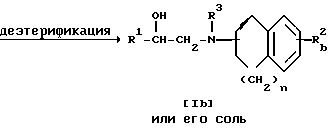
Стадия 3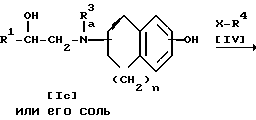
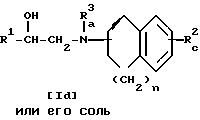
Стадия 4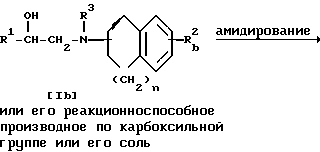
Стадия 5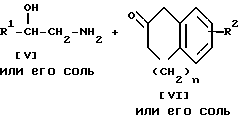
Стадия 6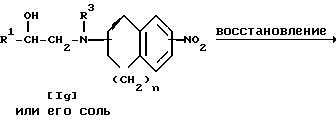
Стадия 7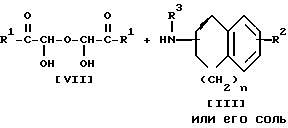
Стадия 8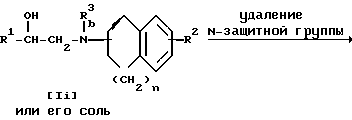
где R1, R2 и R3 и жирная линия имеют указанные значения;
R2 a - низшая алкильная группа, замещенная этерифицированной карбоксигруппой, низшая алкенильная группа, замещенная этерифицированной карбоксигруппой, низшая алкоксигруппа, замещенная этерифицированной карбоксигруппой, или аминогруппа, замещенная этерифицированной карбокси (низшей) алкильной группой;
R2 b - низшая алкильная группа, замещенная карбоксигруппой, низшая алкенильная группа, замещенная карбоксигруппой, низшая алкоксигруппа,замещенная карбоксигруппой, или аминогруппа, замещенная карбокси(низшей)алкильной группой;
R2 a - защитная группа или низшая алкильная группа, дополнительно замещенная низшей акилтиогруппой;
R2 c - низшая алкоксигруппа, дополнительно замещенная ацильной группой;
R4 - низшая алкильная группа, дополнительно замещенная ацильной группой;
X - кислотный остаток;
R2 d - низшая алкильная группа, низшая алкенильная группа, низшая алкоксигруппа, каждая из которых включает карбамоильную группу, дополнительно замещенную низшей алкильной группой, низшей алкокси(низшей)алкильной группой, арилсульфонильной группой, низшей алкилсульфонильной группой или гетероциклической группой, или аминогруппа, замещенная карбамоил(низшей)алкильной группой, в которой карбамоил может быть замещен низшей алкильной группой, низшей алкокси(низшей)алкильной группой, арилсульфонильной группой, низшей алкилсульфонильной группой или гетероциклической группой;
R3 b - N-защитная группа.
Приведенные выше и далее по тексту описания настоящего изобретения соответствующие примеры различных определений, которые должны быть включены в объем притязаний по настоящему изобретению, подробно разъясняются ниже.
Термин "низший" использован, если не сделано дополнительных оговорок, для обозначения группы, содержащей от 1 до 6 атомов углерода.
Подходящим "галогеном" и галогеном в термине "галоген(низшая)алкоксигруппа может быть фтор, хлор, бром или йод, из которых предпочтительными являются хлор или бром.
Подходящей "низшей алкильной группой" и низшим алкильным фрагментом в терминах "ацил(низшая)алкильная группа" и "низшая алкилтиогруппа" может быть алкильная группа с прямой или разветвленной цепью, например, метильная группа, этильная группа, пропильная группа, изо-пропильная группа, бутильная группа, изо-бутильная группа, пентильная группа, изо-пентильная группа, гексильная группа и т.д., из которых предпочтительными являются метильная группа или этильная группа.
Подходящей "низшей алкенильной группой" может быть алкенильная группа с прямой или разветвленной цепью, например, этенильная группа, пропенильная группа, пентинильная группа, изо-пропенильная группа, бутенильная группа, гексенильная группа и т.д., из которых предпочтительной является этенильная группа.
Подходящей "низшей алкоксигруппой" и низшим алкокси-фрагментом в термине "галоген(низшая)алкоксигруппа" может быть алкоксигруппа с прямой или разветвленной цепью, например, метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, пентилоксигруппа, и т.д., из которых предпочтительными являются метоксигруппа, этоксигруппа, пропоксигруппа или пентилоксигруппа.
Подходящей "защищенной окси-группой" может быть замещенная низшая алкоксигруппа, такая как низшая алкокси(низшая)алкоксигруппа (например, метоксиметокси-группа и т.п.), низшая алкокси(низшая) алкокси(низшая)алкоксигруппа например, метоксиэтоксиметокси-группа и т.п.) замещенная или незамещенная арил(низшая)алкоксигруппа (например, бензилоксигруппа, нитробензилоксигруппа и т.п.) и т.д., ацилоксигруппа, такая как низшая алканоилоксигруппа (например, ацетоксигруппа, пропионилоксигруппа, пивалоилоксигруппа и т.п.), ароилоксигруппа (например, бензилокси-группа, флюоренкарбонилоксигруппа и т.д.), низшая алкоксикарбоксигруппа (например, метоксикарбоксигруппа, этоксикарбоксигруппа, пропоксикарбоксигруппа, изопропоксикарбоксигруппа, бутоксикарбоксигруппа, изобутоксикарбоксигруппа, трет-бутоксикарбоксигруппа, пентилоксикарбоксигруппа, гексилоксикарбоксигруппа и т.п. ), замещенная или незамещенная арил(низшая)алкоксикарбоксигруппа (например, бензилоксикарбоксигруппа, бромбензилоксикарбоксигруппа и т. п. ) и т.д., три(низший)алкилсилилоксигруппа (например, триметилсилилоксигруппа и т.п.) и аналогичные группы.
Подходящей "арильной группой" и арильным фрагментом в терминах "арилоксигруппа" и "арилсульфонильная группа" может быть неконденсированная или конденсированная ароматическая углеводородная группа, такая как фенильная группа, нафтильная группа, фенильная группа, замещенная низшей алкильной группой (например, толлильная группа, ксилильная группа, мезитильная группа, куменильная группа, ди(трет-бутил)фенильная группа и т.п.), инденильная группа, инданильная группа и аналогичные группы, из которых предпочтительными являются фенильная группа, нафтильная группа или инданильная группа.
Подхоящей "гетероциклической группой" может быть такая гетероциклическая группа, которая содержит по крайней мере один гетероатом, выбранный из группы, содержащей атомы азота, серы и кислорода, и может включать насыщенные или ненасыщенные, моноциклические или полициклические гетероциклические группы, при этом предпочтительно гетероциклическая группа является N-содержащей гетероциклической группой, такой как ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая от 1 до 4 атомов азота, например, пирролильная группа, пирролинильная группа, имидазолильная группа, пиразолильная группа, пиридильная группа, пиримидинильная группа, пиразинильная группа, пиридазинильная группа, триазолильная группа, например 4H-1,2,4-триазолильная группа, 1H-1,2,3-триазолильная группа, 2H-1,2,3-триазолильная группа и т. п. ), тетразолильная группа (например, 1H-тетразолильная группа, 2H-тетразолильная группа и т.д.);
насыщенная 3-6-членная гетеромоноциклическая группа, содержащая от 1 до 4 атомов азота (например, пирролидинильная группа, имидазолидинильная группа, пиперидино-группа, пиперазинильная группа и т.п.);
ненасыщенная конденсированная гетероциклическая группа, содержащая от 1 до 5 атомов азота, например, индолильная группа, изоиндолильная группа, индолизинильная группа, бензимидазолильная группа, хинолильная группа, изохинолильная группа, индазолильная группа, бензотриазолильная группа, тетразолопиридазинильная группа (например, теразоло[1,5-b]пиридазинильная группа и т.п.) и т.д.;
ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая атом кислорода, например, пиранильная группа, фурильная группа и т.д.;
ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая от 1 до 2 атомов серы, например, тиенильная группа и т.д.;
ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая от 1 до 2 атомов кислорода и от 1 до 3 атомов азота, например, оксазолильная группа, изоксазолильная группа, оксадиазолильная группа (например, 1,2,4-оксадиазолильная группа, 1,3,4-оксадиазолильная группа, 1,2,5-оксадиазолильная групп и т.п.) и т.д.;
ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая от 1 до 2 атомов кислорода и от 1 до 3 атомов азота (например, морфолинильная группа и т.д.);
ненасыщенная конденсированная гетероциклическая группа, содержащая от 1 до 2 атомов кислорода и от 1 до 3 атомов азота (например, бензофуразанильная группа, бензоксазолильная группа, бензоксадиазолильная группа и т.п.);
ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая от 1 до 2 атомов серы и от 1 о 3 атомов азота, например, тиазолильная группа, тиадиазолильная группа (например, 1,2,4-тиадиазолильная группа, 1,3,4-тиадиазолильная группа, 1,2,5-тиадиазолильная группа и т.п.) и т.д.;
насыщенная 3-6-членная гетеромоноциклическая группа, содержащая от 1 до 2 атомов серы и от 1 до 3 атомов азота (например, тиазолидинильная группа и т.д.);
ненасыщенная конденсированная гетероциклическая группа, содержащая от 1 до 2 атомов серы и от 1 до 3 атомов азота (например, бензотиазолильная группа, бензотиадиазолильная группа и т.п.);
ненасыщенная конденсированная гетероциклическая группа, содержащая от 1 до 2 атомов кислорода (например, бензофуранильная группа, бензодиоксолильная группа и т.п.) и аналогичные группы.
Предпочтительными из указанных гетероциклических групп являются пиридильная группа, бензофуразалильная группа или бензодиоксолильная группа.
Подходящей "ацильной группой" и ацильным фрагментом в терминах "ациламино-группа" и "ацил(низшая)алкильная группа" может быть карбоксильная группа, этерифицированная карбоксильная группа, карбамоильная группа, дополнительно замещенная низшей алкильной группой, низшей алкокси(низшей)алкильной группой, арилсульфонильной группой, низшей алкилсульфонильной группой или гетероциклической группой; низшая алканоильная группа, ароильная группа, гетероциклокарбонильная группа и аналогичные группы.
Этерифицированная карбоксильная группа может быть незамещенной или содержать в качестве заместителя низшую алкоксикарбонильную группу (например, метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, бутоксикарбонильную группу, гексилоксикарбонильную группу, 2-иодэтоксикарбонильную группу, 2,2,2-трихлорэтоксикарбонильную группу и т.п.), замещеную или незамещенную арилоксикарбонильную группу (например, феноксикарбонильную группу, 4-нитрофеноксикарбонильную группу, 2-нафтилфеноксикарбонильную группу и т.п.), замещенную или незамещенную арил(низшую)алкоксикарбонильную группу (например, бензилоксикарбонильную группу, фенэтилоксикарбонильную группу, бензгидрилоксикарбонильную группу, 4-нитробензилоксикарбонильную группу и т.п.) и аналогичные группы, предпочтительной из которых является низшая алкоксикарбонильная группа.
Карбамоильной группой, замещенной низшей алкильной группой, может быть метилкарбамоильная группа, этилкарбамоильная группа, пропилкарбамоильная группа, диметилкарбамоильная группа, диэтилкарбамоильная группа, N-метил-N-этил-карбамоильная группа и аналогичные группы.
Карбамоильной группой, замещенной низшей алкокси(низшей)алкильной группой может быть метоксиметилкарбамоильная группа, метоксиэтилкарбамоильная группа, этоксиметилкарбамоильная группа, этоксиэтилкарбамоильная группа и аналогичные группы, предпочтительной среди которых является метоксиэтилкарбамоильная группа.
Карбамоильной группой, замещенной арилсульфонильной группой может быть фенилсульфонилкарбамоильная группа, толилсульфонилкарбамоильная группа и аналогичные группы.
Карбамоильной группой, замещенной низшей алкилсульфонильной группой может быть метилсульфонилкарбамоильная группа, этилсульфонилкарбамоильная группа и аналогичные группы.
Карбамоильной группой, замещенной гетероциклической группой, может быть карбомоильная группа, замещенная одной из гетероциклических групп, которые уже рассмотрены выше.
Низшая алканоильная группа может быть незамещенной или замещенной, как, например, формильная группа, ацетильная группа, пропионильная группа, бутирильная группа, изо-бутирильная группа, валерильная группа, изо-валерильная группа, пивалоильная группа, гексаноильная группа, трифторацетильная группа или аналогичные группы, предпочтительными из которых являются ацетильная группа, пропионильная группа, бутирильная группа и пивалоильная группа.
Ароильная группа может быть бензоильной группой, нафтоильной группой, толуильной группой, ди(трет-бутил)бензоильной группой и аналогичной группой.
Гетероциклическим фрагментом в термине "гетероциклокарбамоильная группа" может быть одна из упомянутых выше гетероциклических групп.
Подходящей "N-защитной группой" может быть замещенная или незамещенная алканоильная группа (например, формильная группа, ацетильная группа, пропионильная группа, трифторацетильная группа и т.п.), фталоильная группа, низшая алкоксикарбонильная группа (например, трет-бутоксикарбонильная группа, трет-амилоксикарбонильная группа и т.п.), замещенная или незамещенная арилалкилоксикарбонильная группа (например, бензилоксикарбонильная группа, п-нитробензилоксикарбонильная группа и т.п.), замещенная или незамещенная аренсульфонильная группа (например, бензолсульфонильная группа, тозильная группа и т.п.), нитрофенилсульфенильная группа, арилалкильная группа (например, тритильная группа, бензильная группа и т.п.) или аналогичные группы, из которых предпочтительной является бензильная группа.
Подходящим "кислотным остатком" может быть галогено-группа (например, фтор, хлор, бром, йод), а ренсульфонилокси-группа (например, бензольсульфонилокси-группа, тозилокси-группа и т.п.), алкансульфонилокси-группа например, мезилоксигруппа, этансульфонилоксигруппа и т.п. и аналогичные группы, из которых предпочтительной является одна из галогеногрупп.
Предпочтительным соединением I является такое, которое в качестве R1 содержит фенильную группу, произвольно замещенную галогеном, в качестве R2 - низшую алкоксигруппу, замещенную карбоксильной группой или этерифицированной карбоксильной группой, в качестве R3 - водород, n имеет значение 0, 2 или 3, а жирная линия означает простую связь.
Более предпочтительно соединением I является такое, которое в качестве R1 содержит фенильную группу, замещенную галогеном, в качестве R2 - метоксигруппу, замещенную этерифицированной карбоксильной группой (более предпочтительно - низшей алкоксикарбонильной группой, в качестве R3 - водород, n имеет значение 0, 2 или 3, а жирная линия означает простую связь.
Наиболее предпочтительно соединением I является такое, которое в качестве R1 содержит фенильную группу, замещенную галогеном, в качестве R2 - метоксигруппу, замещенную низшей алкоксикарбонильной группой, в качестве R3 - водород, n имеет значение 2, а жирная линия означает простую связь.
Подходящими фармакологически приемлемыми солями заявляемого соединения I являются обычные нетоксичные соли, такие как соли присоединения неорганических кислот (например, гидрохлориды, гидробромиды, сульфаты, фосфаты и т.п.), соли органических кислот (например, формиаты, ацетаты, трифторацетаты, оксалаты, малеаты, фумараты, тартраты, метансульфонаты, бензолсульфонаты, толуолсульфонаты и т.п.), соли щелочных металлов (например, соль натрия, соль калия и т.п.) или аналогичные соли.
Стадии получения заявляемого соединения I детально поясняются ниже.
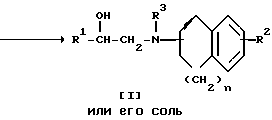
Стадия 1.
Целевое соединение I или его соль можно получить в результате взаимодействия соединения II с соединением III или его солью.
Подходящими солями соединения III могут быть такие же соли, что и рассмотренные выше для соединения I.
Реакцию предпочтительно проводят в присутствии основания, такого как карбонат щелочного металла (например, карбонат натрия, карбонат калия и т.п. ), карбонат щелочноземельного металла (например, карбонат магния, карбонат кальция, бикарбонат щелочного металла (например, бикарбонат натрия, бикарбонат калия и т.п.), три(низший)алкиламин (например, триметиламин, триэтиламин и т.п.), пиколин или аналогичное основание.
Реакцию обычно проводят в стандартном растворителе, таком как спирт (например, метанол, этанол, пропанол, изо-пропанол и т.п.), диэтиловый эфир, тетрагидрофуран, диоксан, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции.
Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении.
Стадия 2.
Целевое соединение Ib или его соль можно получить, подвергнув соединение Ia или его соль реакции деэтерификации.
Подходящими солями соединения Ia могут быть такие же неорганические или органические соли присоединения, что и рассмотренные выше для соединения I.
Подходящими солями соединения Ib могут быть такие же соли, что и рассмотренные выше для соединения I.
Реакцию проводят в соответствии со стандартными методами, такими как гидролиз, восстановление и т.п.
Гидролиз предпочтительно проводят в присутствии основания или кислоты, в том числе кислоты Льюиса.
Приемлемыми основаниями могут быть неорганические основания и органические основания, такие как щелочной металл (например, литий, натрий, калий и т.п.), щелочноземельный металл (например, магний, кальций и т.п.), гидроксид или карбонат или бикарбонат указанных металлов, триалкиламин (например, триметиламин, триэтиламин и т.п.), пиколин, 1,5-диазабицикло[4.3.0]нон-5-ен, 1,4-диазабицикло[2.2.2]октан, 1,8-диазабицикло[5.4.0]ундец-7-ен или аналогичные основания.
Приемлемыми кислотами могут быть органическая кислота (муравьиная кислота, уксусная кислота, пропионовая кислота, трихлоруксусная кислота, трифторуксусная кислота и т.п.), неорганическая кислота (например, соляная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота и т.п.) и кислота Льюиса (например, трехбромистый бор и т.п.).
Реакцию обычно проводят в таких растворителях, как вода, спирт (например, метанол, этанол и т.п.), ксилол, монометиловый эфир диэтиленгликоля, хлористый метилен, тетрагидрофуран, смесь указанных растворителей или любой другой растворитель, который не оказывает вредного воздействия на ход реакции. В качестве растворителя можно также использовать жидкое основание или жидкую кислоту.
Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении.
Восстановление проводят преимущественно для удаления эфирного фрагмента, такого как 4-нитробензильная группа, 2-йодоэтильная группа, 2,2,2-трихлорэтильная группа или аналогичная группа. Метод восстановления, пригодный для проведения реакции элиминирования, может включать химическое восстановление или каталитическое восстановление.
Подходящими восстановительными агентами, пригодными для использования при химическом восстановлении, являются комбинации металла (например, олова, цинка, железа и т. п. ) или соединения металла (например, хлорида хрома, ацетата хрома и т.п.) с органической или неорганической кислотой (например, муравьиной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой, п-толуолсульфокислотой, соляной кислотой, бромистоводородной кислотой и т.п.).
Подходящими катализаторами, пригодными для использования при каталитическом восстановлении, являются стандартные катализаторы, такие как платиновые катализаторы (например, платиновая фольга, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т.п.), палладиевые катализаторы (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий на угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т.п.), никелевые катализаторы (например, восстановленный никель, оксид никеля, никель Ренея и т.п.), кобальтовые катализаторы (например, восстановленный кобальт, кобальт Ренея и т.п.), железные катализаторы (например, восстановленное железо, железо Ренея и т.п.), медные катализаторы (например, восстановленная медь, медь Ренея, медь Ульмана и т. п.) или аналогичные катализаторы.
Реакцию обычно проводят в стандартном растворителе, который не оказывает вредного воздействия на ход реакции, таком как вода, спирт (например, метанол, этанол, пропанол и т.п.), N,N-диметилформамид или смесь указанных растворителей. В случае, если упомянутые выше кислоты, применяемые при химическом восстановлении, представляют собой жидкости, можно также использовать их в качестве растворителя. Далее, подходящим растворителем, применяемым при каталитическом восстановлении, могут быть упомянутые выше растворители и другие стандартные растворители, такие как диэтиловый эфир, диоксан, тетрагидрофуран и т.п. или их смесь.
Температура данной реакции не имеет большого значения; реакцию можно проводить как при охлаждении, так и при нагревании.
В условиях проведения этой реакции, если в качестве исходного соединения используется соединение Ia, в котором R3 N-защитная группа и/или жирная линия обозначает двойную связь, можно получить соединение Ib, в котором R3 - водород, а жирная линия обозначает простую связь. Этот случай входит в объем притязаний по настоящему изобретению.
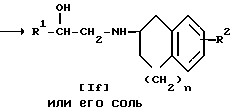
Стадия 3.
Целевое соединение Id или его соль можно получить в результате взаимодействия соединения Ic или его соли с соединением IV.
Подходящими солями соединений Ic и Id могут быть такие же соли, что и рассмотренные выше для соединения I.
Когда при осуществлении этой реакции, используют соединение IV, содержащее галоген в качестве заместителя X, то реакцию предпочтительно проводят в присутствии основания, такого как щелочной металл (например, литий, натрий, калий и т.п.), гидроксид или карбонат или бикарбонат щелочного металла (например, едкий натр, карбонат калия, бикарбонат калия и т.п.), щелочноземельный металл (например, кальций, магний и т.п.), гидрид щелочного металла (например, гидрид натрия и т. п. ), гидрид щелочноземельного металла (например, гидрид кальция, алкоксид щелочного металла (например, метоксид натрия, этоксид натрия, трет-бутоксид калия и т.п.), алкоксид щелочноземельного металла (например, метоксид магния, этоксид магния и т.п.) и аналогичное основание, или в присутствии йодида щелочного металла (например, йодида натрия, иодида калия и т.п.) и указанного основания.
Эту реакцию обычно проводят в стандартных растворителях, таких как тетрагидрофуран, N,N-диметилформамид, ацетон, смесь указанных растворителей или любой другой растворитель, который не оказывает вредного воздействия на ход реакции. В том случае, если соединение IV представляет собой жидкость, его также можно использовать в качестве растворителя.
Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении.
Стадия 4.
Целевое соединение Ie или его соль можно получить в результате взаимодействия соединения Ib или его реакционноспособного производного по карбоксильной группе или соли соединения Ib с амином.
Подходящими солями соединений Ie и Ib и его реакционноспособного производного по карбоксильной группе могут быть те же, что и приведенные в качестве примера для соединения I.
Подходящим амином может быть аммиак, аренсульфонамид, амин, замещенный гетероциклической группой.
Аренсульфонамид может быть бензолсульфонамидом, метилбензолсульфонамидом, этилбензолсульфонамидом и т.д., из которых предпочтительными является метилбензолсульфонамид.
Амином, замещенным гетероциклической группой, может быть амин, замещенный одной из гетероциклических групп, которые уже рассмотрены выше, такой как аминотриазол, аминотиадиазол, аминотриазол, аминотетразол и аналогичные амины, из которых предпочтительным является аминотетразол.
Подходящие реакционноспособные производные по карбоксильной группе соединения Ib могут включать сложный эфир, галоидангидрид, ангидрид кислоты и т. п. Подходящими примерами реакционноспособных производных являются галоидангидриды (например, хлорангидриды, бромангидриды и т.п.); симметричные ангидриды кислоты; смешанные ангидриды кислоты с 1,1'-карбонилдиимидазолом или кислотой, такой как алифатическая карбоновая кислота например, уксусная кислота, пиваловая кислота и т.п., замещенная фосфорная кислота (например, диалкилфосфорная кислота, дифенилфосфорная кислота и т.п.); сложный эфир, такой как низший алкильный эфир (например, метиловый эфир, этиловый эфир, пропиловый эфир, гексиловый эфир и т. п. ), замещенный или незамещенный арил(низший)алкильный эфир (например, бензиловый эфир, бензгидриловый эфир, п-хлорбензиловый эфир и т. п.), замещенный или незамещенный арильный эфир (например, фениловый эфир, толиловый эфир, 4-нитрофениловый эфир, 2,4-динитрофениловый эфир, пентахлорфениловый эфир, нафтиловый эфир и т.п.) или эфир с N, N-диметилгидроксиламином, N-гидроксисукцинимидом, N-гидроксифталимином или 1-окси-6-хлор-1H-бензотриазолом и т.д.
Реакцию обычно проводят в таких стандартных растворителях, как вода, ацетон, диоксан, хлороформ, хлористый метилен, хлористый этилен, тетрагидрофуран, этилацетат, N,N-диметилформамид, пиридин или любой другой растворитель, который не оказывает твердого воздействия на ход реакции. Указанные среди прочих гидрофильные растворители можно использовать в смеси с водой.
В том случае, если соединение Ib используют в виде свободной кислоты, реакцию проводят в присутствии стандартного конденсирующего агента, такого как N,N-дихлоргексилкарбодиимид, N-циклогексил-N'-морфолиноэтилкарбодиимид, N-этил-N'-(3-диметиламинопропил)карбодиимид, хлористый тионил, хлористый оксалил, галогенид низшего алкоксикарбонила (например, хлороформиат, изо-бутилхлороформиат и т.п.), 1-(п-хлорбензолсульфонилокси)-6-хлор-1H-бензотриазол и т. д. Реакцию также проводят в присутствии стандартного основания, такого как триэтиламин, пиридин, едкий натр и т.д.
Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении.
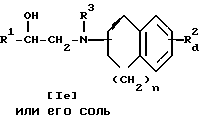
Стадия 5.
Целевое соединение If или его соль можно получить в результате взаимодействия соединения V или его соли с соединением VI или его солью в присутствии восстановительного агента.
Подходящими солями соединения V могут быть такие же неорганические или органические соли присоединения, что и рассмотренные выше для соединения I.
Подходящими солями соединения VI могут быть те же, что и приведенные в качестве примера для соединения I.
Подходящими восстановительными агентами могут быть диборан, комплекс боран-органический амин например, комплекс боран-пиридин и т.п., цианоборгидрид щелочного металла например, цианоборгидрид натрия, цианоборгидрид лития и т.п. и т.д.
Реакцию можно вести также в кислой среде (например, в присутствии уксусной кислоты и т.п.), а температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при нагревании.
Стадия 6.
Целевое соединение Ih или его соль можно получить, подвергнув соединение Ig или его соль реакции восстановления.
Подходящими солями соединения Ig могут быть те же, что и рассмотренные выше для соединения I.
Стадию восстановления можно осуществлять с помощью химического восстановления, каталитического восстановления и т.д.
Подходящими восстановительными агентами, пригодными для использования при химическом восстановлении, являются комбинации металла (например, олова, цинка, железа и т.п.) или соединения металла (например, хлорида хрома, ацетата хрома и т. п. ) с органической или неорганической кислотой (например, муравьиной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой, п-толуолсульфокислотой, соляной кислотой, бромистоводородной кислотой и т.п.).
Подходящими катализаторами, пригодными для использования при каталитическом восстановлении, являются стандартные катализаторы, такие как платиновые катализаторы (например, платиновая фольга, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т.п.), палладиевые катализаторы (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий на угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т.п.), никелевые катализаторы (например, восстановленный никель, оксид никеля, никель Ренея и т.п.), кобальтовые катализаторы (например, восстановленный кобальт, кобальт Ренея и т.п.), железные катализаторы (например, восстановленное железо, железо Ренея и т.п.), медные катализаторы (например, восстановленная медь, медь Ренея, медь Ульмана и т. п.) или аналогичные катализаторы.
Восстановление обычно проводят в стандартном растворителе, который не оказывает вредного воздействия на ход реакции, таком как вода, спирт (например, метанол, этанол, пропанол и т.п.), N,N-диметилформаимд или смесь указанных растворителей. В случае если упомянутые выше кислоты, применяемые при химическом восстановлении, представляют собой жидкости, можно также использовать их в качестве растворителя. Далее, подходящими растворителями, применяемыми при каталитическом восстановлении, могут быть упомянутые выше растворители и другие стандартные растворители, такие как диэтиловый эфир, хлористый метилен, диоксан, этилацетат, тетрагидрофуран и т.п. или их смесь.
Температура данной реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при нагревании.
В условиях проведения этой реакции, если в качестве исходного соединения используется соединение Ig, в котором R3 - N-защитная группа и/или жирная линия обозначает двойную связь, можно получить соединение Ih, в котором R2 - водород, а жирная линия обозначает простую связь. Этот случай входит в объем притязаний по настоящему изобретению.
Стадия 7.
Целевое соединение I или его соль можно получить в результате взаимодействия соединения VII или его соли с соединением III или его солью в присутствии восстановительного агента.
Подходящими солями соединения I и соединения III могут быть те же соли, что и рассмотренные выше для соединения I.
Подходящими восстановительными агентами могут быть боргидридное соединение, такое как боргидрид щелочного металла (например, боргидрид натрия, цианоборгидрид натрия, цианоборгидрид лития, триэтилборгидрит лития и т.п.), цианоборгидрит тетрабутиламмония и т.д., из которых предпочтительным является боргидрит щелочного металла.
Реакцию предпочтительно проводят в присутствии основания, такого как карбонат щелочного металла (например, карбонат натрия, карбонат калия и т.п.), карбонат щелочноземельного металла (например, карбонат магния, карбонат кальция, бикарбонат щелочного металла например, бикарбонат натрия, бикарбонат калия и т.п.), три (низший)алкиламин (например, триметиламин, триэтиламин и т.п.), пиколин или аналогичное основание.
Реакцию обычно проводят в стандартном растворителе, таком как вода, спирт (например, метанол, этанол, пропанол, изо-пропанол и т.п.), диоксан, либо в любом другом органическом растворителе, который не оказывает твердого воздействия на ход реакции.
Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении.
Стадия 8.
Целевое соединение Ij или его соль можно получить, подвергнув соединение Ii или его соль реакции элиминирования N-защитной группы.
Подходящими солями соединений Ii и Ij могут быть такие же соли, что и рассмотренные выше для соединения I.
Реакцию проводят в соответствии со стандартными методами, такими как гидролиз, восстановление и т.п.
Гидролиз предпочтительно проводят в присутствии основания или кислоты, в том числе кислоты Льюиса.
Приемлемыми основаниями могут быть неорганические основания и органические основания, такие как щелочной металл (например, литий, натрий, калий и т.п.), щелочноземельный металл (например, магний, кальций и т.п.), гидроксид или карбонат или бикарбонат указанных металлов, триалкиламин (например, триметиламин, триэтиламин и т. п. ), пиколин, 1,5 - диазабицикло [4.3.0] нон-5-ен, 1,4 - диазабицикло [2,2,2] октан, 1,8 - диазабицикло [5.4.0] унден-7-ен или аналогичные основания.
Приемлемыми кислотами могут быть органическая кислота (муравьиная кислота, уксусная кислота, пропионовая кислота, трихлорукусусная кислота, трифторуксусная кислота и т.п.), неорганическая кислота (например, соляная кислота, бромистоводородная кислота, серная кислота, хлористый водород, бромистый водород, фтористый водород и т.п.) и соли присоединения кислот (например, пиридина гидрохлорид и т.п.).
Реакцию элиминирования с использованием тригалогенуксусной кислоты (например, трихлоруксусной кислоты, трифторуксусной кислоты и т.п.) или аналогичной кислоты предпочтительно проводят в присутствии нуклеофильных агентов (например, анизола, фенола и т.п.).
Реакцию обычно проводят в таких стандартных растворителях, как вода, спирт (например, метанол, этанол и т.п.), хлористый метилен, хлороформ, тетрахлорметан, тетрагидрофуран, смесь указанных растворителей или любой другой растворитель, который не оказывает вредного воздействия на ход реакции. В качестве растворителя можно также использовать жидкое основание или жидкую кислоту.
Метод восстановления, пригодный для проведения реакции элиминирования может включать химическое восстановление, каталитическое восстановление и т. д.
Подходящими восстановительными агентами, пригодными для использования при химическом восстановлении, являются комбинации металла (например, олова, цинка, железа и т.п.) или соединения металла (например, хлорида хрома, ацетата хрома и т.п.), с органической или неорганической кислотой (например, муравьиной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой, п-толуолсульфокислотой, соляной кислотой, бромистоводородной кислотой и т.п.).
Подходящими катализаторами, пригодными для использования при каталитическом восстановлении, являются стандартные катализаторы, такие как платиновые катализаторы (например, платиновая фольга, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т.п.), палладиевые катализаторы (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий на угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т.п.), никелевые катализаторы (например, восстановленный никель, оксид никеля, никель Ренея и т.п.), кобальтовые катализаторы (например, восстановленный кобальт, кобальт Ренея и т. п.), железные катализаторы (например, восстановленное железо, железо Ренея и т.п.), медные катализаторы (например, восстановленная медь, медь Ренея, медь Ульмана и т.п.) или аналогичные катализаторы.
В том случае, если N-защитной группой является бензильная группа, восстановление предпочтительно проводят в присутствии комбинации палладиевого катализатора (например, палладиевой черни, палладия на угле и т.п.) и муравьиной кислоты или ее соли (например, формиата аммония и т.п.).
Восстановление обычно проводят в стандартном растворителе, который не оказывает вредного воздействия на ход реакции, таком как вода, метанол, этанол, пропанол, N,N-диметилформаид или смесь указанных растворителей.
В случае если упомянутые выше кислоты, применяемые при химическом восстановлении, представляют собой жидкости, можно также использовать их в качестве растворителя. Далее, подходящими растворителями, применяемыми при каталитическом восстановлении, могут быть упомянутые выше растворители и другие стандартные растворители, такие как диэтиловый эфир, диоксан, тетрагидрофуран и т.п. или их смесь.
Температура реакции не имеет большого значения; реакцию можно проводить как при охлаждении, так и при кипячении.
В условиях проведения этой реакции, если в качестве исходного соединения используется соединение Ii, в котором R - низшая алкильная группа, низшая алкенильная группа или низшая алкоксигруппа, каждая из которых замещена этерифицированной карбоксильной группой, аминогруппа, замещенная этерифицированной карбокси (низшей) алкильной группой, или нитрогруппой и/или жирная линия обозначает двойную связь, можно получить соединение Ij, в котором R - низшая алкильная группа, низшая алкенильная группа или низшая алкоксигруппая, каждая из которых замещена карбоксильной группой, аминогруппа, замещенная карбокси (низшей) алкильной группой, или аминогруппа, а жирная линия обозначает простую связь. Этот случай входит в объем притязаний по настоящему изобретению.
Исходные соединения II, IIIa, IIIb, IIIc, IIId и VII или их соли могут быть получены по следующим стадиям:
Стадия A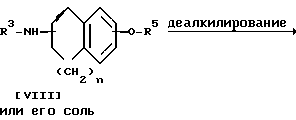
Стадия B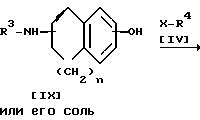
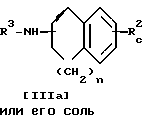
Стадия C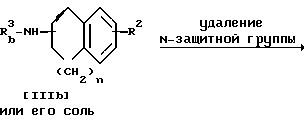
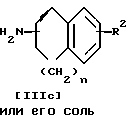
Стадия D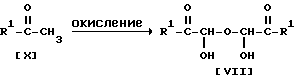
Стадия E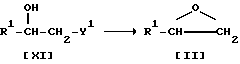
Стадия F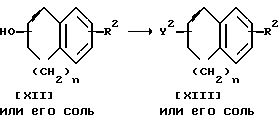
Стадия G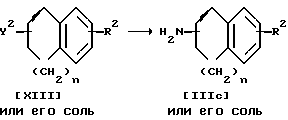
стадия H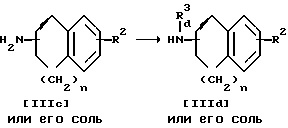
Стадия I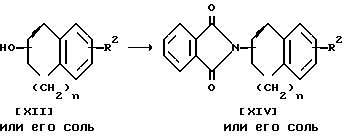
Стадия J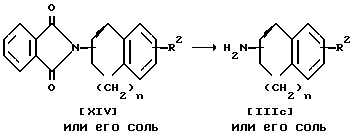
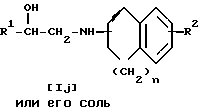
где R2, R2, R3, R3, R4, X и жирная линия имеют каждая то же значение, что и ранее;
R5 - низшая алкильная группа;
R3 c - атом водорода или низшая алкильная группа, дополнительно замещенная низшей алкилтиогруппой;
Y1 - кислотный остаток;
Y2 - низшая алкилсульфонилоксигруппа или арилсульфонилоксигруппа;
R3 d - N-защитная группа или низшая алкильная группа, дополнительно замещенная низшей алкилтиогруппой.
Указанные выше стадии получения исходных соединений детально поясняются ниже.
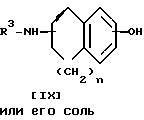
Стадия A.
Соединение IX или его соль можно получить, подвергнув соединение VIII или его соль реакции деалкилирования.
Подходящими солями соединения VIII могут быть соли присоединения неорганических и органических кислот, уже приведенные выше в качестве примера для соединения I.
Подходящими солями соединения IX могут быть те же соли, что и рассмотренные выше для соединения I.
Реакцию проводят в присутствии кислоты, в том числе кислоты Льюиса (например, соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, трехбромистого бора, треххлористого бора и т.п.) или три (низший алкил) силилиодида (например, триметилсилилиодида и т.п.).
Реакцию обычно проводят в таких растворителях, как вода, уксусная кислота, хлористый метилен, тетрагидрофуран, смесь указанных растворителей, либо в любом другом растворителе, который не оказывает вредного воздействия на ход реакции.
Далее, если упомянутые выше кислоты представляют собой жидкости, можно использовать их в качестве растворителя.
Температура реакции не имеет большого значения; реакцию можно проводить как при охлаждении, так и при кипячении.
Стадия B.
Соединение IIIa или его соль можно получить в результате взаимодействия соединения IX или его соли с соединением IV.
Подходящими солями соединения IIIa могут быть те же соли, что и рассмотренные выше для соединения I.
Когда при осуществлении этой реакции используют соединение IV, содержащее галоген в качестве заместителя X, то реакцию предпочтительно проводят в присутствии основания, такого как щелочной металл (например, литий, натрий, калий и т. п. , гидроксид или карбонат или бикарбонат щелочного металла (например, едкий натр, карбонат калия, бикарбонат калия и т.п.), щелочноземельный металл (например, кальций, магний и т.п.), гидрид щелочного металла (например, гидрид натрия и т. п. ), гидрид щелочноземельного металла (например, гидрид кальция, алкоксид щелочного металла например, метоксид натрия, этоксид натрия, трет-бутоксид калия и т.п.), алкоксид щелочноземельного металла (например, метоксид магния, этоксид магния и т.п.) или аналогичное основание, или в присутствии иодида щелочного металла (например, иодида натрия, иодида калия и т.п.) и указанного основания.
Далее, реакцию предпочтительно проводят в условиях катализа с переносом фазы (например в присутствии тетра-н-бутиламмонийбромида и т.п.).
Реакцию обычно проводят в таких стандартных растворителях, как тетрагидрофуран, диоксан, ароматические углеводороды (например, бензол, толуол, ксилол и т. п.), N,N-диметилфомамид, ацетон, смесь указанных растворителей или любой другой растворитель, который не оказывает вредного воздействия на ход реакции. Если соединение VI представляет собой жидкость, его можно использовать в качестве растворителя.
Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении.
Стадия C.
Соединение IIIc или его соль можно получить, подвергнув соединение IIIb или его соль реакции элиминирования N-защитной группы.
Подходящими солями соединения [IIIb] и [IIIc] могут быть те же соли, что и рассмотренные выше для соединения [I].
Эту реакцию можно осуществлять так же, как и стадию 8, поэтому сведения об условиях ее проведения (например, используемом растворителе, температуре процесса и т.п.) могут быть взяты из описания стадии 8.
Стадия D.
Соединение VII можно получить, подвергнув соединение X реакции окисления.
Подходящим окислительным агентом, используемым в этой реакции, может быть диоксид селена и т.п.
Реакцию обычно проводят в таких стандартных растворителях, как вода, диоксан, уксусный ангидрид или любой другой растворитель, который не оказывает вредного воздействия на ход реакции, или смесь указанных растворителей.
Температура реакции не имеет большого значения, реакцию обычно проводят при кипячении.
Стадия E.
Соединение II можно получить, подвергнув соединение XI реакции с основанием.
Подходящим основанием может быть щелочной металл (например, литий, натрий, калий и т.п.), гидроксид или карбонат или бикарбонат щелочного металла (например, едкий натр, карбонат калия, бикарбонат калия и т.п.), щелочноземельный металл (например, кальций, магний и т.п.), гидрид щелочного металла (например, гидрид натрия и т. п. ), гидрид щелочноземельного металла (например, гидрид кальция), алкоксид щелочного металла (например, метоксид натрия, этоксид натрия, трет-бутоксид калия и т.п.), алкоксид щелочноземельного металла (например, метоксид магния, этоксид магния и т.п.) или аналогичное основание.
Реакцию обычно проводят в стандартном растворителе, таком как вода, спирт (например, метанол, этанол и т.п.), диэтиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции, или смеси указанных растворителей.
Температура реакции не имеет большого значения; реакцию можно проводить как при охлаждении, так и при кипячении.
Стадия F.
Соединение XIII или его соль можно получить в результате взаимодействия соединения XII или его соли с низшим алкансульфонилгалогенидом или аренсульфонилгалогенидом.
Подходящими солями соединений XII и XIII могут быть соли присоединения неорганических и органических кислот, уже приведенных выше в качестве примера для соединения I.
Подходящими низшими алкансульфонилгалогенидами могут быть мезитилхлорид, этансульфонилбромид и т.п.
Подходящими аренсульфонилгалогенидами могут быть бензолсульфонилхлорид, тозилхлорид и т.п.
Реакцию предпочтительно проводят в присутствии основания, как это разъясняется при описании стадии I.
Реакцию обычно проводят в стандартном растворителе, таком как вода, спирт (например, метанол, этанол и т.п.), диэтиловый эфир, тетрагидрофуран, диоксан, пиридин, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции, или смеси указанных растворителей.
Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при нагревании.
Стадия G.
Соединение IIIc или его соль можно получить следующим способом, а именно: 1) на соединение XIII или его соль вначале действуют азидным соединением, а затем 2) подвергают полученный продукт каталитическому восстановлению.
Подходящими солями соединений IIIc и XIII могут быть те же соли, что и рассмотренные выше для соединения I.
Используемым на первом этапе азидным соединением может быть азид щелочного металла (например, азид натрия, азид калия и т.п.), азид щелочноземельного металла (например, азид кальция и т.п.), азид водорода и т.д. Реакцию обычно проводят в стандартном растворителе, таком как тетрагидрофуран, диоксан, диметилсульфоксид, N,N-диметилформамид, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции. Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении.
Второй этап этой реакции можно осуществлять так же, как и каталитическое восстановление, описанное на стадии 8, поэтому сведения о катализаторе, типе реакции и об условиях ее проведения (например, используемом растворителе, температуре процесса и т.п.) могут быть взяты из описания процесса каталитического восстановления, приведенного для стадии 8. Восстановление можно также проводить в присутствии комбинации палладиевого катализатора (например, палладиевой черни, палладия на угле и т.п.) и муравьиной кислоты или ее соли (например, формиата аммония и т.п.).
Стадия F.
Соединение IIId или его соль можно получить в результате взаимодействия соединения IIIc или его соли с N-защитным агентом или низшим алкилтио (низшим) алкилгалогенидом.
Подходящими солями соединений IIIc и IIId могут быть те же соли, что и рассмотренные выше для соединения I.
Подходящим N-защитным агентом может быть галогенпроизводное уже упомянутых N-защитных групп, такое как хлористый ацетил, хлористый трет-бутоксикарбонил, хлористый бензил, бромистый бензил и т.п.
Подходящим низшим алкилтио (низшим) алкилгалогенидом может быть метилтиометилхлорид, метилтиоэтилхлорид и т.п.
Реакцию обычно проводят в присутствии основания, как это описано для стадии I.
Реакцию обычно проводят в таких стандартных растворителях, как вода, спирт (например, метанол, этанол и т.п.), диоксан, тетрагидрофуран, пиридин или любой другой растворитель, который не оказывает вредного воздействия на ход реакции, или смеси указанных растворителей.
Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении.
Стадия I
Соединение XIV или соль его можно получить в результате взаимодействия соединения XII или его соли с фталимидом в присутствии трифенилфосфина и диэтил азодикарбоксилата.
Подходящими солями соединений XII и XIV могут быть те же соли, что и рассмотренные выше для соединения I.
Реакцию обычно проводят в стандартном растворителе, таком как диэтиловый эфир, тетрагидрофуран, диоксан, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции.
Температура реакции не имеет большого значения, реакцию предпочтительно проводят при комнатной температуре и как при нагревании, так и при кипячении.
Стадия J.
Соединение IIIc или его соль можно получить в результате взаимодействия соединения XIV или его соли с гидразином.
Подходящими солями соединений IIIc и XIV могут быть соли присоединения неорганических и органических кислот, уже приведенные выше в качестве примера для соединения I.
Реакцию обычно проводят в таких стандартных растворителях, как вода, спирт (например, метанол, этанол и т.п.), или любой другой растворитель, который не оказывает вредного воздействия на ход реакции, или смеси указанных растворителей.
Температура реакции не имеет большого значения; реакцию можно проводить при комнатной температуре и как при нагревании, так и при кипячении.
Соединения, получаемые по описанным выше процессам, можно выделять и очищать обычными методами, такими как распыление, перекристаллизация, колоночная хроматография, переосаждение и т.п., и превращать обычными способами, в случае необходимости, в требуемые соли.
Следует отметить, что соединение I и другие соединения могут включать, благодаря асимметричным атомам углерода, один или два стерео-изомера, и все такие изомеры или их смеси входят в объем притязаний по настоящему изобретению.
Заявляемое соединение I и его фармакологически приемлемые соли обладают по отношению к кишечнику селективной симпатомиметической активностью и активностью против учащенного мочеиспускания, и могут быть использованы для лечения и/или профилактики расстройства желудочно-кишечного тракта, вызванных сокращением гладких мышц человека или животных, а еще более конкретно, для лечения и/или профилактики спазма повышенной перистатики желудочно-кишечного тракта в случае синдрома раздражения кишечника, гастрита, язвы желудка, язвы двенадцатиперсной кишки, воспаление тонкой кишки, воспаления желчного пузыря, воспаления желчных протоков, мочекаменной болезни и т.п. и для лечения и/или профилактики расстройств мочеиспускания, таких как учащенное мочеиспускание, недержание мочи и т.п. в случае нервного учащенного мочеиспускания, нейрогенной дисфункции мочевого пузыря, ночной полиурин, нестабильного мочеиспускания, спазма мочевого пузыря, хронического цистита, хронического простатита и т.п. Ожидается также, что заявляемые соединения могут быть использованы в качестве терапевтических и/или профилактических средств против ожирения и глаукомы.
С целью проиллюстрировать полезность заявляемого соединения I, ниже приводятся фармакологические данные для соединения I.
Испытание 1. Воздействие на изолированную периферическую толстую кишку крыс
(а) Метод испытаний:
Используют самцов крыс разного возраста (вес 180 - 230 г). Перед проведением эксперимента животных не кормят в течение 24 часа. Периферическую толстую кишку удаляют сразу же после умерщвления животных и помещают в ванну, содержащую 25 мл раствора Tyrode, через который при 37oC продувается газовая смесь, содержащая 95% кислорода и 5% углекислого газа. Образец закрепляют под нагрузкой 0,5 г и спонтанные сокращения регистрируют изометрически. После того, как подвижность становится однородной, в ванну вводят тестируемое соединение и наблюдают сокращения в течение 30 минут. Эффект от воздействия тестируемого соединения оценивают, сравнивая сокращение до и после добавления тестируемого соединения.
(б) Результаты тестовых испытаний (см. табл.1).
Испытание 2. Воздействие на изолированную матку небеременных крыс
(а) Метод испытаний:
Используют самок крыс разного возраста (вес 150 - 180 г). За 48 и 24 час перед использованием крысам, чтобы вызвать течку, подкожно вводят эстрадиол (торговое название овагормон бензоат, Teikoku Hormone Mfg.Co.,Ltd) с дозой 40 микрограмм на одну крысу. Животных убивают и удаляют маточные рожки. Каждый образец под нагрузкой 1 г помещают в ванну, содержащую 25 мл раствора Locke, через который при 37oC продувается газовая смесь, содержащая 95% кислорода и 5% углекислого газа. Спонтанные сокращения регистрируют изометрически. После того, как спонтанные сокращения становятся однородными, в ванну вводят тестируемое соединение. Наблюдают подвижность в течение 20 минут. Эффект от воздействия тестируемого соединения оценивают, сравнивая сокращения до и после добавления тестируемого соединения.
(б) Результаты тестовых испытаний (см. табл. 2).
Для терапевтических целей соединение I и его фармакологически приемлемая соль по настоящему изобретению могут быть использованы в форме фармакологического препарата, содержащего в качестве активного ингредиента одно из указанных соединений в смеси с фармакологически приемлемым носителем, таким как органический или неорганический твердый, полутвердый или жидкий наполнитель, пригодный для орального, парентерального или наружного (местного) назначения. Фармацевтические препараты могут быть в виде капсул, таблеток, драже, гранул, свечь, растворов, лосьонов, ингалянтов, глазных препаратов, суспензий, эмульсий, мазей, гелей и т.п. При желании в эти препараты могут быть включены вспомогательные вещества, стабилизирующие агенты, смачивающие или эмульгирующие агенты, буферные смеси или другие обычно применяемые добавки.
Поскольку дозировка соединения I варьируется в зависимости от возраста и состояния пациента, средние дозы 0,1 мг, 1 мг, 10 мг, 50 мг, 100 мг, 250 мг, 500 мг и 1000 мг соединения I могут быть эффективными для лечения указанных болезней. В общем случае средняя суточная доза для одного человека составляет от 0,1 мг до 1000 мг.
Следующие препараты и примеры приводятся для пояснения настоящего изобретения.
Препарат 1.
К смеси 3-метокси-6,7,8,9-тетрагидро-5H-бензоцикло-гептен-6-она (3,6 г), бензиламина (2,5 мл) и уксусной кислоты (27 мл) при охлаждении на водяной бане прибавляют порциями цианоборгидрид натрия (0,49 г) и смесь перемешивают при комнатной температуре в течение 5 час. К смеси прибавляют дополнительное количество бензиламина (2,5 мл) и цианоборгидрида натрия (0,10 г) и перемешивание продолжают еще у течение 2 час. Реакционную массу подщелачивают (pH > 8) 10%-ным раствором едкого натра (150 мл) и один раз экстрагируют этилацетатом. Экстракт промывают насыщеным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, н-гексан-этилацетат, от 3: 1 к 2: 1 до 1:1), получая N-бензил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин (4,8 г) в виде масла.
ИК-спектр (пленка): 3320 см-1
ЯМР-спектр (хлороформ-d, δ): 1,3 - 2,2 (5H, мульт.), 2,6 - 3,0 (5H, мульт. ), 3,78 (3H, сингл.), 3,79 (1H, дубл., J = 13 Гц), 3,89 (1H, дубл., 13 Гц), 6,63 (1H, дублет дублетов, J=8 Гц), 6,73 (1H, дубл., J=2 Гц), 6,99 (1H, дубл., J = 8 Гц), 7,2 - 7,4 (5H, мульт.).
Масс-спектр (m/z): 281
Препарат 2.
Следующие соединения были получены по методике, аналогичной той, которая описана для препарата 1:
1) N-бензил-2-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин
ИК-спектр (пленка): 3320 см-1
ЯМР-спектр (хлороформ - d, δ): 1,2 - 2,2 (5H, мульт.), 2,6 - 3,0 (5H, мульт. ), 3,77 (3H, сингл.), 3,77 (1H, дубл., J= 13 Гц), 3,87 (1H, дубл., 13 Гц), 6,6 - 6,7 (2H, мульт.), 7,0 - 7,1 (1H, мульт.) 7,1 - 7,4 (5H, мульт.)
Масс-спектр (m/z) : 281
2) N-бензил-3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин
Т. пл. 64 - 68oC
ИК-спектр (Nujol): 1520; 1335 см-1
ЯМР-спектр (хлороформ-d, δ): 1,4-1,65 (1H, мульт.),
1,75 - 2,15 (3H, мульт.) 2,65 - 3,05 (5H, мульт.),
3,80 (1H, дубл., J = 13 Гц), 3,89 (1H, дубл, 13 Гц),
7,2 - 6,5 (6H, мульт.), 7,93 - 8,03 (2H, мульт.)
Масс-спектр (m/z): 296
3) N-метилтиоэтил-(7-нитро-1,2,3,4-тетрагидро-2-нафтил)амин
ИК-спектр (пленка): 3300, 1510, 1340 см-1
ЯМР-спектр (хлороформ-d, δ): 1,56 - 1,82 (1H, мульт.),
2,00 - 2,19 (1H, мульт.), 2,11 (3H, сингл.),
2,60 - 3,20 (9H, мульт.), 7,22 (1H, дубл., J = 9,1 Гц),
7,89 - 8,02 (2H, мульт.)
Препарат 3
Смесь N-бензил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амина (3,0 г) и 47%-ной бромистоводородной кислоты (106 мл) перемешивают при температуре 130oC в течение 1,5 час. После охлаждения реакционную массу упаривают в вакууме. К остатку прибавляют 28%-ный водный раствор аммиака и смесь экстрагируют один раз этилацетатом. Экстракт дважды промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, хлороформ-метанол, от 25:1 до 15:1), получая 8-бензиламино-6,7,8,9-тетрагидро-5H-бензоциклогептен - 2-ол (1,9 г) в виде масла, которое застывает при стоянии.
Т.пл. 87 - 89oC
ИК-спектр (Nujol): 3470 см-1
ЯМР-спектр (хлороформ - d, δ): 1,4 - 2,2 (4H, мульт.), 2,5 - 3,7 (7H, мульт. ), 3,80 (2H, сингл.), 6,4 - 6,6 (2H, мульт.) 6,8 - 7,0 (1H, мульт.) 7,1 - 7,4 (5H, мульт.)
Масс-спектр (m/z) : 267
Препарат 4.
Следующие соединения были получены по методике, аналогичной той, которая описана для препарат 3
1) 6-бензиламино-6,7,8,9-тетрагидро-5H-бензоциклогептен-2- ол.
Т. пл. 124 - 125oC
ИК-спектр (Nujol): 3280 см-1
ЯМР-спектр (хлорофор-d, δ): 1,4 - 2,2 (4H, мульт.),
2,2 - 3,6 (7H, мульт.), 3,78 (1H, дубл., J=13 Гц),
3,88 (1Н, дуб., J = 13 Гц), 6,4 - 6,6 (2H, мульт.),
6,9 - 7,0 (1H, мульт.), 7,2 - 7,4 (5H, мульт.)
Масс-спектр (m/z) : 267
2) 9-бензиламино-5,6,7,8,9,10-гексагидробензоциклооктен-2-ол
ИК-спектр (жидкость): 3280, 2680, 2580, 1605 см-1
ЯМР-спектр (хлороформ-d, δ): 1,1-1,8 (6H, мульт.), 2,5-3,0 (5H, мульт.), 3,87 (2H, сингл.), 6,54 (1H, дубл., J = 2,7 Гц), 6,61 (1H, дублет дублетов, J = 2,7 Гц, 8,1 Гц), 6,96 (1H, дубл., J = 8,1 Гц), 7,15-7,5 (5H, мульт.)
Масс-спектр (m/z) : 281
Препарат 5.
К охлаждаемому льдом раствору 8-бензиламино-6,7,8,9-тетрагидро- 5H-бензоциклогептен-2-ола (1,7 г) в толуоле (56 мл) прибавляют порциями гидрид натрия (60%-ная дисперсия в минеральном масле, 0,31 г). После того, как прибавление заканчивается, смесь перемешивают при 70oC в течение 1 час. После охлаждения прибавляют смесь этилбромацетата (0,81 мл) и тетра-н-бутиламмонийбромида (0,10 г) в толуоле (14 мл) и полученную массу перемешивают при 70oC в течение 4 час. После охлаждения смесь выливают в насыщенный водный раствор хлористого аммония и один раз экстрагируют этилацетатом. Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, хлороформ-этанол, от 25:1 к 5:1), получая - бензил-3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-амин (2,0 г) в виде масла).
ИК-спектр (пленка): 3600, 3300, 1750 см-1
ЯМР-спектр (хлороформ-d, δ): 1,29 (3H, трипл., J = 7 Гц), 1,3-2,2 (5H, мульт.), 2,6-3,0 (5H, мульт.), 3,78 (1H, дубл., J = 13 Гц), 3,88 (1H, дубл., J = 13 Гц), 4,26 (2H, кварт., J = 7 Гц), 4,58 (2H, сингл.), 6,61 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,76 (1H, дубл., J = 2 Гц), 6,98 (1H, дубл., J = 8 Гц), 7,0-7,4 (5H, мульт.)
Масс-спектр (m/z) : 353
Препарат 6.
Следующие соединения были получены по методике, аналогичной той, которая описана в препарате 5.
1) бензил-2-этоксикарбонилметокси-6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-амин
ИК-спектр (пленка): 3300, 1740 см-1
ЯМР-спектр (хлороформ-d, δ): 1,29 (3H, трипл., J = 7 Гц), 1,3-2,2 (5H, мульт.), 2,5-3,0 (5H, мульт.), 3,77 (1H, дубл., J = 13 Гц), 3,87 (1H, дубл., J = 13 Гц), 4,26 (2H, кварт., J = 7 Гц), 4,58 (2H, сингл.), 6,62 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,69 (1H, дубл., J = 2 Гц), 7,06 (1H, дубл., J = 8 Гц), 7,1 - 7,4 (5H, мульт.)
Масс-спектр (m/z) : 353
2) N-бензил-2-бис-(этоксикарбонил)метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин
ИК-спектр (пленка): 3320, 1740 см-1
ЯМР-спектр (хлороформ-d, δ): 1,29 (6H, трипл., J = 7 Гц), 1,38 (1H, шир. сингл. ), 1,4-1,6 (1H, мульт.), 1,6-2,1 (3H, мульт.), 2,5-2,9 (5H, мульт.), 3,7-3,9 (2H, мульт.), 4,30 (4H, кварт., J = 7 Гц), 5,15 (1H, сингл.), 6,66 (1H, дублет дублетов, J = 2 Гц), 7,05 (1H, дубл., J = 8 Гц), 7,1-7,4 (5H, мульт.)
Масс-спектр (m/z) : 426 (M+H)+
3) N-бензил-3-этоксикарбонилметокси-5,6,7,8,9,10-гексагидро-5H-бензоциклооктен-6-амин
ИК-спектр (пленка): 1750, 1600 см-1
ЯМР-спектр (хлороформ-d, δ): 1,1-2,0 (6H, мульт.), 1,29 (3H, трипл., J = 7,1 Гц), 2,6-3,0 (5H, мульт.), 3,85 (1H, дубл., J = 13,4 Гц), 3,93 (1H, дубл., J = 13,4 Гц), 4,25 (2H, кварт., J = 7,1 Гц), 4,57 (2H, сингл.), 6,6-6,8 (2H, мульт.), 6,95-7,1 (1H, мульт.), 7,2-7,55 (5H, мульт.)
Масс-спектр (m/z): 367
4) Этил-2-[8-(бензиламино)-6,7,8,9-тетрагидро-5H-бензоциклогептен- 2-илокси]пропионат
ИК-спектр (пленка): 3320, 1720, 1600 см-1
ЯМР-спектр (хлороформ-d, δ): 1,28 (3H, трипл., J = 7,0 Гц), 1,35-2,10 (4H, мульт.), 1,60 (3H, дубл., J = 6,8 Гц), 2,6-2,95 (5H, мульт.), 3,77 (1H, дубл. , J = 13 Гц), 3,87 (1H, дубл., J = 13 Гц), 4,20 (2H, кварт., J = 7,0 Гц), 4,70 (1H, кварт., J = 6,8 Гц), 6,56 (1H, дублет дублетов, J = 2,7 Гц, 8,2 Гц), 6,74 (1H, дубл., J = 2,7 Гц), 6,96 (1H, дубл., J = 7,2 Гц), 7,2-7,4 (5H, мульт.)
Препарат 7.
Смесь N-бензил-3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-амина (1,8 г), формиата аммония (3,2 г) 10%-ного палладия на угле (50% вл. 0,72 г) и этанола (50 мл) кипятят с обратным холодильником в течение 0,5 час. После охлаждения катализатор отфильтровывают и остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, хлороформ-этанол, мот 10: 1 до 5:1), получая 3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H-бензоциклогептен- 6-амин (1,2 г) в виде масла).
ИК-спектр (пленка): 3360, 1750 см-1
ЯМР-спектр (хлороформ-d, δ): 1,29 (3H, трипл., J = 7 Гц), 1,4-2,5 (6H, мульт.), 2,5-3,2 (5H, мульт.), 4,26 (2H, кварт., J = 7 Гц), 4,58 (2H, сингл. ), 6,62 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,75 (1H, дубл., J = 2 Гц), 6,98 (1H, дубл., J = 8 Гц)
Масс-спектр (m/z): 263
Препарат 8.
Следующее соединение было получено путем взаимодействия соединения, полученного по методике, аналогичной той, которая описана для препарата 7, с хлористым водородом.
2-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид
Т. пл. 151-156oC
ИК-спектр (Nujol): 3100-2000, 1740 см-1
ЯМР-спектр (MDMCO-d6, δ): 1,0-1,5 (1H, мульт.), 1,21 (3H, трипл., J = 7 Гц), 1,6-2,3 (3H, мульт. ), 2,5-3,2 (5H, мульт.), 4,16 (2H, кварт., J = 7 Гц), 4,72 (2H, сингл. ), 6,66 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,74 (1H, дубл., J = 2 Гц), 7,04 (1H, дубл., J = 8 Гц), 8,0-8,5 (3H, шир. сингл.)
Масс-спектр (m/z): 263 (M+ - HCl)
Препарат 9.
Следующее соединение было получено путем взаимодействия соединения, полученного по методике, аналогичной той, которая описана для препарата 1, с хлористым водородом.
N-бензил-3-метокси-5,6,7,8,9,10-гексагидробензоциклооктен-6-амин-гидрохлорид
Т. пл. 178-180oC
ИК-спектр (Nujol): 2640, 2575, 1600, 1580 см-1
ЯМР-спектр (DMCO-d6, δ ) 0,8-1,1 (1H, мульт.), 1,3-1,55 (1H, мульт.), 1,88-1,9 (4H, мульт. ), 2,55-2,8 (2H, мульт.), 2,95-3,3 (3H, мульт.), 3,72 (3H, сингл.), 4,27 (2H, мульт.), 6,7-6,85 (2H, мульт.), 7,0-7,1 (1H, мульт. ), 7,35-7,65 (5H, мульт.), 9,2-9,5 (1H, мульт.), 9,6-8,9 (1H, мульт.)
Препарат 10.
Следующие соединения были получены путем взаимодействия соединений, полученных по методике, аналогичной той, которая описана для препарата 5, с хлористым водородом.
1) N-бензил-2-пентилоксикарбонилметокси-6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-амин гидрохлорид
Т. пл. 188-193oC
ИК-спектр (Nujol): 1605, 1580 см-1
ЯМР-спектр (DMCO-d6, δ): 0,9 (3H, трипл., J = 7,0 Гц), 1,1-1,5 (5H, мульт. ), 1,6-2,1 (4H, мульт.), 2,25-2,45 (1H, мульт.), 2,6-3,3 (5H, мульт.), 3,91 (2H, трипл., J = 6,4 Гц), 4,1-5,3 (2H, мульт.), 6,68 (1H, дублет дублетов, J = 8,2 гц), 6,84 (1H, дубл., J = 2,5 Гц), 7,01 (1H, дубл., J = 8,2 Гц), 7,35-7,5 (3H, мульт.), 7,6-7,7 (2H, мульт.), 8,3-7,5 (2H, мульт.)
2) N-бензил-3-(2-оксопентилокси)-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид
Т. пл. 166 - 169oC
ИК-спектр (Nujol): 2425, 2375, 1715, 1610 см-1
ЯМР-спектр (DMCO-d6, δ): 0,87 (3H, трипл., J = 7,4 Гц), 1,05-1,4 (1H, мульт. ), 1,54 (2H, секст., J = 7,4 Гц), 1,8-2,1 (1H, мульт.), 2,3-2,45 (1H, мульт. ), 2,45-2,6 (2H, мульт.), 2,6-3,3 (5H, мульт.), 4,26 (2H, сингл.), 4,75 (2H, сингл.), 6,64 (1H, дублет дублетов, J = 2,6 Гц, 8,3 Гц), 6,84 (1H, дубл. , J = 2,6 Гц), 7,02 (1H, дубл., J = 8,3 Гц), 7,35-7,5 (3H, мульт.), 7,6-7,7 (2H, мульт.), 9,35-9,75 (2H, мульт.).
3) N-бензил-3-[(RS)-2-оксопентан-3-илокси)-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид
Т. пл. 162-166oC
ИК-спектр (Nujol): 2420, 2350, 1715, 1605 см-1
ЯМР-спектр (DMCO-d6, δ): 0,8-1,1 (3H, мульт.), 1,05-1,4 (1H, мульт.), 1,7-2,1 (4H, мульт.), 2,14 (3H, сингл.), 2,2-2,4 (1H, мульт.), 2,6-3,3 (5H, мульт.), 4,25 (2H, сингл.), 4,65 (1H, мульт.), 6,5-6,7 (1H, мульт.), 5,8-6,9 (1H, мульт.), 7,0-7,05 (1H, мульт.), 7,4-7,65 (5H, мульт.), 8,8-9,2 (2H, мульт.).
Масс-спектр (m/z): 351 (M-HCl)+
4) N-бензил-2-этоксикарбонилметокси-6,7-дигидро-5H-бензоциклогептен-7-амин гидрохлорид
Т. пл. 121,5-131oC
ИК-спектр (Nujol): 2750-2300, 1755, 1600-1570, 1200 см-1
ЯМР-спектр (DMCO-d6, δ): 1,21 (3H, трипл., J = 7,1 Гц), 2,16 (1H, мульт. ), 2,39 (1H, мульт. ), 2,7-2,95 (2H, мульт.), 4,02 (1H, мульт.), 4,1-4,25 (4H, мульт.), 4,76 (2H, сингл.), 6,11 (1H, дублет дублетов, J = 11,8 Гц, 3,4 Гц), 6,67 (1H, дубл., J = 11,8 Гц), 6,78 (1H, дублет дублетов, J = 8,3 Гц, 2,6 Гц), 6,89 (1H, дубл., J = 2,6 Гц), 7,14 (1H, дубл., J = 8,3 Гц), 7,4-7,45 (3H, мульт.), 7,55-7,65 (2H, мульт.), 9,7 (2H, шир.).
Масс-спектр (m/z): 351 (M+), 244 (Основной), 91
5) (S)-бензил-2-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-амин-гидрохлорид
Т. пл. 129-130oC
[α]
ИК-спектр (Nujol): 3500, 3420, 1730 см-1
ЯМР-спектр (DMCO-d6, δ): 1,1-1,4 (1H, мульт.), 1,21 (3H, трипл, J = 7 Гц), 1,7-2,1 (2H, мульт. ), 2,2-2,4 (1H, мульт.), 2,6-2,8 (2H, мульт.), 2,8-3,3 (3H, мульт. ), 4,17 (2H, кварт., J = 2 Гц), 4,2-4,4 (2H, мульт.), 4,72 (2H, сингл. ), 6,67 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,86 (1H, дубл. , J = 2 Гц), 7,04 (1H, дубл., J = 8 Гц), 7,3-7,5 (3H, мульт.), 7,5-7,7 (2H, мульт.), 9,2-9,6 (2H, шир. мульт.)
Масс-спектр (m/z): 353
6) (R)-бензил-2-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид
Т. пл. 129-131oC
[α]
ИК-спектр (Nujol): 3550 - 3100, 1730 см-1
ЯМР-спектр (DMCO-d6, δ): 1,1 - 1,4 (1H, мульт.), 1,21 (3H, трипл., J = 7 Гц), 1,8 - 2,2 (2H, мульт.), 2,3 - 2,5 (1H, мульт.), 2,6 -2,8 (2Н, мульт.), 2,8 - 3,3 (3Н, мульт.), 4,17 (2H, кварт., J = 2 Гц), 4,2 - 4,4 (2H, мульт.), 4,72 (2H, сингл. ), 6,67 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,86 (1H, дубл. , J = 2 Гц), 7,03 (1H, дубл., J = 8 Гц), 7,4 - 7,5 (3H, мульт.), 7,6 - 7,8 (2H, мульт.), 9,2 - 9,8 (2H, шир. мульт.)
Масс-спектр (m/z): 353
Препарат 11.
К смеси 8-бензиламино-6,7,8,9-тетрагидро-5H-бензоциклогептен-2- ола (970 мг) и 1,1,1-трихлор-2-метил-2-пропанолгидрата (1,28 г) в ацетоне 30 мл прибавляют порциями порошок KOH (1,71 г) и полученную смесь перемешивают при комнатной температуре в течение 20 час. После удаления растворителя в вакууме остаток выливают в 1N раствор едкого натра (30 мл) и моют диэтиловым эфиром pH водного слоя доводят до 6,0 с помощью 3N раствора соляной кислоты. Выделившийся осадок отфильтровывают. Фильтрат упаривают в вакууме и к остатку прибавляют воду. Полученный осадок выделяют фильтрованием и сушат, получая 2-[8-бензиламино-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-илокси] -2-метилпропионовую кислоту (0,51 г.)
Т. пл. 187 - 189oC
ИК-спектр (Nujol): 3450, 1600 см-1
ЯМР-спектр (NaOD, δ): 1,20 - 1,45 (1H, мульт.), 1,48 (6H, сингл.), 1,5 - 2,0 (3H, мульт.), 2,45 - 2,95 (5H, мульт.), 3,65 - 3,9 (2H, мульт.), 6,6 - 6,8 (2H, мульт.), 6,95 - 7,05 (1H, мульт.), 7,2 - 7,4 (5H, мульт.).
Масс-спектр (m/z): 354 (M + 1)+
Препарат 12.
Хлористый тионил (0,2 мл) прибавляют при -10oC и при перемешивании к этанолу (5 мл). Через 10 минут к смеси порциями прибавляют 2-[8-бензиламино-6,7,8,9-тетрагидро-5H-бензоциклогептен- 2-илокси] -2-метилпропионовую кислоту (0,49 г). Реакционную массу перемешивают при комнатной температуре в течение 1 час, затем кипятят с обратным холодильником в течение 3 час. После охлаждения смесь выливают в водный раствор дикарбоната натрия и экстрагируют этилацетатом. Экстракт промывают водой, сушат над сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-метанол (100 : 1), и получают этил 2-[8-бензиламино-6,7,8,9-тетрагидро-5H- бензоциклогептен-2-илокси]-2-метилпропионат (0,43 г.)
ИК-спектр (жидкость): 1725, 1600 см-1
ЯМР-спектр (хлороформ-d6, δ): 1,25 (3H, трипл., J = 7 Гц), 1,35 - 1,55 (1H, мульт. ), 1,57 (6H, сингл.), 1,65 - 2,1 (3H, мульт.), 2,6 - 2,9 (5H, мульт.), 3,76 (1H, дубл., J = 13 Гц), 3,87 (1H, дубл., J = 13 Гц), 4,22 (2H, кварт. , J = 7,1 Гц), 6,55 (1H, дублет дублетов, J = 2,6 Гц, 8,2 Гц), 6,71 (1H, дубл., J = 2,6 Гц), 6,92 (1H, дубл., J = 8,2 Гц), 7,2 - 7,35 (5H, дмульт.)
Масс-спектр (m/z): 381
Препарат 13.
К суспензии метилтрифенилфосфонийбромида (4,2 г) в тетрагидрофуране (10 мл) при охлаждении в бане со льдом порциями прибавляют трет-бутоксид калия (1,34 г). По завершении прибавления баню со льдом убирают и смесь перемешивают при комнатной температуре в течение 2,5 час. Затем к смеси прибавляют 7-метокси-1-тетралон (1,78 г) и смесь дополнительно перемешивают еще в течение 30 минут. Выливают в ледяную воду, туда же затем прибавляют н-гексан. Выпавшие осадки отфильтровывают и промывают н-гексаном. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток растирают с гексаном и отфильтровывают. Фильтрат упаривают в вакууме и получают 1-метилен-7-метокси-1,2,3,4-тетрагидронафталин (1,69 г) в виде масла.
ИК-спектр (пленка): 3080, 1620 (широкая полоса), 1600 см-1
ЯМР-спектр (DMCO-d6, δ): 1,6 - 1,9 (2H, мульт.), 2,4 - 2,6 (2H, мульт.), 2,71 (2H, триплетоподоб., J = приб. 6 Гц), 3,74 (3H, сингл.), 4,96 (1H, дубл., J = 1 Гц), 6,78 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 7,03 (1H, дубл., J = 8 Гц), 7,16 (1H, дубл., J = 2 Гц).
Масс-спектр (m/z): 175
Препарат 14.
К раствору нитрата таллия (2,4 г) в метаноле (24 мл) прибавляют в одну порцию раствор 1-метилен-7-метокси-1,2,3,4-тетрагидронафталина (1,0 г) в метаноле (7 мл).
Смесь перемешивают в течение 1 минуты и разбавляют хлороформом (24 мл). Образовавшийся осадок отфильтровывают и фильтрат промывают насыщенным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (элюент - н-гексан: этилацетат, 8 : 1) и получают 3-метокси-1,2,3,4-тетрагидро-5H-бензоциклогептен-6-он (0,78 г).
Т.пл. 50 - 52oC
ИК-спектр (пленка): 1700 см-1
ЯМР-спектр (хлороформ -d6, δ ) 1,8 - 2,1 (2H, мульт.), 2,56 (2H, триплетоподобн., J = прибл. 7 Гц), 2,8 - 3,0 (2H, мульт.), 3,68 (2H, сингл.), 3,78 (3H, сингл.), 6,7 - 6,8 (2H, мульт.), 7,0 - 7,1 (1H, мульт.)
Масс-спектр (m/z): 190
Препарат 15.
(S)-3-Метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин- гидрохлорид (35,5 г) нейтрализуют холодным 2N раствором едкого натра (155 мл) и смесь один раз экстрагируют этилацетатом (310 мл). Экстракт промывают один раз насыщенным раствором соли (155 мл), сушат над безводным сульфатом натрия, упаривают в вакууме и получают (S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин (30,1 г). Смесь (S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амина (30,1 г) 10%-ного палладия на угле (50% вл., 5,96 г) уксусной кислоты (0,89 мл), бензальдегида (31,6 мл) и этанола (300 мл) перемешивают при комнатной температуре в течение 3 час. После этого к смеси подают водород и перемешивают еще в течение 1,5 час. Катализатор отфильтровывают и промывают этанолом. Удаление растворителя в вакууме позволяет получить остаток, который растворяют в этилацетате (423 мл). К полученному раствору при механическом перемешивании и при охлаждении на водяной бане прибавляют 4N раствор хлористого водорода в этилацетате (77 мл). После перемешивания при комнатной температуре в течение 1,5 ч. смесь отфильтровывают и кристаллы на фильтре промывают этилацетатом (50 мл). Полученный продукт сушат в вакууме и получают (S)-N-бензил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид (47,3 г) в виде кристаллов белого цвета.
Т. пл. 223 - 224oC
[α]
ИК-спектр (Nujol): 3050 - 2100, 1600, 1570 см-1
ЯМР-спектр (DMCO-d6, δ): 1,1 - 1,4 (1H, мульт.), 1,8 - 2,1 (2H, мульт.), 2,3 - 2,5 (1H, мульт.), 2,6 - 2,8 (2H, мульт.), 2,8 - 3,0 (1H, мульт.), 3,0 - 3,3 (2H, мульт. ), 3,72 (3H, сингл.), 4,26 (2H, шир. сингл.), 6,69 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,84 (1H, дубл., J = 2 Гц), 7,03 (1H, дубл. , J = 8 Гц), 7,3 - 7,5 (3H, мульт.), 7,6 - 7,8 (2H, мульт.), 9,3 - 9,8 (2H, шир. мульт.).
Масс-спектр (m/z): 281
Препарат 16.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 15.
(R)-N-бензил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид
Т. пл. 223 - 224oC
[α]
ИК-спектр (Nujol): 3100 - 2100, 1610, 1580 см-1
ЯМР-спектр (DMCO-d6, δ): 1,0 - 1,4 (1H, мульт.), 1,8 - 2,1 (2H, мульт.), 2,3 - 2,5 (1H, мульт.), 2,6 - 2,8 (2H, мульт.), 2,8 - 3,0 (1H, мульт.), 3,0 - 3,3 (2H, мульт. ), 3,72 (3H, сингл.), 4,2 - 4,4 (2H, мульт.), 6,69 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,84 (1H, дубл., J = 2 Гц), 7,03 (1H, дубл. , J = 8 Гц), 7,3 - 7,5 (3H, мульт.), 7,6 - 7,8 (2H, мульт.), 9,3 - 9,8 (2H, шир. мульт.).
Масс-спектр (m/z): 281
Препарат 17.
1) К суспензии (S)-N-бензил-3-метокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-амин гидрохлорида (46,8 г) в дихлорметане (147 мл) при -10oC по каплям в течение 50 минут прибавляют 1М раствор трехбромистого бора в дихлорметане (294 мл), позволяя смеси в течение указанного времени нагреваться до температуры 10oC. По окончании прибавления дают смеси нагреваться до комнатной температуры и перемешивают так, чтобы общее время перемешивания составило 3 час. Растворитель почти полностью упаривают в вакууме и оставшуюся смесь быстро охлаждают в бане со льдом смесью воды (600 мл) и этилацетата (450 мл). Доводят pH смеси до 8,0, прибавляя сначала твердый бикарбонат натрия (74 г), а затем 1N раствор едкого натра (60 мл).
Слои отделяют друг от друга и водный слой дополнительно один раз экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли (300 мл), сушат над безводным сульфатом натрия и упаривают в вакууме.
2) Полученный остаток растворяют в этилацетате (377 мл) и обрабатывают при охлаждении на водной бане 4N раствором хлористого водорода в этилацетате (73 мл). После перемешивания при комнатной температуре в течение 1 час, смесь отфильтровывают и осадок на фильтре промывают этилацетатом (45 мл). Продукт сушат в вакууме, получая (S)-8-бензиламино-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ол гидрохлорид (43,3 г) в виде белых кристаллов.
Т. пл. 232 - 233oC
[α]
ИК-спектр (Nujol): 32200, 2380 см-1
ЯМР-спектр (DMCO-d6, δ): 1,0 - 1,4 (1H, мульт.), 1,7 - 2,1 (2H, мульт.), 2,2 - 2,4 (1H, мульт.), 2,5 - 2,7 (2H, мульт.), 2,8 - 3,2 (3H, мульт.), 4,24 (2H, шир. сингл.), 6,52 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,67 (1H, дубл. , J = 2 Гц), 6,89 (1H, дубл., J = 8 Гц), 7,3 - 7,5 (3H, мульт.), 7,5 - 7,7 (2H, мульт.), 9,2 - 9,5 (2H, шир. мульт.), 9,24 (1H, сингл.).
Масс-спектр (m/z): 267
Препарат 18.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 17-1).
(R)-8-бензиламино-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ол
Масс-спектр (m/z) : 267
Препарат 19.
К смеси (S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорида (энантиомерный избыток 54% по данным хиральной HPLC хроматографии 13,8 г) N-бензилоксикарбонил-D-лейцина (20,9 г), N-оксибензотриазола (10,6 г) и N,N-диметилформамида (276 мл) прибавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (12,2 г). После перемешивания в течение 3 час при комнатной температуре смесь упаривают в вакууме. Остаток разбавляют хлористым метиленом и последовательно моют водой, 3N раствором соляной кислоты, насыщенным водным раствором бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Перекристаллизацией остатка из этилацетата получают сырой продукт, который далее очищают перекристаллизацией из этанола, получая смеси диастереомеров (6R) и (6S)-N-N-бензилоксикарбонил-D-лейцил)-3-метокси-6,7,8,9-тетрагидро-5H- бензоциклогептена-6-амина (15,0 г)
Т. пл. 158-159oC
ИК-спектр (Nujol): 3300, 1680, 1640 см-1
ЯМР-спектр (хлороформ-d, δ): 0,87 (12H, дубл., J = 6 Гц), 1,3 - 1,8 (12H, мульт. ), 1,8 - 2,0 (4H, мульт.), 2,6 - 3,1 (8H, мульт.), 3,74 (3H, сингл. ), 3,75 (3H, сингл.), 3,9 - 4,3 (4H, мульт.), 4,9 - 5,2 (4H, мульт.), 5,5 - 5,7 (1H, мульт.), 5,7 - 5,9 (1H, мульт.), 6,6 - 6,75 (4H, мульт.), 6,9 - 7,1 (2H, мульт.), 7,2 - 7,5 (10H, мульт.).
Масс-спектр (m/z) ; 438
Препарат 20.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 19.
(6R)- и (6S)-N-(N-бензилоксикарбонил-L-лейцил)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин
Т. пл. 168-173oC
ИК-спектр (Nujol): 3280, 1685, 1635 см-1
ЯМР-спектр (хлороформ-d, δ): 0,87 (12H, дубл., J = 6 Гц), 1,3 - 1,8 (12H, мульт. ), 1,8 - 2,0 (4H, мульт.), 2,6 - 3,1 (8H, мульт.), 3,74 (3H, синг. ), 3,75 (3H, синг.), 3,9 - 4,3 (4H, мульт.), 4,9 - 5,25 (5H, мульт.), 5,6 - 5,9 (1H, мульт.), 6,55 - 6,75 (4H, мульт.), 6,9 - 7,1 (2H, мульт.), 7,2 - 7,4 (10H, мульт.).
Препарат 21.
Смесь (6R)- и (6S)-N-(N-бензилоксикарбонил-D-лейцил)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амина (6R: 6S = 77:23, 20 г) формиата аммония (11,5 г) 10%-ного палладия на угле (50% вл, 4,0 г) и этанола (450 мл) кипятят с обратным холодильником в течение 0,5 час. После охлаждения катализатор отделяют фильтрованием и промывают этанолом. Фильтрат и промывочные растворы объединяют и упаривают в вакууме. Остаток разбавляют этилацетатом, моют насыщенными растворами бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая смесь диастереомеров (6R)- и (6S)-N-D-лейцил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амина (13,5 г).
Оптическое расщепление диастереомеров проводят перекристаллизацией из ди-изо-пропилового эфира, получая (6R)-изомер (7,0 М 92,8 диастереомерный избыток по данным HPLC). Дополнительное количество продукта (1,8 г 91,6% диастереомерный избыток) получают из маточного раствора после удаления растворителя с последующей перекристаллизацией из ди-изо-пропилового эфира. Следующую порцию продукта (0,61 г, 92,3% диастериомерный избыток) получают из второго маточного раствора после колоночной хроматографии на силикагеле (20 - 400 меш, градиентное элюирование, сначала хлороформ изо-пропанол, от 50: 1 до 25:1, затем изо-пропанол) с последующей перекристаллизацией из ди-изопропилового эфира. Все полученные серые образцы (6R)-изомера (9,4 г) объединяют и вновь очищают перекристаллизацией из диизо-пропилового эфира, получая (6R)-N-D-лейцил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин (7,9 г, 95,2% диастериомерный избыток).
Т.пл. 117 - 118oC
[α]
ИК-спектр (Nujol): 3380, 3320, 1610 см-1
ЯМР-спектр (хлороформ-d, δ): 0,8 - 1,0 (6H, мульт.), 1,2 - 1,4 (1H, мульт. ), 1,47 (2H, шир. сингл. ), 1,5 - 1,8 (4H, мульт.), 1,8 - 2,1 (2H, мульт. ), 2,7 - 2,8 (2H, мульт.), 2,8 - 3,1 (2H, мульт.), 3,2 - 3,4 (1H, мульт. ), 3,76 (3H, сингл.), 4,0 - 4,2 (1H, мульт.), 6,6 - 6,7 (2H, мульт.), 6,9 - 7,1 (2H, мульт.).
Масс-спектр (m/z) : 304
Препарат 22.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 21.
(6S)-N-L-лейцил-3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен -6-амин
Т. пл. 117 - 118oC
[α]
ИК-спектр (Nujol): 3380, 3320, 1610 см-1
ЯМР-спектр (хлороформ-d, δ): 0,8 - 1,0 (6H, мульт.), 1,2 - 1,4 (1H, мульт. ), 1,33 (2H, шир. сингл. ), 1,5 - 1,8 (4H, мульт.), 1,8 - 2,1 (2H, мульт. ), 2,7 - 2,8 (2H, мульт.), 2,8 - 3,1 (2H, мульт.), 3,2 - 3,4 (1H, мульт. ), 3,76 (3H, сингл.), 4,0 - 4,2 (1H, культ.), 6,6-6,7 (2H, мульт.), 6,9 - 7,1 (2Н, мульт.).
Масс-спектр (m/z) : 304
Препарат 23.
Смесь (6R)-N-D-лейцил-3-метокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-амина (8,0 г) и 47%-ной бромистоводородной кислоты (262 мл) перемешивают при 150oC в течение 15,5 час. После охлаждения до комнатной температуры реакционную смесь оставляют на ночь в холодильнике. Выпавший осадок отделяют, промывают ди-изо-пропиловым эфиром и сушат, получая гидробромид целевого продукта (2,9 г). Эту соль нейтрализуют 28%-ным водным раствором аммиака и упаривают полученную смесь в вакууме. Остаток разбавляют насыщенным водным раствором бикарбоната натрия и экстрагируют три раза н-бутанолом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая (R)-8-амино-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ол. Полученные продукт, по данным ЯМР и ИК-спектроскопии, загрязнен бромистым аммонием, но может быть без дальнейшей очистки использован на следующей стадии. Дополнительно количество продукта (3,46 г), который также загрязнен бромистым аммонием, получают из маточника по аналогичной обработке, как описано выше. Физические данные приведены для гидробромида целевого продукта.
Т. пл. 298 - 299oC.
[α]
ИК-спектр (Nujol): 3400, 1610, 1580 см-1
ЯМР-спектр (DМСО-d6, δ): 1,1 - 2,2 (4H, мульт.), 2,5 - 3,2 (5H, мульт.), 6,4 - 6,6 (2H, мульт.), 6,85 - 6,95 (1H, мульт.), 7,85 (3H, шир. сингл.), 9,20 (1H, сингл.).
Масс-спектр (m/z): 177
Препарат 24.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 23.
(S)-8-амино-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ол гидробромид
Т. пл. 297 - 299oC
[α]
ИК-спектр (Nujol): 3400, 1610, 1580 см-1
ЯМР-спектр (DМСО-d6, δ): 1,1 - 2,2 (4H, мульт.), 2,5 - 3,2 (5H, мульт.), 6,4 - 6,6 (2H, мульт.), 6,85 - 6,95 (1H, мульт.), 7,85 (3H, шир. сингл.), 9,20 (1H, сингл.).
Масс-спектр (m/z): 177
Препарат 25.
Смесь (R)-8-амино-6,7,8,9-тетрагидро-5H-бензоциклогептен-3-ола (5,8 г загрязнен бромистым аммонием), бензальдегида (5,3 мл), уксусной кислоты (0,15 мл) 10%-ного палладия на угле (50% вл. 1,1 г) и этанола перемешивают под давлением водорода в течение 1 часа, а затем прибавляют дополнительное количество бензальдегида (5,3 мл). После перемешивания в течение 0,5 часа. пускают через смесь ток водорода и перемешивание продолжают еще в течение 3 час. К реакционной массе прибавляют дополнительную порцию уксусной кислоты (0,15 мл) и смесь перемешивают под давлением водорода 1 атм еще в течение 1 час. Катализатор отфильтровывают и промывают этанолом. Удаляя растворитель в вакууме, получают остаток, который разбавляют этилацетатом, моют насыщенными растворами бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, сначала хлороформ, затем хлороформ-метанол, от 100 : 1, к 50:1 до 10:1), получая (R)-8-бензиламино-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ол (6,6 г). Физические данные приведены для гидрохлорида целевого продукта, который перекристаллизовывают из смеси ди-изо-пропиловый эфир-этанол (3:1).
Т. пл. 234 : 235oC
[α]
ИК-спектр (Nujol): 3250, 2400 см-1
ЯМР-спектр (DМСО-d6, δ): 1,0 - 1,4 (1H, мульт.), 1,7 - 2,1 (2H, мульт.), 2,2 - 2,4 (1H, мульт.), 2,5 - 2,7 (2H, мульт.), 2,8 - 3,2 (3H, мульт.), 4,24 (2H, шир. сингл. ), 6,52 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,67 (1H, дубл. , J = 2 Гц), 6,89 (1H, дубл., J = 8 Гц), 7,3 - 7,4 (3H, мульт.), 7,5 - 7,7 (2H, мульт.), 9,2 - 9,5 (2H, шир. мульт.), 9,24 (1H, сингл.).
Масс-спектр (m/z): 267
Препарат 26.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 25.
(S)-8-Бензиламино-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ол гидрохлорид
Т. пл. 233 - 235oC
Препарат 27.
Смесь N-бензил-3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен -6-амина (2,8 г), муравьиной кислоты (8 мл) и уксусного ангидрида (16 мл) перемешивают при комнатной температуре в течение 15 час. Реакционную часть выливают в водный раствор бикарбоната натрия и дважды экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом натрия и упаривают, получая N-бензил-N-формил-3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин (2,71 г)
Т. пл. 126 - 128oC
ИК-спектр (Nujol): 1650, 1510 см-1
ЯМР-спектр (хлороформ-d, δ): 1,20 - 1,50 (1H, мульт.), 1,85 - 2,40 (3H, мульт.), 2,60 - 2,95 (3H, мульт.), 3,15 - 3,70 (2H, мульт.), 4,36 (0,5H, дубл. , J = 15,5 Гц), 4,49 (0,5H, дубл., J = 15 Гц), 4,52 (0,5H, дубл., J = 15,5 Гц), 4,76 (0,5H, дубл., J = 15 Гц), 7,10 - 7,47 (6H, мульт.), 7,65 - 7,78 (1H, мульт. ), 7,90 - 8,15 (1H, мульт.), 8,31 (0,5H, сингл.), 8,42 (0,5H, сингл.).
Масс-спектр (m/z): 324
Препарат 28.
N-Бензил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид (6,0 г) нейтрализуют 7%-ным раствором аммиака и смесь дважды экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая масло (54,29 г. ). Масло растворяют в 1-пропаноле (10 мл) и полученный раствор прибавляют к горячему раствору D-(-)-винной кислоты (3,1 г) в 1-пропаноле (50 мл). После охлаждения выпавшие кристаллы отфильтровывают и перекристаллизовывают дважды с дополнительным количеством D-(-)винной кислоты (сначала 0,7 г, затем 68 мг) из 1-пропанола, получая (S)-N-бензил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин (D)тартрат (1: 1) (1,7 г). Энантиомерный избыток (100%) определяют на двух хиральных колонках (CHIRALCEL, OD). Условия HPLC хроматографии - элюент: гексан-2-пропанол (9:1), скорость потока жидкости 0,6 мл/мин, температура колонки 25oC, контролируемая длина волны 220 нм. Время удерживания составляет 24,6 минут.
Т. пл. 152 - 153oC
[α]
ИК-спектр (Nujol): 3520, 3300, 1730, 1620 см-1
ЯМР-спектр (DМСО-d6, δ): 1,1 - 1,4 (1H, мульт.), 1,65 - 2,05 (2H, мульт. ), 2,1 - 2,3 (1H, мульт.), 2,55 - 3,15 (5H, мульт.), 3,71 (3H, сингл.), 3,99 (2H, сингл.), 4,07 (1H, дубл., J = 14,5 Гц), 4,17 (1H, дубл., J = 13,5 Гц), 6,66 (1H, дублет дублетов, J = 2,7 Гц, 8,2 Гц), 6,80 (1H, дубл., J = 2,7 Гц), 7,00 (1H, дубл., J = 8,2 Гц), 7,3 - 7,6 (5H, мульт.).
Препарат 29.
Смесь N-бензил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амина (68,7 г) формиата аммония (68,15 г) и 10%-ного палладия на угле (50% вл. 6,8 г) в этаноле (1,2 л) кипятят с обратным холодильником в течение 1 час. После охлаждения катализатор отфильтровывают и растворитель удаляют в вакууме. К остатку прибавляют воду и 28%-ный водный раствор аммиака и полученную смесь экстрагируют этилацетатом. Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая 3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин (35,8 г) в виде масла.
ЯМР-спектр (хлороформ-d, δ): 1,38 - 2,10 (4H, мульт.), 1,45 (2H, шир.сингл. ), 2,6 - 3,06 (5H, мульт.), 3,77 (3H, сингл.), 6,64 (1H, дублет дублетов. , J = 2,7 Гц, 8,1 Гц), 6,71 (1H, дубл., J = 2,7 Гц), 6,98 (1H, дубл., J = 8,1 Гц).
Масс-спектр (m/z): 191
Препарат 30.
Следующее соединение было получено путем взаимодействия соединения, полученного по методике, аналогичной той, которая описана для препарата 29, с хлористым водородом.
3-этоксикарбонилметокси-5,6,7,8,9-10-гексагидробензоциклооктен-6- амин гидрохлорид
ИК-спектр (хлороформ-d): 1760, 1600 см-1
ЯМР-спектр (DМСО-d, δ): 0,9 - 1,9 (6H, мульт.), 1,21 (3H, трипл., J = 7,1 Гц), 2,5 - 3,6 (5H, мульт.), 4,17 (2H, кварт., J = 7,1 Гц), 4,73 (2H, сингл.), 6,7 - 6,9 (2H, мульт.), 7,01 (1H, мульт.), 8,20 (3H, шир.сингл.).
Масс-спектр (m/z): 277 (M - HCl)+
Препарат 31.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 29.
2-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H-безоциклогептен-7-амин
ИК-спектр (пленка): 3610, 3360, 3300, 3180, 1755, 1610, 1580, 1205, 1180 см-1
ЯМР-спектр (хлороформ-d, δ): 1,15 - 1,3 (2H, мульт.), 1,30 (3H, трипл., J = 7,1 Гц), 1,41 (2H, шир.сингл.), 2,0 - 2,15 (2H, мульт.), 2,65 - 2,75 (4H, мульт. ), 2,9 - 3,05 (1H, мульт.), 4,27 (2H, кварт., J = 7,1 Гц), 4,59 (2H, сингл. ), 6,62 (1H, дублет дублетов., J = 8,2 Гц, 2,6 Гц), 6,72 (1H, дубл., J = 2,6 Гц), 7,01 (1H, дубл., J = 8,2 Гц).
Масс-спектр (m/z): 263 (M+), 248, 246, 161 (осн.)
Препарат 32.
К горячему раствору D-миндальной кислоты (25,65 г) в этилацетате (300 мл) прибавляют раствор 3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амина (35,8 г) в этилацетате (150 мл). После охлаждения выпавшие кристаллы отфильтровывают и перекристаллизовывают из смеси этилацетат-этанол (2:1) и получают (R)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин (D)-миндалят (23,4 г). Энантиомерный избыток (54%) определяют на хиральной колонке (ULTRON ES-OVМ). Условия HPLC хроматографии - элюент : буферный 0,02 М раствор фосфорной кислоты - ацетонитрил (9:1), скорость потока жидкости 1,0 мл/мин, температура колонки 25oC, контролируемая длина волны 220 нм. Время удерживания составляет 11,8 минут. Оба фильтрата объединяют и упаривают в вакууме. Остаток превращают в его (L)-миндалят обычным способом. Кристаллы перекристаллизовывают из смести этилацетат-этанол (2:1) и получают (S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин (L)-миндалят (17,98 г). Энантиомерный избыток (70%) определяют на той же колонке и в тех же условиях. Время удерживания составляет 7,9 минут.
Препарат 33.
Раствор бензиламина (8,18 г) в бензоле (100 мл) прибавляют по каплям в течение 20 минут к суспензии 8,9-дигидро-3-нитро-5H-бензоциклогептен-5-она (15,51 г. ) в этаноле (155 мл) при комнатной температуре. Полученную смесь перемешивают при указанной температуре в течение 3,5 час, оставляют при той же температуре на ночь и отфильтровывают. Фильтрат упаривают, получая 7-бензиламино-3-нитро-6,7,8,9- тетрагидро-5H-бензоциклогептен-5-он (25,41 г.) в виде темно-коричневого масла.
ИК-спектр (пленка): 3330, 1680, 1515, 1350 см-1
ЯМР-спектр (хлорформ-d, δ): 1,75 - 1,95 (2H, мульт.), 2,1 - 2,3 (1H, мульт.), 2,9 - 3,15 (3H, мульт.), 3,2 - 3,4 (2H, мульт.), 3,81 (1H, дубл., J = 13,2 Гц), 3,91 (1H, дубл., J = 13,2 Гц), 7,25 - 7,45 (6H, мульт.), 8,23 (1H, дублет дублетов, J = 8,2 Гц, 2,4 Гц), 8,60 (1H, дубл., J = 2,4 Гц).
Препарат 34.
Водный раствор (92 мл) боргидрида натрия (18,29 г) прибавляют по каплям при комнатной температуре к перемешиваемому раствору 7-бензиламино-3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-5-она (25,01 г) в течение более 20 минут. Полученную смесь перемешивают в течение 4 час, оставляют на ночь при той же температуре и упаривают в вакууме. Остаток разбавляют водой и экстрагируют дважды дихлорметаном. Экстракты объединяют, моют насыщенным раствором соли, сушат над сульфатом натрия, обрабатывают 4N раствором хлористого водорода в этилацетате и упаривают в вакууме. Остаток суспендируют в метаноле и отфильтровывают. Фильтрат упаривают в вакууме, разбавляют водным раствором аммиака и экстрагируют дважды дихлорметаном. Экстракты объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и хроматографируют на силикагеле, используя в качестве элюента дихлорметанметанол. Элюент упаривают в вакууме и остаток промывают диэтиловым эфиром, получая 7-бензиламино-3-нитро-6,7,8,9-тетрагидро- 5H-бензоциклогептен-5-ол (7,33 г) в виде темно-желтого порошка (смесь диастереомеров).
Т. пл. 109 - 120oC
ИК-спектр (Nujol): 3310, 3150, 1515, 1350 см-1
ЯМР-спектр (хлороформ-d, δ): 1,75 - 2,05 (8H, мульт.), 2,3 (2H, мульт.), 2,6 - 2,85 (2H, мульт.), 3,15 - 3,65 (4H, мульт.), 3,85 (2H, дубл., J = 12,8 Гц), 4,02 (2H, дубл., J = 12,8 Гц), 4,98 (1H, дубл., J = 8,2 Гц), 5,32 (1H, мульт.), 7,2 - 7,4 (14H, мульт.), 8,01 (2H, дублет дублетов, J = 8,2 Гц, 2,2 Гц), 8,14 (1H, дубл., J = 2,2 Гц), 8,29 (1H, дубл., J = 2,2 Гц).
Масс-спектр (m/z): 312 (M+), 221, 91 (осн.).
Препарат 35.
Смесь 7-бензиламино-3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-5-ола (6,51 г.) бисульфата калия (13,0 г.) нагревают при температуре 210oC в течение 20 минут и суспендируют с смесью дихлорметана (150 мл), воды (100 мл) и 28%-ного раствора аммиака. Суспензию фильтруют. Дихлорметановый слой отделяют, сушат над безводным сульфатом натрия и хроматографируют на силикагеле, используя в качестве элюента дихлорметанметанол. Первый элюент дает N-бензил-6,7-дигидро-2-нитро-5H-бензоциклогептен-7-амин (3,11 г) в виде темно-коричневого твердого вещества.
Т. пл. 62,5 - 69oC
ИК-спектр (Nujol): 3310, 1660, 1580, 1520, 1340 см-1
ЯМР-спектр (хлороформ-d): 2,0 (1H, шир.), 2,00 - 2,15 (8H, мульт.), 2,8 - 2,95 (2H, мульт.), 3,45 - 3,55 (1H, мульт.), 3,89 (2H, сингл.), 6,11 (1H, дублет дублетов, J = 12,2 Гц, 4,2 Гц), 6,50 (1H, дублет дублетов, J = 12,2 Гц, 1,6 Гц), 7,2 - 7,4 (6H, мульт.), 7,97 (1H, дублет дублетов, J = 8,2 Гц, 2,4 Гц), 8,04 (1H, дубл., J = 2,4 Гц),
Масс-спектр (m/z): 294 (M+), 203, 91 (осн).
Второй элюент дает 6,7-дигидро-2-нитро-5H-бензоциклогептен-7-амин (95 мг) в виде масла.
ИК-спектр (пленка): 3350, 3280, 3170, 1610, 1580, 1510, 1340 см-1
ЯМР-спектр (хлороформ-d, δ): 1,58 (1H, шир.сингл.), 1,85 - 2,1 (2H, мульт. ), 2,85 - 2,95 (2H, мульт.), 3,71 (1H, мульт.), 6,01 (1H, дублет дублетов, J = 12,2 Гц, 4,0 Гц), 6,42 (1H, дублет дублетов, J = 12,2 Гц, 1,6 Гц), 7,2 - 7,4 (6H, мульт.), 7,28 (1H, дубл., J = 8,2 Гц), 7,97 (1H, дублет дублетов, J = 8,2 Гц, 2,4 Гц), 8,04 (1H, дубл., J = 2,4 Гц).
Масс-спектр (m/z): 204 (M+, осн.)
Препарат 36.
Раствор N-бензил-6,7-дигидро-2-нитро-5H-бензоциклогептен-7-амина (3,03 г) в этаноле (19 мл) и диоксане (19 мл), прибавляют по каплям к перемешиваемой смеси порошка железа (3,03 г.) и хлористого аммония (0,36 г.) в этаноле (15 мл), диоксане (15 мл) и воде (15 мл) при кипячении в течение 20 минут. Полученную смесь кипятят с обратным холодильником в течение 20 минут и еще горячую реакционную смесь фильтруют. Фильтрат упаривают в вакууме и остаток распределяют между этилацетатом и водным раствором бикарбоната натрия. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента дихлорметан и метанол, и получают N7-бензил-6,7-дигидро-5H-бензоциклогептен-2,7-диамин (2,52 г) в виде коричневого масла.
ИК-спектр (пленка): 3440, 3350, 3220, 1620 см-1
ЯМР-спектр (хлороформ-d, δ): 1,57 (1H, шир.), 1,95 - 2,1 (2H, мульт.), 2,6 - 2,8 (2H, мульт.), 3,4 - 3,6 (3H, мульт.), 3,8 (2H, сингл.), 5,92 (1H, дублет дублетов, J = 12,0 Гц, 4,0 Гц), 6,32 (1H, дублет дублетов, J = 12,0 Гц, 1,8 Гц), 6,4 - 6,55 (2H, мульт.), 6,92 (1H, дубл., J = 7,8 Гц), 7,2 - 7,4 (5H, мульт.).
Масс-спектр (m/z): 264 (M+), 157 (осн.) 91
Препарат 37.
Водный раствор (6 мл) нитрита натрия (609 мг) прибавляют по каплям к перемешиваемой суспензии N7-бензил-6,7-дигидро-5H-бензоциклогептен-2,7-диамина (2,22 г) в 6N растворе серной кислоты (22 мл) в течение 15 минут при охлаждении льдом и полученную смесь перемешивают при той же температуре в течение 30 минут. Полученный раствор прибавляют по каплям при перемешивании к раствору серной кислоты (3 мл.) в воде (15 мл) при 75oC в течение 15 минут. Полученную смесь перемешивают при указанной температуре еще в течение 30 минут, охлаждают в бане со льдом, подщелачивают 28%-ным водным раствором аммиака (15 мл.) и шесть раз экстрагируют дихлорметаном. Экстракты объединяют, упаривают в вакууме и хроматографируют через силикагель, используя дихлорметан и метанол в качестве элюента, и получают N-бензиламино-6,7-дигидро-5H-бензоциклогептен-2-ол (1,72 г.) в виде бледно-коричневого масла.
ИК-спектр (пленка): 3270, 2650, 1600, 1570 см-1
ЯМР-спектр (хлороформ-d, δ): 1,95 - 2,15 (2H, мульт.), 2,6 - 2,8 (2H, мульт. ), 3,30 (1H, шир.), 3,45 - 3,55 (1H, мульт.), 3,83 (1H, дубл., J = 13,2 Гц), 3,90 (1H, дубл., J = 13,2 Гц), 5,92 (1H, дублет дублетов, J = 12,2 Гц, 4,0 Гц), 6,31 (1H, дублет дублетов, J = 12,2 Гц, 11,8 Гц), 6,5 - 6,65 (2H, мульт.), 6,96 (1H, дубл., J = 7,8 Гц), 7,2 - 7,35 (6H, мульт.).
Масс-спектр (m/z): 265 (M+), 158 (осн.), 91
Препарат 38.
В атмосфере азота к раствору 6-хлор-2-пиридилальдегида (2,0 г.) в диэтиловом эфире (20 мл) прибавляют при 0oC раствор метилмагнийбромида в диэтиловом эфире (3M 5,65 мл) и перемешивают в течение 1,5 час, затем прибавляют насыщенный водный раствор хлористого аммония (30 мл) и органический слой отделяют. Водный слой дополнительно экстрагируют диэтиловым эфиром. Органические вытяжки объединяют, моют насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают перегонкой при пониженном давлении, получая 1-(6-хлор-2-пиридил)этанол (2,13 г.).
Т. кип. 140 - 145oC/5 мм. рт.ст.
ИК-спектр (пленка): 3375, 1585, 1560, 1435, 1410 см-1
ЯМР-спектр (CDCl3-D2O, δ): 1,52 (3H, дубл., J = 6,6 Гц), 4,87 (1H, кварт., J = 6,6 Гц), 7,2 - 7,34 (2H, мульт.), 7,66 (1H, трипл., J = 7,8 Гц).
Масс-спектр (m/z): 156 (M+), 142, 114, 78
Препарат 39.
Смесь 1-(6-хлор-2-пиридил)этанола (2,13 г.) и двуокиси марганца (8,4 г.) в хлороформе (21 мл) кипятят с обратным холодильником в течение 8 час. После охлаждения смесь фильтруют через слой целита и фильтрат упаривают в вакууме. Остаток очищают перегонкой при пониженном давлении, получая 2-ацетил-6-хлорпиридин (1,84 г.).
Т. кип. 105 - 110oC/5 мм. рт.ст.
ИК-спектр (пленка): 1700, 1570, 1560 см-1
ЯМР-спектр (хлороформ-d, δ): 2,71 (3H, сингл.), 7,52 (1H, дублет дублетов, J = 1,0 Гц, 7,9 Гц), 7,81 (1H, псевдо трипл., J = 7,8 Гц), 7,97 (1H, дублет дублетов, J = 1,0 Гц, 7,6 Гц).
Масс-спектр (m/z): 156 (M+)
Препарат 40.
К раствору 2-ацетил-6-хлорпиридина (7,48 г.) в 1,4-диоксане (112 мл) прибавляют 4N раствор хлористого водорода в 1,4-диоксане (12,6 мл). К полученному раствору при 30oC прибавляют по каплям хлористый сульфурил (13,51 мл). После перемешивания в течение 0,5 час, к смеси прибавляют ледяную воду (150 мл), органический слой отделяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь п-гексана и толуола (1:1), и получают хлорметил 6-хлор-2-пиридилкетон (7,05 г.) в виде твердого вещества.
Т. пл. 61 - 62oC
ИК-спектр (Nujol): 1720 см-1
ЯМР-спектр (хлороформ - d, δ ): 5,07 (2H, сингл.), 7,57 (1H, дублет дублетов, J = 1 Гц, 7,9 Гц), 7,86 (1H, псевдо трипл., J = 7,7 Гц), 8,03 (1H, дублет дублетов, J = 1,0 Гц, 7,6 Гц).
Препарат 41.
Раствор хлорметил 6-хлор-2-пиридилкетона (8,126 г.) в тетрагидрофуране (32 мл) и раствор борана в тетрагидрофуране (1,0 М, 25,7 мл) одновременно прибавляют к смеси раствора (R)-тетрагидро-3,3-дефенил-1H-3H-пирроло[1,2-c] [1,3,2] оксазаборола в тетрагидрофуране (прибл. 0,335 М, 8,9 мл) и раствора борана в тетрагидрофуране (1,0 М, 4,3 мл) при -5oC в атмосфере азота в течение не менее 0,5 час и полученную смесь перемешивают еще в течение 3,5 час. При 0oC к реакционной смеси по каплям прибавляют метанол и оставляют при перемешивании на ночь при комнатной температуре. Смесь упаривают в вакууме и остаток распределяют между этилацетатом и 1N раствором соляной кислоты. Органический слой отделяют, а водный слой дополнительно экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают (-)-2-хлор-1-(6-хлор-2-пиридил) этанол (7,98 г.) в виде масла.
[α]
Препарат 42.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 41.
(-)-2-хлор-1-(2-нафтил)этанол
Т. пл. 93 - 94oC
[α]D = -40,09o (c = 1,07, хлористый метилен)
ИК-спектр (Nujol): 3210 см-1
ЯМР-спектр (хлороформ-d, δ): 2,80 (1H, шир.), 3,5 - 3,9 (2H, мульт.), 5,05 (1H, дублет дублетов, J = 3,6 Гц, 8,5 Гц), 7,4 - 7,5 (3H, мульт.), 7,8 (4H, мульт.).
Препарат 43.
Смесь (-)-2-хлор-1-(6-хлор-2-пиридил)этанола (1,028 г) изо-пропенилацетата (1,8 мл) и PS Amano липазы (2,06 г.) в абсолютном ди-изо-пропиловом эфире (31 мл) перемешивают при комнатной температуре в течение 2,5 дней. Нерастворяющийся материал удаляют фильтрованием и фильтрат упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают (-)-2-хлор-1-(6-хлор-2-пиридил) этанол (0,40 г.).
[α]
ИК-спектр (жидкость): 3375, 1580, 1560 см-1
ЯМР-спектр (хлороформ-d, δ ): 3,54 (1H, дубл., J = 6,3 Гц), 3,80 (1H, дублет дублетов, J = 6,1 Гц, 11,1 Гц), 3,91 (1H, дублет дублетов, J = 4,8 Гц, 11,1 Гц), 4,90 - 5,04 (1H, мульт.), 7,29 (1H, дубл., J = 7,9 Гц), 7,40 (1H, дубл., J = 7,6 Гц), 7,71 (1H, псевдо трипл, J = 7,7 Гц).
Препарат 44.
Смесь (-)-2-хлор-1-(6-хлор-2-пиридил)этанола (390 мг), 2М раствора едкого натра (3,9 мл) и диэтилового эфира (0,2 мл) перемешивают при комнатной температуре в течение 3 часов. Далее к смеси прибавляют насыщенный раствор соли и этилацетат. Органический слой отделяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают (-)-1-(6-хлор-2-пиридил)-1,2-эпоксидэтан (250 мг) в виде масла.
[α]
ИК-спектр (жидкость): 1590, 1560, 1540, 1420 см-1
ЯМР-спектр (хлороформ-d, δ): 2,88 (1H, дублет дублетов, J = 2,5 Гц, 5,8 Гц), 3,18 (1H, дублет дублетов, J = 4,1 Гц, 5,8 Гц), 3,99 (1H, дублет дублетов, J = 2,5 Гц, 4,1 Гц), 7,16 (1H, дублет дублетов, J = 9,7 Гц, 7,6 Гц), 7,27 (1H, дублет дублетов, J = 0,7 Гц, 7,9 Гц), 7,65 (1H, псевдо трипл., J = 7,7 Гц).
Масс-спектр (m/z): 156 (M+).
Препарат 45.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 44.
(+)-2-нафтилоксиран
Т. пл.: 75 - 76oC
[α]D = +34,17o (c = 1,03, толуол)
ИК-спектр (Nujol): 1265, 1240, 820, 740 см-1
ЯМР-спектр (хлороформ-d, δ): 2,89 (1H, дублет дублетов, J = 2,6 Гц, 5,5 Гц), 3,20 (1H, дублет дублетов, J = 4,1 Гц, 5,5 Гц), 4,01 (1H, дублет дублетов, J = 2,6 Гц, 4 Гц), 7,31 (1H, дублет дублетов, J = 1,7 Гц, 8,5 Гц), 7,4 - 7,5 (2H, мульт.), 7,8 (4H, мульт.).
Масс-спектр (m/z): 170 (M+), 141
Препарат 46.
К суспензии 3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-5-она (7,0 г. ) в метаноле (70 мл) при 21oC - 30oC прибавляют порциями боргидрид натрия (1,29 г.) и полученную смесь перемешивают в течение 1 час. Выливают смесь в ледяную воду (210 мл) и выпавший осадок отфильтровывают, промывают водой и сушат, получая 3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-5-ол (6,81 г. ).
Т. пл. 116 - 118oC
ИК-спектр (Nujol): 3260, 3160, 1520, 1340 см-1
ЯМР-спектр (хлороформ-d, δ): 1,25 - 2,18 (7H, мульт.), 2,66 - 3,10 (2H, мульт. ), 4,89 - 5,06 (1H, мульт.), 7,23 (1H, дубл., J = 8,2 Гц), 7,98 (1H, дублет дублетов, J = 2,5 Гц, 8,2 Гц), 8,38 (1H, дубл., J = 2,5 Гц).
Препарат 47.
Смесь 3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-5-ола (70,67) и бисульфата натрия (53,00 г. ) нагревают при 160oC в течение 1 час. После охлаждения к реакционной массе прибавляют смесь воды (400 мл) и этилацетата (400 мл). Органический слой отделяют, а водный слой дополнительно экстрагируют этилацетатом (200 мл). Органические вытяжки объединяют, промывают насыщенным раствором соли (150 мл), сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь н-гексана и хлороформа (1:1), и получают 2-нитро-6,7-дигидро-5H-бензоциклогептен (48,1 г).
Т. пл. 43oC.
ИК-спектр (Nujol): 1520, 1340, 1280, 1085, 930, 900, 835, 760, 740 см-1
ЯМР-спектр (хлороформ-d, δ): 1,88 - 2,10 (2H, мульт.), 2,40 - 2,59 (2H, мульт. ), 2,83 - 3,03 (2H, мульт.), 6,06 (1H, дублет триплетов, J = 12,2 Гц, 4,5 Гц, 4,5 Гц), 6,45 (1H, дублет триплетов, J = 12,2 Гц, 2,0 Гц, 2,0 Гц), 7,2 (1H, дубл., J = 8,2 Гц), 7,93 (1H, дублет дублетов, J = 2,4 Гц, 8,2 Гц), 8,00 (1H, дубл., J = 2,4 Гц).
Препарат 48
Смесь 2-нитро-6,7-дигидро-5H-бензоциклогептена (48,10 г) и м-хлорбензойной кислоты (80%, 65,75 г.) в хлороформе (962 мл) кипятят с обратным холодильником в течение 4 час. После охлаждения к смеси прибавляют 1N раствор едкого натра (350 мл). Органический слой отделяют, а водный слой дополнительно экстрагируют хлороформом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и добавляют к смеси силикагель (100 г). Нерастворимый материал отфильтровывают, а фильтрат упаривают в вакууме, получая 3-нитро-6,7,8,9-тетрагидро-5H-бензоцикло-5,6-эпоксигептан (53,90 г).
Т. пл. 62 - 64oC
ИК-спектр (Nujol): 1610, 1580, 1520, 1340 см-1
ЯМР-спектр (хлороформ-d, δ): 1,43 - 2,32 (4H, мульт.), 2,82 - 3,08 (2H, мульт. ), 3,35 - 3,54 (1H, мульт.), 4,06 (1H, дубл., J = 4,2 Гц), 7,26 (1H, дубл. , J = 8,3 Гц), 8,08 (1H, дублет дублетов, J = 2,4 Гц, 8,3 Гц), 8,37 (1H, дубл., J = 2,4 Гц).
Препарат 49.
В атмосфере азота прибавляют раствор 3-нитро-6,7,8,9-тетрагидро-5H-бензоцикло-5,6-эпоксигептана (53,9 г) в бензоле (540 мл) к хлориду цинка (41,9 г) и полученную смесь перемешивают в течение 1 дня. Прибавляют к смеси силикагель и нерастворимый материал отфильтровывают. Фильтрат упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают 3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-он (33,83 г).
Т. пл. 84 - 86oC
ИК-спектр (Nujol): 1700, 1550, 1505, 1340 см-1
ЯМР-спектр (хлороформ-d, δ): 1,95 - 2,172 (2H, мульт.), 2,55 - 2,71 (2H, мульт. ), 3,00 - 3,16 (2H, мульт.), 3,83 (2H, сингл.), 7,34 (1H, дубл., J = 8,0 Гц), 8,01 - 8,17 (2H, мульт.).
Препарат 50.
Смесь 3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-она (0,20 г) порошка железа (218 мг), хлористого аммония (52 мг), воды (1,2 мл) и этанола (4 мл) кипятят с обратным холодильником в течение 2 час. После охлаждения нерастворимый материал отфильтровывают и фильтрат упаривают в вакууме. К остатку прибавляют этилацетат и воду. Органический слой отделяют, а водный слой дополнительно экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают 3-амино-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-он (153 мг).
ИК-спектр (хлороформ): 375, 1690, 1610 см-1
ЯМР-спектр (хлороформ-d, δ): 1,90 - 2,0 (2H, мульт.), 2,48 - 2,66 (2H, мульт. ), 2,77 - 2,94 (2H, мульт.), 3,62 (2H, сингл.), 6,45 - 6,60 (2H, мульт.), 6,93 (1H, дубл., J = 8,6 Гц).
Препарат 51.
Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 50.
N-бензил-N-формил-(3-амино-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-ил)амин
ИК-спектр (жидкость): 3680, 3450, 3390, 1660 см-1
Конформер А: ЯМР-спектр (CDCl3 - D2O, δ): 1,14 - 1,46 (1H, мульт.), 1,78 - 2,20 (3H, мульт. ), 2,39 - 2,73 (3H, мульт.), 3,04 - 3,88 (2H, мульт.), 4,36 - 4,78 (2H, мульт.), 6,26 - 6,90 (3H, мульт.), 7,20 - 7,44 (5H, мульт. ), 8,27 (1H, сингл.).
Конформер Б: ЯМР-спектр (CDCl3-D2O, δ): 1,14 - 1,46 (1H, мульт.), 1,78 - 2,20 (3H, мульт.), 2,39 - 2,73 (3H, мульт.), 3,04 - 3,88 (2H, мульт.), 4,36 - 4,78 (2H, мульт. ), 6,26 - 6,90 (3H, мульт.), 7,20 - 7,44 (5H, мульт.), 8,39 (1H, синглет).
Конформер А : Конформер Б = 1 : 2,3
Масс-спектр (m/z): 294 (M+), 159, 144, 131, 91
Препарат 52.
К раствору 3-амино-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-она (9,42 г) в смеси уксусной кислоты (1,85 мл), концентрированной серной кислотой (9,24 мл) и воды (24,56 мл) при охлаждении в бане со льдом и солью прибавляют порциями раствор нитрата натрия (4,08 г) в воде (6,00 мл) и полученную массу перемешивают в течение 1 часа. Полученный раствор прибавляют к раствору бромистой меди (10,02 г) и бромистого натрия (9,40 г) в смеси 47%-ной бромистоводородной кислоты (27,72 мл) и воды (61,52 мл) при 75oC и полученную массу перемешивают еще в течение 0,5 час. После охлаждения к реакционной массе прибавляют ледяную воду (100 мл) и хлороформ (200 мл). Нерастворимый материал отфильтровывают. Органический слой отделяют, а водную фазу дополнительно экстрагируют этилацетатом. Экстракты объединяют, моют насыщенным раствором соли, сушат над безводным сульфатом магния и обрабатывают активированным углем (0,65 г). Полученный раствор упаривают в вакууме, а остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента толуол, и получают 3-бром-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-он (6,34 г).
Т. пл. 51 - 59oC
ИК-спектр (Nujol): 1700 см-1
ЯМР-спектр (хлороформ-d, δ): 1,89 - 2,08 (2H, мульт.), 2,47 - 2,65 (2H, мульт. ), 2,83 - 3,00 (2H, мульт.), 3,68 (2H, сингл.), 7,03 (1H, дубл., J = 7,7 Гц), 7,31 (1H, дубл., J = 2,0 Гц), 7,33 (1H, дублет дублетов, J = 7,7 Гц, 2,0 Гц).
Препарат 53.
Смесь 3-бром-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-она (2,00 г) этилакрилата (91,26 г) ацетата палладия (94 мг), трис(2-метилфенил)фосфина (764 мг), триэтиламина (1,69 г) в N,N-диметилформамиде (20 мл) перемешивают в атмосфере водорода при температуре 100oC в течение 20 час. После охлаждения к смеси приливают ледяную воду (20 мл). Образовавшийся осадок отфильтровывают и растворяют в этилацетате (20 мл). Полученный раствор моют три раза водой (20 мл), сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают (E)-3-(8-оксо-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ил)акрилат (1,34 г).
Т. пл. 87 - 88oC
ИК-спектр (Nujol): 1705, 1690 см-1
ЯМР-спектр (хлороформ-d, δ): 1,34 (3H, трипл., J = 7,1 Гц), 1,91 - 2,12 (2H, мульт.), 2,52 - 2,67 (2H, мульт.), 2,89 - 3,07 (2H, мульт.), 3,74 (2H, сингл. ), 4,26 (2H, кварт., J = 7,1 Гц), 6,40 (1H, дубл., J = 16,0 Гц), 7,18 (1H, J = 7,7 Гц), 7,32 (1H, дубл., J = 1,0 Гц), 7,36 (1H, дублет дублетов, J = 7,7 Гц), 7,64 (1H, дублет дублетов, J = 16,0 Гц).
Препарат 54.
Раствор (E)-3-(8-оксо-6,6,7,8,9-тетрагидро-5H-бензоциклогептен- 2-ил) акрилата (400 мг) в этаноле (8 мл) гидрируют над 10%-ным палладием на угле (24 мг). После удаления катализатора раствор упаривают в вакууме и остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь н-гексана и этилацетата (10: 1), и получают (E)-3-(8-оксо-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ил) пропионат (311 мг).
Т. пл. 66-68oC
ИК-спектр (Nujol): 1720, 1695 см-1
ЯМР-спектр (хлороформ-d, δ): 1,23 (3H, трипл., J = 7,1 Гц), 1,91 - 2,08 (2H, мульт.), 2,48 - 2,70 (4H, мульт.), 2,80 - 3,02 (4H, мульт.), 3,70 (2H, сингл.), 4,13 (2H, кварт., J = 7,1 Гц), 6,96 - 7,06 (3H, мульт.).
Препарат 55.
Раствор N-бензил-N-формил-(3-амино-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-ил) амина (0,80 г) в муравьиной кислоте (16 мл) кипятят с обратным холодильником в течение 2 час. После охлаждения раствор упаривают в вакууме. Остаток растворяют в этилацетате и полученный раствор последовательно моют 1N раствором едкого натра, 1N раствором соляной кислоты, насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-метанол (20 : 1), и получают N-бензил-N-формил-(3-формиламино-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-ил) амин (0,84 г).
ИК-спектр (хлороформ): 3660, 3425, 3400, 1690, 1660 см-1
ЯМР-спектр (хлороформ-d, δ): 1,16 - 1,49 (1H, мульт.), 1,80 - 2,30 (3H, мульт. ), 2,42 - 2,82 (3H, мульт.), 3,07 - 3,90 (3H, мульт.), 4,28 - 4,86 (2H, мульт. ), 6,50 - 7,20 (3H, мульт.), 7,20 - 7,46 (5H, мульт.), 7,66 - 7,93 (1H, мульт.), 8,25 - 8,66 (2H, мульт.).
Масс-спектр (m/z): 322 (M+), 187, 172, 159
Препарат 56.
Гидрид натрия (в виде 60%-ной дисперсии в масле, 100 мг) промывают петролейным эфиром и прибавляют к нему при охлаждении на бане со льдом раствор N-бензил-N-формил-(3-формиламино-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-ил) амина (675 мг) в тетрагидрофуране (10 мл). Смесь перемешивают в течение 20 минут, а затем прибавляют к ней раствор этилбромацетата (0,28 мл) в тетрагидрофуране (1 мл) и перемешивают еще в течение 1 час. К смеси прибавляют насыщенный раствор хлористого аммония. Органический слой отделяют, моют насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-метанол (50:1), и получают этил N-[(8-N-бензилформиламино)-6,7,8,9- тетрагидро-5H-бензоциклогептен-2-ил]формиламиноацетат (752 мг).
ИК-спектр (хлороформ): 2940, 1745, 1665 см-1
ЯМР-спектр (хлороформ-d, δ): 1,28 (3H, трипл., J = 7,1 Гц), 1,22 - 1,50 (1H, мульт.), 1,83 - 2,84 (6H, мульт.), 3,09 - 3,76 (2H, мульт.), 4,20 (2H, кварт., J = 7,1 Гц), 4,28 - 4,86 (4H, мульт.), 8,24 - 8,46 (2H, мульт.).
Масс-спектр (m/z): 408 (M+), 307, 273, 245, 172
Препарат 57.
Смесь этил N-[(8-N-бензилформиламино)-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ил] формиламиноацетата (501 мг), 6N раствора соляной кислоты (6,1 мл) и этанола (10 мл) кипятят с обратным холодильником в течение 1 дня. После охлаждения раствор выливают в ледяную воду (20 мл) и доводят его pH до 12 с помощью раствора едкого натра. Водную фазу экстрагируют этилацетатом и экстракт моют насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме.
Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-этанол (20:1), и получают этил N-[(8-N-бензиламино)-6,7,8,9-тетрагидро-5H- бензоциклогептен-2-ил] аминоацетат (217 мг).
ИК-спектр (жидкость): 3400, 1735, 1610, 1585, 1510 см-1
ЯМР-спектр (хлороформ-d, δ): 1,29 (3H, трипл., J = 7,1 Гц), 1,34 - 2,09 (5H, мульт.), 2,52 - 2,95 (6H, мульт.), 3,82 (1H, сингл.), 3,85 (1H, сингл. ), 3,88 (2H, дубл., J = 7,1 Гц), 4,15 (1H, трипл., J = 3,5 Гц), 4,24 (2H, квар. , J = 7,1 Гц), 6,35 (1H, дублет дублетов, J = 2,5 Гц, 8,0 Гц), 6,47 (1H, дубл. , J = 2,5 Гц), 6,90 (1H, дубл., J = 8,0 Гц), 7,17 - 7,36 (5H, мульт.)
Масс-спектр (m/z): 352 (M+), 219, 207, 146
Препарат 58.
В течение 0,5 час поддерживая температуру на уровне 30oC, к энергично перемешиваемой суспензии боргидрида натрия (15,77 г.) в смеси 1,4-диоксана (315 мл) и этанола (98 мл) прибавляют раствор (Z)-2-(3-метоксифенил)-2-нитроэтана (33,85 г. ) в 1,4-диоксане (315 мл). После перемешивания еще в течение 2 час полученную массу разбавляют ледяной водой (393 мл) и избыток боргидрида разлагают 50%-ным водным раствором уксусной кислоты (47,4 мл). К полученному раствору прибавляют хлорид натрия (68 г.) и этилацетат. Органический слой отделяют, а водную фазу дополнительно экстрагируют этилацетатом. Экстракты объединяют, моют насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают перегонкой при пониженном давлении, получая 1-метокси-3-(2-нитроэтил)бензил (23,62 г.)
Т. кип. 104 - 107oC/1 мм. рт. ст.
ИК-спектр (жидкость): 1540, 1375 см-1
ЯМР-спектр (хлороформ-d, δ): 3,29 (2H, трипл., J = 7,4 Гц), 3,80 (3H, сингл. ), 4,60 (2H, трипл., J = 7,4 Гц), 6,70 - 6,87 (3H, мульт.), 7,19 - 7,33 (1H, мульт.)
Препарат 59.
К раствору 1-метокси-3-(2-нитроэтил)бензола (22,59 г.) и трет-бутилакрилата (15,98 г.) в дихлорметане (180 мл) прибавляют при охлаждении в бане со льдом раствор 1,8-диазабицикло[5.4.0] ундец-7-ена (1,90 г.) в дихлорметане (45 мл.). После перемешивания при комнатной температуре в течение 18,5 час к раствору прибавляют ледяную воду (70 мл). Органический слой отделяют и последовательно моют 1N раствором соляной кислоты и насыщенным раствором соли. Полученный раствор обрабатывают силикагелем (70 г.) и упаривают в вакууме, получая трет-бутил-5-(3-метоксифенил)-4-нитровалерат (29,39 г.)
ИК-спектр (жидкость): 1720, 1600, 1545 см-1
ЯМР-спектр (хлороформ-d, δ): 1,37 (9H, сингл.), 1,98 - 2,34 (4H, мульт. ), 2,94 (1H, дублет, дублетов, J = 5,9 Гц, 14,1 Гц), 3,18 (1H, дублет дублетов, J = 8,5 Гц, 14,1 Гц), 3,71 (3H, сингл.), 4,64 - 4,83 (1H, мульт.), 6,61 - 6,75 (3H, мульт.), 7,09 - 7,21 (1H, мульт.)
Масс-спектр (m/z): 308 (M+-1)
Препарат 60.
К раствору трет-бутил-5-(3-метоксифенил)-4-нитровалерата (10,00 г.) в 1,4-диоксане 10 мл) при охлаждении в бане со льдом прибавляют 4N раствор хлористого водорода в 1,4-диоксане (17,8 мл). После перемешивания в течение 3 дней при комнатной температуре к полученному раствору прибавляют ледяную воду (60 мл) и хлорид натрия (6 г.) pH раствора доводят до 9,5 с помощью насыщенного водного раствора бикарбоната натрия и моют раствор этилацетатом. Далее, после того, как pH раствора доводят до 1 с помощью 6N раствора соляной кислоты, реакционную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором соли, сушат над безводным сульфатом натрия, обрабатывают силикагелем (20 г.) и упаривают в вакууме, получая 5-(3-метоксифенил)-4-нитровалериановую кислоту (8,00 г.)
ИК-спектр (жидкость): 2950 - 2300, 1700, 1540 см-1
ЯМР-спектр (хлороформ-d, δ ): 2,03-2,57 (4H, мульт.), 3,03 (1H, дублет дублетов, J = 6,1 Гц, 14,1 Гц), 3,28 (1H, дублет дублетов, J = 8,2 Гц, 14,1 Гц), 3,79 (3H, сингл. ), 4,72-4,91 (1H, мульт.), 6,68-6,90 (3H, мульт.), 7,17-7,31 (1H, мульт.)
Масс-спектр (m/z): 252 (M+-1)
Препарат 61.
Смесь 5-(3-метоксифенил)-4-нитровалериановой кислоты (1,00 г.) и хлористого тионила (0,34 мл) в 1,2-дихлорэтане (2 мл) кипятят с обратным холодильником в течение 1 час. После охлаждения к раствору при -12oC прибавляют хлорид алюминия (0,53 г.) и полученную массу перемешивают в течение 0,5 час. Раствор выливают в ледяную воду (15 мл.). Органический слой отделяют, а водную фазу дополнительно экстрагируют дихлорметаном. Экстракты объединяют, моют насыщенным раствором бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая 2-метокси-8-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-5-он (772 мг.).
Т. пл. 120 - 122oC
ИК-спектр (Nujol): 1665, 1590, 1545 см-1
ЯМР-спектр (хлороформ-d, δ): 2,21 - 2,55 (2H, мульт.), 2,65 - 2,84 (1H, мульт. ), 2,93 - 3,14 (1H, мульт.), 3,37 (1H, дублет дублетов, J = 5,6 Гц, 14,6 Гц), 3,62 (1H, дублет дублетов, J = 7,8 Гц, 14,6 Гц), 3,87 (3H, сингл. ), 4,85 - 5,03 (1H, мульт.), 6,76 (1H, дубл., J = 2,5 Гц), 6,91 (1H, дублет дублетов, J = 2,5 Гц, 8,7 Гц), 7,82 (1H, дубл., J = 8,7 Гц).
Препарат 62.
К раствору (S)-(-)-4-ацетиламино-5-(3-метоксифенил)валериановой кислоты (706 мг) в 1,2-дихлорэтане (2,1 мл) прибавляют при 0oC хлористый тионил (0,25 мл) и перемешивают смесь в течение 3 час. К смеси прибавляют дихлорметан (2,1 мл), а затем порциями при -10oC хлорид алюминия (0,72 г.).
После перемешивания в течение 2 час раствор выливают в ледяную воду и подкисляют разбавленной соляной кислотой. Экстрагируют дихлорметаном, экстракт промывают насыщенным раствором бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток перекристаллизовывают из смеси н-гексана и этилацетата, получая (S)-(-)-8-ацетоамино-2-метокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-5-он (329 мг) в виде порошка.
Т.пл. 132oC
[α]
ИК-спектр (Nujol): 3310, 1650, 1595 см-1
ЯМР-спектр (хлороформ-d, δ ): 1,38 - 1,60 (1H, мульт.), 1,98 (3H, сингл. ), 2,10 - 2,32 (1H, мульт.), 2,50 - 2,84 (2H, мульт.), 2,90 (1H, дублет дублетов, J = 14,4 Гц, 5,0 Гц), 3,19 (1H, дублет дублетов, J = 14,4 Гц, 5,2 Гц), 3,86 (3H, сингл.), 4,37 - 4,58 (1H, мульт.), 5,53 (1H, дубл., J = 7,5 Гц), 6,67 (1H, дубл., J = 2,5 Гц), 6,87 (1H, дублет дублетов, J = 2,5 Гц, 8,6 Гц), 7,79 (1H, дубл., J = 8,6 Гц).
Препарат 63.
Раствор 2-метокси-8-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-5-она (0,20 г.) в уксусной кислоте (2 мл) гидрируют под давлением 4 атм водорода в присутствии палладия на угле (0,20 г.). После удаления катализатора доводят pH раствора до 12 с помощью раствора едкого натра и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая 3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин (153 мг).
ЯМР-спектр (хлороформ-d, δ): 1,38 - 2,10 (4H, мульт.), 1,41 (2H, шир. сингл.), 2,60 - 3,06 (5H, мульт.), 3,77 (3H, сингл.), 6,64 (1H, дублет дублетов, J = 8,1 Гц, 2,7 Гц), 6,71 (1H, дубл., J = 2,7 Гц), 6,98 (1H, дубл., J = 8,1 Гц).
Препарат 64.
Смесь трет-бутил 5-(3-метоксифенил)-4-нитровалерата (0,31 г.) 10%-ного палладия на угле (0,31 г.) и формиата аммония (0,63 г.) в метаноле (3,1 мл) перемешивают при комнатной температуре в течение 0,5 час. После удаления нерастворимого материала, фильтрат упаривают в вакууме. К остатку приливают этилацетат и воду, органический слой отделяют. Водную фазу дополнительно экстрагируют этилацетатом. Органические вытяжки объединяют, моют насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме, получая трет-бутил-4-амино-5-(3-метоксифенил)-валерат (245 мг).
ИК-спектр (жидкость): 3455, 1620, 1600, 1580 см-1
ЯМР-спектр (хлороформ-d, δ): 1,44 (9H, сингл.), 1,51 - 1,95 (2H, мульт. ), 2,05 (2H, шир. сингл.), 2,21 - 2,47 (2H, мульт.), 2,50 (1H, дублет дублетов, J = 8,6 Гц, 13,3 Гц), 2,80 (1H, дублет дублетов, J = 4,8 Гц, 13,3 Гц), 3,80 (3H, сингл.), 6,65 - 6,86 (3H, мульт.), 7,15 - 7,30 (1H, мульт.).
Масс-спектр (m/z): 280 (M+), 224
К раствору трет-бутил-4-амино-5-(3-метоксифенил)валерата (0,22 г.) в 1,4-диоксане (0,2 мл) прибавляют уксусный ангидрид (0,08 мл) и раствор перемешивают в течение 80 минут. Далее, к раствору прибавляют этанол и смесь перемешивают 15 минут. pH реакционной смеси доводят до 12 с помощью раствора едкого натра и экстрагируют водный раствор этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая трет-бутил 4-ацетиламино-5-(3-метоксифенил) валерат (246 мг.).
ИК-спектр (жидкость): 3275, 3060, 1720, 1640, 1540, 1365 см-1
ЯМР-спектр (хлороформ-d, δ): 1,43 (9H, сингл.), 1,52 - 1,90 (2H, мульт. ), 1,83 (2H, шир. сингл.), 2,15 - 2,42 (2H, мульт.), 2,70 (1H, дублет дублетов, J = 7,2 Гц, 13,5 Гц), 2,85 (1H, дублет дублетов, J = 5,6 Гц, 13,5 Гц), 3,79 (3H, сингл.), 4,01 - 4,24 (1H, мульт.), 6,56 (1H, шир. дубл., J = 8,5 Гц), 6,67 - 6,84 (3H, мульт.), 7,15 - 7,28 (1H, мульт.)
Масс-спектр (m/z): 322 (M+), 266, 206
Препарат 65.
К раствору трет-бутил 4-ацетиламино-5-(3-метоксифенил)валерата (508 мг) в 1,4-диоксане (2 мл) прибавляют 4N раствор хлористого водорода в 1,4-диоксане (4 мл) и полученный раствор перемешивают в течение 1 час. Выливают смесь в ледяную воду (6 мл) и доводят pH полученного раствора до 12 с помощью раствора едкого натра, промывают смесь последовательно ди-изо-пропиловым эфиром и этилацетатом, а затем доводят pH раствора до 1 с помощью 6N раствора соляной кислоты. Экстрагируют этилацетатом, экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая 4-ацетиламино-5-(3-метоксифенил) валериановую кислоту (362 мг).
ИК-спектр (жидкость): 3300, 2950 - 2300, 1700 см-1
ЯМР-спектр (хлороформ-d, δ): 1,55-1,98 (2H, мульт.), 1,93 (3H, сингл.), 2,30 - 2,47 (2H, мульт.), 2,65 - 2,92 (2H, мульт.), 3,78 (3H, сингл.), 4,09 - 4,3 (1H, мульт. ), 5,88 (1H, шир. дубл., J = 8,9 Гц), 6,67 - 6,87 (3H, мульт.), 7,13 - 7,26 (1H, мульт.), 9,42 (1H, шир. сингл.)
Масс-спектр (m/z): 266 (M++1)
Препарат 66.
Смесь 4-ацетиламино-5-(3-метоксифенил) валериановой кислоты (151 мг) и (+)-цинконина (110 мг) в 1,4-диоксане 92,6 мл) кипятят с обратным холодильником, а затем дают смеси остыть. Выпавшие кристаллы отделяют фильтрованием и сушат, получая соль (S)-4-ацетиламино-5-(3-метоксифенил) валериановой кислоты и (+)-цинконина (117 мг). Полученное соединение перекристаллизовывают из 1,4-диоксана, получая чистую соль (61 мг.).
Т. пл. 122 - 126oC
[α]
ИК-спектр (Nujol): 3250, 3180, 2725, 1660, 1590 см-1
ЯМР-спектр (DМСО-d, δ): 1,29 - 2,00 (7H, мульт.), 1,75 (3H, сингл.), 2,02-2,39 (3H, мульт.), 2,41 - 2,84 (5H, мульт.), 2,90 - 3,15 (2H, мульт.), 3,20 - 4,90 (1H, шир. мульт.), 3,72 (3H, сингл.), 3,78 - 4,04 (1H, мульт.), 4,99 - 5,20 (2H, мульт.), 5,28 - 5,45 (1H, мульт.), 5,98 - 6,21 (1H, мульт. ), 6,68 - 6,85 (3H, мульт.), 7,10 - 7,26 (1H, мульт.), 7,49 - 7,82 (2H, мульт.), 7,45 (1H, дубл., J = 4,4 Гц), 8,00 (1H, дубл., J = 8,4 Гц), 8,25 (1H, дубл., J = 8,4 Гц) 8,83 (1H, дубл., J = 4,4 Гц).
Препарат 67.
Соль (S)-4-ацетиламино-5-(3-метоксифенил)валериановой кислоты и (+)-цинконина (55,7 г.) суспендируют в этилацетате и доводят pH раствора до 1 с помощью разбавленной соляной кислоты. Органический слой отделяют, а водную фазу дополнительно экстрагируют этилацетатом. Экстракты объединяют, моют насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме, получая (S)-(-)-4-ацетиламино-5-(3-метоксифенил)валериановую кислоту (26,40 г.)
Т.пл. 66-70oC
[α]
ИК-спектр (Nujol): 3270, 1730, 1610 см-1
ЯМР-спектр (хлороформ-d, δ): 1,55 - 1,98 (2H, мульт.), 1,92 (3H, сингл. ), 2,30 - 2,46 (2H, мульт.), 2,64 - 2,92 (2H, мульт.), 3,76 (3H, сингл.), 4,08 - 4,30 (1H, мульт.), 6,19 (1H, шир. дубл., J = 8,8 Гц), 6,67 - 6,85 (3H, мульт.), 7,13 - 7,26 (1H, мульт.), 9,82 (1H, шир. сингл.)
Препарат 68.
К раствору (S)-(-)-8-ацетоамино-2-метокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-5-она (1,2 г.) в комплексе трехфтористый бор-эфир (прибл. 47%, 23,9 мл) прибавляют при комнатной температуре триэтилсилан (3,42 мл) и полученную смесь перемешивают в течение 3 дней, выливают в ледяную воду и доводят pH раствора до 9 с помощью раствора едкого натра. Экстрагируют смесь хлороформом, экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают перекристаллизацией из г-гексана, получая (S)-(-)-N-ацетил-3-метокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-амин (1,09 г.)
Т. пл. 185oC
[α]
ИК-спектр (Nujol): 3290, 1635 см-1
ЯМР-спектр (хлороформ-d, δ): 1,43 - 1,80 (2H, мульт.), 1,85 - 2,00 (2H, мульт. ), 1,89 (3H, сингл.) 2,64 - 2,82 (2H, мульт.), 2,84 (1H, дублет дублетов, J = 13,8 Гц, 7,8 Гц), 3,02 (1H, дублет дублетов, J = 13,8 Гц, 1,7 Гц), 3,78 (3H, сингл.), 4,13 - 4,31 (1H, мульт.) 5,26 (1H, дубл., J = 7,7 Гц), 6,64 - 6,75 (2H, мульт.) 7,02 (1H, дубл., J = 8,9 Гц).
Препарат 69.
Смесь (S)-(-)-N-ацетил-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амина (0,75 г. ) и едкого кали (15,84 г.) в смеси воды (11,2 мл) и метанола (45 мл) кипятят с обратным холодильником в течение 3 дней. После охлаждения смесь упаривают в вакууме. К остатку прибавляют воду и этилацетат. Органический слой отделяют, водную фазу дополнительно экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над поташом и упаривают в вакууме. Остаток растворяют в этилацетате и прибавляют 4N раствор хлористого водорода в этилацетате (0,71 мл). Образовавшийся осадок отделяют фильтрованием и сушат, получая (S)-(+)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид (606 мг) в виде бесцветных кристаллов.
[α]
Препарат 70.
К раствору 7-метокси-1-тетралона (50 г. ) и триметилсульфонийиодида (69,48) в диметилсульфоксиде (330 мл) прибавляют при 24oC - 28oC по каплям раствор трет-бутоксида калия (38,21 г.) в диметилсульфоксиде (165 мл). Смесь перемешивают при комнатной температуре в течение 1 час. Выливают реакционную массу в холодную воду (500 мл) и экстрагируют этилацетатом. Органический слой отделяют, моют водой (500 мл, три раза), сушат над сульфатом магния и упаривают в вакууме, получая сырой спиро(3,4-дигидро-7-метоксинафталин-1-(2H),2'-оксиран) (48,15 г.) в виде бледно-желтого масла.
ИК-спектр (пленка): 1610, 800, 720 см-1
ЯМР-спектр (хлороформ-d, δ): 1,75 - 1,95 (1H, мульт.), 1,95 - 2,20 (3H, мульт. ), 2,80 - 2,95 (2H, мульт.), 2,96 (2H, сингл.), 3,76 (3H, сингл.), 6,61 (1H, дубл. , J = 2,7 Гц), 6,76 (1H, дублет дублетов, J = 8,4 Гц, 2,7 Гц), 7,02 (1H, дубл., J = 8,4 Гц)
Масс-спектр (m/z): 189 (M-1)
Препарат 71.
К раствору бензиламина (22,53 г. ) в 1-пропаноле (120 мл) прибавляют порциями раствор спиро(3,4-дигидро-7-метоксинафталин-1(2H),2'-оксирана (40,0 г. ) в 1-пропаноле (40 мл) при слабом кипячении. Смесь нагревают в тех же условиях в течение 4 час. Растворитель удаляют и к остатку прибавляют этилацетат (200 мл). Экстракт моют водой (200 мл, четыре раза), сушат над сульфатом натрия и упаривают в вакууме. Остаток обрабатывают 4N раствором хлористого водорода в этилацетате, получая 1-бензиламинометил-7-метокси-1,2,3,4-тетрагидро-1-нафталенол гидрохлорид в виде белого порошка.
Т. пл. 188 - 189oC
ИК-спектр (Nujol): 3340, 1610, 100, 740, 700 см-1
ЯМР-спектр (DМСО-d, δ): 1,4 - 1,90 (3H, мульт.), 2,97 (2H, шир. сингл.), 3,69 (3H, сингл. ), 4,19 (2H, шир. сингл.), 5,93 (1H, шир. сингл.), 6,75 - 6,80 (1H, мульт.), 6,95 - 7,05 (2H, мульт.), 7,35 - 7,55 (3H, мульт.), 7,60 - 7,70 (2H, мульт.), 8,94 (1H, шир. сингл.), 9,57 (1H, шир. сингл.).
Масс-спектр (m/z): 298 (M+1)+
Препарат 72.
Смесь 1-бензиламинометил-7-метокси-1,2,3,4-тетрагидро-1-нефталенол гидрохлорида (45,00 г.) формиата аммония (25,50 г.) и 10%-ного палладия на угле (50% вл. 4,5 г.) в метаноле кипятят с обратным холодильником в течение 40 минут. После охлаждения катализатор отделяют фильтрованием и фильтрат упаривают в вакууме. К остатку прибавляют воду (45 мл)), 1N раствор соляной кислоты (90 ил) и диэтиловый эфир (120 мл) и органический слой отделяют. Водный слой подщелачивают 5N водным раствором едкого натра (45 мл) и экстрагируют этилацетатом (6 раз по 600 мл). Органические вытяжки объединяют, сушат над сульфатом натрия и упаривают в вакууме, получая 1-аминометил-7-метокси-1,2,3,4-тетрагидро-1-нафталенол (27,89 г.) в виде порошка бледно-желтого цвета.
Т.пл. 79 - 81oC
ИК-спектр (Nuhol): 3360, 3300, 1610, 810, 730, 700 см-1
ЯМР-спектр (хлороформ-d, δ): 1,60 - 2,20 (7H, мульт.), 2,60 - 2,80 (2H, мульт.), 2,80 - 3,00 (2H, мульт.), 3,79 (3H, сингл.), 6,75 (1H, дублет дублетов, J = 8,4 Гц, 2,7 Гц), 6,99 (1H, дублет дубл., J = 8,4 Гц), 7,06 (1H, дубл., J = 2,7 Гц).
Масс-спектр (m/z): 207 (M+), 178, 121
Препарат 73.
К раствору 1-аминометил-7-метокси-1,2,3,4-тетрагидро-1-нафталенола (27,50 г.) в 10%-ном водном растворе уксусной кислоты (250 мл) прибавляют по каплям при 8oC - 9oC раствор нитрата натрия (10,07 г.) в воде (61 мл.). Полученную смесь перемешивают при указанной температуре в течение 2 час. Образовавшийся осадок отфильтровывают и растворяют в этилацетате. Сушат полученный раствор над сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель, н-гексан :этилацетат: хлороформ = 5:1:3), получая 3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-он (19,39 г.) в виде белого порошка.
Спектральные данные полученного соединения совпадают с аналогичными данными для аутеничного образца.
Препарат 74.
К раствору 3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-она (220 г.) в метаноле (1300 мл) прибавляют порциями при 6oC - 30oC боргидрид натрия (2,0 г. ), а затем перемешивают смесь в течение 40 минут и упаривают в вакууме. Остаток распределяют между этилацетатом (1 л.) и водой (1 л.). Органический слой моют 1N раствором соляной кислоты (500 мл), водным раствором бикарбоната натрия (500 мл) и соли (200 мл) и сушат над сульфатом магния. Растворитель удаляют в вакууме, получая 3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ол в виде белого порошка.
Т.пл. 57 - 59oC
ИК-спектр (пленка): 3350, 1610, 760, 740, 700 см-1
ЯМР-спектр (хлороформ-d, δ): 1,40 - 1,65 (2H, мульт.), 1,70 - 1,95 (2H, мульт.), 1,95 - 2,20 (1H, мульт.), 2,5 - 2,75 (2H, мульт.), 2,90 - 3,10 (2H, мульт. ), 3,78 (3H, сингл.), 3,65 - 3,90 (1H, мульт.) 6,66 (1H, дублет дублетов, J = 8,1 Гц, 2,7 Гц), 6,73 (1H, дубл., J = 2,7 Гц), 6,98 (1H, дубл., J = 8,1 Гц).
Масс-спектр (m/z): 192 (M+), 135
Препарат 75.
Смесь (RS)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ола (221 г. ), изо-пропенилацетата (380 мл) и липазы PS (Amano) (221 г.) в ди-изо-пропиловом эфире (4,8 л.) перемешивают при комнатной температуре в течение 4 дней. Реакционную смесь фильтруют через целит и упаривают при пониженном давлении. Остаток очищают тонкослойной хроматографией (силикагель, используют последовательно дихлорметан и смесь дихлорметан-метанол (20:1) в качестве элюента). Из первого элюата выделяют (R)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-илацетат (138,2 г. ) в виде бледно-желтого масла, а из второго элюата выделяют (S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ол (104,4 г.) в виде бесцветного порошка.
(R)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-илацетат.
[α]
ИК-спектр (пленка): 1715, 1610, 810 см-1
ЯМР-спектр (хлороформ-d, δ): 1,35 - 1,65 (1H, мульт.), 1,65 - 2,00 (2H, мульт. ), 2,01 (3H, сингл. ), 2,00 - 2,20 (1H, мульт.), 2,65 - 2,80 (2H, мульт. ), 2,87 (1H, шир. дубл., J = 13,6 Гц), 3,10 (1H, дублет дублетов, J = 13,6 Гц, 0,8 Гц) 3,77 (3H, сингл.), 4,70 - 4,90 (1H, мульт.), 6,60 - 6,75 (2H, мульт.), 6,99 (1H, дубл., J = 7,9 Гц).
Масс-спектр (m/z): 234 (M+), 174
(S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ол.
Т. пл. 75 - 78oC
[α]
ИК-спектр (Nujol): 3350, 3270, 1610, 810, 700 см-1
ЯМР-спектр (хлороформ-d, δ): 1,30 - 1,65 (2H, мульт.), 1,65 - 1,95 (2H, мульт. ), 1,95 - 2,15 (1H, мульт.), 2,60 - 2,75 (2H, мульт.), 2,90 - 3,10 (2H, мульт.), 3,70 - 3,90 (1H, мульт.), 3,78 (3H, сингл.), 6,66 (1H, дублет дублетов, J = 8,1 Гц, 2,7 Гц), 6,74 (1H, дубл., J = 2,7 Гц), 7,00 (1H, дубл. , J = 8,1 Гц).
Масс-спектр (m/z): 192 (M+), 135
Препарат 76.
К раствору (R)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6- илацетата (136 г.) в метаноле (1,36 л.) прибавляют по каплям раствор едкого натра (46,4 г.) в воде (232 мл) при комнатной температуре. Смесь перемешивают еще в течение 1 час. и упаривают в вакууме. Остаток распределяют между этилацетатом (1,1 л. ) и насыщенным раствором соли (550 мл). Органический слой моют 1N раствором соляной кислоты (550 мл), сушат над сульфатом магния и упаривают, получая (R)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ол (108,96 г.) в виде белого порошка.
Т. пл. 76 - 78oC
[α]
ИК-спектр (Nujol): 3300, 1610, 810, 700 см-1
ЯМР-спектр (хлороформ-d, δ): 1,40 - 1,65 (2H, мульт.), 1,70 - 1,95 (2H, мульт. ), 1,95 - 2,20 (1H, мульт.), 2,65 - 2,75 (2H, мульт.), 2,90 - 3,10 (2H, мульт.), 3,78 (3H, сингл.), 3,65 - 3,90 (1H, мульт.), 6,66 (1H, дублет дублетов, J = 8,1 Гц, 2,7 Гц), 6,73 (1H, дубл., J = 2,7 Гц), 6,98 (1H, дубл. , J = 8,1 Гц)
Масс-спектр (m/z): 192 (M+), 135
Препарат 77.
К раствору (R)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ола (108,96 г. ) в пиридине (550 мл) при 10oC - 13oC прибавляют порциями п-толуолсульфохлорид (129,66 г. ). Полученную смесь перемешивают при комнатной температуре в течение 1 дня. Растворитель удаляют в вакууме и остаток распределяют между этилацетатом (1600 мл) и водой (1080 мл). Органический слой последовательно моют 1N раствором соляной кислоты (1080 мл), водным раствором бикарбоната натрия (1080 мл) и насыщенным раствором соли (500 мл), сушат над сульфатом магния и упаривают, получая бесцветный порошок. Его промывают н-гексаном (дважды) и получают (R)-3-метокси-6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-ил-4-метилбензолсульфонат (182,23 г.)
Т. пл. 88 - 89oC
[α]
ИК-спектр (Nujol): 1610, 1590, 1350, 1180, 760 см-1
ЯМР-спектр (хлороформ-d, δ): 1,20 - 1,50 (1H, мульт.), 1,75 - 2,25 (3H, мульт. ) 2,46 (3H, сингл.), 2,55 - 2,70 (2H, мульт.) 2,84 (1H, дублет триплетов, J = 13,8 Гц, 1,7 Гц), 3,08 (1H, дублет дублетов, J = 13,8 Гц, 10,1 Гц), 3,75 (3H, сингл.), 4,54 - 4,55 (1H, мульт.), 6,44 (1H, дубл., J = 2,7 Гц), 6,65 (1H, дублет дублетов, J = 8,2 Гц, 2,7 Гц), 6,95 (1H, дубл., J = 8,2 Гц), 7,30 - 7,40 (2H, мульт.) 7,75 - 7,85 (2H, мульт.)
Масс-спектр (m/z): 346 (M+), 174
Препарат 78.
Следующие соединения были получены по методике, аналогичной той, которая описана для препарата 77.
1) (S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил-4-метилбензолсульфонат
Т. пл. 92 - 95oC
[α]
ИК-спектр (Nujol): 1610, 1600, 1580, 1350, 1180, 760, 720 см-1
ЯМР-спектр (хлороформ-d, δ ): 1,10 - 1,50 (1H, мульт.), 1,75 - 2,20 (3H, мульт. ), 2,46 (3H, сингл. ), 2,55 - 2,75 (2H, мульт.), 2,75 - 2,95 (1H, мульт. ), 2,95 - 3,15 (1H, мульт.), 3,75 (3H, сингл.), 4,35 - 4,55 (1H, мульт. ), 6,45 (1H, дубл., J = 2,6 Гц), 6,65 (1H, дублет дублетов, J = 8,2 Гц, 2,6 Гц), 6,95 (1H, дубл., J = 8,2 Гц), 7,34 (2H, дубл., J = 8,1 Гц), 7,79 (2H, дубл., J = 8,1 Гц).
Масс-спектр (m/z): 346 (M+), 174
2) 3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил-4-метилбензолсульфонат
Т. пл. 76 - 78oC
ИК-спектр (Nujol): 1600, 1350, 1170, 820, 750 см-1
ЯМР-спектр (хлороформ-d, δ): 1,15 - 1,50 (1H, мульт.), 1,75 - 2,20 (3H, мульт. ), 2,46 (3H, сингл. ), 2,60 - 2,70 (2H, мульт.), 2,80 - 2,90 (1H, мульт. ), 3,00 - 3,15 (1H, мульт.), 3,76 (3H, сингл.), 4,35 - 4,55 (1H, мульт. ), 6,45 (1H, дубл., J = 2,7 Гц), 6,65 (1H, дублет дублетов, J = 8,2 Гц, 2,7 Гц), 6,95 (1H, дубл., J = 8,2 Гц), 7,34 (2H, дубл., J = 8,1 Гц), 7,79 (2H, дубл., J = 8,1 Гц).
Масс-спектр (m/z): 346 (M+), 174
3) 3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-илметансульфонат
Т. пл. 96 - 97oC
ИК-спектр (Nujol): 1610, 1340, 1200, 770, 740, 720 см-1
ЯМР-спектр (хлороформ-d, δ): 1,35 - 1,70 (1H, мульт.), 1,75 - 2,15 (2H, мульт. ), 2,15 - 2,40 (1H, мульт.), 2,70 - 2,75 (2H, мульт.), 3,00 (3H, сингл. ), 3,10 - 3,30 (2H, мульт.), 3,78 (3H, сингл.), 4,65 - 4,85 (1H, мульт.), 6,65 - 6,80 (2H, мульт.), 7,00 (1H, дубл., J = 8,1 Гц).
Масс-спектр (m/z): 270 (M+), 159
Препарат 79.
К раствору (S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил-4-метилбензолсульфоната (181,0 г.) в диметилсульфоксиде (2170 мл) при комнатной температуре прибавляют порциями азид натрия (67,93 г.) и полученную смесь перемешивают при 40oC в течение 2 дней. Реакционную смесь выливают в смесь этилацетата (2,2 л.) и ледяной воды (2,2 л.). Органический слой отделяют, моют последовательно водным раствором бикарбоната натрия (1,1 л.), водой (1,1 л. трижды) и насыщенным раствором соли (550 мл), сушат над сульфатом магния, обрабатывают активированным углем и упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель 350 г, н-гексан:этилацетат = 10:1), получая сырье азидо-производное [ИК-спектр (пленка), 2100 см-1 (-N3)]. Смешивают полученное соединение (111,2 г.) с формиатом аммония (96,82 г. ) и 10%-ным палладием на угле (50% вл. 7,78 г.) в метаноле и кипятят с обратным холодильником в течение 1 час. После охлаждения смеси катализатор отфильтровывают и фильтрат упаривают в вакууме. Остаток распределяют между этилацетатом (1 л.) и 2N водным раствором едкого натра (1,5 л. ). Органический слой отделяют, моют водой (1 л.) и насыщенным раствором соли (500 мл), сушат над поташом и растворитель удаляют в вакууме. Остаток обрабатывают 4N раствором хлористого водорода в этилацетате при охлаждении в бане со льдом, получая (S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид (86,8 г.) в виде бесцветных кристаллов.
Т. пл. 258 - 261oC
[α]
ИК-спектр (Nujol): 2610, 2500, 1610, 830, 760, 720 см.
ЯМР-спектр (DМСО-d, δ): 1,15 - 1,25 (1H, мульт.), 1,65 - 2,05 (2H, мульт. ), 2,05 - 2,25 (1H, мульт.), 2,60 - 2,75 (2H, мульт.), 2,85 - 3,10 (3H, мульт.), 3,72 (3H, сингл.), 6,60 - 6,75 (2H, мульт.), 7,00 - 7,10 (1H, мульт.), 8,15 (3H, шир. сингл.).
Масс-спектр (m/z): 191 (M+), 148
Препарат 80.
Следующие соединения были получены по методике, аналогичной, которая описана для препарата 79.
1) (R)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин-гидрохлорид
Т. пл. 264 - 265oC
[α]
ИК-спектр (Nujol): 2610, 2500, 1610, 830, 760, 720 см-1
ЯМР-спектр (DМСО-d, δ): 1,15 - 1,25 (1H, мульт.), 1,65 - 2,05 (2H, мульт. ), 2,05 - 2,25 (1H, мульт.), 2,60 - 2,75 (2H, мульт.), 2,75 - 3,10 (3H, мульт. ), 3,72 (3H, сингл.) 6,60 - 6,75 (2H, мульт.), 7,00 - 7,10 (1H, мульт.) 8,20 (3H, шир. сингл.)
Масс-спектр (m/z): 191 (M+), 148
2) 3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-амин гидрохлорид
Т.пл. 230 - 233oC (с разл.)
ИК-спектр (Nujol): 2600, 2520, 1610, 760 см-1
ЯМР-спектр (DМСО-d, δ): 1,15 - 1,45 (1H, мульт.), 1,60 - 2,05 (2H, мульт. ), 2,05 - 2,30 (1H, мульт.) 2,55 - 2,80 (2H, мульт.) 2,80 - 3,15 (3H, мульт. ), 3,72 (3H, сингл. ), 6,60 - 6,85 (2H, мульт.), 6,95 - 7,10 (1H, мульт.) 8,19 (3H, шир. сингл.).
Масс-спектр (m/z): 191 (M+), 148
Препарат 81.
К смеси (S)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ола (1,00 г. ) фталимида (0,77 г.) и трифенилфосфина (1,36 г.) в абсолютном тетрагидрофуране при 26oC - 33oC прибавляют по каплям раствор диэтил азодикарбоксилата (0,91 г.) в абсолютном тетрагидрофуране (3 мл.). Смесь перемешивают при комнатной температуре в течение 2 дней. Растворитель упаривают в вакууме. К остатку прибавляют диэтиловый эфир (30 мл) и смесь перемешивают, выпавшие кристаллы трифенилфосфиноксида отделяют фильтрованием. Фильтрат упаривают в вакууме и остаток очищают колоночной хроматографией (силикагель, н-гексан : этилацетат (5:1), получая (R)-N-(3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил)фталимид в виде белого порошка (0,43 г.)
Т. пл. 132 - 133oC
[α]
ИК-спектр (Nujol): 1770, 1610, 800, 720 см-1
ЯМР-спектр (хлороформ): 1,15 - 1,70 (1H, мульт.), 1,90 - 2,20 (2H, мульт.) 2,40 - 3,00 (4H, мульт.), 3,77 (3H, сингл.), 3,90 - 4,10 (1H, мульт. ), 4,10 - 4,30 (1H, мульт.), 6,60 - 6,70 (2H, мульт.), 7,00 - 7,10 (1H, мульт.) 7,60 - 7,75 (2H, мульт.), 7,80 - 7,90 (2H, мульт.)
Масс-спектр (m/z): 321 (M+), 227, 174
Препарат 82.
Смесь (R)-N-(3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6- ил)фталимида (0,50 г.) и гидразин-гидрата (0,2 мл) в этаноле (78,0 мл) кипятят с обратным холодильником в течение 1 час. Выделившиеся осадки отфильтровывают и фильтрат упаривают в вакууме. Остаток распределяют между этилацетатом и 1N водным раствором едкого натра. Органический слой моют водой и насыщенным раствором соли, сушат над сульфатом магния и упаривают в вакууме. Остаток обрабатывают 4N раствором хлористого водорода в этилацетате, получая (R)-3-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен- 6-амин гидрохлорид.
Т.пл. 264 - 265oC
Раствор 2-бромацетилнафталина (7,00 г. ) и тетра-н-бутиламмонийбромид (0,906 г. ) в 1,2-дихлорэтане (226 мл) кипятят с обратным холодильником в течение 3,5 час, затем смесь упаривают в вакууме и экстрагируют дихлорметаном. Экстракт промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают в вакууме. Остаток моют н-гексаном и получают 2-хлорацетилнафталин (4,43 г) в виде порошка желтого цвета.
ИК-спектр (Nujol): 1680 см-1
ЯМР-спектр (хлороформ-d, δ): 4,81 (2H, сингл.) 7,5 - 7,6 (2H, мульт.) 7,8 - 8,0 (4H, мульт.) 7,43 (1H, сингл.)
Масс-спектр (m/z): 206 и 204 (M+), 155, 127
Препарат 84.
Смесь 2-ацетонафтона (3,40 г.) и диоксида селена (4,88 г.) в смеси диоксана (200 мл) и воды (1 мл.) кипятят при перемешивании в течение 6 час и отфильтровывают, фильтр концентрируют в вакууме и экстрагируют диэтиловым эфиром. Экстракт промывают трижды насыщенным раствором соли, сушат над сульфатом магния и упаривают в вакууме, получая бледно-коричневый порошок 2,2''-оксибис(2-окси-2'-ацетонафтона) (3,21 г.)
Т. пл.: 112 - 122oC
ИК-спектр (Nujol): 3320, 1690 см-1
ЯМР-спектр (хлороформ-d, δ): 5,06 (2H, шир. сингл.), 6,58 (2H, сингл.), 7,2 - 8,3 (12H, мульт.), 8,75 (2H, сингл.).
Масс-спектр (m/z): 184, 155, 127
Препарат 85.
Следующие соединения были получены по методике, аналогичной той, которая описана для препарата 84.
1) 2,2''-оксибис(2-окси-1'-ацетонафтон)
Т. пл.: 89 - 91oC
ИК-спектр (Nujol): 3410, 3270, 1665 см-1
ЯМР-спектр (хлороформ-d, δ): 5,16 (2H, шир. сингл.), 6,50 (2H, сингл.) 7,4 - 7,7 (6H, мульт.) 7,85 (2H, дубл., J = 8,6 Гц), 8,06 (2H, дубл., J = 8,2 Гц), 8,40 (2H, дублет дублетов, J = 1,1 Гц, 7,4 Гц), 8,99 (2H, дублет дублетов, J = 0,8 Гц, 8,4 Гц)
Масс-спектр (m/z): 184, 155
2) 2,2''-оксибис[2-окси-1-(5'-инданил)этанон]
Т. пл. 111 - 122oC
ИК-спектр (Nujol): 3380, 1670, 1600 см-1
ЯМР-спектр (хлороформ-d, δ): 2,06 (2H, трипл., J = 7,4 Гц), 2,14 (2Н, трипл. , J = 7,4 Гц), 2,94 (8H, трипл., J = 7,4 Гц), 5,06 (2H, дубл., J = 10,0 Гц), 6,33 (2H, дубл., J = 10,0 Гц), 7,29 (2H, дубл., J = 11,9 Гц), 7,92 (2H, дубл., J = 11,9 Гц), 7,95 (2H, сингл.)
3) 2,2''-оксибис[1-(5'-бензофуразанил)-2-оксиэтанон]
ЯМР-спектр (хлороформ-d, δ ): 4,46 (2H, дубл., J = 10 Гц), 5,72 (2H, дубл., J = 19 Гц), 7,9 - 8,2 (4H, мульт.), 8,6 - 8,7 (2H, мульт.)
Препарат 86.
К суспензии трет-бутоксида калия (0,82 г.) в тетрагидрофуране (6,6 мл), охлаждаемой в бане со льдом, прибавляют раствор триметилсульфонийиодида (98% чистоты, 1,5 г. ) в диметилсульфоксиде (6,6 мл). По окончании прибавления указанного раствора к смеси, температуру которой поддерживают ниже 5oC, прибавляют по каплям раствор пиперонала (1,0 г.) в тетрагидрофуране (3,3 мл). После перемешивания при комнатной температуре в течение 1 часа, смесь выливают в воду и один раз экстрагируют этилацетатом. Экстракт дважды моют водой и один раз насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая 3,4-метилендиоксифенилоксиран (1,0 г.) который без дальнейшей очистки используют в следующей реакции.
ЯМР-спектр (хлороформ-d, δ): 2,74 (1H, дублет дублетов, J = 2 Гц, 5 Гц), 3,09 (1H, дублет дублетов, J = 4 Гц, 5 Гц), 3,78 (1H, дублет дублетов, J = 2 Гц, 4 Гц), 5,94 (2H, сингл.), 6,6 - 6,9 (3H, мульт.)
Масс-спектр (m/z): 164
Препарат 87.
К охлаждаемой в бане со льдом смеси п-толуолсульфоната бензилового эфира L-тирозина (41,0 г.), пиридина (16,4 мл) и дихлорметана (92 мл) прибавляют метилформиат (7,8 мл). Смесь перемешивают в бане со льдом в течение 1 час, разбавляют водой и один раз экстрагируют дихлорметаном. Экстракт упаривают в вакууме, остаток растворяют в этилацетате, моют водой и насыщенным раствором соли, сушат над сульфатом магния и упаривают в вакууме. Очищая продукт колоночной хроматографией на силикагеле (градиентное элюирование, хлороформ-этилацетат: от 10:1 до 5:1), получают бензиловый эфир N-метоксикарбонил L-тирозина (22,0 г.)
Т. пл. 100 - 101oC
ИК-спектр (Nujol): 3360, 1720, 1700 см-1
ЯМР-спектр (хлороформ-d, δ): 3,01 (2H, дубл., J = 6 Гц), 3,65 (3H, сингл. ) 4,5 - 4,8 (1H, мульт.) 4,8 - 5,6 (4H, мульт.) 6,6 - 6,8 (2H, мульт.) 6,8 - 7,0 (2H, мульт.), 7,2 - 7,6 (5H, мульт.)
Масс-спектр (m/z): 329
Препарат 88.
Смесь бензилового эфира N-метоксикарбонил L-тирозина (22,0 г) иодистого метила (10,8 мл) карбоната калия (24,0 г) и N,N-диметилформамида (87 мл) перемешивают при комнатной температуре в течение 5 час. Смесь разбавляют дихлорметаном (87 мл) и фильтруют. Фильтрат упаривают в вакууме и остаток растворяют в этилацетате, моют водой и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме. Сырой продукт очищают пульверизацией в петролейном эфире, получая бензиловый эфир N-метоксикарбонил-O-метил-L-тирозина (16,0 г.)
Т. пл. 83 - 84oC
ИК-спектр (Nujol): 3430, 1730 см-1
ЯМР-спектр (хлороформ-d, δ): 3,03 (2H, дубл. , J = 6 Гц), 3,66 (3H, сингл. ) 3,76 (3H, сингл.) 4,5 - 4,8 (1H, мульт.) 5,0 - 5,3 (3H, мульт.) 6,7 - 6,8 (2H, мульт.) 6,8 - 7,0 (2H, мульт.) 7,2 - 7,5 (5H, мульт.)
Масс-спектр (m/z): 268 (M-H2CO2Me)+
Препарат 89.
Смесь бензилового эфира N-метоксикарбонил-О-метил-L-тирозина (15,5 г.) 10%-ного палладия на угле (0,73 г.) и тетрагидрофурана (14,5 мл) встряхивают при комнатной температуре в атмосфере водорода в течение 2 час. Вносят дополнительное количество 10%-ного палладия на угле (0,73 г.) и встряхивание продолжают еще в течение 2 час. Катализатор отфильтровывают и промывают гидрофураном. Фильтрат и промывочный раствор объединяют и упаривают в вакууме, получая N-метоксикарбонил-O-метил-L-тирозин (10,5 г.)
Т. пл. 85 - 86oC
ИК-спектр (Nujol): 3260, 3140, 1730, 1660 см-1
ЯМР-спектр (хлороформ-d, δ): 2,9 - 3,2 (2H, мульт.) 3,67 (3H, сингл.) 3,79 (3H, сингл. ) 4,5 - 4,8 (1H, мульт.) 5,0 - 5,2 (1H, мульт.) 6,7 - 6,9 (2H, мульт.) 7,0 - 7,2 (2H, мульт.)
Масс-спектр (m/z): 221 (M-CH3OH)+
Препарат 90.
К раствору N-метоксикарбонил-O-метил-L-тирозина (0,5 г.) в дихлорметане (2 мл) прибавляют хлористый тионил (0,29 мл). После перемешивания в течение 1 час при комнатной температуре реакционную смесь упаривают в вакууме. Остаток растворяют в дихлорметане (5 мл) и обрабатывают при охлаждении в бане со льдом 0,9 М раствором дихлорида этилалюминия в дихлорметане (4,4 мл). Дают полученной смеси нагреться до комнатной температуры и оставляют перемешиваться на ночь. Выливают в концентрированную соляную кислоту над ледяной крошкой и один раз экстрагируют дихлорметаном. Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан-этилацетат (10:1), и получают 6-метокси-2-(метоксикарбониламино)индан-1-он (0,12 г.)
Т. пл. 174 - 177oC
ИК-спектр (Nujol): 3330, 1720, 1680 см-1
ЯМР-спектр (хлороформ-d, δ): 2,86 (1H, дублет дублетов, J = 5 Гц, 16 Гц), 3,38 (1H, дублет дублетов, J = 8 Гц, 16 Гц), 3,54 (3H, сингл.) 3,80 (3H, сингл.), 4,26 (1H, двойной дублет дублетов, J = 5 Гц, 8 Гц), 7,11 (1H, дубл. , J = 2 Гц), 7,28 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 7,45 (1H, дубл., J = 8 Гц), 7,69 (1H, дубл., J = 8 Гц).
Масс-спектр (m/z): 235
Препарат 91.
Смесь 6-метокси-2-(метоксикарбониламино) индал-1-она (0,30 г) эфирата трехфтористого бора (0,90 мл) и этандитиола (0,90 мл) перемешивают при комнатной температуре в течение 2 час. Выливают смесь в насыщенный водный раствор бикарбоната натрия и дважды экстрагируют этилацетатом. Экстракты объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, н-гексан-этилацетат, от 5:1 до 2:1), получая этилендитиоацеталь 6-метокси-2-(метоксикарбониламино) индан-1-она (0,48 г) в виде масла.
ИК-спектр (пленка): 3330, 1700 см-1
ЯМР-спектр (хлороформ-d, δ): 2,63 (1H, дублет дублетов, J=7,8 Гц, 15 Гц) 3,0 - 3,6 (5H, мульт) 3,72 (3H, сингл.) 3,81 (3H, сингл.) 4,5 - 4,8 (1H, мульт), 5,3 - 5,6 (1H, мульт.), 6,78 (1H, дублет дублетов, J = 2 Гц, 8 Гц) 6,9 - 7,1 (2H, мульт.)
Масс-спектр (m/z): 311
Препарат 92.
Смесь этилендитиоацеталя 6-метокси-2-(метоксикарбониламино) индан-1-она (0,12 г), никеля Ренея (суспензия в воде, 5 мл) и этанола (12 мл) кипятят с обратным холодильником в течение 0,5 час. фильтруют и промывают катализатор горячим этанолом. Фильтрат и промывочный раствор объединяют и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (элюент - хлороформ), получая 5-метокси-N-метоксикарбонилиндан-2-амин (0,08 г).
Т. пл. 120-121oC
ИК-спектр (Nujol): 3290, 1670 см-1
ЯМР-спектр (DMCO-d6, δ): 2,5 - 2,9 (2H, мульт.) 2,9 - 3,2 (2H, мульт.), 3,52 (3H, сингл) 3,69 (3H, сингл), 4,1 - 4,3 (1H, мульт) 6,68 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,77 (1H, дубл. J=2 Гц), 7,07 (1H, дубл. J=8 Гц) 7,3 - 7,5 (1H, мульт.)
Масс-спектр (m/z): 221
Препарат 93.
Смесь 5-метокси-N-метоксикарбонилиндан-2-амина (0,25 г) и 47%-ной бромистоводородной кислоты (20 мл) кипятят с обратным холодильником в течение 4 час. После охлаждения смесь упаривают в вакууме. К остатку прибавляют толуол и полученный раствор упаривают досуха в вакууме, получая 5-оксииндан-2-амин гидробромид (0,26 г)
Т. пл. > 235oC (с разл.)
ИК-спектр (Nujol) : 3370 см-1
ЯМР-спектр (DMCO-d6, δ): 2,7 - 3,0 (2H, мульт) 3,0 - 3,3 (2H, мульт) 3,8 - 4,1 (1H, мульт) 6,5 - 6,8 (2H, мульт) 7,04 (1H, дубл. J = 7 Гц), 8,03 (3H, шир.сингл.) 9,24 (1H, шир. сингл.).
Масс-спектр (m/z): 149
Препарат 94.
Смесь 5-оксииндан-2-амин гидробромида (0,66 г) триэтиламина (0,95 мл) ди-трет-бутилдикарбоната (0,75 г) и N,N-диметилформамида (6,6 мл) перемешивают при комнатной температуре в течение 4 час, разбавляют этилацетатом и выпавшие осадки отфильтровывают. Фильтрат упаривают в вакууме, получая сырой продукт, который далее очищают колоночной хроматографией на силикагеле (элюент 5: 1 - н-гексан-этилацетат), получая N-трет-бутоксикарбонил-5-оксииндан-2-амин (0,44 г.)
ИК-спектр (пленка): 3330, 1670 см-1
ЯМР-спектр (хлороформ-d, δ): 1,45 (9H, сингл.) 2,6 - 2,8 (2H, мульт) 3,1 - 3,4 (2H, мульт.), 4,3 - 4,6 (1H, шир. мульт.), 4,6 - 4,9 (1H, шир, мульт) 5,32 (1H, шир. сингл. ), 6,64 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,70 (1H, шир, сингл) 7,04 (1H, дубл., J = 8 Гц)
Масс-спектр (m/z) : 249
Препарат 95.
Смесь N-трет-бутоксикарбонил-5-оксииндан-2-амина (0,42 г), карбоната калия (0,34 г. ) этилбромацетата (0,24 мл) и N,N-диметилформамида (4,2 мл) перемешивают при комнатной температуре в течение 20 час. Вносят дополнительное количество этилбромацетата (0,12 мл) и карбоната калия (0,17 г) и перемешивание продолжают еще в течение 12 час. Разбавляют смесь этилацетатом и выпавшие осадки отфильтровывают. Фильтрат упаривают в вакууме, остаток растворяют в этилацетате, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (элюент - 5:1 н-гексан-этилацетат), получая N-трет-бутоксикарбонил-5-этоксикарбонилметоксииндал-2-амин (0,44 г).
Т. пл. 73 - 75oC
ИК-спектр (Nujol) : 3400, 1750, 1700 см-1
ЯМР-спектр (хлороформ-d, δ): 1,30 (3H, трип. J=7 Гц), 1,44 (9H, сингл.) 2,6 - 2,9 (2H, мульт.) 3,1 - 3,4 (2H, мульт) 4,27 (2H, кварт. J= 7 Гц), 4,3 - 4,5 (1H, шир. мульт) 4,58 (2H, сингл.) 4,6 - 4,9 (1H, шир. мульт) 6,72 (1H, дублет дублетов J = 2 Гц), 6,76 (1H, шир. сингл.) 7,10 (1H, дубл. J = 8 Гц).
Масс-спектр (m/z) : 335
Препарат 96.
Смесь N-трет-бутоксикарбонил-5-этоксикарбонилметоксииндан-2-амина (0,39 г) и 4 N раствора хлористого водорода в 1,4 - диоксане (11,6 мл) оставляют стоять при комнатной температуре на 2 час. Упаривают смесь в вакууме и получают твердый продукт, который моют ди-изо-пропиловым эфиром и сушат в вакууме, получая 5 - (этоксикарбонилметокси) индан-2-амин гидхлорид (0,247 г)
Т. пл. 155 - 160oC
ИК-спектр (Nujol): 2600, 1750 см-1
ЯМР-спектр (DMCO-d6, δ): 1,21 (3H, трипл., J = 7 Гц),
2,8 - 3,0 (2H, мульт.) 3,0 - 3,4 (2H, мульт.) 3,9 - 4,1 (1H, мульт.) 4,15 (2H, кварт., J = 7 Гц), 4,73 (2H, сингл.),
6,75 (1H, дублет дублетов, J - 2 Гц, 8 Гц),
6,85 (1H, дубл., J=2 Гц), 7,16 (1H, дубл., J = 8 Гц),
8,23 (3H, шир. сингл.).
Масс-спектр (m/z): 235
Пример 1.
1) Смесь 6-амино-3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H-бензоциклогептена (1,0 г) окиси (R)-3-хлорстирола (0,58 г.) и н-пропанола (7,6 мл) кипятят с обратным холодильником в течение 3 час. После охлаждения реакционную смесь упаривают в вакууме. Первичная хроматография на силикагеле (градиентное элюирование, сначала г-гексан-этилацетат 3:1, затем этилацетати, наконец, этилацетат-этанол, от 25:1 к 10:1) позволяет получить около 0,8 г. сырого продукта. Далее проводят тонкопленочную хроматографию на силикагеле (градиентное элюирование, 1:3 н-гексан-этилацетат к 25:1 этилацетат - этанол) и получают смесь (1R, 6'R) и (1R, 6'S) - 2 -[(3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил) амино] -1-(3-хлорфенил)этанола (0,60 г.)
2) Полученную смесь (0,60 г.) растворяют в этилацетате (2,5 мл) и при охлаждении обрабатывают 4N раствором хлористого водорода в этилацетате (3,5 мл). Перемешивают 5 минут, упаривают смесь в вакууме. Растворяют остаток в этаноле (5 мл) и осаждают, прибавляя н-гексан (40 мл). Растворитель удаляют в вакууме, образовавшееся твердое вещество собирают, промывают н-гексаном и сушат, получая смесь (1R, 6'R) - и (1R, 6'S) - 2-[(3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил) амино] -1-(3-хлорфенил) этанол гидрохлорида (0,54 г.)
Т. пл. 114-119oC
ИК-спектр (Nujol): 3400, 3170, 1740 cм-1
ЯМР-спектр (DMCO-d6, δ): 1,19 (3H, трипл. J = 7 Гц), 1,20 (3H, трипл. J = 7 Гц), 1,1 - 1,5 (2H, мульт.), 1,7 - 2,1 (4H, мульт) 2,2 - 2,5 (2H, мульт. ) 2,5 - 2,9 (4H, мульт.) 2,9 - 3,4 (12H, мульт.) 4,14 (2H, кварт.J = 7 Гц), 4,16 (2H, кварт. J = 7 Гц), 4,70 (2H, сингл.) 4,71 (2H, сингл) 4,9 - 5,1 (2H, мульт. ), 6,3 - 6,4 (2H, мульт.) 6,6 - 6,8 (2H, мульт.) 6,8 - 6,9 (2H, мульт. ) 7,0 - 7,1 (2H, мульт.) 7,3 - 7,6 (8H, мульт.) 8.8 - 9,6 (2H, мульт. ).
FAB масс-спектр (m/z): 420 (M+ + 3 - HCl), 418 (M+ + 1-HCl)
Пример 2.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 1.
1) (1R, 6'R) - и (1R, 6'S) - 2 - [(2-этоксикарбонилметокси-6,6,7,8,9- тетрагидро-5H-бензоциклогептен-6-ил) амино] -1-(3-хлорфенил)этанол гидрохлорид
ИК-спектр (Nujol): 3300, 1740 см-1
ЯМР-спектр (DMCO-d6, δ): 1,29 (6H, трипл. J=7 Гц), 1,3 - 2,3 (8H, мульт. ) 2,3 - 2,6 (2H, мульт.) 2,6 - 2,9 (4H, мульт.) 2,9 - 3,5 (10H, мульт.), 4,26 (2H, кварт. J= 7 Гц), 4,56 (4H, сингл.), 5,2 - 5,8 (2H, мульт.) 6,4 - 6,8 (4H, мульт.) 6,9 - 7,6 (10H, мульт.) 8,2 - 8,8 (2H, мульт.) 9,6 - 10,4 (2H, мульт.)
FАВ масс-спектр (m/z): 420 (M+ + 3 -HCl), 418 (M++1-HCl)
2) (1R, 6'R) и (1R, 6'S) -2-[(3-этоксикарбонилметокси-5,6,7,8,9,10-гексагидробензоциклооктен-6-ил)амино]-1-(3-хлорфенил)этанол гидрохлорид
Т. пл. 62-66oC
ИК-спектр (Nujol): 3275, 1750, 1605, 1575, 1500, 1200 см-1
ЯМР-спектр (DMCO-d6, δ): 0,80-1,0 (2Н, мульт.), 1,20 (6Н, трипл., J = 7,1 Гц), 1,30 - 1,90 (10H, мульт.), 2,57 - 2,89 (4H, мульт.) 3,0 - 3,45 (10H, мульт.), 4,16 (4H, кварт. J = 7,1 Гц), 4,72 (4H, мульт.), 4,95 - 5,13 (2H, мульт.) 6,3 - 6,4 (2H, мульт).)
6,7 - 6,8 (2H, мульт) 6,8 - 6,9 (2H, мульт.)
7,0 - 7,1 (2H, мульт.) 7,35 - 7,6 (8H, мульт.) 8,5 - 9,4 (4H, мульт.)
FAB масс-спектр (m/z): 434 (M+ + 3-HCl), 432 (M++ 1-HCl)
3) (1R, 6'S)-2-[(3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-ил)амино]1-(3-хлорфенил)этанол гидрохлорид
Т. пл. 91 - 98oC
[α]
ИК-спектр (Nujol): 3360, 1750, 1595 см-1
ЯМР-спектр (DMCO-d6, δ): 1,19 (3H, трипл. J = 7 Гц), 1,2 - 1,4 (1H, мульт. ) 1,7 - 2,1 (2H, мульт.) 2,2 - 2,4 (1H, мульт.) 2,6 - 2,8 (2H, мульт.) 2,9 - 3,3 (5H, мульт.) 4,15 (2H, кварт. J = 7 Гц), 4,70 (2H, сингл.) 4,9 - 5,1 (1H, мульт) 6,33 (1H, дубл. J = 4 Гц) 6,6 (1H, дублет дублетов, J = 2 Гц, 8 Гц) 6,87 (1H, дубл.J = 2 Гц), 7,03 (1H, дубл. J = 8 Гц), 7,3 - 7,6 (4H, мульт.) 8,6 - 9,3 (2H, мульт.)
FAB масс-спектр (m/z): 420 (M++ 3-HCl), 418 (M++ 1-HCl)
Хим.анализ для: C23H28ClNO4HCl•H2O
Вычислено, %: C 58,47; H 6,61; N 2.96;
Найдено, %: C 58,63; H 6,79; N 2,98.
4) (1R, 6'R)-2-[(3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-ил)амино]-1-(3-хлорфенил)этанол гидрохлорид
ИК-спектр (Nujol): 3500-2000, 1740 см-1
ЯМР-спектр (DMCO-d6, δ): 1,20 (3H, трипл. , J = 7 Гц), 1,1-1,4 (1H, мульт. ), 1,6-2,1 (2H, мульт.), 2,2-2,4 (1H, мульт.), 2,6-2,8 (2H, мульт.), 2,9-3,4 (5H, мульт.), 4,16 (2H, кварт., J = 7 Гц), 4,71 (2H, сингл.), 4,9-5,1 (1H, мульт.), 6,34 (1H, дубл., J = 3 Гц), 6,67 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,81 (1H, дубл., J = 2 Гц), 7,04 (1H, дубл., J = 8 Гц), 7,3 -7,6 (4H, мульт.), 8,6-8,9 (1H, мульт.), 9,1-9,4 (1H, мульт.)
FAB масс-спектр (m/z): 420 (M+ + 3 -HCl), 418 (M+-HCl)
5) (1R, 2'R)- и (1S, 2'S)-2-[(7-этоксикарбонилметокси-1,2,3,4- тетрагидро-2-нафтил)амино]-1-(3,4-метилендиоксифенил)этанол гидрохлорид
Т. пл. 175-180oC
ИК-спектр (Nujol) : 3320, 2500, 2400, 1750 см-1
ЯМР-спектр (DMCO-d6, δ): 1,20 (CH, трипл. J = 7 Гц), 1,6-2,0 (2H, мульт. ), 2,2-2,5 (2H, мульт.), 2,6-3,6 (14H, мульт.), 4,15 (4H, кварт., J = 7 Гц), 4,71 (4H, сингл. ), 4,9-5,1 (2H, мульт.), 6,02 (4H, сингл.), 6,1-6,2 (2H, мульт. ), 6,6-6,8 (4H, мульт.), 6,8-7,1 (8H, мульт.), 8,7-9,1 (2H, шир. мульт.), 9,2-9,6 (2H, шир. мульт.)
Масс-спектр (m/z): 414 (M+1)+
6) (1R, 2'R)- и (1S, 2'S)-2-[(7-этоксикарбонилметокси-1,2,3,4- тетрагидро-2-нафтил)амино]-1-(5-бензофуразанил) этанол гидрохлорид
Т. пл. 205-220oC
ИК-спектр (Nujol): 3300, 1750 см-1
ЯМР-спектр (DMCO-d6, δ): 1,20 (CH, трипл., J = 7 Гц), 1,6-2,0 (2H, мульт. ), 2,2-2,5 (2H, мульт.), 2,6-3,7 (14H, мульт.), 4,15 (4H, кварт., J = 7 Гц), 4,72 (2H, сингл.), 5,25 (2H, мульт.), 6,5-6,9 (4H, мульт.), 7,02 (2H, дубл. , J = 8 Гц), 7,71 (2H, дубл., J = 9 Гц), 8,05 (2H, сингл.), 8,12 (2H, дубл., J = 9 Гц), 8,9-9,3 (2H, шир. мульт.), 9,4-9,8 (2H, шир. мульт.)
Масс-спектр (m/z): 412 (M+1)+
7) (1R, 6'R)- и (1R, 6'S)-2-[N-бензил[3-(2-этоксикарбонилпропан- 2-илокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил] амино] -2- (3-хлорфенил)этанол гидрохлорид
Т. пл. 95-106oC
ИК-спектр (Nujol) : 3170, 1720, 1600 см-1
ЯМР-спектр (DMCO-d6, δ): 1,0-1,3 (8H, мульт.), 1,4-1,6 (12H, мульт.), 1,8-2,2 (4H, мульт.), 2,4-2,8 (6H, мульт.), 2,9-3,7 (10H, мульт.), 4,05-4,3 (4H, мульт), 4,6-5,6 (6H, мульт.), 6,3-8,0 (26H, мульт.), 10,2-11,2 (2H, мульт.)
Масс-спектр (m/z) : 536 (M+ + 1-HCl)
8) (-)-(2'S)-1-(6-хлор-2-пиридил)2-[(7-этоксикарбонилметокси- 1,2,3,4-тетрагидро-2-нафтил)амино]этанол
Т. пл. 107-109oC
[α]
ИК-спектр (Nujol): 3260, 1730 см-1
ЯМР-спектр (хлороформ-d, δ ) : 1,30 (3H, трипл., J = 7,1 Гц), 1,46-1,73 (1H, мульт.), 1,96-2,15 (1H, мульт.), 2,44-3,30 (7H, мульт.), 1,70-3,10 (2H, шир. мульт. ), 4,27 (2Н, кварт., J = 7,1 Гц), 4,66-4,81 (1H, мульт.), 6,59 (1H, дубл. , J = 2,5 Гц), 6,69 (1H, дублет дублетов, J = 2,7 Гц, 8,4 Гц), 6,98 (1H, дубл., J = 8,4 Гц), 7,23 (1H, дубл., J = 7,8 Гц), 7,44 (1H, дубл., J = 7,6 Гц), 7,67 (1H, псевдо трипл., J = 7,7 Гц).
9) (1R, 2'R)- и (1R, 2'S)-1-[(3-хлорфенил)-2-(N-метилтиоэтил- 7-нитро-1,2,3,4-тетрагидро-2-нафтил)аминоэтанол
ИК-спектр (жидкость): 3400, 1510, 1340 см-1
ЯМР-спектр (хлороформ-d, δ): 1,46-1,95 (2H, мульт.), 1,99-2,24 (2H, мульт. ), 2,16 (3H, сингл.), 2,17 (3H, сингл.), 2,40-3,24 (22H, мульт.), 4,26 (2H, шир. сингл.), 4,57-4,75 (2H, мульт.), 7,26 (10H, сингл.), 7,40 (2H, сингл.), 7,90-8,09 (4H, мульт.)
10) (1R, 6'R)- и (1R, 6'S)2-[N-бензил-[3-этоксикарбонилметиламино-6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-ил] амино] -1-(3-хлорфенил)этанол дигидрохлорид
Т. пл. 132-134oC.
ИК-спектр (Nujol) : 3225, 1740 см-1
Пример 3.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 1-1).
1) (1R, 2'R)-(1R, 2'S)2-[(5-этоксикарбонилметокси-2-инданил) амино]-1-(3-хлорфенил)этанол
Т. пл. 104-105oC
ИК-спектр (Nujol): 1760 см-1
ЯМР-спектр (хлороформ-d, δ): 1,29 (6H, трипл., J = 7 Гц), 1,6-3,3 (12H, мульт.), 3,6-3,8 (2H, мульт.), 4,26 (4H, кварт., J = 7 Гц), 4,58 (4H, сингл. ), 4,65 (2H, дублет дублетов, J = 3 Гц, 8 Гц), 6,6-6,8 (4H, мульт.), 7,09 (2H, дубл., J = 7 Гц), 7,1-7,5 (8H, мульт.).
FAB масс-спектр (m/z): 392 (M++3), 390 (M++1)
2) (1R, 6'R)-2-[(3-этоксикарбонилметокси-6,7,8,9- тетрагидро-5H-бензоциклогептен-6-ил)амино-1-(3-хлорфенил)этанол
Т. пл. 98-100o
[α]
ИК-спектр (раствор в хлористом метилене): 3450 -3400, 1740 см-1
ЯМР-спектр (DMCO-d6, δ): 1,18 (3H, трипл., J = 7 Гц), 1,2-2,1 (4H, мульт.), 2,5-2,9 (7H, мульт.), 4,14 (2H, кварт., J = 7 Гц), 4,5-4,7 (1H, мульт. ), 4,68 (2H, сингл.), 5,3-5,6 (1H, мульт.), 6,58 (1H, дублет дублетов, J = 2 Гц, 8 Гц), 6,73 (1H, дубл., J = 2 Гц), 6,96 (1H, дубл., J = 8 Гц), 7,2-7,5 (4H, мульт.)
FAB масс-спектр (m/z) : 420 (M+3), 418 (M+1)
Хим. анализ для C23H28ClNO4
Вычислено, %: C 66,19; H 6,75; N 3,35;
Найдено, %: C 66,21; H 6,94; N 3,36.
3) (1R, 6'R)- или (1R, 6'S) или (1S, 6'R)- или (1S, 6'S)-1- (2-нафтил)2-[N-бензил-(3-окси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил) амино] этанол (изомер A)
ЯМР-спектр (хлороформ-d, δ): 1,2-1,3 (1H, шир.), 2,0 (3H, шир.), 2,6-2,8 (7H, мульт.), 3,67 (1H, дубл., J = 13,6 Гц), 3,97 (1H, дубл., J = 13,6 Гц), 4,70 (1H, дублет дублетов, J = 3,9 Гц, 9,9 Гц), 6,51 (1H, дублет дублетов, J = 2,6 Гц, 8,0 Гц), 6,62 (1H, дубл., J = 2,6 Гц), 6,88 (1H, дубл., J = 8,0 Гц), 7,1-7,5 (8H, мульт.), 7,8 (4H, мульт.)
Масс-спектр (m/z): 438 ((M+ + 1)
4) (1R, 6'R)- или (1R, 6'S) или (1S, 6'R)- или (1S, 6'S)-1-(2-нафтил)-2-[N-бензил(3-окси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил)амино] этанол (изомер Б)
ЯМР-спектр (хлороформ-d, δ): 1,2-1,3 (1H, шир.), 1,4-1,7 (1H, мульт.), 1,9-2,0 (1H, мульт.), 2,2-2,3 (1H, мульт.), 2,6-3,1 (7H, мульт.), 3,60 (1H, дубл. , J = 13,6 Гц), 3,84 (1H, дубл., J = 13,6 Гц), 4,59 (1H, дублет дублетов, J = 3,6 Гц, 10,1 Гц), 6,51 (1H, дублет дублетов, J = 2,6 Гц, 9,0 Гц), 6,59 (1H, дубл. , J = 2,6 Гц), 6,87 (1H, дубл., J = 9,0 Гц), 7,1-7,5 (8H, мульт.), 7,7-7,8 (4H, мульт.)
5) (1R, 2'S)- или (1S, 2'S)-1-(2-нафтил)-2-[(7-этоксикарбонилметокси-1,2,3,4-тетрагидро- 2-нафтил)амино]этанол
Т. пл. 113-114oC
[α]D = -74,16o (с = 0,48 MeOH)
ИК-спектр (Nujol): 3430, 1725 см-1
ЯМР-спектр (хлороформ-d, δ): 1,29 (3H, трипл., J = 7,2 Гц), 1,5-1,7 (1H, мульт. ), 2,0 (1H, мульт.), 2,2-3,2 (9H, мульт.), 4,22 (2H, кварт., J = 7,2 Гц), 4,56 (2H, сингл.), 4,89 (1H, дублет дублетов, J = 3,6 Гц, 8,8 Гц), 6,59 (1H, дубл. , J = 2,5 Гц), 6,68 (1H, дублет дублетов, J = 2,5 Гц, 8,3 Гц), 6,99 (1H, дуб., J = 8,3 Гц), 7,4-7,5 (3H, мульт.), 7,8-7,9 (4H, мульт.)
Масс-спектр (m/z) : 420 (M+ + 1), 401 и 388
Пример 4.
1) Смесь 2-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-амина (0,69 г) окиси (R)-3-хлор-стирола (0,44 г) и н-пропанола (5,2 мл) кипятят с обратным холодильником в течение 1,5 час. После охлаждения реакционную смесь упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле (этилацетат-этанол, 100:1) и получают смесь (1R, 6'R)- и (1R, 6'S)-2-[(2- этоксикарбонилметокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил) амино]-1-(3-хлорфенил)этанола (0,46 г)
Полученную смесь (0,33 г) растворяют в этаноле (3,3 мл) и обрабатывают раствором щавелевой кислоты (71 мг) в этаноле (3,3 мл). По прошествии 5 минут смесь упаривают в вакууме. Остаток растворяют в этилацетате (3,3 мл) и осаждают прибавлением ди-изо-пропилового эфира (3,3 мл). Растворитель удаляют в вакууме, и осадок высушивают, получая смесь (1R, 6'R)- и (1R, 6'S)-2-[(2-этоксикарбонилметокси 6,7,8,9-тетрагидро-5H- бензоциклогептен-6-ил)амино-1-(3-хлорфенил)этанол оксалата (0,40 г).
Т. пл. 65-87oC
ИК-спектр (Nujol): 3500-2200, 1750-1730 см-1.
ЯМР-спектр (DMCO-d6, δ): 1,1-1,5 (2H, мульт.), 1,20 (6H, трипл., J = 7 Гц), 1,6-2,4 (6H, мульт.), 2,5-2,8 (4H, мульт.), 2,9-3,4 (10H, мульт.), 4,15 (4H, кварт., J = 7 Гц), 4,7 (4H, сингл.), 4,8-5,1 (2H, мульт.), 5,1-6,5 (4H, мульт.), 6,5-6,8 (4H, мульт.), 7,0-7,2 (2H, мульт.), 7,3-7,6 (8H, мульт.)
FAB масс-спектр (m/z): 420 (M+ + 3 - C2H2O4), 418 (M+ + 1 - C2H2O4)
Пример 5.
К суспензии (1R, 6'R)-2-[(3-этоксикарбонилметокси-6,7,8,9- тетрагидро-5H-бензоциклогептен-6-ил)амино] -1-(3-хлорфенил)этанола (0,30 г) в 50%-ном водном растворе этанола (7,0 мл) прибавляют едкий натр (0,09 г). После перемешивания при комнатной температуре в течение 0,5 час реакционную смесь обрабатывают 3М раствором соляной кислоты (0,8 мл) и образовавшийся осадок собирают и промывают холодной водой. Осадок суспендируют в этаноле (20 мл) и полученную смесь оставляют перемешиваться на ночь при комнатной температуре. После фильтрования с последующей сушкой в вакууме получают (R)-[8-[R -2-(3-хлорфенил)-2-оксиэтиламино] -6,7,8,9-тетрагидро-5H-бензоциклогептен-2-илокси]уксусную кислоту (0,22 г)
Т. пл. 265 - 266oC
[α]
ИК-спектр (Nujol): 3500 - 2200, 1600 см-1
ЯМР-спектр (DMCO-d6+NaOD, δ): 1,0 - 2,1 (4H, мульт.), 2,3 - 3,0 (7H, мульт.) 3,9 - 4,2 (2H, мульт.) 4,5 - 4,8 (1H, мульт.), 6,4 - 7,0 (3H, мульт. ) 7,1 - 7,5 (4H, мульт.)
Масс-спектр (m/z): 392 (M+3), 390 (M+1)
Пример 6.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 5.
1) (S)-[8-[(R)-2 -(3-хлорфенил)-2-оксиэтиламино] -6,7,8,9-тетрагидро-5H-бензоциклогептен-2-илокси] уксусная кислота.
Т.пл. 247 - 249oC (с разл.)
[α]
ИК-спектр (Nujol): 2700, 2350, 1600, 1580, 1540 см-1
ЯМР-спектр (DMCO-d6 + NaOD, δ): 1,19 - 2,04 (5H, мульт.) 2,42 - 2,86 (6H, мульт. ) 4,02 (2H, сингл.) 4,47 - 4,66 (1H, мульт.) 6,47 (1H, дублет дублетов, J = 8,1 Гц, 2,5 Гц), 6,61 (1H, дубл. J = 2,5 Гц), 6,88 (1H, дуб. J = 8,1 Гц) 7,17 - 7,55 (4H, мульт.)
Хим.анализ для C21H24ClNO4
Вычислено, %: C 64,69; H 6,20; N 3,59;
Найдено, %: C 64,47; H 6,29; N 3,59.
2) 2-{ (RS) - 8 - [(R) - 2 - (3-хлорфенил) - 2 - оксиэтиламино] 6,7,8,9 -тетрагидро- 5H- бензоциклогептен-2 - илокси} 2 - 2 -метилпропионовая кислота
Т.пл. 134 - 141oC (с разл.)
ИК-спектр (Nujol): 1565, 1145 см-1
ЯМР-спектр (DMCO-d6, δ): 1,0 - 1,3 (2H, мульт.) 1,47 (6H, сигнл.) 1,50 (6H, сингл. ) 1,43 - 3,1 (20H, мульт.), 4,9 - 4,95 (2H, мульт.) 6,55 (2H, дубл. , J = 8,0 Гц), 6,68 (2H, сингл.) 6,89 (2H, дубл. J = 8,0 Гц) 7,3 - 7,5 (8H, мульт.)
3) - {(RS) - [8 - [(R)-2 - (3-хлорфенил) - 2 - оксиэтиламино]- 6,7,8,9 - тетрагидро- 5H-бензоциклогептен-2-ил}пропионовая кислота
Т.пл. 221 - 224oC
ИК-спектр (Nujol): 3210, 2650, 2325 см-1
ЯМР-спектр (DMCO-d6, δ): 1,18 - 2,10 (8H, мульт.) 2,39 - 3,00 (22H, мульт.) 4,58 - 4,75 (2H, мульт.), 5,51 (2H, шир. синг.) 6,86 - 7,08 (6H, мульт. ) 7,23 - 7,48 (8H, мульт.)
(E)- 3 -{(RS) - 8 - [(R)-2 - (3-хлорфенил) 2 - оксиэтиламино]6,7,8,9 - тетрагидро- 5H-бензоциклогептен- 2 - ил} акриловая кислота
Т.пл. 222 - 228oC
ИК-спектр (Nujol-d6, δ ) : 3500, 2670, 2340 см-1
ЯМР-спектр (DMCO-d6, δ ) : 1,20 - 2,23 (8H, мульт.) 2,58 - 3,25 (14H, мульт. ) 4,74 - 5,00 (2H, мульт.), 5,55 (2H, шир. синг.) 6,48 (2H, дубл. J = 15,9 Гц), 7,13 (2H, дубл. J = 7,8 Гц) 7,25 - 7,64 (14H, мульт.)
Пример 7.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 4.
1) (1R, 7'R) - и (1R, 7'S) - 1 - (3- хлорфенил) - 2 - [(2-этоксикарбонилметокси - 6,7,8,9 - тетрагидро- 5H- бензоциклогептен-7-ил)амино] этанол оксалат
Т.пл. 90 - 93oC (с разл.)
ИК-спектр (Nujol) 3300, 2750 - 2300, 1745, 1600, 1195 см-1
ЯМР-спектр (DMCO-d6, δ): 1,21 (6H, трипл. J = 7,1 Гц), 1,15 - 1,45 (4H, мульт. ) 2,2 - 2,35 (4H, мульт.) 2,65 - 2,85 (8H, мульт.) 2,95 - 3,35 (6H, мульт. ), 4,16 (4H, кварт. J = 7,1 Гц) 4,71 (4H, сингл.), 4,90 (2H, шир. дубл. J = 7,4 Гц), 5,55 (8H, шир.), 6,63 (2H, дублет дублетов, J = 8,2 Гц), 7,39 (6H, мульт), 7,48 (2H, мульт).
FAB масс-спектр (m/z) : 420 и 418 (M+ (своб. +1)
2) (1R, 2'R) - и (1R,2') - 1 - [(3-хлорфенил) - 2 - (N-метилтиоэтил - 7 - нитро- 1,2,3,4 - тетрагидро - 2 - нафтил) аминоэтанол оксалат
Т. пл. 90 - 109oC
ИК-спектр (Nujol) : 3250 см-1
ЯМР-спектр (DMCO-d6+ D2O, δ): 1,66 - 2,05 (2H, мульт.) 2,10 - 2,35 (2H, мульт) 2,13 (6H, сингл.), 2,72 - 3,50 (22H, мульт.), 4,88 - 5,07 (2H, мульт. ), 7,27 - 7,61 (10H, мульт.) 7,90 - 8,13 (4H, мульт.)
3) (1R, 2'S) и (1S, 2'S) 1 - (6 - хлор-2-пиридил) 2 -[(7-этоксикарбонилметокси-1,2,3,4 - тетрагидро-2 - нафтил) амино] этанол оксалат
Т. пл. 111 - 125oC (с. разл.)
ИК-спектр (Nujol): 3250 (шир.), 2800 - 2300 (шир.), 1750, 1640, 790, 700 см-1
ЯМР-спектр (DMCO-d6+D2O, δ): 1,20 (3H, трипл. J = 7,1 Гц) 1,21 (3H, трипл. J = 7,1 Гц), 2,05 - 2,40 (4H, мульт.) 2,95 - 3,35 (12H, мульт.) 4,15 (2H, кварт. , J = 7,1 Гц) 4,16 (2H, кварт. J = 7,1 Гц), 4,30 - 4,45 (2H, мульт) 4,70 (2H, сингл.) 4,71 (2H, сингл.), 4,95 - 5,05 (2H, мульт.) 6,65 - 6,95 (6H, мульт.), 7,35 - 7,55 (8H, мульт.)
Масс-спектр (m/z): 418 (M-1), 388, 278, 249
4) [(1R, 6'R)(1R, 6'S) - или [(1S,6'R) и (1S, 6'S)]-1 - (6- хлор -2-пиридил-2-[(3-этоксикарбонилметокси- 6,7,8,9 - тетрагидро-5H -бензоциклогептен-6- ил) амино] этанол оксалат
Т.пл. 60 - 66oC
ИК-спектр (Nujol): 3150, 2660, 2350, 1730, 1580 см-1
ЯМР-спектр (хлороформ-d, δ): 1,1 - 1,2 (6H, мульт.) 1,95 (4H, мульт.) 2,24 (2H, мульт.) 2,5 (4H, мульт.) 2,63 (4H, мульт.) 3,0 - 3,5 (10H, мульт.) 4,0 - 4,2 (4H, мульт.) 4,70 (2H, сингл.) 4,71 (2H, сингл.) 4,9 (2H, мульт.) 6,67 (2H, дублет дублетов, J = 8,1 Гц, 2,6 Гц) 6,79 (1H, дубл. J = 2,6 Гц), 6,85 (1H, дубл. J = 2,6 Гц), 7,04 (2H, дубл. J = 8,1 Гц), 7,48 (2H, дубл., J=7,9 Гц), 7,5 - 7,6 (2H, мульт.), 7,9 - 8,0 (2H, мульт.)
Масс-спектр (m/z): 421 и 419 (M+ (своб.д. + 1)
Пример 8.
Смесь (1R, 6'R) - и (1R, 6'S)- 2 - [N-бензил -(3-окси - 6,7,8,9- тетрагидро- 5H - бензоциклогептен - 6 - ил) амино]-1 - (3-хлорфенил) этанола (0,20 г) карбоната калия (98 мг) и N,N-диметилформамида (2 мл) перемешивали при 60oC в течение 1 час. Дают смеси остыть до комнатной температуры, а затем охлаждают в бане со льдом, прибавляют н-тетрабутиламмонийбромид (7 мл) и диэтилбромалонат (95%-ной чистоты, 0,12 мл) и продолжают перемешивание при охлаждении в бане со льдом в течение 1,5 ч. Разбавляют смесь этилацетатом, осадок отфильтровывают и промывают этилацетатом. Фильтрат и промывочный раствор объединяют, моют дважды водой, затем насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силигакеле (230 - 400 меш. 7,1-н-гексан-этилацетат), получая смесь диастереомеров (1R, 6'R) и (1R, 6'S)-[N-бензил-[(3- бис- этоксикарбонил) метокси - 6,7,8,9 - тетрагидро- 5H - бензоциклогептен- 6 -ил]амино]- 1 - (3-хлорфенил) этанола (0,12 г)
ИК-спектр (пленка) : 3400, 1710 см-1
ЯМР-спектр (хлороформ-d, δ): 1,1 - 1,4 (14Н, мульт.) 1,4 - 2,4 (10H, мульт. ) 2,4 - 3,2 (10H, мульт.), 3,6 - 4,1 (4H, мульт.) 4,2 - 4,5 (9H, мульт.) 5,5 - 4,7 (1H, мульт.) 6,8 - 7,1 (6H, мульт.) 7,1 - 7,5 (18H, мульт. )
Масс-спектр (m/z): 582 (M+2+H)+, 580 (M+H)+
Пример 9.
К раствору (1R,6'R) и (1R,6'S) - 2 [(N- бензил (3-окси- 6,7,8,9 - тетрагидро- 5H- бензоциклогептен-6-ил) амино] - 1 - (3- хлорфенил) этанола (0,42 г) в N,N-диметилформамиде (5 мл) прибавляют карбонат калия (0,15 г). Смесь перемешивают в течение 0,5 час, прибавляют к ней бромацетон (0,1 мл) и перемешивают при комнатной температуре в течение 18 час. Выливают смесь в воду и экстрагируют этилацетатом. Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ - метанол (100 : 1). Выделенный свободный амин превращают в его гидрохлорид обычным способом. Полученное твердое вещество растирают с ди-изо-пропиловым эфиром и получают смесь (1R, 6'R) - и (1R, 6'S) - 2 -[N-(бензил - [3 - (2-оксопропокси) - 6,7,8,9 - тетрагидро- 5H - бензоциклогептен-6- ил] амино] - 1 - (3 - хлорфенил) этанол гидрохлорида.
Т.пл. 66 - 75oC
ИК-спектр (Nujol): 3200, 2600, 1725 см-1
ЯМР-спектр (DMCO-d6 δ): 0,9 - 1,3 (2H, мульт) 1,8 - 2,25 (10H, мульт.) 2,5 - 2,9 (6H, мульт.) 2,9 - 3,65 (10H, мульт.) 4,4 - 5,55 (10H, мульт.) 6,3 - 7,95 (26H, мульт.) 9,9 - 10,3 (2H, мульт.)
Масс-спектр (m/z) : 478 (M+ + 1-HCl)
Пример 10.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 9.
1) (1R, 6'R) и (1R, 6'S)) 2 -[N-бензил - 3 - 2-оксобутокси - 6,7,8,9 - тетрагидро- 5H- бензоциклогептен- 6- ил] амино]-1 - (3-хлорфенил) этанол гидрохлорид
Т. пл. 81 - 88oC
ИК-спектр (Nujol): 3200, 2570, 1715, 1600 см-1
ЯМР-спектр ((DMCO-d6 δ): 0,8 - 1,4 (8H, мульт.), 1,65 - 2,25 (4H, мульт. ) 2,25 - 2,8 (10H, мульт.) 2,9 - 3,7 (10H, мульт.) 4,4 - 5,6 (10H, мульт.), 6,2 - 8,0 (26H, мульт.), 10,0 - 10,9 (2H, мульт.)
Масс-спектр (m/z): 492 (M+ - HCl)
2) (1R, 6'R) - и (1R, 6'S) - 2 -(N-бензил-[3 - (3,3 -диметил-2-оксобутокси-6,7,8,9- тетрагидро- 5H- бензоциклогептен- 6 - ил] амино] 1 - (3- хлорфенил) этанол гидрохлорид
Т. пл. 93 - 101oC
ИК-спектр (Nujol): 3180, 2580, 1710, 1600 см.-1
ЯМР-спектр (DMCO-d6, δ ) 1,0 - 1,3 (20H, мульт.) 1,9 - 2,2 (4H, мульт.) 2,4 - 2,8 (10H, мульт.) 2,8 - 3,7 (10H, мульт.) 4,4 - 5,5 (10H, мульт.) 6,3 - 8,0 (26H, мульт.) 9,9 - 10,8 (2H, мульт.)
Пример 11.
К охлаждаемому в бане со льдом раствору (1R, 6'S)- и (1R, 6'S) 2-[[(2-бис(этоксикарбонил)метокси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-ил] амино] -1-(3-хлорфенил)этанола (0,63 г. ) в этаноле (6,3 мл) прибавляют 1N раствор едкого натра (2,6 мл). После перемешивания при комнатной температуре в течение 5 час смесь упаривают в вакууме и выделяют твердое вещество зеленоватого цвета. Его промывают этанолом и сушат, получая сырой продукт, который далее очищают методом хроматографии высокого разрешения с обращенной фазой (C силикагель, 15%-ный раствор ацетонитрила в воде) и получают динатриевую соль (2R, 6'R)- и (2R, 6S)-6-[(2-(3-хлорфенил)2- оксиэтиламино] 6,7,8,9-тетрагидро-5H-бензоциклогептен-6-илокси] малоновой кислоты (0,38 г) в виде белых кристаллов
ИК-спектр (Nujol): 3380, 1620 см-1
ЯМР-спектр (D2O, δ ): 1,4 - 2,3 (8H, мульт) 2,6 - 3,3 (14H, мульт) 6,6 - 6,9 (4H, мульт) 7,09 (2H, дубл., J = 8 Гц), 7,2 - 7,6 (8H, мульт)
Пример 12.
Смесь (1R, 6'R)-2-[(3-этоксикарбонилметокси-6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-ил)амино] -1-(3-хлорфенил)этанола (0,30 г.) и 2-метоксиэтиламина (6 мл) перемешивают при комнатной температуре в течение 72 час. После удаления растворителя остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, сначала этилацетат, затем этилацетат-этанол от 50 : 1 к 25 : 1 до 5 : 1), получая целевой продукт, который высаживают прибавлением хлороформа. Полученное твердое вещество суспендируют в смеси ди-изо-пропиловый эфир - хлороформ (10 : 1, 11 мл) и перемешивают при комнатной температуре в течение 3 час. Осадок отделяют фильтрованием и сушат в вакууме, получая (1R, 6'R)-1-(3-хлорфенил)-2-[[3-(2-метоксиэтил) аминокарбонилметокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил] амино] этанол (0,21 г.)
Т. пл. 55oC
[α]
ЯМР-спектр (хлороформ-d6, δ ): 1,2 - 2,2 (5H, мульт), 2,5 - 2,9 (7H, мульт.) 3,1 - 3,4 (4H, мульт.) 3,22 (3H, сингл.) 4,39 (2H, сингл.) 4,5 - 4,7 (1H, мульт.) 5,39 (1H, дубл. J = 4 Гц) 6,64 (1H, дублет дублетов, J = 2 Гц, 8 Гц) 6,67 (1H, дубл. J = 2 Гц) 6,98 (1H, дубл. J = 8 Гц) 7,2 - 7,4 (4H, мульт.) 7,9 - 8,1 (1H, мульт.)
Масс-спектр (m/z): 449 (M + 2 H)+, 447 (M + H)+
Пример 13.
Раствор (1R, 2'S)-2-[(7-этоксикарбонилметокси-1,2,3,4- тетрагидро-2-нафтил)амино] -1-(3-хлорфенил)этанола (30 мг.) и 2-метоксиэтиламина (300 мг) в этаноле (0,5 мл) перемешивают при комнатной температуре в течение 72 час. и упаривают в вакууме. Остаток перераспределяют между этилацетатом и водным раствором бикарбоната натрия. Органический слой дважды моют насыщенным раствором соли, сушат над сульфатом магния и упаривают в вакууме. Остаток обычным способом превращают в оксалат, промывают его диэтиловым эфиром и получают (1R, 2'S)-1-(3-хлорфенил)-2-[[(7-(2-метоксиэтил)-амино- карбонилметокси-1,2,3,4-тетрагидро-2-нафтил] амино] этанол (20 мг) в виде бесцветного порошка.
Т.пл. 120 - 124oC
[α]
ИК-спектр (хлороформ): 3430, 3400, 3250, 2950 - 2400, 1735, 1650, 1605, 1240 см-1
ЯМР-спектр (DMCO-d6, δ ): 1,75 (1H, мульт), 2,2 (1H, мульт.) 2,65 - 2,95 (3H, мульт.) 3,05 - 3,45 (11H, мульт.) 4,42 (2H, сингл.) 4,98 (1H, дубл. J = 9,4 Гц), 5,1 (4H, шир. пол.) 6,65 - 6,8 (2H, мульт.) 7,03 (1H, дубл. J = 8,4 Гц), 7,35 - 7,55 (4H, мульт.) 8,05 (1H, мульт.)
Пример 14.
К смеси (R)-2-амино-1-(3-хлорфенил)этанола (172 мг) 3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-она (205 мг) и уксусной кислоты (0,27 мл) в метаноле (4 мл) прибавляют порциями цианоборгидрид натрия (94 мг) и смесь перемешивают при комнатной температуре в течение 1,5 час. Разбавляют реакционную массу водой, подщелачивают 28%-ным раствором аммиака и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-метанол (50 : 1). Полученный свободный амин переводят обычным способом в его гидрохлорид. Образовавшееся твердое вещество растирают с диэтиловым эфиром и получают смесь (1R, 6'S) и (1R, 6'S)-2-(3-нитро-6,7,8,9-тетрагидро-5H-бензоциклогептен-6- ил)амино]-1-(3-хлорфенил)этанол гидрохлорида (220 мг).
Т.пл. 178 - 182oC
ИК-спектр (Nujol): 3270, 1518, 1340 см-1
ЯМР-спектр (DMCO-d6, δ ): 1,17 - 1,47 (2H, мульт), 1,80 - 2,20 (4H, мульт. ) 2,25 - 2,45 (2H, мульт.) 2,80 - 3,5 (14H, мульт.) 5,0 - 5,18 (2H, мульт. ), 6,32 - 6,45 (2H, мульт.), 7,33 - 7,6 (10H, мульт.), 8,0 - 8,1 (2H, мульт. ) 8,1 - 8,3 (2H, мульт.) 8,75 - 9,05 (2H, мульт.) 9,3 - 9,7 (2H, мульт.)
Масс-спектр (m/z): 361 (M+ + 1 - HCl)
Пример 15.
К раствору (R)-2-амино-1-(3-хлорфенил)этанола (343 мг) и 7-нитро-2-тетралона (354 мг) в метаноле (9 мл) при 26oC - 29oC прибавляют цианоборгидрид (189 мг) и уксусную кислоту (0,6 мл) и оставляют перемешиваться на ночь при комнатной температуре. К полученному раствору прибавляют при 0oC концентрированную соляную кислоту (1 мл.). Перемешивают в течение 3,5 час. прибавляют воду (10 мл) и 28%-ный раствор гидроокиси аммония и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над поташом и упаривают в вакууме. Остаток растворяют в этилацетате и к полученному раствору прибавляют 4N раствор хлористого водорода в этилацетате (0,6 мл). Образовавшиеся осадки собирают и сушат, получая (1R, 2'R)- и (1R, 2'S)-1-(3-хлорфенил)-2-[(7-нитро-1,2,3,4-тетрагидро-2-нафтил] амино]этанол гидрохлорид (0,60 г.) Полученный порошок перекристаллизовывают из смеси этанола (12 мл) и метанола (5 мл) и выделяют (1R, 2'R-) или (1R,2'S)-1-(3-хлорфенил)-2-[(7-нитро-1,2,3,4-тетрагидро-2-нафтил] амино]этанол гидрохлорид (0,17 г.)
Т.пл. 216 - 219oC (с разл.)
[α]
ИК-спектр (Nujol): 3325, 2750, 2660 см-1
ЯМР-спектр (DMCO-d6, δ ): 1,71 - 2,03 (1H, мульт), 2,28 - 2,52 (1H, мульт. ) 2,76 - 3,69 (7H, мульт.) 5,03 - 5,21 (1H, мульт.) 6,39 (1H, дубл. J = 3,8 Гц), 7,30 - 7,60 (5H, мульт.), 7,92 - 8,13 (2H, мульт.) 9,13 (1H, шир. сингл.) 9,74 (1H, шир. сингл.)
Фильтрат упаривают в вакууме и остаток растирают с изо-пропанолом и диэтиловым эфиром, получая (1R,2'R)- и (1R,2'S)-1-(3-хлорфенил)-2-[(7-нитро-1,2,3,4-тетрагидро-2-нафтил] амино]этанол гидрохлорид (0,32 г.)
Диастереомер А: ЯМР-спектр (DMCO-d6, δ ): 1,72 - 2,05 (1H, мульт), 2,30 - 2,50 (1H, мульт.) 2,78 - 3,69 (7H, мульт.) 4,80 - 4,95 (1H, мульт.), 6,24 (1H, дубл. J = 4,3 Гц), 7,30 - 7,58 (5H, мульт.), 7,94 - 8,10 (2H, мульт.) 9,11 (1H, шир. сингл.) 9,74 (1H, шир. сингл.)
Диастереомер Б: ЯМР-спектр (DMCO-d6, δ ): 1,72 - 2,05 (1H, мульт), 2,30 - 2,50 (1H, мульт.) 2,78 - 3,69 (7H, мульт.) 5,02 - 5,21 (1H, мульт.), 6,40 (1H, дубл., J = 3,8 Гц), 7,30 - 7,58 (5H, мульт.), 7,94 - 8,10 (2H, мульт.) 9,11 (1H, шир. сингл.) 9,74 (1H, шир. сингл.)
Диастереомер А: Диастереомер Б = 1 : 7
Пример 16.
Раствор (1R, 2'R)- и (1R,2'S)-1-(3-хлорфенил)-2-[(7-нитро- 1,2,3,4-тетрагидро-2-нафтил] амино] этанол гидрохлорида (200 мг) в метаноле (5 мл) подщелачивают 28%-ным раствором гидроокиси аммония. Экстрагируют этилацетатом и экстракт моют насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Остаток растворяют в смеси этилацетата и метанола и гидрируют полученный раствор над 10%-ным палладием на угле (8,5 мг). Катализатор удаляют фильтрованием и к фильтрату прибавляют 4N раствор хлористого водорода в этилацетате. Раствор упаривают в вакууме и остаток растирают с изо-пропанолом и диэтиловым эфиром, получая (1R, 2'R) и (1R, 2'S)-1-(3-хлорфенил)-2-[(7-амино-1,2,3,4-тетрагидро-2-нафтил] амино] этанол дигидрохлорид (191 мг.).
Т. пл. 182 - 185oC
ИК-спектр (Nujol): 2750 - 2500 см-1
ЯМР-спектр (DMCO-d6, δ ): 1,66 - 2,02 (2H, мульт.) 2,24 - 2,46 (2H, мульт. ) 2,60 - 3,81 (16H, мульт), 5,12 (2H, шир. дубл. J = 7 Гц), 6,40 (2H, шир. мульт.) 7,06 - 7,60 (14H, мульт.) 9,04 (2H, шир. сингл.) 9,70 (2H, шир. сингл.) 10,31 (4H, шир. сингл.)
Пример 17.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 14.
1) (1R, 6'R)- и (1R, 6'S)-2-[(3-бром-6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-ил)амино]-1-(3-хлорфенил)этанол
Т. пл. 107 - 120oC
ИК-спектр (Nujol): 3140, 3060, 1590, 1570 см-1
ЯМР-спектр (CDCl3-D2O, δ): 1,40 - 2,15 (8H, мульт.) 2,48 - 3,10 (14H, мульт. ) 4,50 - 4,67 (2H, мульт), 6,95 (2H, дубл. J = 7,8 Гц), 7,14 - 7,42 (12H, мульт.)
2) Этил-3-{ (RS)-8-[(2-(3-хлорфенил)-2-оксиэтиламино- 6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ил)}пропионат
Т. пл. 81 - 85oC
ИК-спектр (Nujol): 3300, 3100, 1720 см-1
ЯМР-спектр (хлороформ-d, δ): 1,23 (6H, трипл. J = 7,1 Гц) 1,44 - 2,14 (6H, мульт.) 1,60 - 2,90 (4H, шир. мульт.), 4,50 - 4,66 (2H, мульт.), 6,90 - 7,44 (14H, мульт.),
Пример 18.
Следующее соединение было получено по методике, аналогичной той, которая приведена в примере 15.
Этил (E)-3-{(RS)-8-[(R)-2-(3-хлорфенил)-2-оксиэтиламино]- 6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ил)}акрилат оксалат (2 : 1)
Т.пл. 123 - 140oC
ИК-спектр (Nujol): 3250, 1700 см-1
ЯМР-спектр (DMCO-d6, δ ): 1,25 (6H, трипл. 0 7,0 Гц), 1,13 - 1,44 (2H, мульт. ) 1,71 - 2,20 (6H, мульт.) 2,65 - 3,36 (14H, мульт.) 4,18 (кварт. J = 7,0 Гц), 4,88 - 5,07 (2H, мульт.) 5,66 - 7,40 (10H, шир. мульт.), 6,56 (2H, дубл. J = 16,0 Гц), 7,12 - 7,70 (16H, мульт.)
Пример 19.
Смесь (1R, 6'R) - или (1R, 6'S) - или (1S, 6'R) - или (1S, 6'S)-1-(2-нафтил)-2-[N-бензил-(3-окси-6,7,8,9-тетрагидро-5H- бензоциклогептен-6-ил)амино] этанола] (Изомер A) (110 мг), 60%-ного гидрида натрия в масле (11 мг) и этилбромацетата (46 мг) в N,N-диметилформамиде (2 мл) перемешивают при комнатной температуре. Полученную смесь разбавляют водой и экстрагируют этилацетатом. Экстракт моют насыщенным раствором соли, сушат, упаривают в вакууме и получают (1R, 6'R) - или (1R, 6'S) - или (1S, 6'R) - или (1S, 6'S) 1-(2-нафтил)-2-[N-бензил-(3-этоксикарбонилметокси-6,7,8,9-тетрагидро- 5H-бензоциклогептин-6-ил)амино]этанол в виде масла (моно-изомер A).
ЯМР-спектр (хлороформ-d, δ ): 1,29 (3H, трипл., J = 7,1 Гц) 2,0 - 2,8 (11H, мульт. ) 3,74 (1H, дубл. J = 13,7 Гц), 4,00 (1H, дубл., J = 13,7 Гц), 4,27 (2H, кварт., J = 7,1 Гц), 4,59 (2H, сингл.) 4,72 (1H, дублет дублетов J = 3,6 Гц, 9,9 Гц), 6,58 (1H, дублет дублетов, J = 2,7 Гц), 8,2 Гц), 6,78 (1H, дубл., J = 2,7 Гц), 6,96 (1H, дубл. J = 8,2 Гц), 7,2 - 7,5 (7H, мульт.) 7,8 (4H, мульт.) 8,01 (1H, сингл.)
Масс-спектр (m/z): 524 (M++1), 506 и 366
Пример 20
Следующее соединение было получено по методике, аналогичной той, которая приведена в примере 19.
(1R, 6'R) - или (1R, 6'S) - или (1S, 6'R) - или (1S, 6'S) -1-(2-нафтил)-2-[N-бензил-(3-этоксикарбонилметокси-6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-ил)амино]этанол] (моно-изомер Б).
ЯМР-спектр (хлороформ-d, δ): 1,2 (3H, трипл., J = 7,1 Гц) 1,3 - 3,1 (12H, мульт. ) 3,70 (1H, дубл. J = 13,7 Гц), 3,77 (1H, дубл. J = 13,7 Гц)Э, 4,20 (2H, кварт., J = 7,1 Гц), 4,5 (2H, сингл.) 4,5 - 4,7 (1H, мульт.), 6,59 (1H, дублет дублетов, J = 2,6 Гц, 8,1 Гц), 6,73 (1H, дубл. J = 2,6 Гц), 6,94 (1H, дубл. J = 8,1 Гц), 7,2 - 7,5 (7H, мульт.) 7,6 - 7,8 (4H, мульт.) 8,01 (1H, сингл.)
Масс-спектр (m/z): 524, (M++1), 506 и 366
Пример 21.
Смесь 8-бензиламино-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-ол гидрохлорида (5,0 г.) N,N-ди-изо-пропилентриамина (5,7 мл) окиси (R)-3-хлорстирола (3,8 г.) и этанола (16,4 мл) кипятят с обратным холодильником в течение 40 час. После охлаждения реакционную массу упаривают в вакууме. Остаток растворяют в этилацетате, моют водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Очищая сырой продукт с помощью колоночной хроматографии на силикагеле (элюент н-гексан-этилацетат 4:1), получают диастереомерную смесь (1R, 6'R) - и (1R, 6'S)-2-[N-бензил-(3-окси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил)амино] -1- (3-хлорфенил)этанола (6,3 г.) в виде масла.
ИК-спектр (пленка): 3250 см-1
ЯМР-спектр (хлороформ-d, δ): 0,8 - 1,0 (1H, мульт.), 1,1 - 1,5 (3H, мульт.) 1,5 - 1,8 (1H, мульт.) 1,8 - 2,1 (4H, мульт.) 2,1 - 2,4 (1H, мульт.) 2,4 - 2,9 (11H, мульт.) 3,07 (1H, дублет дублета J = 19 Гц, 13 Гц), 3,75 (2H, кварт. J = 13 Гц), 3,80 (2H, кварт., J = 13 Гц ), 4,0 - 5,2 (2H, шир. мульт. ) 4,35 (1H, дублет дублетов, J = 4 Гц, 10 Гц) 4,46 (1H, дублет дублетов, J = 4 Гц, 10 Гц), 6,52 (2H, дублет дублетов, J = 2 Гц, 8 Гц), 6,61 (1H, дубл. J = 2 Гц) 6,64 (1H, дубл. J = 2 Гц), 6,98 (2H, дубл. J = 8 Гц), 7,0 - 7,4 (18H, мульт.)
Масс-спектр (m/z): 424 (M+2+H)+, 422 (M+H)+
Пример 22.
Раствор окиси (R)-3-хлорстирола (48 мг) и 6,7-дигидро-2-нитро-5H-бензоциклогептен-7-амина (84 мг.) в этаноле (3 мл) и диоксане (1 мл) кипятят с обратным холодильником в течение 1 час. и упаривают в вакууме. Остаток хроматографируют через силикагель, используя дихлорметан и метанол в качестве элюента, и полученное масло обычным способом превращают в оксалат. Оксалат перекристаллизовывают из диэтилового эфира и получают (1R, 7'R) - и (1R, 7'S)-1-(3-хлорфенил)-2-[[6,7-дигидро-2-нитро-5H-бензоциклогептен -7-ил)амино]этанол]оксалат (48 мг) в виде светло-коричневого масла.
Т. пл. 100 - 108oC (с разл.)
ИК-спектр (Nujol): 3300, 2750 - 2300, 1710, 1600, 1515, 1350 см-1
ЯМР-спектр (DMCO-d6, δ): 2,1 (2H, мульт.) 2,35 (2H, мульт.) 2,95 - 3,3 (8H, мульт. ) 4,15 (2H, мульт.), 4,95 (2H, мульт.) 6,14 (1H, шир. дубл. J = 12,8 Гц) 6,20 (1H, шир. дубл. J = 12,8 Гц) 6,86 (2H, дубл. J = 12,8 Гц) 7,25 - 7,55 (10H, мульт. ) 8,06 (2H, дублет дублетов, J = 8,4 Гц, 2,4 Гц) 8,19 (2H, дубл. J = 2,4 Гц) 6,0 - 9,0 (8H, шир. пол.)
FAB масс-спектр (m/z): 361 и 359 (M+-C2H2O4+1)
Пример 23.
Раствор 2,2'-оксибис 2-окси-2'-ацетонафтона (77,3 мг) (S)-2-амино-7-этоксикарбонилметокси-1,2,3,4-тетрагидронафталин гидрохлорида (114,3 мг) и триэтиламина (0,07 мл) в этаноле (3 мл) перемешивают при комнатной температуре в течение 30 минут и охлаждают ледяной водой. Прибавляют боргидрид натрия (45,4 мг) и полученную смесь перемешивают при комнатной температуре в течение 1 час. Разбавляют реакционную смесь водой и экстрагируют этилацетатом. Экстракт сушат над сульфатом магния и упаривают в вакуме. Выделенное масло превращают обычным способом в гидрохлорид и получают бесцветный порошок (1R, 2'R) - и (1R, 2'S) 2-[(7-этоксикарбонилметокси) 1,2,3,4-тетрагидро-2-нафтил)амино]-1-(2-нафтил)этанол гидрохлорида (90,7 мг)
Т. пл. 154 - 256oC
ИК-спектр (Nujol): 3350, 2800 - 2300, 1730 см-1
ЯМР-спектр (DMCO-d6, δ): 1,20 (6H, трипл. J = 7,1 Гц), 1,7 - 2,0 (2H, мульт. ) 2,2 - 3,6 (16H, мульт.) 4,15 (4H, кварт. J = 7,1 Гц), 4,72 (4H, сингл.) 5,2 - 5,4 (2H, мульт.) 6,3 - 6,4 (2H, мульт.) 6,6 - 6,8 (4H, мульт.) 7,02 (2H, дубл. J = 8,3 Гц), 7,5 - 7,7 (6H, мульт.) 7,8 - 8,1 (8H, мульт.) 9,03 (2H, шир. сингл.) 9,63 (2H, шир, сингл.)
Масс-спектр (m/z): 262, 233
Пример 24.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 23.
1) (1R, 2'S) - и (1S, 2'S) -2-[(7-этоксикарбонилметокси- 1,2,3,4-тетрагидро-2-нафтил)амино]-1-(1-нафтил)этанол гидрохлорид
Т. пл. 70 - 84oC
ИК-спектр (Nujol): 3300, 2750 - 2250, 1750 см-1
ЯМР-спектр (DMCO-d6, δ): 1,20 (6H, трипл. J = 7,1 Гц), 1,6 - 2,0 (2H, мульт. ), 2,2 - 3,6 (16Н, мульт.), 4,15 (4H, кварт. J = 7,1 Гц), 4,70 (2H, сингл.) 4,71 (2H, сингл) 5,8 - 6,0 (2H, мульт.) 6,33 (2H, дубл. J = 3,7 Гц), 6,6 - 6,8 (4H, мульт.) 7,01 (2H, дубл. J = 8,3 Гц), 7,5 - 7,7 (6H, мульт.) 7,80 (2H, дубл. J = 6,9 Гц), 7,9 - 8,1 (4H, мульт.) 8,3 - 8,4 (2H, мульт.) 8,91 (2H, шир. сингл.) 9,96 (2H, шир, сингл.)
Масс-спектр (m/z): 420 (M++1), 262, 233
2) (1R, 2'S) - и (1S, 2'S) -2-[(7-этоксикарбонилметокси- 1,2,3,4-тетрагидро-2-нафтил)амино]-1-(5-инданил)этанол гидрохлорид
Т. пл. 141 - 146oC
ИК-спектр (Nujol): 3325, 2750, 2510, 2490, 1740 см-1
ЯМР-спектр (CDCl3, δ ) 1,29 (6H, трипл. J = 7,1 Гц), 2,01 (2H, трипл. J = 7,4 Гц), 2,08 (2H, трипл., J = 7,4 Гц), 2,00 - 2,28 (2H, мульт.) 2,42 - 2,62 - (2H, мульт.) 2,65 - 3,02 (14H, мульт.) 3,10 - 3,61 (10H, мульт.) 4,25 (4H, кварт. J = 7,1 Гц), 4,51 (4H, сингл.) 5,44 (2H, шир. мульт.) 6,55 (2H, дубл., J = 2,5 Гц), 6,71 (2H, дублет дублетов, J = 2,5 Гц, 8,4 Гц) 6,97 (2H, дубл. J = 8,4 Гц) 7,14 - 7,26 (4H, мульт.) 7,31 (2H,сингл.) 8,91 (2H, шир. сингл.), 10,17 (2H, шир. сингл.)
Пример 25.
Смесь (1R, 6'S) - и (1R, 6'S) -2[(N-бензил-(3-этоксикарбонил-метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил амино] -1-(3-хлорфенил)этанола (0,34 г.) 10%-ного палладия на угле (50% вл., 68 мг), формиата аммония (0,25 г. ) и этанола (17 мл) кипятят с обратным холодильником в течение 20 минут. Катализатор отфильтровывают и промывают этанолом. Удаляя растворитель в вакууме, получают остаток, который моют насыщенными водными растворами бикарбоната натрия и соли и упаривают в вакууме. Очистка сырого продукта методом колоночной хроматографии на силикагеле (элюент-этилацетат-этанол, 25: 1) позволяет выделить диастереомерную смесь (1R, 6'S) - и (1R, 6'S)-2-[(3-этоксикарбонилметокси- 6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил)амино]-1-фенилэтанола (0,21 г.) в виде масла. Его растворяют в этилацетате (2,1 мл) и обрабатывают 4N раствором хлористого водорода в этилацетате (1,4 мл.). После удаления растворителя смесь распыляют с помощью ди-изо-пропилового эфира - этилацетата (3:1, 2,0 мл). Осадок отфильтровывают, промывают ди-изо-пропиловым эфиром и сушат в вакууме, получая (1R, 6'R) - и (1R, 6'S)-2-[(3-этоксикарбонилметокси- 6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил)амино-1-фенолэтанол гидрохлорид в виде белого порошка. Хиральный HPLC анализ показывает, что в процессе реакции наблюдается частичная эпимеризация оксигруппы в бензильном положении.
Т. пл. 152-154oC
ИК-спектр (Nujоl): 3550, 3270, 3160, 2770, 1730 см-1
ЯМР-спектр (DMCO-d6, δ): 1,0 - 1,4 (2H, мульт.) 1,19 (3H, трипл. J = 7 Гц), 1,20 (3H, трипл. J = 7 Гц), 1,7 - 2,1 (4H, мульт.) 2,2 - 2,4 (2H, мульт. ) 2,5 - 2,8 (4H, мульт.) 2,9 - 3,4 (10H, мульт.) 4,15 (2H, кварт. J = 7 Гц), 4,18 (2H, кварт. J = 7 Гц), 4,70 (2H, сингл.) 4,71 (2H, сингл.) 4,9 - 5,1 (2H, мульт.) 6,20 (2H, дубл. J = 4 Гц) 6,67 (2H, дублет дублетов J = 2 Гц, 8 Гц), 6,81 (1H, дубл. J = 2 Гц), 6,87 (1H, дубл. J = 2 Гц) 7,03 (2H, дубл. J = 8 Гц), 7,2 - 7,5 (10H, мульт.) 8,6 - 9,0 (2H, шир. мульт.), 9,1 - 9,6 (2H, шир. мульт.).
Масс-спектр (m/z) : 384 (M+H)+
Пример 26
Смесь (S)-N-бензил-3-этоксикарбонилметокси-6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-амина (35,5 г.) окиси (P)-3-хлорстирола (энантиомерный избыток > 97% 20,0 г.) и этанола (99 мл) кипятят с обратным холодильником в течение 45 час. После охлаждения смесь упаривают в вакууме и полученный остаток очищают колоночной хроматографией на силикагеле (230 - 400 меш, элюент - дихлорметан) выделяя (1R, 6'S)-2-[N-(бензил-(3-этоксикарбонилметокси-6,7,8,9- тетрагидро-5H-бензоциклогептен-6-ил)амино] -1-(3-хлорфенил)этанол (37,7 г), в виде бледно-желтого масла. Его растворяют в этилацетате (340 мл) и обрабатывают при охлаждении в бане со льдом 4N раствором хлористого водорода в этилацетате (37 мл). Баню со льдом убирают, нагревают раствор до 40oC и медленно разбавляют ди-изо-пропиловым эфиром (300 мл), предварительно нагретым до 40oC. Дают образовавшейся суспензии остыть до комнатной температуры и перемешивают еще в течение 3,5 час. Осадок выделяют фильтрованием и промывают на фильтре смесью ди-изо-пропилового эфира и этилацетата (4:5, 90 мл). Продукт сушат в вакууме и получают (1R, 6'S)-2-[(N-бензил-(3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H -бензоциклогептен-6-ил)амино] -1-(3-хлорфенил)этанол гидрохлорид (35,7 г.) в виде белого порошка. Хиральный HPLC анализ показывает, что диастереомерная чистота полученного продукта составляет > 99%.
Т. пл. 152 - 153oC
[α]
ИК-спектр (Nujol): 3270, 2670, 2600, 1750 см-1)
ЯМР-анализ показывает, что продукт в диметилсульфоксиде существует в виде двух ротамеров.
Химсдвиги указаны для основного ротамера
ЯМР-спектр (DMCO-d6, δ): 1,0 - 1,4 (1H, мульт.) 1,22 (3H, трипл. J = 7 Гц), 1,9 - 2,3 (2H, мульт.) 2,3 - 2,5 (1H, мульт.) 2,5 - 2,9 (мульт.) 2,9 - 3,7 (5H, мульт. ) 4,18 (2H, кварт. J = 7 Гц), 4,4 - 4,8 (3H, мульт.) 4,73 (2H, сингл. ) 6,3 - 6,4 (1H, мульт.), 6,6 - 6,8 (1H, мульт.) 6,9 - 7,0 (1H, мульт.) 7,03 (1H, дуб. J = 8 Гц), 7,2 - 7,6 (7H, мульт.) 7,8 - 8,0 (2H, мульт.) 9,8 - 10,0 (1H, мульт.)
Масс-спектр (m/z) : 540 (M+2+H)+, 508 (M+H)+.
Пример 27.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 26.
1) (1R, 6'R)-2-[(N-бензил-(3-этоксикарбонилметокси-6,7,8,9- тетрагидро-5H-бензоциклогептен-6-ил)амино]-1-(3-хлорфенил)этанол гидрохлорид
Т. пл. > 128oC
[α]
ИК-спектр (Nujol) : 3250, 2600, 1760 cм-1
ЯМР-анализ показывает, что продукт в диметилсульфоксиде существует в виде двух ротамеров.
Химсдвиги указаны для основного ротамера.
ЯМР-спектр (DMCO-d6, δ): 1,0 - 1,4 (1H, мульт.) 1,21 (3H, трипл., J = 7 Гц), 1,9 - 2,3 (3H, мульт.) 2,4 - 2,9 (3H, мульт.) 2,4 - 2,9 (3H, мульт.) 2,9 - 4,0 (4H, мульт.) 4,16 (2H, кварт. J = 7 Гц), 4,4 - 5,0 (3H, мульт.) 4,70 (2H, сингл.) 6,49 (1H, шир, мульт.) 6,64 (1H, дублет дублетов, J = 2 Гц 8 Гц) 6,83 (1H, шир. сингл.) 6,9 - 7,1 (1H, мульт.) 7,2 - 7,6 (7H, мульт.) 7,84 (2H, шир. сингл.) 10,2 - 10,6 (1H, шир. мульт.)
Масс-спектр (m/z): 510 (M+2+H)+, 508 (M+H)+
2) (1R, 6'R) и (1R, 6'S)-2-[(N-бензил-(3-пентилокси- 6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил)амино]-1-(3-хлорфенил) этанол гидрохлорид
Т. пл. 154 - 165oC
ИК-спектр (Nujol): 3280, 2600, 1600 см-1
ЯМР-спектр (DMCO-d6, δ): 0,9 - 1,0 (6H, мульт.) 1,0 - 1,5 (10H, мульт.) 1,6 - 1,8 (4H, мульт.) 1,85 - 2,2 (4H, мульт.) 2,35 - 2,8 (6H, мульт.) 2,95 - 3,7 (10H, мульт. ) 3,8 - 4,0 (4H, мульт), 4,4 - 5,5 (6H, мульт.) 6,25 - 7,95 (26H, мульт.) 9,9 - 10,2 (2Н, мульт.)
3) (1R, 6'R) и (1R, 6'S)-2-[N-бензил-3-(2-оксопентилокси)- 6,7,8,9,-тетрагидро-5H-бензоциклогептен-6-ил)-амино] -1-(3-хлорфенил) этанол гидрохлорид
Т. пл. 79 - 85oC
ИК-спектр (Nujol): 3200, 2600, 1720, 1610 см-1
ЯМР-спектр (DMCO-d6, δ): 0,87 (6H, трипл. J = 7,3 Гц), 1,0 - 1,4 (2H, мульт.) 1,4 - 1,7 (4H, мульт.) 1,8 - 2,3 (4H, мульт.) 2,3 - 2,9 (10H, мульт. ) 2,9 - 3,7 (10H, мульт.) 4,4 - 5,6 (10H, мульт.) 6,2 - 8,0 (26H, мульт.) 10,1 - 11,1 (2H, мульт.)
Масс-спектр (m/z): 506 (M++1+HCl)
4) (1R, 6'R)- и (1R, 6'S)-2-[N-бензил-[3-(RS)-2- оксопентан-3-илокси)-6,7,8,9-тетрагидро-5H-бензоциклогептен- 6-ил)амино] -1-(3-хлорфенил)этанол гидрохлорид
Т. пл. 104 - 109oC
ИК-спектр (Nujol) : 3200, 2580, 1710, 1600 см-1
ЯМР-спектр (DMCO-d6, δ)6 0,9 - 1,35 (8H, мульт.) 1,6 - 2,25 (14H, мульт. ) 2,35 - 2,9 (6H, мульт.) 2,9 - 3,7 (10H, мульт.) 4,35 - 5,5 (8H, мульт.), 6,3 - 8,0 (26H, мульт.) 9,8 - 10,8 (2H, мульт.)
Масс-спектр (m/z): 506 (M++1+HCl
5) (1R, 6'R)- и (1R, 6'S)-2-[N-бензил-[2-бис-(этоксикарбонил) метокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил] амино] -1- (3-хлорфенил)этанол гидрохлорид
Т. пл. > 95oC
ИК-спектр (Nujol) : 3400, 1740 см-1
ЯМР-спектр (DMCO-d6, δ): 1,1 - 1,4 (2H, мульт.) 1,19 (12H, трипл. J = 7 Гц), 1,8 - 2,3 (4H, мульт.) 2,3 - 2,9 (8H, мульт.) 2,9 - 3,8 (мульт.) 4,22 (8H, кварт. J = 7 Гц), 4,3 - 4,8 (6H, мульт.) 5,62 (1H, сингл.) 5,64 (1H, сингл.) 6,3 - 6,6 (2H, мульт.) 6,7 - 6,9 (4H, мульт.) 7,1 - 8,0 (20H, мульт. ) 9,7 - 10,1 (1H, мульт.)
Масс-спектр (m/z): 582 (V+2H), 580 (M+H)+
Пример 28.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 21
1) (1R, 6'R)- и (1R, 6'S)-2-[N-бензил-3-этоксикарбонилметокси- 6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил)амино]-1-(3-хлорфенил)этанол
ИК-спектр (пленка): 3400, 3000, 2900, 2830, 1740 см-1
ЯМР-спектр (хлорформ-d, δ): 1,28 (3H, припл. J = 7 Гц), 1,2 - 1,4 (2H, мульт. ) 1,5 - 3,0 (2H, шир. мульт.) 1,6 - 1,8 (1H, мульт.) 1,8 - 2,9 (18H, мульт. ) 3,09 (1H, дублет дублетов, J = 10 Гц, 13 Гц), 3,77 (2H, кварт., J = 13 Гц), 3,82 (2H, кварт. J = 13 Гц), 4,26 (2H, кварт. J = 7 Гц), 4,28 (2H, кварт. J = 7 Гц), 4,30 (1H, дублет дублетов, J = 3 Гц, 10 Гц), 4,48 (1H, дублет дублетов, J = 3 Гц, 10 Гц) 4,57 (2H, сингл.) 4,59 (2H, сингл.) 6,5 - 6,7 (2Н, мульт.), 6,73 (1H, дубл. J = 2 Гц), 6,78 (1H, дубл. J = 2 Гц), 6,95 (2H, дубл. J = 8 Гц) 7,1 - 7,4 (18H, мульт.)
Масс-спектр (m/z): 510 (М+2+H)+, 508 (М+H)+
2) (1R, 6'R)-и (1R, 6'S)-2-[N-(бензил-3-[(RS)-1-этоксикарбонил) этокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил)амино] -1-1 (3-хлорфенил)этанол
Т. пл. 90 - 99oC
ИК-спектр (пленка): 3300, 2580, 1730 см-1
ЯМР-спектр (DMCO-d6, δ): 1,0 - 1,4 (8H, мульт.) 1,4 - 1,6 (6H, мульт.) 1,8 - 2,2 (4h, мульт.) 2,4 - 2,9 (6H, мульт.) 2,9 - 3,7 (10H, мульт.) 4,0 - 4,3 (4H, мульт. ) 4,4 - 5,6 (8H, мульт.) 6,3 - 8,0 (26H, мульт.) 10 - 11,2 (2Н, мульт.)
Пример 29.
1) Смесь (1R, 6'R)- и (1R, 6'S)-2-[(N-бензил-[3-(2-оксопропокси)-6,7,8,9-тетрагидро-5H-бензоциклогептан-6-ил] амино-1- (3-хлорфенил)этанол гидрохлорида (290 мг) каталитически гидрируют при комнатной температуре в смеси этанола (3 мл) и хлорбензола (3 мл), используя 10%-ный палладий на угле (50% вл., 20 мл). После удаления катализатора растворитель упаривают в вакууме. К остатку прибавляют этилацетат и воду, органический слой отделяют, имеют насыщенным раствором бикарбоната натрия и упаривают в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-метанол (50:1). Фракции, содержащие целевой продукт, собирают и упаривают в вакууме, получая (1R, 6'R)- и (1R,6'S)-2-[[(3- (2-оксопропокси) 6,7,9,9(тетрагидро-5H-бензоциклогептен-6 - ил]амино]-1-(3-хлорфенил) этанол.
2) Выделенный свободный амин превращают обычным способом в его гидрохлорид. Образовавшееся твердое вещество растирают с диэтиловым эфиром и получают смесь (1R, 6'R)- и (1R, 6'S)-2-[[(3-(2-оксопропоки)-6,7,8,9 -тетрагидро-5H-бензоциклогептен-2-ил]амино]-1-(3-хлорфенил) этанол гидрохлорида.
Т. пл. 155-161oC
ИК-спектр (Nujol): 1720, 1575 см-1
ЯМР-спектр (DMCO-d6, δ):1,1 - 1,35 (2H, мульт.) 1,75 - 2,1 (4H, мульт.) 2,14 (6H, сингл. ) 2,2 (2H, мульт.) 2,6 - 2,8 (4H, мульт.), 2,3 -3,3 (10H, мульт. ) 4,73 (2H, сингл.) 4,75 (2H , сингл.) 4,95 - 5,1 (2H,мульт.), 6,3 - 6,4 (2Н, мульт. ), 6,6 - 6,7 (2H, мульт.), 6,75 - 6,9 (2H, мульт.), 6,95 - 7,1 (2H,мульт.) 7,3 - 7,55 (8H, мульт.), 8,7 - 8,9 (2H, мульт.) 9,05 - 9,35 (2H, мульт.)
Масс-спектр (m/z): 388 (M+1+HCl)+
Пример 30.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере 29-1).
1) (1R, 6'R) и (1R, 6'R) - 2-[(3 -(3,3-диметил-2-оксобутокси)-6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил]амино]-1-(3-хлорфенил) этанол
Т. пл. 100 - 103oC
ИК-спектр (Nujol): 1715, 1600 см-1
ЯМР-спектр (хлороформ-d, δ): 1,24 (18H, сингл.)
1,4 - 3,1 (22H , мульт.) 4,5 - 5,65 (2H, мульт.) 4,84 (4H, сингл.) 6,55 - 6,75 (4H, мульт.) 6,95 - 7,05 (2H, мульт.) 7,15 - 7,4 (8H, мульт.)
Масс-спектр (m/z ): 430 (M+1)+
2) (1R, 6'R ) -и (1R, 6'S) - 2-[[3-пентилокси) -6,7,8,9-тетрагидро-5H-бензоциклогептен-6-ил]амино]-1-(3-хлорфенил) этанол
Т. пл. 102 - 106oC
ИК-спектр (Nujol): 1605, 1570, 1285 cм-1
ЯМР-спектр (хлороформ-d, δ): 0,92 (6H, трипл. J=7,0 Гц) 1,3 - 2,1 (22H, мульт. ) 2,5 - 3,1 (14H, мульт.) 3,92 (4H, трипл.J =6,5 Гц), 4,5 - 4,6 (2H, мульт. ) 6,6 - 6,75 (4H, мульт.), 6,95 - 7,05 (2H, мульт.), 7,15 - 7,40 (8H, мульт.)
3) (1R, 6'R ) - и (1R, 6'S)-2-[[3[(2-оксопентилокси)-6,7,8,9 - тетрагидро-5H-бензоциклогептен-6-ил}амино]-1-(3-[хлорфенил) этанол
Т. пл. 94 - 95oC
ИК-спектр (Nujol): 3320, 3260, 1720 см-1
ЯМР-спектр (хлороформ-d, δ): 0,94 (6H, трипл. J=7,4 Гц) 1,4 -2,1 (12H, мульт. ) 2,5 - 3,1 (18H, мульт.), 4,51 (4H, сингл.) 4,45 - 4,65 (2H, мульт) 6,55 - 6,75 (4H, мульт.) 6,9 - 7,05 (2H, мульт.) 7,15 - 7,4 (8H, мульт.) 4) (1R,6'R) - и (1R, 6'S) - 2-[[3-((RS) -1- этоксикарбонил)этокси - 6,7,8,9-тетрагидро-5H- бензоциклогептен-6-ил]амино]-(3-хлорфенил)этанол
Т. пл. 97 - 101oC
ИК-спектр (Nujol): 1742, 1605 см-1
ЯМР-спектр (хлороформ-d, δ): 1,24 (6H, трипл. J=7,1 Гц), 1,60 (6H, дубл. J= 6,8 Гц), 1,50 -2,10 (10H, мульт.) 2,45 - 3,1 (14H, мульт.) 4,10 - 4.30 (4H, мульт.) 4,50 - 4.65 (2H, мульт.), 4,70 (2H, кварт., J= 6,8 Гц), 6,50 - 6,65 (2H, мульт.) 6,65 - 6,75 (2H, мульт.) 6,90 - 7,00 (2H, мульт.) 7,15 - 7,40 (8H, мульт.)
5) (1R, 6'R) - и (1R, 6'S) -2-[(3 -этоксикарбонилметиламино - 6,7,8,9 - тетрагидро -5H -бензоциклогептен -6- ил) амино] -1-(3-хлорфенил) этанол
ИК-спектр (хлороформ): 3420, 1735, 1615, 1580 см-1
ЯМР-спектр (хлороформ-d, δ): 1,28 (6H, трипл. J=7,1 Гц), 1,34 - 2,20 (8H, мульт) 2,54 - 3,16 (16H, мульт) 3,86 (4H, сингл.) 4,22 (4H, кварт. J= 7,1 Гц), 4,31 (4H, шир. сингл.), 4,72 - 4,89 (2H, мульт.) 6,28 - 6,54 (4H, мульт.) 6,89 (2H, дубл. J=8,0 Гц) 7,26 - 7,46 (8H, мульт.)
Масс-спектр (m/z ): 417 (М+), 275, 246
6) (1R, 6'R) или (1R, 6'S) или (1S, 6'R)- или (1S, 6'S) -1-(2-нафтил) -2- [(3-этоксикарбонилметокси- 6,7,8,9-тетрагидро-5H-бензоциклогептен -6- ил)амино]этанол (моно-изомер Б).
Т. пл. 97 -99oC
[α]D = - 26,42o (с=0,28 хлористый метилен)
ИК-спектр (Nujol): 3200, 1778 см-1
ЯМР-спектр (хлороформ-d, δ): 1,25 (3H, трипл. J=7,1)Гц) 1,48 (1H, шир. пол. ) 1,84 (2H, мульт.) 2,11 (1H, мульт.) 2,6 - 3,0 (7H, мульт.) 3,17 (1H, дублет дублетов, J=8,8 Гц, 3,2 Гц), 4,55 (2H, сингл.) 5,05 (1H, мульт.) 6,62 (1H, дублет дублетов, J= 2,5 Гц, 8,1 Гц), 6,76 (1H, дубл. J=2,5 Гц), 6,96 (1H, дубл. J=8,1 Гц), 7,4 - 7,5 (3H, мульт.) 7,8 - 7,9 (4H, мульт.)
Масс-спектр (m/z ): 434 (M++1) и 416
7) (1R, 6'R) - (1R, 6'S)-2-[(3 -окси-6,7,8,9 - тетрагидро-5H-бензоциклогептен-6-ил)амино]-1-(3-хорфенил) этанол
Т. пл. 180 - 181oC
ИК-спектр (Nujol): 3150, 2620 см-1
ЯМР-спектр (DMCO-d6, δ): 1,2 - 2,0 (10H, мульт.) 2,4 - 2,9 (14H, мульт.) 4,5 - 4,7 (2H, мульт.) 5,39 (2H, шир. сингл.) 6,43 (2H, дублет дублетов, J=2 Гц, 8 Гц), 6,5 - 6,6 (2H, мульт.) 6,83 (2H, дубл. J=8 Гц), 7,2 - 7,5 (8H, мульт.) 8,99 (2H, шир. сингл.)
Масс-спектр (m/z): 334 (M+2+H)+, 332 (M+H)+
8) (1R, 6'R) - и (1R, 6'S) - 2-[[2-бис(этоксикарбонил) метокси-6,7,8,9 - тетрагидро-5H-бензоциклогептен - 6- ил] амино]-1-(3-хлорфенил)этанол
Т. пл. 95oC
ИК-спектр (Nujol), 1700, 1740 см-1
ЯМР-спектр (хлороформ-d, δ): 1,30 (12H, трипл. J=7 Гц), 1,4 - 1,7 (2H, мульт.) 1,7 - 2,0 (4H, мульт.). 2,0 -2,3 (2H, мульт.) 2,6 - 3,8 (18H, мульт. ) 4,31 (8H, кварт., J= 7 Гц), 4,7 - 4,9 (2H, мульт.) 5,15 (2H, сингл.) 6,65 (2H, дублет дублетов, J = 2 Гц, 8 Гц), 6,75 (2H, дубл. J = 2 Гц), 7,06 (2H, дубл. J = 8 Гц), 7,2 - 7,3 (6H, мульт.) 7,37 (2H, шир. сингл.)
Масс-спектр (m/z): 492 (M+2+H)+, 490 (M+H)+
9) (1R, 6'R) - 2[(3 - этоксикарбонилметокси - 6,7,8,9, - тетрагидро- 5H- бензоциклогептен- 6 - ил) амино]-1- (3-хлорфенил) этанол
Т. пл. 98 - 100oC
[α]
ИК-спектр (Nujol): 3500 - 2500, 1760, 1720 см-1
ЯМР-спектр (DMCO-d6, δ): 1,18 (3H, трипл. J = 7 Гц), 1,2 - 2,1 (6H, мульт. ) 2,4 - 2,9 (6H, мульт.) 4,14 (2H, кварт. J = 7 Гц), 4,5 - 4,6 (1H, мульт.) 4,68 (2H, сингл.) 5,40 (1H, дубл. J = 4 Гц), 6,58 (1H, дублет дублетов, J = 2 Гц, 8 Гц) 6,72 (1H, дубл. J = 2 Гц), 6,96 (1H, дубл. J = 8 Гц), 7,2 - 7,5 (4H, мульт.)
Масс-спектр (m/z): 420 (M+2+H)+, 418 (M+H)+
10) (1R,6'R) - и (1R,6'S) - 2 - [[(3 - (2-этоксикарбонилпропан-2-илокси) - 6,7,8,9 - тетрагидро- 5H- бензоциклогептен -6 - ил]амино - 1 - (3-хлорфенил)этанол
Т. пл. 101 - 115oC
ИК-спектр (Nujol): 1735, 1600 см-1
ЯМР-спектр (хлороформ-d, δ): 1,24 (6H, трипл. J = 7,1 Гц), 1,57 (12H, сингл. ) 1,40- 2,05 (8H, мульт.), 2,45 - 3,10 (14H, мульт.) 4,21 (4H, кварт. J = 7,1 Гц), 4,12 (2H, кварт. J = 7,1 Гц), 4,50 - 4,60 (2H, мульт.) 6,50 - 6,65 (2H, мульт.) 6,65 - 6,70 (2H, мульт.) 6,85 - 7,00 (2H, мульт.) 7,15 - 7,40 (8H, мульт.)
Пример 31.
Следующие соединения были получены по методике, аналогичной той, которая приведена в примере в примере 29.
1) (1R,6'R) - 2 -[(3-этоксикарбонилметокси -6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-ил)амино]-1-(3-хлорфенил) этанол гидрохлорид
Т. пл. : 103oC
[α]
ИК-спектр (Nujol): 3380, 2400, 1760 см-1
ЯМР-спектр (DMCO-d6, δ): 1,1 - 1,4 (1H, мульт.) 1,19 (3H, трипл. J = 7 Гц) 1,7 - 2,1 (2H, мульт.) 2,2 - 2,4 (1H, мульт.) 2,6 - 2,8 (2H, мульт.) 2,9 - 3,3 (5H, мульт.) 4,15 (2H, кварт. J = 7 Гц), 4,70 (2H, сингл) 5,0 - 5,2 (1H, шир. мульт.) 6,34 (1H, шир. дубл. J = 4, Гц), 6,67 (1H, дублет дублетов. J = 2 Гц, 8 Гц) 6,88 (1H, дубл. J = 2 Гц, 7,03 (1H, дубл. J = 8 Гц), 7,3 - 7,6 (4H, мульт.), 8,6 - 9,4 (2H, шир. мульт.)
Масс-спектр (m/z): 420 (M+2+H), 418 (M+H)+
2) (1R, 6'R) и (1R, 6'S) -2-[[3-(2-оксобутокси)-6,7,8,9-тетрагидро- 5H-бензоциклогептен-6-ил]амино]-1-(3-хлорфенил)этанол гидрохлорид
Т. пл. = 119 - 121oC
ИК-спектр (Nujol): 3400, 3190, 1715 см-1
ЯМР-спектр (DMCO-d6, δ): 0,95 (3H, трипл. J = 7,3 Гц) 0,96 (3H, трипл. J = 7,3 Гц), 1,1 - 1,35 (2H, мульт.) 1,75 - 2,1 (4H, мульт.), 2,2 - 2,4 (2H, мульт. ) 2,5- 2,8 (8H, мульт.) 2,95 - 3,3 (10H, мульт.) 4,74 (2H, сингл.) 4,75 (2H, сингл.) 4,95 - 5,1 (2H, мульт.) 6,3 - 6,4 (2H, мульт.) 6,6 - 6,7 (2H, мульт.) 6,75 - 6,9 (2H, мульт.) 6,95 - 7,1 (2H, мульт) 7,3 - 7,55 (8H, мульт.) 8,7 - 8,95 (2H, мульт.) 9,1- 9,4 (2H, мульт).
Масс-спектр (m/z): 402 (M+1-HCl)+
Пример 32.
Следующие соединения были получены путем взаимодействия соединений, полученных по методике, аналогичной той, которая описана в примере 29-1), со щавелевой кислотой.
1) (1R, 6'R) - (1R, 6'S) - 2 - [[3- бис -(этоксикарбонил) метокси - 6,7,8,9 - тетрагидро-5H-бензоциклогептен-6-ил] амино] -1 - (3 - хлорфенил) этанол оксалат
ЯМР спектр (DMCO-d6 + D2O, δ): 1,1 - 1,4 (14H, мульт.) 1,7 - 2,1 (4H, мульт.) 2,1 - 2,4 (2H, мульт.) 2,6 - 2,8 (4H, мульт.) 2,9 - 3,4 (10H, мульт. ) 4,0 - 4,4 (8H, мульт.) 4,8 - 5,0 (2H, мульт.) 5,57 (2H, сингл.), 6,6 - 7,2 (6H, мульт.) 7,3 - 7,6 (8H, мульт.)
Масс-спектр (m/z): 492 (M+2+H)+, 490 (M+H)+
2) (1R, 6'R) - и (1R,6'S) - 2 -[[3 - ((RS)- 2 - оксопентан-3-илокси)- 6,7,8,9 - тетрагидро- 5H-бензоциклогептен-6-ил) амино]- 1 - (3-хлорфенил) этанол оксалат
Т. пл. 70-79oC
ИК-спектр (Nujol): 1710 см-1
ЯМР-спектр (DMCO-d6, δ): 0,75 - 1,0 (8H, мульт.), 1,15 - 1,4 (2H, мульт. ) 1,7 - 2,05 (6H, мульт.) 2,13 (6H, сингл.) 2,15 - 2,35 (2H, мульт.) 2,4 - 3,35 (14H, мульт.) 4,5 - 4,65 (2H, мульт.) 4,85 - 5,0 (2H, мульт.) 6,5 - 7,1 (6H, мульт.) 7,3 - 7,6 (8H, мульт.)
Масс-спектр (m/z) : 416 (M+1 - C2H2O4)
3) (1R, 6'R) - или (1R, 6'S) - или (1S, 6'R) - или (1S, 6'S)- 1-(2-нафтил)-2-[(3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5H- бензоциклогептен -6-ил) амино]этано оксалат (моно-изомер А).
Т. пл. : 90 - 99oC
ИК-спектр (KBr): 3183, 2856, 1751, 1207 см-1
ЯМР-спектр (хлороформ-d, δ): 1,25 (3H, трипл, J=7,1 Гц) 1,5 - 3,4 (12H, мульт. ) 4,2 (2H, кварт. J=7,1 Гц) 4,46 (2H, сингл.) 4,86 (1H, шир. пол.), 6,5 - 6,9 (3H, мульт.) 7,2 - 7,4 (3H, мульт.) 7,6 - 7,8 (4H, мульт.)
Масс-спектр (m/z): 434 (M++1) и 416
Соединение с нейтральными компонентами измельчают в порошок перемешивают и помещают в сухие желатиновые капсулы (см. табл. 3).
Соединение тонко измельчают и смешивают с также измельченными инертными ингредиентами согласно рецептуре, а затем прессуют в таблетки на стандартном оборудовании (см. табл. 4).
Дополнительные данные по биологической активности
Испытание 1.
Действие на удаленную периферическую толстую кишку крысы.
/i/ Метод испытания:
Использовали мужские особи крыс SD ( 180≈ 230 г). Животным не давали пищу в течение 24 часов перед экспериментом. Сразу же после умерщвления животных периферическую толстую кишку удаляли и помещали в ванночку для органов, содержащую 25 мл Тиродного раствора с продуванием смесью 95% O2, 5% CO2 при 37oC. Полоску образца закрепляли с натяжением 0,5 г и изометрически записывали спонтанные сокращения. После того, как подвижность образца стала равномерной, в ванночку добавляли испытательное соединение, и сокращения наблюдали в течение 30 минут. Действие испытательного соединения подсчитывали путем сравнения сокращений до и после введения испытательного соединения.
/ii/ Результаты испытания (см. табл. 5).
Испытание 2.
Действие на изолированную матку небеременной крысы:
/i/ Метод испытания:
Использовали женские особи крыс SD (150≈180 г). За 48 и 24 часа до использования крысам подкожно вводили эстрадиол (яичный гормон (Orahormon) бензоат: торговая марка, Feikоku Hovmone Mfg Co. Ztd в дозе 40 мкг) на крысу, чтобы вызвать течку. Животных умерщвляли и извлекали маточные роговые отростки. Каждую полоску образца помещали в ванночку для органов, содержащую 25 мл раствора Lacke с продуванием 95% O2, 5% СO2 при температуре 37oC и с натяжением 1 г. Сокращения образца изотермически записывали. После того, как спонтанные сокращения становились равномерными, в ванночку добавляли испытательное соединение. Подвижность образца наблюдали в течение 20 минут. Действие испытательного соединения подсчитывали путем сравнения сокращений до и после ввода испытательного соединения.
/ii/ Результаты испытания (см. табл.6).
Другие данные по активности
Испытание
Испытание на действие против частого мочеиспускания методом цистометрографии.
/i/ Метод испытания:
/а/ Подготовка испытательного образца крысы
Мужские особы крыс W:Star (возраст 7-8 недель), анестезированные пентобарбиталом натрия (нитроперитонеальное введение в количестве 45 мг/кг) оперировали в соответствии с методикой Dubois et al. (1995) и Hava et al. (1992). Крыс помещали в стереотаксический аппарат (Kopf Insiruments, Fujunga, California) и поражали мозг с двух сторон инъекцией иботеновой кислоты ( ibotenie acid). Используемые координаты помещений канюли были следующими: переднее 7,7 мм; боковое 2,4 мм; горизонтальное 2,9 мм в соответствии с Paxinos и Watson (1982). Ибеотеновую (ibeotenic) кислоту вводили через 0,4 мм канюлю из нержавеющей стали, соединенную Тефлоновой трубочкой с микрошприцем Гамильтона. Иботеновую кислоту (reslavch Biochemieals, Inc., Natick, ms) растворяли в солевом растворе фосфатного буфера Дульбекко (D-PBS, pH 7,4) при концентрации 10 мг/мл и вводили в объеме 0,75 мкл в течение 3 минут при помощи шприца. Крысам, которым симулировали операцию, вводили только D-PBS.
Литература
Dubois, B., Mayo, W., Agid, Y., Le Moal, M. и Simon, H., Profound disturbances of spontareous and Learned behaviors following Lesions of the nucleus bosalis magnocellu Laris in the rat. Brain Res., 338:249, 1985.
Hara, C. , Kasahara, N. и Ogawa. N.: Characteristics of behavioral and physical disturbances of rats With biloteral Lesions of basal forebrain by ibotlnic acid. Jpn. J. Pharmacol., suppl. 1,58:58P, 1992.
Paxinos, G. и Watson, C. : The rat braik in stereotaxil Coordinates. Sydnley, Australia: Academic Press, 1982.
(в) Цистометрография
Через 1-3 недели после хирургического вмешательства крыс подвергали цистометрографии. Крыс анастезировали эфиром, раскрывали брюшную полость надрезом посередине и имплантировали в мочевой пузырь тонкую канюлю (наружный диаметр 1 мм) из нержавеющей стали. Канюлю подсоединяли к сдвоенной люменовой трубке (внешняя трубка: наружный диаметр 1,7 мм, внутренняя трубка: наружный диаметр 0,61 мм) для введения солевого раствора (37oC) и для одновременного измерения интравезикулярного давления. Полиэтиленовую трубку (наружный диаметр 0,97 мм) помещали в желудок через пищевод для введения лекарств орально. Крыс помещали в клетки Боллмана и давали им отойти от анастезии в течение приблизительно 3 часов. Свободные концы трубок от мочевого пузыря подсоединяли к датчику давления (ТР-4ООТ, Nihon kohden : внешняя трубка) и к нагнетательному шприцу (внутренняя трубка). Солевой раствор (37oC) вводили в мочевой пузырь с помощью нагнетательного шприца со скоростью 61,5 мкл в минуту, и интравезикулярное давление постоянно регистрировали при помощи полиграфной системы (РМ-6000. Nihon kohen). Паузу между мочеиспусканиями измеряли для вычисления объема введенного солевого раствора при каждой цистометрограмме. Были исследованы следующие цистометрические параметры: наполнение мочевого пузыря, давление при мочеиспускании и пороговое давление (интравезикулярное давление непосредственно перед мочеиспусканием). Испытательные лекарственные средства вводили орально через предварительно введенную полиэтиленовую трубку после того, как цистометрограмма стала стабильной. Количество крыс в каждой группе составляло 5 при лишь небольших исключениях (4 или 7). Цистометрографию проводили через 30 минут (или 2 или 3 часа) после введения лекарства, и оказываемое действие на цистометрические параметры (средние значения показателей 2-х или 3-х цистометрограмм) оценивали путем сравнения средних значений показателей 3-х цистометрограмм непосредственно перед введением лекарства.
Наполняемость мочевого пузыря подсчитывали следующим способом: [Наполняемость мочевого пузыря] (мкл) - [ пауза между мочеиспусканиями] (мин) х [61,5:скорость введения] (мкл/мин)
/ii/ Результаты испытания (см. табл. 7).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ N-(3-ПИПЕРИДИНИЛКАРБОНИЛ)-БЕТА-АЛАНИНА В КАЧЕСТВЕ АНТАГОНИСТОВ ФАКТОРА АКТИВАЦИИ ТРОМБОЦИТОВ (ФАТ), СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2161155C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1993 |
|
RU2128172C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ ДЕЙСТВИЯ ТАХИКИНИНА | 1993 |
|
RU2119922C1 |
| ЦИКЛОПЕПТИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБЫ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2108342C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2176640C2 |
| ПОЛИПЕПТИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРОФИЛАКТИКИ ИЛИ/И ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ | 1994 |
|
RU2164230C2 |
| ПОЛИПЕПТИДНОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2165423C2 |
| ПРОИЗВОДНЫЕ ГУАНИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ NA/H - ОБМЕНА В КЛЕТКАХ | 1994 |
|
RU2141946C1 |
| ПРОИЗВОДНЫЕ НАФТАЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2155188C2 |
| СОЕДИНЕНИЯ ЦЕФЕМА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2081874C1 |

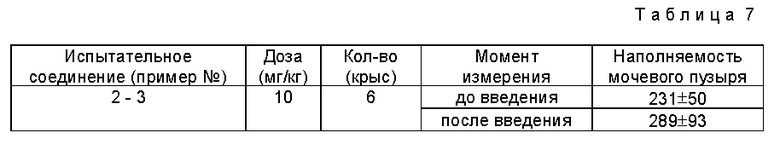
Предложены производные этаноламина общей формулы I, где R1 - фенил, нафтил, индалил, пиридин, бензофуразанил, бензодиоксалил; R2 - атом галогена, нитрогруппа и др., R3 - атом водорода, бензил и т.д., n = 0-3. Способ получения соединений формулы I включает взаимодействие соединений формулы II;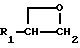
с соединением формулы III. Предложена также фармкомпозиция для лечения и/или профилактики расстройств мочеиспускания, спазмов или повышенной перистальтики желудочно-кишечного тракта, включающая эффективное количество соединений формулы I совместно с фармацевтически приемлемым нетоксичным носителем или инертным наполнителем. Способ лечения и/или профилактики растройств мочеиспускания, спазмов или повышенной перистальтики желудочно-кишечного тракта состоит в назначении людям или животным эффективного количества соединений формулы I. 3 c. и 5 з.п. ф-лы, 7 табл.
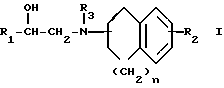
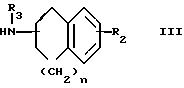
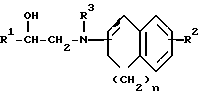
где R1 - фенил, нафтил, индалил, пиридил, бензофуразанил или бензодиоксалил, каждый из которых может содержать такие заместители, как атом галогена или гидрокси;
R2 - атом галогена, нитрогруппа, оксигруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой;
R3 - атом водорода, бензил или низшая алкильная группа, необязательно замещенная низшей алкилтиогруппой;
n = 0 - 3, целое число;
жирная линия означает простую связь или двойную связь,
при этом, если n = 1, то 1) R1 - нафтил, пиридил, бензофуразанил или бензодиоксалил, каждый из которых может содержать такие заместители, как галоген или гидрокси, 2) R2 - атом галогена, нитрогруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)-алкильной группой, 3) R3 - бензил или низшая алкильная группа, необязательно замещенная низшей алкилтиогруппой, 4) жирная линия означает двойную связь,
и его фармацевтически приемлемые соли.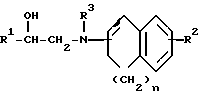
где R1 - фенил, нафтил, индалил, пиридил, бензофуразанил или бензодиоксалил, каждый из которых может содержать такие заместители, как атом галогена или гидрокси;
R2 - атом галогена, нитрогруппа, оксигруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой;
R3 - атом водорода, бензил или низшая алкильная группа, необязательно замещенная низшей алкилтиогруппой;
n = 0 - 3, целое число;
жирная линия означает простую связь или двойную связь,
при этом, если n = 1, то 1) R1 - нафтил, пиридил, бензофуразанил или бензодиоксалил, каждый из которых может содержать такие заместители, как галоген, или гидрокси, 2) R2 - атом галогена, нитрогруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)-алкильной группой, 3) R3 - бензил или низшая алкильная группа, дополнительно замещенная низшей алкилтиогруппой, 4) жирная линия означает двойную связь, и его фармацевтически приемлемые соли, который включает взаимодействие соединения формулы II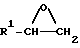
с соединением формулы III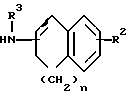
или его солью с целью получения соединения формулы I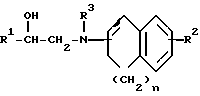
или его соли,
где R1, R2, R3 и жирная линия имеют указанные значения.
| СПОСОБ ПОЛУЧЕНИЯ ФИЛЬТРОВАЛЬНЫХ ПОРОШКОВ НА ОСНОВЕ ВСПУЧЕННОГО ПЕРЛИТА | 0 |
|
SU383686A1 |
| ПРЕСС ДЛЯ ТОЧНОГО ШТАМПОВАНИЯ | 0 |
|
SU383256A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1988, ч.2, с.335. | |||
Авторы
Даты
1999-02-10—Публикация
1993-02-01—Подача