Изобретение относится к новому конденсированному производному тиазола, полезному в качестве фармацевтического агента, особенно в качестве агониста 5-НТ3 рецепторов к его фармацевтически приемлемой соли, к способу его получения и к фармацевтической композиции, включающей это соединение в качестве активного ингредиента.
Соединение изобретения действует как эффективный и селективный агонист нейронного рецептора серотонина (5-НТ), расположенного в первичном афферентном нерве нервной системы брюшной полости или центральной нервной системы. Этот тип рецепторов рассматривается в настоящее время как 5-НТ3 рецептор. Соединение выполняет свою функцию путем высвобождения ацетилхолина из эфферентного нервного окончания в пищеварительном тракте. Известно, что стимуляция ацетилхолинового рецептора в пищеварительных трактах ускоряет сократительную способность желудочно-кишечных трактов и улучшает их функциональное восстановление. [Goonman and Gilman's, the Pharmacological Basis of Therapentics 8th edition, p.125, (1990), Pergamon Press]
Известно также, что 5-НТ3 рецептор присутствует в предсинаптической зоне центральной нервной системы и подавляет нервную активность при его раздражении [J. Neurosoi. 11, 1881 (1991)
В результате, считается, что 5-НТ3 рецепторный агонист полезен особенно против желудочно-кишечных расстройств.
Хотя не было найдено соединения, имеющего селективную агонистическую активность к 5-НТ3 рецептору, заявители изобретения сообщили, что производные тиазола, раскрытые в WO 92/07849, обладают селективной 5-НТ3 рецепторной агонистической активностью.
Авторы изобретения продолжили дальнейшие исследования, касающиеся агонистических активностей относительно 5-НТ3 рецепторов, которые привели к выполнению данного изобретения и обнаружили что 2-(имидазолил)алкилен-конденсированное тиазолпроизводное показывает отличную 5-НТ3 рецепторную агонистическую активность, что явилось результатом синтезов соединений, обладающих 5-НТ3 рецепторной агонистической активностью с учетом сократительных эффекта 5-НТ, опосредованных через 5-НТ3 рецептор на изолированной толстой кишке морской свинки в качестве маркера, независящих от рефлекса Bezold-Jarisch [A. S. Paintal et al. Physiol. Rev. 53, 159(1973)] которая обычно используется в качестве маркера 5-НТ3 рецепторной агонистической активности.
Хотя 2-аминоинденотиазол производное, имеющее противоязвенную активность, раскрытое в JP-A-62-252780 (термин "JP-A", использованный здесь, означает "непрошедшую экспертизу патентную заявку Японии"), и 2-амино конденсированное производное тиазола, имеющее мускарин рецепторную агонистическую активность, раскрытое в JP-A-63-243080, были известны как конденсированные производные тиазола, соединение данного изобретения является новым соединением и его структура и активность полностью отличны от структуры и активности перечисленных соединений.
Конденсированное производное тиазола, представленное общей формулой (I), или его фармацевтически приемлемая соль характеризуется тем, что оно имеет высокое сродство к 5-НТ3 рецептору, вызывает сократительные эффекты в изолированной толстой кишке морской свинки, используемой в качестве маркера 5-НТ3 рецепторной агонистической активности.
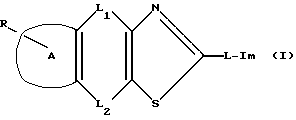
Символы в вышеприведенной формуле означают
R: атом водорода, атом галогена, гидроксильная группа, низшая алкокси группа, карбокси группа, низшая алкокси-карбонил группа, нитро группа, амино группа, циано группа или защищенная гидроксильная группа;
A: фенильное кольцо или нафталиновое кольцо;
L1 и L2: одна является непосредственной связью, а другая является
a) линейной или разветвленной низшей алкилен группой, которая может содержать в себе прерывающий атом кислорода или серы,
b) атомом кислорода или атомом серы или
c) низшей алкиленовой группой;
L: непосредственная связь или линейная или разветвленная низшая алкениленовая группа;
Im: группа, представленная формулой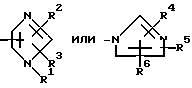
R1, R2 и R3 одинаковые или отличные один от другого, каждый представляющий атом водорода или низшую алкильную группу;
R4, R5 и R6 одинаковые или отличные один от другого, каждый представляющий атом водорода или низшую алкильную группу.
Цель изобретения получение конденсированного производного тиазола, представленного выше общей формулой (I) или его фармацевтически приемлемой соли.
Другой целью изобретения является получение фармацевтической композиции, которая включает конденсированное производное тиазола (I), описанное выше, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Следующая цель изобретения состоит в обеспечении способа получения вышеупомянутого производного (I) или его фармацевтически приемлемой соли.
Соединения данного изобретения детально описаны ниже.
Если не указано особо, термин "низший" в определении общей формулы данного описания означает линейную или разветвленную углеродную цепь, имеющую 1 6 атомов углерода.
В результате иллюстративные примеры "низшей алкильной группы" включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, 1-метилбутил, 2-метилбутил, 1,2-диметилпропил, гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил и т.п.
Из этих групп предпочтительны C1-C4 алкил группы, особенно C1-C3 алкил группы.
Иллюстративные примеры "низшей алкокси группы" включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси (амилокси), изопентилокси, трет-пентилокси, неопентилокси, 2-метилбутокси, 1,2-диметилпропокси, 1-этилпропокси, гексилокси и тому подобные, из которых предпочтительны C1-C4 алкокси группы, особенно C1-C2 алкокси группы.
Иллюстративные примеры "низшей алкоксикарбонил группы" включают (C1-C6 алкокси) карбонил группы, такие как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, неопентилоксикарбонил, трет-пентилоксикарбонил, гексилоксикарбонил и т. п. из которых предпочтительны (C1-C4 алкокси)карбонил группы, особенно (C1-C2 алкокси)карбонил группы.
Иллюстративные примеры "линейной или разветвленной низшей алкиленгруппы", обозначенной L, включают метилен, этилен, метилметилен, триметилен, 1-метилэтилен, 2-метилэтилен, тетраметилен, 1-метилтриметилен, 2-метилтриметилен, 3-метилтриметилен, 1-этилэтилен, 2-этилэтилен, 1,2-диметилэтилен, пропилметилен, пентаметилен, 1-метилтетраметилен, 2-метилтетраметилен, 3-метилтетраметилен, 4-метилтетраметилен, 1-этилтриметилен, 2-этилтриметилен, 3-этилтриметилен, 1,1-диметилтриметилен, 2,2-диметилтриметилен, 3,3-диметилтриметилен, гексаметилен, 1-метилпентаметилен, 2-метилпентаметилен, 3-метилпентаметилен, 4-метилпентаметилен, 5-метилпентаметилен, 1,1-диметилтетраметилен, 4,4-диметилтетраметилен и т. п. из которых предпочтительны линейные или разветвленные C1-C4 алкилен группы, особенно линейные или разветвленные C1-C3 алкилен группы.
"Линейная или разветвленная низшая алкилен группа, которая может содержать в себе прерывающий атом кислорода или серы", представленная каким-либо одним из L1 и L2, включает "низшую алкилен группу, которая содержит в себе прерывающий атом кислорода или серы" и "низшую алкилен группу", и примеры низшей алкилен группы включают предпочтительно линейные или разветвленные C1-C4 алкилен группы, более предпочтительно C1-C3 алкилен группы, которые содержат прерывающий атом кислорода или серы. Также иллюстративные примеры низшей алкилен группы, которая содержит прерывающий атом кислорода или серы, включают все группы, представленные формулой -L3-Y-L4- (в которой каждая из L3 и L4 является непосредственной связью или линейной или разветвленной C1-C6 алкилен группой, L3 и L4 содержат от 1 до 6 углеродных атомов в общей сложности, и Y является атомом кислорода или серы), особенно предпочтительны примеры, включающие оксиметилен группу (-O-CH2) и метиленокси группу (-CH2-O-), тиометилен группу (-S-CH2-), метилентио группу (-CH2-S-), 1-оксатриметилен группу (-O-CH2-CH2-, номенклатура замещения приведена здесь и далее), 2-оксатриметилен группу (-CH2-O-CH2), 3-оксатриметилен группу (-CH2CH2-O-0, 2-метил-1-оксаэтилен группу 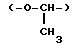 1-метил-2-оксаэтилен группу
1-метил-2-оксаэтилен группу 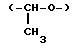 1-тиатриметилен группу (-S-CH2CH2-), 2-тиатриметилен группу (-CH-S-CH0, 3-тиатриметилен группу 9-CH2CH2-S-), 2-метил-1-тиаэтилен группу
1-тиатриметилен группу (-S-CH2CH2-), 2-тиатриметилен группу (-CH-S-CH0, 3-тиатриметилен группу 9-CH2CH2-S-), 2-метил-1-тиаэтилен группу 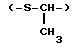 и 1-метил-2-тиаэтилен группу
и 1-метил-2-тиаэтилен группу 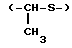
Иллюстративные примеры "низшей алкенилен группы", представленные каким- либо одним из L1 и L2, включают линейные или разветвленные C2-C6 алкенилен группы, такие как винилен, пропилен, 2-пропенилен, 1-метилвинилен, 2-метилвинилен, 1-бутенилен, 2-бутенилен, 3-бутенилен, 1,3-бутадиенилен, 1-метилпропенилен, 2-метилпропенилен, 3-метилпропенилен, 1-метил-2-пропенилен, 2-метил-2-пропенилен, 3-метил-2-пропенилен, 1-этилвинилен, 2-этилвинилен, 1-пропилвинилен, 2-пропилвинилен, 1-изопропилвинилен, 2-изопропилвинилен и т. п. из них предпочтительны группы, имеющие C2-C4 алкенилен группы в виде алкениленовой цепи, содержащей цикл, особенно имеющие C2 алкенилен группы в виде алкениленовой цепи, содержащей цикл.
Иллюстративные примеры "атомов галогена" включают атом фтора, атом хлора, атом брома и атом иода.
Иллюстративные примеры "защитной группы для гидроксил группы" включают бензил, трет-бутил, ацетил, трифтороацетил, бензоил, бензилоксикарбонил и т. п.
Соединение (I) изобретения образует соль присоединения кислоты. Оно образует также соль с основанием, в некоторых случаях зависящих от типа его структуры.
Фармацевтически приемлемые соли соединения (I) также включаются в данное изобретение, и иллюстративные примеры этих солей включают кислотно-аддитивные соли присоединения с неорганическими кислотами, такими как хлористоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п. или с органическими кислотами, такими как муравьиная уксусная, пропионовая, щавелевая, малоновая, янтарная, фумаровая, малеиновая, молочная, яблочная, винная, лимонная, угольная, метиленсульфоновая, этансульфоновая, аспарагиновая глутаминовая и т.п. соли с неорганическими основаниями, такими как соли калия, натрия магния, кальция и тому подобные или с органическими основаниями, такими как триметиламин, триэтиламин, циклогексиламин, моноэтаноламин, диэтаноламин, триэтаноламин, аргинин, лизин и т.п. и соль аммония.
Благодаря наличию имидазольного кольца для соединения изобретения существуют 1Н и 3Н таутомеры. Также в зависимости от типа групп соединение в некоторых случаях может содержать асимметрический атом углерода. Каждый отдельный изомер, выделенный из смеси различных изомеров, или их смесь также включены в настоящее изобретение.
Кроме того, соединение изобретения выделяют в некоторых случаях в виде его гидрата, сольватированного вещества или полиморфной форме, и эти вещества также включены в изобретение.
Особенно предпочтительными примерами соединения изобретения являются те примеры, в которых А цикл представляет фенильный цикл, L1 представляет прямую связь и L2 является линейной или разветвленной низшей алкиленовой группой или низшей алкениленовой группой. Ниже приведены оптимальные из этих соединений.
(1) 2-(4-Имидазолилметил)-8Н-индено[1,2-d]тиазол или его фармацевтически приемлемые соли.
(2) 2-(4-Имидазолилметил)-4,5-дигидронафто[1,2-d]тиазол или его фармацевтически приемлемые соли.
Способ получения заключается в следующем.
Соединение (I) изобретения и его фармацевтически приемлемые соли могут быть получены применением разнообразных методик синтеза, использующих характеристики их основной химической структуры или заместителя. С точки зрения технологии изготовления в некоторых случаях эффективной является защита амино группы (включая азот имидазола), карбокси группы и гидрокси группы соединения изобретения соответствующими защитными группами, а именно функциональными группами, которые легко могут быть вновь превращены в амино группу (включая азот имидазола), карбокси группу и гидроксильную группу соответственно. Примеры таких защитных групп включают группы, о которых сообщают Greene и Wuts в Protective Groups in Organic Synthesis 2nd edition, и эти группы могут быть не использованы в зависимости от реакционных условий. В дополнение к этим защитным группам другие функциональные группы, которые легко могут быть превращены в амино группу, карбокси группу и гидроксил группу, могут также использоваться в качестве защитных групп.
Далее следуют иллюстративные характерные способы получения соединения (I) изобретения и его солей.
Способ получения I (реакция циклизации)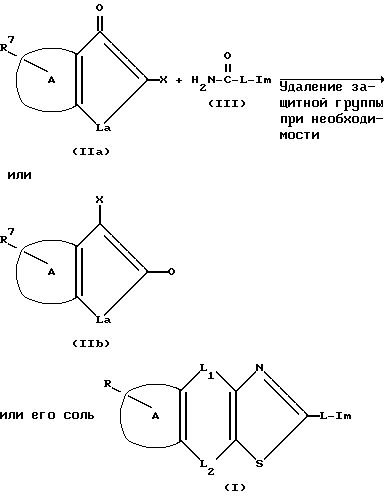
В реакционной схеме A, L1, L2, L и Im такие как определено выше, R7 является такой же группой как R, который может иметь защитную группу. La является a) линейной или разветвленной низшей алкилен группой, которая может содержать в себе прерывающий атом кислорода или серы; b) атомом кислорода или атомом серы или c) низшей алкилен группой и X является атомом галогена.
Соединение (I) изобретения может быть получено по реакции производного α -галогенокетона, представленного общей формулой (IIa) или (IIb) с тиоамидным производным, представленным общей формулой (III) или его солью для осуществления циклизации, и затем при необходимости защитная группа может быть снята.
Примеры атома галогена, обозначенного X, включают атом иода, атом брома, атом хлора и т.п.
Целесообразно выполнять реакцию в инертном органическом растворителе, таком как спиртовые растворители (например, изопропанол, метанол, этанол или т. п.) или водном спиртовом растворителе при комнатной температуре или с нагреванием, предпочтительно с нагреванием до температуры кипения, используя эквимолярные количества (IIa) или (IIb) и (III) или один из них в избыточном молярном соотношении.
Снятие защитной группы варьируется в зависимости от типа защитной группы; например, каталитическая реакция может соответственно использоваться, когда защитная группа для амино группы является замещенной или незамещенной бензилоксикарбонил группой или т. п. или в некоторых случаях может применяться кислотная обработка, например, бромистоводородной кислотой /уксусной, бромистоводородной /трифторуксусной, фтористоводородной кислотой или т.п. В случае других защитных групп уретанового типа, таких как трет-бутоксикарбонил группа и т.п. снимать защиту кислотной обработкой бромистоводородной кислотой/уксусной, трифтороуксусной, хлористоводородной, хлористоводородной/уксусной, хлористоводородной кислотой/диоксаном или т.п.
Что касается снятия защитной группы для карбокси группы, метилгруппа и этилгруппа могут быть легко удалены омылением, а бензилгруппа и разнообразные виды замещенных бензилгрупп могут быть удалены каталитическим восстановлением или омылением, трет-бутил группа может быть удалена путем упомянутой выше кислотной обработки и триметилсилил группа может быть удалена при контакте с водой.
Что касается защитных групп для гидрокси группы, большинство из них может быть удалено путем их обработки натрием/жидким аммиаком или фтористоводородной кислотой, некоторые из них, например 0-бензил и 0-бензилоксикарбонил) могут быть удалены каталитическим восстановлением, и ацил защитные группы, такие как бензоил группа, ацетил группа и т.п. могут быть удалены гидролизом в присутствии кислоты или щелочи.
Эта обработка может выполняться обычным способом.
Способ получения 2 (C-алкилирование или N-алкилирование имидазольного кольца)
(В реакционной формуле, R, R7, A, L1, L2, L, X и Im такие как определено ранее, R1b является атомом водорода, низший алкил группой или защитной группой азота имидазола, и R2b, R3b и R4b одинаковые или отличные друг от друга и каждый представляет атом водорода или низшую алкильную группу при условии, что по крайней мере один из R1b, R2b, R3b или R4b является атомом водорода).
Соединение (I) изобретения и его соли могут быть получены взаимодействием галогеноалкил-замещенного конденсированного тиазол производного, представленного общей формулой (IV), которое может иметь защитную группу с имидазол производным, представленным общей формулой (V), которое может иметь защитную группу для имидазольного атома азота, и затем снятием защитной группы, когда необходимо.
Целесообразно выполнять реакцию, используя эквимолярные количества соединений (IV) и (V) или используя одно из них в избыточном молярном соотношении, при температуре от низкой до повышенной или при нагревании до температуры кипения в инертных растворителях, таких как диметилформамид, диметилсульфоксид, диэтиловый эфир, тетрагидрофуран, диоксан, ацетон, метил этил кетон, метанолэтанол, метилен хлорид, дихлороэтан, хлороформ или тому подобные, при необходимости в присутствии основания такого как пиридин, пиколин, диметиланилин, N-метилморфолин, триметиламин, триэтиламин, гидрид натрия, карбонат калия, карбонат натрия, бикарбонат натрия, гидроокись натрия, гидроокись калия или тому подобного.
Особенно в случае реакции C-алкилирования возможно проведение реакции соединения (IV) с солью щелочного металла соединения (V) при температурах, находящихся в интервале от низкой температуры, например -100oC, до комнатной температуры, в инертном апротонном растворителе, таком как диэтиловый эфир, тетрагидрофуран, диоксан или тому подобные, при необходимости с добавлением гексаметилфосфорамида, гексаметилфосфор триамида, тетраметилэтилендиамина или тому подобных и используя требуемое количество основания, такого как н-бутиллитий, втор-бутиллитий, т-бутиллитий, литий диизопропиламид, т-бутоксид калия, гидрид натрия или тому подобного.
Удаление защитных групп может быть легко произведено тем же способом, что и в случае способа получения 1, например кислотной обработкой или каталитическим восстановлением, когда тритил группа или бензгидрил группа используется в качестве защитной группы для имидазольного азота. Хлористоводородная кислота, уксусная кислота, трифтороуксусная кислота или их смесь могут быть использованы в качестве кислоты, а каталитическое восстановление может быть выполнено в присутствии катализатора, такого как палладий на углероде, окись палладия, гидроокись палладия, платина, окись платины, никель Рения или т.п.
Способ получения 3 (взаимное превращение целевых соединений)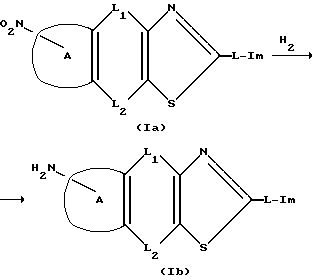
(В реакционной формуле,  L1, L2, L и Im такие как определено выше).
L1, L2, L и Im такие как определено выше).
Соединение изобретения, в котором R представляет амино группу, т.е. соединение (I), может быть получено восстановлением его соответствующего нитро соединения (Ia).
Эта реакция может выполняться с применением обычных способов восстановления ароматических нитро соединений, в частности способом, в котором каталитическое гидрирование проводится в инертном растворителе, таком как спиртовый растворитель (например, метанол, этанол, изопропанол или т.п.) или водный спирт в присутствии катализатора, такого как никель Ренея, палладий на угле, платина, платиновая чернь или тому подобного.
Соединение (I), приготовленное таким способом, выделяют и очищают в виде свободного соединения или в форме его соли, гидрата, сольватированного вещества или т.п. В этот момент фармацевтически приемлемые соли соединения (I) могут также быть получены, если подвергнуть соединение обычной реакции солеобразования.
Выделение и очистка соединения выполняются применением обычных химических способов, таких как экстракция, фракционированная кристаллизация, перекристаллизация, разнообразная фракционированная хроматография и т.п.
Таутомеры могут быть разделены использованием различий в физико-химических свойствах между изомерами.
Рацемическое соединение может быть приведено к стереохимически чистому изомеру использованием соответствующего исходного материала или в соответствии с обычным способом разделения (например, способ, в котором соединение превращается в диастереомерную соль с помощью обычной оптически активной кислоты (винная кислота и т.п.) и затем подвергается оптическому разделению). Кроме того, диастереомерная смесь может быть разделена обычным способом, например фракционированной кристаллизацией, хроматографией или тому подобным.
Промышленная применимость.
Соединение изобретения проявляет отличную 5-НТ3 рецепторную агонистическую активность, особенно в плане влияния на сократительную активность выделенной толстой кишки морской свинки. Ниже описывается такая активность наряду с методами ее измерения.
1) Агонистическая активность относительно 5-НТ3 рецепторов.
Для приготовления полосок около 20 мм вырезали дистальную толстую кишку у самцов Hartley морских свинок (500 800 г).
Каждую полоску продольно подвесили в трубке Magnus и отклик сокращения воздействие измеряли изометрически.
5-НТ (5-окситриптамин) вызывает зависящее от дозы сокращение в пределах области концентраций от 0,1 до 30 мкМ и показал максимальный отклик при концентрации от 10 до 30 мкМ (действие 5-НТ опосредовано через 5-НТ3 рецептор; J.Pharmacol, Exp. Ther. 259, 15-21, 1991).
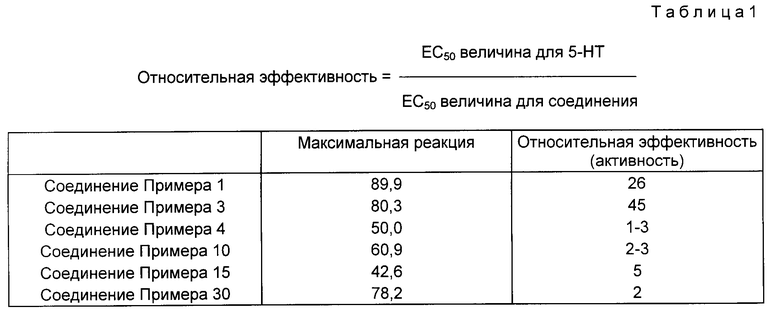
Активность каждого соединения выражается относительной величиной в сравнении с активностью 5-НТ в каждом образце.
Максимальный отклик представлен в процентах максимальной реакции для каждого соединения, при этом максимальное сокращение для 5-НТ принято за 100%
Относительная эффективность показана относительной ЕС50 величиной для каждого соединения, основанной на стандартном значении (I) соответствующей величины для 5-НТ (см. табл.1).
1) Соединение изобретения проявляет сократительные действия в выделенной толстой кишке морской свинки в концентрационно-зависимой форме при концентрации 300 мкМ.
2) Сократительная активность изолированной толстой кишки морской свинки снижены (0,3 мкМ) по сравнению с соединением, которое является 5-НТ3 рецепторным антагонистом, описанным в примере 44 JP-A-3-223278.
2) Эксперимент по рецепторному связыванию
Соединение примера 1 показало высокое сродство к 5-НТ3 рецептору в эксперименте по рецепторному связыванию. На основании полученных результатов был сделан вывод, что соединение данного изобретения является сильным 5-НТ3 рецепторным агонистом.
Предпочтительным примером соединения является соединение, которое проявляет вышеупомянутые действия, но едва показывает 5-НТ3 рецепторную агонистическую активность, когда оценивается использованием рефлекса Bezold-Jarisch (S. Paintal et al. Physiol.Rev. 53, 159 (1973)), который является обычным индексом 5-НТ3 рецепторной агонистической активности.
В связи с этим изобретение также включает некоторые соединения, которые имеют 5-НТ3 рецепторную антагонистическую активность, и эти соединения должны рассматриваться как вариант воплощения изобретения. Эти соединения, по- видимому, пригодны для медицинского применения раскрытого настоящими заявителями в отношении производных тетрагидробензимидазола, например, в JP-A-3-223278, такого как подавление рвоты, вызванной канцеростатическими средствами, такими как цисплатин и т.п. или лучевой нагрузкой, и предотвращение и лечение мигрени, комбинированной головной боли, невралгии тройничного нерва, симптомов тревоги, нарушения желудочно-кишечной сократительной способности, пептической язвы, синдрома раздраженной толстой кишки (слизистого колита) и т.п. Соединение (I) изобретения или его соль, сольват или гидрат проявляют специфическое воздействие на нейрональный 5-НТ3 рецептор, расположенный в нервном сплетении мышечной оболочки кишечника, и поэтому являются полезными при лечении желудочно-кишечных нарушений, таких как сенильный, атонический или проктогенический запор, острый или хронический гастрит, желудочная или дуоденальная язва, желудочно-кишечный невроз, гастроптоз, рефлюкс эзофагит, нарушение желудочно-кишечной сократительной способности, вызванное такими заболеваниями, как диабет и тому подобными, недостаточность желудочно-кишечной функции после операции с применением анестезирующего средства, застой в желудке, диспепсия, метеоризм и т.п. Оно может также быть использовано для лечения панкреатической недостаточности, вызванной такими заболеваниями, как жировая абсорбционная недостаточность и т.п.
Соединение изобретения является также полезным при лечении некоторых симптомов, таких как психические расстройства (шизофрения и депрессия, например тревожность, нарушение памяти и т.п.).
Обладая низкой токсичностью, соединение является подходящим для использования в качестве медицинского средства. Например, ни одно из соединений примеров 1 и 3 не вызывает серьезных побочных эффектов, когда оно назначается в дозировке 100 мг/кг внутривенно ICR самцам мышей (возраст 7-8 недель, 30-40 г, n=5-6).
Соединение (I) изобретения и его фармацевтически приемлемые соли и т.п. вещества могут выпускаться в виде таблеток, порошков, мелких гранул, капсул, пилюль, растворов, инъекций, суппозиториев, мазей, пластырей и т.п. с использованием при изготовлении обычно используемых фармацевтически приемлемых носителей, эксципиентов и других добавок и вводятся перрорально (включая подъязычное введение) или парентерально.
Носители и эксципиенты, используемые для приготовления лекарственных средств, представляют собой твердые или жидкие нетоксичные вещества для медицинского применения. Их иллюстративные примеры включают лактозу, стеарат магния, крахмал, тальк, желатин, агар, пектин, сок акации, оливковое масло, кунжутное масло, масло какао, этилен гликоль и другие обычно используемые вещества.
Клиническая доза соединения обычно определяется с учетом симптомов веса тела, возраста, пола и т.д. для каждого пациента, что обычно составляет от 1 до 100 мг на день на взрослого в случае перрорального введения и ежедневная доза может подразделяться на 1 или несколько доз на день.
Наилучший вариант воплощения изобретения
Далее приведен пример приготовления фармацевтического препарата, использующего соединение данного изобретения.
Пример состава (таблетки).
Композиция Таблетка 20 мг
Соединение изобретения 20 мг
Лактоза 75
Кукурузный крахмал 16
Гидроксипропилцеллюлоза 4,5
Кальций карбоксиметилцеллюлоза 8,7
Стеарат магния 0,7
Всего 120 мг
Таблетка 20 мг.
100 г порцию соединения равномерно смешали с 375 г лактозы и 80 г кукурузного крахмала, используя аппарат для изготовления гранул с покрытием во флюидизированном слое. К этой смеси добавили 225 г 10%-ного распыленного раствора гидроксипропилцеллюлозы с целью получения гранул. После высушивания гранулы пропустили через сито 20 меш. (0,84 мм), смешали с 19 г кальций карбоксиметилцеллюлозы и 3,5 г стеарата магния и затем переработали в таблетки, каждая весом 120 мг, используя ротационную таблеточную машину с перфоратором 7 мм х 8,4 R.
В приведенных далее примерах ЯМР-спектров:
m мультиплет; d дублет; t триплет; s синглет; br уширенный сигнал; dt двойной триплет; dd двойной дублет.
Следующие примеры приведены для дальнейшей более полной иллюстрации изобретения. В связи с этим новые соединения включены в исходные материалы изобретения. Способ получения исходных материалов приведен в следующих далее справочных примерах.
Справочный пример 1.
а) 373 мг гидрида натрия (60%) добавили к 5 мл диметилформамида и к образовавшейся суспензии добавили по каплям раствор 1,0 г 4-цианометилимидазола в 10 мл диметилформамида. После 1 ч перемешивания при комнатной температуре, к раствору добавили 1,9 мл (2-хлорометоксиэтил)триметилсилана и перемешивали при комнатной температуре в течение 2 ч. Реакционный раствор смешали с водой и хлороформом и образовавшийся органический слой собрали и высушили над безводным сульфатом натрия с последующим упариванием растворителя. Остаток подвергли колоночной хроматографии на силикагеле, элюируя смесью гексан-этил ацетат (1: 1), получив 1,128 г 4-цианометил-1-триметилсилилэтоксиметилимидазола и 0,362 г 5-цианометил-1-триметилсилилэтоксиметилимидазола.
4-Цианометил-1-триметилсилилэтоксиметилимидазол
ЯМР-(CDCl3, ТМС внутренний стандарт) δ 0,29(2Н,t), 3,50(2Н,t), 3,72(2Н, s), 5,25(2Н,s), 7,08(1Н,s), 7,56(1Н,s).
5-Цианометил-1-триметилсилилэтоксиметилимидазол
ЯМР- спектр (CDCl3, ТМС внутренний стандарт) d 0,93 (2Н, t), 3,49(2Н, t), 3,81(2Н,s), 5,33(2Н, s), 7,10(1Н, s) 7,58 (1Н, s).
b) 0,16 мл метил иодида добавили к 600 мг 4-цианометил-1-триметилсилилэтоксиметилимидазола, полученного в выше приведенной стадии а), смесь нагревали в запаянной ампуле при 60oC в течение 24 ч. После добавления к реакционному раствору диэтилового эфира и удаления образовавшейся сверху жидкости остаток высушили при пониженном давлении, получив 82 мг 4-цианометил-3-метил-1-триметилсилилэтоксиметилимидазолий иодида.
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d и 0,90(2Н, t), 3,62(2Н, t), 3,83(2Н, s), 4,35(3Н,s), 5,56(2Н,s), 7,90(1Н,s), 9,42 (1Н,s).
c) 157 мг 4-цианометил-3-метил-1-триметилсилилэтоксиметилимизолий иодида, полученного в приведенной выше стадии b), растворили в 5 мл этанола, смешали с 5 мл 1н. соляной кислоты и затем нагревали при 60oC в течение 6 ч. Реакционный раствор смешали с 1н. водным раствором гидроокиси натрия и диэтиловым эфиром и образовавшийся органический слой собрали, промыли водой и насыщенным водным раствором хлористого натрия и затем высушили над безводным сульфатом натрия с последующим упариванием растворителя. Остаток подвергли хроматографии на колонке с окисью алюминия, элюируя смесью дихлорметан-метанол (30:1), получив 15 мг 5-цианометил-1-метилимидазола.
Результат масс-спектрометрического анализа (m/z): 112 (M+)
ЯМР- спектр (CDCl3, ТМС внутренний стандарт) d 3,70(5Н,s), 6,90(1Н, s), 7,37(1Н,s).
d) Используя 500 мг 5-цианометил-1-триметилсилилэтоксиметилимидазола, полученного в приведенной выше стадии a), получили 75 мг 4-цианометил-1-метил-3-триметилэтоксиметилимидазолий иодида по той же методике, что описана в приведенной выше стадии b).
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 0,90(2Н, t), 3,62(2Н, t), 3,83(2Н, s), 3,51(3Н, s), 5,56(2Н, s), 7,92(1Н, s), 9,40(1Н, s).
e) 200 мг 4-цианометил-1-метил-3-триметилэтоксиметилимидазолий иодида, полученного в приведенной выше стадии d), обработали таким образом как указано в методике стадии c), получив 20 мг 4-цианометил-1-метилимидазола.
Результат масс-спектрометрического анализа (m/z): 112 (+)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d 3,67(3Н, s), 3,72(2Н, s), 7,00(1Н, s), 7,47(1Н, s).
Справочный пример 2. 1,3 г гидрида натрия (60%) добавили к 10 мл тетрагидрофурана и к образовавшейся суспензии добавили по каплям раствор 2,0 г имидазола в 10 мл тетрагидрофурана. После 2 ч перемешивания при 0oC раствор смешали с 1,86 мл хлорацетонитрила и перемешивали при комнатной температуре в течение 3 ч. К реакционному раствору добавили воду и хлороформ, и органический слой собрали и высушили над безводным сульфатом натрия с последующим упариванием растворителя. Остаток подвергли хроматографии на колонке с окисью алюминия, элюируя смесью дихлорметан-метанол (200:1), получив 1,043 г 1-цианометилимидазола.
Результат масс-спектрометрического анализа (m/z): 107 (M++1)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d 4,95(2Н, s), 7,06(1Н, d), 7,09(1Н, d), 7,57(1Н, s).
Справочный пример 3. Используя 2,35 мл 3-хлоропропионитрила, 2,0 г имидазола и 1,3 г гидрида натрия (60%), получили 3,2 г 1-(2-цианоэтил)имидазола, используя ту же методику, что описана в справочном примере 2.
Результат масс-спектрометрического анализа (m/z): 121(M+)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d
Справочный пример 4.
Используя 1,75 г 4-хлоробутилонитрила, 805 мг имидазола и 566 мг гидрида натрия (60%), получили 1,15 г 1-(3-цианопропил)имидазола по той же методике, что и в справочном примере 2.
ЯМР-спектр (CDCl3 ТМС внутренний стандарт) d 2,05-2,42 (4Н, m), 4,12(2Н, t), 6,96(1Н, s), 7,08(1Н, s), 7,51(1Н, s).
Справочный пример 5.
a) 1,5 г 2-имидазол карбоксальдегида растворили в 2,18 мл триэтиламина и добавили 4,3 г трифенилметил хлорида к вышеупомянутому раствору, и затем образовавшуюся смесь перемешивали при комнатной температуре в течение 24 ч. К реакционному раствору добавили насыщенный водный раствор бикарбоната натрия и хлороформ, образовавшийся органический слой собрали, промыли насыщенным водным раствором хлористого натрия и затем высушили над безводным сульфатом натрия с последующим упариванием растворителя. Остаток подвергли хроматографии на силикагеле, элюируя смесью дихлорметан-метанол (50:1), получив 4,717 г 1-трифенилметил-2-имидазол карбоксальдегида.
Результат масс-спектрометрического анализа (m/z)% 339 (M+ + 1)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d: 7,02-7,51 (17Н, m), 9,23 (1Н, s)
b) 4,717 г 1-трифенилметил-2-имидазол карбоксальдегида полученного в приведенной выше стадии а) растворили в 50 мл смеси метанол-тетрагидрофуран (1: 1), к раствору добавили при -78oC 526 мг борогидрида натрия. После перемешивания при -78oC в течение 1 ч, насыщенный водный раствор хлористого аммония и дихлорметан добавили к образовавшемуся раствору. Образовавшийся органический слой собрали, промыли водой и насыщенным водным раствором хлористого натрия и затем высушили над безводным сульфатом натрия с последующим упариванием растворителя. Остаток промыли диэтиловым эфиром, получив 1,691 г 2-гидроксиметил-1-трифенилметилимидазола.
Результат масс-спектрометрического анализа (m/z): 341 (M+ + 1)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d 3,66(2Н, s), 6,79(1Н, d), 7,00-7.41 (16Н, m).
с) При охлаждении на ледяной бане 6,2 мл тионилхлорида добавили к 7,728 г 2-гидроксиметил-1-трифенилметилимидазолу, полученному на приведенной выше стадии в), и смесь нагрели до комнатной температуры и перемешивали 30 мин. Упариванием растворителя получили 3,466 г 2-хлорометилимидазол гидрохлорида.
ЯМР- спектр (ДМСО-d6, ТМС внутренний стандарт) d: 5,05(2Н, s), 7,70(2Н, s).
d) При охлаждении в ледяной бане 7,5 г цианида калия растворили в 26 мл воды, к раствору последовательно добавили по каплям раствор 3,446 г 2-хлорометилимидазол гидрохлорида, полученного в приведенной выше стадии с), в 130 мл этанола за 1,5 ч и затем перемешивали 2,5 ч при комнатной температуре. Реакционный раствор профильтровали, к полученному фильтрату добавили насыщенный водный раствор карбоната натрия и затем растворитель удалили упариванием. Остаток экстрагировали этил ацетатом, экстракт профильтровали и затем растворитель удалили выпариванием. Остаток хроматографировали на колонке с окисью алюминия, элюируя смесью дихлорметан-метанол (50:1); получили 1,218 г 2-цианометилимидазола.
Результат масс-спектрометрического анализа (m/z): 108(M+ + 1)
ЯМР- спектр (ДМСО-d6, ТМС внутренний стандарт) d: 4,07(2Н, s), 7,33 (2Н, s).
Справочный пример 6. 450 мг гидрида натрия (60%) добавили к 5 мл диметилформамида и к образовавшейся суспензии добавили по каплям раствор 1,0 г 4-цианометилимидазола в 10 мл диметилформамида. После перемешивания в течение 1 ч при комнатной температуре к образовавшемуся раствору добавили 0,94 мл 2-пропил иодида и перемешивали при комнатной температуре в течение 2 ч. К реакционному раствору добавили воду и хлороформ, и образовавшийся органический слой собрали и высушили над безводным сульфатом натрия с последующим упариванием растворителя. Остаток подвергли колоночной хроматографии на силикагеле, элюируя смесью хлороформ-метанол (30:1), получив 500 мг 4-цианометил-1-(2-пропил)имидазола.
ЯМР- спектр (CDCl3, ТМС внутренний стандарт) d: 1,32 (6Н, d), 3,54(2Н, s), 4,20(1Н, m), 6,83 (1Н, s), 7,82 (1Н, s).
Справочный пример 7. К 660 мг 5-цианометил-1-метилимидазола, полученного в справочном примере 1с)б добавили 10 мл 4 н. раствора хлористоводородной кислоты в этилацетате, и затем 0,92 мл 0,0-диэтил дитиофосфата, и смесь перемешивали при комнатной температуре 18 ч. Образовавшийся твердый продукт собрали фильтрацией, промыли этил ацетатом и затем диэтиловым эфиром и высушили при пониженном давлении, получив 966 мг (1-метил-5-имидазол)тиоацетамид гидрохлорида.
Результат масс-спектрометрического анализа (m/z): 156 (M+ + 1)
Справочный пример 8. Используя 185 мг 4-цианометил-1-метилимидазола, полученного в справочном примере 1е), получили 282 мг (1-метил-4-имидазолил)тиоацетамид гидрохлорида по той же методике, что описана в справочном примере 7.
Результат масс-спектрометрического анализа (m/z): 156 (M+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d: 3,78(3Н, s), 3,84(2Н, s), 7,55(2Н, s), 9,85(2Н, br).
Справочный пример 9. Используя 0,88 г 1-цианометилимидазола, полученного в справочном примере 2, получили 1,309 г 1-имидазолилтиоацетамид гидрохлорида по той же методике, что описана в справочном примере 7.
Результат масс-спектрометрического анализа (m/z): 142 (M+ +1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d: 5,23(2Н, s), 7,64(1Н, d), 7,68(1Н, d), 9,14(1Н, s), 9,98(2Н, br).
Справочный пример 10. Используя 3,2 г 1-(2-цианоэтил)имидазола, полученного в справочном примере 3, получили 3,219 г 3-(1-имидазола)пропанэтиоамид гидрохлорида по той же методике, что описана в справочном примере 7.
Результат масс-спектрометрического анализа (m/z): 155 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d: 3,19(2Н, t), 4,58(2Н, t), 7,06(2Н, d), 7,55(1Н, s), 9,98(2Н, br).
Справочный пример 11. Использованием 1,15 г 1-(3-цианопропил)имидазола, полученного в справочном примере 4, приготовили 1,96 г 4-(1-имидазола)бутантиоамид гидрохлорида по той же методике, что описана в справочном примере 7.
Результат масс-спектрометрического анализа (m/z): 169(M+)
Справочный пример 12. Использованием 1,0208 г 2-цианометилимидазола, полученного в справочном примере 5), приготовили 1,005 г 2-имидазолилтиоацетамид гидрохлорида по той же методике, что описана в справочном примере 7.
Результат масс-спектрометрического анализа (m/z): 142 (M+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d: 4,31(2Н, s), 7,56(2Н, s), 9,95(2Н, br).
Справочный пример 13. Используя 850 мг 4-цианометил-1-(2-пропил)имидазола, полученного в cправочном примере 6, приготовили 905 г (1-(2-пропил)-4-имидазолил)тиоацетамид гидрохлорида по той же методике, что описана в справочном примере 7.
Результат масс-спектрометрического анализа (m/z): 184 (M+ + 1)
ЯМР- спектр (ДМСО-d6, ТМС внутренний стандарт) d: 1,47(6Н, d), 3,99(2Н, s), 4,63(1Н, m), 7,74(1Н, s), 9,18(1Н,s), 9,95(2Н, br).
Справочный пример 14. Используя 1,9 г 4(5)-(1-цианоэтил)-1-трифенилметилимидазола, приготовили 2,0 г 2-(4-имидазолил)пропантиоамид гидрохлорида по той же методике, что описана в справочном примере 7.
Результат масс-спектрометрического анализа (m/z): 156 (M+ + 1)
Пример 1. 0б34 г 2-бромо-1-инданона и 0б26 г 4-имидазолил теоацетамид гидрохлорида растворили в 7 мл 2-пропанола при нагревании, и раствор нагревали в течение 30 мин с обратным холодильником до температуры кипения.
После охлаждения реакционного раствора выпали кристаллы, которые собрали фильтрацией и промыли этил ацетатом. Собранный кристаллы распределили между хлороформом и насыщенным водным раствором бикарбоната натрия, и водный слой экстрагировали несколько раз хлороформом. Объединенные хлороформные слои промыли насыщенным водным раствором хлористого натрия и затем высушили над безводным сульфатом магния. Путем упаривания растворителя получили 0б12 г (32%) 2-(4-имидазолилметил)-8Н-индено[1,2-d]тиазола. Это свободное основание растворили в метаноле и смешали с 0б055 г фумаровой кислоты, чтобы вызвать кристаллизацию. Образовавшиеся неочищенные кристаллы перекристаллизовали из смеси метанол-диэтиловый эфир, получив 0б10 г фумарата.
Температура плавления: 202-203oC метанол-диэтиловый эфир.
Данные элементарного анализа (для C14H11N3S• C4H4O4)
Рассчитано, C 58,53; H 4,09; N 11,38; S 8,68.
Найдено, C 58,37; H 4,21; N 11,25; S 8,69.
Результат масс-спектрометрического анализа (m/z): 253 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d: 3,87(2Н, s), 4,34(2Н, s), 6,63(2Н, s), 7,07(1Н, s), 7,24(1Н, t), 7,36(1Н, t), 7,54(1Н, d), 7,63(1Н, d), 7,69(1Н, s).
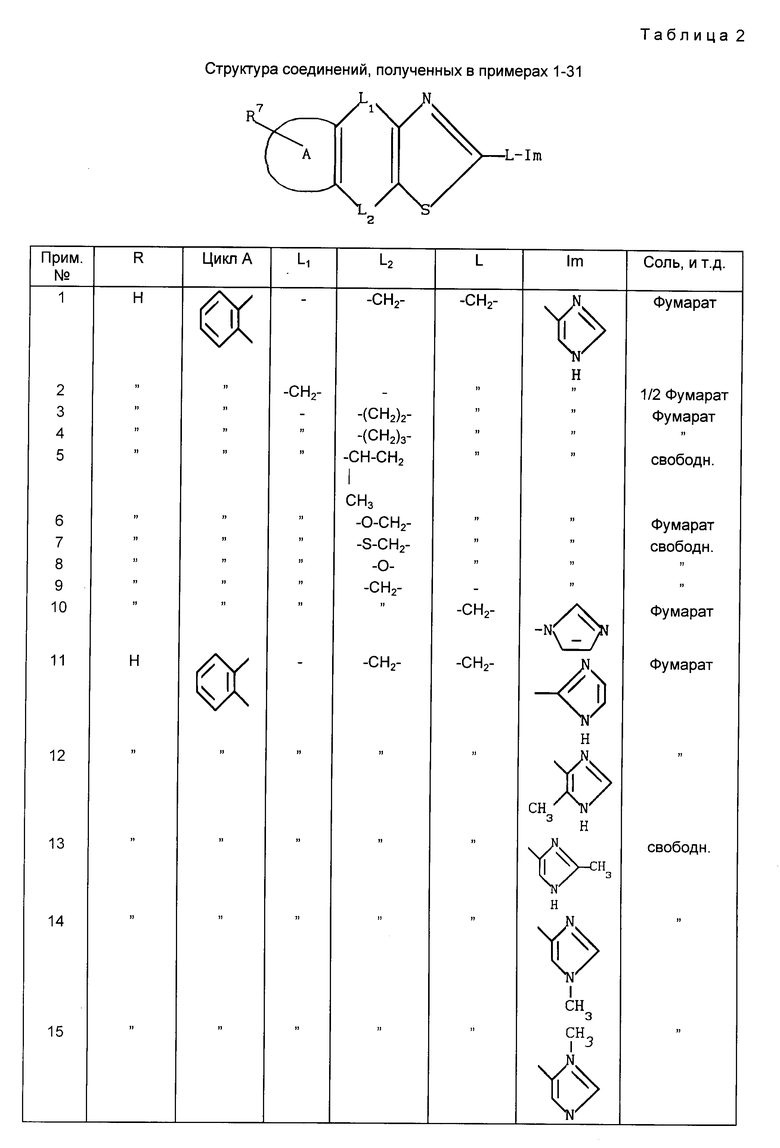
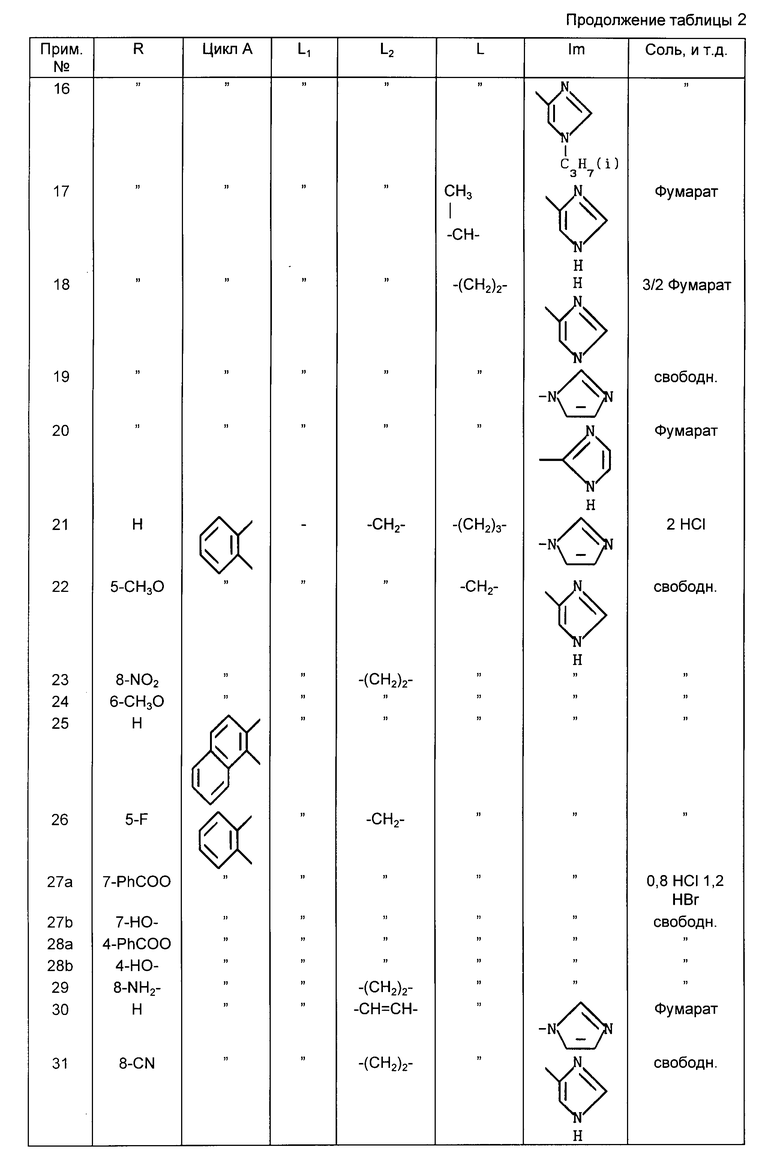
Примеры с 2 по 27а. Следующие далее соединения получены по той же методике, что описана в примере 1.
Пример 2. 2-(4-Имидазолилметил)-4Н-индено[2,1-d]тиазол гемифумарат
Исходные соединения: 1-бромо-2-инданон, 4-имидазолил тиоацетамид гидрохлорид
Температура плавления: 170-172oC этанол-диэтиловый эфир
Данные элементарного анализа (для C14H11N3S•0,5 C4H4O4•0.1H2O)
Рассчитано, C 61,37; H 4,25; N 13,42; S 10,24.
Найдено, C 61,13; H 4,27; N 13,06; S 10,12.
Результат масс-спектрометрического анализа (m/z): 253 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,81(2Н,s), 4,32(2Н,s), 6,63(1Н,s), 7,1-7,8(6Н, m).
Пример 3. 2-(4-Имидазолилметил)-4,5-дигидронафто[1,2-d]тиазол фумарат.
Исходные соединения: 2-бромо-1-тетралон, 4-имидазолил тиоацетамид гидрохлорид
Температура плавления: 180-182oC метанол-диэтиловый эфир.
Данные элементарного анализа (для C15H13N3S•C4H4O4•0.1H2O)
Рассчитано, C 59,24; H 4,50; N 10,91; S8,32.
Найдено, C 58,99; H 4,50; N10,86; S8,36.
Результат масс-спектрометрического анализа (m/z): 267 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 2,95(4Н,s), 4,20(2Н,s), 6,71(2Н,s), 7,1-7,9(6Н,m).
Пример 4. 2-(4-Имидазолилметил)-5,6-дигидро-4Н-бензо[6,7] -циклогепто [1,2-d]тиазол фумарат.
Исходные соединения: 2-бромо-1-бензосуберон, 4-имидазолил тиоацетамид гидрохлорид
Температура плавления: 149-150oC метанол-этил ацетат
Данные элементарного анализа (для C16H15N3S•C4H4O4•0.25 H2O)
Рассчитано, C 59,76; H 4,89; N 10,45; S 7,98.
Найдено, C 59,71; H 4,84; N 10,39; S 7,70.
Результат масс-спектрометрического анализа (m/z): 201 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 2,01-2,08(2Н, m), 2,74-2,77 (2Н, m), 2,94 (2Н,t), 4,19(2Н,s), 6,63(2Н,s), 7,04(1Н,s), 7,19-7,30(3Н,m), 7,63(1Н, s), 7,99(1Н, d).
Пример 5. 2-(4-Имидазолилметил)-5-метил-4,5-дигидронафто[1,2-d]-тиазол
Исходные соединения: 2-бромо-4-метил-1-тетралон, 4-имидазолил тиоацетамид гидрохлорид
Температура плавления: 184-186oC (разл.) этил ацетат
Данные элементарного анализа (для C16H15N3S•0,1H2O)
Рассчитано, C 67,86; H 5,46; N 14,84; S 11,32.
Найдено, C 67,90; H 5,43; N 14,80; S 11,37.
Результат масс-спектрометрического анализа (m/z): 282 (M+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 1,20(3Н,d), 2,77(1Н, dd), 3,05-3,18(2Н, m), 4,23(2Н,s), 7,03(14,m), 7,21-7,29(3Н,s), 7,61(1Н,d), 7,78(1Н, dd), 11,99(1Н, brs)
Пример 6. 2-(4-Имидазолилметил)-4Н-[1]бензопирано[4,3-d]-тиазол фумарат
Исходные соединения: 3-бромо-4-хроманон, 4-имидазолил тиоацетамид гидрохлорид
Температура плавления: 180-184oC (разл.) метанол
Данные элементарного анализа (для C14H11N3OS•C4H4O4•0.1H2O)
Рассчитано, C 55,84; H 3,96; N 10,85; S 8,28.
Найдено, C 55,77; H 3,92; N 10,74; S 8,12.
Результат масс-спектрометрического анализа (m/z): 269 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 4,28(2Н, s), 5,45(2Н, s), 6,63(2Н,s), 6,93(1Н, d), 7,03(1Н, t) 7,07(1Н, s), 7,20(1Н, t), 7,63-7,68 (2Н, m)
Пример 7. 2-(4-Имидазолилметил)-4-[1]бензотиопирано[4,3-d]-тиазол
Исходные соединения: 3-бромотиохроман-4-он, 4-имидазолил тиоацетамид гидрохлорид
Температура плавления: 199-202oC (разл.) метанол
Данные элементарного анализа (для C14H11N3S2•0.2 H2O)
Рассчитано, C 58,19; H 3,98; N 14,54; S 22,19.
Найдено, C 58,29; H 3,97; N 14,47; S 21,93.
Результат масс-спектрометрического анализа (m/z): 285 (M+)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d 4,10(2Н,s), 4,35(2Н,s), 6,97(2Н,s),7,17(1Н,dt), 7,23(1Н,dt), 7,32(1Н,dd), 7,64(1Н,s), 8,00 (1Н, dd).
Пример 8. 2-(4-Имидазолилметил)бензофуро[3,2-d]тиазол
Исходные соединения: 2-бромо-3-кумаранон, 4-имидазолил тиоацетамид гидрохлорид
Температура плавления: 184-186oC (разл.) метанол
Данные элементарного анализа (для C13H9N3OS•0,1 H2O)
Рассчитано, C 60,73; H 3,61; N 16,34; S 12,47.
Найдено, C 60,82; H 3,59; N 16,24; S 12,47.
Результат масс-спектрометрического анализа (m/z): 225 (M+)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d 4,45(2Н,s), 7,02(1Н,s), 7,30-7,37(2Н,m), 7,55(1Н,dd), 7,66(1Н,s), 7,89(1Н,dd).
Пример 9. 2-(4-Имидазолил)-8Н-индено[1,2-d]тиазол
Исходные соединения: 2-бромо-1-инданон, 4-имидазол карботиоамид
Температура плавления: 228-230oC (разл.) хлороформ диэтиловый эфир.
Данные элементарного анализа (для C13H9N3S•0,05 H2O)
Рассчитано, C 65,01; H 3,82; N 17,49; S 13,35.
Найдено, C 65,16; H 3,84; N 17,20; S 13,32.
Результат масс-спектрометрического анализа (m/z): 239 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,95(3Н,s), 7,26(1Н,t), 7,38(1Н,t), 7,57(1Н,d), 7,65(1Н,d), 7,79(1Н,s), 7,61(1Н,s).
Пример 10. 2-(1-Имидазолилметил)-8Н-индено[1,2-d]тиазол фумарат
Исходные соединения: 2-бромо-1-инданон, 1-имидазолил тиоацетамид гидрохлорид
Температура плавления: 155-159oC метанол-диэтиловый эфир
Данные элементарного анализа (для C14H11N3S•C4H4O4•0,1 H2O)
Рассчитано, C 58,24; H 4,13; N 11,32; S 8,64.
Найдено, C 58,21; H 4,09; N 11,05; S 8,74.
Результат масс-спектрометрического анализа (m/z): 253 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,93(2Н,s), 5,69(2Н,s), 6,63(2Н, s), 6,98(1Н, s), 7,28(1Н, t), 7,33(1Н,s), 7,38(1Н,t), 7,57(1Н,d), 7,66(1Н,d), 7,89(1Н,s).
Пример 11. 2-(2-Имидазолилметил)-8Н-индено[1,2-d]тиазол фумарат
Исходные соединения: 2-бромо-1-инданон, 2-имидазолил тиоацетамид гидрохлорид
Температура плавления: 201-204oC метанол
Данные элементарного анализа (для C14H11N3S•C4H4O4•0,3H2O)
Рассчитано, C 57,60; H 4,20; N 11,21; S 8,56.
Найдено, C 57,56; H 4,10; N 11,27; S 8,42.
Результат масс-спектрометрического анализа (m/z): 254 (M+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,89(2Н,s), 4,47(2Н,s), 6,63(2Н,s), 7,25(1Н,t), 7,36(1Н,t), 7,56(1Н,d), 7,63(1Н,d).
Пример 12. 2-[(4-Метил-5-имидазолил)метил]-8Н-индено[1,2-d]-тиазол фумарат
Исходные соединения: 2-бромо-1-инданон, (5-метил-4-имидазолил)тиоацетамид гидрохлорид
Температура плавления: 169-172oC метанол-диэтиловый эфир
Данные элементарного анализа (для C15H13N3S•C4H4O4•0,45H2O)
Рассчитано, C 57,80; H 4,58; N 10,42; S 7,95.
Найдено, C 58,07; H 4,66, N 10,47; S 7,66.
Результат масс-спектроскопии (m/z): 267 (M+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 2,71(2Н,s), 3,85(3Н,s), 4,26(2Н, s), 6,62(2Н, s), 7,23(1Н, t), 7,34(1Н,t), 7,53(1Н,t), 7,54(1Н,d), 7,62(1Н,d).
Пример 13. 2-[(2-Метил-4-имидазолил)метил]-8Н-индено[1,2-d]-тиазол.
Исходные соединения: 2-бромо-1-инданон, (2-метил-4-имидазолил)тиоацетамид гидрохлорид
Температура плавления: 187-190oC метанол-диэтиловый эфир
Данные элементарного анализа (для C15H13N3S•0,45H2O)
Рассчитано, C 65,40; H 5,09; N 15,25; S 11,64.
Найдено, C 65,35; H 4,83; N 15,53; S 11,59.
Результат масс-спектрометрического анализа (m/z): 267 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 2,31(3Н,s), 3,87(2Н,s), 4,23(2Н,s), 7,24(1Н,t), 7,36(1Н,t), 7,55(1Н,d), 7,62(1Н,d).
Пример 14. 2-[(1-Метил-4-имидазолил)метил]-8Н-индено[1,2-d]тиазол
Исходные соединения: 2-бромо-1-инданон, (1-метил-4-имидазолил)тиоацетамид гидрохлорид
Температура плавления: 123-125oC хлороформ-диэтиловый эфир
Данные элементарного анализа (для C15H13N3S)
Рассчитано, C 67,39; H 4,90; N 15,72; S 11,99.
Найдено, C 67,17; H 4,94; N 15,49; S 12,09.
Результат масс-спектрометрического анализа (m/z): 268 (M+ + 1)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d 3,65(3Н,s), 3,79(2Н,s), 4,40(2Н, s), 6,82(1Н, s), 7,22(1Н, t), 7,36(1Н,t), 7,40(1Н,s), 7,48(1Н,d), 7,70(1Н,d).
Пример 15. 2-[(1-Метил-5-имидазолил)метил]-8Н-индено[1,2-d]-тиазол
Исходные соединения: 2-бромо-1-инданон, (1-метил-5-имидазолил)тиоацетамид гидрохлорид
Температура плавления: 148-151oC хлороформ-диэтиловый эфир
Данные элементарного анализа (для C15H13N3S)
Рассчитано, C 67,39; H 4,90; N 15,72; S 11,99.
Найдено, C 67,33; H 4,96; N 15,89; S 11,88.
Результат масс-спектрометрического анализа (m/z): 268 (M+) + 1).
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d 3,58(3Н,s), 3,80(2Н,s), 4,44(2Н, s), 7,70(1Н, s), 7,26(1Н, t), 7,34(1Н,t), 7,46(1Н,s), 7,50(1Н,d), 7,76(1Н,d).
Пример 16. 2-[[1-(2-Пропил)-4-имидазолил]метил]-8Н-индено[1,2-d]-тиазол
Исходные соединения: 2-бромо-1-инданон, [1-(2-пропил)-4-имидазолил] тиоацетамид гидрохлорид
Температура плавления: 90:93oC метанол диэтиловый эфир.
Данные элементарного анализа (для C17H17N3S)
Рассчитано, C 69,12; H 5,80; N 14,22; S 10,85.
Найдено, C 69,01; H 5,84; N 14,16; S 10,98
Результат масс-спектрометрического анализа (m/z): 295 V+)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d 1,46(6Н,d), 3,78(2Н,s), 4,29(1Н, m), 4,41(2Н, s), 6,89(1Н, s), 7,22(1Н,t), 7,36(1Н,t), 7,47(1Н,d), 7,77(1Н,d).
Пример 17. 2-[1-(4-Имидазолил)этил]-8Н-индено[1,2-d]-тиазол фумарат
Исходные соединения: 2-бромо-1-инданон, 2-(4-имидазолил)пропантиоамид гидрохлорид
Температура плавления: 177-180oC метанол.
Данные элементарного анализа (для C15H13N3S•C4H4O4•0.1 H2O)
Рассчитано, C 59,24; H 4,50; N 10,91; S 8,32.
Найдено, C 59,19; H 4,49; N 10,75; S 8,18.
Результат масс-спектрометрического анализа (m/z): 267 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 1,71(3Н,d), 3,84(2Н,s), 4,56(1Н, m), 6,63(2Н, s), 7,06(1Н, s), 7,24(1Н,t), 7,36(1Н,t), 7,54(1Н,d), 7,66(1Н,d), 7,69(1Н,s).
Пример 18. 2-[2-(4-Имидазолил)этил]-8Н-индено[1,2-d]тиазол сесквифумарат
Исходные соединения: 2-бромо-1-инданон, 3-(4-имидазолил)пропантиоамид гидрохлорид
Температура плавления: 143-147oC метанол
Результат масс-спектрометрического анализа (m/z):267(M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,03(2Н,t), 3,39(2Н,t), 3,89(2Н, s), 6,62(3Н, s), 6,88(1Н, s), 7,25(1Н,t), 7,36(1Н,t), 7,55(1Н,d), 7,63(1Н,d), 7,70(1Н,s).
Пример 19. 2-[2-(1-Имидазолил)этил]-8Н-индено[1,2-d]тиазол
Исходные соединения: 2-бромо-1-инданон, 3-(1-имидазолил)пропантиоамид гидрохлорид
Температура плавления: 118-121oC метанол-диэтиловый эфир
Данные элементарного анализа (для C15H13N3S•0,4H2O)
Рассчитано, C 65,62; H 5,07; N 15,30; S 11,68.
Найдено, C 65,74; H 4,90; N 15,13; S 11,60.
Результат масс-спектрометрического анализа (m/z): 267 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,57(2Н,t), 3,89(2Н,s), 4,49(2Н, t), 7,26(1Н, d), 7,27(1Н, t), 7,37(1Н,t), 7,56(1Н,d), 7,64(1Н,d), 7,71(1Н,s).
Пример 20. 2-[2-(2-Имидазолил)этил]-8Н-индено[1,2-d]тиазол фумарат
Исходные соединения: 2-бромо-1-инданон, 3-(2-имидазолил)пропатиоамид гидрохлорид
Температура плавления: 177-180oC метанол
Результат масс-спектрометрического анализа (m/z): (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,15(2Н,t), 3,48(2Н,t), 3,89(2Н, s), 6,62(2Н, s), 6,94(2Н, s), 7,25(1Н,t), 7,36(1Н,t), 7,54(1Н,d), 7,63(1Н,d).
Пример 21. 2-[3-(1-Имидазолил)пропил]-8Н-индено[1,2-d]тиазол дигидрохлорид
Исходные соединения: 2-бромо-1-инданон, 4-(1-имидазолил)бутантиоамид гидрохлорид
Температура плавления: 175-177oC метанол
Данные элементарного анализа (для C16H15N3S•2 HCl•0,3 H2O)
Рассчитано, C 53,43; H 4,93; N 11,68; S 8,91; Cl 19,71.
Найдено, C 53,08; H 4,75; N 11,65; S 9,07; Cl 20,02.
Результат масс-спектрометрического анализа (m/z): 281 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 2,36-2,41(2Н,m), 3,12(2Н, t), 3,92(2Н, s), 4,36(2Н, t), 7,27(1Н,t), 7,37(1Н,t), 7,57(1Н,d), 7,64(1Н,d), 7,71(1Н,s), 7,87(1Н,s), 9,25(1Н,s).
Пример 22. 2-(4-Имидазолилметил)-5-метокси-8Н-индено[1,2-d]-тиазол
Исходные соединения: 2-бромо-6-метокси-1-инданон, 4-имидазолилтиоацетамид гидрохлорид
Температура плавления: 190-191oC этил ацетат.
Данные элементарного анализа (для C15H13N3OS•0.1H2O)
Рассчитано, C 63,18; H 4,67; N 14,74; S 11,25.
Найдено, C 63,06; H 4,64; N 14,64; S 11,29.
Результат масс-спектрометрического анализа (m/z): 270 (M+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,78(2Н,s), 3,81(3Н,s), 4,31(2Н, s), 6,80(1Н, dd), 7,04(1Н,s), 7,18(1Н,s), 7,42(1Н,d), 7,64(1Н,s), 12,10(1Н, br).
Пример 23. 2-(4-Имидазолилметил)-8-нитро-4,5-дигидронафто-[1,2-d]-тиазол
Исходные соединения: 2-бромо-7-нитро-1-тетралон, 4-имидазолилтиоацетамид гидрохлорид
Температура плавления: 230-233oC (разл.) этилацетат
Данные элементарного анализа (для C15H12N4O2S•0.2H2O)
Рассчитано, C 57,02; H 3,96; N 17,73; S 10,15.
Найдено, C 57,15; H 3,90; N 17,45; S 10,06.
Результат масс-спектрометрического анализа (m/z): 313 (M+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,04(2Н,t), 3,14(2Н,t), 4,27(2Н, s), 7,06(1Н, s), 7,56(1Н, d), 7,63(1Н,s), 8,07(1Н,dd), 8,46(1Н,d) 12,03(1Н,br).
Пример 24. 2-(4-Имидазолилметил)-6-метокси-4,5-дигидронафто[1,2-d]-тиазол
Исходные соединения: 2-бромо-5-метокси-1-тетралон, 4-имидазолилтиоацетамид гидрохлорид
Температура плавления: 187-190oC (разл.) этил ацетат
Результат масс-спектрометрического анализа (m/z): 298 (M+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 2,92(4Н,s), 3,81(3Н,s), 4,22(2Н, s), 6,92(1Н, d), 7,03(1Н, s), 7,25(1Н,t), 7,42(1Н,d), 7,61(1Н,s), 12,00(1Н,br).
Пример 25. 2-(4-Имидазолилметил)-10,11-дигидрофенантро[1,2-d]-тиазол
Исходные соединения: 2-бромо-1,2,3,4-тетрагидрофенантрен-1-он, 4-имидазолилацетамид гидрохлорид
Температура плавления: 225-230oC (разл.) метанол
Данные элементарного анализа (для C19H15N3S•0.4H2O)
Рассчитано, C 70,30; H 4,91; N 12,94; S 9,88.
Найдено, C 70,30; H 4,97; N 12,78; S 9,67.
Результат масс-спектрометрического анализа (m/z): 317 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,11(2Н,t), 3,43(2Н,t), 4,26(2Н, s), 7,05(1Н, s), 7,48(1Н, t), 7,56(1Н,dt), 7,62(1Н,s), 7,86(1Н,d), 7,91(1Н,d), 8,05(1Н,d), 8,15(1Н,d), 12,01(1Н, br).
Пример 26. 5-Фторо-2-(4-имидазолилметил)-8Н-индено[1,2-d] тиазол
Исходные соединения: 2-бромо-6-фторо-1-инданон, 4-имидазолилтиоацетамид гидрохлорид
Температура плавления: 175-178oC этил ацетат
Результат масс-спектроскопии (m/z): 271 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,86(2Н,s), 4,32(2Н,s), 7,05(1Н,dd), 7,06(2Н,s), 7,40(1Н,dd), 7,55(1Н,dd), 7,65(1Н,s)
Пример 27а. 7-Бензоилокси-2-(4-имидазолилметил)-8Н-индено[1,2-d]-тиазол 0,8 гидрохлорид 1,2 гидробромид
Исходные соединения: 4-бензоилокси-2-бромо-1-инданон, 4-имидазолилтиоацетамид гидрохлорид
Температура плавления: 220-225oC (разл.) 2-пропанол
Данные элементарного анализа (для C21H15N3O2S•0.8HCl•1,2HBr)
Рассчитано, C 50,48; H 3,43; N 8,41; S 6,42; Cl 5,68; Br 19,19.
Найдено, C 50,12; H 3,43; N 8,31; S 6,55; Cl 5,24; Br 18,95.
Результат масс-спектрометрического анализа (m/z): 374 (M+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,91(2Н,s), 4,62(2Н,s), 7,25(1Н, d), 7,51(1Н,t), 7,61-7,67(4Н,m), 7,80(1Н,t), 8,21(1Н,d), 9,11(1Н, s).
Пример 27b. 1 мл 5 н водного раствора гидроокиси натрия добавили к раствору 0,358 г 7-бензоилокси-2-(4-имидазолилметил)-8Н-индено[1,2-d] тиазол гидрохлорид гидробромида, полученного в примере 27а, в метаноле (10 мл), и смесь перемешивали при комнатной температуре в течение 30 мин. После упаривания растворяли, остаток подкислили 1 н. соляной кислотой, нейтрализовали бикарбонатом натрия и затем экстрагировали смесью хлороформ-метанол. Органический слой высушили над безводным сульфатом магния, растворитель упарили, и образовавшиеся неочищенные кристаллы (0,20 г) перекристаллизовали из этанола, получив 77 мг 7-гидрокси-2-(4-имидазолилметил)-8Н-индено[1,2-d] тиазола.
Температура плавления: 250-255oC (разл.) этанол
Данные элементарного анализа (для C14H11N3OS)
Рассчитано, C 62,43; H 4,12; N 15,60; S 11,91.
Найдено, C 62,33; H 4,10; N 15,47; S 11,94.
Результат масс-спектроскопии (m/z): 270 (V+ + 1)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,71(2Н,s), 4,30(2Н,s), 6,72(1Н, d), 7,03(1Н, s), 7,12(1Н, d), 7,19(1Н,t), 7,61(1Н,s), 9,62(1Н,s), 11,99(1Н, br).
Пример 28. 0,1 мл брома добавили по каплям к раствору 0,47 7-бензоилокси-1-инданона в тетрагидрофуране (10 мл) при комнатной температуре, и смесь перемешивали в течение 30 мин. К 7-бензоилокси-2-бромо-1-инданона, полученному упариванием растворителя, добавили 15 мл 2-пропанола и 0.33 г 4-имидазолилтиоацетамид гидрохлорида, с последующим нагреванием в течение 2,5 ч с обратным холодильником до температуры кипения. После охлаждения и упаривания растворителя, остаток смешали с этил ацетатом и экстрагировали 1 н. соляной кислотой. Водный слой нейтрализовали бикарбонатом натрия и затем экстрагировали хлороформом. Органический слой высушили над безводным сульфатом магния и растворитель упарили. Оставшийся 4-бензоилокси-2-(4-имидазолилметил)-8Н-индено[1,2-d] тиазол растворили в 10 мл метанола, к раствору добавили 1 мл 5 н. водного раствора гидроокиси натрия и затем перемешивали при комнатной температуре 15 мин. После подкисливания с помощью 1н. соляной кислоты, реакционный раствор нейтрализовали бикарбонатом натрия и экстрагировали смесью хлороформ-метанол, и затем экстракт высушили над безводным сульфатом магния. После упаривания растворителя образовавшиеся неочищенные кристаллы перекристаллизовали из этанола, получив 55 мг 4-гидрокси-2-(4-имидазолилметил)-8Н-индено[1,2-d] тиазола.
Температура плавления: 267-269oC (разл.) этанол
Данные элементарного анализа (для C14H11N3OS•0,3H2O)
Рассчитано, C 61,21; H 4,26; N 15,30; S 11,67.
Найдено, C 61,23; H 4,15; N 15,01; S 11,96.
Результат масс-спектрометрического анализа (m/z): 269 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d 3,80(2Н,s), 4,30(2Н,s), 6,81(1Н,d), 6,98-7.06(3Н,m),7,60(1Н,s),9,51(1Н,s), 11,98(1Н,br).
Пример 29. 5,0 г никеля Ренея (влажного) добавили к раствору 0,52 г 2-(4-имидазолилметил)-8-нитро-4,5-дигидронафто[1,2-d] тиазола, полученного в примере 23, в 1,4-диоксан (40 мл) метанол (20 мл), и смесь перемешивали в течение 2 ч в атмосфере водорода (1 атм).
После фильтрации нерастворившегося вещества растворитель упарили из фильтрата, и остаток смешали с этил ацетатом, чтобы вызвать кристаллизацию. Образовавшиеся неочищенные кристаллы промыли горячим этил ацетатом, получив 0,27 г (57%) 3-амино-2-(4-имидазолилметил)-4,5-дигидронафто[1,2-d]тиазола.
Температура плавления: 180-182oC этил ацетат
Данные элементарного анализа (для C15H14N4S•0,4 H2O)
Рассчитано, C 62,22; H 5,15; N 19,35; S 11,07.
Найдено, C 62,17; H 4,90; N 19,15; S 11,03.
Результат масс-спектрометрического анализа (m/z): 282 (M+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) d: 2,78(2Н,t), 2,85(2Н, t), 4,18(2Н,s), 4,98(2Н,s), 6,49)1Н,dd), 6,88(1Н,d), 7,04(1Н, brs), 7,09(1Н, d), 7,60(1Н,s), 11,96(1Н,br).
Справочный пример 15. К 3,98 г 2-метилнафто[1,2-d] тиазола, растворенного в четыреххлористом углероде (40 мл), добавили 3,56 г N-бромсукцинимида и 0,20 г перекиси бензоила с последующим нагреванием до кипения с обратным холодильником в течение 6 ч. После охлаждения реакционного раствора нерастворимый материал удалили фильтрацией, и растворитель упарили. Остаток подвергли колоночной хроматографии на силикагеле, элюируя смесью гексан-хлороформ (5:1), получив 3,50 г (63%), 2-бромометилнафто [1,2-d]тиазола.
Результат масс-спектрометрического анализа (m/z): 277, 279 (M+)
ЯМР-спектр (CDCl3, ТМС внутренний стандарт) d 4,94(2Н,s), 7,5-7,7 (2Н, m), 7,8-8,0(3Н,m), 8,77(1Н,dd).
Пример 30. 0,06 г гидрида натрия (60%) добавили к раствору 0,1 г имидазола в тетрагидрофуране (30 мл). После 30 мин перемешивания при комнатной температуре, к раствору добавили раствор 2-бромометилнафто[1,2-d] тиазола в тетрагидрофуране (10 мл). После перемешивания при комнатной температуре в течение часа и упаривания растворителя остаток распределили между 1 н соляной кислотой и этил ацетатом. Органический слой экстрагировали 1 н соляной кислотой. Объединенный водный слой нейтрализовали бикарбонатом натрия и затем экстрагировали хлороформом. После высушивания над безводным сульфатом магния растворитель упарили, получив 0,27 г (100% ) 2-(1-имидазолилметил)нафто[1,2-d] тиазола. Это свободное основание растворили в метаноле и смешали с 0,10 г фумаровой кислоты, чтобы вызвать кристаллизацию, что дало 0,32 г фумарата.
Температура плавления: 163-165oC метанол
Данные элементарного анализа (для C15H11N3S•C4H4O4)
Рассчитано, Cl 59,83; H 3,96; N 11,02; S 8,41.
Найдено, Cl 59,83; H 3,91; N 10,93; S 8,38.
Результат масс-спектрометрического анализа (m/z): 265 (V+)
ЯМР-спектр (ДМСО-d6, ТМС внутренний стандарт) бета: 5,88(2Н,s), 6,64(2Н, s), 7,04(1Н,s), 7,43(1Н,s), 7,65(1Н,t), 7,63(1Н,t), 7,95(1Н,d), 7,97(1Н,s), 8,09(1Н,d), 8,13(1Н,d), 8,65(1Н,d).
Следующее далее соединение получили тем же способом, что описан в примере 1.
Пример 31. 8-Циано-2-(4-имидазолилметил)-4,5-дигидронафто[1,2-d]тиазол
Исходные соединения: 2-бромо-7-циано-1-тетралон, 4-имидазолилтиоацетамид гидрохлорид
Температура плавления: 201-205oC метанол-этил ацетат
Данные элементарного анализа (для C16H12N4S•0.2 H2O)
Рассчитано, C 64,93; H 4,22; N 18,93; S 10,83.
Найдено, C 65,00; H 4,26; N 18,64; S 10,81.
Результат масс-спектроскопии (m/z): 292 (M+)
ИК спектр (KBr) см-1: 2228 (C ≡ N)
ЯМР-спектр )ДМСО-d6, ТМС внутренний стандарт) δ: 3,00(2Н,t), 3,08(2Н, t), 4,23(2Н,s), 7,07(1Н,s), 7,49(1Н,d), 7,61(1Н,s), 7,66(1Н,dd), 8,01(1Н,s), 11,96(1Н,br).
Структуры соединений примеров 1-31 показаны в табл.1.
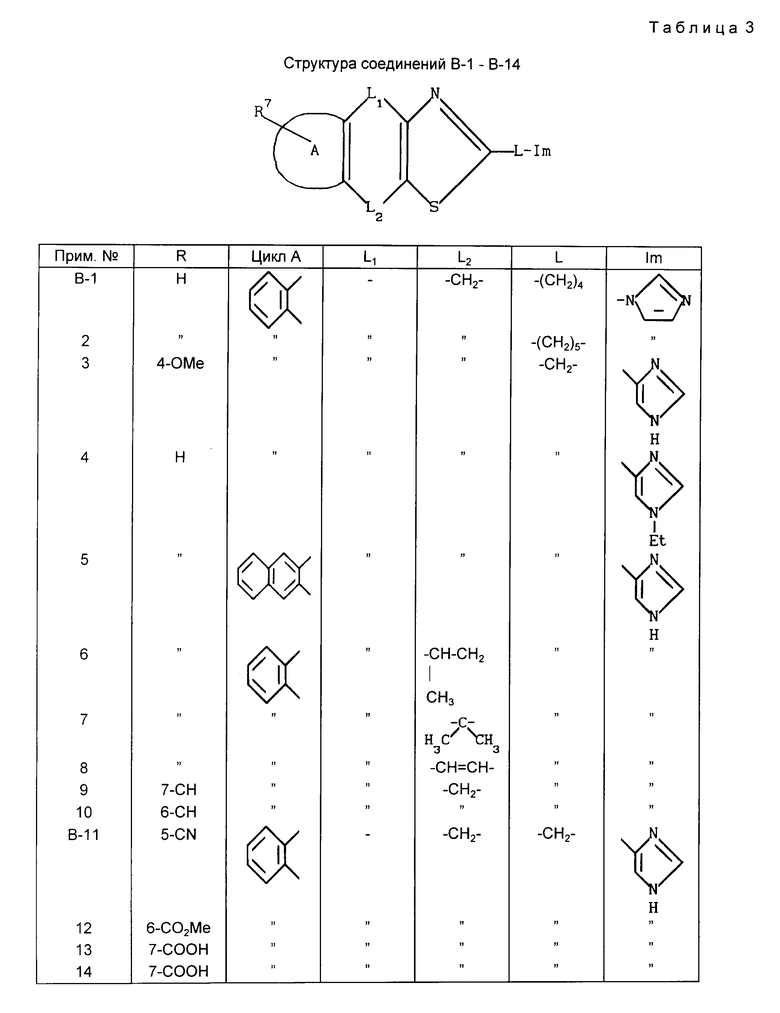
В дополнение к соединениям, описанным выше, другие соединения В-1 В-14 показаны в приведенной далее табл.3. Эти соединения не нуждаются в специальных экспериментах, поскольку могут быть синтезированы в соответствии с синтетическими путями и способами, описанными в вышеупомянутых схемах получения и примерах, равно как в соответствии с их модификациями, известными любому обычному специалисту в соответствующей технике.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1995 |
|
RU2161612C2 |
| ПРОИЗВОДНЫЕ АМИДИНОНАФТИЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2154633C2 |
| ПРОИЗВОДНОЕ БЕНЗАЗЕПИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОИЗВОДНОЕ ДИФТОРБЕНЗАЗЕПИНА И ПРОИЗВОДНОЕ (ЗАМЕЩЕННОГО) АМИНОБЕНЗОИЛДИФТОРБЕНЗАЗЕПИНА | 1994 |
|
RU2137760C1 |
| 1,2,3,4-ТЕТРАГИДРОХИНОКСАЛИНДИОНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2149873C1 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ БЕНЗАЗЕПИНА, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2129123C1 |
| ПРОИЗВОДНОЕ СКОНДЕНСИРОВАННОГО ПИРАЗИНА | 1991 |
|
RU2095352C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ТЕТРАГИДРОБЕНЗИМИДАЗОЛА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ СОЛИ | 1990 |
|
RU2024516C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРЕДУПРЕЖДЕНИЯ И УСТРАНЕНИЯ ТРОМБОЗОВ | 1992 |
|
RU2103276C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АЛКАНСУЛЬФОНАНИЛИДА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1988 |
|
RU2012557C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТИАЗОЛА ИЛИ ИХ СОЛЕЙ С ГАЛОИДВОДОРОДНОЙ КИСЛОТОЙ | 1990 |
|
RU2010026C1 |
Предложено конденсированное производное тиазола, полезное в качестве 5-НТ3 рецепторного агониста, представленное следующей общей формулой (I)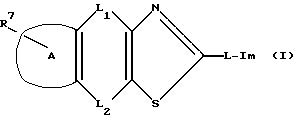
или его фармацевтически приемлемая соль, и его фармацевтическая композиция, где R: атом водорода, атом галогена, гидроксильная группа, низшая алкокси группа, карбокси группа, низшая алкоксикарбонил группа, нитро группа, амино группа, циано группа или защищенная гидроксильная группа, А: фенильное кольцо или нафталиновое кольцо, L1 и L2: одна является непосредственной связью, а другая линейной или разветвленной низшей алкиленовой группой, которая может включать прерывающий атом кислорода или серы, атом кислорода или атом серы или низшей алкениленовой группой, L: непосредственная связь или линейная или разветвленная низшая алкиленовая группа. Im: группа, представленная формулой: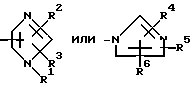
где R1, R2 и R3: одинаковые или отличные один от другого, каждый представляющий атом водорода или низшую алкильную группу; R4, R5 и R6: одинаковые или отличные один от другого, каждый представляющий атом водорода или низшую алкильную группу. 4 с. и 1 з.п.ф-лы, 3 табл.
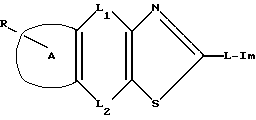
где R является атомом водорода, атомом галогена, гидроксильной группой, низшей алкоксигруппой, карбоксигруппой, низшей алкоксикарбонильной группой, нитрогруппой, аминогруппой, цианогруппой или защищенной гидроксильной группой;
A является фенильным или нафталиновым кольцом;
L1 и L2 представляют собой следующее: одна из групп является прямой связью, а другая линейной или разветвленной низшей алкиленовой группой, которая может включать прерывающий атом кислорода или серы, атомом кислорода, атомом серы или низшей алкениленовой группой;
L является прямой связью или линейной или разветвленной низшей алкиленовой группой;
Im является группой общей формулы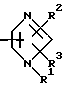
или общей формулы II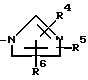
где R1 R3 являются одинаковыми или отличными и каждый представляет атом водорода или низшую алкильную группу;
R4 R6 являются одинаковыми или отличными и каждый представляет атом водорода или низшую алкильную группу,
или его фармацевтически приемлемая соль.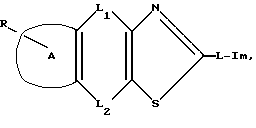
где R является атомом водорода, атомом галогена, гидроксильной группой, низшей алкоксигруппой, карбоксигруппой, низшей алкоксикарбонильной группой, нитрогруппой, аминогруппой, цианогруппой или защищенной гидроксильной группой;
A является фенильным или нафталиновым кольцом;
L1 и L2 представляют собой следующее: одна из групп является прямой связью и другая линейной или разветвленной низшей алкиленовой группой, которая может содержать прерывающий атом кислорода или серы, атомом кислорода, атомом серы или нишей алкениленовой группой;
L является прямой связью или линейной или разветвленной низшей алкиленовой группой;
Im является группой общей формулы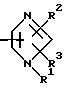
или общей формулы II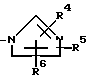
где R1 R3 являются одинаковыми или отличными и каждый представляет атом водорода или низшую алкильную группу;
R4 R6 являются одинаковыми или отличными и каждый представляет атом водорода или низшую алкильную группу.
| US, патент, 4963689, кл.C 07D 277/28, 1990 | |||
| WO, заявка, 92/07849, кл.C 07D 417/06, 1992. |
Авторы
Даты
1997-12-10—Публикация
1995-03-13—Подача