Изобретение относится к тетрагидробензимидазольным производным формулы (1) или к их фармацевтически приемлимым солям, пригодным в качестве 3-НТ3-цепеторных антагонистов: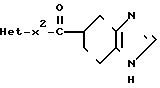 (1) где Неt является гетероциклической группой, возможно замещенной 1-3 заместителями, выбранными из низшего алкила, низшего алкенила, низшего алкинила, группы циклоалкил-низший алкил, арилалкил, низший алкоксикарбонил, атома галогена;
(1) где Неt является гетероциклической группой, возможно замещенной 1-3 заместителями, выбранными из низшего алкила, низшего алкенила, низшего алкинила, группы циклоалкил-низший алкил, арилалкил, низший алкоксикарбонил, атома галогена;
Х представляет собой одинарную связь, присоединенную к атому углерода гетероциклической группы.
Известные антагонисты 5-НТ3-рецепторов включают описанные азабициклосоединения тетрагидрокарбазольные соединения и азабициклосоединения.
Изобретение основано на интенсивных исследованиях соединений, проявляющих антагонизм по отношению к 5-НТ3-рецепторам. В результате было установлено, что соединения формулы 1, являющиеся новыми, проявляют высокую 5-НТ3-рецепторную антагонистическую активность, что и составляет суть данного изобретения. Соединения по данному изобретению совершенно отличны по структуре от любых вышеуказанных антагонистов - 5-НТ3-рецепторов.
В формуле 1 гетероциклическая группа Неt включает остатки моноциклических или конденсированных гетероциклических колец. Конкретными примерами гетероциклов являются пирролидин, пиперидин, пиперазин, морфолин, пиррол, фуран, тиофен, имидазол, оксазол, тиазол, пиразол, изоксазол, изотиазол, триазол, тиадиазол, оксадиазол, пиридин, пиридазин, пиримидин, пиразин, 4Н-циклопентатиазол, индол, изоиндол, 2,3-дигидроиндол (индолин), изоиндолин, гидроксииндол, индазол, индолизин, бензотиофен, бензофуран, бензотиазол, бензимидазол, бензоксазол, 4,5,6,7-тетрагидробензотиофен, 2,3-дигидробензимидазол-2-он, хинолин, изохинолил, 1,2,3,4-тетрагидрохинолин, 1,2,3,4-тетрагидрохинолин, 1,4-бензоксазин, фено- тиазин, карбазол, β -карболин и т.д.
Гетероцикл может иметь заместитель (заместители) в различных положениях, такие как низший алкил, низший алкенил, низший алкинил, группа циклоалкил-низший алкил, арилалкил, низший алкоксил, нитрогруппа, низший алкоксикарбонил, галоген и т.д.
За исключением специально указанных случаев термин "низший алкил" означает линейную или разветвленную алкильную группу, имеющую 1-6 атомов углерода. Конкретными примерами низшего алкила являются: метил, этил, пропил, бутил, пентил, гексил, изопропил, изобутил, трет-бутил- изопентил, трет-пентил, изогексил и т.д.
Примерами низшего алкенила являются винил, аллил, 1-пропенил, 2-бутенил, изопропенил и т.д. Примерами низшего алкинила являются этинил, 2-пропинил и пр. Примерами группы циклоалкилнизший алкил являются циклопропилметил, циклопентилметил, циклогексилметил, циклогексил- этил, циклогептилметил и пр. Примерами арилалкила являются бензил, фенетил и пр. Примерами низшего алкоксила являются метокси,- этокси, пропокси-, бутокси-, пентилокси-, гексилокси-, изопропокси, изобутокси-, трет-бутокси-, изопентилокси-, трет-пенти- локси-, изогексилокси-, 2-этилбутоксигруппы и т.д. Примеры низшего алкоксикарбонила включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил и др.
Атом галогена включает атомы хлора, брома, иода, и фтора. Предпочтительны те соединения формулы I, где Неt cоответствует следующей формуле
R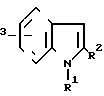 где R1 представляет собой водород, низший алкил, низший алкенил, низший алкинил, группу циклоалкил-низший алкил или арилалкил; R2 является водородом, низшим алкилом или арилалкилом; R3 представляет собой водород, низший алкоксил, нитрогруппу, гидроксил, низший алкоксикарбонил или галоген.
где R1 представляет собой водород, низший алкил, низший алкенил, низший алкинил, группу циклоалкил-низший алкил или арилалкил; R2 является водородом, низшим алкилом или арилалкилом; R3 представляет собой водород, низший алкоксил, нитрогруппу, гидроксил, низший алкоксикарбонил или галоген.
Изобретение включает в себя также соли некоторых соединений формулы I. Примерами таких солей являются соли с неорганическими основаниями, например натриевые и калиевые соли, соли с органическими основаниями, например с этиламином, пропиламином, диэтиламином, триэтиламином, морфолином, пиперидином, N-этилпиперидином, диэтиноламином и циклогексиламином, соли с основными аминокислотами, например с лизином и орнитином, аммониевые соли, соли с неорганическими кислотами, например с хлористоводородной, серной, фосфорной и бромистоводородной кислотами, соли с органическими кислотами, например уксусной кислотой, щавелевой, янтарной, лимонной, малеиновой, яблочной, фумаровой кислотами, с дибензоилвинной кислотой, винной кислотой, метансульфокислотой, соли с кислыми аминокислотами, например с глутаминовой и аспарагиновой кислотами.
Поскольку соединения по данному изобретению соответствуют формуле I, то данное изобретение включает также таутомеры этих соединений, например соединения следующей формулы: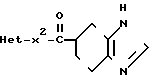
Кроме того, соединения по данному изобретению имеют в своей молекуле асимметричный атом углерода, и все изомеры, обусловленные этими асимметричными атомами углерода, такие как оптически активные соединения, рацематы, диастереомеры и пр. входят в соединения по данному изобретению.
Способ получения соединений по данному изобретению описывается ниже.
Способ 1.
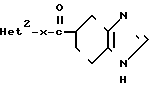
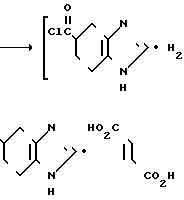
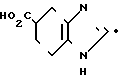
H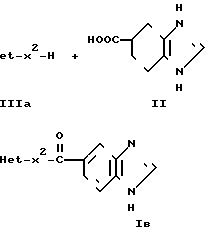 где Неt такой, как указано выше; Х2 является одинарной связью соединений с атомом углерода гетероцикла Неt.
где Неt такой, как указано выше; Х2 является одинарной связью соединений с атомом углерода гетероцикла Неt.
Соединение I можно получать реакцией гетероциклического соединения IIIа с карбоновой кислотой II или с ее реакционноспособным производным.
Реакцию можно проводить по любому известному способу синтеза карбонильных соединений, с использованием карбоновой кислоты или ее реакционноспособного производного.
При использовании карбоновой кислоты формулы II реакция с соединением IIIа является реакцией дегидратационной конденсации с использованием в качестве конденсирующего агента, например полифосфорной кислоты. Реакцию проводят с растворителем или без него. Если растворители инертны по отношению и реакции, но обычно выбирают такие, которые имеют нужную температуру кипения, соответствующую температуре реакции конденсации. Примерами подходящих растворителей являются декалин, тетралин, диглим и др. Реакцию проводят при комнатной температуре или, предпочтительно, при нагреве.
Если используют галоидангидрид карбоновой кислоты II, то это реакция Фриделя-Крафтса, которую проводят по любой известной методике с использованием кислот Льюиса, таких как хлорид алюминия, хлорид железа, хлорид олова, этилэфират трифторида брома и тетрахлорид титана. Предпочтительно выбирают растворители, инертные по отношению к реакции, в зависимости от типа используемой кислоты Льюиса. Примерами подходящих растворителей являются ацетонитрил и дисульфид углерода. Реакцию проводят при комнатной температуре, или, обычно, при нагреве.
Если используют амид карбоновой кислоты II, то это реакция Вилсмейера, которая является известной реакцией, часто используемой для синтеза гетероциклических карбонильных соединений. Реагенты для превращения амида кислоты в комплекс Вилсмейера включают обычные галогенирующие агенты, например пентахлорид фосфора и оксид хлорид фосфора. Эту реакцию можно проводить с растворителем или без него. При использовании растворителя можно использовать растворители различного типа, инертные по отношению к реакции. Подходящим примером растворителя является 1,2-дихлорэтан. Реакцию проводят при комнатной температуре или нагреве, предпочтительно при нагреве.
Способ 2, N-алкилирование: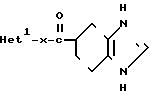

 Ie где Х такой, как определено выше: Het1 является гетероциклом, имеющим в кольце - NH: Неt2 представляет собой гетероцил, где остаток -NH-, в Het1превращен в -N-, где R4 является низшим алкилом, низшим алкенилом, низшим алкинилом, группой циклоалкил-низший алкил или арилалкилом.
Ie где Х такой, как определено выше: Het1 является гетероциклом, имеющим в кольце - NH: Неt2 представляет собой гетероцил, где остаток -NH-, в Het1превращен в -N-, где R4 является низшим алкилом, низшим алкенилом, низшим алкинилом, группой циклоалкил-низший алкил или арилалкилом.
Это реакция N-алкилирования. Алкилирование означает введение низшего алкила, низшего алкенила, низшего алкинила, группы циклоалкил-низший алкил или арилалакила. Применима любая известная метидока алкилирования. Например, если проводят прямое N-алкилирование с использованием алкидирующего агента, то реакцию проводят при охлаждении, при комнатной температуре или нагреве, предпочтительно при охлаждении при комнатной температуре. Можно использовать любой растворитель, инертный по отношению к реакции, например диоксан и диметилформамид. Реакцию проводят в присутствии основания или с использованием соли щелочного металла соединения (Id) на его аминогруппе. Примерами подходящих алкилирующих агентов являются галоидалкилы и алкилсульфаты. Примерами подходящих оснований являются неорганичеаские основания, например гидрид натрия, бикарбонат натрия или калия, карбонат натрия или калия, и органические основания, например триэтиламин, циизопропиламин, диметиланилин и пиридин.
Полученное таким образом соединение по данному изобретению выделяют и очищают в свободной форме или форме соли обычными химическими способами, такими как экстракция, кристаллизация, перекристаллизация и различные хроматографические способы.
Соединения, получаемые в рацемической форме, можно получать в виде стереохимически чистых изомеров с использованием соответствующих исходных соединений или общими способами разделения (например, способом, включающим получение соли диастеромера с обычной оптически активной кислотой, например, дибензоилвинной кислотой, с последующим оптическим разделением.
Соединения по данному изобретению и их соли специфически ингибируют вызываемую серотонином перемежающуюся брадикардию у анестезированных крыс, как описано ниже в испытательном примере 1, и поэтому предполагается, что они имеют антагонизм по отношению к 5-НТ3-рецепторам. Поэтому считается, что соединения по данному изобретению и их соли подавляют рвоту, вызываемую противоопухолевыми агентами, например цисплатином, или облучением и пригодны для предотвращения и лечения мигрени, головной боли, тригеминальной невралгии, тревожного состояния, желудочно-кишечных нарушений, пептической язвы, кишечных раздражений и пр.
Фармацевтическую композицию, содержащую по крайней мере одно соединение по данному изобретению или его соль в качестве активного ингредиента, получают в различных дозированных формах, таких как таблетки, порошки, гранулы, капсулы, пилюли, жидкости, инъекции, суппозитории, мази, пасты и т.п. с использованием носителей, разбавителей и других добавок, обычно используемых в фармации. Рецептуру можно вводить орально, включая подъязычное введение либо парэнтерально.
Носители или разбавители для фармацевтических композиций включают в себя твердые или жидкие нетоксичные вызываемое ceротонином или 2-метилсеротонином ингибируется в зависимости от дозы.
Ингибирующая активность соединений по данному изобретению по отношению к вызываемому серотонином рефлексу Bezold-Jarish (BJ) у крыс показана ниже.
Пример испытуемого соединения N 36. Активность, ингибирующая BJ-рефлекс (ЭД50, мг/кг внутривенно) 0,063.
Испытательный пример 2. Ингибирование рвоты, вызывaемой противораковым агентом.
При введении самцам африканского хорька массой 1-1,5 кг подкожно или орально 0,01-0,3 мг/кг соединения по даному изобретению ингибируется рвота, вызываемая внутрибрюшинным введением 10 мг/кг цисплатина.
Испытательный пример 3.
Ингибирование стрессовой дефекации.
Самцов Вистар-крыс возраста 9 недель помещают в клетку для ограничительного стресса и измеряют число фекалий. Внутривенное введение соединения по даному изобретению или его соли (1-100 мкг/кг) в зависимости от дозы ингибирует ускорение дефекации, вызываемое ограничительным стрессом.
Испытательный пример 4.
Токсичность.
Острая токсичность соединений по данному изобретению, определенная методом возрастающих и убывающих доз при внутривенном введении самцам мышей, составляет 100-150 мг/кг, что указывает на низкую токсичноость этих соединений.
Ниже данное изобретение более подробно иллюстрируется Справочными примерами, примерами и рецептурными примерами, которые, однако, не ограничивают данное изобретение.
Справочный пример 1.
 HCl _____→
HCl _____→  HCl
HCl
К 0,30 г гидрохлорида 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты, содержащего хлорид натрия, прибавляют 5 мл тионилхлорида и перемешивают 2 час при 90оС. Избыток тионилхлорида отгоняют под вакуумом. К остатку прибавляют 10 мл дихлорметана и 2 мл диэтиламина при 5оС, затем перемешивают 16 час при комнатной температуре.
К смеси прибавляют 40 мл дихлорметана, смесь промывают насыщенным водным раствором бикарбоната натрия и сушат над безводным сульфатом магния. Растворитель отгоняют под вакуумом и получают 0,22 г N, N-диметил-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Физико-химические свойства:
ЯМР (TMS, CDCl3): 1,15 (т, 6Н), 2,0-3,5 (м, 7Н), 3,10 (к, 4Н), 8,15 (с, 1Н), 9,50 (с, 1Н),
Масс-спектр (FAB, Pos (m/z, 222 (M+ +1).
К вышеуказанному соединению прибавляют 1 мл 4Н раствора HCl в этилацетате, растворитель удаляют под вакуумом и получают 0,27 г гидрохлорида, N,N-диэтил-4,5,6,7-тетрагидробензимидазол-5-карбоксамида.
Пример 1.
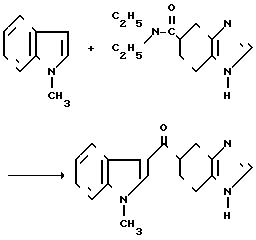
Смесь 0,27 г (1,05 ммоля) гидрохлорида N,N-диэтил 4,5,6,7-тетрагидробензимидазол-5-карбоксамида 0,16 мл (1,25 ммоля) 1-метиландола и 0,15 мл (1,65 ммоля) оксихлорида фосфора нагревают 2 час при 80оС и перемешивают. Прибавляют 30 мл воды и смесь подщелачивают 1Н водным раствором гидроксида натрия, затем экстрагируют этилацетатом. Этилацетатный слой сушат над безводным сульфатом магния и фильтруют. Фильтрат отгоняют под вакуумом, остаток очищают на колонке с силикагелем (элюент: дихлорметан: метанол: водный аммиак 10:1:0,1, по объему) и препаративной тонкослойной хроматографией (растворитель: дихлорметан: метанол: водный аммиак 10:1:0,1, по объему) и получают 20 мг пенообразного соединения. К продукту прибавляют 10 мг фумаровой кислоты, превращая его в фумарат. Перекристаллизацией из смеси этилацетат (метанол) (10: 1 по объему) получают 10 мг фумарата-5-(1-метилиндол-3-ил)-карбонил)-4,5,6,7-тетра- гидробензимидазола.
Физико-химические свойства:
Масс-спектр (Е1): m/z, 279 (М+, как свободное соединение)
ЯМР (CDCl3 ( δ) как свободное соединение):
1,90-3,00 (7Н, м, СН2, СН) 3,80 (3Н, с, N-Ме) 7,20 (2Н, м, ArH)
7,50-8,00 (4Н, м, ArH), 8,30 (1Н, м, NH).
Пример 2.
 HCl ___→
HCl ___→ 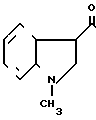
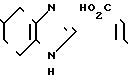
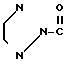
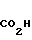 4 г Гидрохлорида N-[/4,5,6,7-тетрагидробензимидазол-5-ил/карбонил]пирролиди-на, добавляют и 40 мл дихлорэтана и прибавляют 2,74 г индола и 4,4 мл оксихлорида фосфора. Смесь перемешивают 7 час при 80-85оС и затем ночь при комнатной температуре. К смеси добавляют 40 мл холодного водного раствора карбоната калия и затем экстрагируют хлороформом. Экстракт сушат над безводным сульфатом магния и растворитель отгоняют под вакуумом. Остаток подвергают колоночной хроматографии с использованием смеси хлороформ/метаном в качестве элюента и получают 1,82 г-5-(индол-3-ил)карбонил(-4,5,6,7-тетраги- дробензимидазола в виде пенообразного продукта 0,16 г. Результирующего продукта растворяют в 1 мл метанола и к раствору прибавляют 0,06 г фумаровой кислоты и 5 мл ацетонитрила. Полученные кристаллы собирают фильтрованием и получают 0,13 г фумарата 5-(индол-3-ил) карбонил- 4,5,6,7-тетрагидробензимидазола.
4 г Гидрохлорида N-[/4,5,6,7-тетрагидробензимидазол-5-ил/карбонил]пирролиди-на, добавляют и 40 мл дихлорэтана и прибавляют 2,74 г индола и 4,4 мл оксихлорида фосфора. Смесь перемешивают 7 час при 80-85оС и затем ночь при комнатной температуре. К смеси добавляют 40 мл холодного водного раствора карбоната калия и затем экстрагируют хлороформом. Экстракт сушат над безводным сульфатом магния и растворитель отгоняют под вакуумом. Остаток подвергают колоночной хроматографии с использованием смеси хлороформ/метаном в качестве элюента и получают 1,82 г-5-(индол-3-ил)карбонил(-4,5,6,7-тетраги- дробензимидазола в виде пенообразного продукта 0,16 г. Результирующего продукта растворяют в 1 мл метанола и к раствору прибавляют 0,06 г фумаровой кислоты и 5 мл ацетонитрила. Полученные кристаллы собирают фильтрованием и получают 0,13 г фумарата 5-(индол-3-ил) карбонил- 4,5,6,7-тетрагидробензимидазола.
Физико-химические свойства:
Т.пл. 153-154оС.
Элементный анализ для C16H15N3O C4H4O4 0,15 СН3CN0,65 Н2О:
Рассчитано (%): С 61,07, Н 5,24, N 11,05.
Найдено, %: С 61,11, Н 5,01, N 11,04.
Масс-спектр (FAB): m/z 266 (M+ +1, как свободное соединение).
Аналогично примеру 2 синтезируют следующие соединения.
Пример 3.
3/4 Фумарат 5-(1,2-диэтилиндол-3-ил)карбонил)-4,5,6,7-тетрагидробензимида- зола.
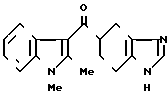 · 3/4
· 3/4 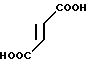
Физико-химические свойства:
Т.пл. 220-223оС
Элементный анализ для С18Н19N 3/4 С4Н4О4:
Рассчитано (%): С 66,30; Н 5. 83. N 11.05.
Найдено, (%) С 66,50; Н 5,83; N 11.13
Масс-спектр (ЕI): m/z 293 (М+, как свободное соединение)
Пример 4.
1/2 фумарат 5-//2-метилиндол-3-ил)карбонил-4,5,6,7,-тетрагидробензимид-азола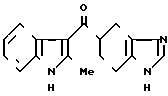 · 1/2
· 1/2 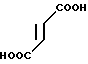
Физико-химические свойства:
Т.пл. 221-223оС.
Элементный анализ для С17Н17N3O.1/ (2O4Н4О4 0,25 Н2О:
Рассчитано (%): С 66,75, Н 5,75, N 12,29.
Найдено, %: С 66,73, H 5,75, N 12,29.
Масс-спектр (ЕI): m/z 279 (М+, как свободное соединение)
Пример 5.
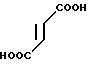
Фумарат 5-((2-бензилиндол-3-ил)карбонил)-4,5,6,7-тетрагидробензимидазо- ла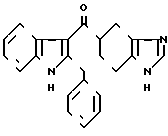 ·
· 
Физико-химическое свойства:
Т.пл. 183-186оС.
Элементный анализ для С23Н21N3О С4Н4О4 0,1Н2О
Рассчитано, %: С 68,52, Н 5,37, N 8,88.
Найдено, %: С 68,38, Н 5,50 N 8,87
Масс-спектр (EI): m/z 355 (M+, как свободное соединение).
Пример 6.
3/4 Фумарат 5-(5-метоксииндол-3-ил)карбонил)-4,5,6,7-тетрагидробензимида- зола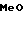
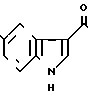
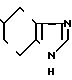 · 3/4
· 3/4 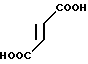
Физическое-химические свойства:
Т.пл. 162-164оС.
Элементный анализ для С17Н17N3O2 3/4С4Н4О4 0,2СН3С 0,85 Н2О:
Рассчитано (%): С 60,36: Н 5,54 11,04
Найдено, (%): С 60,33, Н 5,25, 10,93.
Масс-спектр (ЕI): m/z 295 (М+, как свободное соединение)
Пример 7.
Фумарат 5-(5-хлор-2-метилиндол-3-ил(карбонил)-4,5,6,7-тетрагидиробензими-дазола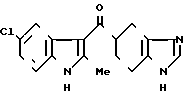 ·
· 
Физико-химическое свойства:
Т.пл. 212-213оС.
Элементный анализ для С17Н16N3ОСl C4H4O4:
Рассчитано: (%): С 58,68, Н 4,67, N 9,78, Cl 8,25.
Найдено, %: С 58,43; Н 4,91; N 9,67; Cl 8,24.
Масс-спектр (FAB), Pos (:m/z, 314 (М+ +1, как свободное соединение).
Пример 8.
5-(5-Нитроиндол-3-ил) карбонил-4,5,6,7-тетрагидробензимидазол.
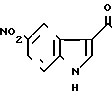
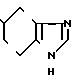
Физико-химическое свойства:
Т.пл. 227-229оС. ЯМР(DMCO-d5) 100M, δ: 2,00 (2Н, м), 2,70 (4Н, м), 3,63 (1Н, м) 7,44 (1Н, с), 7,64 (1Н, д), J6,7=12 Гц).
8,10 (1Н, д) J6,7=12 Гц, J4,6=4 Гц, 8,72 (1Н, с), 9,07 (1Н, д J4,6=4 Гц), 12,56 (1Н, ш).
Масс-спектр (ЕI): m/z 310 (М+).
Пример 9.
5-(5-Метоксикарбонилиндол-3-ил(карбо- нил)-4,5,6,7-тетрагидробензимидазол.
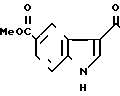
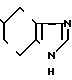
Физико-химические свойства:
Т.пл.: 205-209оС.
ЯМР (DMCO-d6), 100М δ: 1,90-2,15 (2Н, м), 2,83 (4Н) 3,75 (1Н, м) 7,56 (1Н, g, J6,7=12 Гц) 7,84 (1Н, 6,7=12 Гц, J4,6=37 ц) 8,62 (1Н,д,2= =4 Гц), 8,90 (2Н, с), 12,60 (1Н, д, 2 =4 Гц).
Масс-спектр (ЕI): m/z, 323 (М+)
Пример 10.
1/2 Сумарат-5-(5-гидроксииндол-3-ил)карбонил)-4,5,6,7-тетрагидробензимидазола.
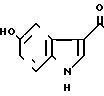
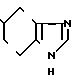 · 1/2
· 1/2 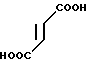
Физико-химические свойства:
Т.пл. 282-286оС.
ЯМР (DMCO-d6): 100 м, δ: 1,90 (2Н, ш), 2,85 (4Н, ш), 3,74 (1Н, ш), 6,76 (1Н, с), 6,84 (1Н, gg, J6,7=12 Гц, J4,6=4 Гц), 7,41 (1Н, д) J6,7=12 Гц).
7,74 (1Н, д, J4,6=4 Гц (8.50 (1Н, д 2NH=5 Г-), 9.07 (1Н, с), 11,95 (1Н, д, J2, NH).
Масс-спектр (EI): m/z, 281 (М+, как свободное соединение)
Пример 11.
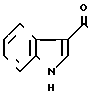
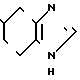 ___→
___→ 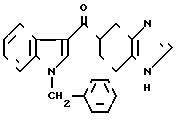
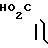
 К 5 мл сухого диметилформамида прибавляют 0,04 г 60% гидрида натрия в масле и медленно, при комнатной температуре прибавляют 0,51 г 5-(индол-3-ил(карбонил)-4,5,6,7, -тетрагидро-1Н-бензимидазола, полученого в примере 2. Через 30 мин медленно, при 0оС прибавляют 0,07 г бензилбромида и затем перемешивают ночь при комнатной температуре. К реакционной смеси прибавляют 20 мл воды и 20 мл хлороформа для разделения на фазы. Органический слой промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют и остаток хромато- графируют с использованием смеси хлороформ (метанол в качестве элюента. Результирующий пенообразный продукт (0,12 г) перекристаллизовывают вместе с 0,04 г фумаровой кислоты из смеси этанол (этилацетата и получают 0,10 г фумарата 5-(1-бензил- индол-3-ил(карбонил)-4,5,6,7-тетрагидробензимидазола.
К 5 мл сухого диметилформамида прибавляют 0,04 г 60% гидрида натрия в масле и медленно, при комнатной температуре прибавляют 0,51 г 5-(индол-3-ил(карбонил)-4,5,6,7, -тетрагидро-1Н-бензимидазола, полученого в примере 2. Через 30 мин медленно, при 0оС прибавляют 0,07 г бензилбромида и затем перемешивают ночь при комнатной температуре. К реакционной смеси прибавляют 20 мл воды и 20 мл хлороформа для разделения на фазы. Органический слой промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют и остаток хромато- графируют с использованием смеси хлороформ (метанол в качестве элюента. Результирующий пенообразный продукт (0,12 г) перекристаллизовывают вместе с 0,04 г фумаровой кислоты из смеси этанол (этилацетата и получают 0,10 г фумарата 5-(1-бензил- индол-3-ил(карбонил)-4,5,6,7-тетрагидробензимидазола.
Физико-химические свойства:
Т.пл. 117-118оС.
Элементный анализ для С23Н21N3О C4Н4О4 0,75Н2О:
Найдено, %: С 66,83; Н 5,48. N 8,88.
Рассчитано, %: С 66,86; Н 5,51; N 8,66.
Масс-спектр (EI): m/z, 321 (М+, как свободное соединение).
Аналогично примеру 11 синтезируют следующие соединения.
Пример 12.
Фумарат 5-(1-циклогексилметилиндол-3-ил) карбонил)-4,5,6,7-тетрагидробензимиида-зола.
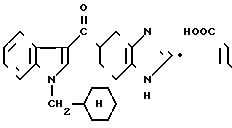
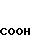
Физико-химические свойства:
Т.пл. 95-100оС (Этанол(этилацетат).
Элементный анализ для С23Н27N3O С4Н4О4 0,54 сОЕ,
Рассчитано (%): С 62,46, Н 7,05. N 7,54.
Найдено, (%): С 62,59; Н 6,69; N 7,19.
Макс-спектр (EI): m/z: 361 (М+, как свободное соединение).
Пример 13.
Фумарат 5-(1-аллилиндол-3-ил)карбонил)-4,5,6,7-тетрагидробензимидазола.
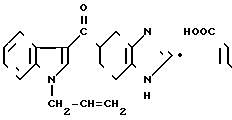
Физико-химические свойства:
Т.пл. 144-145оС (метанол(этилацетат)
Элементный анализ для С19Н19N3O C4H4O4 0,35 AcOEt 0,3Н2О,
Рассчитано, (%): С 64,03; Н 5,81; N 9,18.
Найдено, (%): С 64,00; Н 5,74; N 9,17.
Масс-спектр (EI) m/z 305 (М+, как свободное соединение)
Пример 14.
Фумарат 5-(1-н-бутилиндол (-3-ил) карбонил (-4,5,6,7-тетрагидробензимидазола.
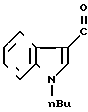
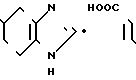
Физико-химические свойства:
Т.пл. 104-106оС (этанол/ацетонитрил)
Элементный анализ для С20Н23N3О С4Н4О4 0,8Н2О:
Рассчитано: (%) C 63,78, H 6,38, N 9,30.
Найдено, (%): С 63,82, Н 6,14, N 9,33.
Масс-спектр (EI): m/z 321 (М+ как свободное соединение).
Пример 15.
Фумарат 5-(1-(2-пропинил(индол-3-ил)карбонил)-4,5,6,6-тетрагидробензиимидазола.
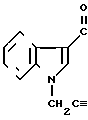

Физико-химические свойства:
Т.пл. 130-131оС (этанол/ацетонитрил)
Элементный анализ для С19Н17N3O x x C4H4O4 1,3H2O:
Рассчитано, (%): С 62,38; Н 5,37, N 9,49.
Найдено, %: С 62,38; Н 5,19; N 9,21.
Масс-спектр (EI) m/z, 303 (М+, как свободное соединение).
Пример 16.
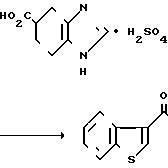
 SO
SO В 5 мл ацетонитрила суспендируют 0,53 г сульфата 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты и суспензии прибавляют 0,29 мл тионилхлорида. Суспензию перемешивают 1 час при -55-60оС и растворитель отгоняют при пониженном давлении. К остатку прибавляют 4,6 мл бензотиофена и затем 0,4 г хлорида алюминия. После перемешивания 3 час при 60о смесь выливают в холодный водный раствор карбоната калия. Раствор доводят до рН 8-9 и экстрагируют хлороформом.
В 5 мл ацетонитрила суспендируют 0,53 г сульфата 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты и суспензии прибавляют 0,29 мл тионилхлорида. Суспензию перемешивают 1 час при -55-60оС и растворитель отгоняют при пониженном давлении. К остатку прибавляют 4,6 мл бензотиофена и затем 0,4 г хлорида алюминия. После перемешивания 3 час при 60о смесь выливают в холодный водный раствор карбоната калия. Раствор доводят до рН 8-9 и экстрагируют хлороформом.
Органический слой сушат над безводным сульфатом магния и растворитель отгоняют под вакумом. Остаток очищают колоночной хроматографией на силикагеле с использованием смеси хлороформ/метанол в качестве элюента и получают 5-(бензотиофен-3-ил(карбонил)-4,5,6,7-тетрагидро-бензимидазол. Продкут обрабатывают эквимольным количеством фумаровой кислоты обычным способом и перекристаллизовывают из сеси этанол (ацетонитрил, получая 0,04 г фумарата 5-(бензотиофен-3-ил) карбонил)-4,5,6,7-тетрагидробензимида- зола.
Физико-химические свойства:
Т.пл. 135-137оС.
Элементный анализ для С16Н14N2OS х х C4H4O4 0,3ЕtOH 0,2Н2О:
Рассчитано (%): С 59,50, Н, 4,90, N 6,74, S 7,71.
Найдено, (%): С 59,41; Н 5,07; N 6,53; S 7,91.
Масс-спектр (EI) m/z, 282 (М+, как свободное соединение).
Пример 17.
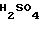
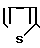
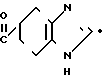 HCl
HCl
Смесь 2 г фосфрной кислоты, 5 мл тиофена и 2,91 г сульфата 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты перемешивают 8 час при 100оС. После охлаждения прибавляют 20 мл холодной воды и реакционную смесь промывают толуолом (20 мл х 2). Водный слой доводят до рН 8-9 карбонатом калия и экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния и растворитель отгоняют. Остаток обрабатывают 4Н раствором HCl в этилацетате, перекристаллизовывают из смеси метанол (ацетонитрил и получают 0,12 г гидрохлорида 5-(тиофен-2-ил)карбонил)-4,5,6,7-тетрагидробензимида- зола.
Физико-химические свойства:
Т.пл. 218-220оС.
Элементный анализ для С12Н12N2OS х х HCl:
Рассчитано (%): С 53,63. Н 4,88 N 10,42; S 11,93.
Найдено, %: C 53,25, H 4,98, N 10,62, S 11,70.
Масс-спектр (ЕI): m/z; 232(М+, как свободное соединение)
Пример 18.
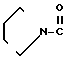
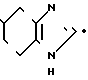 HCl___→
HCl___→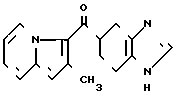 К раствору 0,50 г гидрохлорида N-[(4,5,6,7-тетрагидробензимидазол-5-ил)карбонил] пиролидина и 0,39 г 2-метилиндолизина в 5 мл 1,2-дихлорэтана по каплям прибавляют 0,90 г оксихлорида фосфора. Реакционную смесь нагревают ночь с обратным холодильником при 85оС. После охлаждения до комнатной температуры прибавляют 5 мл воды. Органический слой удаляют и к водному слою прибавляют 10 мл хлороформа. Раствор доводят до рН 9 20% водным раствором гидроксида натрия и экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния и растворитель отгоняют. Остаток очищают колоночной хроматографией на силикагеле с использованием смеси хлороформ (метанол в качестве элюента и получают 0,21 г 5-(2-метилиндолизин-3-ил) карбонил)-4,5,6,7-тетрагидробензимидазола.
К раствору 0,50 г гидрохлорида N-[(4,5,6,7-тетрагидробензимидазол-5-ил)карбонил] пиролидина и 0,39 г 2-метилиндолизина в 5 мл 1,2-дихлорэтана по каплям прибавляют 0,90 г оксихлорида фосфора. Реакционную смесь нагревают ночь с обратным холодильником при 85оС. После охлаждения до комнатной температуры прибавляют 5 мл воды. Органический слой удаляют и к водному слою прибавляют 10 мл хлороформа. Раствор доводят до рН 9 20% водным раствором гидроксида натрия и экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния и растворитель отгоняют. Остаток очищают колоночной хроматографией на силикагеле с использованием смеси хлороформ (метанол в качестве элюента и получают 0,21 г 5-(2-метилиндолизин-3-ил) карбонил)-4,5,6,7-тетрагидробензимидазола.
Физико-химические свойства:
Т.пл. 260-264оС.
Элементный анализ для С17Н17N3O x 0,15 С2Н5ОН 0,2Н2О:
Рассчитано (%): С 71,68; Н 6,36; N 14,50.
Найдено (%): C 71,71; H 6,16. N 14,46.
Масс-спектр (EI) m/z; 279 (М+).
Пример 19.
Аналогично примеру 18, но заменяя 2-метилиндолизин пирролом, синтезируют 5-(2-пирролил)карбонил)-4,5,6,7-тетрагидро-бензимидазол указанной ниже формулы.
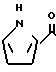
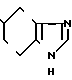
Физико-химические свойства:
Т.пл. 255-256оС
Элементный анализ для С12Н13N3O:
Рассчитано: (%) С 66,96; Н 6,09; N 19,52.
Найдено (%): С 66,74; Н 6,23; N 19,41.
Масс-спектр (EI): m/z, 215 (М+).
Пример 20.
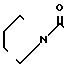
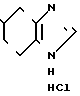
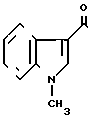
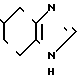
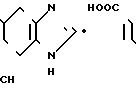
К суспензии 7,0 г гидрохлорида N-[(4,5,6,7-тетрагидробензимидазол-5-ил)кар- бонил] пирролидина и 5,4 г-метилиндола в 70 мл этиленхлорида прибавляют 12,6 г оксихлорида фосфора и смесь перемешивают 7 час при 80-85оС. Смесь охлаждают до 0-5оС и медленно прибавляют 70 мл воды, поддерживая температуру смеси ниже комнатной, для разложения избытка оксихлорида фосфора. Органический слой удаляют, водный слой доводят до рН 9 20% водным раствором гидроксида натрия при охлаждении и экстрагируют хлороформом. К хлороформному слою прибавляют 70 мл воды и 6Н HCl при охлаждении льдом и перемешивании для доведения рН до 2,4-2,8. Хлороформный слой отбрасывают. Водный слой промывают хлороформом и прибавляют 40 мл метанола. Раствор подщелачивают 20% водным раствором гидроксида натрия при охлаждении. Образовавшиеся кристаллы собирают фильтрованием, промывают холодной смесью 1:1 (по объему) метанола и воды и получают 6,87 (89,9%) 5-(1-метилиндол-3-ил)-карбонил)-4,5,6,7-тетрагидробен- зимидазола.
Физико-химические свойства:
Т.пл. 139-141оС.
Масс-спектр (EI): m/z, 279 (М+).
1Н-ЯМР (CDCl3-DMCO-d6): 1,80-2,32 (м, 2Н), 2,56-3,04 (м, 4Н), 3,32-3,60 (м, 1Н), 3,90 (с, 3Н), 7,12-7,20 (м, 3Н), 7,40 (с, 1Н), 7,92 (с, 1Н), 8,20-8,40 (м, 1Н).
Элементный анализ для С17Н17N3O 0,2ЕtОН 0,35 Н2О:
Рассчитано, (%): 70,88; Н 6,46, N 14,25.
Найдено, (%): 70,83, Н 6,50. N 14,23.
Пример 21.
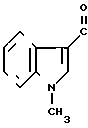
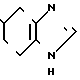 · 1/2
· 1/2 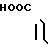
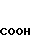 5-(1-Метилиндол-3-ил)карбонил)-4,5,6,7-тетра- гидробензимидазол обрабатывают половиной эквимольного количества фумаровой кислоты в этаноле известным способом с получением 1/2 фумарата 5-(1-метилиндол-3-ил)карбонил)-4,5,6,7-тетрагидробензимидазола.
5-(1-Метилиндол-3-ил)карбонил)-4,5,6,7-тетра- гидробензимидазол обрабатывают половиной эквимольного количества фумаровой кислоты в этаноле известным способом с получением 1/2 фумарата 5-(1-метилиндол-3-ил)карбонил)-4,5,6,7-тетрагидробензимидазола.
Физико-химические свойства:
Т.пл. 224-225оС.
Элементный анализ для С19Н19N3O3:
Рассчитано (%): С 67,64, Н 5,68. N 12,45.
Найдено, (%): С 67,56; Н 5,66; N 12,35.
Масс-спектр (FAB): m/z, 280 (М+ +1, как свободное соединение).
Пример 22.
Оптическое разделение (1) 5-(1-метилиндол-3-икарбонил)-4,5,6,7-тетрагидробен- зимидазола.
(а) в 60 мл метанола добавляют 5,87 г 5-(1-метилиндол-3-ил)-карбонил-4,5,6,7-те-трагидробензимидазола, полученного по примеру 20 и прибавляют раствор 7,52 г (+)-дибензоилвинной кислоты в 240 мл метанола с получением прозрачного раствора. После выстаивания раствора ночь при комнатной температуре осаждаются кристаллы, которые собирают фильтрованием, трижды перекристаллизовывают из смеси диметилформамид (вода и получают 2,30 г (+) -дибензоилтартрата (R)-(-5-(1-метилиндол-3-ил) карбонил)-4,5,6,7-тетрагидробензимидазола.
Физико-химические свойства:
[α]D20=+30,6о (Сl,10, диметилформамид)
Т.пл.: 169,0-170,0оС
Элементный анализ для С17Н17N3O х х C18H14O8 H2O:
Рассчитано (%): С 64,12; Н 5,07; N 6,41.
Найдено, (%): С 64,13; Н 5,03; N 6,55.
Масс-спектр (FAB): m/z 280 (М+ +1, как свободное соединение) (в) К 2Н водному раствору HCl прибавляют 2,2 г соединения, полученного выше в (а), раствор промывают этилацетатом и доводят до рН приблизительно 9 карбонатом натрия. Водный слой экстрагируют смесью хлороформ/метанол (4:1 по объему). Экстракт сушат над безводным сульфатом магния, растворитель отгоняют и получают 0,94 г (R)-(-)-(5-1-метилин- дол-3-ил/карбонил)-4,5,6,6-тетрагидробен- зимидазола в виде пенообразного соединения [α]D20=-16,5о (с=1,13, метанол).
(с) Полученный выше в (b) (R)-(-)-5-//1-метилиндол-3-ил/карбонил)-4,5,6,7-тетра-гидробензимидазол (0,56 г) обрабатывают 0,21 г фумаровой кислоты в смеси метанол/ацетонитрил с получением 0,64 г фумарата (R)-(-)-5-(1-метилиндол-3-ил/карбо- нил)-4,5,6,7-тетрагидробензимидазола.
[α]D20=-28,1о (с=1,22, метанол).
Т.пл.: 150,5-151,5оС.
Элементный анализ для С17Н17N3O х х C4H4O4 0,35 СН3CN 0,25 Н2О:
Рассчитано, (%): С 62,91; N 5,49; N 11,33.
Найдено, %: С 62,94; Н 5,41; N 11,35.
Масс-спектр (ЕI): m/z; 279/m+, как свободное соединение)
Пример 23.
В смеси этанол/этилацетат растворяют 100 мг (R)-(-)-5-(1-метил-3-индолил-карбонил)-4,5,6,7-тетрагидробензимидазола, полученного в примере 43(b) и прибавляют раствор HCl в этилацетате. Полученные кристаллы собирают, перекристаллизовывают из этанола и получают 70 мг гидрохлорида (R)-(-)-5-(1-метилиндол-3-ил)-4,5,6,7- тетрагидробензимидазола.
[α]D20=-42,9о (с=1,02, метанол).
Т.пл. : 215-230оС
Элементный анализ для С17Н17N3O HCl:
Рассчитано, (%): С 64,66; Н 5,75; N 13,31; Сl 11,23.
Найдено (%): С 64,37; Н 5,80; N 13,12; Cl 11,17.
Масс-спектр (EI): m/z, 279 (М+, как свободное соединение)
Пример 24.
Оптическое разделение (2) 5-(1-метилиндол-3-ил/карбонил)-4,5,6,7-тетрагидро- бензимидазола.
(а) Аналогично примеру 22(а), но с использованием (-)-дибензоилвинной кислоты, получают (-)-дибензоилтатртрат (R)-(+)-5- (1-метилиндол-3-ил/карбонил)4,5,6,7-тетра- гидробензимидазола.
[α]D20=230,3о (c=1,07, диметилформамид).
Т.пл.: 168-169,5оС.
Элементный анализ для С17Н17N3O х х C18H14O8 H2O
Рассчитано (%): С 64,12; Н 5,07; N 6,41.
Найдено (%): С 6 4,13; Н 5,13; N 6,171.
Масс-спектр (FAB): m/z, 280 (М+ +1, как свободное соединение)
(в) Аналогично примеру 22(в), но с использованием полученной выше в (а) соли, получают (S)-(+)-5-(1-метиллиндол-3-ил/карбонил)-4,5,6,7-тетрагидробензимидазол в виде пеннообразного соединения.
[α]D20 = +16,7о (с=0,35, метанол).
(с) Аналогичо пример 22 (с), с использованием полученного выше в (в) (S)-(+)-5-(1-метилиндол-3-ил/карбонил)-4,5,6,7-тетра-гидробензимидазола получают кристаллы фумарата (S)-(+)-((1-метилиндол-3-ил/карбонил)-4,5,6,7-тетрагидробензимидазола.
[α]D20=+28,3о (с=1,14, метанол).
Т.пл. 151,0-152,0оС.
Элементный анализ для С17Н17N3O C4H4O4 0,35 СН3С 0,25Н2О:
Рассчитано (%): С 62,91; Н 5,49; N 11,33.
Найдено, (%): С 62,96; Н 5 ,39; N 11,37.
Масс-спектр (EI): m/z: 279 (М+, как свободное соединение).
Пример 25.
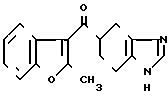
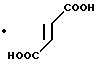
В 40 мл ацетонитрила суспендируют 5,00 г сульфата 4,5,6,7-тетрагидробензимидазол-5-карбоновой кислоты и к суспензии прибавляют 2,75 ил тионилхлорида. Суспензию перемешивают 1 час при 55оС и растворитель отгоняют под вакуумом. К остатку прибавляют 20 мл нитробензола и 1,80 мл 2-метилбензофурана, а также 2,10 мл тетрахлорида олова. После перемешивания в течение ночи при 85оС прибавляют 40 мл 1М водного раствора HCl и 40 мл этилового эфира. Органический слой отбрасывают, прибавляют 40 мл хлороформа и раствор доводят до рН=9 10% водным раствором гидроксида натрия. Реакционный раствор фильтруют через цеолит и экстрагируют хлороформом, содержащим 10% метанола. Органический слой собирают и растворитель отгоняют. К целевому продукту в форме свободного основания, обработанному хроматографией на силикагеле с использованием смеси хлороформ/метанол, добавляют рассчитанное количество фумаровой кислоты для превращения в фумарат, перекристаллизовывают из этанола и получают 0,14 г фумарата-5-(2-метилбензофуран-3-ил/кар-бонил)-4,5,6,7-тетрагидробензимидазол а.
Физико-химические свойства:
Т.пл. 188-189оС.
Элементный анализ для С17Н16N2O2 С4Н4О4:
Рассчитано (%): С 63,63; Н 5,09; N 7,07.
Найдено (%): С 63,47; Н 5,06; N 7,01.
Масс-спектр (EI): m/z, 280 (М+, как свободное основание).
Пример 26.
5-(Индолизин-3-ил)карбонил-4,5,6,7-те- трагидробензимидазол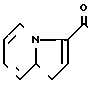
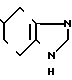
Аналогично примеру 18 но заменяя 2-метилиндолизин индолизином получают целевое соединение.
Физико-химические свойства:
Т.пл. 210-212оС.
Элементный анализ для С16Н15N3O 0,1Н2О
Рассчитано, (%): С 71,94; Н 5,74; N 11,73.
Найдено, (%): С 72,08; Н 5,79; N 15,67.
Масс-спектр (EI): m/z, 265 (М+).
Пример 27.
5-(1-Метилиндолизин-3-ил/карбонил)-4,5,6,7-тетрагидробензимидазол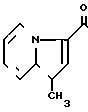
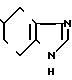
Аналогично примеру 18 но заменяя 2-метилиндолизин на 1-метилиндолизин, получают целевое соединение.
Физико-химические свойства:
Т.пл. 122-123оС.
Элементный анализ для С17Н17N3О 0,25 С4Н10О 0,4Н2О:
Рассчитано, (%): С 70,87; Н 6,71; N 13,77.
Найдено, (%): С 70,88; Н 6,68; N 13,66.
Масс-спектр (EI): m/z, 279 (М+).
Рецептурный пример 1 (таблетки)
Соединение по примеру 44 (далее соединение А) 0,2 мг Лактоза 106,4 мг Кукурузный крахмал 48,0 мг
Гидроксипропилцел- люлоза 4,8 мг Стеарат магния 0,6 мг
________________
Итого: 160/0 мг
на таблетку.
Соединение А (200 мг), лактозу (106,4 мг) и кукурузный крахмал (48 г) тщательно смешивают и прибавляют 48 мг 10% водного раствора гидроксипропилцеллюлозы. Смесь гранулируют в грануляторе. К гранулам прибавляют 0,6 стеарата магния и смесь прессуют с получением 1000 таблеток весом 160 мг каждая.
Рецептурный пример 2 (порошок) Соединение А 0,4 мг Маннит 770,0 мг Кукурузный крахмал 199,6 мг Поливинилпирролидон 30,0 мг
________________ Итого: 1000/0 мг
Соединение А (0,4 г) маннит (770 г) и кукурузный крахмал (199,6 г) тщательно смешивают и прибавляют 300 мл 10% водного раствора поливинилпирролидона, затем гранулируют в грануляторе с получением 1 кг порошка.
Рецептурный пример 3 (капсулы). Соединение А 0,2 мг Кукурузный крахмал 198,8 мг Стеарат кальция 1,0 мг
________________ Итого: 200 мг
Соединение А (0,2 г), кукурузный крахмал (198,8 г) в стеарат кальция (1 г) тщательно смешивают и смесь помещают в капсулы N 3 по 200 мг, получая 1000 капсул.
Рецептурный пример 4 (сироп) Соединение А 0,2 мг Сахароза 8,0 мг Чистая вода 5 мл
Соединение А (0,2 г) и сахароху (8 г) растворяют в дистиллированной воде и получают 5 л сиропа.
Рецептурный пример 5 (инъекции) Соединение А 0,3 мл Хлорид натрия 9 мл Дистиллированная вода для инъекций 1,0 мл
Соединение А (300 мг) и хлорид натрия (9 г) растворяют в дистиллированной воде для инъекций и получают 1000 мл раствора. Раствор фильтруют и помещают в 1000 ампул по 1 мл, вытесняяя атмосферные газы из ампулы газообразным азотом. Ампулы стерилизуют автоклавированием.
Так как изобретение описано подробно, с приведением конкретных вариантов, то специалисту в данной области будет ясно, что можно внести много изменений и модификаций, не выходя за объем и не отклоняясь от сути данного изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 4,5,6,7-ТЕТРАГИДРОБЕНЗИМИДАЗОЛА | 1991 |
|
RU2033414C1 |
| Способ получения 4,5,6,7-тетрагидробензимидазольных производных | 1989 |
|
SU1836358A3 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ ТИАЗОЛА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АКТИВНОСТЬ АГОНИСТА 5-НТ*003-РЕЦЕПТОРА НА ЕГО ОСНОВЕ | 1995 |
|
RU2098418C1 |
| ПРОИЗВОДНОЕ СКОНДЕНСИРОВАННОГО ПИРАЗИНА | 1991 |
|
RU2095352C1 |
| СПИРОСОЕДИНЕНИЕ ИЛИ ЕГО СОЛИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, ОБЛАДАЮЩАЯ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ | 1989 |
|
RU2094432C1 |
| ПРОИЗВОДНЫЕ ТРИФТОРМЕТИЛКЕТОНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2073684C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2043365C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛО [1,5-А] ПИРИДИНА, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2069662C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРЕДУПРЕЖДЕНИЯ И УСТРАНЕНИЯ ТРОМБОЗОВ | 1992 |
|
RU2103276C1 |
| ПРОИЗВОДНЫЕ КАРБАПЕНЕМА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2091381C1 |
Использование: в качестве препаратов, пригодных в качестве 3-HI3 -цепеторных антагонистов. Сущность изобретения: продукт ф-лы 1, где Het - остаток индола, 2,3-дигидроиндола, бензоксазина, дигидробензоксазина, фенотиазина, тетрагидрохинолина, бензотиофена, пиррола, тетрагидроизохинолина, тиадиазола, пиридина, 2,3-дигидробензимидазола, бензофурана, пирролидина, пиримидина, бензимидазола, бензотиазола, хинолина, индазола, циклопентатиазола, дигидроциклопентатиазола, карбазола, 2,3-дигидробензимидазол-2-она, тетрагидробензотиофена, индена, тиофена, индолизина или фурана, которые могут быть замещены 1-3 заместителями, выбранными из группы, состоящей из низшей алкильной группы, низшей алкенильной группы, низшей алкинильной группы, циклоалкил-низшей алкильной группы, аралкильной группы, низшей алкоксигруппы, нитрогруппы, гидроксильной группы, низшей алкоксикарбонильной группы или атома галогена. X2 - связь, соединенную с углеродным атомом гетероциклического кольца Het. Реагент 1: гетероциклическое соединение ф-лы 2, где Het и X2 указано выше. Реагент 2: соединение ф-лы 3 или его реакционноспособное производное. Соединения ф-лы 1, 2, 3 - чертеж.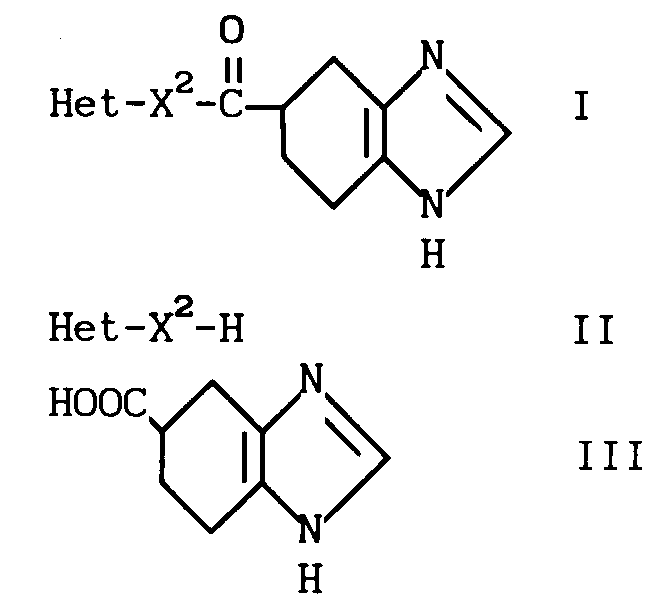
Способ получения производного тетрагидробензимидазола общей формулы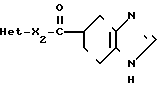
где Het - гетероциклическая группа, такая, как остаток индола, 2,3-дигидроиндола, бензоксазина, дигидробензоксазина, фенотиазина, тетрагидрохинолина, бензотиофена, пиррола, тетрагидроизохинолина, тиадиазола, пиридина, 2,3-дигидробензимидазола бензофурана, пирролидина, пиримидина, бензимидазола, бензотиазола, хинолина, индазола, циклопентатиазола, дигидроциклопентатиазола, карбазола, 2,3-дигидробензимидазол-2-она, тетрагидробензотиофена, индена, тиофена, индолизина или фурана, которые могут быть замещены 1-3 заместителями, выбранными из группы, состоящей из низшей алкильной группы, низшей алкенильной группы, низшей алкинильной группы, циклоалкилнизшей алкильной группы, аралкильной группы, низшей алкоксигруппы, нитрогруппы, гидроксильной группы, низшей алкоксикарбонильной группы или атома галогена;
Х2 - одинарная связь, соединенная с углеродным атомом гетероциклического кольца Het,
или его фармацевтически приемлемой соли, отличающийся тем, что гетероциклическое соединение формулы
Het - X2 - H,
где Het и X2 имеют указанные значения,
подвергают взаимодействию с карбоновой кислотой формулы
или ее реакционноспособным производным.
Приоритет по признакам:
02.02.89 при X2 - одинарная связь, соединенная с углеродным атомом гетероциклического кольца Het, Het - индольная группа, которая может быть замещена низшей алкильной группой;
28.12.89 при Het - гетероциклическая группа, такая как остаток 2,3-дигидроиндола, бензоксазина, дигидробензоксазина, фенотиазина, тетрагидрохинолина, бензотиофена, пиррола, тетрагидроизохинолина, тиадиазола, пиридина, 2,3-дигидробензимидазола, бензофурана, пирролидина, пиримидина, бензимидазола, бензотиазола, хинолина, индазола, циклопентатиазола, дигидроциклопентатиазола, карбазола, 2,3-дигидробензимидазол-2-она, тетрагидробензотиофена, индена, тиофена, индолизина или фурана, которые могут быть замещены 1-3 заместителями, выбранными из группы, состоящей из низшей алкильной группы, низшей алкенильной группы, низшей алкинильной группы, циклоалкилнизшей алкильной группы, аралкильной группы, низшей алкоксигруппы, нитрогруппы, гидроксильной группы, низшей алкоксикарбонильной группы или атома галогена.
| Вейганд-Хильгетаг Методы эксперимента в органической химии, Химия, 1968, с.735. |
Авторы
Даты
1994-12-15—Публикация
1990-02-01—Подача