Изобретение касается лекарственного препарата, а именно нового производного азола или его соли, которое является антагонистом лейкотриена (LTs) и тромбоксана (TX) A2 и полезно в качестве препарата для предупреждения и лечения заболеваний, где указанные соединения служат посредниками, а также фармацевтических составов, включающих вышеуказанное производное, и промежуточных продуктов, применяемых при получении указанного производного.
Известны различные виды астмы - диспептическая астма, аллергическая астма, атопическая астма, бронхиальная астма, инфекционно-аллергическая астма, сердечная астма и другие. В частности, большое число пациентов страдают бронхиальной астмой, поэтому данное исследование проведено на средствах или методах, пригодных для предупреждения и лечения этого вида заболевания. Механизм действия препаратов против бронхиальной астмы рассматривается с двух точек зрения, то есть бронхоэктазы и противовоспаления, и разработано много лекарственных препаратов для лечения и предупреждения заболевания. Примерами вышеупомянутых бронходиляторов являются B2-стимуляторы, метилксантин и холинолитические агенты, а стероиды и медиаторные ингибиторы могут быть примерами противовоспалительных агентов. Однако, так как современные противоастматические агенты имеют недостаток в том, что бронходиляторы дают сильные побочные эффекты, а противовоспалительные препараты малоэффективны для терапии и предупреждения заболевания по сравнению с другими средствами, наибольшие усилия были направлены на разработку лучших средств для предупреждения и лечения астмы, которые лишены указанных недостатков.
В последние годы среди этих противовоспалительных агентов и медиаторных ингибиторов, такие как PAF антагонисты, антагонисты или ингибиторы синтеза тромбоксана A2 (TXA2) и антагонисты лейкотриена (LTs) применялись для лечения астмы, и их эффективность была признана. Однако, было отмечено, что терапевтический эффект этих агентов при лечении астмы (агенты средней или повышенной эффективности) составляет около 50% при использовании его одного (Iqakuno Ayumi 168 (4), 295 (1994) and Iqakuno Ayumi 164 (4), 225 (1993)), полагая, что эффективность не является достаточной из-за разницы в группе медиаторов, которые играют основную роль при лечении пациентов с астмой.
Недавно появилось сообщение о некоторых соединениях, способных подавлять многие медиаторы (например, непрошедшая экспертизу опубликованная заявка на патент Японии (Kokai) N 4-154766). Однако их эффективность недостаточна с точки зрения орального всасывания, поэтому большие усилия были направлены на создание клинически полезных средств, которые могут действовать как хорошо сбалансированные ингибиторы множества медиаторов, а также отлично всасываются при пероральном введении.
Целью данного изобретения является получение соединения, которое дает хорошо сбалансированное подавление двух или более медиаторов (далее называемый "множественный медиаторный ингибитор") и создание фармацевтического препарата, содержащего данное соединение. Авторы настоящего изобретения провели всесторонние исследования, основанные на предположении, что множественный медиаторный ингибитор может быть использован как эффективное средство против широкого спектра аллергических заболеваний, таких как астма и подобные заболевания и, в частности, как очень хорошее противоастматическое средство, в случае ингибитора, являющееся антагонистом как TXA2, так и LTs. В результате было обнаружено, что производное, представленное ниже общей формулой (I), или его соль, которое характеризуется тем, что имеет моноциклическое или конденсированное ядро азольного кольца, и которое отличается по строению от известных соединений, обладает двумя упомянутыми выше функциями хорошо сбалансированного ингибитора и очень хорошо всасывается при пероральном введении, и что оно может являться противоастматическим агентом, широко полезным в качестве множественного медиаторного ингибитора. Это позволило завершить данное изобретение.
В соответствии с этим, настоящее изобретение относится к производному азола, представленному приведенной ниже общей формулой (I), его солям и фармацевтическому составу, содержащему эти соединения в качестве активных ингредиентов, преимущественно, антагонистов лейкотриена и тромбоксана A2.

R1 и R2 могут быть одинаковыми или отличаться друг от друга, и каждый представляет собой атом водорода, циклоалкильную группу, низшую алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или R1и R2 могут быть соединены с кольцом  с образованием конденсированного кольца, представленного формулой:
с образованием конденсированного кольца, представленного формулой: 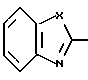 или формулой:
или формулой: 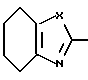 , и эти конденсированные кольца могут быть замещены низшей алкильной группой, которая может быть замещенной аминогруппой, цианогруппой, нитрогруппой, гидроксильной группой, атомом галогена или низшей алкильной группой,
, и эти конденсированные кольца могут быть замещены низшей алкильной группой, которая может быть замещенной аминогруппой, цианогруппой, нитрогруппой, гидроксильной группой, атомом галогена или низшей алкильной группой,
R3, R6, R7 и R8 могут быть одинаковыми или отличаться друг от друга, и каждый представляет собой атом водорода, аминогруппу, цианогруппу, нитрогруппу, гидроксильную группу, атом галогена, низшую алкоксигруппу или низшую алкильную группу, которая может быть замещенной,
R4 представляет цианогруппу, тетразолильную группу, представленную формулой: -COOR9, или группу, представленную формулой: -E-NH-F-R10,
R9 представляет атом водорода или остаток сложного эфира,
E представляет одинарную связь или карбонильную группу,
F представляет одинарную связь или низшую алкиленовую группу,
R10 представляет атом водорода; карбамоильную группу; моно- или ди(низший алкил) карбамоильную группу; карбоксильную группу; низшую алкоксикарбонильную группу; арилкарбонильную группу, которая может быть замещена низшей алкильной группой; низшую алканоильную группу; низшую алкилсульфонильную группу; или арилсульфонильную группу, которая может быть замещена низшей алкильной группой,
R5 представляет атом водорода или низшую алкильную группу,
D представляет низшую алкиленовую группу, которая может быть замещенной,
X и Z могут быть одинаковыми или отличаться друг от друга, и каждый представляет собой атом кислорода (O) или атом серы (S),
Y представляет атом азота (-N=) или метиновую группу (-CH=),
A является группой, представленной формулами:
-O-B-, -B-O-, -S-B-, -B-S- или -B-,
B - это низшая алкиленовая группа или низшая алкениленовая группа, и
n равен 0, 1 или 2; такие же обозначения будут применяться и далее.
Среди соединений, представленных вышеприведенной формулой (I), предпочтительным соединением является
a) производное азола, его фармацевтически приемлемая соль, гидрат или сольват, в которых R4 представляет собой
1) тетразолильную группу,
2) группу, представленную формулой: -COOR9 (R9 - атом водорода или сложноэфирный остаток), или
3) группу, представленную формулой: -E-NH-F-R10 (где E - простая связь или карбонильная группа, F - простая связь или низшая алкиленовая группа, и R10 - атом водорода, карбамоильная группа, карбоксильная группа или низшая алкоксикарбонильная группа, низшая алканоильная группа, низшая алкилсульфонильная группа или арилсульфонильная группа, которая может быть замещена низшей алкильной группой),
b) производное азола, его фармацевтически приемлемая соль, гидрат или сольват, в которых X является атомом серы,
c) производное азола, его фармацевтически приемлемая соль, гидрат или сольват, в которых Y является метиновой группой (-CH=), или
d) производное азола, его фармацевтически приемлемая соль, гидрат или сольват, в которых R1 и R2 могут быть одинаковыми или отличаться друг от друга, и каждый представляет собой атом водорода, циклоалкильную группу, низшую алкильную группу, фенильную группу, которая может быть замещена низшей алкильной группой, или R1 и R2 могут объединяться с кольцом 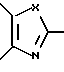 с образованием конденсированного кольца, представленного формулой:
с образованием конденсированного кольца, представленного формулой: 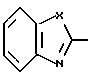 или формулой:
или формулой: 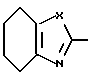 , и эти конденсированные кольца могут быть замещены низшей алкильной группой, которая может быть замещена 1-3 атомами галогена, или аминогруппой, цианогруппой, нитрогруппой, гидроксильной группой, атомом галогена, низшей алкоксигруппой; D - низшая алкиленовая группа, которая может быть замещена атомом галогена, и A - группа, представленная формулой; -B-O-, формулой: -S-B-, формулой: -B-S- или формулой: -B- (где B - низшая алкиленовая или низшая алкениленовая группа).
, и эти конденсированные кольца могут быть замещены низшей алкильной группой, которая может быть замещена 1-3 атомами галогена, или аминогруппой, цианогруппой, нитрогруппой, гидроксильной группой, атомом галогена, низшей алкоксигруппой; D - низшая алкиленовая группа, которая может быть замещена атомом галогена, и A - группа, представленная формулой; -B-O-, формулой: -S-B-, формулой: -B-S- или формулой: -B- (где B - низшая алкиленовая или низшая алкениленовая группа).
Наиболее предпочтительным соединением является производное азола, его фармацевтически приемлемая соль, гидрат или сольват, в которых R1 и R2 могут быть одинаковыми или отличаться друг от друга, и каждый представляет собой атом водорода, циклоалкильную группу, низшую алкильную группу или фенильную группу, которая может быть замещена низшей алкильной группой, каждый из R3, R6 и R7 представляет собой атом водорода, R8 - атом галогена, R5 - атом водорода, D - метиленовую группу, X - атом серы, Y - метиновую группу (-CH= ), Z - атом кислорода, A - группу, представленную формулой: -CH2O-, и n = 2.
Настоящее изобретение относится также к фармацевтическому составу, который содержит производное азола, представленное вышеупомянутой общей формулой (I), его фармацевтически приемлемую соль, гидрат или сольват в качестве активного компонента, в частности, к антагонисту лейкотриена и тромбоксана A2.
Настоящее изобретение относится также к производному 2-гидроксианилина, представленному ниже общей формулой (IVc), или к его фармацевтически приемлемой соли, и к производному бензойной кислоты, представленному ниже формулой (IIIa), или к его фармацевтически приемлемой соли, которые полезны в качестве промежуточных продуктов для соединений, представленных вышеупомянутой формулой (I), или их фармацевтически приемлемых солей.
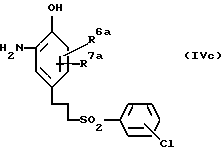
В вышеуказанной формуле R6a и R7a могут быть одинаковыми или отличаться друг от друга, и каждый представляет собой атом водорода или атом галогена.
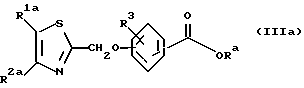
В этой формуле R1a и R2a могут быть одинаковыми или отличаться друг от друга, и каждый представляет собой атом водорода, циклоалкильную группу, низшую алкильную группу или фенильную группу, которая может быть замещена низшей алкильной группой, или R1a и R2a могут объединяться с кольцом 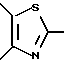 с образованием конденсированного кольца, представленного формулой:
с образованием конденсированного кольца, представленного формулой: 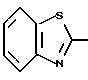 или формулой:
или формулой: 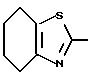 , и эти конденсированные кольца могут быть замещены низшей алкильной группой, которая может быть замещена 1-3 атомами галогена, или аминогруппой, цианогруппой, нитрогруппой, атомом галогена или низшей алкоксигруппой,
, и эти конденсированные кольца могут быть замещены низшей алкильной группой, которая может быть замещена 1-3 атомами галогена, или аминогруппой, цианогруппой, нитрогруппой, атомом галогена или низшей алкоксигруппой,
R3 представляет собой атом водорода, аминогруппу, цианогруппу, нитрогруппу, гидроксильную группу, атом галогена, низшую алкоксигруппу или низшую алкильную группу, и
Ra представляет собой атом водорода или низшую алкильную группу.
Ниже дается детальное описание данного изобретения.
В общих формулах данного изобретения термин "низший" обозначает прямую или разветвленную углеродную цепь, имеющую от 1 до 6 атомов углерода, если не оговорено иначе.
В результате иллюстративными примерами термина "низшая алкильная группа" являются метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, 1-метилбутил, 2-метилбутил, 1,2-диметилпропил, гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил и подобные группы. Предпочтительна алкильная группа, имеющая от 1 до 4 атомов углерода, и более предпочтительны метильная и этильная группы.
Заместитель в термине "низшая алкильная группа, которая может быть замещена", который использован здесь, может представлять даже обычный заместитель, которым могут быть замещены низшие алкильные группы, и иллюстрирующие его примеры включают атом галогена (например, хлор, бром, фтор и т.п.), гидроксильную группу, низшую алкоксильную группу (например, метоксигруппу, этоксигруппу, п-пропоксигруппу, изо-пропоксигруппу и подобные группы), арилоксигруппу (например, нафтилоксигруппу, феноксигруппу и подобные группы), аралкилоксигруппу (например, бензилоксигруппу, фенэтилоксигруппу и подобные группы), меркаптогруппу, низшую алкилтиогруппу (например, метилтиогруппу, этилтиогруппу или подобные группы), арилтиогруппу (например, фенилтиогруппу, нафтилтиогруппу или подобные группы), аралкилтиогруппу (например, бензилтиогруппу, фенетилтиогруппу или подобные группы), аминогруппу, моно- или дизамещенную аминогруппу, замещенную низшей алкильной группой (например, метиламиногруппу, этиламиногруппу, диметиламиногруппу, диэтиламиногруппу или подобные группы), низшую алкоксикарбонильную группу (например, метоксикарбонил, этоксикарбонил или подобные группы), низшую ацильную группу (например, формил, ацетил, пропионил, бензоил или подобные группы), ацилоксигруппу (например, ацетоксигруппу, пропионилоксигруппу или подобные группы), карбоксильную группу, карбамоильную группу и арильную группу, которая может быть замещена, и от 1 до 5, предпочтительно от 1 до 3 атомов водорода низшей алкильной группы, необязательно, могут быть замещены этими группами.
Примерами, иллюстрирующими "циклоалкильную группу", являются насыщенные углеводородные циклические группы, имеющие от 3 до 8 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и подобные группы, из которых предпочтительной является циклоалкильная группа, содержащая от 3 до 7 атомов углерода.
"Арильная группа" означает углеводородную циклическую арильную группу, и иллюстрирующие ее примеры включают фенил, нафтил и подобные группы.
Примеры заместителя в "арильной группе, которая может быть замещена", включают аминогруппу, цианогруппу, нитрогруппу, гидроксильную группу, атом галогена, низшую алкоксильную группу и вышеупомянутую низшую алкильную группу, которая может быть замещена.
Примерами "атома галогена" являются фтор, хлор, бром и т.п.
Примерами "низшей алкоксильной группы" являются метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, пентилоксигруппа (амилоксигруппа), изопентилоксигруппа, трет-пентилоксигруппа, неопентилоксигруппа, 2-метилбутоксигруппа, 1,2-диметилпропоксигруппа, 1-этилпропоксигруппа, гексилоксигруппа и подобные группы.
Примерами "сложноэфирного остатка" являются эфирные остатки, такие как низший алкил, аралкил (бензил, фенетил, 1-нафтилметил или подобные) и подобные группы, или эфирные остатки, гидролизованные путем метаболизма в живом организме, такие как (низшая алканоилокси-)низшая алкильная группа (ацетилоксиметил, ацетилоксиэтил, трет-бутаноилоксиметил или подобные группы), (низшая алкеноил-)низшая алкильная группа (винилкарбонилметил, винилкарбонилэтил или подобные группы), (циклоалкилкарбонилокси-)низшая алкильная группа (циклопропилкарбонилоксиметил, циклобутилкарбонилоксигруппа, циклопентилкарбонилоксиметил или подобные группы), (низшая алкеноилокси-)низшая алкильная группа (винилкарбонилоксиметил, винилкарбонилоксиэтил или подобные группы), (низшая алкокси-)низшая алкильная группа (метоксиметил, метоксиэтил, этоксиметил или подобные группы), (низшая алкокси-)низшая алкильная группа (метоксиметоксиметил или подобные группы), (низшая алкоксикарбонилокси-)низшая алкильная группа (метоксикарбонилоксиметил, этоксикарбонилметил, трет-бутоксикарбонилоксиметил или подобные группы), бензоилокси-низшая алкильная группа (бензоилоксиметил, бензоилоксиэтил или подобные группы), 2-оксотетрагидрофуран-5-ильная группа, 2-оксо-5-(низший алкил)-1,3-диоксолен-4-илметильная группа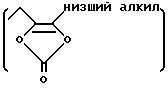
"низшая алкильная группа" в этой формуле, предпочтительно представляет собой метил, этил, пропил, изопропил, бутил или подобные группы), тетрагидрофуранилкарбонилоксиметильная группа, фталидильная группа и подобные группы.
Предпочтительными среди этих групп являются низшая алкильная, аралкильная, (низшая алканоилокси-)низшая алкильная, фталидильная, 2-оксо-5-(низший алкил)-1,3-диоксолен-4-илметильная и (низшая алкоксикарбонилокси-)низшая алкильная группы. Наиболее предпочтительны низшие алкильные группы, такие как метил, этил, пропил, изопропил, бутил и подобные группы.
"Низшей алкиленовой группой" является алкиленовая группа, имеющая от 1 до 6 атомов углерода, и иллюстрирующие ее примеры включают метилен, этилен, метилметилен 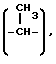 триметилен, пропилен
триметилен, пропилен 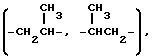 диметилметилен
диметилметилен 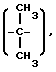 тетраметилен, 1-метилтриметилен, 2-метилтриметилен, 3-метилтриметилен,
тетраметилен, 1-метилтриметилен, 2-метилтриметилен, 3-метилтриметилен, 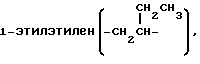
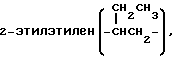
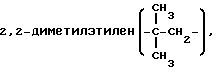
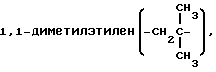
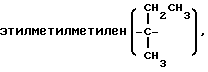 пентаметилен, 1-метилтетраметилен, 2-метилтетраметилен, 3-метилтетраметилен, 4-метилтетраметилен, 1,1-диметилтриметилен, 2,2-диметилтриметилен, 3,3-диметилтриметилен, 1,3-диметилтриметилен, 2,3-диметилтриметилен, 1,2-диметилтриметилен, 1,1,2-триметилэтилен, диэтилметилен, гексаметилен, 1-метилпентаметилен, 1,1-диметилтетраметилен, 2,2-диметилтетраметилен и подобные группы. Предпочтительны алкиленовые группы, имеющие от 1 до 3 атомов углерода, такие как метилен, этилен, пропилен, метилметилен и диметилметилен и метиленовая группа более предпочтительна.
пентаметилен, 1-метилтетраметилен, 2-метилтетраметилен, 3-метилтетраметилен, 4-метилтетраметилен, 1,1-диметилтриметилен, 2,2-диметилтриметилен, 3,3-диметилтриметилен, 1,3-диметилтриметилен, 2,3-диметилтриметилен, 1,2-диметилтриметилен, 1,1,2-триметилэтилен, диэтилметилен, гексаметилен, 1-метилпентаметилен, 1,1-диметилтетраметилен, 2,2-диметилтетраметилен и подобные группы. Предпочтительны алкиленовые группы, имеющие от 1 до 3 атомов углерода, такие как метилен, этилен, пропилен, метилметилен и диметилметилен и метиленовая группа более предпочтительна.
"Моно- или ди-(низший алкил)карбомоильная группа" в R10 означает группу, в которой 1 или 2 атома водорода карбамоильной группы замещены вышеупомянутой низшей алкильной группой, и ее предпочтительными примерами являются моно- или ди-C1-4-алкилкарбамоильные группы, например, метилкарбамоил, этилкарбамоил, пропилкарбамоил, изопропилкарбамоил, диметилкарбамоил и диэтилкарбамоил.
"Низшая алкоксикарбонильная группа" означает группу, в которой вышеупомянутая низшая алкоксильная группа соединена с карбонильной группой, такую как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, неопентилоксикарбонил, трет-пентилоксикарбонил и гексилоксикарбонил.
Арилкарбонильная группа "арилкарбонильной группы, которая может быть замещена низшей алкильной группой" означает углеводородную циклическую арилкарбонильную группу, и ее примерами являются бензоил и нафтоил.
Эти арилкарбонильные группы могут быть замещены вышеупомянутой низшей алкильной группой, и в этом случае они могут быть замещены, предпочтительно, алкильной группой, имеющей от 1 до 3 атомов углерода, что приводит к образованию 2-метилбензоила, 3-метилбензоила, 4-метилбензоила, 2-этилбензоила, 3-этилбензоила, 4-этилбензоила, 1-нафтоила, 2-нафтоила и подобных групп.
Примеры "низшей алканоильной группы" включают формил, ацетил, пропионил, бутилил, изобутилил, валерил, изовалерил, пивалоил и подобные группы. Предпочтительными из них являются формильная, ацетильная и пропионильная группы.
"Низшая алкилсульфонильная группа" означает группу, в которой сульфонильная группа соединена с вышеупомянутой низшей алкильной группой, и иллюстрирующие ее примеры включают метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, пентилсульфонил, гексилсульфонил и подобные группы. Предпочтительной является алкилсульфонильная группа, имеющая от 1 до 3 атомов углерода.
Арилсульфонильная группа в "арилсульфонильной группе, которая может быть замещена низшей алкильной группой" означает углеводородную циклическую арилсульфонильную группу, и ее примерами являются фенилсульфонил и нафтилсульфонил. Эти арилсульфонильные группы могут быть замещены вышеупомянутой низшей алкильной группой. В этом случае они могут быть, предпочтительно, замещены алкильной группой, имеющей от 1 до 3 атомов углерода, что приводит, например, к образованию 2-метилфенилсульфонила, 3-метилфенилсульфонила, 4-метилфенилсульфонила, 2-этилфенилсульфонила, 3-этилфенилсульфонила, 4-этилфенилсульфонила, 2-пропилфенилсульфонила, 3-пропилфенилсульфонила и 4-пропилфенилсульфонила.
Низшая алкиленовая группа "низшей алкиленовой группы, которая может быть замещена" в D является такой группой, определение которой дано выше. Примерами ее заместителей являются атом галогена, гидроксильная группа и низшая алкоксигруппа.
"Низшая алкиленовая группа" в B такова, как это определено выше, и примерами "низшей алкиленовой группы" в B являются винилен, пропенилен (-CH2-CH= CH-, -CH=CH-CH2-), бутенилен (-CH2-CH2-CH=CH-, -CH2-CH=CH-CH2, -CH= CH-CH2-CH2-) и подобные группы. Предпочтительной из них является виниленовая группа.
Соединения настоящего изобретения, представленные общей формулой (I), образуют соли. Соли соединений (I) входят в данное изобретение, и примерами, иллюстрирующими эти соли, являются соли присоединения кислот, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные кислоты, и с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота и т.п., а также с кислыми аминокислотами, такими как аспарагиновая кислота, глутаминовая кислота и подобные кислоты.
Примерами основных солей этих соединений являются их соли с неорганическими основаниями, такие как соли натрия, калия, магния, кальция, алюминия и т.п., и с органическими основаниями, такими как метиламин, этиламин, этаноламин, и основными аминокислотами (например, лизином, аргинином, орнитином и т.п.), а также соль аммония.
Соединение (I) настоящего изобретения может иметь также асимметричный атом углерода, двойную связь и т.п., в некоторых случаях, в зависимости от типа заместителя, так что соединение может находиться в форме стереоизомеров, таких как оптические изомеры, геометрические изомеры и т.п.
В результате, эти стереоизомеры входят в данное изобретение или в форме отдельных стереоизомеров, или в виде смесей.
Кроме того, в данное изобретение также входят гидраты, различные сольваты и кристаллические полиморфы соединения (I).
Соединения данного изобретения можно синтезировать, например, с помощью следующих методов.
Метод получения 1 (см. в конце описания).
В формулах метода 1: P1 - атом галогена или остаток органического сульфоната, P2 - гидроксильная группа, атом галогена или остаток органического сульфоната, R3a - атом водорода, атом галогена, низшая алкоксильная группа, низшая алкильная группа, которая может быть замещена, цианогруппа, нитрогруппа, защищенная гидроксильная группа или защищенная аминогруппа, и R9a - остаток сложного эфира. Те же обозначения будут использованы и в дальнейшем.
На первой стадии метода 1 карбоновая кислота, представленная общей формулой (III), или ее реакционноспособное производное и амин, представленный формулой (IV), или его соль подвергаются амидированию обычным способом с получением соединения, представленного общей формулой (V).
В этой связи примерами защитных групп для аминогруппы, обозначенных через R3a, являются п-нитробензил, бензил, бензгидрил, п-нитробензилоксикарбонил и подобные группы. Примерами защитных групп для гидроксильной группы являются арилметоксигруппа, такая как бензилоксигруппа и т.п., ацилоксигруппа, например, бензоилоксигруппа, низшая алканоилоксигруппа или подобные группы, и триалкилсилильная группа.
Примерами реакционноспособных производных соединения (III) являются галоидангидриды, такие как хлорангидрид и бромангидрид; азидкислоты; активные сложные эфиры 1-гидроксибензотриазола, N-гидроксисукцинимида и подобные эфиры; симметричный ангидрид кислоты; и смешанные ангидриды с алкилкарбоновой кислотой, п-толуолсульфоновой кислотой и подобные ангидриды.
Когда соединение (III) вводят в реакцию в виде свободной карбоновой кислоты, удобно выполнять реакцию в присутствии конденсирующего агента, например, дициклогексилкарбодиимида (DCC), 1-этил-3-(3'-диметиламинопропил)карбодиимида, 1,1'-карбонилдиимидазола или подобных соединений.
Реакция выполняется с использованием соединения (III) или его реакционноспособного производного и соединения (IV) при почти эквимолярном соотношении реагентов или при избытке одного из них, в органическом растворителе, который инертен при реакции, например, пиридине, тетрагидрофуране, диоксане, эфире, бензоле, толуоле, ксилоле, дихлорметане, дихлорэтане, хлороформе, диметилформамиде (ДМФА), этилацетате, ацетонитриле, или в подобном растворителе.
В зависимости от типа реакционноспособного производного, в некоторых случаях выгодно добавлять основание, например, триэтиламин, пиридин, пиколин, лютидин, N, N-диметиланилин, карбонат калия, гидроксид натрия или подобное основание, с целью проведения плавно протекающей реакции. В качестве растворителя также можно использовать пиридин.
Также в зависимости от типа растворителя, например, когда используется сильнополярный растворитель, такой как ДМФА, плавно протекающую реакцию можно осуществить, добавляя, заблаговременно, в реакционную смесь равные или большие количества N-гидроксисукцинимида или N-гидроксибензотриазола.
Температура реакции изменяется в зависимости от типа реакционноспособного производного и выбирается произвольно.
На второй стадии получают соединение (Ia) данного изобретения, подвергая амидное соединение (V), полученное на первой стадии, галогенированным алкильным соединением или подобным соединением, представленным общей формулой (VI).
Этерификацию выполняют, подвергая реакции замещения соединение (V) и галогенид (или сульфонат) (VI) в присутствии основания.
В этой связи примерами атома галогена, обозначенного R1 или R2, являются иод, бром, хлор, фтор и т.п., а примерами остатка органического сульфоната являются алкилсульфонилоксигруппы (например, метансульфонилоксигруппа, этансульфонилоксигруппа и подобные группы) и арилсульфонилоксигруппы (например, бензолсульфонилоксигруппы, толуол (в особенности, п-толуол)сульфонилоксигруппа и подобные группы).
Когда в качестве соединения (VI) используется галогенид, предпочтительно реакцию выполнять, используя соединение (V) и соединение (VI) при почти эквимолярном соотношении или при избытке одного из них, при температуре от комнатной до температуры нагревания или при температуре кипения с обратным холодильником, в органическом растворителе, инертном в данной реакции, например, N, N-диметилформамиде, диметилсульфоксиде, ацетоне, метилэтилкетоне, метаноле, этаноле, изопропаноле, дихлорметане, дихлорэтане, хлороформе, эфире, тетрагидрофуране, диоксане или в подобном растворителе, или в воде, или в смеси этих растворителей.
В некоторых случаях реакцию можно выполнять плавно путем добавления вторичного или третичного основания, например, пиридина, пиколина, N,N-диметиланилина, N-метилморфолина, триметиламина, триэтиламина, диметиламина или подобного или неорганического основания, например, гидрида натрия, гидроксида натрия, гидроксида калия, н-бутиллития, третбутилата калия, карбоната калия, карбоната натрия, бикарбоната натрия или подобного основания.
Когда в качестве соединения (VI) используется сульфонат, реакцию желательно выполнять в растворителе, инертном в реакции, как описано выше, в количествах, описанных выше, и при охлаждении до комнатной температуры.
На третьей стадии соединение (Ib) данного изобретения получают путем гидролиза сложноэфирной группы соединения (Ia) данного изобретения, полученного на второй стадии.
При этой реакции может быть использован обычный метод, при котором гидролиз выполняется в присутствии основания, например, карбоната натрия, гидроксида натрия или подобного основания, или в присутствии кислоты, например, трифторуксусной кислоты, хлористоводородной кислоты или подобных кислот. Желательно осуществлять реакцию при температуре от комнатной до 100oC.
На четвертой стадии соединение (Ia) данного изобретения получают путем этерификации соединения (Ib) данного изобретения, которое представляет собой карбоновую кислоту. Эту стадию выполняют с помощью обычного способа этерификации с использованием таких агентов этерификации как спирт или его галогенид, сульфат, диазосоединение, или подобных агентов, которые хорошо известны специалистам, включая необходимую защиту, депротекцию, гидролиз, восстановление и т.п.
Кроме того, сульфинильные или сульфонильные соединения, как представители соединения данного изобретения, могут быть получены путем окисления соответствующих сульфидных или сульфинильных соединений обычным способом.
Метод получения 2 (см. в конце описания).
В формуле метода 2: P1 - низшая алкильная группа или арильная группа. То же обозначение будет использовано в дальнейшем.
В методе получения 2 соединение (Ic) данного изобретения получают путем реакции соединения, представленного общей формулой (V), i) с цианосоединением, представленным формулой (VIII), и затем ii) с азидом триалкилолова, азидом триарилолова или азидом натрия, представленными общей формулой (IX).
При использовании цианосоединения i) может быть применен инертный при данной реакции растворитель, описанный в первой стадии метода получения 1, при тех же условиях реакции.
При реакции соединения ii) синтез может быть осуществлен путем проведения реакции при температуре от комнатной до температуры кипения с обратным холодильником в течение от нескольких суток до нескольких часов, в инертном растворителе, например, бензоле, толуоле или в подобном растворителе, в присутствии азида триалкилолова или азида триарилолова. Синтез может быть также выполнен в течение от нескольких часов до нескольких суток при перемешивании при температуре от комнатной до температуры кипения с обратным холодильником, в диметилформамиде, в присутствии азида натрия и хлорида аммония.
Метод получения 3 (см. в конце описания).
В методе получения 3 соединение (Ie) данного изобретения получают путем реакции соединения (Id) данного изобретения с аммиаком (X).
Соединение (Ie) данного изобретения получают, осуществляя реакцию с использованием соединения (Id) и соединения (X) в эквимолярном соотношении или при избытке одного из них, при охлаждении льдом, или при комнатной температуре до охлаждения льдом или при кипячении с обратным холодильником, в органическом инертном растворителе, например, метаноле, этаноле, тетрагидрофуране, эфире, диоксане, 2-пропаноле, бензоле, толуоле, ксилоле, N,N-диметилформамиде, диметилсульфоксиде, дихлорметане, хлороформе, пиридине или в подобном растворителе, или в воде, или в смесях этих растворителей.
С другой стороны, соединение (Ie) данного изобретения синтезируют из соединения (Ib) путем обычной реакции амидирования, описанной в первой стадии метода получения 1, или из соединения (V) и соединения формулы: P1-D-CONH2 (где P1 - атом галогена (хлор, бром или иод) или остаток органического сульфоната) таким же способом, как и в случае второй стадии метода получения 1.
Метод получения 4 (см. в конце описания).
В формулах метода 4: R12 - группа, от которой может произойти аминогруппа. То же обозначение будет применено и далее.
В методе получения 4 соединения (If) и (Ig) данного изобретения получают, подвергая амин или его соль (IVb), которые получены этерификацией фенольного производного, представленного общей формулой (IVa), и последующим восстановлением - амидированием соединением (III), с последующим превращением в аминогруппу, N-алкилированию, N-ацетилированию и N-алкилсульфонилированию.
На первой стадии получают аминопроизводное, представленное общей формулой (IVb), i) подвергая этерификации фенольное производное, представленное формулой (IVa), соединением (XI), и ii) восстановлением, затем, нитрогруппы.
В этой связи, фталимидная группа и подобная группа может служить в качестве примера группы, обозначенной R12, из которой можно получить аминогруппу.
Этерификация i) может быть выполнена таким же способом, как на второй стадии метода получения 1, если P2 - атом галогена или остаток органического сульфоната.
Когда P2 - гидроксильная группа, реакция может быть выполнена при температурах от охлаждения льдом до температуры кипения с обратным холодильником, в таком растворителе, как тетрагидрофуран (ТГФ), диэтиловый эфир, диоксан, бензол, толуол, ксилол, N,N-диметилформамид, ацетонитрил, этилацетат, или в подобном растворителе, в присутствии фосфорного соединения, представленного формулой R3P, и соединения, представленного формулой: R13OCO-N= N-COOR13 (где R - низшая алкильная или арильная группа, и R13 - низшая алкильная группа).
Восстановление нитрогруппы ii) может быть выполнено обычным способом.
На второй стадии соединение (XII) получают путем амидирования амина соединения (IVb) вышеупомянутым соединением (III), что можно выполнить таким же способом, как в случае первой стадии метода получения 1.
На третьей стадии соединение (If) данного изобретения получают путем реакции соединения (XII) с гидразином, фенилгидразином, низшим алкиламином или подобным соединением, посредством чего аминогруппу получают из группы, способной дать аминогруппу. Эта реакция может быть выполнена с использованием соединения (XII) и гидразина, фенилгидразина, низшего алкиламина или подобного соединения при эквимолярном соотношении или при использовании избытка одного из них, при температуре от температуры при охлаждении льдом до температуры кипения с обратным холодильником, в инертном органическом растворителе, например, метаноле, этаноле, 2-пропаноле, тетрагидрофуране (ТГФ), диоксане, эфире, N,N-диметилформамиде, бензоле, толуоле, ксилоле, или в подобном растворителе.
На четвертой стадии соединение (Ig) данного изобретения получают, подвергая соединение (If) обычной реакции N-алкилирования, ацилирования или сульфонилирования. Эта стадия может быть применена для упомянутого выше соединения (Ie).
Метод получения 5 (см. в конце описания).
В методе получения 5 соединение (Ih) данного изобретения получают путем реакции соединения (V) с соединением (XIII).
Реакция при этом методе получения может быть выполнена таким же способом, как в случае второй стадии метода получения 1.
С другой стороны, соединение (Ih) данного изобретения может быть синтезировано из соединения (Ib) данного изобретения путем обычной реакции амидирования, как на первой стадии метода получения 1.
Метод получения 6 (см. в конце описания).
В формулах метода 6: R10a является группой R10 иной, чем атом водорода. То же обозначение будет применено далее.
В методе получения 6 соединение (Ii) данного изобретения получают путем реакции соединения (Ib) данного изобретения или его реакционноспособного производного с аминосоединением (XIV).
Реакция может быть выполнена таким же способом, как в случае первой стадии метода получения 1.
Метод получения 7 (см. в конце описания).
В методе получения 7 соединение (Ij) данного изобретения получают путем реакции соединения (Ib) данного изобретения или его реакционноспособного производного с сульфонамидным производным, представленным формулой (XV), или подобным соединением.
Реакцию выполняют, используя соединение (Ib) или его реакционноспособное производное и соединение (XV) в эквимолярном соотношении или при небольшом избытке одного из них, при температуре от охлаждения льдом или от комнатной температуры, до температуры кипения с обратным холодильником, в присутствии органического основания, например, 4-(диметиламино)пиридина или подобного основания, или в присутствии неорганического основания, например, гидроксида натрия, гидрида калия или подобного основания, и, в определенных случаях, при добавлении соответствующего дегидратирующего агента (например, дициклокарбодиимида или 1-(3-диметиламинопропил)-3-этилкарбодиимида, или его гидрохлорида или гидробромида).
В качестве инертного при реакции органического растворителя можно использовать, например, пиридин, ТГФ, диоксан, диэтиловый эфир, бензол, толуол, ксилол, дихлорметан, дихлорэтан, хлороформ, ДМФА, этилацетат, ацетонитрил или подобный растворитель.
Метод получения 8 (см. в конце описания).
В методе получения 8 соединение (Im), имеющее тиокарбонильную группу, получают из соединения (Il), имеющего карбонильную группу. Эту реакцию выполняют, позволяя реагировать соединению (Il) с фосфорным соединением (например, дифосфопентасульфидом или [2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфоэтан-2,4-дисульфидом] , в количествах, соответствующих данной реакции, при температуре от комнатной до температуры кипения с обратным холодильником, в инертном растворителе, например, 1,2-диметоксиэтане, хлороформе, бензоле или в подобном растворителе. В некоторых случаях выгодно добавлять неорганическое основание, например, бикарбонат натрия или подобное основание для того, чтобы реакция протекала плавно.
Метод получения 9 (см. в конце описания).
В формулах метода 9 R5a - низшая алкильная группа.
В методе получения 9 соединение (Io) получают, подвергая соединение (In) реакции N-алкилирования.
Реакцию выполняют при перемешивании амидосоединения (In) и алкилирующего агента (например, галогеноалкана) в количествах, соответствующих данной реакции, в инертном растворителе, например, ДМФА, диметилсульфоксиде, бензоле или в подобном растворителе, при комнатной температуре или при нагревании, в присутствии органического основания, например, 4-(диметиламино)пиридина или подобного основания, или неорганического основания, например, гидроксида натрия, гидрида калия или подобного основания.
Метод получения 10
Кроме описанных выше методов получения соединений данного изобретения, можно использовать модификации методов, хорошо известных специалистам. Например, другие, представляющие интерес соединения данного изобретения могут быть получены с помощью модифицированного метода получения 1, при котором исходному соединению (IV) позволяют реагировать с соединением, из которого группу D-P4 можно получить с помощью процедуры, сходной с процедурой второй стадии метода получения 1, и затем подвергнуть полученное производное соединения IV реакции амидирования с производным соединения (III) и, если необходимо, затем удалить защитную группу путем гидролиза, восстановления или способом, подобным вышеописанному.
Удаление защитной группы
Когда R3a соединений (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii) и (Ij) данного изобретения, полученных каждым из вышеприведенных методов, является защищенной гидроксильной группой или защищенной аминогруппой, защитная группа удаляется как только в ней отпадает необходимость.
Удаление группы, защищающей гидроксильную группу, может быть выполнено 1) гидролизом в присутствии кислоты или основания, 2) восстановлением жидким аммиаком, 3) каталитическим восстановлением с использованием палладия-на-угле или гидроксида палладия-на-угле или 4) десилилированием с использованием фторорганического соединения, например, тетра-н-бутиламмонийфторида или подобного соединения, или с использованием фторсодержащего неорганического соединения, например, фторида натрия, фторида калия, фтористоводородной кислоты.
Гидролизом 1) может быть обычный метод, при котором гидролиз выполняют в присутствии основания, например, карбоната натрия, гидроксида натрия или подобного основания, или в присутствии кислоты, например, трифторуксусной кислоты, хлористоводородной кислоты или подобной кислоты. Предпочтительно, реакцию проводят при температуре от температуры при охлаждении льдом до 100oC.
Метод восстановления 2) может быть выполнен путем добавления соединения, имеющего группу, защищающую гидроксильную группу, к жидкому аммиаку, с добавлением металлического натрия и перемешиванием, затем смеси.
Метод восстановления 3) может быть выполнен при температуре при охлаждении льдом и до температуры при нагревании в присутствии катализатора, например, палладия-на-угле или гидроксида палладия-на-угле.
Метод десилилирования 4) может быть выполнен путем реакции соединения, имеющего группу, защищающую гидроксильную группу, с фторорганическим соединением, таким как тетра-н-бутиламмонийфторид или подобным соединением, или неорганическим соединением фтора, таким как фторид натрия, фторид калия, фтористоводородная кислота или подобным соединением, в инертном для реакции растворителе, например, тетрагидрофуране, дихлорметане, ДМФА, бензоле или подобном растворителе.
Удаление группы, защищающей аминогруппу, может быть выполнено 1) путем восстановления с использованием цинка или железа, 2) восстановлением жидким аммиаком, 3) каталитическим восстановлением с использованием палладия-на-угле.
Метод восстановления 1) может быть выполнен путем добавления соединения, имеющего группу, защищающую аминогруппу, к буферному раствору (если необходимо, добавляется инертный растворитель), последующего добавления цинка в количестве, соответствующем данной реакции или в избыточном количестве, с последующим перемешиванием смеси при температуре от охлаждения льдом и температуры при нагревании.
Метод восстановления 2) может быть выполнен путем добавления соединения, имеющего группу, защищающую аминогруппу, к жидкому аммиаку, добавления металлического натрия и последующего перемешивания смеси.
Метод восстановления 3) может быть выполнен при охлаждении льдом и при нагревании в присутствии катализатора, например, палладия-на-угле или гидроксида палладия-на-угле.
Время реакции выбирается произвольно, в зависимости от условий реакции для исходных соединений, реагентов и т.п., но обычно оно составляет от нескольких десятков минут до нескольких десятков часов, предпочтительно - от нескольких десятков минут до нескольких часов.
Исходные материалы для получения соединений данного изобретения могут быть легко получены с использованием обычных методов, известных специалистам в данной области. Типичные методы получения описаны ниже.
Метод получения соединения (IV) (см. в конце описания).
Обозначения в формулах метода получения соединения IV имеют установленные выше значения.
Спиртовое соединение (d) получают, подвергая этерификации соединение (a) обычным способом, чтобы защитить фенольную гидроксильную группу метоксиметильной группой, и затем восстанавливая эфир. Обычным способом его превращают в эфир метансульфоновой кислоты, который затем вводят в реакцию с бензолтиолом, причем посредством этого получают соединение (f). После окисления сульфидной группы, когда это необходимо, метоксиметильная группа удаляется обычным способом, после чего нитрогруппа восстанавливается до аминогруппы, и в результате образуется соединение (IV) (R5 = H в этом случае).
Метод получения соединения III (см. в конце описания).
В формулах метода получения соединения III: B, R1 и R2 обозначают то же, что и раньше, Rb - низшая алкильная группа.
Соединению (j) позволяют реагировать с соединением (i), а затем с диэтиловым эфиром дитиофосфорной кислоты (m), что дает соединение (n), которое затем реагирует с бромкетоном (p), причем посредством этого получают соединение (IIIb). Это соединение затем обычным способом гидролизуют, и получают соединение (IIIc).
Соединение (III) можно получить также с помощью обычной реакции этерификации или тиоэтерификации. Соединение, в котором A имеет формулу: -CH=CH-, может быть получено с помощью метода, описанного в не прошедшей экспертизу опубликованной заявке на патент Японии (Kokai) N 63-258854. Путем восстановления этого соединения можно получить соединение, в котором A представляет собой этиленовую группу.
Соединение данного изобретения, полученное таким образом, выделяют и очищают в виде свободного соединения, его соли, гидрата, различных сольватов, например, в виде сольвата с этанолом, и т.п., или в виде полиморфного материала. Фармацевтически приемлемую соль соединения (I) можно также получить, подвергая соединение общепринятой реакции солеобразования.
Выделение и очистку выполняют, используя обычные методы химической обработки, например, экстракцию, фракционную кристаллизацию, различные виды фракционной хроматографии и подобные методы.
Различные изомеры можно разделить, используя различия физико-химических свойств изомеров.
Кроме того, оптические изомеры можно получать в стереохимически чистой форме путем отбора соответствующих исходных соединений или путем рацемического расщепления рацемических смесей соединений (например, с помощью метода, при котором соединение превращают в соль диастереомера с обычной оптически активной кислотой или основанием, а затем ее подвергают оптическому расщеплению).
Ниже даются примеры соединений, которые могут быть синтезированы с помощью вышеприведенных методов получения, методов получения, которые будут описаны позднее в примерах, и с помощью различных модификаций этих методов, известных специалистам в данной области, не требующих специальных экспериментов.
A1) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[2-[2-(4-метил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A2) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[2-[2-(5-этил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A3) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[2-[(5-фенил-2- тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A4) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[2-[(4-фенил-2- тиазолил)тиометил]бензоиламино]феноксиуксусная кислота.
A5) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[2-[(5-фенил-2- тиазолил)метилтио]бензоиламино]феноксиуксусная кислота.
A6) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(5-метил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A7) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(4-пропил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A8) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(5-фенил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A9) 3-[3-[2-(5-трет-бутил-2-тиазолил)винил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A10) 4-[3-(4-хлорфенилсульфонил)пропил]-2-[3-[2-(5-циклогексил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A11) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(4-циклопентил-2- тиазолил)оксиметил]бензоиламино]феноксиуксусная кислота.
A12) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(5-метил-2- тиазолил)оксиметил]бензоиламино]феноксиуксусная кислота.
A13) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(4-фенил-2- тиазолил)оксиметил]бензоиламино]феноксиуксусная кислота.
A14) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(5-фенил-2- тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A15) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(5-этил-2- тиазолил)метокси]бензоиламино)феноксиуксусная кислота.
A16) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(5-метил-2- тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A17) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(4-пропил-2- тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A18) 4-[3-(4-хлорфенилсульфонил)пропил]-2-[3-[[4-(4-метилфенил)-2- тиазолил]метокси]бензоиламино]феноксиуксусная кислота.
A19) 2-[3-[(5-трет-бутил-2-тиазолил)метокси]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A20) 2-[3-[(5-циклобутил-2-тиазолил)метокси]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A21) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(5-фенил-2- тиазолил)тиометил]бензоиламино]феноксиуксусная кислота.
A22) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(5-изопропил-2- тиазолил)метилтио]бензоиламино]феноксиуксусная кислота.
A23) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(5-фенил-2- тиазолил)метилтио]бензоиламино]феноксиуксусная кислота.
A24) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[2-(4-фенил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A25) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[2-(5-фенил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A26) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[2-(4-изопропил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A27) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[2-(5-метил-2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A28) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[(5-фенил-2- тиазолил)оксиметил]бензоиламино]феноксиуксусная кислота.
A29) 2-[4-[(4-трет-бутил-2-тиазолил)оксиметил] бензоиламино]- 4-[3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A30) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[(4-фенил-2- тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A31) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[(5-фенил-2- тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A32) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[(4-изопропил-2- тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A33) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[(5-метил-2- тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A34) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[(5-изопропил-2- тиазолил)тиометил]бензоиламино]феноксиуксусная кислота.
A35) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[(5-фенил-2- тиазолил)метилтио]бензоиламино]феноксиуксусная кислота.
A36) 4-[3-(4-хлорфенилсульфонил)пропил]-2-[3-[2-(2- тиазолил)винил]бензоиламино]феноксиуксусная кислота.
A37) 4-[3-(4-хлорфенилсульфонил)пропил]-2-[3-[(2- тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A38) 3-[(4-циклобутил-2-тиазолил)метилтио] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A39) 2-[3-[2-(4-циклобутил-2-тиазолил)этил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A40) 2-[3-[(4-циклобутил-2-тиазолил)метилтио] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A41) 2-[3-[2-(4-трет-бутил-2-тиазолил)этил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетамид.
A42) 2-[3-[(4-трет-бутил-2-тиазолил)метилтио] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетамид.
A43) 2-[3-[(4-циклобутил-2-тиазолил)метокси]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетамид.
A44) 2-[3-[2-(4-циклобутил-2-тиазолил)этил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетамид.
A45) 2-[3-[(4-циклобутил-2-тиазолил)метилтио] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетамид.
A46) 2-[2-[2-(5-хлор-2-бензотиазолил)винил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A47) 2-[2-[2-(2-бензотиазолил)винил] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A48) 2-[2-[(5-хлор-2-бензотиазолил)метокси]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A49) 2-[2-[(2-бензотиазолил)тиометил] бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A50) 2-[2-[(5-бром-2-бензотиазолил)метилтио]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A51) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(5-фтор-2- бензотиазолил)винил]бензоиламино]феноксиуксусная кислота.
A52) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(7-фтор-2- бензотиазолил)винил]бензоиламино]феноксиуксусная кислота.
A53) 2-[3-[2-(4-хлор-2-бензотиазолил)винил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A54) 2-[3-[2-(6-хлор-2-бензотиазолил)винил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A55) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(5-трифторметил-2- бензотиазолил)винил]бензоиламино]феноксиуксусная кислота.
A56) 2-[3-[(2-бензотиазолил)оксиметил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A57) 2-[3-[(5-хлор-2-бензотиазолил)оксиметил] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A58) 2-[3-[(6-хлор-2-бензотиазолил)оксиметил] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A59) 2-[3-[(4-хлор-2-бензотиазолил)метокси] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A60) 2-[3-[(6-хлор-2-бензотиазолил)метокси] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A61) 2-[3-[(5-бром-2-бензотиазолил)тиометил] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A62) 2-[3-[(5-хлор-2-бензотиазолил)метилтио] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A63) 2-[3-[(2-бензотиазолил)метилтио] бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A64) 2-[3-[(2-бензоксазолил)оксиметил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A65) 2-[3-[(2-бензоксазолил)тиометил] бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A66) 2-[3-[2-(2-бензоксазолил)винил] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A67) 2-[3-[(5-хлор-2-бензоксазолил)оксиметил] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A68) 2-[3-[2-(5-хлор-2-бензоксазолил)винил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A69) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[2-(4-фтор-2- бензотиазолил)винил]бензоиламино]феноксиуксусная кислота.
A70) 2-[4-[2-(5-бром-2-бензотиазолил)винил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A71) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[2-(7-фтор-2- бензотиазолил)винил]бензоиламино]феноксиуксусная кислота.
A72) 4-[3-(4-хлорфенилсульфонил)пропил]-2-[4-[2-(5-трифторметил-2- бензотиазолил)винил]бензоиламино]феноксиуксусная кислота.
A73) 2-[4-[(5-хлор-2-бензотиазолил)оксиметил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A74) 2-[4-[(6-хлор-2-бензотиазолил)оксиметил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A75) 2-[4-[(4-хлор-2-бензотиазолил)метокси]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A76) 4-[3-(4-хлорфенилсульфонил)пропил]-2-[4-[(6-трифторметил-2- бензотиазолил)метокси]бензоиламино]феноксиуксусная кислота.
A77) 2-[4-[(5-хлор-2-бензотиазолил)тиометил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A78) 2-[4-[(5-хлор-2-бензотиазолил)метилтио]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A79) 2-[4-[(2-бензоксазолил)оксиметил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A80) 2-[4-[(2-бензоксазолил)тиометил] бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A81) 2-[4-[2-(2-бензоксазолил)винил] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A82) 2-[4-[(5-хлор-2-бензоксазолил)оксиметил] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A83) 2-[4-[2-(5-бром-2-бензоксазолил)винил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A84) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[2-[2-(4-фтор-2- бензотиазолил)винил]бензоиламино]феноксиуксусная кислота.
A85) 4-[3-(4-хлорфенилсульфонил)пропил]-2-[2-[(5-метокси-2- бензоксазолил)оксиметил]бензоиламино]феноксиуксусная кислота.
A86) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[2-[(6-нитро-2- бензотиазолил)метилтио]бензоиламино]феноксиуксусная кислота.
A87) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[2-[(7-метил-2- бензоксазолил)тиометил]бензоиламино]феноксиуксусная кислота.
A88) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(4-этил-2- бензотиазолил)винил]бензоиламино]феноксиуксусная кислота.
A89) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(5-циано-2- бензоксазолил)оксиметил]бензоиламино]феноксиуксусная кислота.
A90) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(6-гидрокси-2- бензотиазолил)метилтио]бензоиламино]феноксиуксусная кислота.
A91) 2-[3-[(7-хлор-2-бензоксазолил)тиометил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A92) 2-[3-(5-бром-2-бензотиазолилметокси)бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
A93) 4-[3-(4-хлорфенилсульфонил)пропил]-2-[4-[(6-трифторметил-2- бензотиазолил)метилтио]бензоиламино]феноксиуксусная кислота.
A94) 4-[3-(4-хлорфенилсульфонил)пропил] -2-[4-[(7-гидрокси-2- бензоксазолил)тиометил]бензоиламино]феноксиуксусная кислота.
A95) 5'-[3-(4-бромфенилсульфонил)пропил] -3-[(4-трет-бутил-2- тиазолил)метокси]-2'-(1H-тетразол-5-илметокси)бензанилид.
A96) 3-[(4-трет-бутил-2-тиазолил)метокси] -5'-[3-(4- фторфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A97) 3-[(4-трет-бутил-2-тиазолил)метокси] -5'-[3-(4- иодфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A98) 3-[(4-трет-бутил-2-тиазолил)метокси] -5'-[3-(4- метилфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A99) 3-[(4-трет-бутил-2-тиазолил)метокси] -2'-(1H-тетразол-5- илметокси)-5'-[3-(4-трифторметилфенилсульфонил)пропил]бензанилид.
A100) 5'-[3-(4-хлорфенилсульфонил)пропил] -3-[(2-пропил)-2- тиазолилметокси]-2'-(1H-тетразол-5-илметокси)бензанилид.
A101) 5'-[3-(4-хлорфенилсульфонил)пропил]-3-[4-(2-метилпропил)-2- тиазолилметокси]-2'-(1H-тетразол-5-илметокси)бензанилид.
A102) 3-[4-циклопропил-2-тиазолилметокси] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A103) 3-[4-циклопентил-2-тиазолилметокси] -5'-[3-(4- хлорфенилсульфонил)пропил-2'-(1H-тетразол-5-илметокси)бензанилид.
A104) 5'-[3-(4-хлорфенилсульфонил)пропил]-3-[4-(2-пропил)-2- тиазолилметилтио]-2'-(1H-тетразол-5-илметокси)бензанилид.
A105) 5'-[3-(4-хлорфенилсульфонил)пропил]-3-[4-(2-метилпропил)-2- тиазолилметилтио]-2'-(1H-тетразол-5-илметокси)бензанилид.
A106) 3-[4-циклопропил-2-тиазолилметилтио] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A107) 3-[4-циклопентил-2-тиазолилметилтио] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A108) 3-[4-циклобутил-2-тиазолилметилтио] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A109) 5'-[3-(4-хлорфенилсульфонил)пропил] -3-[2-[4-(2-пропил)-2- тиазолил]этил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A110) 5'-[3-(4-хлорфенилсульфонил)пропил] -3-[2-[4-(2-метилпропил)-2- тиазолил]этил]-2'-(1-тетразол-5-илметокси)бензанилид.
A111) 3-[2-[4-циклопропил-2-тиазолил] этил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A112) 3-[2-[4-циклопентил-2-тиазолил] этил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A113) 5'-[3-(4-хлорфенилсульфонил)пропил] -3-[2-[4-(2-пропил)-2- тиазолил]винил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A114) 5'-[3-(4-хлорфенилсульфонил)пропил] -3-[2-[4-(2- метилпропил)-2-тиазолил]винил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A115) 3-[2-[4-циклопропил-2-тиазолил] винил]-5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A116) 3-[2-[4-циклопентил-2-тиазолил] винил]-5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A117) 3-[2-[4-циклобутил-2-тиазолил] винил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A118) 3-[2-[4-трет-бутил-2-тиазолил] винил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A119) 5'-[3-(4-хлорфенилсульфонил)пропил]-3-[4-(2-пропил)-2- тиазолилоксиметил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A120) 5'-[3-(4-хлорфенилсульфонил)пропил]-3-[4-(2-метилпропил)-2- тиазолилоксиметил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A121) 3-[4-циклопропил-2-тиазолилилоксиметил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A122) 3-[4-циклопентил-2-тиазолилоксиметил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A123) 3-[4-циклобутил-2-тиазолилоксиметил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A124) 3-[4-трет-бутил-2-тиазолилоксиметил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A125) 5'-[3-(4-хлорфенилсульфонил)пропил]-3-[4-(2-пропил)-2- тиазолилтиометил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A126) 5'-[3-(4-хлорфенилсульфонил)пропил]-3-[4-(2-метилпропил)-2- тиазолилтиометил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A127) 3-[4-циклопропил-2-тиазолилтиометил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A128) 3-[4-циклопентил-2-тиазолилтиометил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A129) 3-[4-циклобутил-2-тиазолилтиометил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
A130) 3-[4-трет-бутил-2-тиазолилтиометил] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1H-тетразол-5-илметокси)бензанилид.
Промышленное применение
Соединения данного изобретения являются веществами, которые служат антагонистами TXA2 и LTs и обладают способностью очень хорошо всасываться при пероральном введении. Поэтому соединения данного изобретения полезны в качестве средств для предупреждения и лечения заболеваний, связанных с TXA2, и заболеваний, связанных с LTs, например, в качестве лекарственных препаратов для предупреждения и лечения аллергических заболеваний (например, бронхиальной астмы, аллергического ринита, крапивницы и т.п.), ишемических заболеваний сердца и головного мозга, тромбозов, грудной жабы, воспалительных и петических язв и гепатитов. Они особенно пригодны для предупреждения и лечения аллергических заболеваний (например, бронхиальной астмы, аллергических ринитов, крапивницы и т.п.), ишемических заболеваний сердца и головного мозга и тромбозов, к которым имеют отношение оба медиатора.
Пригодность соединений данного изобретения подтверждена нижеследующими примерами испытаний на их активность как антагонистов TXA2 и LTs и их действия при пероральном введении.
Примеры испытаний
(1) Метод испытания подавления агрегации тромбоцитов, индуцированной U-46619:
Используя пластиковый шприц, содержащий 1 объем 3,8% водного раствора цитрата натрия, отбирают 9 объемов крови из брюшной аорты самцов морской свинки линии Хартли массой около 800 г. Обогащенную тромбоцитами плазму (ОТП) получают путем центрифугирования крови в течение 10 минут при 270·g, и оставшуюся кровь снова центрифугируют при 1100·g в течение 15 минут для получения фракции плазмы, обедненной тромбоцитами (ПОТ). ОТП разбавляют фракцией ПОТ для получения контролируемого содержания тромбоцитов 500000/мкл, и агрегацию тромбоцитов под действием стабильного аналога TXA2, U-46619 (химическое название: 9,11-дидезокси-9 α, 11 α- метаноэпоксипростагландин F2 α ) измеряют методом Боне и Кросса (Journal of Physiology, vol. 168, pp. 178-195, 1963). А именно, с помощью гемацитометра NBS (Hematracer) измеряют изменение светопропускания препарата ОТП, вызванное U-46619 (10-6 или 5·10-7 М). За 2 минуты перед добавлением U-46619 добавляют соединение и величину IC50 (концентрацию ингибирования на 50%) рассчитывают из степени ингибирования на основании максимального пропускания света U-46619. Результаты приведены в таблице 1.
(2) Метод испытания на подавление сокращения подвздошной кишки, вызванного LTD4, у морской свинки.
Самцов морской свинки линии Хартли массой 500-700 г забивают оглушением. Подвздошную кишку помещают в колбу Магнуса, содержащую 10 мл раствора Тироде, аэрируемого газовой смесью 95% O2 + 5% CO2, при напряжении в 1,0 г. Ткань уравновешивают в течение 60 мин. В течение этого периода раствор Тироде заменяют с интервалами 15 мин, и напряжение устанавливают каждый раз в 1,0 г. Развиваемое тканью напряжение измеряют изотермически, используя калиброванный измерительный прибор с преобразователем. Реакцию сокращения подвздошной кишки под действием LTD4 (10-8 М) измеряют в отсутствие соединения и затем в присутствии испытываемого соединения при различных его концентрациях. Время инкубации с соединением составляет 20 минут. Результаты приведены в таблице 1.
(3) Метод испытания ингибирования увеличения сопротивления дыхательных путей у морской свинки, вызванного U-46619, при пероральном введении соединений.
Самцов морской свинки линии Хартли (500-800 г) анестезируют уретаном (1,2 г/кг, и.п.) и фиксируют на спине для введения трахейной канюли. Спонтанное дыхание останавливают галламином (1 мг/кг, в.в.), и искусственное дыхание проводят с частотой 60 раз/мин, объем 1 мл/100 г массы тела/цикл. После введения в яремочную вену U-46619 (3 мкг/кг) измеряют увеличение сопротивления дыхательных путей с помощью прибора для измерения респираторной функции (Модель 6, Buxco Electronics Inc.). В этом случае испытываемое соединение вводят перорально за 1 час до введения U-46619 в виде раствора в диметилсульфоксиде или в виде суспензии в метилцеллюлозе.
Результат рассчитывают как степень подавления сопротивления дыхательных путей при введении 10 мг/кг соединения. Результаты для типичных соединений приведены в таблице 2.
(4) Метод испытания подавления индуцированного LTD4 ускорения проницаемости сосудов при пероральном введении соединений.
Самцам морской свинки линии Хартли, у которых накануне испытания удаляли дорсальный волосяной покров, внутривенно вводят 1% водный раствор голубого Эванса (1 мл/животное). Через две минуты после этого животным вводят внутрикожно в дорсальный участок LTD4 (5 нг/участок), и через 30 минут животных забивают декапитацией. Участки кожи, куда вводили LTD4, собирают, и проникший в кожу пигмент экстрагируют. Количество проникшего пигмента рассчитывают, измеряя его поглощение при 620 нм, и используют как показатель проницаемости сосудов. Испытываемое соединение вводят перорально в виде раствора в диметилсульфоксиде за 1 час перед внутрикожным введением LTD4. Результаты рассчитывают как степень подавления при введении 10 мг/кг соединения. Результаты для типичных соединений приведены в таблице 2.
(5) Метод испытания на подавление увеличения сопротивления дыхательных путей, индуцированного антигеном у активно сенсибилизированных морских свинок.
В качестве антигена самцам морской свинки линии Хартли вводят внутрибрюшинно три раза с двухнедельным интервалом овальбумин (ОА) вместе с Al(OH)3 для получения активной сенсибилизации. Под анестезией уретаном и при искусственном дыхании сенсибилизированным морским свинкам вводят путем внутривенной инъекции антиген (ОА) через 1-2 недели после последней сенсибилизации, и через разные промежутки времени после этого измеряют сопротивление дыхательных путей. В этом случае, за 10 минут до введения антигена, путем внутривенной инъекции вводят галламин (1 мг/кг) и индометацин (2 мг/кг) за 3 минуты, и мепирамин (2 мг/кг) и пропранолол (0,3 мг/кг) за 2 минуты до введения антигена. Испытываемое соединение вводят перорально за 1 час до введения антигена. Путем вычисления изменения степени сопротивления дыхательных путей после введения антигена, влияние испытываемого соединения проверяют, используя его действие по ингибированию возрастания сопротивления дыхательных путей в качестве показателя. При этом испытании соединение данного изобретения обнаруживает превосходное действие в качестве ингибитора возрастания сопротивления дыхательных путей.
Сравниваемое соединение: 4-[3-(4-хлорфенилсульфонил)пропил]- 2-[3-(2-хинолилметокси)бензоиламино] феноксиуксусная кислота (соединение примера 2 в не прошедшей экспертизу опубликованной заявке на патент (Kokai) N 4-154766).
ДМСО: вводят в виде раствора в диметилсульфоксиде.
МЦ: вводят в виде суспензии в метилцеллюлозе.
Фармацевтический состав, который содержит в качестве активного ингредиента одно, два или более соединений, представленных общей формулой (I), и их фармацевтически приемлемые соли, вводятся перорально или парентерально в виде таких лекарственных форм, как таблетки, порошки, мелкие гранулы, капсулы, драже, растворы, инъекции, суппозитории, мази, адгезивные препараты и т. п., с использованием носителей, эксципиентов и других добавок, обычно используемых при производстве фармацевтических препаратов.
Клинические дозы соединений данного изобретения для человека выбираются по требованию, с учетом симптомов, массы тела, возраста, пола и подобных индивидуальных особенностей каждого пациента, которого лечат, но обычно они составляют от 0,1 до 500 мг для перорального введения и от 0,01 до 100 мг для парентерального введения в сутки для взрослого и ежесуточная доза вводится один раз в сутки или делится на несколько доз в сутки. Так как доза варьируется в зависимости от разных условий, в некоторых случаях достаточный эффект может быть получен при дозах меньших, чем указанные выше.
Таблетки, порошки, гранулы и т.п. используются как твердый состав данного изобретения для перорального введения. В таком твердом составе одно или несколько активных веществ смешиваются, по крайней мере, с одним инертным разбавителем, например, лактозой, маннитом, глюкозой, гидроксипропилцеллюлозой, микрокристаллической целлюлозой, крахмалом, поливинилпирролидоном, метакремниевой кислотой, алюминатом магния и т.п. Обычно наряду с инертными разбавителями состав может содержать добавки, такие как смазывающие вещества (например, гликолят кальцийцеллюлозы или подобное вещество), стабилизаторы (например, лактозу, или подобное вещество) и солюбилизирующее или способствующее солюбилизации вещество (например, глутаминовую кислоту, аспарагиновую кислоту или подобное вещество). При необходимости, таблетки или драже могут быть покрыты пленками из веществ, растворяющихся в желудке и тонком кишечнике, например, из сахарозы, желатины, гидроксипропилцеллюлозы, фталата гидроксипропилметилцеллюлозы и т.п.
Жидкий состав для использования при пероральном введении включает фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры и т.п. , которые содержат обычно
используемые инертные разбавители, например, очищенную воду или этиловый спирт. Кроме инертных разбавителей эти составы могут также содержать вспомогательные вещества, такие как солюбилизаторы или способствующие солюбилизации агенты, увлажняющие агенты, суспендирующие агенты и т.п., подслащиватели, коригенты, ароматические вещества и антисептики.
Препараты для инъекций для парентерального введения включают асептические водные или неводные растворы, суспензии и эмульсии. Примерами разбавителя для водных растворов и суспензий являются дистиллированная вода для инъекций и физиологический раствор. Примерами разбавителя для неводных растворов и суспензий являются пропиленгликоль, полиэтиленгликоль, растительные масла, например, оливковое масло, спирты, например, этиловый спирт, и полисорбат 80 (торговое название). Такие составы могут также содержать добавки, такие как тонизирующие вещества, антисептики, увлажняющие вещества, эмульгаторы, диспергирующие вещества, стабилизирующие вещества (например, лактозу) и солюбилизирующие или способствующие солюбилизации вещества. Эти составы стерилизуют путем фильтрования через фильтры, задерживающие бактерии, смешивания с противомикробными веществами или облучением. Они могут быть произведены предварительно в виде асептических твердых составов и затем, перед употреблением, растворены в стерильной воде или асептическом растворителе для инъекций.
Если соединение данного изобретения имеет низкую растворимость, можно применить обработку для повышения растворимости. Такую обработку можно осуществить с помощью известных методов, которые могут применяться для фармацевтических препаратов, например, методом, при котором добавляются поверхностно-активные вещества (например, полиоксиэтиленированные гидрогенизированные касторовые масла, полиэтиленсорбитаны эфиров высших жирных кислот, полиоксиэтиленполиоксипропиленгликоли, сахарозные эфиры жирных кислот и т.п. ), а также методом, при котором такие вещества готовят в виде твердой дисперсии с солюбилизирующим веществом, таким как полимер (например, водорастворимые полимеры, такие как гидроксипропилметилцеллюлоза (ГПМЦ), поливинилпирролидон (ПВП), полиэтиленгликоль (ПЭГ) или подобные полимеры, или растворимые в кишечнике полимеры, например, карбоксиметилэтилцеллюлоза (КМЭЦ), фталат гидроксипропилметилцеллюлозы (HPMCP), сополимер метилметакрилата с метакриловой кислотой (Eudraqit L, S, торговое название; производства Rohm & Haas Co, ) и т.п.). Если необходимо, можно также использовать метод, при котором вещество готовят в виде растворимой соли, и метод, при котором вводимое вещество формируют, используя циклодекстрин или подобное вещество. Способы солюбилизации могут изменяться в зависимости от используемого вещества ["Saikin no seizaigijyutu sonooyo I", I.Utsumi et al., Iyaku Juornal, 157-159 (1983) and "Iyaku Monoqraph N 1, Seibutuqakuteki riyono", K.Naqai et al. Soft Science, 78-82 (1981)].
Предпочтительно использовать метод, при котором повышение растворимости достигается путем образования твердой дисперсии с солюбилизирующим агентом (не прошедшая экспертизу опубликованная заявка на патент Японии (Kokai) N 56-49314, FR 2460667).
Опыт на токсичность.
Соединение примера 39, растворенное в 5% растворе метилцеллюлозы, вводили перорально крысам Fisher 344 в дозе 0, 50, 100 или 200 мг/100 мл/кг один раз в день в течение двух недель. Количество кормления и результаты клиникопатологического опыта не изменялись при введении соединения.
Пример фармсостава.
Натрия бикарбонат (280 мг) добавляют к соединению примера 39 (120 мг) и полученную смесь (400 мг) помещают в капсулу, получая препарат в виде капсулы.
Наилучший способ осуществления изобретения
Представляющие интерес соединения данного изобретения и методы их получения в дальнейшем будут описаны детально в приведенных ниже примерах, которыми не должно ограничиваться настоящее изобретение.
Ссылочный пример 1
(1) Фенольную гидроксильную группу 3-(4-гидрокси-3-нитрофенил)пропионовой кислоты (J. Heterocycl. Chem., 9 (3), 681, (1972)) защищают метоксиметильной группой, а группу карбоновой кислоты этерифицируют соответствующим спиртом. Полученный эфир восстанавливают до спирта, и затем гидроксильную группу подвергают метансульфонированию, получая, в результате, 3-(4-метоксиметокси-3-нитрофенил)пропил-метилсульфонат.
(2) 60% гидрид натрия (4,47 г, 0,11 мол) суспендируют в тетрагидрофуране (100 мл), и по каплям при перемешивании, при охлаждении льдом, добавляют 4-хлортиофенол (15,85 г, 0,11 мол).
После дополнительного перемешивания в течение 30 минут при охлаждении льдом к реакционной смеси добавляют по каплям, в течение 1 часа, 3-(4-метоксиметокси-3-нитрофенил)пропилметилсульфонат (35,00 г, 0,11 мол), растворенный в тетрагидрофуране (100 мл). После этого реакционную смесь перемешивают в течение 1 часа при охлаждении льдом и в течение 1 часа при комнатной температуре, и затем концентрируют при пониженном давлении. К полученному остатку добавляют воду, и образовавшийся продукт дважды экстрагируют хлороформом. Органический слой промывают 5% водным раствором карбоната калия и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент хлороформ:гексан = 1: 4-7: 3). Получают 4-хлорфенил= 3-(4-метоксиметокси-3-нитрофенип)пропил=сульфид 40,30 г, 100%) в виде маслянистого продукта.
Данные масс-спектроскопии (m/z): 367 (M+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС (тетраметилсилан) - внутренний стандарт)
δ: 1,95-2,01 (2H, м), 2,79 (2H, уш-т, J = 7,9 Гц), 2,94 (2H, уш-т, J = 7,3 Гц), 3,52 (3H, с), 5,26 (2H, с), 7,26-7,44 (6H, м), 7,68 (1H, уш-д, J = 2,4 Гц)
(3) 4-Хлорфенил-3-(4-метоксиметокси-3-нитрофенил)пропил= сульфид (40,00 г, 108,87 ммол) растворяют в дихлорметане (800 мл). К полученному раствору, выдерживаемому при 0oC или ниже, небольшими порциями добавляют 80% 3-хлорпербензойную кислоту (49,32 г, 228,63 ммол). После перемешивания полученного раствора при той же температуре в течение 1 часа и затем при комнатной температуре в течение 1 часа добавляют лед и 5% водный раствор карбоната калия. Органический слой отделяют, промывают 5% водным раствором карбоната калия и рассолом в указанной последовательности, сушат над безводным сульфатом магния, и затем концентрируют при пониженном давлении. Полученный остаток кристаллизуют из смеси хлороформа с гексаном, и получают 4-хлорфенил=3-(4-метоксиметокси-3-нитрофенил)пропилсульфон (42,60 г, 98%).
Данные масс-спектроскопии (m/z): 399 (M-)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 2,02-2,08 (2H, м), 2,74 (2H, т, J = 7,3 Гц), 3,08 (2H, уш-т, J = 7,3 Гц), 3,52 (3H, с), 5,26 (2H, с), 7,24 (1H, уш-д, J = 8,5 Гц), 7,29 (1H, дд, J = 8,5, 1,8 Гц), 7,55 (2H, д, J = 7,8 Гц), 7,56 (1H, уш-с), 7,55 (2H, д, J = 7,8 Гц).
(4) 4-Хлорфенил-3-(4-метоксиметокси-3-нитрофенил)пропилсульфон (42,40 г, 106,29 ммол) суспендируют в тетрагидрофуране (200 мл), добавляют 6N соляную кислоту, и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор концентрируют при пониженном давлении, и образовавшийся продукт дважды экстрагируют хлороформом. Полученный органический слой промывают рассолом, сушат над безводным сульфатом магния, и затем концентрируют при пониженном давлении. Полученный остаток кристаллизуют из смеси хлороформа с эфиром, и получают 4-[3-(4-хлорфенилсульфонил)пропил]-2-нитрофенол (35,90 г, 95%).
Данные масс-спектроскопии (m/z): 356 (M+1).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 2,02-2,09 (2H, м), 2,74 (2H, уш-т, J = 7,3 Гц), 3,09 (2H, уш-т, J = 7,3 Гц), 7,09 (1H, д, J = 8,5 Гц), 7,38 (1H, дд, J = 8,5, 2,4 Гц), 7,55 (2H, д, J = 8,5 Гц), 7,82-7,86 (3H, м), 10,44 (1H, с).
(5) 4-[3-(4-Хлорфенилсульфонил)пропил]-2-нитрофенил (10,00 г, 28,11 ммол) растворяют в 1,4-диоксане, добавляют 4N раствор соляной кислоты в 1,4-диоксане (8,43 мл, 33,73 ммол) и 10% палладий-на-угле, и перемешивают в течение 4 часов в атмосфере газообразного водорода при давлении 1 атмосфера. Кристаллы, выпавшие из реакционного раствора, растворяют, добавляя метанол, реакционную смесь фильтруют, и затем полученный фильтрат концентрируют при пониженном давлении. Путем кристаллизации полученного остатка из смеси ацетонитрил-эфир получают гидрохлорид 2-амино-4-[3-(4-хлорфенилсульфонил)пропил] фенола (9,71 г, 95%).
Данные масс-спектроскопии (m/z): 326 (M-HCl + 1)+
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,74-1,80 (2H, м), 2,57 (2H, уш-т, J = 7,3 Гц), 3,33 (2H, уш-т, J = 7,3 Гц), 6,99 (2H, с), 7,17 (1H, уш-с), 7,75 (2H, д, J = 8,5 Гц), 7,75 (2H, д, J = 8,5 Гц), 9,33 (2H, уш), 10,60 (1H, уш-с)
Ссылочный пример 2
Тионилхлорид (2 мл) добавляют к 3-[2-(4-фенил-2-тиазолил) винил]бензойной кислоте (0,45 г, 1,46 ммол), смесь перемешивают при кипячении с обратным холодильником в течение 30 минут, и затем реакционный раствор концентрируют при пониженном давлении. К полученному остатку добавляют толуол, смесь концентрируют при пониженном давлении, и после повторения этой стадии, сушат в вакууме. Полученный остаток добавляют к смеси гидрохлорида 2-амино-4-[3-(4-хлорфенилсульфонил)пропил]фенола (0,50 г, 1,38 ммол), пиридина (3 мл) и дихлорметана (2 мл), при перемешивании при охлаждении льдом, и реакцию продолжают в течение 12 часов при комнатной температуре. Реакционный раствор выливают в лед и 1N соляную кислоту и твердый осадок собирают фильтрацией. После промывания твердого остатка этанолом получают 5'-[3-(4-хлорфенилсульфонил)пропил] -2'- гидрокси-3-[2-(4-фенил-2-тиазолил)винил] бензанилид (0,79 г, 1,28 ммол, 93%) в виде твердого вещества.
Соединения ссылочных примеров 3-17 синтезируют таким же способом, как описано в ссылочном примере 2. Названия и физические свойства этих соединений приведены в таблицах 3-6.
Ссылочный пример 18
3-[2-(4-трет-Бутил-2-тиазолил)этил]-5'-[3-(4- хлорфенилсульфонил)пропил] -2'-гидроксибензанилид (0,60 г, 1,0 ммол) растворяют в ДМФА (6,0 мл), к раствору при охлаждении льдом добавляют карбонат калия (0,21 г, 1,5 ммол), каталитически эффективное количество тетрабутиламмонийбромида и бромацетонитрила (0,080 мл, 1,2 ммол) в указанной последовательности, и затем перемешивают в течение 12 часов при комнатной температуре. В реакционный раствор добавляют лед с водой, и образовавшийся продукт экстрагируют смесью бензола с этилацетатом (1: 1). Полученный органический слой промывают 5% водным раствором карбоната калия и рассолом в указанном порядке, сушат над безводным сульфатом магния, и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент-хлороформ) и кристаллизуют из ацетонитрила, получая, в результате, 3-[2-(4-трет-бутил-2-тиазолил)этил] -5'-3-(4- хлорфенилсульфонил)пропил-2'-цианометоксибензанилид (0,60 г, 0,94 ммол, 94%) в виде бесцветных кристаллов.
Соединения ссылочных примеров с 19 по 21 синтезируют таким же способом, как описано в ссылочном примере 18. Названия и физические свойства этих соединений приведены в таблицах 7 и 8.
Ссылочный пример 22
N-(2-Гидроксиэтил)фталимид (970 мг, 5,1 ммол) и трифенилфосфин (1,3 г, 5,1 ммол) добавляют в указанной последовательности к раствору 4-[3-(4-хлорфенилсульфонил)пропил]-2-нитрофенола (1,5 г, 4,2 ммол) в безводном тетрагидрофуране (30 мл) при охлаждении льдом, и к смеси по каплям добавляют диэтилазодикарбоксилат (800 мкл, 5,1 ммол). Реакционный раствор перемешивают в течение ночи при охлаждении льдом и затем концентрируют. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент = хлороформ:этилацетат, 20: 1), и кристаллизуют с использованием смеси хлороформ-эфир, получая, в результате, N-[2-[4-[3-(4-хлорфенилсульфонил)пропил]-2-нитрофенокси] этил]фталимид (2,1 г, 4,1 ммол, 96%) в виде белых кристаллов.
Данные масс-спектроскопии (m/z): 529 (M+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,99-2,06 (2H, м), 2,71 (2H, уш-т, J = 7,6 Гц), 3,04 (2H, уш-т, J = 7,6 Гц), 4,15 (2H, т, J = 6,1 Гц), 4,37 (2H, т, J = 6,1 Гц), 7,02 (1H, д, J = 8,5 Гц), 7,29 (1H, д, J = 8,6 Гц), 7,54 (1H, с), 7,54 (2H, д, J = 8,5 Гц), 7,72-7,75 (2H, м), 7,81 (2H, д, J = 8,5 Гц), 7,86-7,90 (2H, м).
Ссылочный пример 23
4N раствор хлористого водорода в диоксане (1,2 мл) и 10% Pd-C добавляют в указанной последовательности к смеси 2-[4-[3-(4-хлорфенилсульфонил)пропил] -2-нитрофенокси] этилфталимида (2,1 г, 3,9 ммол), этанола (20 мл) и диоксана (20 мл), и полученную смесь перемешивают при комнатной температуре в атмосфере водорода. После 4-часового перемешивания реакционный раствор фильтруют через целит, полученный фильтрат концентрируют, и полученный остаток кристаллизуют из смеси хлороформа с этанолом. Получают гидрохлорид N-[2-[2-амино-4-[3-(4-хлорфенилсульфонил)пропил] фенокси]этил]фталимида (1,4 г, 2,6 ммол, 66%) в виде белых кристаллов.
Данные масс-спектроскопии (m/z): 499 (M+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт)
δ: 1,98-2,05 (2H, м), 2,61-2,73 (2H, м), 3,03 (2H, т, J = 7,8 Гц), 4,15-4,17 (2H, м), 4,23-4,24 (2H, м), 6,74-6,82 (2H, м), 7,50 (1H, д, J = 8,3 Гц), 7,53-7,55 (1H, м), 7,71-7,75 (2H, м), 7,82 (2H, д, J = 8,3 Гц), 7,84-7,89 (2H, м).
Таким же способом, какой описан в ссылочном примере 2, синтезируют следующее соединение.
Ссылочный пример 24
N-[2-[2-[3-[(4-трет-Бутил-2-тиазолил)метокси] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]фенокси]этил]фталимид
Данные масс-спектроскопии (m/z): 772 (M+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,35 (9H, с), 1,98-2,03 (2H, м), 2,65 (2H, т, J = 7,3 Гц), 3,03-3,07 (2H, м), 4,19-4,24 (4H, м), 5,50 (2H, с), 6,73-6,79 (2H, м), 6,93 (1H, с), 7,49-7,54 (3H, м), 7,63-7,71 (7H, м), 7,80 (2H, д, J = 8,8 Гц), 8,27 (1H, с), 8,58 (1H, с).
Ссылочный пример 25
(1) При охлаждении при -30oC или ниже к метанолу (150 мл) добавляют по каплям тионилхлорид (75 мл). К этому раствору при температуре -30oC добавляют 3-(4-гидрокси-3-нитрофенил)пропионовую кислоту (26,20 г, 0,12 мол). Реакционный раствор перемешивают при комнатной температуре в течение 1 часа и затем при 40-50oC в течение 3 часов. Реакционный раствор концентрируют при пониженном давлении. Затем дважды повторяют процедуру добавления толуола (100 мл) к остатку и концентрирования смеси при пониженном давлении. После этого полученный остаток кристаллизуют из смеси эфира с гексаном и получают метил 3-(4-гидрокси-3-нитрофенил)пропионат (26,20 г, 94%).
(2) Метил 3-(4-гидрокси-3-нитрофенил)пропионат (26,10 г, 0,12 мол) растворяют в дихлорметане (260 мл), и при охлаждении льдом добавляют диизопропилэтиламин (24,33 мл, 0,14 мол). Затем при той же температуре к реакционному раствору добавляют по каплям хлорметилметиловый эфир (9,68 мл, 0,13 мол). Реакцию продолжают в течение 4 часов при комнатной температуре. Затем добавляют воду (200 мл), и смесь интенсивно перемешивают. Отделяют органический слой, промывают 5% водным раствором карбоната калия и рассолом в указанном порядке, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Получают, таким образом, маслянистое вещество (31,20 г). Это соединение без очистки используют в последующей реакции.
Поддерживая температуру в пределах 50-60oC, к раствору смеси только что полученного маслянистого вещества (30,00 г, 0,11 мол), борогидрида натрия (8,83 г, 0,22 мол) и тетрагидрофурана (446 мл) добавляют по каплям в течение 1 часа метанол (89,14 мл). Реакционный раствор перемешивают при той же температуре в течение 30 минут и затем концентрируют при пониженном давлении. К полученному остатку добавляют смесь воды со льдом, и полученный продукт три раза экстрагируют хлороформом. Органический слой промывают 5% водным раствором карбоната калия и рассолом в указанном порядке, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Получают 3-(4-метоксиметокси-3-нитрофенил)пропанол (26,00 г, 97%) в виде маслянистого вещества.
(3) 3-(4-Метоксиметокси-3-нитрофенил)пропанол (26,8 г, 0,11 мол) растворяют в дихлорметане (270 мл), и к этому раствору, при перемешивании при охлаждении льдом добавляют триэтиламин (18,58 мл, 0,13 мол). К этому раствору, по каплям, при охлаждении льдом при перемешивании, добавляют в течение 2 часов метансульфонилхлорид (9,03 мл, 0,12 мол), который растворен в дихлорметане (27 мл). Реакционный раствор перемешивают при комнатной температуре в течение 30 минут и добавляют лед и 10% водный раствор лимонной кислоты. После этого органический слой отделяют, промывают насыщенным водным раствором бикарбоната натрия и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Получают 3-(4-метоксиметокси-3-нитрофенил)пропилметилсульфонат (35,10 г, 99%).
Ссылочный пример 26
К смеси 4-[2-(2-бензотиазолил)винил] бензойной кислоты (247 мг, 0,88 ммол), диметилформамида (одна капля) и дихлорметана (10 мл) добавляют при -78oC оксалилхлорид (135 мг, 1,06 ммол). Полученную смесь перемешивают при комнатной температуре в течение 2 часов и затем концентрируют при пониженном давлении. При охлаждении льдом полученное соединение постепенно добавляют к смеси гидрохлорида 2-амино-4-[3-(4-хлорфенилсульфонил)пропил]фенола (320 мг, 0,88 ммол), пиридина (3 мл) и дихлорметана (10 мл). Полученную смесь перемешивают при комнатной температуре в течение 12 часов. Реакционный раствор концентрируют при пониженном давлении, к полученному остатку добавляют воду, и смесь нагревают до кипения с обратным холодильником, а затем охлаждают, образовавшееся твердое вещество собирают путем фильтрации и сушат при пониженном давлении. К полученному твердому веществу добавляют этанол (10 мл) и смесь нагревают до кипения с обратным холодильником, а затем охлаждают. Образовавшиеся кристаллы собирают путем фильтрации и сушат при пониженном давлении. Получают 4-[2-(2-бензотиазолил)винил] -5'- [3-(4-хлорфенилсульфонил)пропил]-2'-гидроксибензанилид (335 мг, 0,57 ммол, 65%) в виде бесцветных кристаллов.
Нижеследующие соединения ссылочных примеров с 27 по 36 синтезируют тем же способом, какой описан в ссылочном примере 26. Названия и физико-химические свойства этих соединений приведены в таблицах 9-11.
Ссылочный пример 37
Смесь 4-трет-бутил-2-(гидроксиметил)тиазола (441 мг, 2,57 ммол), трет-бутилата калия (580 мг, 5,17 ммол), трикаприлметиламмонийхлорида (100 мг) и метил-6-хлорпиридин-2-карбоксилата (660 мг, 3,85 ммол) перемешивают при 120oC в течение 2 часов. К этому реакционному раствору добавляют воду, и полученный продукт экстрагируют этилацетатом. Экстракт промывают водой и рассолом в указанном порядке, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент=гексан:этилацетат = от 20:1 до 10:1). Получают метил-6-(4-трет-бутил-2-тиазолилметокси)пиридин-2-карбоксилат (198 мг, 0,65 ммол, 25%).
Спектр ядерного магнитного резонанса (CDCl3, ТМС-внутренний стандарт).
δ: 1,36 (9Н, с), 3,96 (3Н, с), 5,75 (2Н, с), 6,89 (1Н, с), 6,98-7,09 (1Н, м), 7,71-7,78 (2Н, м).
Ссылочный пример 38
Гидрохлорид 4-[3-(4-xлopбензoлcульфoнил)пpoпил] -2-аминофенола (2,0 г, 5,52 ммол) суспендируют в дихлорметане (20 мл) и добавляют пиридин (1,79 мл, 22,08 ммол) и уксусный ангидрид (1,00 мл, 13,80 ммол) в указанной последовательности при перемешивании и при охлаждении льдом. Реакционный раствор перемешивают при комнатной температуре в течение 12 часов, и затем добавляют лед и 5% водный раствор бисульфата натрия. Органический слой отделяют, и водный слой экстрагируют дихлорметаном. Органические слои соединяют, промывают 5% водным раствором бисульфата натрия, 5% водным раствором карбоната калия и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток растворяют в тетрагидрофуране (20 мл) и метаноле (20 мл), к раствору добавляют 1N водный раствор гидроксида натрия (6,62 мл) и эту смесь подвергают реакции в течение 2 часов при комнатной температуре. Реакционную смесь подкисляют, добавляя лед и 5% раствор бисульфата натрия, и затем смесь экстрагируют хлороформом. Полученный органический слой промывают рассолом, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. После кристаллизации полученного остатка из смеси хлороформа с диэтиловым эфиром получают 5-[3-(4-хлорбензолсульфонил)пропил]-2-гидроксиацетанилид (1,69 г, 83%) в виде бесцветных кристаллов.
Спектр ядерного магнитного резонанса (CDCl3,ТМС - внутренний стандарт)
δ: 1,67-2,14 (2Н, м), 2,14 (3Н, с), 2,48-2,64 (2Н, м), 3,07-3,30 (2Н, м), 6,60-6,90 (2Н, м), 7,40 (1Н, уш-с), 7,61 (2Н, уш-д, J=8,5 Гц), 7,86 (2Н, уш-д, J=8,5 Гц), 9,20-9,40 (1Н, уш), 9,30-9,60 (1Н, уш).
Ссылочный пример 39
Диметилформамид (10 мл) добавляют к смеси 5-[3-(4-хлорбензолсульфонил) пропил] -2-гидроксиацетанилида (1,00 г, 2,72 ммол) и N-хлорсукцинимида (0,44 г, 3,26 ммол), и раствору дают реагировать при 50oC в течение 1 часа, и затем при 80oC - в течение 2 часов. К реакционной смеси добавляют лед и воду, и смесь экстрагируют этилацетатом. Полученный органический слой промывают водой и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. К полученному остатку добавляют 2-пропанол (10 мл) и 3N соляную кислоту (10 мл), и раствор кипятят с обратным холодильником в течение 6 часов. Реакционный раствор охлаждают и затем концентрируют при пониженном давлении. После кристаллизации остатка из ацетонитрила получают гидрохлорид 6-хлор-4-[3-(4-хлорбензолсульфонил)пропил] -2-аминофенола (0,47 г, 44%) в виде белого твердого вещества.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт)
δ: 1,60-1,90 (2Н, м), 2,40-2,80 (2Н, м), 3,15-3,50 (2Н, м), 6,90-7,30 (2Н, м), 7,72 (2Н, уш-д, J=8,8 Гц), 7,91 (2Н, уш-д, J =8,8 Гц)
Ссылочный пример 40
Диметилформамид (25 мл) добавляют к смеси 5-[3-(4-хлорбензолсульфонил)пропил] -2-гидроксиацетанилида (1,65 г, 4,49 ммол) и N-хлорсукцинимида (1,32 г, 9,88 ммол), и раствору дают реагировать при 50oC в течение 1 часа и затем при 80oC - в течение 1 часа. К реакционному раствору добавляют лед и воду, и смесь экстрагируют этилацетатом. Полученный органический слой промывают водой и рассолом в указанной последовательности, сушат над обезвоженным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток кристаллизуют из хлороформа, и получают белое твердое вещество (0,95 г). Затем к этому веществу (0,90 г) добавляют 2-пропанол (30 мл) и 3N соляную кислоту (30 мл), и полученную смесь кипятят с обратным холодильником в течение 3 часов. Реакционный раствор охлаждают и затем концентрируют при пониженном давлении. После кристаллизации полученного остатка из ацетонитрила получают гидрохлорид 4-[3-(4-хлорбензолсульфонил)пропил]-5,6-дихлор-2-аминофенола (0,75 г, 38%) в виде белого твердого вещества.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт)
δ: 1,60-1,90 (2Н, м), 2,40-2,80 (2Н, м), 3,15-3,50 (2Н, м), 6,90-7,30 (2Н, м), 7,72 (2Н, уш-д, J =8,8 Гц), 7,91 (2Н, уш-д, J =8,8 Гц).
Ссылочный пример 41
Смесь 2-бромциклогексанона (865 мг, 4,9 ммол), метил 3-(тиокарбамоилметокси)бензоата (1,00 г, 4,4 ммол) и 1,4-диоксана (10 мл) перемешивают в течение 5 часов при комнатной температуре, затем в течение 12 часов при 80oC, после чего ее охлаждают и концентрируют при пониженном давлении. К полученному остатку добавляют насыщенный водный раствор бикарбоната натрия, и полученный продукт экстрагируют этилацетатом. Экстракт промывают водой и рассолом в указанной последовательности, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. После этого полученный остаток очищают колоночной хроматографией на силикагеле (элюент= гексан: этилацетат = 4:1). Получают 3-(4,5,6,7-тетрагидробензотиазол-2-илметокси)бензоат (369 мг, 1,2 ммол, 27%).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,84-1,89 (4Н, м), 2,73-2,80 (4Н, м), 3,91 (3Н, с), 5,76 (2Н, с), 7,18-7,20 (1Н, м), 7,36 (1Н, т, J=8,0 Гц), 7,66-7,68 (2Н, м)
Ссылочный пример 42
Смесь метил 3-(4,5,6,7-тетрагидробензотиазол-2-илметокси)бензоата (361 мг, 1,2 ммол), тетрагидрофурана (2 мл), метанола (2 мл) и 1N гидроксида натрия (2 мл) перемешивают при комнатной температуре в течение 12 часов и затем концентрируют при пониженном давлении. Полученный остаток растворяют в воде, и pH раствора доводят до 3 путем добавления 10% водного раствора лимонной кислоты. После этого образовавшееся твердое вещество собирают путем фильтрации, промывают водой и затем сушат при пониженном давлении. Получают 3-(4,5,6,7-тетрагидробензотиазол-2-илметокси)бензойную кислоту (257 мг, 0,89 ммол, 75%).
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт)
δ: 1,74-1,82 (4Н, м), 2,67-2,78 (4Н, м), 5,39 (2Н, с), 7,29 (1Н, д, J= 8,0 Гц), 7,44 (1Н, т, J =8,0 Гц), 7,53-7,58 (2Н, м), 13,0 (1Н, с).
Таким же способом, какой описан в ссылочном примере 42, получают следующие соединения ссылочных примеров 43-50.
Ссылочный пример 43
6-(4-трет-Бутил-2-тиазолилметокси)пиридин-2-карбоновая кислота.
Спектр ядерного магнитного резонанса (CDCl3 ТМС - внутренний стандарт)
δ: 1,35 (9Н, с), 5,68 (2Н, с), 6,93 (1Н, с), 7,08-7,18 (1Н, м), 7,82-7,88 (2Н, м)
Ссылочный пример 44
3-[(4-трет-Бутил-2-тиазолил)метокси]-5-хлорбензойная кислота.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,37 (9Н, с), 5,42 (2Н, с), 6,95 (1Н, с), 7,29 (1Н, уш-т, J=2,0 Гц), 7,64-7,74 (2Н, м), 9,10-9,60 (1Н, уш)
Ссылочный пример 45
5-[(4-трет-Бутил-2-тиазолил)метокси]-2-хлорбензойная кислота.
Данные масс-спектрометрии (m/z): 326 (М+Н)+
Спектр ядерного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 5,45 (2Н, с), 7,23 (1Н, дд, J=8,8 Гц, 3,4 Гц), 7,31 (1Н, с), 7,45- 7,48 (2Н, м), 13,43 (1Н, с)
Ссылочный пример 46
3-[(4-трет-Бутил-2-тиазолил)метокси]-4-метоксибензойная кислота.
Данные масс-спектрометрии (m/z): 322 (М+)
Спектр ядерного магнитного резонанса (ДМСО-D6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 3,86 (3Н, с), 5,41 (2Н, с), 7,09 (1Н, д, J =8,3 Гц), 7,29 (1Н, с), 7,61 (1Н, J=8,3 Гц), 7,62 (1Н, с), 12,64 (1Н, с).
Ссылочный пример 47
3-[4-трет-Бутил-2-тиазолил)метокси]-4-хлорбензойная кислота.
Данные масс-спектрометрии (m/z): 326 (М+H+)
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 5,59 (2Н, с), 7,32 (1Н, с), 7,55-7,61 (2Н, м), 7,81 (1Н, д, J=1,5 Гц), 13,18 (1Н, с).
Ссылочный пример 48
3-[(4-трет-Бутил-2-тиазолил)метокси]-4-метилбензойная кислота.
Данные масс-спектрометрии (m/z): 306 (М+)
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 2,28 (3Н, с), 5,48 (2Н, с), 7,29 (1Н, с), 7,30 (1Н, д, J =8,3 Гц), 7,50 (1Н, д, J =8,3 Гц), 7,60 (1Н, с), 12,80 (1H, с).
Ссылочный пример 49
3-[(4-трет-Бутил-2-тиазолил)метокси]-4-нитробензойная кислота.
Данные масс-спектрометрии (m/z): 337 (М+)
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,29 (9Н, с), 5,69 (2Н, с), 7,33 (1Н, с), 7,68 (1Н, дд, J=8,3, 1,5 Гц), 7,99 (1Н, уш-д, J=8,3 Гц), 8,00 (1H, с), 13,62 (1H, с).
Ссылочный пример 50
3-[(4-трет-Бутил-5-метил-2-тиазолил)метокси]бензойная кислота.
Данные масс-спектрометрии (m/z): 306 (М+Н)+
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,35 (9Н, с), 2,47 (3Н, с), 5,34 (2Н, с), 7,28 (1Н, уш-д, J=8,3 Гц), 7,43 (1H, т, J= 8,3 Гц), 7,56 (1Н, уш-д, J=8,3 Гц), 7,57 (1Н, уш-с), 13,0 (1H, с).
Таким же способом, какой описан в ссылочном примере 41, получают следующие соединения ссылочных примеров 51-58.
Ссылочный пример 51
Метил-3-[(4-трет-бутил-2-тиазолил)метокси]-5-хлорбензоат.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,36 (9Н, с), 3,91 (3Н, с), 5,37 (2Н, с), 6,93 (1Н, с), 7,23 (1Н, уш-т, J =2,0 Гц), 7,56-7,67 (2Н, м).
Ссылочный пример 52
Метил 5-[(4-трет-бутил-2-тиазолил)метокси]-2-хлорбензоат.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,35 (9Н, с), 3,92 (3Н, с), 5,35 (2Н, с), 6,93 (1Н, с), 7,08 (1Н, дд, J=8,8, 2,9 Гц), 7,35 (1Н, д, J=8,8 Гц), 7,51 (1Н, д, J =2,9 Гц).
Ссылочный пример 53
Метил 3-[(4-трет-бутил-2-тиазолил)метокси]-4-метоксибензоат.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,35 (9Н, с), 3,86 (3Н, с), 3,93 (3H, с), 5,44 (2Н, с), 6,91 (1Н, д, J =8,3 Гц), 7,71 (1Н, д, J=2,0 Гц), 7,72 (1Н, уш-д, J =8,3 Гц).
Ссылочный пример 54
Метил 3-[(4-трет-бутил-2-тиазолил)метокси]-4-хлорбензоат.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,36 (9H, с), 3,90 (3Н, с), 5,47 (2Н, с), 6,94 (1Н, с), 7,45 (1Н, д, J =8,3 Гц), 7,63 (1Н, дд, J=8,3, 2,0 Гц), 7,77 (1Н, д, J=2,0 Гц).
Ссылочный пример 55
Метил-3-[(4-трет-бутил-2-тиазолил)метокси]-4-метилбензоат.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,36 (9H, с), 2,35 (3Н, с), 3,89 (3Н, с), 5,40 (2Н, с), 6,91 (1Н, с), 7,22 (1Н, д, J=7,3 Гц), 7,60-7,62 (2Н, м).
Ссылочный пример 56
Метил-3-[(4-трет-бутил-2-тиазолил)метокси]-4-нитробензоат.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,35 (9H, с), 3,95 (3Н, с), 5,54 (2Н, с), 6,96 (1Н, с), 7,74 (1Н, дд, J=8,3, 1,5 Гц), 7,86 (1Н, д, J=8,3 Гц), 7,99 (1Н, д, J=1,5 Гц).
Ссылочный пример 57
Метил 3-[(4-трет-бутил-5-метил-2-тиазолил)метокси]-бензоат.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,38 (9Н, с), 2,50 (3Н, с), 3,91 (3Н, с), 5,27 (2Н, с), 7,23-7,45 (2Н, м), 7,63-7,72 (2Н, м)
Ссылочный пример 58
Гидробромид метил 3-[2-(4-трет-бутил-2-тиазолили)этокси] бензоата.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,28 (9Н, с), 3,39-3,57 (2Н, м), 4,40 (2Н, т, J =6,3 Гц), 7,18 (1Н, с), 7,23-7,62 (4Н, м).
Ссылочный пример 59
Смесь гидробромида метил 3-[2-(4-трет-бутил-2-тиазозил) этокси]бензоата (102 мг, 0,25 ммол), метанола (1 мл) и 6N соляной кислоты (0,5 мл) перемешивают при 60oC в течение 2 часов, добавляют 6N соляную кислоту (1 мл), и смесь перемешивают при 110oC в течение 2 часов. Реакционный раствор охлаждают и концентрируют при пониженном давлении. Полученное твердое вещество собирают фильтрацией и промывают ацетонитрилом и диэтиловым эфиром в указанной последовательности. Получают гидрохлорид 3-[2-(4-трет-бутил-2-тиазолил)этокси]бензойной кислоты (0,20 ммол, 80%, 69 мг).
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 3,53 (2Н, т, J=5,8 Гц), 4,40 (2Н, т, J=5,8 Гц), 7,21- 7,25 (2Н, м), 7,40-7,46 (2Н, м), 7,55 (1Н, д, J =8,0 Гц).
Таким же способом, какой описан в ссылочном примере 2, получают следующие соединения ссылочных примеров 60-73.
Ссылочный пример 60
5'-[3-(4-Хлорфенилсульфонил)пропил] -2'-гидрокси-3- (6-метокси-2-бензотиазолилметокси)бензанилид.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,76-1,82 (2Н, м), 2,56 (2Н, т, J =7,3 Гц), 3,31-3,34 (2Н, м), 3,83 (3Н, с), 5,64 (2Н, с), 6,82 (2Н, с), 7,13 (1Н, д, J =8,5 Гц), 7,32 (1Н, д, J = 8,0 Гц), 7,43 (1Н, с), 7,48 (1Н, т, J=8,0 Гц), 7,60 (1Н, д,J=7,5 Гц), 7,68-7,74 (4Н, м), 7,88-7,92 (3Н, м), 9,51 (1Н, с), 9,53 (1Н, с).
Ссылочный пример 61
5'-[3-(4-Хлорфенилсульфонил)пропил] -2'-гидрокси-3- (4,5,6,7-тетрагидро-2-бензотиазолилметокси)бензанилид.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,73-1,83 (6Н, м), 2,56 (2Н, т, J=7,5 Гц), 2,63-2,78 (4Н, м), 3,31-3,42 (2Н, м), 5,42 (2Н, с), 6,82 (2Н, с), 7,23-7,32 (1Н, м), 7,42-7,50 (2Н, м), 7,54-7,63 (2Н, м), 7,73 (2Н, д, J=8,0 Гц), 7,89 (2Н, д, J =8,0 Гц), 9,49 (1Н, с), 9,54 (1Н, с).
Ссылочный пример 62
3-[(4-трет-Бутил-2-тиазолил)метокси] -5'-хлор-5'- [3-(4-хлорфенилсульфонил)пропил]-2'-гидроксибензанилид.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 1,73-1,85 (2Н, м), 2,56 (2Н, уш-т, J=7,6 Гц), 3,30-3,36 (2Н, м), 5,53 (2Н, с), 6,83 (2Н, с), 7,32 (1Н, уш-с), 7,33 (1Н, с), 7,44 (1Н, уш-с), 7,62 (2Н, уш-с), 7,73 (2Н, уш-д, J =8,8 Гц), 7,89 (2Н, уш-д, J = 8,8 Гц), 9,46 (1Н, уш-с), 9,65 (1Н, уш-с).
Ссылочный пример 63
5-[(4-трет-Бутил-2-тиазолил)метокси] -2-хлор-5'-[3- (4-хлорфенилсульфонил)пропил]-2'-гидроксибензанилид.
Данные масс-спектрометрии (m/z): 633 (М+Н)+
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,35 (9Н, с), 1,99-2,04 (2Н, м), 2,64 (2Н, уш-т, J=7,3 Гц), 3,03-3,07 (2Н, м), 5,35 (2Н, с), 6,88 (1H, уш-д, J=8,3 Гц), 6,94 (1H, уш-с), 6,95 (1H, уш-д, J=8,3 Гц), 7,09 (1H, уш-д, J-8,8 Гц), 7,10 (1H, с), 7,37 (1H, д, J=8,8 Гц), 7,50 (1H, уш-с), 7,52 (1H, уш-д, J=8,8 Гц), 7,80 (2Н, уш-д, J=8,8 Гц), 8,32 (1H, уш-с), 8,49 (1H, с).
Ссылочный пример 64
3-[(4-трет-Бутил-2-тиазолил)метокси]-5'-[3-(4-хлорфенилсульфонил)пропил] - 2'-гидрокси-4-метоксибензанилид.
Данные масс-спектрометрии (m/z), 629 (М+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,33 (9H, с), 1,95-2,04 (2Н, м), 2,62 (2Н, уш-т, J=7,3 Гц), 3,01-3,09 (2Н, м), 3,96 (3Н, с), 5,46 (2Н, с), 6,85 (1Н, дд, J=8,3, 2,0 Гц), 6,88-6,98 (3Н, м), 7,00 (1Н, д, J=2,0 Гц), 7,52 (2Н, уш-д, J=8,8 Гц), 7,59 (1Н, дд, J= 8,3, 2,0 Гц), 7,65 (1Н, д, J=2,0 Гц), 7,79 (2Н, уш-д, J =8,3 Гц), 8,26 (1Н, с), 8,75 (1Н, уш-с).
Ссылочный пример 65
3-[(4-трет-Бутил-2-тиазолил)метокси] -4-хлор-5'-[3- (4-хлорфенилсульфонил)пропил]-2'-гидроксибензанилид.
Данные масс-спектрометрии (m/z): 633 (М+H+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,35 (9H, с), 1,98-2,01 (2Н, м), 2,63 (2Н, уш-т, J=7,3 Гц), 3,01-3,05 (2Н, м), 5,47 (2Н, с), 6,87 (1Н, уш-д, J=8,3 Гц), 6,95 (1Н, д, J=8,3 Гц), 6,96 (1Н, с), 7,10 (1Н, д, J=2,0 Гц), 7,47 (1Н, уш-д, J=8,3 Гц), 7,51 (1Н, д, J=8,3 Гц), 7,52 (2Н, уш-д, J =8,8 Гц), 7,68 (1Н, д, J=2,0 Гц), 7,79 (2Н, уш-д, J=8,8 Гц), 8,34 (1Н, с), 8,35 (1Н, с).
Ссылочный пример 66
3-[(4-трет-Бутил-2-тиазолил)метокси] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-гидрокси-4-метилбензанилид.
Данные спектр-спектрометрии (m/z): 613 (М+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,32 (9Н, с), 1,95-1,99 (2Н, м), 2,60 (2Н, уш-т, J=7,6 Гц), 3,03 (2Н, м), 5,51 (2Н, с), 6,85 (1Н, дд, J=8,3, 2,0 Гц), 6,91 (1Н, д, J=8,3 Гц), 6,99 (1H, с), 7,29 (1H, д, J=2,0 Гц), 7,52 (2Н, уш-д, J=8,3 Гц), 7,58 (1Н, дд, J= 8,3, 1,5 Гц), 7,78 (2Н, уш-д, J=8,3 Гц), 7,84 (1H, с), 7,89 (1H, д, J=8,3 Гц), 8,30 (1H, уш-с), 8,67 (1H, с).
Ссылочный пример 68
3-[(4-трет-Бутил-5-метил-2-тиазолил)метокси] -5'-[3- (4-хлорфенилсульфонил)пропил]-2'-гидроксибензанилид.
Данные масс-спектрометрии (m/z): 613 (М+Н)+
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,36 (9Н, с), 1,77-1,81 (2Н, м), 2,49 (3Н, с), 2,56 (2Н, уш-т, J=7,3 Гц), 3,32-3,35 (2Н, м), 5,37 (2Н, с), 6,82 (2Н, уш-с), 7,27 (1H, дд, J=7,8, 2,0 Гц), 7,42 (1H, уш-с), 7,46 (1H, т, J=7,8 Гц), 7,57 (1H, д, J=7,8 Гц), 7,64 (1H, уш-с), 7,74 (2Н, уш-д, J=8,8 Гц), 7,89 (2Н, уш-д, J=8,8 Гц), 9,51 (1H, с), 9,53 (1H, с).
Ссылочный пример 69
6-(4-трет-Бутил-тиазолилметокси)-N-[5-[3-(4-хлорфенилсульфонил) пропил] -2-гидроксифенил]пиридин-2-карбоксиамид.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМ - внутренний стандарт).
δ: 1,30 (9H, с), 2,01-2,08 (2Н, м), 2,67 (2Н, т, J=7,2 Гц), 3,04-3,09 (2Н, м), 5,76 (2Н, с), 6,88-6,98 (3Н, м), 7,04 (1Н, с), 7,12 (1Н, д, J=8,0 Гц), 7,52 (2Н, д, J=8,4 Гц), 7,80-7,88 (3Н, м), 7,94 (1H, д, J=7,2 Гц), 9,06 (1Н, уш), 9,91 (1H, с).
Ссылочный пример 70
3-[2-(4-трет-Бутил-2-тиазолил)этокси] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-гидроксибензанилид.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,28 (9H, с), 1,70-1,83 (2Н, м), 2,56 (2Н, т, J =7,3 J Гц), 3,31-3,35 (2Н, м), 3,44 (2Н, т, J=5,9 Гц), 4,41 (2Н, т, J=5,9 Гц), 6,82 (2Н, с), 7,12 (1H, с), 7,18 (1H, д, J=8,0 Гц), 7,42-7,46 (2Н, м), 7,53-7,55 (2Н, м), 7,73 (2Н, д, J=8,8 Гц), 7,90 (2Н, д, J=8,8 Гц), 9,51 (1H, с), 9,52 (1H, с).
Ссылочный пример 71
3-(4-трет-Бутил-2-тиазолилметокси)-2'-гидрокси-5'- (3-фенилсульфонилпропил)бензанилид.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,31 (9H, с), 1,75-1,83 (2Н, м), 2,56 (2Н, т, J =7,2 Гц), 3,27-3,32 (2Н, м), 5,50 (2Н, с), 6,82 (2Н, с), 7,28-7,32 (2Н, м), 7,42 (1H, с), 7,47 (1H, т, J=8,4 Гц), 7,59 (1H, д, J=7,6 Гц), 7,64-7,67 (3Н, м), 7,45
1H, т, J=6,8 Гц), 7,89 (2H, д, J =8,0 Гц), 9,52 (2H, уш).
Ссылочный пример 72
3-[(4-трет-Бутил-2-тиазолил)метокси] -5'-[3-(4- хлорфенилсульфонил)пропил]-3',4'-дихлор-2'-гидроксибензанилид.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,31 (9Н, с), 1,76-1,86 (2H, м), 2,72-2,77 (2H, м), 3,39-3,44 (2H, м), 5,50 (2Н, с), 7,32-7,33 (2H, м), 7,38 (1H, с), 7,49 (1H, уш-т, J=7,8 Гц), 7,63 (1H, уш-д, J=7,8 Гц), 7,71-7,74 (3Н, м), 7,91 (2H, д J=8,8 Гц), 9,97 (1H, уш-с), 10,08 (1H, уш-с).
Ссылочный пример 73
3-[(4-трет-Бутил-2-тиазолил)метокси] -3'-хлор-5'- [3-(4-хлорфенилсульфонил)пропил]-2'-гидроксибензанилид.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,31 (9Н, с), 1,76-1,85 (2H, м), 2,55-2,60 (2H, м), 3,31-3,35 (2H, м), 5,50 (2H, с), 7,70 (1H, уш-с), 7,24 (1H, уш-с), 7,32-7,34 (2Н, м), 7,49 (1H, уш-т, J= 7,8 Гц), 7,62 (1H, уш-д, J=7,8 Гц), 7,70-7,74 (1H, м), 7,73 (2Н, д, J=8,8 Гц), 7,90 (2Н, д, J=8,8 Гц), 9,58 (1H, уш-с), 9,96 (1H, уш-с).
Ссылочный пример 74
5'-[3-(4-Хлорбензолсульфонил)пропил] -2'-гидрокси-3-[(4- трет-бутил-2-тиазолил)метокси бензанилид (1,60 г, 2,67 ммол) растворяют в диметилформамиде (16 мл), в указанном порядке при охлаждении льдом добавляют карбонат калия (0,55 г, 4,00 ммол), каталитически эффективное количество тетрабутиламмонийбромида и бромацетонитрила (0,22 мл, 3,20 ммол), и затем перемешивают в течение ночи при комнатной температуре. К реакционной смеси добавляют воду со льдом, и смесь экстрагируют дважды смесью бензола с этилацетатом (1: 1). Полученный органический слой промывают 5% водным раствором карбоната калия и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Путем кристаллизации полученного остатка из ацетонитрила получают 3-(4- трет-бутил-2-тиазолил)метокси-5'-3-(4-хлорфенилсульфонил)пропил -2'-цианометоксибензанилид в виде бесцветных кристаллов (1,34 г, 79%).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,36 (9Н, с), 2,02- 2,08 (2Н, м), 2,72 (2Н, уш-т, J=7,3 Гц), 3,07-3,11 (2Н, м), 4,87 (2Н, с), 5,41 (2Н, с), 6,88-6,94 (3Н, м), 7,22 (2Н, дт, J= 6,8, 2,4 Гц), 7,43- 7,45 (2Н, м), 7,53 (2Н, дд, J=8,8, 1,9 Гц), 7,55 (1H, уш-с), 7,83 (2H, дд, J=8,8, 1,9 Гц), 8,28 (1H, уш-с), 8,31 (1H, уш-с).
Тем же способом, какой описан в ссылочном примере 74, получают следующие соединения ссылочных примеров 75 и 76.
Ссылочный пример 75
3-[(4-трет-Бутил-2-тиазолил)метокси]-2'-(цианометокси) 5'-[3-(4-фенилсульфонил)пропил]бензанилид.
Данные масс-спектрометрии (m/z): 604 (М+Н)+
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,36 (9Н, с), 2,02-2,10 (2Н, м), 2,71 (2Н, т, J=7,3 Гц), 3,07-3,12 (2Н, м), 4,67 (2Н, с), 5,41 (2Н, с), 6,88-6,94 (3Н, м), 7,20-7,23 (1Н, м), 7,41-7,45 (2Н, м), 7,54-7,59 (3Н, м), 7,62-7,67 (1Н, м), 7,90 (2Н, д, J=8,0 Гц), 8,27 (1Н, с), 8,32 (1Н, с).
Ссылочный пример 76
5'-[3-(4-Хлорфенилсульфонил)пропил] -2'- (цианометокси)-3-[(4-циклобутил-2-тиазолил)метокси] бензанилид.
Данные масс-спектрометрии (m/z): 636 (М+Н)+
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,89-1,95 (1Н, м), 2,00-2,09 (3Н, м), 2,23-2,31 (2Н, м), 2,34-2,41 (2Н, м), 2,70-2,73 (2Н, м), 2,88-3,10 (2Н, м), 3,65-3,72 (1Н, м), 4,87 (2Н, с), 5,41 (2Н, с), 6,89 (1Н, дд, J=8,6, 1,8 Гц), 6,93 (1Н, д, J=8,6 Гц), 6,95 (1Н, с), 7,21 (1Н, дд, J=7,3 Гц, 1,8 Гц), 7,43 (1Н, т, J=7,3 Гц), 7,46 (1Н, уш-д, J= 7,3 Гц), 7,53 (2Н, д, J=8,3 Гц), 7,54 (1Н, с), 7,83 (2Н, д, J=8,3 Гц), 8,28 (1Н, с), 8,32 (1Н, д, J=1,8 Гц).
Ссылочный пример 77
Метил-3-гидроксибензоат (10,00 г, 65,72 ммол) растворяют в диметилформамиде (100 мл). При перемешивании раствора при охлаждении льдом добавляют в указанной последовательности карбонат калия (13,63 г, 98,58 ммол) и хлорацетонитрил (4,99 мл, 78,86 ммол). Смесь перемешивают при комнатной температуре в течение 12 часов. Реакционный раствор выливают в воду со льдом, и выпавшие кристаллы собирают с помощью фильтрации. Полученные кристаллы растворяют в хлороформе, и раствор промывают 5% водным раствором карбоната калия, 10% водным раствором лимонной кислоты и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Путем кристаллизации полученного остатка из смеси диэтилового эфира с гексаном получают метил-3-цианометоксибензоат (811,80 г, 94%).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 3,93 (3Н, с), 4,82 (2Н, с), 7,11-7,25 (1Н, м), 7,43 (1Н, уш-т, J=7,5 Гц), 7,61-7,66 (1Н, м), 7,79 (1Н, дт, J =7,5, 1,3 Гц).
Ссылочный пример 78
Раствор (4N) хлористого водорода в этилацетате (50 мл) и дитиофосфат =O, O-диэтил (4,47 мл, 26,67 ммол) добавляют в указанной последовательности к метил-3-цианометоксибензоату (5,00 г, 26,15 ммол). Полученный раствор перемешивают при комнатной температуре в течение 12 часов. Выпавшие из реакционного раствора кристаллы собирают путем фильтрации и промывают диэтиловым эфиром. Получают метил-3-тиокарбамоилметоксибензоат (4,60 г, 78%).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 3,86 (3Н, с), 4,83 (2Н, с), 7,27 (1Н, дд, J=7,9, 2,4 Гц), 7,46 (1H, уш-т, J=7,9 Гц), 7,54 (1H, уш-с), 7,59 (1H, уш-д, J=7,9 Гц), 9,43 (1H, уш-с), 10,01 (1H, уш-с)
Следующее соединение ссылочного примера 79 получают тем же способом, какой описан в ссылочном примере 78.
Ссылочный пример 79
Метил 3-(2-тиокарбамоилэтокси)бензоат
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 2,92 (2Н, т, J=6,2 Гц), 3,85 (3Н, с), 4,39 (2Н, т, J=6,2 Гц), 7,14-7,60 (4Н, м), 9,20-9,70 (2Н, уш).
Ссылочный пример 80
Циклопентилметилкетон (0,20 г, 1,78 ммол) растворяют в метаноле (5 мл). При перемешивании при охлаждении льдом в раствор добавляют каталитически эффективное количество 33% бромистого водорода в уксусной кислоте, и затем по каплям добавляют бром (0,34 г, 2,14 ммол). К реакционному раствору добавляют карбонат калия (0,15 г, 1,07 ммол), и смесь перемешивают при комнатной температуре в течение 10 минут. Затем к реакционному раствору добавляют метил 3-тиокарбамоилметоксибензоат (0,40 г, 1,78 ммол), и смесь кипятят с обратным холодильником в течение 1 часа. После охлаждения реакционный раствор концентрируют при пониженном давлении, к полученному остатку добавляют лед с водой и 5% водный раствор карбоната калия, и затем образовавшийся продукт экстрагируют хлороформом. Органический слой промывают 5% водным раствором лимонной кислоты и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. К полученному остатку добавляют тетрагидрофуран (5 мл), метанол (5 мл) и 1 N водный раствор гидроксида натрия (2 мл). Смесь перемешивают при комнатной температуре в течение 12 часов. Реакционный раствор концентрируют при пониженном давлении, к полученному остатку добавляют 10% водный раствор лимонной кислоты, и затем полученный продукт экстрагируют хлороформом. Органический слой промывают рассолом, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Путем кристаллизации из смеси диэтилового эфира с гексаном получают 3-(4-циклопентил-2-тиазолил)метоксибензойную кислоту (0,15 г, 28%).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,66-1,81 (6Н, м), 2,06-2,16 (2Н, м), 3,22-3,31 (1Н, м), 5,43 (2Н, с), 6,93 (1Н, с), 7,23-7,26 (1Н, м), 7,40 (1Н, уш-т, J=8,3 Гц), 7,75-7,78 (2Н, м), 8,5-9,5 (1Н, уш).
Тем же способом, который описан в ссылочном примере 80, получают следующие соединения ссылочных примеров 81-85.
Ссылочный пример 81
3-(4-Циклогексил-2-тиазолил)метоксибензойная кислота.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,20-1,31 (1Н, м), 1,37-1,49 (4Н, м), 1,72-1,76 (1Н, м), 1,81-1,87 (2Н, м), 2,05-2,12 (2Н, м), 2,78-2,84 (1Н, м), 5,43 (2Н, с), 6,90 (1Н, с), 7,23-7,26 (1Н, м), 7,38- 7,41 (1Н, м), 7,75-7,80 (2Н, м), 10,6-11,2 (1Н, уш).
Ссылочный пример 82
3-(4-Циклобутил-2-тиазолил)метоксибензойная кислота.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,8-2,2 (6Н, м), 3,54-3,91 (1Н, м), 5,43 (2Н, с), 6,94 (1H, д,J=0,8 Гц), 7,16-7,42 (2Н, м), 7,70-7,84 (2Н, м).
Ссылочный пример 83
3-(4-Фенил-2-тиазолил)метоксибензойная кислота.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 5,49 (2Н, с), 7,20-7,57 (6Н, м), 7,72-7,97 (4Н, м)
Ссылочный пример 84
3-(4-Циклопропил-2-тиазолил)метоксибензойная кислота.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 0,87-1,02 (4Н, м), 1,95-2,26 (1Н, м), 5,38 (2Н, с), 6,86 (1Н, с), 7,16-7,49 (2Н, м), 7,72-7,81 (2Н, м), 8,8-9,3 (1H, уш).
Ссылочный пример 85
3-(4-трет-Бутил-2-тиазолил) метоксибензойная кислота.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,03 (9Н, с), 5,46 (2Н, с), 7,30 (1Н, с), 7,31-7,34 (1Н, м), 7,44 (1Н, уш-т, J=8,3 Гц), 7,57-7,59 (2Н, м), 13,01 (1Н, уш-с).
Ссылочный пример 86
3-[2-(4-трет-Бутил-2-тиазолил)винил]бензойную кислоту
(1,20 г, 4,18 ммол) растворяют в тетрагидрофуране (24 мл), к раствору добавляют порошок 10% палладия-на-угле (0,2 г), и смесь перемешивают при комнатной температуре в течение 3 часов в атмосфере водорода. Реакционный раствор фильтруют и полученный фильтрат концентрируют при пониженном давлении. Путем кристаллизации из смеси диэтилового эфира с гексаном получают 3-[2-(4-трет-бутил-тиазолил)этил]бензойную кислоту (1,12 г, 93%).
Спектр ядерного магнитного резонанса (CDCl3), ТМС - внутренний стандарт).
δ: 1,34 (9Н, с), 3,05-3,48 (4Н, м), 6,74 (1Н, с), 7,32-7,40 (2Н, м), 7,85-8,01 (2Н, м).
Тем же способом, какой описан в ссылочном примере 86, получают следующее соединение ссылочного примера 87.
Ссылочный пример 87
3-[2-(4-Циклобутил-2-тиазолил)этил]бензойная кислота.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,85-1,94 (1Н, м), 1,98-2,08 (1H, м), 2,18-2,27 (2Н, м), 2,33-2,41 (2Н, м), 3,16 (2Н, т, J=8,5 Гц), 3,36 (2Н, т, J=8,5 Гц), 3,67-3,75 (1H, м), 6,78 (1H, с), 7,34-7,39 (2Н, м), 7,95-7,97 (1H, м), 8,03 (1H, уш-с).
Ссылочный пример 88
Метил-3-меркаптобензоат (0,50 г, 2,97 ммол) и 2-бромметил-4- трет-бутилтиазол (0,50 г, 3,27 ммол) растворяют в 2-бутаноне (10 мл). К раствору добавляют карбонат калия (0,41 г, 4,46 ммол) при перемешивании при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 12 часов. Добавляют лед и 5% водный раствор карбоната калия, и полученный продукт экстрагируют хлороформом. Органический слой промывают 5% водным раствором карбоната калия, 10% водным раствором лимонной кислоты и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. К полученному остатку добавляют тетрагидрофуран (10 мл), метанол (5 мл) и 1N водный раствор гидроксида натрия (4,46 мл). Смесь перемешивают при комнатной температуре в течение 7 часов. Реакционный раствор концентрируют при пониженном давлении, к полученному остатку добавляют 10% водный раствор лимонной кислоты, и затем полученный продукт экстрагируют хлороформом. Органический слой промывают рассолом, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Путем кристаллизации полученного остатка из смеси хлороформа с диэтиловым эфиром получают 3-(4-трет-бутил-2-тиазолил) метилтиобензойную кислоту (0,81 г, 83%).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,29 (9Н, с), 5,41 (2Н, с), 6,80 (1Н, с), 7,33 (1Н, уш-т, J=7,8 Гц), 7,56 (1Н, дт, J=7,8, 1,6 Гц), 7,93 (1Н, дт, J=7,8, 1,6 Гц), 8,14 (1Н, уш-т, J=l,6 Гц).
ПРИМЕР 1
5'-[3-(4-хлорфенилсульфонил)пропил] -2'-гидрокси-3- [2-(4-фенил-2-тиазолил)винил] бензанилид (0,60 г, 0,98 ммол) растворяют в диметилформамиде (6 мл), добавляют карбонат калия (0,20 г, 1,45 ммол), каталитически эффективное количество тетрабутиламмонийбромида и этилбромацетат (0,13 мл, 1,17 ммол) в указанной последовательности при охлаждении льдом, затем перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют воду со льдом, и образовавшийся продукт экстрагируют дважды смесью бензола с этилацетатом (1: 1). Полученный органический слой промывают 5% водным раствором карбоната калия и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент= ацетон: хлороформ= 1:100) и кристаллизуют из ацетонитрила. Получают этил 4-[3-(4- хлорфенилсульфонил)пропил] -2-[3-2-(4-фенил-2-тиазолил)винил] бензоиламино феноксиацетат (0,36 г, 0,51 ммол, 53%) в виде бесцветных кристаллов.
Тем же способом, какой описан в примере 1, синтезируют следующие соединения примеров со 2 по 7. Структура и физико-химические свойства этих соединений приведены в таблицах 12 и 13.
В этой связи термин "положение связывания", приведенный в таблицах, означает положение связывания.
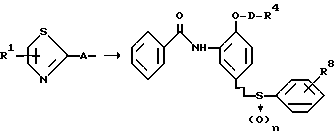
из общей формулы (1), и термин "положение связывания с тиазольным кольцом" означает положение, где R1 связывается с тиазольным кольцом. То же будет использоваться далее.
ПРИМЕР 2
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-[4-(4- метилфенил)-2-тиазолил]винил]бензоиламино]феноксиацетат.
ПРИМЕР 3
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(4- изопропил-2-тиазолил)винил]бензоиламино]феноксиацетат.
ПРИМЕР 4
Этил 2-[3-[2-(4-трет-бутил-2-тиазолил)винил]бензоиламино]-4-[3- (4-хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 5
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(4- фенил-2-тиазолил)метокси]бензоиламино] феноксиацетат.
ПРИМЕР 6
Этил 2-[3-[(4-трет-бутил-2-тиазолил)метокси] бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил] феноксиацетат.
ПРИМЕР 7
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[2-(4-циклопропил-2-тиазолил) винил]бензоиламино]феноксиацетат.
ПРИМЕР 8
Этил 1-[3-(4-хлорфенилсульфонил)пропил] -2 [3-[2-(4- фенил-2-тиазолил)винил] бензоиламино] феноксиацетат (0,30 г, 0,43 ммол) растворяют в смешанном растворе тетрагидрофурана (10 мл) и метанола (5 мл), к этому раствору добавляют 1N водный раствор гидроксида натрия (1,0 мл), и смеси дают реагировать в течение 12 часов. Реакционную смесь подкисляют, добавляя лед и 10% водный раствор лимонной кислоты, и полученный продукт экстрагируют трижды хлороформом. Полученный органический слой промывают рассолом, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Путем кристаллизации полученного остатка из смеси хлороформа с ацетонитрилом получают 4-[3-(4- хлорфенилсульфонил)пропил]-2-[3-[2-(4-фенил-2-тиазолил) винил] бензоиламино] феноксиуксусную кислоту (0,24 г, 0,36 ммол, 83%) в виде бесцветных кристаллов.
Тем же способом, какой описан в примере 8, синтезируют следующие соединения примеров с 9 по 14. Структура и физико-химические свойства этих соединений приведены в таблице 14.
ПРИМЕР 9
4-[3-(4-Хлорфенилсульфонил)пропил] -2 [3-[2-[4-(4- метилфенил)-2-тиазолил]винил]бензоиламино]феноксиуксусная кислота.
ПРИМЕР 10
4-[3-(4-Хлорфенилсульфонил)пропил] -2-[3-[2-(4- изопропил-2-тиазолил)винил]бензоиламино]феноксиуксусная кислота.
ПРИМЕР 11
2-[3-[2-(4-трет-Бутил-2-тиазолил)винил] бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
ПРИМЕР 12
4-[3-(4-Хлорфенилсульфонил)пропил] -2-[3-[(4-фенил-2- тиазолил)метокси] бензоиламино]феноксиуксусная кислота.
ПРИМЕР 13
2-[3-[(4-трет-Бутил-2-тиазолил)метокси]бензоиламино]-4- [3-(4-хлорфенилсульфонил)пропил] феноксиуксусная кислота.
ПРИМЕР 14
4-[3-(4-Хлорфенилсульфонил)пропил] -2-[3-[2-(4- циклопропил-2-тиазолил)винил]бензоиламино]феноксиуксусная кислота.
Тем же способом, какой описан в примере 1, синтезируют следующие соединения примеров с 15 по 21. Структура и физико-химические свойства этих соединений приведены в таблицах 15 и 16.
ПРИМЕР 15
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(4- циклопропил-2-тиазолил)метокси]бензоиламино]феноксиацетат.
ПРИМЕР 16
Этил 2-[3-[(4-трет-бутил-2-тиазолил)метилтио] бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 17
Этил 2-[3-[2-(4-трет-бутил-2-тиазолил)этил]бензоиламино]-4- [3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 18
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3- [(4-циклогексил-2-тиазолил)метокси]бензоиламино]феноксиацетат.
ПРИМЕР 19
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(4- циклопентил-2-тиазолил)метокси]бензоиламино] феноксиацетат.
ПРИМЕР 20
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(4- циклобутил-2-тиазолил)метокси]бензоиламино]феноксиацетат.
ПРИМЕР 21
Этил 2-[3-[1-(4-трет-бутил-2-тиазолил)этокси] бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 22
1) По методу примера 1 синтезируют следующее соединение.
Этил-2-[3-[(4-трет-бутил-2-тиазолил)метокси] -5- (4-нитробензилоксикарбониламино)бензoилaминo]-4-[3- (4-хлорфенилсульфонил)пропил]феноксиацетат.
Данные масс-спектрометрии (m/z): 879 (М+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,27 (3Н, т, J=7,3 Гц), 1,34 (9Н, с), 1,98-2,06 (2Н, м), 2,67 (2Н, уш-т, J= 7,3 Гц), 3,06-3,10 (2Н, м), 4,29 (2Н, к, J=7,3 Гц), 4,70 (2Н, с), 5,28 (2Н, с), 5,43 (2Н, с), 6,82 (2Н, с), 6,92 (1Н, с), 7,23 (1Н, уш-с), 7,42 (1Н, уш-с), 7,50-7,55 (4Н, м), 7,67 (1Н, уш-с), 7,82 (2Н, д, J=8,8 Гц), 8,20 (2Н, д, J=8,8 Гц), 8,24 (1Н, уш-с), 9,30 (1Н, уш-с).
2) Этил-2-[3-[(4-трет-бутил-2-тиазолил) метокси] -5- (4-нитробензилоксикарбониламино)бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетат (0,50 г 0,57 ммол) растворяют в смеси этанола (10 мл) и тетрагидрофурана (10 мл), к раствору добавляют 10% палладий-на-угле (0,10 г) и смесь перемешивают при комнатной температуре в течение 3 часов в атмосфере водорода. Реакционную смесь фильтруют, и полученный фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент=ацетон:хлороформ=3:100) и кристаллизуют из ацетонитрила. Получают этил-2-[3-амино-5-[(4-трет-бутил-2-тиазолил) метокси]бензоиламино]-4-[3-(4-хлорфенилсульфонил) пропил]феноксиацетат (0,17 г, 0,24 ммол, 43%) в виде светло-желтых кристаллов. Его структура приведена в таблице 30.
Данные масс-спектрометрии (m/z): 700 (М+).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,28 (3Н, т, J =7,3 Гц), 1,34 (9Н, с), 1,99-2,07 (2Н, м), 2,68 (2Н, уш-т, J=7,3 Гц), 3,89 (2Н, уш-с), 4,29 (2Н, к, J=7,3 Гц), 4,70 (2Н, с), 5,39 (2Н, с), 6,52 (1Н, уш-т, J=1,9 Гц), 6,81 (2Н, с), 6,91 (1Н, с), 6,99 (1Н, уш-с), 7,07 (1Н, уш-с), 7,53 (2Н, д, J=8,8 Гц), 7,82 (2Н, д, J=8,3 Гц), 8,27 (1Н, уш-с), 9,18 (1Н, уш-с).
По методу примера 1 синтезируют следующие соединения примеров с 23 по 25. Структура и физико-химические свойства этих соединений приведены в таблице 17.
ПРИМЕР 23
Этил 4-[2-[3-[(4-трет-бутил-2-тиазолил)метокси]бензоиламино]-4- [3-[4-хлорфенилсульфонил)пропил]фенокси]бутират.
ПРИМЕР 24
Этил 2-[2-[3-[(4-трет-бутил-2-тиазолил)метокси]бензоиламино]-4- [3-(4-хлорфенилсульфонил)пропил]фенокси]-2-метилпропионат.
ПРИМЕР 25
Этил 2-[2-[3-[(4-трет-бутил-2-тиазолил)метокси бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]фенокси] пропионат
По методу примера 8 синтезируют следующие соединения примеров с 26 по 32. Структура и физико-химические свойства этих соединений приведены в Таблице 18.
ПРИМЕР 26
4-[3-(4-Хлорфенилсульфонил)пропил] -2-[3-[(4-циклопропил-2-тиазолил) метокси]бензоиламино]феноксиуксусная кислота.
ПРИМЕР 27
2-[3-[(4-трет-Бутил-2-тиазолил)метилтио] бензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
ПРИМЕР 28
2-[3-[2-(4-трет-Бутил-2-тиазолил)этил] бензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
ПРИМЕР 29
4-[3-(4-Хлорфенилсульфонил)пропил] -2-[3-[(4-циклогексил- 2-тиазолил)метокси]бензоиламино]феноксиуксусная кислота.
ПРИМЕР 30
4-[3-(4-Хлорфенилсульфонил)пропил] -2-[3-[(4-циклопентил-2-тиазолил) метокси]бензоиламино]феноксиуксусная кислота.
ПРИМЕР 31
4-[3-(4-Хлорфенилсульфонил)пропил] -2-[3-[(4-циклобутил-2-тиазолил) метокси]бензоиламино]феноксиуксусная кислота.
ПРИМЕР 32
2-[3-[1-(4-трет-Бутил-2-тиазолил)этокси] бензоиламино] - 4-[3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
ПРИМЕР 33
По методу примера 8 синтезируют следующее соединение. Его структура приведена в таблице 30.
2-[3-Амино-5-[(4-тpет-бутил-2-тиaзoлил)метoкcи] бензoиламино]-4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
Темп. плавления: 133-135oC.
Данные масс-спектрометрии (m/z): 672 (М+)
Данные элементного анализа (для C32H34N3O7S2Cl)
Рассчитано, %: C 55,68; H 5,26; N 6,09; S 9,29; Cl 5,14;
Обнаружено, %: C 55,47; H 5,02; N 6,06; S 9,10; Cl 4,92.
По методу примера 8 синтезируют следующие соединения примеров с 34 по 36. Структура и физико-химические свойства этих соединений приведены в таблице 19.
ПРИМЕР 34
4-[2-[3-[(4-трет-Бутил-2-тиазолил)метокси] бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]фенокси] масляная кислота
ПРИМЕР 35
2-[2-(3-[(4-трет-Бутил-2-тиазолил)метокси] бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]фенокси]-2-метилпропионовая кислота, полугидрат.
ПРИМЕР 36
2-[2-[3-[(4-трет-Бутил-2-тиазолил)метокси] бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил]фенокси]пропионовая кислота, полугидрат.
ПРИМЕР 37
Этил-2-[3-[(4-трет-бутил-2-тиазолил)метокси] бензоиламино] -4-[3- (4-хлорфенилсульфонил)пропил] феноксиуксусную кислоту (0,30 г, 0,44 ммол) растворяют в метаноле, насыщенном аммиаком (10 мл), и этому раствору дают реагировать в течение 12 часов при комнатной температуре. Реакционный раствор концентрируют при пониженном давлении, и полученный остаток кристаллизуют из ацетонитрила. Получают 2-[3-[(4-трет-бутил-2-тиазолил)метокси] бензоиламино] -4-[3-(4-хлорфенилсульфонил) пропил]феноксиацетамид (0,22 г, 0,34 ммол, 77%) в виде бесцветных кристаллов. Его структура приведена в таблице 30.
Темп. плавления: 147-148oC.
Данные масс-спектрометрии (m/z): 656 (М+).
Данные элементного анализа (для C32H34N3O6S2Cl)
Рассчитано, %: C 58,57; H 5,22; N 6,40; S 9,77; Cl 5,40;
Обнаружено, %: C 58,39; H 5,13; N 6,38; S 9,65; Cl 5,30.
ПРИМЕР 38
Диметилформамид (5,0 мл) добавляют к смеси 3-[2-(4-трет-бутил-2-тиазолил)этил] -5'-[3-(4-хлорфенилсульфонил) пропил] -2'-цианометоксибензанилида (0,57 г, 0,90 ммол), хлористого аммония (96 мг, 1,8 ммол) и азида натрия (0,12 г, 1,9 ммол), и полученную смесь перемешивают при 70oC в течение 12 часов. К реакционному раствору добавляют лед и 10% водный раствор лимонной кислоты. Полученный продукт экстрагируют этилацетатом. Полученный органический слой промывают водой и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент = метанол: хлороформ = 3:100) и затем кристаллизуют из ацетонитрила. Получают 3-[2-(4-трет-бутил-2-тиазолил)этил] -5'-[3-(4- хлорфенилсульфонил)пропил] -2'-(1Н-тетразол-5-илметокси)бензанилид (0,34 г, 0,50 ммол, 56%) в виде бесцветных кристаллов. Его строение приведено в таблице 30.
Темп. плавления: 152-153oC.
Данные масс-спектрометрии (m/z): 679 (М+)
По методу примера 38 синтезируют следующие соединения примеров с 39 по 41. Структура и физико-химические свойства этих соединений приведены в таблице 20.
ПРИМЕР 39
3-[(4-трет-Бутил-2-тиазолил)метокси] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1Н-тетразол-5-илметокси) бензанилид.
ПРИМЕР 40
3-[(4-трет-Бутил-2-тиазолил)метилтио] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(1Н-тетразол-5-илметокси) бензанилид, 0,7 гидрат.
ПРИМЕР 41
5'-[3-(4-Хлорфенилсульфонил)пропил]-3-[2-(4- циклобутил-2-тиазолил)этил] -2'-(1Н-тетразол-5-илметокси)бензанилид.
ПРИМЕР 42
Этанол (5,0 мл) добавляют к 2-[3-[(4-трет-бутил-2-тиазолил)метокси] бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил] феноксиуксусной кислоте (0,30 г, 0,46 ммол), и смесь перемешивают при комнатной температуре. Эту суспензию превращают в однородный раствор путем добавления 0,1 N раствора гидроксида калия в этаноле (4,6 мл), и затем концентрируют при пониженном давлении. Полученный остаток сушат в вакууме и затем растворяют в ацетоне (10 мл). Полученный раствор охлаждают льдом, и добавляют 4-хлорметил-5-метил-1,3-диоксол-2-он (0,10 г, 0,67 ммол) и йодистый натрий (0,21 г, 1,4 ммол), и смесь перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют лед и насыщенный водный раствор бикарбоната натрия, и образовавшийся продукт экстрагируют этилацетатом. Полученный органический слой промывают насыщенным водным раствором бикарбоната натрия, 10% водным раствором лимонной кислоты и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент = ацетон : хлороформ = 3:100) и кристаллизуют из смеси хлороформа с диэтиловым эфиром. Получают (5-метил-2-оксо-1,3-диоксол-4-ил)метил=2-[3-[(4-трет-бутил-2-тиазолил)метокси] бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил] феноксиуксусную кислоту (0,15 г, 0,19 ммол, 43%) в виде бесцветных кристаллов. Ее структура приведена в таблице 30.
Темп. плавления: 114-116oC.
Данные масс-спектрометрии (m/z): 769 (М+)
Данные элементного анализа (для C37H37N2O10S2Cl)
Рассчитано, %: C 57,77; H 4,85; N 3,64; S 8,34; Cl 4,61;
Обнаружено, %: C 57,74; H 4,78; N 3,67; S 8,41; Cl 4,67.
По методу примера 42 синтезируют следующее соединение.
ПРИМЕР 43
Пивалоилоксиметил= 2-[3-[(4-трет-бутил-2-тиазолил)метокси] бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
Темп. плавления: 98-100oC.
Данные масс-спектрометрии (m/z): 177 (М+)
Данные элементного анализа (для C38H43N2O9S2Cl)
Рассчитано, %: C 59,17; H 5,62; N 3,63; S 8,34; Cl 4,60;
Обнаружено, %: C 59,42; H 5,62; N 3,56; S 8,41; Cl 4,64.
ПРИМЕР 44
При охлаждении льдом моногидрат гидразина (190 мкл, 3,8 ммол) добавляют к смеси N-[2-[2-[3-[(4-трет-бутил-2-тиазолил) метокси]бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил] фенокси] этил] фталимида (1,5 г, 1,9 ммол), этанола (5 мл) и тетрагидрофурана (20 мл), и полученную смесь перемешивают в течение ночи при комнатной температуре, а затем кипятят с обратным холодильником в течение 3 часов. К реакционному раствору добавляют воду со льдом, и затем образовавшийся продукт экстрагируют хлороформом. Полученный органический слой промывают насыщенным водным раствором бикарбоната натрия и дистиллированной водой в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент = хлороформ:ацетон=2:1), превращают в гидрохлорид путем добавления 4 N раствора соляной кислоты в этилацетате и затем кристаллизуют из диэтилового эфира. Получают 3-[(4-трет-бутил-2-тиазолил) метокси] -5'-[3-(4-хлорфенилсульфонил)пропил]-2'-(2- аминоэтокси] бензанилид, 1,4 гидрохлорид·0,7 гидрат (160 мг, 0,23 ммол, 12%), в виде белых кристаллов.
Температура плавления: 93-96oC.
Данные масс-спектрометрии (m/z): 642 (М+)
Данные элементного анализа (для C32H36N3O5S2Cl · 1,4HCl · 0,7H2O)
Рассчитано, %: C 54,45; H 5,54; N 5,95; S 9,09; Cl 12,05;
Обнаружено, %: C 54,23; H 5,42; N 5,87; S 8,95; Cl 11,90.
ПРИМЕР 45
При охлаждении льдом добавляют уксусный ангидрид (30 мкл, 0,3 ммол) к смеси 3-[(4-трет-бутил-2-тиазолил)метокси] -5'-[3- (4-хлорфенилсульфонил)пропил] -2'-(2-аминоэтокси)бензанилида, 1,4 гидрохлорид · 0,7 гидрата (170 мг, 0,24 ммол), дихлорметана (2 мл) и пиридина (32 мкл, 0,4 ммол). Полученную смесь перемешивают при комнатной температуре в течение 3 часов. К реакционной смеси добавляют лед с водой, и смесь перемешивают в течение 1 часа. Образовавшийся продукт экстрагируют хлороформом, и полученный органический слой промывают 20% водным раствором гидросульфата калия, насыщенным водным раствором бикарбоната натрия и дистиллированной водой в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют. Полученный остаток кристаллизуют из смеси хлороформа с эфиром. Получают 3-[(4-трет-бутил-2-тиазолил)метокси] -5'-[3-(4- хлорфенилсульфонил)пропил]-2'-(2-ацетиламиноэтокси)бензанилида полугидрат (97 мг, 0,14 ммол, 58%) в виде белых кристаллов.
Темп.плавления: 110,5-111,5oC.
Данные масс-спектрометрии (m/z): 684 (М+)
Данные элементного анализа (для C34H38N3O6S2Cl · 0,5H2O)
Рассчитано, %: C 58,90; H 5,67; N 6,06; S 9,25; Cl 5,11;
Обнаружено, %: C 58,94; H 5,45; N 6,02; S 9,31; Cl 5,12.
По методу примера 45 синтезируют следующее соединение.
ПРИМЕР 46
3-[(4-трет-Бутил-2-тиазолил)метокси]-5'-[3-(4- (хлорфенилсульфонил)пропил]-2'-(2- метилсульфониламиноэтокси)бензанилид.
Темп.плавления: 125,5-126oC
Данные масс-спектрометрии (m/z): 720 (М+)
Данные элементного анализа (для C33H38N3O7S3Cl)
Рассчитано, %: C 55,03; H 5,32; N 5,83; S 13,35; Cl 4,92;
Обнаружено, %: C 54,97; H 5,32; N 5,77; S 13,54; Cl 4,84.
Тем же способом, какой описан в примере 1, получают следующие соединения примеров с 47 по 59.
ПРИМЕР 47
Этил 2-[3-[(4-трет-бутил-2-тиазолил)метокси] -5-хлорбензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
Данные масс-спектрометрии (m/z): 718 (М+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,29 (3Н, т, J=7,3 Гц), 1,35 (9Н, с), 2,00-2,07 (2Н, м), 2,69 (2Н, уш-т, J= 7,3 Гц), 3,06-3,10 (2Н, м), 4,31 (2Н, к, J=7,3 Гц), 4,71 (2Н, с), 5,43 (2Н, с), 6,84 (2Н, уш-с), 6,94 (1Н, с), 7,24 (1Н, уш-с), 7,53 (2Н, уш-д, J= 8,3 Гц), 7,61-7,65 (2Н, м), 7,82 (2Н, уш-д, J=8,3 Гц), 8,25 (1Н, уш-с), 9,35 (1Н, уш-с).
ПРИМЕР 48
Этил 2-[5-[(4-трет-бутил-2-тиазолил)метокси] -2-хлорбензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
Данные масс-спектрометрии (m/z): 719 (М+Н)+
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,25 (3Н, т, J=6,8 Гц), 1,35 (9Н, с), 2,02-2,08 (2Н, м), 2,70 (2Н, уш-т, J= 7,3 Гц), 3,08-3,12 (2Н, м), 4,25 (2Н, к, J=6,8 Гц), 4,66 (2Н, с), 5,38 (2Н, с), 6,78 (1Н, уш-д, J=8,3 Гц), 6,84 (1Н, уш-д, J =8,3 Гц), 6,92 (1H, с), 7,07 (1Н, дд, J=8,8, 2,0 Гц), 7,37 (1Н, уш-д, J=8,8 Гц), 7,49 (1Н, д, J= 2,0 Гц), 7,54 (2Н, уш-д, J=8,8 Гц), 7,83 (2Н, уш-д, J=8,8 Гц), 8,33 (1Н, д, J=2,0 Гц), 9,01 (1Н, с).
ПРИМЕР 49
Этил 2-[3-[(4-трет-бутил-2-тиазолил)метокси] -4-метокси]- бензoиламинo] -4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
Данные масс-спектрометрии (m/z): 715 (М+)
Спектр ядерного магнитного резонанса (CDCl3), ТМС - внутренний стандарт).
δ: 1,29 (3Н, т, J = 6,8 Гц), 1,33 (9Н, с), 1,99-2,07 (2Н, м), 2,69 (2Н, уш-т, J= 7,3 Гц), 3,06-3,10 (2Н, м), 3,96 (3Н, с), 4,29 (2Н, к, J=6,8 Гц), 4,70 (2Н, с), 5,50 (2Н, с), 6,80 (1Н, уш-д, J=8,3 Гц), 6,82 (1Н, уш-с), 6,91 (1Н, с), 7,01 (1Н, уш-д, J=8,3 Гц), 7,52 (2Н, уш-д, J =8,3 Гц), 7,71 (1Н, дд, J=8,3, 2,0 Гц), 7,80 (1Н, дд, J=8,3, 2,0 Гц), 7,82 (2Н, уш-д, J=8,3 Гц), 8,28 (1Н, с), 9,27 (1Н, с).
ПРИМЕР 50
Этил 2-[3-[(4-трет-бутил-2-тиазолил)метокси] -4- хлор-бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил] феноксиацетат.
Данные масс-спектрометрии (m/z): 719 [(M+H)+]
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,30 (3Н, т, J=6,8 Гц), 1,34 (9Н, с), 2,02-2,06 (2Н, м), 2,70 (2Н, уш-т, J= 7,3 Гц), 3,06-3,11 (2Н, м), 4,32 (2Н, к, J=6,8 Гц), 4,71 (2Н, с), 5,55 (2Н, с), 6,86 (2Н, уш-д, J=8,3 Гц), 6,94 (1Н, с), 7,53 (2Н, уш-д, J=8,8 Гц), 7,54 (1Н, с), 7,82 (2Н, уш-д, J=8,8 Гц), 7,85 (1Н, д, J=2,0 Гц), 8,26 (1Н, с), 9,47 (1Н, с).
ПРИМЕР 51
Этил 2-[3-[(4-трет-бутил-2-тиазолил)метокси] -4- метилбензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
Данные масс-спектрометрии (m/z) : 699 (М+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,30 (3Н, т, J =7,3 Гц), 1,35 (9Н, с), 2,00-2,08 (2Н, м), 2,38 (3Н, с), 2,69 (2Н, уш-т, J=7,3 Гц), 3,07-3,11 (2Н, м), 4,32 (2Н, к, J=7,3 Гц), 4,71 (2Н, с), 5,48 (2Н, уш-с), 6,85 (2Н, уш-с), 6,92 (1Н, уш-с), 7,30 (1Н, д, J= 7,8 Гц), 7,53 (2Н, дд, J=8,3, 2,0 Гц), 7,58 (1Н, д, J=7,8 Гц), 7,69 (1Н, уш-с), 7,82 (2Н, уш-д, J=8,3 Гц), 8,30 (1Н, с), 9,35 (1Н, с).
ПРИМЕР 52
Этил 2-[-3-[(4-трет-бутил-2-тиазолил)метокси]-4- нитробензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
Данные масс-спектрометрии (m/z.): 730 (М+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,31 (3H, т, J=7,3 Гц), 1,33 (9Н, с), 2,01-2,08 (2Н, м), 2,71 (2Н, уш-т, J= 7,3 Гц), 3,07-3,11 (2Н, м), 4,33 (2Н, к, J=7,3 Гц), 4,73 (2Н, с), 5,63 (2Н, с), 6,89 (2Н, с), 6,95 (1Н, с), 7,54 (2Н, уш-д, J=8,8 Гц), 7,78 (1Н, дд, J=8,3, 1,5 Гц), 7,83 (2Н, уш-д, J=8,8 Гц), 7,99 (1Н, д, J=8,3 Гц), 8,05 (1H, д, J=1,5 Гц), 8,25 (1Н, с), 9,67 (1Н, с).
ПРИМЕР 53
Этил 2-[3-[(4-трет-бутил-5-метил-2-тиазолил)метокси] бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
Данные масс-спектрометрии (m/z): 699 (М+Н)+
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт)
δ: 1,29 (3Н, т, J = 7,3 Гц), 1,40 (9Н, с), 2,04-2,06 (2Н, м), 2,51 (3Н, с), 2,69 (2Н, уш-т, J=7,3 Гц), 3,07-3,11 (2Н, м), 4,29 (2Н, к, J=7,3 Гц), 4,71 (2Н, с), 5,33 (2Н, с), 6,82 (2Н, уш-с), 7,24 (1H, д, J=7,8 Гц), 7,42 (1Н, т, J=7,8 Гц), 7,53 (2Н, уш-д, J=8,3 Гц), 7,62 (1H, д, J=7,8 Гц), 7,69 (1H, уш-с), 7,82 (2Н, уш-д, J=8,3 Гц), 8,30 (1H, с), 9,25 (1H, с).
ПРИМЕР 54
Этил 2-[6-[(4-трет-бутил-2-тиазолил)метокси] -2-пиридил- карбониламино] -4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
Данные масс-спектрометрии (m/z): 686 (М+)
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,21 (3Н, т, J=7,2 Гц), 1,34 (9Н, с), 2,01-2,08 (2Н, м), 2,19 (2Н, т, J= 7,3 Гц), 3,06-3,10 (2Н, м), 4,18 (2Н, к, J=7,2 Гц), 4,65 (2Н, с), 5,83 (2Н, с), 7,76 (1Н, д, J=8,4 Гц), 6,81 (1Н, д, J=8,4 Гц), 6,90 (1Н, с), 7,05 (1Н, д, J=8,4 Гц), 7,52 (2Н, д, J=8,4 Гц), 7,80-7,85 (3Н, м), 7,92 (1Н, д, J=7,2 Гц), 8,38 (1Н, с), 10,6 (1Н, с).
ПРИМЕР 55
Этил 6-[3-[(4-трет-бутил-2-тиазолил)метокси] бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]-2,3-дихлорфеноксиацетат.
Данные масс-спектрометрии (m/z): 755 (М+Н)+
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,28 (3Н, т, J=7,3 Гц), 1,35 (9Н, с), 2,03-2,12 (2Н, м), 2,90 (2Н, уш-д, J= 7,3 Гц), 3,12-3,17 (2Н, м), 4,31 (2Н, к, J=7,3 Гц), 4,78 (2Н, с), 5,47 (2Н, с), 6,93 (1Н, с), 7,24 (1Н, уш-д, J = 8,3 Гц), 7,45 (1Н, уш-т, J= 8,3 Гц), 7,54 (2Н, д, J=8,8 Гц), 7,85 (1Н, уш-с), 7,86 (2Н, д, J=8,8 Гц), 8,31 (1Н, с), 10,14 (1H, уш-с).
ПРИМЕР 56
Этил 2-[3-[(4-трет-бутил-2-тиазолил)метокси] бензоиламино] -6-хлор-4- [3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
Данные масс-спектрометрии (m/z): 719 (М+Н)+
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,16 (3Н, т, J=7,3 Гц), 1,30 (9Н, с), 1,78-1,87 (2Н, м), 2,26-2,36 (2Н, м), 3,33-3,38 (2Н, м), 4,18 (2Н, к, J=7,3 Гц), 4,82 (2Н, с), 5,52 (2Н, с), 7,10 (1H, уш-с), 7,32-7,34 (2Н, м), 7,51 (IH, уш-т, J=7,8 Гц), 7,64 (1H, уш-д, J=7,8 Гц), 7,72-7,75 (3Н, м), 7,91 (2Н, дд, J=8,8, 2,0 Гц), 10,14 (1H, уш-с).
ПРИМЕР 57
Этил 2-[2-[3-[(4-трет-бутил-2-тиазолил)метокси]бензоиламино]-4- [3-(4-хлорфенилсульфонил)пропил]фенокси]-2-фторацетат.
Данные масс-спектрометрии (m/z.) : 703 (М+Н)+
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,31 (3Н, т, J=7,3 Гц), 1,36 (9Н, с), 2,02-2,10 (2Н, м), 2,71-2,75 (2Н, уш-т, J= 7,3 Гц), 3,07-3,11 (2Н, м), 4,36-4,43 (2Н, м), 5,44 (2H, с), 5,83 (1Н, д, J=58 Гц), 6,88 (1H, дд, J=8,3, 2,0 Гц), 6,93 (1H, с), 7,15 (1H, уш-д, J= 8,3 Гц), 7,22 (1H, дд, J=8,3, 2,0 Гц), 7,44 (1H, т, J=8,3 Гц), 7,52-7,59 (3Н, м), 7,63 (1H, т, J=2,0 Гц), 7,82-7,89
(2H, м), 8,39 (1H, д, J=2,0 Гц), 8,75 (1H, с).
ПРИМЕР 58
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3- [(4,5,6,7-тетрагидро-2-бензотиазолил)метокси]бензоиламино] феноксиацетат
Данные масс-спектрометрии (m/z) : 683 (М+).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,28 (3Н, т, J=6,0 Гц), 1,83-1,90 (4Н, м), 2,01-2,07 (2Н, м), 2,69 (2Н, т, J=6,0 Гц), 2,78-2,81 (4Н, м), 3,07-3,10 (2Н, м), 4,28 (2Н, к, J=7,0 Гц), 4,70 (2Н, с), 5,37 (2Н, с), 6,82 (2Н, с), 7,19 (1H, д, J=6,4 Гц), 7,42 (1H, т, J=6,4 Гц), 7,53 (2Н, д, J=6,8 Гц), 7,62 (1H, д, J=6,4 Гц), 7,68 (1H, с), 7,82 (2Н, д, J=6,8 Гц), 8,30 (1H, с), 9,22 (1H, с).
ПРИМЕР 59
Трет-Бутил 2-[3-[2-(4-трет-бутил-2-тиазолил)этокси] бензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,34 (9Н, с), 1,48 (9Н, с), 1,98-2,07 (2Н, м), 2,69 (2Н, т, J=7,3 Гц), 3,06-3,10 (2Н, м), 3,49 (2Н, т, J=6,4 Гц), 4,32 (2Н, т, J=6,4 Гц), 4,58 (2Н, с), 6,77-6,83 (3Н, м), 7,11 (1H, д, J=8,6 Гц), 7,40 (1H, т, J=8,0 Гц), 7,53 (2Н, д, J=8,4 Гц), 7,58-7,60 (2Н, м), 7,82 (2Н, д, J=8,4 Гц), 8,29 (1H, с), 9,23 (1H, с).
Тем же способом, какой описан в примере 8, получают следующие соединения примеров с 60 по 72.
ПРИМЕР 60
4-[3-(4-Хлорфенилсульфонил)пропил] -2-[3-(4,5,6,7-тетрагидро-2- бензотиазолилметокси)бензоиламино]феноксиуксусная кислота.
Темп. плавления: 213oC.
Данные элементного анализа (для C32H31N2S2O7Cl)
Рассчитано, %: C 58,66; H 4,77; N 4,28; S 9,79; Cl 5,41;
Обнаружено, %: C 58,50; H 4,75; N 4,19; S 9,80; Cl 5,22.
ПРИМЕР 61
2-[3-[(4-трет-Бутил-2-тиазолил)метокси] -5-хлорбензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
Темп. плавления: 143-145oC.
Данные элементного анализа (для C32H32N2O7S2Cl2)
Рассчитано, %: C 55,57; H 4,66; N 4,05; S 9,27; Cl 10,25;
Обнаружено, %: C 55,59; H 4,59; N 4,14; S 9,33; Cl 10,17.
ПРИМЕР 62
2-[5-[(4-трет-Бутил-2-тиазолил)фенокси] -2-хлорбензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусной кислоты· 0,85 гидрат.
Данные элементного анализа (для C32H32N2S2O7Cl2 · 0,85H2O)
Рассчитано, %: C 54,З7; H 4,80; N 3,96; S 9,07; Cl 10,03;
Обнаружено, %: C 53,97; H 4,40; N 3,91; S 9,03; Cl 10,00.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 1,75-1,85 (2Н, м), 2,58-2,63 (2Н, м), 3,34-3,38 (2Н, м), 4,21 (2Н, с), 5,46 (2Н, с), 6,85 (1Н, уш-д, J=8,3 Гц), 6,96 (1Н, уш-д, J= 8,3 Гц), 7,18 (1Н, дд, J=8,8, 2,0 Гц), 7,33 (1Н, с), 7,38 (1Н, д, J=2,0 Гц), 7,45 (1Н, уш-д, J=8,8 Гц), 7,67 (1Н, уш-с), 7,73 (2Н, уш-д, J=8,3 Гц), 7,90 (1Н, уш-с), 7,91 (2Н, уш-д, J=8,3 Гц), 11,95 (1Н, уш-с).
ПРИМЕР 63
2-[3-[(4-трет-Бутил-2-тиазолил)метокси] -4-метоксибензоиламино] -4-[3- (4-хлорфенилсульфонил)пропил] феноксиуксусной кислоты · 0,5 гидрат.
Данные элементного анализа (для C33H35N2S2O8Cl · 0,5H2O)
Рассчитано, %: C 56,93; H 5,21; N 4,02; S 9,21; Cl 5,09;
Обнаружено, %: C 56,80; H 5,11; N 4,08; S 9,32; Cl 5,09.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 1,81-1,83 (2Н, м), 2,61 (2Н, уш-т, J=7,8 Гц), 3,32-3,37 (2Н, м), 3,88 (3Н, с), 4,74 (2Н, с), 5,45 (2Н, с), 6,89 (1Н, д, J=8,3 Гц), 6,99 (1Н, д, J=8,3 Гц), 7,15 (1Н, д, J=8,3 Гц), 7,31 (1Н, с), 7,66 (1Н, д, J= 8,3 Гц), 7,73 (2Н, уш-д, J=8,3 Гц), 7,44 (1Н, уш-с), 7,78 (1Н, д, J=1,5 Гц), 7,90 (2Н, уш-д, J=8,3 Гц), 9,50 (1Н, с), 13,19 (1Н, с).
ПРИМЕР 64
2-[3-[(4-трет-Бутил-2-тиазолил)метокси] -4-хлорбензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
Темп. плавления: 179,5-181,5oC.
Данные элементного анализа (для C32H32N2S2O7Cl2)
Рассчитано, %: C 55,47; H 4,66; N 4,05; S 9,27; Cl 10,25;
Обнаружено, %: C 55,75: 4,64; N 4,16; S 9,34; Cl 10,09.
ПРИМЕР 65
2-[3-[(4-трет-Бутил-2-тиазолил)метокси] -4-метилбензоиламино]-4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусной кислоты гидрат.
Данные элементного анализа (для C33H35N2S2O7Cl · H2O)
Рассчитано, %: C 57,51; H 5,41; N 4,06; S 9,30; Cl 5,14;
Обнаружено, %: C 57,79; H 5,33; N 4,05; S 9,34; Cl 4,99.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 1,75-1,87 (2Н, м), 2,30 (3Н, с), 2,61 (2Н, уш-т, J=7,8 Гц), 3,32-3,37 (2Н, м), 4,74 (2Н, с), 5,51 (2Н, с), 6,91 (1Н, д, J=8,3 Гц), 6,99 (1H, д, J=8,3 Гц), 7,31 (1H, с), 7,35 (1H, д, J = 7,8 Гц), 7,53 (1H, д, J= 7,8 Гц), 7,68 (1H, с), 7,73 (2Н, уш-д, J=8,3 Гц), 7,78 (1H, с), 7,90 (2Н, уш-д, J=8,3 Гц), 9,56 (1H, с), 13,20 (1H, с).
ПРИМЕР 66
2-[3-[(4-трет-Бутил-2-тиазолил)метокси] -4-нитробензоиламино]-4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусной кислоты 0,5 гидрат.
Темп. плавления: 85,5-87,5oC.
Данные элементного анализа (для C32H32N3S2O9Cl · 0,5H2O)
Рассчитано, %: C 54,04; H 4,68; N 5,91; S 9,02; Cl 4,98;
Обнаружено, %: C, 53,99; H 4,82; N 5,87; S 8,87; Cl 4,65.
ПРИМЕР 67
2-[6-(4-трет-Бутил-2-тиазолилметокси)-2-пиридилкарбониламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусной кислоты 0,5 гидрат.
Темп. плавления: 169-171oC.
Данные элементного анализа (для C31H32N3S2O7Cl · 0,5 H2O).
Рассчитано, %: C 55,81; H 4,99; N 6,30; S 9,61; Cl 5,31;
Обнаружено, %: C 55,99; H 4,85; N 6,19; S 9,58; Cl 5,39.
ПРИМЕР 68
6-[3-[(4-трет-Бутил-2-тиазолил)метокси] бензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]-2,3-дихлорфеноксиуксусная кислота.
Темп. плавления: 191-193oC.
Данные элементного анализа (для C32H31N2O7S2Cl3)
Рассчитано, %: C 52,93; H 4,30; N 3,86; S 8,83; Cl 14,65;
Обнаружено, %: C 52,80; H 4,40; N 3,83; S 8,84; Cl 14,53.
ПРИМЕР 69
2-[3-[(4-трет-Бутил-2-тиазолил)метокси] бензоиламино] -6-хлор-4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
Темп.плавления: 201-203oC.
Данные элементного анализа (для C32H32N2O7S2Cl2)
Рассчитано, %: C 55,57; H 4,66; N 4,05; S 9,27; Cl 10,25;
Обнаружено, %: C 55,32; H 4,65; N 4,27; S 9,19; Cl 10,43.
ПРИМЕР 70
2-[3-[(4-трет-Бутил-2-тиазолил)метокси]тиобензоиламино]-4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусной кислоты 0,5 гидрат.
Данные элементного анализа (для C32H33N2S3O6Cl2 · 0,5H2O)
Рассчитано, %: C 56,33; H 5,02; N 4,11; S 14,10; Cl 5,20;
Обнаружено, %: C 56,41; H 4,84; N 4,01; S 13,86; Cl 4,99.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 1,79-1,83 (2Н, м), 2,63 (2Н, т, J=7,3 Гц), 3,33-3,36 (2Н, м), 4,68 (2Н, с), 5,48 (2Н, с), 7,00 (1Н, д, J=8,4 Гц), 7,07 (1Н, д, J= 8,4 Гц), 7,24 (1Н, д, J= 8,4 Гц), 7,32 (1Н, с), 7,40 (1Н, т, J=8,0 Гц), 7,52-7,59 (3Н, м), 7,73 (2Н, д, J=8,3 Гц), 7,89 (2Н, д, J=8,3 Гц), 11,2 (1Н, с), 13,1 (1Н, с).
ПРИМЕР 71
2-[N-[3-[(4-трет-Бутил-2-тиазолил)метокси] бензоил] -N- метиламино]-4-[3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
Данные элементного анализа (для C33H35N2S2O7Cl · H2O)
Рассчитано, %: C 59,05; H 5,26; N 4,17; S 9,55; Cl 5,28;
Обнаружено, %: C 58,67; H 5,19; N 4,13; S 9,45; Cl 5,12.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,29 (9Н, с), 1,56-1,68 (2Н, м), 2,35-2,60 (2Н, м), 2,94-3,15 (2Н, м), 3,23 (3Н, с), 4,67 (2Н, с), 5,23 (2Н, м), 6,74-7,07 (7Н, м), 7,28 (1Н, м), 7,73 (2Н, д, J=8,3 Гц), 7,84 (2Н, д, J=8,3 Гц), 13,1 (1Н, с).
ПРИМЕР 72
2-[3-[(4-трет-Бутил-5-метил-2-тиазолил)метокси] бензоиламино]-4-[3- (4-хлорфенилсульфонил)пропил] феноксиуксусной кислоты 0,5 гидрат.
Данные элементного анализа (для C33H35N2S2O7Cl · 0,5 H2О)
Рассчитано, %: C 58,27; H 5,33; N 4,12; S 9,43; Cl 5,21;
Обнаружено, %: C 58,66; H 5,34; N 4,07; S 9,09; Cl 5,00.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,36 (9Н, с), 1,79-1,85 (2Н, м), 2,51 (3Н, с), 2,61 (2Н, уш-т, J=7,3 Гц), 3,32-3,37 (2Н, м), 4,74 (2Н, с), 5,37 (2Н, с), 6,91 (1Н, уш-д, J=7,3 Гц), 7,00 (1Н, д, J=7,3 Гц), 7,28 (1Н, дд, J=8,3, 2,0 Гц), 7,47 (1Н, т, J = 8,3 Гц), 7,59 (1Н, уш-д, J=8,3 Гц), 7,63 (1Н, уш-с), 7,73 (2Н, д, J=8,3 Гц), 7,79 (1Н, уш-с), 7,90 (2Н, д, J=8,3 Гц), 9,65 (1Н, с), 13,20 (1Н, уш-с).
Тем же способом, какой описан в примере 38, получают следующие соединения примеров 73 и 74.
ПРИМЕР 73
3-(4-трет-Бутил-2-тиазолилметокси)-5'-[3-(фенилсульфонил)пропил] -2- (1Н-тетразол-5-илметокси)бензанилид.
Данные элементного анализа (для C32H34N6S2O5)
Рассчитано, %: C 59,42; H 5,30; N 12,99; S 9,92;
Обнаружено, %: C 59,02; H 5,28; N 12,85; S 10,01.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,30 (9Н, с), 1,76-1,84 (2Н, м), 2,61 (2Н, т, J=7,3 Гц), 3,28-3,31 (2Н, м), 5,47 (2Н, с), 5,55 (2Н, с), 6,95 (1Н, д, J=8,0 Гц), 7,15 (1Н, д, J= 8,8 Гц), 7,28-7,33 (2Н, м), 7,47 (1Н, т, J=8,0 Гц), 7,55 (1Н, д, J=7,6 Гц), 7,61 (1Н, с), 7,64-7,69 (3H, м), 7,70-7,77 (1Н, м), 7,89 (2Н, д, J = 7,2 Гц), 9,48 (1Н, с).
ПРИМЕР 74
5'-[3-(4-Хлорфенилсульфонил)пропил]-3-[(4- циклобутил-2-тиазолил)метокси]-2'-(1Н-тетразол-5-илметокси)бензанилид
Темп. плавления: 178,5-180,0oC.
Данные элементного анализа (для C32H31N6S2O5Cl)
Рассчитано, %: C 56,59; H 4,60; N 12,37; S 9,44; Cl 5,22;
Обнаружено, %: C 56,62; H 4,60; N 12,39; S 9,54; Cl 5,14.
ПРИМЕР 75
Смесь этил 2-[3-[(4-трет-бутил-2-тиазолил)метокси] бензоиламино]-4-[3- (4-хлорфенилсульфонил)пропил]феноксиацетата
(176 мг, 0,26 ммол), дифосфопентасульфида (69 мг, 0,31 ммол), бикарбоната натрия (20 мг, 0,33 ммол) и 1,2-диметоксиэтана (5 мл) перемешивают в течение 5 часов при кипячении с обратным холодильником, и нерастворимое вещество удаляют фильтрацией. Полученный фильтрат разбавляют этилацетатом, промывают водой и рассолом в указанной последовательности, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. После этого полученный остаток очищают колоночной хроматографией на силикагеле (элюент = гексан: этилацетат = 3:1-2:1). Получают этил 2-[3-[(4-третбутил-2- тиазолил)метокси] тиобензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил] феноксиацетат (143 мг, 0,20 ммол, 78%).
Данные масс-спектрометрии (m/z,): 701 (М+).
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,25 (3Н, с), 1,35 (9Н, с), 2,02-2,12 (2Н, м), 2,73 (2Н, т, J=7,2 Гц), 3,11-3,15 (2Н, м), 4,25 (2Н, к, J=7,2 Гц), 4,71 (2Н, с), 5,43 (2Н, с), 6,88-6,98 (3Н, м), 7,15 (1Н, д, J=8,4 Гц), 7,37 (1Н, т, J=8,0 Гц), 7,54 (2Н, д, J=8,8 Гц), 7,61 (1Н, д, J=7,2 Гц), 7,68 (1Н, с), 7,84 (2Н, д, J=8,8 Гц), 8,79 (1Н, с), 10,4 (1Н, с).
ПРИМЕР 76
При охлаждении льдом к смеси трет-бутил 2-[3-[2-(4-трет-бутил-2-тиазолил) этокси]бензоиламино]-4-[3-(4-хлорфенилсульфонил пропил] феноксиацетата (185 мг, 0,25 ммол) и дихлорметана (2 мл) добавляют трифторуксусную кислоту (1,2 мл). Полученный реакционный раствор перемешивают при комнатной температуре в течение 3 часов и затем концентрируют при пониженном давлении, к полученному остатку добавляют насыщенный водный раствор бикарбоната натрия, и образовавшийся продукт экстрагируют этилацетатом. Экстракт промывают рассолом, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток растворяют в воде, и pH раствора доводят до 2, добавляя 10% водный раствор лимонной кислоты. После этого образовавшееся твердое вещество собирают фильтрацией и очищают колоночной хроматографией на силикагеле (элюент = хлороформ: метанол = 50:1). Получают полугидрат 2-[3-[2-(4-трет-бутил-2-тиазолил)этокси] бензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусной кислоты (58 мг, 0,086 ммол, 34%).
Данные элементного анализа (для C33H35N2S2O7Cl · 0,5 H2O)
Рассчитано, %: C 58,27; H 5,33; N 4,12; S 9,43; Cl 5,21;
Обнаружено, %: C 58,56; H 5,30; N 4,12; S 9,53; Cl 4,90.
Спектр ядерного магнитного резонанса (ДМСО-d6, ТМС - внутренний стандарт).
δ: 1,28 (9Н, с), 1,78-1,87 (2Н, м), 2,61 (2Н, т, J=7,2 Гц), 3,30-3,35 (2Н, м), 3,44 (2Н, т, J=5,8 Гц), 4,41 (2Н, т, J=5,8 Гц), 4,74 (2Н, с), 6,91 (1Н, д, J=7,6 Гц), 7,00 (1Н, д, J=8,4 Гц), 7,12 (1Н, с), 7,19 (1Н, д, J=8,0 Гц), 7,45 (1Н, т, J= 7,8 Гц), 7,52-7,57 (2Н, м), 7,73 (2Н, д, J=8,3 Гц), 7,79-7,80 (1Н, м), 7,89 (2Н, д,J=8,3 Гц), 9,62 (1Н, с), 13,2 (1Н, с).
ПРИМЕР 77
При охлаждении льдом этил 2-[3-[(4-трет-бутил-2-тиазолил) метокси]бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил] феноксиацетат (266 мг, 0,39 ммол) добавляют к смеси 60% гидрида натрия (19 мг, 0,48 ммол) и диметилформамида (2 мл), и реакционный раствор перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор снова охлаждают льдом, добавляют метилиодид (29 мкл, 0,47 ммол), и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционной смеси добавляют воду, и образовавшийся продукт экстрагируют толуолом. Экстракт промывают водой и рассолом в указанной последовательности, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. После этого полученный остаток очищают колоночной хроматографией на силикагеле (элюент = хлороформ:метанол = 50:1). Получают этил 2-[N-[3-[(4-трет- бутил-2-тиазолил)метокси]бензоил]-N-метиламин] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетат (213 мг, 0,31 ммол, 78%).
Данные масс-спектрометрии (m/z): 699 [(М+Н)+]
Спектр ядерного магнитного резонанса (CDCl3, ТМС - внутренний стандарт).
δ: 1,29 (2Н, т, J=6,8 Гц), 1,35 (9Н, с), 1,75-1,85 (2Н, м), 2,41- 2,58 (2Н, м), 2,69-2,86 (2Н, м), 3,38 (3Н, с), 4,26 (2Н, к, J=8,8 Гц), 4,62 (2Н, с), 5,18 (2Н, уш), 6,56-6,74 (2Н, м), 6,80-7,10 (6Н, м), 7,52 (2Н, д, J=8,3 Гц), 7,57 (2Н, д, J =8,3 Гц).
ПРИМЕР 78
Диметилформамид (13 мл) добавляют к смеси 3-[(4-трет-бутил-2-тиазолил) метокси] -5'-[3-(4-хлорфенилсульфонил)пропил] -2'-цианометоксибензанилида (1,30 г, 2,04 ммол), хлорида аммония (0,20 г, 4,08 ммол) и азида натрия (0,25 г, 4,08 ммол), и полученную смесь перемешивают при 70oC в течение 12 часов. К реакционному раствору добавляют лед и 5% водный раствор гидросульфата натрия, и образовавшийся продукт экстрагируют этилацетатом. Полученный органический слой промывают водой и рассолом в указанной последовательности, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. После этого полученный остаток очищают колоночной хроматографией на силикагеле (элюент=метанол:хлороформ=5:100) и затем кристаллизуют из ацетонитрила. Получают 3-[(4-трет-бутил-2-тиазолил) метокси]-5'-[3-(4-хлорфенил-сульфонил)пропил] -2'- (1-тетразол-5-илметокси)бензанилид (1,02 г, 78%) в виде бесцветных кристаллов.
Темп. плавления: 161-163oC.
Данные элементного анализа (для C32H33N6O5S2Cl)
Рассчитано, %: C 56,42; H 4,88; N 12,34; S 9,41; Cl 5,20;
Обнаружено, %: C 56,27; H 4,90; N 12,38; S 9,43; Cl 5,18.
Тем же способом, какой описан в примере 8, получают следующее соединение примера 79.
ПРИМЕР 79
Гидрат 2-[2-[3-(4-трет-бутил-2-тиазолил)метокси] бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил]фенокси-2-фторуксусной кислоты.
Темп. плавления: 88-90oC.
Данные элементного анализа (для C32H32N2FS2O7Cl · H2O)
Рассчитано, %: C 55,44; H 4,94; N 4,04; F 2,74; S 9,25;
Обнаружено, %: C 55,55; H 5,00; N 4,02; F 2,54; S 9,28.
ПРИМЕР 80
Смесь 5'-[3-(4-хлорфенилсульфонил)пропил]-2'- гидрокси-3-(6-метокси-2-бензотиазолилметокси)бензанилида (301 мг, 0,48 ммол), карбоната калия (135 мг, 0,98 ммол), этилбромацетата (81 мг, 0,48 ммол) и диметилформамида (5 мл) перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют воду, и образовавшийся продукт экстрагируют этилацетатом. Экстракт промывают водой и рассолом в указанной последовательности, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. К полученному остатку добавляют тетрагидрофуран (2 мл), метанол (1 мл) и 1N гидроксид натрия, и смесь перемешивают при комнатной температуре в течение 12 часов. Реакционный раствор концентрируют, и к полученному остатку добавляют воду. Затем pH смеси доводят до 3 10% водным раствором лимонной кислоты. После этого образовавшееся твердое вещество собирают фильтрацией и промывают ацетонитрилом. Получают 4-[3-(4-хлорфенилсульфонил)пропил]-2-[3-[(6-метокси-2-бензотиазолил) метокси] бензоиламино] феноксиуксусную кислоту (145 мг, 0,21 ммол, 44%).
Темп. плавления: 187-189oC.
Данные элементного анализа (для C33H29N2S2O8Cl)
Рассчитано, %: C 58,19; H 4,29; N 4,11; S 9,41; Cl 5,20;
Обнаружено, %: C 58,09; H 4,48; N 4,12; S 9,46; Cl 5,00.
Структура соединений примеров с 43 по 80 приведена в таблицах 31-38.
ПРИМЕР 81
При охлаждении льдом к смеси 4-[2-(2-бензотиазолил)винил] -5'-[3-(4-хлорфенилсульфонил)пропил] -2'-гидроксибензанилида (307 мг, 0,52 ммол), карбоната калия (145 мг, 1,05 ммол) и диметилформамида (10 мл) добавляют по каплям, этилбромацетат (87 мг, 0,52 ммол), и полученный реакционный раствор перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют воду, и образовавшийся продукт экстрагируют этилацетатом. Полученный экстракт промывают водой и рассолом в указанной последовательности, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. После этого полученный остаток очищают колоночной хроматографией на силикагеле (элюент=гексан:этилацетат=4:1). Получают этил 2-[4-[2-(2- бензотиазолил)винил] бензоиламино] -4-[3-(4-хлорфенилсульфонил) пропил] феноксиацетат (219 мг, 0,32 ммол, 62%) в виде бесцветного твердого вещества.
Тем же способом, какой описан в примере 81, синтезируют следующие соединения примеров с 82 по 89. Структура и физико-химические свойства этих соединений приведены в таблицах 21-24.
В этой связи положение связывания, приведенное в таблицах, обозначает положение связывания.
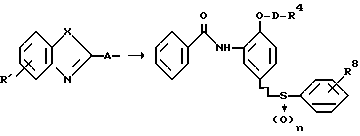
в общей формуле (1). То же будет применяться ниже.
ПРИМЕР 82
Этил 2-[3-(2-бензотиазолилметокси)бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил] феноксиацетат.
ПРИМЕР 83
Этил 2-[3-[2-(2-бензотиазолил)винил] бензоиламино] -4[3- (4-хлорфенилсульфонил)пропил феноксиацетат.
ПРИМЕР 84
Этил 2-[3-[2-бензотиазолил)тиометил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 85
Этил 2-[3-[2-(5-хлор-2-бензотиазолил)винил] бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил] феноксиацетат.
ПРИМЕР 86
Этил 2-[3-(2-бензоксазолилметокси)бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 87
Этил 2-[3-(5-хлор-2-бензотиазолилметокси)бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 88
Этил 4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-(5- трифторметил-2- бензотиазолилметокси)бензоиламино феноксиацетата 0,5 гидрат.
ПРИМЕР 89
1,1-Диметилэтил 2-[3-(2-бензотиазолилметокси)бензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 90
К смеси этил 2-[4-[2-(2-бензотиазолил)винил]бензоиламино]-4- [3-(4-хлорфенилсульфонил)пропил] феноксиацетата (196 мг, 0,29 ммол) и тетрагидрофурана (10 мл) при комнатной температуре добавляют 10% водный раствор гидроксида натрия (6 мл), и реакционный раствор перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор концентрируют при пониженном давлении, к полученному остатку добавляют воду, и затем pH раствора доводят до 1, добавляя концентрированную соляную кислоту. После этого образовавшееся твердое вещество собирают фильтрацией, промывают водой и эфиром в этой последовательности, сушат при пониженном давлении и затем перекристаллизовывают из этанола (50 мл). Получают 2-[4-[2-(2-бензотиазолил)винил]бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил] феноксиуксусную кислоту (156 мг, 0,24 ммол, 83%) в виде бесцветных кристаллов.
Тем же способом, какой описан в примере 90, синтезируют следующие соединения примеров с 91 по 97, представленные общей формулой (1). Структура и физико-химические свойства этих соединений приведены в таблицах 25-26.
ПРИМЕР 91
2-[3-(2-Бензотиазолилметокси)бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота · 0,3H2O.
ПРИМЕР 92
2-[3-[2-(2-Бензотиазолил)винил] бензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота · 0,5 H2O.
ПРИМЕР 93
2-[3-[(2-Бензотиазолил)тиометил] бензоиламино]-4-[3-(4- хлорфенилсульфонил]пропил]феноксиуксусная кислота.
ПРИМЕР 94
2-[3-[2-(5-Хлор-2-бензотиазолил)винил]бензоиламино]-4-[3- (4-хлорфенилсульфонил)пропил]феноксиуксусная кислота · 0,5 H2O.
ПРИМЕР 95
2-[3-(2-Бензоксазолилметокси)бензоиламино] -4-[3-(4-хлорфенилсульфонил) пропил]феноксиуксусная кислота.
ПРИМЕР 96
2-[3-(5-Хлор-2-бензотиазолилметокси)бензоиламино]-4-[3- (4-хлорфенилсульфонил)пропил]феноксиуксусная кислота.
ПРИМЕР 97
4-[3-(4-Хлорфенилсульфонил)пропил] -2-[3-(5- трифторметил-2-бензотиазолилметокси)бензоиламино]феноксиуксусной кислоты, гидрат.
Тем же способом, какой описан в примере 81, синтезируют следующие соединения примеров с 98 по 102. Структура и физико-химические свойства этих соединений приведены в таблицах 27 и 28.
ПРИМЕР 98
Этил 2-[3-(6-хлор-2-бензотиазолилметокси)бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 99
Этил 2-[3-[2-(2-бензотиазолил)этил]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетат.
ПРИМЕР 100
2-[2-[3-(2-Бензотиазолил)метокси]бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиацетамид.
ПРИМЕР 101
3-[2-(2-Бензотиазолилметокси)бензоиламино] -5'-[3- (4-хлорфенилсульфонил)пропил]-2'-(цианометокси)бензанилид.
ПРИМЕР 102
Этил 2-[3-(2-бензоксазолилметилтио)бензоиламино] -4-[3-(4 -хлорфенилсульфонил)пропил]феноксиацетат.
Тем же способом, какой описан в примере 90, синтезируют следующие соединения примеров со 103 по 106. Структура и физико-химические свойства этих соединений приведены в таблице 29.
ПРИМЕР 103
2-[3-(6-Хлор-2-бензотиазолилметокси)бензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил]феноксиуксусная кислота, 0,5 гидрат.
ПРИМЕР 104
2-[3-[2-(2-Бензотиазолил)этил] бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил] феноксиуксусная кислота, 0,3 гидрат.
ПРИМЕР 105
2-[3-(2-Бензотиазолилметилтио)бензoилaминo] -4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусная кислота.
ПРИМЕР 106
N-[[2-[3-(2-Бензотиазолилметокси)бензоиламино] -4-[3- (4-хлорфенилсульфонил)пропил]фенокси]ацетил]глицин.
ПРИМЕР 107
Смесь 2-[3-(2-бензотиазолилметокси)бензоиламино]-4-[3-(4- хлорфенилсульфонил)пропил]феноксиуксусной кислоты (200 мг, 0,31 ммол), метансульфонамида (31 мг), 4-диметиламинопиридина (45 мг), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (125 мг) и дихлорметана (10 мл) перемешивают при комнатной температуре в течение 3 суток. Реакционный раствор промывают 1N соляной кислотой, водой и рассолом в этой последовательности, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Путем перекристаллизации полученного твердого вещества из ацетонитрила (2 мл) получают полугидрат 2-[2-[3-(2-бензотиазолилметокси)бензоиламино] -4- [3-(4-хлорфенилсульфонил)пропил] фенокси] -N-(метансульфонил)ацетамида (70 мг, 0,096, 31%) в виде бесцветных кристаллов.
Темп. плавления: 153oC.
Данные элементного анализа (для C33H30N3O8S3Cl·0,5H2O)
Рассчитано, %: C 53,76; H 4,24; N 5,70; S 13,05; Cl 4,81;
Обнаружено, %: C 53,95; H 4,11; N 5,82; S 13,00; Cl 4,85.
Тем же способом, какой описан в примере 107, синтезируют следующее соединение.
ПРИМЕР 108
2-[2-[3-(2-Бензотиазолилметокси)бензоиламино] -4-[3-(4- хлорфенилсульфонил)пропил]фенокси]-N-(2-метилфенилсульфонил)ацетамид.
Темп. плавления: 157oC.
Данные элементного анализа (для C39H34N3O8S3Cl)
Рассчитано, %: C 58,24; H 4,26; N 5,22; S 11,96; Cl 4,41;
Обнаружено, %: C 58,26; H 4,25; N 5,22; S 12,04; Cl 4,59.
ПРИМЕР 109
При охлаждении льдом к смеси 2-[3-(2-бензотиазолилметокси) бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил] феноксиуксусной кислоты (400 мг, 0,62 ммол), гидрохлорида глицинамида (86 мг), 1-гидроксибензотриазола (125 мг), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (130 мг) и N,N-диметилформамида (10 мл) добавляют триэтиламин (220 мкл).
Полученную смесь перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору добавляют воду и этилацетат. Образовавшееся нерастворимое твердое вещество собирают фильтрацией, промывают этилацетатом, водой, 1N соляной кислотой, водой, эфиром, 1N водным раствором гидроксида натрия, водой и эфиром в указанной последовательности, и затем сушат при пониженном давлении. К полученному твердому веществу добавляют ацетонитрил (13 мл), и смесь кипятят с обратным холодильником в течение 5 минут с перемешиванием и затем охлаждают. Образовавшиеся кристаллы собирают фильтрацией.
Получают Nα- [[2-[3-(2- бензотиазолилметокси)бензоиламино]-4-[3-(4-хлорфенилсульфонил)пропил] фенокси]ацетил]глицинамид (170 мг, 0,24 ммол, 39%) в виде бесцветных кристаллов.
Темп. плавления: 186-188oC.
Данные элементного анализа (для C34H31N4O7S2Cl)
Рассчитано, %: C 57,74; H 4,42; N 7,92; S 9,07; Cl 5,01;
Обнаружено, %: C 57,57; H 4,32; N 7,91; S 9,29; Cl 4,89.
Тем же способом, какой описан в примере 109, синтезируют следующее соединение.
ПРИМЕР 110
Гидрат Этил N-[[2-[3-(2-бензотиазолилметокси)бензоиламино] -4-[3- (4-хлорфенилсульфонил)пропил]фенокси]ацетил]глицина.
Темп.плавления: 132-133oC.
Данные элементного анализа (для C36H34N3O8S2Cl · H2O)
Рассчитано, %: C 57,33; H 4,81; N 5,57; S 8,50;
Обнаружено, %: C 57,68; H 4,54; N 5,55; S 8,60.
ПРИМЕР 111
Смесь 3-[2-(2-бензотиазолилметокси)бензоиламино] -5'-[3- (4-хлорфенилсульфонил)пропил] -2'-(цианометокси)бензанилида (390 мг 0,62 ммол), азида трибутилолова (4,2 г) и толуола (6 мл) перемешивают в течение 2 часов при кипячении с обратным холодильником. Реакционный раствор охлаждают и концентрируют при пониженном давлении. К полученному остатку добавляют метанол (15 мл) и 1N соляную кислоту (15 мл), и смесь перемешивают при комнатной температуре в течение 30 минут. Реакционный раствор концентрируют при пониженном давлении, и к полученному остатку добавляют воду и гексан. Образовавшееся нерастворимое твердое вещество собирают фильтрацией и промывают 1N соляной кислотой и гексаном в указанной последовательности. К полученному твердому веществу добавляют гексан (70 мл), полученную смесь кипятят с обратным холодильником в течение 5 минут при перемешивании и затем охлаждают. Полученное твердое вещество собирают фильтрацией. Получают 3-(2-бензотиазолилметокси)-5'-[3-(4-хлорфенилсульфонил)пропил] -2'- (1Н-тетразол-5-илметокси) бензанилид (270 мг, 0,39 ммол, 63%) в виде бесцветных кристаллов.
Темп. плавления: 189-191oC.
Данные элементного анализа (для C32H27N6O5S2Cl)
Рассчитано, %: C 56,93; H 4,03; N 12,45; S 9,50; Cl 5,25;
Обнаружено, %: C 56,64; H 3,94; N 12,31; S 9,42; Cl 5,28.
Структура соединений примеров с 107 по 111 приведена в таблицах 38 и 39.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ БЕНЗАЗЕПИНА, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2129123C1 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ ТИАЗОЛА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АКТИВНОСТЬ АГОНИСТА 5-НТ*003-РЕЦЕПТОРА НА ЕГО ОСНОВЕ | 1995 |
|
RU2098418C1 |
| ПРОИЗВОДНОЕ БЕНЗАЗЕПИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОИЗВОДНОЕ ДИФТОРБЕНЗАЗЕПИНА И ПРОИЗВОДНОЕ (ЗАМЕЩЕННОГО) АМИНОБЕНЗОИЛДИФТОРБЕНЗАЗЕПИНА | 1994 |
|
RU2137760C1 |
| 1,2,3,4-ТЕТРАГИДРОХИНОКСАЛИНДИОНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2149873C1 |
| ПРОИЗВОДНЫЕ АМИДИНОНАФТИЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2154633C2 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛКАРБАМОИЛБЕНЗОЛА | 2004 |
|
RU2330030C2 |
| НОВЫЕ АМИДНЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМОТИРУЮЩАЯ СЕКРЕЦИЮ ИНСУЛИНА И УСИЛИВАЮЩАЯ ВОСПРИИМЧИВОСТЬ К ИНСУЛИНУ | 1998 |
|
RU2191177C2 |
| ДИАЗЕПАНОВОЕ ПРОИЗВОДНОЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ЕГО СОДЕРЖАЩАЯ, И ИНГИБИТОР АКТИВИРОВАННОГО ФАКТОРА X КОАГУЛЯЦИИ КРОВИ | 2001 |
|
RU2257381C2 |
| КОНДЕНСИРОВАННОЕ 4-ОКСОПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ | 2005 |
|
RU2358969C2 |
| Способ получения гетероциклических соединений или их фармацевтически приемлемых солей щелочного металла | 1986 |
|
SU1454249A3 |
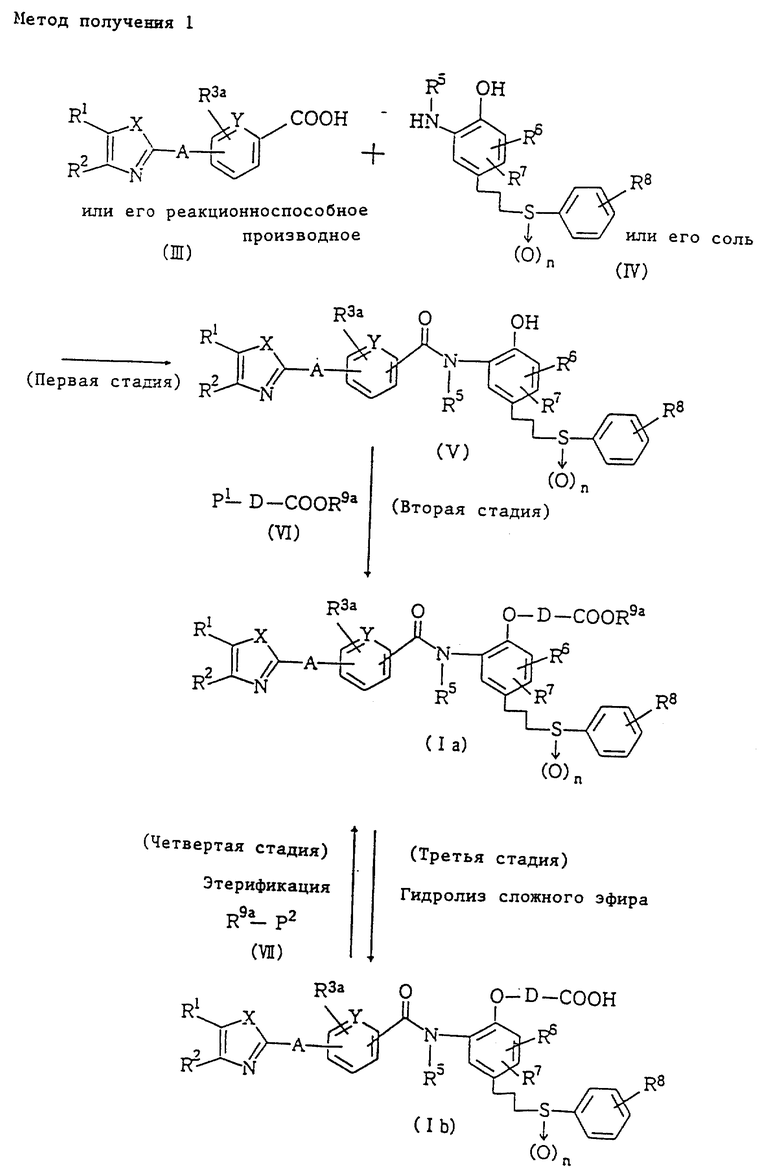
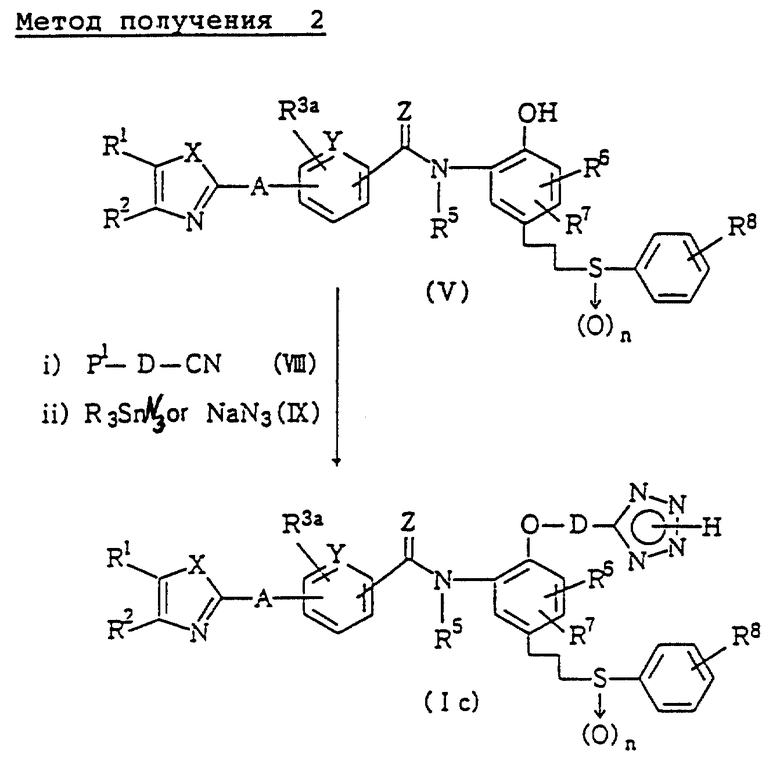
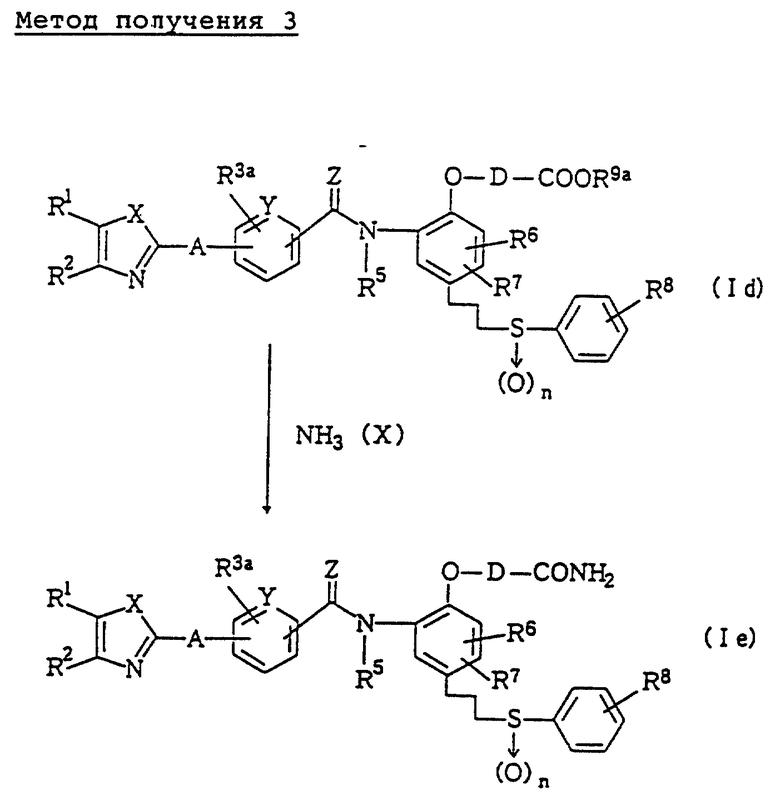
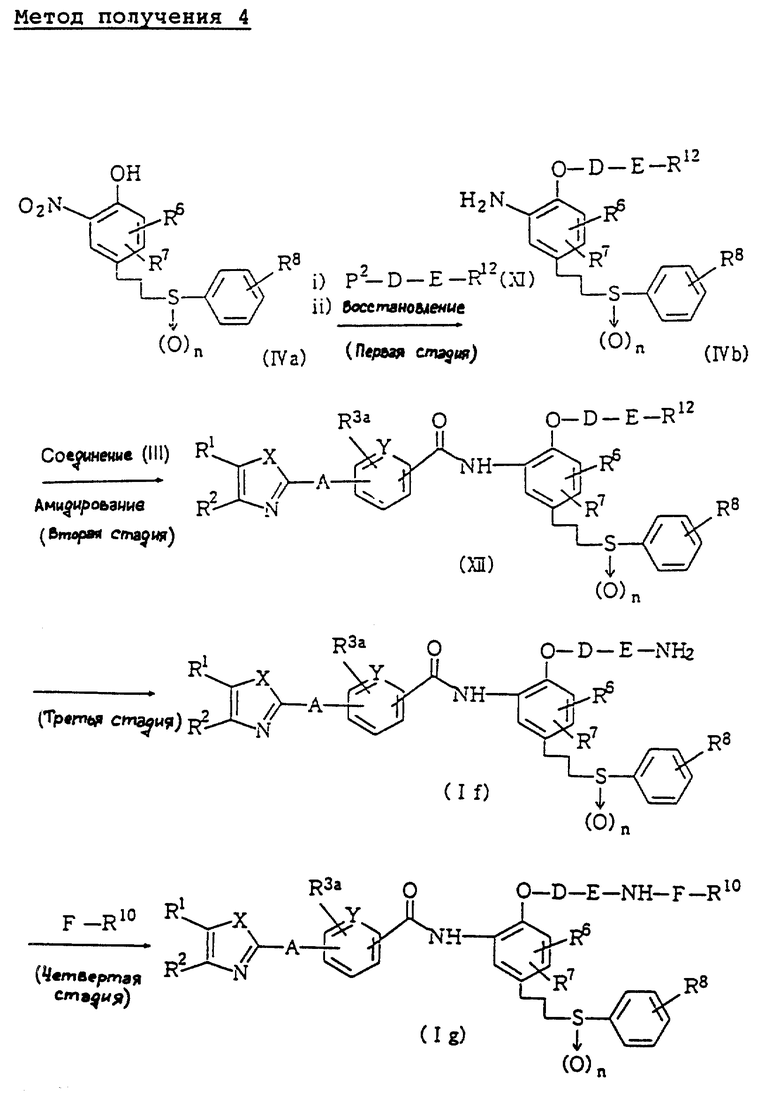
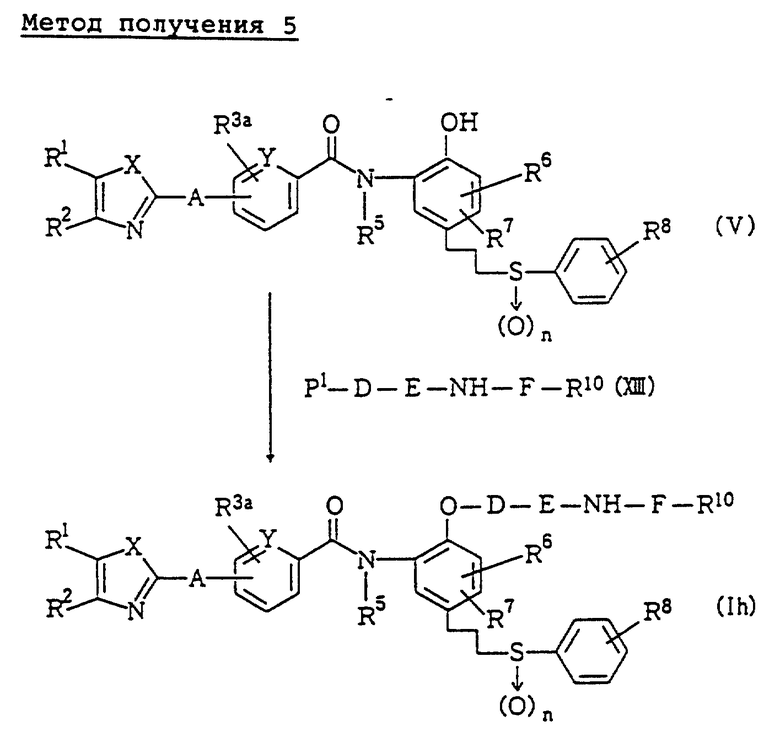
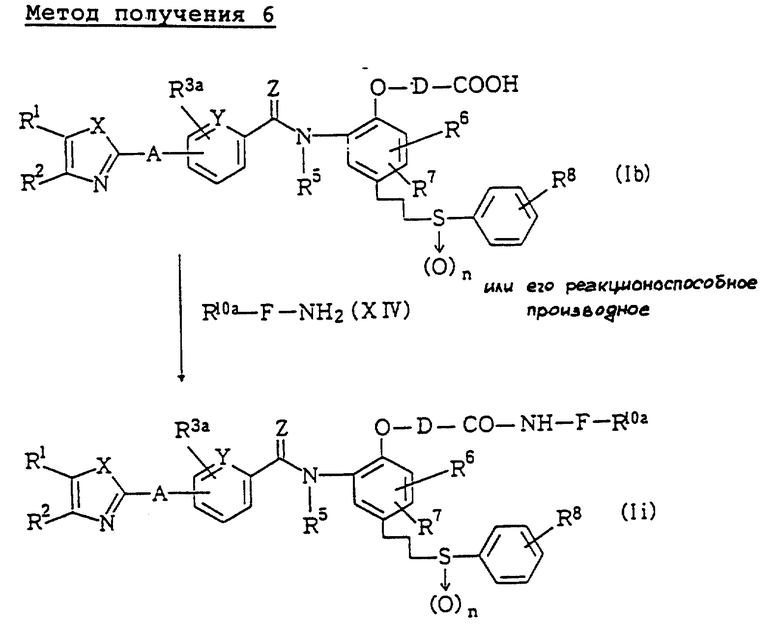
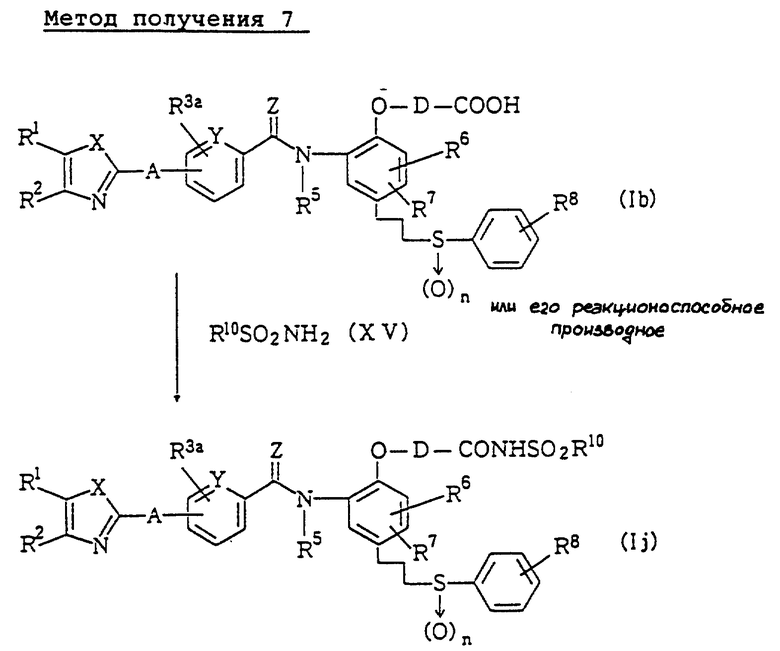
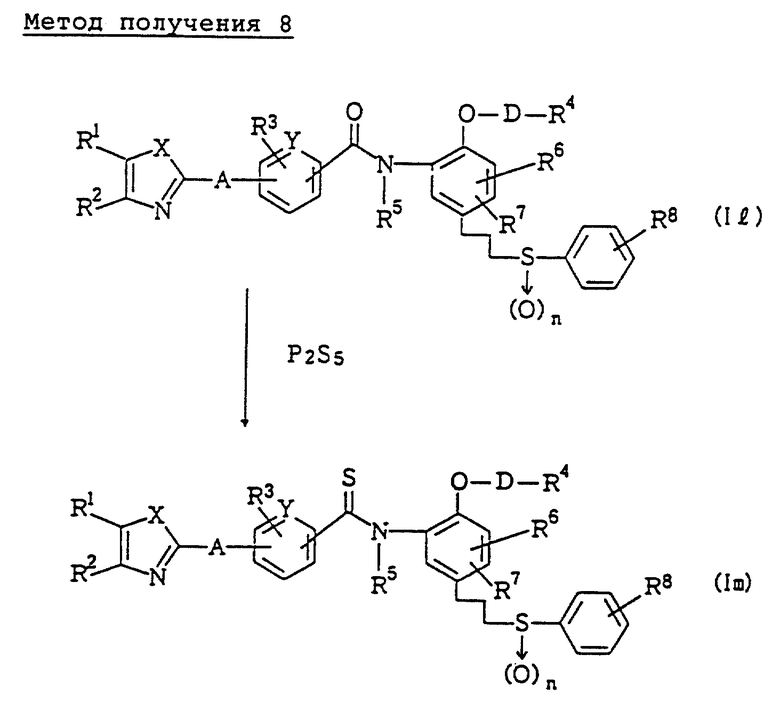
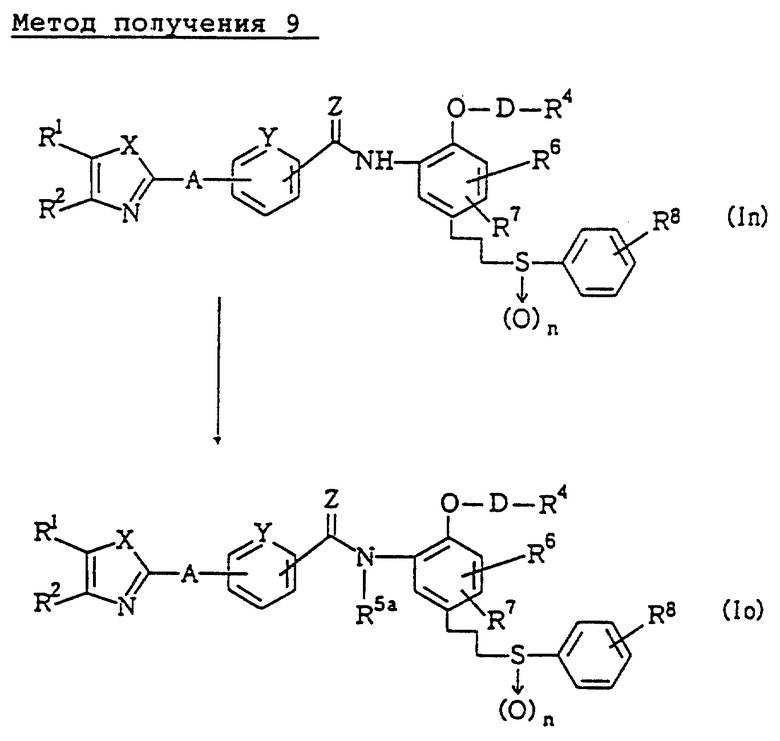
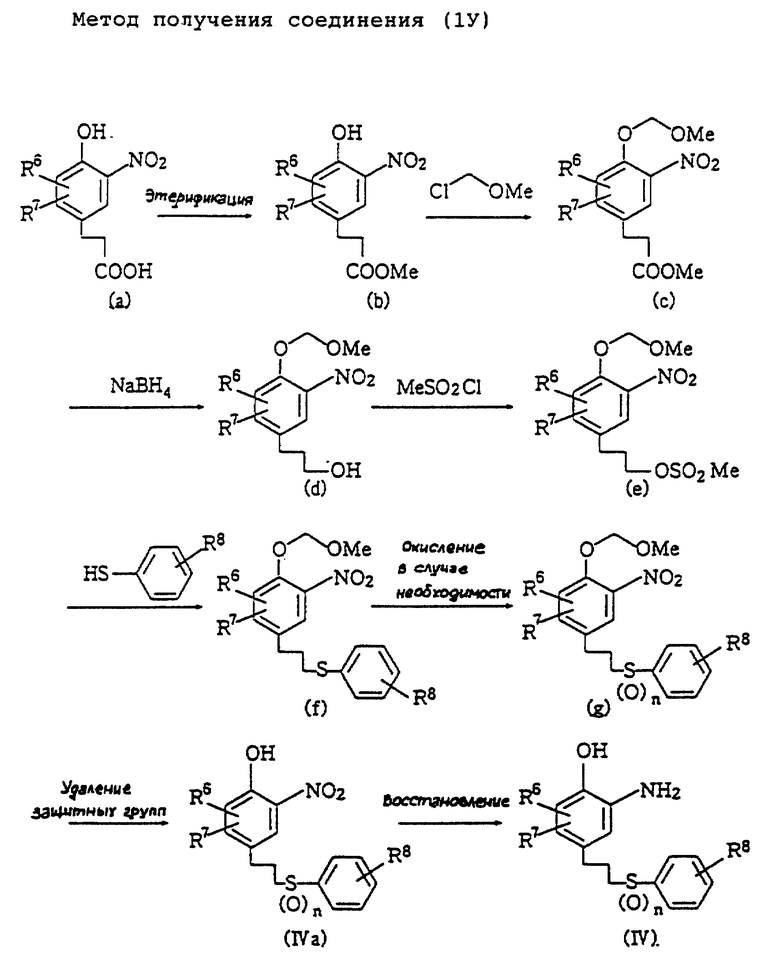
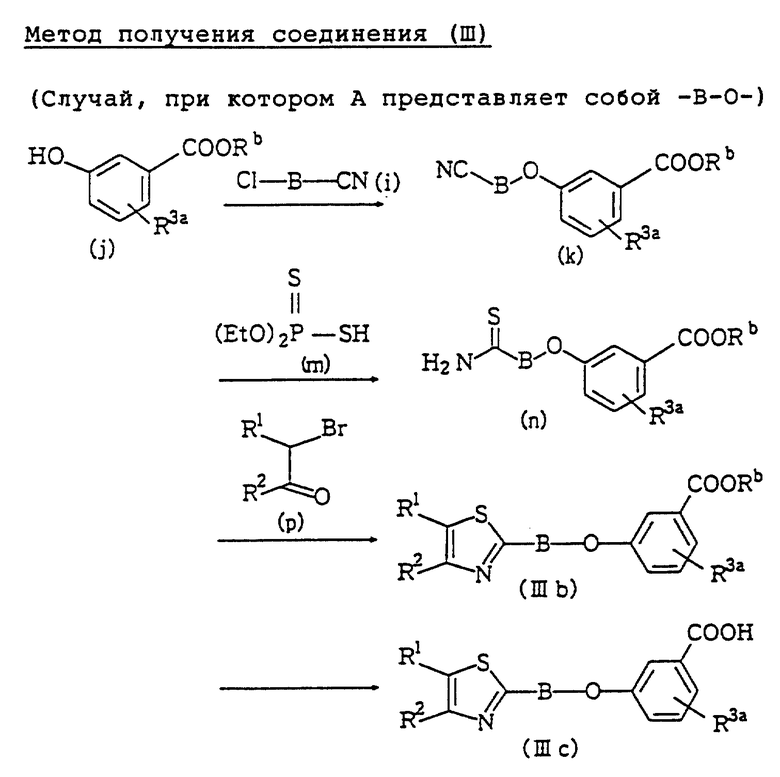
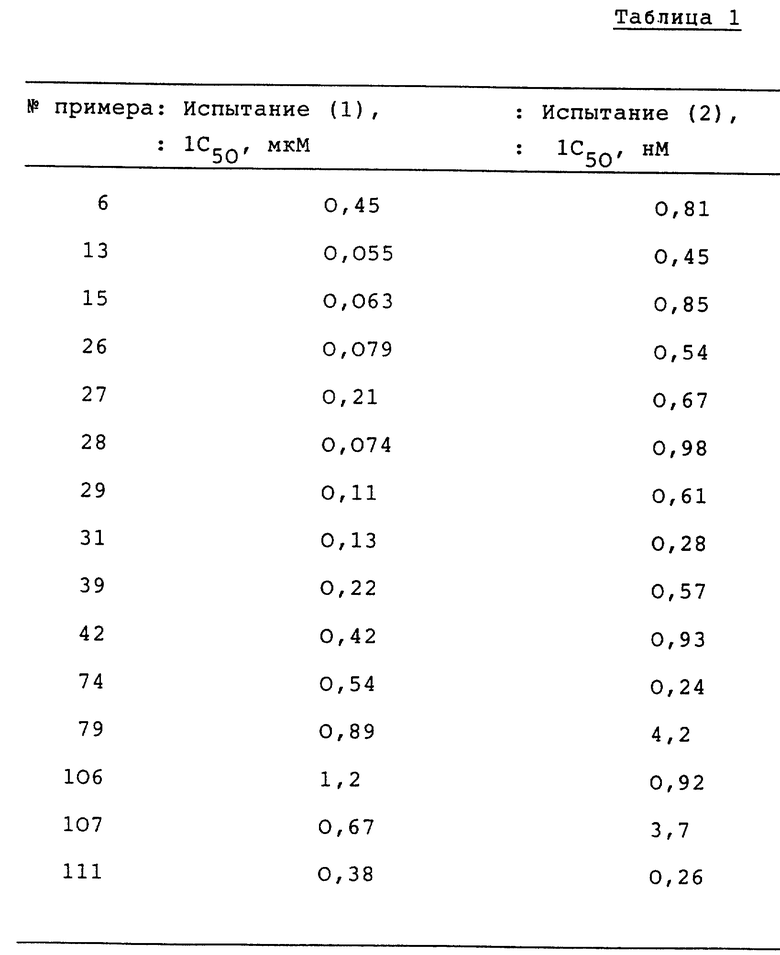
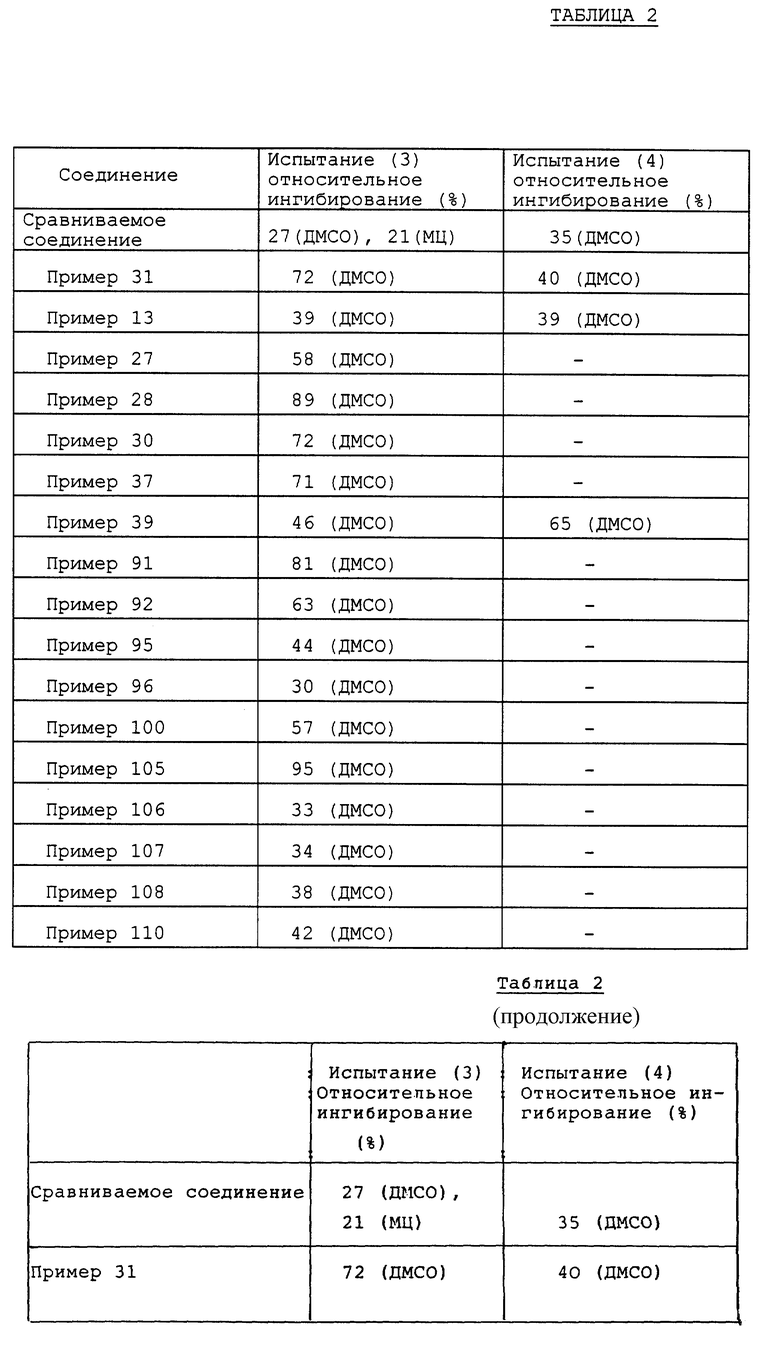



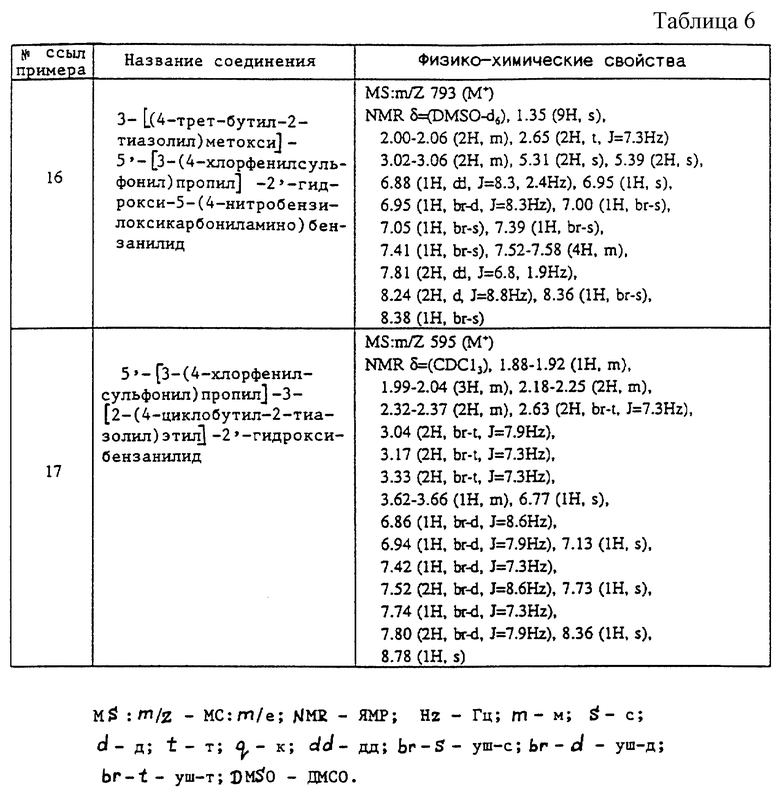



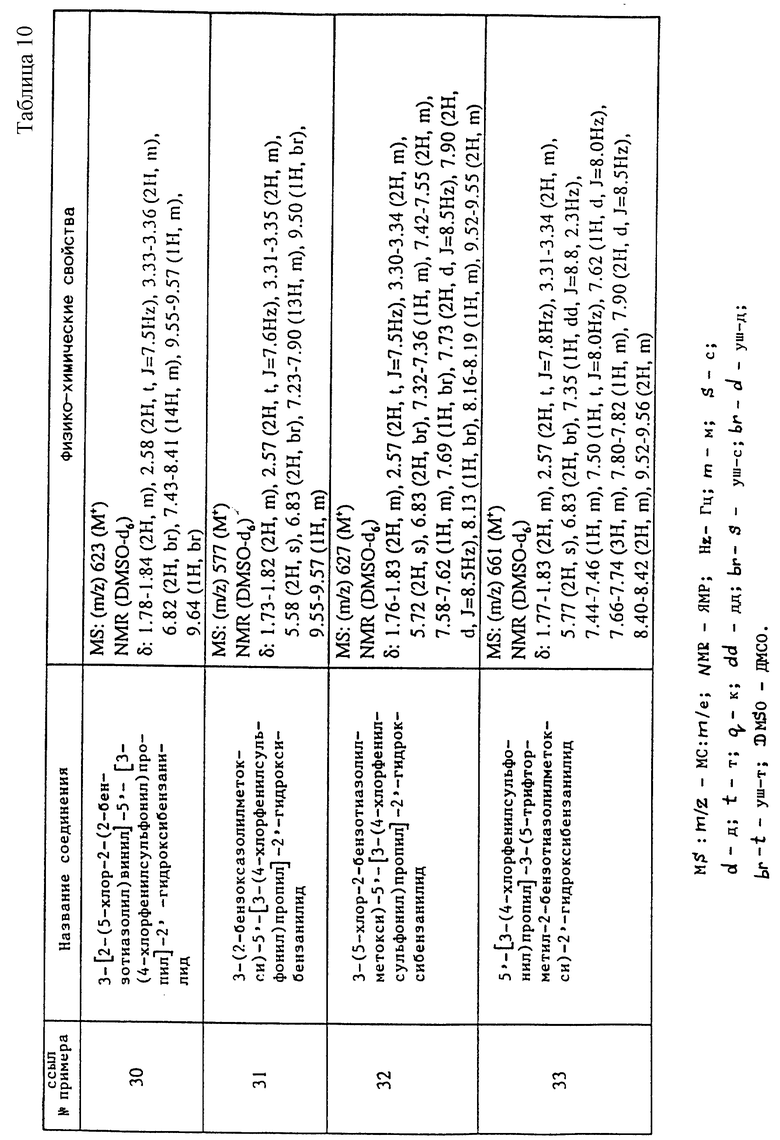


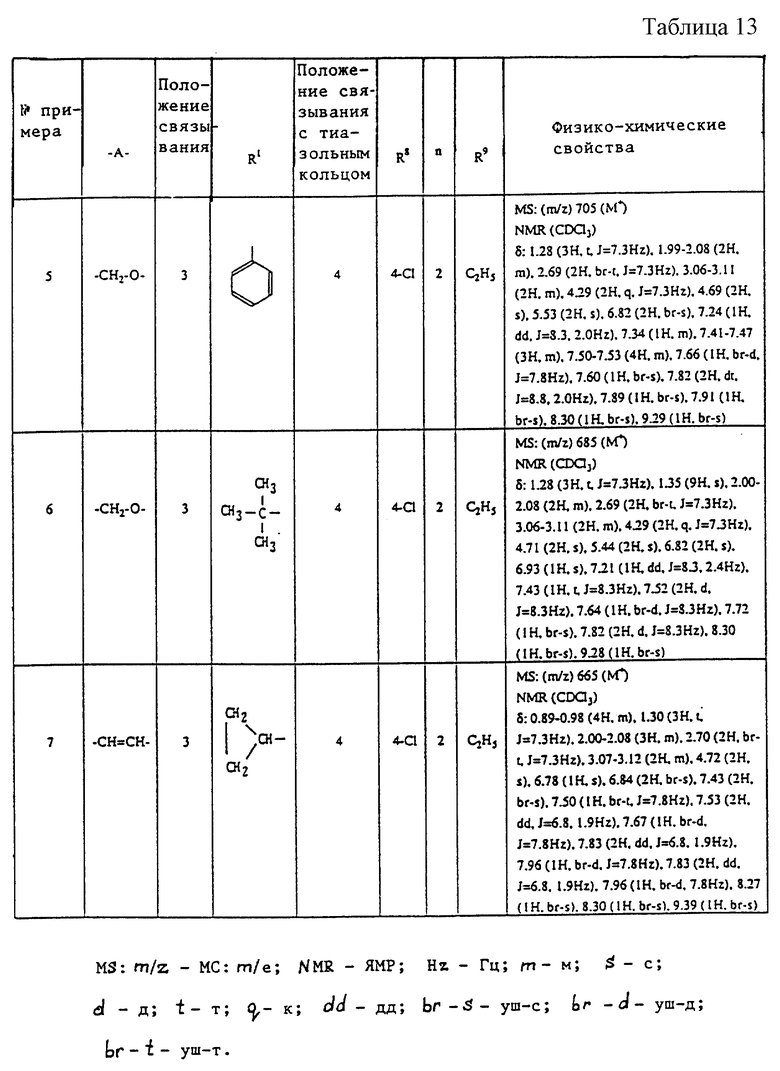
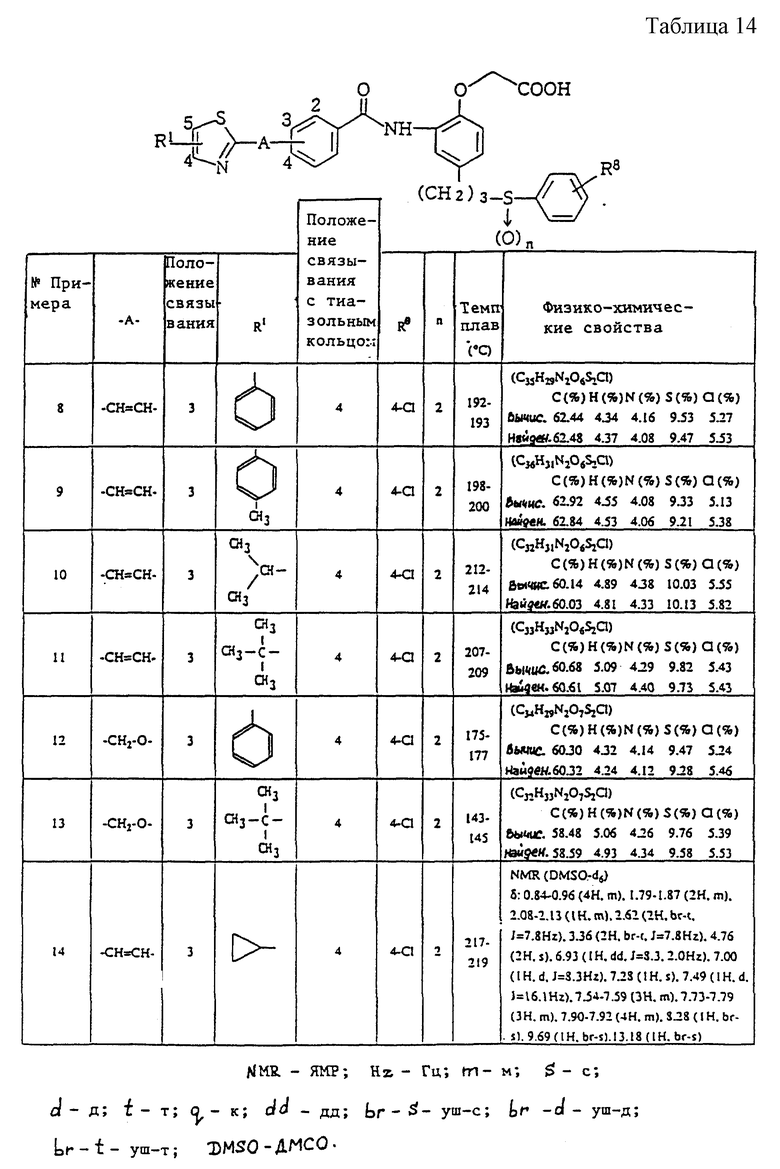
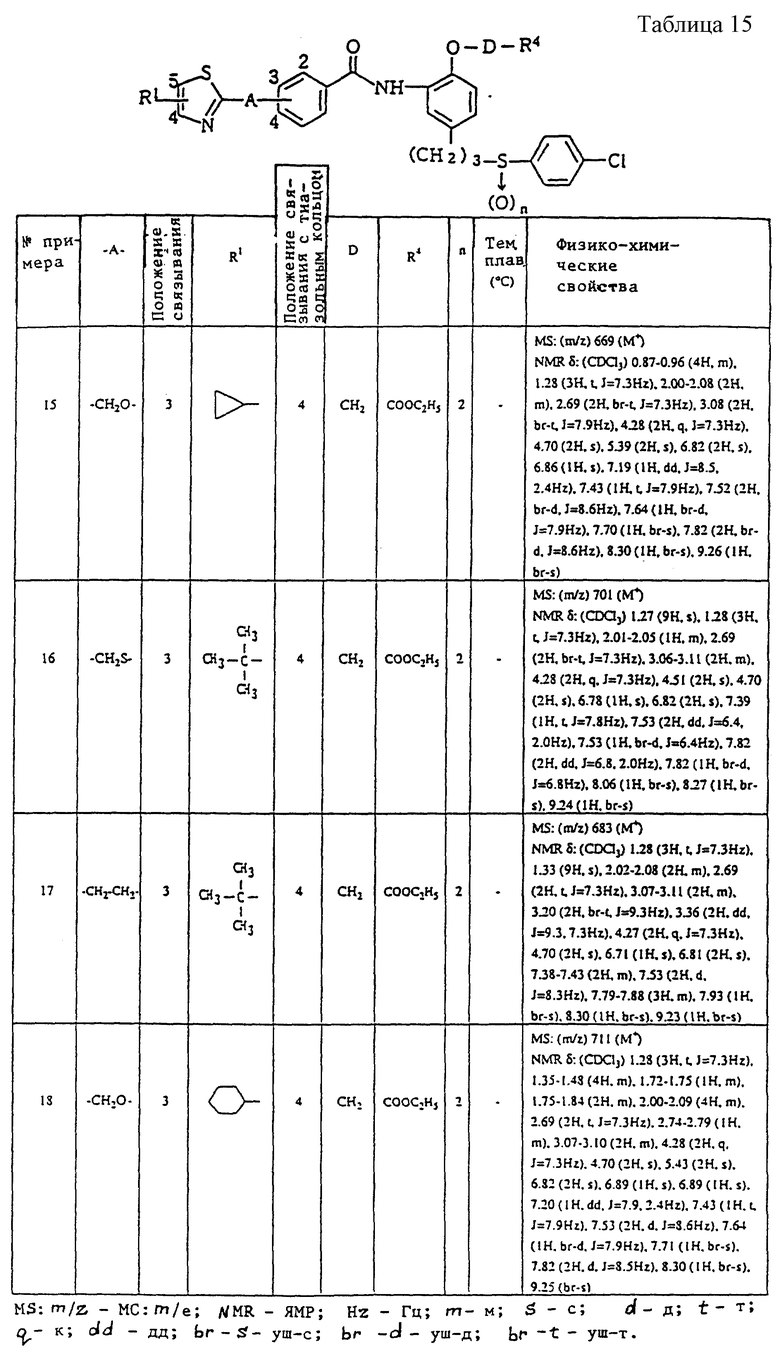
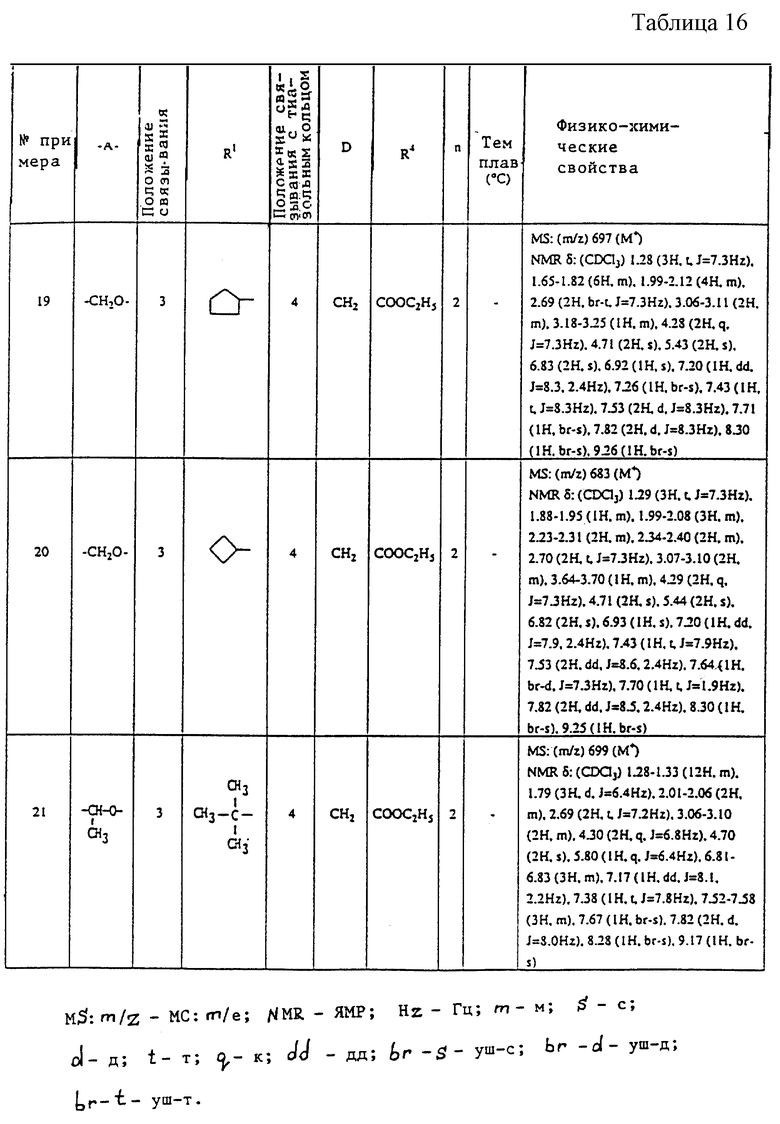
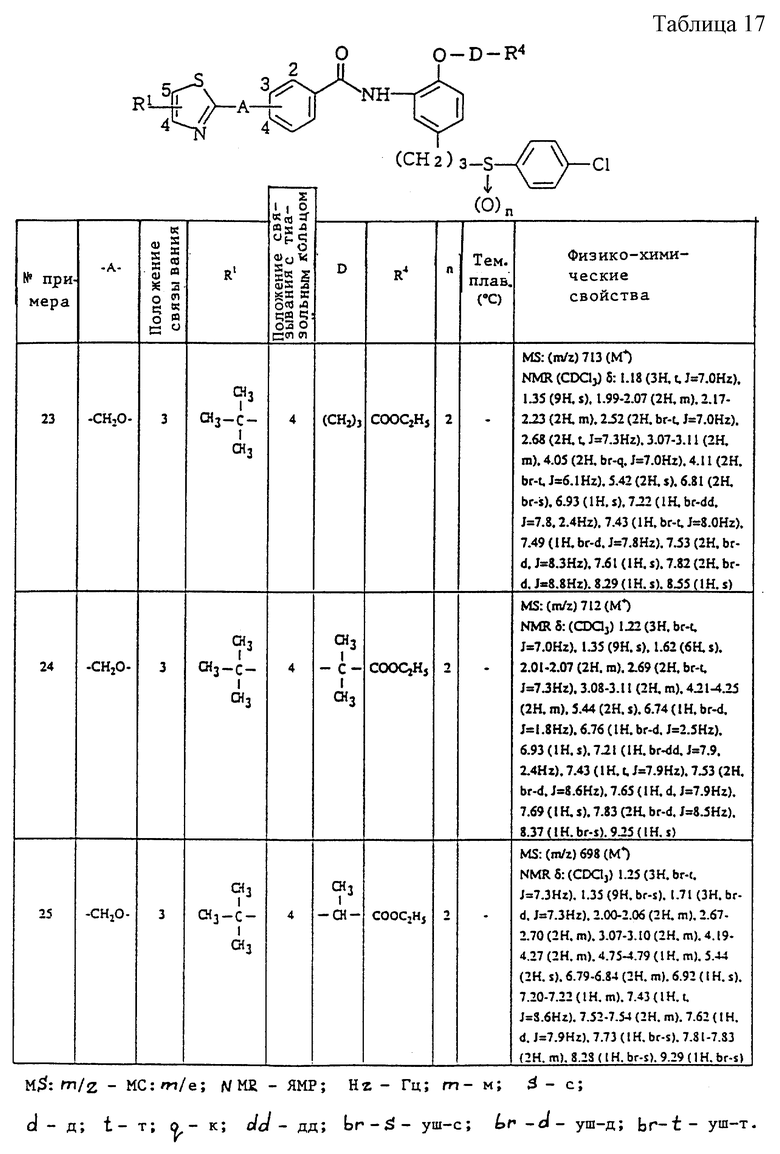
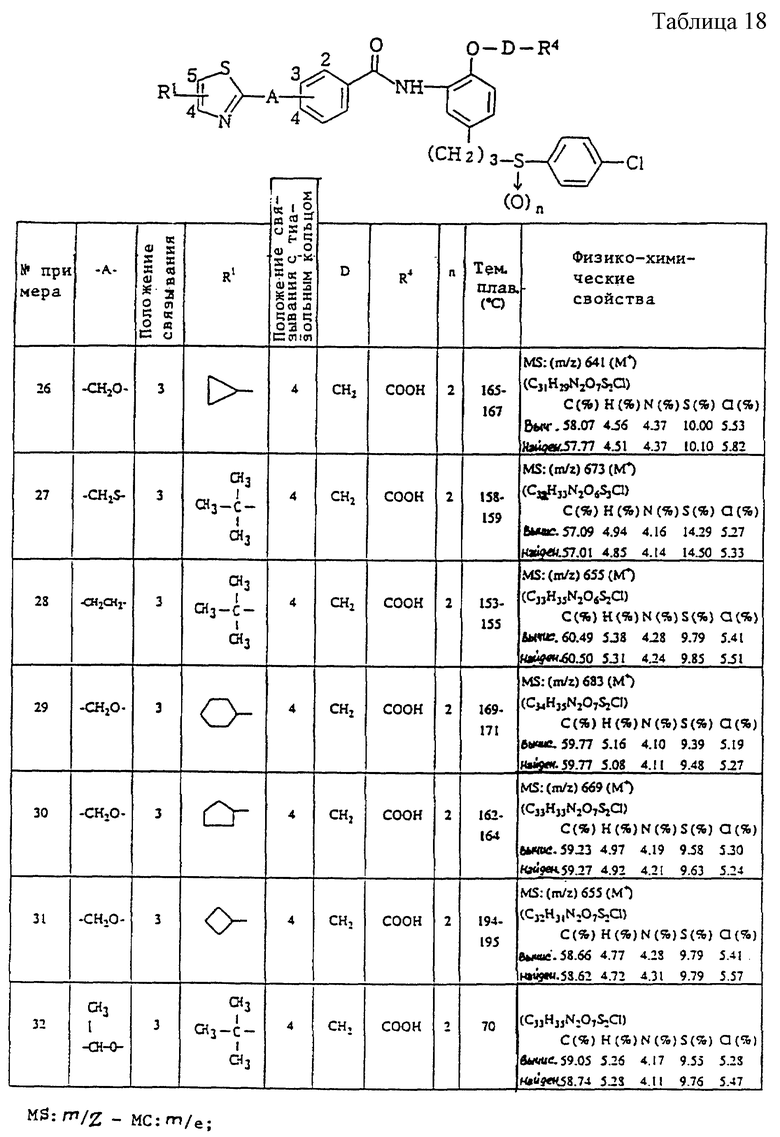
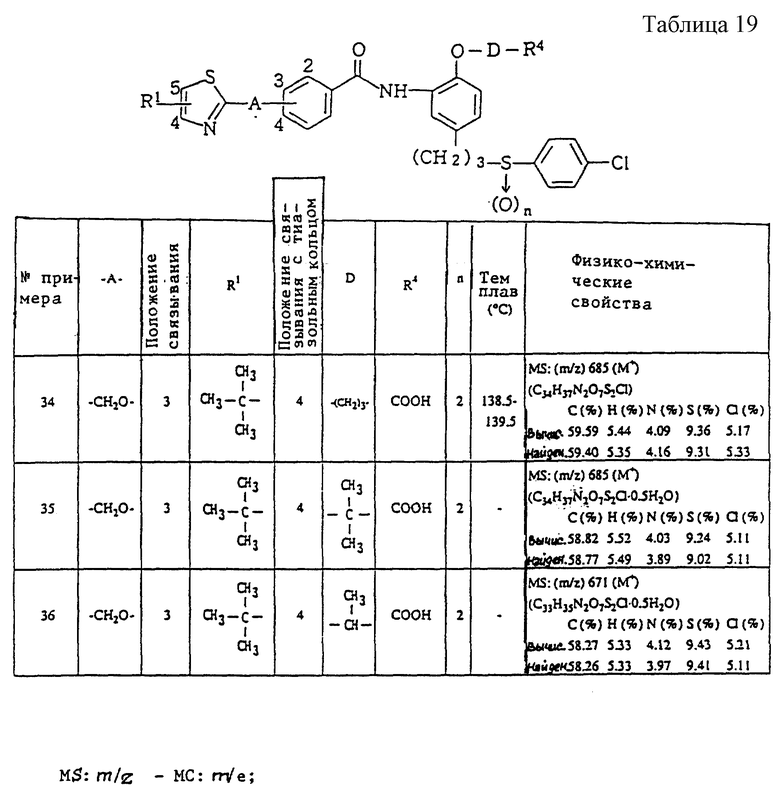
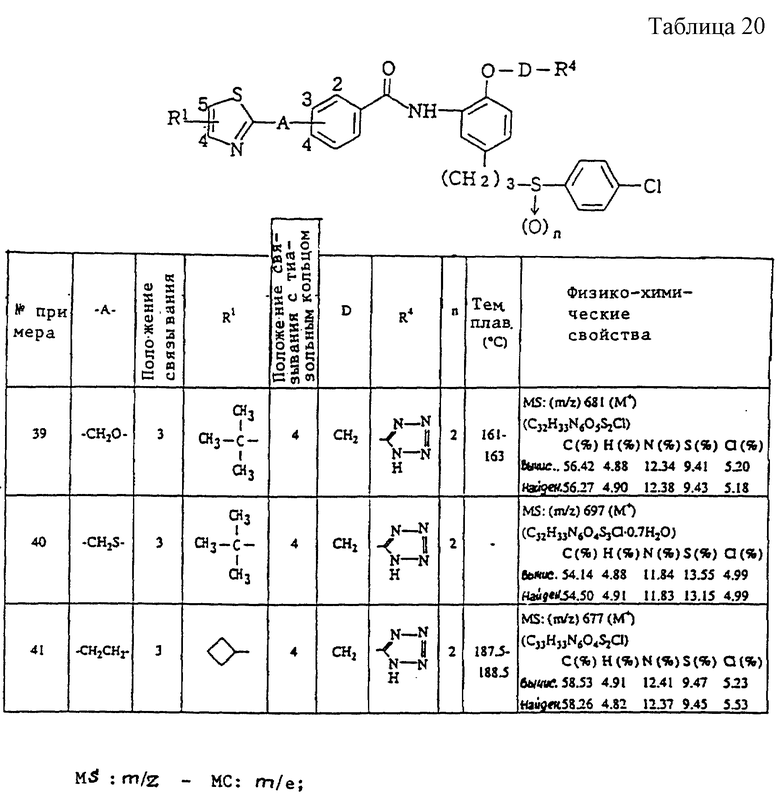
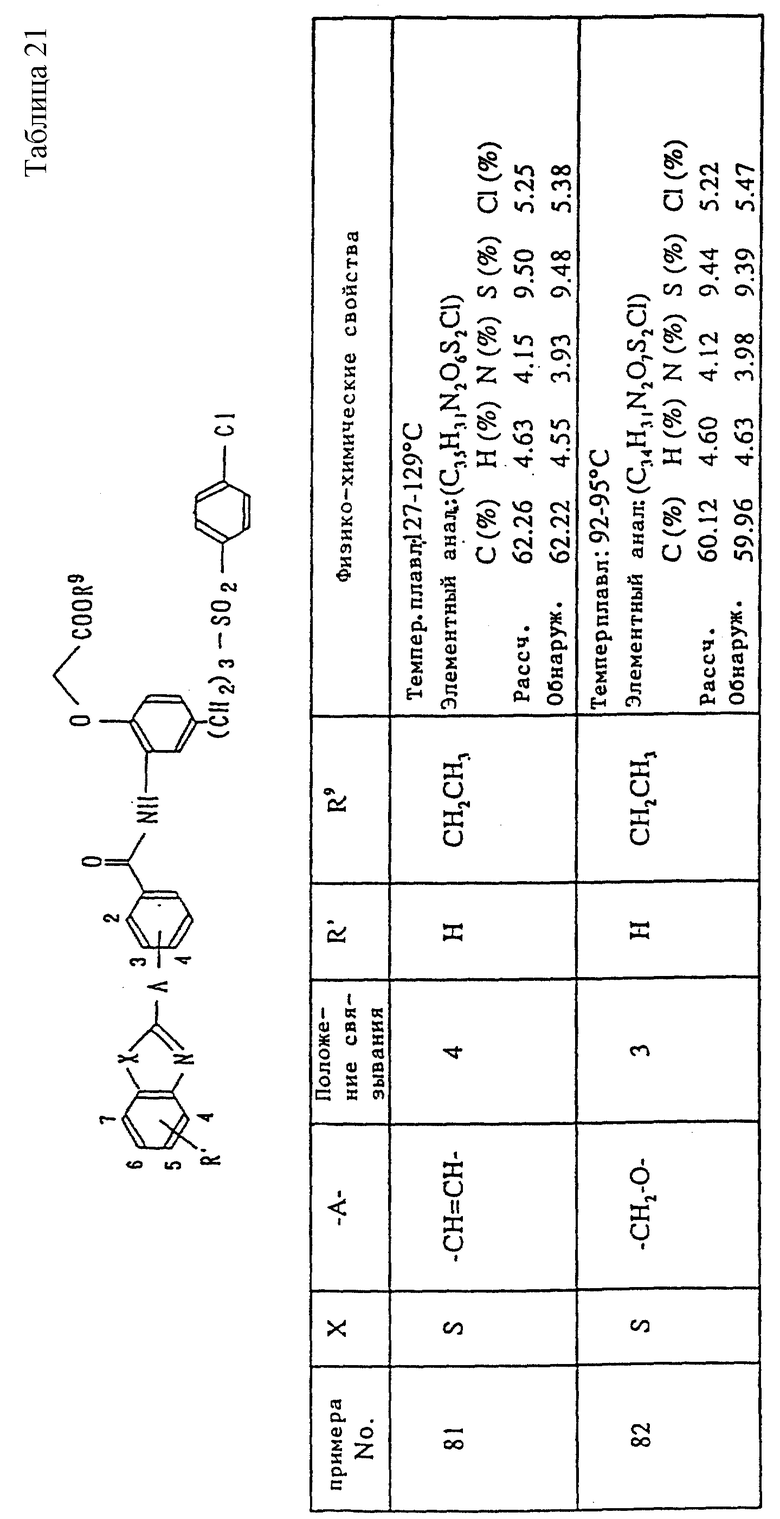
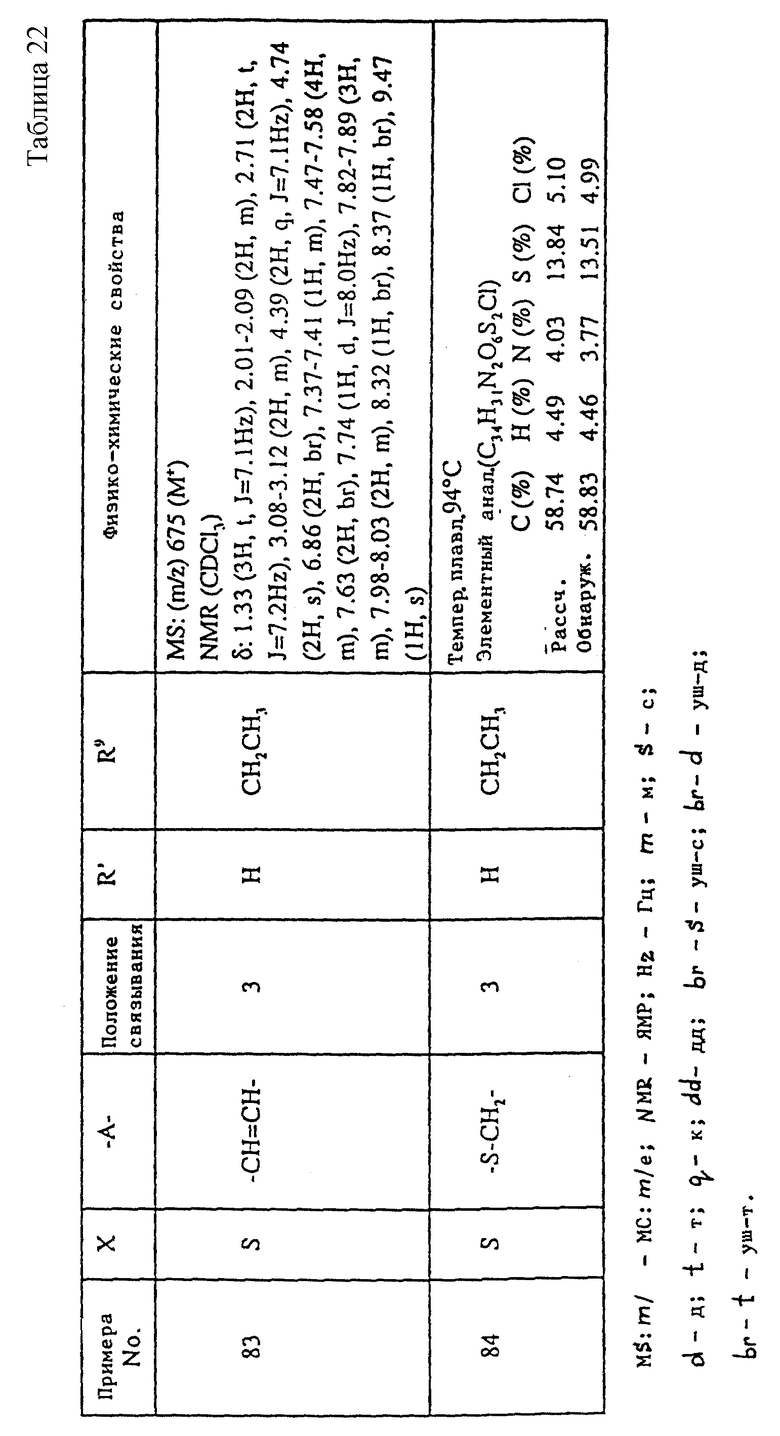
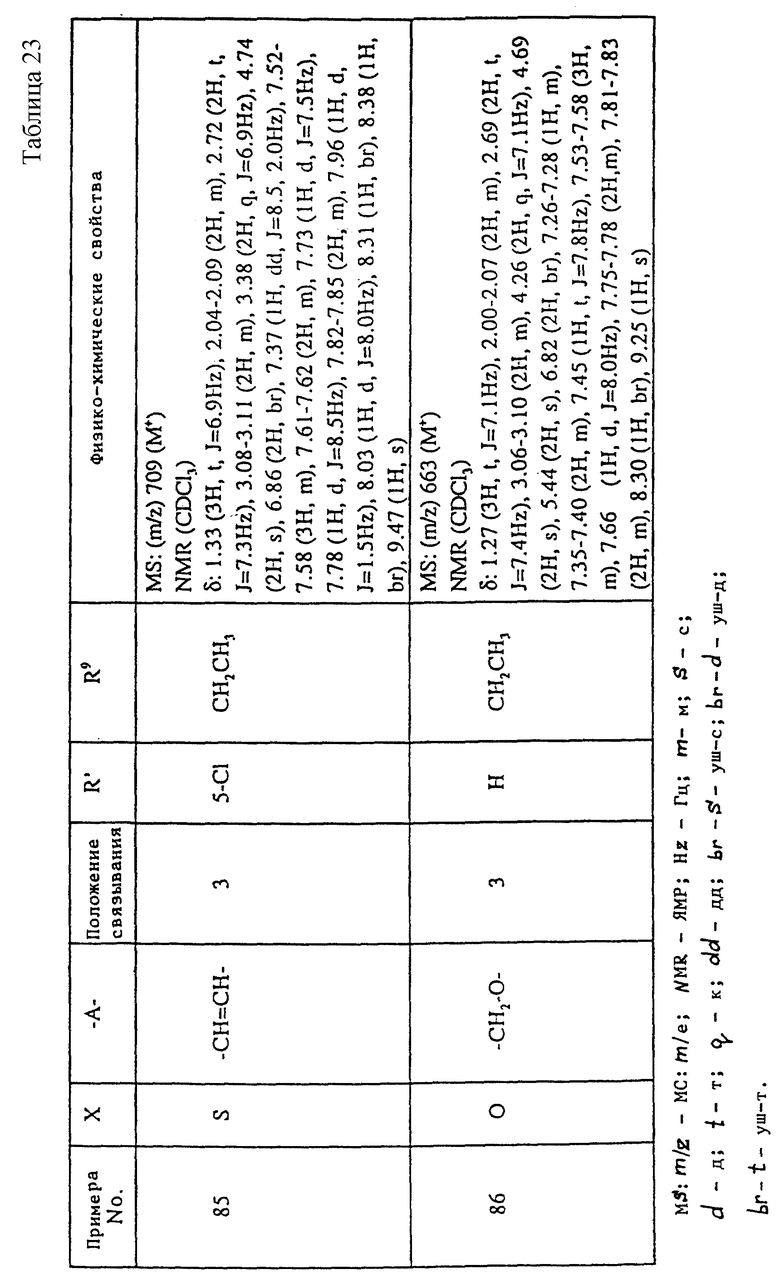
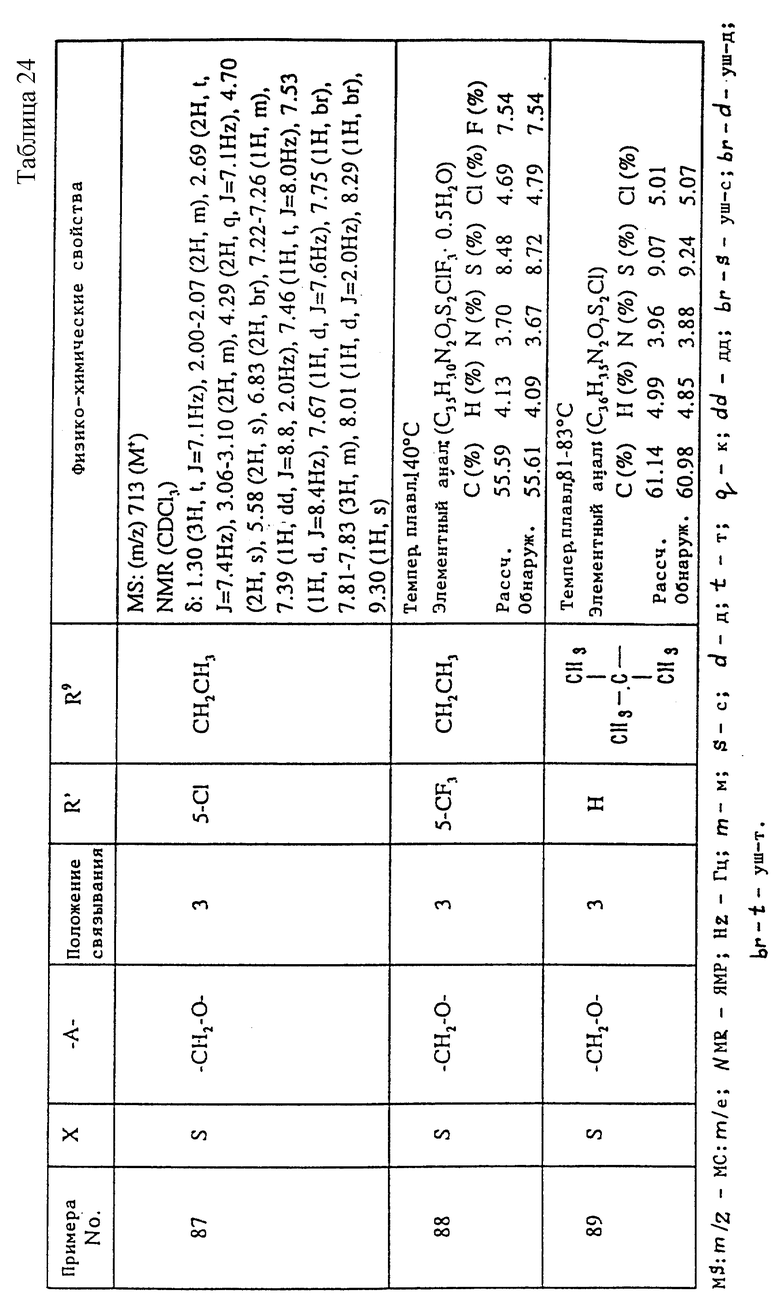
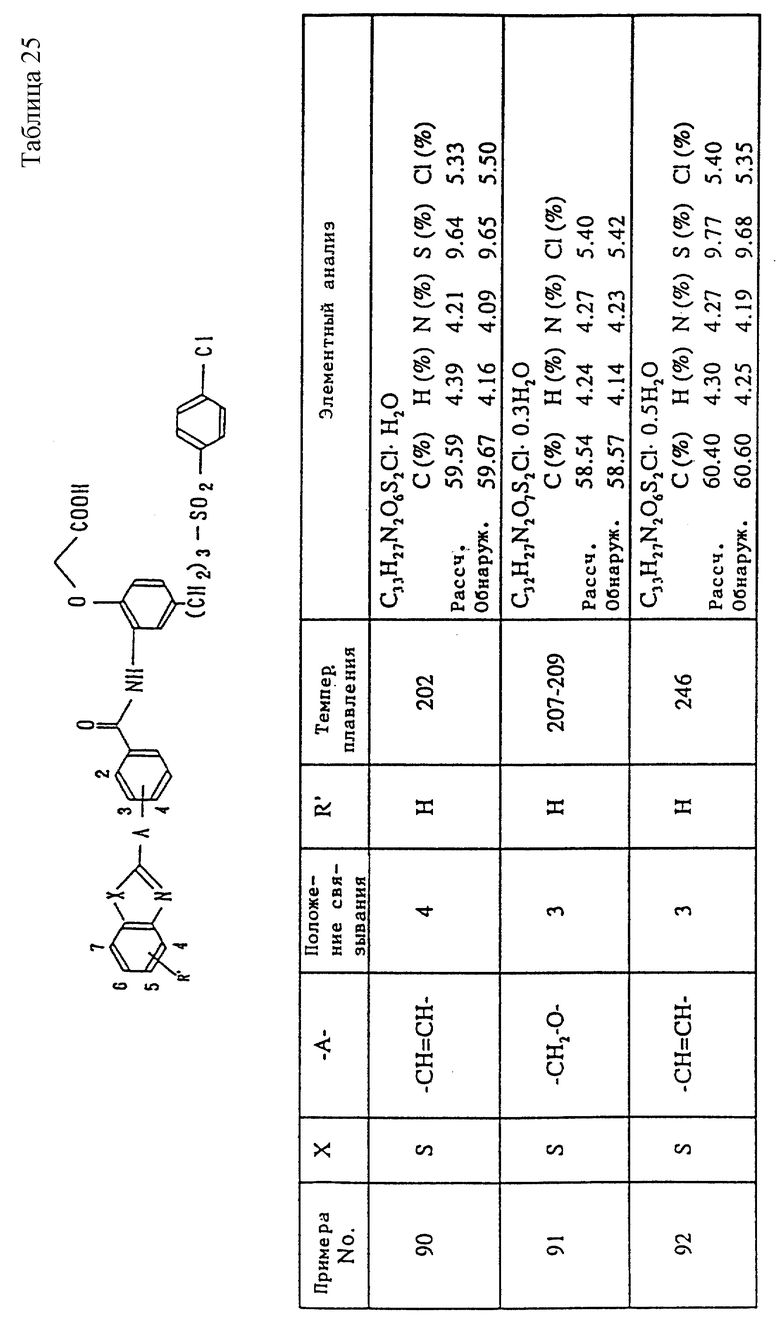

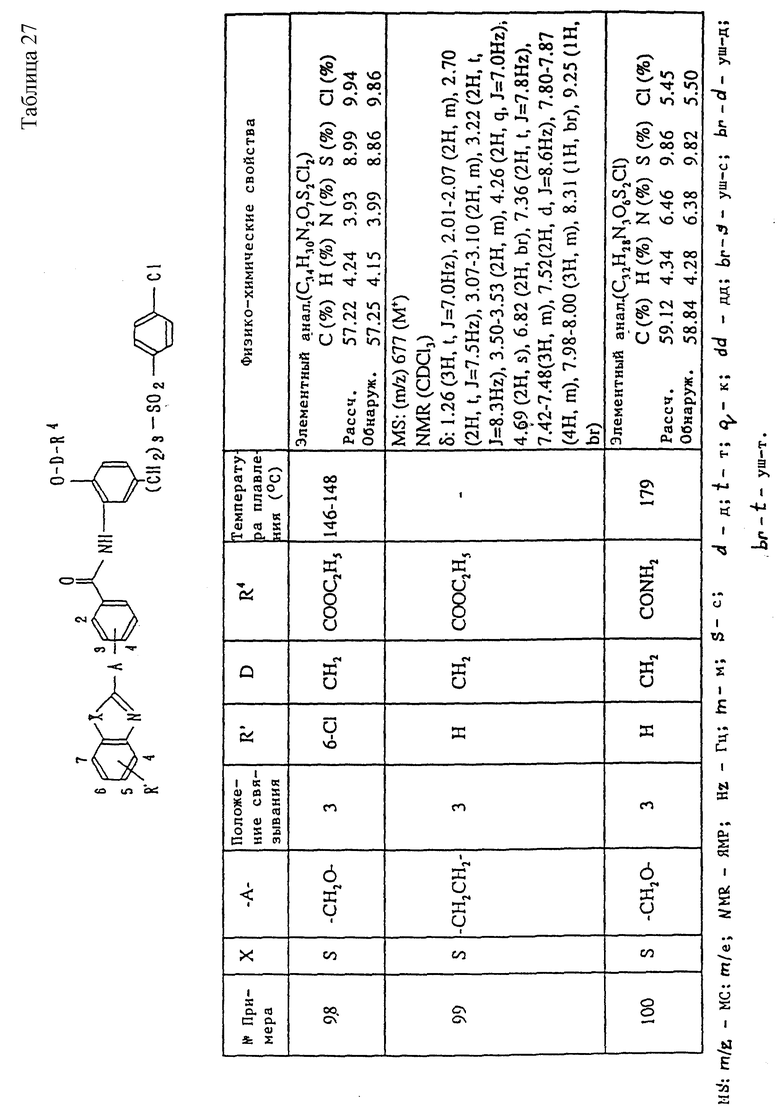
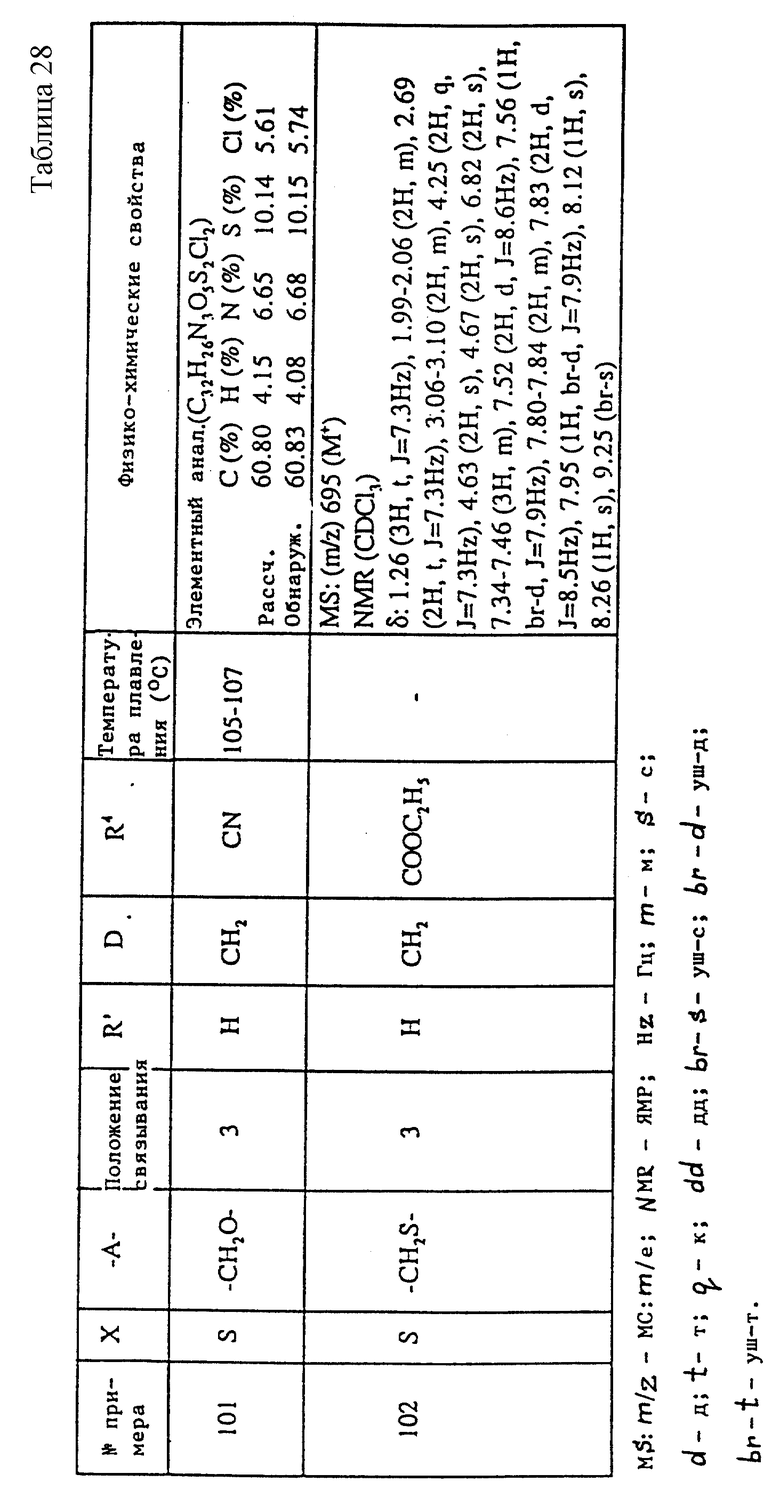
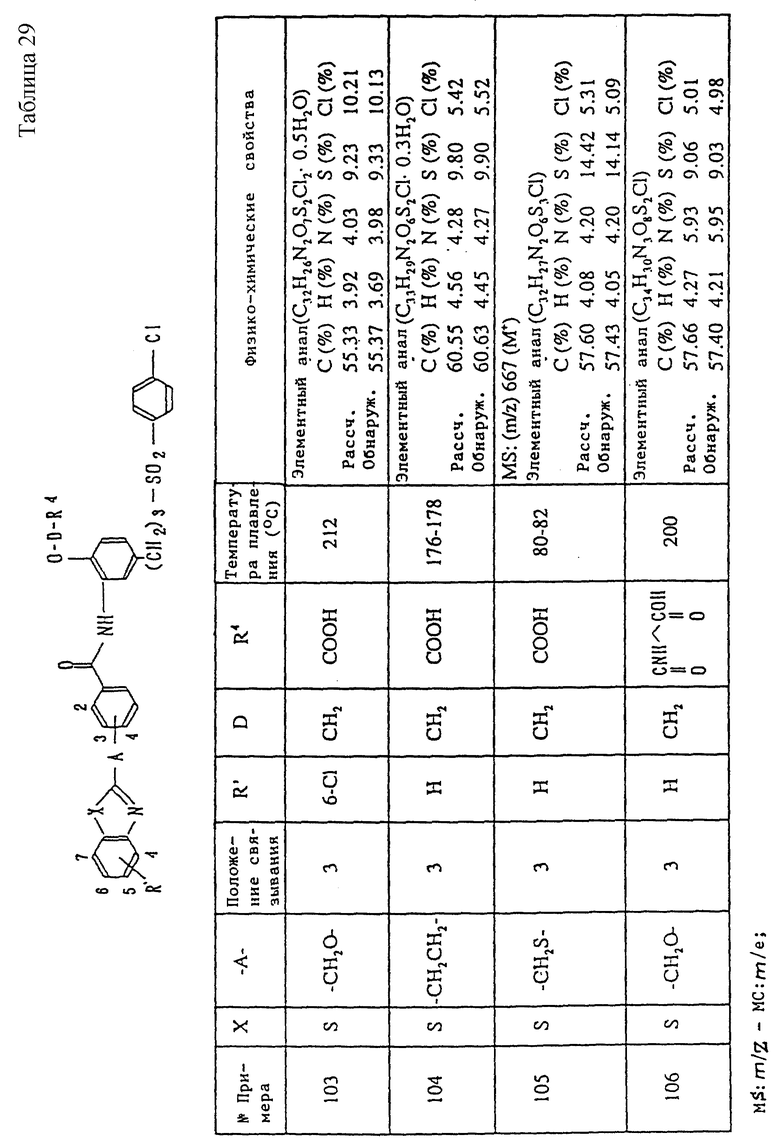
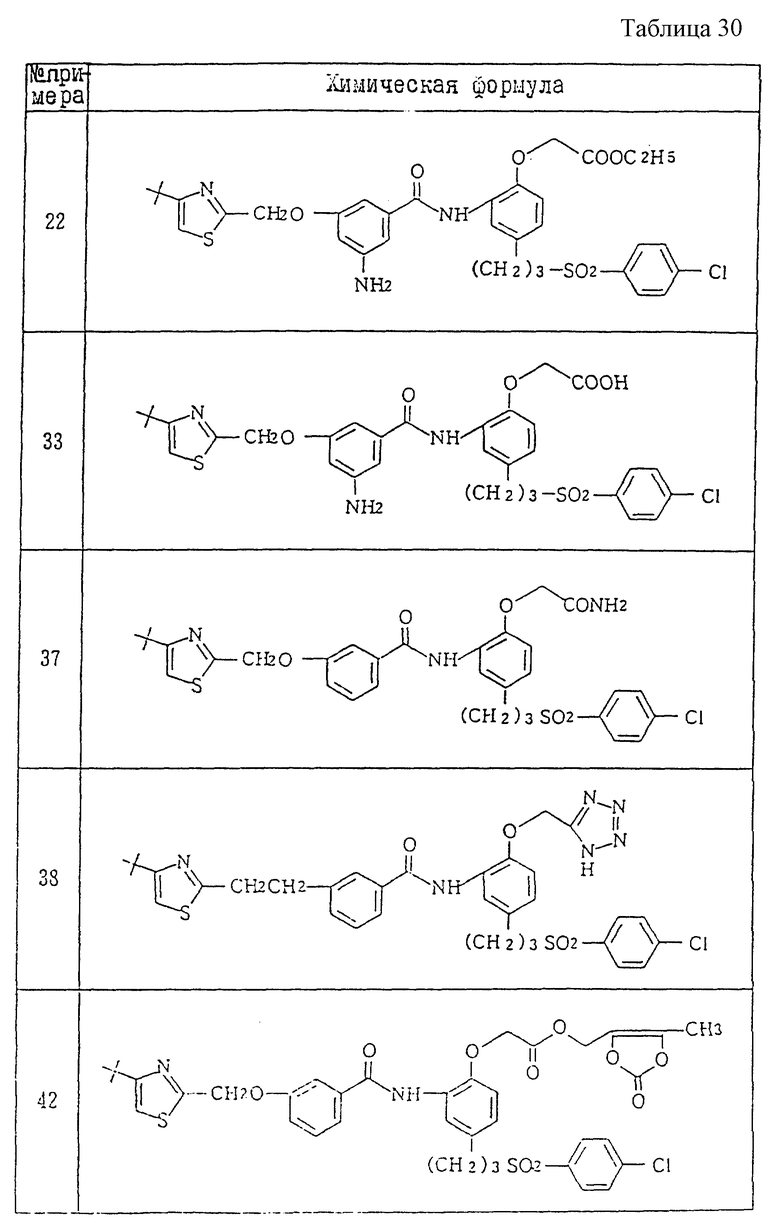
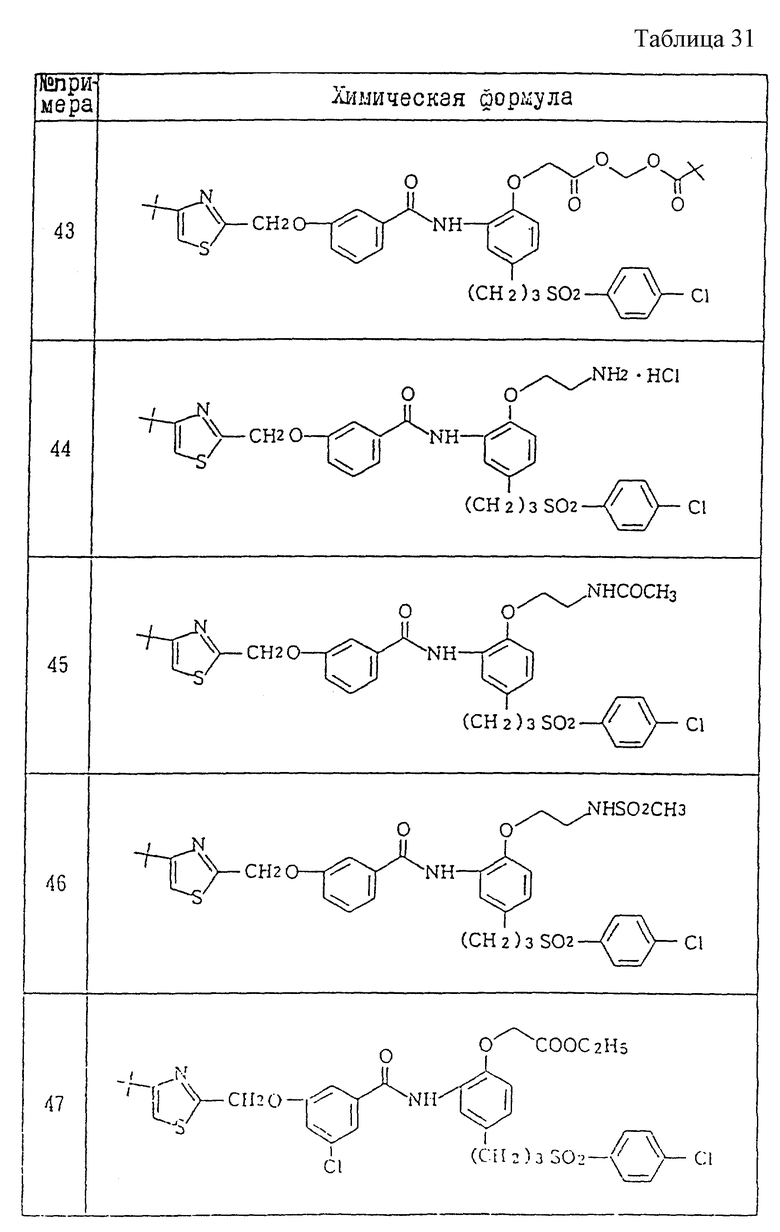
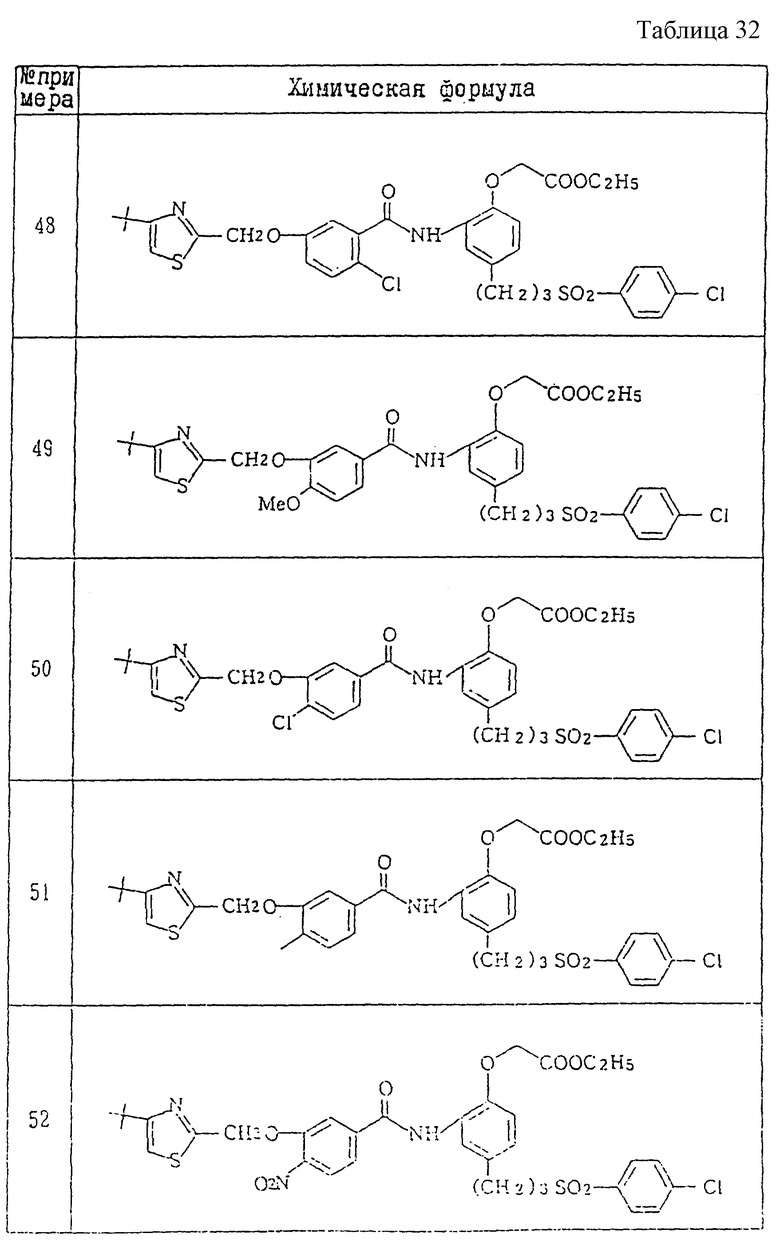
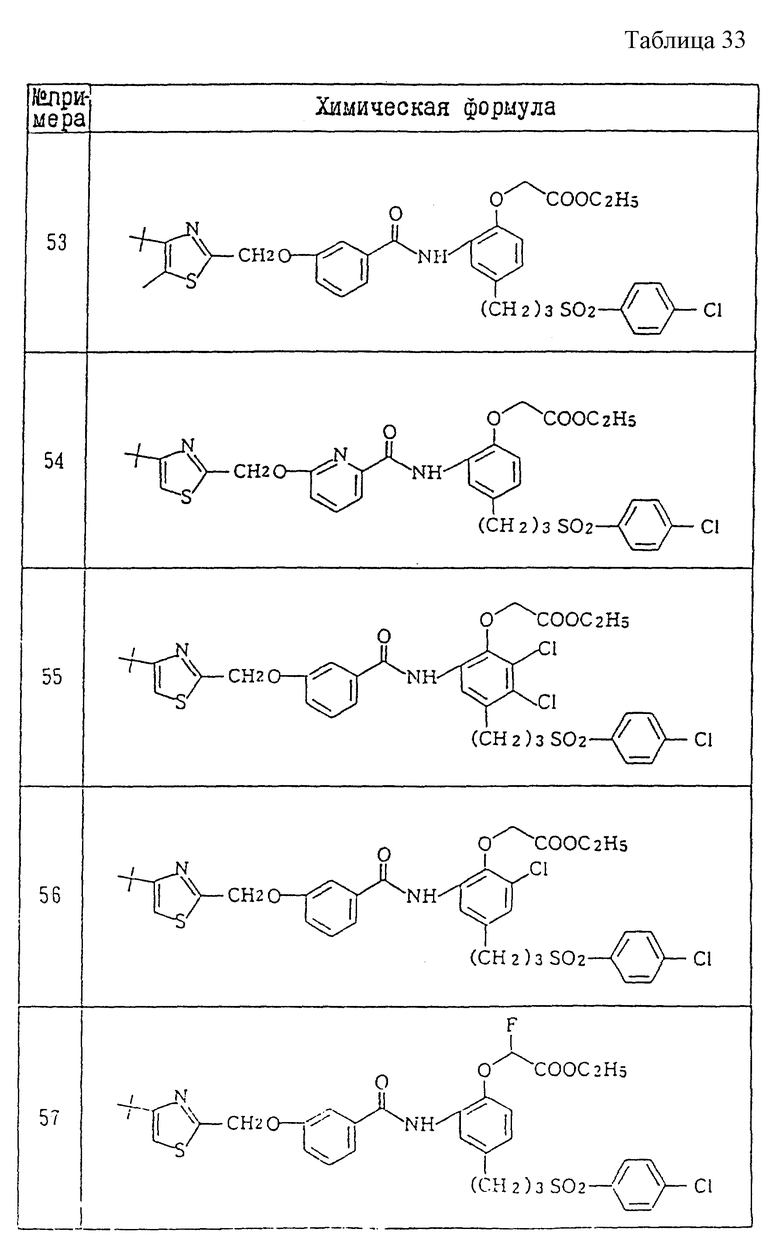
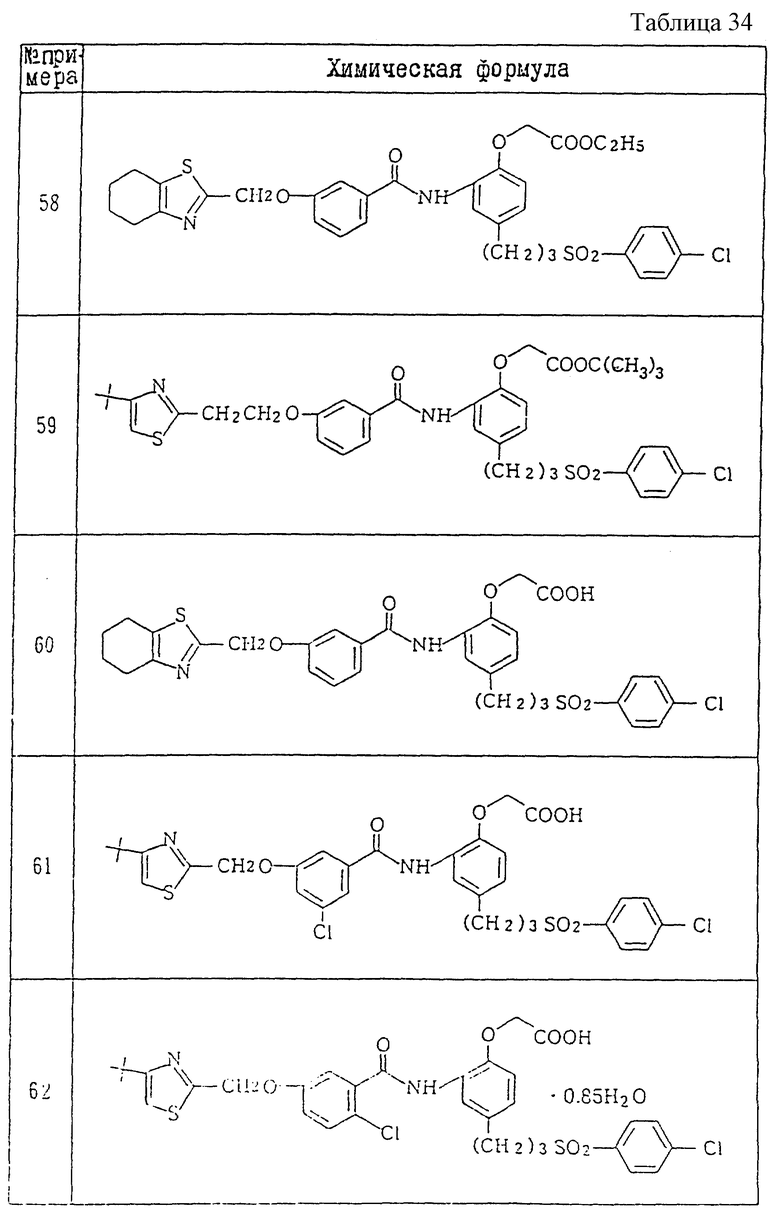
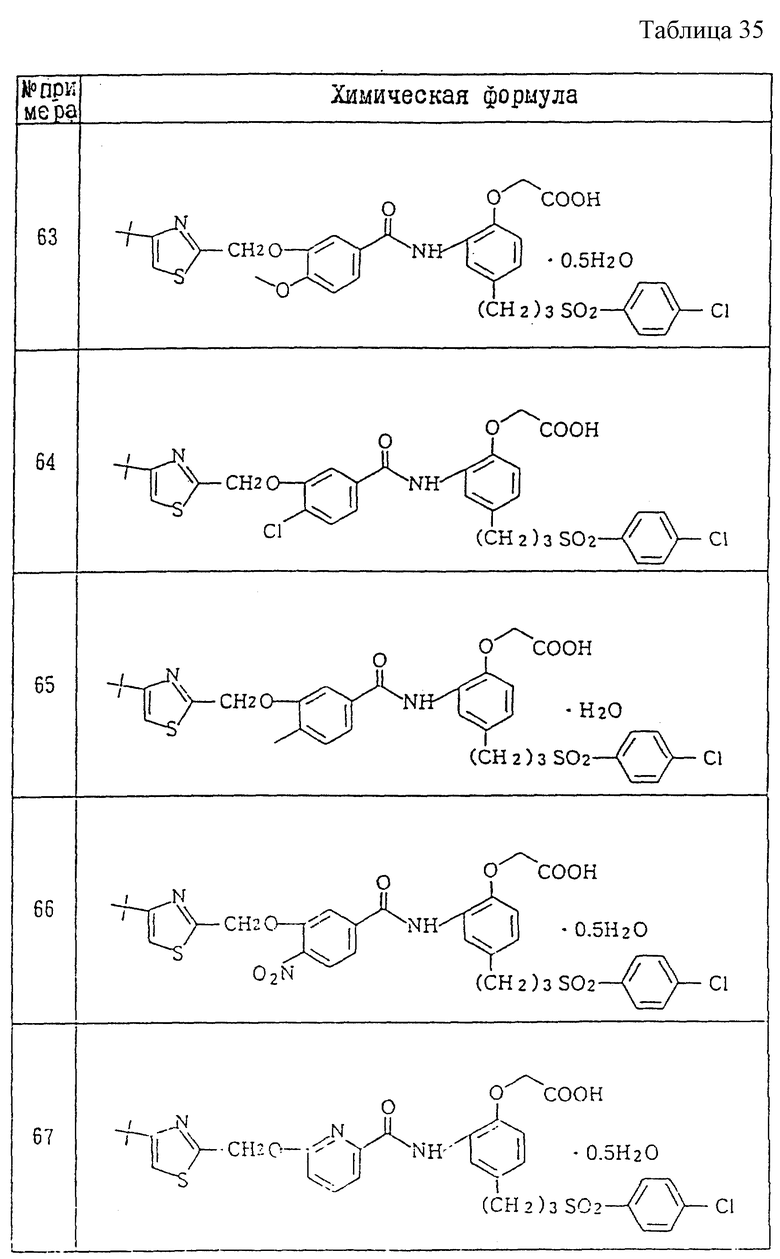
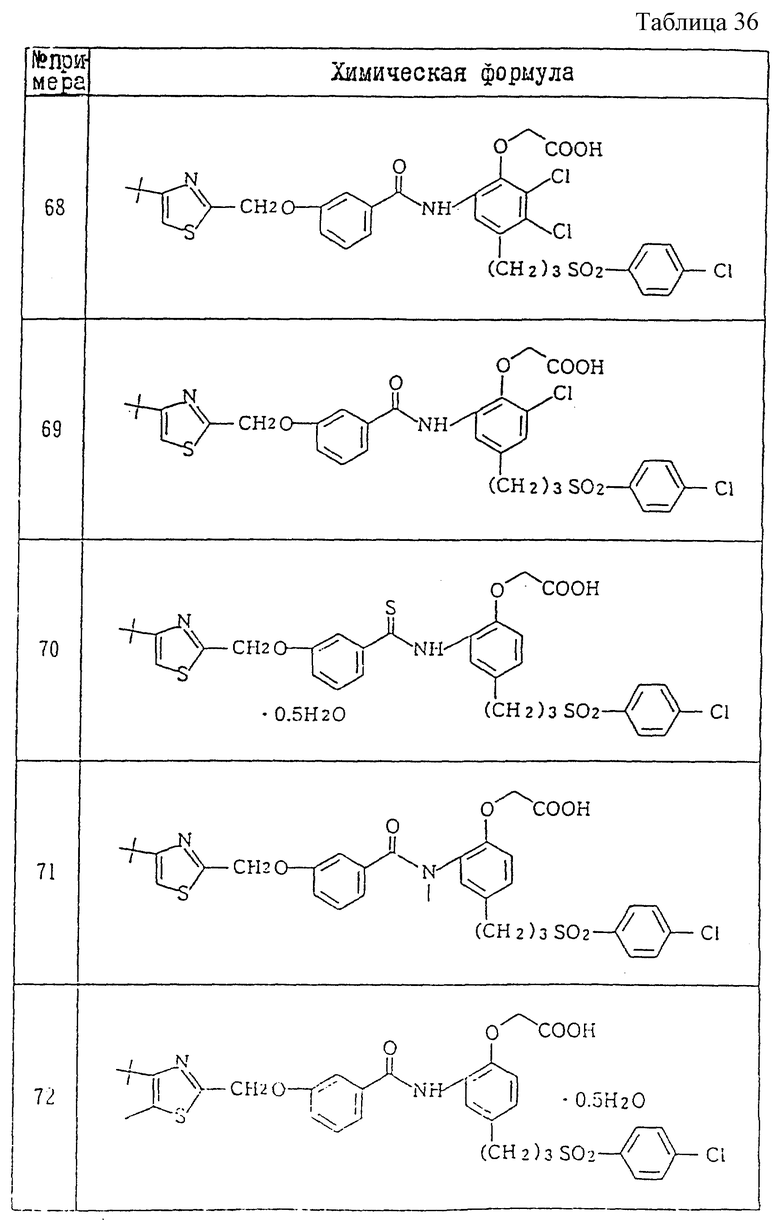
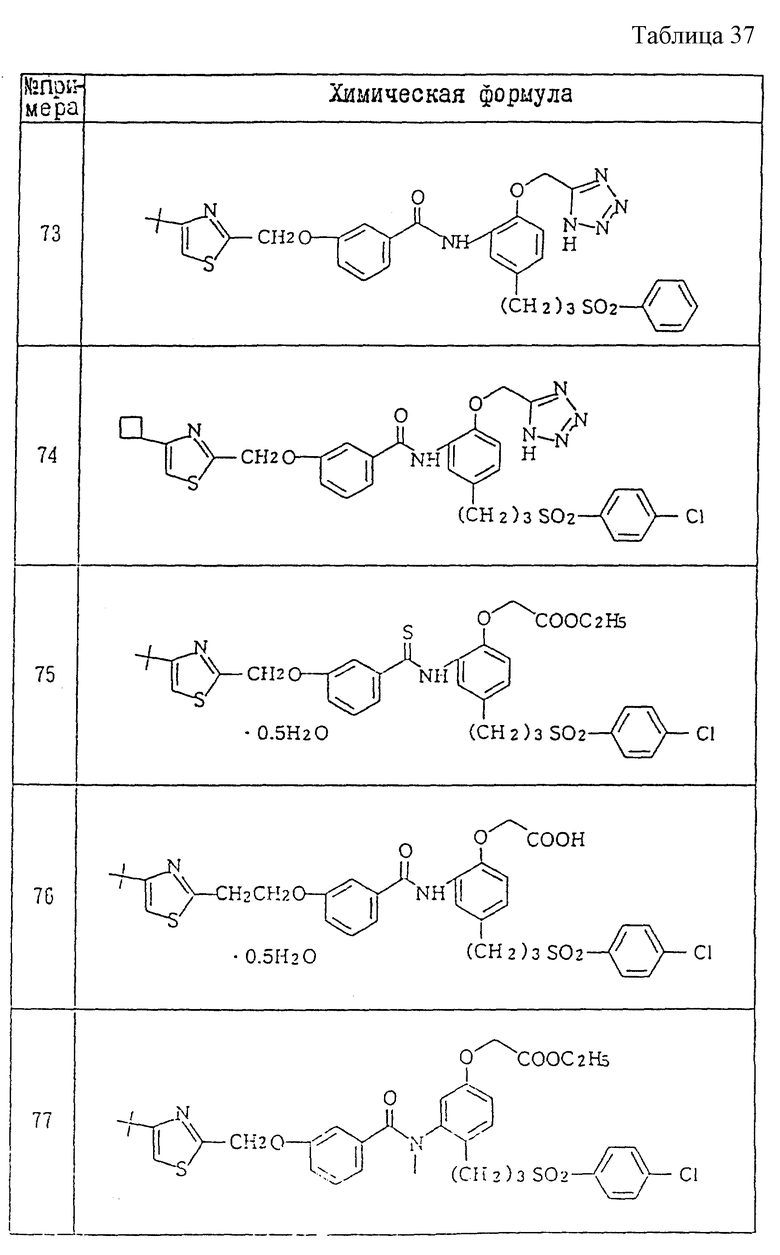
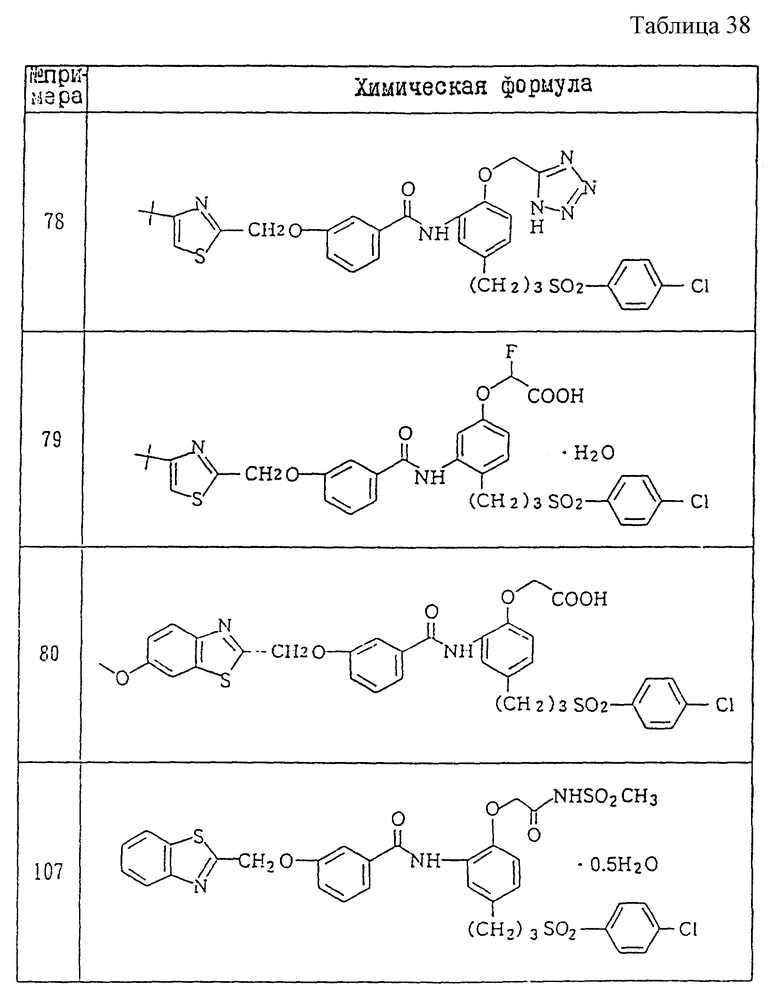
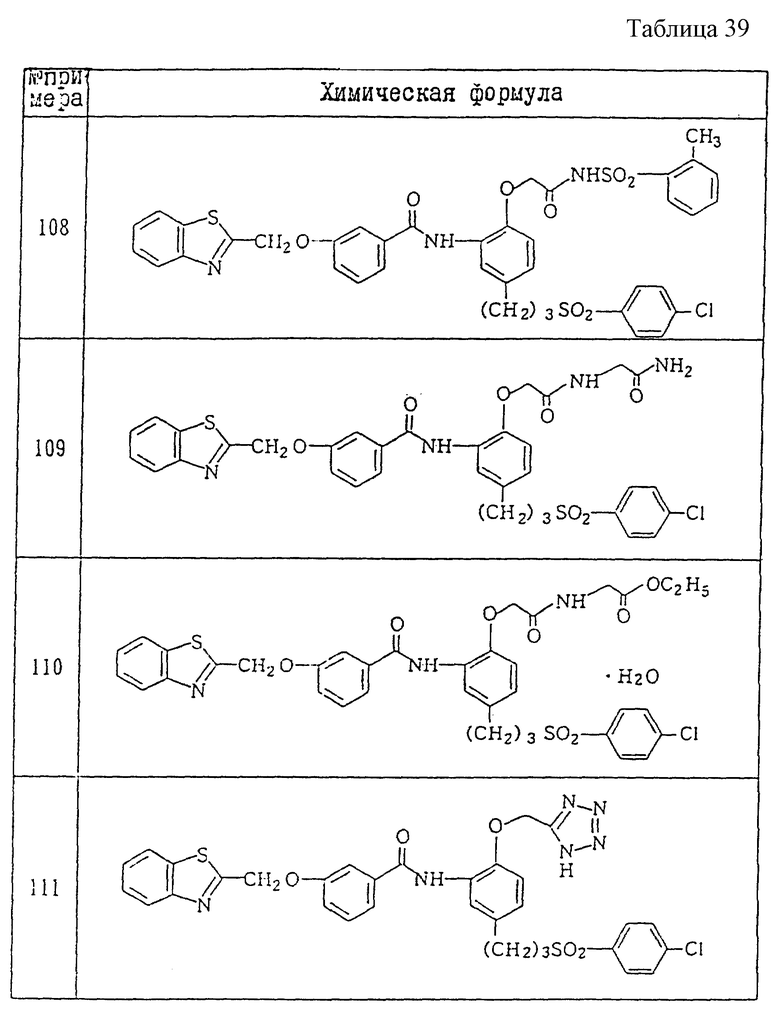
Изобретение относится к новым производным азола общей формулы I, где R1 и R2, одинаковые или различные, каждый представляет водород, циклоалкил и так далее, или R1 и R2 образуют с (а) конденсированное кольцо (b) или (с), которое может быть необязательно замещено замещенным низшим алкилом, аминогруппой и так далее; R3, R6, R7, R8, одинаковые или различные, каждый представляет атом водорода и т.д.; R4 представляет цианогруппу, тетразолил, -COOR9 и т.д.; R5 представляет атом водорода или низший алкил; D представляет необязательно замещенный низший алкилен; X и Z, одинаковые или различные, каждый представляет кислород или серу, Y представляет -N= или -CH=; A представляет -B-O-, -S-B-, -B-S- или -В-; В представляет низший алкилен или низший алкенилен; n = 2. Производные азола общей формулы I или их фармацевтически приемлемые соли с фармацевтически приемлемым носителем образуют фармкомпозицию, обладающую действием антагониста лейкотриена и антагониста тромбоксана A2, полезную для предупреждения или лечения аллергических заболеваний, ишемической болезни сердца и головного мозга. Промежуточные соединения формулы IVc и IIIa. 4 с. и 6 з.п. ф-лы, 39 табл.
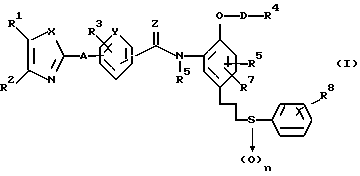
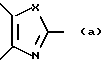
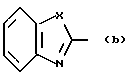
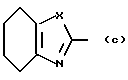
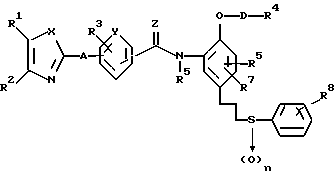
где R1 представляет атом водорода, C3 - C6 циклоалкильную группу, низший алкил или фенил, который может быть замещен низшим алкилом;
R2 представляет водород или низший алкил,
или R1 и R2, объединенные с кольцом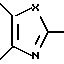
могут образовать конденсированное кольцо, представленное формулой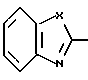
которое может быть замещено низшим алкилом, который может быть замещен атомами галогена; атомом галогена или низшим алкоксилом; или формулой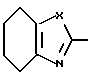
R3 представляет атом водорода, аминогруппу, нитрогруппу, атом галогена, низший алкоксил или низший алкил;
R6, R7 и R8, которые могут быть одинаковыми или отличаться друг от друга и каждый представляет атом водорода или атом галогена;
R4 представляет цианогруппу, тетразолил, группу формулы -COOR9, или группу формулы -E - NH - F - R10,
R9 представляет атом водорода или низший алкил;
E представляет одинарную связь или карбонильную группу;
F представляет одинарную связь или низший алкилен;
R10 представляет атом водорода, карбамоильную группу, карбоксильную группу, низшую алкоксикарбонильную группу, низший алканоил, низший алкилсульфонил; или арилсульфонил, который может быть замещен низшим алкилом;
R5 представляет атом водорода или низший алкил;
D представляет низший алкилен, который может быть замещен атомом галогена;
X представляет атом серы или атом кислорода;
Z представляет атом кислорода или атом серы;
Y представляет атом азота (-N=) или метиновую группу (-CH=);
A представляет группу формулы: -B - O-, -S - B-, -B - S- или -B- ;
B представляет низший алкилен или низший алкенилен;
n = 2,
или его фармацевтически приемлемая соль, гидрат или сольват.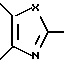
образуя конденсированное кольцо, представленное формулой
которое может быть замещено низшим алкилом, который может быть замещен 1 - 3 атомами галогена; атомом галогена или низшей алкоксигруппой; или формулой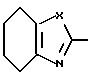
D - представляет низший алкилен, который может быть замещен атомом галогена.
2-[3-(4-трет-бутил-2-тиазолилметокси)бензоиламино] -4-[3-(4-хлорфенилсульфонил)пропил] феноксиуксусную кислоту,
4-[3-(4-хлорфенилсульфонил)пропил] -2-[3-[(4-циклобутил-2-тиазолил)метокси]бензоиламино]феноксиуксусную кислоту,
3-[(4-трет-бутил-2-тиазолил)метокси]-5'-[3-(4-хлорфенилсульфонил)пропил] -2'-(1H-тетразол-5-илметокси)бензанилид,
3-(2-бензотиазолилметокси)-5'-[3-(4-хлорфенилсульфонил)пропил] -2'-(1H-тетразол-5-илметокси)бензанилид, или их фармацевтически приемлемые соли, гидраты или сольваты.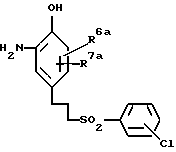
где R6a и R7a, которые могут быть одинаковыми или различными, и каждый представляет атом водорода или атом галогена,
или фармацевтически приемлемая его соль.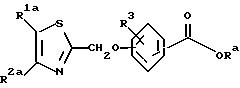
где R1a представляет атом водорода, C3 - C6 циклоалкильную группу, низший алкил или фенильную группу;
R2a представляет атом водорода,
или R1a и R2a могут быть объединены с кольцом
образуя конденсированный цикл, представленный формулой
R3 представляет атом водорода, аминогруппу, нитрогруппу, атом галогена, низшую алкоксигруппу или низший алкил;
Ra представляет атом водорода или низший алкил,
или его фармацевтически приемлемая соль.
Приоритет по пунктам и признакам:
14.10.1994 - по пп.1 - 6, 10: при R1 - атом водорода, C3 - C6 циклоалкильная группа, низший алкил или фенил, который может быть замещен, R2 - водород, R3 - атом водорода, аминогруппа, нитрогруппа, атом галогена или низший алкил; R6, R7 - атом водорода, R8 - атом водорода или атом галогена; R4 - тетразолил, группа формулы -COOR9, или группа формулы -E - NH - F - R10; R9 - атом водорода или низший алкил; E - одинарная связь или карбонильная группа; F - одинарная связь или низший алкилен; R10 - атом водорода, низший алканоил, низший алкилсульфонил; R5 - атом водорода; D - низший алкилен; X - атом серы (S); Z - атом кислорода (O); Y - метиновая группа (-CH= ); A - группа формулы: -B - O-, -S - B-, -B - S- или -B-; B - низший алкилен или низший алкенилен, и n = 2; п.7: первые три по ходу изложения соединения; п. 8: при R6a и R7a - атом водорода; п.9: при R1a - атом водорода, C3 - C6 циклоалкильная группа, низший алкил или фенильная группа; R2a - атом водорода, R3 - атом водорода, аминогруппа, нитрогруппа, атом галогена или низший алкил, Ra - атом водорода или низший алкил;
18.10.1994 - по пп.1 - 6, 10: при R2 - низший алкил, R4 - цианогруппа, R10 - карбамоильная группа, карбоксильная группа, низшая алкоксикарбонильная группа или арилсульфонил, который может быть замещен низшим алкилом; X - атом кислорода (O); п.7: - четвертое по ходу изложения соединение;
12.10.1995 - по пп.1 - 6, 10 при R1 и R2, которые объединенные с кольцом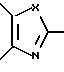
могут образовать конденсированное кольцо, представленное формулой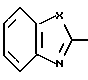
которое может быть замещено низшим алкилом, который может быть замещен атомом галогена или низшим алкоксилом; или формулой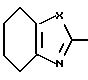
R3 - низший алкоксил; R6, R7 и R8, которые могут быть одинаковыми или отличаться друг от друга и каждый представляет атом водорода или атом галогена; R5 - низший алкил; D - низший алкилен, который может быть замещен; Z - атом серы (S); Y - атом азота (-N=); п.8: при R6a и R7a, которые могут быть одинаковыми или различными, и каждый представляет атом водорода или атом галогена; п.9: при R1a и R2a которые могут быть объединены с кольцом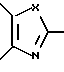
образуя конденсированный цикл, представленный формулой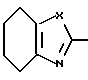
R3 - низшая алкоксигруппа; п.11.
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Способ получения замещенных триарилтиазолов | 1981 |
|
SU957765A3 |
Авторы
Даты
2001-01-10—Публикация
1995-10-12—Подача