Область применения
Изобретение относится к производному амидинонафтила или его соли, полезному для использования в качестве лекарственного средства, в частности, как ингибитор активированного фактора X свертывающей системы крови.
Уровень техники
Несмотря на изменения, которые произошли в стиле жизни населения Европы и Америки, и увеличение за последние годы численности старших возрастных групп, число пациентов, страдающих тромбоэмболической болезнью, включая инфаркт миокарда, церебральный и периферический артериальный тромбоз, год от года увеличивалось, а социальная значимость их лечения возрастала все сильнее и сильнее. Так же как фибринолиз и антитромбоцитарная терапия, антикоагулянтная терапия составляет часть способа лечения и предупреждения тромбоза (Sogo Rinsyo, 41, 2141-2145, 1989). В частности, безопасность, которая противостоит длительному приему лекарств, а также точное и правильное выражение антикоагулянтной активности, являются существенными факторами в предупреждении тромбоза.
Варфарин-калий часто используют в мировой практике как единственный антикоагулянт для перорального введения. Однако, это лекарство чрезвычайно трудно применять в клинической практике, поскольку трудно контролировать его антикоагулирующую способность, обусловленную характеристиками, основанными на механизме его действия (J. Clinical Pharmacology, 32, 196-209, 1992; и N. Eng. Mod. , 324, 26, 1865-1875, 1991), поэтому основное внимание было направлено на разработку более полезного и легко используемого антикоагулянта.
Поскольку тромбин контролирует превращение фибриногена в фибрин, которое является конечной ступенью коагуляции, а также тесно связано с активацией и агрегацией тромбоцитов (T-PA и Pro-UK, ed. O.Matsuo, Gakusai Kikaku, pp. 5-40, Blood Coagulation, 1986), его ингибитор явился центром изучения процесса антикоагуляции и стал объектом, на который были нацелены разработки новых лекарств. Однако, до настоящего времени в литературе не было сообщений об ингибиторах тромбина, назначаемых перорально, из-за их низкой биологической доступности при пероральном введении и проблем, связанных с безопасностью применения (Biomed. Biochim. Acta, 44, 1201-1210, 1985).
Активированный фактор X свертывания крови является ключевым ферментом, который расположен на стыке внешних и внутренних каскадных реакций свертывания крови и локализуется слева и выше по отношению к тромбину, так что имеется возможность, чтобы ингибирование этого фактора протекало более эффективно, чем ингибирование тромбина, и чтобы такой ингибитор был способен затормозить систему коагуляции специфическим способом (THROMBOSIS RESEARCH, 19, 339-349, 1980).
В качестве ссылки, которая раскрывает соединение, которое обладает ингибирующей активностью по отношению к активированному фактору X свертывания крови, можно привести нерассмотренную опубликованную японскую заявку (Kokai) No. 5-208946, в которой описано производное амидинонафтилбензола следующей общей формулы или его соль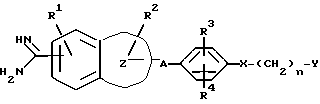
(в формуле, где ряд приводимых значений опущен, A представляет собой алкилен, содержащий 1-4 атома углерода, которые могут быть замещены 1-2 гидроксиалкилом, карбоксилом, алкоксикарбонилом, карбоксиалкилом или алкоксикарбонилалкилом; Y представляет собой насыщенную или ненасыщенную 5-6-членную гетероциклическую группу или циклическую углеводородную группу или им подобную, которая может иметь заместитель,... остальные значения опущены).
Однако соединение, заявленное в настоящем изобретении, является новым соединением, которое отчетливо отличается от вышеописанного по структуре, поскольку амидинонафтилалкильная или амидинонафтилкарбонильная группа связана с замещенным фенилом посредством атома азота. Кроме того, как будет сказано выше, заявленное соединение представляет собой продукт, обладающий более высокой активностью как ингибитора активированного фактора свертывания крови X, по сравнению с известным.
Описание изобретения
Для того, чтобы получить соединение, обладающее превосходной активностью ингибитора активированного фактора X свертывающей системы крови, авторы изобретения провели обширные исследования, в результате которых было установлено, что соединение, которым амидинонафтилалкильная или амидинонафтилкарбонильная группа связана с замещенной фенильной группой посредством атома азота, в частности, соединение, где группа формулы -A-W-R4 замещена атомом азота, оказывает заметно превосходящее ингибирующее действие против активированного фактора свертывания крови X, тем самым приводя к достижению поставленной проблемы.
Соответственно, настоящее изобретение относится к производному амидинонафтила общей формулы (I) или его фармацевтически приемлемой соли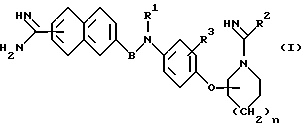
где символы имеют следующие значения:
R1 представляет собой водород или группу формулы -A-W-R4, где A - группа формулы 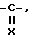 группа формулы
группа формулы 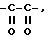 или -SO2-,
или -SO2-,
Х - атом кислорода или серы, W - простая связь или группа формулы NR5, R4 - гидроксил, низший алкокси, низший алкил, который может быть замещен, циклоалкил, который может быть замещен, арил, который может быть замещен, или гетероарил, который может быть замещен, при условии, что когда W - группа формулы NR5, R4 может дополнительно представлять собой атом водорода, но не быть гидроксильной или низшей алкоксигруппой, R5 - атом водорода, карбамоил, низший алкоксикарбонил, моно- или ди-низший алкиламинокарбонил, низший алкилсульфонил, моно- или ди-низший алкиламинотиокарбонил, низший алкил, который может быть замещен, или низший алканоил, который может быть замещен;
R2 представляет собой низший алкил;
R3 представляет собой атом водорода, атом галогена, карбоксил, амино, циано, нитро, гидроксил, низший алкокси, низший алкил или низший алкоксикарбонил;
В представляет собой низший алкилен или карбонил; n = 0 или 1. Те же значения заместителей используют и в дальнейшем.
Соединение (1), заявленное в настоящем изобретении, предпочтительно представляет собой производное амидинонафтила или его фармацевтически приемлемую соль, где низший алкил, который может быть замещен в значении R4 или R5, циклоалкил, который может быть замещен в значении R4 или низший алканоил, который может быть замещен в значении R5, представляет собой низший алкил, циклоалкил или низший алканоил, который может быть замещен членом из ниже следующей группы заместителей C; а арил, который может быть замещен, или гетероарил, который может быть замещен в значении R4, представляет собой арил или гетероарил, который может быть замещен членом из ниже следующей группы заместителей D, причем группа C включает следующие заместители: галоген, карбоксил, карбамоил, амино, циано, нитро, низший алканоил, низший алкокси, низший алкоксикарбонил, моно- или ди-низший алкиламино, арил, аралкилокси, арилокси, меркапто, низший алкилтио, низший алкилтиокарбонил, гидроксил или моно- или ди- низший алкиламинокарбонил, а группа D включает следующие заместители: галоген, карбоксил, амино, циано, нитро, гидроксил, низший алкокси, низший алкоксикарбонил, моно- или ди-низший алкиламино, низший алканоил или низший алкил, который может быть замещен членом из группы C;
более предпочтительно, оно представляет собой производное амидинонафтила или его фармацевтически приемлемую соль, где R4 представляет собой гидроксигруппу; низший алкокси; низший алкил, который может быть замещен галогеном, карбоксилом, карбамоилом, амино, низшим алкокси, низшим алкоксикарбонилом, моно- или ди-низшим алкиламино или фенилом; циклоалкил, который может быть замещен галогеном, карбоксилом, карбамоилом, амино, низшим алкокси, низшим алкоксикарбонилом, моно- или ди-низшим алкиламино или фенилом; арил, который может быть замещен галогеном, карбоксилом, амино, нитро, низшим алкоксикарбонилом или низшим алкокси; гетероарил, который может быть замещен галогеном, карбоксилом, амино, нитро, низшим алкоксикарбонилом или низшим алкокси (при условии, что когда W - группа формулы NR5, R4 может дополнительно представлять собой атом водорода, но не быть гидроксильной или низшей алкоксигруппой),
R5 - атом водорода; карбамоил; карбоксил; низший алкоксикарбонил; низший алканоил; моно- или ди-низший алкиламинотиокарбонил; или низший алкил, который может быть замещен галогеном, карбамоилом, амино, низшим алкокси, низшим алкоксикарбонилом, моно- или ди-низшим алкиламино или фенилом; и
R3 представляет собой атом водорода, атом галогена, карбоксил, низший алкокси, низший алкил или низший алкоксикарбонил.
Наиболее предпочтительным является производное амидинонафтила или его фармацевтически приемлемая соль, где группа формулы -A-W-R4 представляет собой группу, выбираемую из низшего алканоила, который может быть замещен низшим алкокси, низшим алкоксикарбонилом или моно- или ди-низшим алкиламино; аминокарбонила, который может быть замещен низшим алкоксикарбонилом; низшего алкилсульфонила, который может быть замещен галогеном, карбоксилом, карбамоилом, низшим алкоксикарбонилом или фенилом; моно- или ди- низший алкиламинокарбонила, который может быть замещен карбоксилом или низшим алкоксикарбонилом; аминосульфонила, который может быть замещен низшим алкоксикарбонилом; моно- или ди-низшего алкиламиносульфонила, который может быть замещен карбоксилом, карбамоилом или низшим алкоксикарбонилом; N-низший алкил-N-низший алкоксикарбониламиносульфонила, который может быть замещен карбоксилом или низшим алкоксикарбонилом; бензоила, который может быть замещен карбоксилом, низшим алкоксикарбонилом, галогеном или низшим алкокси; бензолсульфонила, который может быть замещен амино, нитро, карбоксилом или низшим алкоксикарбонилом; нафтоила, моно-низшего алкиламинотиокарбонила; пиридилкарбонила; тиенилкарбонила; аминооксалила; или циклоалкилкарбонила; и R3 представляет собой атом водорода или низший алкоксикарбонил.
Кроме того, предпочтительным является производное амидинонафтила или его фармацевтически приемлемая соль, где A - группа формулы 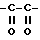 или группа -SO2-.
или группа -SO2-.
Другая цель настоящего изобретения состоит в том, чтобы получить соединение общей формулы (I') или его соль, которое полезно для применения в качестве промежуточного соединения для получения целевого соединения формулы (I).
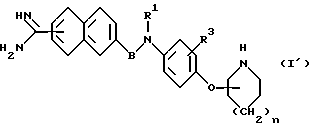
Еще одна цель настоящего изобретения состоит в том, чтобы обеспечить лекарство, в частности, ингибитор активированного фактора X свертывающей системы крови, который в качестве активного ингредиента содержит производное амидинонафтилбензола общей формулы (I) или его соль.
Далее приводится подробное описание настоящего изобретения.
Если не указано особо, в определении групп в описании термин "низший" означает прямую или разветвленную углеродную цепь, имеющую от 1 до 6 атомов углерода.
Поэтому иллюстративные примеры для "низшего алкила" включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, 1-метилбутил, 2- метилбутил, 1,2-диметилпропил, гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил, из числа которых группы, имеющие от 1 до 3 атомов углерода, являются предпочтительными, причем метил и этил являются особенно предпочтительными.
Иллюстративные примеры для "низшего алкокси" включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси (амилокси), изопентилокси, неопентилокси, трет-пентилокси, 2-метилбутокси, 1,2-диметилпропокси, 1-этилпропокси, гексилокси и другие, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, из числа которых группы, имеющие от 1 до 3 атомов углерода, являются предпочтительными, причем метокси и этокси являются особенно предпочтительными.
Примеры "циклоалкила" включают циклоалкил, имеющий 3-8 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и им подобные, из которых циклопропил, циклобутил, циклопентил и циклогексил и им подобные являются предпочтительными.
Иллюстративные примеры для "арила" включают арильные кольцевые углеводородные группы, имеющие от 6 до 14 атомов углерода, такие как фенил, нафтил, бифенил, антрил и им подобные, из которых фенил и нафтил являются предпочтительными.
"Гетероарил" представляет собой одиночное или конденсированное кольцо, имеющее 1 до 3 гетероатомов, включающих кислород, азот, серу и т.д., и их иллюстративные примеры включают фурил, тиснил, пирролил, имидазолил, пиразолил, изотиазолил, изоксазолил, пиридил, пиримидинил, хинолил, изохинолил, хиназолинил, хинолизинил, хиноксалинил, циннолинил, безимидазолил, имидазопиридил, нафтиридинил, 1,2-бензоизоксазолил, бензоксазолил, бензотиазолил, оксазолопиридил, изотиазолопиридил, бензотиенил и им подобные, из которых такие гетероарильные группы, как фурил, тиенил, пирролил, имидазолил, пиридил и им подобные являются предпочтительными.
"Низший алкоксикарбонил" представляет собой группу, образованную из прямого или разветвленного спирта, имеющего 1-6 атомов углерода, и карбоксила путем этерификации, такую как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор- бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, неопентилоксикарбонил, трет- пентилоксикарбонил, гексилоксикарбонил и им подобные, из которых такие группы, которые имеют 1-3 атомов углерода, являются предпочтительными, а метоксикарбонил и этоксикарбонил являются особенно предпочтительными.
"Моно- или ди-низший алкиламинокарбонил" представляет собой группу, в которой один или два атома водорода аминогруппы замещен(ы) описанным выше "низшим алкилом". Иллюстративные примеры для моно-низшего алкиламинокарбонила включают метиламинокарбонил, этиламинокарбонил, пропиламинокарбонил, изопропиламинокарбонил, бутиламинокарбонил, изобутиламинокарбонил, пентиламинокарбонил, изопентиламинокарбонил, гексиламинокарбонил, изогексиламинокарбонил и им подобные. Иллюстративные примеры для диалкиламинокарбонила включают симметричные диалкиламинокарбонильные группы, которые дважды замещены прямыми или разветвленными алкильными группами, имеющими 1-6 атомов углерода, такие как диметиламинокарбонил, диэтиламинокарбонил, дипропиламинокарбонил, диизопропиламинокарбонил, дибутиламинокарбонил, дипентиламинокарбонил и им подобные, и асимметричные диалкиламинокарбонильные группы, которые дважды замещены различными прямыми или разветвленными алкильными группами, имеющими 1-6 атомов углерода, такие как этилметиламинокарбонил, метилпропиламинокарбонил, этилпропиламинокарбонил, бутилметиламинокарбонил, бутилэтиламинокарбонил, бутилпропиламинокарбонил и им подобные.
Иллюстративные примеры для "низшего алкилсульфонила" включают метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, изобутилсульфонил, пентилсульфонил, изо-пентилсульфонил, гексилсульфонил, изогексилсульфонил и им подобные.
"Моно- или ди-низший алкиламинотиокарбонил" представляет собой группу, в которой один или два атома водорода аминогруппы замещен(ы) описанным выше "низшим алкилом". Иллюстративные примеры для моно-низшего алкиламинотиокарбонила включают метиламинотиокарбонил, этиламинотиокарбонил, изопропиламинотиокарбонил, бутиламинотиокарбонил, изобутиламинотиокарбонил, пентиламинотиокарбонил, изопентиламинотиокарбонил, гексиламинотиокарбонил, изогексиламинотиокарбонил и им подобные. Иллюстративные примеры для диалкиламинотиокарбонила включают симметричные диалкиламинотиокарбонильные группы, которые дважды замещены прямыми или разветвленными алкильными группами, имеющими 1-6 атомов углерода, такие как диметиламинотиокарбонил, диэтиламинотиокарбонил, дипропиламинотиокарбонил, диизопропиламинотиокарбонил, дибутиламинотиокарбонил, дипентиламинотиокарбонил и им подобные, и асимметричные диалкиламинотиокарбонильные группы, которые дважды замещены различными прямыми или разветвленными алкильными группами, имеющими 1-6 атомов углерода, такие как этилметиламинотиокарбонил, метилпропиламинотиокарбонил, этилпропиламинотиокарбонил, бутилметиламинотиокарбонил, бутилэтиламинотиокарбонил, бутилпропиламинотиокарбонил и им подобные.
Иллюстративные примеры для "низшего алканоила" включают формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил и им подобные, из которых ацетил, пропионил и бутирил являются предпочтительными, а ацетил и пропионил являются наиболее предпочтительными.
"Низший алкилен" представляет собой алкилен, имеющий 1-6 атомов углерода, и его иллюстративные примеры включают метилен, этилен, метилметилен, триметилен, диметилметилен, тетраметилен, метилтриметилен, этилэтилен, диметилэтилен, этилметилметилен, пентаметилен, метилтетраметилен, диметилтриметилен, триметилэтилен, диэтилметилен, гексаметилен, метилпентаметилен, диметилтетраметилен и им подобные. Из этих групп алкилен, имеющий 1-3 атома углерода, такие как метилен, этилен, метилметилен, триметилен и диметилметилен являются предпочтительными, метилен и этилен являются более предпочтительными, причем метилен является наиболее предпочтительным.
Относительно определения заместителя в терминах "низший алкил, который может быть замещен", "циклоалкил, который может быть замещен" или "низший алканоил, который может быть замещен", используют любую группу, которая может быть заместителем на низшем алкиле, циклоалкиле или низшем алканоиле, однако член группы заместителей C может быть использован предпочтительно. Кроме того, в отношении определения заместителя для "арила, который может быть замещен" или "гетероарила, который может быть замещен" используют любую группу, которая может быть заместителем на ариле или гетероариле, однако член группы заместителей D может быть использован предпочтительно. Рассмотренные выше группы, такие как низший алкил, циклоалкил, низший алканоил, арил или гетероарил, могут быть замещены одним и более заместителями, предпочтительно одним-тремя.
Группа C включает следующие заместители: галоген, карбоксил, карбамоил, амино, циано, нитро, низший алканоил, низший алкокси, низший алкоксикарбонил, моно- или ди-низший алкиламино, арил, аралкилокси, арилокси, меркапто, низший алкилтио, низший алкилтиокарбонил, гидроксил или моно- или ди-низший алкиламинокарбонил, а группа D включает следующие заместители: галоген, карбоксил, амино, циано, нитро, гидроксил, низший алкокси, низший алкоксикарбонил, моно- или ди-низший алкиламино, низший алканоил или низший алкил, который может быть замещен членом из группы C.
Примеры галогена включают атомы фтора, хлора, иода и брома, а примеры моно- или ди-низшего алкиламино включают моно-низшие алкиламиногруппы, такие как метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, пентиламино, изопентиламино, гексиламино, изогексиламино и им подобные, или прямые или разветвленные симметричные или асимметричные ди-низшие алкиламино группы, имеющие от 1 до 6 атомов углерода, такие как диметиламино, метилэтиламино, диэтиламино, дипропиламино, этилпропиламино, дибутиламино, дипентиламино и им подобные. Термин "аралкилокси" означает группу, в которой необязательный водородный атом "низшего алкокси" замещен упомянутым выше "арилом", и его иллюстративные примеры включают бензилокси, нафтилметилокси, фенетилокси, фенилпропилокси и другие, им подобные, а термин "арилокси" означает группу, в которой водородный атом гидроксила замещен упомянутым выше "арилом", и его иллюстративные примеры включают фенилокси, нафтилокси и другие, им подобные.
Термин "алкилтио" означает группу, в которой водородный атом меркаптогруппы замещен упомянутым выше "низшим алкилом", и его иллюстративные примеры включают метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, пентилтио, изопентилтио, гексилтио и им подобные, а термин "низший алкилтиокарбонил" означает группу, в которой карбонильная группа упомянутого выше "низшего алканоила" замещена тиокарбонильной группой, и его иллюстративные примеры включают метилтиокарбонил, этилтиокарбонил, пропилтиокарбонил, изо-пропилтиокарбонил, бутилтиокарбонил, изобутилтиокарбонил, пентилтиокарбонил, изопентилтиокарбонил, гексилтиокарбонил и им подобные.
"Моно- или ди-низший алкиламиносульфонил" означает группу, в которой один или два водородных атома аминосульфонильной группы замещен упомянутым выше "низшим алкилом". Иллюстративные примеры для "моно-низшего алкиламиносульфонила" включают метиламиносульфонил, этиламиносульфонил, пропиламиносульфонил, изопропиламиносульфонил, бутиламиносульфонил, изобутиламиносульфонил, пентиламиносульфонил, изо-пентиламиносульфонил, гексиламиносульфонил, изогексиламиносульфонил и им подобные. Иллюстративные примеры для диалкиламиносульфонила включают симметричные диалкиламинотиосульфонильные группы, которые дважды замещены прямыми или разветвленными алкильными группами, имеющими 1-6 атомов углерода, такие как диметиламиносульфонил, диэтиламиносульфонил, дипропиламиносульфонил, диизопропиламиносульфонил, дибутиламиносульфонил, дипентиламиносульфонил и им подобные, и асимметричные диалкиламиносульфонильные группы, которые дважды замещены различными прямыми или разветвленными алкильными группами, имеющими 1-6 атомов углерода, такие как этилметиламиносульфонил, метилпропиламиносульфонил, этилпропиламиносульфонил, бутилметиламиносульфонил, бутилэтиламиносульфонил, бутилпропиламиносульфонил и им подобные.
Термин "N-низший алкил-N-низший алкоксикарбониламиносульфонил" означает группу, в которой водородный атом аминосульфонильной группы замещен вышеупомянутым "низшим алкилом" или "низшим алкоксикарбонилом". Его иллюстративные примеры включают N-метил-N- метоксикарбониламиносульфонил, N-метил-N- этоксикарбониламиносульфонил, N-этил-N-метоксикарбониламиносульфонил, N-этил-N-этоксикарбониламиносульфонил, N-метил-N- пропоксикарбониламиносульфонил, N-этил-N- пропоксикарбониламиносульфонил, N-пропил-N- пропоксикарбониламиносульфонил, N-бутил-N- метоксикарбониламиносульфонил, N-бутил-N- этоксикарбониламиносульфонил и им подобные, из которых группа, замещенная алкилом, содержащим 1-3 атома углерода, и алкоксикарбонилом, содержащим 1-3 атома углерода, является предпочтительной.
Иллюстративный пример наиболее предпочтительных соединений среди целевых продуктов, заявленных в настоящем изобретении, относится к производному амидинонафтила или его фармацевтически приемлемой соли, выбираемому из группы, включающей:
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7- амидино-2-нафтил)метил-N'-метилсульфамид;
этил-N-[N-4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]карбамат;
4-[N-4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]сульфамоил]бензойная кислота;
[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7- амидино-2-нафтил) метил]сульфамоил]уксусная кислота;
этил-N-[N-4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]глицинат;
N-[N-4-[(1-aцeтoимидoил-4-пипepидил)oкcи] фeнил] -N-[(7- амидино-2-нафтил)метил]сульфамоил]-N-этоксикарбонилглицин; и
N-[N-4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7-амидино-2- нафтил)метил]сульфамоил]глицин.
Поскольку заявленные соединения содержат в некоторых случаях асимметричные углеродные атомы, то в настоящее изобретение включены различные изомеры, такие как геометрические изомеры, таутомеры, оптические изомеры и им подобные, либо их смеси или выделенные формы.
В некоторых случаях соединения формулы (I) образуют кислотно-аддитивные соли. Кроме того, в зависимости от типа заместителя они могут образовать соль с основанием. Иллюстративные примеры таких солей включают кислотно-аддитивные соли с неорганическими кислотами, такими как хлористоводородная, бромистоводородная и иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и им подобные, либо с органическими кислотами, такими как муравьиная, уксусная, пропионовая, оксалиловая, малоновая, янтарная, фумаровая, малеиновая, молочная, яблочная, винная и лимонная кислоты, метансульфоновая и этансульфоновая кислота, аспаргиновая кислота, глутаминовая кислота и им подобные, а также соли с неорганическими основаниями, такими как натриевое, калиевое, магниевое, кальциевое, алюминиевое и им подобные, или органическими основаниями, такими как метиламин, этиламин, этаноламин, лизин, орнитин и им подобные, а также соли аммония и другие, им подобные соединения.
Кроме того, предмет изобретения составляют гидраты, фармацевтически приемлемые различные сольваты, а также полиморфная форма соединения формулы (I). На самом деле настоящее изобретение не ограничивается соединениями, описанными в приводимых ниже примерах, но включает все призводные амидинонафтила, представленные общей формулой (I) и его фармацевтически приемлемые соли.
Способ получения
В настоящем разделе описан типичный способ получения нового соединения формулы (I). Кроме того, поскольку соединение общей формулы (I') как предмет изобретения представляет собой новое соединение, то его получение описано на первой стадии предлагаемого способа.
Первая стадия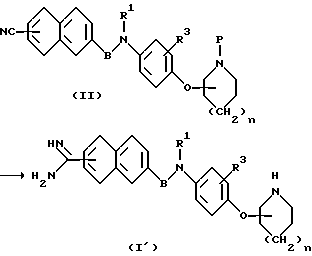
В приведенной формуле P представляет собой аминозащитную группу.
В качестве аминозащитной группы P можно использовать без каких-либо ограничений группы, широко применяемые для этой цепи, такие как низший алкоксикарбонил, ацил, низший алкил, аралкил, сульфонил и им подобные.
Соединение общей формулы (I') можно синтезировать следующими способами (i), (ii) или (iii).
(i) Способ, по которому нитрил переводят в имидат, а затем конденсируют с амином.
Нитрил (II) реагирует со спиртом, таким как метанол, этанол или им подобным, при температуре от -40oC до 0oC в присутствии газообразного хлористого водорода, а затем полученный в результате имидат взаимодействует с аммиаком, карбонатом аммония, хлоридом аммония или другим амином или солью амина. В качестве растворителя используют метанол, этанол, ацетон, тетрагидрофуран и им подобные соединения.
(ii) Способ, по которому нитрил переводят в тиоамид, а затем в тиоимидат, который впоследствии конденсируют с амином.
Нитрил (II) реагирует с сероводородом в присутствии органического основания, такого как метиламин, триэтиламин, пиридин, пиколин, с получением тиоамида. Последний получают также путем взаимодействия нитрила (II) с о,о-диэтилдитиофосфатом в присутствии хлористого водорода.
Полученный тиоамид взаимодействует с низшим галоидоалкилом, таким как йодистый метил, йодистый этил или им подобные, для перевода его в тиоимидат, который затем взаимодействует с аммиаком, карбонатом аммония, хлоридом аммония, ацетатом аммония или другим амином или солью амина. В качестве растворителя используют метанол, этанол, ацетон, тетрагидрофуран, этилацетат и им подобные соединения.
(iii) Способ, по которому амин, соль амина, амид металла или реактив Гриньяра непосредственно прибавляют к нитрилу.
Синтез осуществляют путем добавления к нитрилу (II) такого реагента, как аммиак, хлорид аммония, тиоцианат аммония, тиоцианат алкиламмония, МeAl(Cl)NH2, NaNH2, (CН3)2NMgBr или им подобные соединения, в соответствующем растворителе или в его отсутствие. В качестве растворителя можно использовать хлороформ, метанол, этанол, ацетон, тетрагидрофуран, толуол, диметилформамид и другие. В некоторых случаях реакцию значительно ускоряют при использовании в качестве катализатора основания (например, гидрида натрия), хлорида алюминия или кислоты (например, пара-толуолсульфокислоты). Реакцию проводят при температуре от охлаждения до комнатной или при нагревании.
Во время перевода нитрила в амидиногруппу защиту нитрила P можно удалять или не удалять. В тех случаях, когда защитную группу P не удаляют, соединение (I') получают путем удаления защитной группы P подходящим для этой цели методом, например, в кислой среде с помощью соляной, уксусной, трифторуксусной кислоты и им подобных.
Кроме того, когда алкоксикарбонильная группа присоединена к соединению (II), можно перевести алкоксикарбонильную группу в карбамоильную одновременно с реакцией образования амидиногруппы.
Вторая стадия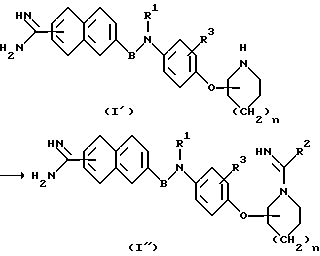
Соединение формулы (I'') получают путем взаимодействия соединения (I'), которое имеет вторичную аминогруппу и которое получают на описанной выше первой стадии, с имидатом в соответствующем растворителе в присутствии основания в интервале температур от охлаждения до комнатной.
Примеры используемого растворителя включают воду, спирты, содержащие 1-4 атома углерода, такие как этанол, пропанол и им подобные, алифатические эфиры, такие как диэтиловый эфир, галогенированные углеводороды, такие как хлороформ, N, N-диметилформамид, диметилсульфоксид, а также смеси этих растворителей.
Примеры оснований включают N- метилморфолин, триэтиламин, триметиламин, гидроокись натрия, гидроокись калия и другие, им подобные основания.
Когда алкоксикарбонильная группа присоединена к соединению формулы (I''), гидролиз осуществляют обычным путем и при необходимости в щелочной, кислой или нейтральной среде.
Примеры оснований, используемых в щелочной среде, включают гидроокись натрия, гидроокись калия, гидроокись лития, гидроокись бария и им подобные, примеры кислот для гидролиза, проводимого в кислой среде, включают кислоты Льюиса, такие как соляная кислота, серная кислота, трихлорид бора и им подобные, трифторуксусная кислота, п-толуолсульфокислота и им подобные, а примеры реагентов, используемых в нейтральной среде, включают ионы галогена, такие как иодид лития, бромид лития и им подобные, соли щелочных металлов тиола и ценолала, иодтриметилсилан и фермент, такой как эстераза. Примеры растворителей, используемых в реакции, включают воду, спирт (например, метанол и этанол), ацетон, диоксан, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, диметилсульфоксид, муравьиную кислоту, пиридинацетат, лутидин, коллидин и другие. Указанные растворители используют в виде смесей с водой.
Хотя реакция как правило протекает при комнатной температуре, бывает необходимо в некоторых случаях осуществлять ее на ледяной бане или при нагревании, с тем, чтобы ее можно было выбрать обычным путем.
Кроме того, соединение общей формулы (I) можно получить путем необязательного объединения известных реакций, которые обычно используются специалистами, таких как алкилирование, ацилирование, окисление, восстановление, гидролиз и др.
Способ получения исходного соединения
Исходные соединения IVa, IVb, IVc, IVd, IVe и VII для получения заявленного соединения формулы I, где R1 представляет собой группу -A-W-R4-, получают следующими способами (a)-(f).
(а) Способ получения амидного соединения (IVа)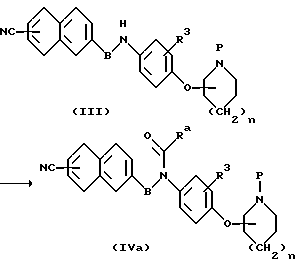
В приведенной формуле Ra - группа, представленная радикалом Ra или группой формулы 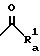 , где Ra 1 представляет собой низший алкил, который может иметь заместить, или циклоалкил, который также может иметь заместитель, или низший алкокси. Соединение (IVa), являющееся амидом, получают путем введения в реакцию ацилирования амина (III) и активного производного карбоновой кислоты в соответствующем растворителе.
, где Ra 1 представляет собой низший алкил, который может иметь заместить, или циклоалкил, который также может иметь заместитель, или низший алкокси. Соединение (IVa), являющееся амидом, получают путем введения в реакцию ацилирования амина (III) и активного производного карбоновой кислоты в соответствующем растворителе.
Примеры активного производного карбоновой кислоты включают активный эфир, получаемый путем взаимодействия с фенольным производным (например, п-нитрофенолом) или производным N-гидроксиамина (например, 1-гидроксисукцинимидом и 1- гидроксибензотриазолом); моноалкилкарбонат или смесь ангидридов кислоты, получаемая путем взаимодействия с органической кислотой, или смесь ангидридов фосфорной кислоты, получаемая путем взаимодействия дифенилфосфорилхлорида с N-метилморфолином; азид кислоты, получаемый путем взаимодействия сложного эфира с гидразином или алкилнитритом; галоидангидрид (например, хлорангидрид или бромангидрид); симметричный ангидрид кислоты и другие.
По другому варианту амид (IVa) можно получить, если подвергнуть карбоновую кислоту реакции ацилирования в соответствующем растворителе в присутствии конденсирующего агента. В этом случае в качестве конденсирующего агента желательно использовать N,N-дициклогексилкарбодиимид (ДЦК), 1-этил-3-(3-(N, N- диметиламино) пропил) карбодиимид, карбонилдиимидазол, дифенилфосфорилазид (ДФФА), диэтилфосфорилцианид и другие, и тому подобные соединения.
Реакцию осуществляют как правило в растворителе в интервале температур от охлаждения и вплоть до комнатной температуры. К используемым растворителям относятся органические растворители, которые не участвуют в реакции, такие как диметилформамид, диметиламид, диоксан, тетрагидрофуран, диэтиловый эфир, дихлорэтан, хлороформ, четыреххлористый углерод, диметоксиметан, диметоксиэтан, этилацетат, бензол, ацетонитрил, диметилсульфоксид и тому подобные, а также их смеси, причем органические растворители необязательно выбирают в зависимости от применяемого способа. В зависимости от типа реакции ацилирования возникает необходимость проведения реакции и в безводной среде.
Кроме того, в зависимости от применяемого способа иногда желательно проведение реакции в мягких условиях в присутствии основания, такого как N-метилморфопин, триэтиламин, триметиламин, пиридин, гидрид натрия, трет-бутоксид калия, бутиллитий, амид натрия или использовать эти основания в качестве растворителя.
(b) Способ получения соединения мочевины (IVb)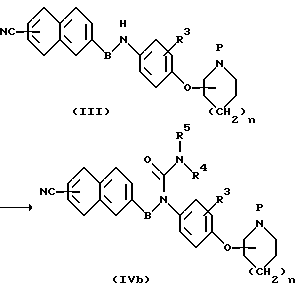
Соединение мочевины (IVb) получают путем взаимодействия амина (III) с изоцианатным производным в соответствующем растворителе в интервале температур от охлаждения до температуры образования флегмы.
По другому варианту производное мочевины (IVb) получают путем взаимодействия амина (III) с фосгеном, дифосгеном или трифосгеном в соответствующем растворителе в интервале температур от охлаждения до температуры образования флегмы с последущим взаимодействием полученного карбамоилхлорида с аминным производным.
К используемым растворителям относятся органические растворители, которые не участвуют в реакции, и их иллюстративные примеры включают диметилформамид, диметиламид, диоксан, тетрагидрофуран, диэтиловый эфир, дихлорэтан, хлороформ, четыреххлористый углерод, диметоксиметан, диметоксиэтан, этилацетат, бензол, ацетонитрил, диметилсульфоксид и тому подобные, а также их смеси, причем органические растворители необязательно выбирают в зависимости от применяемого способа.
В зависимости от применяемого способа иногда желательно проведение реакции в мягких условиях в присутствии основания, такого как триэтиламин, триметиламин, гидрид натрия, трет-бутоксид калия, бутиллитий, амид натрия и тому подобные.
(с) Способ получения тиомочевины (IVc)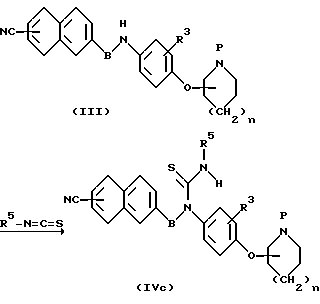
Производное тиомочевины (IVc) получают путем взаимодействия амина (III) с изотиоцианатным производным в соответствущем растворителе в интервале температур от охлаждения до температуры образования флегмы. К используемым растворителям относятся органические растворители, которые не участвуют в реакции, и их иллюстративные примеры включают диметилформамид, диметиламид, диоксан, тетрагидрофуран, диэтиловый эфир, дихлорэтан, хлороформ, четыреххлористый углерод, диметоксиметан, диметоксиэтан, этилацетат, бензол, ацетонитрил, диметилсульфоксид и тому подобные, а также их смеси, причем органические растворители необязательно выбирают в зависимости от применяемого способа.
В зависимости от применяемого способа иногда желательно проведение реакции в мягких условиях в присутствии основания, такого как триэтиламин, триметиламин, гидрид натрия, трет-бутоксид калия, бутиллитий, амид натрия и тому подобные соединения.
(d) Способ получения уретанового производного (IVd)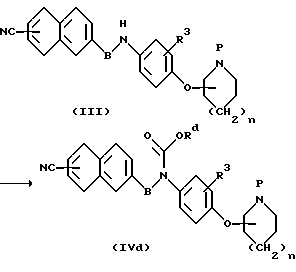
В представленной формуле R4 представляет собой низший алкил, который может иметь заместитель.
Производное уретана (lVd) получают путем взаимодействия амина (III) с возможно замещенным алкилхлорформиатом, возможно замещенным алкилазидоформиатом или алкилкарбонатом, который также может иметь заместитель, в соответствущем растворителе и в интервале температур от охлаждения до температуры образования флегмы.
Используемый растворитель представляет собой органический растворитель, не участвующий в реакции, и его иллюстративные примеры включают диметилформамид, диметиламид, диоксан, тетрагидрофуран, диэтиловый эфир, дихлорэтан, хлороформ, четыреххлористый углерод, диметоксиметан, диметоксиэтан, этилацетат, бензол, ацетонитрил, диметилсульфоксид и тому подобные растворители, а также их смеси, причем эти органические растворители необязательно выбирают в зависимости от применяемого способа.
В зависимости от применяемого способа иногда желательно проведение реакции в мягких условиях в присутствии основания, такого как триэтиламин, триметиламин, гидрид натрия, трет-бутоксид калия, бутиллитий, амид натрия и тому подобные соединения.
Оксалатное соединение получают в тех же реакционных условиях, за исключением того, что в качестве исходного продукта используют производное галогенглиоксиловой кислоты.
(е) Способ получения сульфонамидного производного (IVe)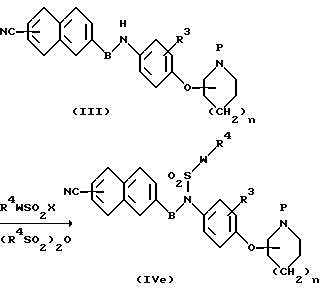
Производное сульфонамида (IVe) получают путем взаимодействия амина (III) с сулфонилгалогенидом и ангидридом сульфокислоты (сульфоновым ангидридом) обычно в присутствии основания, в соответствующем растворителе и в интервале температур от охлаждения до температуры образования флегмы.
Используемый растворитель представляет собой органический растворитель, не участвующий в реакции, и его иллюстративные примеры включают диметилформамид, диметиламид, диоксан, тетрагидрофуран, диэтиловый эфир, дихлорэтан, хлороформ, четыреххлористый углерод, диметоксиметан, диметоксиэтан, этилацетат, бензол, ацетонитрил, диметилсульфоксид и тому подобные растворители, а также их смеси, причем эти органические растворители необязательно выбирают в зависимости от применяемого способа. Иллюстративные примеры основания включают N-метилморфопин, триэтиламин, триметиламин, пиридин, гидрид натрия, трет-бутоксид калия, бутиллитий, амид натрия и тому подобные вещества и в некоторых случаях можно использовать эти основания в качестве растворителя.
(f) Алкилирование
Реакция алкилирования хорошо известна в органической химии. Хотя она и объясняется ниже с ссылкой на иллюстративные примеры, реакции алкилирования, отличные от тех, которые описаны в примерах, также осуществляют в аналогичных условиях.
В представленной формуле Y представляет собой алкилактивирующую группу, такую как галоген, метилсульфонилокси-, трифторметилсульфонилокси-, паратолуолсульфонилоксигруппу и им подобные.
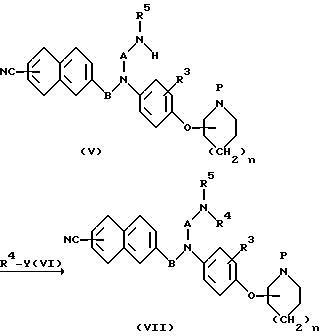
Производное алкиламина общей формулы (VII) получают путем введения производного амина общей формулы (V) в реакцию алкилирования с помощью алкилирующего агента общей формулы (VI). Реакцию алкилирования осуществляют, используя соединение (V) и эквивалентное по реакции или избыточное количество алкилирующего агента (VI), в соответствующем растворителе и в интервале температур от охлаждения до температуры образования флегмы, предпочтительно от комнатной температуры до температуры флегмы. В некоторых случаях выгодно добавлять эквивалентное или избыточное количество основания для достижения гладкой реакции.
В качестве растворителей, не участвующих в этой реакции, необязательно используют спирты (например, этанол и этанол), углеводороды (например, бензол и толуол) или тетрагидрофуран, диоксан, ацетонитрил, диметилформамид, диметилсульфоксид и им подобные соединения, хотя в некоторых случаях возможно осуществление реакции и в отсутствие растворителей.
Примеры оснований, используемых в этой реакции, включают органические основания, такие как триэтиламин, пиридин и им подобные, неорганические соли сильных оснований, такие как карбонат натрия, карбонат калия, гидроокись натрия, гидрид натрия и им подобные основания. Когда основание представляет собой жидкость, его можно использовать также в качестве растворителя.
Кроме того, исходное соединение можно получить необязательной комбинацией алкилирования, окисления, восстановления, гидролиза и других реакций, известных любому специалисту.
Например, при использовании метода алкилирования алкилзамещенное сульфонамидное производное можно получить из производного сульфонамида в присутствии эквивалентного - или избыточного количества спирта (например, метанола и этанола), трифенилфосфина или диэтилазодикарбоксилата в инертном растворителе (например, тетрагидрофуране, бензоле, дихлорметане и др.) при перемешивании при комнатной температуре или при нагревании.
Методику восстановления используют в тех случаях, когда соединение амина получают из нитропроизводного. Иллюстративные примеры включают методику, где используют металл (например, цинк и олово), методику, где используют гидрид металла (например, литийалюминийгидрид LiAlH4), и методику каталитического восстановления, где используют катализатор, такой как палладий на углероде, причем каждый из этих методов осуществляют в инертном растворителе при комнатной температуре или при нагревании.
Соединение, заявленное в настоящем изобретении, получаемое таким способом, выделяют и очищают известными методами, к которым относятся экстракция, осаждение, хроматографическое разделение, фракционированная кристаллизация, перекристаллизация и другие. Кроме того, заявленное соединение можно перевести в желаемые соли путем обычной солеобразующей реакции.
Заявленное соединение может существовать в виде оптических изомеров, когда оно имеет симметричные углеродные атомы. Эти оптические изомеры разделяют стандартным методом фракционированной кристаллизации, по которому изомер перекристаллизовывают вместе с соответствующей солью, или с помощью хроматографии на колонке.
Промышленная применимость
Соединение, заявленное в настоящем изобретении, оказывает сильное антикоагулирующее действие благодаря специфическому ингибированию активированного фактора X свертывающей системы крови. Поэтому оно полезно для применения в качестве ингибитора коагуляции крови или лекарственного средства для предупреждения или лечения заболеваний, вызываемых тромбами или эмболами. Примерами таких заболеваний являются церебрососудистые расстройства, такие как церебральный инфаркт, церебральный тромбоз, церебральная эмболия, приступ транзиторной ишемии, субарахноидальное кровоизлияние и др., ишемические заболевания сердца, такие как острый или хронический инфаркт миокарда, неустойчивая ангина, тромболиз коронарной артерии и др., легочно-сосудистые расстройства, такие как легочный тромбоз, легочная эмболия и др., различные сосудистые заболевания, такие как закупорка периферальной артерии, глубокий венозный тромбоз, синдром диссеминированного внутрисосудистого свертывания крови, образование тромба после операции на искусственных кровеносных сосудах или после замены искусственного сердечного клапана, реокклюзия и рестриктура после операции в обход коронарной артерии, реокклюзия и рестриктура после операции с чрескожной катетерной коронаропластикой и образование тромба при искусственном кровообращении. Кроме того, предлагается возможность применения заявляемого соединения в качестве лекарственного средства для предупреждения или лечения гриппа, основанных на активности этого соединения ингибировать вирус гриппа, что осуществляется путем ингибирования активированного фактора X свертывания крови (нерассмотренная заявка Японии, kokai, N 6- 227971).
Превосходная активность заявленного соединения ингибировать активированный фактор X свертывания крови подтверждается следующими испытаниями.
1) Тест на измерение времени коагуляции посредством человеческого активированного фактора X свертывания крови
Человеческий активированный фактор X свертывания крови, производимый фирмой Космо Био (Cosmo Bio), растворяют в 0,05 М буфере Tris-HCl (pH 7,40) для получения раствора с концентрацией 0,05 ед/мл. Образец крови, отобранный с помощью 1/10 объема 3,8% раствора цитрата натрия, центрифугируют при скорости 3000 об/мин в течение 10 минут. Затем порцию в 90 мкл выделенной человеческой плазмы смешивают с 10 мкл каждого лекарства, разбавленного путем растворения в физиологическом растворе, и 50 мкл раствора вышеупомянутого активированного фактора X свертывания крови и полученную смесь инкубируют при температуре 37oC в течение 3 минут. После этого добавляют 100 мкл 20 мМ раствора CaCl2 и измеряют время свертывания крови, используя для этой цепи КC4A, производимый фирмой Амелунг (Amelung). Дозу, которая в два раза увеличивает время свертывания (в дальнейшем обозначаемую СТ2), рассчитывают на основе того периода времени, который получают при добавлении вместо лекарственного препарата 10 мкл физиологического раствора. Полученные результаты приведены в таблице 1.
2) Тест на измерение времени свертывания крови посредством бычьего тромбина
Человеческий фибриноген, производимый фирмой Сигма (Sigma) методом лиофилизации, растворяют в 0,05 М буфере Tris-HCl (pH 7,40) для получения раствора с концентрацией 6 мг/мл. Бычий тромбин (500 МЕ/ампулу), производимый фирмой Мочида Фармасьютикал (Mochida Pharmaceutical), растворяют в физиологическом растворе для приготовления растворов тромбина различной концентрации. Затем порцию в 100 мкл вышеуказанного человеческого фибриногена смешивают с 100 мкл физиологического раствора и полученную смесь инкубируют при температуре 37oC в течение 3 минут. После этого добавляют 100 мкл раствора тромбина для измерения времени свертывания и определения концентрации тромбина, которая вызывает свертывание крови спустя 20 секунд. Далее порцию в 100 мкл каждого лекарства, полученную при разбавлении физиологическим раствором, добавляют к 100 мкл раствора фибриногена и измеряют время свертывания, используя для этой цепи KC4A, производимый фирмой Амелунг (Amelung). Дозу, которая в два раза увеличивает время коагуляции крови (в дальнейшем обозначаемую СТ2), рассчитывают на основе того периода времени, который получают при добавлении вместо лекарственного препарата 10 мкл физиологического раствора. Полученные результаты приведены в таблице 1.
3) Тест на измерение Ферментного ингибирования методом синтетического субстрата
Человеческий активированный фактор X свертывания крови, производимый фирмой Космо Био (Cosmo Bio), растворяют в 0,02 М буфере Tris-HCl (pH 7,40), содержащем 0,15 М хлористого натрия, и получают раствора с концентрацией 6 ед/мл. Синтетический субстрат S-2222, производимый фирмой Дайичи Кагаку Якухин (Daiichi Kagaku Yakuhin), растворяют в очищенной воде, получая раствор с концентрацией 0,75 мг/мл. Порцию в 25 мкл каждого лекарства, полученную путем растворения лекарства в физиологическом растворе, смешивают с 170 мкл 0,0 М буфера Tris- HCl (pH 8,40) и 50 мкл раствора субстрата S-2222. После этого добавляют 10 мкл раствора человеческого активированного фактора X свертывания крови и полученную смесь инкубируют при температуре 37oC в течение 3 минут. Реакцию останавливают путем добавления 50 мкл 60% уксусной кислоты, измеряют поглощение раствора при 405 нм и вычисляют величину IC50. Для измерения используют спектрофотометр Bio-Rad модель 3550. Реакционную смесь, полученную путем добавления физиологического солевого раствора вместо лекарства и 60% уксусной кислоты перед введением раствора человеческого активированного фактора X свертывания крови, используют в качестве холостой (контрольной) пробы. Концентрацию при 50%-ном торможении реакции (в дальнейшем обозначаемую IC50) определяют по данным холостого опыта.
Результаты показывают, что соединение примера 79 показывает величину IC50, равную 0,091 мкМ, а соединение Примера 88 - 0,047 мкМ.
Результаты испытаний 1), 2) и 3) подтверждают, что соединения, заявленные в настоящем изобретении, специфически ингибируют человеческий активированный фактор X свертывания крови и оказывают превосходное антикоагулирующее действие благодаря увеличению времени свертывания крови при низкой концентрации активного вещества, по сравнению с веществом сравнения, о котором будет сказано ниже.
4) Тест на измерение ex vivo времени коагуляции у мышей (внутривенное введение)
Каждое лекарство, растворенное в физиологическом растворе, вводят путем однократной инъекции в хвостовую вену самца мыши ICR (весом 20-30 г) после воздержания от пищи в течение 12 и более часов, а затем спустя минуту под анестезией (диэтиловый эфир) из аорты отбирают 0,6 мл крови в 1/10 объема 3,8% раствора цитрата натрия и центрифугируют в течение 10 минут при скорости вращения 3000 об/мин до отделения плазмы крови. Используя полученную плазму, в соответствии с описанными ниже методиками а) и b) измеряют время внешнего (РТТ) (частичное тромбопластиновое время) и внутреннего (АРТТ) (частичное активированное тромбопластиновое время) свертывания крови.
а) Время внешнего свертывания крови (РТТ) (частичное тромбопластиновое время)
Тканевой тромбопластин (54 мг/ампулу), полученный фирмой Орто (Ortho) методом лиофилизации, растворяют в 2,5 мл дистиллированной воды и проинкубируют при 3,7oC. Порцию в 50 мкл плазмы крови инкубируют при температуре 37oС в течение 1 минуты, а затем смешивают с 50 мкл раствора тромбопластина и измеряют время свертывания, используя для этой цепи KC4A, производимый фирмой Амелунг (Amelung). В качестве холостого опыта определяют время свертывания для случая, когда вместо лекарства вводят физиологический солевой раствор; активность лекарства выражают в виде относительной величины по отношению к холостому опыту, который принимают за 1.
b) Время внутреннего свертывания крови (АРТТ) (частичное активированное тромбопластиновое время)
Время свертывания крови измеряют путем инкубирования 50 мкл активированных тромбофаксов (фирма Орто) и 50 мкл плазмы крови при температуре 37oС и последующего добавления 50 мкл 20 мМ раствора CaCl2, который преинкубируют при 37oC. Для измерения используют KC4A, производимый фирмой Амелунг (Amelung). В качестве холостого опыта определяют время свертывания для случая, когда вместо лекарства вводят физиологический солевой раствор; активность лекарства выражают в виде относительной величины по отношению к холостому опыту, который принимают за 1. Кроме того, определяют зависимость величины дозы и периодические изменения антикоагулирующего эффекта путем изменения водимой дозы лекарства или времени сбора крови. По результатам проведенных испытаний отмечают превосходное действие препарата по увеличению времени свертывания крови при внутривенном введении заявленного соединения.
5) Тест на измерение ex vivo времени коагуляции у мышей (пероральное введение)
Процедуру описанного выше теста 4) повторяют, за исключением того, что вместо инъекции в хвостовую вену используют форсированное пероральное введение с помощью зонда и кровь собирают спустя 30 минут.
По результатам проведенных испытаний отмечают действие препарата по увеличению времени свертывания крови при пероральном введении заявленного соединения.
Фармацевтическую композицию, содержащую одно, два и более соединений общей формулы I или их фармацевтически приемлемые соли в качестве активного ингредиента, готовят в виде таблеток, порошков, тонкоизмельченных гранул, обычных гранул, капсул, драже, растворов, инъекций, суппозиториев, мазей, адгезивных препаратов и др., используя общеизвестные фармацевтические носители, наполнители и другие добавки, и назначают перорально или парентерально.
Ежедневная клиническая доза соединения для человека определяется индивидуально для каждого пациента в зависимости от симптомов заболевания, веса тела, возраста, пола и других факторов, но обычно находится в интервале от 0,1 до 500 мг для перорального введения или от 0,01 до 100 мг для парентерального, причем эту ежедневную дозу разделяют на один-несколько приемов. Поскольку она меняется при различных состояниях, то и меньшая, по сравнению с указанными выше интервалами, доза в некоторых случаях может быть достаточной.
Твердую композицию для перорального введения применяют в виде таблеток, порошков, гранул и других фармацевтических формах. В такой твердой композиции одно и более активных веществ смешивают по крайней мере с одним инертным разбавителем, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон, метакремниевая кислота или алюминат магния. Как правило, кроме инертных разбавителей композиции могут содержать добавки, такие как смазки (например, стеарат магния), дезинтеграторы (например, кальциевая ацетил-целлюлоза), стабилизаторы (например, лактоза) и солюбилизирующие агенты или вещества, способствующие солюбилизации (например, глутаминовая или аспарагиновая кислота). При необходимости таблетки или драже покрывают желудочно- или энтеросолюбильной оболочкой, такой как сахароза, желатин, гидроксипропилцеллюлоза, фталат гидроксипропилметилцеллюлозы и другие.
Жидкая композиция для перорального введения включает фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры и другие формы и содержат общепринятый инертный разбавитель, такой как очищенная вода или этиловый спирт. В дополнение к инертному разбавителю эта композиция содержит вспомогательные агенты, такие как солюбилизирующий агент или вещество, способствующее солюбилизации, увлажняющий и суспендирующий агенты и другие, а также подсластители, вкусовые добавки, ароматизаторы и антисептики.
Инъекции для парентерального введения включают асептические водные или неводные растворы, эмульсии и суспензии. К разбавителям для применения в водных растворах и суспензиях относятся дистиллированная вода для инъекций и физиологический раствор. К разбавителям для применения в неводных растворах и суспензиях относятся пропиленгликоль, полиэтиленгликоль, растительное масло (например, оливковое масло), спирт (например, этанол), полисорбат 80 (торговая название) и другие вещества. Такая композиция может дополнительно содержать добавки, такие как изотонический агент, антисептик, увлажнитель, эмульгатор, диспергатор, стабилизатор (например, лактозу) и солюбилизирующий агент или вещество, способствующее солюбилизации. В одном случае эти композиции стерилизуют фильтрацией через бактериальный фильтр, смешиванием с бактерицидным препаратом или облучением. В другом случае их можно использовать, получая сначала стерильные твердые композиции, а затем растворяя перед применением в стерильной воде или стерильном растворителе для инъекций. Когда заявленное соединение имеет плохую растворимость, его подвергают специальной обработке. Солюбилизацию осуществляют известными методами, обычно используемыми для фармацевтических препаратов, такими как метод, где в смесь добавляют поверхностно-активные вещества (полиоксиэтилированные отвержденные касторовые масла, полиоксиэтилированные сложные эфиры высших жирных кислот и сорбитана, сополимеры полиоксиэтилена и полиоксипропиленгиколя, сложные эфиры жирных кислот и сахарозы и другие продукты), и метод, где лекарство изготавливают в виде твердой суспензии вместе с солюбилизирующим агентом, таким как полимер (например, водорастворимый высокомолекулярный полимер, такой как гидроксипропилметилцеллюлоза - ГПМЦ, поливинилпирролидон - ПВП, полиэтиленгликоль - ПЭГ, или энтеросолюбильный полимер, такой как карбоксиметилэтилцеллюлоза - КМЭЦ, фталат гидроксипропилметилцеллюлозы - ГПМЦФ и сополимер метакриловой кислоты и метилметакрилата Eudragit L,S (торговое название), производимый фирмой Ром энд Xaac (Rohm & Haas). Кроме того, иногда используют метод, когда лекарство изготавливают в виде растворимой соли, или метод, когда соединение включения получают, используя циклодекстрин или ему подобное соединение. Метод солюбилизации выбирают в зависимости от индивидуального лекарства [см. Saikin по seizaigijyutu to sono oyo (Recent Pharmaceutical Technology and Application), 1. Utsumi et a1., lyaku Journal, 157-159, 1983; Yakugaku Monograph N 1, "Bioavailability", K. Nagai et a1., издательство Soft Science, 78- 82, 1988]. Из вышеописанных методик предпочтительно используют метод, в котором растворимость лекарства улучшают путем образования его твердой дисперсии вместе с солюбилизирующим агентом (нерассмотренная опубликованная японская заявка (kokai) N 56-49314, FR 2460667).
Наилучший выбор осуществления изобретения
В настоящем разделе описан способ получения соединений, заявленных в настоящем изобретении с ссылкой на иллюстративные примеры. Поскольку новые соединения присутствуют и среди исходных продуктов, используемых для получения заявленных целевых соединений, то их синтез описан в соответствующих ссылочных примерах.
Принятые обозначения для характеристик спектров: s - синглет; d - дублет; t - триплет; m - мультиплет; q - квадруплет; brs - широкий синглет; Hz - Гц.
Ссылочный Пример 1
Тетрафторборат серебра (1,168 мг) суспендируют в 6 мл диметисульфоксида, к полученной суспензии прибавляют 1,230 мг 7-бромметил-2-нафталинкарбонитрила и смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь фильтруют, к маточной жидкости добавляют воду и смесь экстрагируют этилацетатом. Экстракт промывают рассолом, сушат над безводным сульфатом натрия и затем испаряют. Полученный остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексана и этилацетата, и получают 543 мг 7-формил-2-нафталинкарбонитрила в виде твердого вещества белого цвета.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 7.78 (1H, dd, J=1.2, 8.5 Hz), 8.01 (1H, d, J=8.5 Hz), 8.02 (1H, dd, J=1.2, 8.5 Hz), 8.13 (1H, dd, J=1.2, 8.5 Hz), 8.40 (2H, s), 10.21 (1H, s).
Ссылочный пример 2
7-формил-2-нафталинкарбонитрил, полученный в ссылочном примере 1 (849 мг), и 1,370 мг 4-[(1-трет-бутоксикарбонил-4- пиперидил)-окси]анилина растворяют в 10 мл дихлорметана и к полученному раствору прибавляют 2,7 мл уксусной кислоты, 1,290 мг триацетоксиборгидрида натрия и смесь перемешивают при комнатной температуре в течение 45 минут. Затем смесь промывают последовательно 2М раствором карбоната калия, водой и 10% водным раствором лимонной кислоты, сушат над безводным сульфатом натрия и затем испаряют. После перекристаллизации полученного остатка из метанола получают 1,698 мг 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]-метил]-2-нафталинкарбонитрила.
Данные масс-спектра (m/z): 457 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.46 (9H, s), 1.63-1.74 (2H, m), 1.80-1.92 (2H, m), 3.21-3.30 (2H, m), 3.65-3.77 (2H, m), 4.00 (1H, bs), 4.21-4.28 (1H, m), 4.49 (1H, s), 6.59 (2H, d, J=8.8Hz), 6.79 (2H, d, J=8.8Hz), 7.59 (1H, d, J-8.3Hz), 7.66 (1H, d, J=8.8Hz), 7.84-7.92 (3H, m), 8.19 (1H, s).
Ссылочный Пример 3
7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино] -метил]-2-нафталинкарбонитрил, полученный в ссылочном примере 2 (150 мг), растворяют в 1 мл пиридина, к раствору прибавляют 268 мг уксусного ангидрида и 10 мг 4-диметиламинопиридина и полученную смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси прибавляют этилацетат и смесь промывают последовательно 10% водным раствором лимонной кислоты и насыщенным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и затем испаряют. После перекристаллизации полученного остатка из этанола получают 139 мг N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)-окси]фенил]-N-[(7-циано-2-нафтил)метил]ацетамида.
Данные масс-спектра (m/z): 500 (M+l)+.
Данные ЯМР спектра (CDCl3 внутренний стандарт - ТМC):
δ: 1.46 (9H, s), 1.67-1.77 (2H, m), 1.85-1.97 (5H, п), 3.27-3.36 (2H, m), 3.63-3.76 (2H, m,) 4.37-4.45 (1H, m), 5.02 (2H, s), 6.81 (2H, d, =8.8 Hz), 6,88 (2H, d, J=8.8 Hz), 7.56-7.65 (3H, m), 7.83 (1H, d, J=8.3 Hz), 7.89 (1H, d, J=8.3 Hz), 8.13 (1H, s).
Ссылочный пример 4
7-[[4-[(трет-бутоксикарбонил-4-пиперидил)окси] анилино] -метил]-2-нафталинкарбонитрил, полученный в ссылочном Примере 2 (200 мг), растворяют в 2 мл дихлорметана, к раствору прибавляют 299 мг этилхлорглиоксилата и 266 мг триэтиламина и полученную смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси прибавляют этилацетат и смесь промывают последовательно 10% водным раствором лимонной кислоты и насыщенным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и затем испаряют. Полученный остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексана и этилацетата (8:2), и получают 241 мг N-[4-[(1-трет- 6утоксикарбонил-4-пиперидил)-окси] фенил]-N-[(7-циано-2- нафтил)метил]-оксамата.
Данные масс-спектра (m/z): 557 (М)+.
Данные ЯМР спектра (CDCl3 внутренний стандарт - ТМC):
δ: 1.01 (3H, t, J=7.1 Hz), 1.46 (9H, s), 1.63-1.75 (2H, m), 1.82-1.94 (2H, m), 3.25-3.36 (2H, m), 4.04 (2H, q, J=7.1 Hz), 4.35-4.45 (1H, m), 5.07 (2H, s), 6.78 (2H, d, J=8.8Hz), 6.97 (2H, d, J=8.8 Hz), 7.58-7.63 (2H, m), 7.68 (1H, s), 7.86 (1H, d, J=8.3Hz), 7.90 (1H, d, J=8.8 Hz), 8.15 (1H, s).
Следующие соединения ссылочных примеров 5-13 получают по методике, описанной в ссылочном Примере 4.
Ссылочный пример 5
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)-окси] фенил]- N-[(7-циано-2-нафтил)метил]циклопропанкарбоксамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино]-метил] - 2-нафталинкарбонитрил, циклопропанкарбонилхлорид.
Данные масс-спектра (m/z): 526 (М+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 0.59-0.78 (2H, m), 0.94-1.13 (2H, m), 1.24-1.31 (1H, m), 1.46 (9H, s), 1.52-1.62 (2H, m), 1.65-1.92 (2H, m), 3.12-3.47 (2H, m), 3.54-3.74 (2H, m), 4.31-4.56 (1H, m), 5.04 (2H, s), 6.90-7.05 (4H, m), 7.51-7.98 (5H, m), 8.14 (1H, s).
Ссылочный пример 6
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)-окси] фенил] -N-[(7-циано-2-нафтил)метил]бензамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]-метил]-2-нафталинкарбонитрил, бензоилхлорид.
Данные масс-спектра (m/z): 562 (M+l)+. Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.45 (9H, s), 1.54-1.84 (4H, m), 3.21-3.82 (4H, m), 4.22- 4.41 (1H, m), 5.27 (2H, s), 6.53-6.94 (4H, m), 7.12-8.00 (10H, m), 8.18 (1H, s).
Ссылочный пример 7
N-[4-[(1- трет -бутоксикарбонил-4-пиперидил)-окси]фенил]-N- [(7-циано-2-нафтил)метил]этанкарбоксамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил) окси] анилино]метил] -2- нафталинкарбонитрил, пропаноилхлорид.
Данные масс-спектра (m/z): 514 (М+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.05 (3H, t, J=7.0 Hz), 1.46 (9H, s), 1.54-2.02 (6H, m), 3.01-3.38 (2H, m), 3.50-3.74 (2H, m), 4.34-4.51 (1H, m), 5.01 (2H, s), 6.91-7.12 (4H, m), 7.45-7.88 (5H, m), 8.14 (1H, s).
Ссылочный пример 8
N-[4-[(1-трет-бутоксикарбонил-4 -пиперидил)- окси]фенил]-N- [(7-циано-2-нафтил) метил] циклогексанкарбоксамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил, циклогексанкарбонилхлорид.
Данные масс-спектра (m/z): 568 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 0.89-1.31 (5H, m), 1.46 (9H, s), 1.54-1.98 (10H, m), 3.17-3.48 (2H, m), 3.54-3.82 (2H, m), 4.34-4.51 (1H, m), 4.99 (2H, s), 6.82-7.07 (4H, m), 7.68-7.91 (5H, m), 8.12 (1H, s).
Ссылочный пример 9
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)-окси] фенил]- N-[(7-циано-2-нафтил)метил]-1-нафталинкарбоксамид.
Исходные соединения: 7-[[4-[(1-трет- бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2- нафталинкарбонитрил, 1-нафталинкарбонилхлорид.
Данные масс-спектра (m/z): 612 (М+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.43 (9H, s), 1.54-1.79 (4H, m), 3.04-3.39 (2H, m), 3.42-3.70 (2H, m), 4.04-4.31 (1H, m), 5.34 (2H, s), 6.35-6.82 (4H, m), 7.15-8.13 (12H, m), 8.18 (1H, s).
Ссылочный пример 10
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N- [(7-циано-2-нафтил)метил]-2-фторбензамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил- 4-пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил, 2- фторбензоилхлорид.
Данные масс-спектра (m/z): 580 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.44 (9H, s), 1.57-1.94 (4H, m), 3.08-3.40 (2H, m), 3.49-3.80 (2H, m), 4.18- 4.40 (1H, m), 5.28 (2H, s), 6.55-6.74 (2H, m), 6.80-7.48 (7H, m), 7.68-7.98 (4H, m), 8.14 (1H, s).
Ссылочный пример 11
N-[4-[(1- трет- бутоксикарбонил-4-пиперидил)окси]фенил] -N-[(7-циано-2-нафтил)метил]-3-метоксибензамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2- нафталинкарбонитрил, 3-метоксибензоилхлорид.
Данные масс-спектра (m/z): 592 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.45 (9H, s), 1.59-1.90 (4H, m), 3.07-3.45 (4H, m), 3.65 (3H, s), 4.21-4.48 (1H, m), 5.25 (2H, s), 6.58-7.10 (8H, m), 7.54- 7.67 (1H, m), 7.69-7.95 (4H, m), 8.14 (1H, s).
Ссылочный пример 12
N-[4-[(1-трет-бутоксикарбонил-4- пипеpидил)-oкcи]фенил]-N-[(7-циано-2-нафтил)метил]-2- тиофенамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил, тиеноилхлорид.
Данные масс-спектра (m/z): 567 (М)+. Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.45 (9H, s), 1.64-1.97 (4H, m), 3.14-3.48 (2H, m), 3.52-3.77 (2H, m), 4.35-4.60 (1H, m), 5.22 (2H, s), 6.74-7.18 (5H, m), 7.28-7.38 (1H, m), 7.52-7.69 (2H, m), 7.70-7.95 (4H, m), 8.12 (1H, s).
Ссылочный пример 13
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)-окси] фенил]- N-[(7-циано-2-нафтил)метил]-3-пиридинкарбоксамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси] анилино]метил]-2-нафталинкарбонитрил, никотиноилхлоридгидрохлорид.
Данные масс-спектра (m/z): 563 (М+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.47 (9H, s), 1.65-1.94 (4H, m), 3.10-3.42 (2H, m), 3.51-3.87 (2H, m), 4.21-4.42 (1H, m), 5.32 (2H, s), 6.72-6.98 (2H, m), 7.62-7.79 (9H, m), 8.17 (1H, s), 8.41- 8.67 (2H, m).
Ссылочный пример 14
7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино] -метил]-2-нафталинкарбонитрил, полученный в ссылочном примере 2 (150 мг), растворяют в 2 мл дихлорметана, к раствору прибавляют 35 мг этилизоцианата и полученную смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси прибавляют 117 мг этилизоцианата и смесь перемешивают при комнатной температуре в течение еще 6 часов и полученный раствор испаряют. Остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексана и этилацетата (65:35), и получают 154 мг 1-[4-[(1-трет- бутоксикарбонил-4-пиперидил)окси]фенил]-1-[(7-циано-2- нафтил)метил]-3-этилмочевины.
Данные масс-спектра (m/z): 528 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.06 (3H, t, J=7.3 Hz), 1.46 (9H, s), 1.65-1.78 (2H, m), 1.82-1.95 (2H, m), 3.20-3.37 (4H, m), 3.62-3.75 (2H, m), 4.24 (1H, t, J=5.5 Hz), 4.36-4.44 (1H, m), 4.99 (2H, s), 6.83 (2H, d, J=7.0 Hz), 6.96 (2H, d, J=7.3 Hz), 7.57 (1H, d, J=8.5 Hz), 7.62-7.68 (2H, m), 7.83 (1H, d, J=8.5 Hz), 7.87 (1H, d, J=8.5 Hz), 8.13 (1H, s).
Следующее соединение ссылочного примера 15 получают по методике, описанной в ссылочном примере 14.
Cсылочный пример 15
Этил-3- [4- [(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-3-[(7-циано-2-нафтил)метил]уреидо-1-ацетат.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил, этилизоцианатоацетат.
Данные масс-спектра (m/z): 586 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.27 (3H, t, J=7.3 Hz), 1.46 (9H, s), 1.65-1.80 (2H, m), 1.80-1.96 (2H, m), 3.25-3.38 (2H, m), 3.60-3.75 (2H, m), 4.00 (2H, d, J=5.9 Hz), 4.19 (2H, q, J=7.3 Hz), 4.35-4.45 (1H, m), 4.80 (1H, t, J=5.6 Hz), 5.01 (2H, s), 6.84 (2H, d, J=9.2 Hz), 7.05 (2H, d, J=8.8 Hz), 7.57 (1H, d, J=8.3 Hz), 7.64 (1H, d, J=8.3 Hz), 7.68 (1H, s), 7.83 (1H, d, J=8.3 Hz), 7.88 (1H, d, J=8.3 Hz), 8.15 (1H, s).
Ссылочный пример 16
7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]анилино] -метил]-2-нафталинкарбонитрил, полученный в ссылочном примере 2 (150 мг), растворяют в 2 мл диметилформамида, к раствору прибавляют 178 мг этилхлорформиата и 271 мг карбоната калия, полученную смесь перемешивают при комнатной температуре в течение 3,5 часов. Реакционную смесь испаряют и полученный остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь ацетата и гексана (2:8), и получают 169 мг этил-N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-N-[(7-циано-2-нафтил)метил]карбамата.
Данные масс-спектра (m/z): 529 (M)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.15-1.3 (3H, br), 1.46 (9H, s), 1.65-1.80 (2H, m), 1.80- 1.95 (2H, m), 3.25-3.37 (2H, m), 3.60-3.75 (2H, m), 4.20 (2H, q, J=6.8 Hz), 4.35-4.45 (1H, m), 4.98 (2H, s), 6.79 (2H, d, J=8.8 Hz), 6.90-7.10 (2H, br), 7.58 (2H, d, J=9.5 Hz), 7.68 (1H, s), 7.84 (1H, d, J=8.3 Hz), 7.89 (1H, d, J=8.8 Hz), 8.15 (1H, s).
Ссылочный Пример 17
7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино] -метил] -2-нафталинкарбонитрил, полученный в ссылочном примере 2 (150 мг), растворяют в 4 мл ацетонитрила, к раствору прибавляют 710 мг этилтиоизоцианата и полученную смесь нагревают при температуре образования флегмы в течение 4 суток. Реакционную смесь испаряют и полученный остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексан:этилацетат (7: 3), и получают 171 мг 1-[4-[(1-трет-бутоксикарбонил-4-пиперидил)-окси] фенил]-N-[(7-циано-2-нафтил)метил]-3-этилтиомочевины.
Данные масс-спектра (m/z): 545 (M+l)+.
Данные ЯМР спектра (CDCl3 внутренний стандарт - ТМC):
δ: 1.11 (3H, t, J=7.I Hz), 1.46 (9H, s), 1.66-1.76 (2H, m), 1.83-1.94 (2H, m), 3.25-3.35 (2H, m), 3.60-3.75 (4H, m), 4.36- 4.44 (1H, m), 5.39 (1H, t, J=5.1 Hz), 5.65 (2H, s), 6.84 (2H, d, J=8.3 Hz), 6.90 (2H, d, J=8.3 Hz), 7.57 (2H, d, J=8.3 Hz), 7.69 (1H, s), 7.77-7.84 (2H, m), 7.88 (1H, d, J=8.3 Hz), 8.14 (1H, s).
Ссылочный Пример 18
7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино] -метил] -2-нафталинкарбонитрил, полученный в ссылочном примере 2 (150 мг), растворяют в 1 мл пиридина, к раствору прибавляют 211 мг этансульфонилхлорида и полученную смесь перемешивают при 0oC в течение 20 минут, а затем при комнатной температуре в течение 3 часов. После этого к реакционной смеси прибавляют этилацетат и смесь промывают последовательно 10% водным раствором лимонной кислоты и рассолом, сушат над безводным сульфатом натрия и затем испаряют. Остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексана и этилацетата (75:25), и получают 176 мг N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -фенил] -N- [(7-циано-2-нафтил)метил]этансульфонамида.
Данные масс-спектра (m/z): 550 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.43-1.50 (12H, m), 1.63-1.73 (2H, m), 1.80-1.91 (2H, m), 3.12 (2H, q, J=7.3 Hz), 3.25-3.36 (2H, m), 3.60-3.70 (2H, m), 4.33-4.41 (1H, m), 5.00 (2H, s), 6.78 (2H, d, J=6.8 Hz), 7.15 (2H, d, J=6.8 Hz), 7.58 (1H, d, J=8.5 Hz), 7.64 (1H, s), 7.69 (1H, d, J=8.5 Hz), 7.84 (1H, d, J=8.3 Hz), 7.88 (1H, d, J=8.3 Hz), 8.13 (1H, s).
Следующие соединения ссылочных примеров 19-27 получают по методике, описанной в ссылочном примере 4.
Ссылочный пример 19
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7-циано-2-нафтил)метил]-2-метоксибензамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил, 2-метокси-бензоилхлорид.
Данные масс-спектра (m/z): 592 (М+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.44 (9H, s), 1.54-1.93 (4H, m), 3.02-3.58 (4H, m), 3.69 (3H, s), 4.14-4.39 (1H, m), 5.25 (2H, s), 6.44-7.36 (8H, m), 7.46-7.73 (1H, m), 7.75-8.00 (4H, m), 8.13 (1H, s).
Ссылочный Пример 20
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7- циано-2-нафтил)метил]-4-метоксибензамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси] анилино]метил]-2-нафталинкарбонитрил, 4-метокси-бензоилхлорид.
Данные масс-спектра (m/z): 592 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.50 (9H, s.), 1.67-1.95 (4H, m), 3.11-3.67 (4H, m), 3.76 (3H, s), 4.28-4.50 (1H, m), 5.32 (2H, s), 6.60-7.01 (8H, m), 7.77- 7.90 (5H, m), 8.14 (1H, s).
Ссылочный Пример 21
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -фенил] -N-[(7-циано-2-нафтил)метил]-4-пиридинкарбоксамид.
Исходные соединения: 7-[[4-[(1-трет- бутоксикарбонил-4-пиперидил)окси] анилино] метил]-2- нафталинкарбонитрил, никотиноилхлоридгидрохлорид.
Данные масс-спектра (m/z): 563 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.48 (9H, s), 1.58-2.02 (4H, m), 3.07-3.82 (4H, m), 4.17- 4.51 (1H, m), 5.29 (2H, s), 6.62-7.05 (4H, m), 7.12-7.41 (2H, m), 7.49-8.08 (6H, m), 8.17 (1H, s), 8.42-8.61 (2H, m).
Ссылочный Пример 22
N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]-фенил]-N-[(7-циано-2-нафтил)метил]-2- пиридинкарбоксамид.
Исходные соединения: 7-[[4-[(1-трет- бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2- нафталинкарбонитрил, пиколиноилхлоридгидрохлорид.
Данные масс-спектра (m/z): 563 (М+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.45 (9H, s), 1.61-1.94 (4H, m), 3.08-3.82 (4H, m), 4.21-4.47 (1H, m), 5.30 (2H, s), 6.54-7.03 (4H, m), 7.05-7.31 (2H, m), 7.43-7.72 (2H, m), 7.76-8.03 (4H, m), 8.15 (1H, s), 8.32-8.49 (2H, m).
Ссылочный пример 23
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -фенил] -N-[(7-циано-2-нафтил)метил]-2-метоксиацетамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси] анилино]метил]-2-нафталинкарбонитрил, метоксиацетилхлорид.
Данные масс-спектра (m/z): 530 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1,47 (9H, s), 1.64-2.07 (4H, m), 3.38 (3H, s), 3.45- 3.77 (4H, m), 3.82 (2H, s), 4.31-4.58 (1H, m), 5-03 (2H, s), 6.79-6.98 (4H, m), 7.49-7.61 (1H, m), 7.77-8.00 (4H, m), 8.12 (1H, s).
Ссылочный пример 24
Этил-N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7-циано-2-нафтил)метил]малонамат.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил, этилмалоилхлорид.
Данные масс-спектра (m/z): 572 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.28 (3H, t, J=8.1 Hz), 1.46 (9H, s), 1.62-1.97 (4H, m), 3.28 (2H, s), 3.36-3.84 (4H, m), 4.14 (2H, q, J=9.0 Hz), 4.32- 4.56 (1H, s), 5.06 (2H, s), 6.67-7.06 (4H, m), 7.52-8.03 (5H, m), 8.15 (1H, s).
Ссылочный пример 25
Этил-N-[4-[(1- трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]сукцинамат.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси] анилино]метил]-2-нафталинкарбонитрил, этилсукцинилхлорид.
Данные масс-спектра (m/z): 586 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.26 (3H, t, J=8.7 Hz), 1.46 (9H, s), 1.64-1.97 (4H, m), 2.27-2.73 (4H, m), 3.15-3.88 (4H, m), 4.13 (2H, q, J=9.0 Hz), 4.32-4.54 (1H, m), 5.04 (2H, s), 6.72-7.07 (4H, m), 7.47-8.03 (5H, m), 8.17 (1H, s).
Ссылочный пример 26
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -фенил] -N-[(7-циано-2-нафтил)метил]-2,6-дифторбензамид.
Исходные соединения: 7-[[4-[(1-трет- бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2- нафталинкарбонитрил, 2,6-дифторбензоилхлорид.
Данные масс-спектра (m/z): 598 (M+l)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.44 (9H, s), 1.54-1.83 (4H, m), 3.05-3.80 (4H, m), 4.16-4.43 (1H, m), 5.23 (2H, s), 6.48-7.22 (7H, m), 7.46-8.01 (5H, m), 8.13 (1H, s).
Ссылочный пример 27
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N- [(7-циано-2-нафтил)метил]-2-бромацетамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино] метил]-2-нафталинкарбонитрил, бромацетил- бромид.
Данные масс-спектра (m/z): 578 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.46 (9H, s), 1.64-2.00 (4H, m), 3.14-3.66 (4H, m), 3.73 (2H, s), 4.30-4.56 (1H, m), 5.04 (2H, s), 6.75-7.12 (4H, m), 7.46- 7.79 (5H, m), 8.12 (1H, s).
Ссылочный Пример 28
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил] -2-бромацетамид (237 мг), полученный в ссылочном Примере 27, растворяют в 1 мл метанола, к раствору прибавляют 10 мл 40% водного раствора диметиламина и полученную смесь перемешивают при 60oC в течение 12 часов. Реакционную смесь испаряют и к полученному остатку прибавляют хлороформ. Далее смесь промывают последовательно водой и рассолом, сушат над безводным сульфатом натрия и затем снова испаряют, получая 247 мг N-[4-[(1-трет-бутоксикарбонил-4- пиперидил) -окси]фенил]-N-[(7-циано-2-нафтил)метил]-2-диметиламиноацетамида.
Данные масс-спектра (m/z): 543 (M+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.46 (9H, s), 1.62-2.10 (4H, m), 2.28 (6H, s), 3.07-3.89 (4H, m), 4.30-4.55 (1H, m), 5.02 (2H, s), 6.75-6.98 (4H, m), 7.39-7.97 (5H, m), 8.27 (1H, s).
Ссылочный Пример 29
Соединение ссылочного Примера 29 получают по методике, описанной в ссылочном примере 14.
Этил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7-циано-2-нафтил)метил]карбамоил]карбонат.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил, этоксикарбонилизоцианат.
Данные масс-спектра (m/z): 573 (М+1)+
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМC):
δ: 1.26 (3H, t, J=7.1 Hz), 1.47 (9H, s), 1,53-1.97 (4H, m), 3.17-3.88 (4H, m), 4.18 (2H, q, J=7.1 Hz), 4.33-4.56 (1H, m), 4.99 (2H, s), 6.81-7.08 (4H, m), 7.46- 8.06 (5H, m), 8.13 (1H, s).
Следующие соединения ссылочных примеров 30-44 получают по той же методике, которая описана в ссылочном примере 18.
Ссылочный Пример 30
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N- [(7-циано-2-нафтил)метил]бензолсульфонамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино]метил]- 2-нафталинкарбонитрил, бензолсульфонилхлорид.
Данные масс-спектра (m/z): 597 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.45 (9Н, s), 1.60-1.70 (2Н, m), 1.80-1.90 (2Н, m), 3.23-3.33 (2H, m), 3.60-3.70 (2Н, m), 4.30-4.38 (1Н, m), 4.86 (2Н, s), 6.69 (2Н, d, J= 8.8Hz), 6.86 (2Н, d, J=8.8Hz), 7.48-7.73 (8H, m), 7.82 (1H, d, J=7.8Hz), 7.86 (1H, d, J=8.3Hz), 8.09 (1H, s).
Ссылочный Пример 31
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -фенил] -N-[(7-циано-2- нафтил)метил]метансульфонамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино]метил] -2-нафталинкарбонитрил, метансульфонилхлорид.
Данные масс-спектра (m/z): 536 (М+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.45 (9Н, s), 1.63-1.73 (2Н, m), 1.80-1.90 (2Н, m), 2.99 (3H, s), 3.25-3.35 (2Н, m), 3.60-3.70 (2Н, m), 4.34-4.40 (1H, m), 4.97 (2Н, s), 6.80 (2Н, d, J= 8.8Hz), 7.17 (2Н, d, J=8.8Hz), 7.59 (1H, dd, J=8.8, 1.5Hz), 7.63-7.72 (2Н, m), 7.85 (1H, d, J=8.3Hz), 7.88 (1H, d, J=8.8Hz), 8.13 (1H, s).
Ссылочный Пример 32
N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]-фенил]-N-[(7-циано-2-нафтил)метил]бензилсульфонамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил, бензилсульфонилхлорид.
Данные масс-спектра (m/z): 611 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.46 (9H, s), 1.63-1.74 (2Н, m), 1.81-1.93 (2Н, m), 3.25-3.36 (2Н, m), 3.61-3.72 (2Н, m), 4.33-4.41 (3Н, m), 4.64 (2Н, s), 6.77 (2Н, d, J= 8.8Hz), 7.08 (2H,d, J=8.8Hz), 7.41-7.59 (8H, m), 7.77 (1H, d, J=8.8Hz), 7.84 (1H, d, J=8.2Hz), 8.06 (1H, s).
Ссылочный Пример 33
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]пропансульфонамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2- нафталинкарбонитрил, пропан-сульфонилхлорид.
Данные масс-спектра (m/z): 563 (M)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.08 (3Н, t, J=7.3Hz), 1.45 (9H, s), 1.63-1.73 (2Н, m), 1.80-2.00 (4H, m), 3.02-3.09 (2Н, m), 3.24-3.34 (2Н, m), 3.59- 3.69 (2Н, m), 4.33-4.41 (1H, m), 4.98 (2Н, s), 6.79 (2Н, d, J=9.3Hz), 7.15 (2Н, d, J=9.3Hz), 7.58 (1H, dd, J=8.3, 1.5Hz), 7.64 (1H, s), 7.69 (1H, dd, J=8.8, 1.5Hz), 7.84 (1H, d, J=8.3Hz), 7.87 (1H, d, J=8.3Hz), 8.12 (1H, s).
Ссылочный Пример 34
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7-циано-2-нафтил) метил]бутансульфонамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]-метил]-2-нафталинкарбонитрил, 1-бутансульфонилхлорид.
Данные масс-спектра (m/z): 517 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 0.95 (3Н, t, J=7.1Hz), 1.24-1.36 (2H,m), 1.45 (9Н, s), 1.63-1.94 (6Н, m), 2.94-3.85 (6H, m), 4.27-4.53 (1H, m), 5.02 (2Н, s), 6.71-7.37 (4H, m), 7.42-7.96 (5Н, m), 8.07 (1H, s).
Ссылочный Пример 35
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7-циано-2- нафтил)метил]трифторметансульфонамид.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперозил)окси] анилино]метил]-2-нафталинкарбонитрил, трифторметансульфоновый ангидрид.
Данные масс-спектра (m/z): 590 (М+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.45 (9Н, s), 1.56-1.92 (4H, m), 3.11-3.82 (4H, m), 4.22-4.51 (1H, m), 5.02 (2Н, s), 6.65-7.18 (4H, m), 7.46-7.97 (5Н, m), 8.11 (1H, s).
Ссылочный Пример 36
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N- [(7-циано-2-нафтил)метил]изопропансульфонамид.
Исходные соединения: 7-[[4-[(1- трет-бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2- нафталинкарбонитрил, изопропилсульфонилхлорид.
Данные масс-спектра (m/z): 563 (M+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.45 (9Н, s), 1.46 (6Н, d, J=6.8Hz), 1.59-1.93 (4H, m), 2.97-3.84 (5Н, m), 4.20-4.52 (1H, m), 5.03 (2Н, s), 6.64-7.26 (4H, m), 7.44-7.96 (5Н, m), 8.08 (1H, s).
Ссылочный Пример 37
Этил-N-[N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]-фенил]-N-[(7-циано-2- нафтил)метил]сульфамоил]карбамат.
Исходные соединения: 7-[[4-[(1- трет-бутоксикарбонил-4-пиперидил)окси] анилино] метил] -2- нафталинкарбонитрил, этил-(хлорсульфонил)карбамат. Этил(хлорсульфонил)карбамат получают также, как трет-бутил(хлорсульфонил)карбамат, описанный в Tetrahedron, 49(1), 65 (1993).
Данные масс-спектра (m/z): 608 (M)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.37 (3Н, t, J=7.1Hz), 1.45 (9Н, s), 1.62-1.74 (2H, m), 1.80-1.92 (2Н, m), 3.25-3.34 (2Н, m), 3.60-3.71 (2H, m), 4.29-4.42 (3Н, m), 5.21 (2Н, s), 6.80 (2H, d, J=8.8Hz), 7.08-7.20 (3Н, m), 7.58 (1H, dd, J=8.3, 1.5Hz), 7.62-7.69 (2Н, m), 7.84 (1H, d, J=8.8Hz), 7.88 (1H, d, J=8.3Hz), 8.13 (1H, s).
Ссылочный Пример 38
N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]-4- нитробензолсульфонамид.
Исходные соединения: 7-[[4-[(1-трет- бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил, 4-нитро-бензолсульфонилхлорид.
Данные масс-спектра (m/z): 642 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.45 (9Н, s), 1.62-1.94 (4Н, m), 3.07-3.83 (4Н, m), 4.21-4.48 (1Н, m), 4.90 (2Н, s), 6.61-6.92 (4Н, m), 7.50-8.04 (7Н, m), 8.10 (1Н, s), 8.31 (1H, s), 8.41 (1H, s).
Ссылочный Пример 39
4-[N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]бензойная кислота.
Исходные соединения: 7- [[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2- нафталинкарбонитрил, 4-(хлорсульфонил)бензойная кислота.
Данные масс-спектра (m/z): 641 (М)+
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.32-1.47 (11Н, m), 7.5-8.6 (2H, m), 3.0-3.15 (2H, m), 3.55-3.66 (2Н, m), 4.37-4.47 (1H, m), 4.97 (2Н, s), 6.80 (2Н, d, J=8.8Hz), 6.96 (2Н, d, J= 9.3Hz), 7.67 (1H, d, J=8.8Hz), 7.74 (1H, dd, J=1.5, 8.3Hz), 7.81 (2Н, d, J= 8.3Hz), 7.89 (1H, s), 8.00 (1H, d, J=8.3Hz), 8.07 (1H, d, J=8.8Hz), 8.15 (2Н, d, J=8.3Hz), 8.52 (1H, s), 13.52 (1H, bs).
Ссылочный Пример 40
3-N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N- [(7-циано-2-нафтил)метил]сульфамоил]бензойная кислота.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино]-метил]-2- нафталинкарбонитрил, 3-(хлорсульфонил)бензойная кислота.
Данные масс-спектра (m/z): 640 (M-1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.32-1.46 (11Н, m), 1.72-1.85 (2Н, m), 3.02-3.15 (2Н, m), 3.52-3.66 (2Н, m), 4.37-4.47 (1Н, m), 4.96 (2Н, s), 6.81 (2Н, d, J=8.8Hz), 6.97 (2Н, d, J=8.8Hz), 7.66 (1Н, d, J=8.3Hz), 7.70-7.83 (2Н, m), 7.90 (1H, s), 7.92-8.09 (4H, m), 8.27 (1H, d, J=7.8Hz), 8.51 (1H, s), 13.51 (1H, s).
Ссылочный Пример 41
Mетил-2-N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]-фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]бензоат.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино]метил]-2- нафталинкарбонитрил, метил-2-(хлорсульфонил)бензоат.
Данные масс-спектра (m/z): 655 (М)+.
Данные ЯМР спектра (CDCl3 внутренний стандарт - ТМС):
δ: 1.55 (9H, s), 1.59-1.70 (2Н, m), 1.80-1.89 (2Н, m), 3.21-3.31 (2Н, m), 3.30-3.40 (2Н, m), 3.96 (3H, s), 4.30-4.38 (1H, m), 5.02 (2Н, s), 6.68 (2Н, d, J=9.2Hz), 6.95 (2Н, d, J=9.2Hz), 7.40-7.50 (2Н, m), 7.52-7.62 (3H, m), 7.65 (1H, s), 7.70 (1H, d, J=8.5Hz), 7.83 (1H, d, J=8.6Hz), 7.87 (1H, d, J=8.6Hz), 8.11 (1H, s).
Ссылочный Пример 42
Трет-бутил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -фенил]-N- [(7-циано-2-нафтил)метил]сульфамоил]карбамат.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино] метил] -2- нафталинкарбонитрил, трет-бутил(хлорсульфонил)карбамат. Методика синтеза трет-бутил-(хлорсульфонил)карбамата описана в Tetrahedron, 49(1), 65 (1993).
Данные масс-спектра (m/z): 636 (M)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.45 (9H, s), 1.57 (9Н, s), 1.63-1.73 (2Н, m), 1.80-1.91 (2Н, m), 3.25-3.35 (2Н, m), 3.60-3.70 (2Н, m), 4.33-4.43 (1H, m), 5.21 (2Н, s), 6.80 (2H, d, J=9.3Hz), 7.00 (1H, bs), 7.18 (2Н, d, J=8.8Hz), 7.58 (1H, dd, J=1.7, 8.5Hz), 7.62-7.70 (2Н, m), 7.84 (1H, d, J=6.6Hz), 7.87 (1H, d, J=8.3Hz), 8.13 (1H, s).
Ссылочный Пример 43
Этил-N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7-циано -2-нафтил)метил]сульфамоил]ацетат.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино] метил] -2-нафталинкарбонитрил, этил-(хлорсульфонил)ацетат. Методика синтеза этил(хлорсульфонил)ацетата описана в Synthetic Letters, 321, 1975.
Данные масс-спектра (m/z): 608 (M+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.34-1.55 (12Н, m), 1.57-1.95 (4H, m), 3.12-3.74 (4H, m), 4.03 (2Н, s), 4.17-4.52 (5Н, m), 5.03 (2Н, s), 6.66-6.91 (4H, m), 7.27-7.96 (5Н, m), 8.11 (1H, s).
Ссылочный Пример 44
Этил-3-N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -фенил] - N-[(7-циано-2-нафтил)метил]сульфамоил]пропионат.
Исходные соединения: 7-[[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] анилино] метил] - 2-нафталинкарбонитрил, этил-3-(хлорсульфонил)пропионат, получаемый по методике, аналогичной для этил(хлорсульфонил)ацетата.
Данные масс-спектра (m/z): 622 (M+1)+.
Данные ЯМР спектра (CDCl3 внутренний стандарт - ТМС):
δ: 1.28 (3Н, t, J=7.3Hz), 1.45 (9Н, s), 1.56-1.94 (4Н, m), 2.71- 3.08 (2Н, m), 3.00-3.82 (6Н, m), 4.19 (2Н, q, J=7.1Hz), 4.35-4.53 (1Н, m.), 4.96 (2Н, s), 6.71-7.24 (4H, m), 7.48-7.94 (5Н, m), 8.12 (1Н, s).
Ссылочный Пример 45
Трет-бутил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -фенил]-N- [(7-циано-2-нафтил)метил]сульфамоил]карбамат, полученный в ссылочном Примере 42 (172 мг), растворяют в 0,7 мл тетрагидрофурана, к раствору при 0oC прибавляют 139 мг трифенилфосфина, 32 мкл метанола и 83 мкл диэтилазодикарбоксилата и полученную смесь перемешивают при комнатной температуре в течение 40 минут. Реакционную смесь испаряют и образовавшийся остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексана и этилацетата (85: 15), и получают 153 мг Трет-бутил-N-[N-[4-[(1- трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано-2- нафтил)метил]сульфамоил]-N-метилкарбамата.
Данные масс-спектра (m/z): 650 (M)+
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.45 (9Н, s), 1.57-1.73 (11Н, m), 1.80-1.92 (2Н, m), 2.93 (3Н, s), 3.24-3.35 (2Н, m), 3.60-3.72 (2Н, m), 4.33-4.42 (1H, m), 5.19 (2Н, s), 6.79 (2Н, d, J= 9.3Hz), 7.15 (2Н, d, J=8.8Hz), 7.57 (1H, dd, J=1.5, 8.3Hz), 7.64-7.70 (2Н, m), 7.84 (1H, d, J=8.3Hz), 7.87 (1H, d, J=8.3Hz), 8.13 (1H, s).
Ссылочный Пример 46
7-формил-2- нафталинкарбонитрил, полученный в ссылочном Примере 1 (3,0 г), растворяют в 50 мл ацетона. Раствор охлаждают до 0oC при перемешивании и добавляют к нему раствор, приготовленный растворением 10 г окиси хрома (IV) в 11 мл концентрированной серной кислоты, и 50 мл воды до тех пор, пока смесь не окрасится в желто-оранжевый цвет. Раствор перемешивают при 0oC в течение 90 минут, а затем при комнатной температуре в течение 45 минут, а затем добавляют 2 мл изопропилового спирта. Смесь выпаривают, к остатку добавляют воду, а затем экстрагируют этилацетатом. Этилацетатный слой экстрагируют насыщенным водным раствором бикарбоната натрия, натрийбикарбонатный экстракт доводят до pH 1 с помощью концентрированной серной кислоты и образовавшийся твердый осадок фильтруют, получая 1,94 г 7-циано-2-нафталинкарбоновой кислоты.
Данные масс-спектра (m/z): 197 (M)+.
Данные ЯМР спектра (DMSO, внутренний стандарт - ТМС):
δ: 7.93 (1H, dd, J=1.2, 8.5Hz), 8.13-8.23 (3Н, m), 8.75 (1H, s), 8.80 (1H, s), 13.33 (1H, s).
Ссылочный Пример 47
7-циано-2-нафталинкарбоновую кислоту, полученную в ссылочном Примере 46 (1,5 г), и 2,2 г 4-[(1-трет- бутоксикарбонил-4-пиперидил)окси]анилина растворяют в 30 мл диметилформамида, к раствору прибавляют 1,75 г 1-этил-3-(3- диметиламинопропил)-карбодиимидгидрохлорида, 1,03 г 1-гидроксибензотриазола и 1,26 мл триэтиламина и полученную смесь перемешивают при комнатной температуре в течение одних суток. Реакционную смесь фильтруют и фильтрат испаряют. Полученный остаток перекристаллизовывают из этанола, получая 2,7 г N-[4-[(1- трет-бутоксикарбонил-4-пиперидил)-окси] фенил] -7-циано-2- нафталинкарбоксамида.
Данные масс-спектра (m/z): 471 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.48 (9Н, s), 1.70-1.80 (2Н, m), 1.85-1.98 (2Н, m), 3.28-3.40 (2Н, m), 3.65-3.7 (2Н, m), 4.41-4.50 (1Н, m), 6.94 (2Н, d, J=8.8Hz), 7.59 (2H,d, J= 8.8Hz), 7.71 (1H, d, J=9.0Hz), 7.94-8.03 (2Н, m), 8.06-8.15 (2Н, m), 8.29 (1H, s), 8.41 (1H, s).
Ссылочный Пример 48
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) -окси] фенил]-7-циано-2-нафталинкарбоксамид, полученный в ссылочном Примере 47 (200 мг), растворяют в 4 мл диметилформамида, к раствору прибавляют 52 мг гидрида натрия (60%) и полученную смесь перемешивают при комнатной температуре в течение 20 минут. Далее при перемешивании к реакционной смеси при 0oC по каплям прибавляют 100 мл метансульфонилхлорида в 1 мл диметилформамидного раствора, а затем оставляют на сутки при перемешивании при комнатной температуре. Реакционную смесь испаряют и к полученному остатку добавляют этилацетат. Смесь промывают последовательно насыщенным водным раствором бикарбоната натрия и 10% лимонной кислотой, сушат над безводным сульфатом натрия и затем испаряют. Полученный остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексан:этилацетат (8:2-7:3), и получают 143 мг N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)-окси] фенил]-7-циано-N-метилсульфонил-2-нафталинкарбоксамида.
Данные масс-спектра (m/z): 550 (M+1)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.45 (9Н, s), 1.59-1.71 (2Н, m), 1.79-1.89 (2Н, m), 3.23-3.33 (2H, m), 3.48 (3Н, s), 3.58-3.69 (2Н, m), 4.33-4.41 (1Н, m), 6.80 (2Н, d, J= 8.8Hz), 7.21 (2Н, d, J=8.8Hz), 7.63-7.77 (3Н, m), 7.86 (1H, d, J=8.3Hz), 8.12 (2Н, s).
Следующее соединение ссылочного Примера 49 получают тем же способом, что и в ссылочном Примере 45.
Ссылочный Пример 49
Этил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7- циано-2-нафтил)метил]сульфамоил]-N-метилкарбамат.
Исходные соединения: Этил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N- [(7-циано-2-нафтил)метил]сульфамоил]-карбамат, метанол.
Данные масс-спектра (m/z): 622 (М)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.39-1.50 (12H, m), 1.61-1.74 (2Н, m), 1.80-1.91 (2H, m), 3.01 (3H, s), 3.23-3.33 (2H, m), 3.61-3.71 (2Н, m), 4.33-4.45 (3H, m), 5.18 (2Н, s), 6.79 (2Н, d, J=9.3Hz), 7.11 (2H, d, J=8.8Hz), 7.58 (1H, dd, J=1.5, 8.8Hz), 7.62-7.70 (2Н, m), 7.85 (1H, d, J=8.3Hz), 7.88 (1H, d, J-8.3Hz), 8.13 (1H, s).
Ссылочный Пример 50
Этил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] - N-[(7-циано-2-нафтил)метил] сульфамоил] карбамат (1 г) растворяют в 10 мл диметилформамида, к раствору прибавляют 376 мг метилбромацетата, 339 мг карбоната калия и полученную смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь испаряют и к полученному остатку добавляют воду и смесь экстрагируют хлороформом. Экстракт сушат над безводным сульфатом натрия и затем испаряют. Полученный остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексан:этилацетат (8:2), и получают 1,097 г метил-N-[N-[4-[(1- трет-бутоксикарбонил-4-пиперидил)окси] фенил] N-(7-циано-2- нафтил)метил]сульфамоил]-N-этоксикарбонилглицината
Данные масс-спектра (m/z): 680 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.38 (3Н, t, J=7.1Hz), 1.45 (9Н, s), 1.62-1.74 (2Н, m), 1.80-1.91 (2Н, m), 3.24-3.35 (2Н, m), 3.60-3.71 (5H, m), 4.21 (2Н, s), 4.34-4.44 (3Н, m), 5.19 (2Н, m), 6.78 (2Н, d, J=8.8Hz), 7.13 (2Н, d, J=8.8Hz), 7.58 (1H, d, J= 8.5Hz), 7.62-7.69 (2Н, m), 7.84 (1H, d, J=8.8Hz), 7.88 (1H, d, J=8.8Hz), 8.12 (1H, s).
Следующее соединение ссылочного Примера 51 получают тем же способом, что и в ссылочном Примере 50.
Ссылочный Пример 51
Этил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N- [(7-циано-2-нафтил)метил]сульфамоил]-N-трет-бутоксикарбонилглицинат.
Исходные соединения: трет-бутил-N-[N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-N-[(7-циано-2-нафтил)метил]-сульфамоил]карбамат, этилбромацетат.
Данные масс-спектра (m/z): 722 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.24 (3Н, t, J=7.1Hz), 1.45 (9Н, s), 1.58 (9H, s), 1.60-1.76 (2Н, m), 1.80-1.92 (2H, m), 3.24-3.35 (2Н, m), 3.60-3.71 (2H, m), 4.08-4.20 (4Н, m), 4.32-4.42 (1H, m), 5.19 (2H, s), 6.77 (2Н, d, J=8.8Hz), 7.15 (2H, d, J= 8.8Hz), 7.57 (1H, d, J=8.3Hz), 7.62-7.70 (2Н, m), 7.83 (1H, d, J=8.3Hz), 7.87 (1H, d, J=8.3Hz), 8.12 (1H, s).
Ссылочный Пример 52
Метил-5-гидроксиантранилат (835 мг) растворяют в 10 мл тетрагидрофурана, к раствору прибавляют 863 мг 1-трет-бутокси-карбонил-4-гидроксипиперидин, 1,572 мг трифенилфосфина и 1,044 мг диэтилазодикарбоксилата и полученную смесь перемешивают при комнатной температуре в течение 4 суток. Реакционную смесь испаряют и к полученному остатку добавляют этилацетат. Смесь промывают последовательно насыщенным водным раствором бикарбоната натрия и 10% лимонной кислотой, сушат над безводным сульфатом натрия и затем испаряют. Полученный остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексан:этилацетат (85:15), и получают 716 мг метил-5-[(1-трет- бутоксикарбонил-4-пиперидил)-окси]антранилата
Данные масс-спектра (m/z): 350 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.47 (9H, s), 1.63-1.76 (2Н, m), 1.80-1.93 (2Н, m), 3.22-3.32 (2Н, m), 3.62-3.75 (2Н, m), 3.87 (3H, s), 4.23-4.31 (1Н, m), 5.47 (2Н, bs), 6.63 (1H, d, J=8.5Hz), 6.96 (1H, dd, J=8.5, 3.1Hz), 7.41 (1H, d, J=3.1Hz).
Следующее соединение ссылочного Примера 53 получают тем же способом, что и в ссылочном Примере 2.
Ссылочный Пример 53
Метил-5-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -N-[(7-циано-2-нафтил) метил]антранилат.
Исходные соединения: метил-5-[(1-трет- бутоксикарбонил-4-пиперидил)окси] антранилат, 7-формил-2-нафталинкарбонитрил.
Данные масс-спектра (m/z): 515 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.46 (9H, s), 1.61-1.73 (2Н, m), 1.79-1.91 (2Н, m), 3.21-3.31 (2Н, m), 3.61-3.73 (2Н, m), 3.89 (3Н, s), 4.21-4.30 (1H, m), 4.62 (2Н, s), 6.55 (1H, d, J=9.1Hz), 6.95 (1H, dd, J=9.1, 3.1Hz), 7.52 (1H, d, J=3.0Hz), 7.58 (1H, d, J= 8.2Hz), 7.64 (1H, d, J=8.5Hz), 7.83 (1H, s), 7.87 (1H, d, J= 8.5Hz), 7.89 (1H, d, J=8.5Hz), 8.05 (1H, bs), 8.18 (1H, s).
Следующее соединение ссылочного Примера 54 получают тем же способом, что и в ссылочном Примере 2.
Ссылочный Пример 54
7-[[4-[[(3S)-1-трет-бутоксикарбонил-3-пирролидинил]окси]- анилино]метил] -2-нафталинкарбонитрил.
Исходные соединения: 7-формил-2-нафталинкарбонитрил, 4-[[(3S)-1-трет-бутоксикарбонил-4- пирролидинил]окси]анилин.
Данные масс-спектра (m/z): 443 (М)+
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.45 (9H, s), 1.92-2.18 (2Н, m), 3.40-3.65 (4Н, m), 4.30 (1H, bs), 4.50 (2Н, s), 4.68-4.77 (1H, m), 6.54-6.66 (2Н, m), 6.74 (2Н, d, J=8.8Hz), 7.58 (1H, d, J=8.3Hz), 7.66 (1H, d, J=9.8Hz), 7.85-7.93 (3H, m), 8.17-8.23 (1H, m).
Следующее соединение ссылочного Примера 55 получают тем же способом, что и в ссылочном Примере 18.
Ссылочный Пример 55
Этил-N-[N-[[4-[(3S)-1-трет-бутоксикарбонил-3-пирролидинил] -окси] фенил] -N-[(7-циано-2-нафтил)метил]сульфамоил]карбамат.
Исходные соединения: 7-[[4-[[(3S)-1-трет-бутоксикарбонил-3- пирролидинил]окси]анилино]метил]-2-нафталинкарбонитрил.
Данные масс-спектра (m/z): 594 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 1.36 (3H, t, J=6.8Hz), 1.44 (9H, s), 1.96-2.20 (2Н, m), 3.39-3.60 (4Н, m), 4.33 (2Н, q, J=6.8Hz), 4.70-4.82 (1H, m), 5.21 (2Н, s), 6.75 (2H, d, J= 8.8Hz), 7.17 (2Н, d, J=8.8Hz), 7.32 (1H, bs), 7.58 (1H, d, J=8.6Hz), 7.62-7.70 (2Н, m), 7.84 (1H, d, J=8.3Hz), 7.87 (1H, d, J=8.3Hz), 8.13 (1H, s).
Ссылочный Пример 56
Этил-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-N-[(7-циано-2-нафтил)метил] сульфамоил]ацетат (500 мг) растворяют в 10 мл ацетонитрила, к раствору прибавляют 0,52 мл йодистого метила и 136 мг карбоната калия и полученную смесь перемешивают при температуре образования флегмы в течение 5 часов 30 минут. После охлаждения реакционной смеси осадок отфильтровывают, фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, используя в качестве элюента смесь гексан: этилацетат (3: 1), и получают 415 мг этил 2-[N-[-4-[(1- трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7-циано-2-нафтил) метил]сульфамоил] пропионата.
Данные масс-спектра (m/z): 621 (М)+.
Данные ЯМР спектра (CDCl3 внутренний стандарт - ТМС):
δ: 1.25-2.15 (19H, m), 3.08-3.79 (4Н, m), 4.00-5.32 (6Н, m), 6.65-6.89 (2Н, m), 7.18-7.38 (2Н, m), 7.41-8.07 (6Н, m).
Следующие соединения ссылочных Примеров 57 и 58 получают тем же способом, что и в ссылочном Примере 56.
Ссылочный Пример 57
Этил-2-[N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]бутилат.
Исходные соединения: этил-N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано-2- нафтил)метил]сульфамоилацетат.
Данные масс-спектра (m/z): 635 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 0.90-1.11 (6Н, m), 1.45 (9Н, s), 1.50-2.32 (6Н, m), 3.12- 4.10 (4Н, m), 4.14-5.25 (6Н, m), 6.67-6.87 (2Н, m), 7.16-7.32 (2Н, m), 7.44-7.92 (7Н, m), 8.05 (1H, s).
Ссылочный Пример 58
Этил-2-[N-[4-[(1-трет-бутоксикарбонил-4 пиперидил] окси]фенил]-N- [(7-циано-2- нафтил)метил]сульфамоил]валерат.
Исходные соединения: этил-[N-[4- [(1-трет-бутоксикарбонил-4-пипеpидил)oкcи]фенил]-N-[(7-циано-2- нафтил)метил]сульфамоил]ацетат.
Данные масс-спектра (m/z): 649 (М)+.
Данные ЯМР спектра (CDCl3, внутренний стандарт - ТМС):
δ: 0.77-1.06 (6Н, m), 1.15-1.40 (4Н, m), 1.45 (9Н, s), 1.54-2.32 (4Н, m), 3.08-3.83 (4Н, m), 3.92-5.28 (6Н, m), 6.71-6.89 (2Н, m), 7.19-7.36 (2H, m), 7.45-7.94 (7Н, m), 8.05 (1H, s).
ПРИМЕР 1
N-[4-[1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано- 2-нафтил)метил] ацетамид, полученный в ссылочном Примере 3 (128 мг), растворяют в смешанном растворителе из 2 мл дихлорметана и 5 мл этанола. При перемешивании раствор охлаждают до -20oC и насыщают хлористым водородом. Смесь перемешивают при 5oC в течение 4 суток и затем испаряют. К полученному остатку прибавляют этанольный раствор (5 мл), насыщенный аммиаком при 10oC, и смесь перемешивают при 5oC еще в течение 6 суток. Реакционную смесь испаряют, полученный остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A 120-230/70), используя в качестве элюента смесь метанол:вода (2:98), а затем добавляют небольшое количество 1н соляной кислоты и лиофилизируют, получая 92 мг N-[(7-амидино-2-нафтил)метил]-N-[4-[(4- пиперидил)окси]фенил]ацетамиддигидрохлорида.
Данные масс-спектра (m/z): 417 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.75-7.85 (2Н, m), 1.86 (3Н, s), 2.03-2.11 (2Н, m), 2.96-3.05 (2Н, m), 3.13-3.22 (2Н, m), 4.53-4.64 (1Н, m), 5.03 (2Н, s), 6.96 (2Н, d, J= 8.5Hz), 7.15 (2Н, d, J=8.5Hz), 7.59 (1H, d, J=8.6Hz), 7.81 (1Н, d, J=8.6Hz), 7.85 (1Н, s), 8.01 (1H, d, J=7.9Hz), 8.11 (1H, d, J=8.6Hz), 8.47 (1H, s), 9.07 (1H, brs), 9.14 (1H, brs), 9.28 (2Н, s), 9.50 (2Н, s).
Следующие соединения ПРИМЕРОВ 2-11 получают тем же способом, что и соединение ПРИМЕРА 1.
ПРИМЕР 2
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил] оксамида дигидрохлорид.
Исходные соединения: этил-N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N- [(7-циано-2-нафтил)метил]оксамат.
Данные масс-спектра (m/z): 446 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.72-1.80 (2Н, m), 2.00-2.09 (2Н, m), 2.95-3.05 (2Н, m), 3.11-3.21 (2H, m), 4.52-4.60 (1H, m), 5.01 (2Н, s), 6.90 (2Н, d, J=9.2Hz), 7.15 (2Н, d, J= 8.5Hz), 7.47 (1H, s), 7.61 (1H, d, J=8.5Hz), 7.82 (1H, d, J=8.5Hz), 7.89 (1H, s), 8.04 (2Н, d, J=8.5Hz), 8.08-8.13 (3H, m), 8.46 (1H, s), 9.05 (1H, bs), 9.13 (1H, bs), 9.29 (2Н, s), 9.52 (2Н, s).
ПРИМЕР 3
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил] - циклопропанкарбоксамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил] циклопропанкарбоксамид.
Данные масс-спектра (m/z): 443 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.67-0.63 (2Н, m), 0.80-0.88 (2Н, m), 1.34-1.38 (1H, m), 1.80-1.82 (2Н, m), 2.00-2.10 (2Н, m), 3.01-3.04 (2Н, m), 3.12-3.18 (2Н, m), 4.60-4.62 (1H, m), 5.06 (2Н, s), 6.98 (2Н, d, J=9.2Hz), 7.16 (2Н, d, J=9.2Hz), 7.54 (1H, d, J= 8.0Hz), 7.81 (1H, s), 7.82 (1H, d, J=9.8Hz), 8.01 (1H, d, J= 8.6Hz), 8.10 (1H, d, J=9.2Hz), 8.48 (1H, s), 9.17 (1H, bs), 9.24 (1H, bs), 9.33 (2Н, s), 9.52 (2Н, s).
ПРИМЕР 4
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]-бензамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]бензамид.
Данные масс-спектра (m/z): 479 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.72-1.74 (2Н, m), 1.97-2.00 (2H, m), 2.95-2.98 (2Н, m), 3.10-3.12 (2Н, m), 4.49-4.51 (1H, m), 5.26 (2Н, s), 6.78 (2Н, d, J=9.2Hz), 7.03 (2Н, d, J= 8.6Hz), 7.24-7.30 (3H, m), 7.36 (2Н, d, J=7.3Hz), 7.68 (1H, d, J= 8.5Hz), 7.84 (1H, d, J=8.5Hz), 7.97 (1H, s), 8.03 (1H, d, J=8.6Hz), 8.11 (1H, d, J=8.6Hz), 8.55 (1H, s), 9.23 (1H, bs), 9.32 (1H, bs), 9.41 (2Н, s), 9.58 (2Н, s).
ПРИМЕР 5
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]-этанкарбоксамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]этанкарбоксамид.
Данные масс-спектра (m/z): 431 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 0.99 (3H, t, J=7.3Hz), 1.84-1.85 (2Н, m), 2.09-2.10 (4H, m), 3.02-3.04 (2Н, m), 3.14-3.16 (2H, m), 5.04 (2Н, s), 6.97 (2Н, d, J=9.1Hz), 7.12 (2Н, d, J= 9.0Hz), 7.68 (1H, d, J=8.5Hz), 7.84 (1H, d, J=8.5Hz), 7.88 (1H, s), 8.01-8.11 (2Н, m), 8.56 (1H, s), 9.20 (1H, bs), 9.32 (1H, bs), 9.52 (2Н, s), 9.69 (2Н, s).
ПРИМЕР 6
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси] фенил] -циклогексанкарбоксамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-N-[(7-циано-2-нафтил)метил] циклогексанкарбоксамид.
Данные масс-спектра (m/z): 485 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 0.91-0.93 (2Н, m), 1.13-1.15 (1H, m), 1.41-1.48 (2Н, m), 1.51-1.53 (1H, m), 1.63-1.71 (4H, m), 1.81-1.83 (2Н, m), 2.06-2.10 (2Н, m), 2.18-2.23 (1H, m), 3.00-3.04 (2H, m), 3.16-3.18 (2Н, m), 4.60-4.62 (1H, m), 4.98 (2Н, s), 6.97 (2Н, d, J=8.6Hz), 7.09 (2Н, d, J=8.5Hz), 7.54 (1H, d, J=7.3Hz), 7.79 (1H, s), 7.83 (1H, d, J=6.7Hz), 8.01 (1H, d, J=8.6Hz), 8.10 (1H, dr J= 9.2Hz), 8.49 (1H, s), 9.22 (1H, bs), 9.29 (1H, bs), 9.37 (2Н,. s), 9.55 (2Н, s).
ПРИМЕР 7
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил) окси]фенил]-1-нафталинкарбоксамида дигидрохлорид.
Исходные соединения: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]-1-нафталинкарбоксамид.
Данные масс-спектра (m/z): 529 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.60-1.64 (2Н, m), 1.84-1.89 (2Н, m), 2.86-2.90 (2H, m), 3.01-3.05 (2Н, m), 4.32-4.36 (1H, m), 5.40 (1H, s), 6.59 (2Н, d, J=9.2Hz), 6.95 (2Н, d, J= 8.5Hz), 7.34 (1H, t, J=7.9Hz), 7.44 (1H, d, J=7.3Hz), 7.52 (1H, t, J= 7.3Hz), 7.61 (1H, t, J=7.9Hz), 7.81 (2Н, t, J=8.5Hz), 7.87 (2Н, d, J=7.3Hz), 8.03 (1H, s), 8.07- 8.15 (3H, m), 8.61 (1H, s), 9.20 (1H, bs), 9.30 (1H, bs), 9.45 (2Н, s), 9.64 (2Н, s).
ПРИМЕР 8
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси] фенил]-2-фторбензамида дигидрохлорид.
Исходные соединения: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]- N-[(7-циано-2-нафтил)метил]-2-фторбензамид.
Данные масс-спектра (m/z): 497 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.68-1.71 (2Н, m), 1.90-1.96 (2Н, m), 2.91-2.95 (2Н, m), 3.05-3.10 (2Н, m), 4.41-4.47 (1H, m), 5.27 (2Н, s), 6.75 (2Н, d, J=9.2Hz), 7.00 (2Н, d, J= 9.2Hz), 7.06 (1H, t, J=9.2Hz), 7.11 (1H, t, J=7.3Hz), 7.30-7.32 (1H, m), 7.45 (1H, t, J=6.1Hz), 7.69 (1H, d, J=8.6Hz), 7.85 (1H, d, J=8.5Hz), 7.96 (1H, s), 8.07 (1H, d, J=8.6Hz), 8.13 (1H, d, J=8.5Hz), 8.53 (1H, s), 9.18 (1H, bs), 9.26 (1H, bs), 9.39 (2Н, s), 9.58 (2Н, s).
ПРИМЕР 9
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]-3-метоксибензамида дигидрохлорид.
Исходные соединения: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил] -3-метоксибензамид.
Данные масс-спектра (m/z): 509 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.70-1.76 (2Н, m), 1.92-2.01 (2Н, m), 2.91-2.97 (2H, m), 3.11-3.16 (2Н, m), 3.64 (3H, s), 4.50- 4.52 (1H, m), 5.26 (2Н, s), 6.80 (2H, d, J= 9.2Hz), 6.85 (1H, d, J=6.1Hz), 6.90-6.93 (2H, m), 7.05 (2Н, d, J=7.9Hz), 7.15 (1H, t, J=7.9Hz), 7.68 (1H, d, J=9.8Hz), 7.83 (1H, d, J=6.7Hz), 7.95 (1H, s), 8.03 (1H, d, J=8.5Hz), 8.11 (1H, d, J=8.55Hz), 8.54 (1H, s), 9.18 (1H, bs), 9.24 (1H, bs), 9.36 (2Н, s), 9.55 (2H, s).
ПРИМЕР 10
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]-2-тиофенамида дигидрохлорид.
Исходные соединения: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]-2-тиофенамид.
Данные масс-спектра (m/z): 485 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.81-1.83 (2H, m), 2.03-2.07 (2H, m), 3.00-3.07 (2H, m), 3.15-3.18 (2H, m), 4.61-4.65 (1H, m), 5.20 (2H, s), 6.76 (1H, s), 6.93 (1H, t, J= 4.3Hz), 6.98 (2H, d, J=8.5Hz), 7.19 (2H, d, J=8.6Hz), 7.65-7.68 (2H, m), 7.83 (1H, d, J=8.6Hz), 7.94 (1H, s), 8.02 (1H, d, J=8.5Hz), 8.11 (1H, d, J= 8.6Hz), 9.22 (1H, bs), 9.28 (1H, bs), 9.35 (2H, s), 9.53 (2H, s).
ПРИМЕР 11
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси]фенил]-2- пиридинкарбоксамида тригидрохлорид.
Исходные соединения: N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-N-[(7-циано-2-нафтил)метил]-3- пиридин-карбоксамид.
Данные масс-спектра (m/z): 480 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.71-1.75 (2H, m), 1.96-1.99 (2H, m), 2.95-2.97 (2H, m), 3.00-3.17 (2H, m), 4.50-4.52 (1H, m), 5.30 (1H, s), 6.82 (2H, d, J=8.6Hz), 7.15 (2H, d, J= 8.5Hz), 7.65-7.67 (1H, m), 7.73 (1H, d, J=8.6Hz), 7.84 (1H, d, J= 8.6HZ), 8.01 (1H, s), 8.04 (1H, d, J=7.9Hz), 8.12 (1H, d, J=8.6Hz), 8.14-8.15 (1H, m), 8.56 (1H, s), 8.66 (1H, s), 8.75 (1H, s), 9.21 (2H, bs), 9.38 (1H, bs), 9.40 (2H, s), 9.58 (2H, s).
ПРИМЕР 12
N-[(7-амидино-2- нафтил)метил]-N-[4-[(4-пиперидил)окси]фенил]-ацетамида дигидрохлорид (56 мг) растворяют в 2 мл этанола, к раствору прибавляют 28 мг этилацетоимидатгидрохлорида и 36 мг триэтиламина и смесь перемешивают при комнатной температуре в течение 2 суток и затем испаряют. Полученный остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A 120-230/70), используя в качестве элюента смесь метанол: вода (2:98), а затем добавляют небольшое количество 1н соляной кислоты и лиофилизируют, получая 60 мг N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7- амидино-2-нафтил)метил]-ацетамиддигидрохлорида.
Данные масс-спектра (m/z): 458 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.61-1.76 (2Н, m), 1.87 (3Н, s), 1.95-2.06 (2H, m), 2.28 (3Н, m), 3.43-3.55 (2Н, m), 3.65-3.73 (1Н, m), 3.75-3.84 (1H, m), 4.65 (1H, bs), 5.03 (2Н, s), 6.96 (2Н, d, J= 8.5Hz), 7.15 (2Н, d, J=8.5Hz), 7.59 (1H, d, J= 8.5Hz), 7.81 (1H, d, J=8.5Hz), 7.85 (1H, s), 8.01 (1H, d, J=8.5Hz), 8.11 (1H, d, J= 8.5Hz), 8.48 (1H, s), 8.80 (1H, s), 9.30 (2Н, s), 9.33 (1H, s), 9.51 (2Н, s).
Следующие соединения ПРИМЕРОВ 13-22 получают тем же способом, что и соединение ПРИМЕРА 12.
ПРИМЕР 13
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]оксамида дигидрохлорид.
Исходные соединения: N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси]фенил]оксамида дигидрохлорид
Данные масс-спектра (m/z): 487 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.61-1.75 (2H, m), 1.95-2.05 (2H, m), 2.27 (3H, s), 3.43-3.54 (2H, m), 3.45-3.75 (1H, m), 3.75-3.82 (1H, m), 4.61 (1H, bs), 5.08 (2H, s), 6.91 (2H, d, J= 8.5Hz), 7.15 (1H, d, J=8.5Hz), 7.47 (1H, s), 7.62 (1H, d, J= 8.5Hz), 7.82 (1H, d, J=8.5Hz), 7.90 (1H, s), 8.04 (1H, d, J=8.5Hz), 8.10-8.15 (2H, m), 8.46 (1H, s), 8.75 (1H, s), 8.24 (2H, s), 8.27 (1H, s), 9.50 (2H, s).
ПРИМЕР 14
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил] циклопропанкарбоксамида дигидрохлорид.
Исходные соединения: N-[(7- амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси]фенил] циклопропанкарбоксамида дигидрохлорид.
Данные масс-спектра (m/z): 484 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.64-0.68 (2Н, m), 0.84-0.89 (2H, m), 1.37- 1.39 (1H, m), 1.68-1.75 (2H, m), 2.00-2.09 (2Н, m), 2.28 (3H, s), 3.45-3.49 (2Н, m), 3.69-3.80 (2Н, m), 4.61-4.67 (1H, m), 5.08 (2Н, s), 6.98 (2Н, d, J=8.5Hz), 7.17 (2Н, d, J= 9.2Hz), 7.55 (1H, d, J=8.6Hz), 7.80-7.83 (1H, m), 8.01 (1H, d, J=8.6Hz), 8.10 (1H, d, J=8.6Hz), 8.47 (1H, s), 8.79 (1H, s), 9.22-9.30 (3H, m), 9.49 (2Н, s).
ПРИМЕР 12
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]бензамида дигидрохлорид.
Исходные соединения: N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]бензамида дигидрохлорид.
Данные масс-спектра (m/z): 520 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.51-1.61 (2Н, m), 1.87-1.99 (2Н, m), 2.26 (3Н, m), 3.02-3.08 (2Н, m), 3.62-3.71 (2Н, m), 4.52-4.59 (1H, m), 5.27 (2Н, s), 6.79 (2Н, d, J= 8.6Hz), 7.02 (2Н, d, J=8.5Hz), 7.13 (1H, s), 7.23-7.35 (4H, m), 7.69 (1H, d, J= 8.4Hz), 7.81 (1H, d, J=8.5Hz), 7.97 (1H, s), 8.03 (1H, d, J=8.6Hz), 8.11 (1H, d, J=8.6Hz), 8.52 (1H, s), 8.74 (1H, s), 9.27 (3Н, s), 9.50 (2H, s).
ПРИМЕР 16
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -М-[(7-амидино- 2-нафтил)метил]этанкарбоксамида дигидрохлорид.
Исходные соединения: N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил]этанкарбоксамида дигидрохлорид.
Данные масс-спектра (m/z): 472 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.99 (3Н, t, J=9.3Hz), 1.64-1.80 (2Н, m), 1.94-2.14 (4H, m), 2.28 (3Н, s), 3.02-3.09 (2Н, m), 3.62-3.80 (2Н, m), 4.60-4.64 (1H, m), 5.03 (2Н, s), 6.95 (2Н, d, J=9.2Hz), 7.12 (2Н, d, J=8.5Hz), 7.48 (1H, d, J=8.5Hz), 7.78-7.86 (2Н, m), 8.00 (1H, d, J=8.4Hz), 8.11 (1H, d, J=8.6Hz), 8.48 (1H, s), 8.82 (1H, s), 9.30 (3Н, s), 9.51 (2Н, s).
ПРИМЕР 17
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]циклогексанкарбоксамида дигидрохлорид.
Исходные соединения: N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]циклогексанкарбоксамида дигидрохлорид.
Данные масс-спектра (m/z): 526 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.90-0.93 (2Н, m), 1.13-1.16 (1Н, m), 1.43-1.46 (2Н, m), 1.50-1.53 (1Н, m), 1.64-1.70 (6Н, m), 2.00-2.10 (2Н, m), 2.10-2.21 (1Н, m), 2.28 (3Н, s), 3.45-3.49 (2Н, m), 3.69-3.80 (2Н, m), 4.64-4.68 (1Н, m), 4.99 (2Н, s), 6.97 (2Н, d, J=8.6Hz), 7.09 (2Н, d, J=8.5Hz), 7.54 (1Н, d, J=8.5Hz), 7.79-7.83 (2Н, m), 8.01 (1H, d, J=8.6Hz), 8.11 (1H, d, J=8.6Hz), 8.47 (1H, s), 8.80 (1H, s), 9.30 (3Н, s), 9.51 (2Н, s).
ПРИМЕР 18
N-[4-[(1-ацетоимидоил- 4- пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]-1-нафталинкарбоксамида дигидрохлорид.
Исходные соединения: N-[(7-амидино-2-нафтил)метил] - N-[4-[(4-пиперидил)окси]фенил]-1-нафталинкарбоксамида дигидрохлорид.
Данные масс-спектра (m/z): 570 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.42-1.55 (2Н, m), 1.78-1.89 (2Н, m), 2.27 (3Н, s), 3.37-3.42 (2Н, m), 3.57-3.65 (2Н, m), 4.38-4.44 (1H, m), 5.39 (2Н, s), 6.59 (2Н, d, J= 8.8Hz), 6.95 (2Н, d, J=8.3Hz), 7.34 (1H, t, J=7.8Hz), 7.43 (1H, d, J=6.8Hz), 7.53 (1H, t, J=7.3Hz), 7.62 (1H, t, J=7.3Hz), 7.79-7.89 (4H, m), 8.04-8.17 (4H, m), 8.53 (1H, s), 8.61 (1H, s), 9.17 (3H, s), 9.48 (2H, s).
ПРИМЕР 19
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]-2-фторбензамида дигидрохлорид.
Исходные соединения: N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси]фенил]- 2-фторбензамида дигидрохлорид.
Данные масс-спектра (m/z): 538 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.52-1.62 (2Н, m), 1.86-1.94 (2H, m), 2.25 (3H, s), 3.40-3.45 (2H, m), 3.65-3.73 (2H, m), 4.46-4.56 (1H, m), 5.26 (2H, s), 6.75 (2H, d, J= 8.6Hz), 6.99 (2H, d, J=8.6Hz), 7.05 (1H, t, J=8.5Hz), 7.11 (1H, t, J=7.3Hz), 7.30-7.32 (1H, m), 7.69 (1H, d, J=7.9Hz), 7.83 (1H, d, J=8.6Hz), 7.96 (1H, s), 8.07 (1H, d, J=8.6Hz), 8.13 (1H, d, J=8.5Hz), 8.50 (1H, s), 8.76 (1H, s), 9.31 (3H, s), 9.53 (2H, s).
ПРИМЕР 20
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]-3-метоксибензамида дигидрохлорид.
Исходное соединение: N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]-3-метоксибензамида дигидрохлорид.
Данные масс-спектра (m/z): 549 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.5.7-1.68 (2H, m), 1.90-1.98 (2Н, m), 2.25 (3H, s), 3.41-3.48 (2Н, m), 3.63 (3H, s), 3.70-3.78 (2H, m), 4.54-4.58 (1H, m), 5.26 (2Н, s), 6.80 (2Н, d, J=9.2Hz), 6.85-6.94 (3H, m), 7.05 (2Н, d, J=7.9Hz), 7.16 (1H, t, J= 7.9Hz), 7.68 (1H, d, J=8.5Hz), 7.81 (1H, d, J=7.3Hz), 7.97 (1H, s), 8.03 (1H, d, J= 8.5Hz), 8.11 (1H, d, J=8.6Hz), 8.51 (1H, s), 8.72 (1H, s), 9.24 (3H, s), 9.49 (2Н, s).
ПРИМЕР 21
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7- амидино-2-нафтил)метил]тиофенамида дигидрохлорид.
Исходные соединения:
N-[(7-амидино-2-нафтил)метил]-N-[4-[(4-пиперидил) окси]фенил]-2-тиофенамида дигидрохлорид.
Данные масс-спектра (m/z): 526 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.64-1.71 (2Н, m), 1.98-2.08 (2Н, m), 2.29 (3H, s), 3.42-3.58 (2Н, m), 3.71-3.82 (2Н, m), 4.62-4.72 (1H, m), 5.20 (2Н, s), 6.76 (1H, d, J= 3.1Hz), 6.93 (1H, t, J=4.9Hz), 6.99 (2Н, d, J=8.6Hz), 7.17 (2Н, d, J=8.6Hz), 7.65 (1H, d, J=10.4Hz), 7.69 (1H, d, J=4.3Hz), 7.83 (1H, d, J=8.6Hz), 7.95 (1H, s), 8.03 (1H, d, J=8.5Hz), 8.11 (1H, d, J=8.6Hz), 8.51 (1H, s), 8.85 (1H, s), 9.37 (3H, s), 9.52 (2Н, s).
ПРИМЕР 22
N-[4-[(1-ацетоимидоил-4- пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]-3- пиридинкарбоксамида тригидрохлорид.
Исходные соединения: N-[(7-амидино-2-нафтил)метил]-N-[4-[(4-
пиперидил)окси]фенил]-2-пиридинкарбоксамида тригидрохлорид.
Данные масс-спектра (m/z): 521 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.56-1.64 (2Н, m), 1.91-1.99 (2H, m), 2.27 (3H, s), 3.41-3.52 (2Н, m), 3.64-3.80 (2H, m), 4.52-4.58 (1H, m), 5.30 (2Н, s), 6.83 (2H, d, J= 7.9Hz), 7.14 (2Н, d, J=7.9Hz), 7.28-7.31 (2Н, m), 7.61-7.66 (1H, m), 7.72 (1H, d, J= 8.6Hz), 7.86 (1H, d, J=8.5Hz), 8.00 (1H, s), 8.04 (1H, d, J= 8.6Hz), 8.12 (1H, d, J=8.6Hz), 8.58 (1H, s), 8.74-8.79 (1H, m), 8.92 (1H, s), 9.45 (4H, s), 9.62 (2Н, s).
ПРИМЕР 23
Этил-N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил] оксамат, полученный в ссылочном Примере 4 (325 мг), растворяют в смешанном растворителе из 2 мл дихлорметана и 5 мл этанола. Раствор при перемешивании охлаждают до -20oC и насыщают хлористым водородом. Смесь перемешивают при 5oC в течение 2 суток и затем испаряют. Полученный остаток растворяют в 5 мл этанола, прибавляют 224 мг ацетата аммония и смесь перемешивают в течение 3 суток при 5oC и далее при комнатной температуре в течение одних суток. Реакционную смесь испаряют и полученный остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A 120-230/70). Частично очищенный этил-N- [(7-амидино-2-нафтил)метил]-N-[4-[(4-пиперидил)- окси]фенил]оксамат получают из фракции, элюированной метанолом. Частично очищенный этил-N-[(7-амидино-2-нафтил)метил] -N-[4- [(4-пиперидил)окси]фенил]оксамат (236 мг) растворяют в 5 мл этанола и к раствору добавляют 123 мг этилацетоимидатгидрохлорида и 156 мг триэтиламина и смесь перемешивают при комнатной температуре в течение 15 часов и затем испаряют. Полученный остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A 120-230/70), используя в качестве элюента смесь метанол:вода (5:95), а затем добавляют небольшое количество 1н соляной кислоты и лиофилизируют, получая 194 мг N-[4-[(1- ацетоимидоил-4-пиперидил)окси]фенил]-N-[(7-амидино-2- нафтил)метил]оксамата дигидрохлорида.
Данные масс-спектра (m/z): 516 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.89 (3Н, t, J=7.3Hz), 1.60-1.73 (2Н, m), 1.94-2.05 (2H, m), 2.27 (3Н, s), 3.42-3.55 (2H, m), 3.64-3.72 (1H, m), 3.72-3.81 (1H, m), 3.99 (2H, q, J= 7.3Hz), 4.62-4.68 (1H, m), 5.13 (2H, s), 6.97 (2H, d, J=9.2Hz), 7.13 (2H, d, J= 9.2Hz), 7.55 (1H, d, J=8.6Hz), 7.83 (1H, d, J=8.6Hz), 7.88 (1H, s), 8.05 (1H, d, J=8.6Hz), 8.13 (1H, d, J=8.6Hz), 8.49 (1H,s), 8.76 (1H, bs), 9.22-9.33 (3Н, m), 9.50 (2H, s).
ПРИМЕР 24
1-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -1-[(7-амидино- 2-нафтил)метил]-3-этилмочевины дигидрохлорид.
Исходные соединения: 1-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-1-[(7-циано-2-нафтил)метил]-3-этилмочевина.
Данные масс-спектра (m/z): 487 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.99 (3H, t, J=7.3Hz), 1.61-1.73 (2H, m), 1.95-2.05 (2Н, m), 2.28 (3H, s), 3.01-3.13 (2Н, m), 3.45-3.59 (2Н, m), 3.64-3.84 (2Н, m), 4.58-4.65 (1H, m), 4.97 (2Н, s), 5.73 (1H, t, J=5.5Hz), 6.93 (2Н, d, J=8.6Hz), 7.08 (2Н, d, J=9.2Hz), 7.60 (1H, d, J=8.5Hz), 7.75-7.86 (2Н, m), 8.00 (1H, d, J= 8.5Hz), 8.10 (1H, d, J=9.2Hz), 8.46 (1H, s), 8.85 (1H, s), 9.23-9.40 (1H, m), 9.51 (2Н, s).
ПРИМЕР 25
Этил-3-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -3-[(7- амидино-2-нафтил)метил]уреидо-1-ацетата дигидрохлорид.
Исходные соединения: этил-3-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-3-[(7-циано-2-нафтил)метил]уреидо-1- ацетат.
Данные масс-спектра (m/z): 545 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.21 (3H, t, J=6.7Hz), 1.52-1.67 (2Н, m), 1.95-2.06 (2Н, m), 2.28 (3H, s), 3.44-3.58 (2Н, m), 3.65-3.83 (4H, m), 4.10 (2Н, q, J=6.7Hz), 4.60- 4.66 (1H, m), 4.99 (2Н, s), 6.12 (1H, t, J=5.8Hz), 6.96 (2Н, d, J=8.6Hz), 7.13 (2Н, d, J=9.2Hz), 7.63 (1H, d, J=8.6Hz), 7.81 (1H, d, J=8.6Hz), 7.83 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.11 (1H, d, J=8.6Hz), 8.43 (1H, s), 8.82 (1H, s), 8.28 (2Н, s), 9.33 (1H, s). 9.50 (2Н, s).
ПРИМЕР 26
Этил-N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]карбамата дигидрохлорид.
Исходные соединения: этил-N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси]фенил]-N-[(7-циано-2-нафтил)метил]карбамат.
Данные масс-спектра (m/z): 488 (М-2HCl + 1)+
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.16 (3Н, t, J=7.0Hz), 1.61-1.77 (2Н, m), 1.95-2.06 (2Н, m), 2.29 (3H, s), 3.43-3.57 (2Н, m), 3.65-3.75 (1H, m), 3.75-3.83 (1H, m), 4.12 (2Н, q, J= 7.0Hz), 4.58-4.65 (1H, m), 5.03 (2Н, s), 6.91 (2Н, d, J=8.5Hz), 7.15 (2Н, d, J= 8.5Hz), 7.60 (1H, d, J=8.5Hz), 7.82 (1H, d, J=8.5Hz), 7.86 (1H, s), 8.03 (1H, d, J=8.5Hz), 8.11 (1H, d, J=8.5Hz), 8.50 (1H, s), 8.81 (1H, s), 9.33 (2Н, s), 9.35 (1H, s), 9.53 (2Н, s).
ПРИМЕР 27
1-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -1-[(7-амидино-2- нафтил)метил]-3-этилтиомочевины дигидрохлорид.
Исходные соединения: 1-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-1-[(7-циано-2-нафтил)метил]-3-этилтиомочевина.
Данные масс-спектра (m/z): 503 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.60 (3Н, t), 1.61-1.76 (2Н, m), 1.94-2.05 (2Н, m), 2.28 (3Н, s), 3.40-3.55 (4H, m), 3.64-3.74 (1H, m), 3.74-3.83 (1H, m), 6.97 (2Н, d, J= 8.9Hz), 7.01 (1H, t, J=5.5Hz), 7.05 (2Н, d, J=8.9Hz), 7.69 (1H, d, J=8.5Hz), 7.81 (1H, d, J=10.4Hz), 7.88 (1H, s), 8.00 (1H, d, J=8.5Hz), 8.10 (1H, d, J= 8.5Hz), 8.46 (1H, s), 8.84 (1H, s), 9.28 (2Н, s), 9.34 (1H, s), 9.50 (2Н, s).
ПРИМЕР 28
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]этансульфонамида дигидрохлорид.
Исходные соединения: N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]этансульфонамид.
Данные масс-спектра (m/z): 508 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.33 (3Н, t, J=7.3Hz), 1.59-1.73 (2H, m), 1.93-2.03 (2Н, m), 2.27 (3Н, s), 3.26 (2Н, q, J= 7.3Hz), 3.43-3.54 (2H, m), 3.63-3.71 (1H, m), 3.71-3.80 (1H, m), 4.58-4.64 (1H, m), 5.07 (2H, s), 6.91 (2H, d, J=9.2Hz), 7.33 (2H, d, J=9.2Hz), 7.65 (1H, d, J=8.5Hz), 7.81 (1H, d, J=8.5Hz), 7.90 (1H, s), 8.01 (1H, d, J=8.5Hz), 8.09 (1H, d, J=9.2Hz), 8.47 (1H, s), 8.74 (1H, s), 9.26 (2H, s), 9.28 (1H, s), 9.50 (2H, s).
ПРИМЕР 29
Этил-N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил] оксамат, полученный в Примере 23 (100 мг), растворяют в 20 мл концентрированной соляной кислоты и полученный раствор оставляют при 5oC на 9 суток. Реакционную смесь испаряют и полученный остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A 120-230/70), используя в качестве элюента смесь метанол:вода (3:97), а затем добавляют небольшое количество 1н соляной кислоты и лиофилизируют, получая 23 мг дигидрохлорида N-[4-[(1-ацетоимидоил-4-пиперидил) окси] фенил]-N-[(7-амидино-2-нафтил)метил]-оксамовой кислоты.
Данные масс-спектра (m/z): 488 (M-2HC1 + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.60-1.75 (2Н, m), 1.94-2.04 (2Н, m), 2.27 (3H, s), 3.40-3.52 (2Н, m), 3.64-3.81 (2H, m), 4.57-4.65 (1H, m), 5.09 (2Н, s), 6.94 (2H, d, J= 8.5Hz), 7.16 (2Н, d, J=8.5Hz), 7.56 (1H, d, J=9.2Hz), 7.82 (1H, d, J=9.2Hz), 7.89 (1H, s), 8.04 (1H, d, J=8.5Hz), 8.12 (1H, d, J=8.5Hz), 8.46 (1H, s), 8.72 (1H, s), 9.17-9.30 (3H, m), 9.46 (2Н, s), 14.0 (1H, bs).
ПРИМЕР 30
Этил-3- [4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -3-[(7-амидино-2- нафтил)метил]уреидо-1-ацетат, полученный в Примере 25 (109 мг), растворяют в 20 мл 1 н соляной кислоты и полученный раствор нагревают при температуре перегонки в течение 10 минут. Реакционную смесь испаряют, полученный остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A 120-230/70), используя в качестве элюента смесь метанол:вода (5:95), а затем добавляют небольшое количество 1н соляной кислоты и лиофилизируют, получая 74 мг дигидрохлорида 3-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил] -N-[(7-амидино-2-нафтил)метил] уреидо-1-уксусной кислоты.
Данные масс-спектра (m/z): 517 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.62-1.78 (2Н, m), 1.93-2.08 (2Н, m), 2.28 (3H, s), 3.40-3.85 (6Н, m), 4.58-4.68 (1H, m), 4.99 (2Н, s), 6.01 (1H, t, J=5.6Hz), 6.96 (2Н, d, J= 8.8Hz), 7.14 (2Н, d, J=8.8Hz), 7.62 (1H, d, J=8.3Hz), 7.81 (1H, d, J=8.8Hz), 7.86 (1H, s), 8.01 (1H, d, J=8.3Hz), 8.11 (1H, d, J=8.8Hz), 8.84 (1H, s), 9.31 (2Н, s), 9.35 (1H, s), 9.51 (2Н, s).
Следующее соединение получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 31
7-[4-[(1-ацетоимидоил-4-пиперидил)окси] анилино] метил] -2-нафтамидина тригидрохлорид.
Исходное соединение: 7-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] анилино]метил]-2-нафталинкарбонитрил.
Данные масс-спектра (m/z): 416 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.60-1.73 (2Н, m), 1.88-1.99 (2H, m), 2.27 (3H, s), 3.42-3.55 (2H, m), 3.63-3.77 (2H, m), 4.35- 4.42 (1H, m), 4.45 (2H, d, J=6.1Hz), 6.16 (1H, d, J= 6.1Hz), 6.55 (2H, d, J=8.5Hz), 6.75 (2H, d, J=8.5Hz), 7.74 (1H, d, J= 8.5Hz), 7.79 (2H, d, J=8.5Hz), 7.99 (1H, s), 8.03 (1H, d, J=8.5Hz), 8.11 (1H, d, J=8.5Hz), 8.43 (1H, s), 9.0-9.6 (8H, br).
ПРИМЕР 32
N-[4-[1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7- циано-2-нафтил)метил] -2-метоксибензамид, полученный в ссылочном Примере 19 (80 мг), растворяют в 5 мл этанола. При перемешивании раствор охлаждают до -70oC и насыщают хлористым водородом. Смесь перемешивают при 5oC в течение 16 часов и затем испаряют. Полученный остаток растворяют в 5 мл этанола, прибавляют 52 мг ацетата аммония и смесь перемешивают при комнатной температуре еще в течение 3 суток. Реакционную смесь испаряют, полученный остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A RO-230/70), используя в качестве элюента смесь метанол:вода (100:0), а затем добавляют небольшое количество 1н соляной кислоты и лиофилизируют, получая 80 мг N-[(7-амидино-2-нафтил)метил]-N-[4-[(4-пиперидил)-окси]фенил]-2- метоксибензамиддигидрохлорида.
Данные масс-спектра (m/z): 509 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.62-1.74 (2Н, m), 1.90-2.00 (2Н, m), 2.87-3.00 (2H, m), 3.02-3.14 (2Н, m), 3.81 (3H, s), 4.41-4.50 (1H, m), 5.22 (2Н, s), 6.69 (2Н, d, J= 9.2Hz), 6.83 (2Н, d, J=8.6Hz), 6.95 (2Н, d, J=9.2Hz), 7.20-7.24 (1H, m), 7.27 (1H, d, J=7.9Hz), 7.73-7.75 (1H, m), 7.84 (1H, d, J=8.6Hz), 7.99 (1H, s), 8.07 (1H, d, J=8.6Hz), 8.13 (1H, d, J=8.5Hz), 8.50 (1H, s), 9.10 (1H, brs), 9.20 (1H, brs), 9.36 (2Н, s), 9.57 (2Н, s)
Следующее соединение ПРИМЕРА 33 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 33
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил) метил]-2-метоксибензамида дигидрохлорид.
Исходное соединение: N-[(7- амидино-2-нафтил)метил] -N-[[(4-пиперидил)окси]фенил]-2- метоксибензамида дигидрохлорид.
Данные масс-спектра (m/z): 550 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.44-1.62 (2H, m), 1.82-1.86 (2Н, m), 2.26 (3H, s), 3.40-3.46 (2Н, m), 3.63-3.79 (2H, m), 3.70 (3H, m), 4.46-4.50 (1H, m), 5.23 (2Н, s), 6.69 (2Н, d, J=9.2Hz),6.83 (2Н, d, J=7.9Hz), 6.95 (2Н, d, J=8.5Hz), 7.20 (1H, t, J= 8.6Hz), 7.27 (1H, d, J=7.3Hz), 7.23 (1H, d, J=8.6Hz), 7.85 (1H, d, J= 8.5Hz), 7.99 (1H, s), 8.08 (1H, d, J=8.6Hz), 8.13 (1H, d, J=8.5Hz), 8.52 (1H, s), 8.86 (1H, s), 9.41 (3H, s), 9.60 (2Н, s)
Следующее соединение ПРИМЕРА 34 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 34
N-[(7-амидино-2-нафтил)метил] -N-[[(4-пиперидил)окси] фенил]-4- метоксибензамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-N-[(7-циано-2-нафтил)метил] -4-метоксибензамид.
Данные масс-спектра (m/z): 509 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.70-1.81 (2Н, m), 1.96-2.07 (2H, m), 2.96-3.00 (2Н, m), 3.07-3.18 (2Н, m), 3.71 (3H, s), 4.48-4.56 (1H, m), 5.26 (2Н, s), 6.79 (2Н, d, J= 8.6Hz), 6.82 (2Н, d, J=9.2Hz), 7.03 (2Н, d, J=8.6Hz), 7.31 (2Н, d, J=8.6Hz), 7.67 (1H, d, J=9.8Hz), 7.84 (1H, d, J=6.7Hz), 7.95 (1H, s), 8.02 (1H, d, J= 8.5Hz), 8.10 (1H, d, J=8.5Hz), 8.54 (1H, s), 9.24 (1H, brs), 9.33 (1H, brs), 9.41 (2Н, s), 9.58 (2Н, s).
Следующее соединение ПРИМЕРА 35 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 35
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]-4-метоксибензамида дигидрохлорид.
Исходное соединение: N-[(7- амидино-2-нафтил)метил] -N-[4-(4-пиперидил)окси]фенил]-4- метоксибензамида дигидрохлорид.
Данные масс-спектра (m/z): 550 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.55-1.68 (2Н, m), 1.86-2.00 (2Н, m), 2.27 (3Н, s), 3.41-3.49 (2Н, m), 3.66-3.78 (2Н, m), 3.72 (3Н, s), 4.54-4.60 (1Н, m), 5.26 (2Н, s), 6.79 (2Н, d, J=9.2Hz), 6.82 (2Н, d, J=9.2Hz), 7.03 (2Н, d, J=8.5Hz), 7.31 (2Н, d, J= 8.6Hz), 7.68 (1H, t, J=10.4Hz), 7.82 (1Н, d, J=8.5Hz), 7.95 (1H, s), 8.02 (1H, d, J= 8.5Hz), 8.10 (1H, d, J=8.6Hz), 8.52 (1H, s), 8.85 (1H, s), 9.37 (3Н, s), 9.55 (2Н, s).
Следующее соединение ПРИМЕРА 36 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 36
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил) окси]фенил]-4-пиридинкарбоксамида тригидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано-2- нафтил)метил] -4-пиридинкарбоксамид.
Данные масс-спектра (m/z): 480 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.68-1.78 (2Н, m), 1.92-2.01 (2Н, m), 2.84-3.00 (2Н, m), 3.02-3.18 (2H, m), 4.44-4.57 (1H, m), 5.30 (2H, s), 6.80 (2Н, d, J=9.2Hz), 7.15 (2Н, d, J= 8.5Hz), 7.74 (1H, d, J=8.6Hz), 7.85-7.87 (3H, m), 8.01 (1H, s), 8.05 (1H, d, J=8.5Hz), 8.13 (1H, d, J=8.5Hz), 8.60 (1H, s), 8.78 (2Н, brs), 9.28 (2Н, brs), 9.37 (1H, brs), 9.44 (2Н, s), 9.62 (2Н, s)
Следующее соединение ПРИМЕРА 37 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 37
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил) метил]-4-пиридинкарбоксамида тригидрохлорид.
Исходное соединение: N-[(7- амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси]фенил]-4- пиридинкарбоксамида тригидрохлорид.
Данные масс-спектра (m/z): 521 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.55-1.62 (2Н, m), 1.92-2.02 (2Н, m), 2.28 (3H, s), 3.40-3.50 (2Н, m), 3.64-3.81 (2Н, m), 4.54-4.57 (1H, m), 5.31 (2Н, s), 6.81 (2Н, d, J= 8.5Hz), 7.16 (2Н, d, J=8.5Hz), 7.75 (1H, d, J=8.5Hz), 7.87 (1H, d, J=8.5Hz), 8.00 (2H, br), 8.06 (1H, d, J=8.5Hz), 8.13 (1H, d, J=8.5Hz), 8.63 (1H, s), 8.46 (2Н, br), 8.85 (1H, s), 9.50 (3H, s), 9.68 (2Н, s)
Следующее соединение ПРИМЕРА 38 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 38
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси] фенил]-2-пиридинкарбоксамида тригидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]-2-пиридинкарбоксамид.
Данные масс-спектра (m/z): 480 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.62-1.78 (2Н, m), 1.89-2.05 (2Н, m), 2.88-3.00 (2H, m), 3.04-3.16 (2Н, m), 4.00-4.10 (1H, m), 5.28 (2Н, s), 6.75 (2Н, d, J=8.5Hz), 7.03 (2Н, d, J= 8.5Hz), 7.32-7.41 (1H, m), 7.56-7-.64 (1H, m), 7.73 (1H, d, J=8.6Hz), 7.76 (1H, d, J=8.6Hz), 7.80-7.89 (1H, m), 8.00 (1H, s), 8.05-8.09 (1H, m), 8.09 (1H, d, J=8.5Hz), 8.43 (1H, s), 8.56 (1H, s), 9.12 (2Н, brs), 9.26 (3H, brs), 9.38 (2Н, s), 9.57 (2Н, s).
Следующее соединение ПРИМЕРА 39 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 39
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]-2-пиридинкарбоксамида тригидрохлорид.
Исходное соединение: N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]-2-пиридинкарбоксамида тригидрохлорид.
Данные масс-спектра (m/z): 521 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO- d6 внутренний стандарт - ТМС):
δ: 1.52-1.64 (2H, m), 1.86-1.97 (2H, m), 2.25 (3H, s), 3.36-3.48 (2H, m), 3.60-3.79 (2H, m), 4.46-4.52 (1H, m), 5.27 (2H, s), 6.67-6.75 (2H, br), 6.91-7.00 (2H, m), 7.22-7.28 (1H, br), 7.51-7.58 (1H, br), 7.72 (1H, d, J= 8.5Hz), 7.76 (2H, d, J=7.9Hz), 7.95 (1H, s), 8.02-8.04 (1H, br), 8.09 (1H, d, J= 8.5Hz), 8.36 (1H, s), 8.57 (1H, s), 8.72 (1H, s), 9.28 (3H, s), 9.50 (2H, s)
Следующее соединение ПРИМЕРА 40 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 40
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил] -2-метоксиацетамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси] фенил]-N-[(7-циано-2-нафтил)метил] -2-метоксиацетамид.
Данные масс-спектра (m/z): 447 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.78-1.84 (2Н, m), 2.01-2.10 (2H, m), 2.97-3.05 (2H, m), 3.10-3.1.9 (2H, m), 3.83 (3H, s), 4.57-4.62 (1H, m), 5.00 (2H, s), 6.95 (2H, d, J= 9.2Hz), 7.15 (2H, d, J=8.5Hz), 7.59 (1H, d, J=8.6Hz), 7.82 (1H, d, J=6.7Hz), 7.86 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.11 (1H, d, J=8.6Hz), 8.48 (1H, s), 9.19 (1H,brs), 9.26 (1H, brs), 9.35 (2H, s), 9.54 (2H, s)
Следующее соединение ПРИМЕРА 41 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 41
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] - N-[(7-амидино-2-нафтил)метил]-2-метоксиацетамида дигидрохлорид.
Исходное соединение: N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]-2-метоксиацетанилида дигидрохлорид.
Данные масс-спектра (m/z): 488 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.60-1.78 (2Н, m), 1.96-2.03 (2H, m), 2.28 (3H, s), 3.25 (3H, s), 3.40-3.58 (2Н, m), 3.60-3.75 (2Н, m), 3.83 (2Н, s), 4.60-4.68 (1H, m), 5.03 (2Н, s), 6.95 (2Н, d, J= 9.2Hz), 7.15 (2Н, d, J=8.5Hz), 7.59 (1H, d, J= 8.6Hz), 7.82 (1H, d, J=8.5Hz), 7.86 (1H, s), 8.02 (1H, d, J=8.5Hz), 8.11 (1H, d, J=8.6Hz), 8.46 (1H, s), 8.83 (1H, s), 8.33 (3H, s), 9.53 (2Н, s).
Следующее соединение ПРИМЕРА 42 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 42
Этил-N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]-фенил]малонамата дигидрохлорид.
Исходное соединение: этил-N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-N-[(7-циано-2-нафтил)метил]малонамата дигидрохлорид.
Данные масс-спектра (m/z): 489 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.37 (3H, t, J=6.7Hz), 1.74-1.83 (2Н, m), 2.01-2.10 (2H, m), 2.96-3.03 (2Н, m), 3.10-3.21 (2H, m), 3.30 (2Н, s), 4.02 (2Н, q, J=7.3Hz), 4.56-4.62 (1H, m), 5.05 (2Н, s), 6.96 (2H, d, J=8.6Hz), 7.14 (2H, d, J= 6.1Hz), 7.63 (1H, d, J=6.7Hz), 7.76 (1H, d, J=7.3Hz), 7.85 (1H, s), 8.03 (1H, d, J=8.5Hz), 8.11 (1H, d, J=8.6Hz), 8.49 (1H, s), 9.20 (1H, brs), 9.29 (1H, brs), 9.39 (2Н, s), 9.57 (2Н, s).
Следующее соединение ПРИМЕРА 43 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 43
Этил-N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил малонамата дигидрохлорид.
Исходное соединение: этил-N-[(7-амидино-2-нафтил)метил] - N-[4-[(4-пиперидил)окси]фенил]малонамата дигидрохлорид.
Данные масс-спектра (m/z): 530 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.14 (3Н, t, J=7.3Hz), 1.60-1.75 (2Н, m), 1.95-2.06 (2Н, m), 2.27 (3H, s), 3.29 (2Н, s), 3.38-3.55 (2H, m), 3.64-3.83 (2Н, m), 4.01 (2Н, q, J= 7.3Hz), 4.60-4.64 (1H, m), 5.07 (2Н, s), 6.96 (2Н, d, J=8.6Hz), 7.13 (2Н, d, J= 9.2Hz), 7.62 (1H, d, J=8.5Hz), 7.81 (1H, d, J=8.5Hz), 7.87 (1H, s), 8.03 (1H, d, J= 8.5Hz), 8.12 (1H, d, J=8.6Hz), 8.43 (1H, s), 8.76 (1H, s), 8.26 (3H, s), 9.50 (2Н, s).
Следующее соединение ПРИМЕРА 44 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 44
Этил-N-[(7-амидино-2- нафтил)метил]-N-[4-[(4-пиперидил)окси]-фенил]сукцинамата дигидрохлорид.
Исходное соединение: этил-N-[4-[(1-трет- бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано-2- нафтил)метил]сукцинамата дигидрохлорид.
Данные масс-спектра (m/z): 503 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.18 (3Н, t, J=6.7Hz), 1.78-1.84 (2Н, m), 2.04-2.14 (2H, m), 2.34 (2Н, t, J=6.1Hz), 2.56 (2Н, t, J=6.1Hz), 2.94-3.06 (2Н, m), 3.12-3.22 (2Н, m), 4.06 (2Н, q, J=6.7Hz), 4.56-4.64 (1H, m), 5.03 (2Н, s), 6.98 (2Н, d, J= 9.2Hz), 7.15 (2Н, d, J=8.6Hz), 7.58 (1H, d, J=9.2Hz), 7.83-7.85 (2Н, m), 8.01 (1H, d, J=8.6Hz), 8.08-8.12 (1H, m), 8.48 (1H, s), 9.29 (1H, brs), 9.38 (1H, brs), 9.41 (2Н, s), 9.58 (2H, s)
Следующее соединение ПРИМЕРА 45 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 45
Этил-N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]сукцината дигидрохлорид.
Исходное соединение: этил-N-[(7-амидино-2-нафтил)метил]-N-[4-[(4-пиперидил)окси]фенил] сукцинамата дигидрохлорид.
Данные масс-спектра (m/z): 544 (M-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.18 (3Н, t, J=6.7Hz), 1.61-1.76 (2H, m), 1.96-2.08 (2Н, m), 2.29 (3Н, s), 2.34 (2Н, t, J=6.1Hz), 2.55 (2Н, t, J=6.1Hz), 3.43-3.55 (2Н, m), 3.64-3.86 (2Н, m), 4.06 (2Н, q, J=6.7Hz), 4.60-4.69 (1H, m), 5.03 (2Н, s), 6.98 (2Н, d, J= 9.15Hz), 7.14 (2Н, d, J=8.6Hz), 7.58 (1H, d, J=8.5Hz), 7.80-7.92 (2Н, m), 8.01 (1H, d, J=8.6Hz), 8.11 (1H, d, J=8.6Hz), 8.48 (1H, s), 8.93 (1H, s), 9.43 (3Н, s), 9.59 (2Н, s).
Следующее соединение ПРИМЕРА 46 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 46
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил]- 2,6-дифторбензамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N- [(7-циано-2-нафтил)метил]-2,6-дифторбензамида дигидрохлорид.
Данные масс-спектра (m/z): 515 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.64-1.72 (2Н, m), 1.91-2.00 (2Н, m), 2.87-3.00 (2H, m), 3.02-3.17 (2Н, m), 4.41-4.50 (1H, m), 5.27 (1H, s), 6.79 (2Н, d, J=8.6Hz), 6.97-7.03 (4H, m), 7.35-7.38 (1H, m), 7.67 (1H, d, J=9.8Hz), 7.86 (1H, d, J=8.6Hz), 7.93 (1H, s), 8.10 (1H, d, J=8.5Hz), 8.14 (1H, d, J=8.6Hz), 8.47 (1H, s), 9.08 (1H, brs), 9.19 (1H, brs), 9.34 (2Н, s), 9.55 (2Н, s).
Следующее соединение ПРИМЕРА 47 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 47
N-[4-[(1-ацетоимидоил-4- пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]-2,6-дифторбензамида дигидрохлорид.
Исходное соединение: N-[(7-амидино-2-нафтил)метил]-N-[4-[(4-пиперидил) окси]фенил]-2,6-дифторбензамида дигидрохлорид.
Данные масс-спектра (m/z): 556 (М - 2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.54-1.61 (2Н, m), 1.85-1.96 (2Н, m), 2.28 (3H, s), 3.38-3.45 (2Н, m), 3.63-3.73 (2H, m), 4.50-4.57 (1H, m), 5.26 (2Н, s), 6.80 (2H, d,J= 9.2Hz), 6.97-7.03 (4Н, m), 7.34-7.38 (1H, m), 7.67 (1H, d, J=8.5Hz), 7.84 (1H, d, J= 8.5Hz), 7.93 (1H, s), 8.09 (1H, d, J=8.5Hz), 8.14 (1H, d, J= 8.6Hz), 8.46 (1H, s), 8.75 (1H, s), 9.28 (3H, s), 9.52 (2Н, s).
Следующее соединение ПРИМЕРА 48 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 48
N-[(7-амидино-2-нафтил) метил]-N-[4-[(4-пиперидил)окси]фенил]-2-диметиламиноацетамида тригидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано-2- нафтил)метил]-2-диметиламиноацетамид.
Данные масс-спектра (m/z): 460 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.77-1.89 (2Н, m), 2.01-2.14 (2H, m), 2.82 (6H, s), 2.96-3.08 (2Н, m), 3.11-3.23 (2Н, m), 3.97 (2Н, s), 4.41-4.45 (1H, m), 5.07 (2Н, s), 7.02 (2Н, d, J= 9.3Hz), 7.22 (2Н, d, J=8.8Hz), 7.50 (1H, d, J=8.8Hz), 7.79 (1H, s), 7.94-7.96 (3H, m), 8.45 (1H, s), 9.43 (2Н, brs), 9.49 (1H, brs), 9.99 (4H, s).
Следующее соединение ПРИМЕРА 49 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 49
N-[4-[(1-ацетоимидоил-4- пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]-2- диметиламиноацетамида тригидрохлорид.
Исходное соединение: N-[(7- амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси]фенил]-2- диметиламиноацетамида тригидрохлорид.
Данные масс-спектра (m/z): 501 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.64-1.73 (2Н, m), 1.93-2.10 (2Н, m), 2.31 (3H, s), 2.82 (6Н, s), 3.46-3.61 (2Н, m), 3.69-3.86 (2Н, m), 3.98 (2Н, s), 4.68-4.69 (1H, m), 5.24 (2Н, s), 7.02 (2Н, d, J=8.8Hz), 7.21 (2Н, d, J=8.8Hz), 7.43-7.55 (2Н, m), 7.78 (1H, s), 7.93-7.95 (2Н, m), 8.11-8.18 (1H, brs), 8.45 (1H, s), 9.05 (1H, s), 9.54 (1H, s), 10.03 (1H, s).
Следующее соединение ПРИМЕРА 50 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 50
Этил-N-[(7- амидино-2-нафтил)метил]карбамоил]-N-[N-[4-(4-пиперидил)окси] фенил]карбоната дигидрохлорид.
Исходное соединение: этил-N-[N-[4-(1-трет- бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано-2- нафтил)метил]карбамоил]карбоната.
Данные масс-спектра (m/z): 490 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.12 (3Н, t, J=6.7Hz), 1.74-1.82 (2Н, m), 2.01-2.10 (2H, m), 2.98-3.03 (2Н, m), 3.10-3.19 (2H, m), 4.01 (2Н, q, J=6.7Hz), 4.56-4.62 (1H, m), 5.02 (2H, s), 6.93 (2H, d, J=9.2Hz), 7.13 (2Н, d, J=8.5Hz), 7.62 (1H, d, J= 8.5Hz), 7.75 (1H, d, J=6.7Hz), 7.86 (1H, s), 8.00 (1H, d, J=8.6Hz),8.07 (1H, d, J= 7.9Hz), 8.51 (1H, s), 8.89 (1H, s), 9.12 (1H, brs), 9.20 (1H, brs), 9.32 (2Н, s), 9.51 (2Н, s).
Следующее соединение ПРИМЕРА 51 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 51
Этил-N-[N-[4-(1-ацетоимидоил-4- пиперидил)окси]фенил]-N-[(7-амидино-2-нафтил)метил]карбамоил] карбоната дигидрохлорид.
Исходное соединение: этил-N-[(7- амидино-2-нафтил)метил]карбамоил]-N-[N-[4-(4- пиперидил)окси]фенил]карбоната дигидрохлорид.
Данные масс-спектра (m/z): 531 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.12 (3Н, t, J=7.3Hz), 1.71-1.75 (2Н, m), 1.94-2.08 (2Н, m), 2.28 (3Н, s), 3.48-3.54 (2Н, m), 3.69- 3.83 (2Н, m), 4.01 (2Н, q, J=7.3Hz), 4.60-4.68 (1H, m), 5.03 (2Н, s), 6.94 (2Н, d, J=9.3Hz), 7.12 (2Н, d, J= 8.8Hz), 7.60 (1H, d, J=9.8Hz), 7.81 (1H, d, J=6.8Hz), 7.90 (1H, s), 8.01 (1H, d, J= 8.8Hz), 8.11 (1H, d, J=8.8Hz), 8.45 (1H, s), 8.82 (1H, s), 8.97 (1H, s), 9.29 (3Н, s), 9.52 (2Н, s).
Следующее соединение ПРИМЕРА 52 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 52
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)-окси] фенил] бензолсульфонамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил- 4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]бензолсульфонамид.
Данные масс-спектра (m/z): 515 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.68-1.80 (2Н, m), 1.97-2.07 (2Н, m), 2.93-3.06 (2Н, m), 3.10-3.22 (2Н, m), 4.50-4.57 (1H, m), 4.99 (2Н, s), 6.84 (2Н, d, J=8.5Hz), 6.98 (2Н, d, J= 9.2Hz), 7.64-7.72 (5H, m), 7.76 (1H, t, J=7.3Hz), 7.81 (1H, d, J= 8.5Hz), 7.92 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.08 (1H, d, J=8.6Hz), 8.45 (1H, s), 9.04 (1H, brs), 9.11 (1H, brs), 9.28 (2Н, s), 9.50 (2Н, s).
Следующее соединение ПРИМЕРА 53 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 53
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]бензолсульфонамида дигидрохлорид.
Исходное соединение: N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]бензолсульфонамида дигидрохлорид.
Данные масс-спектра (m/z): 556 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.58-1.70 (2H, m), 1.91-2.03 (2Н, m), 2.27 (3H, s), 3.42-3.49 (2Н, m), 3.67-3.77 (2H, m), 4.58-4.61 (1H, m), 4.99 (2H, s), 6.84 (2H, d, J= 9.2Hz), 6.98 (2H, d, J=8.5Hz), 7.64-7.76 (6H, m), 7.82 (1H, d, J=10.4Hz), 7.92 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.09 (1H, d, J=8.5Hz), 8.46 (1H, s), 8.81 (1H, s), 9.34 (3H, s), 9.53 (2H, s).
Следующее соединение ПРИМЕРА 54 получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 54
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил) метил]метансульфонамида дигидрохлорид.
Исходное соединение: N-[4-[(1- трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2- нафтил)метил]метансульфонамид.
Данные масс-спектра (m/z): 494 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.60-1.74 (2Н, m), 1.94-2.03 (2H, m), 2.27 (3H, s), 3.13 (3H, s), 3.43-4.55 (2Н, m), 3.63-3.73 (1H, m), 3.73-3.80 (1H, m), 4.60-4.65 (1H, m), 5.03 (2Н, s), 6.93 (2Н, d, J=9.2Hz), 7.34 (2Н, d, J=8.5Hz), 7.66 (1H, dd, J= 8.6, 1.2Hz), 7.81 (1H, dd, J=8.6, 1.8Hz), 7.91 (1H, s), 8.01 (1H, d, J= 8.6Hz), 8.09 (1H, d, J=8.5Hz), 8.47 (1H, s), 8.74 (1H, s), 9.20-9.11 (3H, m), 9.48 (2Н, s).
Следующее соединение ПРИМЕРА 55 получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 55
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил) метил]бензилсульфонамида дигидрохлорид.
Исходное соединение: N-[4-[(1- трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил) метил]бензилсульфонамид.
Данные масс-спектра (m/z): 570 (М-2HCl + 1)6.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.61-1.74 (2Н, m), 1.94-2.04 (2Н, m), 2.27 (3H, s), 3.42-3.55 (2Н, m), 3.64-3.80 (2Н, m), 4.58-4.62 (1H, m), 4.62 (2Н, s), 4.97 (2Н, s), 6.88 (2Н, d, J=9.2Hz), 7.22 (2Н, d, J=9.2Hz), 7.39-7.5.1 (5H, m), 7.62 (1H, dd, J= 1.2, 8.6Hz), 7.75 (1H, dd, J=1.5, 8.9Hz), 7.89 (1H, s), 8.00 (1H, d, J= 8.5Hz), 8.09 (1H, d, J=8.6Hz), 8.45 (1H, s), 8.72 (1H, bs), 9.16-9.29 (3H, m), 9.47 (2Н, bs).
Следующее соединение ПРИМЕРА 56 получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 56
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]пропансульфонамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пипеpидил)oкcи]фенил]- N-[(7-циано-2-нафтил)метил]пропансульфонамид.
Данные масс-спектра (m/z): 522 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.03 (3Н, t, J=7.6Hz), 1.60-1.73 (2H, m), 1.74-1.85 (2Н, m), 1.93-2.03 (2H, m), 2.27 (3H, s), 3.21-3.25 (2H, m), 3.42-3.56 (2H, m), 3.63-3.71 (1H, m), 3.75-3.82 (1H, m), 4.59-4.63 (1H, m), 5.05 (2H, s), 6.92 (2H, d, J= 8.5Hz), 7.33 (2H, d, J=8.5Hz), 7.66 (1H, dd, J=8.6, 1.2Hz), 7.82 (1H, dd, J= 8.5, 1.8Hz), 7.89 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.09 (1H, d, J=8.5Hz), 8.48 (1H, s), 8.80 (1H, s), 9.28-9.38 (3H, m), 9.52 (2H, s).
Следующее соединение ПРИМЕРА 57 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 57
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил] - бутансульфонамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано-2-нафтил) метил]бутансульфонамид.
Данные масс-спектра (m/z): 495 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.92 (3Н, t, J=7.3Hz), 1.41-1.46 (2H, m), 1.70-1.82 (2H, m), 2.03-2.06 (4H, m), 2.92-3.04 (2H, m), 3.10-3.20 (2H, m), 3.24 (2H, t, J=7.9Hz), 4.52-4.60 (1H, m), 5.06 (2H, s), 6.91 (2H, d, J=9.2Hz), 7.33 (2H, d, J= 9.2Hz), 7.65 (1H, d, J=8.6Hz), 7.80 (1H, d, J=8.6Hz), 7.89 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.09 (1H, d, J=8.6Hz), 8.46 (1H, s), 9.02 (1H, brs), 9.10 (1H, brs), 9.27 (2H, s), 9.49 (2H, s).
Следующее соединение ПРИМЕРА 58 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 58
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] - N-[(7-амидино-2-нафтил)метил]бутансульфонамида дигидрохлорид.
Исходное соединение: N-[(7-aмидинo-2-нaфтил)метил] -N-[4-(4- пиперидил)окси]фенил]бутансульфонамида дигидрохлорид.
Данные масс-спектра (m/z): 536 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.92 (3Н, t, J=7.3Hz), 1.41-1.46 (2H, m), 1.62-1.78 (4Н, m), 1.91-2.01 (2H, m), 2.27 (3Н, s), 3.24 (2H, t, J=7.9Hz), 4.58-4.62 (1H, m), 5.06 (2H, s), 6.91 (2H, d, J= 9.2Hz), 7.33 (2H, d, J=9.2Hz), 7.65 (1H, d, J= 8.5Hz), 7.80 (1H, d, J=6.7Hz), 7.90 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.09 (1H, d, J=8.5Hz), 8.46 (1H, s), 7.12 (1H, s), 9.22 (3Н, s), 9.47 (2H, s).
Следующее соединение ПРИМЕРА 59 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 59
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил]- трифторметансульфонамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2- нафтил)метил]трифторметансульфонамид.
Данные масс-спектра (m/z): 507 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.72-1.81 (2H, m), 1.97-2.08 (2H, m), 2.96-3.06 (2H, m), 3.09-3.20 (2H, m), 4.56-4.62 (1H, m), 5.25 (2H, s), 6.95 (2H, d, J=9.2Hz), 7.29 (2H, d, J= 9.2Hz), 7.61 (1H, d, J=8.5Hz), 7.85 (1H, d, J=8.5Hz), 7.91 (1H, s), 8.03 (1H, d, J=7.9Hz), 8.11 (1H, d, J=9.2Hz), 8.51 (1H, s), 9.13 (1H, brs), 9.21 (1H, brs), 9.35 (2H, s), 9.54 (2H, s).
Следующее соединение ПРИМЕРА 60 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 60
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил] трифторметансульфонамида дигидрохлорид.
Исходное соединение: N-[(7-амидино-2-нафтил)метил] -N-[4-(4- пиперидил)окси]фенил]трифторметансульфонамида дигидрохлорид.
Данные масс-спектра (m/z): 548 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.60-1.74 (2Н, m), 1.92- 2.05 (2Н, m), 2.26 (3H, s), 3.44-3.50 (2Н, m), 3.67-3.76 (2Н, m), 4.63-4.65 (1H, m), 5.25.(2Н, s), 6.95 (2Н, d, J= 9.2Hz), 7.30 (2Н, d, J=9.2Hz), 7.60 (1H, d, J=6.7Hz), 7.83 (1H, d, J=7.3Hz), 7.92 (1H, s), 8.04 (1H, d, J=8.6Hz), 8.12 (1H, d, J=8.6Hz), 8.48 (1H, s), 8.68 (1H, s), 9.20 (3H, s), 9.47 (2Н, s)
Следующее соединение ПРИМЕРА 61 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 61
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил) окси]фенил]-изопропансульфонамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси]фенил]-N-[(7-циано-2-нафтил)метил]изопропансульфонамид.
Данные масс-спектра (m/z): 481 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.35 (6Н, d, J=6.4Hz), 1.69-1.80 (2Н, m), 1.96-2.06 (2H, m), 2.94-3.06 (2Н, m), 3.11-3.27 (3H, m), 4.50-4.57 (1H, m), 5.11 (2Н, s), 6.89 (2H, d, J= 8.8Hz), 7.33 (2H, d, J=8.8Hz), 7.64 (1H, d, J=8.3Hz), 7.79 (1H, d, J= 8.8Hz), 7.88 (1H, s), 8.01 (1H, d, J=8.8Hz), 8.09 (1H, d, J=8.8Hz), 8.44 (1H, s), 8.81 (1H, brs), 8.86 (1H, brs), 9.15 (2Н, s), 9.45 (2Н, s).
Следующее соединение ПРИМЕРА 62 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 62
N-[4-[(1-ацетоимидоил-4- пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил] изопропансульфонамида дигидрохлорид.
Исходное соединение: N-[(7-амидино-2-нафтил)метил] -N-[4-(4- пиперидил)окси]фенил]изопропансульфонамида дигидрохлорид.
Данные масс-спектра (m/z): 522 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.35. (d, 6Н, J=6.8Hz), 1.60-1.73 (2H, m), 1.92-2.01 (2Н, m), 2.26 (3H, s), 3.03-3.10 (1H, m), 3.40-3.49 (2H, m), 3.67-3.76 (2Н, m), 4.60-4.67 (1H, m), 5.11 (2Н, s), 6.90 (2Н, d, J=9.3Hz), 7.32 (2Н, d, J=9.3Hz), 7.64 (1H, d, J= 8.8Hz), 7.80 (1H, d, J=6.8Hz), 7.88 (1H, s), 8.01 (1H, d, J= 8.3Hz), 8.09 (1H, d, J=8.8Hz), 8.46 (1H, s), 8.72 (1H, s), 9.23 (3H, s), 9.58 (2Н, s).
Следующее соединение ПРИМЕРА 63 получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 63
Этил-N-[N-[4-(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]сульфамоил]карбамата дигидрохлорид.
Исходное соединение: этил-N-[N-[4-(1-трет-бутоксикарбонил-4-пиперидил) окси]фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]-карбамат.
Данные масс-спектра (m/z): 567 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.27 (3Н, t, J=7.3Hz), 1.60-1.75 (2Н, m), 1.95-2.03 (2Н, m), 2.27 (3Н, s), 3.41-3.57 (2Н, m), 3.63-3.73 (1H, m), 3.73-3.82 (1H, m), 4.23 (2Н, q, J= 7.3Hz), 4.60-4.67 (1H, m), 5.17 (2Н, s), 6.96 (2Н, d, J=9.2Hz), 7.23 (2Н, d, J= 8.5Hz), 7.65 (1H, d, J=7.3Hz), 7.82 (1H, d, J=8.5Hz), 7.91 (1H, s), 8.03 (1H, d, J=8.5Hz), 8.10 (1H, d, J=8.5Hz), 8.47 (1H, s), 8.81 (1H, bs), 9.23-9.40 (3Н, m), 9.51 (2Н, s), 11.52 (1H, s).
Следующее соединение ПРИМЕРА 64 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 64
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] - фенил]-4-нитробензолсульфонамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]-4- нитробензолсульфонамид.
Данные масс-спектра (m/z): 560 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.71-1.82 (2Н, m), 2.00-2.08 (2Н, m), 2.91-3.03 (2Н, m), 3.08-3.19 (2Н, m), 4.51-4.60 (1Н, m), 5.03 (2Н, s), 6.86 (2Н, d, J=8.6Hz), 7.02 (2Н, d, J= 9.2Hz), 7.66 (1H, d, J=8.6Hz), 7.83 (1Н, d, J=6.7Hz), 7.90 (1H, s), 7.98 (2H, d, J=8.6Hz), 8.02 (1H, d, J=8.5Hz), 8.09 (1H, d, J=8.5Hz), 8.45 (2Н, d, J= 9.2Hz), 8.48 (1H, s), 9.22 (1H, brs), 9.29 (1H, brs), 9.38 (2Н, s), 9.56 (2Н, s).
Следующее соединение ПРИМЕРА 65 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 65
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил) метил]-4-нитробензолсульфонамида дигидрохлорид.
Исходное соединение: N-[(7-амидино-2-нафтил)метил] -N-[4-(4- пиперидил)окси]фенил]-4-нитробензолсульфонамида дигидрохлорид.
Данные масс-спектра (m/z): 601 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.63-1.68 (2Н, m), 1.84-2.02 (2H, m), 2.27 (3H, s), 3.47-3.51 (2Н, m), 3.66-3.79 (2Н, m), 4.58-4.62 (1H, m), 5.03 (2Н, s), 6.86 (2Н, d, J= 8.5Hz), 7.02 (2Н, d, J=9.2Hz), 7.66 (1H, d, J=8.5Hz), 7.83 (1H, d, J=8.6Hz), 7.91 (1H, s), 7.98 (1H, d, J=9.2Hz), 8.02 (1H, d, J=8.5Hz), 8.09 (1H, d, J= 8.6Hz), 8.45-8.48 (3H, m), 8.82 (1H, s), 9.34 (3H, s), 9.54 (2Н, s).
Следующее соединение ПРИМЕРА 66 получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 66
Этил-4-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино- 2-нафтил)метил]сульфамоил]бензоата дигидрохлорид.
Исходное соединение: 4-N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]-бензойная кислота.
Данные масс-спектра (m/z): 628 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.37 (3Н, t, J=7.0Hz), 1.57-1.73 (2Н, m), 1.92-2.02 (2Н, m), 2.26 (3Н, s), 3.40-3.50 (2Н, m), 3.62-3.80 (2Н, m), 4.39 (2Н, q, J=7.0Hz), 4.55-4.62 (1H, m), 5.00 (2Н, s), 6.85 (2Н, d, J=9.2Hz), 6.99 (2Н, d, J= 8.6Hz), 7.66 (1H, d, J=8.6Hz), 7.81 (1H, dd, J=1.8, 9.2Hz), 7.85 (2Н, d, J= 8.5Hz), 7.92 (1H, s), 8.02 (1H, d, J=8.6Hz), 8.09 (1H, d, J=8.5Hz), 8.18 (2Н, d, J=8.6Hz), 8.44 (1H, s), 8.71 (1H, s), 9.13-9.27 (3Н, m), 9.47 (2Н, s).
Следующее соединение ПРИМЕРА 67 получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 67
Этил-3-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]сульфамоил]бензоата дигидрохлорид.
Исходное соединение: 3-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси] фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]бензойная кислота.
Данные масс-спектра (m/z): 628 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.33 (3Н, t, J=7.0Hz), 1.58-1.72 (2Н, m), 1.93-2.02 (2H, m), 2.26 (3Н, s), 3.41-3.52 (2H, m), 3.63-3.80 (2Н, m), 4.36 (2H, q, J=7.0Hz), 4.56-4.63 (1H, m), 4.99 (2Н, s), 6.86 (2Н, d, J=9.2Hz), 7.02 (2Н, d, J= 8.5Hz), 7.67 (1H, d, J=8.6Hz), 7.78-7.86 (2Н, m), 7.93 (1H, s), 7.99-8.03 (2Н, m), 8.05-8.12 (2Н, m), 8.30 (1H, d, J=7.9Hz), 8.44 (1H, s), 8.71 (1H, bs), 9.14-9.30 (3Н, m), 9.47 (2Н, s).
Следующее соединение ПРИМЕРА 68 получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 68
Метил-2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7- амидино-2-нафтил)метил]сульфамоил]бензоата дигидрохлорид.
Исходное соединение: метил-2-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси]фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]бензоат.
Данные масс-спектра (m/z): 614 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.57-1.73 (2Н, m), 1.91-2.02 (2Н, m), 2.26 (3Н, s), 3.41-3.51 (2Н, m), 3.63-3.80 (5Н, m), 4.55-4.62 (1Н, m), 5.08 (2Н, s), 6.87 (2Н, d, J= 9.2Hz), 7.08 (2Н, d, J=9.2Hz), 7.60-7.71 (4H, m), 7.75-7.84 (2Н, m), 7.93 (1Н, s), 8.02 (1H, d, J=8.5Hz), 8.10 (1Н, d, J=8.5Hz), 8.45 (1Н, s), 8.72 (1H, bs), 9.12-9.20 (3H, m), 9.48 (2Н, bs).
Следующее соединение ПРИМЕРА 69 получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 69
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил) метил]сульфонамида дигидрохлорид.
Исходное соединение: трет-бутил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N- [(7-циано-2-нафтил)метил]сульфамоил]карбамат.
Данные масс-спектра (m/z): 495 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.59-1.74 (2Н, m), 1.93-2.03 (2Н, m), 2.27 (3H, s), 3.43-3.57 (2Н, m), 3.63-3.71 (1H, m), 3.73-3.81 (1H, m), 4.56-4.63 (1H, m), 4.90 (2Н, s), 6.89 (2Н, d, J=9.2Hz), 7.20 (2Н, s), 7.27 (2Н, d, J=9.2Hz), 7.71 (1H, d, J= 7.6Hz), 7.80 (1H, dd, J=1.8, 8.6Hz), 7.92 (1H, s), 7.99 (1H, d, J=8.5Hz), 8.08 (1H, d, J=8.6Hz), 8.44 (1H, s), 8.80 (1H, bs), 9.24-9.37 (3H, m), 9.51 (2Н, s).
Следующее соединение ПРИМЕРА 70 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 70
Этил-[N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил]сульфамоил]ацетата дигидрохлорид.
Исходное соединение: этил-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано-2 -нафтил)метил]сульфамоил]ацетат.
Данные масс-спектра (m/z): 525 (М-2HCl+1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.26 (3Н, t, J=7.3Hz), 1.74-1.82 (2Н, m), 1.97-2.09 (2H, m), 2.97-3.04 (2Н, m), 3.10-3.21 (2H, m), 3.23 (2Н, q, J=6.7Hz), 4.43 (2Н, s), 4.51-4.62 (1H, m), 5.05 (2Н, s), 6.94 (2H, d, J=9.2Hz), 7.32 (2Н, d, J= 9.2Hz), 7.64 (1H, d, J=9.8Hz), 7.80 (1H, d, J=8.6Hz), 7.90 (1H, s), 8.01 (1H, d, J=9.2Hz), 8.09 (1H, d, J=8.5Hz), 8.46 (1H, s), 8.98 (1H, brs), 9.05 (1H, brs), 9.25 (2Н, s), 9.48 (2Н, s).
Следующее соединение ПРИМЕРА 71 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 71
Этил-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]сульфамоил]ацетата дигидрохлорид.
Исходное соединение: этил-[N-[(7-амидино-2-нафтил)метил]-N-[4-[(4-пиперидил)окси]фенил] сульфамоил]ацетата дигидрохлорид.
Данные масс-спектра (m/z): 566 (M-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.25 (3Н, t, J=7.3Hz), 1.61-1.74 (2Н, m), 1.94-2.04 (2H, m), 2.26 (3Н, s), 3.43-3.51 (2H, m), 3.64-3.78 (2Н, m), 4.23 (2H, q, J=7.3Hz), 4.43 (2H, s), 4.59-4.65 (1H, m), 5.05 (2H, s), 6.94 (2H, d, J=9.2Hz), 7.32 (2Н, d, J= 9.2Hz), 7.64 (1H, d, J=8.5Hz), 7.79 (1H, d, J=8.6Hz), 7.92 (1H, s), 8.01 (1H, d, J=8.0Hz), 8.10 (1H, d, J=8.5Hz), 8.45 (1H, s), 8.64 (1H, s), 9.12 (3Н, s), 9.43 (2Н, s).
Следующее соединение ПРИМЕРА 72 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 72
Этил-3-[N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил] сульфамоил]пропионата дигидрохлорид.
Исходное соединение: этил-3-[N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси] фенил] -N-[(7-циано-2-нафтил)метил] сульфамоил] -пропионата дигидрохлорид.
Данные масс-спектра (m/z): 539 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.20 (3Н, t, J=7.3Hz), 1.72-1.84 (2Н, m), 1.99-2.13 (2Н, m), 2.82 (2Н, t, J= 7.3Hz), 2.97-3.10 (2Н, m), 3.12-3.22 (2Н, m), 3.53 (2Н, t, J= 7.3Hz), 4.11 (2Н, q, J=6.7Hz), 4.56-4.62 (1H, m), 5.07 (2Н, s), 6.92 (2Н, d, J= 8.5Hz), 7.35 (2Н, d, J=8.6Hz), 7.64 (1H, d, J=8.5Hz), 7.82 (1H, d, J= 8.5Hz), 7.89 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.09 (1H, d, J=8.5Hz), 8.43 (1H, s), 9.12 (1H, brs), 9.21 (1H, brs), 9.33 (2Н, s), 9.52 (2Н, s).
Следующее соединение ПРИМЕРА 73 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 73
Этил-3-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]сульфамоил]пропионата дигидрохлорид.
Исходное соединение: этил-3-[N-[(7-амидино-2-нафтил)метил] -N-[4-(4- пиперидил)окси]фенил]сульфамоил]пропионата дигидрохлорид.
Данные масс-спектра (m/z): 580 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.20 (3Н, t, J=7.3Hz), 1.58-1.73 (2Н, m), 1.94-2.08 (2H, m), 2.29 (3Н, s), 2.82 (2H, t, J=7.3Hz), 3.47-3.49 (2Н, m), 3.53 (2Н, t, J=7.3Hz), 3.68-3.75 (2Н, m), 4.11 (2Н, q, J=7.3Hz), 4.58-4.64 (1H, m), 5.07 (2Н, s), 6.92 (2Н, d, J=8.6Hz), 7.35 (2Н, d, J=8.6Hz), 7.64 (1H, d, J=8.5Hz), 7.79 (1H, d, J= 8.6Hz), 7.90 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.09 (1H, d, J= 9.1Hz), 8.45 (1H, s), 8.66 (1H, s), 9.16 (3Н, s), 9.45 (2Н, s).
Следующее соединение ПРИМЕРА 74 получают тем же методом, что и соединение ПРИМЕРА 30.
ПРИМЕР 74
4-[N-[4-[(1-ацетоимидоил- 4-пиперидил)окси] -фенил] -N-[(7-амидино-2- нафтил)метил]сульфамоил]бензойной кислоты дигидрохлорид.
Исходное соединение: этил-4-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7-амидино-2-нафтил)метил]сульфамоил]бензоата дигидрохлорид.
Данные масс-спектра (m/z): 600 (M-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.57-1.72 (2Н, m), 1.91-2.02 (2Н, m), 2.26 (3H, s), 3.40-3.51 (2Н, m), 3.62-3.80 (2H, m), 4.55-4.62 (1H, m), 5.01 (2Н, s), 6.85 (2Н, d, J= 9.2Hz), 7.00 (2Н, d, J=9.2Hz), 7.67 (1H, d, J=9.5Hz), 7.77-7.85 (3H, m), 7.92 (1H, s), 8.02 (1H, d, J=8.6Hz), 8.09 (1H, d, J=8.5Hz), 8.16 (2Н, d, J= 8.6Hz), 8.45 (1H, s), 8.74 (1H, s), 9.18-9.34 (3H, m), 9.49 (2Н, s), 13.53 (1H, bs).
Следующее соединение ПРИМЕРА 75 получают тем же методом, что и соединение ПРИМЕРА 30.
ПРИМЕР 75
[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] -фенил]-N-[(7-амидино-2- нафтил)метил]сульфамоил]уксусной кислоты дигидрохлорид.
Исходное соединение: этил-[N-[4-[(1-ацетоимидоил-4- пиперидил)окси]фенил]-N-[(7-амидино-2-нафтил)метил]сульфамоил]-ацетата дигидрохлорид.
Данные масс-спектра (m/z): 538 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.61-1.75 (2Н, m), 1.92-2.04 (2Н, m), 2.27 (3H, s), 3.47-3.52 (2Н, m), 3.68-3.78 (2Н, m), 4.30 (2Н, s), 4.58-4.64 (1H, m), 5.05 (2Н, s), 6.94 (2Н, d, J=9.2Hz), 7.32 (2Н, d, J=8.5Hz), 7.65 (1H, d, J=8.6Hz), 7.82 (1H, d, J= 8.5Hz), 7.90 (1H, s), 8.01 (1H, d, J=8.6Hz), 8.09 (1H, d, J=9.2Hz), 8.48 (1H, s), 8.80 (1H, s), 9.33 (3H, s), 9.52 (2Н, s).
ПРИМЕР 76
N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] - N-[(7-циано-2-нафтил)метил] -4-нитробензолсульфонамид, полученный в ссылочном Примере 38 (450 мг), растворяют в 10 мл этилацетата, к раствору прибавляют 1,6 г дигидрата хлорида олова и смесь нагревают при температуре образования флегмы в течение 5 часов. Смесь охлаждают, прибавляют насыщенный водный раствор бикарбоната натрия и образовавшийся осадок фильтруют через целит. Органический слой последовательно промывают водой и рассолом, сушат над безводным сульфатом натрия и испаряют. Полученный сырой N-[(7- циано-2-нафтил)метил]-N-[4-[(4-пиперидил)окси] фенил] -4-аминобензол-сульфонамид растворяют в смешанном растворителе из 5 мл этанола и 5 мл хлороформа. Раствор при перемешивании охлаждают до -70oC и насыщают хлористым водородом. Смесь перемешивают при комнатной температуре в течение 2 суток и затем испаряют. Полученный остаток растворяют в 5 мл этанола, прибавляют 1 г ацетата аммония и смесь перемешивают в течение 4 суток при комнатной температуре. Реакционную смесь испаряют, остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A 120-230/70), используя в качестве элюента смесь метанол: вода (100:0), а затем добавляют небольшое количество 1н соляной кислоты и лиофилизируют, получая 109 мг N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]-4-аминобензол-сульфонамидтригидрохлорида.
Данные масс-спектра (m/z): 530 (M-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.71-1.80 (2H, m), 1.98-2.06 (2H, m), 2.91-3.02 (2H, m), 3.10-3.21 (2H, m), 4.51-4.57 (1H, m), 4.88 (2H, s), 6.69 (2H, d, J=9.15Hz), 6.83 (2H, d, J= 9.2Hz), 6.99 (2H, d, J=9.2Hz), 7.32 (2H, d, J=8.5Hz), 7.66 (1H, d, J= 8.5Hz), 7.79 (1H, d, J=8.6Hz), 7.90 (1H, s), 7.92 (1H, d, J=8.5Hz), 8.07 (1H, d, J= 8.6Hz), 8.43 (1H, s), 9.10 (1H, brs), 9.19 (1H, brs), 9.32 (2H, s), 9.51 (2H, s).
Следующее соединение ПРИМЕРА 77 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 77
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]- 4-аминобензолсульфонамида тригидрохлорид.
Исходное соединение:
N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси] фенил]- 4-аминобензолсульфонамида тригидрохлорид.
Данные масс-спектра (m/z): 571 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.57-1.72 (2Н, m), 1.91-2.02 (2H, m), 2.28 (3H, s), 3.40-3.53 (2H, m), 3.66-3.76 (2H, m), 4.20-4.25 (2H, br), 4.52-4.61 (1H, m), 4.87 (2H, s), 6.65 (2Н, d, J=8.8Hz), 6.83 (2H, d, J=8.8Hz), 6.99 (2H, d, J=8.8Hz), 7.30 (2Н, d, J=8.8Hz), 7.66. (1H, d, J=8.8Hz), 7.79 (1H, d, J=10.3Hz), 7.91 (1H, s), 7.98 (1H, d, J=8.8Hz), 8.07 (1H, d, J=8.3Hz), 8.43 (1H, s), 8.76 (1H, s), 9.27 (3H, s), 9.49 (2Н, s).
Следующее соединение ПРИМЕРА 78 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 78
N-[(7-амидино-2-нафтил)метил] -N'-метил-N- [4-[(4-пиперидил)-окси]фенил] сульфамида дигидрохлорид.
Исходное соединение: трет-бутил-N-[N-[4-[(1-трет-бутоксикарбонил-4- пиперидил)окси]фенил]-N-[(7-циано-2-нафтил)метил]-сульфамоил]- N-метилкарбамат.
Данные масс-спектра (m/z): 468 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.70-1.82 (2Н, m), 1.96-2.08 (2H, m), 2.67 (3H, d, J=4.9Hz), 2.93-3.06 (2Н, m), 3.11-3.21 (2H, m), 4.49-4.59 (1H, m), 4.96 (2H, s), 6.89 (2Н, d, J= 8.8Hz), 7.27 (2H, d, J=9.3Hz), 7.38-7.46 (1H, m), 7.65 (1H, d, J= 8.3Hz), 7.80 (1H, d, J=8.8Hz), 7.89 (1H, s), 7.99 (1H, d, J=8.3Hz), 8.08 (1H, d, J=8.8Hz), 8.43 (1H, s), 8.90-9.13 (2Н, m), 9.23 (2Н, s), 9.48 (2Н, s).
Следующее соединение ПРИМЕРА 79 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 79
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил] -N'-метилсульфамида дигидрохлорид.
Исходное соединение: N-[(7-амидино-2-нафтил)метил]-N'-метил-N-[4-[(4-пиперидил)окси]фенил] сульфамида дигидрохлорид.
Данные масс-спектра (m/z): 509 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.59-1.73 (2H, m), 1.92-2.03 (2H, m), 2.27 (3H, s), 2.67 (3H, d, J= 4.9Hz), 3.41-3.55 (2H, m), 3.63-3.72 (1H, m), 3.72-3.81 (1H, m), 4.56-4.63 (1H, m), 4.96 (2H, s), 6.89.(2H, d, J=9.2Hz), 7.27 (2H, d, J=8.5Hz), 7.39-7.46 (1H, m), 7.66 (1H, d, J=8.6Hz), 7.81 (1H, dd, J=1.5, 8.8Hz), 7.89 (1H, s), 8.00 (1H, d, J=8.5Hz), 8.09 (1H, d, J=8.6Hz), 8.45 (1H, s), 8.79 (1H, s), 9.23-9.40 (3H, m), 9.52 (2H, s).
Следующее соединение ПРИМЕРА 80 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 80
7-амидино-N-метилсульфонил-N-[4-[(4-пиперидил)окси] фенил] - 2-нафталинкарбоксамида дигидрохлорид.
Исходное соединение: N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси]фенил]-7-циано-N-метилсульфонил-2-нафталинкарбоксамид.
Данные масс-спектра (m/z): 467 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.65-1.77 (2Н, m), 1.84-2.06 (2H, m), 2.92-3.04 (2Н, m), 3.09-3.20 (2H, m), 3.59 (3Н, s), 4.51-4.61 (1H, m), 6.90 (2Н, d, J=8.8Hz), 7.42 (2Н, d, J= 8.8Hz), 7.72 (1H, dd, J=8.8, 1.5Hz), 7.87 (1H, d, J=9.5Hz), 7.94 (1H, d, J= 8.8Hz), 8.11 (1H, d, J=8.8Hz), 8.34 (1H, s), 8.49 (1H, s), 8.71-8.92 (2Н, m), 9.20 (2Н, s), 9.51 (2Н, s).
Следующее соединение ПРИМЕРА 81 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 81
N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -7-амидино-N- метилсульфонил-2-нафталинкарбоксамида дигидрохлорид.
Исходное соединение: 7-амидино-N-метилсульфонил-N-[4-[(4- пиперидил)окси]фенил]-2-нафталинкарбоксамида дигидрохлорид.
Данные масс-спектра (m/z): 508 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.55-1.70 (2Н, m), 1.89-2.00 (2H, m), 2.26 (3H, s), 3.40-3.50 (2Н, m), 3.60 (3H, s), 3.62-3.69 (1H, m), 3.69-3.78 (1H, m), 4.57-4.67 (1H, m), 6.91 (2Н, d, J=9.2Hz), 7.42 (2Н, d, J=9.2Hz), 7.72 (1H, dd, J=1.5, 8.9Hz), 7.89 (1H, dd, J=1.8, 8.5Hz), 7.94 (1H, d, J=8.6Hz), 8.11 (1H, d, J=8.6Hz), 8.34 (1H, s), 8.51 (1H, s), 8.65-8.74 (1H, m), 9.17-9.31 (3H, m), 9.54 (2Н, s).
Следующее соединение ПРИМЕРА 82 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 82
Этил-N-[N-[(7-амидино-2-нафтил)метил]-N- [(4-пиперидил)окси]фенил]сульфамоил]-N-метилкарбамата дигидрохлорид.
Исходное соединение: этил-N-[N-[4-[(1-трет- бутоксикарбонил-4-пиперидил)окси]фенил]-N-[(7-циано-2- нафтил)метил]сульфамоил]-N-метилкарбамат.
Данные масс-спектра (m/z): 540 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.35 (3Н, t, J=7.0Hz), 1.70-1.82 (2Н, m), 1.96-2.10 (2H, m), 2.92 (3Н, s), 2.94-3.08 (2H, m), 3.10-3.21 (2H, m), 4.36 (2H, q, J=7.0Hz), 4.55-4.63 (1H, m), 5.18 (2H, s), 6.98 (2H, d, J=9.2Hz), 7.22 (2H, d, J= 9.2Hz), 7.64 (1H, d, J=8.5Hz), 7.82 (1H, d, J=8.5Hz), 7.93 (1H, s), 8.04 (1H, d, J= 8.6Hz), 8.11 (1H, d, J=8.6Hz), 8.47 (1H, s), 8.90-9.32 (3Н, m), 9.49 (3Н, s).
ПРИМЕР 83
Этил-N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7-амидино-2-нафтил)метил]сульфамоил]-N-метилкарбаматадигидрохлорид.
Исходное соединение: этил-N-[N-[(7- амидино-2-нафтил)метил]-N-[4-[(4-пиперидил)окси]фенил]сульфамоил]- N-метилкарбамат.
Данные масс-спектра (m/z): 581 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.35 (3Н, t, J=7.0Hz), 1.51-1.75 (2H, m), 1.94-2.06 (2H, m), 2.27 (3Н, s), 2.92 (3Н, s), 3.41-3.53 (2H, m), 3.64-3.73 (1H, m), 3.73-3.82 (1H, m), 4.36 (2H, q, J=7.0Hz), 4.61-4.68 (1H, m), 5.18 (2H, s), 6.98 (2H, d, J= 9.2Hz), 7.22 (2H, d, J=9.2Hz), 7.64 (1H, dd, J=1.2, 8.5Hz), 7.83 (1H, dd, J= 1.8, 8.5Hz), 7.93 (1H, s), 8.05 (1H, d, J=8.6Hz), 8.11 (1H, d, J=8.6Hz), 8.48 (1H, s), 8.76 (1H, bs), 9.22-9.35 (3H, m), 9.51 (2H, s).
Следующее соединение ПРИМЕРА 84 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 84
Метил-N-[N-[(7-амидино-2- нафтил)метил]-N-[4-[(4-пиперидил)-окси]фенил] сульфамоил]-N- этоксикарбонилглицината дигидрохлорид.
Исходное соединение: метил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси]фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]-N-этоксикарбонилглицинат.
Данные масс-спектра (m/z): 598 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.30 (3Н, t, J=7.0Hz), 1.71-1.83 (2H, m), 1.98-2.09 (2H, m), 2.93-3.04 (2H, m), 3.10-3.21 (2H, m), 3.62 (3Н, s), 4.17 (2H, s), 4.35 (2H, q, J= 7.0Hz), 4.54-4.62 (1H, m), 5.19 (2H, s), 6.96 (2H, d, J=9.2Hz), 7.23 (2H, d, J= 9.2Hz), 7.63 (1H, d, J=9.5Hz), 7.82 (1H, d, J=8.5Hz), 7.91 (1H, s), 8.03 (1H, d, J= 8.5Hz), 8.11 (1H, d, J=8.6Hz), 8.46 (1H, s), 8.95-9.15 (2H, m), 9.26 (2H, s), 9.50 (2H, s).
Следующее соединение ПРИМЕРА 85 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 85
Метил-N-[N-[4-[(1-ацетоимидоил-4- пиперидил)окси]фенил]-N-[(7-амидино-2-нафтил)метил]сульфамоил]-N- этоксикарбонилглицината дигидрохлорид.
Исходное соединение: метил-N-[N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]сульфамоил]-N-этоксикарбонилглицината дигидрохлорид.
Данные масс-спектра (m/z): 639 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.30 (3Н, t, J=7.0Hz), 1.60-1.75 (2Н, m), 1.95-2.05 (2H, m), 2.27 (3Н, s), 3.41-3.53 (2H, m), 3.62 (3Н, s), 3.65-3.72 (1H, m), 3.75-3.82 (1H, m), 4.17 (2H, s), 4.35 (2H, q, J=7.0Hz), 4.60-4.67 (1H, m), 5.19 (2H, s), 6.96 (2H, d, J=9.2Hz), 7.23 (2H, d, J=9.2Hz), 7.63 (1H, d, J=8.6Hz), 7.83 (1H, d, J= 8.6Hz), 7.91 (1H, s), 8.04 (1H, d, J=8.6Hz), 8.11 (1H, d, J= 8.6Hz), 8.47 (1H, s), 8.79 (1H, s), 9.26-9.35 (3Н, m), 9.52 (2H, s).
Следующее соединение ПРИМЕРА 86 получают тем же методом, что и соединение ПРИМЕРА 30.
ПРИМЕР 86
N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]сульфамоил]-N-этоксикарбонилглицина дигидрохлорид.
Исходное соединение: метил-N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино- 2-нафтил)метил]сульфамоил]-N-этоксикарбонилглицината дигидрохлорид.
Данные масс-спектра (m/z): 625 (M-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 1.30 (3Н, t, J=7.0Hz), 1.61-1.73 (2Н, m), 1.95-2.05 (2H, m), 2.27 (3Н, s), 3.41-3.53 (2H, m), 3.62-3.72 (1H, m), 3.72-3.82 (1H, m), 4.01 (2Н, s), 4.34 (2H, q, J=7.0Hz), 4.59-4.68 (1H, m), 5.19 (2Н, s), 6.96 (2H, d, J= 9.2Hz), 7.23 (2Н, d, J=9.2Hz), 7.64 (1H, d, J=8.5Hz), 7.82 (1H, d, J=8.5Hz), 7.92 (1H, s), 8.03 (1H, d, J=8.5Hz), 8.11 (1H, d, J=8.6Hz), 8.46 (1H, s), 8.74 (1H, s), 9.20-9.40 (3Н, m), 9.48 (2Н, s), 13.01 (1H, bs).
Следующее соединение ПРИМЕРА 87 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 87
Этил-N-[N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)-окси] фенил] сульфамоил]глицината дигидрохлорид.
Исходное соединение: этил-N-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил)окси] фенил] -N-[(7-циано-2-нафтил)метил]сульфамоил]-N-трет-бутоксикарбонилглицинат.
Данные масс-спектра (m/z): 540 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.21 (3Н, t, J=7.0Hz), 1.70-1.81 (2Н, m), 1.95-2.06 (2Н, m), 2.93-3.05 (2Н, m), 3.07-3.19 (2Н, m), 3.83 (2Н, d, J=6.7Hz), 4.14 (2Н, q, J= 7.0Hz), 4.49-4.57 (1H, m), 4.94 (2Н, s), 6.88 (2Н, d, J=8.5Hz), 7.28 (2Н, d, J= 8.6Hz), 7.65 (1H, d, J=8.5Hz), 7.80 (1H, d, J=8.6Hz), 7.88 (1H, s), 7.98 (1H, d, J=8.5Hz), 8.03-8.13 (2Н, m), 8.42 (1H, s), 8.90-9.12 (2Н, m), 9.25 (2Н, s), 9.48 (2Н,s).
Следующее соединение ПРИМЕРА 88 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 88
Этил-N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N- [(7-амидино-2-нафтил)метил]сульфамоил]глицината дигидрохлорид.
Исходное соединение: этил-N-[N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]сульфамоил]глицината дигидрохлорид.
Данные масс-спектра (m/z): 581 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO- d6, внутренний стандарт - ТМС):
δ: 1.21 (3Н, t, J=7.3Hz), 1.60-1.73 (2H, m), 1.92-2.02 (2Н, m), 2.27 (3Н, s), 3.42-3.55 (2Н, m), 3.63-3.70 (1H, m), 3.70-3.80 (1H, m), 3.83 (2Н, d, J= 6.1Hz), 4.14 (2Н, q, J=7.3Hz), 4.56-4.62 (1H, m), 4.94 (2Н, s), 6.89 (2Н, d, J=9.2Hz), 7.28 (2Н, d, J=9.2Hz), 7.65 (1H, d, J=8.5Hz), 7.80 (1H, d, J= 8.6Hz), 7.89 (1H, s), 7.99 (1H, d, J=8.5Hz), 8.04-8.10 (2Н, m), 8.43 (1H, s), 8.74 (1H, s), 9.20-9.31 (3Н, m), 9.48 (2Н, s).
Следующее соединение ПРИМЕРА 89 получают тем же методом, что и соединение ПРИМЕРА 29.
ПРИМЕР 89
N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N-[(7-амидино- 2-нафтил)метил]сульфамоил]глицина дигидрохлорид.
Исходное соединение: этил-N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7-амидино-2-нафтил)метил]сульфамоил]глицината дигидрохлорид.
Данные масс-спектра (m/z): 553 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.60-1.71 (2Н, m), 1.90-2.02 (2Н, m), 2.26 (3Н, s), 3.40-3.55 (2Н, m), 3.61-3.81 (4Н, m), 4.56-4.62 (1Н, m), 4.94 (2Н, s), 6.88 (2Н, d, J= 9.2Hz), 7.28 (2Н, d, J=8.6Hz), 7.64 (1Н, d, J=8.5Hz), 7.78 (1Н, d, J=8.5Hz), 7.81-7.93 (2Н, m), 7.97 (1H, d, J=8.6Hz), 8.07 (1H, d, J=8.6Hz), 8.42 (1H, s), 8.71 (1H, s), 9.26 (1H, s), 9.30-9.50 (4Н, m), 12.8 (bs).
ПРИМЕР 90
Этанол, насыщенный аммиаком при 10oC (30 мл), прибавляют к 384 мг этил-N-[N-[(7-амидино-2-нафтил)метил]-N-[4- [(4-пиперидил)окси]-фенил]сульфамоил]глицинатдигидрохлорида и смесь перемешивают при 5oC в течение 5 суток. Смесь испаряют и полученный остаток растворяют в 5 мл этанола и 10 мл метанола. Далее к раствору прибавляют 1,007 мг этилацетоимидатгидрохлорида и 956 мг триэтиламина и смесь перемешивают в течение суток при комнатной температуре. Реакционную смесь испаряют, остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A 120-230/70), используя в качестве элюента смесь метанол: вода (1: 99), а затем добавляют небольшое количество 1н соляной кислоты и лиофилизируют, получая 260 мг N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]глицинамиддигидрохлорида.
Данные масс-спектра (m/z): 552 (М-3HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.60-1.73 (2H, m), 1.91-2.02 (2H, m), 2.26 (3H, s), 3.42-3.51 (2H, m), 3.60-3.79 (4H, m), 4.57-4.62 (1H, m), 4.95 (2H, s), 6.87 (2H, d, J= 8.5Hz), 7.22 (1H, s), 7.29 (2H, d, J=8.6Hz), 7.40 (1H, s), 7.65 (1H, d, J= 8.5Hz), 7.76-7.82 (2H, m), 7.89 (1H, s), 7.98 (1H, d, J=8.6Hz), 8.08 (1H, d, J=9.2Hz), 8.43 (1H, s), 8.69 (1H, s), 9.15-9.25 (3H, m), 9.47 (2H, s).
Следующее соединение ПРИМЕРА 91 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 91
Метил-N-[(7-амидино-2-нафтил)метил] -5-[(4-пиперидил)- окси]антранилата дигидрохлорид.
Исходное соединение: метил-5-[(1-трет-бутоксикарбонил-4-пиперидил)окси] -N-[(7-циано-2-нафтил)метил]антранилат.
Данные масс-спектра (m/z): 433 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.71-1.82 (2H, m), 1.95-2.06 (2H, m), 2.93-3.05 (2H, m), 3.12-3.22 (2H, m), 3.84 (3H, s), 4.36-4.42 (1H, m), 4.69 (2H, s), 6.68 (1H, d, J= 9.2Hz), 7.09 (1H, dd, J=9.1, 3.1Hz), 7.43 (1H, d, J=3.1Hz), 7.72 (1H, d, J= 8.5Hz), 7.81 (1H, d, J=8.5Hz), 7.90 (1H, s), 7.98 (1H, bs), 8.06 (1H, d, J= 8.5Hz), 8.12 (1H, d, J=8.5Hz), 8.45 (1H, s), 8.80-9.03 (2H, m), 9.22 (2H, s), 9.47 (2H, s).
Следующее соединение ПРИМЕРА 92 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 92.
Метил-N-[(7-амидино-2-нафтил)метил] -5-[(1-ацетоимидоил- 4-пиперидил)окси]антранилата дигидрохлорид.
Исходное соединение: метил-N-[(7-амидино-2-нафтил)метил]-5-(4- пиперидил)окси]антранилата дигидрохлорид.
Данные масс-спектра (m/z): 474 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.61-1.76 (2Н, m), 1.90-2.01 (2Н, m), 2.28 (3H, s), 3.45-3.80 (4Н, m), 3.84 (3H, s), 4.42-4.49 (1H, m), 4.70 (2Н, s), 6.69 (1H, d, J=9.1Hz), 7.10 (1H, dd, J=9.1, 3.0Hz), 7.43 (1H, d, J=3.1Hz), 7.72 (1H, d, J=8.5Hz), 7.82 (1H, d, J=8.5Hz), 7.97 (1H, s), 8.0 (1H, bs), 8.06 (1H, d, J=8.5Hz), 8.13 (1H, d, J=8.5Hz), 8.47 (1H, s), 8.78 (1H, s), 9.25-9.35 (3H, m), 9.50 (2Н, m).
ПРИМЕР 93
Этил-[N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)окси]-фенил] сульфамоил]ацетата дигидрохлорид (490 мг) растворяют в 1 мл этанола, прибавляют 5 мл этанола, насыщенного аммиаком при 10oC, и смесь перемешивают в течение 2 суток при 0oC. Реакционную смесь испаряют, остаток очищают ODS хроматографией на колонке (YMC-GEL ODS-A 120-230/70), используя в качестве элюента воду, получая 318 мг [N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]-фенил]сульфамоил]ацетамида.
Данные масс-спектра (m/z): 496 (М + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.50-1.98 (2Н, m), 1.86-1.94 (2Н, m), 2.68-2.73 (2H, s), 2.96-3.06 (2Н, m), 4.08 (2Н, s), 4.38-4.42 (1H, m), 5.01 (2Н, s), 6.89 (2Н, d, J= 8.6Hz), 7.36 (2Н, d, J=8.5Hz), 7.53 (1H, s), 7.65 (1H, d, J=8.6Hz), 7.89 (1H, d, J= 6.7Hz), 7.88 (2Н, s), 8.00 (1H, d, J=8.5Hz), 8.07 (1H, d, J= 9.2Hz), 8.42 (1H, s).
Следующее соединение ПРИМЕРА 94 получают тем же методом, что и соединение ПРИМЕРА 23.
ПРИМЕР 94
Этил-N-[N-[4-[[(3S)-1-ацетоимидоил-3- пирролидинил)окси] фенил]-N-[(7-амидино-2- нафтил)метил]сульфамоил]карбамата дигидрохлорид.
Исходное соединение: этил-N-[N-[4-[[(3S)-1-трет-бутоксикарбонил-3- пирролидинил)окси]фенил]-N-[(7-циано-2-нафтил)метил]-сульфамоил]карбамат.
Данные масс-спектра (m/z): 553 (M-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.27 (3H, t, J=7.3Hz), 2.07-2.30 (5Н, m), 3.33-3.95 (4H, m), 4.23 (2Н, q, J=7.3Hz), 5.05-5.22 (2Н, m), 6.90-6.99 (2H, m), 7.23-7.32 (2Н, m), 7.64 (1H, d, J=8.5Hz), 7.81 (1H, d, J=8.5Hz), 7.92 (1H, d, J=4.3Hz), 8.03 (1H, d, J=8.5Hz), 8.10 (1H, d, J=8.5Hz), 8.40-8.52 (2Н, m), 9.15-9.30 (3H, m), 9.48 (2Н, s), 11.54 (1H, s).
Следующие соединения ПРИМЕРОВ 95-97 получают тем же методом, что и соединение ПРИМЕРА 32.
ПРИМЕР 95
Этил-2-[N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил)- окси]фенил] сульфамоил]пропионата дигидрохлорид.
Исходное соединение: этил-2-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси]фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]пропионат.
Данные масс-спектра (m/z): 539 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.29 (3H, t, J=7.3Hz), 1.50-1.55 (5Н, m), 1.84-1.96 (2Н, m), 2.69-2.73 (2Н, m), 2.99-3.02 (2Н, m), 4.25-4.29 (2Н, m), 4.39-4.42 (2Н, m), 4.99 (1H, d, J=19.3Hz), 5.11 (1H, d, J=15.9Hz), 6.91 (2Н, d, J=9.2Hz), 7.32 (2Н, d, J= 9.2Hz), 7.65 (1H, d, J=8.5Hz), 7.82 (1H, d, J=8.5Hz), 7.89 (1H, s), 8.03 (1H, d, J=8.5Hz), 8.00 (1H, d, J=8.5Hz), 8.44 (1H, s).
ПРИМЕР 96
Этил-2-[N-[(7-амидино-2-нафтил)метил] -N-[4- [(4-пиперидил)-окси]фенил] сульфамоил]валерата дигидрохлорид.
Исходное соединение: этил-2-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси]фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]валерат.
Данные масс-спектра (m/z): 567 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.89 (3Н, t, J= 7.3Hz), 1.25 (3Н, t, J=7.3Hz), 1.30-1.36 (2Н, m), 1.51-1.55 (2Н, m), 1.81-2.02 (4Н, m), 2.68-2.72 (2Н, m), 2.97-3.00 (2H, m), 4.24-4.29 (3Н, m), 4.40-4.43 (1H, m), 5.00 (1H, d, J=15.2Hz), 5.07 (1H, d, J= 15.8Hz), 6.89 (2Н, d, J=9.1Hz), 7.28 (2Н, d, J=9.1Hz), 7.62 (1H, d, J= 6.7Hz), 7.80 (1H, d, J=6.7Hz), 7.86 (1H, s), 8.01 (1H, d, J=8.5Hz), 8.08 (1H, d, J=8.5Hz), 8.41 (1H, s).
ПРИМЕР 97
Этил-2-[N-[(7-амидино-2-нафтил)метил] -N-[4-[(4-пиперидил) окси] фенил] сульфамоил]бутилата дигидрохлорид.
Исходное соединение: этил-2-[N-[4-[(1-трет-бутоксикарбонил-4-пиперидил) окси]фенил]-N-[(7-циано-2-нафтил)метил]сульфамоил]бутилат.
Данные масс-спектра (m/z): 553 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.94 (3Н, t, J= 7.3Hz), 1.26 (3Н, t, J=7.3Hz), 1.49-1.51 (2Н, m), 1.88-1.90 (2Н, m), 1.98-2.05 (2Н, m), 2.50-2.69 (2Н, m), 2.96-2.99 (2Н, m), 4.22-4.29 (3H, m), 4.38-4.40 (1H, m), 4.98 (1H, d, J=15.3Hz), 5.06 (1H, d, J= 15.3Hz), 6.87 (2H, d, J=9.2Hz), 7.28 (2H, d, J=8.5Hz), 7.62 (1H, d, J= 8.5Hz), 7.80 (1H, d, J=8.6Hz), 7.86 (1H, s), 8.00 (1H, d, J=8.6Hz), 8.08 (1H, d, J=8.5Hz), 8.41 (1H, s).
Следующие соединения ПРИМЕРОВ 98-107 получают тем же методом, что и соединение ПРИМЕРА 12.
ПРИМЕР 98
Этил-2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]сульфамоил]пропионата дигидрохлорид.
Исходное соединение: этил-2-[N-[(7-амидино-2-нафтил)метил] -N-[4-[(4- пиперидил)окси]фенил]сульфамоил]пропионата дигидрохлорид.
Данные масс-спектра (m/z): 580 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.27 (3Н, t, J= 7.3Hz), 1.53 (3H, d, J=7.3Hz), 1.61-1.76 (2H, m), 1.92-2.06 (2H, m), 2.29 (3H, s), 3.42-3.52 (2H, m), 3.62-3.80 (2H, m), 4.25 (2H, q, J=7.3Hz), 4.41 (1H, q, J=6.7Hz), 4.63-4.64 (1H, m), 4.99 (1H, d, J= 15.3Hz), 5.10 (1H, d, J= 15.3Hz), 6.94 (2H, d, J=8.5Hz), 7.32 (2H, d, J= 8.5Hz), 7.64 (1H, d, J=8.5Hz), 7.84-7.88 (3Н, m), 8.02 (1H, d, J=8.5Hz), 8.09 (1H, d, J=8.5Hz), 8.50 (1H, s), 9.37 (6H, br).
ПРИМЕР 99
Этил-2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7- амидино-2-нафтил)метил]сульфамоил]бутилата дигидрохлорид.
Исходное соединение: этил-2-[N-[(7-амидино-2- нафтил)метил]-N-[4-[(4-пиперидил)окси]фенил]сульфамоил]бутилата дигидрохлорид.
Данные масс-спектра (m/z): 594 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 0.95 (3Н, t, J=7.3Hz), 1.26 (3Н, t, J=7.3Hz), 1.50-1.66 (2Н, br), 1.99-2.08 (4H, m), 2.29 (3Н, s), 3.40-3.51 (2Н, br), 3.71-3.79 (2H, br), 4.24-4.30 (3Н, m), 4.63-4.64 (1H, m), 5.03 (1H, d, J=15.3Hz), 5.05 (1H, d, J= 15.3Hz), 6.93 (2Н, d, J=9.2Hz), 7.31 (2Н, d, J=9.2Hz), 7.63 (1H, d, J= 9.8Hz), 7.85-7.87 (2Н, m), 8.02 (1H, d, J=8.5Hz), 8.09 (1H, d, J=8.5Hz), 8.51 (1H, s), 9.43 (6Н, br).
ПРИМЕР 100
Этил-2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7-амидино-2-нафтил)метил]сульфамоил]валерата дигидрохлорид.
Исходное соединение: этил-2-[N-[(7-aмидинo-2- нaфтил)метил]-N-[4-[(4-пиперидил)окси]фенил]сульфамоил]валерата дигидрохлорид.
Данные масс-спектра (m/z): 608 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6 внутренний стандарт - ТМС):
δ: 0.89 (3Н, t, J=7.3Hz), 1.25 (3Н, t, J=7.3Hz), 1.30-1.36 (2Н, m), 1.67 (2Н, br), 1.88-2.00 (4H, m), 2.28 (3Н, s), 3.49 (2Н, br), 3.75 (2Н, br), 4.24-4.28 (3Н, m), 4.60-4.68 (1H, m), 5.01 (1H, d, J=15.9Hz), 5.08 (1H, d, J= 15.9Hz), 6.94 (2Н, d, J=9.2Hz), 7.31 (2Н, d, J=8.6Hz), 7.63 (1H, d, J= 8.6Hz), 7.84 (1H, d, J=8.5Hz), 7.87 (1H, s), 8.02 (1H, d, J=8.5Hz), 8.09 (1H, d, J=8.5Hz), 8.49 (1H, s), 9.39 (6H, br).
ПРИМЕР 101
[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтил)метил]сульфамоил]ацетамида дигидрохлорид.
Исходное соединение: [N-[(7-aмидинo-2-нaфтил)метил] -N-[4-[(4- пиперидил)окси]фенил]сульфамоил]ацетамид.
Данные масс-спектра (m/z): 537 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.60-1.72 (2Н, m), 1.94-2.02 (2H, m), 2.26 (3H, s), 3.42-3.51 (2Н, m), 3.64-3.78 (2Н, m), 4.07 (2Н, s), 4.58-4.64 (1H, m), 5.01 (2Н, s), 6.93 (2Н, d, J= 8.6Hz), 7.38 (2Н, d, J=9.2Hz), 7.52 (1H, s), 7.66 (1H, d, J= 8.6Hz), 7.80 (1H, d, J=8.6Hz), 7.84 (1H, s), 7.90 (1H, s), 8.00 (1H, d, J= 8.6Hz), 8.08 (1H, d, J=9.2Hz), 8.44 (1H, s), 8.84-9.14 (5H, br).
Следующее соединение ПРИМЕРА 102 получают тем же методом, что и соединение ПРИМЕРА 30.
ПРИМЕР 102
2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N-[(7-амидино-2-нафтил) метил]сульфамоил]пропионовой кислоты дигидрохлорид.
Исходное соединение: этил-2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] N-[(7-амидино-2-нафтил)метил]сульфамоил]-пропионата дигидрохлорид.
Данные масс-спектра (m/z): 552 (М-2HCl + 1)+.
Данные ЯМР спектра (DMSO-d6, внутренний стандарт - ТМС):
δ: 1.50 (3H, d, J=6.7Hz), 1.57-1.71 (2Н, m), 1.91-2.04 (2H, m), 2.27 (3H, s), 3.40-3.54 (2H, m), 3.64-3.82 (2H, m), 4.25-4.29 (1H, m), 4.58-4.62 (1H, m), 4.97 (1H, d, J=15.3Hz), 5.10 (1H, d, J=15.3Hz), 6.92 (2H, d, J= 9.2Hz), 7.33 (2H, d, J=9.2Hz), 7.64 (1H, d, J=8.5Hz), 7.82 (1H, d, J=8.5Hz), 7.88 (1H, s), 8.02 (1H, d, J=8.5Hz), 8.09 (1H, d, J=9.2Hz), 8.47 (1H, s), 8.79 (1H, s), 9.31-9.33 (3H, br), 9.51 (2H, s).
Химические структуры соединений, полученных в приведенных выше ПРИМЕРАХ 1-79, 82-90, 93 и 95-102, иллюстрируют Таблицы 2-11.
Следующие соединения (1А)-(53А) легко получают почти таким же образом, как описано в вышеприведенных ПРИМЕРАХ, а методики их получения содержат незначительные изменения, очевидные любому специалисту.
(1А) [N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил) метил]-2-тиофенсульфонамида дигидрохлорид;
(2А) [N-[4-[(1-ацетоимидоил-4- пиперидил)окси]фенил]-N-[(7-амидино-2-нафтил)метил]-2- фторбензолсульфонамида дигидрохлорид;
(3А) [N-[4-[(1-ацетоимидоил- 4-пиперидил)окси] фенил]-N-[(7-амидино-2- нафтил)метил]метилсульфонилметансульфонамида дигидрохлорид;
(4А) [N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(6-амидино-2- нафтил)метил]оксамида дигидрохлорид;
(5А) [N-[4-[(1-ацетоимидоил- 4-пиперидил)окси]фенил]-N-[(5-амидино-2-нафтил)метил]оксамида дигидрохлорид;
(6А) [N-[4-[(1-ацетоимидоил-4- пиперидил)окси]фенил]-N-[(8-амидино-2-нафтил)метил]оксамида дигидрохлорид;
(7А) [N-[4-[(1-ацетоимидоил-3-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]оксамида дигидрохлорид;
(8А) [N-[4-[(l-aцетoимидoил-2-пипеpидил)oкcи] фенил] -N-[(7-амидино-2- нафтил)метил]оксамида дигидрохлорид;
(9А) N-[(7-aмидинo-2- нaфтил)метил] -N-[4-[(1-иминoпpoпил-4-пиперидил)окси]фенил]оксамида дигидрохлорид;
(10A) N-[(7-амидино-2-нафтил)метил] -N-[4-[(3- пирролидинил)окси]фенил] оксамида дигидрохлорид;
(11А) N-[(7-амидино-2-нафтил)метил]-N-[4-[(3-пирролидинил)- окси]фенил] оксамата дигидрохлорид;
(12А) 1-[(7-амидино-2-нафтил)метил]-1-[4-[(3-пирролидинил)-окси] фенил] -3-этилмочевины дигидрохлорид;
(13А) N-[(7-амидино-2-нафтил)метил] -N-[4-[(3-пирролидинил)окси] фенил] этоксикарбониланилина дигидрохлорид;
(14А) N-[(7-амидино-2-нафтил)метил]-N-[4-[(3-пирролидинил)-окси] фенил] ацетамида дигидрохлорид;
(15А) N-[(7-амидино-2-нафтил)метил] -N-[4-[(3-пирролидинил)окси] фенил] этансульфонамида дигидрохлорид;
(16А) N-[4-[(1-ацетоимидоил-3-пирролидинил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]оксамида дигидрохлорид;
(17А) N-[4-[(1-ацетоимидоил-3-пирролидинил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]оксамата дигидрохлорид;
(18А) 1-[4-[(1-ацетоимидоил-3-пирролидинил)окси]фенил]-1- [(7-амидино-2-нафтил)метил]-3-этилмочевины дигидрохлорид;
(19А) N-[4-[(1-ацетоимидоил-3-пирролидинил)окси] фенил]-N-[(7-амидино-2-нафтил)метил]этоксикарбониланилина дигидрохлорид;
(20А) N-[4-[(1-ацетоимидоил-3-пирролидинил)окси] фенил]-N-[(7-амидино-2-нафтил)метил]ацетамида дигидрохлорид;
(21А) N-[4-[(1-ацетоимидоил-3-пирролидинил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]этансульфонамида дигидрохлорид;
(22А) N-[4-[(1-aцетoимидoил-4-пипеpидил)oкcи]фенил]-N- [(7-амидино-2-нафтил)метил]-2-аминоэтансульфонамида дигидрохлорид;
(23А) N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7-амидино- 2-нафтил)метил]-2-диметиламиноэтансульфонамида тригидрохлорид;
(24A) N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]-2-гидроксиэтансульфонамида дигидрохлорид;
(25А) N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]-2-метоксиэтансульфонамида дигидрохлорид;
(26А) [N-[4-[(1-aцетoимидoил-4-пипеpидил)oкcи]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]пропионовой кислоты дигидрохлорид;
(27A) Метил-N-[N-[4-[1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]глицината дигидрохлорид;
(28А) N-[N-[4-[1-aцетoимидoил-4-пипеpидил)oкcи] фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]-N-метилглицина дигидрохлорид;
(29A) Метил-N-[N-[4-[1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-aмидинo-2-нaфтил)метил]cульфaмoил]-N-метилглицинaтa дигидрохлорид;
(30А) N-[N-[4-[1-ацетоимидоил-4-пиперидил)окси] фенил]-N- [(7-aмидинo-2-нaфтил)метил]cульфaмoил]-N- мeтилглицинaмидa дигидрохлорид;
(31А) N-[N-[4-[l-aцетoимидoил-4- пипеpидил)oкcи]фенил]-N-[(7-амидино-2-нафтил)метил]сульфамоил]- N-этоксикарбонилглицинамида дигидрохлорид;
(32А) Метил-N-[N-[4-[1-aцетoимидoил-4-пиперидил)окси]фенил] -N-[(7-амидино-2-нафтил)метил]сульфамоил]карбамата дигидрохлорид;
(33А) N-[4-[1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2- нафтоил)сульфамоил]уксусной кислоты дигидрохлорид;
(34А) Этил-N-[N-[4-[1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7- амидино-2-нафтоил)сульфамоил]карбамата дигидрохлорид;
(35A) N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]- N-[(7-амидино-2-нафтил)метил]сульфамоил]мочевина;
(36A) N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]-N'-метилмочевина;
(37A) N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]метансульфонамид;
(38A) N-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7-амидино-2-нафтил) метил]сульфамоил]-N'-метилмочевина;
(39А) N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N'-ацетил-N- [(7-амидино-2-нафтил)метил]сульфамид;
(40A) 2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил]-N-[(7-амидино-2-нафтил) метил]сульфамоил]масляная кислота;
(41A) 2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]валериановая кислота;
(42A) 2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]изовалериановая кислота;
(43A) 2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил] -N-[(7-амидино-2-нафтил)метил]сульфамоил]-3 -фенилпропионовая кислота;
(44А) N-[4-[(1-ацетоимидол-4-пиперидил)окси] фенил] -N-[(7-амидино- 2-нафтил)метил]дифторуксусная кислота;
(45A) 2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]изомасляная кислота;
(46A) 2-[N-[4-[(1- ацетоимидоил-4-пиперидил)окси]фенил]-N-[(7-амидино-2-нафтил)метил] сульфамоил]-2-этилмасляная кислота;
(47A) 1-[N-[4-[(1-ацетоимидоил-4- пиперидил)окси]фенил]-N-[(7-амидино-2-нафтил)метил]сульфамоил] -1-циклогексанкарбоновая кислота;
(48А) Этил-2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N-[(7-амидино-2- нафтил)метил]сульфамоил]изовалерат;
(49А) Этил-2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N-[(7-амидино-2- нафтил)метил]сульфамоил]-3-фенилпропионат;
(50А) Этил-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]дифторацетат;
(51А) Этил-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N- [(7-амидино-2-нафтил)метил]сульфамоил]изобутират;
(52А) Этил-2-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N-[(7-амидино-2- нафтил)метил]сульфамоил]-2-этилбутират;
(53А) Этил-1-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси]фенил]-N-[(7-амидино-2- нафтил)метил]сульфамоил]-1-циклогексанкарбоксилат.
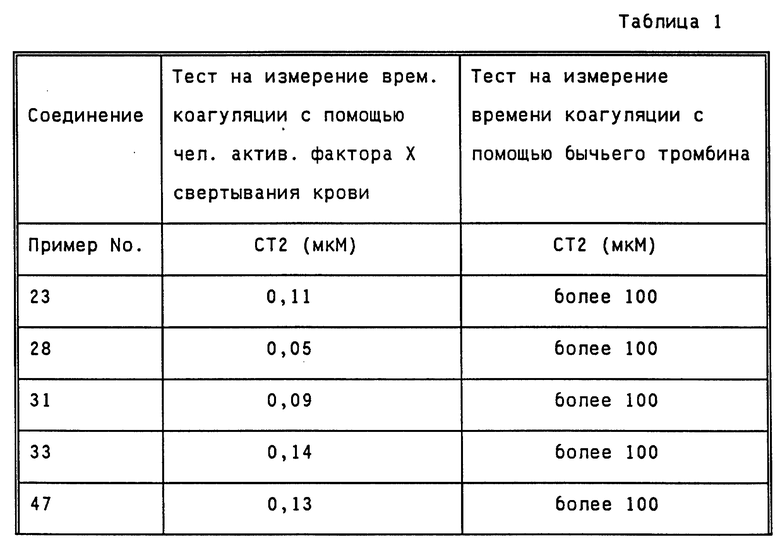
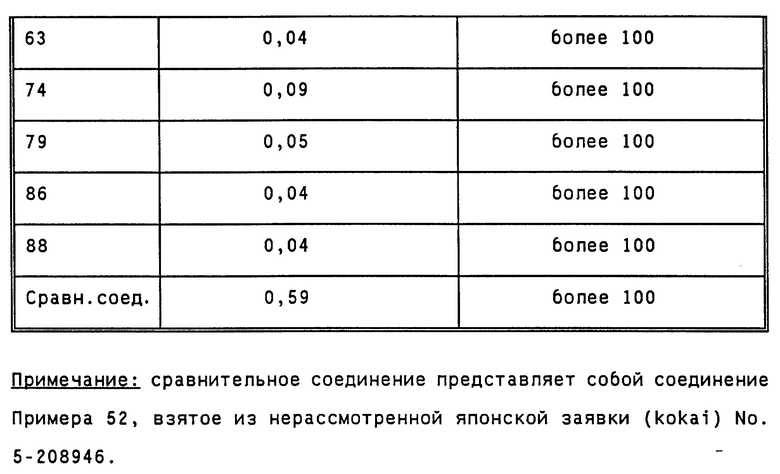
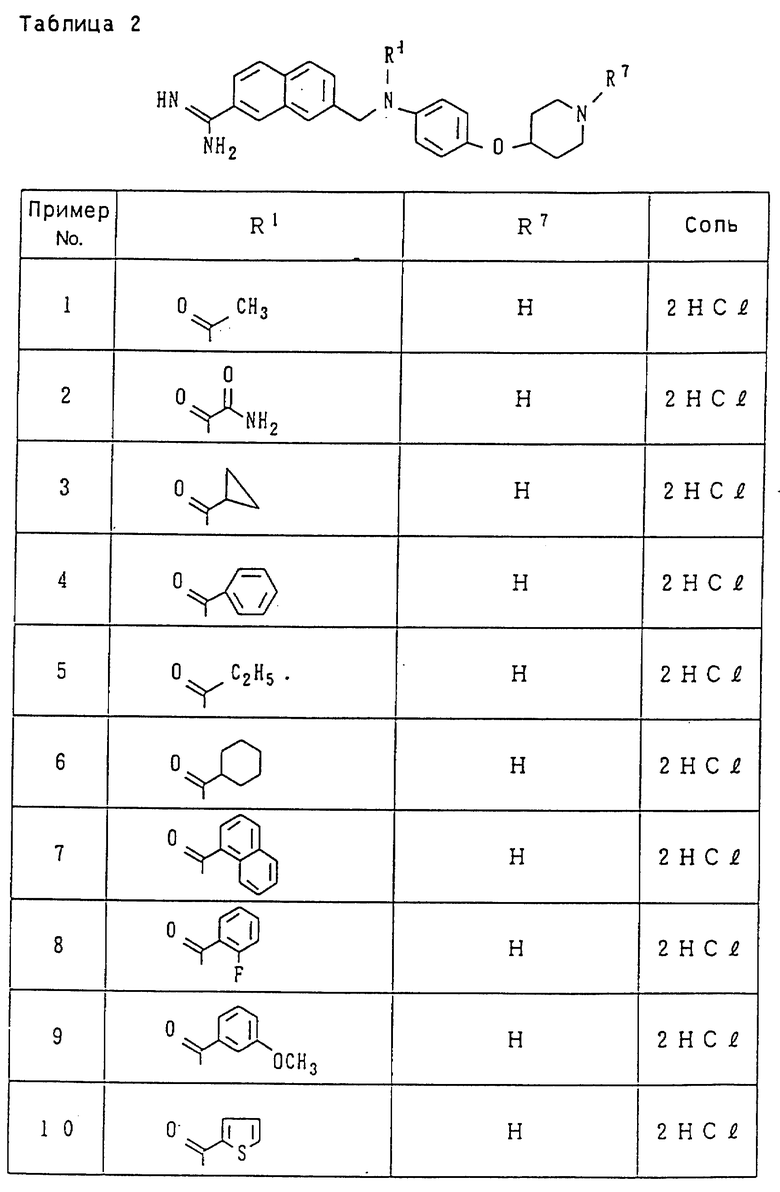
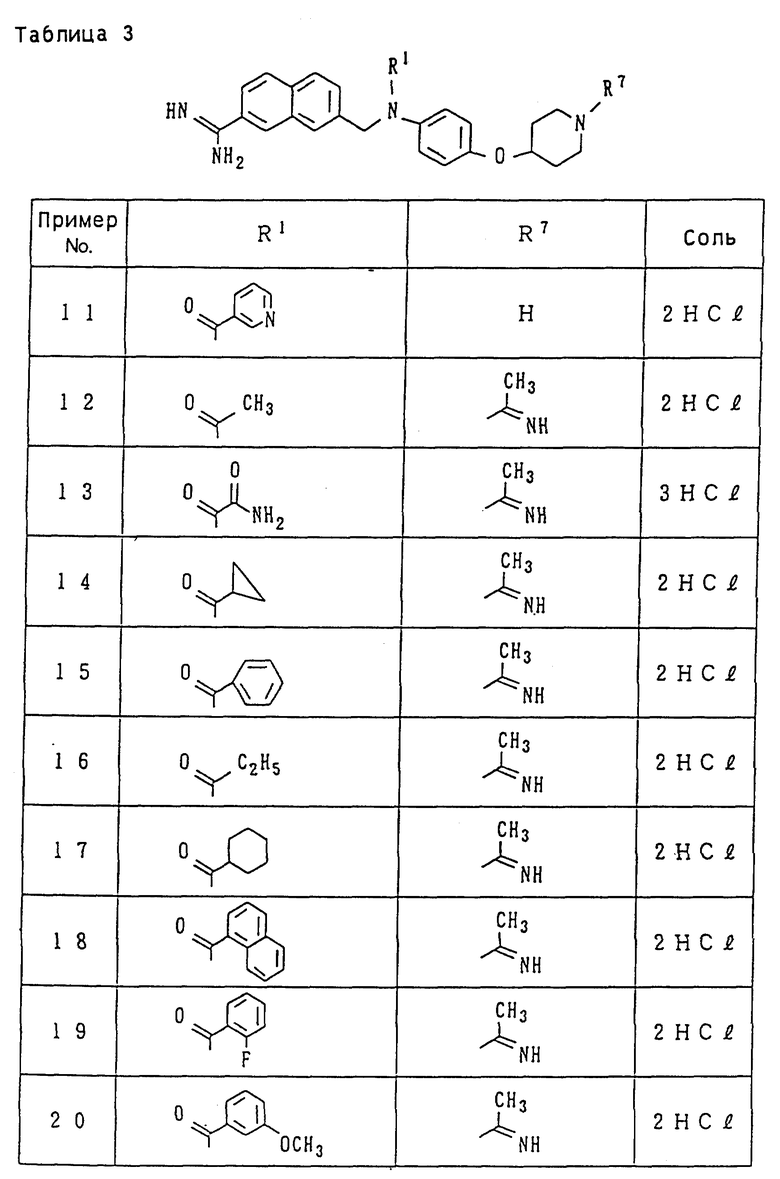
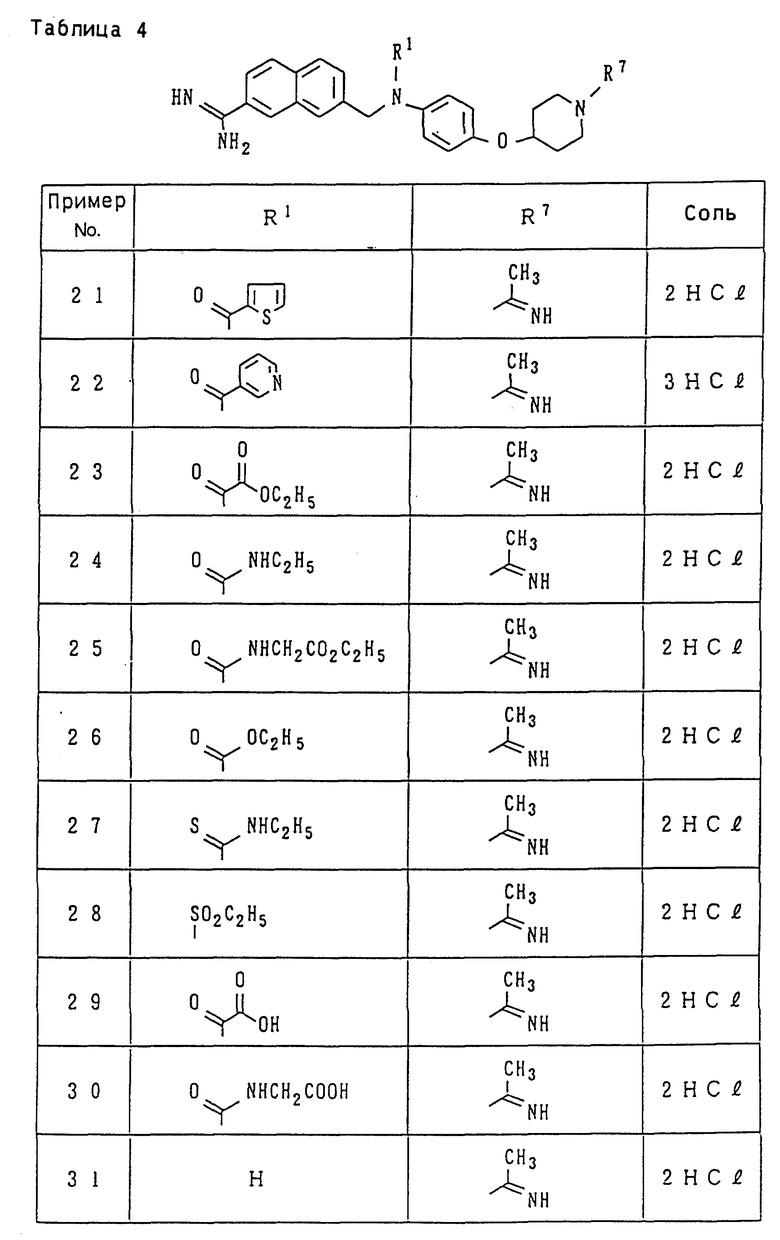
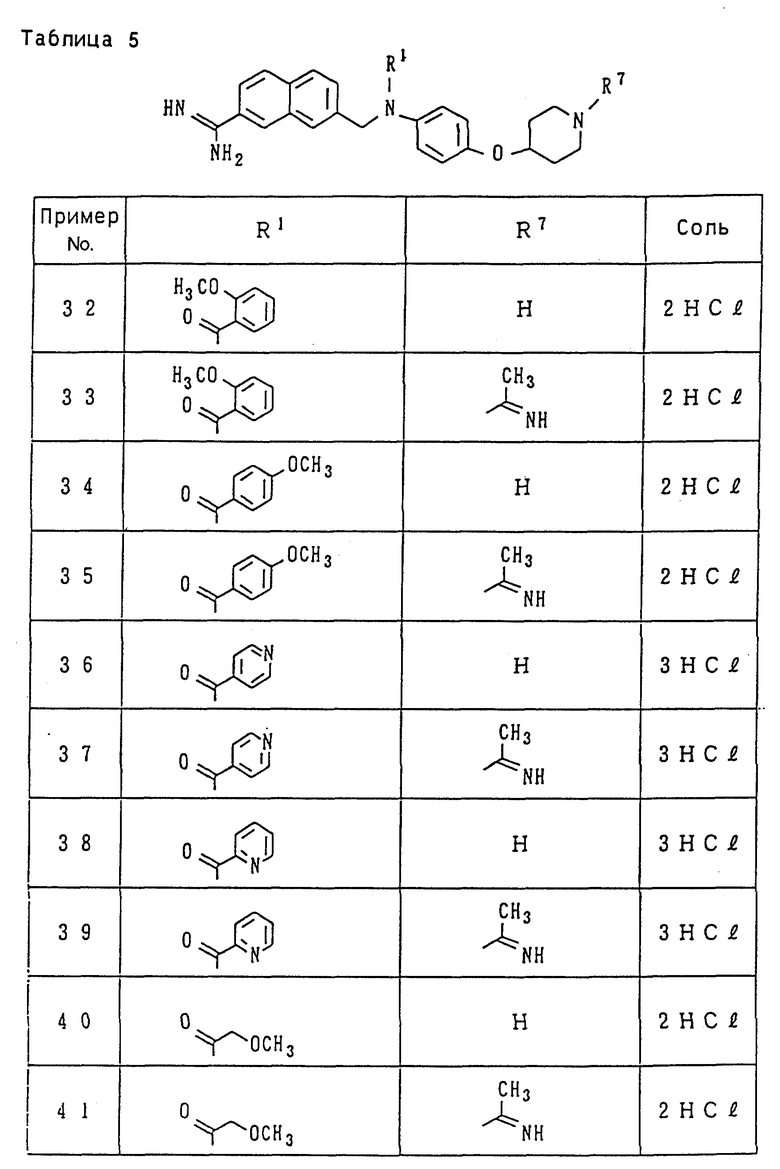
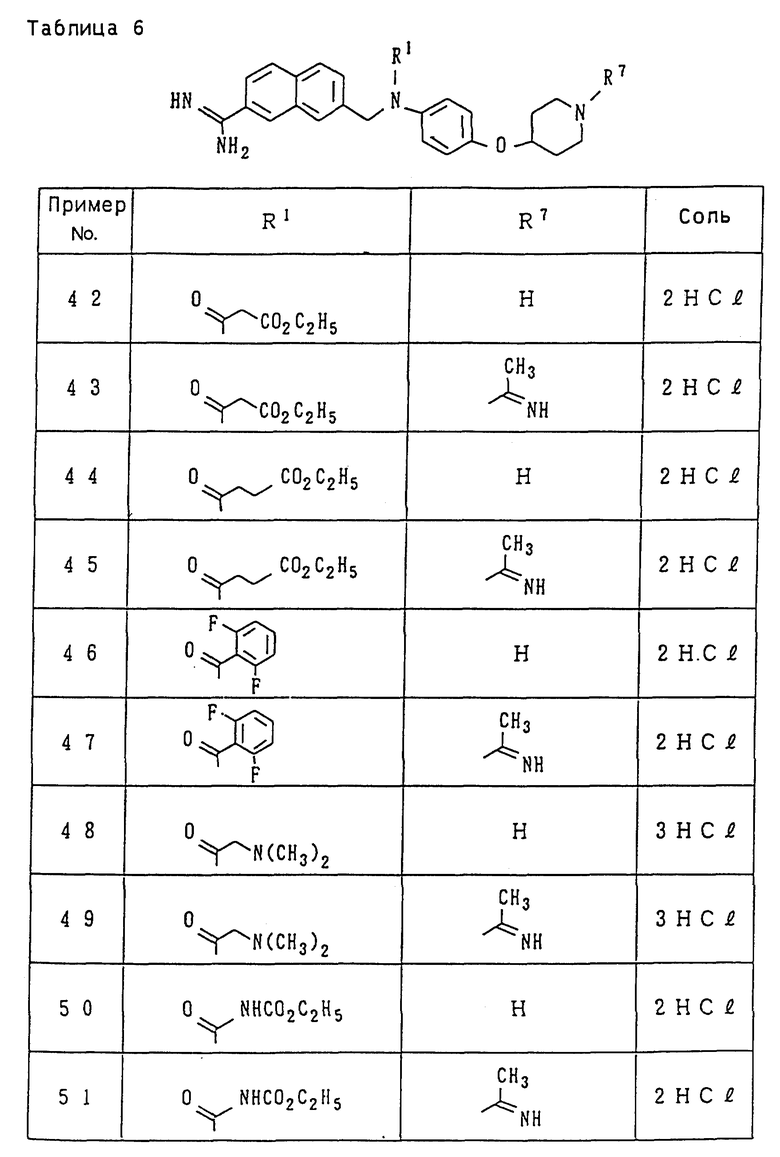
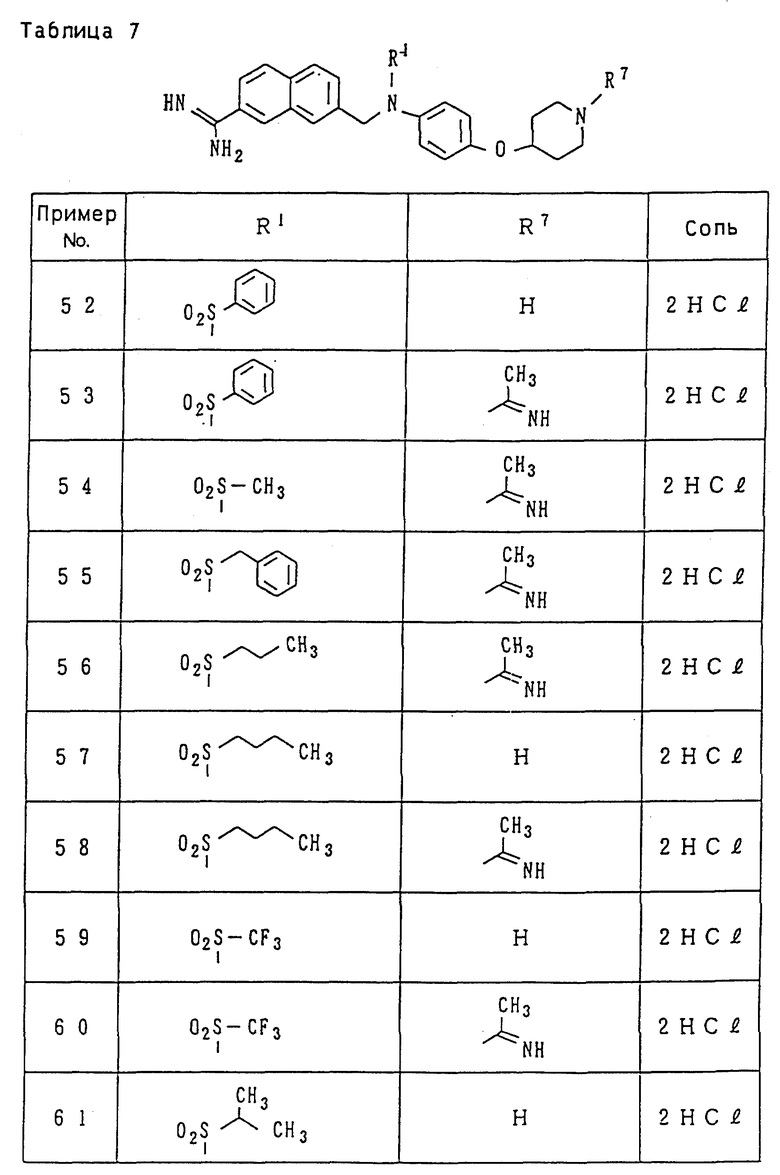
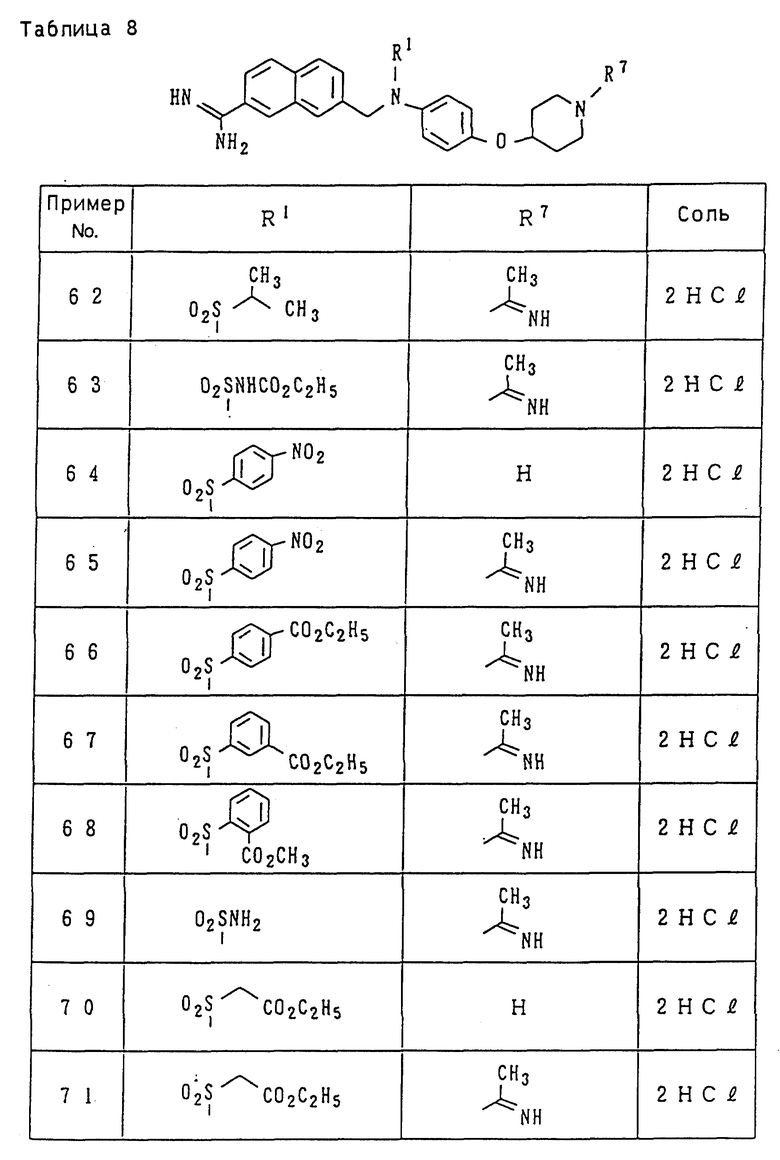
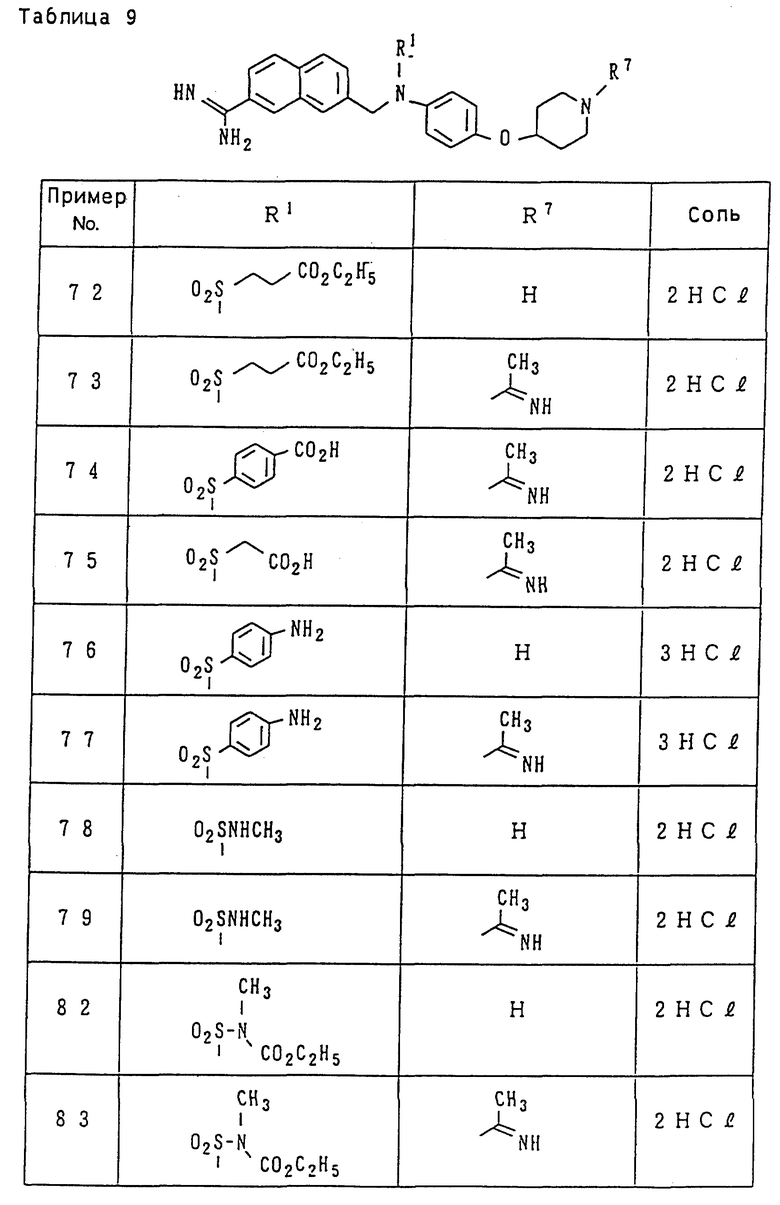
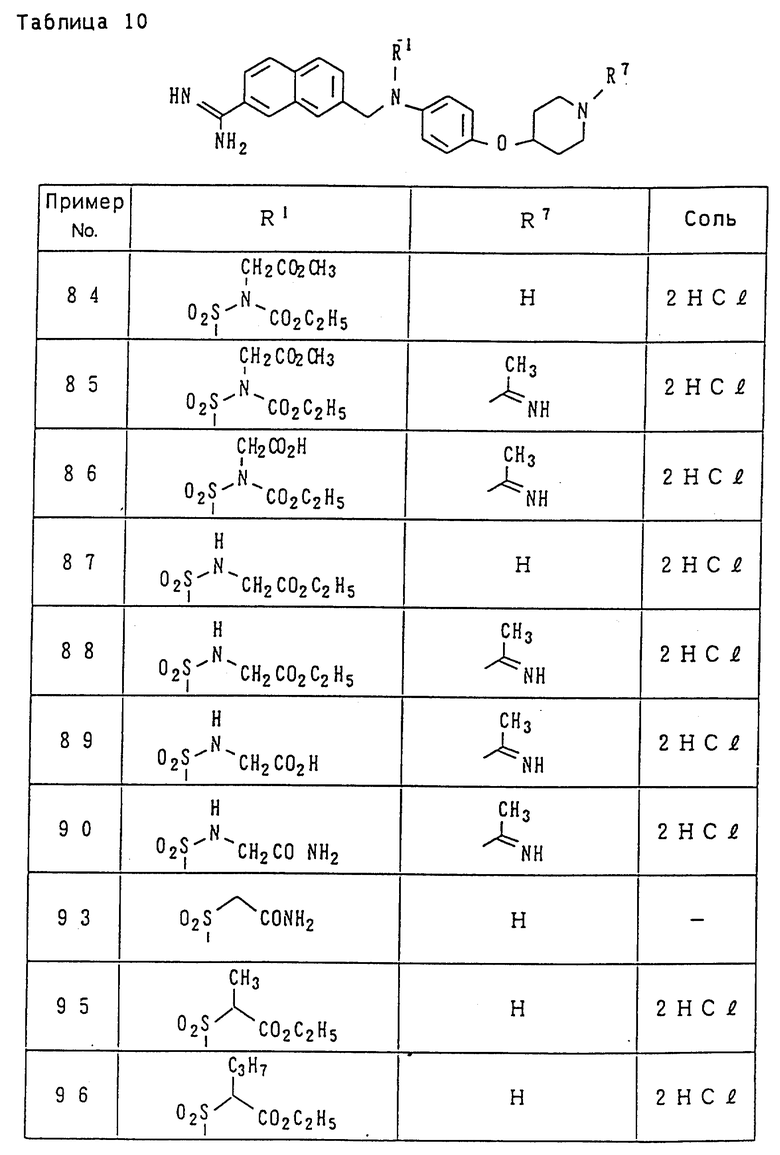
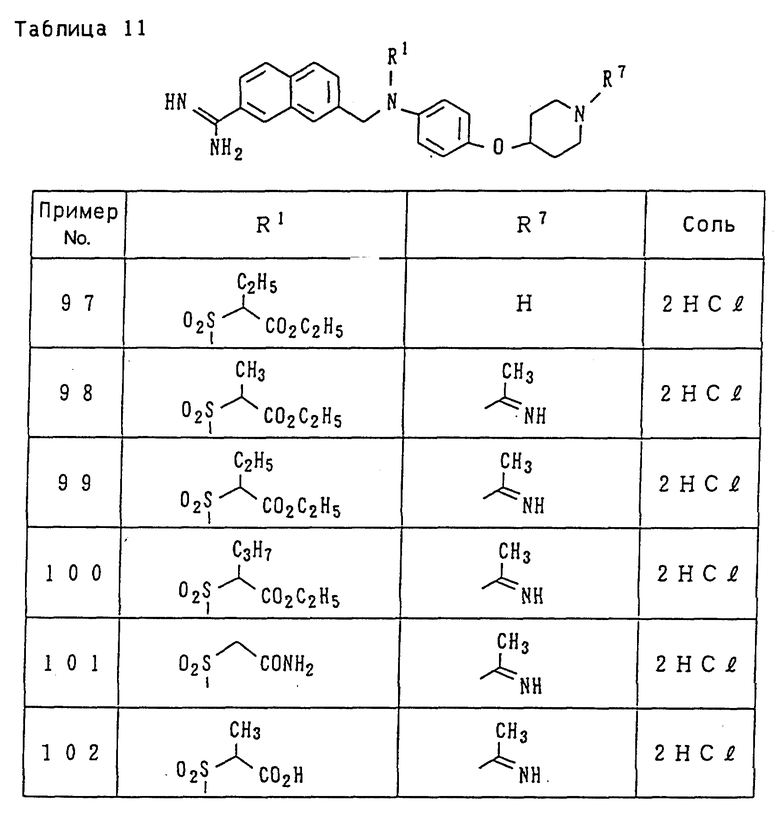
Предложены производные амидинонафтила общей формулы (I), где R1 представляет собой водород или группу -A-W-R4, A означает группу формулы  группу формулы
группу формулы 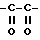 или -SO2-, X - атом кислорода или серы, W - простая связь или группа формулы NR5, R4 - гидроксил, низший алкокси, низший алкил, который может быть замещен, циклоалкил, который может быть замещен, арил, который может быть замещен, или гетероарил, содержащий 1-2 гетероатома, выбранных из серы и азота, который может быть замещен, при условии, что, когда W - группа формулы NR5, R4 может дополнительно представлять собой атом водорода, но не быть гидроксильной или низшей алкоксигруппой, R5 - атом водорода, карбамоил, низший алкоксикарбонил, моно- или ди-низший алкиламинокарбонил, низший алкилсульфонил, моно- или ди- низший алкиламинотиокарбонил, низший алкил, который может быть замещен, или низший алканоил, который может быть замещен; R2 представляет собой низший алкил; R3 представляет собой атом водорода или низший алкоксикарбонил; В представляет собой низший алкилен или карбонил; n = 0 или 1, или их фармацевтически приемлемые соли, которые оказывают ингибирующее действие против агрегации тромбоцитов, обусловленное действием ингибитора активированного фактора X свертывающей системы крови, и полезны для применения в качестве агентов для предупреждения образования тромбов. Предложены также промежуточные соединения для их получения и фармацевтические композиции, содержащие эти производные. 4 с. и 7 з. п.ф-лы, 11 табл.
или -SO2-, X - атом кислорода или серы, W - простая связь или группа формулы NR5, R4 - гидроксил, низший алкокси, низший алкил, который может быть замещен, циклоалкил, который может быть замещен, арил, который может быть замещен, или гетероарил, содержащий 1-2 гетероатома, выбранных из серы и азота, который может быть замещен, при условии, что, когда W - группа формулы NR5, R4 может дополнительно представлять собой атом водорода, но не быть гидроксильной или низшей алкоксигруппой, R5 - атом водорода, карбамоил, низший алкоксикарбонил, моно- или ди-низший алкиламинокарбонил, низший алкилсульфонил, моно- или ди- низший алкиламинотиокарбонил, низший алкил, который может быть замещен, или низший алканоил, который может быть замещен; R2 представляет собой низший алкил; R3 представляет собой атом водорода или низший алкоксикарбонил; В представляет собой низший алкилен или карбонил; n = 0 или 1, или их фармацевтически приемлемые соли, которые оказывают ингибирующее действие против агрегации тромбоцитов, обусловленное действием ингибитора активированного фактора X свертывающей системы крови, и полезны для применения в качестве агентов для предупреждения образования тромбов. Предложены также промежуточные соединения для их получения и фармацевтические композиции, содержащие эти производные. 4 с. и 7 з. п.ф-лы, 11 табл.
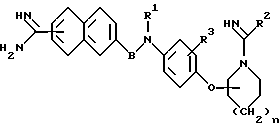
где R1 представляет собой водород или группу -A-W-R4, А означает группу формулы  группу формулы
группу формулы 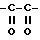 или -SO2-, Х - атом кислорода или серы, W - простая связь или группа формулы NR5, R4 - гидроксил, низший алкокси, низший алкил, который может быть замещен, циклоалкил, который может быть замещен, арил, который может быть замещен, или гетероарил, содержащий 1 - 2 гетероатома, выбранных из серы и азота, который может быть замещен, при условии, что когда W - группа формулы NR5, R4 может дополнительно представлять собой атом водорода, но не быть гидроксильной или низшей алкоксигруппой, R5 - атом водорода, карбамоил, низший алкоксикарбонил, моно- или ди-низший алкиламинокарбонил, низший алкилсульфонил, моно- или ди-низший алкиламинотиокарбонил, низший алкил, который может быть замещен, или низший алканоил, который может быть замещен;
или -SO2-, Х - атом кислорода или серы, W - простая связь или группа формулы NR5, R4 - гидроксил, низший алкокси, низший алкил, который может быть замещен, циклоалкил, который может быть замещен, арил, который может быть замещен, или гетероарил, содержащий 1 - 2 гетероатома, выбранных из серы и азота, который может быть замещен, при условии, что когда W - группа формулы NR5, R4 может дополнительно представлять собой атом водорода, но не быть гидроксильной или низшей алкоксигруппой, R5 - атом водорода, карбамоил, низший алкоксикарбонил, моно- или ди-низший алкиламинокарбонил, низший алкилсульфонил, моно- или ди-низший алкиламинотиокарбонил, низший алкил, который может быть замещен, или низший алканоил, который может быть замещен;
R2 представляет собой низший алкил;
R3 представляет собой атом водорода или низший алкоксикарбонил;
В представляет собой низший алкилен или карбонил;
n = 0 или 1, или их фармацевтически приемлемые соли.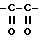 .
.
N-[4-[(1-ацетоимидоил-4-пиперидил)оксил] фенил] -N-[(7-амидино-2-нафтил)метил]-N'-метилсульфамид;
этил-N-[N-[4-[1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]сульфамоил]карбамат;
4-[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]сульфамоил]бензойная кислота;
[N-[4-[(1-ацетоимидоил-4-пиперидил)окси] фенил] N-[(7-амидино-2-нафтил)метил]сульфамоил]уксусная кислота;
этил-N-[N-[4-[1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]сульфамоил]глицинат;
N-[N-[4-[1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]сульфамоил]-N-этоксикарбонилглицин; и
N-[N-[4-(1-ацетоимидоил-4-пиперидил)окси] фенил] -N-[(7-амидино-2-нафтил)метил]сульфамоил]глицин,
или их фармацевтически приемлемые соли.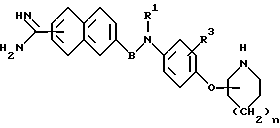
где R1 представляет собой водород или группу -A-W-R4, A означает группу формулы 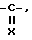 группу формулы
группу формулы 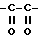 или -SO2-, Х - атом кислорода или серы, W - простая связь или группа формулы NR5, R4 - гидроксил, низший алкокси, низший алкил, который может быть замещен, циклоалкил, который может быть замещен, арил, который может быть замещен, или гетероарил, содержащий 1 - 2 гетероатома, выбранных из серы и азота, который может быть замещен, при условии, что когда W - группа формулы NR5, R4 может дополнительно представлять собой атом водорода, но не быть гидроксильной или низшей алкоксигруппой, R5 - атом водорода, карбамоил, низший алкоксикарбонил, моно- или ди-низший алкиламинокарбонил, низший алкилсульфонил, моно- или ди-низший алкиламинотиокарбонил, низший алкил, который может быть замещен или низший алканоил, который может быть замещен;
или -SO2-, Х - атом кислорода или серы, W - простая связь или группа формулы NR5, R4 - гидроксил, низший алкокси, низший алкил, который может быть замещен, циклоалкил, который может быть замещен, арил, который может быть замещен, или гетероарил, содержащий 1 - 2 гетероатома, выбранных из серы и азота, который может быть замещен, при условии, что когда W - группа формулы NR5, R4 может дополнительно представлять собой атом водорода, но не быть гидроксильной или низшей алкоксигруппой, R5 - атом водорода, карбамоил, низший алкоксикарбонил, моно- или ди-низший алкиламинокарбонил, низший алкилсульфонил, моно- или ди-низший алкиламинотиокарбонил, низший алкил, который может быть замещен или низший алканоил, который может быть замещен;
R3 представляет собой атом водорода или низший алкоксикарбонил;
В представляет собой низший алкилен или карбонил;
n = 0 или 1,
или их фармацевтически приемлемые соли.
Приоритет по пунктам и признакам:
02.12.94 - п.1, где В имеет значения -CH2-, R3-H;
28.04.95 - п.1, где В имеет остальные значения, R3 - Н; п.7 - первые четыре соединения;
03.08.95 - п.1 (все остальные соединения), п.7 - последние три соединения.
| Способ получения @ -арилсульфонил- @ -аргининамида или его солей | 1978 |
|
SU1181539A3 |
| Способ получения N @ -арил-сульфонил- @ -аргининамидов | 1979 |
|
SU1042615A3 |
| US 4443462 A, 17.04.84. | |||
Авторы
Даты
2000-08-20—Публикация
1995-12-01—Подача