Изобретение относится к пищевой промышленности и медицине и может быть использовано для определения примесных количеств малеиновой, фумаровой и щавелевой кислот в препарате кристаллической янтарной кислоты из фурфурола "ч" медицинского и пищевого назначения, ТУ 6-09-40-3237-87.
Известен способ потенциометрического (pH-метрического) определения малеиновой и фумаровой кислот в совместном присутствии, основанный на потенциометрическом титровании раствора смеси кислот, содержащей 1 -13% фумаровой кислоты в 1-пропаноле 0,1 молярным раствором гидроксида тетрабутиламмония [1] Его недостатками являются невозможность анализировать трех- и четырехкомпонентные системы и низкая чувствительность, не позволяющая определять примеси малеиновой кислоты в количествах менее 0,1%
Известен также способ определения адипиновой, малеиновой и фумаровой кислот в совместном присутствии, основанный на высокочастотном титровании раствора смеси кислот в ацетоновоэтиленгликолевой смеси (9:1) 0,1 молярным раствором гидроксида калия в бензольно-2-пропанольном растворе (4:1) [2] Недостатками этого способа являются невозможность анализировать четырехкомпонентные системы и низкая чувствительность, не позволяющая определять примеси малеиновой кислоты в количествах менее 0,1%
Наиболее близким предлагаемому способу является способ определения примесей малеиновой кислоты в кристаллической янтарной кислоте, основанный на косвенном потенциометрическом определении без проведения титрования путем растворения исследуемого препарата в воде и в 80% по объему этаноле, добавления небольших количеств буры, измерения величины pH полученных буферных растворов, приготовленных на основе химически чистой янтарной кислоты, не содержащей примесей сильных кислот и оснований и расчета массовой доли малеиновой кислоты в препарате по линейной калибровочной зависимости изменения величины pH полученного буферного раствора с ростом массовой доли определяемой малеиновой кислоты [3] Недостатками этого способа являются невозможность анализировать трех- и четырехкомпонентные системы и низкая чувствительность, не позволяющая определять примеси малеиновой кислоты в препарате в количествах менее 0,035%
Целью изобретения является обеспечение возможности анализа четырехкомпонентных систем и повышение чувствительности путем понижения нижней границы определяемых содержаний малеиновой кислоты.
Поставленная цель достигается тем, что в предлагаемом способе предусмотрено приготовление нескольких пар буферных растворов, причем один из каждой пары готовят из химически чистой янтарной кислоты, не содержащей примесей сильных кислот и оснований, а другой из анализируемого препарата, измерение величин их pH при комнатной температуре и определение массовой доли примесных количеств малеиновой, фумаровой и щавелевой кислот в препарате кристаллической янтарной кислоты. Последовательно готовят первую пару буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-3 моль/дм3 по тетраборату натрия в воде, вторую пару с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-3 моль/дм3 по уротропину в 80,0% по объему водном 2-пропаноле, третью пару с концентрацией (0,200±0,001) моль/дм 3 по янтарной кислоте и (5,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 80,0% по объему водном 2-пропаноле и определяют массовую долю щавелевой кислоты в препарате по формуле
где mщк массовая доля щавелевой кислоты в препарате, мас.
pH
pH
Массовую долю малеиновой кислоты в препарате определяют по формуле
mмк = 1,32•(pH
где mмк массовая доля малеиновой кислоты в препарате, мас.
Массовую долю фумаровой кислоты в препарате определяют по формуле
mфк = 34,5•(pH
где mфк массовая доля фумаровой кислоты в препарате, мас.
9,52; 1,71; 14,1; 1,32; 1,32; 0,612; 34,5; 3,17 и 3,66 коэффициенты пропорциональности, полученные экспериментально при решении системы трех линейных уравнений
где 0,092; 0,56; 0,85; 0,029; 0,016; 0,026; 0,106; 0,30 и 0,57 - коэффициенты линейных аддитивных калибровочных зависимостей изменения величины pH буферных растворов соответственно первой, второй и третьей пары от массовой доли соответственно добавленной малеиновой, фумаровой и щавелевой кислот, полученные также экспериментально.
При определении найденной суммарной массовой доли малеиновой и щавелевой кислот в анализируемом препарате менее 0,13% готовят четвертую пару буферных растворов с концентрацией (0,2±0,001) моль/дм3 по янтарной кислоте и (6,00±0,01)•10-3 моль/дм3 по тетраборату натрия в воде и пятую пару с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 96,0% по объему водном этаноле и определяют массовую долю фумаровой кислоты в препарате по формуле
mфк = 34,5•(pH
где pH
Массовую долю малеиновой кислоты в препарате определяют по формуле
где pH
2,15; 2,85 и 5,00 коэффициенты пропорциональности, полученные экспериментально.
Массовую долю щавелевой кислоты в препарате определяют по формуле
mщк = (PH
где 1,84 коэффициент пропорциональности, полученный экспериментально.
При определении найденной массовой доли малеиновой и щавелевой кислот в анализируемом препарате соответственно менее 0,02% и менее 0,03% готовят шестую пару буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте в 97,0 мас. в водном 2-пропаноле и определяют массовую долю фумаровой кислоты в препарате по формуле
mфк = 34,5•(pH
где pH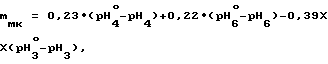
где pH
0,23; 0,22; 0,39 коэффициенты пропорциональности, полученные экспериментально, а массовую долю щавелевой кислоты в препарате по формуле
mщк = (PH
где 0,69 и 6,00 коэффициенты пропорциональности, полученные экспериментально.
Способ основан на том, что зависимость изменения величины pH буферных растворов на основе химически чистой янтарной кислоты в условиях значительного избытка кислотного компонента от массовой доли добавленной к ней более сильной, в частности малеиновой, фумаровой или щавелевой, кислоты является линейным в определенном интервале массовых долей, а также на аддитивности вклада различных кислот в уменьшение значения pH.
Величина интервала линейной зависимости потенциометрического сигнала и ее углового коэффициента определяются как природой добавленной кислоты и растворителя, так и составом буферной смеси. Для каждого водноорганического растворителя можно подобрать оптимальное соотношение количеств кислотного и основного компонентов буферной смеси, при котором линейный участок имеет максимальную протяженность. При дальнейшем увеличении количества основного компонента зависимость становится S-образной, и линейной ее считать уже нельзя.
На фиг. 1 представлены зависимости изменения величины pH буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и 0; (5,00±0,01)•10-4; (1,00±0,01)•10-3; (2,00±0,01)•10-3 моль/дм3 по тетраборату натрия и (2,00±0,01)• 10-3 моль/дм3 по уротропину соответственно в 80,0% по объему водном 2-пропаноле от массовой доли добавленной к ней малеиновой кислоты (кривые 1-5 соответственно). Из нее видно, что оптимальными являются кривые 2 и 5, обеспечивающие максимальную протяженность интервала линейности при высоком угловом коэффициенте начального участка зависимости. При замене воды смешанным водноорганическим растворителем угловые коэффициенты начального указанной зависимости меняются по-разному: для фумаровой не более чем в 2 раза, для щавелевой в несколько раз, а для малеиновой в несколько десятков раз. Это и создает возможность селективного определения примесных количеств малеиновой, фумаровой и щавелевой кислот в кристаллической янтарной кислоте благодаря использованию нескольких пар буферных растворов в различных растворителей, выбранных экспериментально. Использование в случае второй пары буферных растворов уротропина в качестве основного компонента позволяет максимально расширить интервал линейности и заметно уменьшить угловой коэффициент начального участка зависимости (как видно из фиг.1), что необходимо для обеспечения селективности определения.
Использование водного буферного раствора с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-3 моль/дм3 по тетраборату натрия предпочтительнее в первом случае, так как угловые коэффициенты начальных участков зависимости для малеиновой и щавелевой кислот все еще достаточно высоки для обеспечения приемлемого разброса результатов. В случае же, если суммарное содержание малеиновой и щавелевой кислот в анализируемом препарате не превышает 0,13% предпочтительнее становится использование водного буферного раствора с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (6,00±0,01)•10-3 моль/дм3 по тетраборату натрия, так как в этом случае вклад малеиновой и щавелевой кислот в изменение величины pH настолько мал (из-за низких значений их угловых коэффициентов в этой среде), что составляет меньше 0,007 единицы pH и практически не регистрируется. Это заметно упрощает расчет, следствием чего является уменьшение среднего стандартного отклонения получаемых значений.
Благодаря использованию пятой пары буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 96,0% по объему водном этаноле со значительно более высоким значением углового коэффициента зависимости изменения величины pH от массовой доли малеиновой кислоты в препарате обеспечивается значительное повышение чувствительности, что позволяет значительно снизить нижнюю границу определяемых содержаний малеиновой кислоты до 0,02% Применение же шестой пары буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте в 97,0% по массе в водном 2-пропаноле позволяет снизить ее до 0,004% по малеиновой кислоте, но интервал аддитивности этой системы не превышает 0,02% по малеиновой кислоте и 0,03% по щавелевой кислоте.
На фиг. 2 представлены зависимости изменения величины pH буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и соответственно (5,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 80,0% по объему водном 2-пропаноле, (2,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 96,0% по объему водном этаноле и в отсутствие основного компонента в 97,0% по массе водном 2-пропаноле от массовой доли добавленной к ней малеиновой кислоты (кривые 1 3 соответственно).
На фиг.3 представлена зависимость среднего стандартного отклонения предлагаемого способа от массовой доли взятой малеиновой кислоты в препарате (сплошная линия).
Аналитические выражения зависимостей средних стандартных отклонений от массовой доли взятой малеиновой и щавелевой кислот при использовании различных комбинаций буферных систем представлены в табл.1. Штрихпунктирной линией обозначена нижняя граница массовая доля малеиновой кислоты
Sr 0,33•mмк
Пунктирной линией обозначена зависимость среднего стандартного отклонения предлагаемого способа от массовой доли взятой малеиновой кислоты в условиях присутствия больших количеств щавелевой кислоты (более 0,08%), не позволяющих пользоваться пятой парой буферных растворов. Из фиг.3 видно, что в этом случае результаты находятся за нижней границей определяемых содержаний малеиновой кислоты.
Таким образом, только использование комбинации указанных шести пар буферных растворов позволяет селективно определить массовой доли щавелевой (0,01 -0,1% ) кислот в препарате кристаллической янтарной кислоты, причем присутствие муравьиной и яблочной кислот в количествах не более 0,1% не мешает определению.
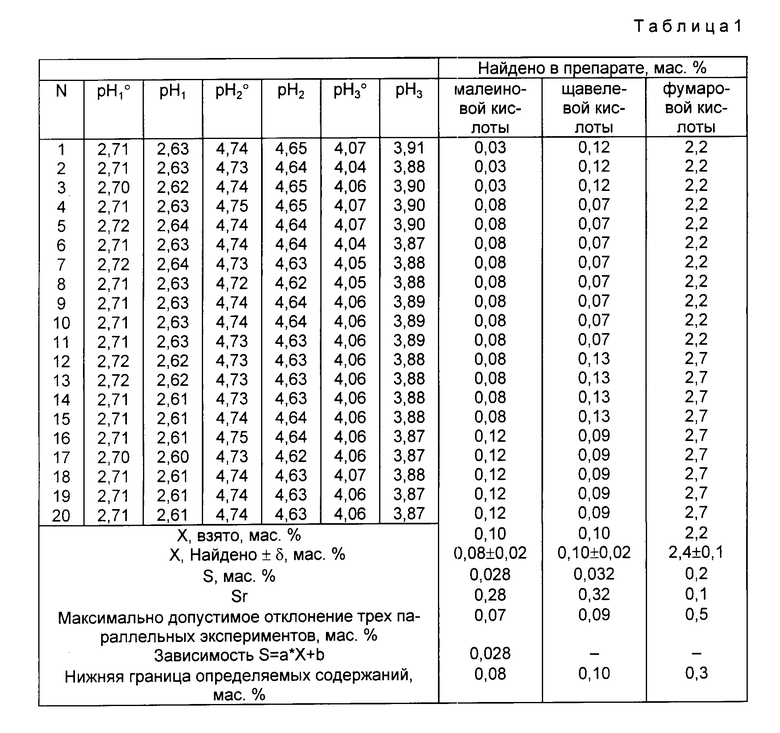
Таким образом, только совокупность существенных признаков позволяет достичь технический результат, а именно обеспечить возможность анализа четырехкомпонентных систем и повысить чувствительность путем понижения нижней границы определяемых содержаний малеиновой кислоты до 0,004 мас.2 Пример 1. В три чистые сухие мерные колбы вместимостью 100,00 см3 вносят по (2,23±0,01) г химически чистой янтарной кислоты, не содержащей примесей сильных кислот и оснований по ГОСТ 6341-75, после чего в первую мерную колбу вносят (0,0762±0,0003) г буры Na2B4O7•10H2O, во вторую - (0,0281±0,0001)г уротропина, а в третью (0,0191±0,0001) г буры Na2B4O7•10H2O. Затем содержимое первой колбы растворяют в дистиллированной воде, доводят до метки и перемешивают. Полученный раствор в 1 дм3 содержит (0,200±0,001) моль янтарной кислоты и (2,00±0,01)•10-3 моль тетрабората натрия. Содержимое второй и третьей колб растворяют в 80,0% по объему водном 2-пропаноле, полученном путем прибавления 50,00 см3 дистиллированной воды, отмеренной с помощью пипетки Мора вместимостью 50,00 см3, к 200,00 см3 химически чистого 2-пропанола, Ту 6-09-402-87, отмеренной с помощью пипетки Мора вместимостью 100,00 см3 в конической колбе емкостью 500 см3 и тщательного перемешивания, также доводят им содержимое второй и третьей колб до метки и перемешивают. Полученные растворы в 1 дм3 содержат по (0,200±0,001) моль янтарной кислоты и соответственно (2,00±0,01)• 10-3 моль уротропина и (5,00±0,01)•10-4 моль тетрабората натрия. После этого в три другие чистые сухие мерные колбы вместимостью 100,00 см3 вносят по (2,23±0,01) г анализируемого препарата кристаллической янтарной кислоты, после чего в первую мерную колбу вносят (0,0762±0,0003) г буры Na2B 4O7•10H2O, во вторую - (0,0281±0,0001) г уротропина, а в третью (0,0191±0,0001) г буры Na2B 4O7•10H2O. Затем содержимое первой колбы растворяют в дистиллированной воде, а содержимое второй и третьей колб в 80,0% по объему водном 2-пропаноле, доводят до меток и перемешивают. Величину pH каждого полученного буферного раствора измеряют при комнатной температуре с помощью цифрового pH-метра, обеспечивающего погрешность измерения величины pH с погрешностью ±0,01 0,02 единицы pH, причем проводят три параллельных измерения для каждого полученного буферного раствора, для чего из каждой мерной колбы в три химических стакана вместимостью 50,00 см3 вносят приблизительно по 25-30 см3 соответствующего буферного раствора. Измеренные в ходе трех параллельных измерений величины pH для водного буферного раствора с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10 -3 моль/дм3 по тетраборату натрия, приготовленного из химически чистой янтарной кислоты, не содержащей примесей сильных кислот и оснований, составляют 2,71; 2,71; 2,70; а из анализируемого препарата 2,63; 2,61; 2,60; в то время как величины pH для буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-3 моль/дм3 по уротропину в 80,0% по объему водном 2-пропаноле составляют соответственно 4,75; 4,75; 4,73 и 4,65; 4,64; 4,62; а величины pH для буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (5,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 80,0% по объему водном 2-пропаноле составляют соответственно 4,07; 4,06; 4,06 и 3,90; 3,87; 3,87. Массовую долю щавелевой кислоты в препарате кристаллической янтарной кислоты определяют по формуле
где mщк массовая доля щавелевой кислоты в препарате, мас.
pH
pH
9,52; 1,71 и 14,10 коэффициенты пропорциональности, полученные экспериментально.
Результаты трех параллельных определений дают соответственно значения массовой доли щавелевой кислоты в препарате, равные 0,07% 0,10% и 0,10% Их среднее арифметическое составляет 0,09% Массовую долю малеиновой кислоты в препарате кристаллической янтарной кислоты определяют по формуле
mмк = 1,32•(pH
где mмк массовая доля малеиновой кислоты в препарате, мас.
1,32; 1,32; 0,612 коэффициенты пропорциональности, полученные экспериментально.
Результаты трех параллельных определений дают соответственно значения массовой доли малеиновой кислоты в препарате, равные 0,08% 0,12% и 0,12% Их среднее арифметическое составляет 0,11% Все три значения находятся в пределах максимального отклонения трех параллельных определений, составляющего ±0,07% для данного случая. Массовую долю фумарной кислоты в препарате кристаллической янтарной кислоты определяют по формуле
mфк = 34,5•(pH
где mфк массовая доля фумарной кислоты в препарате, мас.
34,5; 3,17 и 3,66 коэффициенты пропорциональности, полученные экспериментально.
Результаты трех параллельных определений дают соответственно значения массовой доли фумарной кислоты в препарате, равные 2,2% 2,7% и 2,7% Их среднее арифметическое составляет 2,4% Все три значения находятся в пределах максимального отклонения трех параллельных определений, составляющего ±0,5% для данного случая. Результаты определения и метрологические параметры представлены в табл.1.
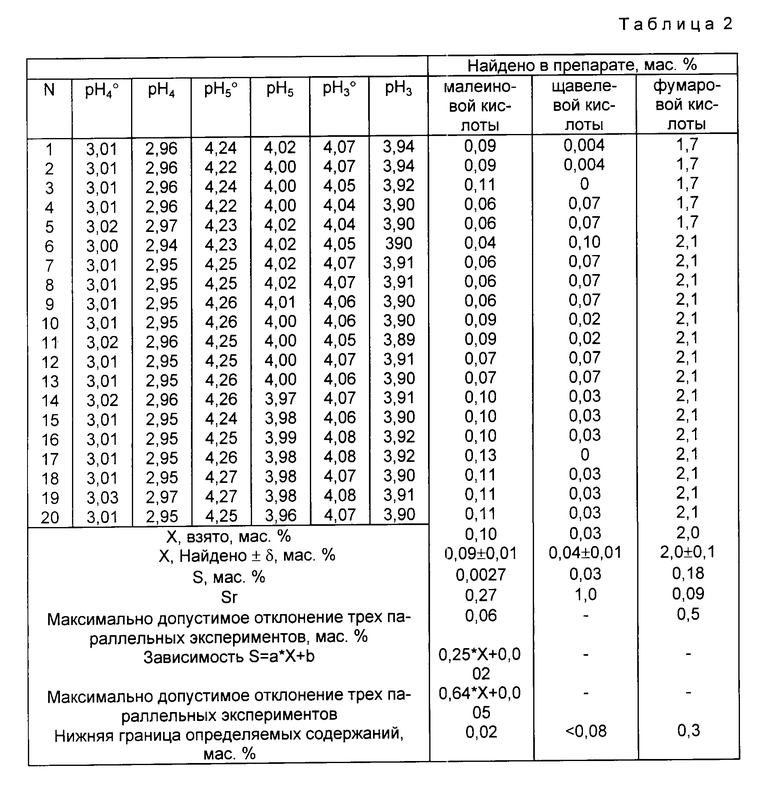
Пример 2. В три чистые сухие мерные колбы вместимостью 100,00 см3 вносят по (2,23±0,01) г химически чистой янтарной кислоты, не содержащей примесей сильных кислот и оснований по ГОСТ 6341-75, после чего в первую мерную колбу вносят (0,2286±0,0003) г буры Na2B4O7•10H2O, во вторую - (0,0076±0,0001)г буры Na2B4O7• 10H2O, а в третью (0,0191±0,0001) г буры Na2B4O7•10H2O. Затем содержимое первой колбы растворяют в дистиллированной воде, доводят до метки и перемешивают. Полученный раствор в 1 дм3 содержит (0,200±0,001) моль янтарной кислоты и (6,00±0,01)•10-3 моль тетрабората натрия. Содержимое второй колбы растворяют в 96,0% по объему водном этаноле, также доводят до метки и перемешивают, причем полученный раствор в 1 дм3 содержит (0,200±0,001) моль янтарной кислоты и (2,00±0,01)•10-4 моль тетрабората натрия, а содержимое третьей колбы растворяют в 80,0% по объему водном 2-пропаноле, также доводят содержимое до метки и перемешивают, причем полученный раствор в 1 дм3 содержит (0,200±0,001) моль янтарной кислоты и (5,00±0,01)•10-4 моль тетрабората натрия. После этого в три другие чистые сухие мерные колбы вместимостью 100,00 см3 вносят по (2,23±0,01) г анализируемого препарата кристаллической янтарной кислоты, после чего в первую мерную колбу вносят (0,2286±0,0003)г буры Na2B 4O7•10H2O, во вторую (0,0076±0,0001) г буры Na2B4O7•10H2O, а в третью - (0,0191±0,0001) г буры Na2B4O7•10H 2O. Затем содержимое первой колбы растворяют в дистиллированной воде, а содержимое второй в 96,0% по объему водном этаноле, а третьей в 80% по объему водном 2-пропаноле, доводят до меток и перемешивают. Величину pH каждого полученного буферного раствора измеряют при комнатной температуре с помощью цифрового pH-метра, обеспечивающего погрешность измерения величины pH с погрешностью ±0,01 0,02 единицы pH, причем проводят три параллельных измерения для каждого полученного буферного раствора, для чего из каждой мерной колбы в три химические стакана вместимостью 50,00 см3 вносят приблизительно по 25-30 см3 соответствующего буферного раствора. Измеренные в ходе трех параллельных измерений величины pH для водного буферного раствора с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (6,00±0,01)• 10 -3 моль/дм3 по тетраборату натрия, приготовленного из химически чистой янтарной кислоты, не содержащей примесей сильных кислот и оснований, составляют 3,01; 3,02; 3,01; а из анализируемого препарата 2,95; 2,96; 2,95; в то время как величины pH для буферных растворов с концентрацией (0,200±0.001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-3 моль/дм3 по тетраборату натрия в 96,0% по объему водном этаноле составляют соответственно 4,25; 4,24; 4,25 и 4,00; 3,97; 3,96; а величины pH для буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (5,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 80,0% по объему водном 2-пропаноле составляют соответственно 4,06; 4,07; 4,07 и 3,90; 3,91; 3,90. Массовую долю фумаровой кислоты в препарате кристаллической янтарной кислоты определяют по формуле
mфк = 34,5•(pH
где pH
Результаты трех параллельных определений дают соответственно значения массовой доли фумаровой кислоты в препарате, равные 2,1% 2,1% и 2,1% Их среднее арифметическое составляет 2,1% Все три значения находятся в пределах максимального отклонения трех параллельных определений, составляющего ±0,5% для данного случая. Массовую долю малеиновой кислоты в препарате кристаллической янтарной кислоты определяют по формуле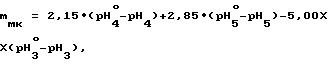
где pH
2,15; 2,85 и -5,00 коэффициенты пропорциональности, полученные экспериментально.
Результаты трех параллельных определений дают соответственно значения массовой доли малеиновой кислоты в препарате, равные 0,09% 0,10% и 0,11% Их среднее арифметическое составляет 0,10% Все три значения находятся в пределах максимального отклонения трех параллельных определений, составляющего ±0,06% для данного случая. Массовую долю щавелевой кислоты в препарате определяют по формуле
mщк = (PH
где -1,84 коэффициент пропорциональности, полученный экспериментально.
Результаты трех параллельных определений дают соответственно значения массовой доли щавелевой кислоты в препарате, равные 0,02% 0,03% и 0,03% Их среднее арифметическое составляет 0,03%
Результаты определения и метрологические параметры представлены в табл. 2.
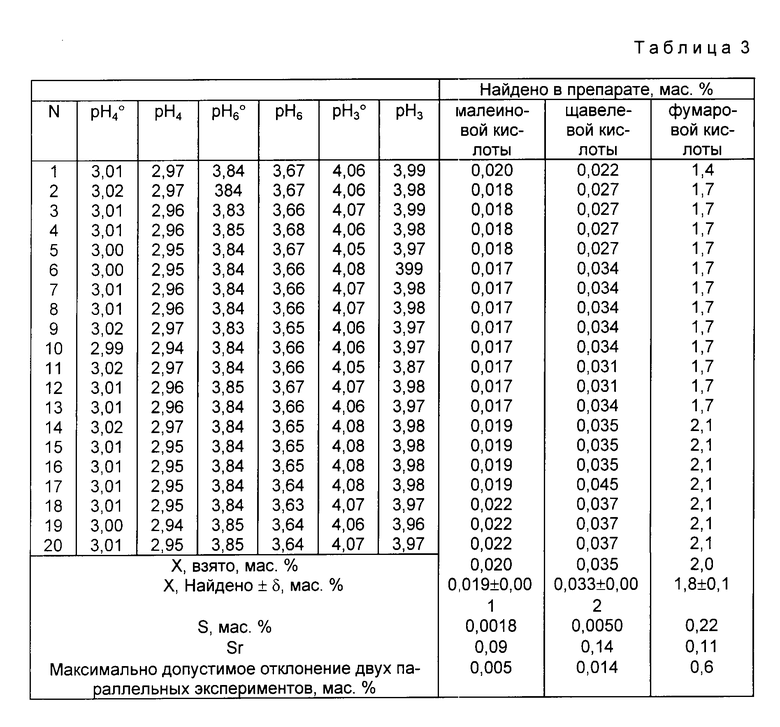
Пример 3. В три чистые сухие мерные колбы вместимостью 100,00 см3 вносят по (2,23±0,01) г химически чистой янтарной кислоты, не содержащей примесей сильных кислот и оснований по ГОСТ 6341-75, после чего в первую мерную колбу вносят (0,2286±0,0003) г буры Na2B4O7•10H2O, а в третью - (0,0191±0.0001) г буры Na2B4O7•10H2O. Затем содержимое первой колбы растворяют в дистиллированной воде, доводят до метки и перемешивают. Полученный раствор в 1 дм3 содержит (0,200±0,001) моль янтарной кислоты и (6,00±0,01)•10-3 моль тетрабората натрия. Содержимое второй колбы растворяют в 97,0% по массе водном 2-пропаноле, полученном путем внесения 2,40±0,01 см3 дистиллированной воды, отмеренной с помощью пипетки вместимостью 2,00 см3, в мерную колбу вместимостью 100,00 см3 и доведения ее до метки химически чистым 2-пропанолом, ТУ 6-09-402-87, при комнатной температуре, доводят содержимое до метки и перемешивают, причем полученный раствор в 1 дм3 содержит (0,200±0,001) моль янтарной кислоты, а третьей колбы в 80,0% по объему водном 2-пропиноле, также доводят содержимое до метки и перемешивают, причем полученный раствор в 1 дм3 содержит (0,200±0,001) моль/дм3 янтарной кислоты и (5,00±0,01)•10 -4 моль тетрабората натрия. После этого в три другие чистые сухие мерные колбы вместимостью 100,00 см3 вносят по (2,23±0,01) г анализируемого препарата кристаллической янтарной кислоты, после чего в первую мерную колбу вносят (0,2286±0,0003)г буры Na2B 4O7•10H2O, а в третью (0,0191±0,0001) г буры Na2B4O7•10H2O. Затем содержимое первой колбы растворяют в дистиллированной воде, второй в 97,0% по массе водном 2-пропаноле, а третьей в 80% по объему водном 2-пропаноле, доводят до меток и перемешивают. Величину pH каждого полученного буферного раствора измеряют при комнатной температуре с помощью цифрового pH-метра, обеспечивающего погрешность измерения величины pH с погрешностью ±0,01 0,02 единицы pH, причем проводят три параллельных измерения для каждого полученного буферного раствора, для чего из каждой мерной колбы в три химические стакана вместимостью 50,00 см3 вносят приблизительно по 25-30 см3 соответствующего буферного раствора. Измеренные в ходе трех параллельных измерений величины pH для водного буферного раствора с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (6,00±0,01)•10-3 моль/дм3 по тетраборату натрия, приготовленного из химически чистой янтарной кислоты, не содержащей примесей сильных кислот и оснований, составляют 3,01; 3,02; а из анализируемого препарата 2,96; 2,97; в то время как величины pH для буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (5,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 80,0% по объему водном 2-пропаноле составляют соответственно 4,06; 4,08; и 3,97; 3,98. Массовую долю фумаровой кислоты в препарате кристаллической янтарной кислоты определяют по формуле
mфк = 34,5•(pH
где pH
Результаты двух параллельных определений дают соответственно значения массовой доли фумаровой кислоты в препарате, равные 1,7% и 2,1% Их среднее арифметическое составляет 1,9% Оба значения находятся в пределах максимального отклонения двух параллельных определений, составляющего ±0,6% для mфк, равного 1,9% Массовую долю малеиновой кислоты в препарате кристаллической янтарной кислоты определяют по формуле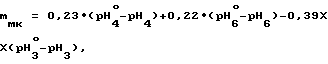
где pH
0,23; 0,22 и 0,39 коэффициенты пропорциональности, полученные экспериментально.
Результаты двух параллельных определений дают соответственно значения массовой доли малеиновой кислоты в препарате, равные 0,017% и 0,019% Их среднее арифметическое составляет 0,018% Оба значения находятся в пределах максимального отклонения двух параллельных определений, составляющего ±0,005% для mмк, равного 0,019% Массовую долю щавелевой кислоты в препарате определяют по формуле
mщк = (PH
где 0,69 и -6,00 коэффициенты пропорциональности, полученные экспериментально.
Результаты трех параллельных определений дают соответственно значения массовой доли щавелевой кислоты в препарате, равные 0,034% и 0,035% Их среднее арифметическое составляет 0,035% Оба значения находятся в пределах максимального отклонения двух параллельных определений, составляющего ±0,014% для mщк, равного 0,035% Результаты определения и метрологические параметры представлены в табл.3.
Пример 4. Как в примере 3, но измеренные в ходе двух параллельных измерений величины pH для водного буферного раствора с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (6,00±0,01)•10-3 моль/дм3 по тетраборату натрия, приготовленного из химически чистой янтарной кислоты, не содержащей примесей сильных кислот и оснований, составляют 3,02; 3,01; а из анализируемого препарата 2,97; 2,96; в то время как величины pH для буферных растворов с концентрацией (0,200±0,001)моль/дм3 по янтарной кислоте в 97,0% по массе водном 2-пропаноле составляют соответственно 3,67; 3,62; и 3,60; 3,56; а величины pH для буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (5,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 80,0% по объему водном 2-пропаноле составляют соответственно 4,06; 4,09; и 4,00; 4,03. Массовую долю фумаровой, малеиновой и щавелевой кислот в препарате кристаллической янтарной кислоты определяют по тем же формулам, что и в примере 6.
Результаты двух параллельных определений дают соответственно значения массовой доли фумаровой кислоты в препарате, равные 1,7% и 1,7% Их среднее арифметическое составляет 1,7% Оба значения находятся в пределах максимального отклонения двух параллельных определений, составляющего ±0,5% для mфк, равного 1,7% Результаты двух параллельных определений дают соответственно значения массовой доли малеиновой кислоты в препарате, равные 0,004% и 0,006% Их среднее арифметическое составляет 0,005% Оба значения находятся в пределах максимального отклонения двух параллельных определений, составляющего ±0,004% для mмк, равного 0,005% Результаты двух параллельных определений дают соответственно значения массовой доли щавелевой кислоты в препарате, равные 0,013% и 0,010% Их среднее арифметическое составляет 0,012% Оба значения находятся в пределах максимального отклонения двух параллельных определений, составляющего ±0,014% для mщк, равного 0,012% результаты определения и метрологические параметры представлены в табл.4.



Использование: в пищевой промышленности и медицине, определение примесных количеств малеиновой, фумаровой и щавелевой кислот в препарате кристаллической янтарной кислоты из фурфурола "ч" медицинского и пищевого назначения, ТУ 6-09-40-3237-87. Сущность изобретения: последовательно готовят первую пару буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-3 моль/дм3 по тетраборату натрия в воде, вторую пару - с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-3 моль/дм3 по уротропину в 80,0% по объему водном 2-пропаноле, третью пару - с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (5,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 80,0% по объему водном 2-пропаноле и, зная значения величин их pH, определяют массовую долю щавелевой, малеиновой и фумаровой кислот в препарате, при определении найденной суммарной массовой доли малеиновой и щавелевой кислот в анализируемом препарате менее 0,13% готовят четвертую пару буферных растворов с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (6,00±0,01)•10-3 моль/дм3 по тетраборату натрия в воде и пятую пару - с концентрацией (0,200±0,001) моль/дм3 по янтарной кислоте и (2,00±0,01)•10-4 моль/дм3 по тетраборату натрия в 96,0% по объему водном этаноле и определяют массовую долю фумаровой, малеиновой и щавелевой кислот в препарате, а при определении найденной массовой доли малеиновой и щавелевой кислот в препарате, а при определении найденной массовой доли малеиновой и щавелевой кислот в препарате соответственно менее 0,02% и 0,03% готовят шестую пару буферных растворов с концентрацией (0,200±0,01) моль/дм3 по янтарной кислоте в 97,0 мас.% в водном 2-пропаноле и определяют массовую долю фумаровой, малеиновой и щавелевой кислот в препарате кристаллической янтарной кислоты. 2 з.п. ф-лы, 4 табл. 3 ил.

где mщ. к массовая доля щавелевой кислоты в препарате, мас.
pH
pH
9,52, 1,71 и 14,10 коэффициенты пропорциональности, полученные экспериментально,
массовую долю малеиновой кислоты в препарате по формуле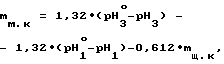
где mм.к массовая доля малеиновой кислоты в препарате, мас.
1,32, 1,32, 0,612 коэффициенты пропорциональности, полученные экспериментально,
массовую долю фумаровой кислоты в препарате по формуле
где mф. к массовая доля фумаровой кислоты в препарате, мас.
34,5, 3,17 и 3,66 коэффициенты пропорциональности, полученные экспериментально.

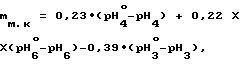

| Trzmielewska H | |||
| Potencjometryczncoznaczanie Kwdzu fumarouego obok kwaru maleinowego i bez walniku maleinowego II Chem | |||
| and l | |||
| (PRI), 1979, т | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| Способ восстановления электрических ламп накаливания с разрушенными нитями | 1921 |
|
SU693A1 |
| SU, авторское свидетельство, 427279, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Акулинин В.Е., Рувинский О.Е., Бадовская Л.А | |||
| Способ приготовления сернистого красителя защитного цвета | 1921 |
|
SU84A1 |
| докл | |||
| - Краснодар, 1994, с | |||
| Способ сопряжения брусьев в срубах | 1921 |
|
SU33A1 |
Авторы
Даты
1997-12-10—Публикация
1996-01-05—Подача