Изобретение относится к медицине, а именно к методам повышения устойчивости живых тканей к лучистой энергии и ее последействию.
Предупреждение или ослабление воздействия лучистой энергии на живые ткани осуществляется целым рядом химических, биологических и физиологических методов. Химические и биологические методы противорадиационной защиты включают использование лекарственных средств и биопрепаратов, которые повышают резистентность тканей к лучистой энергии. Применяются препараты (мексамин), вызывающие гипоксию в клетках (М.Д. Машковский, 1988). Средства типа диэтилстильбэстрола приводят к уменьшению потребности тканей в кислороде и обратимому цитостатическому действию. Кроме того, резистентность тканей к лучистой энергии повышают антиоксиданты, адаптогены, стимуляторы, нуклеиновые кислоты, витаминно-аминокислотные комплексы (А.С. Мозжухин и соавт. 1979; А.К. Гуськова и соавт. 1989; П. Куна, 1989; И.С. Бадюгин, 1992). В качестве радиопротекторов широко применяются аминотиолы (диаминодиэтилсульфид) и тиофосфорные препараты (цистафос), которые поглощают энергию возбужденных молекул, нейтрализуют образующиеся продукты радиолиза воды и липоперекиси (Н.Н. Суворов и соавт. 1975; И.С. Бадюгин, 1992).
Однако применение химико-биологических методов предполагает введение в клетку лекарственных веществ, которые влияют на ее биохимизм и приводят к возникновению побочного действия. Кроме того, они эффективны как профилактические средства и не оказывают влияния на последействие лучистой энергии в тканях.
Наиболее близким по технической сущности являются физические методы профилактики лучевых поражений экранирование защищаемых тканей. Однако данные методы не повышают устойчивость живых клеток к лучистой энергии и не уменьшают ее последействие в тканях.
Целью изобретения является повышение эффективности и физиологичности способа за счет возможности воздействия на ткани в условиях in vivo прерывистым световым потоком до возникновения в них эффекта просветления среды и развития при этом в прилежащих тканях резистентности к лучистой энергии и ее последействию.
Эта цель достигается следующим способом.
Защищаемый клеточный материал размещают в непосредственной близости (0,1 1,0 см) от живых тканей, которые будут подвергаться воздействию прерывистого светового потока. Для индикации защитного взаимодействия тканей с клеточным материалом используется взвесь живых бактериальных клеток в стерильном физиологическом растворе (0,5 1,0 млрд. микробных тел в 1 см3 раствора), равные количества которой (0,8 1,0 см3) в стерильных пробирках помещаются рядом с защищаемым клеточным материалом (опыт) и на удалении (3 4 м) от него (контроль). При индикации повышения резистентности клеточного материала к последействию лучистой энергии индикаторные взвеси заранее подвергают соответствующему виду облучения, а при индикации защиты от предстоящего облучения индикаторные взвеси подвергают воздействию лучистой энергии после взаимодействия с освещаемыми прерывистым светом тканями.
Освещение прерывистым световым потоком с одновременным измерением светопроводности тканей in vivo осуществляется с помощью устройства и способом, разработанными нами (В.Г. Журавель, 1991; 1992) по следующей методике. Через тубус светового излучателя на ткани в условиях in vivo проводится световой поток, получаемый от лампы мощностью 100 300 Вт. В течение 15 30 с на живую ткань воздействуют светом с одновременным измерением ее светопроводности. Затем воздействие прекращается на 15 30 с. Далее вновь осуществляется световое облучение этого же участка ткани в течение 15 30 с при одновременном измерении ее светопроводности. Проводимое таким образом прерывистое освещение ткани продолжается до регистрации в ней эффекта просветления среды (В.Г. Журавель, 1993).
Затем индикаторные взвеси засевают на твердую питательную среду в чашках Петри. Инкубируют 18 24 ч при 37oC и проводят подсчет колоний в опыте (n1) и в контроле (n2). При статистически достоверном неравенстве n1 > n2 считается, что резистентность защищаемого клеточного материала к лучистой энергии или ее последействию повышена.
Примеры конкретного применения.
Методы исследований.
1. Световое воздействие на ткани (кожа человека и листья растения сциндаксус золотистый) в условиях in vivo с одновременным измерением их светопроводности осуществлялось с помощью устройства и способа, разработанных нами.
Способ определения светопроводности кожи человека (патент N 1802869, 1991).
Устройство для определения светопроводности кожи человека in vivo (заявка N 5035395/14 (015786) от 1.04.92), состоящее из светового излучателя, фотоэлемента, подключенного к амперметру, отличается тем, что с целью снижения травматичности исследования, повышения его физиологичности за счет возможности регистрации светопроводности кожи в условиях in vivo, содержит съемные тубусы для проведения светового потока на кожу и приспособления для фиксации фотоэлемента и тубусов светового излучателя над поверхностью кожи и на ее поверхности.
2. Изменения оптических свойств освещаемых прерывистым светом тканей и прилежащего к ним клеточного материала определялись разработанным нами способом (заявка N 93020255/14 (020312) от 20.04.93).
Способ определения изменения функционального состояния кожи человека в условиях in vivo при эффекте просветления ее тканей под воздействием прерывистого света отличается тем, что с целью снижения травматичности способа, повышения его физиологичности за счет возможности регистрации изменения состояния кожи in vivo размещают объект живой природы, обладающий способностью под воздействием прерывистого света повышать свою светопроводность вблизи исследуемого участка кожи, затем на этот участок кожи воздействуют прерывистым белым светом до появления эффекта просветления ее тканей, а возникающее при этом изменение функционального состоянии кожи регистрируют по отсутствию эффекта просветления или затемнению тканей опытного объекта.
Для излучения бактериостатического и цитостатического действия лучистой энергии использовались стафилококки и одноклеточные класса Ciliata.
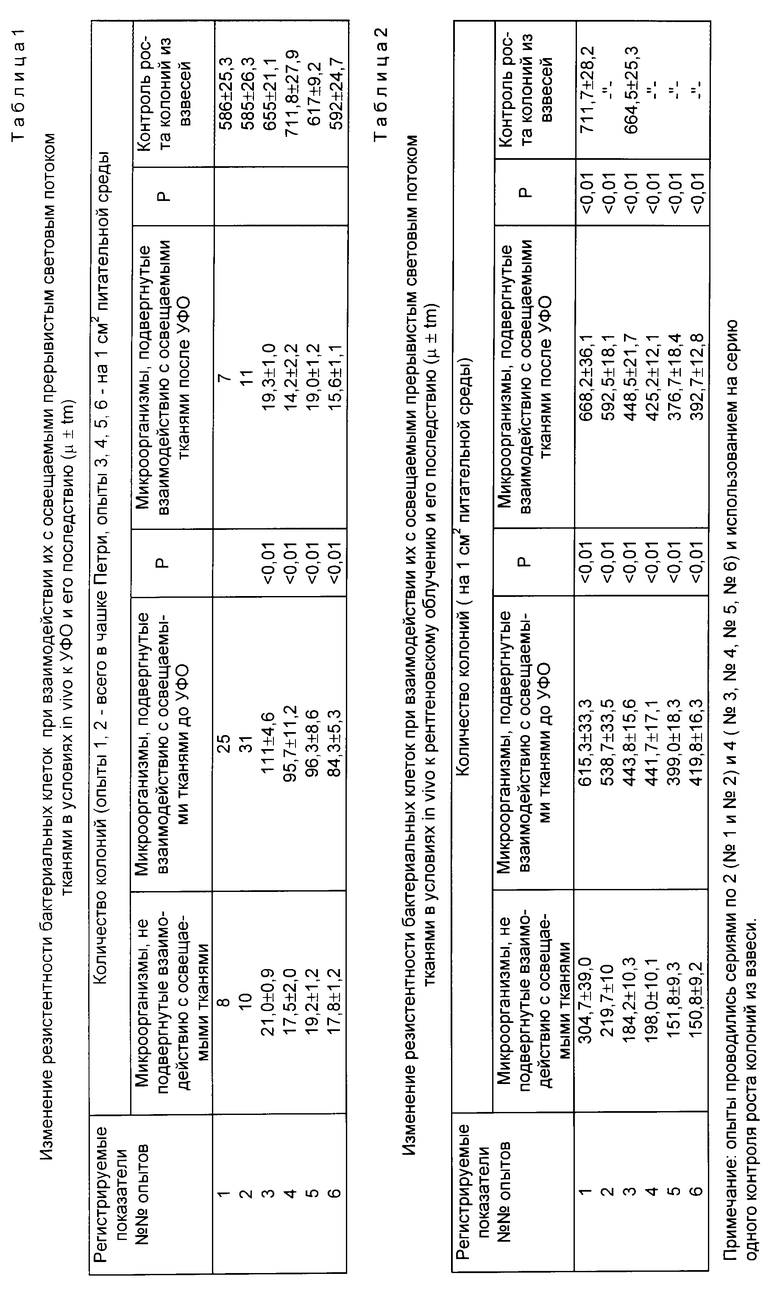
Взвесь живых стафилококков в стерильном физиологическом растворе (0,5 - 1,0 млрд. микробных тел в 1 см3) разливали в равных количествах (0,8 - 1,0 см3) в четыре стерильные пробирки, из которых одна (N 4) служила для контроля роста микроорганизмов из взвеси. Затем пробирку N 2 размещали вблизи (0,1 1,0 см) участка кожи человека, подвергаемого воздействию прерывистого света с одновременным измерением величины светопроводности кожи по 15 30 с с интервалами 15 30 с до регистрации эффекта просветления среды в тканях кожи. Затем содержимое пробирок N 1, 2, 3 разливали в открытые стерильные чашки Петри и облучали их ультрафиолетовыми лучами (УФЛ) 180 400 нм 5 8 с с расстояния 0,6 м от лампы мощностью 900 Вт. Далее содержимое чашек помещали вновь в соответствующие пробирки N 1, 2, 3. Пробирку N 3 со взвесью кокков размещали вблизи (0,1 1,0 см) участка кожи человека, на который воздействовали прерывистым белым светом по вышеописанной методике. После этого взвеси из пробирок засевали на твердую питательную среду (мясо-пептонный агар) в чашках Петри. Подсчет колоний проводили через 18 24 ч инкубации при 37oC.
Полученные результаты представлены в табл.1.
Как видно, из взвесей, находившихся до УФО вблизи освещаемого прерывистым светом участка кожи, высевалось большее число колоний, чем из взвесей, подвергнутых воздействию освещаемой кожи человека после УФО, и взвесей, не подвергнутых такому воздействию вовсе.
В табл.2 представлены результаты повышения резистентности микроорганизмов к рентгеновскому облучению. Ход опытов аналогичен вышеописанному. Только взвеси кокков в данном случае подвергались рентгеновскому облучению непосредственно в пробирках. Дозы облучения составляли 3 мэВ (опыты 1, 3, 4) и 6 мэВ (опыты 2, 5, 6). Видно, что микроорганизмы из взвесей, подвергнутых взаимодействию с освещаемыми тканями кожи человека до и после рентгеновского облучения, дали рост большего числа колоний по сравнению с контролем. Это свидетельствует о том, что при рентгеновском облучении данное взаимодействие повышает резистентность клеток также и к последействию лучистой энергии рентгеновского диапазона.
Применение одноклеточных класса Ciliata как индикатора лучевого поражения осуществлялось следующим образом.
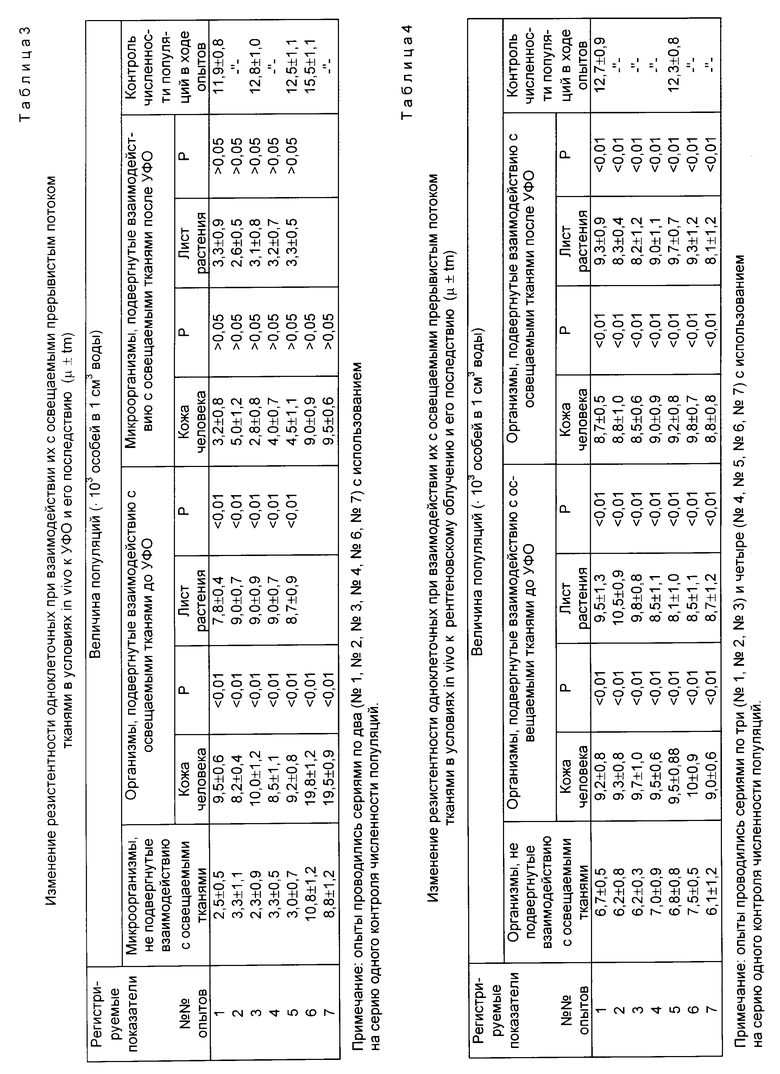
Из флакона, содержащего 12 20 тысяч особей в 1 см3 воды, разливали равные количества взвеси (10 см3) в шесть пробирок, из которых одна (N 6) служила для контроля численности популяций в ходе опыта.
Популяции, находящиеся в пробирке N 2, размещали вблизи участка кожи, подвергаемого освещению прерывистым светом по вышеописанной методике с одновременным измерением светопроводности ее тканей. Клеточный материал в пробирке N 3 размещали вблизи живого листа растения сциндаксус золотистый, подвергаемого воздействию прерывистого светового потока. Затем содержимое пробирок NN 1, 2, 3, 4, 5 выливали в открытые чашки Петри и все взвеси одновременно подвергали воздействию интегрального УФО (180 400 нм) в течение 7 8 мин с расстояния 1,2 м (опыты 1, 2, 3, 4) от лампы мощностью 900 Вт. Далее клеточный материал вновь помещали в соответствующие пробирки. Содержимое пробирки N 4 размещали вблизи участка кожи, а пробирки N 5 вблизи листа растения, на которые воздействовали прерывистым световым потоком по вышеописанной методике. В опытах 5 и 6 воздействие освещаемых тканей кожи и растения на клеточный материал проводились дважды до УФО и дважды после, а длительность УФО составляла 4 мин.
Учет результатов подсчет живых особей проводился каждые 20 24 ч. Различия в величине популяций были отмечены через 100 ч наблюдений. Полученные данные представлены в табл. 3. Как видно, повышение резистентности клеток отмечалось только при взаимодействии их с освещаемыми прерывистым светом тканями до УФО. Повышение резистентности одноклеточных к последействию УФЛ в большинстве опытов не регистрировалось.
Исследование повышения резистентности одноклеточных к рентгеновскому излучению проводилось по вышеописанной методике. Только рентгеновское облучение клеточного материала проводилось непосредственно в пробирках. Доза облучения составила 12 15 мэВ.
Различия в величине популяций были отмечены через 120 140 ч наблюдений. Полученные результаты представлены в табл.4.
Как видно, численность популяций, подвергнутых взаимодействию с освещаемыми прерывистым светом тканями, превышает количество клеток во взвесях, не подвергнутых данному воздействию. Иными словами, воздействие на клеточный материал тканей кожи и растения, которые освещали прерывистым светом до развития в них эффекта просветления среды, привело к повышению резистентности одноклеточных к рентгеновскому облучению и его последействию.
Использование предлагаемого технического решения позволяет повысить эффективность и физиологичность способа за счет возможности повышения резистентности клеточного материала к лучистой энергии и ее последействию в результате взаимодействия его с облучаемым прерывистым светом тканями in vivo до возникновения в них эффекта просветления среды.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗБИРАТЕЛЬНОГО ИЗМЕНЕНИЯ ЧУВСТВИТЕЛЬНОСТИ КЛЕТОК С РАЗЛИЧНОЙ ИНТЕНСИВНОСТЬЮ ДЕЛЕНИЯ К ЛУЧИСТОЙ ЭНЕРГИИ | 2000 |
|
RU2188423C2 |
| СПОСОБ РЕГИСТРАЦИИ ПРОТИВОЛУЧЕВОГО ЭФФЕКТА, ВОЗНИКАЮЩЕГО ПРИ ВОЗДЕЙСТВИИ НА ТКАНИ ПРЕРЫВИСТЫМ СВЕТОМ В УСЛОВИЯХ IN VIVO | 1994 |
|
RU2090893C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ИЗМЕНЕНИЯ ОПТИЧЕСКИХ СВОЙСТВ КОЖИ В УСЛОВИЯХ IN VIVO ПОД ВОЗДЕЙСТВИЕМ БЕЛОГО СВЕТА | 1993 |
|
RU2130182C1 |
| Способ определения светопроводности кожи человека | 1991 |
|
SU1802869A3 |
| УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ СВЕТОПРОВОДНОСТИ КОЖИ IN VIVO | 1992 |
|
RU2057344C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПАТОМОРФОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ КОЖИ ПО ЕЕ ОПТИЧЕСКИМ ПАРАМЕТРАМ, РЕГИСТРИРУЕМЫМ IN VIVO | 2000 |
|
RU2187955C2 |
| ФОТОМЕТР МЕДИЦИНСКИЙ | 2003 |
|
RU2301972C2 |
| Устройство для определения степени проникновения лазерных лучей в организм | 1981 |
|
SU946559A1 |
| СПОСОБ ЛАЗЕРНОЙ ГИПЕРТЕРМИИ ОПУХОЛЕЙ ПРИ ВВЕДЕНИИ ПЛАЗМОННО-РЕЗОНАНСНЫХ НАНОЧАСТИЦ С ПРИМЕНЕНИЕМ ТЕХНИКИ ИММЕРСИОННОГО ОПТИЧЕСКОГО ПРОСВЕТЛЕНИЯ | 2022 |
|
RU2800156C1 |
| СПОСОБ РАЗРУШЕНИЯ БАКТЕРИАЛЬНОЙ БИОПЛЕНКИ, ОБРАЗОВАННОЙ НА СВИНОЙ КОЖЕ В EX VIVO-МОДЕЛИ | 2024 |
|
RU2835154C1 |
Использование: в медицине, а именно как метод повышения устойчивости тканей к лучистой энергии и ее последействию. Технический результат: повышение эффективности и физиологичности способа за счет возможности воздействия на ткани в условиях in vivo прерывистым световым потоком до возникновения в них эффекта просветления среды и развития в защищаемом материале резистентности к лучистой энергии и ее последействию. Сущность изобретения: защищаемый клеточный материал размещают на расстоянии 0,1 - 1,0 см от живой ткани, на которую воздействуют in vivo прерывистым потоком излучения видимого диапазона, получаемого от лампы накаливания 100 - 300 Вт, по 15 - 30 с с интервалом 15 - 30 с до возникновения в ней эффекта просветления среды, в результате чего резистентность защищаемого материала является повышенной. 4 табл.
Способ повышения резистентности клеток в условиях in vivo к лучистой энергии и ее последействию, отличающийся тем, что защищаемый клеточный материал в виде взвесей бактерий (0,5 1,0)•1010 микробных тел в 1 см3 физиологического раствора и/или одноклеточных (12 - 20)•103 особей в 1 см3 воды размещают на расстоянии 0,1 - 1,0 см от живой ткани, на которую in vivo воздействуют прерывистым потоком излучения видимого диапазона, получаемого от лампы накаливания мощностью 100 - 300 Вт, по 15 30 с с интервалом 15 30 с до возникновения в ней эффекта просветления среды, в результате чего резистентность к лучистой энергии и ее последствию клеток во взвесях, расположенных вблизи облученных в видимом диапазоне тканей, является повышенной.
| Бадюгин И.С | |||
| Военная токсикология, радиология и защита от оружия массового поражения | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
Авторы
Даты
1997-12-10—Публикация
1993-11-16—Подача