Изобретение относится к некоторым новым производным тиомаринола и к способам их получения, описывает методы и композиции для использования их в качестве антибактериальных агентов.
Тиомаринол описан, например, в Европейской заявке на патент N 512824. Он может быть представлен следующей формулой: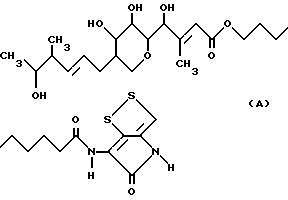
Его получают ферментацией микроорганизмов вида Alteromonas, в частности Alteromonas rava штамм SANK 73390. Мы обнаружили два производных тиомаринола, которые проявляют сходный тип бактерицидной активности, что и оригинальный тиомаринол.
Организмы вида Alteromonas могут быть выделены из морской воды и, как было показано, некоторые из них способны производить соединения, которые потенциально пригодны для использования в терапевтических целях. Так, например, соединение, известное под названием бесукаберин, было получено из одной из разновидностей Alteromonas и, как было показано, обладает противоопухолевой активностью (Японская заявка на патент N Sho 63-27484).
Что касается структуры тиомаринола, то известно несколько антибиотиков, имеющих сходную структуру, которые можно разбить на четыре группы.
В первую группу входят псевдомоновые кислоты, впервые выделенные из микроорганизмов Pseudomonas spp. Она включает псевдомоновую кислоту A [продуцируемую видом Pseudomonas fluorescens, описанным в J. Chem. Soc. Perkin Trans. 1, 294 (1977)] псевдомоновую кислоту B [там же, 318 (1977)] псевдомоновую кислоту C [там же, 2827 (1982)] и псевдомоновую кислоту D [там же, 2655 (1983)] Псевдомоновая кислота A выпускается под названием "бактробан" (торговый знак фирмы Beecham) в форме 2%-ной кожной мази для антибактериального использования. Однако эти, известные из области техники соединения, имеют более слабую антибактериальную активность, чем производные тиомаринола по изобретению.
Вторую группу веществ, имеющих сходную структуру с соединениями по изобретению, составляют такие антибиотики, как холомицин [Helv. Chim. Acta, vol. 42, 563 (1959)] пирротин [J. Am. Chem. Soc. vol. 77, 2861 (1955)] тиолутин [Angew. Chem. Bd. 66, 745 (1954)] ауреотрицин [J. Am. Chem. Soc, vol. 74, 6304, (1952)] и другие. Эти антибиотики обычно продуцируются актиномицитами и характеризуются тем, что имеют в своем составе серусодержащий хромофор. Ксенорхабдины I-Y являются веществами, родственными холомицину, и были также выделены из бактерий (описано в патенте WO/01775).
Были проведены многочисленные исследования производных соединений, входящих в две эти группы, однако, мы не располагаем какими-либо сведениями об описании соединений, имеющих молекулярную структуру, сходную со структурой тиомаринола, или обладающих аналогичными свойствами.
Третья группа соединений описана в таких публикациях, как Японские заявки Kokai NN 52-102279, 54-12375, 54-90179, 54-103871 и 54-125672. Ее составляют производные псевдомоновой кислоты, в которых концевая карбоксильная группа замещена амидноЙ группой. Эти соединения не проявляют сравнимую антибактериальную активность и не обладают широким спектром антибактериальной активности. Фактически эти соединения обладают меньшей антибактериальной активностью, чем первоначальная псевдомоновая кислота.
Четвертая группа включает соединение, сходное с тиомаринолом в том, что оно является физиологическим продуктом, происходящим из морских бактерий [Рефераты статей 200 Ежегодной конференции Американского химического общества (26-31 августа 1990), часть 2, N 139] Однако гетероциклической группой, присоединенной к концевой карбонильной группе данного соединения, является 2-оксо-3-пиперидильная группа. Как недавно было показано, она обладает антимикробной активностью [Experimentia, vol. 48, pp. 1165-169 (1992)]
Однако представляется, что наиболее близким известным соединением является псевдомоновая кислота A, а все из тиомаринолов, то есть первоначальный тиомаринол, тиомаринол B и тиомаринол C обладают значительно более сильной антибактериальной активностью, чем псевдомоновая кислота A.
Целью изобретения является предоставление некоторых новых производных тиомаринола.
Следующей и более конкретной целью изобретения является предоставление соединений, которые обладают превосходной антибактериальной и антимикоплазменной активностью.
Другие цели и преимущества станут понятны при рассмотрении описания изобретения.
В изобретении предлагается новое производное тиомаринола, которое является s,s-диоксопроизводным и далее обозначается как "тиомаринол B".
В настоящее время установлено, что структура тиомаринола B является следующей: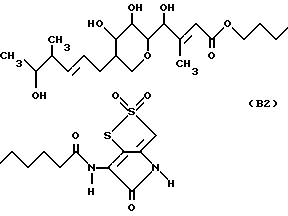
Тиомаринол B характеризуется следующими физико-химическими свойствами:
1) Внешний вид: порошок желтого цвета.
2) Молекулярная формула C30H44N2O11S2.
3) Молекулярная масса: 672 (по данным FAB масс-спектрометрии); FAB масс-спектрометрия масс-спектрометрия с бомбардировкой быстрыми атомами.
4) Масс-спектрометрия высокого разрешения;
C30H44N2O11S2 [(M+H)+; по данным FAB масс-спектрометрии]
Найдено 673,2468.
Вычислено 673,2465.
5) Элементный анализ.
C30H44N2O11S2 + H2O.
Вычислено, C 52,16; H 6,71; N 4,06; S 9,28.
Найдено, C 52,34; H 6,79; N 3,92; S 9,02%
6) ИК-спектр: νmax см-1.
ИКспектр, измеренный по методу с диском бромистого калия, представлен ниже: 3660, 3503, 3318, 3075, 2966, 2928, 2870, 1704, 1653, 1509, 1467, 1381, 1349, 1299, 1217, 1199, 1152, 1112, 1063, 1047, 1019, 975, 949, 884, 839, 764, 730, 660, 609, 553.
7) УФ-спектр: λmax нм (s).
УФ спектр, измеренный в 1-пропаноле, представлен ниже:
377(2900), 301(13000), 215(21000)
УФ-спектр, измеренный в смеси 1-пропанол + соляная кислота, представлен ниже:
377(2900), 301(13000), 223(17000).
УФ-спектр, измеренный в смеси 1-пропанол + едкий натр, представлен ниже:
377(2900), 301(13000), 223(19000).
8) Удельное вращение плоскости поляризации:
[α]
9) Жидкостная хроматография высокого разрешения:
разделительная колонка: Senshu-Pak ODS H-2151 (диаметр колонки 6 мм, длина 150 мм, торговая марка фирмы Senshu Scientific Co. Ltd.);
растворитель: 40 об. водный ацетонитрил;
скорость подачи элюента: 1,5 мл/мин;
время удерживания: 8,4 мин;
10) 1H-ЯМР-спектр: ( δ м.д,);
ЯМР-спектр (360 МГц), измеренный в гексадейтерированном диметилсульфоксиде с использованием тетраметилсилана в качестве внутреннего стандарта, представлен ниже:
0,92(3H, дублет, J=6,9 Гц), 0,96(3 H, дублет, J=6,3 Гц);
1,25(2H), 1,30(2H), 1,32(2H), 1,50(2H), 1,58(2H);
1,61(1H), 2,02(3H, синглет), 2,03(1H), 2,09(1H),
2,12(1H), 2,43(2H, триплет, J=7,3 Гц), 3,35(1H, дублет,
J=10,9 Гц), 3,51(1H), 3,54(1H), 3,61(1H), 3,64(1H),
3,74(1H, широкий синглет), 4,02(2H, триплет, J=6,6 Гц),
4,18(1H, дублет, J=7,2 Гц), 4,28(1H, дублет, J=3,6 Гц),
4,43(1H, дублет, J=7,2 Гц), 4,61(1H, широкий синглет),
4,88(1H, дублет, J=7,5 Гц), 5,37(2H, мультиплет),
5,97 (1H, синглет), 7,23 (1H, синглет), 10,47 (1H, синглет)
11,28 (1H, широкий синглет).
11) 13C-ЯМР спектроскопия: ( d м.д.).
ЯМР-спектр (90 МГц), измеренный в гексадейтерированном диметилсульфоксиде с использованием тетраметилсилана в качестве внутреннего стандарта, представлен ниже:
15,6 (квартет), 15,7 (квартет), 20,0 (квартет),
24,5 (триплет), 25,3 (триплет), 28,1 (триплет),
28,2 (триплет), 28,3 (триплет), 31,9 (триплет),
34,7 (триплет), 42,2 (дублет), 43,2 (дублет),
63,0 (триплет), 63,9 (дублет), 64,3 (триплет),
69,3 (дублет), 69,6 (дублет), 72,4 (дублет),
76,2 (дублет), 109,4 (дублет), 114,4 (дублет),
115,2 (синглет), 123,3 (синглет), 127,8 (дублет),
134,2 (дублет), 143,2 (синглет), 160,8 (синглет),
165,7 (синглет), 166,1 (синглет), 173,5 (синглет).
12) Растворимост.
Растворим в спиртах, таких как метанол, этанол, пропанол и бутанол, а также в диметилсульфоксиде, диметилформамиде, хлороформе, этилацетате, ацетоне и диэтиловом эфире. Нерастворим в гексане и воде.
13) Тонкослойная хроматография.
Величина Rf 0,52
Адсорбент: силикагель (фирма Merck Co. Inc. Art. 715).
Элюент: хлористый метилен:метанол 85:15 по объему.
Изобретение предоставляет также способ получения тиомаринола B, который состоит в культивировании тиомаринолпродуцирующего микроорганизма рода Alteromonas и выделении тиомаринола B из культуры.
Изобретение предоставляет также способ получения тиомаринола B окислением тиомаринола.
Описывается также фармакологическая композиция, включающая антибактериальный или антимикоплазменный агент в смеси с фармакологически приемлемым носителем или разбавителем, в которой антибактериальным или антимикоплаэменным агентом является тиомаринол B.
Метод лечения или профилактики бактериальных или микоплазменных инфекций с использованием соединения изобретения состоит в назначении млекопитающему, которым может быть человек, страдающему от инфекции или подверженному воздействию таких инфекций, эффективного количества антибактериального или антимикоплазменного агента.
Из представленной формулы видно, что тиомаринол в содержит ряд асимметрических атомов углерода и несколько кратных связей. В частности, возможна изомеризация в альфа-, бета-ненасыщенном карбонильном фрагменте тиомаринолов. Таким образом, тиомаринол B может образовывать различные стерео- и геометрические изомеры. Хотя все они представлены здесь в виде одной молекулы, изобретение включает в себя как индивидуальные, выделенные изомеры, так и их смеси, включая рацематы. В том случае, если проводится стереоспецифический синтез либо исходные соединения являются оптически активными, индивидуальные изомеры можно получить непосредственно в результате синтеза; с другой стороны, если получена смесь изомеров, то индивидуальные изомеры могут быть получены обычными методами расщепления.
Однако поскольку тиомаринолы, как правило, получают с помощью ферментации или химической манипуляции с продуктом ферментации, они имеют тенденцию приобретать стандартную оптическую конфигурацию. Поэтому, хотя предоставляются и другие конфигурации, природная конфигурация является предпочтительной.
Тиомаринол B можно получить путем выращивания продуцирующего тиомаринол организма рода Alteromonas, и затем сбора желаемого тиомаринола из культуральной среды. Разновидности тиомаринола B с требуемой антибактериальной активностью могут быть получены аналогично из других штаммов или видов Alteromonas, которые производят целевое соединение, или же их можно получить, модифицируя подходящим образом соединение, выделенное в процессе указанной ферментации, или же их можно получить прямым химическим синтезом.
В частности, представляется особенно предпочтительным использовать в качестве микроорганизма вид Alteromonas rava и особенно недавно выделенный штамм Alteromonas rava, которому мы дали обозначение SANK 73390. Штамм SANK 73390 является морским организмом, который выделен из морской воды, собранной у побережья Коина, Минами-Изу Мати, префектура Сизуока, Япония, и указанный штамм депонирован в Депозитарном институте, Исследовательском институте ферментации Агентства прикладных наук и технологии Министерства международной торговли и промышленности, Япония, 30 апреля 1991 г. с регистрационным номером FERM BP-3381, в соответствии с Будапештским договором.
Таксономические характеристики Alteromonas rava штамма SANK 73390 представлены ниже.
1. Морфологические характеристики.
Alteromonas rava штамм SANK 73390 выращивался при 23oC в течение 24 ч на морском агаре (Difco). Последовательные микроскопические наблюдения показали, что клетки имеют палочкообразную форму с диаметром 0,8-1,0 мкм и длиной 2,0-3,6 мкм. Данный штамм является грамотрицательным и перемещается с помощью полярных бактериальных жгутиков.
2. Рост на морском агаре.
SANK 73390 выращивался при 23oC в течение 24 ч на морском агаре (Difco). Полученные колонии имеют бледный серо-зеленый цвет, непрозрачны, плоские, сплошные и имеют кольцевую форму.
Водорастворимый пигмент не образуется.
3. Физиологические свойства.
(1) Требования к морской воде: SANK 73390 требует для своего роста морскую воду.
(2) Окислительно-ферментативный тест (метод Хью-Лейфсона) [J. Bact. vol. 66, 2426 (1953)] в среде, приготовленной из искусственной морской воды: не оказывает воздействия на углевод.
(3) Оксидаза: +
(4) Каталаза: +
(5) Потребность в кислороде: аэробный.
(6) Восстановление нитратов: -
(7) Гидролиз крахмала: +
(8) Разложение агара: -
(9) Разжижение желатина: +
(10) Производство дифосфопиридиновой нуклеотидазы: +
(11) Производство липазы: +
(12) Температура для роста: медленный рост при 4oC, хороший рост в интервале от 17oC до 26oC, прекращение роста при 35oC.
(13) Требования к факторам роста: на основной питательной среде, описанной в J. Bact. vol. 107, 268 (1971), SANK 73390 требует добавления свободной от витаминов казамино кислоты.
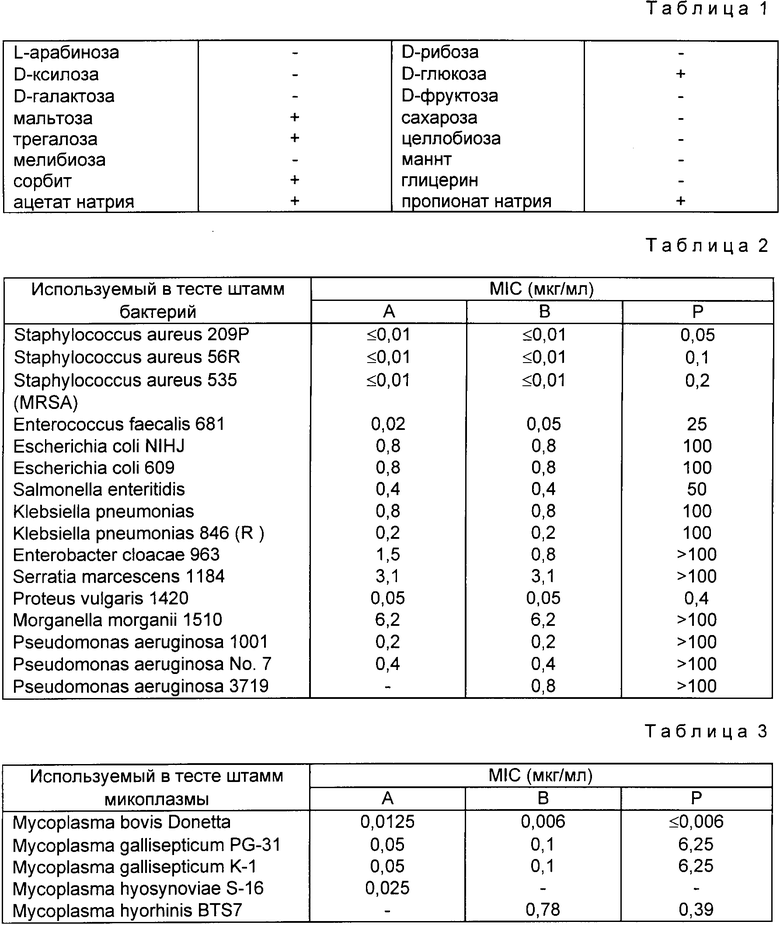
(14) Усвоение источников углерода: в основной питательной среде, описанной в J. Bact. vol. 107, 268 (1971), дополнительно содержащей 0,1 мас./об. свободной от витаминов казамино кислоты, при встряхивании культуры. Данные приведены в табл. 1.
4. Хемотаксономические характеристики.
(1) Мол. гуанина и цитозина (содержание Г+Ц) в ДНК: 43,4% (по данным жидкостной хроматографии высокого разрешения).
(2) Хиноновая система: убихинон Q-8.
Принимая во внимание приведенные таксономические характеристики, Alteromonas rava штамм SANK 73390 сравнивался со штаммами, описанными в Bergey's Manual of Systematic Bacteriology, vol. 1 (1984), а также со штаммами, описанными в последних выпусках International Journal of Bacteriology. Обнаружено, что Alteromonas rava штамм SANK 73390 имеет некоторое сходство с Alteromonas citrea, еще одним морским организмом. Проведено выращивание и сравнивание свойств SANK 73390 и Alteromonas citrea, ATCC 29719 (стандартный штамм).
В отличие от бледного серовато-зеленого цвета SANK 73390 колонии ATCC 29719 имели желто-зеленый цвет. SANK 73390 отличается от Alteromonas citrea также по скорости роста при 4oC и по способности утилизировать трегалозу и пропионат натрия в качестве источников углерода. Соответственно, Alteromonas rava штамм SANK 73390 является новым штаммом нового вида Alteromonas rava и отличается по своим важнейшим характеристикам от ближайшего известного вида, депонированного под регистрационным номером ATCC 29719.
Приведенные характеристики являются типичными для SANK 73390. Однако хорошо известно, что характеристики Alteromonas spp. являются изменчивыми как естественным, так и искусственным путем. Приведенные характеристики определяют штамм Alteromonas rava, как он был депонирован, но они необязательно являются типичными для других видов Alteromonas или штаммов Alteromonas rava, которые способны продуцировать тиомаринол или его встречающиеся в природе варианты. Все такие штаммы включены в объем притязаний по изобретению.
Понятно, что SANK 73390 или любой другой штамм, способный продуцировать тиомаринол, или один из его вариантов может субкультивироваться или биотехнологически изменяться, или модифицироваться, давая организмы с отличными характеристиками. Единственным требованием к получаемому организму является способность продуцировать или вырабатывать требуемое соединение.
Такие изменения и модификации могут принимать любую желаемую форму или же могут, например, зависеть от условий выращивания культуры. Штаммы могут модифицироваться культурой, и поэтому селекционируются таким образом, чтобы проявлять такие свойства, как усиленный рост или рост при более высоких или более низких температурах.
Биотехнологические модификации обычно являются преднамеренными и могут вводить селекционируемые характеристики, такие как, например, устойчивость или восприимчивость к бактериостату или их комбинацию для того, чтобы поддерживать чистоту, или время от времени обеспечить возможность очистки культур, особенно элитных культур.
Другими характеристиками, которые могут вводиться с помощью генетических манипуляций, являются любые, которые допустимы для Alteromonas spp. Например, могут встраиваться плазмиды, колирующие сопротивляемости плазмидам, или любые природные плазмиды могут удаляться. Наибольшие преимущества представляют те плазмиды, которые обеспечивают ауксотрофию. Плазмиды могут получаться из любого подходящего источника или могут формироваться методами генной инженерии с помощью выделения природной плазмиды Alteromonas и включения в нее нужного гена или генов из другого источника. Природные плазмиды можно также модифицировать любым другим желаемым образом.
Для того, чтобы получить тиомаринол B из культуры подходящего микроорганизма, микроорганизм необходимо подвергнуть ферментации в подходящей среде. Такие среды, как правило, хорошо известны из области техники и часто используются при производстве других ферментативных продуктов.
Обычно такая среда должна включать любую комбинацию источника углерода, источника азота и одной или более неорганических солей, которые усваиваются соответствующим микроорганизмом. Минимальным требованием к среде является то, чтобы она содержала ингредиенты, существенные для роста микроорганизма.
Подходящими источниками углерода являются глюкоза, фруктоза, мальтоза, сахароза, маннит, глицерин, декстран, овсяная мука, рожь, кукурузный крахмал, картофель, пшеничная мука, соевая мука, хлопковое масло, патока, лимонная кислота и винная кислота, любой из которых может применяться самостоятельно или же в сочетании с одним или более других источников углерода. Типичные количества составляют примерно от 1 до 10 мас./об. от количества среды, хотя это количество может меняться, если необходимо, и в соответствии с желаемым результатом.
Подходящими источниками азота могут быть любые вещества, которые, например, содержат белок. Типичными примерами источников азота являются органические источники азота, получаемые из животных и растений, это могут быть экстракты из таких природных источников, как соевая мука, отруби, арахисовая мука, мука из семян хлопчатника, гидролизат казеина, фермамин, рыбная мука, кукурузный экстракт, пептон, мясной экстракт, дрожжи, дрожжевой экстракт, солодовый экстракт; и неорганические источники азота, такие как нитрат натрия, нитрат аммония и сульфат аммония. Так же, как и в случае источников углерода, их можно использовать отдельно или же в сочетании друг с другом. Типичные количества составляют 0,1-6 мас./об. от количества среды.
Подходящими питательными неорганическими солями являются соли, которые наряду с основными компонентами соли содержат следы других элементов. Соли должны преимущественно содержать такие ионы, как ионы натрия, калия, аммония, кальция, магния, железа, фосфат-, сульфат-, хлорид- и карбонатионы. Могут также присутствовать следы металлов, таких как кобальт, марганец и стронций, или соли, способные давать такие ионы, как бромид-, фторид-, борат- или силикатионы.
Alteromonas rava встречается в природе в морской воде, поэтому, если специально не оговорено, условия для выращивания этих организмов должны идеально соответствовать условиям морской среды. Так, следы ионов, содержащихся в морской воде, преимущественно включаются в любую среду, используемую для выращивания Alteromonas. В частности, микроорганизмы должны предпочтительно выращиваться в присутствии морской волы, искусственной морской воды или компонентов, соответствующих составу морской воды.
Если микроорганизмы ферментатируют в виде жидкой культуры, то предпочтительно использовать пеногасители, такие как силиконовое масло или растительное масло или другие подходящие поверхностно-активные вещества.
При использовании Alteromonas rava штамм SANK 73390 для получения тиомаринола B показатель pH культуральноЙ среды предпочтительно поддерживается в интервале pH 5,0-8,0, хотя единственным требованием является то, чтобы показатель pH среды не препятствовал росту микроорганизма или не оказывал вредного и необратимого влияния на качество целевого продукта. Для прекращения ферментации можно добавлять избыток кислоты или щелочи.
Штамм Alteromonas rava SANK 73390 обычно растет при 4-32oC, и хорошо растет при температуре 17-26oC. Другие температуры, которые не попадают в указанный интервал, могут быть применимы, когда разработан штамм, способный расти при более низких или более высоких температурах. Для получения тиомаринола B предпочтительный интервал температур составляет между 20 и 26oC.
Тиомаринол B идеально получается при аэробном выращивании и можно использовать любую подходящую методику аэробного выращивания, такую как твердую культуру, встряхиваемую культуру или перемешиваемую аэрируемую культуру.
Если выращивание проводят в небольшом масштабе, то обычно предпочтительна встряхиваемая культура, которую ферментатируют в течение нескольких дней при 20-26oC.
Для начала ферментативного культивирования предпочтительно применять методику с использованием начального инокулюма, приготавливаемого в одну или две стадии, например, в колбе Эрленмейера. Для культуральной среды можно использовать комбинацию источника углерода и источника азота. Колбу с посевом встряхивают в термостатируемом инкубаторе при 23oC в течение 1-3 дней или же до тех пор, пока не будет наблюдаться ощутимый рост. Полученную посевную культуру можно далее использовать для инокулирования второй посевной культуры или продуцирующей культуры. Если проводят повторный высев, его можно осуществлять обычным способом, а часть использовать для инокуляции производящей среды, колба, в которую помещается посевной материал, встряхивается в течение подходящего периода времени, например, 1-3 дней, или же до тех пор, пока не будет получена максимальная производительность, при подходящей температуре, например, как описано выше. После окончания инкубационного периода содержимое колбы может быть собрано центрифугированием или фильтрованием.
Если выращивание проводят в больших масштабах, то может быть предпочтительной культура в подходящем ферментере с аэрированием -перемешиванием. В этом случае питательную среду можно приготовить прямо в ферментере. После стерилизации при 125oC среду охлаждают и высевают инокулят, предварительно приготовленный в стерилизованной среде. Выращивание проводят при перемешивании и аэрации при 20-26oC. Данная процедура является подходящей для получения соединения в больших количествах.
Количество тиомаринола B, продуцируемого культурой, можно время от времени контролировать с помощью, например, жидкостной хроматографии высокого разрешения. Обычно количество произведенного тиомаринола B достигает максимума после периода времени 19-200 ч.
После подходящего времени выращивания тиомаринол B можно выделить и очистить любыми известными способами. Например, любое количество тиомаринола B, оставшееся в бульоне с культурой, можно выделить, отфильтровывая твердые вещества, например используя в качестве материала для фильтрования диатомитовую землю, или центрифугированием с последующей экстракцией надосадочной жидкости и очисткой в соответствии с физико-химическими свойствами тиомаринола B. Например, тиомаринол B, находящийся в фильтрате или в остатке после центрифугирования, можно экстрагировать не смешиваемыми с водой органическими растворителями, такими как этилацетат, хлороформ, хлористый этилен, хлористый метилен или смесь указанных растворителей в нейтральных или кислых условиях, а затем очистить.
Альтернативно в качестве адсорбента можно использовать активированный уголь или адсорбирующую смолу, такую как Amberlit (торговый знак) XAD-2, XAD-4 (фирма Rohm Haas) или Diaion (торговый знак) HP-10, HP-20, CHP-20, HP-50 (фирма Mitsubishi Kasei Corporation). Примеси можно удалить после адсорбции, пропуская жидкость, содержащую тиомаринол B, через тонкий слой адсорбента; тиомаринол B можно также очистить после адсорбции элюированием подходящим растворителем, например, водным метанолом, водным ацетоном или смесью бутанол/вода.
Внутриклеточный тиомаринол B может быть очищен экстракцией подходящим растворителем, например, водным ацетоном или водным метанолом, который предпочтительно имеет концентрацию 50-90 об. и удалением органического растворителя с последующей экстракцией, как это описано ранее для фильтрата или надосадочной жидкости.
Получающийся тиомаринол B может быть дополнительно очищен с помощью хорошо известных методов, а именно:
адсорбционной колоночной хроматографией, используя такие носители, как силикагель или магний-силикагель, например, поставляемый в продажу под торговым названием "флорисил";
распределительной колоночной хроматографией, используя такие адсорбенты, как Sephadex LH-20 (торговое название продукта фирмы Pharmacia);
жидкостной хроматографией высокого разрешения с использованием колонок с нормальной или обращенной фазой. Как хорошо известно из области техники, эти способы выделения и очистки можно осуществлять отдельно или в любом удобном сочетании, а, если необходимо, и многократно с целью выделить и очистить целевой продукт.
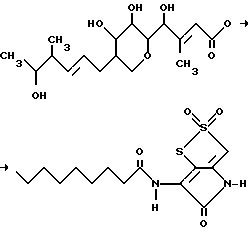
Тиомаринол B можно получить также окислением тиомаринола, причем этот способ является предпочтительным, поскольку при ферментации тиомаринол B образуется лишь в небольших количествах.
Окисление предпочтительно проводят, позволяя окислителю воздействовать на тиомаринол в присутствии растворителя и в присутствии или отсутствии основания.
Природа используемого окислительного агента не имеет большого значения для способа по изобретению, и с одинаковым успехом в данном случае может быть применен любой обычно используемый окислительный агент. Примерами таких окислительных агентов являются: перманганат калия; хроматы, такие как дихромат калия (бихромат калия), дихромат натрия (бихромат натрия), оксид хрома (YI), хлористый хромил и трет-бутилхромат; тетраоксид рутения; галогены, такие как хлор, бром и иод; озон; кислород; перекись водорода; органические перекиси, такие как бис(триметилсилил)пероксид, гидроперекись кумола и гидроперекись трет-бутила; диоксираны, такие как диоксиран, метилдиоксиран, диметилдиоксиран, диэтилдиоксиран, этилметилдиоксиран, метилпропилдиоксиран, бутилметилдиоксиран, фтордиоксиран, метилфтордиоксиран, дифтордиоксиран, бис(трифторметил)диоксиран, метилтрифторметилдиоксиран и трифторметилхлордифторметилдиоксиран; органические надкислоты и их соли, такие как надуксусная кислота, надмуравьиная кислота, м-хлорнадбензойная кислота; и пероксисерные кислоты и их соли, такие как пероксимоносерная кислота, пероксидисульфат калия и пероксимоносульфат калия (особенно выпускаемые фирмой Aldrich Chemical Co. под торговым названием "оксон"). Предпочтительные примеры окислительных агентов включают перекись водорода, органические надкислоты и их соли, органические перекиси, диоксираны или пероксисерные кислоты и их соли, а наиболее предпочтительными примерами являются перекись водорода, диметилдиоксиран и пероксисерные кислоты и их соли.
Аналогично не существует никаких особых ограничений относительно природы используемых в этой реакции оснований за исключением того, что они не должны оказывать вредного воздействия на ход реакции и на участвующие в ней реагенты. Предпочтительными примерами таких оснований являются: неорганические соли, например карбонаты щелочных металлов (такие как карбонат натрия, карбонат калия или карбонат лития), кислые карбонаты щелочных металлов (такие как бикарбонат натрия, бикарбонат калия и бикарбонат лития), гидриды щелочных металлов (такие как гидрид лития, гидрид натрия или гидрид калия), гидроокиси щелочных металлов (такие как гидроокись натрия, гидроокись калия, гидроокись бария или гидроокись лития) и фториды щелочных металлов (такие как фторид натрия, фторид калия или фторид цезия); органические соли, например алкоксиды щелочных металлов (такие как метоксид натрия, этоксид натрия, трет-бутоксид калия или метоксид лития), алкилсульфиды щелочных металлов (такие как метилсульфид натрия или этилсульфид натрия); и соединения азота (такие как триэтиламин, трибутиламин, ди-изо-пропилэтиламин, N-метилморфолин, пиридин, 4- (N,N-диметиламино) пиридин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диаэабицило[4,3,0] нон-5-eн(DBN), 1,4-диазабицило[2,2,2]октан (DABCO) и 1,8-диазабицило[5,4,0]ундец-7-ен (DBU). Наиболее предпочтительными являются карбонаты щелочных металлов и кислые карбонаты щелочных металлов.
Реакцию обычно и предпочтительно проводят в присутствии растворителя, природа которого большой роли не играет, за исключением того, что он не должен оказывать вредного воздействия на ход реакции, но должен растворять реагенты по крайней мере до некоторой степени. Примерами приемлемых растворителей являются: вода; спирты, такие как метанол, этанол или пропанол; кетоны, такие как ацетон или метилэтилкетон; органические кислоты, такие как уксусная кислота или муравьиная кислота; сложные эфиры, такие как этилацетат; простые эфиры, такие как диэтиловый эфир и тетрагидрофуран; амиды, такие как диметилформамид или диметилацетамид; а также смеси любых двух или большего количества указанных растворителей. Предпочтительными являются спирты и смеси воды с кетонами, причем наиболее предпочтительной является смесь воды и ацетона.
Для того, чтобы ускорить реакцию, ее можно проводить в присутствии неорганического катализатора, такого как оксид платины или окись ванадия, хотя реакция протекает и без катализатора.
Реакцию можно осуществлять в широком интервале температур, и выбранное конкретное значение температуры не играет большой роли для данного изобретения. Установили, что в общем случае реакцию удобно проводить в интервале температур от -78oC до 100oC, наиболее предпочтительно от -10oC до комнатной температуры. Время, необходимое для завершения реакции, также может варьироваться в зависимости от множества факторов, в том числе от температуры процесса и природы реагентов, в частности от используемых окислительного агента и основания. Однако в большинстве случаев достаточен период времени от 15 мин до 30 ч, а более предпочтительно от 15 мин до 2 ч.
По завершении реакции целевое соединение можно выделить из реакционной смеси обычными способами. Например, удобная методика выделения включает следующие операции: выливают смесь в воду; экстрагируют водную фазу не смешиваемым с водой растворителем, таким как ароматический углеводород (например, бензол), простым эфиром (например, диэтиловым эфиром), сложным эфиром органической кислоты (например, этилацетатом) или галоидированным углеводородом (например, хлористым метиленом); и удалением растворителя из экстракта. Полученное таким способом целевое соединение в случае необходимости подвергают дополнительной очистке обычными способами, например, с использованием различных хроматографических методов или препаративной тонкослойной хроматографией.
Тиомаринол, который является исходным соединением в этой реакции окисления, можно получить ферментацией микроорганизмов вида Alteromonas, в частности штамма Alteromonas rava SANK 73390, описанного ранее относительно получения тиомаринола B.
Поскольку тиомаринол B обладает антибактериальным воздействием на грампозитивные и грамнегативные бактерии и микоплазмы в животных организмах (в частности человека, собаки, кошки и кролика), их можно самыми разнообразными способами, в зависимости от природы инфекции, использовать для лечения или профилактики бактериальных или микоплазменных инфекций.
Когда соединения изобретения предполагается использовать в терапевтических целях, их можно назначать самостоятельно или в виде фармацевтической препаративной формы, содержащей помимо активного соединения один или два стандартных разбавителя, носителя, инертных наполнителя или вспомогательных соединений. Характер готовой препаративной формы конечно зависит от способа приема лекарства. Для орального назначения соединение предпочтительно формируется в виде порошков, гранул, таблеток, капсул или сиропов. Для парентерального назначения оно предпочтительно составляется в виде инъекций (которые могут быть внутривенными, внутримышечными или подкожными), капель, свечей, мазей или линиментов.
Данные готовые формы могут быть приготовлены известными способами, добавлением к активному соединению таких добавок, как носители, связующие, разрыхлители, смазки, стабилизаторы, модификаторы, солюбилизирующие агенты, ароматизирующие вещества, отдушки, суспендирующие агенты или агенты для покрытия. Хотя доза может зависеть от симптомов заболевания и возраста пациента, природы и степени тяжести инфекции, а также от способа назначения лекарств, в случае орального назначения взрослому больному, соединения по изобретению могут обычно приниматься в виде дневной дозы от 20 до 2000 мг. Соединения можно принимать в виде одной дозы или в виде раздельных доз, например, два или три раза в день.
Получение соединений по изобретению далее поясняется следующими примерами, которые не ограничивают изобретение, а биологическая активность этих соединений иллюстрируется далее в примерах испытаний. В примере 6 приведен метод получения тиомаринола, который используется в качестве исходного соединения в окислительном способе получения тиомаринола B.
Пример 1. Получение тиомаринола B выращиванием в тенке.
А) Культура.
Alteromonas rava штамм SANK 73390 выращивают в течение 3 дней при 22oC на скошенном морском агаре (продукт компании Difco). Полученную культуру суспендируют в 3 мл стерилизованной искусственной морской волы. По 0,1 мл полученной суспензии инокулируют в каждую из двух колб Эрленмейера емкостью 500 мл каждая, содержащих по 100 мл стерилизованной среды, имеющей следующий состав:
Морской бульон (Difco) 37,4 г
Деионизованная вода 1000 мл
pH Не устанавливается.
Культуру затем инкубируют в течение 24 ч при 23oC при встряхивании со скоростью 210 об/мин, используя ротационную качалку. Всю полученную культуру затем инокулируют в 600-литровый аэрируемый тенк, снабженный мешалкой и содержащий 200 л среды, имеющей тот же состав, что и приведенный выше, которая была простерилизована отдельно. Смесь затем культивируют в течение 26 ч при 23oC, при этом аэрирование культуры проводят воздухом со скоростью 0,5 об/об. мин (то есть "объем на объем в минуту": 1 об/об.мин означает, что количество воздуха, подаваемого за 1 мин, равняется объему воздуха в тенке), и устанавливают скорость вращения в интервале 82,5-170 об/мин так, чтобы поддерживать концентрацию растворенного кислорода на уровне 5,0 промилей.
В) Выделение.
К 230 л полученного раствора с культурой добавляют достаточное количество раствора соляной кислоты с тем, чтобы довести pH до 2,5. Затем добавляют 200 л ацетона и экстрагируют смесь при перемешивании в течение 0,5 ч. К смеси далее добавляют 4,0 кг целита 545 (торговое название продукта фирмы Johnes Manvill Project Corporation, США) в качестве фильтровального средства и смесь фильтруют. Фильтрат (430 л) экстрагируют один раз 200 л этилацетата, а затем дважды 100 л этилацетата. Объединенные этилацетатные экстракты промывают 200 л 5%-ного водного раствора бикарбоната натрия, а затем 100 л насыщенного водного раствора хлористого натрия, после чего их сушат над безводным сульфатом натрия и упаривают досуха в вакууме, получая приблизительно 80 г масла.
Все полученное на предыдущей стадии масло растворяют в хлористом метилене, и раствор помещают в колонку, содержащую 1,1 кг силикагеля, насыщенного хлористым метиленом. Раствор затем элюируют смесью хлористого метилена и этилацетата (1:1), затем одним этилацетатом и, наконец смесью этилацетата и метанола (9: 1), (полярность растворителя возрастает в указанном порядке). После того, как элюат фракционируют на порции по 500 мл каждая, собирают фракцию, содержащую тиомаринол B, который элюируют смесью этилацетата и метанола, и упаривают досуха при пониженном давлении, получая 60 г масла.
Все полученное масло растворяют в 6 л 50%-ного водного раствора метанола, и полученный раствор помещают в колонку емкостью 2,3 л, наполненную носителем Diaion HP-20 (торговое название), насыщенным водой, после чего раствор масла подвергают градиентному элюированию водным раствором метанола, концентрацию которого увеличивают от 30 до 90 об. Более конкретно, после того как на колонку наносят по 4 л каждого из водного раствора, содержащего 30% метанола, 50% метанола, 60% метанола, 70% метанола, 80% метанола, колонку элюируют 90% -ным водным раствором метанола. Элюирование продолжают до тех пор, пока элюирование целевого соединения не будет больше наблюдаться, что контролируют с помощью жидкостной хроматографии высокого разрешения, при этом общее количество использованного при элюировании 90%-ного раствора метанола составляет 10 л. Фракцию, элюированную 90%-ным метанолом, собирают и упаривают досуха при пониженном давлении, получая 3,8 г порошка желтого цвета. Порошок подвергают хроматографии на колонке с 320 г носителя Sephadex LH-20, насыщенного смесью хлористого метилена, этилацетата и метанола (19: 19:2 по объему), элюируя смесью того же состава, для очистки.
Полученный продукт далее очищают методом жидкостной хроматографии высокого разрешения, используя колонку с обращенной фазой [Senshu-Pak ODS H-5251 (Размер колонки: диаметр 20 мм, длина 250 мм), торговая марка продукции фирмы Senshu Scientilic Co. Ltd. и 40 об. раствор ацетонитрила в воде в качестве элюента при скорости потока 15 мл/мин; контроль метода очистки осуществляют по поглощению при 220 нм. Поскольку тиомаринол B выходит в виде пика с временем удерживания 13-14 мин, эту фракцию собирают и упаривают досуха при пониженном давлении, выделяя 130 мг целевого соединения, которое имеет физико-химические свойства, приведенные выше.
Пример 2. Получение тиомаринола B окислением тиомаринола.
100,9 мг тиомаринола (получают как описано в примере 5) растворяют в смеси 5 мл ацетона и 5 мл воды и охлаждают полученный раствор в ванне со льдом. Добавляют 112,2 мг оксона (торговое название продукта фирмы Aldrich Chemical Co. Inc.) и смесь перемешивают при охлаждении в ванне со льдом в течение 40 мин. По окончании указанного срока добавляют 1,2 мл насыщенного водного раствора бикарбоната натрия, и смесь вновь перемешивают при охлаждении в ванне со льдом в течение 30 мин, добавляют 5 мл воды и экстрагируют смесью хлористого метилена и тетрагидрофурана 10: 1. Экстракт сушат над безводным сульфатом натрия и растворитель затем удаляют с помощью перегонки при пониженном давлении. Остаток отделяют и очищают жидкостной хроматографией высокого разрешения с обращенной фазой (используя колонку Senshu Pak ODS-5251-N и 40 об. водный раствор ацетонитрила в качестве элюента), получая 79,5 мг (выход 75%) тиомаринола B светло-желтого цвета, который имеет физико-химические параметры, приведенные выше.
Пример 3. Получение тиомаринола B окислением тиомаринола.
100 мг тиомаринола (получают, как описано в примере 5) растворяют в смеси 15 мл ацетона и 7,5 мл воды, а затем добавляют 0,074 мл 35%-ного водного раствора перекиси водорода и 2 капли разбавленного водного раствора бикарбоната натрия. Полученную смесь перемешивают 5 мин и удаляют ацетон перегонкой при пониженном давлении. К остатку добавляют ацетонитрил, образование тиомаринола B подтверждается жидкостной хроматографией высокого разрешения с обращенной фазой (с использованием колонки Senshu Pak ODS-H-5251 и 40 об. водного раствора ацетонитрила в качестве элюента). Растворитель удаляют перегонкой при пониженном давлении, остаток растворяют в 40%-ном водном ацетонитриле. Затем его отделяют и очищают жидкостной хроматографией высокого разрешения с обращенной фазой (используя колонку Senshu Pak ODS-5251-N и 40 об. водный раствор ацетонитрила в качестве элюента), получая 43,2 мг (выход 41% ) тиомаринола B светло-желтого цвета, который имеет физико-химические параметры, приведенные выше.
Пример 4. Получение тиомаринола B окислением тиомаринола.
100 г тиомаринола (полученного как описано в примере 5) растворяют в 40 мл ацетона и затем при охлаждении в ванне со льдом и при перемешивании добавляют к полученному раствору 134 мг м-хлорнадбензойной кислоты. Смесь далее перемешивают при комнатной температуре в течение 1,5 ч, экстрагируют хлористым метиленом и промывают три раза водой и затем один раз насыщенным водным раствором сульфата натрия. Экстракт сушат над безводным сульфатом натрия и растворитель затем удаляют перегонкой при пониженном давлении. Остаток отделяют и очищают жидкостной хроматографией высокого разрешения с обращенной фазой (используя колонку Senshu Pak ODS-5251-N и 40 об. водный раствор ацетонитрила в качестве элюента), получая 8,5 мг (выход 8%) тиомаринола B светло-желтого цвета, который имеет физико-химические параметры, приведенные выше.
Пример 5. Ферментация тиомаринола в сосуде.
А) Культура.
Штамм Alteromonas rava SANK 73390 выращивают в течение 3 дней при 22oC на скошенном морском агаре (продукт компании Difco). Полученную культуру суспендируют в 3 мл искусственной морской воды. По 0,1 мл полученной суспензии вносят асептически в колбу Эрленмейера емкостью 500 мл, содержащую 100 мл стерилизованной среды [37,4 г морского бульона (продукт компании Difco) в 1 л деионизованной воды, pH не устанавливается]
Колбу затем инкубируют в течение 24 ч при 23oC при встряхивании со скоростью 200 об/мин (радиус вращения 70 мм), используя ротационную качалку. По прошествии указанного времени в каждый из четырех ферментеров кувшинного типа емкостью 30 л, содержащих по 15 л стерильной среды, описанной выше, инокулируют 15 мл культуры, взятой асептически из колбы Эрленмейера. Ферментеры инкубируют в течение 23 ч при 23oC и перемешивают со скоростью 100 об/мин, скорость аэрирования составляет 7,5 л/мин.
В) Выделение.
Через 23 ч содержимое ферментеров объединяют, получая 60 л жидкости с культурой. Доводят pH жидкости до 3 с помощью соляной кислоты, а затем добавляют 60 л ацетона и смесь экстрагируют при перемешивании в течение 30 мин. Раствор фильтруют, используя 1,2 кг целита 545 (торговая марка продукции фирмы Johns Manville Co.) в качестве фильтровального средства. 110 л полученного фильтрата экстрагируют затем один раз 60 л этилацетата, а затем дважды по 30 л этилацетата. Экстракты в этилацетате объединяют, промывают 30 л 5%-ного водного раствора бикарбоната натрия, а затем 30 л насыщенного водного раствора хлористого натрия, после чего их сушат над безводным сульфатом натрия и упаривают досуха в вакууме, получая 14 г маслянистого вещества.
Все полученное на предыдущей стадии маслянистое вещество растворяют в хлористом метилене и раствор помещают в колонку, содержащую 200 г силикагеля, насыщенного хлористым метиленом. Элюируют раствор сначала смесью хлористого метилена и этилацетата (1:1), затем одним этилацетатом и, наконец, смесью этилацетата и метанола (9:1), полярность растворителя возрастает в указанном порядке. Элюент собирают в виде фракций по 18 мл и фракции, элюированные смесью этилацетата и метанола, которые содержат тиомаринол, сохраняют.
Отделенные фракции упаривают в вакууме, получая 7 г маслянистого вещества, которое растворяют в 400 мл 50%-ного водного раствора метанола, и полученный раствор помещают в колонку емкостью 600 мл, наполненную носителем Diaion HP-20 (торговая марка продукции фирмы Mitsubishi Chem. Ind.), насыщенным водой. Колонку промывают 50%-ным водным раствором метанола и целевой продукт элюируют 90%-ным водным раствором метанола. С помощью упаривания при пониженном давлении из фракции получают 1 г порошка желтого цвета. Желтый порошок дополнительно элюируют на хроматографической колонке с Sephadex LH-20 смесью хлористого метилена, этилацетата и метанола (19:19:2). Из активных фракций выделяют 750 мг тиомаринола в виде порошка желтого цвета.
Полученный тиомаринол имеет следующие характеристики.
1) Внешний вид: порошок желтого цвета.
2) Температура плавления: 84-89oC.
3) Молекулярная формула C30H44N2O9S2.
4) Молекулярная масса: 640 (по данным FAB масс-спектрометрии). FAB масс-спектрометрия масс-спектрометрия с бомбардировкой быстрыми атомами.
5) Масс-спектр высокого разрешения:
C30H44N2O9S2 [N+H]+; по данным FAB масс-спектрометрии).
Найдено 641,2567.
Вычислено 641,2585.
6) Элементный анализ.
Вычислено, C 56,23; H 6,92; N 4,37; S 10,01.
Найдено, C, 55,92; H, 6,82; N, 4,23; S 9,90.
7) ИК-спектр: в ИК-спектре (метод с диском KBr, nmax см-1) наблюдаются следующие пики:
3394, 2930, 1649, 1598, 1526, 1288, 1216, 1154, 1102, 1052.
8) УФ-спектр: λmax нм (s).
УФ-спектр, измеренный в метаноле или смеси метанол+соляная кислота, представлен ниже:
387(12000), 300(3500), 214(26000).
УФ-спектр, измеренный в смеси метанол+едкий натр, представлен ниже:
386(9600), 306(3200), 206(25000).
9) Удельное вращение:
[α]
10) Жидкостная хроматография высокого разрешения.
Разделительная колонка: Senshu-Pak ODS H-2151 (диаметр колонки 6 мм, длина 150 мм, продукция компании Senshu Scientific Co. Ltd.).
Растворитель: 40 об. водный ацетонитрил.
Скорость подачи элюента: 1,5 мл/мин.
Длина волны: 220-350 нм (детектор фотодиодная матрица).
Время удерживания: 5,9 мин.
11) 1H-ЯМР спектроскопия ( δм.д.).
ЯМР-спектр (270 МГц), измеренный в гексадейтерированном диметилсульфоксиде с использованием тетраметилсилана в качестве внутреннего стандарта, представлен ниже:
0,91(3H, дублет, J=6,8 Гц), 0,95(3H, дублет, J=5,9 Гц),
1,30(6H, широкий мультиплет), 1,55(5H, широкий мультиплет), 2,03 (3H, синглет), 2,09 ( 3H, мультиплет),
2,34(2H, триплет, J=7,3 Гц), 3,33(1H, дублет, J=10,7 Гц),
3,52(2H, мультиплет), 3,64(2H, мультиплет), 3,73(1H, дублет дублетов), 4,02(2H, триплет, J=6,6 Гц), 4,18(1H, широкий дублет, J= 7,3 Гц), 4,30(1H, дублет, J= 4,4 Гц), 4,44(1H, дублет, J=7,8 Гц), 4,63(1H, дублет, J=3,4 Гц), 4,89(1H, дублет, J=7,3 Гц), 5,37(2H, мультиплет), 5,97(1H, широкий синглет), 7,04(1H, синглет), 9,80(1H, широкий синглет), 10,68(1H, широкий синглет).
12) 13C-ЯМР спектр: ( dм.д.).
ЯМР-спектр (68 МГц), измеренный в гексадейтерированном диметилсульфоксиде с использованием тетраметилсилана в качестве внутреннего стандарта, представлен ниже:
16,3 (квартет), 16,6 (квартет), 20,3 (квартет),
26,7 (триплет), 27,0 (триплет), 29,7 (триплет),
30,0 (триплет), 30,1 (триплет), 33,4 (триплет),
36,6 (триплет), 43,9 (дублет), 45,3 (дублет),
64,9 (триплет), 65,7 (дублет), 66,0 (триплет),
71,8 (дублет), 72,1 (дублет), 74,4 (дублет),
77,6 (дублет), 113,7 (дублет), 115,8 (синглет),
116,3 (дублет), 129,8 (дублет), 135,1 (синглет),
135,7 (дублет), 137,9 (синглет), 161,1 (синглет),
168,6 (синглет), 170,4 (синглет), 174,3 (синглет).
13) Растворимость.
Растворим в спиртах, таких как метанол, этанол, пропанол и бутанол, а также в диметилсульфоксиде, диметилформамиде, хлороформе, этилацетате, ацетоне и диэтиловом эфире; не растворим в гексане и воде.
14) Цветные реакции.
Положительные с серной кислотой, иодом и перманганатом калия.
15) Тонкослойная хроматография.
Величина Rf 0,57.
Адсорбент: силикагель (фирма Merck Co. inc. Art. 5719).
Элюент: хлористый метилен:метанол 85:15 по объему.
Биологическая активность.
Биологическая активность тиомаринола B подтверждается следующими примерами тестовых испытаний, в которых он сравнивается с псевдомоновой кислотой A и тиомаринолом.
Пример тестовых испытаний 1.
Антибактериальная активность тиомаринола B.
Минимальную ингибирующую концентрацию (MIC) тиомаринола, тиомаринола B и псевдомоновой кислоты A (обозначены, соответственно, через "A", "B" и "P"), выраженную в мкг/мл, по отношению к грампозитивным и грамнегативным бактериям, определяют методом разбавления агаровой среды, используя питательную агаровую среду (продукт компании Eiken Chemical Co. Ltd.).
Полученные результаты представлены в табл. 2.
Пример тестовых испытаний 2.
Антимикоплазменная активность тиомаринола B.
По аналогичной методике, приведенной в примере тестовых испытаний 1, проводят количественное определение активности тиомаринола, тиомаринола B и псевдомоновой кислоты A (обозначены, соответственно, "A", "B" и "P") по отношению к различным образцам микоплазмы. Результаты представлены в табл. 3.
Инокулюм: 0,005 мл 105 CFU/мл.
Среда для анализа.
Для всех микроорганизмов испытания тиомаринола B и псевдомоновой кислоты A проводят в среде Ченока (полученной по методике, приведенной в P.N.A.S. v. 48, 41-49 (1962) с добавлением 20% сыворотки лошади).
Тиомаринол подвергают анализу в следующих средах.
M. bovis и M. gallisepticum: среда Ченока (полученная, как указано выше).
M. hyosynoviae: агаровая среда с муцином PPLO (*) (с добавлением 15% сыворотки лошади),
(*) PPLO плевро-пневмониеобразный организм
PPLO бульон без CV (Difco) 21 г
Муцин бактериологический (Difco) 5 г
Вода дистиллированная 800 мл
Агар благородный (Difco) 12 г
Лошадиная сыворотка 150 мл
25%-ный свежий дрожжевой экстракт 50 мл
Условия выращивания культуры: 37oC, 5 дней, слегка аэробная среда (метод газового укутывания BBL [выращивание в генераторе CO2 одноразового использования фирмы Becton Dickinson Microbiology Sysyems, Коккисвиль, Мэриленд, США]).
Из представленных результатов ясно, что тиомаринол B проявляет превосходную антибактериальную и антимикоплазменную активность, которая по крайней мере не хуже, чем у тиомаринола, и в общем случае значительно выше, чем активность псевдомоновой кислоты A.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТИОМАРИНОЛ C И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2089548C1 |
| ТИОМАРИНОЛ, ОБЛАДАЮЩИЙ АНТИБАКТЕРИАЛЬНЫМИ СВОЙСТВАМИ, ШТАММ МИКРООРГАНИЗМА ALTEROMONAS RAVA SANK-73390 - ПРОДУЦЕНТ ТИОМАРИНОЛА И СПОСОБ ПОЛУЧЕНИЯ АНТИБИОТИКА ТИОМАРИНОЛА | 1992 |
|
RU2077534C1 |
| ЛЕЙСТРОДУКСИН, СПОСОБ ПОЛУЧЕНИЯ ЛЕЙСТРОДУКСИНА ШТАММ STREPTOMYCES PLATENSIS - ПРОДУЦЕНТ ЛЕЙСТРОДУКСИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ КРОВЕТВОРНОЙ И ПРОТИВОГРИБКОВОЙ АКТИВНОСТЬЮ, ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЕ СРЕДСТВО | 1992 |
|
RU2082760C1 |
| ГЕКСАГИДРОНАФТАЛИНОВЫЕ СЛОЖНОЭФИРНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2104997C1 |
| ПРОИЗВОДНЫЕ ОКТАГИДРОНАФТАЛИНОКСИМА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2125043C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ГРИЗЕОЛЕВОЙ КИСЛОТЫ | 1988 |
|
RU2024539C1 |
| α,ω ДИАРИЛАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2105752C1 |
| ПРОИЗВОДНЫЕ БИФЕНИЛА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2109736C1 |
| ТИАЗОЛИДИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СПОСОБ СНИЖЕНИЯ СОДЕРЖАНИЯ САХАРА В КРОВИ У МЛЕКОПИТАЮЩИХ | 1992 |
|
RU2095354C1 |
| ПРОИЗВОДНЫЕ НУКЛЕОЗИДОВ ПИРИМИДИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2085557C1 |
Использование: получение тиомаринола B. Сущность изобретения: тиомаринол B, обладающий антибактериальными и антимикоплазменными свойствами. Способ получения тиомаринола B культивированием микроорганизма вида Alteromonas rava в питательной среде, содержащей источник углерода, азота и неорганических солей в аэробных условиях с последующим его выделением и способ получения тиомаринола B окислением тиомаринола. 3 с. и 5 з.п.ф-лы, 3 табл.
2. Способ получения тиомаринола B, отличающийся тем, что микроорганизм вида Alteromonas rava культивируют в питательной среде, содержащей источники углерода, азота и неорганических солей, при аэробных условиях с последующим выделением целевого продукта.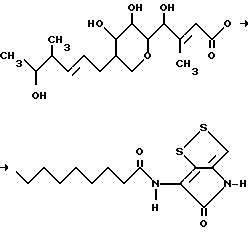
подвергают реакции с окисляющим агентом.
Приоритет по пунктам:
18.09.92 по пп.1 3.
| J.Chem.soc., Perkin Trans | |||
| Шеститрубный элемент пароперегревателя в жаровых трубках | 1918 |
|
SU1977A1 |
Авторы
Даты
1998-01-10—Публикация
1993-09-17—Подача